Способ синтеза пирроламидов
Номер патента: 2243
Опубликовано: 28.02.2002
Авторы: Эм Энд Дейвид Джон, Куоллич Джордж Джозеф, Рейган Джон Энтони, Клиффорд Памела Джейн, Айзенбайс Шейн Аллен, Мейкоуски Териза Вудолл, Аллен Даглас Джон Мелдрам, Конрад Алисон Кей, Янг Грегори Рэндл
Формула / Реферат
1. Способ получения соединения формулы
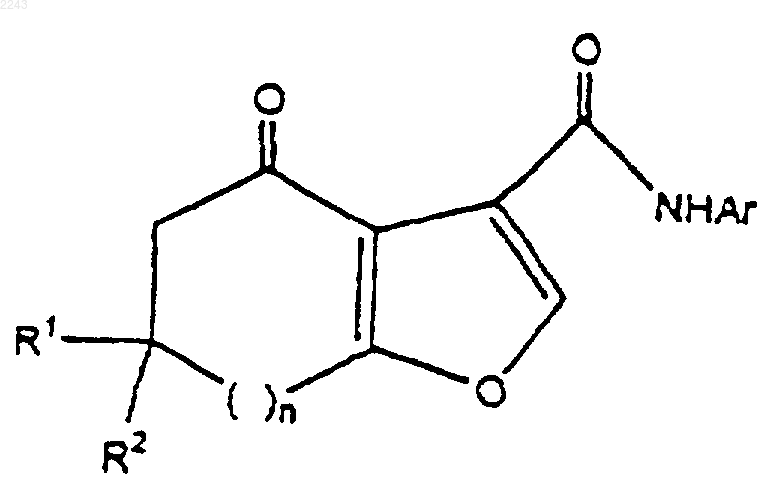
где R1 и R2 независимо выбраны из водорода и C1-С6алкила; а Аr представляет собой фенил или гетероцикл; либо фенил или гетероцикл, замещенный заместителями числом до трех, выбранными из C1-С6алкокси, C1-С6алкила, C2-С6алкенила, C1-С6перфторалкила, C1-С6алкокси, C1-С6перфторалкокси, F, Cl, Br, -O-(CH2)k-O- или (CH2)mNR1R2; либо Аr представляет собой 4-(N-метил-N-трет-бутилкарбоксиаминометил)фенил, где
n представляет собой целое число, выбранное из диапазона от 0 до 2;
m представляет собой целое число, выбранное из диапазона от 0 до 6; и
k представляет собой целое число, выбранное из 1 или 2, при котором:
1) соединение формулы
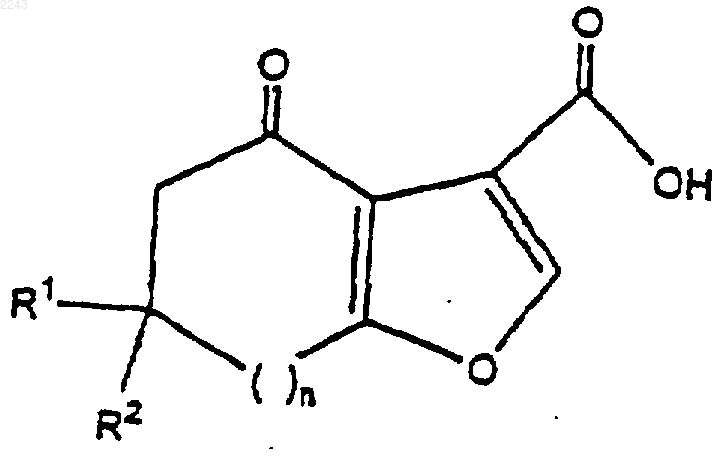
подвергают взаимодействию с избытком хлорангидрида кислоты или ангидрида кислоты в реакционно инертном растворителе, содержащем избыток акцептора кислоты, до тех пор, пока реакция не завершится;
2) к раствору со стадии 1 добавляют эквивалентное количество NH2-Аr и выдерживают до тех пор, пока реакция не завершится.
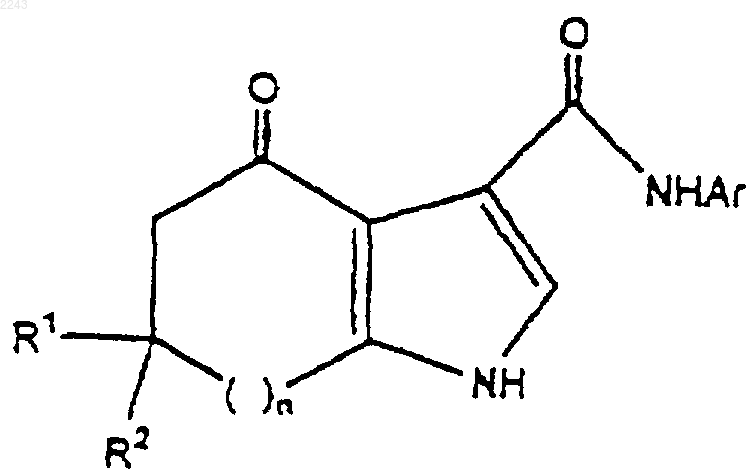
2. Способ по п.1, при котором соединение формулы I дополнительно подвергают взаимодействию с избытком источника аммония в реакционно инертном растворителе при повышенной температуре, до тех пор, пока реакция не завершится, для получения соединения формулы
3. Способ по п. 2, где Аr выбран из группы, состоящей из
2-фтор-4-метоксифенила,
4-(N-метил-N-трет-бутилкарбоксиаминометил)фенила,
4-этоксифенила или 4-метоксифенила,
4-фторфенила,
4-пиридила или 3-пиридила,
6-(2-гидроксиэтокси)-3-пиридила и бензо [1,3]диоксол-5-ила.
4. Способ по п.1, где n представляет собой 2, a R1 и R2 представляют собой водород.
5. Способ по п.1, где n представляет собой 1, a R1 и R2 представляют собой метил.
6. Способ по п.1, где n представляет собой единицу, а R1 и R2 представляют собой водород.
7. Способ по п.1, где n представляет собой ноль, а R1 и R2 представляют собой водород.
8. Способ по п.1, где n представляет собой 1, R1 представляет собой метил, а R2 представляет собой водород.
9. Соединение, выбранное из группы, состоящей из
4-оксо-5,6,7,8-тетрагидро-4Н-циклогепта[b]фуран-3-карбоновой кислоты,
4-оксо-5,6,7,8-тетрагидро-4Н-циклогепта[b]фуран-3-карбоновой кислоты (2-фтор-4-метоксифенил)амида,
6,6-диметил-4-оксо-4,5,6,7-тетрагидробензофуран-3-карбоновой кислоты (2-фтор-4-метоксифенил)амида,
4-[(4-оксо-4,5,6,7-тетрагидробензофуран-3-карбонил)амино]бензилметилкарбаминовой кислоты трет-бутилового эфира,
4-оксо-5,6-дигидро-4Н-циклопента[b]фуран-3-карбоновой кислоты (4-этоксифенил)амида,
4-оксо-5,6,7,8-тетрагидро-4Н-циклогепта[b]фуран-3-карбоновой кислоты бензо[1,3]диоксол-5-иламида,
4-оксо-5,6,7,8-тетрагидро-4Н-циклогепта[b]фуран-3-карбоновой кислоты-(4-метоксифенил)амида,
6-метил-4-оксо-4,5,6,7-тетрагидробензофуран-3-карбоновой кислоты (4-фторфенил)амида,
6-метил-4-оксо-4,5,6,7-тетрагидробензофуран-3-карбоновой кислоты пиридин-4-иламида,
6-метил-4-оксо-4,5,6,7-тетрагидробензофуран-3-карбоновой кислоты пиридин-3-иламида и
6-метил-4-оксо-4,5,6,7-тетрагидробензофуран-3-карбоновой кислоты [6-(2-гидроксиэтокси)пиридин-3-ил]амида.
10. Соединение, которое представляет собой 4-[(4-оксо-4,5,6,7-тетрагидро-1Н-индол-3-карбонил)амино]бензилметилкарбаминовой кислоты трет-бутиловый эфир.
11. Способ по п.2, где Аr представляет собой 4-(N-метил-N-трет-бутилкарбоксиаминометил)фенил, при котором продукт способа по п.2 дополнительно подвергают взаимодействию с водой в присутствии кислоты.
12. Способ по п.1, где указанным хлорангидридом кислоты является этилхлорформиат.
Текст
1 Предпосылки изобретения Область изобретения Настоящее изобретение относится к способу синтеза новых конденсированных пирролкарбоксамидов, которые селективно связываются с ГАМК-рецепторами. Данное изобретение также относится к химическим промежуточным продуктам для синтеза таких соединений. Соединения, которые связываются с ГАМКрецепторами, полезны при лечении тревоги,расстройств сна и судорог, при передозировках лекарств бензодиазепинового типа и для усиления бдительности. Описание родственной области-Аминомасляная кислота (ГАМК) считается одним из основных тормозных аминокислотных медиаторов в головном мозге млекопитающего. Более 30 лет прошло с тех пор, как было продемонстрировано ее присутствие в головном мозге (RobertsFrankel, J. Вiol. Chem 187: 55-63, 1950; Udenfriend, J. Biol. Chem. 187: 65-69, 1950). С того времени огромное количество усилий было посвящено вовлечению ГАМК в этиологию судорог, сна, тревоги и познания (Tallman and Gallager, Ann. Rev. Neuroscience 8: 21-44, 1985). Считается, что широко,хотя неравномерно, распространенная в головном мозге млекопитающего ГАМК является медиатором приблизительно в 30% синапсов в головном мозге. В большинстве участков головного мозга ГАМК связана с местными тормозными нейронами, и только в двух участках ГАМК связана с более длинными выростами. ГАМК опосредует многие из своих действий через комплекс белков, локализованных как на телах клеток, так и на нервных окончаниях; их называют ГАМКA-рецепторы. Постсинаптические реакции на ГАМК опосредуются через изменения в хлоридной проводимости, которая обычно, хотя и не неизменно, ведет к гиперполяризации клетки. Последние исследования показали, что комплекс белков, связанных с постсинаптическими ответами на ГАМК, является основным сайтом действия для ряда структурно неродственных соединений, способных к модификации постсинаптических ответов на ГАМК. В зависимости от способа взаимодействия эти соединения способны давать спектр активностей (либо седативную, анксиолитическую и противосудорожную, либо бессонницу, судороги и тревогу). 1,4-Бензодиазепины продолжают находиться в ряду наиболее широко используемых в мире лекарств. Основными из имеющихся в продаже бензодиазепинов являются хлордиазепоксид, диазепам, флуразепам и триазолам. Эти соединения широко используются в качестве анксиолитиков, седативно-гипнотических средств, миореклаксантов и противосудорожных средств. Некоторые из этих соединений являются чрезвычайно сильнодействующими лекарствами; такая эффективность свидетельствует о 2 сайте действия с высоким сродством и специфичностью к отдельным рецепторам. Ранние электрофизиологические исследования показали, что основным действием бензодиазепинов являлось усиление ГАМК-ергического торможения. Бензодиазепины были способны к усилению пресинаптического торможения моносинаптического рефлекса вентральных корешков,ГАМК-опосредованного случая (Schmidt et al.,1967, Arch. Exp. Path. Pharmacol. 258:69-82). Все последующие электрофизиологические исследования (рассмотрены Tallman et al. 1980, Science 207: 274-81, Haefley et al., 1981, Handb.Exptl. Pharmacol. 33: 95-102) в целом подтвердили данное открытие, и к середине 70-х среди электрофизиологов существовало общее мнение, что бензодиазепины могут усиливать действия ГАМК. С открытием "рецептора" для бензодиазепинов и последующего определения природы взаимодействия между ГАМК и бензодиазепинами, стало ясно, что поведенчески важные взаимодействия бензодиазепинов с различными нейромедиаторными системами обусловлены по большей части повышенной способностью самой ГАМК модифицировать эти системы. Каждая модифицированная система, в свою очередь,может быть связана с выражением поведения. Исследования механистической природы этих взаимодействий зависели от обнаружения бензодиазепин-связывающего сайта (рецептора) высокого сродства. Такой рецептор присутствует в ЦНС всех позвоночных, филогенетически более поздних, чем костные рыбы (SquiresOkada, 1977, Br. J. Psychiatry 133: 261-68). Путем использования меченного тритием диазепама и множества других соединений, было доказано, что эти бензодиазепин-связывающие сайты удовлетворяют многим критериям фармакологических рецепторов; связывание с этими сайтами in vitro является быстрым, обратимым,стереоспецифическим и насыщаемым. Более важно, были показаны высокозначимые корреляции между способностью бензодиазепинов вытеснять диазепам с его сайтов связывания и активностью в ряде тестов на поведение животных, предсказывающих эффективность бензодиазепинов (BraestrupSquires 1978, Вr. J. Psychiatry 133: 261-68). Средние терапевтические дозы этих лекарств для человека также коррелируют с эффективностью рецептора (Tallman etal. 1980, Science 207: 274-281. Некоторые конденсированные пирролкарбоксамиды, которые полезны в качестве лигандов ГАМК-рецепторов головного мозга, описаны в патенте США 5484944, который включен сюда путем ссылки. Эти соединения могут быть получены по схеме, представленной ниже. где z представляет собой N-R или атом углерода, замещенный R группами; a W представляет собой возможно замещенное ароматическое кольцо. Сущность изобретения Данное изобретение предлагает способ получения соединения формулы где R1 и R2 независимо выбраны из водорода иC1-С 6 алкила; а Аr представляет собой фенил или гетероцикл; либо фенил или гетероцикл, замещенный заместителями числом до трех, выбранными из C1-С 6 алкокси, C1-С 6 алкила, С 2-С 6 алкенила, C1-С 6 перфторалкила, C1-С 6 алкокси,C1-С 6 перфторалкокси, F, Cl, Br, -O-(CH2)k-Oили (CH2)mNR1R2; гдеn представляет собой целое число, выбранное из диапазона от 0 до 2;m представляет собой целое число, выбранное из диапазона от 0 до 6; и k представляет собой целое число, выбранное из 1 или 2 при котором 1) соединение формулы подвергают взаимодействию с избытком хлорангидрида кислоты или ангидрида кислоты в реакционно инертном растворителе, содержащей избыток акцептора кислоты, до тех пор,пока реакция не завершится. 2) к раствору со стадии 1 добавляют эквивалентное количество NН 2-Аr и выдерживают до тех пор, пока реакция не завершится. Данное изобретение предлагает также способ получения соединения формулы при котором соединение формулы II подвергают взаимодействию с избытком источника аммония в реакционно инертном растворителе при повы 002243 4 шенной температуре, до тех пор, пока реакция не завершится. Данное изобретение также предлагает способ получения соединения формулы III, где Аr представляет собой 2-фтор-4-метоксифенил, (4 метил-N-трет-бутилкарбаминовой кислоты эфир)аминометилфенил, 4-этоксифенил или 4 метоксифенил, 4-фторфенил, 4-пиридил или 3 пиридил, b-(2-гидроксиэтокси)-3-пиридил, бензо[1,3]диоксол-5-ил. Данное изобретение также предлагает способ получения соединения формулы I, где n представляет собой 2, a R1 и R2 представляют собой водород;n представляет собой 1, а R1 и R2 представляют собой метил; n представляет собой единицу, а R1 и R2 представляют собой водород; n представляет собой ноль, а R1 и R2 представляют собой водород; и n представляет собой 1, R1 представляет собой метил, а R2 представляет собой водород. В соответствии с другим аспектом настоящее изобретение предлагает соединение формулы I, которое представляет собой 4-оксо-5,6,7,8-тетрагидро-4 Н-циклогепта 5 Данное изобретение также предлагает промежуточные соединения:(4-аминобензил)метилкарбаминовой кислоты тpeт-бутиловый эфир. Данное изобретение предлагает также способ получения соединения формулы III, где Аr замещен -(CH2)mNHR1, при котором соединение формулы подвергают взаимодействию с водой в присутствии кислоты. Подробное описание изобретения Способ по изобретению иллюстрируется схемой, приведенной ниже. где Аr, R1, R2 и n такие, как определено выше. Соединения формулы II легко получают путем взаимодействия соответствующего 1,3 дикетона со сложным эфиром галогенпировиноградной кислоты, предпочтительно с этилбромпируватом, как описано в патенте США 5484944 и общей методике А примера 1 настоящего изобретения. Соединение I получают из соединения II путем превращения группы карбоновой кислоты соединения I в смешанный ангидрид кислоты, и из него в карбоксанилид путем взаимодействия ангидрида кислоты с выбранным анилином в присутствии основания. Данную реакцию предпочтительно осуществляют в реакционно инертном растворителе при пониженной температуре без выделения промежуточного ангидрида кислоты. Любой хлорангидрид кислоты или ангидрид кислоты может быть использован для образования смешанного ангидрида кислоты, предпочтительным реагентом является этилхлорформиат. Вышеупомянутая реакция иллюстрируется общей методикой Б примера 1 ниже. Превращение соединения I в конечный продукт (соединение III) выполняют путем взаимодействия соединения I с солью аммония в реакционно инертном растворителе при повышенной температуре, достаточной для того,чтобы осуществить реакцию в разумный период времени. Подходит любой полярный реакционно инертный растворитель; н-метилпирролидинон является предпочтительным. Ацетат 6 аммония является подходящим источником иона аммония. Эта методика иллюстрируется общей методикой В примера I ниже. Специалисту в данной области техники будет понятно, что исходные материалы могут варьировать и дополнительные стадии, используемые для получения соединений, включены в настоящее изобретение, что демонстрируется следующими примерами. В некоторых случаях защита определенных реакционных функциональностей может быть необходима для достижения некоторых из вышеуказанных превращений. Вообще необходимость в таких защитных группах будет очевидна для специалиста в области органического синтеза, также как и условия, необходимые для присоединения или удаления таких групп. Данное изобретение иллюстрируется далее следующими примерами, которые не должны рассматриваться как ограничивающие настоящее изобретение рамками или общим характером конкретных процедур, описанных в них. Пример 1[b]фуран-3-карбоновая кислота. Общая методика А (дикетон до фуранкарбоновой кислоты). Циклогептан-1,3-дион (22,1 г, 174 ммоль) растворяют в 176 мл изопропанола и охлаждают до 0 С. Добавляют этилбромпируват (21,9 мл,174 ммоль), затем К 2 СО 3 (24,2 г, 175 ммоль). Данному раствору затем дают нагреться до комнатной температуры и перемешивают в течение 16 ч. Добавляют 220 мл воды и данный раствор экстрагируют четырьмя порциями дихлорметана по 110 мл. Объединенные органические экстракты затем промывают рассолом и концентрируют с получением оранжевокоричневого масла. Затем добавляют 220 мл 1 НH2SO4 и данный раствор нагревают на 85 С масляной бане в течение 16 ч. После охлаждения до комнатной температуры раствор экстрагируют двумя порциями дихлорметана по 220 мл. Объединенные органические экстракты промывают рассолом и концентрируют с получением 37,2 г рыжевато-коричневого твердого вещества. Данный неочищенный продукт затем гранулируют со 170 мл метил-трет-бутилового бутилового эфира, нагревая почти до температуры флегмы в течение 30 мин, с последующим перемешиванием при комнатной температуре в течение 16 ч. Фильтрование дает продукт в виде 7 не совсем белого твердого вещества, 14,6 г (75 ммоль, 43% выход от дикетона). 1 Н-ЯМР (CDCl3): 8.07 (s, 1 Н), 3.14-3.10 (m,2H), 2.89-2.86 (m, 2H), 2.05-1.93 (m, 4H). МС (масс-спектрометрия) (Cl): 195 (М+1,100). 4-Оксо-5,6,7,8-тетрагидро-4 Н-циклогепта[b]фуран-3-карбоновой кислоты (2-фтор-4 метоксифенил)амид. Общая методика Б (фуранкарбоновая кислота до фуранкарбоксамида). Раствор фурановой кислоты из методики А(7,65 г, 39,4 ммоль) растворяют в 80 мл дихлорметана и охлаждают до 0 С. Добавляют триэтиламин (7,1 мл, 51 ммоль), затем этилхлорформиат (4,5 мл, 47 ммоль). Через 20 мин несколькими маленькими порциями добавляют 2-фтор 4-метоксианилин (5,56 г, 39,4 ммоль). Раствору дают нагреться до комнатной температуры и перемешивают в течение 5 ч. Реакционную смесь обрабатывают путем разбавления дихлорметаном, промывания рассолом и высушивания над MgSO4. Фильтрование и концентрирование дает 15,0 г не совсем белого твердого вещества, которое гранулируют со 100 мл метил-тpeт-бутилового эфира в течение 16 ч. Фильтрование затем дает 11,71 г продукта (36,9 ммоль, 94% выход) в виде рыжевато-белого твердого вещества: т.пл. 168-172 С. 1 Н-ЯМР (CDCl3): 8.28-8.24 (m, 1 Н), 8.10 (s,1 Н), 6.72-6.66 (m, 2H), 3.78 (s, 3 Н), 3.11-3.06 (m,2H), 2.86-2.83 (m, 2H), 2.01-1.93 (m, 4H). МС (масс-спектрометрия) (Cl): 318 (М+1,100). 4-Оксо-1,4,5,6,7,8-гексагидроциклогепта[b]пиррол-3-карбоновой кислоты (2-фтор-4 метоксифенил)амид. Общая методика В (фуранкарбоксамид до пирролкарбоксамида). В 500 мл колбу загружают 4-оксо-5,6,7,8 тетрагидро-4 Н-циклогепта[b]фуран-3-карбоновой кислоты (2-фтор-4-метоксифенил)амид из методики Б (10,0 г, 31,5 ммоль), ацетат аммония(12,1 г, 158 ммоль) и 20 мл N-метиопирролидинона. Полученную суспензию нагревают на 100 С масляной бане в статической атмосфере азота в течение 20 ч. После охлаждения до комнатной температуры реакционный раствор обрабатывают 180 мл воды, добавляемой по каплям в течение периода 30 мин. Полученные твердые частицы гранулируют в течение 6 ч,затем собирают путем фильтрования. После 16 ч в вакууме при 30 С продукт выделяют в виде рыжевато-коричневого твердого вещества (9,12 г, 28,8 ммоль, 91% выход): т.пл. 158-159 С. 1 Н-ЯМР (CDCl3): 12.62 (s, 1 Н), 11.25 (br s,1H), 8.11-8.06 (m, 1H), 7.53 (br s, 1H), 6.70-6.63 6,6-Диметил-4-оксо-4,5,6,7-тетрагидробензофуран-3-карбоновой кислоты (2-фтор-4 метоксифенил)амид. Начиная с (6,6-диметил-4-оксо-4,5,6,7 тетрагидробензофуран-3-карбоновой кислоты),полученной из димедона с помощью методики А, и 2-фтор-4-метоксианилина, общая методика Б дает соединение, указанное в заголовке, в виде белого твердого вещества: т.пл. 174-176 С. 1 Н-ЯМР (СDСl3): 8.23 (t, J=9, 1H), 8.09 (s,1H), 6.64 (m, 2H), 3.75 (s, 3H), 2.79 (s, 2H), 2.50(2-фтор-4-метоксифенил)амида), общая методика В дает соединение, указанное в заголовке, в виде белого твердого вещества: т.пл. 203-205 С. 1 Н-ЯМР (CDCl3): 12.40 (s, 1H), 11.45 (br s,1H), 8.08 (t, J=8.8 Гц, 1H), 7.49 (d, J=1.8 Гц, 1H),6.72-6.64 (m, 2H), 3.77 (s, 3H), 2.55 (s, 2H), 2.42(4-Нитробензил)метилкарбаминовой кислоты тpeт-бутиловый эфир. К раствору трет-ВuO2 С)2O (24,9 г, 114 ммоль) в 100 мл ЕtOАс по каплям добавляют раствор (4-нитробензил)метиламина (19,0 г, 114 ммоль) (J. Chem. Soc. 1925, 127, р. 1814) в 19 мл ЕtOАс. Полученный раствор перемешивают при(4-Aминобензил)метилкарбаминовой кислоты тpeт-бутиловый эфир. В колбу Парра загружают (4-нитробензил) метилкарбаминовой кислоты трет-бутиловый эфир (30,0 г, 113 ммоль), 150 мл EtOAc и 10%Pd/C (3,0 г, 10 мас.%) и встряхивают под давлением водорода 275,8 кПа в течение 90 мин. Когда поглощение водорода прекратится, реакционный сосуд продувают азотом, фильтруют через целит и концентрируют с получением рыжевато-коричневого твердого вещества, которое гранулируют с 300 мл изопропилового эфира с получением соединения, указанного в заголовке, в виде не совсем белого твердого веществаbr синглеты, 9 Н). 4-[(4-Oксо-4,5,6,7-тетрагидробензофуран 3-карбонил)амино]бензилметилкарбаминовой кислоты тpeт-бутиловый эфир. Начиная с (4,5,6,7-тетрагидробензофуран 3-карбоновой кислоты) и (4-аминобензил)метилкарбаминовой кислоты трет-бутилового эфира, общая методика Б дает соединение,указанное в заголовке, в виде белого твердого вещества: т.пл. 150 С 1 Н-ЯМР (СDСl3): 8.06 (s, 1H), 7.71 (d, J=8,2H), 7.17 (d, J=8, 2H), 4.35 (fr s, 2H), 2.92 (t, J=6,2H), 2.78 (br s, 3H), 2.62 (t, J=6, 2H), 2.20 (m,2H), 1.44 (s, 9H). 13 С-ЯМР (СDСl3): (16 из 18 линий наблюдались) 197.5, 170.2, 159.1, 148.9, 137.7, 133.6,127.8, 121.9, 119.9, 116.8, 79.0, 37.8, 33.7, 28.4,23.5, 22.1. 4-[(4-Оксо-4,5,6,7-тетрагидро-1 Н-индол-3 карбонил)амино]бензилметилкарбаминовой кислоты трет-бутиловый эфир Следующая общая методика В, с использованием (4-[(4-Oксо-4,5,6,7-тетрагидробензофуран-3-карбонил)амино]бензилметилкарбаминовой кислоты трет-бутилового эфира, дает соединение, указанное в заголовке, в виде бледножелтого масла: 1(4-метиламинометилфенил)амид. Раствор 4-[(4-Оксо-4,5,6,7-тетрагидро-1 Ниндол-3-карбонил)амино]-бензилметилкарбаминовой кислоты тpет-бутилового эфира (5,0 г, 13 ммоль) в 50 мл 95% EtOH обрабатывают 15 мл концентрированной HCl. Через 24 ч суспензию охлаждают до 0 С и твердые частицы собирают путем фильтрования с получением соединения,указанного в заголовке, в виде его НСl соли,3,21 г (9,6 ммоль, 74% выход) в виде белого твердого вещества: 1 Н-ЯМР (СD3OD): 12.88 (br s, 1H), 7.82 (d,J=8,5 Гц, 2H), 7.49 (d, J=8,5 Гц, 2H), 4.15 (s, 2H),2.91-2.88 (m, 2H), 2.71 (s, 3H), 2.66-2.61 (m, 2H),2.20-2.15 (m, 2H). Пример 4 1-(Триметилсилокси)циклопентен: В 1 л круглодонную колбу загружают циклопентанон(50,7 г, 0,603 моль) и ДМФ (250 мл). Добавляют триэтиламин (200 мл, 1,45 моль), с последующим добавлением по каплям в течение 5 минTMSCI (TMS = тетраметилсилан) (91 мл, 0,72 моль). Раствор затем нагревают до температуры дефлегмации (90 С) в течение 26 ч. После охлаждения до температуры окружающей среды,данную смесь переносят на делительную воронку, промывая 500 мл гексанов. Раствор промывают водой (3 порции по 100 мл каждая), рассолом (100 мл), затем концентрируют с получением 110 г темно-оранжевого масла. 1H-ЯМР анализ показывает желаемый продукт плюс 10-15% триэтиламина. Этот материал используют в следующей реакции без дальнейшей очистки. 7,7-Дихлор-1-(триметилсилокси)бицикло[3.2.0]гептан-6-он. Неочищенный простой эфир енола и TMS(100 мл, 0,72 моль), с последующим добавлением дихлорацетилхлорида (58 мл, 0,60 моль) в виде раствора в 450 мл гексанов, по каплям в течение 2 ч. Раствор затем перемешивают при температуре окружающей среды в течение ночи. Реакционную смесь затем фильтруют через фриттованное стекло, промывая несколькими порциями гексана по 50 мл. Этот прозрачный раствор концентрируют в вакууме с получением 128 г (80% за 2 стадии) продукта в виде темнокоричневого масла. Этот материал является гомогенным по данным ГХ/МС (газовая хроматография/масс-спектрометрия) и 1H-ЯМР, со следами Et3N и ДМФ, и используется непосредственно в следующей реакции. Циклогептан-1,3-дион (1): дихлорциклобутанон 3 (128 г, 0,48 моль) растворяют в 520 мл смеси изопропанол-вода (1:1) в 2 л трехгорлой колбе с верхней мешалкой. Гранулы цинка (126 г, 1,9 моль, -30+100 зернистость) добавляют 15 одной порцией. Через 60 мин при комнатной температуре через капельную воронку добавляют по каплям 130 мл АсОН плюс 260 мл воды(примерно 4 мл добавляют сначала, с последующим выдерживанием в течение 10 мин для контроля экзотерм; затем добавляют 20 мл, с последующим выдерживанием в течение следующих 10 мин, как только какая-нибудь экзотерма уменьшилась, оставшийся раствор кислоты добавляют по каплям; все добавление занимает 1,5-2 ч). Через 16 ч смесь переносят на делительную воронку, декантируя от большей части цинка (используют несколько маленьких изопропанольных промывок). Смесь изопропанол-АсОН-вода экстрагируют затем 5 порциями толуола (250 мл каждая), которые объединяют и концентрируют с получением 51,7 г продукта в виде темного оранжево-коричневого масла (85% неочищенный массовый баланс, примерно 85% чистота, измеренная с помощью 1H-ЯМР). Этот материал является подходящим для последующих реакций, или может быть очищен путем дистилляции, что дает 29,4 г (0,23 моль, 49% выход) продукта в виде прозрачного, бесцветного масла (т. кип. 65-75 С при 1,2 мм). Его спектральные свойства 1H-ЯМР, ГХ/МС) идентичны образцам, полученным с помощью способа оксимеркурирования Хандрасекарана 1-(2-Фтор-4-иодфенил)-2,5-диметил-1 Нпиррол: В 500 мл круглодонную колбу загружают 2-фтор-4-иоданилин (53,3 г, 220 ммоль),толуол (250 мл), TsOHH2O (0,43 г, 2,3 ммоль, 1 молярный %) и ацетонилацетон (30,8 г, 270 ммоль, 1,2 эквив.). Раствор нагревают до температуры дефлегмации в условиях Дина-Старка(Dean-Stark) в течение 1 ч, и в это время ГХ/МС и ТСХ (тонкослойная хроматография) анализы показывают полное превращение в пиррол. Раствор охлаждают до комнатной температуры,промывают водным NаНСО 3, сушат над МgSO4,фильтруют и концентрируют с получением темно-коричневого масла, которое кристаллизуется при стоянии (выход неочищенного продукта = 72,8 г, 103% от теоретического). Этот материал является гомогенным по данным ВЭЖХ (высокоэффективная жидкостная хроматография) и 1H-ЯМР и подходит для применения в следующей реакции. Аналитический образец получают 16 путем растворения в 210 мл горячих гексанов,охлаждения, затем концентрирования до 50% от первоначального объема. Охлаждение на ледяной бане с быстрым перемешиванием дает 35,5 г (49% выход извлеченного продукта) коричневого гранулированного твердого вещества (т.пл. 68-70 С). 1m/z 268 (100). 1-(2-Фтор-4-метоксифенил)-2,5-диметил 1 Н-пиррол: неочищенный продукт из предыдущей реакции(1-(2-фтор-4-иодфенил)-2,5 диметил-1 Н-пиррол, 70,0 г, 222 ммоль) растворяют в 230 мл МеОН и 70 мл ДМФ. К этому раствору добавляют NaOMe (35,9 г, 666 ммоль,3,0 эквив.) и CuCl (3,3 г, 31 ммоль, 15 мол.%). Полученную смесь нагревают до температуры дефлегмации в течение 4 ч. После охлаждения до комнатной температуры добавляют изопропиловый эфир (ИПЭ) (500 мл), 5% водныйNН 4 Сl (220 мл) и воду (350 мл), и смесь перемешивают в течение ночи. Смесь затем фильтруют через целит, слои разделяют и водный слой экстрагируют 350 мл ИПЭ. Объединенные органические экстракты затем промывают 10% водным NH4OH (200 мл) и пропускают через подушку из силикагеля (100 г). Концентрирование дает коричневое масло, которое кристаллизуется при стоянии (45,2 г, 93% выход). Перекристаллизация из 135 мл горячих гексанов дает 30,1 г (62% выход) продукта в виде коричневого твердого вещества, т.пл. 67-69 С. 1(d, J=8 Гц, 1 Н), 6.73 (s, 1H), 5.89 (s, 2H), 3.82 (s,3 Н), 1.97 (s, 6H); 13 С-ЯМР (CDCl3) (9 из 10 линий наблюдались) d 159.1 (d, J=260 Гц), 130.7,129.5, 109.9 (d, J=3 Гц), 106.0, 105.6, 102.3 (d,J=25 Гц), 55.7, 12.4; МС (ЭИ): m/z 219 (100). 2-Фтор-4-метоксианилин: В 2 л круглодонную колбу загружают 1-(2-фтор-4-метоксифенил)-2,5-диметил-1 Н-пиррол (60,0 г, 271 ммоль), H2NOHHCl (188 г, 2,71 моль, 10 эквив.), ЕtOН (600 мл), воду (300 мл) и Еt3N (76 мл, 0,54 моль), затем нагревают до температуры дефлегмации в течение 16 ч. После охлаждения до комнатной температуры реакционную смесь медленно выливают в 1,7 л ледяной 1 н. HCl и промывают двумя порциями ИПЭ по 500 мл. В водной фазе затем доводят рН до 10 путем осторожного добавления 6 н. NaOH и экстрагируют двумя порциями ИПЭ по 500 мл. Органические экстракты концентрируют с получением маслянистого твердого вещества, которое затем фильтруют, промывая дополнительным ИПЭ(это твердое вещество не имеет отношения к анилиновому продукту по данным 1H-ЯМР анализа и представляет собой, по-видимому, некий родственный ацетонилацетону побочный про 17 дукт удаления защиты). Дальнейшее концентрирование раствора ИПЭ дает коричневое масло (36 г, 98% выход), которое перекристаллизовывают из 200 мл горячего ИПЭ, с получением 26,8 г (70% выход) 2-фтор-4-метоксианилина 1 в виде коричневого твердого вещества, т.пл. 4647 С (в литературе 47-48 С). Спектральные данные (1H-ЯМР, масс-спектрометрия) идентичны образцам, полученным с помощью способа, описанного в литературе (Aust. J. Chem. 1972, 25, 2621-2629). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы где R1 и R2 независимо выбраны из водорода иC1-С 6 алкила; а Аr представляет собой фенил или гетероцикл; либо фенил или гетероцикл, замещенный заместителями числом до трех, выбранными из C1-С 6 алкокси, C1-С 6 алкила, C2-С 6 алкенила, C1-С 6 перфторалкила, C1-С 6 алкокси,C1-С 6 перфторалкокси, F, Cl, Br, -O-(CH2)k-Oили (CH2)mNR1R2; либо Аr представляет собой 4-(N-метил-N-трет-бутилкарбоксиаминометил) фенил, гдеn представляет собой целое число, выбранное из диапазона от 0 до 2;m представляет собой целое число, выбранное из диапазона от 0 до 6; и k представляет собой целое число, выбранное из 1 или 2, при котором: 1) соединение формулы подвергают взаимодействию с избытком хлорангидрида кислоты или ангидрида кислоты в реакционно инертном растворителе, содержащем избыток акцептора кислоты, до тех пор,пока реакция не завершится; 2) к раствору со стадии 1 добавляют эквивалентное количество NH2-Аr и выдерживают до тех пор, пока реакция не завершится. 2. Способ по п.1, при котором соединение формулы I дополнительно подвергают взаимодействию с избытком источника аммония в реакционно инертном растворителе при повышенной температуре, до тех пор, пока реакция не завершится, для получения соединения формулы[b]фуран-3-карбоновой кислоты-(4-метоксифенил)амида,6-метил-4-оксо-4,5,6,7-тетрагидробензофуран-3-карбоновой кислоты (4-фторфенил) амида,6-метил-4-оксо-4,5,6,7-тетрагидробензофуран-3-карбоновой кислоты пиридин-4-иламида,6-метил-4-оксо-4,5,6,7-тетрагидробензофуран-3-карбоновой кислоты пиридин-3 иламида и 6-метил-4-оксо-4,5,6,7-тетрагидробензофуран-3-карбоновой кислоты [6-(2-гидроксиэтокси)пиридин-3-ил]амида. 10. Соединение, которое представляет собой 4-[(4-оксо-4,5,6,7-тетрагидро-1 Н-индол-3 карбонил)амино]бензилметилкарбаминовой кислоты трет-бутиловый эфир. 11. Способ по п.2, где Аr представляет собой 4-(N-метил-N-трет-бутилкарбоксиаминометил)фенил, при котором продукт способа по п.2 дополнительно подвергают взаимодействию с водой в присутствии кислоты. 12. Способ по п.1, где указанным хлорангидридом кислоты является этилхлорформиат.
МПК / Метки
МПК: A61K 31/343, A61P 25/00, C07D 209/42
Метки: пирроламидов, синтеза, способ
Код ссылки
<a href="https://eas.patents.su/10-2243-sposob-sinteza-pirrolamidov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ синтеза пирроламидов</a>
Предыдущий патент: Пептиды млекопитающих для лечения микробной инфекции
Следующий патент: Композиции для управления образованием бактериальных колоний
Случайный патент: Улучшение суспендирующих характеристик инвертных эмульсий












