Способ получения 5-(2-аминопиримидин-4-ил)-2-арил-1н-пиррол-3-карбоксамидов
Формула / Реферат
1. Способ получения 5-(2-аминопиримидин-4-ил)-2-арил-1Н-пиррол-3-карбоксамида формулы I
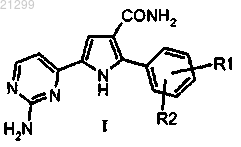
в которой R1 и R2 независимо представляют собой галоген или C1-С6 алкил,
где указанный способ включает:
а) взаимодействие ацеталя формулы II
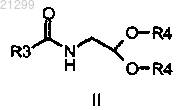
в которой R3 является C1-С6 алкилом и оба R4 независимо представляют собой C1-C6 алкил или совместно представляют собой алкиленовую цепь, содержащую 2 или 3 атома углерода и формирующую циклический ацеталь,
со сложным бета-кетоэфиром или его солью формулы III
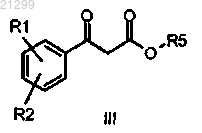
в которой R1 и R2 являются такими, как определено выше, и R5 представляет собой C1-С6 алкил,
сначала в сильнокислых условиях, затем в водно-спиртовом растворе;
(b) ацетилирование полученного в результате соединения формулы IV
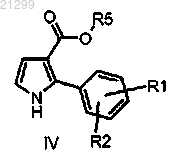
в которой R1, R2 и R5 являются такими, как определено выше,
с ацетилгалогенидом или уксусным ангидридом в присутствии кислоты Льюиса;
(с) взаимодействие полученного в результате соединения формулы V
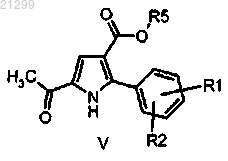
в которой R1, R2 и R5 являются такими, как определено выше,
с C1-С6 диалкилацеталем N,N-диметилформамида;
(d) взаимодействие полученного в результате енаминона формулы VI
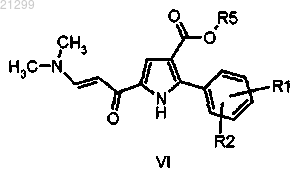
в которой R1, R2 и R5 являются такими, как определено выше,
с гуанидином или его солью;
(е) гидролиз сложноэфирной группы эфира карбоновой кислоты полученного в результате соединения формулы VII
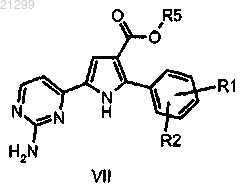
в которой R1, R2 и R5 являются таковыми, как определено выше;
(f) конденсацию карбоксильной группы карбоновой кислоты полученного в результате соединения формулы VIII
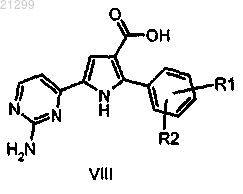
в которой R1 и R2 являются такими, как определено выше,
с формой аммиака с образованием карбоксамида формулы I, как определено выше; и, необязательно, превращение в фармацевтически приемлемую соль.
2. Промежуточное соединение формулы IV'
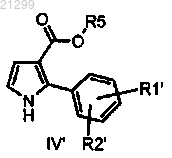
в которой R1' и R2' являются атомами хлора;
R5 является таким, как определено в п.1.
3. Способ получения соединения формулы IV, как определено в п.1, который включает взаимодействие диалкилацеталя формулы II, как определено в п.1, со сложным бета-кетоэфиром или его солью формулы III, как определено в п.1, сначала в кислых условиях, затем в водно-спиртовом растворе.
4. Способ по п.1 или 3, отличающийся тем, что взаимодействие осуществляют в сильнокислых условиях, используя трифторуксусную кислоту в качестве растворителя, при температуре от комнатной температуры до температуры кипения с обратным холодильником; затем реакционную смесь обрабатывают водно-спиртовым раствором, таким как этанол/гидроксид натрия.
5. Способ по пп.1, 3 или 4, отличающийся тем, что сложный бета-кетоэфир является солью имидазола.
6. Промежуточное соединение формулы V
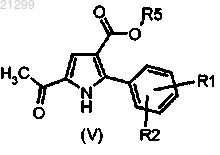
в котором R1, R2 представляют собой хлор или метил и R5 является таким, как определено в п.1.
7. Способ получения соединения формулы V, как определено в п.6, в котором способ включает обработку соединения формулы IV, как определено в п.1, ацетилгалогенидом или ангидридом уксусной кислоты в присутствии кислоты Льюиса.
8. Способ по п.1 или 7, отличающийся тем, что ацетилирование выполняют с ацетилхлоридом в присутствии кислоты Льюиса, такой как трихлорид алюминия или тетрахлорид титана, при температуре от
-5°С до комнатной температуры в органическом растворителе.
9. Способ по п.8, отличающийся тем, что органический растворитель представляет собой дихлорметан.
10. Промежуточный енаминон формулы VI
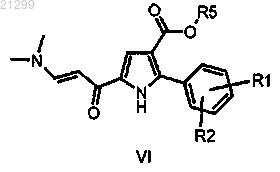
в котором R1, R2 представляют собой хлор или метил и R5 является таким, как определено в п.1.
11. Способ получения соединения формулы VI, как определено в п.10, где способ включает стадии (а)-(с), как определено в п.1.
12. Способ получения соединения формулы VI, как определено в п.10, в котором способ включает взаимодействие соединения формулы V, как определено в п.6, с диалкилацеталем N,N-диметилформамида.
13. Способ по пп.1, 11 или 12, отличающийся тем, что реакцию проводят, используя диалкилацеталь, такой как диметил- или диизопропилацеталь N,N-диметилформамида, при температуре между комнатной и температурой кипения с обратным холодильником в органическом растворителе.
14. Способ по п.13, отличающийся тем, что органический растворитель представляет собой диоксан.
15. Способ по любому из пп.1, 4, 5, 8 или 13, отличающийся тем, что соединение формулы I представляет собой
амид 5-(2-аминопиримидин-4-ил)-2-(2,3-диметилфенил)-1Н-пиррол-3-карбоновой кислоты;
амид 5-(2-аминопиримидин-4-ил)-2-(2,4-дихлорфенил)-1Н-пиррол-3-карбоновой кислоты.
16. Способ по любому из пп.1, 4, 5, 8 или 13, отличающийся тем, что соединение формулы I представляет собой амид 5-(2-аминопиримидин-4-ил)-2-(2,4-дихлорфенил)-1Н-пиррол-3-карбоновой кислоты.
Текст
Изобретение относится к способу получения 5-(2-аминопиримидин-4-ил)-2-арил-1 Н-пиррол-3 карбоксамидов и к полезным промежуточным соединениям, получаемым в ходе осуществления такого способа. Способ позволяет получить желаемые продукты с высокими выходами и чистотой. Синтез начинают с присоединения ацеталя к сложному бета-кетоэфиру; получившееся в результате соединение ацетилируют и затем вводят в реакцию с диалкилацеталем N,N-диметилформамида до получения промежуточного соединения, которое циклизуют до сложного эфира 5-(2 аминопиримидин-4-ил)-2-арил-1 Н-пиррол-3-карбоновой кислоты; сложный эфир карбоновой кислоты затем гидролизуют и полученную в результате карбоновую кислоту подвергают взаимодействию с соответствующей формой аммония до получения карбоксамида. Соединения,полученные согласно способу изобретения, проявляют ингибирующую активность в отношении протеинкиназы и в особенности ингибирующую активность в отношении Cdc7 или Cdc7/Cdks. Соединения полезны для лечения различных форм рака, нарушений клеточной пролиферации и заболеваний, связанных с протеинкиназами.(71)(73) Заявитель и патентовладелец: НЕРВИАНО МЕДИКАЛ САЙЕНСИЗ С.Р.Л. (IT) Настоящее изобретение относится к способу получения 5-(2-аминопиримидин-4-ил)-2-арил-1 Нпиррол-3-карбоксамидов и к полезным промежуточным соединениям, получаемым в ходе осуществления такого способа. Патент WO2007110344 описывает и заявляет гетеропентациклические соединения, способ их получения, фармацевтические композиции, их содержащие, а также их применение в качестве терапевтических реагентов, в частности, при лечении рака и нарушений пролиферации клеток. Такие соединения обладают ингибирующей активностью по отношению к протеинкиназе и, конкретнее, ингибирующей активностью по отношению к Cdc7 или Cdc7/Cdks. Конкретнее, соединения, получаемые согласно данному изобретению, являются полезными при лечении различных видов рака и нарушений пролиферации клеток. Данные соединения также могут являться ингибиторами других протеинкиназ и, таким образом,являются эффективными при лечении заболеваний, опосредованных другими протеинкиназами. Эти соединения и их аналоги можно получать согласно известному способу, включающему, по существу, реакцию конденсации между производным карбоновой кислоты и либо активированной формой аммиака, либо амином, для получения требуемого амида. Подобное производное карбоновой кислоты, в свою очередь, получают согласно процедуре, включающей в себя сочетание галогенкетона с бетакетоэфиром, реакцию Ганча (Hantzsch) и гидролиз. Для информации этот способ описан в вышеупомянутой патентной заявке WO2007110344. В этом отношении теперь заявителем неожиданно обнаружено, что вышеуказанные гетеропентациклические соединения можно успешно получать способом, который позволяет синтезировать требуемые продукты с высокими выходами. В связи с этим первая цель настоящего изобретения заключается в предоставлении способа получения 5-(2-аминопиримидин-4-ил)-2-арил-1 Н-пиррол-3-карбоксамида формулы I где R1 и R2 независимо представляют собой атом галогена или C1-С 6 алкильную группу, указанный способ включает:(а) взаимодействие ацеталя формулы II где R3 представляет собой С 1-С 6 алкильную группу, а оба R4 независимо представляют собой C1-С 6 алкильную группу или совместно представляют собой алкиленовую цепь с 2 или 3 атомами углерода,образующую циклический ацеталь,с бета-кетоэфиром или его солью формулы III(b) ацетилирование полученного в результате соединения формулы IV где R1, R2 и R5 являются такими, как определено выше,с ацетилгалогенидом или уксусным ангидридом в присутствии кислоты Льюиса;(с) взаимодействие полученного в результате соединения формулы V(d) взаимодействие полученного в результате енаминона формулы VI где R1, R2 и R5 являются такими, как определено выше,с гуанидином или его солью;(е) гидролиз сложноэфирной группы эфира карбоновой кислоты полученного в результате соединения с формулой VII(f) конденсацию карбоксильной группы карбоновой кислоты полученного в результате соединения формулы VIII где R1 и R2 являются такими, как определено выше,с формой аммиака с образованием карбоксамида формулы I, как определено выше, и если необходимо, превращения его в фармацевтически приемлемую соль. Любые промежуточные соединения и/или конечные соединения можно отделить и очистить, используя обычные способы, например хроматографию и/или кристаллизацию и солеобразование. Карбоксамиды формулы I, как определено выше, можно превратить в фармацевтически приемлемые соли. Карбоксамиды формулы I, как определено выше, или их фармацевтически приемлемые соли можно далее составлять с фармацевтически приемлемым носителем или разбавителем для получения фармацевтической композиции. Новый процесс проиллюстрирован на схеме где R1, R2, R3, R4 и R5 определены выше. Далее, другой целью настоящего изобретения являются полезные промежуточные соединения, а также способы их получения. В настоящем патентном описании термины"галоген" относится к брому, хлору, йоду или фтору, предпочтительно хлору или фтору;"C1-С 6 алкил" относится к неразветвленным или разветвленным насыщенным алифатическим углеводородным группам, содержащим от 1 до 6 атомов углерода; этот термин можно проиллюстрировать такими группами, как метильная, этильная, н-пропильная, изопропильная, н-бутильная, изобутильная,втор-бутильная, трет-бутильная, н-пентильная, н-гексильная и им подобными;"арил" относится к ароматической карбоциклической группе из 6-14 атомов углерода, содержащей единичное кольцо (например, фенил) или множественные конденсированные кольца (например, нафтил или антранил), в которой конденсированные кольца могут быть, а могут и не быть ароматическими (на-2 021299 пример, 2-бензоксазолинон, 2 Н-1,4-бензоксазин-3(4 Н)-он-7-ил и им подобные), при условии, что местом присоединения является ароматический атом углерода; предпочтительные арилы включают фенил и нафтил; в названии соединений формулы I арил представляет собой фенил, замещенный R1 и R2, определенными выше;"циклический ацеталь" относится к соединению формулы II, определенному выше, в котором R3 представляет собой C1-С 6 алкил и оба R4, взятых вместе, представляют собой алкиленовую цепь, содержащую 2 или 3 атома углерода, то есть в которой R3 определен выше и n равно 2 или 3. Предпочтительным классом соединений формулы I, получаемых согласно способу по настоящему изобретению, являются соединения, в которых R1 и R2 независимо представляют водород, метильные группы или атомы фтора или хлора, более предпочтительно R1 и R2 являются атомами хлора, даже более предпочтительно R1 и R2 находятся в положениях 2, 6 бензольного кольца. Предпочтительные конкретные соединения формулы I представляют собой соединения, перечисленные ниже: амид 5-(2-аминопиримидин-4-ил)-2-(2,3-диметилфенил)-1 Н-пиррол-3-карбоновой кислоты,амид 5-(2-аминопиримидин-4-ил)-2-(2,4-дихлорфенил)-1 Н-пиррол-3-карбоновой кислоты. Наиболее предпочтительным соединением формулы I является амид 5-(2-аминопиримидин-4-ил)-2(2,4-дихлорфенил)-1 Н-пиррол-3-карбоновой кислоты. Как указано выше, настоящее изобретение также обеспечивает промежуточное соединение формулы IV' в которой R1' и R2' являются атомами хлора и R5 является таким, как определено выше. Дополнительной целью настоящего изобретения является способ получения промежуточного соединения формулы IV, определенного выше, путем взаимодействия диалкилацеталя формулы II, определенного выше, со сложным бета-кетоэфиром или его солью формулы III, определенным выше, сначала в кислых условиях и затем в водно-спиртовом растворе. Настоящее изобретение также обеспечивает промежуточное соединение формулы V в которой R1, R2 представляют собой хлор или метил и R5 является таким, как определено выше. Следующей целью настоящего изобретения является способ получения промежуточного соединения формулы V, определенного выше, путем обработки соединения формулы IV, определенного выше,ацетилгалогенидом или уксусным ангидридом в присутствии кислоты Льюиса. Также обеспечивается промежуточное соединение енаминон формулы VI в которой R1, R2 представляют собой хлор или метил и R5 является таким, как определено выше. Следующей целью настоящего изобретения является способ получения промежуточного соединения енаминона формулы VI, определенного выше, характеризующийся стадиями (а)-(с), определенными выше. Еще одной целью настоящего изобретения является способ получения промежуточного соединения енаминона формулы VI, определенного выше, путем взаимодействия соединения формулы V, определенного выше, с диалкилацеталем N,N-диметилформамида. Согласно стадии (а) взаимодействие диалкилацеталя формулы II со сложным бета-кетоэфиром или его солью формулы III до получения соединения формулы IV проводят в сильно кислых условиях, например, используя трифторуксусную кислоту (TFA) в качестве растворителя. Предпочтительно сложный бета-кетоэфир является солью, более предпочтительно сложный бета-кетоэфир является солью имидазола. Реакцию можно осуществить при температуре в интервале от комнатной температуры до температуры кипения с обратным холодильником, предпочтительно при температуре между комнатной температу-3 021299 рой и 60. Затем реакционную смесь обрабатывают водно-спиртовым раствором, например этанол/гидроксид натрия. Согласно стадии (b) ацетилирование соединения формулы IV до получения соответствующего ацетилированного производного формулы V проводят с ацетилхлоридом в присутствии кислоты Льюиса,например треххлористого алюминия или четыреххлористого титана, при температуре от -5 С до комнатной температуры в органическом растворителе, например в дихлорметане. Аналогичная реакция описана в J. Het. Chem. 1983, 20, 61. Согласно стадии (с) реакцию соединения формулы V с диалкилацеталем N,N-диметилформамида,например с диметилацеталем или с диизопропилацеталем, можно провести при температуре от комнатной температуры до температуры кипения с обратным холодильником. Предпочтительно реакцию проводят при температуре от 60 до 100 С в органическом растворителе, таком как, например, диоксан. Аналогичное превращение было описано, например, в Heterocycles 1998, 47, 689. Согласно стадии (d) реакцию соединения формулы VI с гуанидином или его солью можно осуществить при температуре от комнатной температуры до температуры кипения с обратным холодильником. Предпочтительно соль гуанидина является гидрохлоридом или карбонатом. Предпочтительно реакцию проводят при температуре от 60 С до температуры кипения с обратным холодильником в органическом растворителе, таком как, например, этанол. Такой вид превращения описан в научной литературе, например в J. Het. Chem. 1989, 26, 1147. Согласно стадии (е) гидролиз соединения формулы VII проводят способами, хорошо известными специалистам в данной области, предпочтительно его проводят в смеси разбавленной NaOH и органического растворителя, такого как, например, диоксан, при температуре от 60 С до температуры кипения с обратным холодильником. Согласно стадии (f) конденсацию соединения формулы VIII проводят способами, хорошо известными специалистам в данной области, предпочтительно ее проводят в органическом растворителе, таком как диоксан, при температуре от комнатной температуры до 80 С, с соответствующим агентом, таким как, например, карбонилдиимидазол, и в соответствующем источнике аммония, таком как 30% водный аммоний. Исходные соединения и реагенты, используемые в способе по настоящему изобретению, являются известными соединениями или могут быть получены из известных соединений путем использования общеизвестных способов. В частности, диалкилацеталь формулы II получен различными способами, хорошо известными специалистам в данной области. Например, получение N-(2,2-диметоксиэтил)ацетамида описано ниже. Сложный бета-кетоэфир или его соль формулы III, если они не являются коммерчески доступными,может быть получен различными способами согласно ссылкам в литературе. Например, для превращения кислот в гомологичные сложные бета-кетоэфиры можно использовать ацилхлориды или карбоновые кислоты путем активирования их 2,2-диметил-1,3-диоксан-4,6-дионом (кислоты Мельдрума), как описано в J. Med. Chem. 2001, 44, 90; из ацилхлоридов и этилгидромалоната, как сообщают в J. Het. Chem. 1990, 27, 1609; из арилэтанонов с диэтилкарбонатом, как показано в Can. J. Chem. 1992, 1323; или из дизамещенных бензойных кислот по реакции с коммерчески доступными малонатами формулы IX, в которых М представляет собой металл, такой как калий, и R3 является таким, как определено выше, в присутствии конденсирующего агента, как сообщают в Synthetic Communications 1990, 20, 773. Например, ниже описано получение этил 3-(2,4-дихлорфенил)-3-оксопропаноата в виде соли имидазола. Следующие примеры иллюстрируют, но не ограничивают изобретение. Получение исходных соединений 8,2 мл ацетилхлорида добавляли к раствору 150 мл этилацетата, 11,2 мл 2,2-диметоксиэтанамина и 21 мл триэтиламина при комнатной температуре. Спустя 1 ч добавляли 1,5 мл этанола. Полученную в результате суспензию перемешивали дополнительно в течение 1 ч и затем фильтровали. Из экстракта путем выпаривания удаляли этилацетат, получая указанное в заголовке соединение в виде масла, которое использовали без дополнительной очистки. 1 Н-ЯМР (ДМСО-d6)м.д.: 7,85 (ушир.с, 1 Н); 4,30 (т; 1 Н); 3,25 (с, 6 Н); 3,10 (т, 2 Н); 1,80 (с, 3 Н). В реакторе, охлажденном до 20 С, 3,76 кг карбонилдиимидазола в 5 л ДМФ добавляли к раствору 4 кг 2,4-дихлорбензойной кислоты в 25 л ДМФ. Спустя 2 ч добавляли 2,4 кг MgCl2 и 7,16 кг моноэтилмалоната калия. Смесь нагревали до 100 С при перемешивании до тех пор, пока реакция не завершалась(контролировали ВЭЖХ), затем охлаждали до комнатной температуры и добавляли по каплям к 80 л воды, давая возможность твердому веществу выпасть в осадок. Твердое вещество затем отделяли фильтрованием, получая на выходе 8,33 кг указанного в заголовке соединения, которое использовали без дополнительной очистки. 1 Н-ЯМР (ДМСО-d6)м.д.: 7,65 (с, 1 Н); 7,55 (с, 1 Н); 7,4 (с, 2 Н); 7,1 (ушир.с, 1 Н); 6,9 (ушир.с, 1 Н); 4,7 (с, 1 Н); 4,0 (кв, 1 Н); 1,15 (т, 3 Н). Пример 1. Стадия а). Этил 2-(2,4-дихлорфенил)-1 Н-пиррол-3-карбоксилат (IV, R1=R2=Cl, R5=этил)TFA. Реакционную смесь нагревали в течение 60 мин при 60 С, затем TFA удаляли выпариванием и маслянистый остаток растворяли в 450 мл этилацетата, дважды промывали в 300 мл воды и затем в 300 мл насыщенного раствора NaHCO3. Отделяли органический слой и выпаривали растворитель, получая на выходе темное масло. Масло обрабатывали 100 мл этанола и 50 мл 2 N раствора NaOH, полученную в результате реакционную смесь перемешивали при комнатной температуре в течение ночи, затем фильтровали, получая на выходе указанное в заголовке соединение в виде твердого вещества от белого до желтовато-белого цвета (7,2 г). 1 Н-ЯМР (ДМСО-d6)м.д.: 7,7 (д, 1 Н); 7,45 (дд, 1 Н); 7,4 (д, 1 Н); 6,87 (д, 1 Н); 6,5 (д, 1 Н); 4,0 (кв, 2 Н); 1,0 (т, 3 Н). Ту же самую процедуру повторяли до получения необходимого количества указанного в заголовке соединения, обладающего теми же самыми физико-химическими свойствами. Стадия b). Этил 5-ацетил-2-(2,4-дихлорфенил)-1 Н-пиррол-3-карбоксилат (V, R1=R2=Cl, R5=этил) В круглодонной колбе при комнатной температуре растворяли 11,8 г этил 2-(2,4-дихлорфенил)-1 Нпиррол-3-карбоксилата (IVa) в 230 мл дихлорметана, получая суспензию желтого цвета. Затем к суспензии желтого цвета добавляли 4,72 мл ацетилхлорида с последующим добавлением 16,5 г AlCl3, наблюдая образование раствора красного цвета. Спустя 30 мин реакция завершалась и реакционную смесь по каплям добавляли в 230 мл 2 N раствора HCl при тщательном перемешивании, поддерживая температуру ниже 40 С. Конечную гомогенную смесь охлаждали до 4 С в течение 2 ч, затем фильтровали и получившееся в результате твердое вещество промывали 20 мл воды, получая на выходе первую порцию 9,4 г указанного в заголовке соединения. Органический слой отделяли от двухфазного маточного раствора и уменьшали объем выпариванием. Получившееся в результате масло обрабатывали 20 мл этанола и охлаждали до -20 С в течение 1 ч. Путем фильтрования получали вторую порцию, которая давала на выходе 2,1 г указанного в заголовке соединения. Две порции объединяли, получая 11,5 г указанного в заголовке соединения, которое использовали без дополнительной очистки. Н 1-ЯМР (ДМСО-d6)м.д.: 7,57 (д, 1 Н); 7,45 (с, 1 Н); 7,41 (дд, 1 Н); 7,37 (д, 1 Н); 4,10 (кв, 2 Н); 1,1 (т,3 Н). К 10,6 г этил 5-ацетил-2-(2,4-дихлорфенил)-1 Н-пиррол-3-карбоксилата (V) добавляли 37 мл диоксана и 27 мл диизопропилацеталя N,N-диметилформамида. Реакционную смесь нагревали при 95 С в течение 12 ч, затем охлаждали до комнатной температуры и фильтровали. Твердое вещество промывали три раза 10 мл диоксана, получая на выходе 11,7 г указанного в заголовке соединения в виде твердого вещества белого цвета, которое использовали без дополнительной очистки. 1 Н-ЯМР (ДМСО-d6)м.д.: 7,7 (д, 1 Н); 7,6 (д, 1 Н); 7,45 (дд, 1 Н); 7,40 (д, 1 Н); 7,2 (с, 1 Н); 5,75 (д, 1 Н); 4,0 (кв, 2 Н); 3,1 (ушир.с, 3 Н); 2,9 (ушир.с, 3 Н); 1,05 (т, 3 Н). Ту же самую процедуру повторяли до получения необходимого количества указанного в заголовке соединения, обладающего теми же самыми физико-химическими свойствами. Стадия d). Этил 5-(2-аминопиримидин-4-ил)-2-(2,4-дихлорфенил)-1 Н-пиррол-3-карбоксилат (VII,R1=R2=Cl; R5=этил)(VIa) растворяли в 200 мл этанола. Добавляли 8,1 г гуанидингидрохлорида и 28 мл EtONa в EtOH 21% вес./вес. и получившийся в результате раствор перемешивали при температуре кипения с обратным холодильником в течение 24 ч. Этанол выпаривали и остаток растворяли в 200 мл этилацетата. Органическую фазу промывали 200 мл воды, затем 200 мл водного раствора (96% воды, 1,5% уксусной кислоты,2,5% солевого раствора). Органический слой затем концентрировали путем выпаривания до небольшого объема и охлаждали при 4 С в течение 2 ч. Твердое вещество извлекали фильтрованием, получая на выходе 8,9 г указанного в заголовке соединения. Маточный раствор уменьшали выпариванием до небольшого объема и добавляли 20 мл пентана; смесь охлаждали при 4 С в течение 2 ч, затем фильтровали,получая 1,6 г указанного в заголовке соединения в виде твердого вещества от белого до желтоватого цвета. Две порции объединяли, получая 10,5 г указанного в заголовке соединения, которое использовали без дополнительной очистки. 1 Н-ЯМР (ДМСО-d6)м.д.: 8,20 (д, 1 Н); 7,71 (ушир.с, 1 Н); 7,48 (с, 2 Н); 7,27 (с, 1 Н); 7,00 (д, 1 Н); 6,40 10,5 г этил 5-(2-аминопиримидин-4-ил)-2-(2,4-дихлорфенил)-1 Н-пиррол-3-карбоксилата (VIIa) обрабатывали 80 мл диоксана, 100 мл воды и 10 мл раствора NaOH 35% вес./вес. Смесь нагревали до температуры кипения с обратным холодильником в течение 8 ч. Затем добавляли 100 мл этилацетата и 100 мл воды. Водную фазу отделяли и ее рН доводили до 6 добавлением 6 N раствора HCl, затем фильтровали, получая на выходе указанное в заголовке соединение (10,1 г) в виде твердого вещества светложелтого цвета, которое использовали без дополнительной очистки. 1 Н ЯМР (ДМСО-d6/400 МГц)м.д.: 8,2 (д, 1 Н); 7,7 (м, 1 Н); 7,46 (ушир.с, 2 Н); 7,2 (с, 1 Н); 6,95 (д,1 Н); 6,4 (ушир.с, 2 Н) МС: m/z 347 [М-Н+]. Стадия f). Амид (2-Аминопиримидин-4-ил)-2-(2,4-дихлорфенил)-1 Н-пиррол-3-карбоновой кислоты Раствор 9,3 г карбонилдиимидазола в 80 мл диоксана по каплям добавляли к смеси 10,1 г (2-6 021299 аминопиримидин-4-ил)-2-(2,4-дихлорфенил)-1 Н-пиррол-3-карбоновой кислоты (VIIIa) в 50 мл диоксана при 60 С. Далее 4,9 г карбонилдиимидазола добавляли тремя порциями к реакционной смеси при 60 С. Реакционной смеси давали возможность остыть до комнатной температуры, затем добавляли 15 мл 30% вес./вес. раствора NH3 в воде и реакционную смесь перемешивали в течение трех дней при комнатной температуре. Твердое вещество извлекали фильтрованием и промывали 15 мл раствора, состоящего из 30% вес./вес. раствора NH3 в воде, воды и диоксана в соотношении 1:1:1, получая на выходе 8,1 г указанного в заголовке в виде твердого вещества желтого цвета. 1 Н ЯМР (ДМСО-d6/400 МГц)м.д. 6,81 (ушир.с, 1 Н), 6,95 (ушир.с, 2 Н), 7,01 (д, J=5,73 Гц, 1 Н), 7,37(ушир.с, 1 Н), 7,46 (д, J=2,68 Гц, 1 Н), 7,68 (дд, J=l,77, 0,55 Гц, 1 Н), 8,23 (д, J=5,73 Гц, 1 Н), 12,17 (ушир.с,1 Н); ESI (+) МС: m/z 348 (МН+). Пример 2. Действуя так, как описано в стадиях a)-f) примера 1 и начиная с замещенного соответствующим образом сложного бета-кетоэфира или его соли формулы (III, R1=R2=CH3); 1H ЯМР (ДМСО-d6/500 МГц)м.д.: 1,15 (т, J=7,07 Гц, 3 Н), 2,21 (с, 3 Н), 2,25 (с, 3 Н), 4,00 (кв, J=7,09 Гц, 2 Н), 4,61 (с, 2 Н), 6,91 (с, 0 Н), 6,96-7,03 (м, 2 Н), 7,04-7,07 (м, 1 Н), 7,11 (с, 1 Н), 7,63 (с, 1 Н). можно получить соответственно следующее соединение: амид 5-(2-аминопиримидин-4-ил)-2-(2,3-диметилфенил)-1 Н-пиррол-3-карбоновой кислоты; 1 Н ЯМР (ДМСО-d6/500 МГц)м.д.: 1,03 (т, J=7,14 Гц, 3 Н), 1,98 (с, 3 Н), 2,27 (с, 3 Н), 3,97 (кв, J=7,05 Гц, 2 Н), 6,49 (т, J=2,54 Гц, 2 Н), 6,80 (т, J=2,40 Гц, 1 Н), 6,98-7,05 (м, 1 Н), 7,09 (т, J=7,62 Гц, 1 Н), 7,18 (д,J=7,41 Гц, 1 Н), 11,41 (ушир.с, 1 Н). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения 5-(2-аминопиримидин-4-ил)-2-арил-1 Н-пиррол-3-карбоксамида формулы I в которой R1 и R2 независимо представляют собой галоген или C1-С 6 алкил,где указанный способ включает: а) взаимодействие ацеталя формулы II в которой R3 является C1-С 6 алкилом и оба R4 независимо представляют собой C1-C6 алкил или совместно представляют собой алкиленовую цепь, содержащую 2 или 3 атома углерода и формирующую циклический ацеталь,со сложным бета-кетоэфиром или его солью формулы III(b) ацетилирование полученного в результате соединения формулы IV в которой R1, R2 и R5 являются такими, как определено выше,с ацетилгалогенидом или уксусным ангидридом в присутствии кислоты Льюиса;(с) взаимодействие полученного в результате соединения формулы V(d) взаимодействие полученного в результате енаминона формулы VI в которой R1, R2 и R5 являются такими, как определено выше,с гуанидином или его солью;(е) гидролиз сложноэфирной группы эфира карбоновой кислоты полученного в результате соединения формулы VII(f) конденсацию карбоксильной группы карбоновой кислоты полученного в результате соединения формулы VIII в которой R1 и R2 являются такими, как определено выше,с формой аммиака с образованием карбоксамида формулы I, как определено выше; и, необязательно, превращение в фармацевтически приемлемую соль. 2. Промежуточное соединение формулы IV'R5 является таким, как определено в п.1. 3. Способ получения соединения формулы IV, как определено в п.1, который включает взаимодействие диалкилацеталя формулы II, как определено в п.1, со сложным бета-кетоэфиром или его солью формулы III, как определено в п.1, сначала в кислых условиях, затем в водно-спиртовом растворе. 4. Способ по п.1 или 3, отличающийся тем, что взаимодействие осуществляют в сильнокислых условиях, используя трифторуксусную кислоту в качестве растворителя, при температуре от комнатной температуры до температуры кипения с обратным холодильником; затем реакционную смесь обрабатывают водно-спиртовым раствором, таким как этанол/гидроксид натрия. 5. Способ по пп.1, 3 или 4, отличающийся тем, что сложный бета-кетоэфир является солью имидазола. 6. Промежуточное соединение формулы V в котором R1, R2 представляют собой хлор или метил и R5 является таким, как определено в п.1. 7. Способ получения соединения формулы V, как определено в п.6, в котором способ включает обработку соединения формулы IV, как определено в п.1, ацетилгалогенидом или ангидридом уксусной кислоты в присутствии кислоты Льюиса. 8. Способ по п.1 или 7, отличающийся тем, что ацетилирование выполняют с ацетилхлоридом в присутствии кислоты Льюиса, такой как трихлорид алюминия или тетрахлорид титана, при температуре от -5 С до комнатной температуры в органическом растворителе. 9. Способ по п.8, отличающийся тем, что органический растворитель представляет собой дихлорметан. 10. Промежуточный енаминон формулы VI в котором R1, R2 представляют собой хлор или метил и R5 является таким, как определено в п.1. 11. Способ получения соединения формулы VI, как определено в п.10, где способ включает стадии(а)-(с), как определено в п.1. 12. Способ получения соединения формулы VI, как определено в п.10, в котором способ включает взаимодействие соединения формулы V, как определено в п.6, с диалкилацеталем N,Nдиметилформамида. 13. Способ по пп.1, 11 или 12, отличающийся тем, что реакцию проводят, используя диалкилацеталь, такой как диметил- или диизопропилацеталь N,N-диметилформамида, при температуре между комнатной и температурой кипения с обратным холодильником в органическом растворителе. 14. Способ по п.13, отличающийся тем, что органический растворитель представляет собой диоксан. 15. Способ по любому из пп.1, 4, 5, 8 или 13, отличающийся тем, что соединение формулы I представляет собой амид 5-(2-аминопиримидин-4-ил)-2-(2,3-диметилфенил)-1 Н-пиррол-3-карбоновой кислоты; амид 5-(2-аминопиримидин-4-ил)-2-(2,4-дихлорфенил)-1 Н-пиррол-3-карбоновой кислоты. 16. Способ по любому из пп.1, 4, 5, 8 или 13, отличающийся тем, что соединение формулы I представляет собой амид 5-(2-аминопиримидин-4-ил)-2-(2,4-дихлорфенил)-1 Н-пиррол-3-карбоновой кислоты.
МПК / Метки
МПК: C07D 403/04, C07D 207/34
Метки: получения, способ, 5-(2-аминопиримидин-4-ил)-2-арил-1н-пиррол-3-карбоксамидов
Код ссылки
<a href="https://eas.patents.su/10-21299-sposob-polucheniya-5-2-aminopirimidin-4-il-2-aril-1n-pirrol-3-karboksamidov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 5-(2-аминопиримидин-4-ил)-2-арил-1н-пиррол-3-карбоксамидов</a>
Предыдущий патент: Ингибиторы cxcr1/2 в качестве адъювантов трансплантата островковых клеток поджелудочной железы
Следующий патент: Азотсодержащее гетероциклическое соединение и сельскохозяйственный фунгицид
Случайный патент: Применение композиции, содержащей обогащенный анти-lps-антителами иммуноглобулиновый препарат, для лечения заболеваний печени














