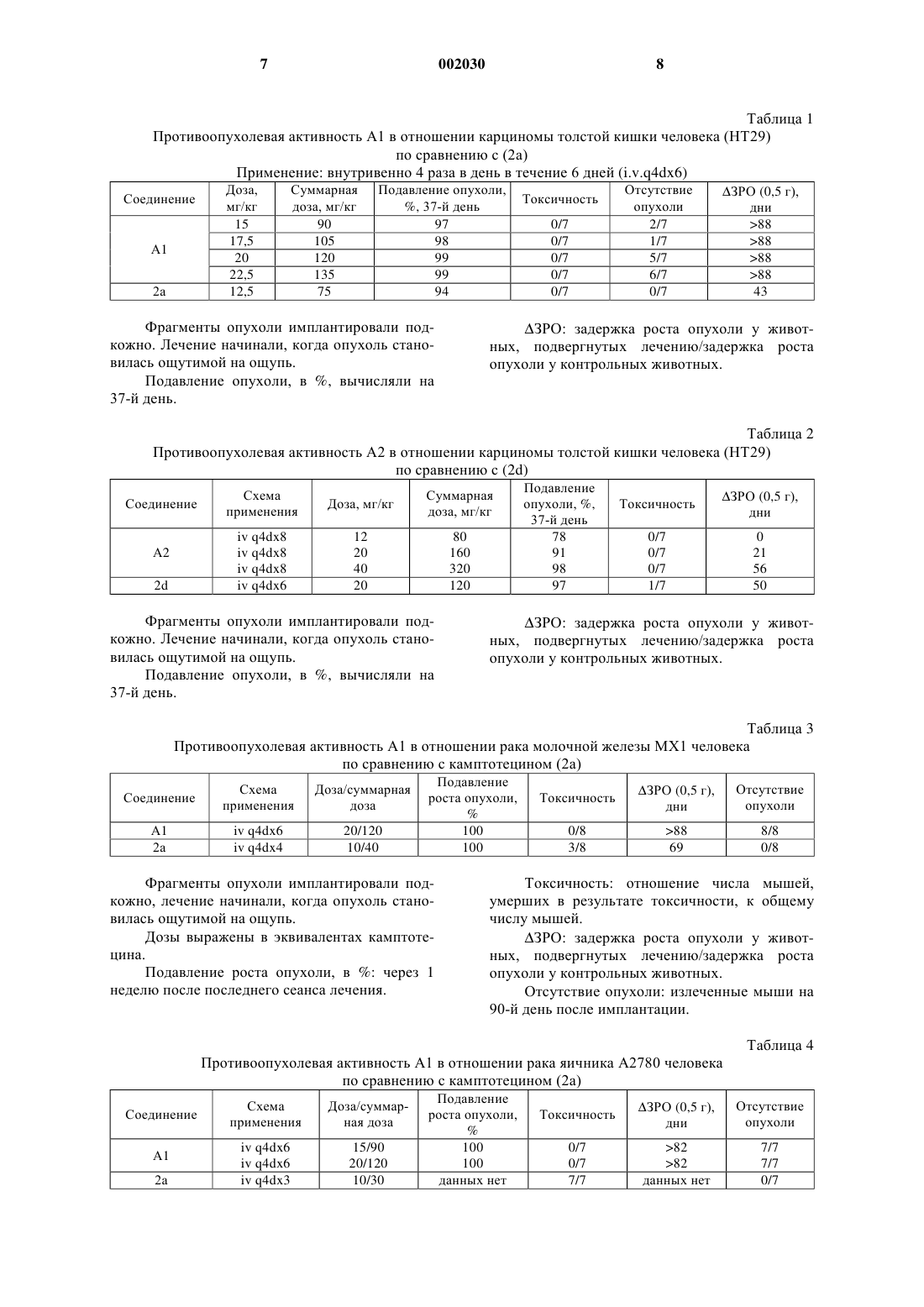
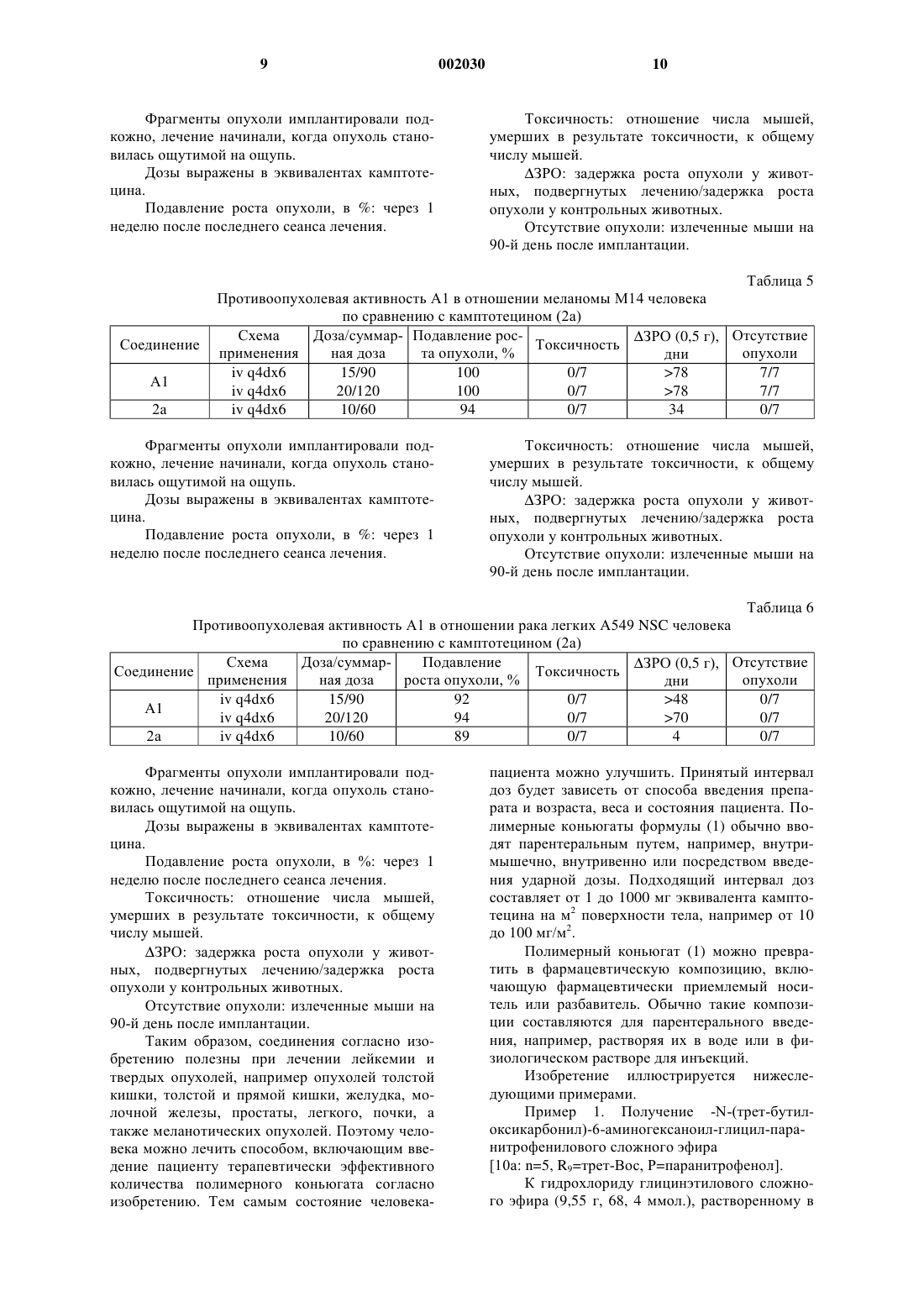
Полимерные производные камптотецинов
Номер патента: 2030
Опубликовано: 24.12.2001
Авторы: Анджелуччи Франческо, Суарато Антонино, Факин Габриеле, Дзамаи Морено, Кайольфа Валерия, Орци Фабрицио
Формула / Реферат
1. Полимерный конъюгат, содержащий
(i) от 85 до 97 мол.% N-(2-гидроксипропил)метакрилоиламидных звеньев, представленных формулой (3)
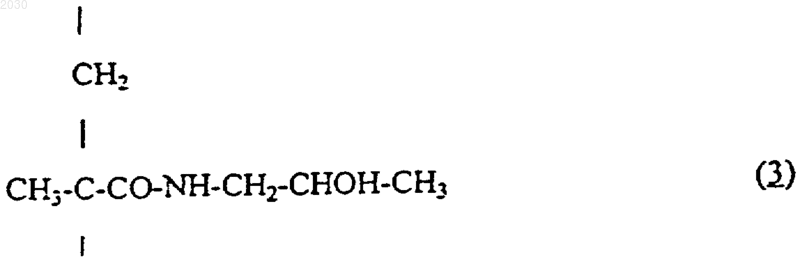
(ii) от 3 до 15 мол.% 20-O-(N-метакрилоил-глицил-аминоацил-глицил)камптотециновых звеньев, представленных формулой (4)
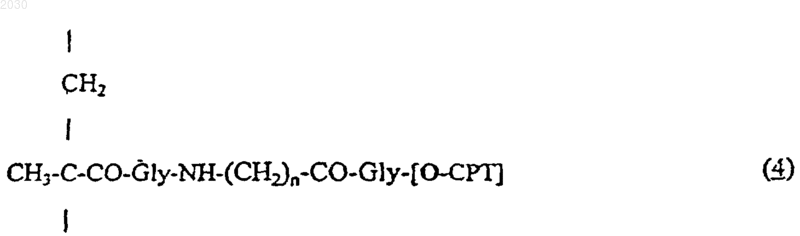
где n принимает значения от 2 до 8, -[O-СРТ] представляет собой остаток камптотецина формулы (2)
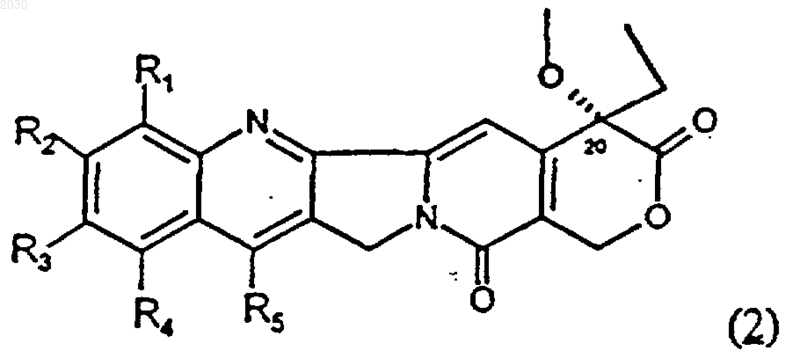
связанный в положении С-20, в котором каждый из R1, R2, R3, R4 и R5, являющихся одинаковыми или различными, представляет собой водород, C1-С2 линейный или разветвленный алкил, нитрогруппу, аминогруппу,
(СН2)aNR6R7, где а принимает значения от 0 до 4, R6 и R7 означают водород, или один из R6 или R7 означает водород, а другой означает C1-C6алкил, или NR6R7 является пиперазино- или N-алкил-пиперазино-циклом, который может быть замещен C1-С6 линейным или разветвленным алкилом, или пиперидино-циклом,
(CH2)aNHCOR8, где а принимает вышеуказанные значения, a R8 представляет собой С1-С8 линейный или разветвленный алкил или группу NR6R7 как определено выше;
гидроксильную группу или O-CO-R8, где R8 имеет вышеуказанные значения или представляет собой 1-пиперидино-цикл или 1,4'-бипиперидин,
или R2 и R3 совместно представляют собой остаток O-(СН2)b-O, в котором b равно 1 или 2,
или R4 и R5 представляют собой остаток (СН2)m, в котором m принимает значения от 2 до 4, или остаток СН2-О-СН2 или CH2NHCH2 и
(iii) от 0 до 12 мол.% N-метакрилоил-глициновых или N-(2-гидроксипропил)метакрилоил-глицинамидных звеньев формулы (5)
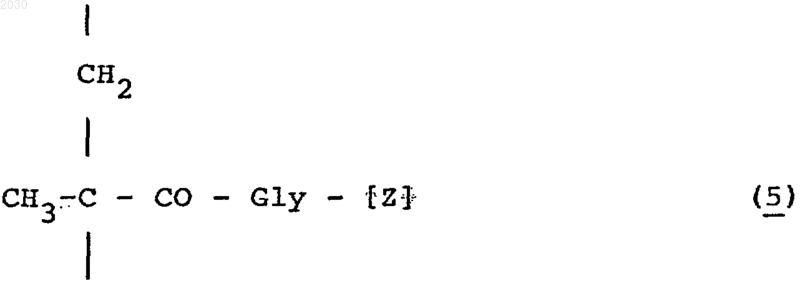
в которой [Z] означает гидроксильную группу или остаток, имеющий формулу -NН-СН2-СН(ОН)-СН3.
2. Полимерный конъюгат по п.1, содержащий N-(2-оксипропил)метакрилоиламидные звенья, представленные формулой (3), в количестве 90 мол.%.
3. Полимерный конъюгат по п.1, содержащий 10 мол.% звеньев, представленных формулой (4).
4. Полимерный конъюгат по п.1, в котором звено, представленное формулой (5), отсутствует.
5. Полимерный конъюгат по п.1, в котором -[О-СРТ] в формуле (4) представляет собой остаток камптотецина формулы (2), выбранный из камптотецина, 9-аминокамптотецина, 9-нитрокамптотецина, 7-этил-10-гидроксикамптотецина, 7-этил-10-[1,4'-бипиперидинил]карбонилоксикамптотецина и 7-метилендиметиламино-10-гидроксикамптотецина.
6. Полимерный конъюгат по п.1, в котором содержание активного производного камптотецина формулы (2) равно 10% (мас./мас.).
7. Способ получения полимерного конъюгата по п.1, включающий реакцию производного 20-O-(аминоацил-глицил)камптотецина формулы (6)
NH2-(CH2)n-CO-Gly-[O-CPT] (6)
где n и [O-СРТ] имеют значения, указанные в п.1, с полимером (В), содержащим, в основном, от 85 до 97 мол.% N-(2-гидроксипропил)метакрилоиламидных звеньев, представленных формулой (3), как определено в п.1, и от 3 до 15 мол.% звеньев N-метакрилоил-глицил производного, представленных формулой (7)

где [Y] - остаток активного сложного эфира или гидроксильная группа, и необязательное замещение оставшихся групп активного сложного эфира 1-амино-2-пропанолом.
8. Способ получения полимерного конъюгата по п.1, включающий полимеризацию N-(2-гидроксипропил)метакриламида формулы (8)
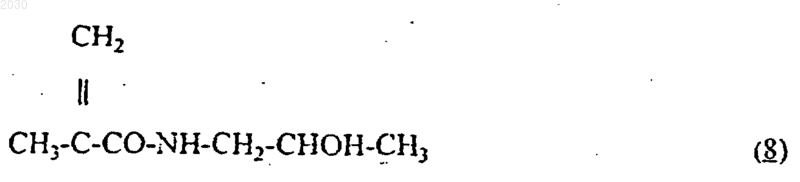
с производными 20-O-[метакрилоил-глицил-(аминоацил)-глицил]камптотецина формулы (9)
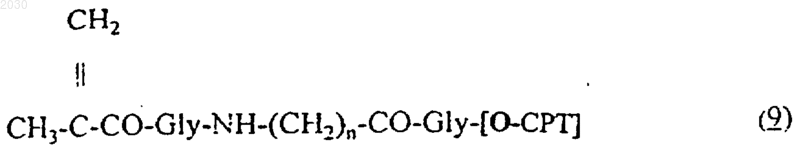
где n и [O-СРТ] такие, как определено в п.1, в условиях, позволяющих сохранить характер связи между камптотецином и глицил-аминоацил-глициловым спейсером, а также характер конъюгата.
9. Производное 20-O-[(аминоацил)-глицил]камптотецина формулы (6), как определено в п.7, или его соль.
10. Способ получения соединения формулы (6), как определено в п.7, включающий конденсацию производного формулы (2), как определено в п.1, с N-защищенным аминоацил-глицил производным формулы (10)
R9-HN-(CH2)n-CO-Gly-[P] (10)
где значение n определено как в п.1, R9 представляет собой защитную группу для аминогруппы, а [Р] представляет собой остаток активированного сложного эфира, с получением соединения формулы (11)
R9-NH-(CH2)n-CO-Gly-[OCPT] (11)
где n и R9 определены выше, [O-СРТ] определено в п.1; и снятие защитной N-группы с получаемого соединения.
11. Производное 20-O-[метакрилоил-глицил-(аминоацил)-глицил]камптотецина формулы (9), как определено в п.8, или его соль.
12. Способ получения производного формулы (9), как определено в п.11, включающий конденсацию производного камптотецина формулы (6), как определено в п.7, с N-метакрилоил-глицилом формулы (7')

где [Y'] - уходящая группа.
13. Полимерный конъюгат по п.1, представляющий собой МАG-камптотецин, где MAG означает метакрилоил-глициновый полимер, и содержание камптотецина равно 10% мас./мас.
14. Полимерный конъюгат по п.1, получаемый в результате реакции между производным 20-O-(6-аминогексаноил-глицил)камптотецина формулы (6)
NH2-(CH2)6-CO-Gly-[O-CPТ] (6)
где [O-СРТ] - остаток камптотецина, с полимером (В), содержащим, в основном, от 85 до 97 мол.% N-(2-гидроксипропил)метакрилоиламидных звеньев формулы (3), как определено в п.1, и от 3 до 15 мол.% звеньев производного N-метакрилоил-глицила формулы (7)
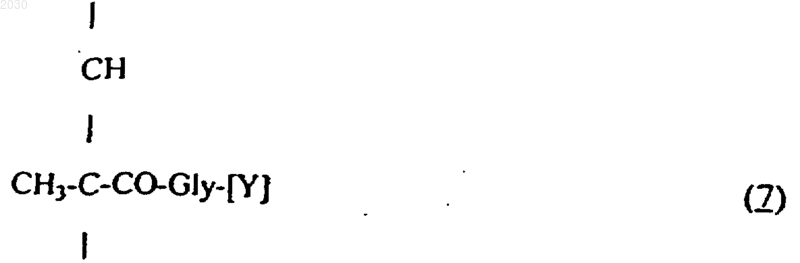
где [Y] - паранитрофеноксигруппа, и необязательного замещения оставшихся групп активного сложного эфира 1-амино-2-пропанолом.
15. Полимерный конъюгат по п.1, получаемый в результате полимеризации N-(2-гидроксипропил)метакриламида формулы (8)
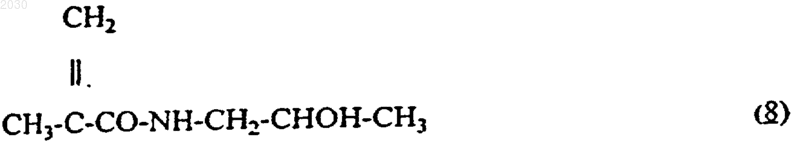
с производными 20-O-[метакрилоил-глицил-(6-аминогексаноил)-глицил]камптотецина формулы (9)
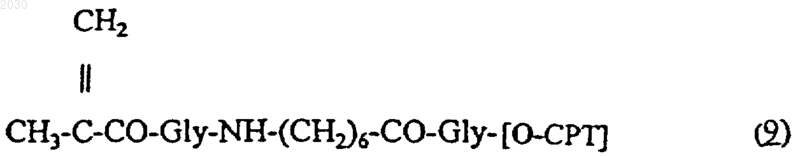
где [O-СРТ] - остаток камптотецина.
16. Фармацевтическая композиция, содержащая фармацевтически приемлемый разбавитель или носитель и в качестве активного ингредиента полимерный коньюгат по любому из пп.1-6 или 13-15 или соединение формулы (6) или (9) по п.9 или 11.
Текст
1 Изобретение относится к полимерным конъюгатам 20-O-[глицил-аминоацил-глицил] камптотецинов. В заявке WO-95/10304 описаны и заявлены конъюгаты камптотецинов, связанные с полимером через пептидиловый спейсер. Теперь нами обнаружено, что конъюгаты, в которых спейсером является глицил-аминоацилглицил, представляют исключительную ценность как антиопухолевые агенты и обладают поразительной противоопухолевой активностью и меньшей токсичностью по сравнению со свободным лекарственным средством. В частности, данное изобретение дает полимерные конъюгаты формулы (1), содержащие где n принимает значение от 2 до 8, -[O-СРТ] представляет собой остаток камптотецина формулы (2) который связан в положении С-20, и в котором каждый из R1, R2, R3, R4 и R5, являющихся одинаковыми или различными, представляет собой водород, C1-С 2 линейный или разветвленный алкил, нитрогруппу, аминогруппу,(СН 2)aNR6R7, где а принимает значения от 0 до 4, R6 и R7 означают водород, или один из R6 или R7 означает водород, а другой из R6 или R7 означает С 1-С 6 алкил, или NR6R7 является пиперазино- или N-алкил-пиперазиноциклом, который может быть замещен С 1-С 6 линейным или разветвленным алкилом, или пиперидиноциклом,(СН 2)aNHCOR8, где а принимает вышеуказанные значения, а R8 представляет собой С 1-С 8 линейный или разветвленный алкил или группуR8 имеет вышеуказанные значения или представляет собой 1-пиперидино-цикл или 1,4'-бипиперидин,или R2 и R3 совместно представляют собой остаток O-(СН 2)b-O, в котором b равно 1 или 2, 002030(СН 2)m, в котором m принимает значения от 2 до 4, или остаток СН 2-О-СН 2 или CH2NHCH2 и в которой [Z] означает гидроксильную группу или остаток, имеющий формулу -NH-CH2CH(OH)-CH3. Полимерные конъюгаты формулы (1) можно обозначить аббревиатурой MAG-CPT, а также представить следующим образом:z составляет от 0 до 12 мол.%. Предпочтительными вариантами соединений согласно изобретению являются соединения, в которых -[O-СРТ] в формуле (4) представляет собой остаток камптотецина формулы(2), выбранного из камптотецина [2 а: R1=R2=R3=R4=R5=Н]; 9-аминокамптотецина [2b: R1=R2=R3=R5= Н, R4-NH2]; 9-нитрокамптотецина [2 с: R1=R2=R3=R5=H,R4=NO2]; 7-этил-10-гидроксикамптотецина [2d: R1=R1=R2=R4=Н,R3=ОН,R5=СН 2N(СН 3)2] и 7-[метилен-(4'-метилпиперазино)]-9,10 этилендиоксикамптотецина [2g: R1=R4=H, R2,R3=O-CH2CH2-O, R5=метилен-(4'-метилпипeразино)]. Предпочтительно, чтобы полимерные конъюгаты формулы (1) содержали звенья N-(2 гидроксипропил)метакрилоил амида, представленные формулой (3), в количестве 90% или более, предпочтительно 90%. Коньюгаты могут также содержать от 3 до 10 мол.% звеньев,представленных формулой (4), предпочтительно 10 мол.% таких звеньев. Предпочтительно, чтобы конъюгат формулы (1) не содержал остатков,представленных формулой (5), т.е. чтобы z=0. Содержание активного производного камптотецина формулы (2) в коньюгате формулы(1) может быть от 2 до 15% (массовое отношение, далее - мас./мас.), предпочтительно 10%(мас./мас.). Соединения согласно изобретению могут быть получены способом (который назван Путь I), включающим взаимодействие 20-O 3(аминоацил-глицил) производного камптотецина формулы (6)(6) где n и [ОСРТ] имеют значения, определенные выше, с полимером (В), содержащим, в основном от 85 до 97 мол.% N-(2-гидроксипропил) метакрилоиламидных звеньев формулы (3), как определено выше, и от 3 до 15 мол.% звеньев производного N-метакрилоил-глицила формулы где [Y] - остаток активного сложного эфира,предпочтительно паранитрофенилового эфира,или гидроксильная группа, и необязательное замещение оставшихся групп активного сложного эфира 1-амино-2-пропанолом. Реакцию конденсации производного формулы (6) с полимером формулы (В) проводят в условиях, позволяющих сохранить характер связи между камптотецином и аминоацилглициловым спейсером, а также характер конъюгата. Полимеры формулы (В), состоящие из звеньев N-(2-гидроксипропил)метакрилоиламида формулы (3) и из звеньев N-метакрилоилглицина формулы (7), получают сополимеризацией N-(2-гидроксипропил)метакриламида с Nметакрилоил-глицином или с N-метакрилоилглициновыми производными активного сложного эфира, как описано в Makromol. Chem. 178,2159 (1977). Остаток [Y] может представлять собой феноксигруппу, замещенную на фенильном кольце одной или несколькими электронакцепторными группами, например, нитрогруппами или водородом. Остаток [Y] предпочтительно представляет собой паранитрофеноксигруппу. Реакция между (6) и (В) с образованием полимерного лекарственного конъюгата формулы (1) согласно изобретению обычно может проводиться при температуре от 15 до 30 С,предпочтительно при комнатной температуре в течение 15 ч; затем можно провести аминолиз оставшихся групп активного сложного эфира в присутствии 1-амино-2-пропанола при комнатной температуре в течение 0,5-1 ч. Коньюгат осаждают этилацетатом, растворяют в этаноле и переосаждают этилацетатом. Например, полимер (В), в котором [Y] представляет собой остаток активного сложного эфира, с концентрацией, равной 15% (отношение массы к объему, далее - мас./об.) в безводном диметилсульфоксиде, обрабатывают 3%(мас./об.) производного 20-O-(аминоацилглицил)камптотецина (6) при комнатной температуре в течение 15 ч. Затем добавляют 0,1% 4 реакционную смесь при комнатной температуре в течение 1 ч. Полимерный лекарственный конъюгат, MAG-CPT, можно осадить этилацетатом, собрать, промыть этилацетатом, затем растворить абсолютным этанолом с концентрацией 10% (мас./об.) и вновь осадить этилацетатом для получения конъюгатов формулы (1) согласно изобретению. Содержание камптотецина в полимерном конъюгате согласно изобретению определяют методом жидкостной хроматографии высокого разрешения или абсорбционной спектроскопии. Соединенияформулы (1) могут быть получены также способом (который назван ПутьII, включающим полимеризацию между N-(2 гидроксипропил)метакриламидом формулы (8) где n и [ОСРТ] такие, как определено выше, в условиях, позволяющих сохранить характер связи между камптотецином и глициламиноацил-глициловым спейсером, а также характер конъюгата. Обычно реакция между (8) и (9) может проводиться при температуре от 50 до 70 С,предпочтительно при 60 С, в течение 6-24 ч,предпочтительно в течение 15 ч, в апротонном растворителе, таком как диметилсульфоксид, и в присутствии катализатора, такого как 2,2'азобисизобутиронитрил. Конъюгат осаждают этилацетатом, растворяют в этаноле и переосаждают этилацетатом. Например,N-(2-гидроксипропил)метакриламид (8) с концентрацией 22% (мас./об.) и 20-O-[метакрилоил-глицил-(6-аминогексаноил)глицил]камптотециновое производное (9) с концентрацией 6% (мас./об.) в безводном диметилсульфоксиде нагревают при 60 С в атмосфере азота, затем добавляют 2,2'-азобисизобутиронитрил с концентрацией 1,3% (мас./об.). Смесь перемешивают в течение 24 ч. Затем реакционную смесь охлаждают при комнатной температуре, а конъюгат осаждают этилацетатом, растворяют в этаноле, и переосаждают этилацетатом с получением конюгата формулы (1) согласно изобретению. Изобретение также относится к производным 20-O-(аминоацил-глицил)камптотецина (6) как определено выше и их солям. Кроме того, в данном изобретении предусмотрен способ получения производных 20-O(аминоацил-глицил)камптотецина (6), включающий конденсацию остатка, представленного формулой (2) как определено выше, с N 5 защищенным аминоацил-глицил производным формулы (10)(10) где значение n определено выше, R представляет собой защитную группу для аминогруппы,такую как бутоксикарбонил (Вос), 9-флуоренилметоксикарбонил (FMOC), трифенилсилил, дифенилметилен или трифенилметил, а [Р] представляет собой остаток активированного сложного эфира, такой как паранитрофенокси или Nоксисукцинимидо, с получением соединения формулы (11)(11) где n, [ОСРТ] и R9 определены выше; и снятие защитной N-группы с получаемого соединения. Соединение формулы (10) получают в соответствии со стандартными процедурами синтеза, известными из литературы. ПодходящиеN-защищенные аминоацил-производные формулы (10) включают 6-N-(трифенилметил)гексаноил-глицил-паранитрофениловый эфир (10 а),6-N-(трет-бутоксикарбонил)гексанонил-глицилпаранитрофениловый эфир (10b). Так, например, камптотецин (2 а) можно ввести в реакцию в молярном избытке, например, в пятикратном молярном избытке или выше, в особенности в случае 2-молярного эквивалента N-защищенного аминоацильного производного формулы (10) в безводном растворителе, таком как безводный диметилсульфоксид, в присутствии 4-диметиламинопиридина. Реакцию можно проводить в течение 8-48 ч, при температуре от 15 до 40 С. Временную аминозащитную группу R9 снимают при помощи соответствующего противозащитного агента, и получают 20-O-(аминоацил-глицил) камптотецин формулы (6 а). Поэтому снятие защиты можно осуществить кислотной обработкой, например, обработкой 1,5 Н водным раствором соляной кислоты в уксусной кислоте или 90% водным раствором трифторуксусной кислоты в течение 1-6 ч при температуре от 10 до 30 С, предпочтительно в течение 2 ч при комнатной температуре. Настоящее изобретение также относится к производным 20-O-[метакрилоил-глицил-(аминоацил)-глицил]камптотецина (9), как определено выше, и способу их получения, включающему конденсацию производных камптотецина формулы (6), как определено выше, с Nметакрилоил-глицилом формулы (7') где [Y'] - уходящая группа. Так например, 20-O[аминоацил-глицил]камптотецин (6 а) с концентрацией 25% (мас./об.) в безводном диметилсульфоксиде приводят во взаимодействие с паранитрофениловым эфиром N-метакрилоилглицила 7'), [Y']=паранитрофенол), 13%(мас./об.) в присутствии эквивалентного коли 002030 6 чества основания, такого как триэтиламин, в течение 15 ч при комнатной температуре. Конечное производное выделяют осаждением и очищают методом хроматографии. Соединения формулы (8) и полимер (В) известны или могут быть синтезированы известными способами. Все производные камптотецина формулыReviews, т. 17,4, 367-425, 1997) или могут быть получены хорошо известными методами. Молекулярный вес полимерных конъюгатов формулы (1) лежит в пределах от 5000 до 45000, предпочтительно в пределах от 18000 до 35000. Полимерные лекарственные конъюгаты формулы (1) растворимы в воде и проявляют поразительную противоопухолевую активность и меньшую токсичность по сравнению со свободным камптотецином. Противоопухолевая активность Соединение А 1 испытывали на карциноме толстой кишки человека (НТ 29), трансплантированной мышам, и сравнивали со свободным лекарственным средством (2 а) при внутривенном введении. А 1 оказался нетоксичным и дал 95% подавления опухоли при всех испытанных дозах и исключительно большом числе безопухолевых животных в конце эксперимента (90 дней) (табл. 1). Соединение А 2, испытанное на той же модели по сравнению со свободным 7 этил-10-гидроксикампотенцином (2d), оказалось активным и нетоксичным, дало 98% подавления опухоли при самой высокой испытанной дозе в 40 мг/кг (табл. 2). Соединение А 1 испытывали также при внутривенном введении на широком спектре других моделей опухолей человека: рак яичника А 2780, рак молочной железы МХ 1, рак легких А 549 NSC и меланома М 14. Соединение А 1 было активнее свободного камптотецина (2 а) и дало большое число излеченных животных. Данные по активности против рака молочной железы МХ 1, рака яичника А 2780, и меланомы M14, по сравнению со свободным камптотецином, представлены в табл. 3, 4 и 5, соответственно. Соединение А 1 действовало весьма активно против этих моделей опухолей: полное подавление роста опухоли для них наблюдалось при общем отношении 7/7 и 8/8 излеченных мышей и внутривенном введении лекарственного средства в количестве 15 или 20 мг/кг со схемой применения: 4 раза в день в течение 6 дней(q4dx6). Соединение А 1 оказалось также активным против рака легких А 549 NSC в дозе 20 мг/кг (внутривeнно 4 раза в день в течение 6 дней (i.v. q4dx6: 94-процентное подавление опухоли и поразительная 70-дневная задержка роста опухоли, не наблюдаемая при использовании других химиотерапевтических средств Таблица 1 Противоопухолевая активность А 1 в отношении карциномы толстой кишки человека (НТ 29) по сравнению с (2 а) Применение: внутривенно 4 раза в день в течение 6 дней (i.v.q4dx6) Соединение ЗРО: задержка роста опухоли у животных, подвергнутых лечению/задержка роста опухоли у контрольных животных. Фрагменты опухоли имплантировали подкожно. Лечение начинали, когда опухоль становилась ощутимой на ощупь. Подавление опухоли, в %, вычисляли на 37-й день. Таблица 2 Противоопухолевая активность A2 в отношении карциномы толстой кишки человека (НТ 29) по сравнению с (2d) Фрагменты опухоли имплантировали подкожно. Лечение начинали, когда опухоль становилась ощутимой на ощупь. Подавление опухоли, в %, вычисляли на 37-й день. ЗРО: задержка роста опухоли у животных, подвергнутых лечению/задержка роста опухоли у контрольных животных. Таблица 3 Противоопухолевая активность А 1 в отношении рака молочной железы МХ 1 человека по сравнению с камптотецином (2 а) Соединение Фрагменты опухоли имплантировали подкожно, лечение начинали, когда опухоль становилась ощутимой на ощупь. Дозы выражены в эквивалентах камптотецина. Подавление роста опухоли, в %: через 1 неделю после последнего сеанса лечения. Токсичность: отношение числа мышей,умерших в результате токсичности, к общему числу мышей. ЗРО: задержка роста опухоли у животных, подвергнутых лечению/задержка роста опухоли у контрольных животных. Отсутствие опухоли: излеченные мыши на 90-й день после имплантации. Таблица 4 Противоопухолевая активность А 1 в отношении рака яичника А 2780 человека по сравнению с камптотецином (2 а) Соединение А 1 2 а 9 Фрагменты опухоли имплантировали подкожно, лечение начинали, когда опухоль становилась ощутимой на ощупь. Дозы выражены в эквивалентах камптотецина. Подавление роста опухоли, в %: через 1 неделю после последнего сеанса лечения. 10 Токсичность: отношение числа мышей,умерших в результате токсичности, к общему числу мышей. ЗРО: задержка роста опухоли у животных, подвергнутых лечению/задержка роста опухоли у контрольных животных. Отсутствие опухоли: излеченные мыши на 90-й день после имплантации. Таблица 5 Противоопухолевая активность А 1 в отношении меланомы М 14 человека по сравнению с камптотецином (2 а) Схема Доза/суммар- Подавление росЗРО (0,5 г), Отсутствие Токсичность опухоли применения ная доза та опухоли, % дни Фрагменты опухоли имплантировали подкожно, лечение начинали, когда опухоль становилась ощутимой на ощупь. Дозы выражены в эквивалентах камптотецина. Подавление роста опухоли, в %: через 1 неделю после последнего сеанса лечения. Токсичность: отношение числа мышей,умерших в результате токсичности, к общему числу мышей. ЗРО: задержка роста опухоли у животных, подвергнутых лечению/задержка роста опухоли у контрольных животных. Отсутствие опухоли: излеченные мыши на 90-й день после имплантации. Таблица 6 Противоопухолевая активность А 1 в отношении рака легких А 549 NSC человека по сравнению с камптотецином (2 а) Схема Доза/суммарПодавление ЗРО (0,5 г), Отсутствие Токсичность Соединение опухоли применения ная доза роста опухоли, % дниiv q4dx6 10/60 89 0/7 4 0/7 Фрагменты опухоли имплантировали подкожно, лечение начинали, когда опухоль становилась ощутимой на ощупь. Дозы выражены в эквивалентах камптотецина. Подавление роста опухоли, в %: через 1 неделю после последнего сеанса лечения. Токсичность: отношение числа мышей,умерших в результате токсичности, к общему числу мышей. ЗРО: задержка роста опухоли у животных, подвергнутых лечению/задержка роста опухоли у контрольных животных. Отсутствие опухоли: излеченные мыши на 90-й день после имплантации. Таким образом, соединения согласно изобретению полезны при лечении лейкемии и твердых опухолей, например опухолей толстой кишки, толстой и прямой кишки, желудка, молочной железы, простаты, легкого, почки, а также меланотических опухолей. Поэтому человека можно лечить способом, включающим введение пациенту терапевтически эффективного количества полимерного коньюгата согласно изобретению. Тем самым состояние человека пациента можно улучшить. Принятый интервал доз будет зависеть от способа введения препарата и возраста, веса и состояния пациента. Полимерные коньюгаты формулы (1) обычно вводят парентеральным путем, например, внутримышечно, внутривенно или посредством введения ударной дозы. Подходящий интервал доз составляет от 1 до 1000 мг эквивалента камптотецина на м 2 поверхности тела, например от 10 до 100 мг/м 2. Полимерный коньюгат (1) можно превратить в фармацевтическую композицию, включающую фармацевтически приемлемый носитель или разбавитель. Обычно такие композиции составляются для парентерального введения, например, растворяя их в воде или в физиологическом растворе для инъекций. Изобретение иллюстрируется нижеследующими примерами. Пример 1. Получение -N-(трет-бутилоксикарбонил)-6-аминогексаноил-глицил-паранитрофенилового сложного эфира[10 а: n=5, R9=трет-Вос, Р=паранитрофенол]. К гидрохлориду глицинэтилового сложного эфира (9,55 г, 68, 4 ммол.), растворенному в 11 диметилформамиде (100 мл), добавляли триэтиламин (9,5 мл, 68,4 ммол.), а затем N-(третбутилоксикарбонил)-6-аминогексаноил-паранитрофениловый эфир (19 г, 54 ммол.), полученного по способу, описанному в Европейском патенте 0673258. Реакционную смесь выдерживали в течение 2 ч при комнатной температуре, затем растворитель удаляли при пониженном давлении. Остаток растворяли в этилацетате (300 мл) и последовательно промывали холодным 1 Н водным раствором соляной кислоты(3200 мл), водой (100 мл), 5% водным раствором бикарбоната натрия (2200 мл) и водой (2200 мл). Органическую фазу осушали безводным сульфатом натрия, затем растворитель удаляли при пониженном давлении. Остаток кристаллизовали из этилового эфира, получая N(трет-бутилоксикарбонил)-6-аминогексаноилглицил-этиловый эфир (15 г, ГЖX на кизельгелевой пластинке F254 (фирмы Merck), элюирующая система - этиловый эфир, Rf=0,3), который суспендировали в этаноле (150 мл) и обрабатывали при перемешивании 1 Н раствором гидроокиси натрия (48 мл, 48 ммол.). Через час в реакционную смесь добавляли 1 Н водный раствор соляной кислоты (48 мл, 48 ммол.) и полученную смесь перегоняли при пониженном давлении. Остаток суспендировали в безводном тетрагидрофуране (200 мл), к суспензии добавляли паранитрофенол (6,53 г, 47 ммол.), смесь охлаждали при 0 С, а затем добавляли раствор 1,3 дициклогексил-карбодиимида (9,7 г, 47 ммол.) в тетрагидрофуране (100 мл.). Реакционную смесь оставляли на ночь в тех же условиях, а затем фильтровали через воронку из пористого стекла. Растворитель удаляли при пониженном давлении. Остаток кристаллизовали из этилового эфира и получали 17,5 г целевого соединения формулы (10 а). ТСХ на кизельгелевой пластинке F254 (фирмы Merck), элюирующая система метиленхлорид/метанол (95/5 oб./oб.),Rf=0,34. 1N-(трет-бутилоксикарбонил)-6 аминогексаноил-глицил-паранитрофениловым эфиром (10 а: 6,3 г, 15 ммол.) и 4-диметиламинопиридином (2,4 г, 20 ммол.). Реакционную смесь выдерживали в течение 24 ч, затем к ней добавляли аликвотное количество N-(трет 002030 12 бутилоксикарбонил)-6-аминогексаноил-глицилпаранитрофенилового эфира (6,3 г, 15 ммол.). Через 48 ч реакционную смесь разбавляли метиленхлоридом (500 мл) и промывали 0,2 Н водным раствором соляной кислоты (2250 мл) и водой (2250 мл). Органическую фазу осушали безводным сульфатом натрия, затем растворитель удаляли при пониженном давлении. Остаток растворяли в метиленхлориде (100 мл), добавляли этиловый эфир (500 мл) и смесь оставляли на ночь при 0 С. Получали 5 г твердого целевого соединения формулы (11 а). ТСХ на кизельгелевой пластинке F254 (фирмы Merck),элюирующая система - метиленхлорид/метанол[6 а: n=5, OСРТ=(2 а)]. 20-O-[(N-трет-бутоксикарбонил)-6-аминогексаноил-глицил]камптотецин (11 а; 5 г) обрабатывали 90% водным раствором трифторуксусной кислоты (40 мл) в течение 1 ч, затем растворитель удаляли при пониженном давлении. Остаток растирали с этиловым эфиром (300 мл) и отфильтровывали. Твердое вещество растворяли в метаноле, объем уменьшали (до 50 мл) при пониженном давлении и добавляли этиловый эфир (300 мл). Осадок собирали и получали 3,9 целевого соединения (6 а). ТСХ на кизельгелевой пластинке F254[9 а: n= 5, ОСРТ=(2 а)]. Трифторацетат 20-O-(6-аминогексаноилглицил)камптотецина (6 а: 2,53 г, 4 ммол.) растворяли в безводном диметилсульфоксиде (10 мл) и добавляли метакрилоил-глицил-паранитрофениловый эфир (1,32 г, 5 ммол.), полученный как описано в Macromol. Chem. 178,2159 (1977), и триэтиламин (0,56 мл, 4 ммол.). Раствор оставляли на ночь при комнатной температуре, а затем выливали в воду (100 мл), осадок собирали и отмывали водой (2100 мл). Твердый материал подвергали ТСХ-анализу на силикагеле, используя в качестве элюирующей системы смесь метиленхлорид/метанол (95,5 об./об.). Получали 2,2 г целевого соединения(9 а). ТСХ на кизельгелевой пластинке F254(30 мл) и выдерживали при комнатной температуре в течение 3 дней при перемешивании. Затем реакционную смесь выливали в 0,1 Н водный раствор соляной кислоты (500 мл), полученный осадок собирали, растворяли в метиленхлориде (300 мл) и промывали водой (2100 мл). Органическую фазу отделяли, осушали безводным сульфатом натрия и испаряли при пониженном давлении. Остаток обрабатывали 90% водным раствором трифторуксусной кислоты(40 мл) в течение 3 ч, затем растворитель удаляли при пониженном давлении, а остаток подвергали ТСХ на силикагеле, используя смесь метиленхлорид/уксусная кислота/метанол (100/5/20 об./об.) в качестве элюирующей системы. Фракции, содержащие целевые соединения, объединяли и испаряли при пониженном давлении. Получали 1,02 г соединения формулы (6b) в форме производного соли трифторуксусной кислоты. ТСХ на кизельгелевой пластинке F254[6b: n=5, OCPT=(2d)]. Проводили реакцию 7-этил-10-гидроксикамптотецина (2d, 0,8 г, 2 ммол.) с паранитрофениловым эфиром N-(трет-бутоксикарбонил)-6-аминогексанонил-глицила (10 а; 2,5 г, 6 ммол.) и 4-диметиламинопиридином, как описано в примере 5. Промежуточный продукт,экстрагированный из реакционной смеси мети 002030 14 ленхлоридом, растворяли в смеси 1,5 Н соляной кислоты и уксусной кислоты (20 мл). После перемешивания в течение часа при комнатной температуре, объем раствора уменьшали перегонкой и добавляли этиловый эфир (100 мл). Осадок собирали и промывали этиловым эфиром (250 мл). Получали 1 г целевого соединения (6b) в форме свободного аминопроизводного. Пример 7. Получение MAG-камптотецина,применяя путь I[A1]: n=5, OCРT=(2 а)]. Полимерный предшественник В (R2=паранитрофенокси, 2,58 г, содержащий 1,1610-3 экв. остатка паранитрофенилового эфира), полученный как описано в Makromol Chem. 178,2159 (1977), растворяли в безводном диметилсульфоксиде (15 мл) и добавляли сначала трифторацетат 20-O-(6-аминогексаноил-глицил) камптотецина (6 а: 0.63 г, 1 ммол.), а затем триэтиламин (0,14 мл, 1 ммол.). Реакционную смесь перемешивали при комнатной температуре в течение 22 ч, затем к смеси добавляли 2 пропаноламин (0,05 мл) и перемешивание продолжали еще 1 ч. После этого реакционную смесь осаждали этилацетатом (200 мл) и перемешивали в течение 30 мин. Твердый материал собирали в воронку из пористого стекла, промывали этилацетатом (200 мл) и этиловым эфиром (100 мл), затем растворяли в этаноле (30 мл). Спиртовой раствор обрабатывали влажным анионитом DOWEX 50 в сульфоформе (1,2 г) при перемешивании в течение 30 мин и после этого прикапывали к н-гексану (200 мл). Осадок собирали в воронку из пористого стекла, промывали этиловым эфиром и сушили до постоянного веса. Получали 2,68 г целевого соединения (Al). Средневесовая молекулярная масса(Mw): 19800. Полидисперсность (Mw/Mn): 1,5. Содержание камптотецина, определенное после щелочного гидролиза: 10% (мас./мас.). Пример 8. Получение МАG-(7-этил-10 гидроксикамптотецина с применением пути I[A2]: n=5, OCPT=(2d)]. Полимерный предшественник В (R2=паранитрофенокси, 2,58 г, содержащий 1,1610-3 экв. остатка паранитрофенилового эфира), полученный как описано в Makromol. Chem. 178,2159 (1977), растворяли в безводном диметилсульфоксиде (15 мл ) и добавляли сначала трифторацетат 7-этил-10-гидрокси-20-O-(6-аминогексаноил-глицил)камптотецина (6b; 0,68 г, 1 ммол.), а затем триэтиламин (0,14 мл, 1 ммол.). Реакционную смесь перемешивали при комнатной температуре в течение 22 ч, затем к смеси добавляли 2-пропаноламин (0,05 мл) и перемешивание продолжали еще 1 ч. После этого реакционную смесь осаждали этилацетатом (200 мл) и перемешивали в течение 30 мин. Твердый продукт собирали в воронку из пористого стекла, промывали этилацетатом (200 мл) и этило 15 вым эфиром, затем растворяли в этаноле (30 мл). Спиртовой раствор обрабатывали влажным анионитом DOWEX 50 в сульфоформе (1,2 г) при перемешивании в течение 30 мин и после этого прикапывали к н-гексану (200 мл). Осадок собирали в воронку из пористого стекла, промывали этиловым эфиром и сушили до постоянного веса. Получали 2,68 г целевого соединения (А 2). Средневесовая молекулярная масса[A1]: n=5, ОСРТ=(2 а)]. 20-O-[метакрилоил-глицил-(6-аминогексаноил)глицил]камптотецин (9 а: 1,26 г, 2 ммол.),N-(2-гидроксипропил)метакриламид (8, 4,4 г, 31 ммол.), полученный как описано в Makromol.Chem. 178, 2159 (1977), и 2,2'-азобисизобутаронитрил (0,26 г, 1,6 ммол.) растворяли в безводном диметилсульфоксиде (20 мл), выдерживали при 60 С в атмосфере азота при перемешивании в течение 24 ч. После этого реакционную смесь охлаждали при комнатной температуре и выливали в этилацетат (500 мл). Осадок собирали и растворяли в этаноле (50 мл),откуда вещество переосаждали, добавляя этилацетат (500 мл). Твердое вещество собирали,промывали этилуксусным эфиром (2100 мл). Получали 5 г целевого соединения (А 1). или различными, представляет собой водород,C1-С 2 линейный или разветвленный алкил, нитрогруппу, аминогруппу,(СН 2)aNR6R7, где а принимает значения от 0 до 4, R6 и R7 означают водород, или один из R6 или R7 означает водород, а другой означает C1C6 алкил, или NR6R7 является пиперазино- илиN-алкил-пиперазино-циклом, который может быть замещен C1-С 6 линейным или разветвленным алкилом, или пиперидино-циклом,(CH2)aNHCOR8, где а принимает вышеуказанные значения, a R8 представляет собой С 1-С 8 линейный или разветвленный алкил или группуNR6R7 как определено выше; гидроксильную группу или O-CO-R8, гдеR8 имеет вышеуказанные значения или представляет собой 1-пиперидино-цикл или 1,4'бипиперидин,или R2 и R3 совместно представляют собой остаток O-(СН 2)b-O, в котором b равно 1 или 2,или R4 и R5 представляют собой остаток(СН 2)m, в котором m принимает значения от 2 до 4, или остаток СН 2-О-СН 2 или CH2NHCH2 и в которой [Z] означает гидроксильную группу или остаток, имеющий формулу -NН-СН 2 СН(ОН)-СН 3. 2. Полимерный конъюгат по п.1, содержащийN-(2-оксипропил)метакрилоиламидные звенья, представленные формулой (3), в количестве 90 мол.%. 3. Полимерный конъюгат по п.1, содержащий 10 мол.% звеньев, представленных формулой (4). 4. Полимерный конъюгат по п.1, в котором звено, представленное формулой (5), отсутствует. 5. Полимерный конъюгат по п.1, в котором-[О-СРТ] в формуле (4) представляет собой остаток камптотецина формулы (2), выбранный из камптотецина, 9-аминокамптотецина, 9-нитрокамптотецина, 7-этил-10-гидроксикамптотецина, 7-этил-10-[1,4'-бипиперидинил]карбонилоксикамптотецина и 7-метилендиметиламино-10 гидроксикамптотецина. 6. Полимерный конъюгат по п.1, в котором содержание активного производного камптотецина формулы (2) равно 10% (мас./мас.). 7. Способ получения полимерного конъюгата по п.1, включающий реакцию производного 20-O-(аминоацил-глицил)камптотецина формулы (6) где n принимает значения от 2 до 8, -[O-СРТ] представляет собой остаток камптотецина формулы (2) связанный в положении С-20, в котором каждый из R1, R2, R3, R4 и R5, являющихся одинаковыми где [Y] - остаток активного сложного эфира или гидроксильная группа, и необязательное замещение оставшихся групп активного сложного эфира 1-амино-2-пропанолом. 8. Способ получения полимерного конъюгата по п.1, включающий полимеризацию N-(2 гидроксипропил)метакриламида формулы (8) где n и [O-СРТ] такие, как определено в п.1, в условиях, позволяющих сохранить характер связи между камптотецином и глициламиноацил-глициловым спейсером, а также характер конъюгата. 9. Производное 20-O-[(аминоацил)глицил]камптотецина формулы (6), как определено в п.7, или его соль. 10. Способ получения соединения формулы (6), как определено в п.7, включающий конденсацию производного формулы (2), как определено в п.1, с N-защищенным аминоацилглицил производным формулы (10)(10) где значение n определено как в п.1, R9 представляет собой защитную группу для аминогруппы, а [Р] представляет собой остаток активированного сложного эфира, с получением соединения формулы (11) 18 12. Способ получения производного формулы (9), как определено в п.11, включающий конденсацию производного камптотецина формулы (6), как определено в п.7, с Nметакрилоил-глицилом формулы (7') где [Y'] - уходящая группа. 13. Полимерный конъюгат по п.1, представляющий собой МАG-камптотецин, гдеMAG означает метакрилоил-глициновый полимер, и содержание камптотецина равно 10% мас./мас. 14. Полимерный конъюгат по п.1, получаемый в результате реакции между производным 20-O-(6-аминогексаноил-глицил)камптотецина формулы (6) где [Y] - паранитрофеноксигруппа, и необязательного замещения оставшихся групп активного сложного эфира 1-амино-2-пропанолом. 15. Полимерный конъюгат по п.1, получаемый в результате полимеризации N-(2 гидроксипропил)метакриламида формулы (8) где [O-СРТ] - остаток камптотецина. 16. Фармацевтическая композиция, содержащая фармацевтически приемлемый разбавитель или носитель и в качестве активного ингредиента полимерный коньюгат по любому из пп.1-6 или 13-15 или соединение формулы (6) или (9) по п.9 или 11.
МПК / Метки
МПК: A61K 47/48, A61P 35/00, C08F 120/60
Метки: камптотецинов, производные, полимерные
Код ссылки
<a href="https://eas.patents.su/10-2030-polimernye-proizvodnye-kamptotecinov.html" rel="bookmark" title="База патентов Евразийского Союза">Полимерные производные камптотецинов</a>
Предыдущий патент: Способ передачи сигнала времени и способ приема сигнала времени
Следующий патент: Бензамиды для лечения нейродегенеративных заболеваний
Случайный патент: Игровой автомат, способ управления игрой и программа для них