Способ получения 1-бензил-3-гидроксиметил-1н-индазола и его производных и необходимые промежуточные соединения с магнием
Номер патента: 19060
Опубликовано: 30.12.2013
Авторы: Фурлотти Гвидо, Караччоло Торкиароло Джулиано, Иакоанджели Томмазо
Формула / Реферат
1. Способ получения 1-бензил-3-гидроксиметил-1H-индазола, представленного следующей формулой (I):
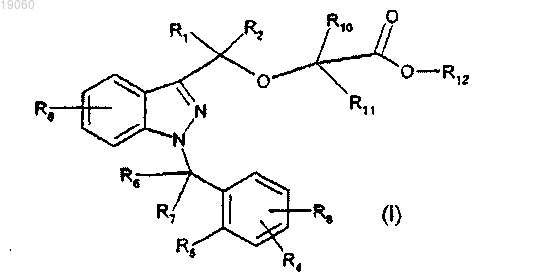
в которой R1 и R2, которые могут быть одинаковыми или разными, означают водород или алкильную группу, имеющую от 1 до 6 атомов углерода,
R3, R4 и R8, которые могут быть одинаковыми или разными, представляют собой водород, алкильную группу, имеющую от 1 до 5 атомов углерода, алкоксигруппу, имеющую от 1 до 3 атомов углерода и атом галогена,
R5 представляет собой водород, алкильную группу, имеющую от 1 до 5 атомов углерода, алкоксигруппу, имеющую от 1 до 3 атомов углерода, атом галогена, или вместе с одним из R6 и R7 может образовывать кольцо, имеющее 5 или 6 атомов углерода,
R6 и R7, которые могут быть одинаковыми или разными, представляют водород, алкильную группу, имеющую от 1 до 5 атомов углерода, или один из R6 и R7 вместе с R5 может образовывать кольцо, имеющее 5 или 6 атомов углерода,
R10 и R11, которые могут быть одинаковыми или разными, означают водород или алкильную группу, имеющую от 1 до 5 атомов углерода, и
R12 обозначает водород или алкильную группу, имеющую от 1 до 4 атомов углерода, в котором:
а) 1-бензил-3-гидроксиметил-1H-индазол или его производное, представленное следующей формулой (II):

подвергают взаимодействию с галогеноводородной кислотой формулы НХ", где X" обозначает атом галогена, выбранный из группы, содержащей хлор, бром и йод, предпочтительно хлор, с получением 1-бензил-3-галогенметил-1H-индазола или его производного, представленного следующей формулой (V)
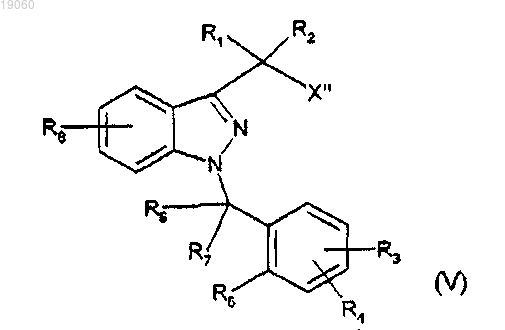
b) 1-бензил-3-галогенметил-1H-индазол или его производное, представленное указанной формулой (V), подвергают взаимодействию в присутствии сильного основания с соединением, представленным следующей формулой (VI):
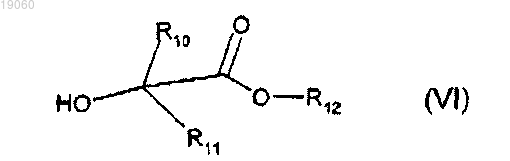
с получением 1-бензил-3-гидроксиметил-1H-индазола, представленного выше указанной формулой (I).
2. Способ получения по п.1, в котором указанный 1-бензил-3-гидроксиметил-1H-индазол, представленный формулой (I), превращают в соль с карбоксильной группой -COOR12 путем обработки его фармацевтически приемлемым органическим или неорганическим основанием.
3. Способ получения по п.1, где R1 и R2, которые могут быть одинаковыми или разными, представляют собой атом водорода или алкильную группу, имеющую от 1 до 3 атомов углерода.
4. Способ получения по п.1, где R3, R4 и R8, которые могут быть одинаковыми или разными, представляют собой водород, метильную группу, этильную группу, метоксигруппу, этоксигруппу, атом хлора и атом фтора.
5. Способ получения по п.1, где R5 представляет собой водород, метильную группу, этильную группу, метоксигруппу, этоксигруппу, атом хлора и атом фтора или вместе с R6 и R7 может образовывать кольцо, имеющее 6 атомов углерода.
6. Способ получения по п.1, где R6 и R7, которые могут быть одинаковыми или разными, представляют собой водород, метильную группу, этильную группу, или один из R6 и R7 вместе с R5 может образовывать кольцо, имеющее 6 атомов углерода.
Текст
СПОСОБ ПОЛУЧЕНИЯ 1-БЕНЗИЛ-3-ГИДРОКСИМЕТИЛ-1 Н-ИНДАЗОЛА И ЕГО ПРОИЗВОДНЫХ И НЕОБХОДИМЫЕ ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ С МАГНИЕМ(71)(73) Заявитель и патентовладелец: АЦЬЕНДЕ КИМИКЕ РЬЮНИТЕ АНДЖЕЛИНИ ФРАНЧЕСКО Область изобретения Данное изобретение относится к способу получения 1-бензил-3-гидроксиметил-1H-индазола. В частности, данное изобретение относится к способу превращения 1-бензил-3-гидроксиметил-1Hиндазола формулы (II) ниже в 1-бензил-3-гидроксиметил-1H-индазол формулы (I) ниже. Уровень техники Европейский патент ЕР-В-0382276 описывает некоторые производные 1-бензил-3-гидроксиметил 1H-индазола формулы (А), обладающие болеутоляющим действием в которой R и R', которые могут быть одинаковыми или разными, обозначают Н или C1-5 алкил, иR" обозначает Н или C1-4 алкил, возможно, в форме его соли с фармацевтически приемлемым органическим или неорганическим основанием, когда R" обозначает Н. В свою очередь, европейский патент ЕР-В-0510748 описывает, с другой стороны, применение тех же производных для получения фармацевтической композиции эффективных при лечении аутоиммунных болезней. В дополнение к этому, документ ЕР-В 1-0858337 описывает фармацевтическую композицию, содержащую соединение формулы (А), в которой R=R'=CH3 и R"=H, и иммунодепрессант. Европейский патент ЕР-В-1005332 описывает применение тех же самых производных для получения фармацевтической композиции, эффективной при лечении состояний, связанных с продуцированием МСР-1. И наконец, международная патентная зявка WO 2008/061671 описывает применение соединения формулы (А) для снижения в крови уровней триглицеридов, холестерина и глюкозы. Различные способы получения соединений формулы (А) описаны в указанном патенте ЕР-В 0382276. Способы, описанные в патенте ЕР-В-0382276, имеют в качестве важного пункта получение 1 бензил-3-гидроксиметил-1H-индазол, из которого могут быть получены соединения формулы (А) тремя различными путями реакции. Первый путь реакции предусматривает превращение 1-бензил-3-гидроксиметил-1H-индазола в соответствующий алкоголят, который затем подвергают реакции с X-CRR'-COOR", где X обозначает уходящую группу, выбранную из группы, включающей галогены, арилен-SO2-О- или алкилен-SO2-О-, с получением соединения формулы (А). Второй путь реакции предусматривает превращение 1-бензил-3-гидроксиметил-1H-индазола в соответствующее 3-галогенметил-производное, которое впоследствии подвергают реакции с алкоголятом формулыMeO-CRR'-COOR", где Me обозначает щелочной металл с получением соединения формулы (А). Третий путь реакции предусматривает взаимодействие 1-бензил-3-гидроксиметил-1H-индазола с хлороформом и кетоном формулы O=CRR' в присутствии щелочного основания, такого как гидроксид натрия, с получением соединения формулы (А), где R" обозначает водород. Получение важного промежуточного соединения 1-бензил-3-гидроксиметил-1H-индазола способами,описанными в патенте ЕР-В-0382276, проводят восстановлением соответствующей 3-карбоновой кислоты подходящим восстановителем, таким как, например, смешанный гидрид алюминия и лития (LiAlH4). Сущность изобретения Установлено, что способы синтеза, известные в технике и описанные в указанном патенте ЕР-В 0382276, имеют некоторые недостатки. Во-первых, 1-бензил-1(Н)-индазол-3-карбоновая кислота не является продуктом, который легко можно приобрести на рынке, а является, скорее, дорогостоящим. В частности, существует лишь немного поставщиков, и пути синтеза, описанные в литературе, предусматривают бензилирование соответствующей 1(Н)-индазол-3-карбоновой кислоты, которая также является дорогостоящей и не легко доступной. Во-вторых, восстановление 1-бензил-1(Н)-индазол-3-карбоновой кислоты для получения 1-бензил-3 гидроксиметил-1H-индазола проводят с высоким фактором разбавления. Кроме того, второй путь реакции предусматривает применение тионилхлорида для превращения 1 бензил-3-гидроксиметил-1H-индазола в соответствующее 3-хлорметил-производное. Применение тионилхлорида, высокотоксичного вещества, создает серьезные проблемы в отношении безопасности при использовании его в промышленных способах. Наконец, третий путь реакции (реакция Баргеллини) показал промышленные недостатки, такие как низкие выходы (менее чем 50%), образование монооксида углерода, токсичного и горючего газа, и значительные экзотермические явления, которыми трудно управлять в производстве (Davis et al., Synthesis,-1 019060 12, (2004), 1959-1962). Кроме того, реакция Баргеллини находит более хорошее применение в синтезе простых эфиров из фенолов, а не из алифатических спиртов (US 3262850; Cvetovich et al., J. Org. Chem.,(2005), 70, 8560-8563). Поэтому рассматривается проблема разработки нового, способного преодолевать указанные недостатки способа получения 1-бензил-3-гидроксиметил-1H-индазола с получением соединения формулы(А). В частности, проблема распространяется на получение 1-бензил-3-гидроксиметил-1H-индазолов,имеющих следующую формулу (II) с получением соединения, имеющего следующую формулу (I) в которой заместители от R1 до R12 имеют значения, указанные ниже в подробном описании и в формуле изобретения. Найден новый способ получения 1-бензил-3-гидроксиметил-1H-индазолов формулы (II) с получением соединения формулы (I), который значительно улучшает, с одной стороны, промышленное применение, выходы и затраты на новый способ по сравнению с известными ранее способами и, с другой стороны, улучшает качество соединений, полученных с его использованием. Неожиданно обнаружено, что 1-бензил-3-гидроксиметил-1H-индазол или его производные формулы (II) легко могут быть получены при взаимодействии реагента Гриньяра, имеющего формулу (IV),описанного ниже, с соответствующим электрофильным соединением, таким как, например, альдегиды,кетоны или амиды, с последующим восстановлением, если необходимо, промежуточного карбонильного соединения. В частности, неожиданно было обнаружено, что реагент Гриньяра формулы (IV) легко получают из 1-бензил-3-галогено-1H-индазола или его производных формулы (III), описанных ниже, путем реакции обмена галоген/магний с реагентами Гриньяра типа галогенида алкилмагния при низкой температуре. Вероятно, что реагенты Гриньяра формулы (IV) не известны в технике. Фактически, в технике известны только металлорганические производные индазола с металлом в положении 3 - это производные с такими металлами, как цинк (Knochel et al., Synlett, 2005, 267) или медь(Knochel et al., Synthesis, 2006, 15, 2618 и Knochel et al., Synlett, 2004, 13, 2303-2306), в то же время известны реакции, разрушающие кольцо индазола при попытке получить соответствующие 3 органолитиевые соединения (Welch et al., Synthesis, 1992, 937) и 3-органонатриевые производные (Tertovet al. Zhurnal Organicheskoi Khimii, 1970, 6; 2140). Указанные производные 1-бензил-3-галогено-1H-индазола формулы (III), которые широко известны в литературе, могут быть легко получены галогенированием 1 Н-индазола в положении 3 с последующим бензилированием в положении 1 (Collot et al., Tetrahedron, 1999, 55, 6917; Coller et al., Aust. J. Chem. 1974,27, 2343). Неожиданно также было обнаружено, что 1-бензил-3-гидроксиметил-1H-индазол или его производные формулы (III) легко могут быть превращены в соответствующие 3-галогенметил производные простой обработкой галогеноводородными кислотами и затем в соединения формулы (I) - этерификацией соответствующей гидроксикарбоновой кислотой или сложным эфиром формулы (VI). В качестве варианта неожиданно также было обнаружено, что 1-бензил-3-гидроксиметил-1Hиндазол или его производные формулы (II) легко могут быть превращены в соединения формулы (I) этерификацией соответствующей -галогенокарбоновой кислотой или сложным эфиром формулы (VII),описанным ниже. Соответственно, данное изобретение относится к способу получения производных 1-бензил-3 гидроксиметил-1H-индазола, представленных формулой (I) в которой заместители от R1 до R12 имеют значения, указанные ниже в подробном описании и в формуле изобретения, в котором а) 1-бензил-3-гидроксиметил-1H-индазол или его производное, представленное следующей формулой (II) подвергают взаимодействию с галогеноводородной кислотой формулы НХ", где X" обозначает атом галогена, выбранный из группы, содержащей хлор, бром и йод, предпочтительно хлор, с получением 1 бензил-3-галогенметил-1H-индазола или его производной формулы (V)(V), подвергают взаимодействию в присутствии сильного основания с соединением, представленным следующей формулой (VI) с получением производного 1-бензил-3-гидроксиметил-1H-индазола, представленного указанной формулой (I). Подробное описание изобретения Преимущественно, способ получения 1-бензил-3-гидроксиметил-1H-индазола и его производных,представленных следующей формулой (II) в которой R1 и R2, которые могут быть одинаковыми или разными, обозначают водород или алкильную группу, имеющую от 1 до 6 атомов углерода,R3, R4 и R8, которые могут быть одинаковыми или разными, обозначают водород или алкильную группу, имеющую от 1 до 5 атомов углерода, алкоксигруппу, имеющую от 1 до 3 атомов углерода, и атом галогена,R5 может представлять водород, алкильную группу, имеющую от 1 до 5 атомов углерода, алкоксигруппу, имеющую от 1 до 3 атомов углерода, атом галогена или вместе с одним из R6 и R7 может образовывать кольцо, имеющее 5 или 6 атомов углерода, иR6 и R7, которые могут быть одинаковыми или разными, могут представлять водород, алкильную группу, имеющую от 1 до 5 атомов углерода, или один из R6 и R7 вместе с R5 может образовывать кольцо, имеющее 5 или 6 атомов углерода, предусматривает, что а) 1-бензил-3-галогено-1H-индазол формулы (III) в которой X обозначает атом галогена, выбранный из йода и брома, предпочтительно йода, и R3-R8 имеют указанные выше значения, подвергают взаимодействию с галогенидом алкилмагния формулыRMgX', где R обозначает алкильную группу из 1-6 атомов углерода, и X' обозначает атом галогена, выбранный из брома и хлора, предпочтительно хлора, с получением промежуточного соединения (IV)b) указанное промежуточное соединение (IV) подвергают взаимодействию с карбонильным соеди-3 019060 нением формулы R1-CO-R2, где R1 и R2 имеют указанные выше значения, с получением соединения формулы (II), или в качестве варианта b);b') указанное промежуточное соединение (IV) подвергают взаимодействию с амидом формулыR'R"N-CO-R1, где R' и R", которые могут быть одинаковыми или разными, представляют алкильную группу, имеющую 1-3 атома углерода, и R1 имеет указанные выше значения с получением промежуточного соединения (VIII) которое подвергают взаимодействию с восстановителем карбонильной группы с получением соединения формулы (II). Преимущественно стадию а) осуществляют в присутствии подходящего растворителя, такого как,например, тетрагидрофуран, 2-метил-тетрагидрофуран, диэтиловый простой эфир, диоксан, трет-бутилметиловый простой эфир, дибутиловый простой эфир, ксилол, толуол, дихлорметан, хлороформ, нгексан, н-гептан и их смеси и т.д., предпочтительно 2-метилтетрагидрофуран, тетрагидрофуран, толуол,ксилол и их смеси и еще более предпочтительно 2-метилтетрагидрофуран. Галогенидом алкилмагния формулы RMgX', используемым на стадии а), может быть метил MgCl,этил MgCl, н-пропил MgCl, изопропил MgCl, н-бутил MgCl, изобутил MgCl, втор-бутил MgCl, третбутил MgCl, н-пентил MgCl, н-гексил MgCl, аллил MgCl, циклогексил MgCl, метил MgBr, этил MgBr, нпропил MgBr, изопропил MgBr, н-бутил MgBr, изобутил MgBr, втор-бутил MgBr, трет-бутил MgBr, нпентил MgBr, н-гексил MgBr, аллил MgBr, циклогексил MgBr и предпочтительно изопропил MgCl. Указанные реагенты могут быть приобретены коммерчески или получены согласно способам, широко описанным в литературе (Silverman et al., Handbook of Grignard reagents, Chapter 2, CRC Press). Преимущественно реакция обмена на стадии а) может быть катализирована добавлением солей лития, например LiCl, как описано в литературе (Knochel et al., Chem. Commun., 2005, 543). Преимущественно стадию а) проводят при температуре между -30C и +30C, предпочтительно при температуре в интервале от -20 до 10C. Преимущественно стадию а) проводят, используя молярное соотношение между галогенидом алкилмагния формулы RMgX' и 1-бензил-3-галоген-1H-индазолом формулы (III) в интервале 1-4, предпочтительно в интервале 1,5-4. Преимущественно стадию b) проводят в присутствии подходящего растворителя, такого как, например, тетрагидрофуран, 2-метилтетрагидрофуран, диэтиловый простой эфир, диоксан, трет-бутилметиловый простой эфир, дибутиловый простой эфир, ксилол, толуол, дихлорметан, хлороформ, н-гексан,н-гептан и их смеси и т.д., предпочтительно 2-метилтетрагидрофуран, тетрагидрофуран, толуол, ксилол и их смеси, но предпочтительно 2-метилтетрагидрофуран. Преимущественно стадию b) проводят, используя карбонильное соединение, выбранное из группы альдегидов, таких как, например, формальдегид, ацетальдегид, пропанал, бутанал, пентанал, гексанал и тому подобное, и кетонов, таких как, например, ацетон, этилметил кетон, изобутилметил кетон и т.д. Предпочтительно используют формальдегид и, в частности, в качестве источника формальдегида используют полимеры, такие как подходяще деполимеризованный параформальдегид или триоксан. Преимущественно стадию b) проводят, используя молярное соотношение между 1-бензил-3 галоген-1H-индазолом формулы (III) и карбонильным соединением формулы R1-CO-R2 в интервале 1-6. Преимущественно стадию b) проводят при температуре в интервале -30 и +30C, предпочтительно при температуре в интервале от -10 до 0C. Преимущественно стадию b') проводят, используя алкиламид, выбранный из группы, содержащейN,N-диметилформамид, N,N-диэтилформамид, N,N-ди-н-пропилформамид, N,N-диметилацетамид, N,Nдиэтилацетамид, N,N-ди-н-пропилацетамид, N,N-диметилпропионамид, N,N-диэтилпропионамид, N,Nди-н-пропилпропионамид, предпочтительно N,N-диметилформамид. Преимущественно стадию b') проводят при температуре ммежду -30 и +30C, предпочтительно при температуре в интервале от -10 до 0C. В частности, стадию b') проводят, используя молярное соотношение между 1-бензил-3-галоген-1Hиндазолом формулы (III) и амидом формулы R'R"N-CO-R1, составляющим 1 и 4. Преимущественно восстановитель карбонильной группы, используемый на стадии b'), выбран из группы, содержащей гидриды, такие как, например, NaBH4, KBH4, LiBH4, Zn(BH4)2, Са(ВН 4)2, NaAlH4,LiAlH4, Et3SiH, Bu3SnH, i-Bu2AlH, 70% NaAlH2(OCH2CH2OCH3)2 в толуоле и производные. Восстановителем карбонильной группы предпочтительно является 70% NaAlH2(ОСН 2 СН 2 ОСН 3)2 в толуоле. Восстановители карбонильной группы широко представлены в литературе (описаны, например, в Smith, March,March's Advanced Organic Chemistry, 5th ed., pages 1197-1205, John WileySons, Inc. и Carey, Sundberg,Advanced Organic Chemistry, 4th ed., pages 262-290). Преимущественно восстановление на стадии b') осуществляют в присутствии подходящего растворителя, такого как, например, тетрагидрофуран, 2-метилтетрагидрофуран, диэтиловый простой эфир,диоксан, трет-бутилметиловый простой эфир, дибутиловый простой эфир, ксилол, толуол, дихлорметан,хлороформ, н-гексан, н-гептан, метанол, этанол, н-пропанол, изопропанол, диглим (бис-(2-метоксиэтил) простой эфир), пиридин, диметилсульфоксид (DMSO), уксусная кислота, их смеси и т.д., предпочтительно толуол, ксилол, тетрагидрофуран, 2-метил-тетрагидрофуран и их смеси. Преимущественно восстановление на стадии b') проводят при температуре в интервале 10 - 100C,предпочтительно при температуре в интервале 20-60C. В частности, восстановление карбонильной группы на стадии b') проводят, используя число эквивалентов гидрида, составляющее 1-3, предпочтительно 2. Преимущественно группы R1-R8 в формулах (II), (III), (IV) и (VIII), описанных выше, могут иметь следующие значения. Предпочтительно R1 и R2, которые могут быть одинаковыми или разными, представлены атомом водорода или алкильной группой, имеющей от 1 до 3 атомов углерода. Предпочтительно R3, R4 и R8, которые могут быть одинаковыми или разными, могут быть представлены метильной группой, этильной группой, метоксигруппой, этоксигруппой, атомом хлора и атомом фтора. Преимущественно R5 может представлять водород, метильную группу, этильную группу, метоксигруппу, этоксигруппу, атом хлора и атом фтора или вместе с одним из R6 и R7 может образовывать кольцо, имеющее 6 атомов углерода. Предпочтительно R6 и R7, которые могут быть одинаковыми или разными, могут представлять водород, метильную группу, этильную группу, или один из R6 и R7 вместе с R5 может образовывать кольцо,имеющее 6 атомов углерода. Данное изобретение относится к способу получения производных 1-бензил-3-гидроксиметил-1Hиндазола, представленных следующей формулой (I):R10 и R11, которые могут быть одинаковыми или разными, обозначают водород или алкильную группу, имеющую от 1 до 5 атомов углерода, иR12 обозначает водород или алкильную группу, имеющую от 1 до 4 атомов углерода. Способ получения производных 1-бензил-3-гидроксиметил-1H-индазола, представленных указанной выше формулой (I) по изобретению, предусматривает, что а) 1-бензил-3-гидроксиметил-1H-индазол или его производное, представленное следующей формулой (II): в которой R1-R8 имеют указанные выше значения, подвергают взаимодействию с галогеноводородной кислотой формулы НХ", где X" обозначает атом галогена, выбранный из группы, содержащей хлор,бром и йод, предпочтительно хлор, с получением 1-бензил-3-галогенметил-1H-индазола или его производного, представленного следующей формулой (V): в которой R1-R8 и X" имеют указанные выше значения,b) 1-бензил-3-галогенметил-1H-индазол или его производное, представленное указанной формулой(V), подвергают взаимодействию в присутствии сильного основания с соединением, представленным следующей формулой (VI): в которой R10, R11, которые могут быть одинаковыми или разными, и R12 имеют указанные выше значения с получением производных 1-бензил-3-гидроксиметил-1H-индазола, представленных указанной выше формулой (I). Предпочтительно указанный способ получения производных 1-бензил-3-гидроксиметил-1Hиндазола, представленных формулой (I), может включать образование соли карбоксильной группы,представленной -COOR12, путем обработки фармацевтически приемлемым органическим или неорганическим основанием. Обработка может быть проведена непосредственно на соответствующей кислоте,когда R12 обозначает водород, или последующей реакцией гидролиза сложного эфира, когда R12 обозначает алкильную группу из 1-4 атомов углерода. Преимущественно стадию а) проводят в водном растворе или в органическом растворителе. Используемая галогеноводородная кислота формулы НХ" является концентрированной или разбавленной хлороводородной кислотой, бромоводородной кислотой или йодоводородной кислотой, предпочтительно хлороводородной кислотой, в такой концентрации, чтобы молярное соотношение между кислотой и соединением формулы (II) составляло 1-20, предпочтительно 1-5 и еще более предпочтительно приблизительно 3. Преимущественно стадию а) проводят при температуре в интервале 25-100C, предпочтительно при температуре в интервале 60-90C. Органический растворитель, используемый на стадии а), предпочтительно выбран из группы,включающей толуол, ксилол, уксусную кислоту, диоксан, дибутиловый простой эфир, 2-метилтетрагидрофуран. Преимущественно стадию а) проводят в апротонных растворителях, таких как, например, тетрагидрофуран, диоксан, N,N-диметилформамид, толуол, N-метилпирролидон, диметилсульфоксид, гексаметилфосфорамид, ацетон, изобутилметилкетон, метилэтилкетон или их смеси, предпочтительно толуол или N,N-диметилформамид и их смеси. Сильное основание, используемое на стадии b), предпочтительно выбрано из группы, включающей гидрид натрия, металлический натрий, металлический калий, бутиллитий, литийдиизопропиламид, натрий амид, гидрид калия, предпочтительно гидрид натрия. Преимущественно стадию b) проводят, используя -гидроксикислоту, выбранную из группы, содержащей гидроксиуксусную кислоту, молочную кислоту, -гидроксиизомасляную кислоту, -гидроксимасляную кислоту, 2-этил-2-гидроксимасляную кислоту, 2-гидроксиизовалериановую кислоту, 2 гидрокси-3,3-диметилмасляную кислоту, 2-гидроксиизокапроновую кислоту, предпочтительно гидроксиизомасляную кислоту. Преимущественно стадию b) проводят, используя сложный -гидроксиэфир, выбранный из группы,содержащей метилгликолят, этилгликолят, бутилгликолят, метиллактат, этиллактат, бутиллактат, третбутиллактат, изопропиллактат, изобутиллактат, метил-2-гидроксиизобутират, этил-2-гидроксиизобутират, этил-2-гидроксиизовалерат, трет-бутилгидроксибутират, предпочтительно этил-2-гидроксиизобутират. Предпочтительно молярное соотношение между 1-бензил-3-галогенметил-1H-индазолом формулы (V) и-гидроксикислотой или сложным эфиром формулы (VI) составляло 1-2, предпочтительно около 1, 2. В частности, молярное соотношение между -гидроксикислотой формулы (VI) и сильным основанием составляет 1-3, предпочтительно около 2. Подобным образом молярное соотношение между сложным -гидроксиэфиром формулы (VI) и сильным основанием составляет 1-1,5, предпочтительно около 1. Преимущественно группы R1-R12 в формулах (I), (II), (V), (VI) и (VII), описанных выше, могут иметь следующие значения. Предпочтительно R1 и R2, которые могут быть одинаковыми или разными, представлены атомом водорода или алкильной группой, имеющей от 1 до 3 атомов углерода. Предпочтительно R3, R4 и R8, которые могут быть одинаковыми или разными, могут быть представлены водородом, метильной группой, этильной группой, метоксигруппой, этоксигруппой, атомом хлора и атомом фтора. Преимущественно R5 может быть представлен водородом, метильной группой, этильной группой,метоксигруппой, этоксигруппой, атомом хлора и атомом фтора или вместе с одним из R6 и R7 может образовывать кольцо, имеющее 6 атомов углерода. Предпочтительно R6 и R7, которые могут быть одинаковыми или разными, могут быть представлены водородом, метильной группой, этильной группой, или один из R6 и R7 вместе с R5 может образовывать кольцо, имеющее 6 атомов углерода. Предпочтительно R10 и R11, которые могут быть одинаковыми или разными, означают водород или алкильную группу, имеющую от 1 до 3 атомов углерода, и R12 обозначает водород или алкильную группу, имеющую от 1 до 3 атомов углерода. Следующие примеры предназначены для пояснения данного изобретения, однако, без ограничения его каким-либо образом. Экспериментальная часть Соединения 3-иод-1H-индазол и 1-бензил-3-иод-1H-индазол получали согласно процедуре, описанной Collot et al. (Tetrahedron, 55, 6917, 1999). Соединение 3-бром-1H-индазол получали согласно процедуре, описанной Coller et al. (Aust. J. Chem., 1974, 27, 2343). Пример 1. Получение 1-бензил-3-броминдазола. 3-Бром-1H-индазол (90,4 г, 0,459 моль, 1,0 экв.) и толуол (450 мл) помещали в колбу емкостью 1 л,снабженную механической мешалкой, в атмосфере азота. Затем трет-бутоксид калия (t-BuOK, 54,2 г,0,483 моль, 1,05 экв.) добавляли при комнатной температуре в течение около получаса и добавляли бензилбромид (86,3 г, 0,505 моль, 1,1 экв.) в течение приблизительно 1,5 ч. Смесь оставляли перемешиваться при той же температуре до завершения реакции (отслеживаемой TLC, приблизительно 3 ч). Затем добавляли 0,1 М HCl (45 мл) и воду (90 мл) и полученные в результате фазы разделяли. Органическую фазу промывали водой и растворитель выпаривали при пониженном давлении до получения красного маслянистого остатка. Продукт затем осаждали путем добавления н-гептана, фильтровали и сушили в вакууме при комнатной температуре. Выход: 65,9 г бежевого твердого вещества (50%). 1H ЯМР (300 МГц, ДМСО-d6)(ч/млн) 5,67 (с, 2 Н), 7,29 (м, 6 Н), 7,50 (ддд, 1 Н, J=8,6 Гц, 6,9 Гц, 1,0 Гц), 7,60 (дд, 1 Н, J=8,2 Гц, 0,7 Гц), 7,80 (дд, 1 Н, J=8,6 Гц, 0,7 Гц). 13 С ЯМР (300 МГц, ДМСО-d6)(ч/млн) 52,2, 110,4, 119,5, 121,7, 122,9, 127,4, 127,4, 127,6, 127,7, 128,6, 128,6, 129,6, 136,9, 140,5. Пример 2. Получение 1-бензил-3-гидроксиметил-1H-индазола. Раствор хлорида изопропилмагния (i-PrMgCl) в 2-метилтетрагидрофуране (Me-THF) получали в соответствующим образом тщательно высушенной колбе в атмосфере азота из металлического магния (Mg, 10,91 г, 0,4489 моль, 1,5 экв.), активированного кристаллами йода и раствора изопропилхлорида (i-PrCl, 41,0 мл,0,4489 моль, 1,5 экв.) в безводном Me-THF (185 мл). После охлаждения приблизительно до -10C раствор 1 бензил-3-йод-1H-индазола (100 г, 0,2993 моль, 1,0 экв.) в безводном Me-THF (120 мл) добавляли в течение 1 ч,поддерживая постоянную температуру. Реакционную смесь выдерживали при перемешивании еще в течение часа до завершения обмена галоген/магний и получали желтую суспензию. Газообразный формальдегид (образующийся при нагревании суспензии 54 г параформальдегида в 150 мл ксилола при приблизительно 115C) пропускали поверх нее в течение приблизительно двух часов при температуре ниже 0C. Когда реакция завершалась, добавляли разбавленную H3PO4 и избыток снова полимеризованного параформальдегида удаляли фильтрованием. Фазы разделяли и органическую фазу затем промывали разбавленным раствором NaHCO3 и затем концентрировали. Продукт осаждали добавлением н-гексана, собирали фильтрованием и сушили. Выход: 56,8 г белого твердого вещества (79,6%). Т.пл. 85-86C. 1 Н ЯМР (300 МГц, ДМСО-d6)(ч/млн) 4,79 (д, 2 Н, J=5,8 Гц), 5,27 (т, 1 Н, J=5,8 Гц), 5,6 (с, 2 Н), 7,12(300 МГц, ДМСО-d6)(ч/млн) 51,6, 56,6, 109,6, 120,0, 120,9, 122,2, 126,2, 127,3, 127,3, 127,4, 128,5, 128,5,137,7, 140,3, 145,2. Пример 3. Получение 1-бензил-3-гидроксиметил-1H-индазола. Раствор 2 М i-PrMgCl в THF (69 мл, 138 ммоль, 4,0 экв.) добавляли в соответствующим образом тщательно высушенную колбу с поддерживаемой в ней атмосферой азота. Раствор охлаждали приблизительно до -10C. Раствор 1-бензил-3-бром-1H-индазола (10 г, 34,8 ммоль, 1,0 экв.) в безводном THF (40 мл) добавляли в течение приблизительно одного часа, поддерживая постоянную температуру. Реакционную смесь выдерживали при перемешивании по меньшей мере 6 ч и получали желтую суспензию. Газообразный формальдегид (образующийся при нагревании суспензии 16,7 г параформальдегида в 60 мл ксилола при приблизительно 115C) пропускали поверх нее в течение приблизительно двух часов при температуре ниже 0C. Когда реакция завершалась, добавляли разбавленную Н 3 РО 4 и избыток снова полимеризованного параформальдегида удаляли фильтрованием. К смеси добавляли Ме-THF (60 мл) и фазы разделяли. Органическую фазу промывали разбавленным раствором NaHCO3. После концентрирования органической фазы получали маслянистый остаток, содержащий продукт. Последующая очистка сырого продукта хроматографией на силикагеле давала 2,8 г белого твердого вещества (выход 34%). Т.пл. 85-86C. 1HCl (422 мл, 5,1 моль, 3,0 экв.) добавляли в трехгорлую колбу, снабженную механической мешалкой и оросительным конденсатором. Реакционную смесь нагревали приблизительно до 90C и оставляли перемешиваться до завершения реакции (отслеживаемой TLC, приблизительно 2 ч). После охлаждения до комнатной температуры добавляли NaCl (приблизительно 10 г), фазы разделяли и водную фазу отбрасывали. Органическую фазу промывали насыщенным раствором NaHCO3 (приблизительно 100 мл) и затем концентрировали. Продукт осаждали добавлением н-гексана (приблизительно 500 мл), фильтровали и сушили. Выход: 398,2 г белого твердого вещества (91%). Т.пл. 89-91C. 1 Н ЯМР (300 МГц, ДМСО-d6)(ч/млн) 5,14 (с, 2 Н), 5,65 (с, 2 Н), 7,27 (м, 6 Н), 7,43 (м, 1 Н), 7,12 (д,1 Н, J=8,5 Гц), 7,88 (д, 1 Н, J=8,2 Гц). 13 С ЯМР (300 МГц, ДМСО-d6)(ч/млн) 38,2, 51,8, 110,2, 120,1,120,9, 121,7, 126,7, 127,3, 127,3, 127,5, 128,5, 128,5, 137,2, 140,4, 140,6. Пример 5. Получение 2-[(1-бензил-1H-индазол-3-ил)метокси]-2-метилпропановой кислоты. Этил-2-гидроксиизобутират (18,5 г, 140 ммоль, 1,2 экв.), толуол (100 мл) и DMF (20 мл) помещали в трехгорлую колбу, снабженную механической мешалкой и оросительным конденсатором, в инертной атмосфере. Дисперсию 60% NaH (5,6 г, 140 ммоль, 1,2 экв.) добавляли к смеси порциями в течение периода приблизительно 1,5 ч. Раствор 1-бензил-3-хлорметил-1H-индазола (30 г, 117 ммоль, 1 экв.) в толуоле (90 мл) и DMF (60 мл) затем добавляли по каплям. Реакционную смесь нагревали приблизительно до 90C и выдерживали при этой температуре до завершения реакции (отслеживаемой TLC, приблизительно 10 ч). После охлаждения до комнатной температуры смесь промывали подкисленной водой и водой. Органическую фазу концентрировали при пониженном давлении и полученный маслянистый остаток обрабатывали 10 М NaOH (36 мл) при температуре кипения с возвращением флегмы в течение по меньшей мере 3 ч. Продукт, который осаждали добавлением концентрированной НСl, фильтровали и сушили. Выход: 32,3 г белого твердого вещества (85%). Т.пл. 133-134C. Элементарный анализ: рассчитано: С (70,35), Н (6,21), N (8,64); обнаружено: С (70,15), Н (6,17), N(8,63). 1 Н ЯМР (300 МГц, ДМСО-d6)(ч/млн) 1,44 (с, 6 Н), 4,76 (с, 2 Н), 5,60 (с, 2 Н), 7,14 (т, 1 Н, J=7,6 Гц),7,20-7,34 (м, 5 Н), 7,37 (ддд, 1 Н, J=8,3 Гц, 7,0 Гц, 1,1 Гц), 7,66 (д, 1 Н, J=8,4 Гц), 7,94 (д, 1 Н, J=8,1 Гц),12,77 (с, 1 Н). 13 С ЯМР (300 МГц, ДМСО-d6)(ч/млн) 24,48, 24,48, 51,63, 59,65, 76,93, 109,69, 120,22,121,06, 122,62, 126,28, 127,36, 127,36, 127,44, 128,46, 128,46, 137,49, 140,31, 141,97, 175,46. Пример 6. Получение 1-бензил-1H-индазол-3-карбальдегида. Раствор i-PrMgCl в THF получали в соответствующим образом тщательно высушенной колбе в атмосфере азота из металлического магния (Mg, 164 мг, 6,75 ммоль, 1,5 экв.), активированного кристаллами йода, и раствора i-PrCl (0,62 мл, 6,75 ммоль, 1,5 экв.) в безводном THF (2,8 мл). После охлаждения приблизительно до -10C раствор 1-бензил-3-иод-1H-индазола (1,5 г, 4,5 ммоль,1,0 экв.) в безводном THF (5 мл) добавляли к реакционной смеси в течение одного часа, поддерживая постоянную температуру. Реакционную смесь выдерживали при перемешивании еще в течение 1 ч до завершения обмена галоген/магний, получая желтую суспензию. При перемешивании диметилформамид(DMF) (1,4 мл, 18 ммоль, 4 экв.) добавляли к суспензии в течение одного часа при температуре ниже 0C и реакционную смесь выдерживали при той же температуре до завершения реакции (отслеживаемойTLC). К реакционной смеси добавляли разбавленную Н 3 РО 4 и толуол и фазы разделяли. Органическую фазу промывали разбавленным раствором NaHCO3. После концентрирования органической фазы продукт, осажденный добавлением н-гексана, отфильтровывали и сушили. Выход: 1,0 г белого желтоватого твердого вещества (94%). 1 Н ЯМР (300 МГц, ДМСО-d6)(ч/млн) 5,84 (с, 2 Н), 7,32 (м, 5 Н), 7,39 (ддд, 1 Н, J=8,1 Гц, 7,0 Гц, 1,0 Гц), 7,53 (ддд, 1 Н, J=8,4 Гц, 7,0 Гц, 1,2 Гц) 7,90 (дт, 1 Н, J=8,5 Гц, 1,0 Гц), 8,16 (дт, 1 Н, J=8,1 Гц, 1,2 Гц),10,19 (с,1 Н). 13 С ЯМР (300 МГц, ДМСО-d6)(ч/млн) 52,9, 111,0, 121,0, 121,2, 124.2, 127,5, 127,6, 127,6,127,9, 128,6, 128,6, 136,2, 140,7, 142,4, 186,8. Пример 7. Получение 1-бензил-3-гидроксиметил-1H-индазола. 1-Бензил-1H-индазол-3-карбальдегид (2,36 г, 10 ммоль, 1 экв.) и толуол (12 мл) помещали в тщательно высушенную колбу емкостью 100 мл, снабженную магнитной мешалкой и заполненную азотом. Затем 70% раствор натрий дигидро-бис(2-метоксиэтокси)алюмината в толуоле (2,8 мл, 10 ммоль, 2 экв.) медленно добавляли к раствору при комнатной температуре. После завершения реакции (спустя приблизительно 15 мин) добавляли 2 М HCl (10 мл), H2O (10 мл) и толуол (15 мл). Фазы разделяли и водную фазу экстрагировали дважды толуолом. Слитые органические фазы промывали водой и концентрировали. Продукт затем осаждали добавлением н-гексана, фильтровали и сушили. Выход: 1,95 г белого твердого вещества (82,0%). Т.пл. 85-86C. 1(300 МГц, ДМСО-d6)(ч/млн) 51,6, 56,6, 109,6, 120,0, 120,9, 122,2, 126,2, 127,3, 127,3, 127,4, 128,5, 128,5,137,7, 140,3, 145,2. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения 1-бензил-3-гидроксиметил-1H-индазола, представленного следующей формулой (I): в которой R1 и R2, которые могут быть одинаковыми или разными, означают водород или алкильную группу, имеющую от 1 до 6 атомов углерода,R3, R4 и R8, которые могут быть одинаковыми или разными, представляют собой водород, алкильную группу, имеющую от 1 до 5 атомов углерода, алкоксигруппу, имеющую от 1 до 3 атомов углерода и атом галогена,R5 представляет собой водород, алкильную группу, имеющую от 1 до 5 атомов углерода, алкоксигруппу, имеющую от 1 до 3 атомов углерода, атом галогена, или вместе с одним из R6 и R7 может образовывать кольцо, имеющее 5 или 6 атомов углерода,R6 и R7, которые могут быть одинаковыми или разными, представляют водород, алкильную группу,имеющую от 1 до 5 атомов углерода, или один из R6 и R7 вместе с R5 может образовывать кольцо,имеющее 5 или 6 атомов углерода,R10 и R11, которые могут быть одинаковыми или разными, означают водород или алкильную группу, имеющую от 1 до 5 атомов углерода, иR12 обозначает водород или алкильную группу, имеющую от 1 до 4 атомов углерода, в котором: а) 1-бензил-3-гидроксиметил-1H-индазол или его производное, представленное следующей формулой (II): подвергают взаимодействию с галогеноводородной кислотой формулы НХ", где X" обозначает атом галогена, выбранный из группы, содержащей хлор, бром и йод, предпочтительно хлор, с получением 1 бензил-3-галогенметил-1H-индазола или его производного, представленного следующей формулой (V)(V), подвергают взаимодействию в присутствии сильного основания с соединением, представленным следующей формулой (VI): с получением 1-бензил-3-гидроксиметил-1H-индазола, представленного выше указанной формулой (I). 2. Способ получения по п.1, в котором указанный 1-бензил-3-гидроксиметил-1H-индазол, представленный формулой (I), превращают в соль с карбоксильной группой -COOR12 путем обработки его фармацевтически приемлемым органическим или неорганическим основанием. 3. Способ получения по п.1, где R1 и R2, которые могут быть одинаковыми или разными, представляют собой атом водорода или алкильную группу, имеющую от 1 до 3 атомов углерода. 4. Способ получения по п.1, где R3, R4 и R8, которые могут быть одинаковыми или разными, представляют собой водород, метильную группу, этильную группу, метоксигруппу, этоксигруппу, атом хлора и атом фтора. 5. Способ получения по п.1, где R5 представляет собой водород, метильную группу, этильную группу, метоксигруппу, этоксигруппу, атом хлора и атом фтора или вместе с R6 и R7 может образовывать кольцо, имеющее 6 атомов углерода. 6. Способ получения по п.1, где R6 и R7, которые могут быть одинаковыми или разными, представляют собой водород, метильную группу, этильную группу, или один из R6 и R7 вместе с R5 может образовывать кольцо, имеющее 6 атомов углерода.
МПК / Метки
МПК: C07F 3/02, C07D 231/56
Метки: магнием, получения, способ, промежуточные, соединения, 1-бензил-3-гидроксиметил-1н-индазола, производных, необходимые
Код ссылки
<a href="https://eas.patents.su/10-19060-sposob-polucheniya-1-benzil-3-gidroksimetil-1n-indazola-i-ego-proizvodnyh-i-neobhodimye-promezhutochnye-soedineniya-s-magniem.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 1-бензил-3-гидроксиметил-1н-индазола и его производных и необходимые промежуточные соединения с магнием</a>
Предыдущий патент: Дизамещенные фталазиновые антагонисты пути hedgehog
Следующий патент: Внутриматочная система
Случайный патент: Клапанное устройство газового прибора














