Покрытая пленочной оболочкой таблетка, содержащая иматиниб мезилат, и способ ее получения
Формула / Реферат
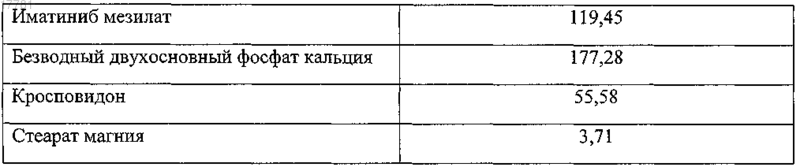
1. Лекарственная форма иматиниба мезилата, представляющая собой покрытую пленочной оболочкой таблетку, включающую сердцевину и пленочную оболочку, причем сердцевина содержит кристаллический иматиниб мезилат, безводный двухосновный фосфат кальция в качестве наполнителя, кросповидон в качестве дезинтегранта и стеарат магния в качестве любриканта, отличающаяся тем, что сердцевина таблетки имеет следующий состав (в мг):
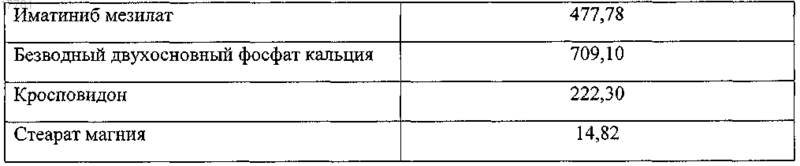
2. Лекарственная форма иматиниба мезилата, представляющая собой покрытую пленочной оболочкой таблетку, включающую сердцевину и пленочную оболочку, причем сердцевина содержит кристаллический иматиниб мезилат, безводный двухосновный фосфат кальция в качестве наполнителя, кросповидон в качестве дезинтегранта и стеарат магния в качестве любриканта, отличающаяся тем, что сердцевина таблетки имеет следующий состав (в мг):
3. Таблетка по п.1 или 2, отличающаяся тем, что пленочная оболочка изготовлена из пленкообразующего материала Opadry® II 85F97369.
4. Способ получения таблетки по любому из пп.1-3, включающий следующие стадии:
а) смешивают кристаллический иматиниб мезилат с 9/10 от необходимого количества безводного двухосновного фосфата кальция и приблизительно 2/3 от необходимого количества кросповидона, добавляют очищенную воду и проводят гранулирование;
б) полученные гранулы высушивают в сушилке с псевдоожиженным слоем;
в) высушенные гранулы подвергают измельчению;
г) полученный на стадии в) порошок объединяют с оставшейся частью кросповидона;
д) к полученному на стадии г) порошку добавляют оставшуюся часть безводного двухосновного фосфата кальция и стеарат магния;
е) полученный на стадии д) порошок спрессовывают в таблетки;
ж) таблетки покрывают пленочной оболочкой.
5. Способ по п.3, отличающийся тем, что на стадии а) гранулирование проводят с использованием гранулятора с высоким срезывающим усилием.
6. Способ по п.3, отличающийся тем, что на стадии в) высушенные гранулы измельчают посредством размалывания на мельнице.
Текст
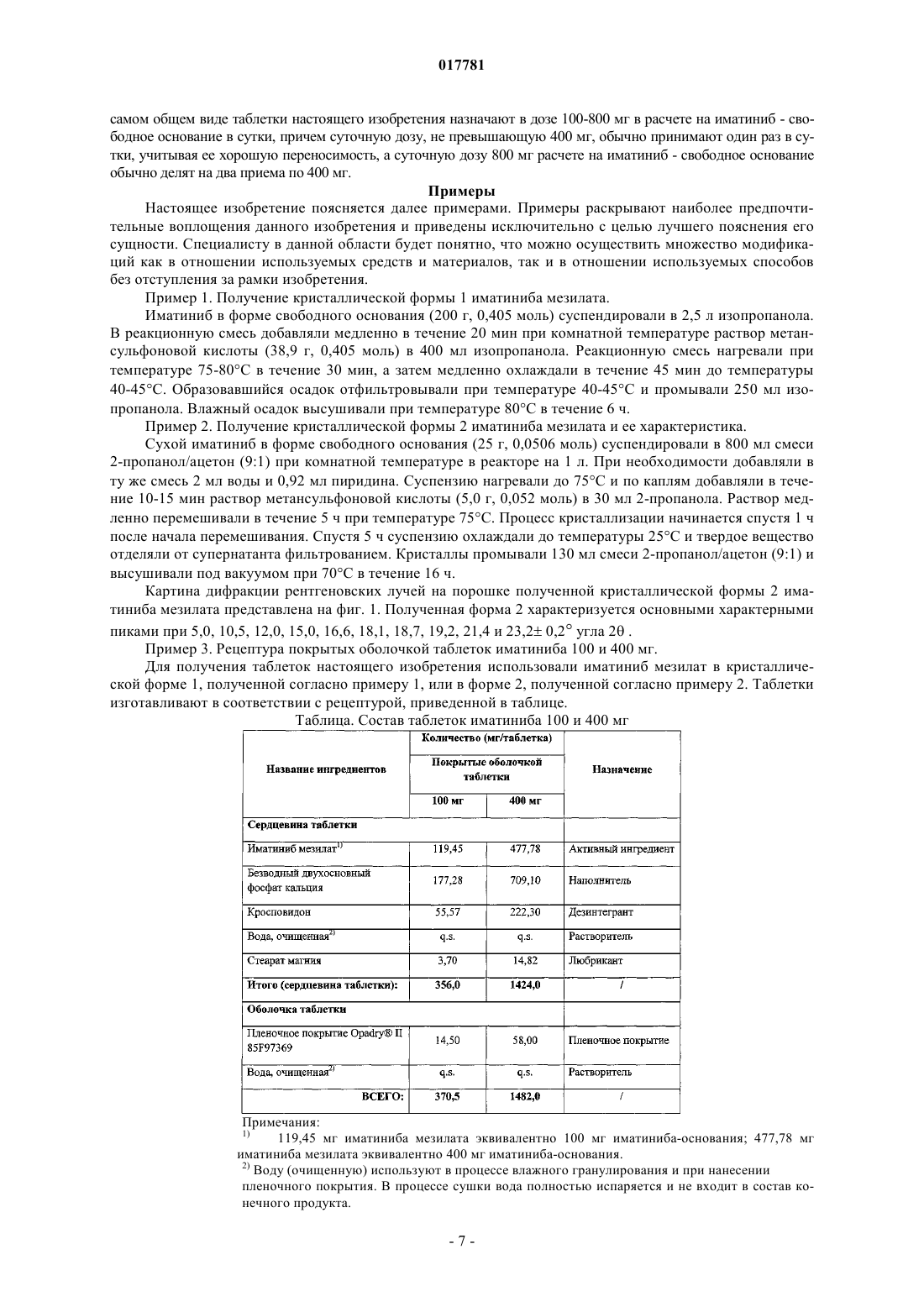
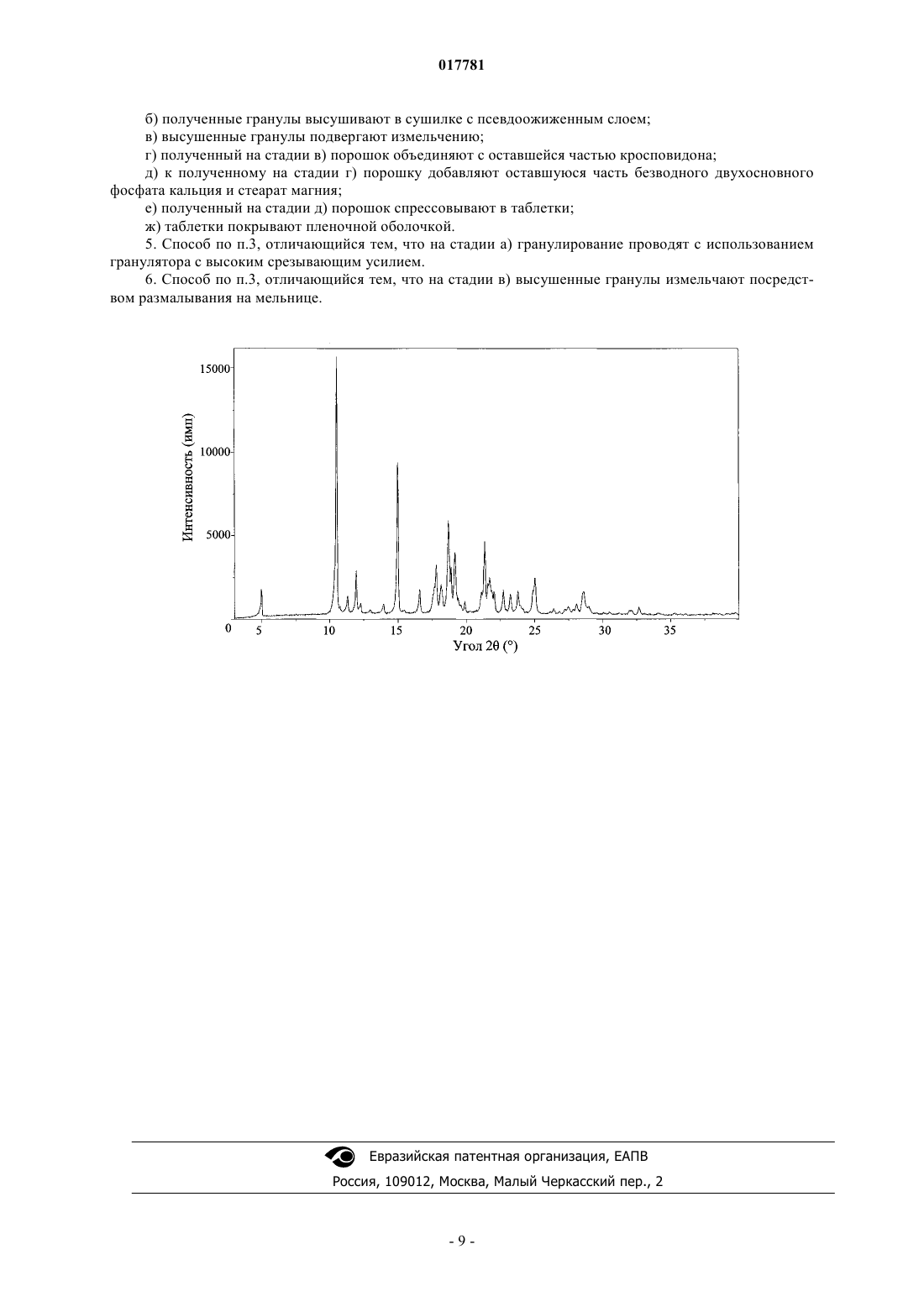
(71)(73) Заявитель и патентовладелец: ТЕВА КАНАДА ЛИМИТЕД (CA); ООО "ТЕВА" (RU) Настоящее изобретение относится к области медицины, в частности фармацевтической промышленности, и обеспечивает новую лекарственную форму иматиниба мезилата,представленную покрытой пленочной оболочкой таблеткой. Сердцевина таблетки содержит в качестве активного вещества кристаллическую форму иматиниба мезилата, безводный двухосновный фосфат кальция в качестве наполнителя и фармацевтически приемлемые вспомогательные вещества, выбранные из группы дезинтегрантов и любрикантов. Изобретение также предусматривает способ получения предложенной таблетки. При производстве таблетки гранулы, полученные после стадии влажного гранулирования, не слипаются и обладают превосходной текучестью и способностью к спрессовыванию в таблетку без необходимости использования связующих веществ и глидантов. Таблетка согласно изобретению обладает устойчивостью к абсорбции атмосферной влаги и высокой стабильностью при хранении. Область техники, к которой относится изобретение Настоящее изобретение относится к области фармацевтической промышленности и медицины и обеспечивает новую лекарственную форму иматиниба (в форме его мезилатной соли), представляющую собой покрытую пленочной оболочкой таблетку, а также способ получения такой таблетки и ее применение. Сведения о предшествующем уровне техники Иматиниб (систематическое название 4-[(4-метил-1-пиперазинил)метил]-N-[4-метил-3-4-(3 пиридинил)-2-пиримидинил]амино]фенил]бензамид) и, в частности, его метансульфонатная соль (иматиниб мезилат) является первым представителем класса ингибиторов тирозиновых протеинкиназ, который селективно ингибирует тирозиновую протеинкиназу Bcr-Abl как в условиях in vitro, так и в условияхin vivo. Соединение селективно ингибирует пролиферацию и индуцирует апоптоз Bcr-Ablположительных клеточных линий, а также свежевыделенных лейкозных клеток от пациентов, страдающих хроническим миелолейкозом (ХМЛ) или острым лимфобластным лейкозом (ОЛЛ), которые являются положительными по Филадельфийской хромосоме. ХМЛ является гематологическим расстройством, связанным со стволовыми клетками, которое характеризуется избыточной пролиферацией клеток миелоидной линии дифференцировки. Отличительным признаком ХМЛ является так называемая Филадельфийская хромосома, возникающая в результате реципрокной транслокации между хромосомами 9 и 22. Молекулярными последствиями такой транслокации является замена первого экзона гена с-Abl на последовательности из гена Bcr, что приводит к слитому гену Bcr-Abl, чей белковый продукт обладает повышенной тирозинкиназной активностью (см., к примеру, O.N. Witte, Role of the BCR-ABL Oncogene in Human Leukemia: Fifteenth Richard and Hinda RosenthalBiol. 1985, 5, 3116-3123). Онкобелок p210Bcr-Abl, встречающийся при ХМЛ, представляет собой полипептид с молекулярной массой 210 кДа и содержит 902 из 927 аминокислот белка Bcr, слитых с экзонами 2-11 белка с-Abl. Онкобелок р 210Bcr-Abl обнаруживают у 95% пациентов, страдающих ХМЛ, а также у 5-10% взрослых пациентов, страдающих ОЛЛ, у которых отсутствуют доказательства наличия предшествующего ХМЛ. Другой слитый белок Bcr-Abl, имеющий молекулярную массу 185 кДа и содержащий последовательность экзона 1 Bcr (426 аминокислот), слитую с экзонами 2-11 с-Abl, встречается в 10% случаев ОЛЛ у взрослых и 5-10% случаев ОЛЛ у детей, но не при ХМЛ (Е. Buchdunger, J. Zimmermann,H. Mett, et al., Selective inhibition of the platelet-derived growth factor signal transduction pathway by a protein-tyrosine kinase inhibitor of the 2-phenylaminopyrimidine class, Proc. Natl. Acad. Sci. 1995, 92, 2558-2562;Derivative CGP 41251, Cancer Research 1992, 52, 5353-5358). Кроме того, иматиниб является ингибитором рецепторных тирозинкиназ для тромбоцитарного фактора роста (PDGF) и фактора стволовых клеток (SCF), c-kit (Kit, CD117) и ингибирует PDGF- и SCFопосредованные клеточные ответы. Иматиниб имеет структурную формулу, приведенную ниже. Соединение в виде свободного основания и его соли, а также фармацевтическая композиция, обладающая противоопухолевой активностью, впервые были раскрыты в патенте RU 2125992 (европейский эквивалент ЕР 0564409). Из международной заявки WO 03/090720 (российский эквивалент RU 2363450) известна таблетка с высоким содержанием активного вещества, представляющего собой иматиниб или его фармацевтически приемлемую соль, где содержание активного вещества составляет от 30 до 80% по массе от общей массы таблетки. Различные кристаллические формы иматиниба мезилата, такие как Форма H1 (Форма I), Форма II,Формы , 2, , , F, G, Н, I, K, а также аморфная форма были описаны в документах WO 99/03854, WO 2005/077933, WO 2005/095379, WO 2004/106326, WO 2006/054314, WO 2006/024863, WO 2006/048890,US 2006/0030568, WO 2007/023182, WO 2007/059963 и US Pat. No. 6894051. Физические свойства твердофазного состояния соединения влияют на такие характеристики, как,например, текучесть. Текучесть является важным технологическим свойством в процессе переработки активного фармацевтического ингредиента в готовый фармацевтический препарат. В частности, в том случае, когда частицы порошкообразного соединения обладают недостаточной текучестью, специалист в области создания рецептур при разработке рецептуры таблетки или капсулы должен учитывать это обстоятельство и включить в состав рецептуры глиданты, такие как, например, коллоидный диоксид кремния, крахмал, тальк или трехосновный фосфат кальция. Также важной характеристикой соединения, зависящей от его кристаллической/аморфной структуры, является скорость его растворения в водной среде. Скорость растворения активного ингредиента при попадании в жидкую среду желудка может иметь терапевтические последствия, поскольку она определяет верхний предел скорости, с которой активный ингредиент, введенный перорально, сможет поступать в системный кровоток пациента. Кроме того, конкретная кристаллическая/аморфная структура будет влиять на поведение соединения в процессе прессования, а также на его стабильность при хранении. Указанные выше важные в практическом отношении физические характеристики зависят от конформации и ориентации молекул соединения в элементарной ячейке, которая собственно и определяет конкретную полиморфную форму соединения. Полиморфная форма может отличаться своим температурным поведением от поведения аморфной формы или другой полиморфной формы. Температурное поведение принято определять в лабораторных условиях с использованием таких методов, как термогравиметрический анализ, определение точки плавления в капилляре, дифференциальная сканирующая калориметрия, причем эти методы могут быть использованы для того, чтобы отличить одну полиморфную форму от другой. Также различные полиморфные формы могут характеризоваться различными спектроскопическими свойствами при рентгеновской кристаллографии на порошке, твердофазной 13 С-ЯМР спектроскопии и инфракрасной спектрометрии. В настоящее время около 75% всех имеющихся фармацевтических средств и препаратов предназначены для перорального введения в организм в форме твердых лекарственных форм, среди которых преобладают таблетки и капсулы. Помимо активного фармацевтического ингредиента в состав таблеток или содержимого капсул входят различные вспомогательные вещества. В подавляющем большинстве случаев порошкообразные смеси, содержащие активный ингредиент, не могут быть переработаны в готовую лекарственную форму путем прямого прессования с использованием таблетировочного пресса или инкапсулирования в связи с неудовлетворительными технологическими свойствами порошка. При этом могут иметь место расслаивание порошкообразной смеси, неполное заполнение матрицы таблетировочного пресса или капсулы, а также невоспроизводимость показателей конечного продукта. Существующим подходом для преодоления указанных трудностей при переработке такой порошкообразной смеси в готовый продукт является гранулирование. Гранулирование влияет на такие физические свойства материалов, как, например, размер частиц, распределение, твердость, насыпная плотность и площадь поверхности. По сравнению с порошками, из которых их получают, гранулированные материалы отличаются значительно лучшей текучестью и увеличенной плотностью. В свою очередь, это имеет следующие важные с технологической точки зрения последствия: гранулированные материалы легко поддаются точному дозированию (при подаче в таблетировочную машину или при заполнении капсул); часто наблюдается улучшение скорости растворения или диспергирования при получении гранулированных материалов; достигается гомогенное распределение активного фармацевтического ингредиента; образуется меньше пылевидных частиц, что снижает риск нанесения вреда здоровью работников и увеличивает время жизни оборудования. Одной из проблем при изготовлении таблеток иматиниба, связанной с физико-химическими свойствами активного начала и необходимостью включения его в состав лекарственной формы в большом относительном количестве при сохранении приемлемых (для перорального введения) размеров таблетки,является высокая хрупкость и низкая прочность на истирание. На преодоление этих недостатков было направлено изобретение, описанное в патенте RU 2363450 (Novartis AG, Швейцария). Предложенное техническое решение заключалось в использовании стадии влажного гранулирования и микрокристаллической целлюлозы или гидроксипропилметилцеллюлозы, или их смеси в качестве связующего при производстве таблетки. В настоящее время лекарственный препарат на основе иматиниба мезилата производится фирмойNovartis и поставляется на рынок под двумя зарегистрированными товарными знаками Gleevec (для США) и Glivec (для Европы, Австралии, Латинской Америки). Он представлен твердыми капсулами,содержащими 50 или 100 мг действующего вещества, и покрытыми пленочной оболочкой таблетками,содержащими 100 или 400 мг действующего вещества (см., к примеру http://www.glivec.com/summary-ofproduct-characteristics.jsp). Также в состав покрытых оболочкой таблеток Gleevec/Glivec помимо активного вещества входят следующие компоненты: Сердцевина таблетки: Микрокристаллическая целлюлоза Кросповидон (поперечно-сшитый поливинилпирролидон) Гипромеллоза (гидроксипропилметилцеллюлоза) Стеарат магния Безводный коллоидный диоксид кремния Оболочка таблетки: Оксид железа красный (Е 172) Оксид железа желтый (Е 172) Макрогол Тальк Гипромеллоза Гарантийный срок хранения препарата составляет 3 г при температуре не выше 30 С. Препарат должен храниться в оригинальной упаковке с целью защиты от проникновения влаги. Препарат Gleevec/Glivec назначают для лечения пациентов (детей и взрослых): с впервые диагностированным ХМЛ; с ХМЛ в фазе обострения, бластного криза, а также в хронической фазе при неэффективности предшествующей терапии интерфероном альфа. Также препарат Gleevec/Glivec назначают для лечения взрослых пациентов: с впервые диагностированным позитивным (с присутствием в лейкоцитах Филадельфийской хромосомы) острым лимфобластным лейкозом (Ph+-ОЛЛ) в составе химиотерапии; с острым лимфобластным лейкозом в стадии рецидива или при стойкой толерантности к химиотерапии (в форме монотерапии); с MDS/MPD (миелодиспластическими/миелопрофелиративными заболеваниями), связанными с генетической перестройкой рецептора PDGF; с системным мастоцитозом (СМ) с отсутствием c-Kit-мутации D816V или при отсутствии данных о мутационном статусе c-Kit-мутации; с HES/CEL (гиперэозинофильным синдромом и/или хронической эозинофильной лейкемией); с неоперабельными и/или метастатическими злокачественными стромальными опухолями органов пищеварительного тракта; в качестве адъювантной терапии после резекции стромальной опухоли ЖКТ; с DFSP (неоперабельной, рекуррентной и/или метастазирующей бугорковой дерматофибросаркомой). Суточные дозы препарата зависят от конкретного заболевания и его тяжести и обычно составляют 400-800 мг в сутки в расчете на взрослого пациента. В состав препаратов Gleevec/Glivec иматиниб мезилат входит в виде -кристаллической формы. Одной из особенностей иматиниба мезилата как активного фармацевтического ингредиента является его малая насыпная плотность, склонность к слипанию и низкая текучесть. В связи с указанным выше существует настоятельная потребность в расширении арсенала доступных лекарственных препаратов на основе иматиниба и в разработке таких лекарственных форм, при производстве которых были бы обеспечены необходимые технологические свойства, в частности увеличенная насыпная плотность, высокая текучесть гранул, полученных в результате процесса влажного гранулирования, отсутствие слипания и высокая способность к спрессовыванию в таблетку. Также важным аспектом является обеспечение устойчивости к абсорбции атмосферной влаги (негигроскопичности) и высокой стабильности активного фармацевтического ингредиента и всей лекарственной формы (таблетки) в целом в течение срока годности. Сущность изобретения Первый аспект настоящего изобретения направлен на создание лекарственной формы иматиниба мезилата, представляющей собой покрытую пленочной оболочкой таблетку, включающую сердцевину и пленочную оболочку, причем сердцевина содержит кристаллический иматиниб мезилат, безводный двухосновный фосфат кальция в качестве наполнителя, кросповидон в качестве дезинтегранта и стеарат магния в качестве любриканта. В одном из предпочтительных вариантов сердцевина таблетки имеет следующий состав (в мг): В другом предпочтительном варианте сердцевина таблетки имеет следующий состав (в мг): В другом предпочтительном варианте пленочная оболочка изготовлена из пленкообразующего материала Opadry II 85F97369. Второй аспект настоящего изобретения направлен на разработку способа получения предложенной лекарственной формы. Разработанный способ включает следующие стадии: а) смешивают кристаллический иматиниб мезилат с 9/10 от необходимого количества безводного двухосновного фосфата кальция и приблизительно 2/3 от необходимого количества кросповидона, добавляют очищенную воду и проводят гранулирование; б) полученные гранулы высушивают в сушилке с псевдоожиженным слоем; в) высушенные гранулы подвергают измельчению; г) полученный на стадии в) порошок объединяют с оставшейся частью кросповидона; д) к полученному на стадии г) порошку добавляют оставшуюся часть безводного двухосновного фосфата кальция и стеарат магния; е) полученный на стадии д) порошок спрессовывают в таблетки; ж) таблетки покрывают пленочной оболочкой. В одном предпочтительном варианте на стадии а) гранулирование проводят с использованием гранулятора с высоким срезывающим усилием. В другом предпочтительном варианте на стадии в) высушенные гранулы измельчают посредством размалывания на мельнице. Благодаря использованию разработанной рецептуры, а также благодаря использованию способа настоящего изобретения при переработке порошкообразного активного фармацевтического ингредиента в гранулы достигается увеличение насыпной плотности компактизованного материала, предотвращается слипание, обеспечиваются превосходные текучесть и способность к спрессовыванию полученных гранул в таблетку без необходимости использования связующего вещества и глиданта. Таблетка настоящего изобретения устойчива к абсорбции атмосферной влаги и обладает высокой стабильностью при хранении. Срок годности таблетки настоящего изобретения составляет не менее трех лет. Предложенная лекарственная форма иматиниба мезилата, представляющая собой покрытую пленочной оболочкой таблетку, может быть использована для перорального лечения заболевания или состояния, при которых показано применение иматиниба. Перечень фигур На чертеже представлена картина дифракции рентгеновских лучей на порошке кристаллической формы 2 иматиниба мезилата. Сведения, подтверждающие возможность осуществления изобретения Для получения таблетки согласно изобретению используют кристаллическую форму иматиниба мезилата. Различные кристаллические формы иматиниба мезилата, такие как Форма H1 (Форма I), ФормаII, Формы , 2, , , F, G, Н, I, K были описаны в документах WO 99/03854, WO 2005/077933, WO 2005/095379, WO 2006/054314, WO 2006/024863, WO 2006/048890, US 2006/0030568, WO 2007/023182,WO 2007/059963 и US Pat. No 6894051. Предпочтительно кристаллическая форма может быть представлена такими известными из уровня техники формами, как Формыи 2. Способы получения кристаллической Формы а иматиниба мезилата раскрыты, например, в US 6894051, WO 2006/024863 и WO 2006/048890. Способ получения кристаллической Формы 2 иматиниба мезилата раскрыт, например, вWO 2005/077933. Другими предпочтительными кристаллическими формами для получения таблетки настоящего изобретения являются форма 1, которая может быть получена способом, как описано ниже в примере 1, или форма 2, имеющая основные характерные пики на дифрактограмме рентгеновских лучей на порошке при 5,0, 10,5, 12,0, 15,0, 16,6, 18,1, 18,7, 19,2, 21,4 и 23,20,2 угла 2 и описанная ниже в примере 2. Таблетка настоящего изобретения является покрытой пленочной оболочкой и, таким образом, состоит из сердцевины, содержащей активный компонент и фармацевтически приемлемые вспомогательные вещества (эксципиенты), и собственно пленочной оболочки. Одной из функций пленочного покрытия inter alia является защита активного компонента от таких факторов окружающей среды, как воздух,влажность и свет, с целью улучшения стабильности. Таблетка настоящего изобретения включает наполнитель. Под наполнителем в настоящем изобретении понимается вещество, используемое для придания порошкообразной таблетируемой смеси объема, так чтобы можно было получить таблетку приемлемого размера, как предусмотрено, например, вRemington's Pharmaceutical Sciences (18th Edition, A. R. Gennaro, Ed., Mack Publishing Company, Easton, PA,1990, pp. 1633-1665). Обычно в большинстве коммерчески производимых таблеток на долю наполнителя приходится основная доля общей массы таблетки. Известен широкий спектр наполнителей, который включает такие соединения, как целлюлоза, сульфат кальция, крахмал, маннит, сахароза, лактоза, двузамещенный фосфат кальция, каолин и т.д. Однако выбор конкретного наполнителя определяется как свойствами активного начала, так и обычными требованиями, налагаемыми самим процессом производства таблеток, а именно достаточной текучестью смеси, подвергаемой таблетированию, достаточно низким трением между частицами порошка, отсутствием прилипания частиц подвергаемого прессованию порошка к матрице и пуансону таблетировочной машины, и т.д. В случае иматиниба мезилата при создании рецептуры для таблетки необходимо принимать во внимание низкую насыпную плотность, склонность к слипанию и низкую текучесть порошкообразного активного фармацевтического ингредиента. Заявители неожиданно обнаружили, что при использовании безводного двухосновного фосфата кальция в качестве наполнителя при производстве таблеток настоящего изобретения получаемые в результате осуществления стадии влажного гранулирования гранулы обладают превосходными текучестью и способностью к спрессовыванию в таблетки. Также в таблетке настоящего изобретения может присутствовать один или более фармацевтически приемлемых вспомогательных веществ (эксципиентов), которые применяются традиционно в данной области, например, по меньшей мере один дезинтегрант, способствующий дезинтеграции таблетки при попадании ее в жидкую среду. Примеры таких агентов хорошо известны в данной области и включают, в частности, крахмалы, глины, производные целлюлозы, производные альгиновой кислоты, камеди, поперечно-сшитые полимеры (см., к примеру, Remington's Pharmaceutical Sciences (18th Edition, A. R. Gennaro,Ed., Mack Publishing Company, Easton, PA, 1990, pp. 1633-1665). Среди предпочтительных дезинтегрантов следует отметить группу так называемых супердезинтегрантов, к которой относятся кроскармелоза(пример поперечно-сшитых целлюлоз), кросповидон (поперечно-сшитый поливинилпирролидон - представитель группы поперечно-сшитых полимеров) и натриевая соль гликолята крахмала (представитель поперечно-сшитых крахмалов). Согласно настоящему изобретению наиболее предпочтительным дезинтегрантом является кросповидон. Также таблетка настоящего изобретения может включать один или более любрикантов (замасливателей). В настоящем изобретении под любрикантами понимают агенты, которые могут выполнять несколько функций, в частности препятствуют прилипанию материала таблетки к матрице и пуансону таблетировочной машины, уменьшают трение между частицами порошка, препятствуют залипанию таблетки в матрице таблетировочной машины после окончания прессования и могут увеличивать текучесть на стадии гранулирования. В качестве любрикантов обычно используют такие вещества, как, например,тальк, стеарат магния, стеарат кальция, стеариновую кислоту, гидрогенизированные растительные масла,полиэтиленгликоль и т.д. (см., к примеру, Remington's Pharmaceutical Sciences (18th Edition, A. R. Gennaro,Ed., Mack Publishing Company, Easton, PA, 1990, pp. 1633-1665. Таблетка согласно настоящему изобретению предпочтительно содержит стеарат магния в качестве любриканта. В данной области техники имеется множество руководств и справочных пособий, относящихся к указанным выше и другим эксципиентам (см., например, Handbook of Pharmaceutical Excipients,APhA/Pharm. Soc. Great Britain, APhA, Washington, DC 1986). Один или несколько из этих эксципиентов могут быть выбраны и использованы с учетом конкретных желаемых свойств таблетки обычным экспериментальным методом. Специалисту в данной области будет понятно, что выбранные эксципиенты могут одновременно выполнять несколько функций, например, глиданта и любриканта и т.д. В связи с тем, что иматиниб мезилат назначают в количестве в среднем от 400 до 800 мг в расчете на иматиниб - свободное основание в сутки в расчете на взрослого пациента и в меньших дозах - для детей, стандартная лекарственная форма иматиниба мезилата должна содержать достаточно большое количество активного вещества, например, от 100 до 400 мг с целью обеспечить удобство приема (легкость при проглатывании) и, при необходимости, кратность приема (например, два раза в сутки). Учитывая данное обстоятельство, таблетка настоящего изобретения будет содержать наполнитель - безводный двухосновный фосфат кальция в количестве 45-55 мас.% в расчете на общую массу сердцевины таблетки. Таблетка настоящего изобретения также будет содержать один или более дезинтегрантов в суммарном количестве приблизительно от 10 до 20 мас.% в расчете на общую массу сердцевины таблетки. В соответствии с данным изобретением сердцевина таблетки предпочтительно будет содержать кросповидон в качестве дезинтегранта. Содержание одного или более любрикантов в составе таблетки настоящего изобретения будет находиться в диапазоне приблизительно от 0,5 до 1,5 мас.% в расчете на общую массу сердцевины таблетки. На долю активного вещества должно приходиться приблизительно от 30 до 40 мас.% в расчете на общую массу сердцевины таблетки. В состав пленочной оболочки могут входить такие традиционно используемые в данной области вещества, как, например, пленкообразующий полимер, пластификатор, краситель и растворитель или разбавитель (см., к примеру, Remington's Pharmaceutical Sciences (18th Edition, A. R. Gennaro, Ed., MackPublishing Company, Easton, PA, 1990, pp. 1666-1675. В качестве пленкообразующих полимеров наиболее широкое распространение имеют простые эфиры целлюлозы, такие как гидроксипропилметилцеллюлоза, метилцеллюлоза, гидроксипропилцеллюлоза, а также различные акриловые полимеры, такие как сополимеры акрилата или метилметакрилата. Помимо перечисленных выше компонентов смесь для нанесения пленочного покрытия может содержать дополнительные ингредиенты, известные в данной области. Предпочтительно пленочная оболочка таблетки настоящего изобретения содержит пленкообразующий полимер, один или более красителей, глидант и растворитель (который не входит в состав конечного продукта, т.к. он испаряется в ходе нанесения покрытия). Наиболее предпочтительно таблетка согласно настоящему изобретения покрыта пленочной оболочкой, выполненной из смеси, содержащей следующие компоненты: один или более пленкообразующих полимеров, глидант, например, тальк, красители, например смесь оксида железа (III) желтого, оксида железа (III) красного и диоксида титана, а также очищенную воду в качестве растворителя. Наиболее предпочтительным в соответствии с настоящим изобретением является использование для получения пленочной оболочки пленкообразующего материала, зарегистрированного под товарным знаком Opadry II 85F97369 (Colorcon) и содержащего частично гидролизованный поливиниловый спирт, макрогол, тальк, оксид железа (III) желтый, оксид железа(III) красный и диоксид титана. В предпочтительном воплощении настоящее изобретение обеспечивает стандартные лекарственные формы, представленные покрытыми пленочной оболочкой таблетками, содержащие 100 или 400 мг активного начала в расчете на иматиниб - свободное основание. Для изготовления таблетки согласно настоящему изобретению могут быть использованы способы,известные в данной области техники и описанные, например, в Remington's Pharmaceutical Sciences (Alfonso R. Gennaro, Ed., 18th Edition, Mack Publishing Company, Easton, PA, 1990, p. 1633-1665). В частности,таблетка согласно настоящему изобретению может быть изготовлена с помощью влажного гранулирования с последующим прессованием. В качестве растворителя используют очищенную воду. Способ согласно изобретению включает следующие стадии: а) смешивают кристаллический иматиниб мезилат, с частью от необходимого количества безводного двухосновного фосфата кальция и частью от необходимого количества одного или более дезинтегрантов, добавляют очищенную воду в необходимом количестве и проводят гранулирование; б) полученные гранулы высушивают в сушилке с псевдоожиженным слоем; в) высушенные гранулы подвергают измельчению; г) полученный на стадии в) порошок объединяют с оставшейся частью одного или более дезинтегрантов; д) к полученному на стадии г) порошку добавляют оставшуюся часть безводного двухосновного фосфата кальция и необходимое количество одного или более любрикантов; е) полученный на стадии д) порошок спрессовывают в таблетки; ж) таблетки покрывают пленочной оболочкой. В одном из предпочтительных воплощений кристаллический иматиниб мезилат представлен формой 1, которая может быть получена способом, как описано ниже в примере 1, или формой 2, имеющей основные характерные пики на дифрактограмме рентгеновских лучей на порошке при 5,0, 10,5, 12,0,15,0, 16,6, 18,1, 18,7, 19,2, 21,4 и 23,2 0,2 угла 2 и описанной ниже в примере 2. В предпочтительном воплощении в качестве дезинтегранта используют кросповидон. В следующем предпочтительном воплощении в качестве любриканта используют стеарат магния. На стадии а) гранулирование проводят известными способами, например, как описано в Remington'sPharmaceutical Sciences (Alfonso R. Gennaro, Ed., 18th Edition, Mack Publishing Company, Easton, PA, 1990,p. 1633-1665). Предпочтительно используют гранулятор с высоким срезывающим усилием. На стадии в) измельчение проводят известными способами, например, как описано в Remington'sPharmaceutical Sciences (Alfonso R. Gennaro, Ed., 18th Edition, Mack Publishing Company, Easton, PA, 1990,p. 1633-1665). Предпочтительно гранулы размалывают на мельнице. В еще одном предпочтительном воплощении для изготовления пленочной оболочки используют коммерчески доступный продукт, зарегистрированный под товарным знаком Opadry II 85F97369(Colorcon). Способы нанесения пленочной оболочки на полученную прессованием таблетку хорошо известны в данной области техники и описаны, например, в Remington's Pharmaceutical Sciences (Alfonso R.Gennaro, Ed., 18th Edition, Mack Publishing Company, Easton, PA, 1990, p. 1666-1675). Сердцевине таблетки и, соответственно, самой таблетке может быть придана любая форма в зависимости от формы матрицы и пуансона, используемых при прессовании (см. к примеру Remington'sPharmaceutical Sciences (Alfonso R. Gennaro, Ed., 18th Edition, Mack Publishing Company, Easton, PA, 1990,p. 1633-1665. Показания к применению таблеток согласно изобретению определяются содержащимся в таблетках активным фармацевтическим ингредиентом - иматинибом мезилатом и, таким образом, совпадают с показаниями к применению имеющихся в продаже препаратов иматиниба мезилата, напримерGleevec/Glivec. Показатели биодоступности/биоэквивалентности могут быть определены в стандартных фармакокинетических исследованиях. Таблетки изобретения могут применяться по назначению врача в качестве единственного активного лекарственного средства или совместно с другими лекарственными средствами, которые могут вводиться по отношению к таблеткам настоящего изобретения одновременно, последовательно или отдельно. Дозы и режимы введения таблеток настоящего изобретения определяются конкретным диагнозом,тяжестью заболевания, весом и возрастом пациента, нуждающегося в лечении, приемом дополнительных лекарственных средств, наличием сопутствующих заболеваний, и лечащий врач сможет без труда определить их. В целом, дозировки и режимы введения таблеток настоящего изобретения не будут отличаться от таковых для имеющихся в продаже препаратов иматиниба мезилата, например Gleevee/Glivec. В самом общем виде таблетки настоящего изобретения назначают в дозе 100-800 мг в расчете на иматиниб - свободное основание в сутки, причем суточную дозу, не превышающую 400 мг, обычно принимают один раз в сутки, учитывая ее хорошую переносимость, а суточную дозу 800 мг расчете на иматиниб - свободное основание обычно делят на два приема по 400 мг. Примеры Настоящее изобретение поясняется далее примерами. Примеры раскрывают наиболее предпочтительные воплощения данного изобретения и приведены исключительно с целью лучшего пояснения его сущности. Специалисту в данной области будет понятно, что можно осуществить множество модификаций как в отношении используемых средств и материалов, так и в отношении используемых способов без отступления за рамки изобретения. Пример 1. Получение кристаллической формы 1 иматиниба мезилата. Иматиниб в форме свободного основания (200 г, 0,405 моль) суспендировали в 2,5 л изопропанола. В реакционную смесь добавляли медленно в течение 20 мин при комнатной температуре раствор метансульфоновой кислоты (38,9 г, 0,405 моль) в 400 мл изопропанола. Реакционную смесь нагревали при температуре 75-80 С в течение 30 мин, а затем медленно охлаждали в течение 45 мин до температуры 40-45 С. Образовавшийся осадок отфильтровывали при температуре 40-45 С и промывали 250 мл изопропанола. Влажный осадок высушивали при температуре 80 С в течение 6 ч. Пример 2. Получение кристаллической формы 2 иматиниба мезилата и ее характеристика. Сухой иматиниб в форме свободного основания (25 г, 0,0506 моль) суспендировали в 800 мл смеси 2-пропанол/ацетон (9:1) при комнатной температуре в реакторе на 1 л. При необходимости добавляли в ту же смесь 2 мл воды и 0,92 мл пиридина. Суспензию нагревали до 75 С и по каплям добавляли в течение 10-15 мин раствор метансульфоновой кислоты (5,0 г, 0,052 моль) в 30 мл 2-пропанола. Раствор медленно перемешивали в течение 5 ч при температуре 75 С. Процесс кристаллизации начинается спустя 1 ч после начала перемешивания. Спустя 5 ч суспензию охлаждали до температуры 25 С и твердое вещество отделяли от супернатанта фильтрованием. Кристаллы промывали 130 мл смеси 2-пропанол/ацетон (9:1) и высушивали под вакуумом при 70 С в течение 16 ч. Картина дифракции рентгеновских лучей на порошке полученной кристаллической формы 2 иматиниба мезилата представлена на фиг. 1. Полученная форма 2 характеризуется основными характерными пиками при 5,0, 10,5, 12,0, 15,0, 16,6, 18,1, 18,7, 19,2, 21,4 и 23,2 0,2 угла 2 . Пример 3. Рецептура покрытых оболочкой таблеток иматиниба 100 и 400 мг. Для получения таблеток настоящего изобретения использовали иматиниб мезилат в кристаллической форме 1, полученной согласно примеру 1, или в форме 2, полученной согласно примеру 2. Таблетки изготавливают в соответствии с рецептурой, приведенной в таблице. Таблица. Состав таблеток иматиниба 100 и 400 мг Примечания: 1) 119,45 мг иматиниба мезилата эквивалентно 100 мг иматиниба-основания; 477,78 мг иматиниба мезилата эквивалентно 400 мг иматиниба-основания. 2) Воду (очищенную) используют в процессе влажного гранулирования и при нанесении пленочного покрытия. В процессе сушки вода полностью испаряется и не входит в состав конечного продукта. Пример 4. Изготовление покрытых оболочкой таблеток иматиниба 100 и 400 мг. Таблетки иматиниба получают способом, детально описанным ниже. Количества активного фармацевтического ингредиента и вспомогательных веществ, используемых при производстве таблетки, указаны выше в табл. 1. Таблетки получают следующим образом: а) смешивают кристаллический иматиниб мезилат, представленный его формой 1, полученной согласно примеру 1, или формой 2, полученной согласно Примеру 2, приблизительно 9/10 от необходимой массы безводного двухосновного фосфата кальция и 2/3 от необходимой массы кросповидона в грануляторе с высоким срезывающим усилием, добавляют очищенную воду в необходимом количестве и проводят гранулирование; б) полученные гранулы высушивают в сушилке с псевдоожиженным слоем; в) высушенные гранулы подвергают размалыванию на мельнице; г) полученный на стадии в) порошок объединяют с оставшейся 1/3 от необходимой массы кросповидона; д) к полученному на стадии г) порошку добавляют оставшуюся приблизительно 1/10 от необходимой массы безводного двухосновного фосфата кальция и необходимое количество стеарата магния; е) полученный на стадии д) порошок спрессовывают в таблетки; ж) таблетки покрывают пленочной оболочкой с использованием водной суспензии коммерчески доступного пленкообразующего материала Opadry II 85F97369. Полученные таблетки упаковывают в специальную оболочку. Все патенты, публикации, научные статьи и другие документы и материалы, цитируемые или упоминаемые здесь, включены в настоящее описание путем отсылки в такой степени, как если бы каждый из этих документов был включен путем отсылки индивидуально или приведен здесь в его полном виде. Конкретные используемые материалы и методы, описанные здесь, относятся к предпочтительным вариантам осуществления, приведены в качестве примеров и не предназначены для ограничения объема данного изобретения. При изучении этого описания другие объекты, аспекты и воплощения будут приходить в голову специалистам в данной области, и они охватываются рамками данного изобретения. Специалистам в данной области будет понятно, что различные замены и модификации могут быть произведены в отношении описанного здесь изобретения без отклонения от его объема и рамок, которые определяются прилагаемой формулой изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Лекарственная форма иматиниба мезилата, представляющая собой покрытую пленочной оболочкой таблетку, включающую сердцевину и пленочную оболочку, причем сердцевина содержит кристаллический иматиниб мезилат, безводный двухосновный фосфат кальция в качестве наполнителя, кросповидон в качестве дезинтегранта и стеарат магния в качестве любриканта, отличающаяся тем, что сердцевина таблетки имеет следующий состав (в мг): 2. Лекарственная форма иматиниба мезилата, представляющая собой покрытую пленочной оболочкой таблетку, включающую сердцевину и пленочную оболочку, причем сердцевина содержит кристаллический иматиниб мезилат, безводный двухосновный фосфат кальция в качестве наполнителя, кросповидон в качестве дезинтегранта и стеарат магния в качестве любриканта, отличающаяся тем, что сердцевина таблетки имеет следующий состав (в мг): 3. Таблетка по п.1 или 2, отличающаяся тем, что пленочная оболочка изготовлена из пленкообразующего материала Opadry II 85F97369. 4. Способ получения таблетки по любому из пп.1-3, включающий следующие стадии: а) смешивают кристаллический иматиниб мезилат с 9/10 от необходимого количества безводного двухосновного фосфата кальция и приблизительно 2/3 от необходимого количества кросповидона, добавляют очищенную воду и проводят гранулирование; б) полученные гранулы высушивают в сушилке с псевдоожиженным слоем; в) высушенные гранулы подвергают измельчению; г) полученный на стадии в) порошок объединяют с оставшейся частью кросповидона; д) к полученному на стадии г) порошку добавляют оставшуюся часть безводного двухосновного фосфата кальция и стеарат магния; е) полученный на стадии д) порошок спрессовывают в таблетки; ж) таблетки покрывают пленочной оболочкой. 5. Способ по п.3, отличающийся тем, что на стадии а) гранулирование проводят с использованием гранулятора с высоким срезывающим усилием. 6. Способ по п.3, отличающийся тем, что на стадии в) высушенные гранулы измельчают посредством размалывания на мельнице.
МПК / Метки
МПК: A61K 31/506, A61J 3/10, A61K 47/30, A61K 9/20, A61K 47/12, A61P 35/00, A61K 47/04
Метки: иматиниб, пленочной, покрытая, оболочкой, способ, получения, мезилат, таблетка, содержащая
Код ссылки
<a href="https://eas.patents.su/10-17781-pokrytaya-plenochnojj-obolochkojj-tabletka-soderzhashhaya-imatinib-mezilat-i-sposob-ee-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Покрытая пленочной оболочкой таблетка, содержащая иматиниб мезилат, и способ ее получения</a>
Предыдущий патент: Погрузочное устройство для агломерационной шихты с упругим отклоняющим матом
Следующий патент: Капсула, содержащая иматиниб мезилат, и способ ее получения
Случайный патент: Комплект из сцепного устройства и прицепа