Антагонисты мускариновых рецепторов ацетилхолина
Номер патента: 15033
Опубликовано: 29.04.2011
Авторы: Томас Соня М., Нейпп Кристофер Э., Лэн Драман И., Палович Майкл Р., Макклеланд Брент У.
Формула / Реферат
1. 4-[Гидрокси(дифенил)метил]-1-{2-[(фенилметил)окси]этил}-1-азониабицикло[2.2.2]октанбромид формулы
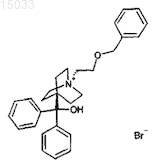
2. Фармацевтическая композиция, содержащая 4-[гидрокси(дифенил)метил]-1-{2-[(фенилметил)окси]этил}-1-азониабицикло[2.2.2]октанбромид и фармацевтически приемлемый носитель.
3. Фармацевтическая композиция по п.2, дополнительно содержащая одно или несколько других терапевтических ингредиентов.
4. Применение соединения по п.1 в безопасном и эффективном количестве при лечении заболевания, опосредованного мускариновым рецептором ацетилхолина, где ацетилхолин связан с указанным рецептором.
5. Применение по п.4, где заболевание выбрано из группы, состоящей из хронического обструктивного легочного заболевания, хронического бронхита, астмы, хронической респираторной обструкции, пневмосклероза, эмфиземы легких и аллергического ринита.
6. Применение по п.4, где введение проводят посредством ингаляции через рот или нос.
7. Применение по п.4, где введение проводят посредством устройства подачи лекарственного средства, выбранного из группы, состоящей из ингалятора сухого порошка с резервуаром, многодозового ингалятора сухого порошка и ингалятора с отмеренной дозой.
Текст
(71)(73) Заявитель и патентовладелец: ГЛЭКСО ГРУП ЛИМИТЕД (GB) Предоставлено новое производное хинуклидина, фармацевтическая композиция и его применение для лечения заболеваний дыхательных путей, опосредованных мускариновыми рецепторами ацетилхолина. 015033 Область изобретения Изобретение относится к новому производному хинуклидина, фармацевтическим композициям и их применению для лечения заболеваний дыхательных путей, опосредованных мускариновыми рецепторами ацетилхолина. Предпосылки изобретения Ацетилхолин, высвобождаемый из холинергических нейронов в периферической и центральной нервных системах, воздействует на многие различные биологические процессы посредством взаимодействия с двумя основными классами рецепторов ацетилхолина - никотиновыми и мускариновыми рецепторами ацетилхолина. Мускариновые рецепторы ацетилхолина (mAChRs) относятся к суперсемейству рецепторов, соединенных с белком G, которые имеют семь трансмембранных доменов. Существуют пять подтипов mAChRs, именуемых M1-M5, и каждый из них представляет собой продукт определенного гена. Каждый из этих пяти подтипов проявляет уникальные фармакологические свойства. Мускариновые рецепторы ацетилхолина широко распределены в органах позвоночных, где они опосредуют многие из жизненно важных функций. Мускариновые рецепторы могут опосредовать и ингибирующие, и возбуждающие действия. Например, в гладкой мускулатуре, обнаруживаемой в дыхательных путях, М 3 mAChRs опосредуют сократительные реакции (обзор представлен в публикации Caulfield (1993 Pharmac. Ther. 58:319-79). В легких локализация mAChRs была определена в гладких мышцах в трахее и бронхах, подслизистых железах и парасимпатических ганглиях. Плотность мускариновых рецепторов самая высокая в парасимпатических ганглиях и затем их плотность уменьшается от подслизистых желез к гладкой мускулатуре трахеи и бронхов. Мускариновые рецепторы почти отсутствуют в альвеолах. Обзор экспрессии и функции mAChRs в легких представлен в публикации Fryer and Jacoby (1998 Am J Respir Crit Care Med 158(5, pt3) S 154-60). Три подтипа raAChRs были идентифицированы как важные в легких, M1, M2 и М 3 mAChRs. M3mAChRs, локализующиеся на гладких мышцах дыхательных путей, опосредуют мышечное сокращение. Стимуляция М 3 mAChRs активирует фермент фосфатазу С через связывание стимулирующего белка GGq/11 (Gs), приводя к освобождению фосфатидил инозитол-4,5-бисфосфата, приводя к фосфорилированию сократительных белков. М 3 mAChRs также обнаруживаются на легочных подслизистых железах. Стимуляция этой популяции М 3 mAChRs приводит к секреции слизи. М 2 mAChRs составляют приблизительно 50-80% популяции холинергических рецепторов на гладких мышцах дыхательных путей. Хотя их точная функция еще неизвестна, они ингибируют катехоламинергическое расслабление мышц дыхательных путей через ингибирование генерирования цАМФ. Нейронные M2 mAChRs локализуются на постганглионарных парасимпатических нервах. В нормальных физиологических условиях, нейронные М 2 mAChRs обеспечивают жесткий контроль высвобождения ацетилхолина из парасимпатических нервов. Ингибиторные М 2 mAChRs были также продемонстрированы на симпатических нервах в легких некоторых видов. Эти рецепторы ингибируют высвобождение норадреналина, таким образом, уменьшая входящую в легкие симпатическую импульсацию.M1 mAChRs обнаруживаются в легочных парасимпатических ганглиях, где они функционируют для усиления нейропередачи. Локализация этих рецепторов была также установлена в периферической легочной паренхиме, однако, их функция в паренхиме неизвестна. Дисфункция мускариновых рецепторов ацетилхолина в легких была отмечена при множестве различных патофизиологических состояний. В частности, при астме и хроническом обструктивном легочном заболевании (COPD), воспалительные состояния приводят к потере ингибиторной функции М 2 мускариновых ауторецепторов ацетилхолина на парасимпатических нервах, снабжающих легочную гладкую мускулатуру, вызывая увеличенное высвобождения ацетилхолина после стимуляции блуждающих нервов (Fryer et al. 1999 Life Sci 64 (6-7) 449-55). Эта дисфункция mAChR приводит к гиперреактивности и гиперреагированию дыхательных путей, опосредованных увеличенной стимуляции М 3 mAChRs. Таким образом, идентификация сильнодействующих антагонистов mAChRs была бы полезна с учетом возможности их применения в качестве лечебных средств при этих патологических состояниях, опосредованныхCOPD представляет собой неточный термин, который охватывает разнообразные прогрессирующие медицинские проблемы, включая хронический бронхит, хронический бронхиолит и эмфизему, и оно является основной причиной смертности и заболеваемости в мире. Курение представляет собой основной фактор риска развития COPD; только в США сигареты курят около 50 млн людей, и, по оценкам, ежедневно 3000 людей приобретают эту привычку. В результате, ожидается, что к 2020 г, COPD станет одной из пяти главных проблем здравоохранения во всем мире. Ингаляционная антихолинергическая терапия в настоящее время считается "золотым стандартом" в качестве терапии первой линии по поводуCOPD (Pauwels et al. 2001 Am. J. Respir. Crit. Care Med. 163:1256-1276). Несмотря на большое количество доказательств в поддержку применения антихолинергической терапии для лечения заболеваний, связанных с гиперреактивностью дыхательных путей, имеется сравнительно немного антихолинергических соединений для применения в клинике по поводу легочных показаний. Конкретнее, в США ипратропий бромид (Atrovent и Combivent в комбинации с албутеролом)-1 015033 представляет собой единственный имеющийся в продаже ингаляционный антихолинергический препарат для лечения заболеваний, связанных с гиперреактивностью дыхательных путей. Хотя это соединение представляет собой сильнодействующее антимускариновое средство, оно характеризуется коротким действием и, таким образом, его необходимо вводить до четырех раз в сутки для обеспечения облегчения у пациента с COPD. В Европе и Азии недавно был допущен к применению длительно действующий антихолинергический препарат тиотропий бромид (Spiriva), однако, в США этот продукт в настоящее время недоступен. Таким образом, остается необходимость в новых соединениях, которые способны вызвать блокаду mAChRs, имеют длительное действие и могут вводиться 1 раз/день, для лечения заболеваний, связанных с гиперреактивностью дыхательных путей, таких как астма и COPD. Поскольку mAChRs широко распределены по всему организму, возможность наносить антихолинергические средства локально и/или местно в дыхательные пути имеет особые преимущества, поскольку они бы обеспечили возможность использования более низких доз препарата. Кроме того, возможность создания топически активных препаратов, которые имеют большую длительность действия и,в частности, удерживаются или у рецептора, или легкими, позволила бы избежать нежелательных побочных эффектов, которые могут наблюдаться при системном применении антихолинергических средств. Краткое изложение сущности изобретения Изобретение предоставляет способ лечения заболеваний, опосредованных мускариновыми рецепторами ацетилхолина (mAChRs), в котором ацетилхолин связывается с mAChRs, и причем способ включает введение эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Настоящее изобретение также относится к способу ингибирования связывания ацетилхолина с его рецепторами у нуждающегося в этом млекопитающего, который включает введение указанному млекопитающему эффективного количества соединения формулы (I). Настоящее изобретение также предоставляет новое соединение формулы (I) и фармацевтические композиции, включающие соединение формулы (I) и фармацевтический носитель или разбавитель. Соединение формулы (I), которое можно применять в настоящем изобретении, представлено структуройX представляет собой бромид. Подробное описание изобретения Настоящее изобретение относится к новому соединению биарил-8-азониабицикло[3.2.1]октана,фармацевтическим композициям, способам их получения и их применению для лечения заболеваний,опосредованных mAChR. В предпочтительном варианте осуществления настоящего изобретения соединение имеет представленную ниже формулу (I)X представляет собой бромид. Соединение формулы (I) представляет собой 4-[гидрокси(дифенил)метил]-1-2-[(фенилметил)окси] этил-1-азониабицикло[2.2.2]октанбромид. Способы получения Соединение формулы (I) может быть получено применением синтетических методик, некоторые из которых проиллюстрированы ниже на схемах. Синтез, представленный на этой схеме, применим для получения соединения формулы (I), имеющее R1, R2 и R3, которые взаимодействуют с использованием заместителей, которые подходящим образом защищены, для достижения совместимости с описанными здесь реакциями. Последующее снятие защиты в указанных случаях дает затем соединения раскрытой природы. Как показано на схеме 1, желательное соединение формулы (I) может быть получено в 4 стадии синтеза из имеющегося в продаже предшественника 1 этил-4-пиперидинкарбоксилата. Соединение 1 взаимодействует с 1-бром-2-хлорэтаном в соответствии со стандартными методиками алкилирования,хорошо известными в данной области, таким как карбонат калия в ацетоне, с последующим взаимодействием промежуточного соединения с диизопропиламидом лития в апротонном растворителе, таком как тетрагидрофуран, для получения промежуточного хинуклидинового соединения 2. Конденсация соединения 2 с металлоорганическими реагентами, такими как реагент Гриньяра, или литийорганическое производное в апротонном растворителе, таком как тетрагидрофуран, приводит к образованию третичного спирта 3 формулы (I) (R1 отсутствует). Далее N-алкилирование соединения 3 подходящим алкилгалидом в органическом растворителе, таком как хлороформ или ацетонитрил, дает соединение 4 формулы (I) (R1 присутствует). Схема 1 Реагенты и условия: а) 1-бром-2-хлорэтан, K2CO3, ацетон; b) LDA, THF; с) R2M, THF; d) R1X, ACN,CHCl3. Примеры синтеза Изобретение будет описано со ссылкой на следующие примеры. Все величины температуры даны вC. Тонкослойную хроматографию (t.l.c.) проводили на диоксиде кремния и колоночную хроматографию- на диоксиде кремния (при отсутствии других указаний, колоночную флэш-хроматографию с использованием Merck 9385) . Ниже представлены экспериментальные условия для LC-MS (жидкостной хроматографии - масс спектрометрии). Экспериментальные условия LC-MS: Жидкостный хроматограф: Препаративную ВЭЖХ проводили, используя систему ВЭЖХ Gilson в следующих условиях: колонка: 75 х внутренний диаметр 33 мм, S-5 мкм, 12 нм; скорость потока: 30 мл/мин; объем инжекции: 0,800 мл; комнатная температура; растворитель А: вода; растворитель В: ацетонитрил. Все используемые здесь растворители имеют самую высокую имеющуюся чистоту, и пока нет других указаний, все реакции проводят в безводных условиях в воздушной атмосфере. Пример 1. Получение 1-азабицикло[2.2.2]окт-4-ил(дифенил)метанола. Этил-1-(2-хлорэтил)-4-пиперидинкарбоксилат. К раствору этилнипекотата (20,0 мл, 130 ммоль) в ацетоне (180 мл) добавляют 1-бром-2-хлорэтан(21,6 мл, 260 ммоль) с последующим добавлением безводного K2CO3 (27,12 г, 196 ммоль). Реакционную смесь перемешивают в течение 24 ч и затем концентрируют в вакууме. Полученный остаток обрабатывают Н 2 О (75 мл) и экстрагируют Et2O. Объединенные органические слои сушат MgSO4, фильтруют и концентрируют в вакууме. Очистка неочищенного остатка флэш-хроматографией (50% Et2O/50% гексан) на силикагеле дает указанное в заголовке соединение (10,99 г, 38,6%). EI-MS m/z 220(M+H+) Rt (1,20 мин). Этил-1-азабицикло[2.2.2]октан-4-карбоксилат. Раствор этил-1-(2-хлорэтил)-4-пиперидинкарбоксилата.(20,42 г, 92,9 ммоль) в THF (600 мл) охлаждают до -50 С в атмосфере Ar. LDA (2,0 М в гептан/THF/этилбензоле, 70 мл, 140 ммоль) медленно добавляют к раствору при -50 С в течение 25 мин. Реакционной смеси дают возможность согреться до комнатной температуры в течение 16 ч. Реакцию гасят K2CO3 (насыщенным водным) (500 мл) и экстрагируют Et2O (3500 мл). Объединенные органические слои сушат MgSO4, фильтруют и концентрируют в вакууме. Полученное оранжевое масло совместно выпаривают 3 раза с DCM (дихлорметаном) для удаления избыточного этилбензола, что приводит к получению указанного в заголовке соединения (16,29 г, 95,7%). EI-MS m/z 184(М+Н+) Rt (1,08 мин). 1-Азабицикло[2.2.2]окт-4-ил(дифенил)метанол. Раствор фениллития (1,5-1,7 М в 70 циклогексана/30 простого эфира, 20,0 мл, 32 ммоль) охлаждают до -30 С в атмосфере Ar. Этил-1-азабицикло[2.2.2]октан-4-карбоксилат (1,51 г, 8,23 ммоль) в THF (20 мл) медленно добавляют к реакционной смеси при -30 С в течение 25 мин. Реакционной смеси дают возможность согреться до комнатной температуры в течение 16 ч. Реакцию гасят Н 2 О и затем выпаривают до сухости в вакууме. Добавляют Н 2 О и EtOAc, вызывая выпадение белого твердого вещества. Это твердое вещество отфильтровывают для получения указанного в заголовке соединения (0,79 г). Водную фазу дополнительно экстрагируют EtOAc, объединенные органические слои сушат MgSO4, фильтруют и концентрируют в вакууме. Полученный неочищенный продукт обрабатывают EtOAc и гексаном, и фильтруют для выхода дополнительного количества указанного в заголовке соединения (0,67 г). Общий выход(0,020 г, 0,068 ммоль) разбавляют в CHCl3 (1,8 мл) и подают непосредственно во флакон емкостью 1 драхма, содержащий простой 2-бромэтилфенилметилэфир (0,022 г, 0,102 ммоль). Добавляют CH3CN(1,2 мл); во флакон помещают перемешивающий брусок и закрывают колпачком. Реакционную смесь перемешивают и нагревают при 60 С в течение 24 ч. Содержимое флакона переносят (после удаления перемешивающего бруска) в полипропиленовую пробирку и концентрируют в атмосфере азота. Неочи-4 015033 щенный продукт собирают на фритту полипропиленовой пробирки. Избыток бромида удаляют промыванием неочищенного продукта EtOAc (52 мл) и гексаном (52 мл). Затем продукт сушат в вакууме для получения указанного в заголовке соединения (0,008 г, 23,8%). Способ В. К раствору 1-азабицикло[2.2.2]окт-4-ил (дифенил)метанола (3,30 г, 11,2 ммоль) в 2CH3CN/3 CHCl3 (200 мл) добавляют простой 2-бромэтилфенилметилэфир (2,31 мл, 14,6 ммоль). Раствор перемешивают при 60 С в течение 16 ч. Реакционную смесь охлаждают до комнатной температуры и концентрируют. EtOAc (200 мл) добавляют к твердому веществу и смеси дают возможность перемешиваться в течение 1 ч, затем фильтруют. Полученное твердое вещество собирают в МеОН (125 мл) и нагревают до 60 С. Горячий раствор фильтруют и снова охлаждают до комнатной температуры. Реакционную смесь концентрируют до низкого объема МеОН (20 мл). Затем добавляют воду (75 мл) и полученную смесь нагревают при 55 С при энергичном перемешивании в течение 40 мин. После охлаждения до комнатной температуры, твердое вещество отфильтровывают, промывают водой (20 мл) и сушат в вакуумной печи при 45 С в течение 16 ч для получения указанного в заголовке соединения (2,47 г, 43,3%).EI/MS m/z 428(М+) Rt (1,90 мин), 1 Н ЯМР (DMSO-d6)7,56 (д, 4 Н, J=1,2 Гц), 7,28 (м, 11 Н), 5,95 (с, 1 Н),4,50 (с, 2H), 3,81 (д, 2H, J=4,0 Гц), 3,48 (т, 6 Н, J=7,2 Гц), 3,38 (д, 2 Н, J=4,0 Гц), 2,01 (т, 6 Н, J=7,2 Гц); элементный анализ (C29H34NO2Br) С, Н, N: рассчитано, 68,50, 6,74, 2,75; обнаружено, 68,28, 6,68, 2,73. Биологические примеры Ингибирующие эффекты соединений настоящего изобретения на М 3 mAChR определяются следующими функциональными анализами in vitro и in vivo. Анализ ингибирования активации рецепторов мобилизацией кальция Стимуляцию mAChRs, экспрессируемых на клетках СНО, анализируют мониторингом активируемой рецепторами мобилизации кальция, как описано ранее (Н. М. Sarau et al., 1999. Mol. Pharmacol. 56,657-663). Клетки CHO, устойчиво экспрессирующие М 3 mAChRs, высевают в 96-луночные планшеты с черными стенками/прозрачным дном. Через 18-24 ч среду аспирируют и замещают 100 мкл загружаемой среды (ЕМЕМ с солями Earl, 0,1% BSA сорта RIA (Sigma, St. Louis МО) и 4 мкМ флюоресцентного индикаторного красители простого флюо-3-ацетоксиметилэфира (Fluo-3 AM, Molecular Probes, Eugene, OR) и инкубируют 1 ч при 37 С. Среду, содержащую краситель, затем аспирируют, замещают свежей средой(без Fluo-3 AM) , и клетки инкубируют в течение 10 мин при 37 С. Затем клетки промывают 3 раза и инкубируют в течение 10 мин при 37 С в 100 мкл аналитического буфера (0,1% желатин (Sigma), 120 мМHEPES (рН 7,4. Добавляют 50 мкл соединения (конечная концентрация в анализе 1l0-11-110-5 M), и планшеты инкубируют в течение 10 мин при 37 С. Затем планшеты помещают в устройство считывания интенсивности флюоресцентного света для планшет (FLIPR, Molecula Probes), где загруженные красителем клетки подвергаются воздействию возбуждающего света (488 нм) от аргонового лазера мощностью 6 Вт. Клетки активируют добавлением 50 мкл ацетилхолина (конечная концентрация 0,1-10 нМ), полученного в буфере, содержащем 0,1% BSA, со скоростью 50 мкл/с. Мониторинг мобилизации кальция в виде изменения концентрации цитозольного кальция проводят измерением изменения интенсивности светоизлучения при 566 нм. Изменение интенсивности светоизлучения прямо связано с уровнями цитозольного кальция. Флюоресценцию, испускаемую из всех 96 лунок, измеряют одновременно с использованием охлажденной CCD камеры. Сбор данных проводят ежесекундно. Затем эти данные наносят на график и анализируют с использованием программного обеспечения GraphPad PRISM. Вызванное метахолином сужение бронхов - сила и длительность действия Реактивность бронхов на метахолин определяют у бодрствующих, не ограниченных в движении мышей Balb С (n = 6 в каждой группе). Барометрическую плетизмографию используют для измерения увеличенной паузы (Penh), не имеющего единицы измерения показателя, который, как было показано,коррелируется с изменениями сопротивления дыхательных путей, которые возникают во время бронхиальной стимуляции метахолином (2). Мышам предварительно вводили 50 мкл соединения (0,003-10 мкг/мышь) в 50 мкл носителя (10% DMSO) интраназально (i.n.), и затем их помещают в плетизмографическую камеру через определенное время после введения препарата (15 мин - 96 ч) . Для определения силы действия выполняли определение зависимости реакции от дозы данного препарата, и все измерения проводили через 15 мин после i.n. введения препарата. Для определения длительности действия измерения проводили в любое время с 15 мин до 96 ч после i.n. введения препарата. После помещения в камеру, животным давали возможность достичь уравновешивания в течение 10 мин перед проведением исходного измерения Penh в течение 5 мин. Затем у мышей проводили стимуляцию аэрозолем метахолина (10 мг/мл) в течение 2 мин. Penh регистрировали непрерывно в течение 7 мин, с начала введения аэрозоля метахолина, и продолжали в последующем в течение 5 мин. Данные по каждой мыши анализировали и наносили на график с использованием программного обеспечения GraphPad PRISM. Эксперимент обеспечивает возможность определения длительности активности введенного соединения. Соединения по настоящему изобретению можно использовать для лечения по разнообразным показаниям, включая, но не ограничиваясь, расстройства дыхательных путей, такие как хроническое обструк-5 015033 тивное легочное заболевание, хронический бронхит, астму, хроническую респираторную обструкцию,пневмосклероз, эмфизему легких и аллергический ринит. Анализ связывания радиолиганда с мускариновыми рецепторами Исследования связывания радиолиганда с использованием 0,5 нМ [3 Н]-N-метилскополамина (NMS) в формате SPA используются для оценки связывания мускариновых антагонистов с M1, M2, М 3, М 4 и М 5 мускариновых рецепторов ацетилхолина. В 96-луночной планшете шарики SPA предварительно инкубируют с содержащей рецепторы мембраной в течение 30 мин при 4 С. Затем добавляют 50 мМ HEPES и испытуемого соединения и инкубируют при комнатной температуре (встряхивая) в течение 2 ч. Затем шарики отделяют центрифугированием и считают, используя сцинтилляционный счетчик. Определение активности и длительности действия на изолированной трахее морских свинок Трахеи удаляют у взрослых самцов морских свинок Hartley (Charles River, Raleigh, NC; 400-600 г) и помещают в модифицированный раствор Кребса-Хенселейта. Состав раствора был (мМ): NaCl 113,0, KCl 4,8, CaCl2 2,5, KH2PO4 1,2, MgSO4 1,2, NaHCO3 25,0 и декстроза 11,0, который газировали 95% О 2: 5% СО 2 и поддерживали при 37 С. Каждую трахею очищают от прилипшей ткани и вскрывают по длине. Эпителий удаляют осторожным трением просветной поверхности аппликатором с хлопковым наконечником. Отсекают отдельные полоски шириной приблизительно 2 хрящевых кольца и подвешивают посредством шелковой нити в бани с водяным кожухом емкостью 10 мл для органов, содержащие раствор Кребса-Хенселейта, и соединенные с преобразователями силы-смещения Grass FT03C. Механические реакции регистрируют изометрически устройством, подтверждающим получение данных MP100WS(BIOPAC Systems, Goleta, CA, www.biopac.com), работающим на компьютерах Apple G4. Уравновешивание тканей проводят при напряжении покоя 1,5 г, определяемом как оптимальное оценкой длинынапряжения и промывают раствором Кребса-Хенселейта через каждые 15 мин в течение 1 ч. После периода уравновешивания легочные ткани подвергают сокращению действием 10 мМ карбахола до достижения плато, которое служит в качестве эталонного сокращения для анализа данных. Затем ткани споласкивают через каждые 15 мин в течение 1 ч до достижения исходного тонуса. Затем препараты оставляют по меньшей мере на 30 мин перед началом эксперимента. Кривые зависимости реакции от концентрации получают кумулятивным добавлением карбахола полулогарифмическими добавками (Van Rossum, 1963, Arch. Int. Pharmacodyn., 143:299), начинающимися при 1 нМ. Каждую концентрацию оставляют в контакте с препаратом до тех пор, пока реакция не выходит на плато, перед добавлением последующей концентрации карбахола. Парные ткани подвергают воздействию соединений - антагонистов mAChR или носителя в течение 30 мин перед построением кривых зависимости реакции от кумулятивной концентрации карбахола. Все данные представлены в виде средней величиныстандартная ошибка средней (s.e.m.), причем n представляет собой количество различных животных. Для исследований суперфузии (длительности действия) ткани непрерывно перфузируют раствором Кребса-Хенселейта со скоростью 2 мл/мин в течение всей продолжительности эксперимента. Маточные растворы агониста и антагониста инфузируют (0,02 мл/мин) через иглу 22 калибра, введенную в перфузинную трубку. Механические реакции регистрировали изометрически, используя имеющееся в продаже устройство, подтверждающее получение данных MP100WS (BIOPAC Systems, Goleta, CA, www.biopac.com), соединенное интерфейсом с компьютером Macintosh G4 (Apple, Cupertino, CA www.apple.com). Ткани суспендируют при оптимальном напряжении покоя 1,5 г. Через 60 мин периода уравновешивания,ткани подвергают сокращению действием карбахола (1 мМ) в течение длительности эксперимента. После достижения длительного сокращения вводят изопротеренол (10 мМ) для максимального расслабления ткани, и это изменение служит в качестве эталона. Воздействие изопротеренола прекращают, и дают возможность восстановиться напряжению, вызванному карбахолом. Антагонисты мускариновых рецепторов инфузируют в одной концентрации на ткань до тех пор, пока не достигается стойкий уровень ингибирования. Затем соединение удаляют и снова дают возможность восстановиться напряжению, вызванному карбахолом. Следующие показатели определяют для каждой концентрации антагониста и выражают в виде средней величиныS.E.M для n отдельных животных. Ингибирование вызванного корбахолом сокращения выражают в виде процента эталонной реакции (изопротеренол), и измеряют время, требуемое для достижения половины этого расслабления (начало реакции). Восстановление напряжения после удаления соединения определяют как время, требуемое для достижения восстановления половины максимального напряжения (компенсация реакции) . Через 60 и 180 мин после удаления антагониста определяют остающийся уровень ингибирования и выражают в виде процента эталонной реакции на изопротеренол. Кривые зависимости реакции от концентрации антагониста получают нанесением на график данных максимального расслабления через 0, 60 и 180 мин после удаления антагониста. Восстановление,именуемое сдвигом, рассчитывают по отношению кривой ингибирования IC50 через 0 мин к концентрации соединения, дающего аналогичное восстановление напряжения через 60 и 180 мин. Половины времени до начала и компенсации реакции наносят на график зависимости от соответствующей концентрации, и данные корригируют нелинейной регрессией. Эти величины экстраполируют-6 015033 при IC50 (определяемой по кривой зависимости реакции от концентрации) и обозначают Ot50 (время, при концентрации IC50, требуемое для достижения половины начальной реакции) и Rt50 (время, при концентрации IC50, требуемое для достижения половины реакции восстановления). Введение композиции Соответственно, настоящее изобретение дополнительно предоставляет фармацевтическую композицию, содержащую соединение формулы (I) или его фармацевтически приемлемую соль, или физиологически функциональное производное (например, соли и сложные эфиры) и фармацевтически приемлемый носитель или эксципиент, и, необязательно, один или более других терапевтических ингредиентов. Далее, термин "активный ингредиент" означает соединение формулы (I) или его фармацевтически приемлемую соль, сольват или физиологически функциональное производное. Соединения формулы (I) должны вводиться посредством ингаляции через рот или нос. Сухие порошковые композиции для местной доставки в легкие путем ингаляции могут, например,быть представлены в капсулах и кассетах, например, из желатина, или блистерах, например, из ламинированной алюминиевой фольги, для использования в ингаляторе или инсуффляторе. Композиции порошковой смеси в целом содержат порошковую смесь для ингаляции соединения по изобретению и подходящей порошковой основы (вещества носителя/разбавителя/эксципиента), такой как моно-, ди- или полисахариды (например, лактоза или крахмал), органические или неорганические соли (например, хлорид кальция, фосфат кальция или хлорид натрия), полиспирты (например, маннит), или их смеси, альтернативно, с одним или более дополнительными материалами, причем такие добавки включены в смешанную композицию для улучшения химической и/или физической устойчивости или эффекта композиции, как описано ниже, или ее смесей. Предпочтительно использование лактозы. Каждая капсула или кассета может в целом содержать от 20 мкг до 10 мг соединения формулы (I), необязательно, в комбинации с другим терапевтически активным ингредиентом. Альтернативно, соединение по изобретению может быть представлено без эксципиентов, или может быть сформировано в частицы, включающие соединение,необязательно, другие терапевтически активные материалы, и материалы эксципиентов, например, совместным осаждением или покрытием. Устройство подачи лекарственного средства может относиться к типу, выбранному из группы, состоящей из ингалятора сухого порошка с резервуаром (RDPI), многодозового ингалятора сухого порошка(MDPI) и ингалятора отмеренной дозы (MDI). Под ингалятором сухого порошка с резервуаром (RDPI) подразумевается ингалятор, имеющий упаковку в форме резервуара для включения множественных (не отмеренных) доз лекарственного средства в форме сухого порошка, и включающий средство для отмеривания дозы лекарственного средства из резервуара в положение доставки. Отмеривающее средство может, например, включать мерный колпачок или перфорированную пластину, которая подвижна из первого положения, в котором колпачок может быть заполнен лекарственным средством из резервуара, во второе положение, в котором отмеренная доза лекарственного средства делается доступной для ингаляции пациентом. Под многодозовым ингалятором сухого порошка (MDPI) подразумевается ингалятор, подходящий для подачи лекарственного средства в форме сухого порошка, в котором лекарственное средство содержится внутри многодозовой упаковки, содержащего (или несущего другим образом) множественные,определенные дозы (или их части) лекарственного средства. В предпочтительном аспекте носитель имеет форму блистерной упаковки, но он может также включать, например, форму упаковки на основе капсул или носителя, на который было нанесено лекарственное средство любым подходящим способом,включающим печать, окрашивание и вакуумную окклюзию. Композиция может быть предварительно отмеренной (например, как в Diskus, см. GB 2242134, илиDiskhaler, см. GB 2178965, 2129691 и 2169265) или отмеренной для применения (например, как в Turbuhaler, см, ЕР 69715). Примером устройства стандартной дозы является Rotahaler (см. GB 2064336). Ингаляционное устройство Diskus включает удлиненную полоску, образованную из листка-основания,имеющего множество углублений, расположенных с промежутками вдоль его длины, и листок-крышку,герметично, но отслаиваемо установленный на него, для ограничения множества контейнеров, причем каждый контейнер имеет в себе ингалируемую композицию, содержащую соединение формулы (I),предпочтительно, в комбинации с лактозой. Предпочтительно, полоска достаточно гибкая для сворачивания в рулон. Листок-крышка и листок-основание предпочтительно имеют части ведущего конца, которые негерметично соединены друг с другом, и по меньшей мере одна из указанных частей ведущего конца сконструирована для прикрепления к сворачивающему средству. Также предпочтительно герметичный уплотнитель между листком-основанием и листком-крышкой простирается по их всей ширине. Листок-крышка может предпочтительно отслаиваться от листка-основания в продольном направлении от первого конца указанного листка-основания. В одном аспекте многодозовая упаковка представляет собой блистерную упаковку, включающую множество блистеров для помещения лекарственного средства в форме сухого порошка. Блистеры обычно располагаются в упорядоченном виде для легкости высвобождения лекарственного средства из них. В одном аспекте многодозовая блистерная упаковка включает множество блистеров, расположенных, в целом, по кругу на блистерной упаковке в форме диска. В другом аспекте многодозовая блистер-7 015033 ная упаковка является удлиненной по форме, например, включающей полоску или лент. Предпочтительно, многодозовая блистерная упаковка ограничивается между двумя элементами, отслаиваемо укрепленными друг к другу. В патентах США 5860419, 5873360 и 5590645 описаны упаковки для лекарственных средств этого общего типа. В этом аспекте, устройство обычно обеспечено открывающим устройством, включающим отслаивающее средство для отслаивания элементов друг от друга для доступа к каждой дозе лекарственного средства. Подходящим образом средство приспособлено для использования, где отслаиваемые элементы представляют собой удлиненные листки, которые ограничивают множество контейнеров лекарственного средства, расположенных с промежутками вдоль их длины, причем устройство обеспечено индексирующим средством для индексации по очереди каждого контейнера. Предпочтительнее, устройство приспособлено для применения, где один из листков представляет собой листок-основание, имеющий в нем множество карманов, а другой из листков представляет собой листок-крышку, причем каждый карман и прилегающая часть листка-крышки ограничивает соответствующий один из контейнеров, причем устройство включает средство привода для вытягивания листка-крышки и отсоединения его от листка-основания у открывающего устройства. Под ингалятором отмеренной дозы (MDI) подразумевается средство подачи лекарственного средства, подходящее для подачи лекарственного средства в аэрозольной форме, где лекарственное средство содержится в аэрозольном контейнере, подходящем для содержания аэрозольной композиции лекарственного средства на основании газа-вытеснителя. Аэрозольный контейнер обычно снабжен отмеривающим клапаном, например золотниковым клапаном, для подачи аэрозольной композиции лекарственного средства пациенту. Аэрозольный контейнер в целом сконструирован для доставки заданной дозы лекарственного средства при каждом приведении в действие посредством клапана, который может открываться или нажатием клапана при стационарном удерживании контейнера, или сжатием контейнера при стационарном удерживании клапана. Распыляемые композиции для местной доставки в легкие ингаляцией можно, например, составить в композиции в виде водных растворов или суспензий или в виде аэрозолей, доставляемых из упаковок под повышенным давлением, таких как ингалятор отмеренной дозы, использованием подходящего сжиженного газа-вытеснителя. Аэрозольные композиции, подходящие для ингаляции, могут представлять собой или суспензию, или раствор, и в целом содержат соединение формулы (I), необязательно, в комбинации с другим терапевтически активным ингредиентом и подходящим газом-вытеснителем, таким как фторуглерод или содержащий водород хлорфторуглерод, или их смеси, в частности, гидрофторалканы,например, дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, в частности, 1,1,1,2-тетрафторэтан, 1,1,1,2,3,3,3-гептафтор-н-пропан, или их смеси. В качестве газа-вытеснителя, можно также использовать диоксид углерода или другой подходящий газ. Аэрозольная композиция может быть лишена эксципиента или, необязательно, может содержать дополнительные эксципиенты композиции, хорошо известные в данной области, такие как поверхностно-активные вещества, например, олеиновую кислоту или лецитин, и совместные растворители, например, этанол. Аэрозольные композиции канистре), закрытой клапаном (например, отмеривающим клапаном) и устанавливаться в привод, обеспеченный мундштуком. Лекарственные средства для введения ингаляцией желательно имеют регулируемый размер частиц. Оптимальный аэродинамический размер частиц для ингаляции в бронхиальную систему для локализованной доставки в легкие составляет обычно 1-10 мкм, предпочтительно 2-5 мкм. Оптимальный аэродинамический размер частиц для ингаляции в альвеолярную область для достижения системной доставки в легкие составляет приблизительно 0,5-3 мкм, предпочтительно 1-3 мкм. Частицы, имеющие аэродинамический размер более 20 мкм, в целом слишком крупные при ингаляции для достижения мелких дыхательных путей. Средний аэродинамический размер частиц композиции можно измерить, например, с использованием каскадного импактора. Средний геометрический размер частиц можно измерить, например, лазерной дифракцией, оптическими средствами. Для достижения желательного размера частиц размер полученных частиц активного ингредиента можно уменьшить обычными средствами, например регулируемой кристаллизацией, микронизацией или нанопомолом. Желательную фракцию можно отделить воздушной классификацией. Альтернативно, частицы желательного размера можно непосредственно получить, например, сушкой распылением, регулируя параметры сушки распылением для создания частиц желательного диапазона размера. Предпочтительно, частицы должны быть кристаллическими, хотя, при желании, можно использовать аморфный материал. Когда используется эксципиент, такой как лактоза, в целом, размер частиц должен быть гораздо больше, чем ингалируемого лекарственного средства, в рамках настоящего изобретения, так что "грубый" носитель не вдыхаем. Когда эксципиент представляет собой лактозу, он обычно должен присутствовать в виде молотой лактозы, где не более чем 85% частиц лактозы имеют MMD 60-90 мкм и не менее чем 15% имеют MMD менее чем 15 мкм. Дополнительные материалы в сухой порошковой смеси в дополнение к носителю могут быть или вдыхаемыми, т.е., аэродинамически меньше чем 10 мкм, или не вдыхаемыми, т.е. аэродинамически больше чем 10 мкм. Подходящие дополнительные материалы, которые можно использовать, включают аминокислоты,такие как лейцин; растворимые в воде или нерастворимые в воде, натуральные или синтетические, по-8 015033 верхностно-активные вещества, такие как лецитин (например, соевый лецитин), и жирные кислоты в твердом состоянии (например, лауриновая, пальмитиновая и стеариновая кислоты) и их производные(такие как соли или сложные эфиры); фосфатидилхолины; сложные эфиры сахаров. Дополнительные материалы могут также включать красители, вкусовые агенты (например, сахарин), антистатические средства, смазывающие вещества (см., например, опубликованную заявку на патент РСТWO 87/905213, положения которой включены сюда в качестве ссылки), химические стабилизаторы, буферы,консерванты, усилители всасывания и другие материалы, известные обычным специалистам в данной области. Материалы покрытия для длительного высвобождения (например, стеариновую кислоту или полимеры, например поливинилпирролидон, полимолочную кислоту) можно также использовать на активном материале или частицах, содержащих активный материал (см., например, патентыUS 3634582, GB 1230087, GB 1381872, положения которых включены сюда в качестве ссылки). Интраназальные спреи можно составить в композиции с водными или не водными носителями с добавлением агентов, таких как загустители, буферные соли или кислоты или щелочи для регулирования рН, средства регулировки изотоничности или антиоксиданты. Растворы для ингаляции распылением можно составить в композицию с водным носителем с добавлением таких агентов как кислота или щелочь, буферные соли, средства регулировки изотоничности или антимикробные средства. Их можно стерилизовать фильтрацией или нагреванием в автоклаве, или представить в виде не стерильного продукта. Предпочтительными стандартными дозированными композициями являются те, которые содержат эффективную дозу активного ингредиента, как указано здесь выше, или ее фракцию. Пока контекст не требует иного, во всем описании и формуле изобретения, которая следует ниже,слово "включают" и такие вариации как "включает" и "включающий", следует понимать как подразумевающие включение указанного целого числа или интервал или группы целых чисел, но не относится к исключению любого другого целого числа или интервала, или группы целых чисел или интервалов. Все публикации, включая, но не ограничиваясь, патенты и патентные заявки, приведенные в этом описании, включены в него в качестве ссылки, как если бы каждая отдельная публикация была определенно и отдельно указана как включенная сюда в качестве полностью изложенной ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. 4-[Гидрокси(дифенил)метил]-1-2-[(фенилметил)окси]этил-1-азониабицикло[2.2.2]октанбромид формулы 2. Фармацевтическая композиция, содержащая 4-[гидрокси(дифенил)метил]-1-2-[(фенилметил)окси]этил-1-азониабицикло[2.2.2]октанбромид и фармацевтически приемлемый носитель. 3. Фармацевтическая композиция по п.2, дополнительно содержащая одно или несколько других терапевтических ингредиентов. 4. Применение соединения по п.1 в безопасном и эффективном количестве при лечении заболевания, опосредованного мускариновым рецептором ацетилхолина, где ацетилхолин связан с указанным рецептором. 5. Применение по п.4, где заболевание выбрано из группы, состоящей из хронического обструктивного легочного заболевания, хронического бронхита, астмы, хронической респираторной обструкции,пневмосклероза, эмфиземы легких и аллергического ринита. 6. Применение по п.4, где введение проводят посредством ингаляции через рот или нос. 7. Применение по п.4, где введение проводят посредством устройства подачи лекарственного средства, выбранного из группы, состоящей из ингалятора сухого порошка с резервуаром, многодозового ингалятора сухого порошка и ингалятора с отмеренной дозой.
МПК / Метки
МПК: A61K 31/44, A61P 11/00, C07D 453/02
Метки: ацетилхолина, мускариновых, рецепторов, антагонисты
Код ссылки
<a href="https://eas.patents.su/10-15033-antagonisty-muskarinovyh-receptorov-acetilholina.html" rel="bookmark" title="База патентов Евразийского Союза">Антагонисты мускариновых рецепторов ацетилхолина</a>
Предыдущий патент: Зарядная схема для зарядки двух аккумуляторных батарей
Следующий патент: 2-анилин-4-арил-замещенные тиазольные производные
Случайный патент: Газоочистное устройство и способ очистки газа