Способ получения бензиловых эфиров
Номер патента: 1467
Опубликовано: 23.04.2001
Авторы: Арваи Геза, Пап Ласло, Секей Иштван, Куруцне Рибаи Жужанна, Берток Бэла
Формула / Реферат
1. Способ получения смешанных эфиров общей формулы I
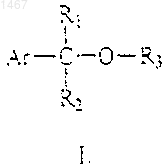
где Аr означает алициклическую, ароматическую или содержащую один или более гетероатомов гетероциклическую группу, которая может быть замещена одной или более С1-4алкокси-, метилендиокси-, C1-4алкильной группой, галогеном, С1-4галогеноалкильной или нитрогруппой, и/или конденсирована с бензольным кольцом,
R1 и R2 независимо друг от друга означают водород, C1-4алкил, С1-4галогеноалкил, С2-4алкенил, фенил, замещенный фенил, С3-6циклоалкил,
R3 означает С3-6алкинильную группу, которая может быть замещена одним или более C1-6алкилом, С3-6алкенилом, С3-6алкинилом, C1-6галогеноалкилом или атомом галогена; или С1-4алкилокси-С1-4алкилокси-С1-4алкильную группу,
отличающийся тем, что проводят реакцию между соединениями общей формулы II
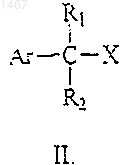
где X означает гидроксил, галоген или сульфоэфирную отщепляемую группу,
и 1-3 молярными эквивалентами спирта общей формулы III
R3-ОН,
где заместитель имеет значения, указанные выше, в присутствии кислоты, кислоты Льюиса, оксида металла или карбоната металла; полученный эфир общей формулы I выделяют, если необходимо, стабилизируют добавлением основания и/или антиоксиданта и, если необходимо, регенерируют избыток спирта.
2. Способ по п.1, отличающийся тем, что в качестве кислоты используют 0,01-3 молярных эквивалента сильной неорганической или органической кислоты, предпочтительней соляной, серной, хлорной или ароматической сульфокислоты.
3. Способ по пп.1-2, отличающийся тем, что реакцию проводят в растворах солей, предпочтительней в растворах хлористого натрия, хлористого кальция, хлористого магния, хлористого цинка.
4. Способ по пп.1-3, отличающийся тем, что реакцию проводят в водном растворе кислоты, предпочтительней в 10 вес./вес.% водном растворе кислоты, насыщенном неорганической солью при температуре от -20 до +30шС, причем в качестве неорганической соли используют хлористый натрий, хлористый кальций, хлористый магний.
5. Способ по п.1, отличающийся тем, что в качестве кислоты Льюиса используют 0,01-3 молярных эквивалента хлорида цинка(II) или ароматической сульфокислоты, предпочтительней бензолсульфокислоты или паратолуолсульфокислоты, причем реакцию проводят в неполярном апротонном растворителе.
6. Способ по п.5, отличающийся тем, что в качестве неполярного апротонного растворителя используют дихлорэтан, а реакцию проводят при температуре от -30 до +40шС.
7. Способ по п.1, отличающийся тем, что в качестве оксида металла используют 0,01-3 молярных эквивалента оксида цинка, в качестве карбоната металла используют карбонат цинка, а реакцию проводят без растворителя или в неполярном апротонном растворителе, предпочтительней в дихлорэтане.
Текст
1 Это изобретение относится к способу получения смешанных эфиров общей формулы I,где Аr означает алициклическую, ароматическую или содержащую один или более гетероатомов гетероциклическую группу, которая может быть замещена одной или более С 1-4 алкокси-, метилендиокси-, С 1-4 алкильной группой,галогеном, С 1-4 галогеноалкильной или нитрогруппой, и/или конденсирована с бензольным кольцом,R1 и R2 независимо друг от друга означают водород, С 1-4 алкил, С 1-4 галогеноалкил, С 2-4 алкенил, фенил, замещенный фенил, С 3-6 циклоалкил,R3 означает С 3-6 алкинильную группу, которая может быть замещена одним или болееC1-6 лкилом, С 3-6 алкенилом, С 3-6 алкинилом, C1-6 галогеноалкилом или атомом галогена; или C1-4 алкилокси-С 1-4 алкилокси-С 1-4 алкильную группу, путем реакции в кислых условиях соединений общей формулы II, гдеX означает гидроксил, галоген или сульфоэфирную отщепляемую группу, с соединениями общей формулы III, гдеR3 имеет значения, указанные выше,Аr в значении ароматической группы предпочтительно является фенилом или нафтилом,Аr в значении гетероциклической группы может содержать один или более О, S, N гетероатомов, в предпочтительной реализации представляет бензодиоксольную, бензодиоксановую, 2-бензофурановую, 7-бензофурановую группы. В предпочтительной реализации алициклическая группа может быть конденсирована с бензольным кольцом, например, может представлять индановую или 1,2,3,4-тетрагидронафтильную группы. Карбоксимидная группа может предпочтительно представлять фтальимидную группу. Ароматические, гетероциклические и алициклические Аr группы могут быть замещены С 1-4 алкокси,метилендиокси,С 1-4 алкилом, галогеном, С 1-4 галогеноалкилом или нитрогруппой. Эфиры общей формулы I являются потенциальными исходными материалами или активными ингредиентами большого количества химических продуктов. Некоторые их представители являются артроподицидными синергистами, обладающими значительной активностью(Венгерская заявка 3318/95). За исключением уже известных метилендиокси (MDP) синергистов, имеющих насыщенную боковую цепь (таких как РВО, а именно, 5-[2-(2-бутоксиэтокси)этоксиметил]-6-пропил-1,3-бензодиоксол), эти соединения являются новыми, несмотря на их простую структуру. Из-за их чрезвычайной важности способ их получения и промышленный синтез имеет большое значение. 2 Вышеупомянутые эфиры можно получить общими способами, известными для синтеза эфиров (Gy. Matolcsy, M. Nadasdy, V. Andriska;Pesticide Chemistry, Akademia (1988); описание Венгерского патента 3318/95). Сущность этих способов заключается в реакции нуклеофильного замещения между алкоголятом щелочного металла и соответствующим реагентом. Этот реагент содержит отщепляемую группу, которая обычно является галогеном,предпочтительней атомом брома. Реакцию можно проводить двумя способами, в зависимости от того, какая часть молекулы является нуклеофилом. Благодаря высокой реакционной способности бензилгалогенидов, обычно на практике алкоголят боковой цепи реагирует с бензилбромидом. Этот способ, однако, имеет ограничения, если по каким-либо причинам трудно получить алкоголят. В этих случаях реакцию можно проводить другим способом, однако, как правило, выход реакции меньше. Этот способ получения эфира известен из органической химии как классический синтез Вильямсона (В.Р. Mundy, M.G. Ellerd, Name Reactions andReagents in Organic Synthesis, Wiley (1988. Эта реакция, однако, имеет ряд недостатков. Промышленное получение алкоголятов является дорогостоящим, оно требует использования дорогих реагентов и строгих технологий,гарантирующих условия отсутствия воды или включающих стадию сушки (Венгерские заявки на патент 180500, 190842). Получение галогенида или реагента, содержащего отщепляемую группу, требует отдельной стадии и использования других дорогостоящих реагентов. Если альфа-атом углерода имеет дополнительные заместители (R1 и/или R2 - отличны от водорода), при получении активированного, например, галогенового производного возникают трудности, т.к. продукт легко поддается реакции отщепления или побочным реакциям, например, ароматического электрофильного замещения. Выход реакции сильно зависит от реакционной способности реагента, а конечный продукт нуждается в последующей очистке. Для получения эфиров общей формулы I также известны другие способы. Наиболее старым и хорошо известным является способ кислотно-катализируемой димеризации спиртов(Houben Weyl 6/3 11-19). Согласно литературным данным реакция обычно идет при высоких температурах и для того, чтобы избежать разрушения продукта необходимо его постоянно удалять из реакционной смеси. Образующийся под действием кислоты катион оксония может легко вступать в реакции перегруппировки либо может быть стабилизирован так называемым отщеплением атома водорода от соседнего атома углерода с получением соответствующего олефина. Это вызывает образование значительного количества побочных продуктов, а выделяющаяся в процессе реакции вода приводит к 3 замедлению реакции. В результате выход реакции и чистота продукта являются низкими. Поэтому при планировании синтеза этот способ в расчет не берут. Его скорее рассматривают как побочную реакцию кислотно-катализируемого способа (Chem. Pharm. Bull. 31, 3024, (1983. Для бензиловых эфиров был разработан способ димеризации в присутствии метилсульфоксида, позволяющий устранить указанные недостатки (J. Org. Chem., 42, 2012, (1977. Однако из-за применяемых реагентов и высоких температур (175 С) этот способ нельзя использовать в промышленных объемах. Большим достижением в этой области был факт, когда обнаружили, что в дополнение к тому, что образование эфиров может катализироваться кислотами Льюиса, реакцию с хлоридом цинка (II) можно проводить в относительно мягких условиях (J. Org. Chem., 52, 3917,(1987. Однако этот способ был разработан практически только для реакций димеризации и внутримолекулярной циклизации. Для смешанных эфиров воспроизводимость реакции, а также качество и выход продукта были низкими. С бензил(параметоксибензил)овым спиртом, содержащим ароматический заместитель, реакция дает низкий выход из-за полимеризации; смешанный эфир с ненасыщенной цепью (метилбензилаллиловый эфир) - в отличие от его насыщенного аналога - можно получить с низким выходом из-за димеризации. В опубликованной версии реакции бензилгалогенид реагирует с нуклеофильным реагентом в присутствии оксида цинка (Tetrahedron, 38, 1843, (1982, но применение этой реакции для получения соединений общей формулы I не известно. Образование эфиров в реакции с кислотным катализом происходит через соответствующий промежуточный катионный продукт. Была изучена стабильность замещенных в кольце 1-фенилэтилкарбокатионов и их реакция с нуклеофильными реагентами в системе трифторэтанол/вода = 1/1 (J. Am. Chem. Soc., 106, 1361,(1984); 106, 1373, (1984. В этих двух ссылках,однако, нет примера получения соединений общей формулы I, а также нет даже намека на то,что в этом синтезе главную роль играет реакционная среда (полярность, сольватация), и даже небольшие отклонения могут помешать чувствительному равновесию. Авторы этих ссылок в их более поздней теоретической работе отмечали, что эфиры, подобные эфирам общей формулы I, удивительно чувствительны к кислотам в отличие от других эфиров. Эфиры получаются в ходе обратимой реакции, которая увеличивает возможность образования побочных продуктов,что снижает чистоту и выход продукта. Как показано в опубликованных источниках, алкоксиспирты, такие как монометиловый эфир этиленгликоля, имеют низкую реакционную способность, ненасыщенные спирты, например,пропаргиловый спирт, имеют среднюю реакци 001467 4 онную способность и уступают реакционной способности простых насыщенных спиртов,таких как метанол, этанол и бутанол, которые реагируют быстро. Электрон-акцепторные заместители в ароматическом кольце увеличивают, а электрон-донорные заместители уменьшают константу равновесия образования эфиров. Увеличение соотношения вода/трифторэтанол оказывает неблагоприятное действие на прямое эфирообразование. Производство эфиров в промышленности очень трудная задача. Не только из-за высокой стоимости реагентов и возможных побочных реакций, но также из-за того, что и исходные спирты, и полученные эфиры легко образуют пероксиды и являются взрывоопасными веществами. Более того, алкинильные соединения изза тройной связи являются чувствительными к нагреванию. Безопасное производство в большом объеме (1000 т/год) возможно только в случае, если реакцию можно проводить в мягких условиях и нет необходимости очищать и перегонять конечный продукт, который в большинстве случаев является жидкостью. Учитывая вышесказанное, мы детально исследовали возможности получения несимметричных эфиров общей формулы I. Сущностью способа, который мы разработали на основании экспериментальных результатов, является то,что смешанные эфиры общей формулы I, значения радикалов которых указаны выше, могут быть легко получены путем реакции соединений общей формулы II, где X означает гидрокси, галоген или сульфоэфирную отщепляемую группу с 1-3 молярными эквивалентами спирта общей формулы III, значения заместителей которого указаны выше, в присутствии кислоты,кислоты Льюиса, оксида или карбоната металла. Полученный эфир общей формулы I выделяют,избыток спирта регенерируют и, если необходимо, продукт стабилизируют добавлением основания и/или антиоксиданта. В общих формулах I, II и III значения Ar, R1, R2 и R3 такие, как указано выше. Из кислот предпочтительно использовать 0,01-3 молярных эквивалента сильной неорганической или органической кислоты, предпочтительно соляной, серной, хлорной или ароматической сульфокислоты. Реакцию проводят в растворах солей, предпочтительней в растворе хлористого натрия, хлористого кальция, хлористого магния, хлористого цинка, предпочтительней в 10 вес./вес.% водном растворе кислоты, предпочтительней насыщенном неорганической солью, и при температуре от -20 С до+30 С. Из кислот Льюиса предпочтительней использовать 0,01-3 молярных эквивалента хлорида цинка (II) или ароматической сульфокислоты, предпочтительней бензолсульфокислоты или паратолуолсульфокислоты, реакцию прово 5 дят в неполярном апротонном растворителе при температуре от -30 до +40 С. Из оксидов металлов предпочтительней использовать 0,01-3 молярных эквивалента оксида цинка, из карбонатов металлов используют карбонат цинка, реакцию проводят без растворителя или в неполярном апротонном растворителе. Из органических растворителей хорошо себя показали галогенированные растворители,среди них наилучший - дихлорэтан. В этом случае также можно использовать кислоту Льюиса. Как сообщалось в литературе, хлорид цинка (II) не показал хороших результатов при синтезе соединений, близких по структуре соединениям формулы I, продукты получались с низким выходом и загрязненные (J. Org. Chem., 52, 3917,(1987, тем не менее, в оптимизированной системе по настоящему изобретению реакция проходила с хорошим выходом, а полученный продукт имел нужную чистоту. Аналогично, хорошие результаты давала реакция с использованием оксида цинка. Побочный продукт галогенида цинка не вызывал полимеризации в этом случае. Реакция не требовала безводных растворителей и условий. Вода, которая образовывалась в ходе реакции, не мешала полноте прохождения реакции и связывалась с катализатором. Полученная эмульсия или суспензия может быть разделена простым осаждением или фильтрацией и после соответствующей обработки может быть использована повторно. В промышленном производстве использование воды в качестве растворителя является особенно удобным. Этот способ уникален не только тем, что он не применялся ранее, но также и тем, что он является неожиданным, так как считали, что образование эфиров - равновесная реакция - подавляется в водной среде (J. Am.Chem. Soc., 107, 1340 (1985. Этот способ, вопреки литературным данным, хорошо подходит даже для получения бензилалкинильных эфиров с электрон-донорными заместителями (гидрокси-, метокси-, этокси-, метилендиоксигруппами). Бензиловые эфиры, содержащие фенольную гидроксигруппу, также могут быть селективно синтезированы прямым способом, не смотря на то, что они содержат более одного нуклеофильного центра. Усиление полярности среды является благоприятным. Следовательно,использование вспомогательных материалов,предпочтительней различных солей, является благоприятным. Выбирая правильные параметры реакции, равновесие реакции можно сдвигать в сторону образования продукта. 1-2 мол.% кислотного катализатора является достаточным. Реакция протекает быстро даже при низких температурах, таким образом можно избежать нежелательных побочных реакций. Спирт используют предпочтительней в избытке, чем сильно сокращают время реакции. Продукт можно выделять из реакционной смеси путем 6 простой седиментации, а электролит можно использовать повторно. Исходный спирт, регенерированный после реакции, можно использовать повторно. Таким образом, способ является практически количественным для обоих компонентов. Сырой продукт реакции получается очень хорошей чистоты. Его чистота достигает 93-95%. Конечно, продукт может быть очищен последующей перегонкой либо, если возможно,кристаллизацией, но его можно использовать и без очистки. Для увеличения стабильности и подавления кислотного гидролиза рекомендуется промыть продукт до нейтральной реакции и хранить в щелочном буфере. Для обеспечения безопасности при работе с этими продуктами рекомендуется добавлять антиоксиданты различного типа. В качестве антиоксидантов можно использовать, например, TMQ; ВНТ (бутилированный гидрокситолуол); гидрохинон; монометиловый эфир гидрохинона; 2,2,6,6-тетраметил-4-пиперидинол-N-оксид. Для иллюстрации способа по настоящему изобретению далее приведены примеры, которые не претендуют на полноту иллюстрации и не ограничивают объем охраны изобретения. Примеры 1) 1-[l-(Бут-2-инилокси)этил]-3-гидрокси 4-метоксибензол. А) 1,7 г (10,7 ммоль) 1-(3-гидрокси-4 метоксифенил)этанола растворяли в 1,4 г 2 бутинола, к этому раствору добавляли 1,5 мл раствора 1% НСl - 50% СаСl2 при перемешивании при комнатной температуре. Смесь перемешивали при комнатной температуре в течение ночи. Затем проводили тонкослойную хроматографию (ТСХ) (элюент : н-гексан : этилацетат 7: 3; Rf=0,19). Затем к реакционной смеси добавляли диэтиловый эфир до тех пор, пока не растворилась органическая фаза. После этого смесь нейтрализовали 1 М раствором NaOH,фазы разделяли, водный слой дважды экстрагировали эфиром, объединенные органические фазы промывали последовательно водой и насыщенным раствором хлористого натрия, сушили над MgSO4, фильтровали и выпаривали. Выход: 2,08 г (94%) бесцветного густого масла. Газовая хроматография (ГХ) (СР 9000, CPSIL-5CB 60 m х 0,53 mm, 5 ml/min N2 FID,250C): tR= 4,44 min, 93%. ИК (СНСl3, сm-1) : 3601, 3541, 2972, 2924,2857, 1728, 1615, 1596, 1507, 1457, 1443, 1372,1308, 1288, 1271, 1235, 1164, 1132, 1110, 1084,1043, 1030, 1004, 934, 877, 841, 808, 644, 611. 1(1H, t, ароматич. СH). 13 С-ЯМР (50 MHz, CDCl3) : 3.56 (C-CH3),23.65 (CH-CH3), 55.84 (OCH3), 55.89 (=C-CH2O),75.35 (=C-CH2), 76.06 (Ar-CH-СН 3), 81.89 (ССН 3), 110.47 (C-2), 112.66 (C-5), 118.08 (С-6),135.93 (C-1), 145.65 (С-4), 146.08 (С-3). В) Проводили процедуру, описанную в предыдущем примере, с тем отличием, что вместо раствора хлористого кальция использовали раствор хлорида цинка (II). Конечный продукт был идентичен продукту, полученному в предыдущем примере. 2) 1-[1-(Бут-2-инилокси)этил]-3,4-диметоксибензол 1-(3',4'-диметоксифенил)этилбут-2 иниловый эфир. А) Подготовительные операции. 125 г дигидрата хлористого кальция растворяют в 250 мл при перемешивании. По измеренной плотности (d=1,33 г/мл) концентрация раствора составляет примерно 35 вес./вес.% хлористого кальция. Если необходимо, раствор отфильтровывают. В мерную колбу помещают 7,6 мл (9,0 г) концентрированной соляной кислоты и доводят до объема 250 мл подготовленным раствором хлористого кальция. Основная процедура. К интенсивно перемешиваемой смеси 500,0 г -метилвератрилового спирта и 192,3 г 2-бутин-1-ола быстро добавляли смесь 250 мл раствора хлористого кальция и соляной кислоты и 192,3 г 2-бутин-1-ола. После окончания реакции проводили анализ ГХ и ТСХ. Через 6 ч относительное количество продукта достигло 9293%, что было показано анализом ГХ, а количество исходного материала уменьшилось менее чем до 2%. После этого реакционную смесь разбавляли при перемешивании 500 мл эфира и нейтрализовали при перемешивании 1 М раствором гидроксида натрия. После разделения водный слой экстрагировали дважды по 100 мл эфира. Объединенные органические фазы промывали насыщенным раствором хлористого натрия (рН водного слоя проверяли на нейтральную реакцию) и сушили. Раствор выпаривали при атмосферном давлении. Избыток бутинола перегоняли в вакууме с водоструйным насосом. 182 г регенерированного бутинола можно было использовать снова после проверки на чистоту (ГХ, показатель преломления). Продукт: 650 г бесцветного масла. Чистота: прямым интегрированием 93%, с использованием октакозана в качестве внутреннего стандарта 95%, выход: 94%, nD20 1,5280. ИК (СНCl3 сm-1) : 2976, 2855, 2837, 1605,1595, 1514, 1465, 1419, 1371, 1353, 1311, 1260,1164, 1141, 1086, 1027, 864 1 Н-ЯМР (200 MHz, CDCl3) : 1.46 (3 Н, d,J=6.5 Hz, СН-СH3), 1.85 (3h, t, J=2.3 Hz, ССH3), 3.83 and 4.01 (2H, ABX3, JAB=15.0 Hz,JАХ=JВХ=2.3 Hz, С-СH2-О), 3.87 and 3.89 (всего-метилвератриловый спирт (8,72 г, 0,0478 моль) и 2-бутин-1-ол (4,36 г, 0,0623 моль) и растворяли в 100 мл дихлорэтана. Затем к смеси добавляли хлорид цинка (II) (1,97 г, 0,0145 моль) при перемешивании при комнатной температуре. Реакция сопровождалась характерным изменением цвета. Через два часа образовавшуюся в ходе реакции водную фазу отделяли,органическую фазу промывали трижды по 30 мл насыщенного раствора хлористого натрия, сушили и выпаривали. Сырой продукт (12,1 г) перегоняли в вакууме с вакуумным насосом. Выход: 9,2 г (0,0393 моль, 82,2%). ГХ (с внутренним стандартом) 98,2%. Полученный продукт был идентичен соединению, полученному предыдущим способом. 3) 1-[1-(Бут-3-инилокси)этил]-3,4-диметоксибензол. В колбу с мешалкой помещали 3,0 г(0,0164 моль) -метилвератрилового спирта и 2,3 г (0,0329 моль) 3-бутин-1-ола и быстро добавляли к этой смеси 1,5 мл раствора, содержащего 50 вес./об.% хлористого кальция и 1 вес./вес.% соляной кислоты. Смесь перемешивали в течение ночи при комнатной температуре. Затем ее разбавляли эфиром и нейтрализовали несколькими каплями 1 М раствора гидроксида натрия. Фазы разделяли, водную фазу тщательно экстрагировали эфиром. Объединенные органические фазы промывали насыщенным раствором хлористого натрия, сушили и выпаривали. Выход: 3,5 г (93%). Чистота 92%. ИК (СНСl3, cm-1) : 3307, 3027, 2958, 2933,2869, 2838, 2120, 1607, 1595,1509, 1465, 1443,1259, 1163, 1142, 1098, 1027, 861. 1 Н-ЯМР(200 MHz, CDCl3) : 1.45 (3 Н, d,J=6.5 Hz, СН-СH3), 1.96 (1H, t, J=2.7Hz, CH),2.44 (2H, td, J=7, 2.7 Hz, CH2-C), 3.43 (2H, t, J=7(0,02345 моль) -метилвератрилового спирта и 5,0 г (0,0469 моль) 2-хлорбут-2-ен-1-ола (состоящего в основном из Z геометрического изомера) и быстро добавляли к этой смеси 5,0 мл раствора, содержащего 50 вес./об.% хлористого кальция и 1 вес./вес.% соляной кислоты. Смесь перемешивали в течение ночи при комнатной температуре. Затем ее разбавляли эфиром и нейтрализовали несколькими каплями 1 М раствора гидроксида натрия. Фазы разделяли, водную фазу тщательно экстрагировали эфиром. Объединенные органические фазы промывали насыщенным раствором хлористого натрия,сушили и выпаривали. Было получено 5,7 г бесцветного масла. Выход: 90%. Чистота (ГХ) примерно 88,5%. ГХ (СР 9000, CP-SIL-5CB, 60 m х 0.53 mm,5 ml/min N2, FID. 250C): ИК (СНСl3, cм-1) : 2973, 2931, 2862, 2339,1659, 1606, 1595, 1511, 1465, 1443, 1261, 1164,1141, 1093, 1028. 1 Н-ЯМР (200 MHz, CDCl3) : 1.43 (3 Н, d,J=6.5 Hz, СН-СH3), 1.97 (3H, t, J=0.5 Hz, =CClCH3), 3.80 (2H, m, OCH2), 3.87 and 3.89 (всего 6H, кажд. s, OCH3), 4.38 (2H, q, J=6.5 Hz, АrСHО), 5.78 (1H, m, CH=CCl), 6.83 (2H, d, Ar),6.87(1H, d, Ar). 13and C-4). 5) 1-[1-(Бут-2-инилокси)этил]-3-метокси-4 гидроксибензол. 4,0 г (23,6 ммоль) 1-(3-метокси-4-гидроксифенил)этилового спирта растворяли в 4,0 г 2-бутинола, к полученному раствору добавляли 8,0 мл раствора, содержащего 50 вес./об.% хлористого кальция и 1 вес./вес.% соляной кислоты, при перемешивании при комнатной температуре. Смесь перемешивали в течение ночи при комнатной температуре. После окончания реакции проводили ТСХ (элюент: н-гексанэтилацетат 7:3, Rf=0,55). Затем к смеси добавляли эфир до тех пор, пока не растворилась маслянистая органическая фаза, и нейтрализовали 1 М раствором гидроксида натрия. Фазы разделяли, водную фазу дважды экстрагировали эфиром. Объединенные органические фазы промывали последовательно водой и насыщенным раствором хлористого натрия, сушили над(16,46 ммоль) 3-пентин-1-ола и быстро добавляли к этой смеси 3,0 мл раствора, содержащего 50 вес./об.% хлористого кальция и 1 вес./вес.% соляной кислоты. Смесь перемешивали в течение ночи при комнатной температуре. Затем ее разбавляли эфиром и нейтрализовали несколькими каплями 1 М раствора гидроксида натрия. Фазы разделяли, водную фазу тщательно экстрагировали эфиром. Объединенные органические фазы промывали насыщенным раствором хлористого натрия, сушили и выпаривали. Выход: 1,9 г (93%). ГХ (СР 9000, CP-SIL-5CB, 60 m х 0.53 mm,5 ml/min N2, FID, 250C) tR=5.0 мин, примерно 93,2%. ИК (СРСl3, см-1) : 2995, 2974, 2957, 2864,2838, 1607, 1595, 1510, 1465, 1260, 1163, 1142,1098, 1027. 1(Ar-CH-СН 3, СС два сигнала перекрываются),108.92 (С-2), 110.83 (С-5), 118.52 (С-6), 136.34(0,0164 моль) -метилвератрилового спирта и 3,46 г (0,0493 моль) 3-бутин-2-ола и быстро добавляли к этой смеси 1,5 мл раствора, содержащего 50 вес./об.% хлористого кальция и 1 вес./ вес.% соляной кислоты. Смесь перемешивали в течение ночи при комнатной температуре. Затем ее разбавляли 10 мл эфира и нейтрализовали несколькими каплями 1 М раствора гидроксида натрия. Фазы разделяли, водную фазу тщательно экстрагировали эфиром. Объединенные органические фазы промывали насыщенным раствором хлористого натрия, сушили и выпаривали. Кубовый остаток очищали колоночной хро 11 матографией (элюент: гексан - этилацетат 4:1,Rf=0,41 и 0,36). Два стереоизомера были частично разделены: Более неполярный (главный) альфа-изомер 1,9 г, 40-60% смесь 0,76 г; Более полярный бэта-изомер 0,32 г. Соотношение двух изомеров, рассчитанное на основе изолированных количеств, примерно 3,7:1. Выход: 2,98 г (0,0127 моль 77,6%). ГХ (СР 9000, CP-SIL-5CB, 60 m х 0.53 mm,5 ml/min N2, FID, 250C): Альфа-изомер: tR=3,4 мин, примерно 97,27%, бета-изомер: tR=3,58 мин, примерно 94,26%. Альфа-изомер: ИК (СНСl3, cм-1) : 3306, 2981, 2934, 2833,1608, 1595, 1509, 1465, 1464, 1260, 1168, 1141,1098, 1048, 963, 910, 860, 635. 1 Н-ЯМР (200 МНz, СDСl3) : 1.39 (3 Н, d,J=6.6 Hz, ССН-СH3), 1.46 (3 Н, d, J=6.5 Hz, ArCH-СH3), 2.41 (1 Н, d, J=2 Hz, CH), 3.87 and 3.89 (всего 6 Н, кажд. s, ОСН 3), 3.89 (1H, qd, J=2,6.6 Hz, CCH), 4.75 (2H, q, J=6.5 Hz, Аr-СHСН 3), 6.80-6.89 (3 Н, m, ароматич.). 13 С-ЯМР(50 МНz, CDCl3) : 22.19 (ССНСН 3), 24.15 (Ar-CH-CH3), 55.82 (ОСН 3), 61.78(0,0164 моль) -метилвератрилового спирта и 1,9 г аллилового спирта и быстро добавляли к этой смеси 1,5 мл раствора, содержащего 50 вес./об.% хлористого кальция и 1 вес/вес.% соляной кислоты. Смесь перемешивали в течение ночи при комнатной температуре. Затем ее разбавляли эфиром и нейтрализовали несколькими каплями 1 М раствора гидроксида натрия. Фазы разделяли, водную фазу тщательно экстрагировали эфиром. Объединенные органические фазы промывали насыщенным раствором хлористого(C-3 and C-4). 9) 1-[1-(Бут-2-инилокси)этил]-нафталин 1(1-нафтил)этилбут-2-иниловый эфир. В колбу, снабженную магнитной мешалкой, холодильником и осушительной трубкой,заполненной хлоридом кальция, помещали метил-1-нафтилметанол (0,86 г, 5 ммоль) и 2 бутин-1-ол (0,7 г, 10 ммоль) и растворяли в 15 мл дихлорэтана. Затем к смеси добавляли хлорид цинка (II)(0,68 г, 5 ммоль) при перемешивании при комнатной температуре. Реакция сопровождалась характерным изменением цвета. Через 24 ч органическую фазу промывали трижды по 5 мл насыщенного раствора хлористого натрия, сушили и выпаривали. Сырой продукт (1,2 г) очищали колоночной хроматографией. Выход: 1,8 г (3,57 ммоль, 71%). ГХ 95%. ИК (СНСl3, см-1) : 3052, 2977, 2921, 2856,1596, 1509, 1444, 1371, 1095, 1078. 1 Н-ЯМР (200 MHz, СDСl3) : 1.67 (3 Н, d,J=6.5 Hz, СH3-СН), 1.87 (3 Н, t, J=2.3 Hz, CСH3), 2.96 and 4.15 (всего 2 Н, ABX, JAB=15.0 Hz,JAX=JBX=2.3 Hz, ОСH2-С C), 5.40 (1H, q, J=6.5(СН 3-СН), 75.36 and 82.14 (CC), 123.26 (C-8),123.52, 125.50, 125.85, 127.92, 128.83, 130.78 (C8a), 133.88 (C-4a), 138.42 (C-1). 10) Общая процедура получения бут-2 инилбензиловых эфиров. В колбу с мешалкой помещают 10 ммоль указанного ниже бензилового спирта и 1,2 г (20 ммоль) 2-бутин-1-ола и быстро добавляют к этой смеси 1,5 мл раствора, содержащего 50 вес./об.% хлористого кальция и 1 вес./вес.% соляной кислоты. Смесь перемешивают в течение ночи при комнатной температуре. После окончания реакции проводят ТСХ. Затем реакционную смесь разбавляют эфиром и нейтрализуют 13 несколькими каплями 1 М раствора гидроксида натрия. Фазы разделяют, водную фазу тщательно экстрагируют эфиром. Объединенные органические фазы промывают насыщенным раствором хлористого натрия, сушат и выпаривают. Полученный продукт очищают колоночной хроматографией. а) Исходный бензиловый спирт: 3,4 диметоксибензиловый спирт. Продукт: 3,4-диметоксибензилбут-2-иниловый эфир. Выход: 85%. Чистота (ГХ): 94%. ИК (СНСl3, см-1) : 3025, 3000, 2956, 2937,2921, 2855, 2839, 1607, 1595, 1512, 1466, 1443,1420, 1158, 1140, 1070, 1028. 1 Н-ЯМР (200 МНz, СОСl3) : 1.84 (3 Н, t,J=2.3 Hz, С-СН 3), 3.83 and 3.85(всего 6 Н,СН 3O), 4.08 (2 Н, q, J=2.3 Hz, ОСН 2 СС-), 4.48Hz, OCH2), 4.22 (1H, t, J=6.8 Hz, CH-O), 6.806.83 (3H, m, ароматич.) (сигналы этилацетата можно видеть при 1.22 (t), 2.01 (s) and 4.08 (q)(13,95 ммоль) пиперонилбромида, 2,0 г (27,9 ммоль) 2-бутин-1-ола и 50 мл дихлорэтана. После добавления оксида цинка (II) (1,1 г, 13,5 ммоль) суспензию перемешивали при комнатной температуре в течение 1 ч. Реакция сопровождалась характерным изменением цвета. После этого смесь фильтровали, фильтрат выпаривали. Кубовый остаток растворяли в 50 мл эфира, промывали дважды по 10 мл воды, сушили и выпаривали. Выход: 2,3 г (11,2 ммоль, 80,7%), ГХ 82%. ИК (СНСl3, см-1) : 2997, 2946, 2921, 2888,2376, 1609, 1503, 1491, 1445, 1251, 1099, 1070,1042, 937, 865, 810 1 Н-ЯМР (400 MHz, CDCl3) : 1.87 (3 Н, t,J=2.3 Hz, Me), 4.10 (2H, q, J=2.3 Hz, O-СH2-С),4.47, (2H, s, О-СH2-Аr), 5.94 (2H, s, O-СH2-О),6.76 (1H, d, J=8 Hz, H-7), 6.81 (1H, dd, J=8.15 Hz,H-6), 6.86 (1H, J=1.5 Hz, H-4). 13 С-ЯМР (100 МНz, CDCl3) : 3.52 (Me),57.29 (O-СH2-С), 71.15 (O-СH2-Ar), 82.54 (СН 3 С), 100.9 C-2, 107.95, 108.71 (C-4,7), 121.66 (C6), 131.39, (C-5), 147.15, 147.66 (C3a, C-7a). 12) l-[(2-Бyтинилокси)метил]нафталин. В колбу, снабженную магнитной мешалкой, холодильником и осушительной трубкой,заполненной хлоридом кальция, помещали бромметилнафталин (1,0 г, 4,52 ммоль), 2 бутин-1-ол (0,63 г, 9 ммоль) и 10 мл дихлорэтана. После добавления оксида цинка (II) (4,0 г,4,52 ммоль) суспензию перемешивали при комнатной температуре в течение 1 ч, затем дефлегмировали в течение 1 ч. Реакция сопровождалась характерным изменением цвета. После этого смесь фильтровали, фильтрат выпаривали. Кубовый остаток растворяли в 15 мл эфира,промывали дважды по 50 мл воды, сушили и выпаривали. Продукт очищали колоночной хроматографией. Чистота (ГХ) 95%. ИК (СНСl3, cм-1) : 3044, 3001, 2945, 2920,2854, 1598, 1509, 1356, 1166, 1086, 1067. 1 Н-ЯМР (400 МHz, СDСl3) : 1.93 (3 Н, t,J=2.3 Hz, СС-СH3), 4.22 (2 Н, q, J=2.1 Hz, OСH2-CС), 5.06 (2 Н, s, С 10 Н 7-СH2-O), 7.45 (1 Н, t,J=8 Hz), 7.53 (3 Н, m), 7.84 (1 Н, d, J=8.1 Hz), 7.88 16 75.10 (O-СН 2-СС), 82.76 (O-СН 2-CС), 124.03,125.10, 125.72, 126.19, 126.85, 128.43, 128.72,131.79 (С-8 а), 133.06, 133.70. 13) 5-[2-(2-Бутоксиэтокси)этоксиметил]-6 пропил-1,3-бензодиоксол, РВО. а) В колбу, снабженную магнитной мешалкой, холодильником и осушительной трубкой, заполненной хлоридом кальция, помещали 2,98 г (14,02 ммоль) 5-хлорметилдигидросафрола, 2,72 г (16,82 ммоль) монобутилового эфира диэтиленгликоля и 20 мл дихлорэтана. После добавления оксида цинка (II) (1,22 г, 15 ммоль) суспензию перемешивали 24 ч при комнатной температуре. Окончание реакции контролировали ТСХ и после исчезновения исходного бензилхлорида смесь фильтровали, фильтрат выпаривали. Кубовый остаток растворяли в 25 мл эфира, промывали дважды по 50 мл воды,сушили и выпаривали. Продукт перегоняли в вакууме. Температура кипения: 180 С/1 мм. рт.ст. Продукт был идентичен имеющемуся в продаже РВО. Выход: 4,0 г (90%). Чистота (ГХ) 98%.b) В колбу, снабженную магнитной мешалкой, холодильником и осушительной трубкой, заполненной хлоридом кальция, помещали 2,12 г (10,0 ммоль) 5-хлорметилдигидросафрола, 2,42 г (15,0 ммоль) монобутилового эфира диэтиленгликоля. После добавления 0,97 г (15,0 ммоль) оксида цинка (II) суспензию перемешивали 12 ч при комнатной температуре. Окончание реакции контролировали ТСХ и после исчезновения исходного бензилхлорида смесь разбавляли диэтиловым эфиром, фильтровали, фильтрат промывали дважды по 50 мл воды, сушили и выпаривали. Продукт перегоняли в вакууме. Температура кипения: 180 С/1 мм.рт.ст. Продукт был идентичен имеющемуся в продаже РВО. Выход: 2,8 г (91%). Чистота (ГХ) 98%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения смешанных эфиров общей формулы I где Аr означает алициклическую, ароматическую или содержащую один или более гетероатомов гетероциклическую группу, которая может быть замещена одной или более С 1-4 алкокси-, метилендиокси-, C1-4 алкильной группой,галогеном, С 1-4 галогеноалкильной или нитрогруппой, и/или конденсирована с бензольным кольцом,R1 и R2 независимо друг от друга означают водород, C1-4 алкил, С 1-4 галогеноалкил, С 2-4 ал 17 кенил, фенил, замещенный фенил, С 36 циклоалкил,R3 означает С 3-6 алкинильную группу, которая может быть замещена одним или болееC1-6 алкилом, С 3-6 алкенилом, С 3-6 алкинилом, C1-6 галогеноалкилом или атомом галогена; или С 1-4 алкилокси-С 1-4 алкилокси-С 1-4 алкильную группу,отличающийся тем, что проводят реакцию между соединениями общей формулы II где X означает гидроксил, галоген или сульфоэфирную отщепляемую группу,и 1-3 молярными эквивалентами спирта общей формулы IIIR3 - ОН,где заместитель имеет значения, указанные выше, в присутствии кислоты, кислоты Льюиса,оксида металла или карбоната металла; полученный эфир общей формулы I выделяют, если необходимо, стабилизируют добавлением основания и/или антиоксиданта и, если необходимо,регенерируют избыток спирта. 2. Способ по п.1, отличающийся тем, что в качестве кислоты используют 0,01-3 молярных эквивалента сильной неорганической или органической кислоты, предпочтительней соляной,серной, хлорной или ароматической сульфокислоты. 18 3. Способ по пп.1-2, отличающийся тем,что реакцию проводят в растворах солей, предпочтительней в растворах хлористого натрия,хлористого кальция, хлористого магния, хлористого цинка. 4. Способ по пп.1-3, отличающийся тем,что реакцию проводят в водном растворе кислоты, предпочтительней в 10 вес./вес.% водном растворе кислоты, насыщенном неорганической солью при температуре от -20 до +30 С, причем в качестве неорганической соли используют хлористый натрий, хлористый кальций, хлористый магний. 5. Способ по п.1, отличающийся тем, что в качестве кислоты Льюиса используют 0,01-3 молярных эквивалента хлорида цинка(II) или ароматической сульфокислоты, предпочтительней бензолсульфокислоты или паратолуолсульфокислоты, причем реакцию проводят в неполярном апротонном растворителе. 6. Способ по п.5, отличающийся тем, что в качестве неполярного апротонного растворителя используют дихлорэтан, а реакцию проводят при температуре от -30 до +40 С. 7. Способ по п.1, отличающийся тем, что в качестве оксида металла используют 0,01-3 молярных эквивалента оксида цинка, в качестве карбоната металла используют карбонат цинка,а реакцию проводят без растворителя или в неполярном апротонном растворителе, предпочтительней в дихлорэтане.
МПК / Метки
МПК: C07C 41/09, C07D 317/54
Метки: бензиловых, эфиров, способ, получения
Код ссылки
<a href="https://eas.patents.su/10-1467-sposob-polucheniya-benzilovyh-efirov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения бензиловых эфиров</a>
Предыдущий патент: Система и способ выработки синтез-газа
Следующий патент: Фармацевтическая композиция, содержащая ингибитор иммуноглобулин-рецепторного взаимодействия
Случайный патент: Синергетические гербицидные композиции и способы их применения












