Производные гидроксамовой кислоты
Формула / Реферат
1. Соединение формулы (I)
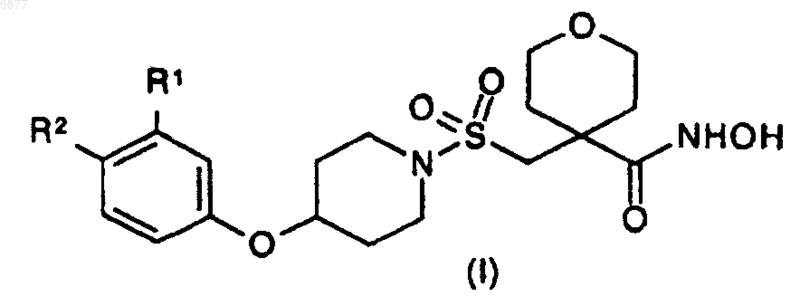
где R1 и R2, которые могут быть одинаковыми или разными, представляют собой, каждый, атом водорода или группу СF3, CF2H или CFH2, при условии, что, когда один из R1 или R2 представляет собой атом водорода, другой представляет собой группу СF3, CF2H или CFH2;
и его соли, сольваты или гидраты.
2. Соединение по п.1, где R1 представляет собой атом водорода и R2 представляет собой группу СF3, CF2H или CFH2.
3. Соединение по п.1, где R2 представляет собой атом водорода и R1 представляет собой группу СF3, CF2H или CFH2.
4. Соединение, которое представляет собой гидроксиамид 4-[4-(4-трифторметил-фенокси)пиперидин-1-сульфонилметил]тетрагидропиран-4-карбоновой кислоты, и его соли, сольваты или гидраты.
5. Фармацевтическая композиция, включающая соединение по пп.1-4 и фармацевтически приемлемый разбавитель или носитель.
6. Применение соединения по пп.1-4 при лечении рака, воспаления или аутоиммунного, инфекционного или глазного заболевания.
7. Применение соединения по пп.1-4 при лечении реакции "трансплантат против хозяина", псориаза, атопического дерматита, ринита, экземы, системной красной волчанки, трансплантации твердого органа и муковисцидоза.
8. Применение соединения по пп.1-4 при лечении ревматоидного артрита, остеоартрита, остеопороза, болезни Крона, неспецифического язвенного колита, рассеянного склероза, периодонтита, костной резорбции, бактериальных инфекций, врожденного буллезного эпидермолиза, роста опухоли, ангиогенеза, офтальмологического заболевания, ретинопатии, астмы, эмфиземы, бронхита и хронического закупоривающего легочного заболевания (COPD).
Текст
006877 Область изобретения Данное изобретение относится к производным гидроксамовой кислоты и их применению в медицине. Предпосылки создания изобретения Матричные металлопротеиназы (ММР) являются группой структурно родственных эндопептидаз,которые разлагают белковые элементы внеклеточного матрикса. Членам семейства ММР присущ ряд важных особенностей, и они включают атом цинка в каталитическом сайте, каталитическую активность при нейтральном рН, первоначальное существование в виде неактивных проферментов, активацию,включающую восстановление N-концевого домена, структурную стабилизацию кальцием и ингибирование каталитически активных форм семейства специфических ингибиторов белка, названных тканевыми ингибиторами металлопротеиназ (TIMP). Семейство классических ММР в настоящее время состоит по меньшей мере из двадцати членов, включающих коллагеназы, желатиназы, стромелизины и ММР мембранного типа. ММР являются подсемейством значительно большей группы содержащих цинк протеиназ, которые включают репролизины и серрализины и семейство астацина. Показано, что некоторые соединения, которые ингибируют классические ММР, обладают также способностью ингибировать ряд других событий, которые опосредуются нематричными металлопротеиназами (МР) и которые включают высвобождение TNF, CSF-1 и TGF и высвобождение L-селектина и рецепторов IL-6, TNF-R1 и TNF-RII. См. Hooper et аl. (1997), Biochem. J., 321: 265-279. Матричные металлопротеиназы ассоциированы со многими патологическими состояниями, поэтому ингибирование активности одной или нескольких ММР может быть полезным при таких патологических состояниях. Такие состояния включают раковое, воспалительное, аутоиммунное, инфекционное или глазное заболевание. См. Whittaker M. et al., (1999), Chem. Rev., 99, 2735-2776 and (1994) Annals of theNew York Academy of Sciences, Vol. 732. Таким образом, соединения с ММР-ингибирующими свойствами могут быть использованы для лечения ряда разных заболеваний. Особенно полезными являются те соединения, которые имеют также хорошие фармакокинетические свойства. Однако ингибирование нематричных металлопротеиназ (МР) такими соединениями может не оказывать терапевтическую пользу и фактически может быть вредным. Например, было предположено, что ингибиторы ММР, которые также ингибируют высвобождение TNF, могут играть роль в обострении поражения печени; см. Solorzano et al. (1997), J. Immunol., 158: 414-419. Аналогично этому, клиническое доказательство, полученное ранее при использовании ингибиторов ММР, которые не являются селективными только для классических ММР, позволяет предположить, что их применение ассоциируется у многих пациентов с болью в суставах (тендинитом). См. Wojtowicz-Praga(MMPI) administered orally to patients with metastatic lung cancer." Развитие боли в суставах является дозаограничивающим и может требовать перерыва вплоть до 50% курса лечения или введения нестероидных противовоспалительных агентов (NSAID). Следовательно, существует потребность в селективных ингибиторах ММР, которые могут быть использованы в медицине при дозах, при которых они не вызывают нежелательные побочные действия,такие как боль в суставах. В WO 99/24399 описан класс производных гидроксамовой кислоты в качестве ингибиторов ММР. Краткое изложение сущности изобретения Авторами данного изобретения теперь обнаружен ряд соединений, которые являются сильнодействующими ингибиторами ММР, которые преимущественно не вызывают тендинит на приемлемой животной модели. Можно ожидать, что соединения будут использованы в медицине, особенно, когда желательно избежать побочных действий, таких как боль в суставах. Поэтому можно предположить, что соединения изобретения имеют улучшенный профиль побочного действия по сравнению с такими соединениями, как Marimastat, который, как известно, ассоциирован с доза-ограничивающими действиями. Таким образом, авторы изобретения предлагают соединение формулы (I) где R1 и R2, которые могут быть одинаковыми или разными, представляют собой, каждый, атом водорода или группу СF3, CF2H или CFH2, при условии, что, когда один из R1 или R2 представляет собой атом водорода, другой представляет собой группу CF3, CF2H или CFH2; и его соли, сольваты или гидраты.-1 006877 Описание изобретения В одной конкретной группе соединений изобретения R1 представляет собой атом водорода и R2 представляет собой группу СF3, CF2H или CFH2. В другой конкретной группе соединений изобретения R2 представляет собой атом водорода и R1 представляет собой группу СF3, CF2H или CFH2. Особенно предпочтительными соединениями изобретения являются соединения, описанные в примерах. Особенно предпочтительным соединением изобретения является соединение формулы I, где R2 представляет собой группу СF3 и R1 представляет собой атом водорода, а именно, гидроксиамид 4-[4-(4 трифторметилфенокси)пиперидин-1-сульфонилметил]тетрагидропиран-4-карбоновой кислоты. Следует принять во внимание, что требуемые соединения изобретения могут быть введены в форме пролекарства, например, в виде защищенного производного гидроксамовой кислоты, которая может быть защищена в виде либо N-, либо O-замещенных производных, таких как O-бензил и O-третбутилпроизводные. Следует принять далее во внимание, что пролекарства могут быть превращены invivo в активные соединения формулы (I), и изобретение также включает такие пролекарственные средства. Соли соединений формулы (I) включают фармацевтически приемлемые соли, например, основноаддитивные соли, полученные из неорганических или органических оснований, например, соли щелочных металлов, такие как соли магния или кальция, и соли органических аминов, такие как соли морфолина, пиперидина, диметиламина или диэтиламина. Соединения общей формулы (I) могут быть получены любым подходящим способом, известным в данной области, и/или нижеследующими способами. В описании и приведенных ниже формулах группыR1 и R2 имеют значения, указанные выше, за исключением случаев, где указано по-другому. Следует принять во внимание, что может быть необходимо, чтобы функциональные группы, такие как амино,гидроксильные или карбоксильные группы, которые присутствуют в различных соединениях, описанных ниже, и которые желательно сохранить, были в защищенной форме до того, как начинается любая реакция. В таких случаях удаление защитной группы может быть конечной стадией в конкретной последовательности реакций. Подходящие защитные группы для таких функциональных групп должны быть очевидны специалисту в данной области. Конкретные подробности см. в Greene T.W. et al. "Protective Groupsin Organic Synthesis" (1999). Так, например, соединения изобретения можно получить следующим общим путем, как показано на схеме 1: Соединения формулы (iii) могут быть получены взаимодействием соединения формулы (i) (где Х представляет собой, например, гидроксильную группу или уходящую группу, например атом фтора) с соединением формулы (ii) (где PG1 представляет собой подходящую защитную группу, например, третбутоксикарбонильный сложный эфир) с использованием стандартного метода образования простой эфирной связи. Например, когда Х в соединении формулы (i) является атомом фтора, такое соединение формулы (i) может быть подвергнуто взаимодействию с соединением формулы (ii) в присутствии подходящего основания, такого как трет-бутоксид калия, в подходящем растворителе, таком как N,Nдиметилформамид (ДМФ), с получением соединения формулы (iii). Защитная группа PG1 может быть удалена с использованием стандартных способов, известных специалисту в данной области, для получения соединения формулы (iv). Так, например, когда PG1 представляет собой трет-бутоксикарбонильную сложную эфирную группу, ее можно удалить в среде кислот, таких как трифторуксусная кислота в галогенированном растворителе, например дихлорметане.-2 006877 Соединение формулы (vi) может быть получено взаимодействием соединения формулы (iv) с соединением формулы (v), предпочтительно в присутствии основания, такого как триэтиламин, в галогенированном растворителе, например дихлорметане. Следует принять во внимание, что соединение формулы (v) может быть получено аналогично способам, описанным в литературе. Соединение формулы (vi) можно затем превратить в карбоновую кислоту с использованием, например, основания, такого как гидроксид лития, в подходящей системе растворителей, такой как метанол и вода, при подходящей температуре, например, при температуре дефлегмации. Таким образом образованная карбоновая кислота может быть затем превращена в соединение формулы (I) с использованием условий, хорошо известных в литературе. Например, обработка кислоты оксалилхлоридом в инертном растворителе (таком как дихлорметан) в присутствии каталитического количества ДМФ дает промежуточный хлорангидрид кислоты, который может быть или может не быть выделен, но который, в свою очередь, подвергают взаимодействию с гидроксиламином при подходящей температуре, такой как комнатная температура, получая при этом требуемые гидроксамовые кислоты (I). Любые полученные смеси конечных продуктов или промежуточных продуктов могут быть разделены на основе физико-химических различий компонентов смесей известным способом на чистые конечные продукты или промежуточные продукты, например, хроматографией, перегонкой, фракционной кристаллизацией или образованием соли, если это является подходящим или возможным в данных случаях. Способность соединений ингибировать ММР можно определить с использованием подходящего испытания на ингибирование фермента, например, как описано в примере А. В испытаниях настоящего изобретения с соединениями изобретения тендинит преимущественно не наблюдается. Модель крысы, описанная в примере В, может быть использована для предсказания предрасположенности соединений изобретения вызывать боль в суставах. Соединения изобретения имеют преимущественно полезные фармакокинетические свойства, например хорошую биологическую доступность. Фармакокинетический профиль соединений может быть определен с использованием способа анализа, описанного в примере С. Данное изобретение относится также к способу лечения пациентов (в том числе человека и/или млекопитающих животных, выращиваемых в молочной, мясной или пушной промышленности или живущих в качестве домашних животных), страдающих нарушениями или заболеваниями, которые могут быть отнесены к ММР, как описано ранее, и более определенно, способу лечения, заключающемуся во введении ингибитора матричной металлопротеиназы формулы (I) в качестве активного компонента. В соответствии с этим, соединения формулы (I) могут быть использованы в числе других средств при лечении остеоартрита и ревматоидного артрита и при заболеваниях и показаниях, являющихся результатом сверхэкспрессии этих матричных металлопротеиназ, таких как обнаружены в некоторых метастатических опухолевых клеточных линиях, или состояниях, включающих глазную реваскуляризацию. Как указано выше, соединение формулы (I) является полезным в медицине и ветеринарии, так как они являются ингибиторами ММР. В соответствии с другим аспектом, данное изобретение относится к терапевтическому способу (который подразумевает лечение или профилактику) заболевания или состояний, опосредованных ММР у млекопитающих, в частности, у людей, причем данный способ включает введение млекопитающему эффективного количества вышеуказанного соединения формулы (I) или его фармацевтически приемлемой соли, и соединению формулы (I) для применения в медицине или ветеринарии, в частности в терапии (которая подразумевает лечение или профилактику) заболеваний или состояний, опосредованных ММР, и применению соединения формулы (I) при получении терапевтического агента (который подразумевает применение при лечении или профилактике заболеваний или состояний, опосредованных ММР). Заболевания или состояния, указанные выше, включают воспалительные заболевания, аутоиммунные заболевания, рак, сердечно-сосудистые заболевания, заболевания, включающие отторжение ткани. Соответствующие заболевания включают ревматоидный артрит, остеоартрит, остеопороз, нейродегенерацию, болезнь Альцгеймера, удар, васкулит, болезнь Крона, неспецифический язвенный колит, рассеянный склероз, периодонтит, гингивит, заболевания, включающие повреждение ткани (такие как костная резорбция, кровотечение, коагуляция, острая фазовая восприимчивость, кахексия и анорексия), острые инфекции, ВИЧ-инфекции, лихорадку, шоковые состояния, реакции трансплантат против хозяина,дерматологические состояния, заживление хирургических ран, псориаз, атопический дерматит, врожденный буллезный эпидермолиз, рост опухоли, ангиогенез и инвазию вторичными метастазами, офтальмологическое заболевание, ретинопатию, роговичную язву, повреждение при реперфузии, мигрень, менингит, астму, ринит, аллергический конъюнктивит, экзему, анафилаксию, рестеноз, застойную сердечную недостаточность, эндометриоз, атеросклероз, эндосклероз, аспирин-независимый антитромбоз, системную красную волчанку, трансплантацию твердого органа и глазные нарушения. Соединения формулы (I) могут быть также полезными при лечении воспалительных заболеваний тазовых органов (PID) и вызванной раком костной резорбции. Кроме того, они могут быть использованы при лечении заболеваний легких, например выбранных из муковисцидоза, респираторного дистресссиндрома взрослых индивидуумов (ARDS), эмфиземы, пневмонии, вызывающей облитерирующий брон-3 006877 хит (ВООР), идиопатического легочного фиброза (PIF), диффузного альвеолярного повреждения, гранулематоза легочных клеток Лангерхана, легочного лимфангиолейомиоматоза (LAM) и хронического закупоривающего легочного заболевания (COPD). Соединения изобретения особенно используют при лечении воспалительных заболеваний, аутоиммунных заболеваний, рака и глазных нарушений. Так, например, соединения можно использовать при лечении и/или профилактике реакций трансплантат против хозяина, псориаза, атопического дерматита, ринита, экземы, системной красной волчанки, трансплантации твердого органа, муковисцидоза и,особенно, ревматоидного артрита, остеоартрита, остеопороза, болезни Крона, неспецифического язвенного колита, рассеянного склероза, периодонтита, костной резорбции, бактериальных инфекций, врожденного буллезного эпидермолиза, роста опухоли, ангиогенеза, офтальмологического заболевания, ретинопатии, астмы, эмфиземы, бронхита и хронического закупоривающего легочного заболевания (COPD). Такие заболевания или состояния, включающие глазную реваскуляризацию, включают, но не ограничиваются перечисленным, диабетическую ретинопатию, ретинопатию преждевременного развития(ROP) или связанную с возрастом дегенерацию желтого пятна (ARMD). Для лечения всех заболеваний, указанных выше, соединения формулы (I) могут быть введены пероральным, местным, парентеральным, ректальным способом или ингаляционным распылением в формах,содержащих единицу дозы, содержащих нетоксичные фармацевтически приемлемые носители, вспомогательные добавки и наполнители. Термин парентеральный, используемый здесь, включает способы подкожной инъекции, внутривенной, внутримышечной, внутригрудинной инъекции или инфузии. Может также быть использована глазная инъекция, такая как инъекция в стекловидное тело, субтеноновая,субконъюнктивальная, периокулярная и ретробульбарная инъекция, а также устройства и имплантаты для медленного внутриглазного высвобождения. Кроме лечения теплокровных животных, таких как мыши, крысы, лошади, крупный рогатый скот, овцы, собаки, кошки и т.д. соединения изобретения являются эффективными при лечении людей. Фармацевтическая композиция, содержащая активный ингредиент, может быть в форме, подходящей для перорального использования, например в виде таблеток, пастилок, лепешек, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий, твердых или мягких капсул или сиропов или эликсиров. Композиции, предназначенные для перорального использования, могут быть получены любым способом, известным в данной области для изготовления фармацевтических композиций, и такие композиции могут содержать один или несколько агентов, выбранных из группы, состоящей из подслащивающих агентов, корригентов, красящих агентов и консервантов, чтобы обеспечить получение фармацевтически изящных и приятных на вкус препаратов. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, которые являются подходящими для изготовления таблеток. Упомянутыми эксципиентами могут быть, например, инертные разбавители,такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие агенты, например кукурузный крахмал или альгиновая кислота; связывающие агенты, например крахмал, желатин или аравийская камедь, и смазывающие агенты, например стеарат магния, стеариновая кислота или тальк. Таблетки могут быть непокрытыми или они могут быть покрыты известными способами для задержки дезинтеграции и абсорбции в желудочно-кишечном тракте и, таким образом, обеспечения непрерывного действия на протяжении более долгого периода. Например, можно использовать материал для задержки действия таблеток, такой как глицерилмоностеарат или глицерилдистеарат. Они могут быть также покрыты способами, описанными в патентах США 4256108, 4166452 и 4265874, для образования осмотических терапевтических таблеток с регулируемым высвобождением. Препараты для перорального использования могут быть также представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водной или масляной средой, например, арахисовым маслом, жидким парафином или оливковым маслом. Водные суспензии содержат активные вещества в смеси с эксципиентами, подходящими для изготовления водных суспензий. Такими эксципиентами являются суспендирующие агенты, например, натриевая соль карбоксиметилцеллюлозы, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и аравийская камедь; диспергирующими или смачивающими агентами могут быть природный фосфатид, например, лецитин, или продукты конденсации оксида алкилена с жирными кислотами, например, полиоксиэтиленстеарат, или продукты конденсации оксида этилена с алифатическими спиртами с длинной цепью, например, гептадекаэтиленоксицетанол,или продукты конденсации оксида этилена с неполными эфирами, полученными из жирных кислот и гексита, такие как полиоксиэтилированные неполные эфиры, полученные из жирных кислот и ангидридов гексита, например, моноолеат полиоксиэтиленсорбитана. Водные суспензии могут содержать также один или несколько консервантов, например, этил- или н-пропил-, п-гидроксибензоат, один или несколько красящих агентов, один или несколько корригентов и один или несколько подслащивающих агентов,таких как сахароза или сахарин.-4 006877 Масляные суспензии могут быть изготовлены суспендированием активного ингредиента в растительном масле, например, арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле,или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загущающий агент, например, пчелиный воск, твердый парафин или цетиловый спирт. Для получения приятного на вкус перорального препарата могут быть добавлены подслащивающие агенты, такие как указанные выше подслащивающие агенты, и корригенты. Эти композиции могут быть защищены добавлением антиоксиданта, такого как аскорбиновая кислота. Диспергируемые порошки и гранулы, подходящие для получения водной суспензии добавлением воды, содержат активный ингредиент в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом и одним или несколькими консервантами. Приводятся примеры подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, которые могут также присутствовать,например, подслащивающие агенты, корригенты и красящие агенты. Фармацевтические композиции изобретения могут быть также в форме эмульсий типа "масло в воде". Масляной фазой может быть растительное масло, например, оливковое масло или арахисовое масло,или минеральное масло, например, жидкий парафин, или их смеси. Подходящими эмульгирующими агентами могут быть природные камеди, например, аравийская камедь, трагакантовая камедь, природные фосфатиды, например, соевые бобы, лецитин и эфиры или неполные эфиры, полученные из жирных кислот и ангидридов гексита, например, моноолеат сорбитана, и продукты конденсации указанных неполных эфиров с оксидом этилена, например, моноолеат полиоксиэтиленсорбитана. Эмульсии могут содержать также подслащивающие агенты и корригенты. Сиропы и эликсиры могут быть изготовлены с подслащивающими агентами, например, с глицерином, пропиленгликолем, сорбитом или сахарозой. Такие препараты могут содержать также средство,уменьшающее раздражение, консервирующие и красящие агенты и корригенты. Фармацевтические препараты могут быть в форме стерильной инъецируемой водной или маслянистой суспензии. Эта суспензия может быть получена способом, известным в данной области, с использованием тех подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, которые были указаны выше. Стерильный инъецируемый препарат может также быть стерильным инъецируемым раствором или суспензией в нетоксичном, парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых наполнителей и растворителей, которые могут быть использованы, имеются вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные жирные масла. Для указанной цели может быть использовано легкое жирное масло, в том числе синтетические моно- или диглицериды. Кроме того, при получении инъецируемых препаратов находят применение жирные кислоты, такие как олеиновая кислота. Соединения формулы (I) могут быть также введены в форме суппозиториев для ректального введения лекарственного средства. Указанные композиции могут быть получены смешиванием лекарственного средства с подходящим нераздражающим эксципиентом, который является твердым при обычной температуре, но жидким при ректальной температуре и, следовательно, будет плавиться в прямой кишке,высвобождая при этом лекарственное средство. Такими материалами являются какао-масло и полиэтиленгликоли. Для местного применения используют кремы, мази, желе, растворы или суспензии и т.д., содержащие соединение формулы (I). Для местного глазного введения могут быть использованы фармацевтически приемлемые растворы, суспензии или гели, содержащие соединение формулы (I). Для интравитреального или интракамерального использования могут также быть приспособлены растворы и суспензии. Уровни доз порядка приблизительно от 0,05 мг до приблизительно 140 мг на килограмм массы тела в день являются полезными при лечении вышеуказанных состояний (приблизительно от 2,5 мг до приблизительно 7 г для пациента в день). Количество активного ингредиента, которое может быть объединено с веществами-носителями, для получения одной лекарственной формы, будет изменяться в зависимости от подвергаемого лечению хозяина и конкретного способа введения. Например, препарат, предназначенный для перорального введения человеку, может содержать количество приблизительно от 5 до приблизительно 95% общей композиции. Лекарственные формы, содержащие единицу дозы, обычно содержат между приблизительно 1 мг и приблизительно 500 мг активного ингредиента. Однако должно быть понятно, что определенный уровень доз для любого конкретного пациента будет зависеть от различных факторов, включающих активность применяемого определенного соединения,возраст, массу тела, общее состояние здоровья, пол, введение во время приема пищи, путь введения, скорость экскреции, комбинацию лекарственных средств и тяжесть конкретного заболевания, подвергаемого терапии. Соли соединений формулы (I) могут быть получены взаимодействием соединения формулы (I) с подходящей кислотой в подходящем растворителе или смеси растворителей, например в органическом растворителе, таком как простой эфир, например диэтиловый эфир, или спирт, например этанол, с использованием общепринятых процедур.-5 006877 Хроматография, перекристаллизация и другие общепринятые методы разделения могут также быть использованы при разделении промежуточных продуктов или конечных продуктов, когда нужно получить конкретный геометрический изомер изобретения. Следующие примеры иллюстрируют получение соединений изобретения. Все температуры приводятся в С. Используют следующие аббревиатуры:ELISA = твердофазный иммуноферментный анализ; РВМС = мононуклеарные клетки периферической крови; РМА - 12-миристат-13-ацетат форбола; час = часов. Все ЯМР получали либо при 300 МГц, либо при 400 МГц. Все промежуточные продукты и соединения примеров называли с помощью Beilstein Autonom (доступен от MDL Information Systems GmbH, Therdor-Heuss-Allee 108D 60486, Frankfurt, Germany) или им давали названия, которые представлялись согласующимися со структурой. Пример А. Флуориметрический анализ активности ингибирования ММР. Эффективность действия в качестве ингибитора желатиназы-А (ММР-2) и желатиназы-В (ММР-9) для соединения формулы (I) определяли с использованием следующей методики. Ингибитор растворяют в диметилсульфоксиде, содержащем 0,02% -меркаптоэтанола, и получают серийные разведения. Активированный фермент инкубируют в буфере для анализа, содержащем 50 мМTris, pH 7,4, 5 мМ CaCl2, 0,002% NaN3 и Brij 35, в присутствии и в отсутствие ингибитора. Образцы предварительно инкубируют при 37 С в течение 15 мин перед добавлением флуориметрического субстрата(Mca-Pro-Leu-Gly-Leu-Dpa-Ala-Arg-NH2) до конечной концентрации 10 мкМ. Анализируемую смесь инкубируют в течение 20-30 мин при 37 С и затем проводят считывание с помощью Fluoroscan II при возб(340 нм) и исп (405 нм). Активность фермента сравнивают с активностью в контроле, лишенном ингибитора, и результаты представляют как концентрацию ингибитора, вызывающую 50% ингибирование фермента (IC50). Пример В. Крысиная модель тендинита. Тендинит может быть определен с использованием модели, описываемой в WO-A-9925693. Пример С. Определение фармакокинетического профиля. Фармакокинетический профиль соединения изобретения определяют на крысах, канюлированных в правой сонной артерии для сбора крови. Для внутривенного дозирования соединение вводят в составе подходящего препарата, например 10% (объем/объем) ДМСО, 50% (объем/объем) ПЭГ 400 в воде, и дозирование проводят канюлированием левой яремной вены. Образцы собирают через 5 мин, 0,5, 1, 2, 4, 6 и 8 ч после дозирования. Для перорального дозирования соединение вводят в виде подходящего препарата, такого как 0,4% (мас./объем) метилцеллюлоза в воде. Образцы собирают через 0,5, 1, 2, 4, 6 и 8 ч после дозирования. В некоторых случаях образцы собирают также через 12 ч после дозирования. Плазму получают центрифугированием образца крови и концентрацию лекарственного средства затем определяют с использованием стандартных способов, таких как жидкостная хроматография-массспектрометрия с последующим осаждением белка. Промежуточный продукт 1. трет-Бутиловый эфир 4-(4-трифторметилфенокси)пиперидин-1 карбоновой кислоты Перемешиваемый раствор трет-бутилового эфира 4-гидроксипиперидин-1-карбоновой кислоты(134,8 г) в N,N-диметилформамиде (850 мл) охлаждают на ледяной бане в атмосфере азота. Порциями добавляют трет-бутоксид калия (75,2 г) так, чтобы температура не превышала 22 С, и образовавшуюся смесь выдерживают при 0 С в течение дополнительных 1,5 ч, затем по каплям на протяжении 15 мин добавляют 4-фторбензотрифторид (100 г). Реакционной смеси дают возможность нагреться до комнатной температуры и перемешивают на протяжении ночи. Добавляют воду (200 мл) и смесь экстрагируют трет-бутилметиловым эфиром (1 х 400 мл, 1 х 300 мл, 1 х 200 мл). Объединенные органические экстракты промывают водой (2 х 400 мл), насыщенным раствором соли (200 мл) и затем сушат над сульфатом магния и упаривают в вакууме, получая при этом указанное в заголовке соединение в виде не совсем белого/светло-желтого твердого вещества (206,4 г). Масс-спектр m/z 331 (М-14)+. Аналогично получают указанное ниже соединение. Промежуточный продукт 2. трет-Бутиловый эфир 4-(3-трифторметилфенокси)пиперидин-1 карбоновой кислоты. Гидрид натрия (0,9 г, 60% дисперсия в минеральном масле) добавляют к раствору трет-бутилового эфира 4-гидроксипиперидин-1-карбоновой кислоты (4 г) в NMP (40 мл) и раствор перемешивают в течение 1 ч, затем добавляют раствор 3-фторбензотрифторида (3,5 г) в NMP (10 мл) и смесь перемешивают в течение 2 ч при 80 С. Смесь добавляют к воде (200 мл) и экстрагируют диэтиловым эфиром (2 х 100 мл),раствор промывают водой, 1 М гидроксидом натрия и насыщенным раствором соли, сушат и упаривают,-6 006877 получая при этом указанное в заголовке соединение в виде желтого масла (5,2 г), которое переносят в следующую стадию без очистки. Масс-спектр m/z 331 (М-14)+. Промежуточный продукт 3. 4-(4-трифторметилфенокси)пиперидин Перемешиваемый раствор промежуточного продукта 1 (206 г) в дихлорметане (1236 мл) охлаждают на ледяной бане и на протяжении 0,5 ч добавляют трифторуксусную кислоту (365 мл). Перемешивание продолжают в течение дополнительных 4,5 ч, когда смесь охлаждают на ледяной бане и гасят 4 М раствором гидроксида натрия до получения рН 13. Слои разделяют и водную фазу снова экстрагируют свежим дихлорметаном (125 мл). Объединенные органические экстракты промывают насыщенным раствором соли (1 х 500 мл, 1 х 250 мл), сушат над сульфатом магния и затем упаривают в вакууме. Указанное в заголовке соединение получают в виде не совсем белого твердого вещества (101 г). Масс-спектр m/z 246 (М+1)+. Аналогично получают указанное ниже соединение. Промежуточный продукт 4. 4-(3-Трифторметилфенокси)пиперидин Получение проводят из промежуточного продукта 2 (5,2 г) по методике для промежуточного продукта 3 с образованием указанного в заголовке соединения в виде не совсем белого твердого вещества(4,2 г). ТСХ Rf 0,3 (1% NH4OH в этилацетате). Промежуточный продукт 5. Метиловый эфир 4-[4-(4-трифторметилфенокси)пиперидин-1 сульфонилметил]тетрагидропиран-4-карбоновой кислоты Триэтиламин (12 мл) добавляют к перемешиваемому раствору промежуточного продукта 3 (9,6 г) в дихлорметане (50 мл) и образовавшуюся смесь охлаждают на ледяной бане в атмосфере азота. Затем на протяжении приблизительно 5 мин по каплям добавляют раствор метил-4(хлорсульфонил)метилтетрагидропиран-4-карбоксилата (САS374822-74-9) (10 г) в дихлорметане (50 мл) и образовавшейся смеси дают возможность нагреться до комнатной температуры и перемешивают на протяжении ночи. Добавляют воду (50 мл) и слои разделяют. Водный слой экстрагируют свежим DCM(30 мл) и объединенные органические экстракты промывают водой (40 мл), разбавленной хлористоводородной кислотой (3 х 40 мл) и, наконец, водой (40 мл). Органический раствор переносят в колбу установки для перегонки при атмосферном давлении и концентрируют до объема 50 мл. Порциями (1 х 50 мл, 1 х 30 мл) добавляют трет-бутилметиловый эфир и смесь концентрируют снова до 50 мл после каждого добавления. Смесь перемешивают на протяжении ночи при комнатной температуре, охлаждают на ледяной бане и продукт выделяют фильтрованием. Осадок с фильтра промывают холодным третбутилметиловым эфиром (20 мл) и затем сушат в вакуумном сушильном шкафу, получая при этом указанное в заголовке соединение в виде не совсем белого твердого вещества (12,5 г). Масс-спектр m/z 466 (М+1)+. Промежуточный продукт 6. 4-[4-(4-Трифторметилфенокси) пиперидин-1-сульфонилметил]тетрагидропиран-4-карбоновая кислота Смесь промежуточного продукта 5 (5 г) и моногидрата гидроксида лития (0,9 г) в метаноле (25 мл) и воде (25 мл) кипятят с обратным холодильником в течение 4,5 ч. Реакционную смесь подвергают перегонке при атмосферном давлении и добавляют воду (33,5 мл) с последующей ее отгонкой. Дистилляцию продолжают до достижения температуры головной части 90 С. Образовавшийся раствор охлаждают до 60-70 С, когда по каплям добавляют концентрированную хлористо-водородную кислоту (1,8 мл). Смеси дают возможность охладиться до комнатной температуры и перемешивают на протяжении ночи. Продукт выделяют фильтрованием, промывают водой (4 х 10 мл) и сушат в вакуумном сушильном шкафу,получая при этом указанное в заголовке соединение в виде не совсем белого твердого вещества (4,42 г). Масс-спектр m/z 450 (М-1)-1. Промежуточный продукт 8. 4-[4-(3-Трифторметилфенокси)пиперидин-1-сульфонилметил]тетрагидропиран-4-карбоновая кислота Промежуточный продукт 4(0,50 г) добавляют к раствору метил-4(хлорсульфонил)метилтетрагидропиран-4-карбоксилата (0,60 г) в DCM и добавляют триэтиламин (0,5 мл). Раствор перемешивают в течение 2 ч, затем промывают водной лимонной кислотой (10% водная, 20 мл), водой и насыщенным раствором соли, сушат и выпаривают. Остаток растворяют в метаноле (20 мл) и добавляют раствор гидроксида лития (250 мг) в воде (20 мл). Раствор перемешивают при кипении с обратным холодильником в течение 2 ч, охлаждают и упаривают до половины объема. Водный раствор промывают диэтиловым эфиром, подкисляют лимонной кислотой до рН 4 и экстрагируют DCM. Раствор промывают водой и насыщенным раствором соли, сушат и упаривают, получая при этом указанное в заголовке соединение в виде белого твердого вещества (0,65 г). ТСХ Rf 0,42 (диэтиловый эфир). Пример 1. Гидроксиамид 4-[4-(4-трифторметилфенокси)пиперидин-1-сульфонилметил]тетрагидропиран-4-карбоновой кислоты Оксалилхлорид (0,65 мл) добавляют по каплям к перемешиваемому раствору промежуточного продукта 6 (2,25 г) и N,N-диметилформамида (39 мкл) в тетрагидрофуране (35 мл). Образовавшуюся смесь-7 006877 перемешивают при комнатной температуре в атмосфере азота в течение приблизительно 3 ч, когда растворитель удаляют в вакууме. К остатку добавляют толуол (1 х 20 мл, 1 х 10 мл), смесь затем снова упаривают после каждого добавления растворителя. К остатку добавляют тетрагидрофуран (27 мл) и образовавшийся раствор охлаждают на ледяной бане, когда добавляют гидроксиламин (1,5 мл 50% (мас./мас.) раствора в воде). Смеси дают возможность нагреться до комнатной температуры и перемешивают в течение 2,5 ч. Реакционную смесь затем перегоняют при атмосферном давлении и добавляют воду (23,5 мл) с последующей ее отгонкой до тех пор, пока температура головной части не достигнет 65 С. Смесь охлаждают до комнатной температуры и рН устанавливают до 8-8,5 разбавленным водным раствором аммиака. После перемешивания на протяжении ночи при комнатной температуре продукт выделяют фильтрованием, промывают водой (3 х 10 мл) и затем сушат в вакуумном сушильном шкафу, получая при этом указанное в заголовке соединение в виде не совсем белого/светло-коричневого твердого веществаH ЯМР (d6-ДМСО, 400 МГц):1,72 (м, 4 Н), 1,98 (м, 4 Н), 3,15 (м, 2 Н), 3,35 (м, 2 Н), 3,46 (м, 2 Н),3,65 (м, 2 Н), 4,67 (м, 1 Н), 7,17 (д, 2 Н), 7,65 (д, 2 Н), 8,87 (шир. с, 1 Н), 10,58 (шир. с, 1 Н). Аналогично получают указанное ниже соединение. Пример 2. Гидроксиамид 4-[4-(3-трифторметилфенокси) пиперидин-1-сульфонилметил]тетрагидропиран-4-карбоновой кислоты Получение проводят, как в примере 1, из промежуточного продукта 7 (0,65 г) с образованием указанного в заголовке соединения в виде бежевого твердого вещества (450 мг). ТСХ Rf 0,44 (7% метанол в дихлорметане). Масс-спектр m/z 465 (М-1)-. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) где R1 и R2, которые могут быть одинаковыми или разными, представляют собой, каждый, атом водорода или группу СF3, CF2H или CFH2, при условии, что, когда один из R1 или R2 представляет собой атом водорода, другой представляет собой группу СF3, CF2H или CFH2; и его соли, сольваты или гидраты. 2. Соединение по п.1, где R1 представляет собой атом водорода и R2 представляет собой группу СF3,CF2H или CFH2. 3. Соединение по п.1, где R2 представляет собой атом водорода и R1 представляет собой группу СF3,CF2H или CFH2. 4. Соединение,которое представляет собой гидроксиамид 4-[4-(4-трифторметилфенокси)пиперидин-1-сульфонилметил]тетрагидропиран-4-карбоновой кислоты, и его соли, сольваты или гидраты. 5. Фармацевтическая композиция, включающая соединение по пп.1-4 и фармацевтически приемлемый разбавитель или носитель. 6. Применение соединения по пп.1-4 при лечении рака, воспаления или аутоиммунного, инфекционного или глазного заболевания. 7. Применение соединения по пп.1-4 при лечении реакции трансплантат против хозяина, псориаза, атопического дерматита, ринита, экземы, системной красной волчанки, трансплантации твердого органа и муковисцидоза. 8. Применение соединения по пп.1-4 при лечении ревматоидного артрита, остеоартрита, остеопороза, болезни Крона, неспецифического язвенного колита, рассеянного склероза, периодонтита, костной резорбции, бактериальных инфекций, врожденного буллезного эпидермолиза, роста опухоли, ангиогенеза, офтальмологического заболевания, ретинопатии, астмы, эмфиземы, бронхита и хронического закупоривающего легочного заболевания (COPD).
МПК / Метки
МПК: A61P 35/00, A61K 31/445, C07D 309/08
Метки: кислоты, гидроксамовой, производные
Код ссылки
<a href="https://eas.patents.su/9-6877-proizvodnye-gidroksamovojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Производные гидроксамовой кислоты</a>
Следующий патент: Противоопухолевые составы, содержащие производные таксанов
Случайный патент: Профильная система для раздвижной двери













