Способ получения 1-замещенных 5- или 3-гидроксипиразолов
Номер патента: 3753
Опубликовано: 28.08.2003
Авторы: Штайнметц Андриан, Ракк Михаель, Айскар Байето Хуан Хосе, Гётц Норберт, Хенкельманн Йохем, Майвальд Фолькер, Гётц Роланд, Беккер Хайке
Формула / Реферат
1. Способ получения 1-замещенных 5- и/или 3-гидроксипиразолов формулы I, соответственно II

где R1 означает C1-C6алкил, C2-C6алкенил, C2-C6алкинил, C3-C6циклоалкил или C1-C4алкокси, причем эти группы могут быть замещены галогеном, C1-C4алкокси, фенокси, C1-C6алкоксикарбонилом, C1-C6алкилтиокарбонилом или циклической системой с 3-14 атомами цикла, отличающийся тем, что
в) алкилвиниловый эфир общей формулы V
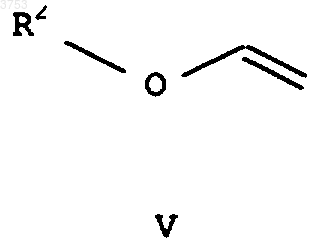
где R2 означает C1-C6алкил или C3-C6циклоалкил, подвергают взаимодействию с фосгеном VIa, "дифосгеном" VIb или "трифосгеном" VIc
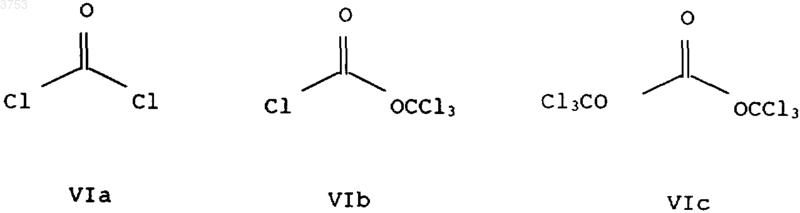
с получением хлорангидридов формулы VII
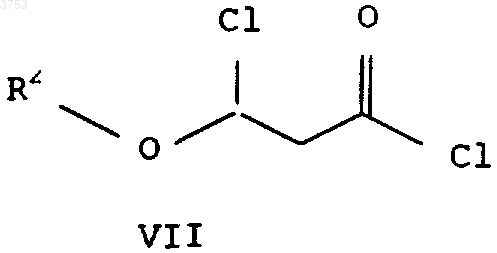
г) переводят элиминированием хлорводорода в соответствующий хлорангидрид 3-алкоксиакриловой кислоты формулы VIII

и д) его этерифицируют спиртом формулы IX
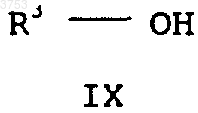
где R3 означает C1-C6алкил или C3-C6циклоалкил, в соответствующий сложный алкиловый эфир 3-алкоксиакриловой кислоты формулы III, этот сложный алкиловый эфир 3-алкоксиакриловой кислоты формулы III
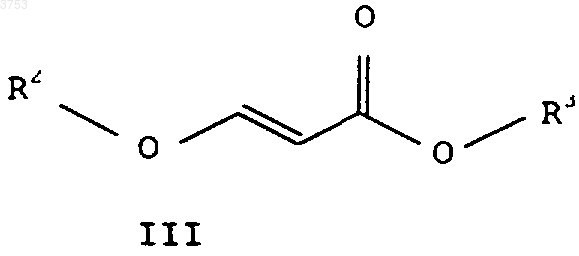
подвергают взаимодействию с гидразином формулы IV
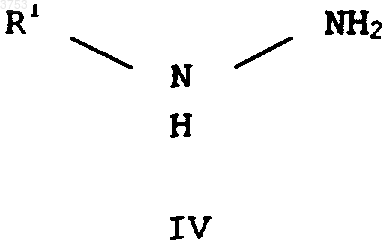
где R1 имеет вышеприведенное значение,
а) с получением при значении pH, равном 6-11, 5-гидроксипиразолов формулы I
или
б) с получением при значении pH, равном 11-14, 3-гидроксипиразолов формулы II.
2. Способ по п.1, отличающийся тем, что взаимодействие на стадии а) проводят при температуре от -30 до 100шC.
3. Способ по п.1, отличающийся тем, что взаимодействие проводят в присутствии основания.
4. Способ по п.1, отличающийся тем, что в качестве основания применяют гидроксиды щелочного металла, гидроксиды щелочно-земельного металла или трет.-амины.
5. Способ по п.2, отличающийся тем, что берут растворитель и сложный алкиловый эфир 3-алоксиакриловой кислоты III и гидразин IV дозируют одновременно в растворитель.
6. Способ по п.5, отличающийся тем, что в качестве растворителя применяют воду, спирты, эфиры или их смеси.
7. Способ по п.1, отличающийся тем, что взаимодействие на стадии б) проводят при температуре от -30 до 100шC.
8. Способ по п.7, отличающийся тем, что реакцию взаимодействия проводят в присутствии основания.
9. Способ по п.8, отличающийся тем, что в качестве основания применяют гидроксид щелочного металла, гидроксид щелочно-земельного металла, трет.-амины или их смеси.
10. Способ по п.1, отличающийся тем, что реакцию взаимодействия на стадии в) проводят при температуре от -78 до 100шC.
11. Способ по п.1, отличающийся тем, что алкилвиниловый эфир V подвергают взаимодействию с фосгеном VIa, дифосгеном VIb или трифосгеном VIc в молярном отношении от 0,1:1 до 1:1.
12. Способ по п.1, отличающийся тем, что реакцию взаимодействия на стадии г) проводят при температуре от 30 до 80шC.
13. Способ по п.1, отличающийся тем, что этерифицирование на стадии д) проводят при температуре от -20 до 80шC.
Текст
1 Настоящее изобретение относится к способу получения 1-замещенных 5-и/или 3 гидроксипиразолов формул I и II где R1 означает C1-С 6 алкил, C2-С 6 алкенил, C2 С 6 алкинил, C3-С 6 циклоалкил или С 1-С 4 алкокси,причем эти группы могут быть замещены галогеном, C1-С 4 алкокси, фенокси, C1-С 6 алкоксикарбонилом, C1-С 6 алкилтиокарбонилом или циклической системой с 3-14 атомами цикла(кольцевыми атомами). 1-замещенные 5- и 3-гидроксипиразолы находят широкое применение в качестве исходных продуктов для получения лекарственных средств и средств защиты растений, в особенности, гербицидов, и известны, например, изWО 96/26206, WO 97/23135, WO 97/19087, US 5,631,210, WO 97/12885, WO 97/08164, ZA 9510980, WO 97/01550, WO 96/31507, WO 96/30368, WO 96/25412 и US 5,663,365. Поэтому способы для их получения представляют интерес. До сих пор в качестве способа получения низших 1-алкил-5-гидроксипиразолов известны следующие методы синтеза: 1. Получение, при котором гидролизуют 2 метил-1-(п-толуолсульфонил)-3-пиразолидон или 2-метил-1-ацетилпиразолидон (см. публикацию J. Prakt. Chem. 1971, 313, стр. 115-128 и J.Prakt. Chem. 1971, 313, стр. 1118-1124). 2. Вариант, при котором получают сложный алкиловый эфир 5-гидрокси-1-алкилпиразол-4-карбоновой кислоты посредством циклизации сложного диалкилового эфира алкоксиметиленмалоновой кислоты с низкими алкилгидразинами, потом к этому продукту реакции добавляют водный раствор минеральной кислоты и одновременно проводят гидролиз и декарбоксилирование (см. патенты JP 61257974,JP 60051175, JP 58174369, JP 58140073 и JP 58140074, а также US 4643757). 3. Синтез, при котором сложный этиловый эфир пропионовой кислоты подвергают взаимодействию с метилгидразином с получением 5 гидрокси-1-метилпиразола (см. Annalen 1965,686, стр. 134-144). 4. Синтез, при котором сложный эфир 3 гидразинопропионовой кислоты, получаемой присоединением гидразина к эфиру акриловой кислоты, подвергают взаимодействию с альдегидом с получением соответствующих гидразонов и потом циклизуют (см. JP 06166666, JP 61229852 и JP 61268659, также ЕР 240001). 5. Вариант синтеза, при котором термически расщепляют 5-гидрокси-1-метилпиразол-3 003753 2 карбоновую кислоту (см. Chem. Веr. 1976, 109,с. 261). 6. Вариант, при котором сложный эфир 3 алкоксиакриловой кислоты подвергают взаимодействию с метилгидразином, соответственно,этилгидразином с образованием 1-метил-5 гидроксипиразола, соответственно, 1-этил-5 гидроксипиразола (см. JP 189 271/86, ЕР-А-837 058). 7. Способ, при котором сложный эфир 2 галоакриловой кислоты подвергают взаимодействию с производными гидразина с получением 1-замещенных 3-гидроксипиразолов (см. US 5,663,365). При вышеприведенном варианте 1 синтеза процесс является многостадийным и сложным. Введение и удаление защитной группы очень сложно, означает дополнительные стадии и снижает выход. Возможность получения 2 является многостадийной, кроме того, наряду с 1-алкил-5 гидроксирпиразолами одновременно образуются региоизомеры целевых соединений, которые в сложном процессе должны отделяться от целевых соединений. К тому же синтез связан с плохим выходом углерода, так как применяется узел С 4, от которого под конец способа должен отщепляться один атом углерода. При варианте синтеза 3, который описывает только получение 1-метил-5-гидроксипиразола, обязательно применение сверхстехиометрических количеств метилгидразина,причем способ является неэкономичным. Образующийся побочно изомер 3-гидрокси-1 метилпиразола при очистке должен отделяться сложным методом от 1-метил-5-гидроксипиразола. Кроме того, этот способ является неэкономичным вследствие высокой цены на сложный эфир пропиоловой кислоты. При альтернативе 4 процесс получения многостадийный и сложный. Последняя стадия дорогого способа дает плохой выход и большое количество побочных продуктов. При синтезе 5 для термического отщепления требуется высокая температура, выход в 6% является очень низким. При синтезе 6, который относится к получению 1-метил-5-гидроксипиразола, применяется получаемый сложным и дорогостоящим методом сложный эфир 3-алкоксиакриловой кислоты. Получение сложного эфира 3-алкоксиакриловой кислоты осуществляется взаимодействием метанола с дорогостоящими сложными эфирами пропиоловой кислоты (см. TetrahedronLett. 1983, 24, 5209, J. Org. Chem. 1980, 45, 48,Chem. Ber. 1966, 99, 450, Chem. Lett. 1996, 9,727-728), взаимодействием дорого и сложно синтезируемых ,-дихлордиэтиловых эфиров со сложными эфирами бромуксусной кислоты(см. Zh. Org. Khim. 1986, 22, 738), взаимодействием сложных эфиров бромуксусной кислоты с триалкилформиатами (см. Bull. Soc. Chim.France 1983, N 1-2, 41-45) и отщеплением метанола от сложных эфиров 3,3 диалкоксипропионовой кислоты (см. DE 3701113) (получаемых взаимодействием дорогого сложного эфира пропиоловой кислоты с метанолом (см. J. Org. Chem. 1976, 41, 3765),взаимодействием сложных эфиров 3-N-ацетилN-алкил-3-метоксипропионовой кислоты с метанолом (J. Org. Chem. 1985, 50, 4157-4160, JP 60-156643), взимодействием сложных эфиров акриловой кислоты с алкиаминами и ангидридом уксусной килоты (см. J. Org. Chem. 1985,50, 4157-4160), взаимодействим кетена с триалкилортоформиатом (см. DK 158462), посредством катализированной палладием и одновременно медью реакции сложных эфиров акриловой кислоты с метанолом (см. DE 4100178. 8),взаимодействием трихлорацетилхлорида с винилэтиловым эфиром (см. Synthesis 1988, 4,274),взаимодействием-трихлор-метокси-бутен-2-она с метанолом (см. Synthesis 1988,4, 274) и взаимодействием натриевых солей сложных эфиров 3-гидроксиакриловой кислоты со спиртами (см. DB 3641605). Плохая доступность сложных эфиров 3-алкоксиакриловой кислоты делает синтез по варианту 6 неэкономичным. В патенте JP 189 271/86 описывается, кроме того, выделение 5-гидрокси-1 метилпиразола в качестве гидрохлорида, однако здесь не упоминается выделение и очистка свободного основания. Если попытаться применять условия реакции по JP 189 271/86 и выделять свободное основание, то получают только очень малый выход, который неэкономичен для промышленного получения гидроксипиразолов. Вариант синтеза по п.7 имеет тот недостаток, что по нему можно получать исключительно 3-гидроксипиразолы, а не 5-гидроксипиразолы. Таким образом эти методы синтеза не могут быть удовлетворительными по их экономичности и эффективности способами получения 1-замещенныx 5- и 3-гидроксипиразолов. Из уровня техники не известны способы,которые позволяют простой вариацией параметров получать 1-замещенные 5- , так и 3 гидроксипиразолы. Кроме того, из уровня техники не известны способы, которые могут исходить из простых исходных веществ, таких, как алкилвиниловый эфир для получения желаемых 1-замещенных 5 и 3-гидроксипиразолов. Задачей изобретения является разработка способа, при котором изменением параметров способа можно получать 1-замещенные 5 гидроксипиразолы и/или 3-гидроксипиразолы. Другой задачей настоящего изобретения является разработка способа получения 1 замещенных 5-гидроксипиразолов и/или 3-гидроксипиразолов из легко получаемых исходных компонентов, который не имеет вышеприведен 003753 4 ных недостатков известных до сих пор способов. Неожиданным образом эта задача решается способом получения 1-замещенных 5- и/или 3-гидроксипиразолов формул I и II где R1 означает C1-С 6 алкил, С 2-С 6 алкенил, С 2 С 6 алкинил,C3-С 6 циклоалкил или С 1 С 4 алкокси, причем эти группы могут быть замещены галогеном, C1-С 4 алкокси, фенокси,C1-С 6 алкоксикар-бонилом, C1-С 6 алкилтиокарбонилом или циклической системой с 3-14 атомами цикла, заключающийся в том, что сложный алкиловый эфир 3-алкоксиакриловой кислоты формулы III, где R2, R3 независимо друг от друга означают где R1 имеет вышеприведенное значение,а) с получением при значении рН, равном 6-11, 5-гидроксипиразолов формулы I,или б) с получением при значении рН, равном 11-14, 3-гидроксипиразолов формулы II. Кроме того, был разработан способ, который исходит из легко доступных алкилвиниловых эфиров, причем получают сложный алкиловый эфир 3-алкоксиакриловой кислоты формулы III таким образом, что в) алкилвиниловый эфир общей формулы с получением хлорангидридов формулы VII г) их переводят элиминированием хлорводорода в соответствующий хлорангидрид 3 алкоксиакриловой кислоты формулы VIII и д) его этерифицируют спиртом формулыIX где R3 имеет приведенное в п.1 формулы изобретения значение, в соответствующие сложные алкиловые эфиры 3-алкоксиакриловой кислоты формулы III. Неожиданным и новым при способе согласно настоящему изобретению является то,что подходящим выбором условий взаимодействия можно получать выборочно 5- или 3 гидроксипиразолы формулы I, соответственно II и что можно применять легкодоступные исходные соединения. Предпочтительные формы выполнения способа по настоящему изобретению вытекают из зависимых пунктов формулы и из нижеследующего описания. Стадия а). При взаимодействии сложного алкилового эфира 3-алкоксиакриловой кислоты формулы III с гидразинами формулы IV с получением 1 замещенных 5-гидроксипиразолов в общем поступают таким образом, что один из обоих реагентов подают в подходящий растворитель и добавляют второй реагент при температуре между -30 и 100 С. Значение рН добавкой основания держат на величине 7-11, прeдпочтительно на 8-11, особенно предпочтительно на 9-11. Подходящим основанием являются, например,гидроксиды щелочного и щелочно-земельного металла, такие как гидроксид натрия и гидроксид калия, а также трет.-амины. В качестве основания применяют предпочтительно гидроксиды щелочного и щелочноземельного металла, такие, как гидроксид натрия и гидроксид калия. Молярное соотношение сложного алкилового эфира 3-алкоксиакриловой кислоты формулы III к гидразидам формулы IV составляет от 1:1 до 1:10, предпочтительно, от 1:1 до 1:8. Это соотношение можно снижать добавкой основания от значения 1:10 на значение 1:1. Согласно предпочтительному варианту способа по изобретению берут растворитель и к нему прикапывают гидразин формулы IV и слoжный алкиловый эфир 3-алкоксиакриловой кислоты формулы III одновременно в течение от 10 мин до 10 ч, предпочтительно в течение 1-4 ч. Особое преимущество этой параллельной 6 дозировки заключается в том, что благодаря этому без необходимости добавки основания можно удерживать постоянным значение рН в течение приблизительно 10 ч. Соблюдение этого значения рН необходимо для региоселективности реакции. Например, при соблюдении этого значения рН, равном 10, могут быть получены соотношения региоизомеров соединений I: II более 300:1. Благоприятным является снижение температуры после определенного времени реакции и реакцию пополнять при соответственно более низкой температуре. Подходящими растворителями или разбавителями являются, например, вода, алифатические углеводороды, такие, как пентан, гексан,циклогексан и петролейный эфир, ароматические углеводороды, такие, как толуол, о-, м- и пксилол, галогенированные углеводороды, такие,как метиленхлорид, хлороформ и хлорбензол,спирты, такие, как метанол и этанол, а также эфиры, такие, как диэтиловый эфир, диизопропиловый эфир, трет.-бутилметиловый эфир, диоксан, анизол и тетрагидрофуран, и нитрилы,такие, как ацетонитрил и пропионитрил. Также могут применяться смеси приведенных растворителей. Предпочтительными растворителями являются, например, вода, такие спирты, как метанол и этанол, такие эфиры, как диэтиловый эфир,диизопропиловый эфир,трет.бутилметиловый эфир, диоксан, анизол, диэтиленгликольдиалкиловый эфир и тетрагидрофуран, а также их смеси. Гидразины формулы IV могут применяться как само вещество, так и в форме своих приобретаемых в торговле растворов. Стадия б). При взаимодействии сложного алкилового эфира 3-алкоксиакриловой кислоты формулы III с гидразинами IV с получением 1-замещенных 3-гидроксипиразолов формулы II работают таким образом, что гидразин IV подают в подходящий растворитель и при температуре от -30 дo 100 С, предпочтительно при 10-40 С, в течение времени от 10 мин до 10 ч, предпочтительно в течение 1-4 ч добавляют сложный алкиловый эфир 3-алкоксиакриловой кислоты VII. Значение рН при этом держат величиной между 11 и 14, предпочтительно 12-13, в особенности, при 12 добавкой основания. Установкой рН на приведенное последним значение удается получение 1 -замещенных 3-гидроксипиразолов формулы II с высокой региоселективностью. Подходящими основаниями являются гидроксиды щелочных и щелочно-земельных металлов, такие, как гидроксид натрия и калия и трет.амины. Предпочтительными основаниями являются гидроксиды щелочных и щелочноземельных металлов. Подходящими растворителями являются приведенные для стадии а) растворители. 7 Стадия в): Исходным пунктом общего способа по настоящему изобретению являются алкивиниловые эфиры формулы V, которые сначала подвергаются взаимодействию при температуре от-78 до 100 С, предпочтительно от -10 до 80 С, в особенности от 20 до 60 С, с хлорангидридом формулы VIa, VIb или VIc, с получением соответствующего хлорангидрида формулы VII. Взаимодействие можно осуществлять без применения растворителей, соответственно,разбавителей, если реагенты при температуре взаимодействия являются жидкими. Однако,имеется также возможность проведения реакции взаимодействия в апротонном растворителе или разбавителе. Подходящими растворителями или разбавителями являются алифатические углеводороды, такие как пентан, гексан, циклогексан и петролейный эфир, ароматические углеводороды, такие, как толуол, о-, м- и п-ксилол, галогенированные углеводороды, такие, как метиленхлорид, хлороформ и хлорбензол, а также эфиры, такие как диэтиловый эфир, диизопропиловый эфир, трет.-бутилметиловый эфир, диоксан,анизол и тетрагидрофуран, и нитрилы, такие,как ацетонитрил и пропионитрил. Могут также применяться смеси приведенных растворителей. Особенно предпочтительно реакцию взаимодействия проводят без растворителя или же в таких ароматических углеводородах, как толуол. Реагенты формул V и VI в общем подвергают взаимодействию в соотношении от 0,1:1 до 1:1 моль V/VIa, VIb, соответственно, VIc, предпочтительно от 0,2:1 до 0,8:1 моль V/VIa, VIb,соответственно, VIc, в особенности, от 0,4:1 до 0,6:1 моль V/VIa, VIb, соответственно, VIc. В связи с тем, что галогениды VI, а также образовавшийся хлорангидрид VII чувствительны к влажности, рекомендуется проводить реакцию взаимодействия с исключением воды в атмосфере защитного газа (азота или другого инертного газа). В случае взаимодействия соединения V с соединением VIb, соответственно, VIc может давать преимущество - ускорение реакции добавкой каталитического количества вторичного амина, такого, как триэтиламин и пиридин. Стадия г). Полученный таким образом хлорангидридVII отщепляет при температуре от 30 до 80 С хлористый водород (НСl), при этом образуется соответствующий 3-алкоксиакрилхлорангидридVIII. Для этой стадии превращения может давть преимущество удаление образовавшегося хлористого водорода из реакционной смеси, например, легким понижением давления или посредством пропускания через реакционную смесь или через реакционную емкость инертного газа. 8 Избыточный хлорид формулы VIa, VIb,соответственно, VIc может рециркулироваться обратно в синтез и в любом случае должен отделяться для обеспечения выделения чистого целевого продукта. Это действительно также и для возможно примененных катализаторов. Полученные таким образом сырые 3 алкоксиакрилхлорангидриды формулы VIII могут выделяться дистилляцией или ректификации в чистой форме. Они могут быть также непосредственно,без дальнейшей очистки, переведены в соответствующие сложные алкиловые эфиры 3 алкоксиакриловой кислоты формулы III. Стадия д). При этерификации хорангидридов формулы VIII поступают таким образом, что к хлорангидриду VIII прикапывают спирт IX при температуре от -20 до 80 С, предпочтительно, от 0 до 50 С в течение 0,5-8 ч, предпочтительно в течение 1-6 ч и полученный сложный алкиловый эфир 3-алкоксиакриловой кислоты III очищают постоянной или прерывистой дистилляцией или ректификацией. Также имеется возможность проведения реакции взаимодействия в апротонном растворителе или разбавителе. Подходящими растворителями или разбавителями являются алифатические углеводороды, такие как пентан, гексан, циклогексан и петролейный эфир, ароматические углеводороды, такие как толуол, о-, м- и п-ксилол, галогенированные углеводороды, такие как метиленхлорид, хлороформ и хлорбензол, спирты, такие как метанол и этанол, а также эфиры, такие как диэтиловый эфир, диизопропиловый эфир, трет.-бутилметиловый эфир, диоксан, анизол и тетрагидрофуран, и нитрилы,такие, как ацетонитрил и пропионитрил. Также могут применяться смеси приведенных растворителей. Рекомендуется проводить реакцию в присутствии связывающих хлорводород реагентов,например, таких, как пиридин. Само собой разумеется такие реагенты можно применять в качестве растворителей. При учете цели применения 1-замещенных 5- и/или 3-гидроксипиразолов общих формул I иII в качестве заместителей могут служить следующие радикалы:C1-С 4 алкокси, как например, метокси,этокси, н-пропокси, 1-метилэтокси, н-бутокси,1-метилпропокси, 2-метилпропокси и 1,1 диметилэтокси,в особенности, C1-С 3 алкокси, как например, метокси, этокси, и пропокси; причем эти группы необязательно могут быть замещены одним, максимально пятью атомами галогена, такими, как фтор, хлор, бром и йод, предпочтительно фтор и хлор, группами С 1-С 4 алкокси, фенокси, C1-С 6 алкоксикарбонил,C1-С 6 алкилтиокарбонил или циклической системой с 3-14 кольцевыми атомами, причем заместители имеют следующие значения:C1-С 4 галогеналкил означает вышеприведенный С 1-С 4 алкильный остаток, который может быть частично или полностью замещен фтором, хлором, бромом и/или йодом, а именно,например, хлорметил, дихлорметил, трихлорметил, фторметил, дифторметил, трифторметил,хлорфторметил, дихлорфторметил, хлордифторметил, 2-фторэтил, 2-хлорэтил, 2-бромметил,2-йодэтил, 2,2-дифторэтил, 2,2,2-трифторэтил,2-хлор-2-фторэтил, 2-хлор-2,2-дифторэтил, 2,2 дихлор-2-фторэтил, 2,2,2-трихлорэтил, пентафторэтил, 2-фторпропил, 3-фторпропил, 2,2 дифторпропил, 2,3-дифторпропил, 2-хлорпропил, 3-хлорпропил, 2,3-дихлорпропил, 2-бромпропил, 3-бромпропил, 3,3,3-трифторпропил,3,3,3-трихлорпропил,2,2,3,3,3-пентафторпропил, гептафторпропил, 1-(фторметил)-2-фторэтил, 1-(хлорметил)-2-хлорэтил, 1-(бромметил)2-бромметил, 4-фторбутил, 4-хлорбутил, 4 бромбутил и нонафторбутил; Циклическая система с 3-14 атомами означает, например, следующие группы: С 3-С 14 циклоалкил, C3-С 14 циклоалкенил, ароматические группы, такие как фенил, нафтил, а также их частично гидрированные производные. Далее циклические системы могут представлять собой гетероциклические системы, в которых один,два или три атома углерода могут быть заменены гетероатомами, такими, как, например, О, N,S. В принципе, циклические системы могут быть гидрированы ароматически частично или полностью. Циклические системы могут быть замещены любым образом. В качестве заместителей пригодны, например, C1-С 6 алкил, C1 С 4 галогеналкил, C1-С 4 алкокси, галоген, циано,нитро, гидроксил, тионил, сульфоксил, сульфонил,С 1-С 4 алкилсульфонил,амино,С 1 С 4 алкиламино и ди-С 1-С 4 алкиламино. Предпочтение отдается циклическим системам из группы,включающейC1 С 6 циклоалкил, фенил, от пяти до шестичленный, гетероциклический, насыщенный или ненасыщенный остаток, содержащий от одного до трех гетероатомов, выбранных из группы,включающей О, N и S, которые могут быть замещены приведенным выше образом. Особенно предпочтительны C1-С 6 циклоалкил и фенил, которые могут быть замещены приведенным выше образом. В особой степени предпочтение отдается такой циклической системе, как фенил, который может быть замещен приведенным выше образом.R2, R3 означают независимо друг от другаC1-С 6 алкил, приведенный выше, или C3 С 6 циклоалкил, предпочтительно C1-С 6 алкил. Примеры Пример 1. Хлорангидрид 3-этоксиакриловой кислоты. В раствор из 72 г (1 моль) этилвинилового эфира в 100 г толуола вводят 110 г (1,1 моль) фосгена при 35 С в течение 1,5 ч. После этого реакционную смесь перемешивают в течение 4 ч при 60 С. Во время всего опыта фосген и этилвиниловый эфир реконденсируют в реакционную смесь с помощью охлаждения сухим льдом с температурой -78 С. После этого из раствора удаляют фосген отгонкой легких фракций при комнатной температуре и дистилляцией отгоняют растворитель. После дистилляции в вакууме при 36 С/0,4 мбар получают 88 г (66%) целевого продукта. Пример 2. Хлорангидрид 3-изобутоксиакриловой кислоты. 100 г (1 моль) изобутилвинилового эфира подают в 2-х- литровую мешалку и нагревают до 50-55 С. После этого вводят 1024 г (10,4 моль) фосгена в течение 21 ч и 900 г (9 моль) изобутилвинилового эфира прибавляют по каплям в течение 19 ч. Еще через 0,5 ч реакционную смесь нагревают при отгонке легких фракций азотом до 80 С, чтобы отщепить хлорводород. После этого отгоняют дистилляцией низкокипящую фракцию с помощью колонны Вигро в 15 см и остаток подвергают газохроматографическому анализу. Получают 1551 г (80%) сырого хлорангидрида изобутоксиакриловой кислоты(рассчит. 100%). Пример 3. Хлорангидрид 3-циклогексилоксиакриловой кислоты. В мешалке с аппаратурой для -78 С-го охлаждения конденсируют 50 г (0,5 моль) фосгена. После этого в течение 3 ч добавляют по каплям 50,5 г (0,4 моль) циклогексилвинилового эфира при 20 С. Затем реакционную смесь перемешивают в течение 5 ч при 50 С. Избыточный фосген отгоняют вводом азота и сырой продукт дистиллируют. При 110 С/2,5 мбар получают 66,4 г (88%) целевого продукта. Пример 4. Сложный изобутиловый эфир изобутоксиакриловой кислоты. В мешалку вместимостью 500 мл подают 100 г (1,0 моль) изобутилвинилового эфира и нагревают до 50-55 С. После этого в реакционную смесь водят 113 г (1,15 моль) фосгена в течение 11 ч. Через 1,5 ч реакции из реакционной смеет при 50-55 С отгоняют фосген вводом азота. Затем реакционную смесь охлаждают до комнатной температуры и прикапывают 60,7 г(0,82 ммоль) изобутанола. После окончания подачи изобутанола полученную реакционную смесь ректифицируют. Получают 150,4 г (75%) сложного изобутилового эфира 3-изобутокиакриловой кислоты с Т.кип. 97 С при 2,5 мбар. 12 Пример 5. 5-гидрокси-1-метилпиразол из сложного метилового эфира 3-метоксиакриловой кислоты и монометилгидразина(0,808 моль) 35%-го водного монометилгидразина и 47,82 г (0,404 моль) сложного метилового эфира 3-метоксиакриловой кислоты в течение 25 мин. После перемешивания в течение 2 ч при 25 С реакционную смесь подвергают газовой хроматографии. Выход составляет 95 % при конверсии в 100% (в пересчете на сложный метиловый эфир 3-метоксиакриловой кислоты). Соотношение изомеров: (5-гидроксиизомер: 3 гидроксиизомер) 200:1. Пример 6. 5-гидрокси-1-метилпиразол из сложного бутилового эфира 3-изобутоксиакриловой кислоты и монометилгидразина (35%). В реакторе вместимостью в 0,75 л к 202 г метанола одновременно подают при 25 С 287,5 г (2,18 моль) 35%-го водного монометилгидразина и 175,2 г (0,875 моль) сложного изобутилового эфира 3-изобутоксиакриловой кислоты в течение 1, 5 ч. Через 6,75 ч перемешивания при 25 С реакционную смесь подвергают газохроматографичесому анализу. Выход составляет 88% при 98% конверсии (в пересчете на сложный бутиловый эфир изобутоксиакриловой кислоты),соотношение изомеров:(5 гидроксиизомер: 3-гидроксиизомер) 300:1). Пример 7. 3-гидрокси-1-метилпиразол из сложного метилового эфира 3-метоксиакриловой кислоты и монометилгидразина(35%). В колбу вместимостью 250 мл подают 70 г метанола и 60,5 г (0,46 моль) 35%-го водного монометилгидразина при 25 С. В течение 25 мин при той же температуре прибавляют 47,8 г(0,40 моль) сложного метилового эфира 3 метоксиакриловой кислоты. Посредством параллельной подачи 17%-го водного раствораNaOH устанавливают значение рН реакционной смеси во время добавки сложного метилового эфира метоксиакриловой кислоты и во время последующего перемешивания в течение 6 ч на значение 12. В этот промежуток времени расходуют 97,5 г раствора NaOH. Выход составляет 75% при 100% конверсии. Соотношение изомеров: (3-гидроксиизомер: 5-гидроксиизомер) 15:1. Пример 8. 1-этоксикарбонилметил-5 гидроксипиразол из сложного метилового эфира 3-метоксиакриловой кислоты и гидрохлорида сложного этилового эфира гидразинуксусной кислоты. В круглую колбу вместимостью 2 л при 25 С подают 85,5 г (0,55 моль) гидрохлорида сложного этилового эфира гидразинуксусной кислоты в 770 мл этанола. В течение 1,25 ч при 60-65 С добавляют 63,8 г (0,55 моль) сложного 13 метилового эфира 3-метоксиакриловой кислоты. После этого реакционную смесь нагревают в течение 2 ч на температуру кипения с обратным холодильником и затем устанавливают раствором метанол Na-метилата на значение рН 5. Затем реакционную смесь подвергают газовому хроматографическому анализу. Выход составляет 85% при конверсии в 100%. Согласно вышеприведенным способам получают следующие соединения. где R1 означает C1-С 6 алкил, C2-С 6 алкенил, C2 С 6 алкинил, C3-С 6 циклоалкил или C1-С 4 алкокси,причем эти группы могут быть замещены галогеном, C1-С 4 алкокси, фенокси, C1-С 6 алкоксикарбонилом, C1-С 6 алкилтиокарбонилом или циклической системой с 3-14 атомами цикла,отличающийся тем, что в) алкилвиниловый эфир общей формулы с получением хлорангидридов формулы VII г) переводят элиминированием хлорводорода в соответствующий хлорангидрид 3-алкоксиакриловой кислоты формулы VIII и д) его этерифицируют спиртом формулы Полученные способом по изобретению 1 замещенные 5- или 3-гидроксипиразолы являются ценными продуктами для получения, например, таких средств защиты растений, как гербициды. Известными из WO 96/26206 гербицидами являются, например, следующие:IX где R3 означает C1-С 6 алкил или C3-С 6 циклоалкил, в соответствующий сложный алкиловый эфир 3-алкоксиакриловой кислоты формулы III,этот сложный алкиловый эфир 3-алкоксиакриловой кислоты формулы III где R1 имеет вышеприведенное значение,а) с получением при значении рН, равном 6-11, 5-гидроксипиразолов формулы I или б) с получением при значении рН, равном 11-14, 3-гидроксипиразолов формулы II. 2. Способ по п.1, отличающийся тем, что взаимодействие на стадии а) проводят при температуре от -30 до 100 С. 3. Способ по п.1, отличающийся тем, что взаимодействие проводят в присутствии основания. 4. Способ по п.1, отличающийся тем, что в качестве основания применяют гидроксиды щелочного металла,гидроксиды щелочноземельного металла или трет.-амины. 5. Способ по п.2, отличающийся тем, что берут растворитель и сложный алкиловый эфир 3-алоксиакриловой кислоты III и гидразин IV дозируют одновременно в растворитель. 6. Способ по п.5, отличающийся тем, что в качестве растворителя применяют воду, спирты,эфиры или их смеси. 16 7. Способ по п.1, отличающийся тем, что взаимодействие на стадии б) проводят при температуре от -30 до 100 С. 8. Способ по п.7, отличающийся тем, что реакцию взаимодействия проводят в присутствии основания. 9. Способ по п.8, отличающийся тем, что в качестве основания применяют гидроксид щелочного металла,гидроксид щелочноземельного металла, трет.-амины или их смеси. 10. Способ по п.1, отличающийся тем, что реакцию взаимодействия на стадии в) проводят при температуре от -78 до 100 С. 11. Способ по п.1, отличающийся тем, что алкилвиниловый эфир V подвергают взаимодействию с фосгеном VIa, дифосгеном VIb или трифосгеном VIc в молярном отношении от 0,1:1 до 1:1. 12. Способ по п.1, отличающийся тем, что реакцию взаимодействия на стадии г) проводят при температуре от 30 до 80 С. 13. Способ по п.1, отличающийся тем, что этерифицирование на стадии д) проводят при температуре от -20 до 80 С.
МПК / Метки
МПК: C07D 231/20
Метки: способ, получения, 3-гидроксипиразолов, 1-замещенных
Код ссылки
<a href="https://eas.patents.su/9-3753-sposob-polucheniya-1-zameshhennyh-5-ili-3-gidroksipirazolov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 1-замещенных 5- или 3-гидроксипиразолов</a>
Предыдущий патент: Способ выделения гидроксиметилтиобутановой кислоты
Следующий патент: 4-[5-метил-3-фенилизоксазол-4-ил] бензолсульфонамид
Случайный патент: Системы для введения лекарственного средства пациентам с ревматоидным артритом













