Фитазы из микроорганизма monascus anka, способ их получения и корм для животных, содержащий указанные фитазы
Номер патента: 3632
Опубликовано: 28.08.2003
Авторы: Ямамура Таданори, Яно Кейити, Нагасима Тадаси, Като Йоко, Аназава Хидехару, Куроянаги Сатоси, Сугимото Сейдзи
Формула / Реферат
1. Фитаза, полученная из микроорганизма Monascus anka, обладающая следующими свойствами:
а) значение константы Михаэлиса (Км) от 10 до 110 мкМ при использовании фитиновой кислоты в качестве субстрата;
б) субстратная специфичность: п-нитрофенилфосфат, фитиновая кислота, D-глюкозо-6-фосфат, фруктозо-6-фосфат, D-миоинозит-2-фосфат, D-миоинозит-1-фосфат, D-миоинозит-1,4-дифосфат и аденозинтрифосфат;
в) оптимальное значение pH 2,5-6,0;
г) pH-стабильность: устойчива в диапазоне pH 2,0-8,0;
д) оптимальная температура 45-50шC;
е) термостойкость: устойчива до 35-60шC;
ж) молекулярная масса приблизительно 80-140 кДа (определена методом гель-фильтрации);
з) изоэлектрическая точка (pI) 4,8-5,7 (определена методом хроматофокусировки).
2. Фитаза, полученная из микроорганизма Monascus anka, обладающая следующими физико-химическими свойствами:
а) Км 27 мкМ при использовании фитиновой кислоты в качестве субстрата;
б) субстратная специфичность: действует на фитиновую кислоту, п-нитрофенилфосфат, D-глюкозо-6-фосфат, фруктозо-6-фосфат, D-миоинозит-2-фосфат, D-миоинозит-1-фосфат, D-миоинозит-1,4-дифосфат и аденозинтрифосфат в качестве субстрата;
в) оптимальное значение pH 5,5;
г) pH-стабильность: устойчива в диапазоне pH 5,5-6,5;
д) оптимальная температура 50шC;
е) термостойкость: устойчива вплоть до 35шC;
ж) молекулярная масса приблизительно от 80 до 100 кДа (определена методом гель-фильтрации) и
з) изоэлектрическая точка pI 5,7 (определена методом хроматофокусировки).
3. Фитаза, полученная из микроорганизма Monascus anka, обладающая следующими физико-химическими свойствами:
а) Км 20 мкМ при использовании фитиновой кислоты в качестве субстрата;
б) субстратная специфичность: действует на фитиновую кислоту, п-нитрофенилфосфат, D-глюкозо-6-фосфат, фруктозо-6-фосфат, D-миоинозит-2-фосфат, D-миоинозит-1-фосфат, D-миоинозит-1,4-дифосфат и аденозинтрифосфат в качестве субстрата;
в) оптимальное значение pH 6,0;
г) pH-стабильность: устойчива в диапазоне pH 6,0 до 7,0;
д) оптимальная температура 50шC;
е) термостойкость: устойчива вплоть до 50шC;
ж) молекулярная масса приблизительно 120 кДа (определена методом гель-фильтрации) и
з) изоэлектрическая точка рI 4,8 (определена методом хроматофокусировки).
4. Фитаза, полученная из микроорганизма Monascus anka, обладающая следующими физико-химическими свойствами:
а) Км 107 мкМ при использовании фитиновой кислоты в качестве субстрата;
б) субстратная специфичность: действует на фитиновую кислоту, п-нитрофенилфосфат, D-глюкозо-6-фосфат, фруктозо-6-фосфат, D-миоинозит-2-фосфат, D-миоинозит-1-фосфат, D-миоинозит-1,4-дифосфат и аденозинтрифосфат в качестве субстрата;
в) оптимальное значение pH 2,5;
г) pH-стабильность: устойчива в диапазоне pH 2,0 до 8,0;
д) оптимальная температура 45шC;
е) термостойкость: устойчива вплоть до 60шC;
ж) молекулярная масса приблизительно 140 кДа (определена методом гель-фильтрации);
з) изоэлектрическая точка pI 5,2 (определена методом хроматофокусировки);
и) N-концевая аминокислотная последовательность: показана в SEQ ID NO: 1.
5. Фитаза по п.1, где микроорганизм Monascus anka представлен штаммом IFO 30873.
6. Способ получения фитазы, охарактеризованной в любом из пп.1-5, который включает культивирование микроорганизма Monascus anka, обладающего способностью продуцировать и накапливать фитазу до тех пор, пока фитаза образуется и накапливается, и выделение фитазы из культуральной среды или клеток микроорганизма.
7. Способ по п.6, где микроорганизм Monascus anka представлен штаммом IFO 30873.
8. Корм для животных, содержащий фитазу, охарактеризованную в любом из пп.1-5.
Текст
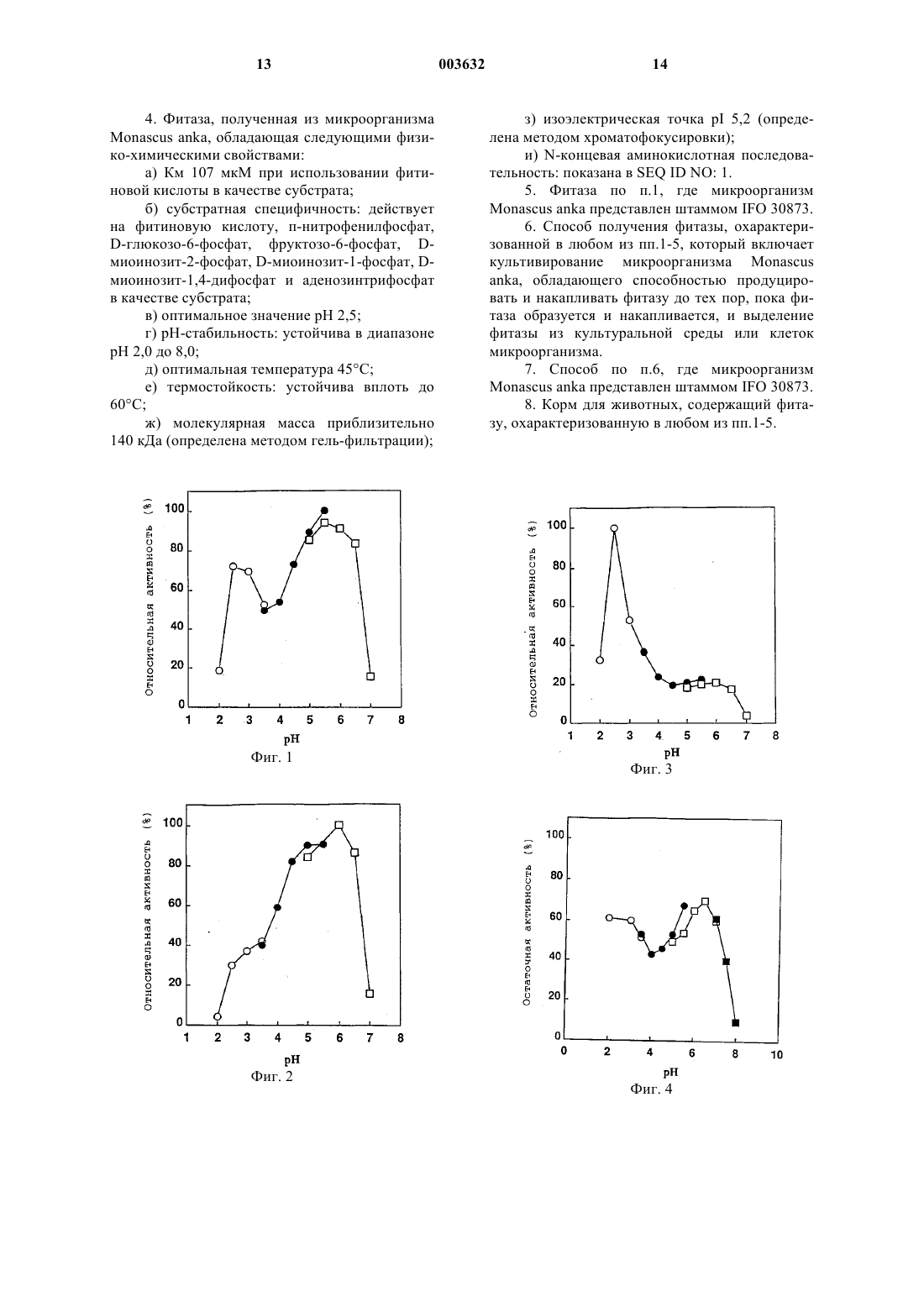
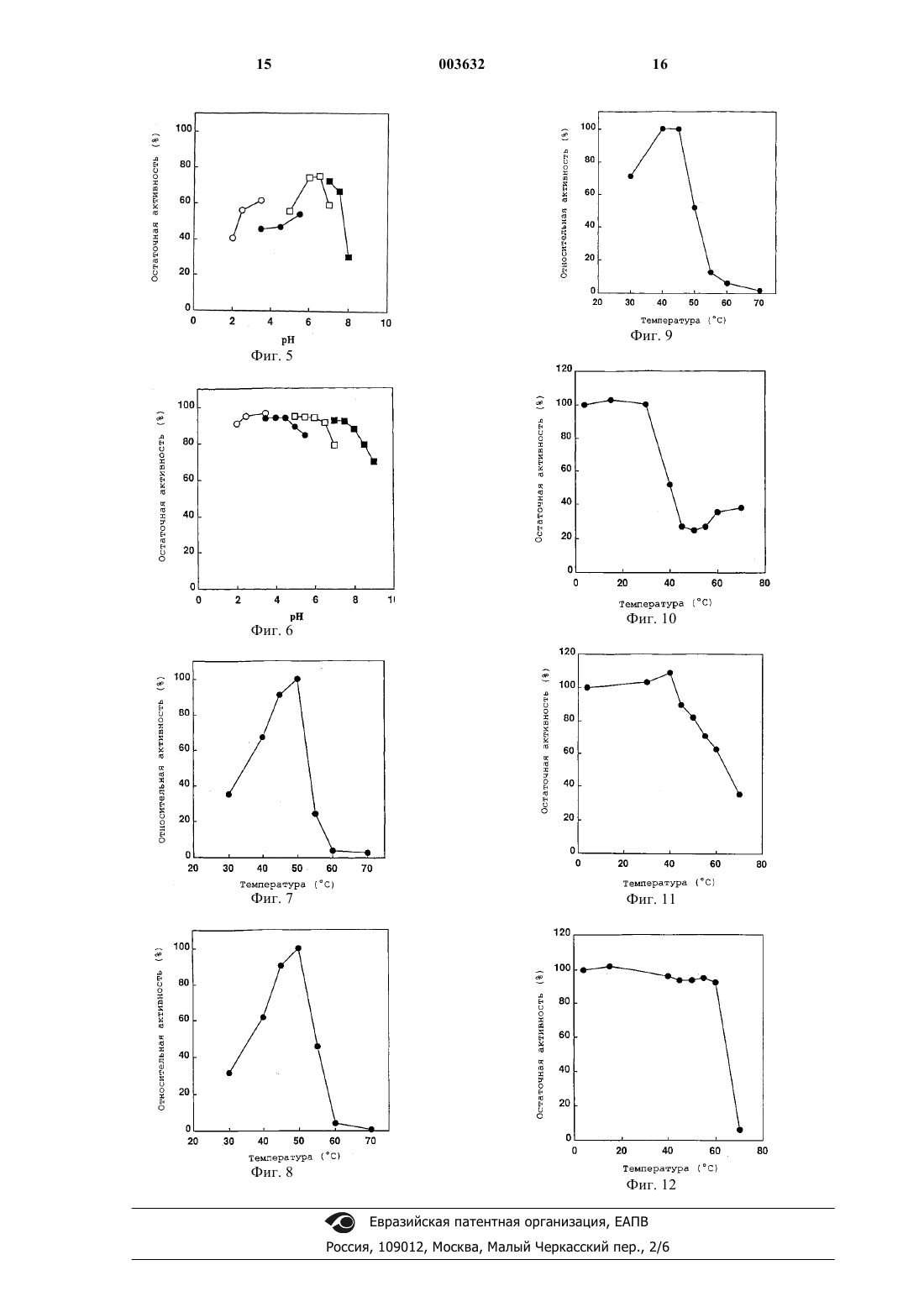
1 Область техники Настоящее изобретение относится к недорогим фитазам с низкими значениями константы Михаэлиса (сокращенно обозначаемой здесь далее как Км) для фитиновой кислоты, которые разлагают фитиновую кислоту как антитрофический фактор, содержащийся в корме, повышая тем самым питательную ценность корма и одновременно обеспечивая эффективную утилизацию фосфата, выделяющегося при указанном разложении. Предпосылки к созданию изобретения Фосфор является незаменимым элементом для каждого организма. Фосфор входит в состав растительного корма, используемого при разведении домашних животных, и от 50 до 70% фосфора присутствует в виде фитиновой кислоты. Фитиновая кислота, присутствующая в больших количествах в семенах растений, является главным запасаемым источником фосфата. Однако фитиновая кислота выводится из организма без переваривания и всасывания пищеварительных органах животных с единственным отделом желудка, таких как свиньи, куры и т.д.,так что содержащийся в ней фосфор совсем не утилизируется, хотя она является главным запасаемым источником фосфата. Соответственно,неорганический фосфат добавляют к корму для животных с единственным отделом желудка с целью ускорения роста. Однако добавление фосфата к корму приводит к повышению количества фосфора в фекалиях. В последние годы,поскольку производство домашних животных увеличивается, количество фекалий домашних животных возрастает, создавая проблему для окружающей среды во всем мире. В частности,фосфор, содержащийся в фекалиях, указывается в качестве причины явления эвтрофикации озер и болот, и количество выделяемого с экскрементами фосфора приближается к тому, что требует регулирования, и возникает необходимость заниматься этим. Кроме того, фитиновая кислота образует хелаты с двухвалентными металлами, важными как питательные источники, такими как магний,кальций, цинк, железо и т.д., делая их трудно усваиваемыми животными, в результате чего снижается питательная ценность корма. Поэтому фитиновую кислоту считают антитрофическим фактором. Исходя из указанного выше, делаются попытки усовершенствований питательной ценности корма путем обработки корма ферментом для гидролиза фитиновой кислоты до инозита и неорганического фосфата, что позволяет фитиновой кислоте высвобождать фосфат для замещения им обычно добавляемого фосфата, посредством чего количество фосфора в фекалиях снижается, и фитиновая кислота как антитрофический фактор разлагается [Патент США 3297548 (1967), J. Nutrition 101, 1289-1294(1971)]. Известные микроорганизмы для проду 003632ficuum и Aspergillus awamori. Что касается фитазы, выделенной из Aspergillus ficuum, ее очистка и биохимические свойства описаны в PreparativeBiochem., 18, 443-458 (1986) и ее нуклеотидная аминокислотная последовательность описаны вGene, 127, 87-94 (1993). Что касается фитазы,выделенной из Aspergillus awamori, ее нуклеотидная последовательность и аминокислотная последовательность описаны в Gene, 133, 55-62(1993). Чтобы продемонстрировать способность,которой обладает фермент, необходимо, чтобы концентрация его субстрата была выше, чем константа Михаэлиса (Км), и в случае ферментов, имеющих такую же максимальную скорость реакции (Vmax), фермент, имеющий более низкое значение Км, не снижает скорость реакции даже при более низкой концентрации субстрата, по сравнению с ферментом, имеющим более высокую величину Км. То есть, фермент, имеющий более низкое значение Км, может обеспечивать достаточную скорость разложения даже при более низкой концентрации субстрата, и количество неразложившегося субстрата, может быть сведено к минимуму по сравнению с ферментом, имеющим более высокое значение Км. Константы Михаэлиса (Км) известных фитаз, выделенных из нитчатых грибов, составляют 250 мкМ для Aspergillus ficuum (WO 91/05053) и 330 мкМ Aspergillus oryzae (Biosci.Biotech. Biochem., 57, 1364-1365 (1993. С одной стороны, кислотные фосфатазы выделяют из различных микроорганизмов и сообщают их свойства, и, например, 2 кислые фосфатазы, выделенные из Aspergillus ficuum,очищают и исследуют их свойства [Prep. Biochem., 18, 37-65 (1988)]. Однако указанные кислые фосфатазы не могут утилизировать фитиновую кислоту в качестве субстрата, так что их применение в целях усовершенствования питательной ценности корма, как указано выше, невозможно. При указанных выше обстоятельствах существует потребность в фитазе, которая разлагает фитиновую кислоту как антитрофический фактор, содержащийся в корме, повышая тем самым питательную ценность корма и одновременно делая возможным эффективную утилизацию фосфата, высвобождающегося при указанном разложении. Описание изобретения Соответственно, цель данного изобретения заключается в обеспечении фитаз, имеющие низкими значениями Км для фитиновой кислоты, и способ получения указанных фитаз. 3 В результате широкого исследования для решения проблем, описанных выше, авторы настоящего изобретения обнаружили в микроорганизмах, принадлежащих к роду Monascus,новые фитазы, имеющие значения Км от 10 до 110 мкМ, когда в качестве субстрата применяли фитиновую кислоту, и они описали их свойства и разработали способ получения указанных фитаз, чтобы завершить создание данного изобретения. То есть, данное изобретение относится к новым фитазам, имеющим значения Км от 10 до 110 мкМ, и способу получения указанных фитаз. Конкретные примеры новых фитаз по изобретению включают 3 фитазы, имеющие следующие физико-химические свойства: 1. Фитаза I: 1) Км: 27 мкМ, когда в качестве субстрата применяют фитиновую кислоту; 2) оптимальная рН: 5,5; 3) рН-стабильность: устойчива в диапазоне рН 5,5 до 6,5; 4) оптимальная температура: 50 С; 5) термостойкость: устойчивая вплоть до 35 С; 6) субстратная специфичность: действует на фитиновую кислоту, п-нитрофенилфосфат,D-глюкоза-6-фосфат, фруктоза-6-фосфат, Dмиоинозит-2-фосфат, D-миоинозит-1-фосфат, Dмиоинозит-1,4-дифосфат и аденозинтрифосфат в качестве субстрата; 7) молекулярная масса: приблизительно от 80 до 100 кДа (метод гель-фильтрации); и 8) изоэлектрическая точка: рI 5,7 (метод хроматофокусировки) . 2. Фитаза II: 1) Км: 20 мкМ, когда в качестве субстрата применяют фитиновую кислоту; 2) оптимальная рН: 6,0; 3) рН-стабильность: устойчива в диапазоне рН 6,0 до 7,0; 4) оптимальная температура: 50 С; 5) термостойкость: устойчивая вплоть до 50 С; 6) субстратная специфичность: действует на фитиновую кислоту, п-нитрофенилфосфат,D-глюкоза-6-фосфат, фруктоза-6-фосфат, Dмиоинозит-2-фосфат, D-миоинозит-1-фосфат, Dмиоинозит-1,4-дифосфат и аденозинтрифосфат в качестве субстрата; 7) молекулярная масса: приблизительно 120 кДа (метод гель-фильтрации) ; и 8) изоэлектрическая точка: рI 4,8 (метод хроматофокусировки). 3. Фитаза III: 1) Км: 107 мкМ, когда в качестве субстрата применяют фитиновую кислоту; 2) оптимальная рН: 2,5; 3) рН-стабильность: устойчива в диапазоне рН 2,0 до 8,0; 4) оптимальная температура: 45 С; 4 5) термостойкость: устойчивая вплоть до 60 С; 6) субстратная специфичность: действует на фитиновую кислоту, п-нитрофенилфосфат,D-глюкоза-6-фосфат, фруктоза-6-фосфат, Dмиоинозит-2-фосфат, D-миоинозит-1-фосфат, Dмиоинозит-1,4-дифосфат и аденозинтрифосфат в качестве субстрата; 7) молекулярная масса: приблизительно 140 кДа (метод гель-фильтрации); 8) изоэлектрическая точка: рI 5,2 (метод хроматофокусировки) ; и 9) N-концевая аминокислотная последовательность: показана в SEQ ID NO:1. Микроорганизмами, применяемыми в настоящем изобретении, могут быть любые микроорганизмы, продуцирующие новые фитазы,имеющие значения Км от 10 до 110 мкМ, когда в качестве субстрата применяют фитиновую кислоту и примерами являются микроорганизмы, принадлежащие к роду Monascus. Конкретно, может быть указан Monascus anka IFO 30873. Кроме того, животные клетки, обладающие способностью продуцировать новые фитазы, имеющие значения Км от 10 до 110 мкМ,когда в качестве субстрата применяют фитиновую кислоту, могут быть также применимы в данном изобретении. Микроорганизм, обладающий способностью продуцировать новую фитазу, культивируют в соответствии с традиционной методикой культивирования до тех пор, пока не образуется и не накопится новая фитаза, и новую фитазу выделяют из культуры, посредством чего может быть получена новая фитаза. Здесь далее, микроорганизм или мутант, применяемый для получения новой фитазы, называют организмом,продуцирующим новую фитазу. Если организм, продуцирующий новую фитазу, является прокариотическим, таким какEscherichia coli, или эукариотическим, таким как нитчатый гриб, дрожжевой гриб и т.д., средой для культивирования указанного микроорганизма может быть натуральная или синтетическая среда, при условии, что такая среда содержит источник углерода, источник азота, неорганические соли и т.д., которые могут ассимилироваться микроорганизмом, и в которой микроорганизм может быть эффективно культивирован. Источник углерода может быть любым способным ассимилироваться микроорганизмом и включает глюкозу, фруктозу, сахарозу, мелассы, содержащие такой сахар, углеводороды,такие как крахмал, гидролизаты крахмала и т.д.,органические кислоты, такие как уксусная кислота, пропионовая кислота и т.д., и спирты,такие как этанол, пропанол и т.д. Источник азота включает аммиак, аммониевые соли различных неорганических и органических кислот, таких как хлорид аммония,сульфат аммония, ацетат аммония, фосфат ам 5 мония и т.д., и другие азотистые соединения, а также пептон, мясной экстракт, дрожжевой экстракт, экстракт кукурузы, гидролизаты казеина,соевый жмых, гидролизаты соевого жмыха и широкое разнообразие микроорганизмов, получаемых путем ферментации, и переваренные материалы. Неорганические вещества включают дигидрофосфат калия, моногидрофосфат калия,фосфат магния, сульфат магния, хлорид натрия,сульфат железа (II), сульфат марганца, сульфат меди, карбонат кальция и т.д. Далее, среда, содержащая пшеничные отруби, рисовые отруби и т.д. в качестве источников углерода, азота и неорганических веществ,обогащенная подходящими солями, может быть применена в качестве среды для культивирования нитчатых грибов. Культивирование проводят в аэробных условиях во встряхиваемой культуре или погруженной культуре с постоянным перемешиванием при аэрации. Температура культуры, предпочтительно, составляет от 15 до 40 С, и период культивирования обычно составляет от 16 до 96 ч. Во время культивирования значение рН поддерживают в диапазоне от 3,0 до 9,0. Установление значения рН среды осуществляют неорганической или органической кислотой, раствором щелочи, мочевиной, карбонатом кальция или аммиаком. Во время культивирования к среде могут быть добавлены антибиотики, такие как ампициллин, тетрациклин и т.д. Если культивированию подлежат нитчатые грибы в среде, содержащей твердые компоненты, такие как пшеничные отруби и т.д., нитчатые грибы засевают, смешивают в достаточной степени с твердыми компонентами и распределяют в виде тонкого слоя на множестве лотков из алюминия или нержавеющей стали в камере для выращивания и культивируют при регулируемых условиях температуры, влажности и вентиляции. Конкретно, грибы подвергают стационарному культивированию в культуральной камере при влажности 100% при 25-35 С в течение 3-10 суток. Если организм, продуцирующий новую фитазу, представляет собой животные клетки,среда для культивирования животных клеток включает обычно применяемую среду RPMI 1640, среду Eagle MEM и среды, содержащие околоплодную сыворотку крупного рогатого скота в указанных выше средах, и т.д. Культивирование проводят в таких условиях, как наличие 5% СO2 и т.д. Температура культуры, предпочтительно, составляет от 35 до 37 С, и период культивирования обычно составляет от 3 до 7 суток. Во время культивирования к среде могут быть добавлены антибиотики, такие как канамицин, пеницилин и т.п. 6 Для выделения и очистки новой фитазы из культуры организма, продуцирующего новую фитазу, могут быть использованы традиционные методы выделения и очистки ферментов. Например, если новая фитаза накапливается в клетках организма, продуцирующего новую фитазу, клетки выделяют из культуры путем центрифугирования, затем промывают и разрушают с помощью ультразвукового дезинтегратора, пресса French, гомогенизатора MantonGaulin, диномельницы или тому подобного, посредством чего получают свободный от клеток экстракт. Супернатант, полученный путем центрифугирования свободного от клеток экстракта, повергают высаливанию, например, сульфатом аммония, обессоливанию, осаждению органическим растворителем, анионообменной хроматографии на смоле, такой как диэтилоаминоэтил (DEAE)-Сефароза и DIAION НРА-75 (Mitsubishi Chemical Industries Ltd.), катионообменной хроматографии на смоле, такой как SСефароза FF (Pharmacia), гидрофобной хроматографии на смоле, такой как бутил-Сефароза и фенил-Сефароза, гель-фильтрации на молекулярных ситах, хроматофокусировке и электрофорезу, такому как изоэлектрическое фокусирование, посредством чего может быть получен очищенный ферментный препарат. Анализ структуры очищенного ферментного препарата может быть осуществлен в соответствии с методиками, обычно используемыми в белковой химии, например, методиками, описанными в "Protein Structural Analisis for GeneCloning", написанной Hisashi Hirano и опубликованной Tokio Kagaku Dojin (1993). Если новая фитаза секретируется во внеклеточное пространство, культуру подвергают,например, центрифугированию для получения растворимой фракции. Если в числе ингредиентов среды присутствуют твердые компоненты,такие как пшеничные отруби и т.д., новую фитазу экстрагируют добавлением горячей воды или тому подобным и подвергают таким обработкам, как центрифугирование, чтобы получить растворимую фракцию. Из данной растворимой фракции препарат очищенного фермента новой фитазы может быть получен в соответствии с теми же методиками, как выделение и очистка супернатанта свободного от клеток экстракта, как описано выше. В настоящем изобретении активность новой фитазы может быть определена в соответствии со стандартной методикой измерения активности (смотри сравнительный пример ниже). Далее, значение Км новой фитазы может быть определено по диаграмме LineweatherBurk, где активность новой фитазы, которую определяют в соответствии со стандартной методикой измерения активности, графически изображают при различных концентрациях субстрата. 7 Новая фитаза по изобретению может быть использована на различных стадиях, необходимых для превращения соли фитата в инозит и неорганический фосфат, например при производстве корма для животных, переработке соевых бобов, жидкого корма для свиней и птицы,и для получения инозита или инозит монофосфата из солей фитатов. Корм для животных, содержащий новую фитазу по изобретению, может быть получен путем смешивания указанного фермента с носителями, такими как чешуйки пшеницы, сушки смеси в распылительной колонне или в псевдоожиженном слое и добавления стабилизаторов осмотического давления, таких как сорбит, и консервантов, таких как бензойная кислота, к высушенному материалу. Количество новой фитазы в корме для животных составляет от 10 до 5000 Ед., предпочтительно от 100 до 1000 Ед. на кг корма для животных. Краткое описание чертежей На фиг. 1 показана оптимальная рН для фитазы I. На фиг. 2 показана оптимальная рН для фитазы II. На фиг.3 показана оптимальная рН для фитазы III. На фиг. 4 показана оптимальная рНстабильность фитазы I. На фиг. 5 показана оптимальная рНстабильность фитазы II. На фиг. 6 показана оптимальная рНстабильность фитазы III. На фиг. 7 показана оптимальная температура для фитазы I. На фиг. 8 показана оптимальная температура для фитазы II. На фиг. 9 показана оптимальная температура для фитазы III. На фиг. 10 показана термостойкость фитазы I. На фиг. 11 показана термостойкость фитазы II. На фиг. 12 показана термостойкость фитазы III. Наилучший способ осуществления изобретения Здесь, далее, настоящее изобретение подробно описано ссылкой на примеры. Однако настоящее изобретение не ограничивается примерами. Сравнительный пример (методика измерения активности фитазы). В настоящем изобретении стандартное измерение активности фитазы проводили следующим образом. 0,5 мл 0,2 М ацетатного буфера, рН 5,5,(или буфера глицин-HCl , рН 2,5, в случае исследования активности кислой фосфатазы при разложении фитиновой кислоты), содержащего 2,5 мМ фитат натрия (Sigma), выдерживали при 37 С в течение 5 мин и добавляли 0,5 мл рас 003632 8 твора фермента, для запуска реакции (в итоге 1,25 мМ фитат натрия-0,1 М ацетатный буфер,рН 5,5, или 0,1 М буфер глицин-HCl, рН 2,5). После выдерживания при 37 С в течение 20 мин добавляли 2 мл раствора, останавливающего ферментативную реакцию, (т.е. смесь, состоящую из 10 мМ молибдата аммония, 5 н. серной кислоты и ацетона в соотношении 1:1:2), для остановки реакции, и добавляли 0,1 мл 1 М лимонной кислоты и смешивали с реакционным раствором. Оптическую плотность данного раствора при 380 нм измеряли спектрофотометром(Hitachi U-2000). 1 единицу активности фитазы определяли как количество фермента, позволяющее высвободить 1 мкмоль неорганического фосфора в минуту. Пример 1 (получение фитаз). В колбу Эрленмейера емкостью 2000 мл вносили 200 мл среды для продукции фитазы[1% сахарозы, 0,2% NaNO3, 0,05% MgSO47 Н 2O,0,05% КСl, 0,001% FeSO47H2O, 0,1% экстракта кукурузы (э.к.), рН 5,5], закрывали пробкой из силиконовой губки и стерилизовали при 120 С в течение 20 мин. Инокулируют туда гифыMonascus anka IFO 30873 и подвергают стационарному культивированию в течение 10 суток с получением фитаз. В качестве сырого раствора фитазы использовали 980 мл полученной культуры и таким образом получали 6 единиц фитаз. Пример 2 (очистка фитаз). Сырой раствор фитазы обессоливали путем пропускания его через Ультрафильтр (молекулярная масса исключения 10000, Advantec). Полученный раствор фермента наносили на колонку с DEAE-Сефарозой F.F. (Pharmacia),предварительно уравновешенную 20 мМ буфером MES, рН 6,0 (Katayama Kagaku). После промывания 20 мМ буфером MES (рН 6,0) фитазы I и III элюировали 20 мМ буфером MES(pH 6,0), содержащим 0,05 М NaCl. Далее, фитазу II элюировали 20 мМ буфером MES (pH 6,0),содержащим 0,1 М NaCl. Каждый отделенный таким образом раствор фермента обессоливали и концентрировали примерно в 20 раз, соответственно, с помощью Ультрафильтра (молекулярная масса исключения 10000, Advantec). Затем каждый фермент наносили на колонку сMES (pH 6,0) белок элюировали по линейному градиенту от 0 до 0,3 М NaCl, посредством чего получали фракции фитазы I, II и III. Каждый из полученных таким образом растворов ферментов концентрировали примерно в 20 раз с помощью Ультрафильтра (молекулярная масса исключения 10000, Advantec) и наносили на колонкуCorporation), предварительно уравновешенную 20 мМ буфером MES, pH 6,0, содержащим 0,05 М КСl. Фитазы I, II и III элюировали, соответст 9 венно, 20 мМ буфером рН 6,0, содержащим 0,05 М КСl. Фитазы I, II и III очищали, соответственно,на стадиях, указанных выше. Пример 3 (измерение Км фитаз I, II и III). Очищенные фитазы I, II и III измеряли в соответствии стандартной методикой измерения активности, где фитиновую кислоту использовали в качестве субстрата при различных концентрациях в диапазоне от 0,00625 до 0,8 мМ. Для определения Км графически изображали обратную величину результата LineweatherBurk. Величины Км фитаз I, II и III для фитиновой кислоты составляли 27, 20 и 107 мкМ. Пример 4 (физико-химические свойства фитаз I, II и III).(1) Оптимальная рН: Буфер в стандартной методике измерения активности заменяли 0,2 М буфером, указанным ниже, и активность при каждом значении рН измеряли в соответствии со стандартной методикой измерения активности. Буфер глицин-HCl рH 2,0-3,5. Буфер уксусная кислота-ацетат натрия рН 3,5-5,5. Буфер MES (буфер Гуда) рН 5,0-7,0. Буфер Трис-HCl рН 7,0-9,0 Результаты показаны на фиг. 1, 2 и 3. Фитазы I, II и III проявляли максимальную активность при рН 5,5, рН 6,0 и рН 2,5, соответственно.(2) рН-стабильность: После того, как раствор фермента выдерживали при 30 С в течение 60 мин в 50 мМ буфере, указанном ниже, активность измеряли в соответствии со стандартной методикой измерения активности. Буфер глицин-НСl рH 2,0-4,0. Буфер уксусная кислота-ацетат натрия рН 4,5-5,5. Буфер MES (буфер Гуда) рН 5,5-7,0. Буфер Трис-HCl рН 7,0-9,0. Результаты показаны на фиг. 4, 5 и 6. Фитаза I была стабильна в диапазоне рН 5,5-6,5, фитаза II в диапазоне рН 6,0-7,0 и фитаза III - в диапазоне рН 2,0-8,0.(3) Оптимальная температура: После того,как температуру реакции, использованную для измерения активности фермента, изменяли в диапазоне от 30 до 70 С, активность при каждой температуре измеряли согласно стандартному методу измерения активности. Результаты показаны на фиг. 7, 8 и 9. Обе фитазы I и II проявляли максимальную активность при 50 С. Фитаза III проявляла максимальную активность при 45 С.(4) Термостойкость: Затем раствор фермента выдерживали при 4-70 С в течение 10 мин в 20 мМ буфере MES (рН 6,0), активность измеряли в соответствии со стандартной методикой измерения активности. Результаты показаны на фиг. 10, 11 и 12. 10 Фитаза I была стабильна вплоть до 35 С,фитаза II - вплоть до 50 С и фитаза III - вплоть до 60 С.(5) Субстратная специфичность: Активность измеряли в соответствии со стандартной методикой измерения активности, используя каждый субстрат, приготовленный в концентрации 2,5 мМ, и результаты показаны в табл. 1. Каждая из фитаз I, II и III имела низкую субстратную специфичность. Таблица 1. Субстратная специфичность фитаз Фитазы(6) Молекулярная масса: Молекулярную массу определяли по методу гель-фильтрации на TOYO-pearl HW-55F (размеры колонки 1,0 х 119 см, 93,4 мл). Калибровочную кривую строили, используя в качестве стандартов РНКазу А(Мол. м. 15500), овальбумин (Мол. м. 42700),альбумин (Мол. м. 63300) и альдолазу (Мол. м. 163000) . Молекулярные массы фитаз I, II и III составляли от 80 до 100, 120 и 140 кДа соответственно.(7) Изоэлектрическая точка: Фитазу наносили на Полибуферную обменную колонну РВЕ 94 (Pharmacia), предварительно уравновешенную 20 мМ буфером MES (pH 6,0), и затем элюировали 10% Полибуфером 74-НСl (рН 4,0). Газоэлектрическую точку фитазы определяли путем измерения значения рН элюированной фракции с помощью рН-метра. Результаты показали, что изоэлектрические точки фитаз I, II и III составляли рI 5,7, 4,8 и 5,2, соответственно. Пример 5 (анализ N-концевой аминокислотной последовательности фитазы III). Чтобы определить молекулярную массу фитазы III путем электрофореза в SDSполиакриламидном геле (SDS-PAGE), фермент очищали до высокой степени чистоты. К 12,5% мультигелю (Daiichi Kagaku К.К.) добавляли 50 мкл фермента, очищенного согласно примеру 2,и подвергали нативному PAGE согласно методу(1964)]. После электрофореза гель надрезали на кусочки шириной 5 мм и погружали их в 1 мл 20 мМ буфера MES (pH 6,0) и выдерживали при 4 С в течение 12 ч с тем, чтобы экстрагировать фермент. После того, как экстракт концентрировали в 15-20 раз в роторном испарителе,фракцию фитазы идентифицировали в соответствии со стандартной методикой измерения активности, описанной в сравнительном примере. 11 После восстановления меркаптоэтанолом 10 мкл активной фракции подвергали SDS-PAGE с получением фитазы III высокой чистоты. Исходя из данного результата, молекулярную массу фитазы III определяли как приблизительно 65 кДа. Анализ N-концевой аминокислотной последовательности фитазы III проводили следующим образом. То есть, фитазу III, очищенную в примере 2, подвергали SDS-PAGE при восстановлении меркаптоэтанолом и затем электрически переносили в мембрану PVDF(ProBlott, Perkin Elmer) согласно методу P. Matsudaira [J.B.C., 262, 10035-10038 (1987)]. Мембрану, содержащую перенесенный в нее фермент, окрашивают Coomassie Blue и полосу фермента с молекулярной массой около 65 кДа вырезали и анализировали его N-концевую аминокислотную последовательность в соответствии с методикой, рекомендуемой в инструкциях производителя, в газофазном белковом секвенаторе (PPSQ-10, Shimadzu Corporation). Аминокислотная последовательность, полученная таким образом, показана в SEQ ID N0:1. В результате исследования гомологии описанной здесь аминокислотной последовательности путем использования белковой базы данных было обнаружено, что она является новой последовательностью. Промышленное применение В соответствии с настоящим изобретением, могут быть обеспечены фитазы, имеющие низкое значение Км для фитиновой кислоты, и способ получения путем использования микроорганизма, обладающего способностью продуцировать и накапливать фитазы. Фитазы могут быть добавлены к корму для разложения фитиновой кислоты как антитрофического фактора, содержащегося в корме, с увеличением, таким образом, питательной ценности корма, и одновременно становится возможной эффективная утилизация фосфата, высвобождающегося при указанном разложении. Список последовательностей 12 а) значение константы Михаэлиса (Км) от 10 до 110 мкМ при использовании фитиновой кислоты в качестве субстрата; б) субстратная специфичность: пнитрофенилфосфат, фитиновая кислота, Dглюкозо-6-фосфат,фруктозо-6-фосфат,Dмиоинозит-2-фосфат, D-миоинозит-1-фосфат, Dмиоинозит-1,4-дифосфат и аденозинтрифосфат; в) оптимальное значение рН 2,5-6,0; г) рН-стабильность: устойчива в диапазоне рН 2,0-8,0; д) оптимальная температура 45-50 С; е) термостойкость: устойчива до 35-60 С; ж) молекулярная масса приблизительно 80-140 кДа (определена методом гельфильтрации); з) изоэлектрическая точка (рI) 4,8-5,7 (определена методом хроматофокусировки). 2. Фитаза, полученная из микроорганизмаMonascus anka, обладающая следующими физико-химическими свойствами: а) Км 27 мкМ при использовании фитиновой кислоты в качестве субстрата; б) субстратная специфичность: действует на фитиновую кислоту, п-нитрофенилфосфат,D-глюкозо-6-фосфат, фруктозо-6-фосфат, Dмиоинозит-2-фосфат, D-миоинозит-1-фосфат, Dмиоинозит-1,4-дифосфат и аденозинтрифосфат в качестве субстрата; в) оптимальное значение pH 5,5; г) рН-стабильность: устойчива в диапазоне рН 5,5 до 6,5; д) оптимальная температура 50 С; е) термостойкость: устойчива вплоть до 35 С; ж) молекулярная масса приблизительно от 80 до 100 кДа (определена методом гельфильтрации) и з) изоэлектрическая точка pI 5,7 (определена методом хроматофокусировки). 3. Фитаза, полученная из микроорганизмаMonascus anka, обладающая следующими физико-химическими свойствами: а) Км 20 мкМ при использовании фитиновой кислоты в качестве субстрата; б) субстратная специфичность: действует на фитиновую кислоту, п-нитрофенилфосфат,D-глюкозо-6-фосфат, фруктозо-6-фосфат, Dмиоинозит-2-фосфат, D-миоинозит-1-фосфат, Dмиоинозит-1,4-дифосфат и аденозинтрифосфат в качестве субстрата; в) оптимальное значение рH 6,0; г) рН-стабильность: устойчива в диапазоне рН 6,0 до 7,0; д) оптимальная температура 50 С; е) термостойкость: устойчива вплоть до 50 С; ж) молекулярная масса приблизительно 120 кДа (определена методом гель-фильтрации) и з) изоэлектрическая точка рI 4,8 (определена методом хроматофокусировки).Monascus anka, обладающая следующими физико-химическими свойствами: а) Км 107 мкМ при использовании фитиновой кислоты в качестве субстрата; б) субстратная специфичность: действует на фитиновую кислоту, п-нитрофенилфосфат,D-глюкозо-6-фосфат, фруктозо-6-фосфат, Dмиоинозит-2-фосфат, D-миоинозит-1-фосфат, Dмиоинозит-1,4-дифосфат и аденозинтрифосфат в качестве субстрата; в) оптимальное значение pH 2,5; г) рН-стабильность: устойчива в диапазоне рН 2,0 до 8,0; д) оптимальная температура 45 С; е) термостойкость: устойчива вплоть до 60 С; ж) молекулярная масса приблизительно 140 кДа (определена методом гель-фильтрации);Monascus anka представлен штаммом IFO 30873. 6. Способ получения фитазы, охарактеризованной в любом из пп.1-5, который включает культивирование микроорганизма Monascusanka, обладающего способностью продуцировать и накапливать фитазу до тех пор, пока фитаза образуется и накапливается, и выделение фитазы из культуральной среды или клеток микроорганизма. 7. Способ по п.6, где микроорганизм
МПК / Метки
МПК: A23K 1/165, C12N 9/16
Метки: содержащий, фитазы, корм, monascus, указанные, получения, животных, микроорганизма, способ, anka
Код ссылки
<a href="https://eas.patents.su/9-3632-fitazy-iz-mikroorganizma-monascus-anka-sposob-ih-polucheniya-i-korm-dlya-zhivotnyh-soderzhashhijj-ukazannye-fitazy.html" rel="bookmark" title="База патентов Евразийского Союза">Фитазы из микроорганизма monascus anka, способ их получения и корм для животных, содержащий указанные фитазы</a>
Предыдущий патент: Способ получения ячеистых полиуретановых эластомеров и преполимеры для них
Следующий патент: Способ установления предрасположенности к фонтанированию у напитка
Случайный патент: Ручной насос