Фармацевтическая композиция антимикробного действия для парентерального введения и способ ее получения
Номер патента: 21874
Опубликовано: 30.09.2015
Авторы: Гайдуль Константин Валентинович, Душкин Александр Валерьевич
Формула / Реферат
1. Фармацевтическая композиция антимикробного действия для парентерального применения, включающая в качестве терапевтического вещества бета-лактамный антибиотик, отличающаяся тем, что она выполнена в форме порошка для приготовления инъекций, содержащая механоактивированную смесь бета-лактамного антибиотика и высокодисперсного наноструктурированного диоксида кремния в весовом соотношении бета-лактамный антибиотик : высокодисперсный наноструктурированный диоксид кремния, равном (10-75):1, причем доля частиц высокодисперсного наноструктурированного диоксида кремния, имеющих размер ≤5 мкм, составляет не менее 25% от их общего количества.
2. Способ получения фармацевтической композиции антимикробного действия для парентерального применения, включающий смешение порошка бета-лактамного антибиотика с порошком высокодисперсного наноструктурированного диоксида кремния в весовом соотношении бета-лактамный антибиотик : высокодисперсный наноструктурированный диоксид кремния, равном (10-75):1, причем полученную смесь подвергают механической обработке путем ударно-истирающих воздействий таким образом, чтобы доля частиц высокодисперсного наноструктурированного диоксида кремния, имеющих размер ≤5 мкм, составляла не менее 25% от их общего количества.
Текст
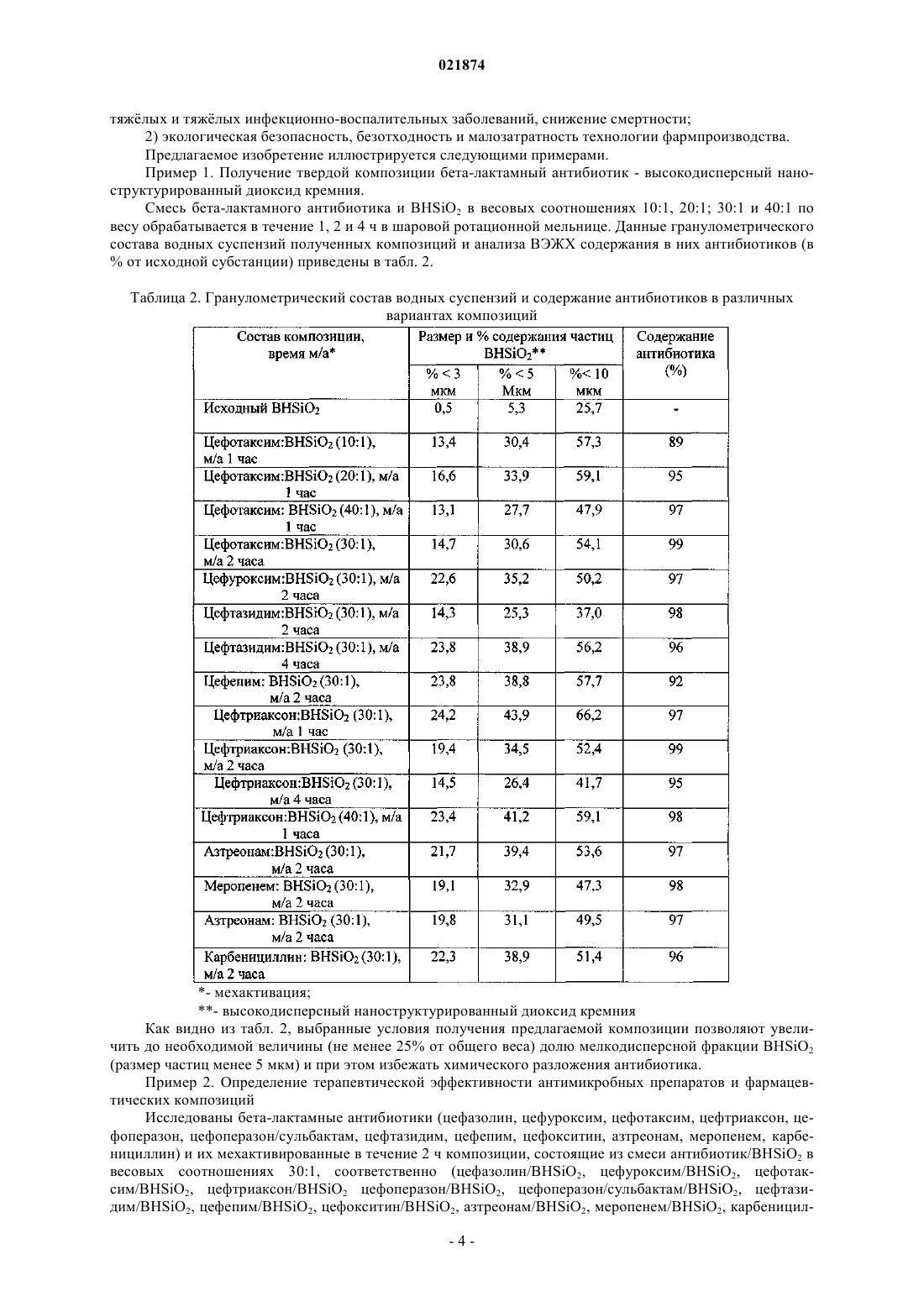
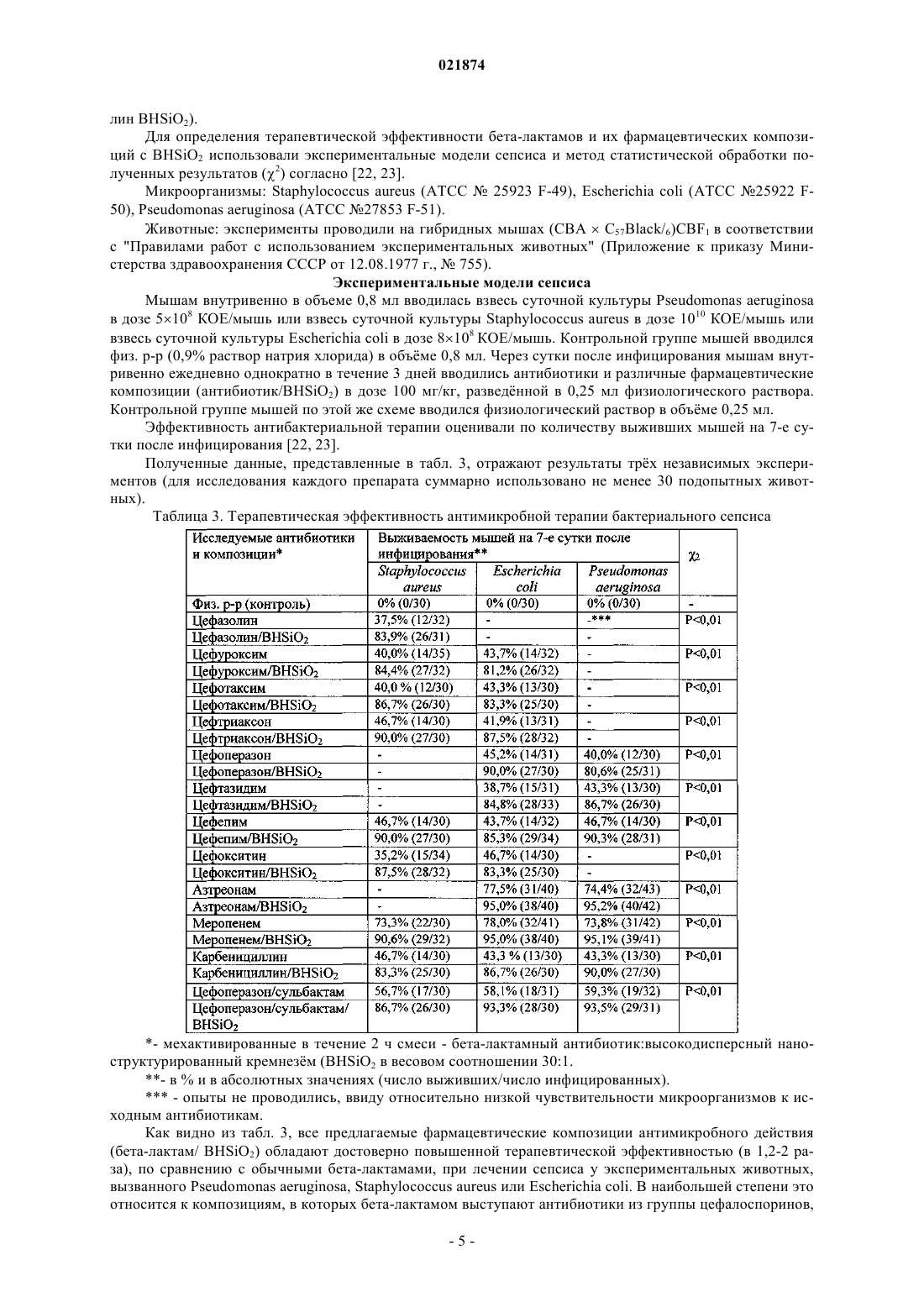
ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ АНТИМИКРОБНОГО ДЕЙСТВИЯ ДЛЯ ПАРЕНТЕРАЛЬНОГО ВВЕДЕНИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ(71)(73) Заявитель и патентовладелец: ЛИМОНОВ ВИКТОР ЛЬВОВИЧ (RU) Изобретение относится к фармакологии, медицине, ветеринарии и к фармацевтической промышленности, в частности к способу получения оригинальных композитных антимикробных препаратов для парентерального применения, которые обладают повышенной терапевтической эффективностью при лечении тяжлых форм инфекционно-воспалительных заболеваний. Предложенные фармацевтические композиции содержат в качестве действующего вещества бета-лактамные антибиотики и высокодисперсный наноструктурированный диоксид кремния в соотношениях от 10:1 до 75:1 по весу соответственно. Присутствующие в композиции частицы диоксида кремния являются средствами доставки молекул антибиотиков в фагоциты, что позволяет целенаправленно повышать концентрацию антимикробных препаратов в зонах воспаления и существенно нивелировать феномен антибиотикорезистентности микроорганизмов. Заявляемый способ получения фармацевтической композиции заключается в смешивании субстанции беталактамного антибиотика с высокодисперсным наноструктурированным диоксидом кремния,отличающийся тем, что смесь вышеуказанных веществ в соотношениях от 10:1 до 75:1 по весу соответственно подвергают механической обработке путем ударно-истирающих воздействий до увеличения весовой доли мелкодисперсной фракции ( 5 мкм) не менее чем до 25%. Полученную смесь используют для приготовления инъекционных растворов. Изобретение относится к антимикробным фармацевтическим препаратам и технологиям их приготовления и может использоваться в медицине и ветеринарии для лечения инфекционно-воспалительных заболеваний, а также в фармацевтической промышленности для производства лекарственных средств. В настоящее время успешная терапия большинства инфекционно-воспалительных заболеваний основана на применении различных антибактериальных средств, в том числе, бета-лактамных антибиотиков. К бета-лактамам относятся препараты (природные и полусинтетические пенициллины, цефалоспорины, цефамицины, карбапенемы и монобактамы), имеющие общим фрагментом в химической структуре бета-лактамное кольцо, которое определяет антимикробную активность и целый ряд общих свойств данной группы лекарственных средств. Все бета-лактамы обладают широким спектром антимикробного действия и высокой антимикробной активностью, однако, ко многим из них относительно быстро развивается устойчивость микроорганизмов, обусловленная выработкой ими специфических ферментов бета-лактамаз (бета-лактамазы расширенного спектра, хромосомные бета-лактамазы класса С и др.), гидролизующих бета-лактамное кольцо, что лишает данных препаратов антибактериальных свойств и приводит к развитию резистентных штаммов микроорганизмов. В последние десятилетия созданы специфические ингибиторы бета-лактамаз (клавулановая кислота, сульбактам, тазобактам и др.), на основе использования которых разработан ряд эффективных комбинированных антибактериальных бета-лактамных препаратов пенициллинового и цефалоспоринового ряда (амоксициллин/клавулановая кислота, ампициллин/сульбактам, пиперациллин/тазобактам, цефоперазон/сульбактам и др.), которые отличаются повышенной устойчивостью к бета-лактамазам и более выраженной антибактериальной активностью [2, 3]. Однако следует отметить, что многие из этих "ингибитор-защищнных" препаратов оказались недостаточно эффективны, так как при высоком уровне продукции патогенными микроорганизмами беталактамаз вышеуказанные ингибиторы полностью не защищают антибиотики от гидролиза. Устойчивые к действию многих бета-лактамаз карбапенемы также полностью не решают проблему резистентности микроорганизмов к этим антибиотикам, так как их широкое применение для лечения тяжлых инфекций приводит к формированию множественно устойчивых штаммов P. aeruginosa [3]. Кроме того, необходимо подчеркнуть, что зачастую клиническая неэффективность (или низкая эффективность) бета-лактамов при инфекциях, вызываемых различными микроорганизмами, связана не только с негативным действием бета-лактамаз, но и с ограниченной способностью этих препаратов локально концентрироваться в очаге инфекционного воспаления и проникать внутрь макрофагов, в которых депонируются фагоцитированные возбудители многих инфекционно-воспалительных заболеваний и от выраженности функционального состояния которых в значительной мере зависит уровень противомикробной резистентности [4, 5]. В последние годы обнаружено, что использование разнообразных наночастиц в качестве носителей для доставки различных антибиотиков (в том числе, бета-лактамов) вовнутрь бактерий и макрофагов, с целью повышения их концентрации в зоне инфекционного воспаления, и, соответственно, с целью усиления их антимикробных свойств, а также для стимуляции функциональной активности фагоцитов (нейтрофилов и макрофагов) и их дополнительного рекрутирования в инфицированные ткани, является перспективным направлением развития современной экспериментальной фармакологии и клинической медицины [6, 7, 8, 9, 10, 11, 12]. Сущность изобретения заключается в том, что с целью усиления терапевтической эффективности бета-лактамов предлагается использовать наночастицы SiO2 (диоксида кремния), которые, отличаясь фармакологически выгодными свойствами биосовместимости, биораспределения, биодеградации и малотоксичности (независимо от степени выраженности пористости структуры), способны служить в качестве носителя антибиотиков для внутриклеточной доставки в макрофаги, которые концентрированно расположены в очагах воспаления, наблюдаемых в легких, печени, почках, селезнке, лимфоузлах, сердце, коже, мочевом пузыре и других органах млекопитающих (т.е. значительно повышать концентрацию антибиотиков в инфицированных зонах), а также стимулировать противомикробную активность этих клеток иммунной системы, тем самым достоверно усиливать терапевтический эффект антимикробных препаратов при лечении инфекционно-воспалительных заболеваний [13, 14, 15, 16, 17, 18, 19, 20, 21]. Изобретение решает задачу создания фармацевтической композиции антимикробного действия для инъекций на основе использования антибиотиков из группы бета-лактамов и наночастиц диоксида кремния, обладающей повышенной терапевтической эффективностью (по сравнению с обычными беталактамами, которые рассматриваются в данном изобретении в качестве прототипа) при лечении инфекционно-воспалительных заболеваний. Поставленная задача решается тем, что предлагается фармацевтическая композиция антимикробного действия для инъекций, которая содержит бета-лактамный антибиотик и высокодисперсный наноструктурированный диоксид кремния в весовом соотношении, равном (10-75):1. Поставленная задача решается также тем, что предлагается способ получения фармацевтической композиции антимикробного действия для инъекций, включающий смешивание бета-лактамных анти-1 021874 биотиков с другими компонентами, по которому бета-лактамный антибиотик в форме порошка смешивают с порошковым высокодисперсным наноструктурированным диоксидом кремния в весовом соотношении, равном (10-75):1, и полученную смесь подвергают механической обработке путем ударноистирающих воздействий. Терапевтическая эффективность предлагаемой фармацевтической композиции повышается, если полученную смесь подвергают механической обработке путем ударно-истирающих воздействий таким образом, чтобы доля частиц высокодисперсного наноструктурированного диоксида кремния, имеющих размер не более 5 мкм, составляла не менее 25%. Для приготовления фармацевтической композиции использовались бета-лактамные антибиотики импортного производства, предоставленные российской фармкомпанией ООО "АБОЛмед" (пенициллины: карбенициллин; цефалоспорины: цефазолин, цефуроксим, цефотаксим, цефтриаксон, цефоперазон,цефтазидим, цефоперазон/сульбактам, цефепим; цефамицины: цефокситин; карбапенемы: меропенем; монобактамы: азтреонам). В качестве высокодисперсного наноструктурированного диоксида кремния(далее по тексту: BHSiO2) использовался лекарственный препарат "Полисорб" (фармакологическая группа: энтеросорбирующее средство; действующее вещество: кремния диоксид коллоидный), производимый российской фирмой ЗАО "Полисорб", состоящий из наночастиц диоксида кремния округлой формы(размер 5-20 нм), объединнных в агрегаты (микрочастицы неправильной формы), имеющие размеры 90 мкм (регистрационный 001140/01-100908). Аналогичный препарат производится украинской фирмой ЗАО "Биофарма" под торговым наименованием "Силикс" [12]. В основу выбора состава композиции положено явление обратимой сорбции молекул бета-лактамов нано- и микроразмерными частицами BHSiO2, а также уменьшение размеров микрочастиц BHSiO2 при механической активации его смесей с субстанциями бета-лактамов интенсивными ударно-истирающими механическими воздействиями. Заявляемый способ получения вышеуказанной фармацевтической композиции путем механической активации порошкообразной смеси бета-лактамного антибиотика и BHSiO2 интенсивными ударноистирающими воздействиями позволяет по сравнению с известными способами повысить долю мелкодисперсных (размером менее 5 мкм) частиц BHSiO2, на которых адсорбируются молекулы бета-лактамов и которые фагоцитируются преимущественно макрофагами [10, 19]. Для этого смесь вышеуказанных веществ в весовом соотношении бета-лактамный антибиотик :BHSiO2, равном (10-75):1, подвергают механической активации путем ударно-истирающих воздействий до увеличения весовой доли мелкодисперсной фракции, не менее чем до 25%. Данные гранулометрического состава водной суспензии композиции на примере смеси цефтриаксон : BHSiO2, равной 30:1 по весу, измеренные на лазерном гранулометре Micro-Sizer 201, представлены на фиг. 1 и 2. Как видно из фиг. 1 и 2, двухчасовая мехактивация исследуемой композиции приводит к увеличению весовой доли е мелкодисперсной фракции (частицы размером 5 мкм), которая составляет не менее 25%. Из полученной порошкообразной композиции готовят инъекционные коллоидные растворы для парентерального введения (разведением е любым известным способом, принятым для бета-лактамов), состоящие из мелкодисперсных частиц BHSiO2 с обратимо сорбированными на их поверхности молекулами того или иного бета-лактама. В табл. 1 приведены данные (полученные методом высокоэффективной жидкостной хроматографии ВЭЖХ) о степени сорбции различных бета-лактамных антибиотиков на частицах BHSiO2 после мехактивации композиции антибиотик:BHSiO2, в весовом соотношении 30:1, которые говорят о том, что высокодисперсный наноструктурированный диоксид кремния может быть использован при парентеральном введении в качестве носителя антимикробных и других лекарственных средств, способных сорбироваться на нано- и микрочастицах этого неорганического вещества, для доставки в зоны воспаления, опухолевого роста, регенерации, заживления,рубцевания и др., т.е. в зоны повышенного присутствия макрофагов, с целью целенаправленного увеличения локальной (в том числе, внутриклеточной) концентрации фармпрепарата и, соответственно, усиления терапевтического эффекта.- высокодисперсный наноструктурированный диоксид кремния;- мехактивация Введение в предлагаемую композицию высокодисперсного наноструктурированного диоксида кремния в соотношениях бета-лактам: BHSiO2 от 10:1 до 75:1 по весу, соответственно, определяется сочетанием двух факторов: 1) при увеличении содержания BHSiO2 более 10 вес.% композиции у лабораторных животных наблюдаются явления блокады мелких капилляров в паренхиматозных органах; 2) при уменьшении содержания BHSiO2 ниже 1 вес.% композиции, е терапевтическая эффективность (в частности, при лечении бактериального сепсиса у мышей) фактически не отличается от базовой эффективности исходного антибиотика. Для получения композиций использован механохимический подход, заключающийся в обработке смеси твердых компонентов интенсивными механическими воздействиями - давлением и сдвиговыми деформациями, реализуемыми преимущественно в различного типа мельницах, осуществляющих ударно-истирающие воздействия на вещества. Смесь твердой субстанции бета-лактамного антибиотика и высокодисперсного наноструктурированного диоксида кремния, взятых преимущественно в соотношениях от 10:1 до 75:1 по весу, подвергают механической активации в шаровых мельницах. Использованный способ получения смесей позволяет в значительной мере избежать химического разложения, достичь полной гомогенности порошкообразных компонентов по сравнению с получением смесей простым смешением компонентов, или выпариванием их растворов и, как следствие, обуславливает высокую фармакологическую активность фармацевтической композиции. В качестве количественного критерия минимально необходимой дозы механического воздействия удобно использовать метод гранулометрии суспензии получаемой композиции. При этом необходимо,чтобы массовая доля частиц размером не более 5 мкм составила не менее 25%. С другой стороны, необходимо избегать избыточной механической обработки, которая ведет к химическому разложению беталактамов, степень которой контролируется известными аналитическими методами, например ВЭЖХ. Механическую обработку порошкообразных смесей осуществляют в ротационных, вибрационных или планетарных мельницах. В качестве мелющих тел могут использоваться шары, стержни и др. Фармакологические испытания полученных композиций на лабораторных животных (мышах) показали, что заявляемые композиции, приготовленные заявляемым способом, обладают значительно повышенной терапевтической эффективностью при лечении бактериального сепсиса, вызванного Staphylococcus aureus, Escherichia coli и Pseudomonas aeruginosa, по сравнению с исходными антибиотиками. Таким образом, использование заявляемых фармацевтических композиций и способ их получения обеспечивает следующие преимущества: 1) клинически значимое повышение эффективности и качества антимикробной терапии средне-3 021874 тяжлых и тяжлых инфекционно-воспалительных заболеваний, снижение смертности; 2) экологическая безопасность, безотходность и малозатратность технологии фармпроизводства. Предлагаемое изобретение иллюстрируется следующими примерами. Пример 1. Получение твердой композиции бета-лактамный антибиотик - высокодисперсный наноструктурированный диоксид кремния. Смесь бета-лактамного антибиотика и BHSiO2 в весовых соотношениях 10:1, 20:1; 30:1 и 40:1 по весу обрабатывается в течение 1, 2 и 4 ч в шаровой ротационной мельнице. Данные гранулометрического состава водных суспензий полученных композиций и анализа ВЭЖХ содержания в них антибиотиков (в% от исходной субстанции) приведены в табл. 2. Таблица 2. Гранулометрический состав водных суспензий и содержание антибиотиков в различных вариантах композиций- высокодисперсный наноструктурированный диоксид кремния Как видно из табл. 2, выбранные условия получения предлагаемой композиции позволяют увеличить до необходимой величины (не менее 25% от общего веса) долю мелкодисперсной фракции BHSiO2(размер частиц менее 5 мкм) и при этом избежать химического разложения антибиотика. Пример 2. Определение терапевтической эффективности антимикробных препаратов и фармацевтических композиций Исследованы бета-лактамные антибиотики (цефазолин, цефуроксим, цефотаксим, цефтриаксон, цефоперазон, цефоперазон/сульбактам, цефтазидим, цефепим, цефокситин, азтреонам, меропенем, карбенициллин) и их мехактивированные в течение 2 ч композиции, состоящие из смеси антибиотик/BHSiO2 в весовых соотношениях 30:1, соответственно (цефазолин/BHSiO2, цефуроксим/BHSiO2, цефотаксим/BHSiO2, цефтриаксон/BHSiO2 цефоперазон/BHSiO2, цефоперазон/сульбактам/BHSiO2, цефтазидим/BHSiO2, цефепим/BHSiO2, цефокситин/BHSiO2, азтреонам/BHSiO2, меропенем/BHSiO2, карбеницил-4 021874 лин BHSiO2). Для определения терапевтической эффективности бета-лактамов и их фармацевтических композиций с BHSiO2 использовали экспериментальные модели сепсиса и метод статистической обработки полученных результатов (2) согласно [22, 23]. Микроорганизмы: Staphylococcus aureus (ATCC25923 F-49), Escherichia coli (АТСС 25922 F50), Pseudomonas aeruginosa (ATCC 27853 F-51). Животные: эксперименты проводили на гибридных мышах (СВАC57Black/6)CBF1 в соответствии с "Правилами работ с использованием экспериментальных животных" (Приложение к приказу Министерства здравоохранения СССР от 12.08.1977 г.,755). Экспериментальные модели сепсиса Мышам внутривенно в объеме 0,8 мл вводилась взвесь суточной культуры Pseudomonas aeruginosa в дозе 5108 КОЕ/мышь или взвесь суточной культуры Staphylococcus aureus в дозе 1010 КОЕ/мышь или взвесь суточной культуры Escherichia coli в дозе 8108 КОЕ/мышь. Контрольной группе мышей вводился физ. р-р (0,9% раствор натрия хлорида) в объме 0,8 мл. Через сутки после инфицирования мышам внутривенно ежедневно однократно в течение 3 дней вводились антибиотики и различные фармацевтические композиции (антибиотик/BHSiO2) в дозе 100 мг/кг, разведнной в 0,25 мл физиологического раствора. Контрольной группе мышей по этой же схеме вводился физиологический раствор в объме 0,25 мл. Эффективность антибактериальной терапии оценивали по количеству выживших мышей на 7-е сутки после инфицирования [22, 23]. Полученные данные, представленные в табл. 3, отражают результаты трх независимых экспериментов (для исследования каждого препарата суммарно использовано не менее 30 подопытных животных). Таблица 3. Терапевтическая эффективность антимикробной терапии бактериального сепсиса- в % и в абсолютных значениях (число выживших/число инфицированных).- опыты не проводились, ввиду относительно низкой чувствительности микроорганизмов к исходным антибиотикам. Как видно из табл. 3, все предлагаемые фармацевтические композиции антимикробного действия(бета-лактам/ BHSiO2) обладают достоверно повышенной терапевтической эффективностью (в 1,2-2 раза), по сравнению с обычными бета-лактамами, при лечении сепсиса у экспериментальных животных,вызванного Pseudomonas aeruginosa, Staphylococcus aureus или Escherichia coli. В наибольшей степени это относится к композициям, в которых бета-лактамом выступают антибиотики из группы цефалоспоринов,-5 021874 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция антимикробного действия для парентерального применения,включающая в качестве терапевтического вещества бета-лактамный антибиотик, отличающаяся тем, что она выполнена в форме порошка для приготовления инъекций, содержащая механоактивированную смесь бета-лактамного антибиотика и высокодисперсного наноструктурированного диоксида кремния в весовом соотношении бета-лактамный антибиотик:высокодисперсный наноструктурированный диоксид кремния, равном (10-75):1, причм доля частиц высокодисперсного наноструктурированного диоксида кремния, имеющих размер 5 мкм, составляет не менее 25% от их общего количества. 2. Способ получения фармацевтической композиции антимикробного действия для парентерального применения, включающий смешение порошка бета-лактамного антибиотика с порошком высокодисперсного наноструктурированного диоксида кремния в весовом соотношении бета-лактамный антибиотик:высокодисперсный наноструктурированный диоксид кремния, равном (10-75):1, причм полученную смесь подвергают механической обработке путм ударно-истирающих воздействий таким образом, чтобы доля частиц высокодисперсного наноструктурированного диоксида кремния, имеющих размер 5 мкм, составляла не менее 25% от их общего количества.
МПК / Метки
МПК: A61K 9/14, A61K 47/04, A61K 31/33
Метки: способ, получения, парентерального, введения, антимикробного, действия, фармацевтическая, композиция
Код ссылки
<a href="https://eas.patents.su/9-21874-farmacevticheskaya-kompoziciya-antimikrobnogo-dejjstviya-dlya-parenteralnogo-vvedeniya-i-sposob-ee-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая композиция антимикробного действия для парентерального введения и способ ее получения</a>