По существу очищенная композиция, выделенная из растительной клетки, способная активировать экспрессию гена сесквитерпенсинтазы, и способ её получения
Формула / Реферат
1. По существу очищенная композиция, выделенная из растительной клетки, причем указанная композиция способна активировать экспрессию гена сесквитерпенсинтазы в клетке растения, отличающаяся тем, что
(1) указанная композиция способна активировать экспрессию указанного гена сесквитерпенсинтазы в указанной клетке растения после обработки протеазой, пектиназой, ДНКазой или РНКазой;
(2) указанная композиция способна активировать экспрессию указанного гена сесквитерпенсинтазы в указанной клетке растения после лиофилизации и восстановления;
(3) указанная композиция не переходит в органическую фазу при экстракции добавлением гексана; и
(4) указанная композиция включает способное к диффузии соединение, имеющее молекулярную массу, менее или равную 10000 Да.
2. Композиция по п.1, отличающаяся тем, что указанное способное к диффузии соединение имеет молекулярную массу, менее или равную 1000 Да.
3. Композиция по п.1, отличающаяся тем, что указанная сесквитерпенсинтаза представляет собой эпи-5-аристолохенсинтазу.
4. Композиция по п.1, отличающаяся тем, что указанная растительная клетка выбрана из группы, состоящей из клетки табака, клетки томата и клетки картофеля.
5. Способ получения композиции, которая способна активировать экспрессию гена сесквитерпенсинтазы в клетке растения, причем данный способ включает:
а) обеспечение контактирования растительной клетки с таким количеством элиситина и при таких условиях, которые стимулируют продукцию указанной клеткой композиции, которая активирует экспрессию гена сесквитерпенсинтазы в клетке растения; и
б) выделение указанной элиситин-индуцированной композиции, которая
(1) способна активировать экспрессию указанного гена сесквитерпенсинтазы в указанной клетке растения после обработки протеазой, пектиназой, ДНКазой или РНКазой;
(2) способна активировать экспрессию указанного гена сесквитерпенсинтазы в указанной клетке растения после лиофилизации и восстановления;
(3) не переходит в органическую фазу при экстракции добавлением гексана; и
(4) включает способное к диффузии соединение, имеющее молекулярную массу, менее или равную 10000 Да.
6. Способ по п.5, отличающийся тем, что способное к диффузии указанное соединение имеет молекулярную массу, менее 1000 Да.
7. Способ по п.6, отличающийся тем, что композицию выделяют путем диализа.
8. Способ по п.5, отличающийся тем, что указанный элиситин представляет собой криптогеин.
9. Способ по п.5, отличающийся тем, что указанная растительная клетка выбрана из группы, состоящей из клетки табака, клетки томата и клетки картофеля.
10. Способ по п.5, отличающийся тем, что указанная сесквитерпенсинтаза представляет собой эпи-5-аристолохенсинтазу.
11. Способ по п.5, отличающийся тем, что композицию выделяют фракционированием по размеру.
Текст
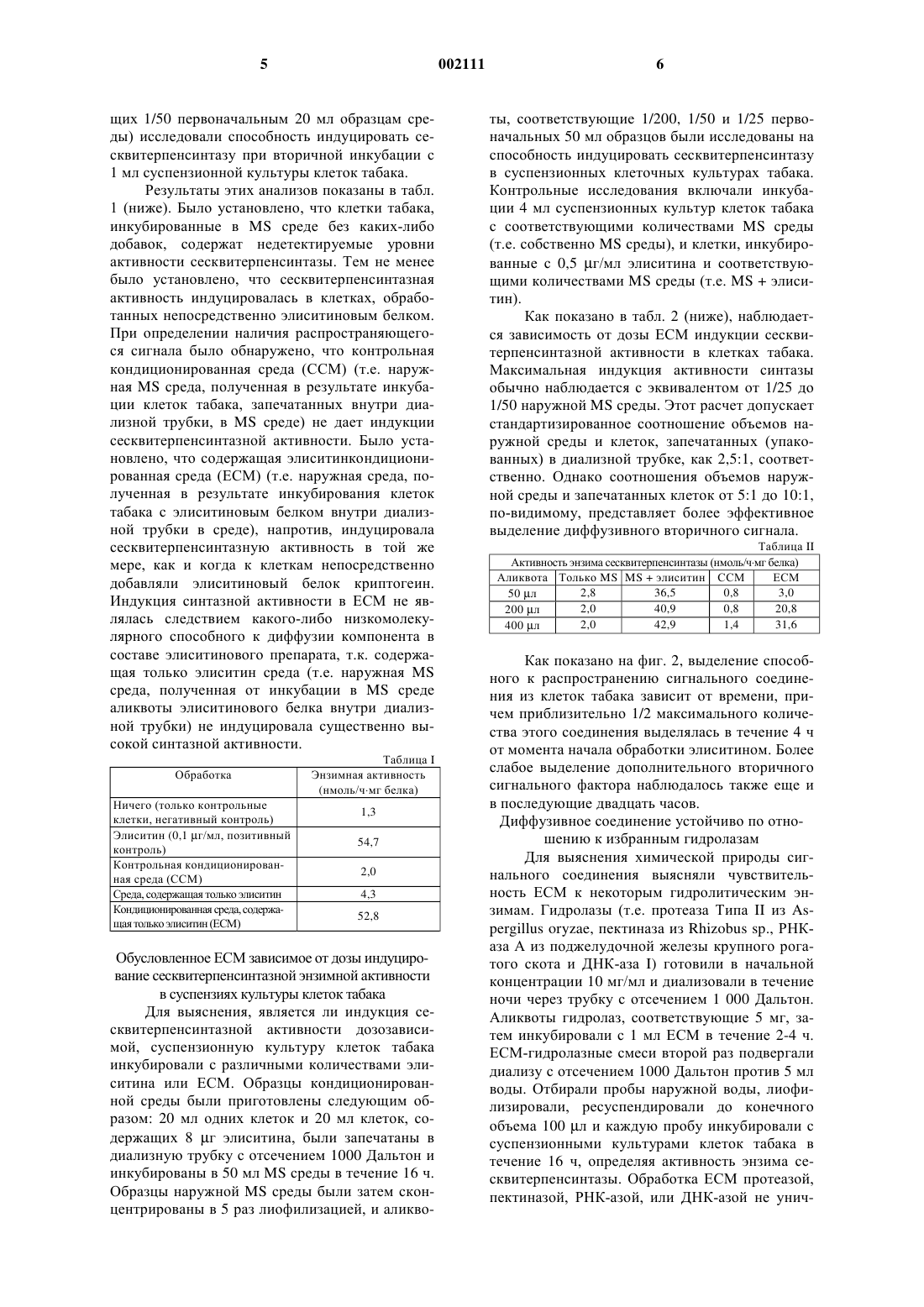
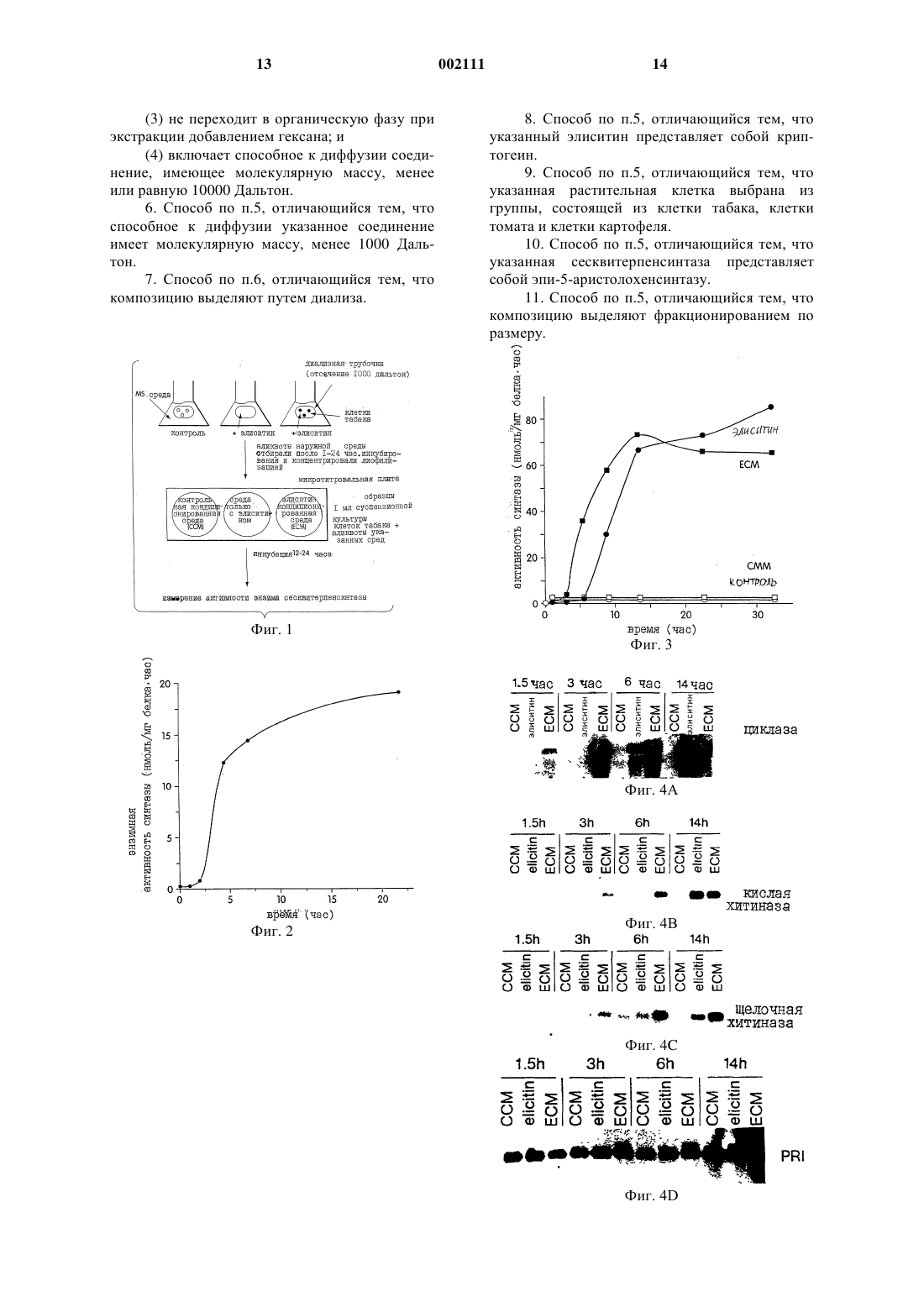
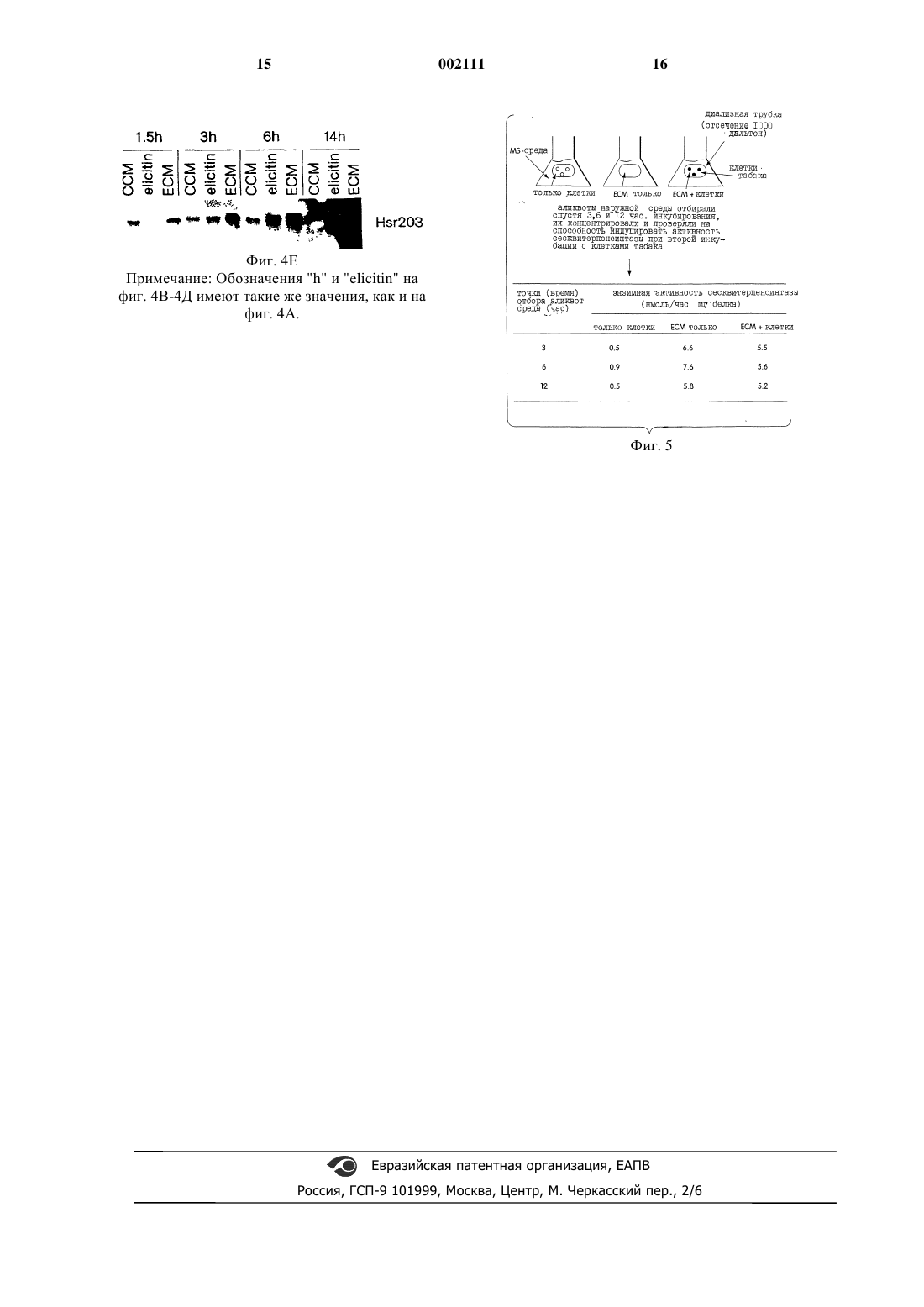
1 Настоящее изобретение было частично профинансировано Правительством, и поэтому Правительству принадлежат определенные права в отношении этого изобретения. Предшествующий уровень Модели механизмов, лежащие в основе взаимодействий растений с патогенами, обычно включали специфические по отношению к "хозяину" рецепторы, которые узнают специфические по отношению к патогену вещества, выделяемые внедряющимся патогеном (Dixon et al.,Annu. Rev. Phytopathol 32:479-501, 1994; Lamb,Cell 76:419-422, 1994; Boller, Annu. Rev. Plant.Physiol. Plant Mol. Biol. 46:189-214, 1995). Этот путь сигнальной трансдукции ведет далее к возбуждению целого набора защитных реакций со стороны растения-хозяина, включая биосинтез фитоалексина (Keen, In: Plant Disease Control,R.C. Staple, ed, John WileySons, New York, pp. 155-177, 1981), синтез и выделение гидролитических энзимов (Kombrink et al., Proc. Natl.Acad. Sci. USA 84:6750-6754, 1988), ригидификацию клеточных стенок растения (Bradley etal., Cell 70:21-30, 1992), и активацию эволюционной программы для ограничения гибели клеток. В случае успеха эти реакции сразу же останавливают рост внедрившегося микроорганизма. Помимо сообщений о патогенспецифичных сигналах, которые индуцируют экспрессию генов защиты хозяина, имеется ряд сообщений утверждающих, что диффузивные или передающиеся от "хозяина" сигналы включаются в упорядоченную систему защитных реакций растения. Например, Dixon et al. (Plantphysiol. 71:251-256, 1983) сообщили о том, что денатурированная РНК-аза способна индуцировать низкомолекулярный растворимый фактор,который активирует фенилпропаноидные биосинтетические энзимы и аккумуляцию фитоалексина как в гипокотилях сои, так и в клеточных суспензионных культурах. Graham и Graham (Plant Physiol. 105:571-578, 1994) также сообщили о том, что передающий сигнал, называемый "фактором способности элиситации",был выделен из травмированных клеток, и было обнаружено, что он индуцирует и усиливает реакции клеток на ранение в близко расположенных или непосредственно соседствующих клетках. Кроме того, Н 2 О 2 была идентифицирована как передающийся диффузивный сигнал,который способен селективно запускать индукцию клеткой-"хозяином" подкласса генов защиты (Levine et аl., Cell 79:583-593, 1994). Краткое изложение изобретения Настоящее изобретение относится к существенно очищенной композиции, выделенной из растительной клетки, причем указанная композиция способна активировать экспрессию гена сесквитерпенсинтазы в клетке растения. Заявленная композиция отличается тем, что(1) способна активировать экспрессию указанного гена сесквитерпенсинтазы в указанной клетке растения после обработки протеазой,пектиназой, ДНКазой или РНКазой;(2) способна активировать экспрессию указанного гена сесквитерпенсинтазы в указанной клетке растения после лиофилизации и восстановления;(3) не переходит в органическую фазу при экстракции добавлением гексана; и(4) включает способное к диффузии соединение, имеющее молекулярную массу менее или равную 10000 Дальтон. Далее, настоящее изобретение также относится к способу получения композиции, которая способна активировать экспрессию гена сесквитерпенсинтазы в клетке растения, причем данный способ включает а) обеспечение контактирования растительной клетки с таким количеством элиситина и при таких условиях, которые стимулируют продукцию указанной клеткой композиции, которая активирует экспрессию гена сесквитерпенсинтазы в клетке растения; и б) выделение указанной элиситининдуцированной композиции. Термин "изопреноид" означает вещество,которое построено на основе изопренового блока, в частности, изопреноидные соединения включают (без ограничения ими) монотерпены,дитерпены, сесквитерпены и стерины. Как уже здесь отмечалось, термин "растительный изопреноид" означает, что данный изопреноид обнаружен в растении, но это определение не должно истолковываться таким образом, чтобы исключались изопреноиды, которые обнаружены также и в других организмах, например, в источниках животного, грибкового или бактериального происхождения. Термин "элиситор" означает некое вещество, продуцированное патогеном, которое способно инициировать защитную реакцию растения. Примерами элиситоров являются (без ограничения ими) один или несколько токсических ионов, например, ионы ртути, другие вещества с определенной химической структурой, ингибиторы метаболизма, гликаны клеточной стенки,С-гликозидные элиситоры (см.например, Midland et al. J. Organic. Chemistry 58:2940; Smith etal. Tetrahedron Letters 34:223, 1993), некоторые гликопротеины, некоторые ферменты, грибковые споры, хитозаны и элиситины (например,гарпин, криптогеин и парисцеин). Под термином "элиситин" подразумевают элиситор белковой природы, как тот, например,что описан Yu et al., Proc. Natl. Acad. Sci. USA 92:4088-4094, 1995. Под композицией, индуцированной под действием элиситора, подразумевают композицию, которая получена из растительной клетки вследствие контакта этой клетки с элиситором. 3 Под "существенно чистой элиситориндуцированной композицией" подразумевают композицию (например, ЕСМ композицию,описанную здесь), которая была отделена, по крайней мере, частично от сопутствующих ей природных компонентов. Обычно композиция является существенно чистой, когда она очищена, по крайней мере, в 100 раз, предпочтительно, в 200 раз, более предпочтительно, в 300 раз,и наиболее предпочтительно, в 400 раз oт соединений и сопровождающих ее природных примесных органических веществ, с которыми она связана. Существенно чистая композиция,полученная в результате действия элиситора,может быть получена, например, в соответствии с описанными здесь способами (например, из растительных клеток). Чистоту определяют с помощью любого подходящего метода, например, с использованием стандартных хроматографических методов, например, высокоэффективной жидкостной хроматографии (ВЭЖХ). Другие детали и преимущества данного изобретения станут очевидными из нижеследующего описания предпочтительных вариантов осуществления изобретения. Подробное описание изобретения Графические материалы Фиг. 1 представляет собой схематичное отображение стадий биологического исследования, с помощью которого определяют, способен ли вторичный сигнал клетки-хозяина запускать процесс индукции изопреноидного биосинтетического энзима. Инкубированные в присутствии элиситина криптогеина и без него в среде Мурасиге-Скуга (MS) клетки табака запечатывали в диализную трубку (отсечение 1000 Дальтон) на различные промежутки времени и инкубировали в находящейся снаружи MS среде. Затем собирали образцы наружной среды, концентрировали лиофилизацией, определяли наличие вещества, способного индуцировать энзимную активность сесквитерпенсинтазы в свежеприготовленных суспензиях клеточных культур табака. Фиг. 2 графически показывает динамику распространения распространяющегося вторичного сигнала клеток табака. 10 мл суспензионной клеточной культуры табака + 4 г элиситина были запечатаны в диализную трубку и инкубированы в наружной MS среде. В указанные моменты времени собирали образцы наружной MS среды, подвергали 6-кратному концентрированию и соответствующие 1/20 собранных образцов аликвоты исследовали на способность индуцирования сесквитерпенсинтазной активности в суспензионной клеточной культуре табака. Фиг. 3 графически отражает сопоставление времени индуцирования сесквитерпенсинтазы в суспензионных культурах клеток табака, обработанных элиситином или элиситинкондиционированной средой. В экстрактах,приготовленных из контрольных культур (пока 002111 4 зано кривой с незаштрихованными кружками),культур, обработанных контрольной кондиционированной средой (ССМ, как показано на кривой с незаштрихованными квадратами), элиситин-кондиционированной средой (ЕСМ; показано на кривой с затушеванными квадратами), или элиситином (0,1 г/мл) (показано на кривой с затушеванными кружками) определяли активность энзима сесквитерпенсинтазы. Образцы кондиционированных сред (ССМ или ЕСМ) добавляли в концентрации, соответствующей 1/20 собранного образца наружной среды. На фиг. 4 А, 4 В, 4 С, 4 Д и 4 Е показаны фотографии РНК-блотов, показывающие индукцию экспрессии гена защиты растения в суспензионной культуре клеток табака, которые были обработаны EСМ. Блоты были гибридизованы с помощью следующих генных проб: сесквитерпенсинтаза (фиг. 4 А), кислая хитиназа (фиг. 4 В),щелочная хитиназа (фиг. 4 С), PR1 (фиг. 4 Д) иHsr203 (фиг. 4 Б). Фиг. 5 является схематической иллюстрацией того, что ЕСМ не регулирует выработки дополнительного распространяющегося вторичного сигнала. MS среду или ЕСМ образцы (5 мл) с 5 мл суспензионной культуры клеток табака или без нее, запечатанные в диализной трубке, инкубировали в 25 мл наружной MS среды. Аликвоту в 1 мл наружной MS среды отбирали спустя три, шесть и двенадцать часов инкубации, концентрировали путем лиофилизации и половину ресуспендированных образцов проверяли на способность индуцировать сесквитерпенсинтазу в суспензионной культуре клеток табака. Далее следует описание серии экспериментов, подтверждающих выделение и характеристику сигнального соединения, распространяющегося клеткой-хозяином, которое активирует экспрессию гена изопреноидсинтазы. Этот пример также предназначен для иллюстрации изобретения и его не следует рассматривать как ограничивающий изобретение. Биоисследование вторичных сигналов, способных индуцировать сесквитерпенсинтазную энзимную активность в клетках табака Стратегия эксперимента, используемая для исследования выхода распространяющегося хозяйского сигнала от элиситор-нагруженных клеток табака, показана на фиг. 1. Образцы кондиционированной среды готовили следующим образом: 2 мл клеток, 2 млMS среды, содержащей 0,5 г элиситина (среда только с элиситином) или 2 мл клеток (ССM) и 0,5 г элиситина (ЕСМ) были запечатаны в диализную трубку с отсечением 1000 Дальтон, и каждый образец отдельно инкубировали в 20 мл наружной среды в течение 16 ч. Образцы наружной MS среды каждого типа обработки были подвергнуты концентрированию в 8 раз лиофилизацией, и в 50 мл аликвотах (соответствую 5 щих 1/50 первоначальным 20 мл образцам среды) исследовали способность индуцировать сесквитерпенсинтазу при вторичной инкубации с 1 мл суспензионной культуры клеток табака. Результаты этих анализов показаны в табл. 1 (ниже). Было установлено, что клетки табака,инкубированные в MS среде без каких-либо добавок, содержат недетектируемые уровни активности сесквитерпенсинтазы. Тем не менее было установлено, что сесквитерпенсинтазная активность индуцировалась в клетках, обработанных непосредственно элиситиновым белком. При определении наличия распространяющегося сигнала было обнаружено, что контрольная кондиционированная среда (ССМ) (т.е. наружная MS среда, полученная в результате инкубации клеток табака, запечатанных внутри диализной трубки, в MS среде) не дает индукции сесквитерпенсинтазной активности. Было установлено, что содержащая элиситинкондиционированная среда (ЕСМ) (т.е. наружная среда, полученная в результате инкубирования клеток табака с элиситиновым белком внутри диализной трубки в среде), напротив, индуцировала сесквитерпенсинтазную активность в той же мере, как и когда к клеткам непосредственно добавляли элиситиновый белок криптогеин. Индукция синтазной активности в ЕСМ не являлась следствием какого-либо низкомолекулярного способного к диффузии компонента в составе элиситинового препарата, т.к. содержащая только элиситин среда (т.е. наружная MS среда, полученная от инкубации в MS среде аликвоты элиситинового белка внутри диализной трубки) не индуцировала существенно высокой синтазной активности. Обработка Ничего (только контрольные клетки, негативный контроль) Элиситин (0,1 г/мл, позитивный контроль) Контрольная кондиционированная среда (ССМ) Среда, содержащая только элиситин Кондиционированная среда, содержащая только элиситин (ЕСМ) Обусловленное ЕСМ зависимое от дозы индуцирование сесквитерпенсинтазной энзимной активности в суспензиях культуры клеток табака Для выяснения, является ли индукция сесквитерпенсинтазной активности дозозависимой, суспензионную культуру клеток табака инкубировали с различными количествами элиситина или ЕСМ. Образцы кондиционированной среды были приготовлены следующим образом: 20 мл одних клеток и 20 мл клеток, содержащих 8 г элиситина, были запечатаны в диализную трубку с отсечением 1000 Дальтон и инкубированы в 50 мл MS среды в течение 16 ч. Образцы наружной MS среды были затем сконцентрированы в 5 раз лиофилизацией, и аликво 6 ты, соответствующие 1/200, 1/50 и 1/25 первоначальных 50 мл образцов были исследованы на способность индуцировать сесквитерпенсинтазу в суспензионных клеточных культурах табака. Контрольные исследования включали инкубации 4 мл суспензионных культур клеток табака с соответствующими количествами MS среды(т.е. собственно MS среды), и клетки, инкубированные с 0,5 г/мл элиситина и соответствующими количествами MS среды (т.е. MS + элиситин). Как показано в табл. 2 (ниже), наблюдается зависимость от дозы ЕСМ индукции сесквитерпенсинтазной активности в клетках табака. Максимальная индукция активности синтазы обычно наблюдается с эквивалентом от 1/25 до 1/50 наружной MS среды. Этот расчет допускает стандартизированное соотношение объемов наружной среды и клеток, запечатанных (упакованных) в диализной трубке, как 2,5:1, соответственно. Однако соотношения объемов наружной среды и запечатанных клеток от 5:1 до 10:1,по-видимому, представляет более эффективное выделение диффузивного вторичного сигнала. Таблица II Активность энзима сесквитерпенсинтазы (нмоль/чмг белка) Аликвота Только MS MS + элиситин ССМ ЕСМ 2,8 36,5 0,8 3,0 50 л 2,0 40,9 0,8 20,8 200 л 2,0 42,9 1,4 31,6 400 л Как показано на фиг. 2, выделение способного к распространению сигнального соединения из клеток табака зависит от времени, причем приблизительно 1/2 максимального количества этого соединения выделялась в течение 4 ч от момента начала обработки элиситином. Более слабое выделение дополнительного вторичного сигнального фактора наблюдалось также еще и в последующие двадцать часов. Диффузивное соединение устойчиво по отношению к избранным гидролазам Для выяснения химической природы сигнального соединения выясняли чувствительность ЕСМ к некоторым гидролитическим энзимам. Гидролазы (т.е. протеаза Типа II из Aspergillus oryzae, пектиназа из Rhizobus sp., РНКаза А из поджелудочной железы крупного рогатого скота и ДНК-аза I) готовили в начальной концентрации 10 мг/мл и диализовали в течение ночи через трубку с отсечением 1 000 Дальтон. Аликвоты гидролаз, соответствующие 5 мг, затем инкубировали с 1 мл ЕСМ в течение 2-4 ч. ЕСМ-гидролазные смеси второй раз подвергали диализу с отсечением 1000 Дальтон против 5 мл воды. Отбирали пробы наружной воды, лиофилизировали, ресуспендировали до конечного объема 100 л и каждую пробу инкубировали с суспензионными культурами клеток табака в течение 16 ч, определяя активность энзима сесквитерпенсинтазы. Обработка ЕСМ протеазой,пектиназой, РНК-азой, или ДНК-азой не унич 7 тожала способности ЕСМ индуцировать синтазную активность (табл. III), что показывает либо устойчивость этого фактора к этим энзимам,либо что он не является белок- или пектинсодержащим фактором или фактором на основе РНК или ДНК. Непохоже также, что диффузивное соединение является H2 О 2 или родственным активированным кислородом вещества, т.к. ни обработка ЕСМ каталазой, ни лиофилизация ЕСМ не убавляли индуцированной синтазной активности; ожидалось, что обе эти обработки приведут к удалению из ЕСМ Н 2O2 или аналогичных окисленных кислородом фрагментов(данные не показаны). В соответствии с этим представлением непосредственное добавление Н 2 О 2 в широком диапазоне концентраций к клеточным культурам не индуцировало активности синтазы. Кроме того, диффузивное сигнальное соединение, по-видимому, не является гидрофобным, т.к. оно не разделяется в органических растворителях, таких как хлороформ или гексан; способность ЕСМ стимулировать активность сесквитерпенов также не изменялась в результате этих обработок. Обработка Ничего ЕСМ ЕСМ + протеаза ЕСМ + пектиназа ЕСМ + РНК-аза ЕСМ + ДНК-аза Диффузивное сигнальное соединение как первичный индуктор Диффузивное сигнальное соединение могло представлять собой либо первичное индуцирующее средство (т.е. цельный компонент сигнальной трансдукционной цепи, действующей с целью вызвать полный набор защитных реакций), либо сигнал мог представлять собой вторично переданное сообщение (т.е. компонент относительно низкой эффективности и специфичности для возбуждения защитных реакций,которые неспецифическим образом проявляются у отмирающих клеток). Если диффузивный фактор - первичное индуцирующее средство,тогда следует ожидать, что свойственная ему способность стимулировать активность сесквитерпенсинтазы и другие защитные реакции будет выше, чем активность элиситинового белка. Для того, чтобы различить эти возможности,определяли динамику активности сесквитерпенсинтазы, зависящую от времени индуцирования с помощью оптимальных количеств ЕСМ и элиситина. Как показано на фиг. 3, обработка ЕСМ вызывала значительно более быстрое индуцирование синтазной активности, чем обработка только элиситином, причем половина максимума активности приходилась на 5-6 ч после начала ЕСМ обработки только элиситином. Однако 8 и обработка ЕСМ, и обработка элиситином вызывали одни и те же максимальные значения синтазной активности между 14-ым и 15-ым часом после начала обработки. Видоизменяющиеся в зависимости от применения ЕСМ и элиситина кривые зависимостей синтазной активности от времени индукции сопровождались постоянно проводимыми измерениями синтазной мРНК (фиг. 4 А). мРНК индуцированной элиситином синтазы впервые наблюдалась между 3-им и 6-ым часом от начала обработки, уровень синтазной мРНК выравнивался через 14 ч эксперимента. Для сравнения,ЕСМ обработка вызывала быстрое накопление синтазной мРНК с максимумом ее аккумуляции,приходящимся приблизительно на третий час после начала обработки (фиг. 4 А). Спустя 3 ч уровень мРНК синтазы снижался. Обработки элиситором и элиситином обычно связывают с индукцией некоторых других генов защиты,включая гены PR белков и гидролаз, например,хитиназы и глюканазы. Для определения спектра защитных генов,индуцированных ЕСМ, устанавливали модели генной индукции хитиназы, PR1 и Hsr203 и сравнивали с моделями индукции, полученными в результате обработки элиситином (фиг. 4 В 4 Е). ЕСМ обработка индуцировала и кислую, и щелочную хитиназы более быстро, чем обработка элиситином (фиг. 4 В и 4 С), несмотря на то, что зависимости индукции от времени значительно отставали по сравнению с такими же для синтазной мРНК. мРНК PR1 легко определялась в контрольных клеточных культурах, и,по-видимому, ее немного, если вообще имеет место какая-либо модуляция уровня этой мРНК под воздействием ЕСМ обработки и обработки элиситином (фиг. 4 Д). Основываясь, однако, на относительной интенсивности сигнала гибридизации, ЕСМ обработка индуцировала большее накопление Hsr203 мРНК, чем обработка элиситином. Диффузивный сигнал не влияет на испускание дополнительного сигнала. Если диффузивный сигнал, обнаруженный в ЕСМ, служил средством предостережения соседним клеткам,тогда он может также стимулировать подачу дополнительных диффузивных сигналов от клеток, на которые он воздействует. Чтобы определить такую возможность, сравнивали выделение диффузивных факторов клетками, запечатанными в трубках с 10000 Дальтонным отсечением, содержащих ЕСМ, и выделение диффузивного фактора только ЕСМ, запечатанной в диализной трубке (фиг. 5). Результаты показали,что преобладающая доля диффузивного фактора выделялась образцом, содержащим только ЕСМ, в течение первых трех часов эксперимента. Несколько сниженный уровень диффузивного фактора был получен от ЕСМ-обработанных клеток также в течение такого же интервала времени. Никакого дополнительного диффузив 9 ного фактора в образцах обработанных ЕСМ клеток в более поздние моменты времени не было определено, что показывает, что диффузивный сигнал сам не вызывает выделения других сигнальных веществ. Вышеописанные опыты выполнялись согласно следующим методикам. Клеточные культуры и описание экспериментов Клеточные суспензионные культурыNicotiana tabacum cv. Kentucky 14 поддерживались в среде Мурасиге-Скуга (MS), подращивались в течение недели и их рост контролировали измерением прироста массы клеток, как это описано Chappell и Nable (Plant Physiol. 85:469473, 1987). Во всех выше представленных экспериментах использовали культуры в логарифмической фазе роста. Эксперименты по индукции выполнялись как обычно на 12-луночных платах для тканевых культур, содержащих 1 мл аликвоты суспензионной культуры клеток на каждую лунку. Обработку элиситором начинали с добавления 0,1-0,5 г элиситинового белка криптогеина Phytophthora cryptogea к 1 мл клеточной суспензионной культуры (Blein et al.Plant Physiol. 95:486-491, 1991). Клетки собирали фильтрованием под вакуумом и хранили замороженными в жидком азоте, пока не требовались для анализа. Для того, чтобы исследовать диффузивный вторичный, происходящий от клетки-хозяина сигнал, аликвоты суспензионных культур клеток табака с добавлением элиситинового белка криптогеина и без него запечатывали внутрь диализной мембраны, не пропускающей частицы с молекулярной массой от 1 000 Дальтон (Spectra/por). Диализную трубку затем инкубировали на качалке в МS среде, образцы наружной MS среды собирали в различные моменты времени и лиофилизировали. Лиофилизированные образцы ресуспендировали в стерильной воде при 5-10-кратном превышении концентрации по сравнению с собранными образцами и использовали непосредственно в последующих инкубационных исследованиях сесквитерпенсинтазы в культурах клеток табака,как описано выше. Определение энзима сесквитерпенсинтазы Замороженные клетки табака гомогенизировали в 400-800 л 80 мМ натрий-фосфатного буфера(рН 7,0), 20% глицерина, 10 мM метабисульфита натрия, 10 мМ аскорбата натрия, 15 мМ хлорида магния и 5 мМ ДДТ с помощью механического гомогенизатора, предназначенного для работы с пробирками Эппендорфа, и полученный шлам центрифугировали в течение 10 мин в микроцентрифуге при 12000 Да. Определение синтазы осуществляли путем инкубирования 5-10 л аликвот супернатанта (5-25 г общего белка),1,5 нмоль [3H]FPP (87 Сi/моль) и основного реакционного буфера (0,5 М Трис 7,5, 0,2 М МgСl2) для доведения до конечного объема 50 л, в течение 30 мин при 37 С перед экстракци 002111 10 ей 150 л н-гексана. Гексановую фракцию затем подвергали обработке порошком кремния, чтобы связать фарнезол, образовавшийся в результате активности фосфатазы. Затем, в соответствии со стандартными методами, определяли радиоактивность в аликвоте (50 л) гексановой фазы. Активность сесквитерпенсинтазы выражали в нмолях циклического продукта, образовавшегося в час на 1 мг белка. Полная структура сесквитерпенового продукта была предварительно охарактеризована как 5-эпиаристолохенWhitehead и Threlfall (1992). РНК блоты Общую клеточную РНК экстрагировали и гибридизовали, как описано Pepper et al. (Cell 78:109-116, 1994). Гибридизационные пробы представляли собой кДНК сесквитерпенсинтазы табака (Back and Chappell, J. Biol. Chem. 270:7375-7381 (1995, кислой и щелочной хитиназ (см. например, Lawton et al., Plant Mol.(см. например, Pontier et al., Plant J. 5:507-521,1994). Характеристика Дальнейший анализ существенно чистой элиситор-индуцированной композиции (например, ЕСМ) выполняли с помощью обычно применяемых методов очистки. Например, дальнейшая характеристика и фракционирование композиции выполнялись такими методами, как хроматография (например, ионообменная, гельфильтрация по величине молекулярной массы,ВЭЖХ или ВЭЖХ с обращенной фазой), газовая хроматография(G-C),GC-массспектроскопия или другие спектроскопические методы, такие как ИК- или ЯМР-спектроскопии. Кроме того, другие свойства элиситориндуцированных композиций изобретения могут быть определены с помощью ряда гидролитических энзимов (например, целлюлазы, полигалактуроназы, пектиназы, пектолиазы, хитиназы, глюканазы, протеаз или протеиназ), также как и стандартными кислотно-щелочными гидролазами при подборе стандартных условий. Применение Описываемое изобретение пригодно для различных сельскохозяйственных и коммерческих целей, в том числе (но не только) для контроля, модулирования и регулирования экспрессии генов (например, фармацевтически полезного вещества), увеличения урожайности,улучшения урожая и его товарного вида, снижения стоимости сельскохозяйственной продукции. Способы данного изобретения обеспечивают простое средство для получения существенно чистых композиций, которые способны активировать гены, вовлеченные в синтез некоего ряда изопреноидных соединений (например,метаболитов, таких как стерины, каротиноиды,регуляторы роста, и полипренольных замените 11 лей долихолов, хинонов и белков; монотерпенов; дитерпенов и сесквитерпенов). Активируя эти генетические направления, композиции модулируют множество биологических функций,включающее (без ограничения ими) поддержание мембранной целостности, светопротектирование и взаимодействия, связанные с защитой клеток. Таким образом, описанные здесь методы представляют ценность для сельского хозяйства в отношении приготовления композиций, которые могут использоваться для защиты растений. Такие элиситор-индуцированные композиции можно получить на основе множества растений, в том числе (но не только) пород деревьев, декоративных видов растений, фруктовых пород средней климатической зоны, фруктовых пород тропического климата, овощных культур,бобовых, односемядольных, двусемядольных растений или любого растения, имеющего значимость в отношении коммерческого или сельскохозяйственного применения. Особыми примерами подходящих растений являются (но без ограничения ими): хвойные деревья, петуния,томаты, картофель, табак, салат, подсолнечник,рапс, лен, хлопок, сахарная свекла, сельдерей,соя, люцерна, лотос, огурец, морковь, баклажан,цветная капуста, хрен, ипомея, тополь, грецкий орех, яблоня, спаржа, рис, кукуруза, просо, лук,ячмень, овес, рожь и пшеница. Для сельскохозяйственных целей элиситор-индуцированные композиции или средства,отождествляемые с использованием описанных здесь методов, пригодны в качестве химических средств, применяемых в виде спреев или порошков на листья растений. Обычно такие средства наносятся на растения поверхностно до заражения для предотвращения инфицирования. Семена, луковицы, корни, клубни и клубнелуковицы могут также быть обработаны для предотвращения болезнетворных инфекций после посадки при контроле за находящимися на них патогенами или находящимися в почве в месте посадки. Почва, в которую сажают овощи, декоративные растения, кустарники или деревья,может также быть обработана элиситориндуцированной композицией в качестве фумиганта для контроля за множеством микробных патогенов. Предпочтительно обработку проводят за несколько дней или недель до посадки. Композиция данного изобретения может быть применена стандартным механизированным способом, например, с помощью трактора или вручную. Композиции данного изобретения могут также использоваться для стимулирования или усовершенствования различных свойств растений, включая светопротектирование или синтез регуляторов роста или пигментов растений. Все публикации, упомянутые в этом описании, включены в описание посредством ссылки. 12 Другие виды воплощения изобретения Из вышеизложенного с очевидностью вытекает, что могут быть осуществлены варианты и модификации данного изобретения, описанного здесь, с целью расширения областей и условий использования. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. По существу очищенная композиция,выделенная из растительной клетки, причем указанная композиция способна активировать экспрессию гена сесквитерпенсинтазы в клетке растения, отличающаяся тем, что(1) указанная композиция способна активировать экспрессию указанного гена сесквитерпенсинтазы в указанной клетке растения после обработки протеазой, пектиназой, ДНКазой или РНКазой;(2) указанная композиция способна активировать экспрессию указанного гена сесквитерпенсинтазы в указанной клетке растения после лиофилизации и восстановления;(3) указанная композиция не переходит в органическую фазу при экстракции добавлением гексана; и(4) указанная композиция включает способное к диффузии соединение, имеющее молекулярную массу, менее или равную 10000 Дальтон. 2. Композиция по п.1, отличающаяся тем,что указанное способное к диффузии соединение имеет молекулярную массу, менее или равную 1000 Дальтон. 3. Композиция по п.1, отличающаяся тем,что указанная сесквитерпенсинтаза представляет собой эпи-5-аристолохенсинтазу. 4. Композиция по п.1, отличающаяся тем,что указанная растительная клетка выбрана из группы, состоящей из клетки табака, клетки томата и клетки картофеля. 5. Способ получения композиции, которая способна активировать экспрессию гена сесквитерпенсинтазы в клетке растения, причем данный способ включает: а) обеспечение контактирования растительной клетки с таким количеством элиситина и при таких условиях, которые стимулируют продукцию указанной клеткой композиции, которая активирует экспрессию гена сесквитерпенсинтазы в клетке растения; и б) выделение указанной элиситининдуцированной композиции, которая(1) способна активировать экспрессию указанного гена сесквитерпенсинтазы в указанной клетке растения после обработки протеазой,пектиназой, ДНКазой или РНКазой;(2) способна активировать экспрессию указанного гена сесквитерпенсинтазы в указанной клетке растения после лиофилизации и восстановления;(3) не переходит в органическую фазу при экстракции добавлением гексана; и(4) включает способное к диффузии соединение, имеющее молекулярную массу, менее или равную 10000 Дальтон. 6. Способ по п.5, отличающийся тем, что способное к диффузии указанное соединение имеет молекулярную массу, менее 1000 Дальтон. 7. Способ по п.6, отличающийся тем, что композицию выделяют путем диализа. 14 8. Способ по п.5, отличающийся тем, что указанный элиситин представляет собой криптогеин. 9. Способ по п.5, отличающийся тем, что указанная растительная клетка выбрана из группы, состоящей из клетки табака, клетки томата и клетки картофеля. 10. Способ по п.5, отличающийся тем, что указанная сесквитерпенсинтаза представляет собой эпи-5-аристолохенсинтазу. 11. Способ по п.5, отличающийся тем, что композицию выделяют фракционированием по размеру. Фиг. 4 Е Примечание: Обозначения "h" и "elicitin" на фиг. 4 В-4 Д имеют такие же значения, как и на фиг. 4 А.
МПК / Метки
МПК: A01N 61/00, C12P 1/00, C08F 36/08
Метки: выделенная, способ, растительной, гена, очищенная, способная, экспрессию, композиция, получения, активировать, сесквитерпенсинтазы, клетки, существу
Код ссылки
<a href="https://eas.patents.su/9-2111-po-sushhestvu-ochishhennaya-kompoziciya-vydelennaya-iz-rastitelnojj-kletki-sposobnaya-aktivirovat-ekspressiyu-gena-seskviterpensintazy-i-sposob-eyo-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">По существу очищенная композиция, выделенная из растительной клетки, способная активировать экспрессию гена сесквитерпенсинтазы, и способ её получения</a>
Предыдущий патент: Преобразование сигнала с импульсно-кодовой модуляцией в сигнал с широтно-импульсной модуляцией с равномерным распределением
Следующий патент: Носитель данных и способ его изготовления
Случайный патент: Способ производства сока и сок, полученный данным способом