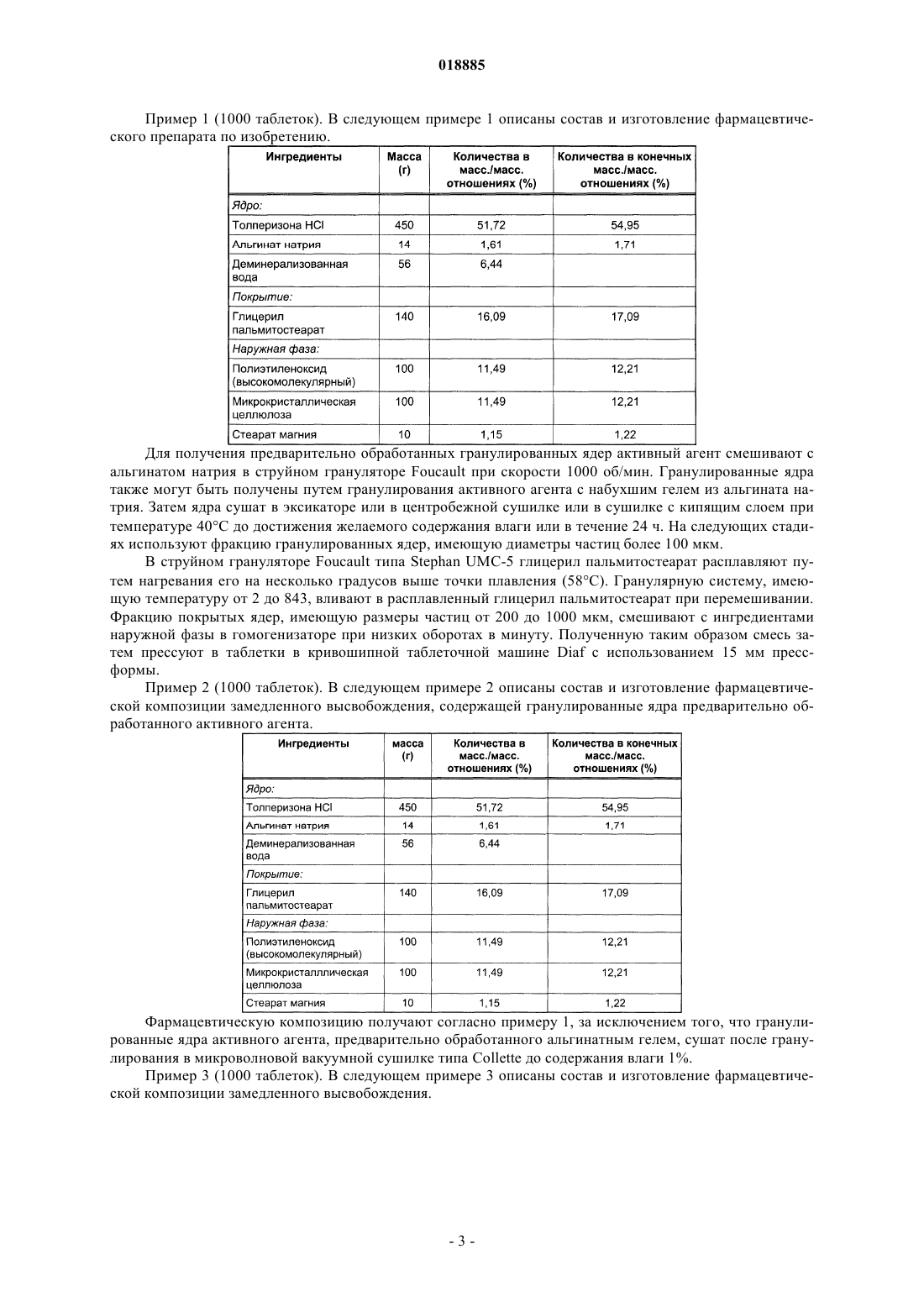
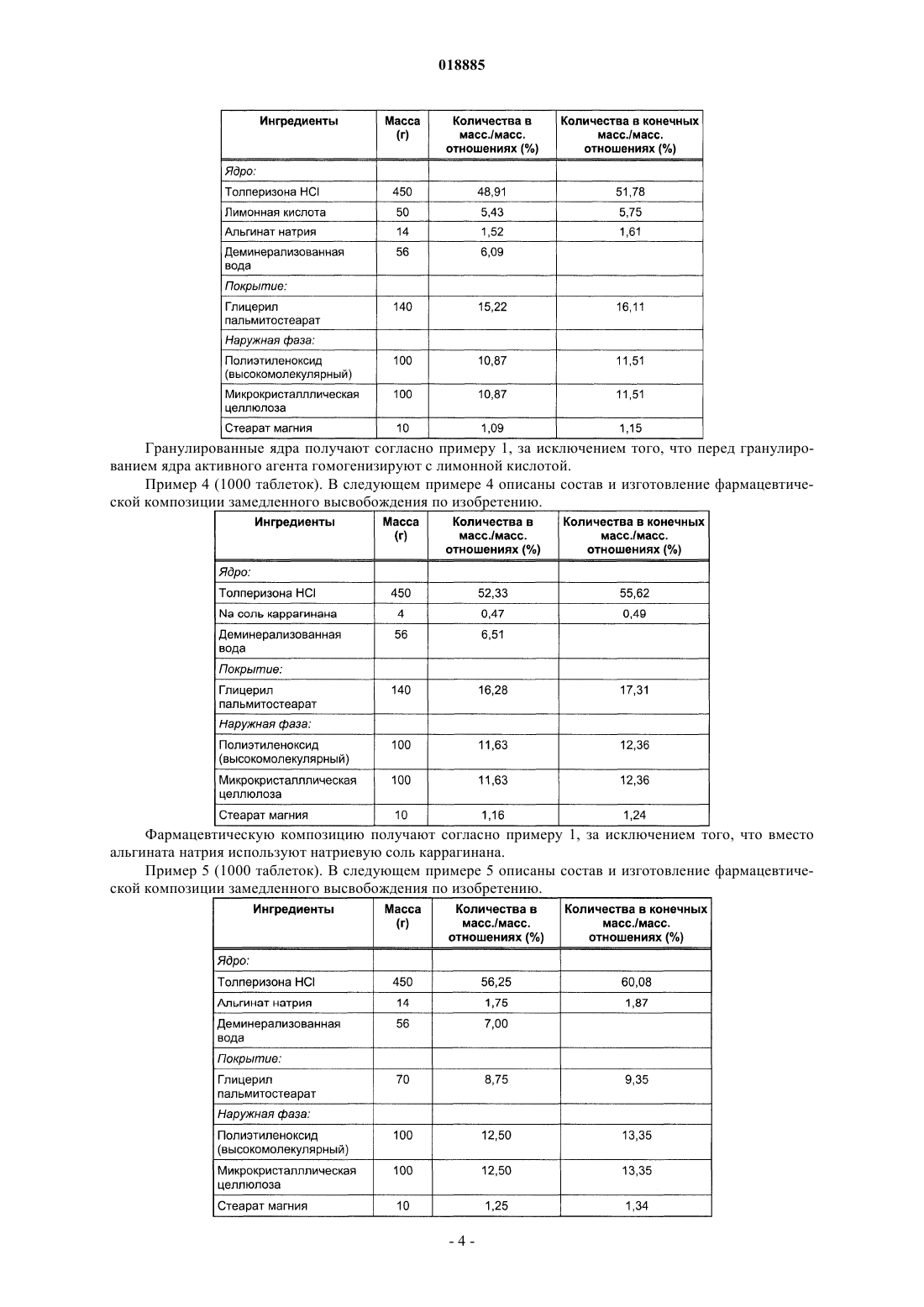
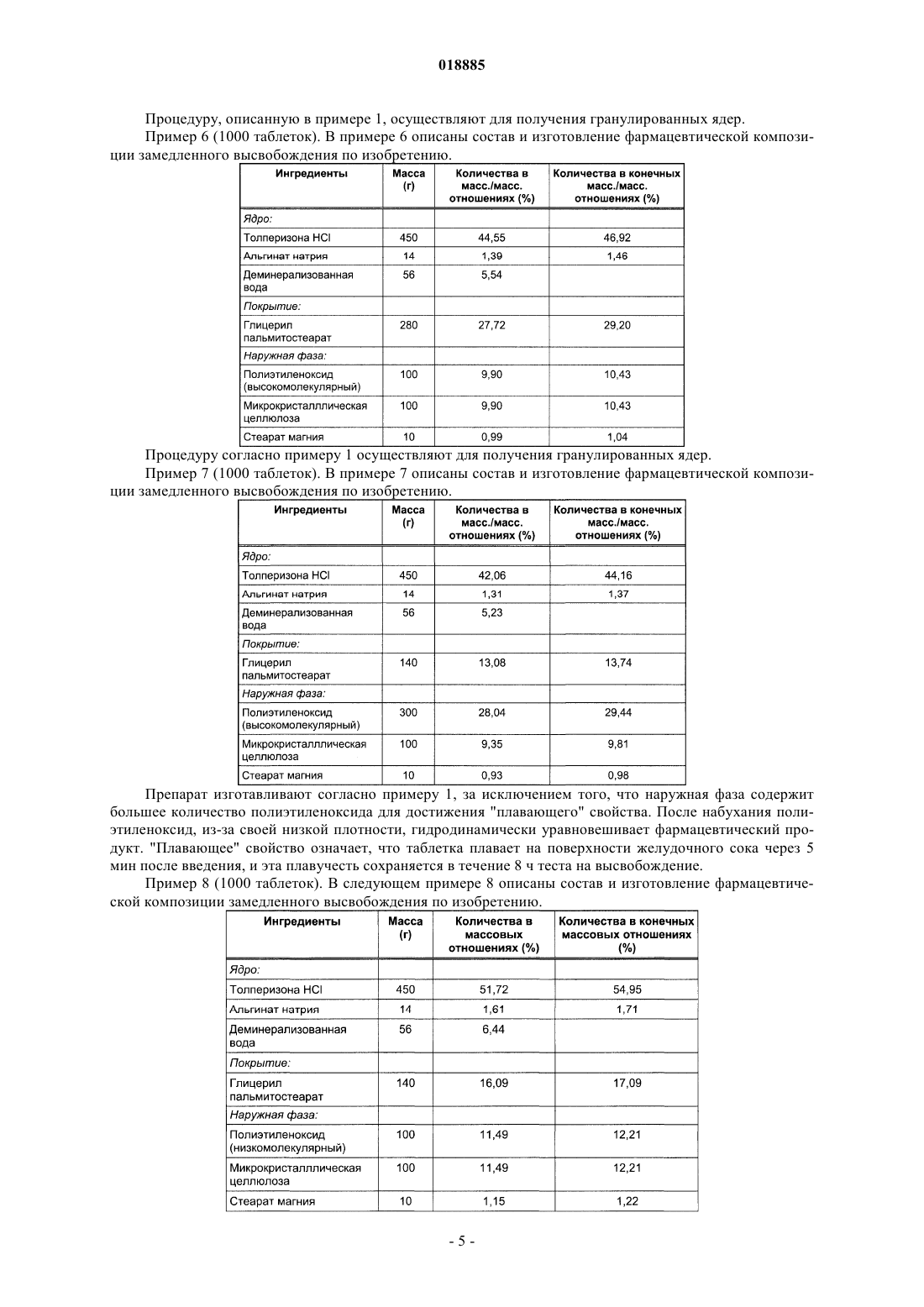
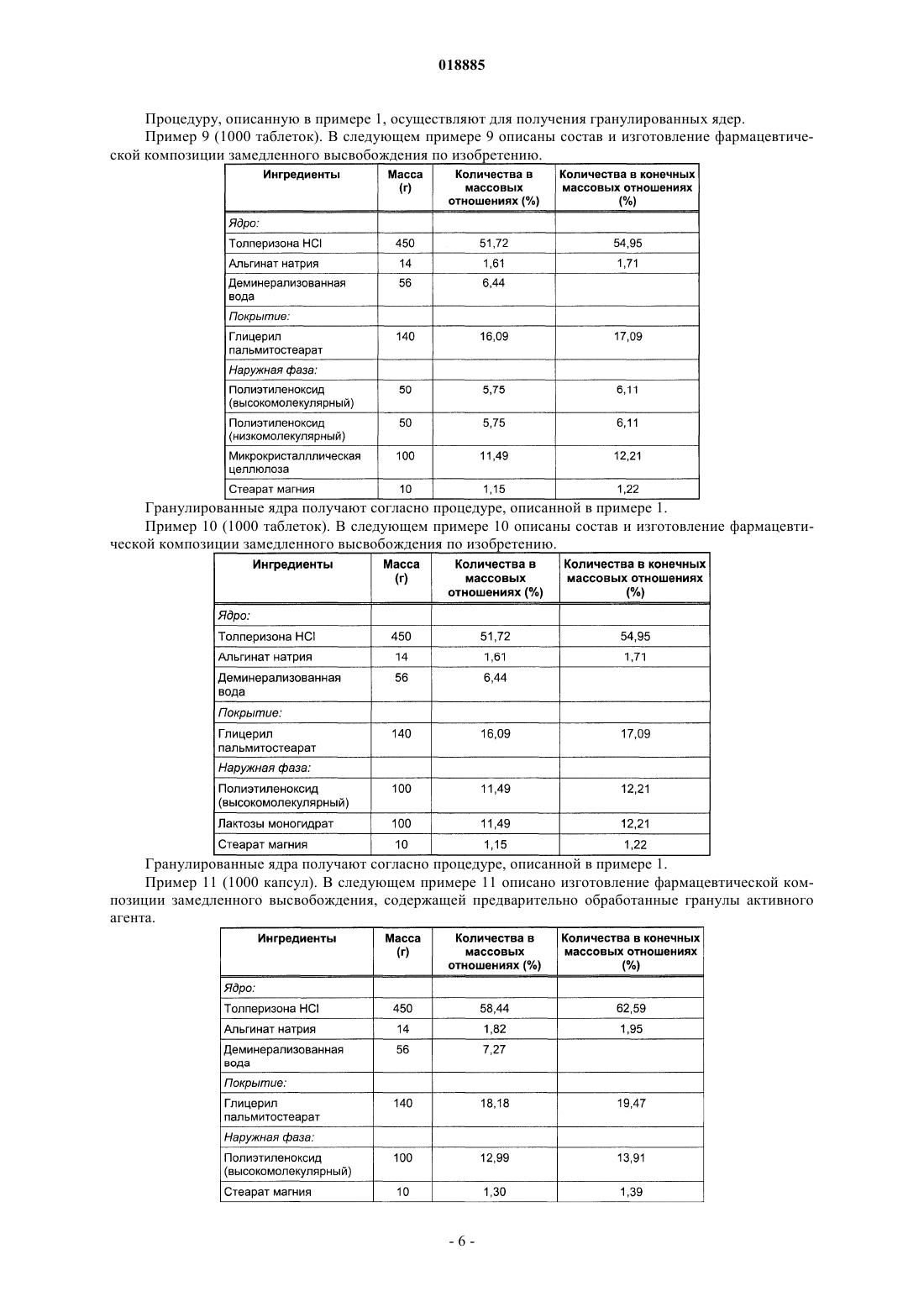
Фармацевтическая композиция контролируемого высвобождения, содержащая толперизона гидрохлорид
Номер патента: 18885
Опубликовано: 29.11.2013
Авторы: Ноцаль Бела, Зелько Романа, Оргован Габор, Штиедль Бернадетт, Анталь Иштван, Киш Дороттья, Клебович Имре
Формула / Реферат
1. Фармацевтическая композиция контролируемого высвобождения, содержащая толперизона гидрохлорид в качестве активного ингредиента, отличающаяся тем, что содержит гранулированные ядра активного ингредиента, включающие природный анионный полимер, выбранный из альгиновой кислоты, или альгината натрия, или каррагинана, или каррагинана натрия, при этом ядра покрыты липофильным наполнителем, выбранным из глицерил пальмитостеарата или глицерил бегената, и в заключение, диспергированы в гидрофильном матрицеобразующем наполнителе, представляющем собой полиэтиленоксид, и фармацевтически приемлемых наполнителях.
2. Фармацевтическая композиция по п.1, где природный анионный полимер содержится в количестве 0,1-5 мас.% в расчете на общую массу композиции.
3. Фармацевтическая композиция по п.1 или 2, где размер гранулированных ядер, образованных природным анионным полимером, находится в диапазоне от 100 до 800 мкм.
4. Фармацевтическая композиция по любому из пп.1-3, где липофильный наполнитель представляет собой глицерил пальмитостеарат.
5. Фармацевтическая композиция по любому из пп.1-4, где размер гранулированных ядер после покрытия липофильным наполнителем находится в диапазоне от 200 до 1200 мкм.
6. Фармацевтическая композиция по любому из пп.1-5, где фармацевтически приемлемый наполнитель представляет собой органическую кислоту, предпочтительно лимонную кислоту.
7. Фармацевтическая композиция по п.6, где количество лимонной кислоты находится в диапазоне от 5 до 15 мас.% от общей массы композиции.
8. Способ получения фармацевтической композиции по любому из пп.1-7, отличающийся тем, что толперизона гидрохлорид гранулируют с коллоидным раствором в воде природного анионного полимера, выбранного из альгиновой кислоты, или альгината натрия, или каррагинана, или каррагинана натрия, при значении рН 4,5, полученное гранулированное ядро покрывают расплавом липофильного наполнителя с образованием покрытия, гранулируют полученные ядра с матрицеобразующим наполнителем и фармацевтически приемлемыми наполнителями, и прессуют полученную композицию в виде таблеток.
Текст
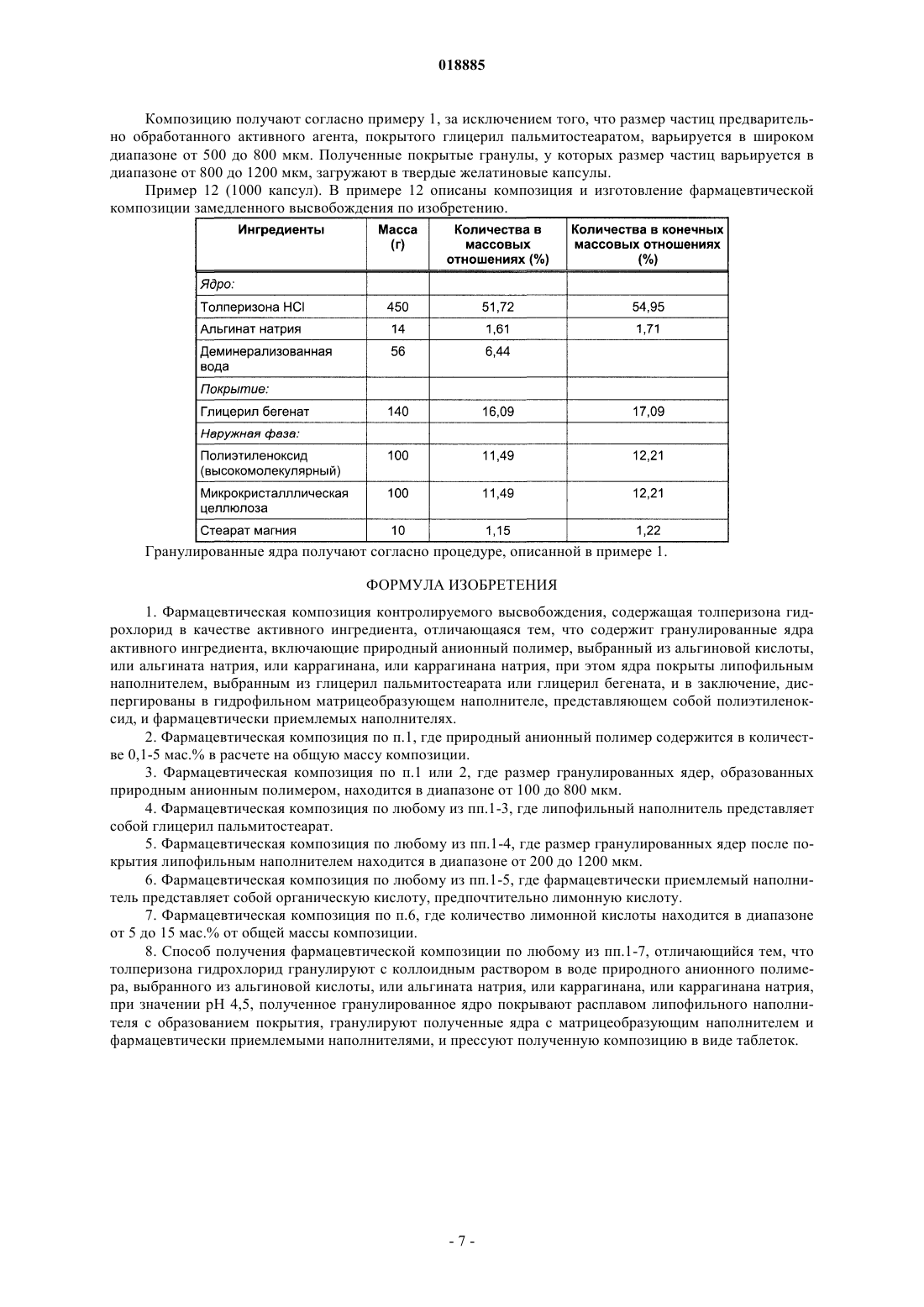
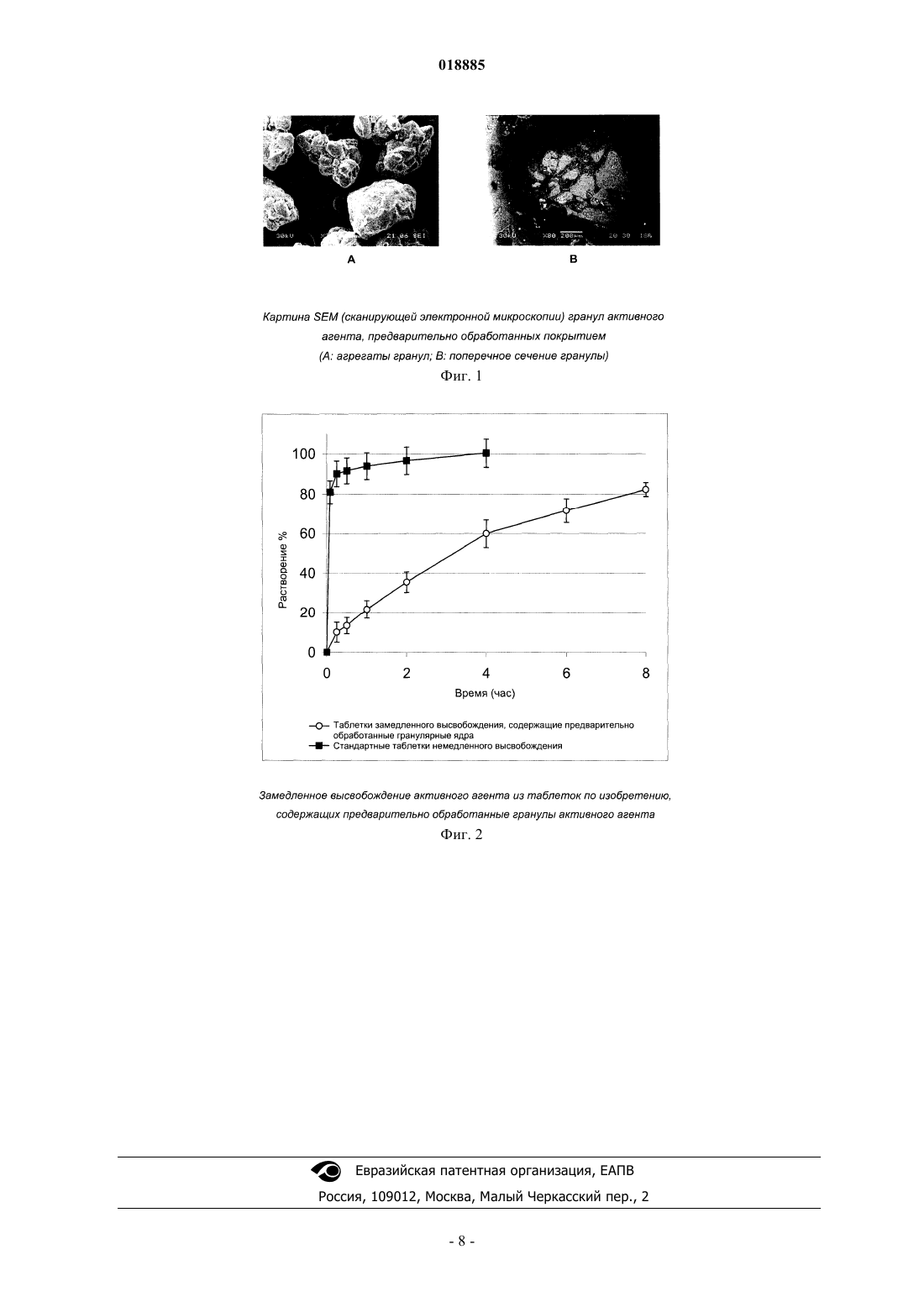
ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ КОНТРОЛИРУЕМОГО ВЫСВОБОЖДЕНИЯ,СОДЕРЖАЩАЯ ТОЛПЕРИЗОНА ГИДРОХЛОРИД Изобретение относится к фармацевтическим композициям, содержащим толперизона гидрохлорид,с контролируемым высвобождением активного агента и к способу их получения. Фармацевтическая композиция контролируемого высвобождения по изобретению содержит сложные гранулированные ядра, образованные природным анионным полимером и липофильным наполнителем, гидрофильный матрицеобразующий наполнитель, который окружает ядра, и другие фармацевтически приемлемые наполнители. Область техники Изобретение относится к фармацевтическим композициям, содержащим толперизона гидрохлорид,с контролируемым высвобождением активного агента, и к способу их получения. Предшествующий уровень техники Фармацевтическая композиция контролируемого высвобождения по изобретению содержит сложные гранулированные ядра, образованные природным анионным полимером и липофильным наполнителем, гидрофильный матрицеобразующий наполнитель, который окружает ядра, и другие фармацевтически приемлемые наполнители. Толперизон представляет собой миорелаксант центрального действия со значительными фармакологическими эффектами. Особым фармакокинетическим свойством активного агента толперизона является прекрасная адсорбция из предвздошной кишки после перорального введения, где максимальная концентрация в плазме(Cmax) достигается в течение 0,5-1 ч после введения, однако биодоступность составляет примерно 20% вследствие значительного пресистемного метаболизма. Поскольку дозировка толперизона обычно составляет одну таблетку три раза в сутки, желательным является препарат замедленного высвобождения для введения "один раз в сутки", который обеспечивает суточную дозу активного агента толперизона гидрохлорида 450 мг путем введения один раз в сутки. Многочисленные заявки на патенты и ссылки касаются получения толперизонсодержащих фармацевтических препаратов пролонгированного действия. В описании патента Венгрии 208920 (Sinnreich) раскрыта покрытая оболочкой твердая фармацевтическая композиция пролонгированного действия, причем после перорального введения дозы композиция остается в желудке, обеспечивая непрерывное высвобождение активного агента, в то время как периодически происходит очистка желудка. Указанная композиция содержит гидрофильный набухающий компонент и гидрокарбонат натрия, высвобождающий газообразный диоксид углерода. Указанные компоненты окружены мембраной (поливиниловый спирт, сложный эфир жирной кислоты и полиэтиленгликоля). Однако продукция газообразного диоксида углерода зависит, с одной стороны, от значения рН в желудке, а с другой стороны, это неблагоприятно с физиологической точки зрения. В описании патента ВенгрииР 0200669 раскрыт способ получения пероральной композиции пролонгированного действия, содержащей толперизон или его фармацевтически приемлемую соль. В этом документе описаны 4 способа получения композиций пролонгированного действия. Согласно способу активный агент покрывают смесью метанола и раствора синтетического, полусинтетического или природного гидрогеля в хлороформе в колонке в потоке воздуха; или микрокапсулы, содержащие толперизон, суспендируют в водном растворе, насыщенном толперизоном. Согласно следующему способу воду добавляют к гидрогелю, затем смесь гранулируют, сушат и образуют массу путем смешивания гранул с толперизоном, и полученную смесь разбавляют раствором гидрогеля в этаноле. Полученную таким образом массу гранулируют, затем смешивают с таблетирующими наполнителями и прессуют таблетки. Согласно четвертому способу толперизон, лактозу и гидрогель гранулируют водным раствором. Полученный гранулированный материал просеивают со стеаратом магния и тонкодисперсным диоксидом кремния, затем гомогенизируют и прессуют в таблетки. Недостатком четвертого способа является то, что применение хлороформа является вредным для здоровья. В опубликованных международных заявках на патент WO 2005/094825 и WO 2005/094676 (Sanochemie) раскрыта оболочка контролируемого высвобождения, содержащая полимеры типа Eudragit. Недостатком данной процедуры является устаревший способ таблетирования с использованием органических растворителей. Задача авторов изобретения состояла в том, чтобы предложить способ получения фармацевтической композиции пролонгированного действия, содержащей толперизона гидрохлорид, с помощью которого недостатки способов, описанных в технической литературе, устранены, тогда как преимущества известных решений сохранены. Сущность изобретения В ходе экспериментов, осуществленных авторами изобретения, гранулы, покрытые гидрогелем, погружали в липофильный наполнитель. Полученные агломераты показаны в фиг. 1. В полученной гранулярной системе гранулы активного агента сцеплены и частично покрыты гелем, образованным из анионного полимера. Липофильный слой наносят на гранулярную систему, с помощью которой гранулы дополнительно сцепляются и погружаются. Гранулярная система, образованная покрытием из гидрогеля,имеет диапазон размеров частиц от 100 до 800 мкм, предпочтительно от 200 до 600 мкм. После нанесения липофильного слоя размер частиц полученной гранулярной системы составляет от 200 до 1200 мкм,предпочтительно от 300 до 1000 мкм. Ядра гранул, погруженные в липофильный наполнитель, могут быть диспергированы в гидрофильном матрицеобразующем наполнителе твердой лекарственной формы. Авторы изобретения неожиданно обнаружили, что при одновременном использовании липофильных и гидрофильных наполнителей и при предварительной обработке активного агента получили новую систему контролируемого высвобождения, которая одновременно обеспечивает поддерживающие растворение эффекты липофильных наполнителей и ограничивающие диффузию эффекты гидрофильных набу-1 018885 хающих наполнителей. На фиг. 2 можно видеть, что таблетки по изобретению демонстрируют пролонгированное высвобождение активного агента. Тесты на высвобождение осуществляли с использованием аппарата типа Hanson SR8 в 500 мл среды для высвобождения при температуре 371 С, рН 1,2. Среду для высвобождения перемешивали роторами при скорости 50 об/мин. Содержание активного агента в образцах, отбираемых в заранее определенные моменты времени, измеряли посредством спектрофотометрического анализа (260 нм). Фармацевтическая композиция по изобретению обеспечивает контролируемое высвобождение толперизона гидрохлорида в желудке и/или в верхней части подвздошной кишки. Помимо ее благоприятного фармакокинетического профиля и эффекта пролонгированного высвобождения, дополнительным преимуществом фармацевтической композиции по изобретению является содержание органической угольной кислоты. Благодаря содержанию угольной кислоты химическое разложение активного агента замедляется. Органическая кислота, предпочтительно лимонная кислота, присутствует в количествах, варьирующихся от 5 до 15 мас.% от общей массы композиции. Композиция по изобретению демонстрирует следующий профиль растворения: по меньшей мере 20%, но не более 60% активного агента высвобождается из композиции в течение 2 ч после введения; по меньшей мере 30%, но не более 70% активного агента высвобождается из композиции в течение 4 ч после введения; по меньшей мере 40%, но не более 85% активного агента высвобождается из композиции в течение 6 ч после введения и по меньшей мере 50% активного агента высвобождается из композиции в течение 8 ч после введения. Изобретение относится к фармацевтической композиции для контролируемого высвобождения толперизона гидрохлорида, которая содержит сложные гранулированные ядра, образованные природным анионным полимером и липофильным наполнителем, гидрофильный матрицеобразующий наполнитель,который окружает ядра, и другие фармацевтически приемлемые ингредиенты. В фармацевтической композиции по изобретению природный анионный полимер может представлять собой карбомер, карбоксиметиловый крахмал, натрийкарбоксиметиловый крахмал, кармеллозу,кармеллозу кальция, кармеллозу натрия, каррагинан, каррагинан натрия, сшитую кармеллозу, сшитую кармеллозу натрия, альгинат натрия или альгиновую кислоту. В предпочтительной форме осуществления настоящего изобретения природный анионный полимер представляет собой альгинат натрия или альгиновую кислоту, и природный анионный полимер присутствует в количестве от 0,1 до 5 мас.% от общей массы композиции, размер частиц системы гранулированных ядер составляет от 100 до 800 мкм, более предпочтительно от 200 до 600 мкм. В фармацевтической композиции по изобретению липофильный наполнитель может представлять собой жирную кислоту, сложный эфир жирной кислоты, простой эфир жирной кислоты, предпочтительно глицерил пальмитостеарат, глицерил бегенат, цетилстеарат, пчелиный воск (сложный эфир мирицилового спирта), парафин, карнаубский воск, цетиловый сложный эфир, спирт карнаубского воска, гидрогенизированное касторовое масло, стеарат кальция, цетил(стеариловый) спирт, глицерина моностеарат,полиэтиленгликоля стеарат, сложный эфир сорбита и жирной кислоты, стеариновую кислоту, пальмитиновую кислоту, простой эфир полиэтиленгликоля и жирного спирта, сложный эфир полиэтиленгликоля и жирной кислоты. В другой предпочтительной форме осуществления изобретения точка плавления липофильного наполнителя находится ниже 110C, и он присутствует в композиции в количествах, варьирующихся в диапазоне от 5 до 50 мас.%, предпочтительно от 10 до 30 мас.% на основании общей массы композиции. После покрытия липофильным наполнителем размер частиц гранулярной системы составляет от 200 до 1200 мкм, предпочтительно от 300 до 1000 мкм. В фармацевтической композиции по изобретению гидрофильный матрицеобразующий наполнитель, присутствующий в наружной фазе, благодаря его низкой плотности после набухания, обеспечивает"плавающие" свойства композиции. В предпочтительной форме осуществления изобретения гидрофильный матрицеобразующий наполнитель, который окружает ядра из фармацевтической композиции, представляет собой полиэтиленоксид. В предпочтительной форме осуществления изобретения активный агент фармацевтической композиции гомогенизируют с органической кислотой, предпочтительно с 5-15 мас./мас.% лимонной кислоты. Настоящее изобретение также включает способ получения фармацевтической композиции контролируемого высвобождения, содержащей толперизона гидрохлорид, включающий следующие стадии: активный агент гранулируют с коллоидным раствором природного анионного полимера, не содержащим органические растворители, при значении рН 4,5, полученное гранулированное ядро покрывают расплавом липофильного наполнителя или любым видом его физической смеси, и его гранулируют, затем полученные таким образом покрытые гранулированные ядра смешивают с матрицеобразующим наполнителем и с другими наполнителянаполнителями, и полученную в результате смесь прессуют в таблетки. Сведения, подтверждающие возможность осуществления изобретения Изобретение далее объяснено подробно с помощью следующих примеров, которые даны для иллюстрации изобретения, а не для ограничения его объема. Пример 1 (1000 таблеток). В следующем примере 1 описаны состав и изготовление фармацевтического препарата по изобретению. Для получения предварительно обработанных гранулированных ядер активный агент смешивают с альгинатом натрия в струйном грануляторе Foucault при скорости 1000 об/мин. Гранулированные ядра также могут быть получены путем гранулирования активного агента с набухшим гелем из альгината натрия. Затем ядра сушат в эксикаторе или в центробежной сушилке или в сушилке с кипящим слоем при температуре 40 С до достижения желаемого содержания влаги или в течение 24 ч. На следующих стадиях используют фракцию гранулированных ядер, имеющую диаметры частиц более 100 мкм. В струйном грануляторе Foucault типа Stephan UMC-5 глицерил пальмитостеарат расплавляют путем нагревания его на несколько градусов выше точки плавления (58 С). Гранулярную систему, имеющую температуру от 2 до 843, вливают в расплавленный глицерил пальмитостеарат при перемешивании. Фракцию покрытых ядер, имеющую размеры частиц от 200 до 1000 мкм, смешивают с ингредиентами наружной фазы в гомогенизаторе при низких оборотах в минуту. Полученную таким образом смесь затем прессуют в таблетки в кривошипной таблеточной машине Diaf с использованием 15 мм прессформы. Пример 2 (1000 таблеток). В следующем примере 2 описаны состав и изготовление фармацевтической композиции замедленного высвобождения, содержащей гранулированные ядра предварительно обработанного активного агента. Фармацевтическую композицию получают согласно примеру 1, за исключением того, что гранулированные ядра активного агента, предварительно обработанного альгинатным гелем, сушат после гранулирования в микроволновой вакуумной сушилке типа Collette до содержания влаги 1%. Пример 3 (1000 таблеток). В следующем примере 3 описаны состав и изготовление фармацевтической композиции замедленного высвобождения. Гранулированные ядра получают согласно примеру 1, за исключением того, что перед гранулированием ядра активного агента гомогенизируют с лимонной кислотой. Пример 4 (1000 таблеток). В следующем примере 4 описаны состав и изготовление фармацевтической композиции замедленного высвобождения по изобретению. Фармацевтическую композицию получают согласно примеру 1, за исключением того, что вместо альгината натрия используют натриевую соль каррагинана. Пример 5 (1000 таблеток). В следующем примере 5 описаны состав и изготовление фармацевтической композиции замедленного высвобождения по изобретению. Процедуру, описанную в примере 1, осуществляют для получения гранулированных ядер. Пример 6 (1000 таблеток). В примере 6 описаны состав и изготовление фармацевтической композиции замедленного высвобождения по изобретению. Процедуру согласно примеру 1 осуществляют для получения гранулированных ядер. Пример 7 (1000 таблеток). В примере 7 описаны состав и изготовление фармацевтической композиции замедленного высвобождения по изобретению. Препарат изготавливают согласно примеру 1, за исключением того, что наружная фаза содержит большее количество полиэтиленоксида для достижения "плавающего" свойства. После набухания полиэтиленоксид, из-за своей низкой плотности, гидродинамически уравновешивает фармацевтический продукт. "Плавающее" свойство означает, что таблетка плавает на поверхности желудочного сока через 5 мин после введения, и эта плавучесть сохраняется в течение 8 ч теста на высвобождение. Пример 8 (1000 таблеток). В следующем примере 8 описаны состав и изготовление фармацевтической композиции замедленного высвобождения по изобретению. Процедуру, описанную в примере 1, осуществляют для получения гранулированных ядер. Пример 9 (1000 таблеток). В следующем примере 9 описаны состав и изготовление фармацевтической композиции замедленного высвобождения по изобретению. Гранулированные ядра получают согласно процедуре, описанной в примере 1. Пример 10 (1000 таблеток). В следующем примере 10 описаны состав и изготовление фармацевтической композиции замедленного высвобождения по изобретению. Гранулированные ядра получают согласно процедуре, описанной в примере 1. Пример 11 (1000 капсул). В следующем примере 11 описано изготовление фармацевтической композиции замедленного высвобождения, содержащей предварительно обработанные гранулы активного агента. Композицию получают согласно примеру 1, за исключением того, что размер частиц предварительно обработанного активного агента, покрытого глицерил пальмитостеаратом, варьируется в широком диапазоне от 500 до 800 мкм. Полученные покрытые гранулы, у которых размер частиц варьируется в диапазоне от 800 до 1200 мкм, загружают в твердые желатиновые капсулы. Пример 12 (1000 капсул). В примере 12 описаны композиция и изготовление фармацевтической композиции замедленного высвобождения по изобретению. Гранулированные ядра получают согласно процедуре, описанной в примере 1. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция контролируемого высвобождения, содержащая толперизона гидрохлорид в качестве активного ингредиента, отличающаяся тем, что содержит гранулированные ядра активного ингредиента, включающие природный анионный полимер, выбранный из альгиновой кислоты,или альгината натрия, или каррагинана, или каррагинана натрия, при этом ядра покрыты липофильным наполнителем, выбранным из глицерил пальмитостеарата или глицерил бегената, и в заключение, диспергированы в гидрофильном матрицеобразующем наполнителе, представляющем собой полиэтиленоксид, и фармацевтически приемлемых наполнителях. 2. Фармацевтическая композиция по п.1, где природный анионный полимер содержится в количестве 0,1-5 мас.% в расчете на общую массу композиции. 3. Фармацевтическая композиция по п.1 или 2, где размер гранулированных ядер, образованных природным анионным полимером, находится в диапазоне от 100 до 800 мкм. 4. Фармацевтическая композиция по любому из пп.1-3, где липофильный наполнитель представляет собой глицерил пальмитостеарат. 5. Фармацевтическая композиция по любому из пп.1-4, где размер гранулированных ядер после покрытия липофильным наполнителем находится в диапазоне от 200 до 1200 мкм. 6. Фармацевтическая композиция по любому из пп.1-5, где фармацевтически приемлемый наполнитель представляет собой органическую кислоту, предпочтительно лимонную кислоту. 7. Фармацевтическая композиция по п.6, где количество лимонной кислоты находится в диапазоне от 5 до 15 мас.% от общей массы композиции. 8. Способ получения фармацевтической композиции по любому из пп.1-7, отличающийся тем, что толперизона гидрохлорид гранулируют с коллоидным раствором в воде природного анионного полимера, выбранного из альгиновой кислоты, или альгината натрия, или каррагинана, или каррагинана натрия,при значении рН 4,5, полученное гранулированное ядро покрывают расплавом липофильного наполнителя с образованием покрытия, гранулируют полученные ядра с матрицеобразующим наполнителем и фармацевтически приемлемыми наполнителями, и прессуют полученную композицию в виде таблеток.
МПК / Метки
МПК: A61K 9/50, A61K 9/20, A61K 31/4453
Метки: содержащая, фармацевтическая, гидрохлорид, контролируемого, толперизона, высвобождения, композиция
Код ссылки
<a href="https://eas.patents.su/9-18885-farmacevticheskaya-kompoziciya-kontroliruemogo-vysvobozhdeniya-soderzhashhaya-tolperizona-gidrohlorid.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая композиция контролируемого высвобождения, содержащая толперизона гидрохлорид</a>