Способ получения изоиммунной плазмы крови
Номер патента: 17172
Опубликовано: 30.10.2012
Авторы: Мальцева Линура Марсовна, Пешняк Жанна Витальевна, Потапнев Михаил Петрович, Смирнов Михаил Николаевич
Формула / Реферат
Способ получения изоиммунной плазмы крови, включающий реиммунизацию изоиммунного донора путем введения в его организм размороженных криоконсервированных Rh0(D) аллоэритроцитов активных доноров группы крови 0 (I) или одноименной группы с кровью реиммунизированного донора, отрицательных по фактору Kell, сходных по антигенам систем MNS и Daffi, в количестве 3-5 мл внутривенно или внутримышечно, осуществление забора крови каждые две недели после начала реиммунизации до снижения титра анти-D антител до 1:64, с последующим выделением из нее плазмы, отличающийся тем, что реиммунизацию проводят однократно Rh0(D) донорскими аллоэритроцитами и дополнительно Ронколейкином, причем Ронколейкин вводят подкожно в область нижнего угла лопатки в дозе 1000 МЕ/кг через 30 мин после введения Rh0(D) аллоэритроцитов.
Текст
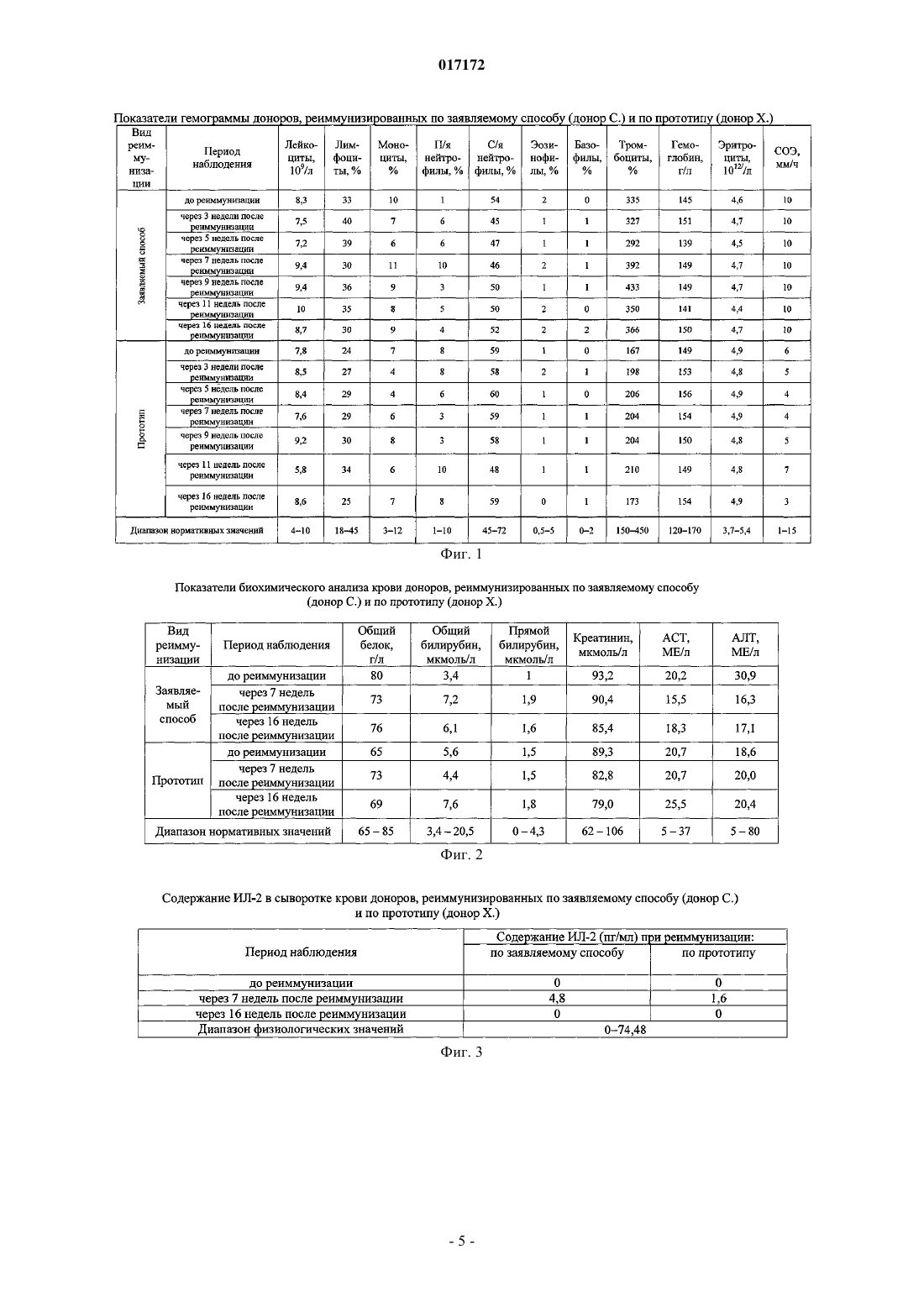
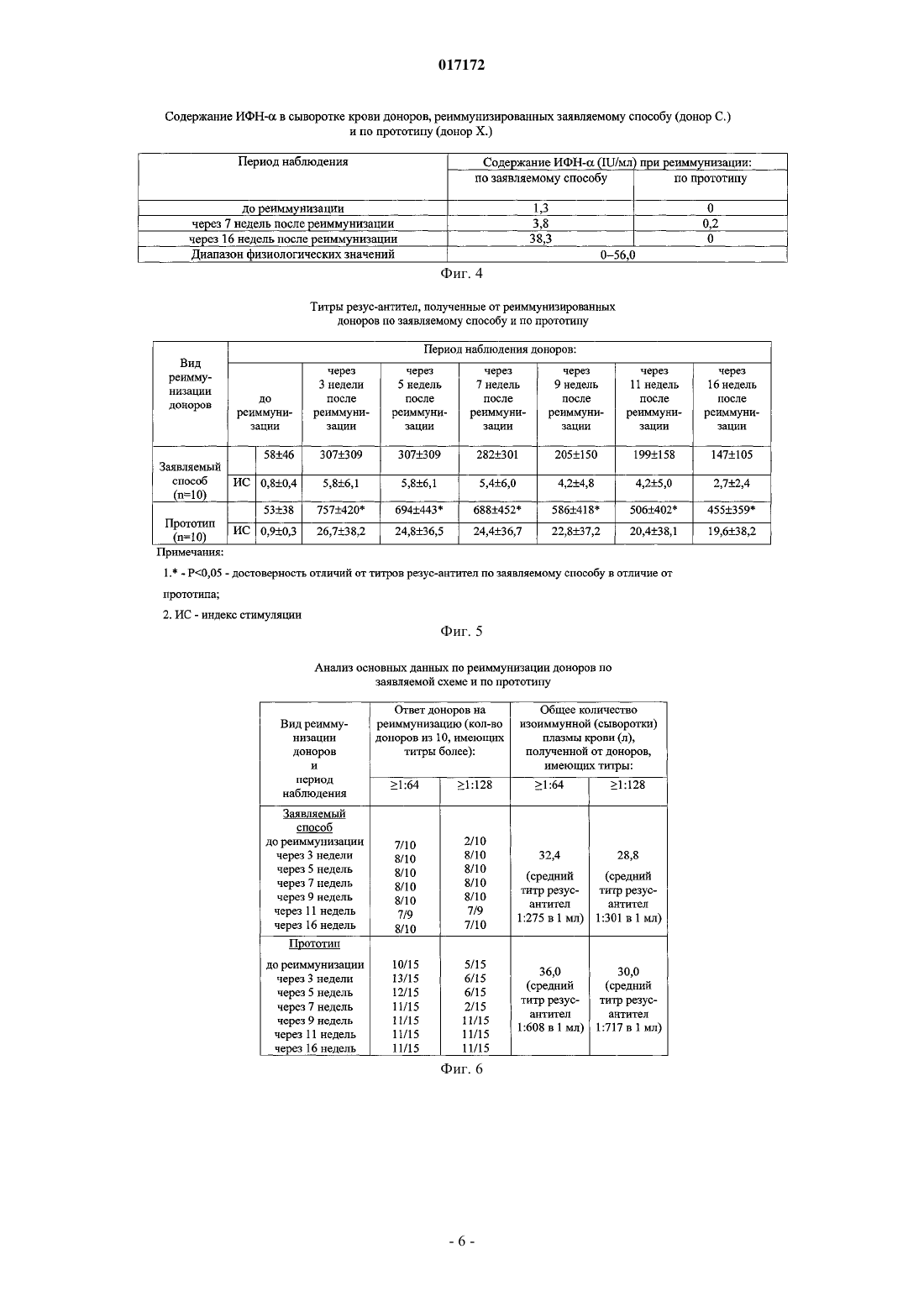
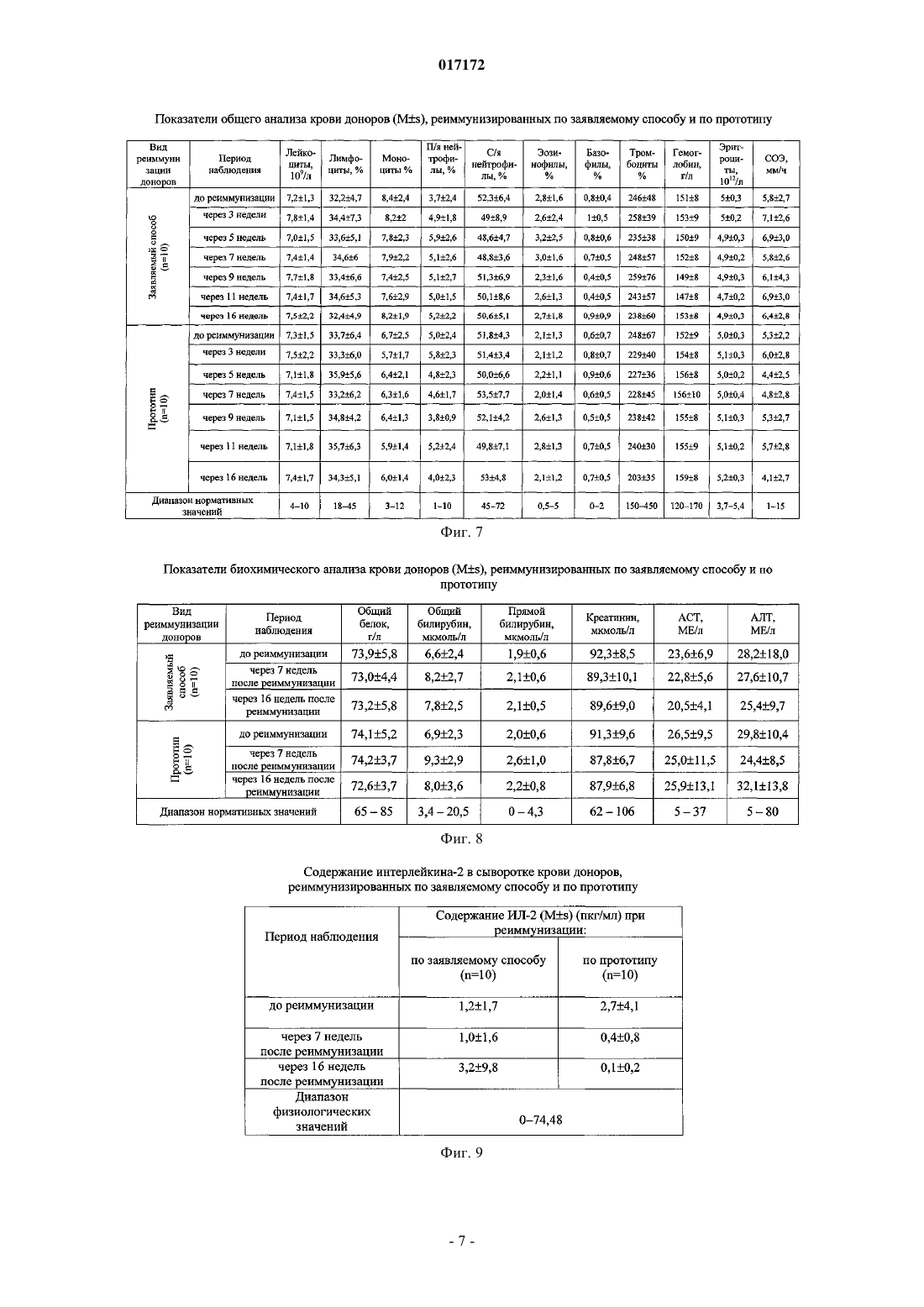
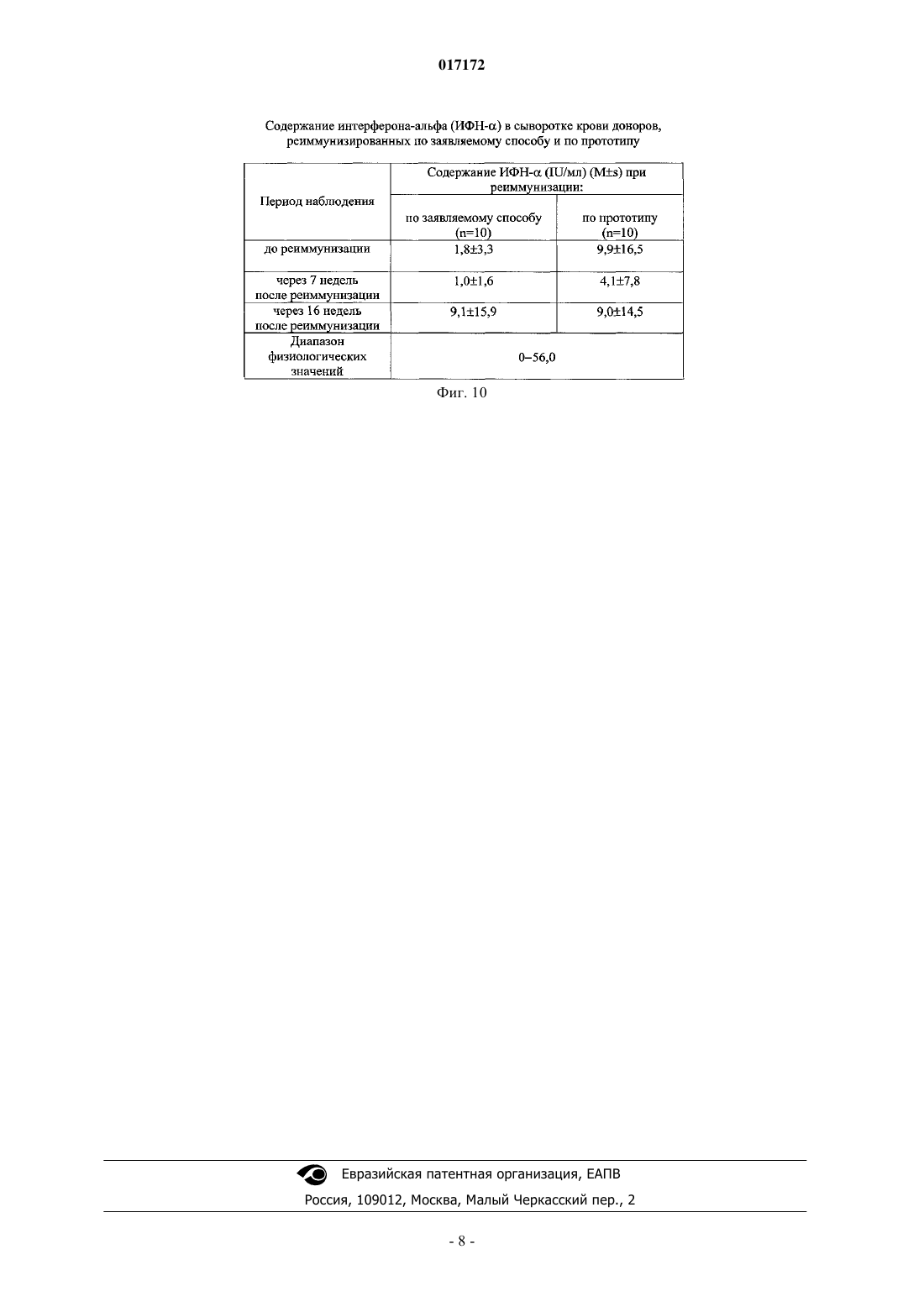
СПОСОБ ПОЛУЧЕНИЯ ИЗОИММУННОЙ ПЛАЗМЫ КРОВИ(56) Инструкция по иммунизации доноров для получения сыворотки, разделы 1-6. Приказ Минздрава РФ от 09.01.19982 "Об утверждении инструкций по иммуносерологии" Инструкция по медицинскому применению препарата Ронколейкин, 2008, [он-лайн]. [найдено 01.04.2010]. Найдено из Интернет: URL:http:// Изобретение относится к области медицины, а именно к изоиммунному донорству, и касается получения высокоактивного сырья изоиммунной плазмы из крови реиммунизированных доноров для производства иммуноглобулина человеческого антирезус (анти-D) и диагностических сывороток антирезус. Задача заявляемого изобретения заключается в получении плазмы крови с высокими титрами резус-антител от изоиммунных доноров, сокращении сроков реиммунизации и снижении антигенной нагрузки на организм доноров. Сущность изобретения заключается в том, что реиммунизацию проводят однократно Rh0(D) аллоэритроцитами и дополнительно Ронколейкином. При реиммунизации вводят внутривенно или внутримышечно 3-5 мл Rh0(D) аллоэритроцитов и Ронколейкин в дозе 1000 МЕ/кг подкожно в область нижнего угла левой или правой лопатки через 30 мин после введения аллоэритроцитов. Через каждые две недели после начала реиммунизации осуществляют забор крови с последующим выделением из нее плазмы. Потапнев Михаил Петрович, Пешняк Жанна Витальевна, Мальцева Линура Марсовна (BY), Смирнов Михаил Николаевич (RU) 017172 Изобретение относится к области медицины, а именно к изоиммунному донорству, и касается получения высокоактивного сырья - изоиммунной плазмы крови от реиммунизированных Rh0(D) аллоэритроцитами доноров для производства иммуноглобулина человеческого анти-D и диагностических сывороток антирезус. Известен способ получения биологически активной плазмы крови антирезус от лиц, ранее сенсибилизированных антигенами системы Резус вследствие резус-конфликтных беременностей или введения им резус-несовместимой крови [1]. Недостатком способа является, несмотря на присутствие резусантител, быстрое снижение их титров. Наиболее близким по технической сущности и достигаемому результату является способ получения плазмы крови от доноров, реиммунизированных Rh0(D) аллоэритроцитами 2-3 раза по 3-5 мл через 3-4 дня через каждые 4 месяца после цикла иммунизации или реиммунизации Rh0(D) аллоэритроцитами для последующего получения иммуноглобулина человеческого анти-D и диагностических сывороток антирезус [2]. Недостатками данного способа являются следующие: 1) необходимость частого вызова в рабочее время доноров для реиммунизации аллоэритроцитамиRh0(D) (через 3-4 дня через каждые 4 месяца после цикла иммунизации или реиммунизации Rh0(D) аллоэритроцитами); 2) невысокий и непродолжительный иммунный ответ у доноров, т.е. низкие титры анти-D антител после реиммунизации донорскими аллоэритроцитами Rh0(D); 3) трудоемкость получения и приготовления каждой дозы отмытых размороженных донорских эритроцитов (Rh0(D) аллоэритроцитов) и использование дорогостоящих рутинных методов тестирования по определению у доноров группы крови, антигенов системы Резус (D, С, Е, с, е и других систем Келл,Даффи и т.д.), маркеров вирусов гепатитов В и С, вируса иммунодефицита человека (ВИЧ 1 и 2). Соблюдение полугодовой карантинизации донорских эритроцитов с последующим повторным обследованием доноров на маркеры вышеназванных вирусов для исключения серонегативного окна; 4) у 10% изоиммунных доноров наблюдается полное отсутствие иммунного ответа на антигенный стимул после иммунизации и реиммунизации донорскими Rh0(D) аллоэритроцитами, заключающееся в отсутствии титров анти-D антител. Задачи заявляемого изобретения заключаются в получении плазмы крови с высокими титрами резус-антител от изоиммунных доноров, сокращении сроков реиммунизации и соответственно снижении антигенной нагрузки на организм донора. Поставленные задачи достигаются за счет того, что в способе получения изоиммунной плазмы крови, включающем реиммунизацию изоиммунного донора путем введения в его организм размороженных криоконсервированных Rh0(D) аллоэритроцитов активных доноров группы крови 0 (I) или одноименной группы с кровью реиммунизируемого лица, Kell отрицательных, сходных по антигенам системы MNSs,Daffi, в количестве 3-5 мл внутривенно или внутримышечно, после чего через каждые две недели после начала реиммунизации осуществляют забор крови до снижения титра анти-D антител до 1:64 с последующим выделением из нее плазмы, новым является то, что реиммунизацию проводят однократноRh0(D) донорскими аллоэритроцитами и дополнительно Ронколейкином, причем Ронколейкин в дозе 1000 МЕ/кг вводят подкожно в область нижнего угла левой или правой лопатки через 30 мин после введения Rh0(D) аллоэритроцитов. Сущность изобретения заключается в следующем. Резус отрицательным донорам однократно вводят 3-5 мл размороженных криоконсервированныхRh0(D) эритроцитов активных доноров группы крови 0 (I) или одноименной группы с кровью реиммунизируемого лица, Kell отрицательных, сходных по антигенам системы MNSs, Daffl, со сроком хранения не менее 6 месяцев, внутривенно или внутримышечно. Общая и местная реакции на введение должны отсутствовать в течение 30 мин. Через 30 мин после этого раствор Ронколейкина, разведенный стерильной водой для инъекций до 100000 МЕ/мл, вводится подкожно в область нижнего угла левой или правой лопатки в количестве 1000 МЕ/кг веса, т.е. при весе донора до 60 кг - 0,6 мл; при весе донора от 61 до 70 кг - 0,7 мл; при весе донора от 71 до 80 кг - 0,8 мл; при весе донора от 81 до 90 кг - 0,9 мл; при весе донора от 91 до 100 кг и более - 1,0 мл. Ронколейкин - препарат рекомбинантного дрожжевого ИЛ-2 человека, производства ООО "Биотех"(Санкт-Петербург, Россия). Практика более чем 8-летнего использования Ронколейкина в клинической медицине выявила его приоритет во многих областях цитокиновой иммунокорригирующей терапии рекомбинантным ИЛ-2(рИЛ-2) по сравнению с препаратами, применяемыми в зарубежных странах [3]. Ронколейкин создан на основе продуцента непатогенных штаммов дрожжей-сахаромицетов Saccharomyces cerevisiae. Получаемый рИЛ-2 идентичен по аминокислотной последовательности пептидному фрагменту эндогенного че-1 017172 ловеческого ИЛ-2. Технология производства рИЛ-2 на основе дрожжевого продуцента является более экономичной по сравнению с продуцентом на основе E.coli, поэтому конечная стоимость препарата ниже, чем у зарубежных аналогов рИЛ-2 (Proleukin, Aldesleukin, Teceleukin, Macrolin IL-2, Bioleukin). Зарубежным аналогом Ронколейкина, созданным в 2002 г. по сходной технологии, является препарат рИЛ-2Albuleukin (albumin-interleukin-2, Human Genome Sciences, Inc.) [4]. Ввиду того что Ронколейкин является структурным и функциональным аналогом эндогенного человеческого ИЛ-2, для оценки иммунокорригирующей эффективности данного препарата следует отметить главные механизмы иммунных эффектов эндогенного ИЛ-2. ИЛ-2 относится к семейству цитокинов-гематопоэтинов и представляет собой гликопротеин с молекулярной массой 15000 Да (в гликолизированной форме 17000-22000 Да). Основной фармакологический эффект - иммуномодулирующий [5, 6]. Иммунологическая роль ИЛ-2 заключается в регуляции специфического (антигензависимого) иммунного ответа за счет стимуляции пролиферации и дифференцировки иммунных клеток, участвующих в его реализации. Взаимодействуя с рецепторами клеток, ИЛ-2 индуцирует рост, дифференцировку и пролиферацию T- и B-лимфоцитов, моноцитов, макрофагов, олиго-дендроглиальных клеток, эпидермальных клеток Лангерганса. ИЛ-2 вызывает образование лимфокинактивированных киллеров. Он также стимулирует цитолитическую активность натуральных киллеров и цитотоксических Tлимфоцитов, повышает устойчивость клеток к программированной клеточной гибели - апоптозу. Применение препарата ИЛ-2 обеспечивает иммунную защиту, направленную против опухолевых клеток, а также возбудителей вирусной, бактериальной и грибковой инфекции. Показаниями к его применению является комплексная терапия септических состояний различной этиологии, сопровождающихся иммуносупрессией у взрослых лиц, в хирургии, травматологии, гинекологии, ожоговый сепсис, тяжелые пневмонии, лечение рака почки у взрослых лиц. Сущность изобретения и полученные положительные результаты по применению заявляемого способа поясняются графическими материалами, в которых приведено: на фиг. 1 - показатели общего анализа крови доноров, реиммунизированных по заявляемому способу (донор C.) и по прототипу (донор X.); на фиг. 2 - показатели биохимического анализа крови доноров, реиммунизированных по заявляемому способу (донор C.) и по прототипу (донор X.); на фиг. 3 - содержание ИЛ-2 в сыворотке крови доноров, реиммунизированных по заявляемому способу (донор C.) и по прототипу (донор X.); на фиг. 4 - содержание ИФН- в сыворотке крови доноров, реиммунизированных по заявляемому способу (донор C.) и по прототипу (донор X.); на фиг. 5 - титры резус-антител у доноров, реиммунизированных по заявляемому способу и по прототипу; на фиг. 6 - анализ основных данных при реиммунизации доноров по заявляемой схеме и по прототипу; на фиг. 7 - показатели гемограммы доноров, реиммунизированных по заявляемому способу и по прототипу; на фиг. 8 - показатели биохимического анализа крови доноров, реиммунизированных по заявляемому способу и по прототипу; на фиг. 9 - содержание интерлейкина-2 в сыворотке крови доноров, реиммунизированных по заявляемому способу и по прототипу; на фиг. 10 - содержание интерферона-альфа (ИФН-) в сыворотке крови доноров, реиммунизированных по заявляемому способу и по прототипу. Изобретение иллюстрируется следующими примерами. Пример 1. Донору С. вводили внутримышечно 3 мл трижды отмытых размороженных криоконсервированныхRh0(D) аллоэритроцитов активного донора с группой крови 0 (I), Kell отрицальных, сходных по антигенам системы MNSs, Daffi. Через 30 мин вводили Ронколейкин в дозе 1000 МЕ/кг подкожно в область нижнего угла левой лопатки. До и через каждые 14 дней после начала реиммунизации перед плазмаферезом в течение 4 месяцев наблюдения определены следующие титры анти-D антител: до реиммунизации 1:64, после начала реиммунизации через 3, 5, 7, 9, 11 недель - 1:1024, затем перерыв 1 месяц после 5 плазмаферезов и через 16 недель - 1:512. Пример 2. Донору K. вводили внутримышечно 5 мл трижды отмытых размороженных криоконсервированныхRh0(D) аллоэритроцитов активного донора с группой крови 0 (I), Kell отрицальных, сходных по антигенам системы MNSs, Daffi. Через 30 мин вводили Ронколейкин в дозе 1000 МЕ/кг подкожно в область нижнего угла левой лопатки. До и через каждые 14 дней после начала реиммунизации перед плазмаферезом в течение 4 месяцев наблюдения определены следующие титры анти-D антител: до реиммунизации 1:64, после начала реиммунизации через 3, 5, 7, 9, 11 недель - 1:1024, затем перерыв 1 месяц после 5-2 017172 плазмаферезов и через 16 недель - 1:1024. Пример 3 (по прототипу). Донор X, реиммунизированный по стандартной схеме реиммунизации 3 раза по 3 мл внутримышечно через 3 дня трижды отмытыми размороженными криоконсервированными Rh0(D) аллоэритроцита-ми активного донора с группой крови 0 (I), Kell отрицальными, сходными по антигенам системыMNSs, Daffi, имел следующие титры: до реиммунизации - 1:64, через 3, 5, 1,9, 11 недель - 1:128, затем перерыв 1 месяц после 5 плазмаферезов и через 16 недель после начала реиммунизации - 1:128. Пример 4 (по прототипу). Донор III., реиммунизированный по стандартной схеме 2 раза по 5 мл внутримышечно через 4 дня трижды отмытыми размороженными криоконсервированными Rh0(D) аллоэритроцитами активного донора с группой крови 0 (I), Kell отрицальными, сходными по антигенам системы MNSs, Daffi, имел следующие титры: до реиммунизации - 1:64, через 3, 5, 7, 9, 11 недель - 1:256, затем перерыв 1 месяц после 5 плазмаферезов и через 16 недель после начала реиммунизации - 1:128. Данные показателей общего анализа крови, биохимического анализа крови, содержания ИЛ-2 в сыворотке крови, а также содержания ИФН- в сыворотке крови донора С. и донора X. приведены на фиг. 1-4. Все изменения исследуемых клинико-лабораторных показателей находились в пределах нормативных значений. Клинические испытания по заявляемому способу получения плазмы крови проведены на 10 донорах мужского пола в возрасте от 20 до 50 лет. Одновременно в качестве сравнения была проведена реиммунизация 10 донорам по прототипу. Статистический анализ полученных результатов осуществляли с использованием пакета программMicrosoft Excel, Statistica v. 6.0. Исследуемые данные представляли в виде Ms (где М - среднее арифметическое и s - стандартное отклонение). Контроль качества проведения исследований выполняли путем статистической обработки и анализа данных исследования независимо в 2-х группах выборки доноров,реиммунизированных по заявляемому способу и по прототипу. Достоверность различий между сравниваемыми величинами определяли однофакторным дисперсионным анализом с последующими попарными сравнениями по критерию Ньюмена-Кейлса при выявлении отличий между исследуемыми группами. Различия считали достоверными при вероятности P0,05. Как видно из данных, приведенных на фиг. 5, исходные титры резус-антител достоверно не отличались в исследуемых группах доноров и составляли соответственно для доноров, иммунизированных по заявляемому способу (реиммунизация аллоэритроцитами+Ронколейкин) - 5846 (индекс стимуляции 0,80,4), а для доноров, реиммунизированных по прототипу (реиммунизация аллоэритроцитами), - 5338(индекс стимуляции 0,90,3). Установлено, что Ронколейкин повышал титры анти-D антител в 2,5-3,1 раза в период с 3 по 16 недели после реиммунизации доноров по заявляемому способу в сравнении с прототипом. Однократное введение Ронколейкина по заявляемому способу повышает титры анти-D антител по сравнению с прототипом следующим образом: через 3 недели после начала реиммунизации - в 2,5 раза, через 5 недель - в 2,3 раза, через 7 недель - в 2,4 раза, через 9 недель - в 2,9 раза, через 11 недель - в 2,5 раза, через 16 недель - в 3,1 раза. Следует отметить, что у доноров, реиммунизированных по заявляемому способу, титры анти-D антител были не менее 1:64 до реиммунизации у 7 из 10 доноров, через 3 недели - у 8 из 9 доноров, через 5 недель - у 9 из 10 доноров, через 7 недель - у 9 из 10 доноров, через 9 недель - у 9 из 10 доноров, через 11 недель - у 9 из 10 доноров, через 16 недель - у 9 из 10 доноров и не менее 1:128 до реиммунизации у 1 из 10 доноров, через 3 недели - у 8 из 9 доноров, через 5 недель - у 9 из 10 доноров, через 7 недель - у 8 из 10 доноров, через 9 недель - у 8 из 10 доноров, через 11 недель - у 8 из 10 доноров, через 16 недель - у 8 из 10 доноров (фиг. 6). У доноров, реиммунизированных по прототипу, установлены титры анти-D антител не менее 1:64 до реиммунизации у 7 из 10 доноров, через 3 недели - у 8 из 10 доноров,через 5 недель - у 8 из 10 доноров, через 7 недель - у 8 из 10 доноров, через 9 недель - у 8 из 10 доноров,через 11 недель - у 7 из 9 доноров, через 16 недель - у 8 из 10 доноров и не менее 1:128 до реиммунизации у 2 из 10 доноров, через 3 недели - у 8 из 10 доноров, через 5 недель - у 8 из 10 доноров, через 7 недель - у 8 из 10 доноров, через 9 недель - у 8 из 10 доноров, через 11 недель - у 7 из 9 доноров, через 16 недель - у 7 из 10 доноров. В результате от доноров, реиммунизированных по заявляемому способу за весь период наблюдения после начала реиммунизации, получено изоиммунной плазмы с титрами резус-антител более 1:64 - 36,0 л(со средним титром резус-антител 1:608 в 1 мл), с титрами более 1:128 - 30,0 л (средний титр резусантител 1:717 в 1 мл), а от доноров, реиммунизированных по прототипу, получено изоиммунной плазмы с титрами более 1:64 - 32,4 л (средний титр резус антител 1:275 в 1 мл) и более 1:128 - 28,8 л (средний титр резус-антител 1:301 в 1 мл). Безопасность применения Ронколейкина при реиммунизации доноров по заявляемому способу определяли, оценивая их состояние на основе изучения комплекса клинико-лабораторных показателей, в том числе показателей общего анализа крови с лейкоцитарной формулой и биохимического анализа крови, содержания в сыворотке крови доноров эндогенных цитокинов ИЛ-2 и ИФН-.-3 017172 При реиммунизации в исследуемых группах доноров не отмечалось аллергических и клинически выявляемых патологических реакций. После реиммунизации по заявляемому способу и по прототипу отклонений от нормы в состоянии здоровья доноров и показателях общего анализа крови за весь период наблюдения выявлено не было (данные приведены на фиг. 7). До реиммунизации и через 7 и 16 недель после начала реиммунизации по заявляемому способу отклонений от диапазона нормативных значений в исследуемых показателях биохимического анализа крови в группах доноров не выявлено (фиг. 8). До реиммунизации и через 7 и 16 недель после начала реиммунизации в обследуемых группах доноров, реиммунизированных по заявляемому способу и по прототипу, не выявлено отклонений от диапазона значений физиологической нормы в содержании эндогенных ИЛ-2 и ИФН- в сыворотке крови(фиг. 9 и 10). Заявляемый способ приводит к повышению титров анти-D антител у реиммунизированных доноров, сокращает введение Rh0(D) аллоэритроцитов до одного раза вместо двух-трех, в результате чего снижается антигенная нагрузка на организм донора и на 1 неделю сокращаются сроки реиммунизации,что влечет экономию финансовых затрат при получении изоиммунной плазмы. Предложенный способ при реиммунизации доноров будет способствовать получению высокоактивного сырья для производства иммуноглобулина человеческого антирезус (анти-D) (используемого в акушерской практике для профилактики выработки резус-антител у резус-отрицательных беременных женщин, т.е. для пассивной иммунизации резус-отрицательных матерей), а также диагностических сывороток антирезус, необходимых для определения антигенов системы Резус. Источники информации. 1. Донсков, С.И. Группы крови системы Rhesus. Теория и практика. М.: ВИНИТИ РАН, 2005, с. 151-154. 2. Инструкция по применению "Иммунизация доноров для получения стандартной сыворотки и иммуноглобулина антирезус" (регистрационный 119-1108 от 13.11.2008 г.), Минск, 2008, 8 с. 3. Ребенок, Ж.А. Ронколейкин - новое и эффективное средство лечения/Ж.А. Ребенок//Мед. знания,1999,4, с. 17-19. 4. Симбирцев, А.С. Иммунотропные препараты на основе цитокинов/А.С. Симбирцев//[Электронный ресурс], 2006, Режим доступа: http://www/asvomed.ru/php/content.phpid=697. - Дата доступа: 24.11.2006. 5. Михайленко А.А., Коненков В.И., Базанов Г.А., Покровский В.И. Руководство по клинической иммунологии, аллергологии, иммуногенетике и иммунофармакологии (для врачей общеклинической практики)/Под ред. В.И. Покровского, т. 2. Тверь: ООО "Издательство "Триада", 2005, с. 395. 6. Попович A.M. Достижения и перспективы клинического применения Ронколейкина при лечении иммунодефицитов различной этиологии//Материалы VII Всероссийского форума с межд. участием "Дни иммунологии в Санкт-Петербурге" им. Акад. В.И. Иоффе, 2003, с. 2-7. ФОРМУЛА ИЗОБРЕТЕНИЯ Способ получения изоиммунной плазмы крови, включающий реиммунизацию изоиммунного донора путем введения в его организм размороженных криоконсервированных Rh0(D) аллоэритроцитов активных доноров группы крови 0 (I) или одноименной группы с кровью реиммунизированного донора,отрицательных по фактору Kell, сходных по антигенам систем MNS и Daffi, в количестве 3-5 мл внутривенно или внутримышечно, осуществление забора крови каждые две недели после начала реиммунизации до снижения титра анти-D антител до 1:64, с последующим выделением из нее плазмы, отличающийся тем, что реиммунизацию проводят однократно Rh0(D) донорскими аллоэритроцитами и дополнительно Ронколейкином, причем Ронколейкин вводят подкожно в область нижнего угла лопатки в дозе 1000 МЕ/кг через 30 мин после введения Rh0(D) аллоэритроцитов.
МПК / Метки
МПК: A61K 35/16, A61K 39/395
Метки: получения, крови, способ, плазмы, изоиммунной
Код ссылки
<a href="https://eas.patents.su/9-17172-sposob-polucheniya-izoimmunnojj-plazmy-krovi.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения изоиммунной плазмы крови</a>
Предыдущий патент: Комбинированная терапия заболеваний нижних мочевыводящих путей с использованием лигандов α2δ и нестероидных противовоспалительных препаратов (нпвп)
Следующий патент: Способ синтеза соединений, пригодных для лечения гепатита с
Случайный патент: Комбинации для лечения заболеваний, связанных с клеточной пролиферацией, миграцией или апоптозом клеток миеломы или с ангиогенезом