Фармацевтический препарат на основе энтекавира и способ его получения
Номер патента: 6181
Опубликовано: 27.10.2005
Авторы: Харианавала Абизер, Десаи Дивякант, Шпрокель Омар Л., Колонно Ричард Дж., Фейкс Майкл Г.
Формула / Реферат
1. Фармацевтический препарат в форме таблетки или капсулы для одноразового ежедневного приема для лечения гепатита B у человека, включающий фармацевтически приемлемый носитель и примерно от 0,01 до 5 мг энтекавира.
2. Препарат по п.1, содержащий около 0,01 мг энтекавира.
3. Препарат по п.1, содержащий около 0,05 мг энтекавира.
4. Препарат по п.1, содержащий около 0,1 мг энтекавира.
5. Препарат по п.1, содержащий около 0,5 мг энтекавира.
6. Препарат по п.1, содержащий около 1,0 мг энтекавира.
7. Препарат по п.1, содержащий одно или более фармацевтически активных веществ.
8. Фармацевтический препарат в форме таблетки или капсулы для одноразового ежедневного приема для лечения гепатита B у человека, содержащий примерно от 0,001 до 10 мг энтекавира, прикрепленного к субстрату-носителю.
9. Препарат по п.8, где субстрат-носитель выбран из группы, включающей лактозу, микрокристаллическую целлюлозу, фосфат кальция, декстрин, декстрозу, декстраны, маннитол, сорбитол и сахарозу и их смеси, а энтекавир прикреплен к субстрату-носителю с помощью связывающего вещества, которое представляет собой полимерный материал, обладающий достаточной липкостью.
10. Препарат по п.9, где связывающее вещество выбрано из повидона, метилцеллюлозы, гидроксиметилцеллюлозы, гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозы, гидроксиэтилцеллюлозы, желатина, гуаровой смолы и ксантановой смолы и их смесей.
11. Препарат по п.8, включающий смазывающее вещество, выбранное из стеарата магния, стеариновой кислоты, стеарилфумарата натрия и лаурилсульфата натрия и их смесей, и дезинтегрирующее вещество, выбранное из кросповидона, натрийкроскармеллозы, натрийкрахмалгликолата, прежелатинизированного крахмала и кукурузного крахмала и их смесей.
12. Фармацевтический препарат в форме таблетки или капсулы массой 100 мг для одноразового ежедневного приема для лечения гепатита B у человека, включающий энтекавир, прикрепленный с помощью связывающего вещества к субстрату-носителю, смазывающее вещество и дезинтегрирующее вещество, и содержащий энтекавир в количестве примерно от 0,001 до 10 мг, связывающее вещество в количестве примерно от 0,01 до 10 мг, субстрат-носитель в количестве примерно от 80 до 95 мг, дезинтегрирующее вещество в количестве примерно от 1 до 7 мг, смазывающее вещество в количестве примерно от 0,1 до 5 мг.
13. Препарат по п.12, где
связывающее вещество выбрано из повидона, метилцеллюлозы, гидроксиметилцеллюлозы, гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозы, гидроксиэтилцеллюлозы, желатина, гуаровой смолы и ксантановой смолы и их смесей,
субстрат-носитель выбран из лактозы, микрокристаллической целлюлозы, фосфата кальция, декстрина, декстрозы, декстранов, маннитола, сорбитола и сахарозы и их смесей,
дезинтегрирующее вещество выбрано из кросповидона, натрийкроскармеллозы, натрий-крахмалгликолата, прежелатинизированного крахмала и кукурузного крахмала и их смесей и
смазывающее вещество выбрано из стеарата магния, стеариновой кислоты, стеарилфумарата натрия и лаурилсульфата натрия и их смесей.
14. Препарат по п.13, где связывающим веществом является повидон; субстратом-носителем является микрокристаллическая целлюлоза или лактоза или их смесь; дезинтегрирующим веществом является кросповидон и смазывающим веществом является стеарат магния.
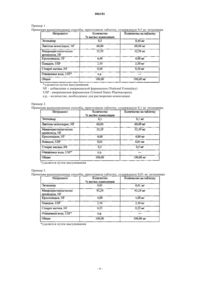
15. Препарат энтекавира в форме таблетки массой 100 мг, содержащий следующие ингредиенты в вес.%:
около 0,01% энтекавира,
около 93,24% микрокристаллической целлюлозы,
около 4,0% кросповидона,
около 2,50% повидона и
около 0,25% стеарата магния; или
около 1,0% энтекавира,
около 90,0% маннитола,
около 4,0% натрийкроскармеллозы,
около 2,50% метилцеллюлозы и
около 2,50% стеариновой кислоты; или
около 0,5% энтекавира,
около 60,00% моногидрата лактозы,
около 32,50% микрокристаллической целлюлозы,
около 4,0% кросповидона,
около 2,50% повидона и
около 0,50% стеарата магния; или
около 0,1% энтекавира,
около 60,00% моногидрата лактозы,
около 35,39% микрокристаллической целлюлозы,
около 4,0% кросповидона,
около 0,01% повидона и
около 0,5% стеарата магния.
16. Препарат по п.15, имеющий наружный тонкий слой покрытия.
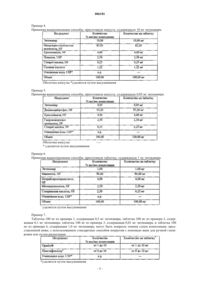
17. Препарат энтекавира в форме капсулы массой 100 мг, содержащий следующие ингредиенты в вес.%:
около 10,0% энтекавира,
около 82,03% микрокристаллической целлюлозы,
около 4,00% кросповидона,
около 2,50% повидона, и
около 0,25% стеарата магния, и
около 1,22% соляной кислоты, или
около 0,05% энтекавира,
около 93,20% дикальцийфосфата,
около 4,00% кросповидона,
около 2,50% гидроксипропилцеллюлозы и
около 0,25% стеарата магния.
18. Способ приготовления фармацевтической композиции для перорального приема, содержащей низкую дозу энтекавира, составляющую примерно от 0,001 до 10 мг, включающий
(а) растворение энтекавира и связывающего вещества в растворителе,
(б) распыление раствора из этапа (а) на субстрат-носитель, который находится в движении,
(в) высушивание покрытого субстрата-носителя из этапа (б) для удаления растворителя и
(г) объединение высушенного покрытого субстрата-носителя из этапа (в) с другими необходимыми ингредиентами для получения фармацевтической композиции.
19. Способ по п.18, где содержание энтекавира составляет примерно от 0,001 до 10% от общего веса композиции, и
растворитель представляет собой воду или воду, имеющую кислый или щелочной pH.
20. Способ по п.18, отличающийся тем, что субстрат-носитель поддерживают в движении во время этапа распыления (б) путем механического перемешивания и
покрытый субстрат-носитель высушивают на этапе (в) на сушильном поддоне или в сушилке с кипящим слоем; или
субстрат-носитель поддерживают в движении во время этапа распыления (б) путем перемешивания потоком воздуха и
покрытый субстрат-носитель высушивают на этапе (в) также путем перемешивания потоком воздуха.
Текст
представляет собой антивирусный агент, который в настоящее время проходит клинические испытания,предназначенный для лечения гепатита В. Энтекавир и его использование для лечения гепатита В раскрыты Zahler с соавт. в патенте US 5206244. В этом патенте описывается, что эффективная антивирусная доза для перорального или парентерального введения находится, по-видимому, в пределах примерно от 1,0 до 50 мг/кг веса тела и что необходимая доза может вводиться несколько раз в день с соответствующими интервалами. Усовершенствованные способы синтеза энтекавира раскрыты Bisacchi с соавт. в WO 98/09964. Данное изобретение касается фармацевтических композиций, содержащих низкую дозу энтекавира,и использования таких композиций для безопасного и эффективного лечения гепатита В. Данное изобретение касается также фармацевтических композиций для перорального приема, содержащих низкие дозы фармацевтически активного вещества. Этот результат достигается благодаря адгезии частиц фармацевтически активного вещества на поверхности субстрата-носителя. Процесс осаждения активного вещества на субстрате-носителе подвергается контролю для того, чтобы свести до минимума агломерацию частиц активное вещество/субстрат-носитель. Данное изобретение касается фармацевтических композиций, содержащих низкую дозу активного антивирусного агента энтекавира, концентрация которого варьирует примерно от 0,001 до 25 мг, предназначенных для одноразового ежедневного приема для лечения гепатита В у взрослых пациентов. Предпочтительные фармацевтические композиции содержат примерно от 0,01 до 10 мг энтекавира, и более предпочтительные фармацевтические композиции содержат примерно от 0,01 до 5 мг энтекавира. Такие предпочтительные и более предпочтительные фармацевтические композиции применяют также один раз в день для лечения гепатита В у взрослых пациентов. Термин взрослый пациент подразумевает пациента в возрасте от 16 лет и старше, имеющего вес тела, равный приблизительно 50 кг или больше. Фармацевтические композиции, содержащие минимальные дозы энтекавира из тех, которые определены выше, пригодны для лечения педиатрических пациентов или взрослых пациентов, которые весят менее 50 кг. Описанные выше фармацевтические композиции, содержащие низкую дозу энтекавира и предназначенные для ежедневного приема, могут приниматься некоторыми пациентами менее часто. Например,пациенты, ежедневно принимавшие фармацевтические композиции с низкой дозой энтекавира и достигшие того, что их состояние находится под контролем, могут быть переведены на поддерживающий режим приема энтекавира для защиты от дополнительной инфекции вирусом гепатита В. Такая поддерживающая терапия может включать прием фармацевтической композиции с низкой дозой энтекавира реже,чем раз в день. Например, достаточной может быть однократная доза, принимаемая каждые три или четыре дня или еженедельно. Фармацевтические композиции данного изобретения, содержащие низкую дозу энтекавира, могут приготавливаться любыми подходящими способами. Например, композиции для перорального приема,которые являются наиболее предпочтительными, могут приготавливаться в виде таблеток, капсул, гранул или порошков или в виде эликсиров, растворов или суспензий. Фармацевтические композиции с низкой дозой энтекавира могут приготавливаться также для парентерального, ректального, трансдермального или назального введения в соответствии с известными в данной области методами. Такие лекарственные формы могут включать фармацевтически приемлемые носители, например наполнители,смазывающие агенты, дезинтегрирующие агенты, связывающие агенты и т.д., которые обычно применяются в таких композициях. Лекарственные формы, обеспечивающие длительное высвобождение лекарства, также находятся в рамках данного изобретения. Неожиданно было обнаружено, что одноразовый ежедневный прием фармацевтических композиций данного изобретения, содержащих низкую дозу энтекавира, является эффективным при лечении гепатита В без нежелательных побочных эффектов, которые возникают после приема высоких доз, как описано в патенте US 506244. Данное изобретение также направлено на лечение гепатита В с помощью описанных выше композиций, содержащих низкую дозу энтекавира, в сочетании с одним или большим количеством других фармацевтически активных агентов. Подходящие для этой цели фармацевтически активные агенты-1 006181 включают один или более антивирусных агентов, например диданозин, ламивудин, абакавир, адефовир,адефовир дипивоксил, фамцикловир, (2R, 4R)-4-(2,6-диамино-9 Н-пурин-9-ил)-2-гидроксиметил-1,3 диоксолан (DAPD), гепатит В иммуномодулирующие белки (ЕНТ 899 от Enzo Biochem), эмтрицитабин,1-(2-дезокси-2-фторD-арабинофуранозил)-тимин (FMAU), GLQ-223 (Соединение А, альфатрихосантин), эпавудин (L-dT), эпцитабин (L-dC), рибавирин, тенофовир (РМРА), 2',3'-дидезокси-2',3'дидегидро-бета-L(-)-5-фторцитидин [L(-)Fd4C], а также другие фтор-L- и D-нуклеозиды. Подходящие для этой цели фармацевтически активные агенты также включают один или более иммуномодуляторов,например альфа-интерферон, бета-интерферон и т.п., тимозин альфа и вакцины против гепатита В, такие как HBV/MF59, Hepagene и Theradigm-HBV. Если другой фармацевтически активный агент или агенты пригодны для перорального приема, то они могут комбинироваться с низкой дозой энтекавира в одной таблетке или капсуле. Если другой фармацевтически активный агент или агенты несовместимы с энтекавиром для совместного приема в одной лекарственной форме, например, если различаются способ приема или частота приема, то другой фармацевтически активный агент или агенты будут приниматься (назначаться) отдельно. Количество другого принимаемого агента или агентов является таким, которое обычно применяют при монотерапии, или уменьшенным количеством, что определяется лечащим врачом. Отдельные лекарственные формы могут приниматься в одно и то же время или последовательно в соответствии с предписанным режимом приема. Данное изобретение также включает лечение ко-инфицированных пациентов с помощью описанных выше композиций, содержащих низкую дозу энтекавира. Ко-инфицированный пациент представляет собой пациента, который инфицирован другими вирусными или невирусными инфекциями, кроме гепатита В. В частности, такое лечение возможно для пациентов с гепатитом В, ко-инфицированных гепатитом С или ВИЧ-инфекцией. Таких ко-инфицированных пациентов предпочтительно лечат композициями с низкой дозой энтекавира, как описано выше, в сочетании с одним или большим количеством других фармацевтически активных агентов, описанных выше. Например, пациента, ко-инфицированного гепатитом В и гепатитом С, можно лечить с помощью композиции, содержащей низкую дозу энтекавира,дополнительно к лечению с помощью рибавирина и интерферона. Другой аспект данного изобретения заключается в приготовлении фармацевтических композиций, в особенности таблеток и капсул, содержащих энтекавир в количестве, меньшем или равном примерно 10 мг. Такие композиции с хорошей однородностью содержания не могут быть приготовлены путем простого смешивания активного вещества и наполнителей. Традиционные способы гранулирования также не подходят для получения продукта, который бы сохранял активность при таких низких дозах. Таблетированные и капсулярные композиции, содержащие примерно от 0,001 до 10 мг этекавира,приготавливают в соответствии со следующими методами, которые обеспечивают высокую эффективность и хорошую однородность продукта. Композиции приготавливают следующим образом: сначала энтекавир осторожно осаждают на поверхности частиц субстрата-носителя. Этот этап осуществляют путем приготовления раствора энтекавира в растворителе вместе со связывающим веществом при температурах, варьирующих примерно от 25 до 80 С, и нанесения раствора в виде аэрозоля или в виде потока на частицы субстрата-носителя, которые находятся в движении. Условия контролируют для того, чтобы свести до минимума агломерацию частиц. Затем растворитель удаляют с поверхности носителя, оставляя частицы энтекавира прикрепленными к поверхности субстрата-носителя. Это предотвращает отделение энтекавира от субстрата и уменьшает потерю энтекавира во время последующего процесса приготовления лекарственных форм. После сушки частицы субстрата-носителя, покрытые энтекавиром, смешивают с любыми другими ингредиентами, которые подлежат включению в композицию, например, в качестве дезинтегрирующего вещества и/или смазывающего вещества. Полученный порошок затем спрессовывают в таблетки или помещают в капсулы. Во время этапа распыления частицы субстрата-носителя поддерживают в движении посредством механического перемешивания или перемешивания потоком воздуха. При механическом перемешивании субстрат-носитель помещают в механический (высокоскоростной) миксер и перемешивают. Раствор,содержащий энтекавир и связывающее вещество и поддерживаемый при температуре примерно от 25 до 80 С, распыляют на частицы субстрата-носителя с контролируемой скоростью и давлением (от 0 до 2 бар). Для того, чтобы максимально увеличить количество энтекавира, осажденного на носителе, положение распылительной установки регулируют таким образом, чтобы струя из распылителя охватывала только носитель. Скорость осаждения и тип распыления контролируют, для того чтобы минимизировать агломерацию частиц. Когда осаждают раствор, содержащий энтекавир, влажные частицы энтекавир/субстрат-носитель переносят в сушилку или на подходящий сушильный поддон, или в сушилку с кипящим слоем. Растворитель удаляют при повышенной температуре. Если растворитель представляет собой воду или воду с подведенным pH, то подходящей является температура примерно от 50 до 80 С. В процессе перемешивания потоком воздуха субстрат-носитель помещают в сосуд с мелким ситом на дне. Поступающий поток воздуха регулируют таким образом, чтобы движение частиц субстрата было постоянным. Температуру субстрата-носителя выравнивают до температуры, варьирующей примерно от-2 006181 25 до 80 С. Раствор, содержащий энтекавир и связывающее вещество, выдерживаемый при температуре примерно от 25 до 80 С, распыляют на частицы субстрата-носителя с контролируемой скоростью и давлением, как описано выше. Положение распылительной установки снова регулируют таким образом,чтобы струя из распылителя охватывала только носитель, а скорость осаждения контролируют для того,чтобы свести к минимуму агломерацию частиц. При нанесении раствора энтекавира увеличивают температуру для удаления растворителя. Если в качестве растворителя используют воду или воду с подведенным рН, то подходящей является температура примерно от 50 до 80 С. В процессе перемешивания потоком воздуха и осаждение энтекавира на субстрат-носитель, и удаление растворителя осуществляются в одну стадию, тогда как процесс механического перемешивания требует осуществления в две стадии. Вышеописанные способы имеют дополнительное преимущество, которое заключается в уменьшении воздействия энтекавира на производственный персонал. Несмотря на то, что вышеуказанные способы описаны для приготовления фармацевтических композиций, содержащих примерно от 0,005 до 10 мг энтекавира, они могут также применяться для приготовления фармацевтических композиций, содержащих низкие дозы любого фармацевтически активного вещества. Предпочтительными растворителями для вышеописанных способов являются вода и вода с подведенным рН. Растворимость энтекавира в воде может быть увеличена при снижении рН воды путем добавления кислоты, например соляной кислоты, или при увеличении рН воды путем добавления основания, например гидроксида аммония. Связывающее вещество предпочтительно представляет собой полимерный материал, обладающий высокой липкостью. Подходящие материалы включают повидон, метилцеллюлозу, гидроксиметилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, желатин,гуаровую смолу и ксантановую смолу и их смеси, причем предпочтительным связывающим веществом является повидон. В суммарной композиции связывающее вещество предпочтительно составляет примерно от 0,01 до 10% от общего веса композиции. Субстрат-носитель представляет собой фармацевтически приемлемое вещество, на которое можно легко наносить путем распыления активный агент, но которое при этом не будет слипаться. Подходящие материалы включают лактозу, микрокристаллическую целлюлозу, фосфат кальция, декстрин, декстрозу,декстраны, маннитол, сорбитол и сахарозу и их смеси, где предпочтительными являются лактоза и микрокристаллическая целлюлоза и их смеси. В суммарной композиции субстрат-носитель предпочтительно составляет примерно от 80 до 95% от общего веса композиции. Дезинтегрирующее вещество в суммарной композиции предпочтительно составляет примерно от 1 до 7% от общего веса композиции. Подходящие дезинтегрирующие агенты включают кросповидон, кроскармеллозу, натрийкрахмалгликолат, прежелатинированный крахмал и кукурузный крахмал и их смеси,причем кросповидон является предпочтительным. Смазывающее вещество в суммарной композиции предпочтительно составляет примерно от 0,1 до 5% от общего веса композиции. Подходящие смазывающие вещества включают стеарат магния, стеариновую кислоту, стеарилфумарат натрия и лаурилсульфат натрия и их смеси, причем стеарат магния является предпочтительным. Готовая таблетка или капсула могут покрываться тонким слоем для облегчения приема. Подходящими материалами, которые могут использоваться для тонкого слоя покрытия, являются полимерные покрывающие агенты, пигменты, пластификаторы, растворяющиеся агенты и т.д. Подходящие покрывающие агенты включают гидроксипропилметилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, фталат гидроксипропилметилцеллюлозы и т.д. Полиэтиленгликоль может быть включен в состав тонкого слоя покрытия в качестве пластификатора. Дополнительные пластификаторы, такие как диэтилцитрат и триэтилцитрат, могут быть также включены в состав тонкого слоя покрытия. Подходящие растворяющиеся агенты включают полиоксиэтилен-сорбитановые эфиры жирных кислот, особенно полисорбат 80. Подходящие пигменты включают диоксид титана и различные оксиды железа. Ингредиенты, входящие в состав покрытия, диспергируют в подходящем растворителе, предпочтительно воде. Тонкий слой покрытия может наноситься на таблетки или капсулы с помощью стандартных методов покрытия с использованием ванн для ручной глазировки или путем напыления. Следующие примеры описывают композиции с низкой дозой энтекавира, находящиеся в рамках данного изобретения.USP - американская фармакопея (Uniated States Pharmacopeia) к.р. - количество, необходимое для растворения композиции Пример 2. Применяя вышеописанные способы, приготовили таблетку, содержащую 0,1 мг энтекавира. удаляется путем высушивания Пример 3. Применяя вышеописанные способы, приготовили таблетку, содержащую 0,01 мг энтекавира. Оболочка капсулы удаляется путем высушивания Пример 5. Применяя вышеописанные способы, приготовили капсулу, содержащую 0,05 мг энтекавира. Пример 7. Таблетка 100 мг из примера 1, содержащая 0,5 мг энтекавира, таблетка 100 мг из примера 2, содержащая 0,1 мг энтекавира, таблетка 100 мг из примера 3, содержащая 0,01 мг энтекавира, и таблетка 100 мг из примера 6, содержащая 1,0 мг энтекавира, могут быть покрыты тонким слоем композиции, представленной ниже, с использованием стандартных способов покрытия с помощью ванн для ручной глазировки или путем распыления.Opadry имеется в продаже и содержит гидроксипропилметилцеллюлозу, диоксид титана, полиэтиленгликоль, полисорбат 80, синтетический желтый оксид железа и синтетический красный оксид железа. 1 Расчеты сделаны, исходя из предположения, что вес таблетки составляет 100 мг. 2 Подходящими пластификаторами являются диэтилцитрат и триэтилцитрат. Пример 8. Безопасность и антивирусную активность энтекавира, который давали в течение 28 дней пациентам,страдающим хроническим гепатитом В, изучали в опытах со случайным подбором пациентов, с дважды слепым испытанием (лекарственного препарата), с плацебо в качестве контроля, с возрастанием доз. Энтекавир показал мощную антивирусную активность для всех тестируемых доз. Значение снижения log уровней содержания ДНК вируса гепатита В в крови на 28-й день были 2,21, 2,25, 2,81 и 2,42, соответственно для 0,05, 0,1, 0,5 и 1,0 мг однократных ежедневных доз энтекавира. Энтекавир хорошо переносился больными. Пример 9. Безопасность и антивирусную активность трех доз энтекавира (0,01 мг, 0,1 мг и 0,5 мг), которые давали один раз в сутки ежедневно в течении 24 недель взрослым людям, страдающим хроническим гепатитом В, изучали в опытах со случайным подбором пациентов, с дважды слепым испытанием (лекарственного препарата), с ламивудином в качестве контроля (100 мг ежедневно). Все три дозы энтекавира показали мощную антивирусную активность. Две наиболее высокие дозы энтекавира вызывают значительно большее снижение уровней содержания ДНК вируса гепатита В в крови по сравнению с ламивудином. Все дозы энтекавира хорошо переносились больными. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтический препарат в форме таблетки или капсулы для одноразового ежедневного приема для лечения гепатита В у человека, включающий фармацевтически приемлемый носитель и примерно от 0,01 до 5 мг энтекавира. 2. Препарат по п.1, содержащий около 0,01 мг энтекавира. 3. Препарат по п.1, содержащий около 0,05 мг энтекавира. 4. Препарат по п.1, содержащий около 0,1 мг энтекавира. 5. Препарат по п.1, содержащий около 0,5 мг энтекавира. 6. Препарат по п.1, содержащий около 1,0 мг энтекавира. 7. Препарат по п.1, содержащий одно или более фармацевтически активных веществ. 8. Фармацевтический препарат в форме таблетки или капсулы для одноразового ежедневного приема для лечения гепатита В у человека, содержащий примерно от 0,001 до 10 мг энтекавира, прикрепленного к субстрату-носителю. 9. Препарат по п.8, где субстрат-носитель выбран из группы, включающей лактозу, микрокристаллическую целлюлозу, фосфат кальция, декстрин, декстрозу, декстраны, маннитол, сорбитол и сахарозу и их смеси, а энтекавир прикреплен к субстрату-носителю с помощью связывающего вещества, которое представляет собой полимерный материал, обладающий достаточной липкостью. 10. Препарат по п.9, где связывающее вещество выбрано из повидона, метилцеллюлозы, гидроксиметилцеллюлозы, гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозы, гидроксиэтилцеллюлозы, желатина, гуаровой смолы и ксантановой смолы и их смесей. 11. Препарат по п.8, включающий смазывающее вещество, выбранное из стеарата магния, стеариновой кислоты, стеарилфумарата натрия и лаурилсульфата натрия и их смесей, и дезинтегрирующее вещество, выбранное из кросповидона, натрийкроскармеллозы, натрийкрахмалгликолата, прежелатинизированного крахмала и кукурузного крахмала и их смесей. 12. Фармацевтический препарат в форме таблетки или капсулы массой 100 мг для одноразового ежедневного приема для лечения гепатита В у человека, включающий энтекавир, прикрепленный с помощью связывающего вещества к субстрату-носителю, смазывающее вещество и дезинтегрирующее вещество, и содержащий энтекавир в количестве примерно от 0,001 до 10 мг, связывающее вещество в количестве примерно от 0,01 до 10 мг, субстрат-носитель в количестве примерно от 80 до 95 мг, дезинтегрирующее вещество в количестве примерно от 1 до 7 мг, смазывающее вещество в количестве примерно от 0,1 до 5 мг. 13. Препарат по п.12, где связывающее вещество выбрано из повидона, метилцеллюлозы, гидроксиметилцеллюлозы, гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозы, гидроксиэтилцеллюлозы, желатина,гуаровой смолы и ксантановой смолы и их смесей, субстрат-носитель выбран из лактозы, микрокристаллической целлюлозы, фосфата кальция, декстрина, декстрозы, декстранов, маннитола, сорбитола и сахарозы и их смесей, дезинтегрирующее вещество выбрано из кросповидона, натрийкроскармеллозы, натрийкрахмалгликолата, прежелатинизированного крахмала и кукурузного крахмала и их смесей и смазывающее вещество выбрано из стеарата магния, стеариновой кислоты, стеарилфумарата натрия и лаурилсульфата натрия и их смесей.-6 006181 14. Препарат по п.13, где связывающим веществом является повидон; субстратом-носителем является микрокристаллическая целлюлоза или лактоза или их смесь; дезинтегрирующим веществом является кросповидон и смазывающим веществом является стеарат магния. 15. Препарат энтекавира в форме таблетки массой 100 мг, содержащий следующие ингредиенты в вес.%: около 0,01% энтекавира,около 93,24% микрокристаллической целлюлозы,около 4,0% кросповидона,около 2,50% повидона и около 0,25% стеарата магния; или около 1,0% энтекавира,около 90,0% маннитола,около 4,0% натрийкроскармеллозы,около 2,50% метилцеллюлозы и около 2,50% стеариновой кислоты или около 0,5% энтекавира,около 60,00% моногидрата лактозы,около 32,50% микрокристаллической целлюлозы,около 4,0% кросповидона,около 2,50% повидона и около 0,50% стеарата магния или около 0,1% энтекавира,около 60,00% моногидрата лактозы,около 35,39% микрокристаллической целлюлозы,около 4,0% кросповидона,около 0,01% повидона и около 0,5% стеарата магния. 16. Препарат по п.15, имеющий наружный тонкий слой покрытия. 17. Препарат энтекавира в форме капсулы массой 100 мг, содержащий следующие ингредиенты в вес.%: около 10,0% энтекавира,около 82,03% микрокристаллической целлюлозы,около 4,00% кросповидона,около 2,50% повидона и около 0,25% стеарата магния и около 1,22% соляной кислоты или около 0,05% энтекавира,около 93,20% дикальцийфосфата,около 4,00% кросповидона,около 2,50% гидроксипропилцеллюлозы и около 0,25% стеарата магния. 18. Способ приготовления фармацевтической композиции для перорального приема, содержащей низкую дозу энтекавира, составляющую примерно от 0,001 до 10 мг, включающий(а) растворение энтекавира и связывающего вещества в растворителе,(б) распыление раствора из этапа (а) на субстрат-носитель, который находится в движении,(в) высушивание покрытого субстрата-носителя из этапа (б) для удаления растворителя и(г) объединение высушенного покрытого субстрата-носителя из этапа (в) с другими необходимыми ингредиентами для получения фармацевтической композиции. 19. Способ по п.18, где содержание энтекавира составляет примерно от 0,001 до 10% от общего веса композиции, и растворитель представляет собой воду или воду, имеющую кислый или щелочной рН. 20. Способ по п.18, отличающийся тем, что субстрат-носитель поддерживают в движении во время этапа распыления (б) путем механического перемешивания и покрытый субстрат-носитель высушивают на этапе (в) на сушильном поддоне или в сушилке с кипящим слоем; или субстрат-носитель поддерживают в движении во время этапа распыления (б) путем перемешивания потоком воздуха и покрытый субстрат-носитель высушивают на этапе (в) также путем перемешивания потоком воздуха.
МПК / Метки
МПК: A61K 31/52
Метки: основе, фармацевтический, энтекавира, получения, препарат, способ
Код ссылки
<a href="https://eas.patents.su/8-6181-farmacevticheskijj-preparat-na-osnove-entekavira-i-sposob-ego-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтический препарат на основе энтекавира и способ его получения</a>
Предыдущий патент: Способ экстракции
Следующий патент: Создание базы данных связей между понятиями
Случайный патент: Рекомбинантные мутанты интерферона α2 (ifnα2)