Ковалентный конъюгат полиэтиленгликоля с полипептидом, имеющим активность интерферона-гамма
Номер патента: 20220
Опубликовано: 30.09.2014
Авторы: Катлинский Владимир Антонович, Катлинский Антон Викентьевич, Коровкин Сергей Анатольевич, Семченко Андрей Викторович, Шереметьев Сергей Викторович
Формула / Реферат
Ковалентный конъюгат полиэтиленгликоля с полипептидом, имеющим активность интерферона-гамма (IFN-γ) формулы (I)
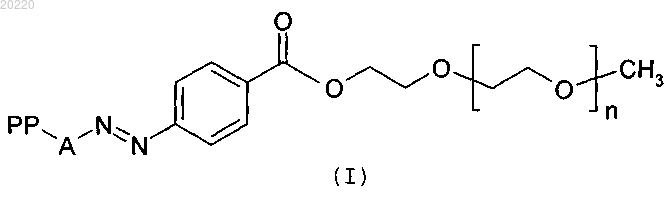
где n - целое число в интервале от 100 до 1200;
А - аминокислотный фрагмент тирозина или гистидина;
РР - полипептид с активностью IFN-γ, выбранный из группы, состоящей из IFN-γ и дельтаферона.
Текст
КОВАЛЕНТНЫЙ КОНЪЮГАТ ПОЛИЭТИЛЕНГЛИКОЛЯ С ПОЛИПЕПТИДОМ,ИМЕЮЩИМ АКТИВНОСТЬ ИНТЕРФЕРОНА-ГАММА Изобретение относится к медицине и биотехнологии и касается ковалентного конъюгата полиэтиленгликоля с полипептидами, имеющими биологическую активность интерферона-гамма где n - целое число в интервале от 100 до 1200, А - аминокислотный фрагмент тирозина или гистидина, РР - полипептид с активностью IFN-, и способа его получения. Изобретение позволяет расширить арсенал лекарственных средств, увеличив при этом длительность циркуляции активного вещества в крови с сохранением значительной части биологической активности немодифицированного полипептида. Область техники, к которой относится изобретение Изобретение относится к медицине и биотехнологии и касается ковалентного конъюгата полиэтиленгликоля с полипептидами, имеющими биологическую активность интерферона-гамма (IFN-), в котором полимер присоединн к полипептиду посредством азогруппы. Сведения о предшествующем уровне техники Интерферон-гамма (IFN-) является димеризованным растворимым цитокином с молекулярной массой около 17 кДа и единственным представителем интерферонов II типа [Gray P.W., Goeddel D.V.Structure of the human immune interferon gene. Nature. Vol. 298 (5877) (August 1982). P. 859-863]. В отличие от интерферона- и интерферона-, которые могут экспрессироваться всеми клетками, IFN- производится только Th1-, Т- и NK-клетками.IFN- необходим для врожденного и адаптивного иммунитета к вирусным и внутриклеточным бактериальным инфекциям, а также для контроля опухолей. Роль IFN- в иммунной системе состоит, в частности, в его способности ограниченно подавлять репликацию вируса как таковую. Но основными активностями IFN- являются иммуностимулирующая и иммуномодулирующая активности [Schoenborn J.R.,Wilson С.В. Regulation of interferon-gamma during innate and adaptive immune responses. Adv. Immunol.Vol. 96 (2007). P. 41-101]. Аберрантная экспрессия IFN- связана с рядом воспалительных и аутоиммунных заболеваний. Интерферон-гамма применяют для лечения хронических гранулематозных заболеваний [Todd P.A.,Goa K.L. Interferon gamma-1b. A review of its pharmacology and therapeutic potential in chronic granulomatous disease. Drugs. Vol. 43(1) (January 1992). Pp. 111-122], остеопороза [Key L.L., Ries W.L., Rodriguiz(July 1992). P. 119]. В комплексной терапии хронических вирусных гепатитов В и С, ВИЧ/СПИД-инфекции, туберкулеза, онкологических заболевания, урогенитального хламидиоза и генитальной герпес-вирусной инфекции применяют препарат Ингарон (производитель - НПП Фармаклон, РФ), который представляет собой лиофилизат рекомбинантного интерферона-гамма человека с молекулярной массой 16,9 кДа, состоящего из 144 аминокислотных остатков, в начале последовательности которых первые три Cys-Tyr-Cys заменены на Met. Препарат получен микробиологическим синтезом в рекомбинантном штамме Escherichia coli и очищен колоночной хроматографией. Тем не менее, применение препаратов IFN- в медицине ограничено рядом факторов, среди которых наиболее существенным является недостаточная энзиматическая стабильность в организме [Cantell(1986). P.671-675; Dobeli H., Gents R., Jucker W., Garotta G., Hartmann D.W., Hochuli E. Role of the carboxyterminal sequence of the biological activity of human immune interferon. J. Biotechnol. Vol.7 (1988). P.199216; Rutenfranz I., Bauer A., Kirchner H. Pharmacokinetic study of liposome-encapsulated human interferongamma after intravenous and intramuscular injection in mice. J. Interferon Res. Vol. 10(3) (June 1990). P.337341], которая приводит к необходимости увеличения дозы и частоты введения препарата, что, в ряде случаев, сопряжено с побочными эффектами, например, аллергией. Так, например, препарат Ингарон вводятся ежедневно или через день. В связи с этим возникает необходимость в химическом модифицировании молекулы интерферона-гамма с целью преодоления указанных недостатков. Одним из путей является изменение аминокислотной последовательности и получение более стабильных полипептидов с активностью IFN-. В патенте RU 2326944 (опубл. 20.06.2008) предложен рекомбинантный аналог IFN- человека - дельтаферон с молекулярной массой 16,2 кДа, который имеет делецию 10 аминокислотных остатков на С-конце молекулы и замену кластера KRKR на KGSA по сравнению с природным IFN-. В результате данной модификации у молекулы-аналога IFN- (дельтаферона) появилась устойчивость к протеолизу. В другом случае для модифицирования различных полипептидов известно применение монометоксиполиэтиленгликоля (мПЭГ), который представляет собой нейтральный полиэфир с различной молекулярной массой [Никитин И.Г., Сторожаков Т.Н. Пегилированные лекарственные препараты: современное состояние проблемы и перспективы, в сборнике Вирусные гепатиты: достижения перспективы. 3 (13)(2001). С. 3-8]. Как правило, в ковалентных конъюгатах полимерный фрагмент присоединен к полипептиду через одну из свободных аминогрупп последнего [Kozlowski A., Charles S.A., Harris J.М. Development of Pegylated Interferons for the Treatment of Chronic Hepatitis C. BioDrugs.; Vol. 15(7) (2001). P. 419-429]. В патенте US 5109120 (опубл. 28.04.1992) предложен конъюгат рекомбинантного INF-, в котором полиэтиленгликолевый фрагмент присоединен к полипептиду через N-терминальную аминогруппу или концевую аминогруппу одного из фрагментов лизина. Такие препараты представляют собой смеси позиционных изомеров, химическая структура которых отличается местом присоединения полимера к полипептиду. Теоретически число позиционных изомеров в данном случае равно количеству свободных аминогрупп в полипептиде [Блохин Н.П., Никитин И.Г. Особенности фармакологической динамики и кинетики пегилированного -интерферона (40 кДа) Пегасис: новые возможности терапии хронического гепатита С в сборнике Материалы VII Российской конференции Гепатология сегодня. РЖГГК. 2002. С. 6.]. Известно, что позиционные изомеры полипептидов имеют различную биологическую активность(US 2004/0223950, опубл. 11.11.2004). Это создат предпосылки для расширения арсенала таких средств за счт различных вариантов модифицирования молекул протеинов. Например, изменение положений и способов присоединения ПЭГ к протеину позволяет изменить соотношения позиционных изомеров, а также получить новые типы конъюгатов, в которых, например, не затронуты аминогруппы полипептидов. В патенте US 6958388 (опубл. 25.10.2005) и международной заявке WO 2002/081507 (опубл. 17.10.2002) раскрыты полипептидные варианты интерферона-гамма, имеющие способность связываться с рецептором IFNG, содержащие от 1 до 10 модификаций его аминокислот, предпочтительно - введение звена цистеина, ковалентно присоединнного к неполипептидному фрагменту, которым является, например, линейный или разветвлнный полиэтиленгликоль, причем в качестве пегилирующих агентов использованы ортопиридилдисульфидные (ПЕГ-OPSS) и малеимидные (ПЕГ-MAL) производные ПЕГ. При использовании ПЕГ-OPSS в образующемся конъюгате полимер связан с цистеиновым фрагментом полипептида малостабильной дисульфидной связью, а при использовании ПЕГ-MAL полимер связывается как с тиольными, так и с аминогруппами полипептидов, образуя смесь соответствующих позиционных изомеров [Гершкович А.А., Кибирев В.К. Химический синтез пептидов. Киев, Наукова Думка. 1992; Shan S. Wong. Chemistry of protein conjugation and cross-linking. CRC Press, Inc. 1993]. В патенте US 179337 (опубл. 18.12.1979) раскрыты физиологически активные конъюгаты инсулина,содержащие в молекуле фрагмент пара-фенилендиазония и имеющие строение аминоазопроизводного формулы где R представляет PEG-O-CH2-, PEG-O-CH2-CH(OH)-CH2-O- или PEG-O-C(=O)-, а представляет пептидную цепь, которые можно рассматривать в качестве ближайших аналогов. Недостатками таких производных являются относительно большое количество возможных вариантов позиционных изомеров вследствие присоединения полимерной части к аминогруппам полипептидов и их невысокая стабильность в организме и, как следствие, связанные с этим возможности неконтролируемого изменения структуры и отщепления реакционноспособных частиц, в частности - диазосоединений. Таким образом, существует потребность в новых конъюгатах полипептидов с активностью IFN-. Сущность изобретения Авторы изобретения неожиданно установили, что недостатки известного уровня техники можно преодолеть, синтезировав монопегилированные полипептиды с активностью IFN-, имеющие общую структуру (I) где n - целое число в интервале от 100 до 1200,А - аминокислотный фрагмент тирозина или гистидина,РР - полипептид с активностью IFN-,в которых полимер присоединен к тирозиновым или гистидиновым фрагментам полипептида посредством азогруппы. Техническим результатом такого модифицирования химической структуры является увеличение длительности циркуляции активного вещества в крови при сохранении им значительной части биологической активности немодифицированного полипептида. В соответствии с изобретением в качестве полипептида с активностью IFN- можно применять интерферон-гамма (INF-) или дельтаферон. Таким образом, первым объектом изобретения является ковалентный конъюгат полиэтиленгликоля с полипептидом, имеющим активность интерферона-гамма (IFN-) формулы (I) где n - целое число в интервале от 100 до 1200,А - аминокислотный фрагмент тирозина или гистидина,РР - полипептид с активностью IFN-. Ковалентный конъюгат получают азосочетанием 4-([метоксиполэтиленгликольокси]карбонил)бензолдиазония (М.м. 30 кДа) с гистидиновыми и тирозиновыми фрагментами полипептидов, выступающими в данной реакции в качестве азосоставляющих. Для доказательства строения конъюгата как азосоединения применяют, в частности, электронную спектроскопию поглощения (ЭСП), сравнивают спектральные характеристики (интенсивность, ширину и положение максимумов полос поглощения) растворов исходных и модифицированных полипептидов с активностью IFN- и интерпретируют полученные закономерности с позиций теории цветности органических соединений, необязательно, с привлечением адекватных методов квантово-химического моделирования. Характеристики максимумов полос поглощения приведены в табл. 1. Таблица 1. Характеристики максимумов полос поглощения IFN-, дельтаферона и их монопегилированных аналогов (вода, рН 6,5, l 1,0 см)- поглощение 1% (мас./об.) раствора при l 1 см.- проявляется в виде плеча. Появление полос поглощения у монопегилированных IFN- и дельтаферона с максимумами при 344,414 и 346,412 нм может быть объяснено, например, с позиций теории цветности органических соединений, локальными электронными переходами в хромофорных системах не связанных сопряжением диарилазогрупп, IFN- образовавшихся в результате ковалентного присоединения ПЭГ-агента к тирозиновыми и гистидиновыми звеньями молекул полипептидов. Уширение полос обусловлено наличием нескольких позиционных изомеров с близкими энергиями электронно-колебательных переходов. Достижение технического результата, заключающегося в увеличении времени циркуляции в кровотоке ковалентных конъюгатов (пегилированных полипептидов) с активностью IFN-, подтверждают в сериях исследований на мышиной модели. Результаты сравнительных исследований in vivo приведены в табл. 2. Полученные данные показывают, что конъюгаты IFN- и дельтаферона в соответствии с изобретением обладают большим временем циркуляции в кровотоке по сравнению с непегилированными полипептидами. Достижение технического результата, заключающегося в сохранении ковалентными конъюгатами значительной части биологической активности исходных полипептидов, подтверждается результатами определения остаточной активности пегилировнных полипептидов с активностью INF-. Таблица 3. Активность INF-, дельтаферона и их конъюгатов (остаточная активность) Ковалентный конъюгат полиэтиленгликоля с полипептидом, имеющим активность интерферонагамма (IFN-) формулы (I) где n - целое число в интервале от 100 до 1200,А - аминокислотный фрагмент тирозина или гистидина,РР - полипептид с активностью IFN-, можно получить способом, включающим стадии, на которых: а) метоксиполиэтиленгликолевый эфир аминобензойной кислоты где n принимает значения от 100 до 1200, диазотируют нитритом щелочного или щелочноземельного металла в водной или водно-органической среде при температуре от -2 до 30 С или органическим нитритом в среде полярного органического растворителя, неограниченно смешивающегося с водой, при температуре от -40 до 30 С, молярном соотношении нитрита к метоксиполиэтиленгликолевому эфиру аминобензойной кислоты от 1,1:1 до 1000:1 и молярном соотношении кислоты к метоксиполиэтиленгликолевому эфиру аминобензойной кислоты 3:1 до 10000:1 с последующим удалением избытка нитрита и получением активированного пегилирующего агента - 4-([метоксиполиэтиленгликольокси]карбонил)бензолдиазония где n - принимает вышеуказанные значения; б) активированный пегилирующий агент без выделения из реакционной смеси вводят в реакцию азосочетания с полипептидом, имеющим активность INF- в водной или водно-органической среде с рН от 7,0 до 10,0 при температуре от 0 до 30 С; по достижении степени превращения по меньшей мере 70% реакцию останавливают добавлением к реакционной массе низкомолекулярной азосоставляющей с получением смеси монопегилированного, дипегилированого и немодифицированного полипептида с активностью интерферона гаммма и блокированного ПЭГ-агента, и в) смесь разделяют ионообменной хроматографией с увеличением ионной силы буферных элюирующих растворов с получением монопегилированого полипептида, имеющего активность INF-. При реализации указанного способа обеспечивается повышение выхода пегилированного полипептида, имеющего активность INF-, и расширение арсенала лекарственных средств для борьбы с вирусными и некоторыми бактериальными инфекциями. Повышение выхода пегилированного полипептида, имеющего активность INF-, достигается за счет количественного переведения ПЕГ-агента в активную форму непосредственно перед конъюгацией,исключая деградацию активной группировки - диазогруппы при транспортировке и хранении. Увеличение времени циркуляции пегилированного полипептида с активностью INF- в кровотоке возможно за счт способности тирозиновых и гистидиновых звеньев INF- вступать в реакцию азосочетания с активными диазосоединениями с образованием биологически активных азопроизводных полипептидов с активностью INF-. В случае необходимости, повышение устойчивости пегилирующего агента при хранении достигается в результате применения для активации пегилирующего агента органического нитрита в среде полярного органического растворителя, неограниченно смешивающегося с водой, что дополнительно позволяет расширить температурный диапазон проведения реакции диазотирования. В предпочтительном варианте изобретения на стадии а) диазотирование проводят нитритом натрия в среде водного раствора бромисто-водородной кислоты, а избыток нитрита удаляют сульфаминовой кислотой. В следующем предпочтительном варианте изобретения на стадии а) диазотирование проводят третбутилнитритом в присутствии HCl в тетрагидрофуране. В следующем предпочтительном варианте изобретения на стадии б) для создания и поддержания рН применяют боратно-карбонатный буферный раствор, степень превращения полипептидов с активностью INF- составляет 80-85%, а в качестве низкомолекулярной азосотавляющей применяют тирозин. В следующем предпочтительном варианте изобретения на стадии в) смесь разделяют ионообменной хроматографией с увеличением ионной силы буферных элюирующих растворов от 0,02 до 1,0 М NaCl. На стадии а) диазотирование метоксиполиэтиленгликолевого эфира аминобензойной кислоты осуществляют прибавлением нитрита щелочного или щелочно-земельного металла в кислой водной или водно-органической среде при температуре от -2 до 30 С. В первом варианте диазотирования применяют нитрит щелочного или щелочно-земельного металла в кислой водной или водно-органической среде. Наиболее предпочтительный интервал температур диазотирования составляет от 0 до 5 С. Кислую среду создают с помощью органических кислот, например, с помощью уксусной кислоты или ее галогенпроизводных, таких как хлоруксусная, трихлоруксусная, бромуксусная, трибромуксусная, трифторуксусная кислоты, а также лимонной или винной кислот, или неорганических кислот, например хлористо-водородной, бромисто-водородной, серной или фосфорной кислот, а также смесью органических и/или нерганических кислот. Молярное соотношение нитрита к метоксиполиэтиленгликолевому эфиру аминобензойной кислоты составляет от 1,1:1 до 1000:1, предпочтительно - от 1,1:1 до 10:1. Молярное соотношение кислоты к метоксиполиэтиленгликолевому эфиру аминобензойной кислоты составляет от 3:1 до 10000:1. Реакцию предпочтительно проводят в присутствии катализатора диазотирования, в качестве которого используют бромид-ионы, вносимые в реакционную смесь в виде бромоводородной кислоты или ее растворимых солей, например бромидов щелочных металлов. Наиболее предпочтительно создавать кислую среду раствором бромисто-водородной кислоты. Во втором варианте диазотирование проводят с применением органического нитрита в среде полярного органического растворителя, неограниченно смешивающегося с водой, при температуре от -40 до 30 С. Наиболее предпочтительный интервал температур диазотирования составляет от -20 до 0 С. Предпочтительными органическими нитритами являются бутилнитриты или амилнитриты, более предпочтительно - трет-бутилнитрит. Молярное соотношение нитрита к метоксиполиэтиленгликолевому эфиру аминобензойной кислоты составляет от 1,1:1 до 1000:1, предпочтительно от 1,1:1 до 10:1. Кислую среду в полярной органической среде создают растворами HCl или HBr в алифатическом эфире, например диэтиловом эфире, или циклическом эфире, например диоксане или тетрагидрофуране. Молярное соотношение кислоты к метоксиполиэтиленгликолевому эфиру аминобензойной кислоты составляет от 3:1 до 10000:1. По завершении диазотирования активированный ПЭГ-агент можно хранить при пониженной температуре в течение не более 2 ч в водной или водно-органической среде, или не более 24 ч в полярной органической среде без существенной потери его способности к азосочетанию. Термин пониженная температура означает температуру от -2 до 5 С в случае применения водной или водно-органической среды и от -40 до 0 С в случае применения полярной органической среды. Перед применением активированного ПЭГ-агента для пегилирования интерферона требуется удаление избытка нитрит-ионов, для чего к его раствору добавляют мочевину или сульфаминовую кислоту. Альтернативно применяют азиды щелочных или щелочно-земельных металлов. На стадии б) пегилирование полипептида с активностью INF- достигается в результате протекания реакции азосочетания диазотированного метоксиполиэтиленгликолевого эфира аминобензойной кислоты с интерфероном -2b в нейтральной или слабощелочной водной или водно-органической среде при температуре от 0 до 30 С. Наиболее предпочтительный интервал рН при пегилировании составляет от 9 до 10. Поддержание рН обеспечивают применением подходящего буферного раствора, например боратнокарбонатного буферного раствора. Выбор раствора находится в рамках компетенции среднего специалиста в данной области. Молярное соотношение диазотированного метоксиполиэтиленгликолевого эфира 4-аминобензойной кислоты к полипептиду с активностью INF- составляет от 1:1 до 20:1, наиболее предпочтительно от 3:1 до 8:1. Контроль процесса пегилирования осуществляют эксклюзионной или обращено-фазовой ВЭЖХ. По достижении требуемой степени превращения полипептида реакцию пегилирования останавливают добавлением к реакционной массе низкомолекулярной азосотавляющей. Для этого в качестве низкомолекулярной азосотавляющей применяют вещества фенольной природы или их эфиры, вещества, имеющие природу ароматических аминов, или вещества, имеющие гетероциклическую природу, у которых гетероцикл способен выступать в качестве азосотавляющей в реакции азосочетания. Наиболее предпочтительными являются тирозин и гистидин, более предпочтительно - тирозин. Предпочтительно степень превращения полипептида, вычисленная по результатам ВЭЖХ-анализа, составляет 80-90%. Выделение монопегилированного полипептида с активностью INF- из реакционной смеси осуществляют обычными методами ионообменной хроматографии, последовательно используя буферные растворы с возрастающей ионной силой. Концентрацию полипептида с активностью INF- определяют методом ВЭЖХ или спектрофотометрически, используя соответствующее значение А 280 для раствора с концентрацией полипептида 1 мг/мл. Сведения, подтверждающие возможность осуществления изобретения Далее изобретение будет проиллюстрировано следующими примерами, подтверждающими возможность его осуществления с достижением указанного в описании технического результата. Пример 1. Диазотированный монометоксиполиэтиленгликолевый эфир 4-аминобензойной кислоты(активированный ПЭГ-агент с м.м. 30 кДа). К охлажденному до 1 С раствору 0,077 г (2,5 мкмоль) монометоксиполиэтиленгликолевого эфира 4-аминобензойной кислоты (м.м. 30 кДа) в 1 мл 0,1 М HBr приливают 1 мл охлажденного 0,01 М NaNO2 и выдерживают в ледяной бане 20 мин, после чего приливают 1 мл 0,01 М H2NSO3H и сразу же используют для пегилирования или хранят в холодильнике не более 2 ч. ЭСП (вода, рН 4) , нм (lg ): 203 (4,86), 256 (4,51), 275 (4,43, плечо). Пример 2. Диазотированный монометоксиполиэтиленгликолевый эфир 4-аминобензойной кислоты(активированный ПЭГ-агент с м.м. 30 кДа). К охлажденному до -35 С раствору 0,077 г (2,5 мкмоль) монометоксиполиэтиленгликолевого эфира 4-аминобензойной кислоты (м.м 30 кДа в 0,5 мл 0,2 М раствора HCl в тетрагидрофуране приливают 0,5 мл 0,01 М трет-бутилнитрита в тетрагидрофуране и оставляют при -35 С не менее чем на 30 мин (но не более чем на 24 ч), после чего прибавляют 0,5 мл 0,01 М H2NSO3H и сразу же используют для пегилирования. Пример 3 а. Получение монопегилированного полипептида, имеющего активность INF- (интерферона-гамма). К охлажденному до 3 С раствору 0,5 мкмоль полипептида с активностью интерферона INF- в боратно-карбонатном буфере с рН 9,5 приливают охлажденный раствор 0,077 г (2,5 мкмоль) диазотированного монометоксиполиэтиленгликолевого эфира 4-аминобензойной кислоты (м.м. 30 кДа), полученный в соответствии с примером 1 или 2, поддерживая рН реакционной смеси 9,50,3. Реакционную смесь при охлаждении перемешивают приблизительно 3 ч, контролируя протекание превращений обращенофазовой ВЭЖХ (колонка Kromasil 300-5C4, 2504,6 мм, спектрофотометрическое детектирование при 220, 280, 340 и 400 нм, градиентное элюирование: от 30% водн. ацетонитрил+0,2% ТФУ до 80% водн. ацетонитрил+0,2% ТФУ). По достижении степени превращения соответствующего полипептида, равной 80-85%, приливают раствор тирозина, перемешивают 5 мин и уксусной кислотой доводят рН до 5,0-6,5. Далее реакционную смесь, содержащую смесь дипегилированого, монопегилированного и немодифицированного полипептида с активностью INF-, а также блокированный пегилирующий агент, разделяют ионообменной хроматографией с увеличением ионной силы буферных элюирующих растворов от 0,02 до 1,0 М NaCl. Выход очищенного монопегилированного IFN- 44% (считая на IFN-). ЭСП (вода, рН 6,5, l 1,0 см), макс, нм (E1%1 см): 224 (75,0), 281 (10,2), 344 (2,7), 414 (3,0). Пример 3 б. Получение монопегилированного полипептида, имеющего активность INF- (дельтаферона). В условиях, приведнных в примере 3 а, получают очищенный монопегилированный дельтаферон с выходом 51% (считая на дельтаферон). ЭСП (вода, рН 6,5, l 1,0 см), макс, нм (E1%1 см): 208 (71,7), 278 (9,3), 346 (2,9), 412 (3,1). Пример 4. Определение времени циркуляции монопегилированных IFN- и дельтаферона в крови на мышиной модели. Самцам мышей линии СВА внутримышечно вводят по 1 мкг пегилированного полипептида с активностью IFN- в соответствии с изобретением (30 кДа), после чего собирают кровь в первый день через 2 ч после инъекции и далее через каждые 24 ч в течение 10 дней. В качестве контроля используют соответствующий немодифицированный полипептид, который вводят по той же схеме. Взятые пробы крови инкубируют в течение 45 мин при 37 С, после чего отделяют тромб и повторно инкубируют при 4 С,полученную сыворотку центрифугируют и сохраняют при -65 С до проведения тестов. Содержание полипептидов (пг/мл) в сыворотках крови определяют с помощью иммуно-ферментного анализа, результаты усредняют. Вычисляют относительное содержание полипептида (в %), при этом за 100% принимают среднюю максимальную концентрацию белка в крови в каждой группе животных. Пример 5. Определение активности монопегилированных и немодифицированных IFN- и дельтаферона. Противовирусную активность определяют микрометодом в 96-луночных планшетах с плоским дном по подавлению цитопатического действия тест-вируса в диплоидной культуре клеток Л-68 (200000 кл/мл). Для этого используют тест-вирус ЕМС штамм Колумбия в дозе 100 ЦПД 50 и питательную среду Игла MEM с добавлением 10% сыворотки КРС. Остаточную активность конъюгатов выражают по отношению к результатам параллельного титрования активности стандартного раствора соответствующего полипептида, имеющего биологическую активность IFN-. ФОРМУЛА ИЗОБРЕТЕНИЯ Ковалентный конъюгат полиэтиленгликоля с полипептидом, имеющим активность интерферонагамма (IFN-) формулы (I) где n - целое число в интервале от 100 до 1200; А - аминокислотный фрагмент тирозина или гистидина; РР - полипептид с активностью IFN-, выбранный из группы, состоящей из IFN- и дельтаферона.
МПК / Метки
МПК: C07K 14/57, C08G 73/00, A61K 31/25, A61K 38/21
Метки: активность, имеющим, ковалентный, полипептидом, полиэтиленгликоля, интерферона-гамма, конъюгат
Код ссылки
<a href="https://eas.patents.su/8-20220-kovalentnyjj-konyugat-polietilenglikolya-s-polipeptidom-imeyushhim-aktivnost-interferona-gamma.html" rel="bookmark" title="База патентов Евразийского Союза">Ковалентный конъюгат полиэтиленгликоля с полипептидом, имеющим активность интерферона-гамма</a>
Предыдущий патент: Комплект для переделки велосипеда в скибайк
Следующий патент: Типографская краска для глубокой печати, включающая дендримеры
Случайный патент: Способ сбора и вывоза бытовых отходов и машина для его осуществления












