Набор олигонуклеотидных праймеров и зондов и способ для определения резус-фактора эмбриона или плода по фетальной днк из крови резус-отрицательной беременной женщины
Номер патента: 19861
Опубликовано: 30.06.2014
Авторы: Тороповский Андрей Николаевич, Никитин Алексей Георгиевич
Формула / Реферат
1. Набор олигонуклеотидных праймеров и зондов для определения резус-фактора эмбриона или плода по фетальной ДНК из крови резус-отрицательной беременной женщины, включающий
по меньшей мере три пары частично комплементарных олигонуклеотидных праймеров длиной по меньшей мере 25 нуклеотидов, обладающих специфичностью к противоположным концам последовательностей ДНК экзонов 6, 7 и 10 гена резус-фактора человека (RHD) и/или прилегающих интронных областей, по меньшей мере по одной паре упомянутых праймеров на каждый экзон или прилегающую к нему интронную область, каждая из которых (последовательность) включает от 65 до 130 нуклеотидов, и
праймеры-зонды, обладающие специфичностью к упомянутым экзонам, имеющие длину, от 15 до 19 нуклеотидов, причем в каждом из упомянутых праймеров-зондов по меньшей мере 3 нуклеотида представляют собой модифицированные нуклеотиды, увеличивающие температуру плавления ДНК,
в котором
по меньшей мере 9 нуклеотидов на 5' конце каждого праймера не комплементарны последовательности упомянутых экзонов, а 3' конец одного из праймеров каждой пары отличается от гомологичной последовательности гена RHCE по меньшей мере на 4 нуклеотида, причем в 3' области, что гарантирует отсутствие неспецифичной амплификации,
каждый из упомянутых частично комплементарных праймеров является частично комплементарным по отношению к последовательности ДНК экзонов 6, 7 или 10 гена резус-фактора человека или прилегающей интронной области.
2. Набор по п.1, в котором упомянутые модифицированные нуклеотиды представляют собой рибонуклеотиды, у которых 2' атом кислорода и 4' атом углерода рибозы соединены между собой.
3. Набор по любому из пп.1 или 2, в котором упомянутая пара праймеров для упомянутого экзона 6 включает олигонуклеотиды, имеющие следующую последовательность:
где подчеркиванием выделены упомянутые нуклеотиды, не комплементарные последовательности упомянутого экзона, а зонд имеет последовательность
где подчеркиванием выделены модифицированные нуклеотиды,
F1 - флуоресцентная группа,
Q - группа гасителя флуоресценции.
4. Набор по любому из пп.1-3, в котором упомянутая пара праймеров для упомянутого экзона 7 включает олигонуклеотиды, имеющие следующую последовательность:
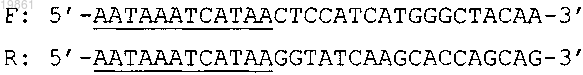
где подчеркиванием выделены упомянутые нуклеотиды, не комплементарные последовательности упомянутого экзона, а зонд имеет последовательность
где подчеркиванием выделены модифицированные нуклеотиды,
F1 - флуоресцентная группа,
Q - группа гасителя флуоресценции.
5. Набор по любому из пп.1-4, в котором упомянутая пара праймеров для упомянутого экзона 10 включает олигонуклеотиды, имеющие следующую последовательность:
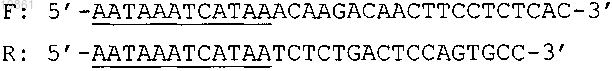
где подчеркиванием выделены упомянутые нуклеотиды, не комплементарные последовательности упомянутого зкзона, а зонд имеет последовательность
где подчеркиванием выделены модифицированные нуклеотиды,
F1 - флуоресцентная группа,
Q - группа гасителя флуоресценции.
6. Набор по любому из пп.1-5, дополнительно включающий праймеры для положительного контроля.
7. Набор по п.6, в котором упомянутые праймеры для положительного контроля представляют собой пару олигонуклеотидов, специфичных к последовательности гена глицеральдегид-3-фосфат дегидрогеназы человека (GAPDH)
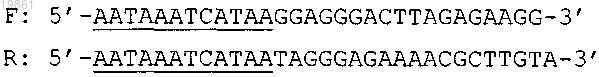
где подчеркиванием выделены упомянутые нуклеотиды, не комплементарные последовательности упомянутого гена, при этом зонд для положительного контроля имеет последовательность
где подчеркиванием выделены модифицированные нуклеотиды,
F1 - флуоресцентная группа,
Q - группа гасителя флуоресценции.
8. Набор по любому из пп.1-7, в котором длина упомянутых олигонуклеотидных праймеров составляет от 29 до 33 нуклеотидов, длина упомянутых олигонуклеотидных зондов составляет от 15 до 19 нуклеотидов, каждый зонд содержит от 3 до 4 модифицированных нуклеотидов.
9. Набор по любому из пп.1-8, в котором упомянутая флуорофорная группа представляет собой FAM, а упомянутая группа гасителя флуоресценции представляет собой BHQ1.
10. Набор по п.9, в котором упомянутые флуорофорные группы и группы гасителей флуоресценции выбраны из следующих пар: FAM - BHQ1 (6-карбоксифлуоресцеин), HEX - BHQ2 (гексахлорофлуоресцеин), JOE - BHQ2 (6-карбокси-4',5'-дихлор-2',7'-диметоксифлуоресцеин), R6G - BHQ2 (6-карбоксиродамин), VIC - BHQ2, ROX - BHQ2 (карбокси-Х-родамин), Су5 - BHQ3.
11. Набор по любому из пп.1-3, дополнительно включающий раствор, содержащий 67 мМ трис-HCl с рН 8,8, 16,6 мМ (NH4)2SO4, 6,7 мМ MgCl2 и 170 мкг БСА, смесь четырех основных dNTP в концентрации 0,2 мМ каждого, а также раствор термостабильной ДНК-полимеразы 10 единиц/мкл.
12. Способ определения резус-фактора эмбриона или плода по фетальной ДНК из крови резус-отрицательной беременной женщины, в котором
выделяют ДНК из крови резус-отрицательной беременной женщины,
проводят начальное плавление по меньшей мере 90 с при температуре 94-96°С,
проводят полимеразную цепную реакцию с набором вышеуказанных праймеров-зондов и праймеров по любому из пп.1-11, включая по меньшей мере тридцать циклов отжига, синтеза и плавления,
причем плавление осуществляют 10-30 с при температуре 94-96°С,
отжиг и синтез проводят 30-60 с при температуре 62-66°С, а детекцию осущетсвляют во время отжига посредством флуоресцентной спектрометрии.
13. Способ по п.12, в котором начальное плавление проводят в течение по меньшей мере 100 с.
14. Способ по любому из пп.12 или 13, в котором начальное плавление проводят при температуре 95°С.
15. Способ по любому из пп.12-14, в котором проводят по меньшей мере тридцать пять упомянутых циклов отжига, синтеза и плавления.
16. Способ по любому из пп.12-15, в котором проводят по меньшей мере сорок циклов плавления.
Текст
НАБОР ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ И ЗОНДОВ И СПОСОБ ДЛЯ ОПРЕДЕЛЕНИЯ РЕЗУС-ФАКТОРА ЭМБРИОНА ИЛИ ПЛОДА ПО ФЕТАЛЬНОЙ ДНК ИЗ КРОВИ РЕЗУС-ОТРИЦАТЕЛЬНОЙ БЕРЕМЕННОЙ ЖЕНЩИНЫ Изобретение относится к медицине, молекулярно-биологическим исследованиям в области определения ДНК гена резус-фактора и может быть использовано для определения резус-фактора плода по крови резус-отрицательной беременной женщины. Задачей предлагаемого решения является создание способа определения наличия ДНК гена резус-фактора, позволяющего выявлять ДНК в плазме человека в минимальных концентрациях, и диагностического набора для его осуществления, позволяющего определять резус-фактора плода по крови резус-отрицательной беременной женщины. Область техники Изобретение относится к медицине, молекулярно-биологическим исследованиям в области определения ДНК гена резус-фактора и может быть использовано для определения резус-фактора эмбриона или плода по крови резус-отрицательной беременной женщины. Уровень техники Известна система праймеров и зондов, рекомендованная European Commission for the Special Noninvasive Advances in Fetal and Neonatal Evaluation (SAFE) с праймерами на 5-й и 7-й экзоны гена RHD, и ее разновидности (Faas В.Н., Beuling E.А., Christiaens G.С., von dem Borne A E, van der Schoot С Е. 1998.noninvasive fetal RHD genotyping service. Transfusion. 42 (8), 1079-1085.). Метод флуоресцентной детекции - стандартные Такман-зонды. В известной системе в силу ограничения на длину стандартных зондов невозможно повысить температуру реакции выше 60 С, так как при длине более 25-30 нуклеотидов сильно падает эффективность гашения флуорофора и резко ухудшается соотношение сигнал/шум, что ведет к падению характеристик тест-системы. Повышение температуры необходимо для уменьшения времени проведения анализа (амплификатор меньше времени тратит на каждый цикл) и повышения специфичности праймеров. Кроме того, длинные зонды имеют сниженную эффективность разгорания флуорофора при малых концентрациях ДНК в реакции, что приводит к слабому подъему кривых флуоресценции, нестандартному виду этих кривых и возможности ошибки персонала, который может спутать положительный результат с отсутствием амплификации. Более того, праймеры отличаются от гомологичной последовательности RHCE (этот ген на 98% гомологичен RHD) только на один нуклеотид в 3'-области,что не позволяет гарантировать отсутствие неспецифичной амплификации и может приводить к ложноположительным результатам. Типичный график флуоресценции при входной концентрации 1000 копий ДНК на реакцию (то есть заведомо выше, чем обычное количество фетальной ДНК в крови индивидуума) представлен на фиг. 1. При еще более низких концентрациях кривые флуоресценции практически не отличаются от отрицательных контролей, что приводит к ошибкам. Раскрытие изобретения Задачей предлагаемого решения является создание способа определения резус-фактора эмбриона или плода по фетальной ДНК в плазме резус-отрицательной беременной женщины в минимальных концентрациях и диагностического набора для его осуществления. Технический результат состоит в улучшении метрологических характеристик, а именно в повышении чувствительности вплоть до надежного определения единичных копий ДНК, в сокращении времени анализа на 30%, в улучшении специфичности ПЦР и увеличении скорости разгорания флуоресценции,что упрощает интерпретацию результатов. Вышеуказанная задача решена с помощью набора олигонуклеотидных праймеров и зондов для определения резус-фактора эмбриона или плода по фетальной ДНК из крови резус-отрицательной беременной женщины, в котором по меньшей мере три пары частично комплементарных олигонуклеотидных праймеров длиной по меньшей мере 25 нуклеотидов, обладающих специфичностью к противоположным концам последовательностей ДНК экзонов 6, 7 и/или 10 гена резус-фактора человека (RHD) и/или прилегающих интронных областей, каждая из которых (последовательность) включает, от 65 до 130 нуклеотидов, и праймеры-зонды, обладающие специфичностью к упомянутым экзонам, имеющие длину от 15 до 19 нуклеотидов, каждый из которых (праймеров-зондов) включает по меньшей мере 3 модифицированных нуклеотида, увеличивающих температуру плавления ДНК,в котором по меньшей мере 9 нуклеотидов на 5' конце каждого праймера не комплементарны последовательности упомянутых экзонов, а 3'-конец одного из праймеров каждой пары отличается от гомологичной последовательности гена RHCE по меньшей мере на 4 нуклеотида, причем в 3'-области, что гарантирует отсутствие неспецифичной амплификации. Благодаря тому, что один из праймеров в паре отличается от гомологичной последовательностиRHCE не менее чем на 4-5 букв, причем в 3'-области, обеспечивается практически полное отсутствие неспецифичной амплификации. Выбор минимальной длины ампликонов (79-102 пар нуклеотидов) обеспечивает повышенное качество анализа при сильной фрагментации фетальной ДНК. Включение в последовательность зондов модифицированных нуклеотидов, увеличивающих температуру плавления на 2-4 С на каждую модифицированную букву, позволяет резко снизить длину зонда,улучшает соотношение сигнал/шум, позволяет повысить температуру реакции до 64-66 С, снижает время шага отжига/элонгации до 30-40 с вместо стандартной одной минуты. Сокращение времени цикла позволяет уменьшить общее время анализа на 30%, увеличивает скорость разгорания флуорофора даже на низких концентрациях ДНК в реакции. Добавление неспецифичных к целевой последовательности 5'-хвостов к праймерам привело к уве-1 019861 личению чувствительности, так как пороговые циклы тест-системы снизились на 2-4 единицы. Увеличение количества экзонов, по которым проводится определение гена резус-фактора, повышает надежность анализа и снижает вероятность ложноотрицательного результата. В одной из форм выполнения упомянутые модифицированные нуклеотиды представляют собой рибонуклеотиды, у которых 2' атом кислорода и 4' атом углерода рибозы соединены между собой. В еще одной из форм выполнения праймеры для экзона 6 могут иметь следующую последовательность: где подчеркиванием выделены упомянутые нуклеотиды, не комплементарные последовательности упомянутого экзона, а зонд имеет последовательность где подчеркиванием выделены модифицированные нуклеотиды,F1 - флуоресцентная группа,Q - группа гасителя флуоресценции. В другой форме выполнения, упомянутая пара праймеров для упомянутого экзона 7 включает олигонуклеотиды, имеющие следующую последовательность: где подчеркиванием выделены упомянутые нуклеотиды, не комплементарные последовательности упомянутого экзона, а зонд имеет последовательность где подчеркиванием выделены модифицированные нуклеотиды,F1 - флуоресцентная группа,Q - группа гасителя флуоресценции. В одной из форм выполнения, упомянутая пара праймеров для упомянутого экзона 10 включает олигонуклеотиды, имеющие следующую последовательность: где подчеркиванием выделены упомянутые нуклеотиды, не комплементарные последовательности упомянутого экзона, а зонд имеет последовательность где подчеркиванием выделены модифицированные нуклеотиды,F1 - флуоресцентная группа,Q - группа гасителя флуоресценции. В еще одной форме выполнения упомянутые праймеры для положительного контроля представляют собой пару олигонуклеотидов, специфичных к последовательности гена глицеральдегид-3-фосфат дегидрогеназы человека (GAPDH): где подчеркиванием выделены упомянутые нуклеотиды, не комплементарные последовательности упомянутого экзона, при этом зонд для положительного контроля имеет последовательность где подчеркиванием выделены модифицированные нуклеотиды,F1 - флуоресцентная группа,Q - группа гасителя флуоресценции. В одной из форм выполнения длина упомянутых олигонуклеотидных праймеров составляет от 29 до 33 нуклеотидов, длина упомянутых олигонуклеотидных зондов составляет от 15 до 19 нуклеотидов,каждый зонд содержит от 3 до 4 модифицированных нуклеотидов. В еще одной форме выполнения упомянутая флуорофорная группа представляет собой FAM, а упомянутая группа гасителя флуоресценции представляет собой BHQ1. В еще одной форме выполнения упомянутые флуорофорные группы и группы гасителей флуоресценции выбраны из следующих пар FAM - BHQ1 (6-карбоксифлуоресцеин), HEX - BHQ2 (гексахлорофлуоресцеин), JOE - BHQ2 (6-карбокси-4',5'-дихлор-2',7'-диметоксифлуоресцеин), R6G - BHQ2 (6 карбоксиродамин), VIC - BHQ2, ROX - BHQ2 (карбокси-Х-родамин), Су 5 - BHQ3. В другой форме выполнения набор дополнительно включает раствор, содержащий 67 мМ трис-HCl с рН 8,8, 16,6 мМ (NH4)2SO4, 6,7 мМ MgCl2 и 170 мкг БСА, смесь четырех основных dNTP в концентрации 0,2 мМ каждого, а также раствор термостабильной ДНК-полимеразы 10 единиц/мкл. Вышеуказанная задача также решена благодаря тому, что в способе определения резус-фактора эмбриона или плода по фетальной ДНК из крови резус-отрицательной беременной женщины используют вышеописанный набор праймеров-зондов и праймеров,выделяют ДНК из крови резус-отрицательной беременной женщины,проводят начальное плавление по меньшей мере 90 с при температуре 94-96 С,проводят полимеразную цепную реакцию с набором вышеуказанных праймеров-зондов и праймеров, включая по меньшей мере тридцать циклов отжига, синтеза и плавления, причем плавление осуществляют 10-30 с при температуре 94-96 С,отжиг и синтез проводят 30-60 с при температуре 62-66 С, а детекцию осуществляют во время отжига посредством флуоресцентной спектрометрии. В одном из вариантов осуществления начальное плавление проводят в течение по меньшей мере 100 с. В еще одном варианте осуществления начальное плавление проводят при температуре 95 С. В другом варианте осуществления проводят по меньшей мере тридцать пять упомянутых циклов отжига, синтеза и плавления. В одном из вариантов осуществления проводят по меньшей мере сорок циклов плавления. Краткое описание фигур На фиг. 1 показана диаграмма флуоресценции при использовании стандартного теста; на фиг. 2 диаграмма флуоресценции при использовании теста по изобретению; на фиг. 3 - последовательности гена RHCE, гомологичные последовательностям гена RHD, и последовательности комплементарных генуRHD участков праймеров RHD-10-F, RHD-10-R, RHD-7-F, RHD-7-R, RHD-6-F, RHD-6-R, где подчеркиванием выделены отличающиеся нуклеотиды; на фиг. 4 - последовательности экзонов 6, 7 и 10 и прилегающих интронных областей гена RHD, приведенные по референсной последовательности NG007494.1(база данных NCBI), где подчеркиванием выделены соответствующие экзоны. Осуществление изобретения Пример 1 (сравнительный). Используют диагностический набор для определения ДНК гена резус-фактора, включающий компоненты 67 мМ трис-HCl, рН 8,8 при 25 С; 16,6 мМ (NH4)2SO4; 6,7 мМ MgClg; 170 мкг БСА, смесь четырех основных dNTP в концентрации 0,2 мМ каждого и термостабильную ДНК-полимеразу 10 ед./мкл,при этом все компоненты для проведения полимеразной цепной реакции (за исключением ДНКполимеразы) смешаны в одном объеме, а в набор дополнительно включены ДНК для проведения положительного контроля полимеразной цепной реакции, вода ампулированная и следующие олигопраймеры: Способ определения ДНК гена резус-фактора включает выделение ДНК из плазмы крови, проведение полимеразной цепной реакции, проведение детекции продуктов полимеразной цепной реакции с помощью флуоресцентной спектрометрии. Способ определения ДНК гена резус-фактора осуществляют следующим образом. Выделяют ДНК; проводят полимеразную цепную реакцию для определения наличия ДНК гена в геноме, состоящую из начального плавления и ряда циклов из плавления, отжига и синтеза; проводят детекцию продуктов полимеразной цепной реакции с помощью флуоресцентной спектрометрии. Полимеразную цепную реакцию с использованием праймеров-зондов и праймеров проводят при следующих условиях: начальное плавление проводят в течение 2 мин при температуре 95 С, далее проводят цикл от 50 до 60 раз, включающий плавление при 94 С в течение 10 с, отжиг и синтез при температуре от 60 С в течение 1 мин, во время отжига проводят детекцию с помощью флуоресцентной спектрометрии. Как показано на фиг. 1, кривые флуоресценции поднимаются поздно, а рост флуоресценции при низких концентрациях фетальной ДНК не позволяет однозначно трактовать полученный результат, что приводит к ошибкам анализа. Ряд приборов не детектирует столь малое относительное приращение флуоресценции и выдает ложноотрицательный результат. Пример 2. Используют диагностический набор для определения ДНК гена резус-фактора, включающий компоненты 67 мМ трис-HCl, рН 8,8 при 25 С; 16,6 мМ (NH4)2SO; 6,7 мМ MgClg; 170 мкг БСА, смесь четырех основных dNTP в концентрации 0,2 мМ каждого и термостабильную ДНК-полимеразу 10 ед./мкл,-3 019861 при этом все компоненты для проведения полимеразной цепной реакции (за исключением ДНКполимеразы) смешаны в одном объеме, а в набор дополнительно включены ДНК для проведения положительного контроля полимеразной цепной реакции, вода ампулированная и следующие олигопраймеры: где в зондах подчеркиванием выделены модифицированные нуклеотиды LNA. Способ определения ДНК гена резус-фактора включает выделение ДНК из плазмы крови, проведение полимеразной цепной реакции, проведение детекции продуктов полимеразной цепной реакции с помощью флуоресцентной спектрометрии. Диагностический набор содержит положительные контроли, что позволяет проконтролировать качество выделения ДНК и снизить вероятность ложноотрицательных результатов. Преимуществом данного подхода является возможность определять наличие ДНК гена резусфактора в концентрациях менее 100 копий ДНК на 1 мл плазмы. Способ определения ДНК гена резус-фактора осуществляют следующим образом. Выделяют ДНК; проводят полимеразную цепную реакцию для определения наличия ДНК гена в геноме, состоящую из начального плавления и ряда циклов из плавления, отжига и синтеза; проводят детекцию продуктов полимеразной цепной реакции с помощью флуоресцентной спектрометрии. Полимеразную цепную реакцию с использованием праймеров-зондов и праймеров проводят при следующих условиях: начальное плавление проводят в течение 2 мин при температуре 95 С, далее проводят цикл от 50 до 60 раз, включающий плавление при 94-96 С в течение от 10 до 30 с, отжиг и синтез при температуре от 62 до 66 С в течение от 30 с до 1 мин, во время отжига проводят детекцию с помощью флуоресцентной спектрометрии. Техническим результатом является создание способа определения наличия ДНК гена резусфактора, позволяющего выявлять ДНК в плазме человека в минимальных концентрациях, и диагностического набора для его осуществления, позволяющего определять резус-фактора плода по крови резусотрицательной беременной женщины. Как показано на фиг. 2 кривые флуоресценции поднимаются раньше (ср. фиг. 1), а рост флуоресценции более интенсивный даже при низких концентрациях фетальной ДНК. В состав набора введены праймеры и зонды с упомянутыми модификациями для дополнительного экзона, что снижает вероятность ложноотрицательных результатов и повышает качество исследования. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Набор олигонуклеотидных праймеров и зондов для определения резус-фактора эмбриона или плода по фетальной ДНК из крови резус-отрицательной беременной женщины, включающий по меньшей мере три пары частично комплементарных олигонуклеотидных праймеров длиной по меньшей мере 25 нуклеотидов, обладающих специфичностью к противоположным концам последовательностей ДНК экзонов 6, 7 и 10 гена резус-фактора человека (RHD) и/или прилегающих интронных областей, по меньшей мере по одной паре упомянутых праймеров на каждый экзон или прилегающую к нему интронную область, каждая из которых (последовательность) включает от 65 до 130 нуклеотидов, и праймеры-зонды, обладающие специфичностью к упомянутым экзонам, имеющие длину, от 15 до 19 нуклеотидов, причем в каждом из упомянутых праймеров-зондов по меньшей мере 3 нуклеотида представляют собой модифицированные нуклеотиды, увеличивающие температуру плавления ДНК,в котором по меньшей мере 9 нуклеотидов на 5' конце каждого праймера не комплементарны последовательности упомянутых экзонов, а 3' конец одного из праймеров каждой пары отличается от гомологичной последовательности гена RHCE по меньшей мере на 4 нуклеотида, причем в 3' области, что гарантирует отсутствие неспецифичной амплификации,-4 019861 каждый из упомянутых частично комплементарных праймеров является частично комплементарным по отношению к последовательности ДНК экзонов 6, 7 или 10 гена резус-фактора человека или прилегающей интронной области. 2. Набор по п.1, в котором упомянутые модифицированные нуклеотиды представляют собой рибонуклеотиды, у которых 2' атом кислорода и 4' атом углерода рибозы соединены между собой. 3. Набор по любому из пп.1 или 2, в котором упомянутая пара праймеров для упомянутого экзона 6 включает олигонуклеотиды, имеющие следующую последовательность: где подчеркиванием выделены упомянутые нуклеотиды, не комплементарные последовательности упомянутого экзона, а зонд имеет последовательность где подчеркиванием выделены модифицированные нуклеотиды,F1 - флуоресцентная группа,Q - группа гасителя флуоресценции. 4. Набор по любому из пп.1-3, в котором упомянутая пара праймеров для упомянутого экзона 7 включает олигонуклеотиды, имеющие следующую последовательность: где подчеркиванием выделены упомянутые нуклеотиды, не комплементарные последовательности упомянутого экзона, а зонд имеет последовательность где подчеркиванием выделены модифицированные нуклеотиды,F1 - флуоресцентная группа,Q - группа гасителя флуоресценции. 5. Набор по любому из пп.1-4, в котором упомянутая пара праймеров для упомянутого экзона 10 включает олигонуклеотиды, имеющие следующую последовательность: где подчеркиванием выделены упомянутые нуклеотиды, не комплементарные последовательности упомянутого зкзона, а зонд имеет последовательность где подчеркиванием выделены модифицированные нуклеотиды,F1 - флуоресцентная группа,Q - группа гасителя флуоресценции. 6. Набор по любому из пп.1-5, дополнительно включающий праймеры для положительного контроля. 7. Набор по п.6, в котором упомянутые праймеры для положительного контроля представляют собой пару олигонуклеотидов, специфичных к последовательности гена глицеральдегид-3-фосфат дегидрогеназы человека (GAPDH) где подчеркиванием выделены упомянутые нуклеотиды, не комплементарные последовательности упомянутого гена, при этом зонд для положительного контроля имеет последовательность где подчеркиванием выделены модифицированные нуклеотиды,F1 - флуоресцентная группа,Q - группа гасителя флуоресценции. 8. Набор по любому из пп.1-7, в котором длина упомянутых олигонуклеотидных праймеров составляет от 29 до 33 нуклеотидов, длина упомянутых олигонуклеотидных зондов составляет от 15 до 19 нуклеотидов, каждый зонд содержит от 3 до 4 модифицированных нуклеотидов. 9. Набор по любому из пп.1-8, в котором упомянутая флуорофорная группа представляет собойFAM, а упомянутая группа гасителя флуоресценции представляет собой BHQ1. 10. Набор по п.9, в котором упомянутые флуорофорные группы и группы гасителей флуоресценции выбраны из следующих пар: FAM - BHQ1 (6-карбоксифлуоресцеин), HEX - BHQ2 (гексахлорофлуоресцеин), JOE - BHQ2 (6-карбокси-4',5'-дихлор-2',7'-диметоксифлуоресцеин), R6G - BHQ2 (6 карбоксиродамин), VIC - BHQ2, ROX - BHQ2 (карбокси-Х-родамин), Су 5 - BHQ3. 11. Набор по любому из пп.1-3, дополнительно включающий раствор, содержащий 67 мМ трис-HCl с рН 8,8, 16,6 мМ (NH4)2SO4, 6,7 мМ MgCl2 и 170 мкг БСА, смесь четырех основных dNTP в концентрации 0,2 мМ каждого, а также раствор термостабильной ДНК-полимеразы 10 единиц/мкл. 12. Способ определения резус-фактора эмбриона или плода по фетальной ДНК из крови резус-5 019861 отрицательной беременной женщины, в котором выделяют ДНК из крови резус-отрицательной беременной женщины,проводят начальное плавление по меньшей мере 90 с при температуре 94-96 С,проводят полимеразную цепную реакцию с набором вышеуказанных праймеров-зондов и праймеров по любому из пп.1-11, включая по меньшей мере тридцать циклов отжига, синтеза и плавления,причем плавление осуществляют 10-30 с при температуре 94-96 С,отжиг и синтез проводят 30-60 с при температуре 62-66 С, а детекцию осущетсвляют во время отжига посредством флуоресцентной спектрометрии. 13. Способ по п.12, в котором начальное плавление проводят в течение по меньшей мере 100 с. 14. Способ по любому из пп.12 или 13, в котором начальное плавление проводят при температуре 95 С. 15. Способ по любому из пп.12-14, в котором проводят по меньшей мере тридцать пять упомянутых циклов отжига, синтеза и плавления. 16. Способ по любому из пп.12-15, в котором проводят по меньшей мере сорок циклов плавления.
МПК / Метки
МПК: C12Q 1/68, G01N 33/50
Метки: днк, плода, резус-фактора, набор, праймеров, эмбриона, определения, олигонуклеотидных, зондов, беременной, крови, способ, резус-отрицательной, фетальной, женщины
Код ссылки
<a href="https://eas.patents.su/8-19861-nabor-oligonukleotidnyh-prajjmerov-i-zondov-i-sposob-dlya-opredeleniya-rezus-faktora-embriona-ili-ploda-po-fetalnojj-dnk-iz-krovi-rezus-otricatelnojj-beremennojj-zhenshhiny.html" rel="bookmark" title="База патентов Евразийского Союза">Набор олигонуклеотидных праймеров и зондов и способ для определения резус-фактора эмбриона или плода по фетальной днк из крови резус-отрицательной беременной женщины</a>
Предыдущий патент: Новый способ получения дронедарона
Следующий патент: Способ получения пропилена и катализатор получения пропилена
Случайный патент: Устройство для непрерывного гравиметрического дозирования и пневмотранспортирования сыпучего материала












