Способ получения сертиндола
Формула / Реферат
1. Способ получения N-(4-фторфенил)-N-(2-карбокси-4-хлорфенил)глицина, включающий катализируемое медью арилирование 2,5-дихлорбензойной кислоты при помощи N-(4-фторфенил)глицина, в котором используют соли щелочных металлов 2,5-дихлорбензойной кислоты и N-(4-фторфенил)глицина в водно-щелочной среде в присутствии медного катализатора в соответствии с реакционной схемой
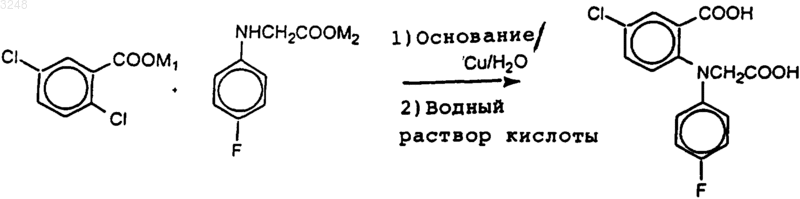
где M1 и M2 являются ионами щелочных металлов.
2. Способ по п.1, отличающийся тем, что реакцию осуществляют при температуре выше комнатной, предпочтительно при температуре между 80шC и температурой кипения с обратным холодильником среды, в частности около температуры кипения с обратным холодильником.
3. Способ по п.1 или 2, отличающийся тем, что реакционная среда является водой или водой, к которой добавлен сорастворитель, причем сорастворитель предпочтительно является протонным сорастворителем, таким как этиленгликоль.
4. Способ по п.3, отличающийся тем, что в качестве растворителя используют воду.
5. Способ по п.3 или 4, отличающийся тем, что количество воды меньше чем 10 мл/г 2,5-дихлорбензойной кислоты, предпочтительно меньше чем 5 мл/г.
6. Способ по п.5, отличающийся тем, что количество воды меньше чем 3,5 мл/г, предпочтительно меньше чем 2,5 мл/г 2,5-дихлорбензойной кислоты.
7. Способ по любому из пп.1-6, отличающийся тем, что соли щелочных металлов являются солями лития, натрия или калия.
8. Способ по п.1, отличающийся тем, что используют те же самые соли реагентов, предпочтительно соли калия.
9. Способ по любому из пп.1-8, отличающийся тем, что основание является карбонатом щелочного металла, предпочтительно Li2CO3, Na2CO3 или K2CO3.
10. Способ по любому из пп.1-9, отличающийся тем, что щелочной металл карбоната щелочного металла является тем же, что и щелочной металл реагентов.
11. Способ по любому из пп.1-8, отличающийся тем, что основание является карбонатом калия.
12. Способ по любому из пп.1-11, отличающийся тем, что количество основания больше чем стехиометрическое количество 2,5-дихлорбензойной кислоты.
13. Способ по любому из пп.1-12, отличающийся тем, что катализатором является медь-бронза.
14. Способ по любому из пп.1-13, отличающийся тем, что соотношение количеств соли щелочного металла N-(4-фторфенил)глицина и соли щелочного металла 2,5-дихлорбензойной кислоты составляет от 0,5 до 3,0, предпочтительно от 1,0 до 2,5, в частности от 2,0 до 2,3 мол/мол.
15. Способ получения 5-хлор-1-(4-фторфенил)-3-(1,2,3,6-тетрагидропиридин-4-ил)индола, включающий реакцию 5-хлор-1-(4-фторфенил)индола с 4-пиперидоном в смеси минеральной кислоты и уксусной кислоты.
16. Способ по п.15, отличающийся тем, что 4-пиперидон используют в форме гидрохлорида 4-пиперидонгидрата.
17. Способ по п.15 или 16, отличающийся тем, что используемой минеральной кислотой является фосфорная кислота, азотная кислота, серная кислота или хлороводородная кислота.
18. Способ по п.17, отличающийся тем, что используемой минеральной кислотой является хлороводородная кислота.
19. Способ по п. 15 или 16, отличающийся тем, что используют, по меньшей мере, 1,5 эквивалента 4-пиперидона на эквивалент 5-хлор-1-(4-фторфенил)индола.
20. Способ по п.19, отличающийся тем, что используют, по меньшей мере, 1,75 эквивалента 4-пиперидона на эквивалент 5-хлор-1-(4-фторфенил)индола.
21. Способ по п.20, отличающийся тем, что используют, по меньшей мере, 2,0 эквивалента 4-пиперидона на эквивалент 5-хлор-1-(4-фторфенил)индола.
22. Способ по п.18, отличающийся тем, что хлороводородную кислоту используют в количестве, по меньшей мере, 2,5 мл концентрированной HCl на грамм 5-хлор-1-(4-фторфенил)индола.
23. Способ по п.15, отличающийся тем, что используют, по меньшей мере, 8 мл уксусной кислоты на грамм 5-хлор-1-(4-фторфенил)индола.
24. Способ по п.23, отличающийся тем, что используют, по меньшей мере, 10 мл уксусной кислоты на грамм 5-хлор-1-(4-фторфенил)индола.
25. Способ по п.24, отличающийся тем, что используют 10-14 мл уксусной кислоты на грамм 5-хлор-1-(4-фторфенил)индола.
26. Способ по п.22, отличающийся тем, что указанное соотношение составляет 3,5-5 мл концентрированной HCl на грамм 5-хлор-1-(4-фторфенил)индола.
27. Способ по п.18, отличающийся тем, что соотношение между уксусной кислотой и концентрированной HCl составляет от 2:1 до 4:1 (об./об.).
28. Способ производства сертиндола, включающий
a) получение по любому из пп.1-14 N-(4-фторфенил)-N-(2-карбокси-4-хлорфенил)глицина путем взаимодействия соли щелочного металла 2,5-дихлорбензойной кислоты с солью щелочного металла N-(4-фторфенил)глицина в водно-щелочной среде в присутствии медного катализатора;
b) циклизацию N-(4-фторфенил)-N-(2-карбокси-4-хлорфенил)глицина до соответствующего 3-ацетоксииндола с использованием уксусного ангидрида/ацетата щелочного металла, предпочтительно ацетата натрия;
c) восстановление 3-ацетоксииндола и затем
d) удаление H2O с получением таким путем 5-хлор-1-(4-фторфенил)индола;
e) взаимодействие 5-хлор-1-(4-фторфенил)индола с 4-пиперидоном по любому из пп.15-27 в смеси уксусной кислоты и концентрированной HCl;
f) восстановление полученного 5-хлор-1-(4-фторфенил)-3-(1,2,3,6-тетрагидропиридин-4-ил)индола с целью получения 5-хлор-1-(4-фторфенил)-3-(пиперидин-4-ил)индола;
g) взаимодействие продукта стадии f) с 1-(2-хлорэтил)-2-имидазолидиноном; или
h) взаимодействие 5-хлор-1-(4-фторфенил)-3-(1,2,3,6-тетрагидропиридин-4-ил)индола с 1-(2-хлорэтил)-2-имидазолидиноном с последующим восстановлением продукта, с получением таким способом сертиндола.
Текст
1 Изобретение относится к новому способу получения соединения 1-[2-[4-[5-хлор-1-(4-фторфенил)-1-Н-индол-3-ил]-1-пиперидинил]этил]-2 имидазолидинона, которое имеет рекомендованноеINN наименование "сертиндол", и новому способу получения промежуточных соединений N-(4-фторфенил)-N-(2-карбокси-4-хлорфенил)глицина и 5 хлор-1-(4-фторфенил)-3-(1,2,3,6-тетрагидропиридин-4-ил)индола, используемых в данном способе. Сертиндол является хорошо известным антипсихотическим лекарственным средством,имеющим формулу Соединение раскрыто в патенте США 4710500, а его антипсихотическое действие описано в патенте США 5112838. Сертиндол является сильнодействующим антагонистом 5 НТ 2 рецептора, оказывающим действие на центральную нервную систему in vivo, и, кроме того, была раскрыта его активность на моделях,показывающая действие этого лекарственного средства при лечении беспокойства, гипертензии, злоупотребления лекарственными средствами и расстройства познавательной способности. Недавно сообщалось о том, что этот препарат показал антипсихотическое действие в клинических исследованиях, Psychopharmacology(1996) 124:168-175. Патент США 4710500 охватывает класс 1-арил-3-(пиперазинил-, тетрагидропиридил или пиперидил)индоловых соединений, включающих сертиндол. Были раскрыты некоторые общие способы получения этих соединений, некоторые из которых можно использовать для получения сертиндола. Эти способы включают а) взаимодействие подходящим образом замещенного 1-арилиндола с подходящим 1 замещенным 4-пиперидоном, и последующее восстановление полученного тетрагидропиридилового соединения;b) арилирование соответствующего соединения 1-замещенного индола;c) восстановление соответствующего соединения, имеющего оксогруппу в положении 2 индольного кольца. Сертиндол был подтвержден конкретными примерами, однако, не были приведены примеры экспериментального получения этого соединения.Perregaard et al., J. Med. Chem., 1992, 35, 10921101 раскрыли новый способ получения сертиндола. Этот способ включает взаимодействие промежуточного соединения 5-хлор-1-(4-фторфенил) индола с 4-пиперидоном в смеси трифторуксусной кислоты и уксусной кислоты, восстановление полученного 5-хлор-1-(4-фторфенил)-3-(1,2,3,6-тетрагидропиридин-3-ил)индола для получения 5-хлор 1-(4-фторфенил)-3-(пиперидин-4-ил)индола, кото 003248K2 СО 3 и KI в метилизобутилкетоне (MIBK). 5 Хлор-1-(4-фторфенил)индол получали из соответствующего 3-ацетоксииндола путем восстановления с использованием NaBH4 в метаноле и последующим удалением Н 2 О в кислотных условиях. 3 ацетокси-индол получали из N-(4-фторфенил)-N-(2 карбокси-4-хлорфенил)глицина, следуя процедурам, которые описаны в литературе. Процедура получения N-(4-фторфенил)-N(2-карбокси-4-хлорфенил)глицина описана вPerregaard et al., Dansk Kemi, 95, 3, р. 6. По этому способу глицин получают реакцией 2,5 дихлорбензойной кислоты и N-(4-фторфенил) глицина с использованием медного катализатора. Соли калия этих двух кислот используют в присутствии K2 СО 3 в растворителе N-метилпирролидоне (NMP). Однако было обнаружено, что вышеперечисленные способы нельзя использовать в промышленном производстве. Общий выход продукта в этих способах слишком низкий и в них также используют реагенты или растворители,не являющиеся подходящими, а в некоторых случаях, запрещенные по экологическим причинам и причинам безопасности. Кроме того, из-за того, что NMP является водорастворимым, реакция проходит вяло, а восстановление NMP является длительным и дорогостоящим. Таким образом настоящее изобретение относится к новому способу, который можно использовать для промышленного получения сертиндола. Было обнаружено, что основными ограничивающими стадиями способа являются получение N-(4-фторфенил)-N-(2-карбокси-4-хлорфенил)глицина и реакция 5-хлор-1-(4-фторфенил)индола с 4-пиперидоном. Настоящее изобретение относится к способу получения N-(4-фторфенил)-N-(2-карбокси-4-хлорфенил)глицина, включающий взаимодействие соли щелочного металла 2,5 дихлорбензойной кислоты с солью щелочного металла N-(4-фторфенил)глицина в воднощелочной среде в присутствии медного катализатора, с последующей обработкой водным раствором кислоты, как показано на приведенной ниже реакционной схеме где M1 и М 2 являются ионами щелочных металлов. Как указано в Perregaard et al., Dansk Kemi,95, реакцию с использованием солей калия указанных реагентов осуществляют в NMP. Однако при использовании NMP необходима занимающая много времени экстракционная обработка,и в результате реакции образуется значительное 3 количество смолистых побочных продуктов. Температура реакции 120-130 С. При замене среды NMP водной средой при осуществлении реакции получают более высокий выход и незначительное количество смолистых побочных продуктов. Кроме того, процедура осуществления способа проста и использование водной среды дает значительные преимущества с точки зрения защиты окружающей среды. И, наконец, температуру реакции снижают до температуры обратного холодильника водной среды или ниже. Объектом изобретения является также способ получения 5-хлор-1-(4-фторфенил)-3(1,2,3,6-тетрагидропиридин-4-ил)индола, включающий взаимодействие 5-хлор-1-(4-фторфенил)индола с 4-пиперидоном в смеси минеральной кислоты и уксусной кислоты, как показано на нижеследующей схеме реакции Использование смеси уксусной кислоты и минеральной кислоты вместо смеси трифторуксусная кислота-уксусная кислота обеспечивает значительные преимущества с точки зрения защиты окружающей среды. Кроме того, трифторуксусная кислота является сильно летучим и агрессивным соединением и, следовательно, нежелательным для использования в промышленном производстве. При этом также не образуются нежелательные бисзамещенные пиперидины: Объектом изобретения является и способ получения сертиндола, включающий получениеN-(4-фторфенил)-N-(2-карбокси-4-хлорфенил) глицина путем взаимодействия, включающего катализируемую медью реакцию соли щелочного металла 2,5-дихлорбензойной кислоты с солью щелочного металла N-(4-фторфенил)глицина в водно-щелочной среде в присутствии медного катализатора и/или в котором 5-хлор-1-(4 фторфенил)-3-(1,2,3,6-тетрагидропиридин-4-ил) индол получают путем взаимодействия, включающего реакцию 5-хлор-1-(4-фторфенил)индола с 4-пиперидоном в смеси минеральной кислоты и уксусной кислоты. Реакцию соли щелочного металла 2,5 дихлорбензойной кислоты с солью щелочного металла N-(4-фторфенил)глицина осуществляют в условиях повышенной температуры, обычно в интервале от 80 С до температуры кипения с обратным холодильником используемой среды, 003248 4 предпочтительно при температуре обратного холодильника. В данном описании и в формуле изобретения термин "водная среда" включает воду и воду, в которую добавлен сорастворитель, такой как этиленгликоль, для использования в качестве реакционной среды. Предпочтительно используют деминерализованную, деионизированную или дистиллированную воду. Предпочтительно используемые в качестве реагентов соли щелочных металлов представляют собой соли лития, натрия или калия, и обычно используют те же соли участвующих в реакции веществ. Наиболее предпочтительно используют соли калия. Важно, чтобы образующаяся в ходе реакции НСl была нейтрализована в целях избежания нежелательных побочных реакций. Реакционную среду подщелачивают путем добавления основания, такого как гидроксид щелочного металла, ацетат щеточного металла, карбонат щелочного металла, гидрокарбонат щелочного металла, фосфат щелочного металла или цитрат щелочного металла. Предпочтительно используют карбонат щелочного металла, такой какLi2CO3, Nа 2 СО 3 или К 2 СО 3. Удобно, когда такой же щелочной металл входит в состав участвующих в реакции веществ. Предпочтительным основанием является карбонат калия. Количество основания предпочтительно больше, чем стехиометрическое количество 2,5-дихлорбензойной кислоты. С другой стороны, [ОН-] может вызвать гидролиз 2,5-дихлорбензойной кислоты, при этом снижается выход продукта. Таким образом, основание удобно добавлять постепенно в ходе реакции. Катализатор может быть любым Сu(О)катализатором, предпочтительно это меднобронзовый катализатор. Его добавляют в каталитических количествах. Конкретное количество не имеет критического значения и легко определяется специалистом в данной области. Соотношение между количествами соли щелочного металла N-(4-фторфенил)глицина и соли щелочного металла 2,5-дихлорбензойной кислоты обычно составляет от 0,5 до 3,0, предпочтительно 1,0-2,5, и наиболее предпочтительно 2,0-2,3 мол/мол. Избыток N-(4-фторфенил) глицина регенерируют. Обычно реакцию осуществляют в минимально возможном, насколько это технически достижимо, количестве водного растворителя. Так, улучшенный выход получают путем снижения количества растворителя. Количество воды предпочтительно составляет меньше чем 10 мл/г 2,5-дихлорбензойной кислоты, более предпочтительно меньше чем 5 мл/г, в частности меньше чем 3,5 мл/г, и наиболее предпочтительно меньше чем 2,5 мл/г. Время реакции не является критическим и его легко определит специалист в данной области техники. 5 Обработку продукта разбавленным водным раствором кислоты осуществляют просто добавлением отфильтрованной реакционной смеси к разбавленной кислоте, при этом продукт осаждается. Затем продукт подвергают дальнейшей очистке горячим толуолом или путем перекристаллизации из водного раствора этанола. Разбавленной в воде кислотой предпочтительно является хлороводородная кислота. Минеральной кислотой, используемой в реакции 5-хлор-1-(4-фторфенил)индола с 4 пиперидоном, предпочтительно является фосфорная кислота, азотная кислота, серная кислота или хлороводородная кислота, например 30% вес/вес водный раствор хлороводородной кислоты, в частности концентрированной хлороводородной кислоты. Под концентрированной хлороводородной кислотой имеют ввиду 37% вес/вес раствор НСl. 4-пиперидон предпочтительно используют в виде гидрохлорида 4-пиперидонгидрата. Реакцию предпочтительно проводят в избыточном количестве гидрохлорида 4-пиперидонгидрата. Предпочтительно используют больше чем 1,5 эквивалента 4-пиперидона на эквивалент 5-хлор-1-(4-фторфенил)индола, более предпочтительно используют более 1,75 эквивалента. Обычно используют 2,0 эквивалента. Для получения значительного выхода продукта важным условием является присутствие достаточного количества кислоты. Когда в качестве минеральной кислоты используют хлороводородную кислоту, предпочтительное количество составляет 2,5 мл концентрированной НСl на грамм 5-хлор-1-(4-фторфенил)индола. Более предпочтительным является количество 3,5-5 мл концентрированной НСl на грамм 5-хлор-1-(4 фторфенил)индола. Необходимо, чтобы количество уксусной кислоты было достаточным, чтобы реакция была технически осуществима. Обычно используют, по меньшей мере, 8 мл уксусной кислоты на грамм 5-хлор-1-(4-фторфенил)индола. Предпочтительно количество уксусной кислоты больше чем 10 мл уксусной кислоты на грамм 5-хлор-1(4-фторфенил)индола, более предпочтительно 10-14 мл. Соотношение уксусной кислоты и концентрированной НСl предпочтительно составляет от 2:1 до 4:1 об./об. Реакцию обычно осуществляют путем добавления по каплям раствора 5-хлор-1-(4-фторфенил)индола в горячей уксусной кислоте к гидрохлориду пиперидонгидрата или путем смешивания этих двух реагентов в смеси уксусной кислоты и минеральной кислоты с последующим нагреванием с обратным холодильником. Время реакции легко определяется специалистом в данной области техники. Промежуточный продукт можно легко обрабатывать обычным способом. Дальнейший процесс, приводящий к образованию сертиндо 003248 6 ла, включает циклизацию N-(4-фторфенил)-N(2-карбокси-4-хлорфенил)глицина до соответствующего 3-ацетоксииндола с использованием,например, уксусного ангидрида в присутствии ацетата щелочного металла, такого как ацетат натрия. 5-Хлор-1-(4-фтор)индол затем получают из 3-ацетоксииндола путем восстановления и затем удаления Н 2 О. Полученный 5-хлор-1-(4 фторфенил)индол подвергают взаимодействию с 4-пиперидоном в соответствии с указанной выше процедурой, полученный 5-хлор-1-(4 фторфенил)-3-(1,2,3,6-тетрагидропиридин-4-ил) индол восстанавливают для получения 5-хлор-1(4-фторфенил)-3-(пиперидин-4-ил)индола, который, в свою очередь, взаимодействует с 1-(2 хлорэтил)-2-имидазолидиноном с получением сертиндола. Альтернативно 5-хлор-1-(4-фторфенил)-3-(1,2,3,6-тетрагидропиридин-4-ил)индол сначала подвергают взаимодействию с 1-(2 хлорэтил)-2-имидазолидиноном с последующим восстановлением, получая при этом сертиндол,который можно выделить в виде кислотноаддитивной соли, например тартрата, или в виде свободного основания. Используемые в качестве исходных материалов соль щелочного металла 2,5-дихлорбензойной кислоты и соль щелочного металла N-(4 фторфенил)глицина можно легко получить из коммерчески доступных 2,5-дихлорбензойной кислоты и N-(4-фторфенил)глицина соответственно, с использованием стандартных процедур. Полученный таким способом сертиндол удобно формулируют в композицию, как описано в патенте США 51128387. Экспериментальная часть Пример 1. Получение N-(4-фторфенил)-N-(2-карбоксифенил)глицина. Суспензию, состоящую из 2,5-дихлорбензоата калия (100 г, 0,44 мол, 1 экв.), N-(4 фторфенил)глицината калия (190 г, 0,92 мол, 2,1 экв.), карбоната калия (36,2 г, 0,26 мол, 0,6 экв. СO3), медно-бронзового катализатора (2,8 г,0,04 мол Сu, 0,1 экв.) и 250 мл деминерализованной воды нагревали до температуры кипения с обратным холодильником в атмосфере азота в течение 20,5 ч и затем охлаждали до 50 С. К реакционной смеси добавляли 2,5 мл воды и 5 г активированного угля, при этом реакционная смесь, за исключением Сu-бронзы, была гомогенной. Смеси давали охладиться при перемешивании в течение 1 ч, затем смесь фильтровали. Фильтровальную лепешку промывали водой 2 х 125 мл. Фильтрат выливали на смесь льда (2 л) и 37% водного раствора НСl (3400 мл) при интенсивном перемешивании, способствуя этим кристаллизации неочищенного продукта в виде мелкокристаллического вещества желто-коричневого цвета. Суспензию перемешивали в течение 30 мин при температуре 75-80 С, охлаждали до 15-20 С и фильтровали,фильтровальную лепешку промывали 500 мл 7 воды и сушили в токе воздуха при температуре 50 С в течение ночи. Фильтрат собирали для восстановленияN-(4-фторфенил)глицината. Выход неочищенного продукта: 113 г (80,3%),т.пл. 170-86 С. Данные ВЭЖХ: 84,2% вес/вес продукта, 10,5% вес/вес 3-хлорсалициловой кислоты. 20 г указанного выше неочищенного продукта подвергали дальнейшей очистке путем суспендирования в 200 мл толуола и кипячения с обратным холодильником в течение 30 мин. Суспензии давали охладиться до комнатной температуры при перемешивании и затем фильтровальную лепешку промывали толуолом (20 мл) и сушили в вакууме в течение ночи при температуре 50 С. Выход: 17,0 г,т.пл. 190-92 С. Чистота продукта, определенная методом ЯМР, 98%. Пример 2. Получение N-(4-фторфенил)-N-(2-карбоксифенил)глицина. В реактор емкостью 180 л добавляли 21,0 кг 2,5-дихлорбензоата калия, затем добавляли 36,0 л воды. Эту смесь нагревали при перемешивании до практически полного растворения всех твердых веществ (темп. 60-70 С) и медленно добавляли 25,0 кг N-(4-фторфенил)глицината калия. Смесь нагревали до полного растворения всех веществ,т.е. до около 80 С и добавляли к смеси 7,67 кг К 2 СО 3, 582 г Сu-бронза и 7 л воды. Объединенную смесь кипятили с обратным холодильником в течение ночи (около 15 ч) и охлаждали до 50 С. Добавляли 1 кг активированного угля, суспендированного в 5 л воды, затем добавляли 40 л воды. Смесь перемешивали при охлаждении в течение 1 ч и фильтровали на желобе, покрытым вспомогательным фильтрующим материалом. Фильтровальную лепешку промывали 1% л воды и сырой фильтрат медленно в течение 2 ч выливали на смесь 22,5 л 37% НСl и 30 л воды при небольшом нагревании (45-50 С) и перемешивании. Смесь нагревали до 72 С, охлаждали до 25 С и фильтровали. Фильтровальную лепешку промывали водой(2 х 10 л) и сушили на поддонах в течение ночи при 60 С. Выход неочищенного кристаллического продукта бледно-желтого цвета составил 26,7 кг. Неочищенный продукт (26,7 кг) переносили в реактор емкостью 200 л и добавляли 150 л толуола и смесь нагревали до температуры кипения с обратным холодильником (90 С) под слоем азота. Затем смесь подвергали перегонке до достижения температуры 110 С (5 л дистиллята). Добавляли 5 л толуола и смесь кипятили с обратным холодильником при 110 С в течение 2 ч, охлаждали до около 60 С и оставляли на ночь при 27 С. Смесь фильтровали и фильтровальную лепешку промывали толуолом (3 х 15 л) и сушили, при этом получали 21,0 кг чистого указанного в заголовке продукта. Пример 3. 1-(4-фторфенил)-3-ацетокси-5-хлориндол. В трехгорлую колбу емкостью 4 л, снабженную механическим смесительным устройст 003248(717,1 г, 2,22 мол), ацетат натрия (36,4 г, 0,44 мол, 0,2 экв.) и уксусный ангидрид. Суспензию нагревали при перемешивании до температуры кипения с обратным холодильником. Смесь кипятили с обратным холодильником в течение 1 ч и охлаждали до комнатной температуры на бане лед/вода. Гомогенную суспензию при перемешивании выливали на ледNaOH (примерно 6 л) до достижения рН 6-7. В процессе нейтрализации температуру поддерживали до примерно 30 С, что требовало добавления дополнительных 5-6 л льда. При этом получали осаждение продукта и продукт выделяли фильтрованием. Продукт тщательно промывали 3 л воды и 2 л н-гептана и сушили в вакууме в течение ночи при 60 С. Выход: 600,5 г(100,0 г, 0,33 мол) растворяли в 1000 мл EtOH. В течение следующего часа при температуре кипения с обратным холодильником порциями добавляли гранулы борогидрида натрия (18,7 г, 1,5 экв.). Реакционную смесь перемешивали в течение ночи при кипячении с обратным холодильником и охлаждали до комнатной температуры. Добавляли концентрированную НСl (примерно 50 мл до достижения рН 1) и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Добавляли 200 мл деминерализованной воды и полученную суспензию фильтровали. Фильтровальную лепешку промывали дополнительными 50 мл воды и 10 млEtOH. Продукт сушили в вакууме в течение ночи при 50 С. Выход: 68,4 г (84,7%), т.пл. 91-93 С. Пример 5. Получение 5-хлор-1-(4-фторфенил)-3-(1,2,3,6-тетрагидропиридин- 4-ил)индола. В реактор емкостью 200 л под слоем азота переносили 6,70 кг 5-хлор-1-(4-фторфенил) индола и 8,38 кг гидрохлорида 4-пиперидонмоногидрата. Добавляли уксусную кислоту (67 л) и реакционную смесь нагревали до 60 С. В течение 1/2 ч добавляли концентрированную НСl (37%, 33,5 л), и затем смесь нагревали до температуры кипения обратного холодильника (85 С) и кипятили с обратным холодильником в течение 1 ч (конечная температура 95 С). После охлаждения до 30 С добавляли 33,5 л ацетона и затем продолжали охлаждение до 25 С. После фильтрации, промывки (ацетон, 20 л) и сушки в вакууме при 60 С получали указанный в заголовке продукт в виде порошка белого цвета с выходом 8,94 кг. Пример 6. 1-[2-[4-[5-хлор-1-(4-фторфенил)-1 Н-индол-3 ил]-1,2,3,6-тетрагидро-1-пиридил]этил]-2-имидазолидинон. Смешивали 5-хлор-1-(4-фторфенил)-3-(1,2,3,6-тетрагидропиридин-4-ил)индол (6,0 кг, 16,5 9 мол), 1-(2-хлорэтил)-имидазолон (3,19 кг, 1,3 экв.), карбонат натрия (безводный) и метилизобутилкетон (60 л). Реакционную смесь нагревали до 90-95 С при перемешивании под слоем азота и перемешивали при этой температуре в течение ночи. На следующий день еще горячую реакционную смесь фильтровали. Реактор и фильтровальную лепешку промывали дополнительными 2,5 л метилизобутилкетона. Объединенные фильтраты оставляли на ночь для кристаллизации. Продукт отделяли на желобе, промывали 7,5 л н-гептана и сушили в вакууме в течение ночи при 60 С. Выход: 5,39 кг (74,3%),т.пл. 146,4 С. Пример 7. Тартрат 1-[2-[4-[5-хлор-1-(4-фторфенил)-1 Н-индол-3-ил]-1-пиперидинил]этил]-2-имидазолидинона. 1-[2-[4-[5-хлор-1-(4-фторфенил)-1H-индол 3-ил]-1,2,3,6-тетрагидро-1-пиридил]этил]-2 имидазолидинон (3,5 кг) растворяли в уксусной кислоте (98-100%, 29 л) при нагревании до 40 С. Добавляли активированный уголь и суспензию перемешивали в течение 1 ч, оставляли на ночь и фильтровали. Фильтровальную лепешку промывали 6 л уксусной кислоты. Объединенные фильтраты добавляли в реактор гидрогенизации (емкостью 50 л) под слоем азота. Добавляли 70 г PtO2, реактор закрывали и продували азотом в течение 5 мин. Гидрогенизацию осуществляли в потоке Н 2 (2,5 л/мин) в течение 8,25 ч. Реакционную смесь продували азотом, добавляли активированный уголь и смесь фильтровали на закрытом желобе. Полученный фильтрат объединяли с соответствующими фильтратами трех других циклов гидрогенизации (всего 14,53 кг исходного материала) и выпаривали в вакууме при около 50 С. Фильтрат отделяли промывкой 3 х 10 л толуола при 5060 С. Оставшееся вещество растворяли в 146 л этанола и к этой суспензии при перемешивании добавляли нагретую до 40 С суспензию L-(+) винной кислоты (5,22 кг) в деминерализованной воде (16 л). Суспензию оставляли на ночь без охлаждения или перемешивания. Кристаллизованный тартрат отфильтровывали на желобе и промывали 15 л этанола. Неочищенный тартрат перекристаллизовывали из 190 л этанола и 30 л деминерализованной воды при нагревании до кипения (около 78 С). Суспензию оставляли на ночь для кристаллизации без охлаждения или перемешивания. На следующий день суспензию охлаждали до примерно 18 С и тартрат отфильтровывали,промывали 60 л этанола и сушили в течение ночи в потоке воздуха при 60 С. Пример 8. 1-[2-[4-[5-хлор-1-(4-фторфенил)-1 Н-индол 3-ил]-1-пиперидинил]этил]-2-имидазолидинон. 7,96 кг тартрата 1-[2-[4-[5-хлор-1-(4-фторфенил)-1 Н-индол-3-ил]-1,2,3,6-тетрагидро-1 003248 10 пиридил]этил]-2-имидазолодиона суспендировали в 25 л деминерализованной воды и добавляли 30 л дихлорметана. К суспензии при перемешивании добавляли 27% раствор NaOH, рН=9(общее количество 3 л). Смесь перемешивали в течение 1 ч (при сохранении рН=9), затем дихлорметановую фазу отделяли. Водную фазу экстрагировали дополнительными 15 л дихлорметана. Объединенные дихлорметановые фазы сушили NaSO4 и упаривали. Продукт выделяли промывкой 5 л ацетона,добавляли 35 л ацетона и суспензию нагревали до температуры обратного холодильника. Кристаллизованный продукт не растворялся полностью. Нагревание прекращали и смесь оставляли на ночь при осторожном охлаждении. Кристаллизованный продукт отделяли на желобе,промывали дополнительными 5 л ацетона и сушили в потоке воздуха в течение ночи при 60 С. Выход: 4,90 кг (83,2%), т.пл. 154,7 С. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения N-(4-фторфенил)-N(2-карбокси-4-хлорфенил)глицина,включающий катализируемое медью арилирование 2,5 дихлорбензойной кислоты при помощи N-(4 фторфенил)глицина, в котором используют соли щелочных металлов 2,5-дихлорбензойной кислоты и N-(4-фторфенил)глицина в воднощелочной среде в присутствии медного катализатора в соответствии с реакционной схемой где M1 и М 2 являются ионами щелочных металлов. 2. Способ по п.1, отличающийся тем, что реакцию осуществляют при температуре выше комнатной, предпочтительно при температуре между 80 С и температурой кипения с обратным холодильником среды, в частности около температуры кипения с обратным холодильником. 3. Способ по п.1 или 2, отличающийся тем,что реакционная среда является водой или водой, к которой добавлен сорастворитель, причем сорастворитель предпочтительно является протонным сорастворителем, таким как этиленгликоль. 4. Способ по п.3, отличающийся тем, что в качестве растворителя используют воду. 5. Способ по п.3 или 4, отличающийся тем,что количество воды меньше чем 10 мл/г 2,5 дихлорбензойной кислоты, предпочтительно меньше чем 5 мл/г. 6. Способ по п.5, отличающийся тем, что количество воды меньше чем 3,5 мл/г, предпочтительно меньше чем 2,5 мл/г 2,5-дихлорбензойной кислоты. 7. Способ по любому из пп.1-6, отличающийся тем, что соли щелочных металлов являются солями лития, натрия или калия. 8. Способ по п.7, отличающийся тем, что используют те же самые соли реагентов, предпочтительно соли калия. 9. Способ по любому из пп.1-8, отличающийся тем, что основание является карбонатом щелочного металла, предпочтительно Li2 СО 3,Nа 2 СО 3 или K2 СО 3. 10. Способ по любому из пп.1-9, отличающийся тем, что щелочной металл карбоната щелочного металла является тем же, что и щелочной металл реагентов. 11. Способ по любому из пп.1-8, отличающийся тем, что основание является карбонатом калия. 12. Способ по любому из пп.1-11, отличающийся тем, что количество основания больше чем стехиометрическое количество 2,5 дихлорбензойной кислоты. 13. Способ по любому из пп.1-12, отличающийся тем, что катализатором является медь-бронза. 14. Способ по любому из пп.1-13, отличающийся тем, что соотношение количеств соли щелочного металла N-(4-фторфенил)глицина и соли щелочного металла 2,5-дихлорбензойной кислоты составляет от 0,5 до 3,0, предпочтительно от 1,0 до 2,5, в частности от 2,0 до 2,3 мол/мол. 15. Способ получения 5-хлор-1-(4 фторфенил)-3-(1,2,3,6-тетрагидропиридин-4 ил)индола, включающий реакцию 5-хлор-1-(4 фторфенил)индола с 4-пиперидоном в смеси минеральной кислоты и уксусной кислоты. 16. Способ по п.15, отличающийся тем, что 4-пиперидон используют в форме гидрохлорида 4-пиперидонгидрата. 17. Способ по п.15 или 16, отличающийся тем, что используемой минеральной кислотой является фосфорная кислота, азотная кислота,серная кислота или хлороводородная кислота. 18. Способ по п.17, отличающийся тем, что используемой минеральной кислотой является хлороводородная кислота. 19. Способ по п. 15 или 16, отличающийся тем, что используют, по меньшей мере, 1,5 эквивалента 4-пиперидона на эквивалент 5-хлор 1-(4-фторфенил)индола. 20. Способ по п.19, отличающийся тем, что используют, по меньшей мере, 1,75 эквивалента 4-пиперидона на эквивалент 5-хлор-1-(4 фторфенил)индола. 21. Способ по п.20, отличающийся тем, что используют, по меньшей мере, 2,0 эквивалента 4 12 пиперидона на эквивалент 5-хлор-1-(4-фторфенил)индола. 22. Способ по п.18, отличающийся тем, что хлороводородную кислоту используют в количестве, по меньшей мере, 2,5 мл концентрированной НСl на грамм 5-хлор-1-(4-фторфенил)индола. 23. Способ по п.15, отличающийся тем, что используют, по меньшей мере, 8 мл уксусной кислоты на грамм 5-хлор-1-(4-фторфенил)индола. 24. Способ по п.23, отличающийся тем, что используют, по меньшей мере, 10 мл уксусной кислоты на грамм 5-хлор-1-(4-фторфенил)индола. 25. Способ по п.24, отличающийся тем, что используют 10-14 мл уксусной кислоты на грамм 5-хлор-1-(4-фторфенил)индола. 26. Способ по п.22, отличающийся тем, что указанное соотношение составляет 3,5-5 мл концентрированной НСl на грамм 5-хлор-1-(4 фторфенил)индола. 27. Способ по п.18, отличающийся тем, что соотношение между уксусной кислотой и концентрированной НСl составляет от 2:1 до 4:1a) получение по любому из пп.1-14 N-(4 фторфенил)-N-(2-карбокси-4-хлорфенил)глицина путем взаимодействия соли щелочного металла 2,5-дихлорбензойной кислоты с солью щелочного металла N-(4-фторфенил)глицина в водно-щелочной среде в присутствии медного катализатора;d) удаление Н 2 О с получением таким путем 5-хлор-1-(4-фторфенил)индола;e) взаимодействие 5-хлор-1-(4-фторфенил) индола с 4-пиперидоном по любому из пп.15-27 в смеси уксусной кислоты и концентрированной НСl;g) взаимодействие продукта стадии f) с 1(2-хлорэтил)-2-имидазолидиноном; илиh) взаимодействие 5-хлор-1-(4-фторфенил)3-(1,2,3,6-тетрагидропиридин-4-ил)индола с 1-(2 хлорэтил)-2-имидазолидиноном с последующим восстановлением продукта, с получением таким способом сертиндола.
МПК / Метки
МПК: C07D 401/14, C07C 229/40
Метки: получения, сертиндола, способ
Код ссылки
<a href="https://eas.patents.su/7-3248-sposob-polucheniya-sertindola.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения сертиндола</a>
Предыдущий патент: Композиция, содержащая мезилат тровафлоксацина (варианты)
Следующий патент: Способ получения высокооктановых бензиновых фракций и ароматических углеводородов.
Случайный патент: Способ транспортирования содержащего углерод сырья











