Ковалентный конъюгат полиэтиленгликоля с гранулоцитарным колониестимулирующим фактором человека
Номер патента: 20425
Опубликовано: 28.11.2014
Авторы: Шереметьев Сергей Викторович, Коровкин Сергей Анатольевич, Катлинский Антон Викентьевич, Катлинский Владимир Антонович, Семченко Андрей Викторович
Формула / Реферат
Конъюгат полиэтиленгликоля с гранулоцитарным колониестимулирующим фактором, в котором полимер присоединен к тирозиновым или гистидиновым фрагментам полипептида посредством азогруппы, имеющий общую структурную формулу
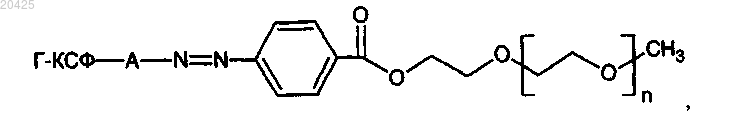
где n - целое число в интервале от 100 до 1200;
А - аминокислотный фрагмент тирозина или гистидина;
Г-КСФ - гранулоцитарный колониестимулирующий фактор.
Текст
КОВАЛЕНТНЫЙ КОНЪЮГАТ ПОЛИЭТИЛЕНГЛИКОЛЯ С ГРАНУЛОЦИТАРНЫМ КОЛОНИЕСТИМУЛИРУЮЩИМ ФАКТОРОМ ЧЕЛОВЕКА Изобретение относится к медицине и биотехнологии и касается ковалентного конъюгата полиэтиленгликоля с гранулоцитарным колониестимулирующим фактором человека, в котором ПЕГ присоединен к тирозиновым или гистидиновым фрагментам полипептида посредством азогруппы общей структуры: где n - целое число в интервале от 100 до 1200; А - аминокислотный фрагмент тирозина или гистидина; Г-КСФ - гранулоцитарный колониестимулирующий фактор. Конъюгат Г-КСФ обладает большим временем циркуляции в кровотоке по сравнению с немодифицированным полипептидом при сохранении существенной доли его активности. Область техники, к которой относится изобретение Изобретение относится к медицине и биотехнологии и касается ковалентного конъюгата полиэтиленгликоля с гранулоцитарным колониестимулирующим фактором человека, в котором полимер присоединн к полипептиду посредством азогруппы. Сведения о предшествующем уровне техники Гранулоцитарный колониестимулирующий фактор (Г-КСФ, G-CSF) - полипептидный гормон, стимулирующий в культуре клеток формирование колоний гранулоцитов. Г-КСФ стимулирует пролиферацию и дифференцировку поздних клеток-предшественников в нейтрофилы. Гранулоцитарный колониестимулирующий фактор является главным гемопоэтическим фактором роста, регулирующим гранулоцитопоэз, и широко применяется в медицине при лечении нейтропений различной этиологии. Показаниями к применению G-CSF являются нейтропения наследственная, периодическая или идиопатическая, при которой число нейтрофилов ниже или равно 500 клеток/мкл (в том числе у больных, получающих цитостатические лекарственные средства по поводу немиелоидных злокачественных новообразований, а также имеющих в анамнезе тяжелые или рецидивирующие инфекции в последние 12 месяцев), сокращение продолжительности периода нейтропений и ее клинических последствий у пациентов, готовящихся к трансплантации костного мозга, стойкая нейтропения у пациентов с развернутой стадией ВИЧ-инфекции (абсолютное число нейтрофилов 1000 клеток/мкл и менее), мобилизация периферических стволовых клеток (в том числе после миелосупрессивной терапии). Известны препараты Г-КСФ, например "Филграстим" - метионилколониестимулирующий фактор с молекулярной массой 18800 Да, представляющий собой негликозилированный протеин, состоящий из 175 аминокислот (производство: Мастерклон, Россия). Тем не менее, применение Г-КСФ в медицине ограничено рядом факторов, среди которых наиболее существенным является недостаточная энзиматическая стабильность в организме, которая приводит к необходимости увеличения частоты введения препарата, что в ряде случаев сопряжено с усилением побочных эффектов. Среднее значение периода полувыведения филграстима из сыворотки как у здоровых людей, так и у больных с опухолями составляет около 3,5 ч; скорость клиренса приблизительно 0,5-0,7 мл/(минкг). Только при непрерывных 24-часовых в/в инфузиях филграстима в дозе 20 мкг/кг в течение 11-20 дней достигается равновесная концентрация в крови. В связи с этим возникает необходимость в химическом модифицировании молекулы Г-КСФ с целью преодоления указанных недостатков. Для модифицирования различных полипептидов известно применение монометоксиполиэтиленгликоля (мПЭГ), который представляет собой нейтральный полиэфир с различной молекулярной массой[Никитин И.Г., Сторожаков Т.Н. Пегилированные лекарственные препараты: современное состояние проблемы и перспективы, в сб.: "Вирусные гепатиты: достижения и перспективы".3 (13) (2001),с. 3-8]. Как правило, в ковалентных конъюгатах полимерный фрагмент присоединен к полипептиду через одну из свободных аминогрупп последнего Kozlowski A., Charles S.A., Harris J.М. Development of Pegylated Interferons for the Treatment of Chronic Hepatitis C. BioDrugs.; vol. 15(7) (2001), p. 419-429], а препарат представляет собой смесь позиционных изомеров, химическая структура которых друг от друга отличается местом прикрепления полимера к полипептиду. Теоретически число позиционных изомеров в данном случае равно количеству свободных аминогрупп в полипептиде при условии их доступности для пегилирующего агента [Блохин Н.П., Никитин И.Г. Особенности фармакологической динамики и кинетики пегилированного -интерферона (40 кДа) "Пегасис": новые возможности терапии хронического гепатита С. В сб.: "Материалы VII Российской конференции "Гепатология сегодня". РЖГГК. 2002, с. 6]. В заявке RU 2009122976 (опубл. 27.12.2010) предложен конъюгат трехветвистого ПЕГ-Г-КСФ следующей общей формулы: в котором отношение связывания трехветвистого полиэтиленгликоля и Г-КСФ составляет 1:1(моль/моль) и ПЭГ имеет среднюю молекулярную массу от 200 до 45000 Да,где n представляет собой целое число от 1 до 1000;m представляет собой целое число от 10 до 1000;Z представляет собой (CH2)s или (CH2)sNHCO(CH2)s в качестве линкера Г-КСФ и ПЭГ, где s представляет собой целое число от 1 до 6;Y представляет собой амидную связь, образованную объединением одной из NH2-функциональной группы в Г-КСФ и функциональной группы производного ПЭГ. В заявке US 2008/0287659 (опубл. 20.11.2008) раскрыт пегилированный мутеин Г-КСФ, представляющий собой смесь ковалентных конъюгатов с разной степенью пегилирования, имеющих общую формулуn - целое число от 420 до 550;m - целое число от 1 до 5. Таким образом, предложенная смесь конъюгатов представляет собой смесь различных позиционных изомеров разной степени пегилирования. Известно, что позиционные изомеры полипептидов имеют различную биологическую активность(US 2004/0223950, опубл. 11.11. 2004). Это создат предпосылки для расширения арсенала таких средств за счт различных вариантов модифицирования молекул протеинов. Например, изменение положений и способов присоединения ПЭГ к протеину позволяет изменить соотношения позиционных изомеров в конечном продукте. Одним из способов снижения числа позиционных изомеров является присоединение ПЕГ преимущественно к N-терминальной аминогруппе полипептида с использованием разности значений pKa дляN-концевой -аминогруппы и -аминогруппы лизиновых фрагментов белка. Так, в международной заявке WO 96/011953 (опубл. 25.04.1996) предложен ковалентный конъюгат Г-КСФ с ПЕГ, полученный восстановительным алкилированием N-терминальной аминогруппы пептида метоксиполиэтиленгликоль-альдегидом в присутствии NaCNBH3 при рН 5. Однако условия конъюгации в данном патенте полностью не исключают вероятность побочных реакций, в том числе присоединения ПЕГ к -аминогруппам лизиновых фрагментов, часть которых, несмотря на высокое значение pKa, даже при кислых рН депротонирована, а их количество в белке, в отличие от N-терминальной -аминогруппы,больше одной. Другим направлением снижения числа позиционных изомеров является присоединение ПЕГ к тиольной группе цистеинового фрагмента полипептида. Так, в патенте WO 03/078461 (опубл. 25.03.2003) раскрыт ковалентный конъюгат, в котором полиэтиленгликоль связан с Г-КСФ в соотношении 1:1 через малеимидную группу с тиолом цистеинового фрагмента полипептида. Однако приведенные в патенте значения относительных активностей конъюгатов показывают, что модификация по тиольным фрагментам значимых преимуществ перед конъюгатами,образованным по аминогруппам лизина, не имеют. Таким образом, дальнейшая разработка новых типов конъюгатов, включая те, в которых не затронуты аминогруппы полипептидов, является весьма перспективной задачей. Наиболее близкими по технической сущности рассматриваются физиологически активные конъюгаты, в частности, инсулина, раскрытые в US 4179337 (опубл. 18.12.1979), содержащие в молекуле фрагмент парафенилендиазония и имеющие строение аминоазопроизводного формулы где R представляет PEG-O-CH2-, PEG-O-CH2-CH(OH)-CH2-O- или PEG-O-C(=O)-; представляет пептидную цепь. Недостатками таких производных являются относительно большое количество возможных вариантов позиционных изомеров вследствие присоединения полимерной части к аминогруппам полипептидов и их невысокая стабильность в организме и, как следствие, связанные с этим возможности неконтролируемого изменения структуры и отщепления реакционноспособных частиц, в частности диазосоединений. Сущность изобретения Авторы изобретения неожиданно установили, что конъюгаты ПЕГ с Г-КСФ, в которых полимер присоединен к тирозиновым или гистидиновым фрагментам полипепетида посредством азогруппы,имеющие общую структуру (I), приобретают способность длительной циркуляции в крови и сохраняют значительную часть биологической активности немодифицированного Г-КСФ. где n - целое число в интервале от 100 до 1200; А - аминокислотный фрагмент тирозина или гистидина; Г-КСФ - гранулоцитарный колониестимулирующий фактор. Для доказательства строения конъюгата как азосоединения применяют, в частности, электронную спектроскопию поглощения (ЭСП), сравнивают спектральные характеристики (интенсивность, ширину и положение максимумов полос поглощения) растворов пегилированного и немодифицированного Г-КСФ и интерпретируют полученные закономерности с позиций теории цветности органических соединений,необязательно, с привлечением адекватных методов квантово-химического моделирования. Характеристики максимумов полос поглощения приведены в табл. 1. Таблица 1 Характеристики максимумов полос поглощения пегилированного и немодифицированного Г-КСФ (вода, рН 4,5, 11 см) Появление полос поглощения у пегилированного Г-КСФ с максимумами при 339 и 400 нм может быть объяснено, например, с позиций теории цветности органических соединений, локальными электронными переходами в хромофорных системах не связанных сопряжением диарилазогрупп, образовавшихся в результате ковалентного присоединения ПЭГ-агента к тирозиновым и гистидиновым звеньям Г-КСФ. Уширение полос обусловлено наличием нескольких позиционных изомеров с близкими энергиями электронно-колебательных переходов. Достижение технического результата, заключающегося в увеличении времени циркуляции в кровотоке пегилированного Г-КСФ, подтверждают в сериях исследований на мышиной модели (табл. 2). Таблица 2 Время достижения максимальной концентрации (Tmax) и период полупревращения (Т 1/2) Г-КСФ и его конъгата в соответствии с изобретением в крови мышей после п/к инъекции Приведнные данные показывают, что конъюгат Г-КСФ в соответствии с изобретением обладает большим временем циркуляции в кровотоке по сравнению с немодифицированным протеином. Результаты исследования биологической активности конъюгатов в соответствии с настоящим изобретением приведены в табл. 3. Таблица 3 Биологическая активность пегилированного и немодифицированного Г-КСФ Таким образом, конъюгат в соответствии с настоящим изобретением сохраняет существенную часть биологической активности немодифицированного Г-КСФ. В соответствии с изобретением конъюгат Г-КСФ с высокой степенью чистоты может быть получен способом, включающим стадии, на которых: а) метоксиполиэтиленгликолевый эфир аминобензойной кислоты где n принимает значения от 10 до 1200,диазотируют нитритом щелочного или щелочно-земельного металла в водной или водно-органической среде при температуре от -2 до 30C или органическим нитритом в среде полярного органического растворителя, неограниченно смешивающегося с водой, при температуре от -40 до 30C, молярном соотношении нитрита к метоксиполиэтиленгликолевому эфиру аминобензойной кислоты от 1,1:1 до 1000:1 и молярном соотношении кислоты к метоксиполиэтиленгликолевому эфиру аминобензойной кислоты от 3:1 до 10000:1 с последующим удалением избытка нитрита и получением активированного пегилирующего агента - ([метоксиполиэтиленгликольокси]карбонил)бензолдиазония: где n - принимает вышеуказанные значения; б) активированный пегилирующий агент без выделения из реакционной смеси вводят в реакцию азосочетания с Г-КСФ в молярном соотношении ПЕГ-агента к Г-КСФ 1-10:1 соответственно в водной или водно-органической среде с рН от 7,0 до 10,0 при температуре от 0 до 30C; по достижении степени превращения по меньшей мере 70% реакцию останавливают добавлением к реакционной массе низкомолекулярной азосоставляющей с получением смеси конъюгатов разной степени пегилирования, немодифицированного полипептида и блокированного ПЭГ-агента; в) полученную смесь разделяют ионообменной хроматографией с увеличением ионной силы буферных элюирующих растворов с выделением монопегилированного Г-КСФ. При реализации заявленного способа обеспечивается повышение выхода пегилированного Г-КСФ и увеличение времени его циркуляции в кровотоке. Повышение выхода пегилированного Г-КСФ достигается за счет количественного переведения ПЕГ-агента в активную форму непосредственно перед конъюгацией, исключая деградацию активной группировки - диазогруппы при транспортировке и хранении. Увеличение времени циркуляции пегилированного Г-КСФ в кровотоке возможно за счт способности тирозиновых и гистидиновых звеньев полипептида вступать в реакцию азосочетания с активными диазосоединениями с образованием биологически активных азопроизводных Г-КСФ. В случае необходимости, повышение устойчивости пегилирующего агента при хранении достигается в результате применения для активации пегилирующего агента органического нитрита в среде полярного органического растворителя, неограниченно смешивающегося с водой, что дополнительно позволяет расширить температурный диапазон проведения реакции диазотирования. В предпочтительном варианте изобретения на стадии а) диазотирование проводят нитритом натрия в среде водного раствора бромисто-водородной кислоты, а избыток нитрита удаляют сульфаминовой кислотой. В следующем предпочтительном варианте изобретения на стадии а) диазотирование проводят третбутилнитритом в присутствии HCl в тетрагидрофуране. В следующем предпочтительном варианте изобретения на стадии б) для создания и поддержания рН применяют боратно-карбонатный буферный раствор, степень превращения Г-КСФ составляет 75100%, а в качестве низкомолекулярной азосоставляющей применяют тирозин. В следующем предпочтительном варианте изобретения на стадии в) смесь разделяют ионообменной хроматографией с увеличением ионной силы буферных элюирующих растворов от 0,02 до 1,0 М NaCl. На стадии а) диазотирование метоксиполиэтиленгликолевого эфира аминобензойной кислоты осуществляют прибавлением нитрита щелочного или щелочно-земельного металла в кислой водной или водно-органической среде при температуре от -2 до 30C. В первом варианте диазотирования применяют нитрит щелочного или щелочно-земельного металла в кислой водной или водно-органической среде. Наиболее предпочтительный интервал температур диазотирования составляет от 0 до 5C. Кислую среду создают с помощью органических кислот, например с помощью уксусной кислоты или ее галогенпроизводных, таких как хлоруксусная, трихлоруксусная, бромуксусная, трибромуксусная, трифторуксусная кислоты, а также лимонной или винной кислот, или неорганических кислот, например хлористо-водородной, бромисто-водородной, серной или фосфорной кислот, а также смесью органических и/или нерганических кислот. Молярное соотношение нитрита к метоксиполиэтиленгликолевому эфиру аминобензойной кислоты составляет от 1,1:1 до 1000:1, предпочти-4 020425 тельно от 1,1:1 до 10:1. Молярное соотношение кислоты к метоксиполиэтиленгликолевому эфиру аминобензойной кислоты составляет от 3:1 до 10000:1. Реакцию предпочтительно проводят в присутствии катализатора диазотирования, в качестве которого используют бромид-ионы, вносимые в реакционную смесь в виде бромоводородной кислоты или ее растворимых солей, например бромидов щелочных металлов. Наиболее предпочтительно создавать кислую среду раствором бромисто-водородной кислоты. Во втором варианте диазотирование проводят с применением органического нитрита в среде полярного органического растворителя, неограниченно смешивающегося с водой, при температуре от -40 до 30C. Наиболее предпочтительный интервал температур диазотирования составляет от -20 до 0C. Предпочтительными органическими нитритами являются бутилнитриты или амилнитриты, более предпочтительно трет-бутилнитрит. Молярное соотношение нитрита к метоксиполиэтиленгликолевому эфиру аминобензойной кислоты составляет от 1,1:1 до 1000:1, предпочтительно от 1,1:1 до 10:1. Кислую среду в полярной органической среде создают растворами HCl или HBr в алифатическом эфире, например диэтиловом эфире, или циклическом эфире, например диоксане или тетрагидрофуране. Молярное соотношение кислоты к метоксиполиэтиленгликолевому эфиру аминобензойной кислоты составляет от 3:1 до 10000:1. По завершении диазотирования активированный ПЭГ-агент можно хранить при пониженной температуре в течение не более 2 ч в водной или водно-органической среде или не более 24 ч в полярной органической среде без существенной потери его способности к азосочетанию. Термин "пониженная температура" означает температуру от -2 до 5C в случае применения водной или водно-органической среды и от -40 до 0C в случае применения полярной органической среды. Перед применением активированного ПЭГ-агента для пегилирования Г-КСФ требуется удаление избытка нитрит-ионов, для чего к его раствору добавляют мочевину или сульфаминовую кислоту. Альтернативно, применяют азиды щелочных или щелочно-земельных металлов. На стадии б) пегилирование Г-КСФ достигается в результате протекания реакции азосочетания диазотированного метоксиполиэтиленгликолевого эфира аминобензойной кислоты с Г-КСФ в нейтральной или слабощелочной водной или водно-органической среде при температуре от 0 до 30C. Наиболее предпочтительный интервал рН при пегилировании составляет от 9 до 10. Поддержание рН обеспечивают применением подходящего буферного раствора, например боратно-карбонатного буферного раствора. Выбор раствора находится в рамках компетенции среднего специалиста в данной области. Молярное соотношение диазотированного метоксиполиэтиленгликолевого эфира 4-аминобензойной кислоты к Г-КСФ составляет от 1:1 до 10:1, наиболее предпочтительно от 3:1 до 8:1. Контроль процесса пегилирования осуществляют эксклюзионной или обращенно-фазовой ВЭЖХ. По достижении требуемой степени превращения полипептида реакцию пегилирования останавливают добавлением к реакционной массе низкомолекулярной азосоставляющей. Для этого в качестве низкомолекулярной азосотавляющей применяют вещества фенольной природы или их эфиры, вещества, имеющие природу ароматических аминов, или вещества, имеющие гетероциклическую природу, у которых гетероцикл способен выступать в качестве азосоставляющей в реакции азосочетания. Наиболее предпочтительными являются тирозин и гистидин, более предпочтительно тирозин. Предпочтительно степень превращения Г-КСФ, вычисленная по результатам ВЭЖХ-анализа, составляет 75-100%. Выделение пегилированного Г-КСФ из реакционной смеси осуществляют обычными методами ионообменной хроматографии, последовательно используя буферные растворы с возрастающей ионной силой. Концентрацию Г-КСФ определяют методом ВЭЖХ или спектрофотометрически, используя соответствующее значение А 280 для раствора с концентрацией полипептида 1 мг/мл. Сведения, подтверждающие возможность осуществления изобретения Далее изобретение будет проиллюстрировано следующими примерами, подтверждающими возможность его осуществления с достижением указанного в описании технического результата. Пример 1. Получение пегилированного Г-КСФ. К охлажденному до 3C раствору 0,5 мкмоль Г-КСФ в боратно-карбонатном буфере с рН 9,5 приливают охлажденный раствор 2,5 мкмоль 4-([метоксиполиэтиленгликольокси]карбонил)бензолдиазония(М.м. 30 кДа), поддерживая рН реакционной смеси 9,50,3. Реакционную смесь при охлаждении перемешивают приблизительно 2 ч, контролируя протекание превращений обращенно-фазовой ВЭЖХ (колонка Kromasil 300-5C4, 2504,6 мм, спектрофотометрическое детектирование при 220, 280, 340 и 400 нм, градиентное элюирование: от 30% водн. ацетонитрил + 0,2% ТФУ до 80% водн. ацетонитрил + 0,2% ТФУ). По достижении степени превращения Г-КСФ равной 70-80% приливают раствор тирозина,перемешивают 10 мин и уксусной кислотой доводят рН до 5,0-6,5. Далее реакционную смесь, содержащую смесь дипегилированого, монопегилированного и немодифицированного Г-КСФ, а также блокированный пегилирующий агент, разделяют ионообменной хроматографией с увеличением ионной силы буферных элюирующих растворов от 0,02 до 1,0 М NaCl. Выход очищенного пегилированного Г-КСФ 39% (считая на Г-КСФ). ЭСП (вода, рН 4,5, 11 см), макс, нм(3,8). Пример 2. Определение времени циркуляции пегилированного Г-КСФ в крови на мышиной модели. Самцам мышей линии СВА вводят подкожно по 5 мкг пегилированного Г-КСФ в соответствии с изобретением, после чего собирают кровь в первый день через 2 ч после инъекции и далее через каждые 24 ч в течение 10 дней. В качестве контроля используют немодифицированный Г-КСФ, который вводят по той же схеме. Взятые пробы крови инкубируют в течение 45 мин при 37C, после чего отделяют тромб и повторно инкубируют при 4C, полученную сыворотку центрифугируют и сохраняют при -65C до проведения тестов. Содержание в сыворотках крови (пг/мл) определяют с помощью ИФА набора"Human G-CSF ELISA Kit", далее рассчитывают время достижения максимальной концентрации и период полупревращения. Данные представлены в табл. 2. Пример 3. Определение активности пегилированного Г-КСФ. Человеческую миелоидную клеточную линию HL-60 (ATCC CCL-240) культивируют в среде RPMI 1640, в которую добавлен 10% FBS. Культивированные клетки суспендируют при плотности примерно 2,2105 клеток/мл и добавляют ДМСО (диметилсульфоксид со степенью чистоты, пригодной для культивирования, Sigma) при конечной концентрации 1,25% (об./об.). Затем 90 мкл клеточной суспензии высевают в каждую лунку 96-луночного планшета (Coming/96-луночный планшет с выпариванием при низкой температуре), после чего планшет оставляют до достижения плотности примерно 2104 клеток на лунку и культивируют в инкубаторе при 37C в атмосфере 5% CO2 в течение 72 ч. Каждый образец разводят средой RPMI 1640 до идентичной концентрации 10 мкг/мл, а затем проводят двукратное разведение средой RPMI 1640 в 19 раз. Эти серийные двукратные разведения отдельно добавляют в каждую лунку, содержащую клетки HL-60 в объеме 10 мкл, так, чтобы концентрация каждого образца изначально составляла 1 мкг/мл. Затем клетки культивируют в инкубаторе при 37C в течение 72 ч. Пролиферацию клеток HL-60 анализируют с использованием реагента 96 (Cell Titer 96TM, Cat. No.G4100, Promega) для определения клеточного титра и увеличивающееся число клеток определяют путем измерения оптической плотности при 670 нм. Результаты измерения приведены в табл. 3. ФОРМУЛА ИЗОБРЕТЕНИЯ Конъюгат полиэтиленгликоля с гранулоцитарным колониестимулирующим фактором, в котором полимер присоединен к тирозиновым или гистидиновым фрагментам полипептида посредством азогруппы, имеющий общую структурную формулу где n - целое число в интервале от 100 до 1200; А - аминокислотный фрагмент тирозина или гистидина; Г-КСФ - гранулоцитарный колониестимулирующий фактор.
МПК / Метки
МПК: A61K 31/25, C08G 73/00, A61K 38/19, C07K 14/53
Метки: фактором, полиэтиленгликоля, ковалентный, человека, гранулоцитарным, конъюгат, колониестимулирующим
Код ссылки
<a href="https://eas.patents.su/7-20425-kovalentnyjj-konyugat-polietilenglikolya-s-granulocitarnym-koloniestimuliruyushhim-faktorom-cheloveka.html" rel="bookmark" title="База патентов Евразийского Союза">Ковалентный конъюгат полиэтиленгликоля с гранулоцитарным колониестимулирующим фактором человека</a>
Предыдущий патент: Не содержащие азот средства дезодорирующей очистки от сульфидов
Следующий патент: Очистка спиртов перед их применением в присутствии кислотного катализатора
Случайный патент: Пневматический перфоратор











