Способ получения кандесартана цилексетила
Формула / Реферат
1. Способ получения кандесартана цилексетила формулы (I)
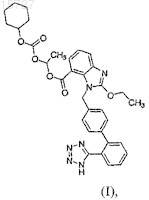
включающий снятие защитной группы с тетразолила в кандесартане цилексетиле с защищенным тетразолилом в смеси растворителей, состоящей из спирта и галогенированного углеводорода, в присутствии кислоты Льюиса, выбранной из группы, состоящей из трифторида бора, тригалида алюминия и дигалида цинка.
2. Способ по п.1, отличающийся тем, что защитная группа на тетразолиле представляет собой трифенилметильную (тритильную) защитную группу.
3. Способ по п.1, отличающийся тем, что спирт представляет собой метанол.
4. Способ по п.1, отличающийся тем, что галогенированный углеводород представляет собой хлористый метилен.
5. Способ по п.1, отличающийся тем, что реакцию проводят при температуре от 20 до 100°С.
6. Способ по п.1, отличающийся тем, что кислота Льюиса представляет собой дигалид цинка.
7. Способ по п.1, отличающийся тем, что кислота Льюиса представляет собой трифторид бора.
8. Способ по любому из пп.1, 6 и 7, отличающийся тем, что кислоту Льюиса добавляют в количестве от 0,4 до 1,5 эквивалентов, предпочтительно в количестве от 0,6 до 1,2 эквивалентов, наиболее предпочтительно в количестве от 0,7 до 1,0 эквивалента.
9. Способ получения кандесартана цилексетила, включающий:
i) трансэтерификацию или этерификацию производного кандесартана с защищенным тетразолилом или кандесартана в кислотной форме с защищенным тетразолилом с получением кандесартана цилексетила с защищенным тетразолилом,
ii) обработку кандесартана цилексетила с защищенным тетразолилом кислотой Льюиса, выбранной из группы, состоящей из трифторида бора, тригалида алюминия и дигалида цинка, в смеси растворителей, состоящей из спирта и галогенированного углеводорода,
iii) добавление второго растворителя, предпочтительно воды, и нагревание реакционной смеси,
iv) выделение полученного кандесартана цилексетила.
10. Способ получения кандесартана цилексетила, включающий:
ii) обработку (+/-)-1-[[(циклогексилокси)карбонил]окси]этил-2-этокси-1-[[2'-(N-трифенилметилтетразол-5-ил)-1,1'-бифенил-4-ил]метил]-1Н-бензимидазол-7-карбоксилата (тритилкандесартана цилексетила) кислотой Льюиса, выбранной из группы, состоящей из трифторида бора, тригалида алюминия и дигалида цинка, в смеси растворителей, состоящей из спирта и галогенированного углеводорода,
iii) добавление второго растворителя, предпочтительно воды, и нагревание реакционной смеси,
iv) выделение полученного кандесартана цилексетила.
11. Способ по любому из пп.9 и 10, отличающийся тем, что второй растворитель на стадии (iii), предпочтительно воду, добавляют в количестве от 0% (об./об.) до 10% (об./об.), предпочтительно от 1 до 5%.
12. Способ по любому из пп.9 и 10, отличающийся тем, что реакционную смесь нагревают до температуры от 0 до 120°С, предпочтительно до температуры кипения в течение от 0,5 до 10 ч, предпочтительно от 2 до 5 ч.
13. Способ по любому из пп.9 и 10, отличающийся тем, что на стадии (ii) в качестве растворителя для реакции используют метанол.
14. Способ по любому из пп.1, 9 и 10, отличающийся тем, что выделение полученного кандесартана цилексетила включает кристаллизацию, осаждение, лиофилизацию, экстракцию, включая экстракцию в сверхкритических состояниях либо с использованием сжатых газов, распылительную сушку, или любую другую процедуру, известную специалисту в данной области.
15. Способ по любому из пп.1, 9 и 10, отличающийся тем, что получают кандесартана цилексетил, который содержит менее чем 5000 ч./млн остаточных растворителей.
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента СПОСОБ ПОЛУЧЕНИЯ КАНДЕСАРТАНА ЦИЛЕКСЕТИЛА Согласно настоящему изобретению предложен улучшенный способ синтеза для производства кандесартана, а также его фармацевтически приемлемых солей и сложных эфиров в качестве активных ингредиентов лекарственного средства для лечения гипертензии и связанных с ней заболеваний и болезненных состояний, который включает снятие защитной группы с тетразолила в органическом растворителе в присутствии кислоты Льюиса. 015727 Область техники Настоящее изобретение относится к улучшенному способу производства кандесартана, а также его фармацевтически приемлемых солей и сложных эфиров в качестве активных ингредиентов лекарства для лечения гипертензии, а также связанных с ней заболеваний и состояний. Техническая задача Кандесартана цилексетил формулы (I) описывается с химической точки зрения как (+/-)-1(циклогексилокси)карбонил]окси]этил-2-этокси-1-2'-(1 Н-тетразол-5-ил)-1,1'-бифенил-4-ил]метил]-1 Нбензимидазол-7-карбоксилат. Благодаря своей способности ингибировать ангиотензин-превращающий фермент он широко используется для лечения гипертензии, а также связанных с ней заболеваний и состояний. Являясь антагонистом рецептора ангиотензина второго типа, кандесартана цилексетил не обладает побочными эффектами, свойственными антагонистам кальция и показывает высокую стабильность и несомненные лечебные эффекты. В настоящее время он продатся в рацемической смеси. Его производят в соответствии с опубликованными патентами, например ЕР 0720982 В 1 и ЕР 0459136. Как будет указано ниже, для получения кандесартана цилексетила было бы весьма выгодно использовать более эффективный и более экономичный технологический процесс. Уровень техники ЕР 0720982 В 1 описывает получение кандесартана цилексетила посредством снятия защиты в виде трифенилметановой (тритильной) группы в метиловом спирте в присутствии соляной кислоты. Недостатками этой процедуры являются весьма низкий выход, а также то, что продукт нуждается в хроматографической очистке. ЕР 0668272 описывает улучшенный способ снятия защиты путем использования раствора безводного хлороводорода в метаноле. При этом несколько увеличивается выход, по сравнению с ЕР 0720982 В 1, однако доля продуктов распада остатся высокой. Другими недостатками вышеописанных способов является применение высококоррозионных кислот, а также необходимость очистки реакционной смеси посредством комплексной экстракции или хроматографии. В WO 2005/021535 описывается получение кандесартана цилексетила посредством снятия защиты в виде тритильной группы при помощи сольволиза безводным спиртом, содержащим 1-5 атомов углерода,при кипячении с обратным холодильником в нейтральных или слабощелочных условиях. Сообщается,что выход кандесартана цилексетила составляет при этом от 76 до 91%, что также не является оптимальным для промышленного производства, а время реакции, как сообщается в заявке, составляет 24 ч, что также является недостатком с промышленной точки зрения. Кроме того, значительная длительность реакции при температуре кипения обычно приводит к высокому содержанию продуктов распада. В WO 2005/037821 описывается снятие защиты с тетразольной группы с (+/-)-1(циклогексилокси)карбонил]окси]этил-2-этокси-1-2'-(N-трифенилметилтетразол-5-ил)-1,1'-бифенил-4 ил]метил]-1 Н-бензимидазол-7-карбоксилата (тритилкандесартана цилексетила) при помощи метансульфоновой, п-толуолсульфоновой, муравьиной и трифторуксусной кислот либо путем кипячения тритилкандесартана цилексетила с обратным холодильником в смеси толуола, метанола и воды. Недостатки этих способов состоят в том, что снятие защиты оказывается неполным, а также в том, что конечный продукт в большинстве случаев выделяют в виде вязкой маслянистой жидкости ввиду наличия примесей.WO 2005/051928 описывает способы получения тетразольных соединений, включающие удаление защитных групп с N-защищнных тетразольных соединений, в частности, с кандесартана цилексетила, с помощью органических кислот. Поскольку применяют низкую температуру от 30 до 35 С, выход не превышает 60%, и применяются дополнительные стадии экстрагирования и очистки на активированных углях и целите, что ясно указывает на присутствие нежелательных побочных продуктов и/или присутствие исходного вещества. Краткое описание изобретения Согласно настоящему изобретению предложен улучшенный способ синтеза для производства кандесартана, а также его фармацевтически приемлемых солей и сложных эфиров в качестве активных ингредиентов лекарственного средства для лечения гипертензии, а также связанных с ней заболеваний и-1 015727 состояний, включающий снятие защитной группы с тетразолила в кандесартана цилексетиле с защищенным тетразолилом в смеси растворителей, состоящей из спирта и галогенированного углеводорода, в присутствии кислоты Льюиса, выбранной из группы, состоящей из трифторида бора, тригалида алюминия и дигалида цинка. Под кислотами Льюиса в целом понимают вещества, имеющие незаполненную орбиталь и/или доступную LUMO (lowest unoccupied molecular orbital - нижнюю незаполненную молекулярную орбиталь), а также вещества с полным или частичным положительным зарядом. Обычно применяют такие кислоты Льюиса, как трифторид бора, тригалид алюминия и/или дигалид цинка. В предпочтительном варианте осуществления настоящего изобретения предложена улучшенная реакция снятия защиты, приводящая к образованию кандесартана, а также его фармацевтически приемлемых солей и сложных эфиров, которая состоит в удалении трифенилметановой (тритильной) защитной группы с тетразольной группы в смеси растворителей, состоящей из спирта и галогенированного углеводорода, в присутствии кислоты Льюиса, выбранной из группы, состоящей из трифторида бора, тригалида алюминия и дигалида цинка. Предпочтительно в качестве кислоты Льюиса применяют какой-либо дигалид цинка, в частности, дифторид, дихлорид, дибромид или дииодид цинка. Более предпочтительно применяют дихлорид цинка. Неожиданно было обнаружено, что при изготовлении кандесартана, а также его фармацевтически приемлемых солей и сложных эфиров, предпочтительно кандесартана цилексетила, реакция удаления защитной группы с тетразолила, в частности, в случае защиты тетразолила тритильной группой, имеет больший выход, если ее осуществляют в смеси растворителей, состоящей из спирта и галогенированного углеводорода, в присутствии кислоты Льюиса, выбранной из группы, состоящей из трифторида бора,тригалида алюминия и дигалида цинка. Длительность реакции при этом сокращается по сравнению с реакциями снятия защитной группы, известными из уровня техники, и в результате получают кандесартана цилексетил с меньшим содержанием примесей. Ниже описываются предпочтительные варианты осуществления настоящего изобретения. Подробное описание изобретения Согласно настоящему изобретению предложен улучшенный способ синтеза для производства кандесартана цилексетила, включающий снятие защитной группы с тетразолила в кандесартана цилексетиле с защищенным тетразолилом в смеси растворителей, состоящей из спирта и галогенированного углеводорода, в присутствии кислоты Льюиса, выбранной из группы, состоящей из трифторида бора, тригалида алюминия и дигалида цинка. Исходное вещество, представляющее собой производное кандесартана или кандесартан в виде свободной кислоты, предпочтительно сложный эфир кандесартана, более предпочтительно (+/-)-1(циклогексилокси)карбонил]окси]этил-2-этокси-1-2'-25(N-трифенилметилтетразол-5-ил)-1,1'-бифенил-4-ил]метил]-1 Н-бензимидазол-7-карбоксилат (тритилкандесартана цилексетил), может быть получено, как описано в литературе (напр., J. Med. Chem. 1993, 36, 2343-2349), или любым другим способом,известным специалистам, и может применяться в виде тврдого вещества или раствора. Соответственно,тритилкандесартана цилексетил может применяться в очищенном виде, в виде раствора или в виде неочищенной реакционной смеси. В первом варианте осуществления настоящего изобретения предложена улучшенная реакция снятия защиты, приводящая к образованию кандесартана, а также его фармацевтически приемлемых солей и сложных эфиров, которая включает удаление защитной группы с тетразольной группы в смеси растворителей, состоящей из спирта и галогенированного углеводорода, в присутствии кислоты Льюиса, которая представляет собой классическое вещество с недостатком электрона, такое, например, как трифторид бора, тригалид алюминия, дигалид цинка и т.п. Предпочтительно применяют какой-либо дигалид цинка,более предпочтительно дихлорид цинка. В предпочтительном варианте осуществления защитной группой на тетразолиле является трифенилметил (тритил). Способ получения (+/-)-1-(циклогексилокси)карбонил]окси]этил-2-этокси-1-2'-(N-тетразол-5 ил)-1,1'-бифенил-4-ил] метил]-1 Н-бензимидазол-7-карбоксилата (кандесартана цилексетила) включает:i) трансэтерификацию или этерификацию производного кандесартана с защищенным тетразолилом или кандесартана в кислотной форме с защищенным тетразолилом с получением кандесартана цилексетила с защищенным тетразолилом;ii) обработку кандесартана цилексетила с защищенным тетразолилом кислотой Льюиса, выбранной из группы, состоящей из трифторида бора, тригалида алюминия и дигалида цинка, в смеси растворителей, состоящей из спирта и галогенированного углеводорода;iv) выделение полученного кандесартана цилексетила. Если трансэтерификацию на стадии (i) осуществляют с производным кандесартана с защищенным тетразолилом, например, этиловым эфиром тритил-защищнного кандесартана, очень важно, чтобы по завершении стадии (i) содержание используемого производного кандесартана с защищенным тетразолилом, например этилового эфира тритил-защищнного кандесартана, составляло менее 0,5%, поскольку в противном случае могут образоваться нежелательные примеси, например этиловый эфир кандесартана,от которого сложно избавиться на стадии (iv). Если на стадии (i) осуществляют этерификацию кандесар-2 015727 тана в форме кислоты с защищенной тетразольной группой, следует обратить внимание на содержание производных кандесартана с защищенной тетразольной группой, например на этиловый эфир кандесартана с тритильной защитой. Предпочтительно содержание производных кандесартана с защищенной тетразольной группой, например этилового эфира кандесартана с тритильной защитой, должно быть ниже 0,4%. В предпочтительном варианте осуществления настоящего изобретения способ получения (+/-)-1(циклогексилокси)карбонил]окси]этил-2-этокси-1-2'-(1 Н-тетразол-5-ил)-1,1'-бифенил-4-ил]метил]-1Hбензимидазол-7-карбоксилата (кандесартана цилексетила) включает:(+/-)-1-(циклогексилокси)карбонил]окси]-этил-2-этокси-1-2'-(N-трифенилметилтетразол-3-ил)-1,1'-бифенил-4-ил]метил]-1 Н-бензимидазол-7-карбоксилата (тритилкандесартана цилексетила) кислотой Льюиса, выбранной из группы, состоящей из трифторида бора, тригалида алюминия и дигалида цинка, в смеси растворителей, состоящей из спирта и галогенированного углеводорода,iii) добавление второго растворителя, предпочтительно воды, и нагревание реакционной смеси,iv) выделение полученного кандесартана цилексетила. Предпочтительным способом получения кандесартана цилексетила является такой способ, при котором кислота Льюиса представляет собой дигалид цинка, предпочтительно дихлорид цинка. Кислоту Льюиса добавляют в количестве от 0,4 до 1,5 эквивалентов, предпочтительно в количестве от 0,6 до 1,2 эквивалента, более предпочтительно в количестве от 0,7 до 1,0 эквивалента. Второй растворитель на стадии (iii), представляет собой предпочтительно воду, добавляют в количестве от 0% (об./об.) до 10% (об./об.), предпочтительно от 0,5% (об./об.) до 10% (об./об.), более предпочтительно от 1 до 5%. В качестве второго растворителя могут добавлять какой-либо полярный растворитель до нагревания или в ходе последнего. Предпочтительно второй растворитель представляет собой воду. На стадии (iii) реакционную смесь нагревают до температуры от 0 до 120 С, предпочтительно до температуры кипения, в течение времени от 0,5 до 10 ч, предпочтительно от 2 до 5 ч. Предпочтительно используют смеси спирта с неполярным органическим растворителем, таким как галогенированные углеводороды, наиболее же предпочтительно смеси, которые применяют в качестве растворителя на стадии (ii), представляют собой смеси метанола с хлористым метиленом. Конверсия исходного вещества является почти полной, поскольку в реакционной смеси остатся менее 2% исходного вещества (тритил кандесартана цилексетила). Количество побочного продукта 2 оксокандесартана цилексетила в реакционной смеси составляет менее 2%. Выделение полученного кандесартана цилексетила включает кристаллизацию, осаждение, лиофилизацию, экстракцию, в частности экстракцию в сверхкритических условиях либо с использованием сжатых газов, распылительной сушки или любой другой процедуры, известной специалистам в данной области. В предпочтительном варианте осуществления, когда на стадии (ii) применяют смеси органических растворителей, на стадии выделения (iv) реакционную смесь охлаждают до температуры ниже 30 С,возможно, разбавляют неполярным органическим растворителем (таким как галогенированные углеводороды, алканы, циклоалканы, ароматические углеводороды, органические карбонаты) и промывают водой или солевым раствором. Органическую фазу осушают над осушителем, таким как безводный сернокислый натрий или магний. Экстракцию осуществляют при температуре ниже 50 С, предпочтительно ниже 30 С, более предпочтительно ниже 20 С. Органическую фазу полностью или частично отгоняют при пониженном давлении, остаток, возможно, разводят неполярным органическим растворителем, после чего добавляют второй органический растворитель. Предпочтительно первый растворитель представляет собой хлористый метилен, а в качестве второго органического растворителя, добавляемого после отгонки, применяют сложные или простые эфиры (такие как диэтиловый эфир, этилметиловый эфир,диизопропиовый эфир, трет-бутилэтилвый эфир, метилциклопентиловый эфир, тетрагидрофуран, метилацетат, этилацетат, пропилацетат, изопропилацетат, изобутилацетат, трет-бутилацетат и бутилацетат),толуол, ксилол и циклогексан. После добавления второго растворителя смесь перемешивают и охлаждают ниже 30 С в течение от 2 до 24 ч. По окончании стадии очистки (iv) выпавший в осадок или кристаллизовавшийся продукт (неочищенный кандесартана цилексетил) собирают и высушивают в течение до 10 ч при температуре от 10 до 50 С до получения кандесартана цилексетила, содержащего менее 5000 частей на миллион остаточных растворителей. Для сушки полученного кандесартана цилексетила могут применять все способы высушивания, известные среднему специалисту в области техники, такие, например, как высушивание на воздухе, вакуумная сушка, сушка в псевдоожиженном слое, включая сушку в псевдоожиженном слое при помощи влажного воздуха или инертного газа, и распылительную сушку. Предпочтительно применяют вакуумную сушку. Неочищенный продукт могут перекристаллизовывать из органических растворителей, таких как спирты, кетоны, сложные эфиры и нитрилы и/или их смеси. Могут также применять смеси указанных растворителей с простыми и сложными эфирами, галогенированными углеводородами и углеводородами. Неочищенный продукт могут, кроме того, суспендировать в органическом растворителе, таком как-3 015727 простые эфиры (диэтиловый эфир, этилметиловый эфир, диизопропиовый эфир, трет-бутилэтилвый эфир, метилциклопентиловый эфир, тетрагидрофуран), сложные эфиры (метилацетат, этилацетат, пропилацетат, изопропилацетат, изобутилацетат, трет-бутилацетат и бутилацетат), алканы (гексан, гептан,петролейный эфир, циклогексан), толуол и ксилол. Кристаллические формы продуктов, перекристаллизованных из вышеуказанных растворителей соответствовали описанным в литературе (Chem. Pharm.Bull. 47(2) 182-186 (1999). В ходе перекристаллизации и фильтрования могут образовываться сольваты кандесартана цилексетила. Важно контролировать размер частиц кандесартана цилексетила в ходе его получения. В данной работе применяют частицы со средним размером от 10 до 100 мкм, предпочтительно менее 50 мкм, которые обычно получают при кристаллизации кандесартана цилексетила из органических растворителей или их смесей с водой при перемешивании. Если перемешивание не проводят, кристаллизация из органических растворителей или их смесей с водой может приводить также к образованию более крупных частиц со средним диаметром более 100 мкм, которые нужно размалывать или обрабатывать каким-либо другим образом для уменьшения размера частиц перед использованием их в фармацевтических составах. В результате перемалывания могут получать частицы со средним диаметром менее 3 мкм. Для этих целей в качестве мельничного оборудования обыкновенно используют струйные мельницы, шаровые мельницы или молотковые мельницы. Однако требуется контролировать не только средний размер частиц, но и распределение частиц по размерам. Средний размер частиц и распределение частиц по размерам важны, чтобы обеспечить промышленную применимость технологического процесса, т.е. добиться того, чтобы он не приводил к сегрегации ингредиентов смеси для таблетирования, в случае если таблетирование/прессование не проводят сразу после изготовления смеси для таблетирования. Все приведенные здесь проценты представляют собой мас.%. 2-оксопримеси и производные кандесартана с защищенной и. незащищнной тетразольной группой выявляли способом ВЭЖ включающим: Оборудование: ВЭЖХ: Agilent 1100 Оценка данных: ChemStation Условия хроматографии: Колонка: Zorbax Eclipse XDB С-18, 1,8 мкм, 504,6 мм Подвижная фаза: Растворитель А: 0,01 М натрия дигидрофосфат, рН 2.5 Растворитель В: ацетонитрил Градиент: Промывание колонки Температура колонки Скорость потока: Выявление: Инъекция: 2 мин 30 С 1,0 мл/мин УФ, 225 нм 10 мкл Раствор для сравнения (СР) СР 1: Растворяли 5 мг стандартного кандесартана цилексетила и по 5 мг промежуточных продуктов синтеза кандесартана - тритилкандесартана цилексетил и тритилкандесартан - в ацетонитриле и разбавляли до 10,0 мл. СР 2: Разбавляли 1,0 мл этого раствора ацетонитрилом до 100,0 мл. Тестируемые растворы (ТР) ТР 1: 20,0 мкл реакционной смеси разбавляли ацетонитрилом до 20,0 мл. ТР 2: около 10 мг тестируемого вещества растворяли в ацетонитриле и разбавляли ацетонитрилом до 25,0 мл. Если хроматограммы регистрировали в предписанных условиях, то время удержания канрдесартана составляло около 7 мин, относительное время удержания тритилкандесартана цилексетила составляло около 1,2, относительное время удержания тритилкандесартана - около 2,1, а аналогичные параметры для 2-оксокандесартана цилексетила, Ph3COH, Ph3COMe, Ph3COEt составляли соответственно 0,6, 0,8, 1,3,1,4. Относительное время удержания этилового эфира тритилкандесартана составляло около 1,8, а относительное время удержания этилового эфира кандесартана составляло около 0,5. Способ оценки пред-4 015727 ставлял собой % площади. Настоящее изобретение иллюстрируется нижеследующими примерами, которые не ограничивают его. Точки плавления определяли при помощи аппарата Коффлера для определения температуры плавления, а инфракрасные спектры снимали с помощью спектрометра Paragon 100 Perkin-Elmer FT-IR. Примеры Сравнительный пример 1 (WO 2005/021535, пример 12) Смесь тритилкандесартана цилексетила (0,43 г) и метанола (8,6 мл) перемешивали и кипятили с обратным холодильником 24 ч. Затем полученную реакционную смесь анализировали ВЭЖХ (высокоэффективной жидкостной хроматографией). Кандесартана цилексетил: 64,9% Тритилкандесартана цилексетил: 0,64% 2-оксокандесартана цилексетил: 8,0% Смесь упаривали до 1/4 первоначального объема и после охлаждения отфильтровывали выпавшие кристаллы. Фильтрат упаривали, остаток после упаривания перекристаллизовывали в циклогексане. При этом получали белые кристаллы (ВЭЖХ, % площади: кандесартана цилексетил: 76,1%, тритилкандесартана цилексетил: 1,2%, 2-оксокандесартана цилексетил: 10,9 %). Сравнительный пример 2 (WO 2005/037821, пример 5) Раствор, содержащий тритилкандесартана цилексетил (0,43 г), муравьиную кислоту (0,38 мл), хлористый метилен (1,7 мл) и метанол (0,9 мл) перемешивали 5 ч при 25 С. По прошествии указанного срока анализировали полученную смесь. ВЭЖХ % площади, 5 ч: кандесартана цилексетил: 68,1%, тритилкандесартана цилексетила: 12,4%,2-оксокандесартана цилексетил: 0,5% ВЭЖХ % площади, 7 ч: кандесартана цилексетил: 64,6%, тритилкандесартана цилексетил: 14,9%, 2 оксокандесартана цилексетил: 1,7 % ВЭЖХ % площади, 23 ч: кандесартана цилексетил: 61,6%, тритилкандесартана цилексетил: 18,4%,2-оксокандесартана цилексетил: 2,2%. Пример 1. Смесь 1,55 г (1,8 ммоль) тритилкандесартана цилексетила, 5,4 мл метанола, 22 мл хлористого метилена, 0,05 г (1,61 ммоль) ZnCl2 и 0,5 мл воды кипятили с обратным холодильником 5 ч при перемешивании. Реакционную смесь анализировали (ВЭЖХ % площади: кандесартана цилексетил: 76,3%, тритилкандесартана цилексетил: 1,8%, 2-оксокандесартана цилексетил: 0,7%, этиловый эфир кандесартана 0,09%) и остужали до комнатной температуры. Затем к смеси добавляли 36 мл хлористого метилена и 55 мл воды. Фазы разделяли, и органическую фазу промывали 255 мл воды. Затем органическую фазу осушали над Na2SO4, отфильтровывали и выпаривали до получения маслянистого остатка. Этот остаток разводили в 1,6 мл хлористого метилена, затем добавляли 16 мл изопропилацетата. Полученную смесь перемешивали 24 ч при 0 С. Продукт, выпавший в осадок, собирали фильтрованием и высушивали. Затем полученный продукт суспендировали в 5 мл трет-бутилметилового эфира. Эту смесь перемешивали в течение 2-х ч. Продукт собирали фильтрованием и сушили при 40 С в течение 2 ч в вакуумной сушилке (0,7 г). ВЭЖХ % площади: кандесартана цилексетил: 99,6%, 2-оксокандесартана цилексетил: 0,00%,этиловый эфир кандесартана 0,08%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения кандесартана цилексетила формулы (I) включающий снятие защитной группы с тетразолила в кандесартане цилексетиле с защищенным тетразолилом в смеси растворителей, состоящей из спирта и галогенированного углеводорода, в присутствии кислоты Льюиса, выбранной из группы, состоящей из трифторида бора, тригалида алюминия и дигалида цинка. 2. Способ по п.1, отличающийся тем, что защитная группа на тетразолиле представляет собой три-5 015727 фенилметильную (тритильную) защитную группу. 3. Способ по п.1, отличающийся тем, что спирт представляет собой метанол. 4. Способ по п.1, отличающийся тем, что галогенированный углеводород представляет собой хлористый метилен. 5. Способ по п.1, отличающийся тем, что реакцию проводят при температуре от 20 до 100 С. 6. Способ по п.1, отличающийся тем, что кислота Льюиса представляет собой дигалид цинка. 7. Способ по п.1, отличающийся тем, что кислота Льюиса представляет собой трифторид бора. 8. Способ по любому из пп.1, 6 и 7, отличающийся тем, что кислоту Льюиса добавляют в количестве от 0,4 до 1,5 эквивалентов, предпочтительно в количестве от 0,6 до 1,2 эквивалентов, наиболее предпочтительно в количестве от 0,7 до 1,0 эквивалента. 9. Способ получения кандесартана цилексетила, включающий:i) трансэтерификацию или этерификацию производного кандесартана с защищенным тетразолилом или кандесартана в кислотной форме с защищенным тетразолилом с получением кандесартана цилексетила с защищенным тетразолилом,ii) обработку кандесартана цилексетила с защищенным тетразолилом кислотой Льюиса, выбранной из группы, состоящей из трифторида бора, тригалида алюминия и дигалида цинка, в смеси растворителей, состоящей из спирта и галогенированного углеводорода,iii) добавление второго растворителя, предпочтительно воды, и нагревание реакционной смеси,iv) выделение полученного кандесартана цилексетила. 10. Способ получения кандесартана цилексетила, включающий:ii) обработку (+/-)-1-(циклогексилокси)карбонил]окси]этил-2-этокси-1-2'-(N-трифенилметилтетразол-5-ил)-1,1'-бифенил-4-ил]метил]-1 Н-бензимидазол-7-карбоксилата (тритилкандесартана цилексетила) кислотой Льюиса, выбранной из группы, состоящей из трифторида бора, тригалида алюминия и дигалида цинка, в смеси растворителей, состоящей из спирта и галогенированного углеводорода,iii) добавление второго растворителя, предпочтительно воды, и нагревание реакционной смеси,iv) выделение полученного кандесартана цилексетила. 11. Способ по любому из пп.9 и 10, отличающийся тем, что второй растворитель на стадии (iii),предпочтительно воду, добавляют в количестве от 0% (об./об.) до 10% (об./об.), предпочтительно от 1 до 5%. 12. Способ по любому из пп.9 и 10, отличающийся тем, что реакционную смесь нагревают до температуры от 0 до 120 С, предпочтительно до температуры кипения в течение от 0,5 до 10 ч, предпочтительно от 2 до 5 ч. 13. Способ по любому из пп.9 и 10, отличающийся тем, что на стадии (ii) в качестве растворителя для реакции используют метанол. 14. Способ по любому из пп.1, 9 и 10, отличающийся тем, что выделение полученного кандесартана цилексетила включает кристаллизацию, осаждение, лиофилизацию, экстракцию, включая экстракцию в сверхкритических состояниях либо с использованием сжатых газов, распылительную сушку, или любую другую процедуру, известную специалисту в данной области. 15. Способ по любому из пп.1, 9 и 10, отличающийся тем, что получают кандесартана цилексетил,который содержит менее чем 5000 ч./млн остаточных растворителей.
МПК / Метки
МПК: C07D 403/10
Метки: кандесартана, способ, получения, цилексетила
Код ссылки
<a href="https://eas.patents.su/7-15727-sposob-polucheniya-kandesartana-cileksetila.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения кандесартана цилексетила</a>
Предыдущий патент: Комбинированный реактивный многорежимный двигатель
Следующий патент: Ингибиторы коррозии на основе вольфрамата
Случайный патент: Способ получения сальниковых уплотнителей для полиграфических машин











