Производные гуанидина с антимикробным действием на основе диамина
Формула / Реферат
1. Применение полимерного производного гуанидина на основе диамина, где диамин содержит оксиалкиленовые цепи между двумя аминогруппами, причем производное гуанидина является продуктом поликонденсации кислотно-аддитивной гуанидиновой соли с диамином, где диамин содержит полиоксиалкиленовые цепи между двумя аминогруппами, для получения лекарственного средства, эффективного в отношении микробов.
2. Применение по п.1, отличающееся тем, что представителями ряда полиоксиалкиленгуанидиновых солей являются соли с применением триэтиленгликольдиамина (относительная молекулярная масса 148), полиоксипропилендиамина (относительная молекулярная масса 230), а также полиоксиэтилендиамина (относительная молекулярная масса 600).
3. Применение по одному из пп.1 или 2, отличающееся тем, что поли[2-(2-этоксиэтоксиэтил)гуанидингидрохлорид] содержит по меньшей мере 3 гуанидиновых остатка.
4. Применение по п.3, отличающееся тем, что средняя молекулярная масса активного вещества находится в интервале от 500 до 3000.
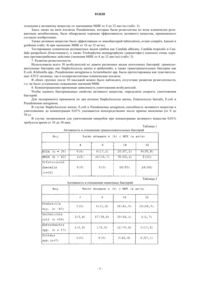
5. Применение по одному из пп.1-4, отличающееся тем, что лекарственное средство выполнено в виде ветеринарно-медицинского лекарственного средства.
Текст
012620 Изобретение относится к лекарственным средствам с антимикробным или бактерицидным действием. В последние годы разработка новых антибиотиков происходит с учетом усиливающегося развития резистентности микроорганизмов. Лечение внутрибольничных инфекций, часто обусловленных резистентными микроорганизмами, представляет собой одну из самых больших проблем больниц во всем мире. Инфекции в области дерматологии, такие как инфекции после ожогов кожи, раневые инфекции,пролежни или угри, часто требуют продолжительного лечения антибиотиками. Одновременно часто можно наблюдать развитие резистентности у штаммов стафилококков и псевдомонаса. Инфекции в желудочно-кишечном тракте, вызванные Helikobakter pylori, также часто представляют терапевтическую проблему. Кроме этого, вызывать терапевтические проблемы могут прежде всего конъюктивиты, инфекции в лор-органах и половых органах, которые вызваны бактериями или вирусами. Задачей изобретения является получение нового лекарственного средства, которое обладает повышенной эффективностью в отношении большого числа микроорганизмов. Поставленная задача решается согласно изобретению путем применения полимерного производного гуанидина на основе диамина, которое содержит оксиалкиленовые цепи между двумя аминогруппами,причем производное гуанидина является продуктом поликонденсации кислотно-аддитивной гуанидиновой соли с диамином, содержащим полиоксиалкиленовые цепи между двумя аминогруппами, а также их фармацевтически приемлемых солей для получения лекарственного средства, эффективного в отношении микробов. Далее изобретение относится к применению полиоксиалкиленгуанидиновых солей, полученных с использованием триэтиленгликольдиамина (относительная молекулярная масса 148), полиоксипропилендиамина (относительная молекулярная масса 230), а также полиоксиэтилендиамина (относительная молекулярная масса 600). В качестве активного вещества особенно предпочтителен поли[2-(2-этоксиэтоксиэтил)гуанидингидрохлорид], который содержит по меньшей мере 3 гуанидиновых остатка, причем средняя молекулярная масса составляет, в частности, от 500 до 3000 Да. Применяемые согласно изобретению полимерные производные гуанидина известны из документа РСТ/АТ 01/00134. Содержание этой публикации включается в настоящее описание ссылкой. Получение предпочтительного представителя соединения, применяемого согласно изобретению, а также доказательство антимикробной эффективности описано ниже. В качестве примера применяемого согласно изобретению класса соединений далее будет описана антимикробная эффективность поли(2-(2-этоксиэтоксиэтил)гуанидингидрохлорида) со средней молекулярной массой 1000 Да (CAS374572-91-5). Для получение этого соединения 4,43 моль гуанидингидрохлорида растворяют в 4,03 моля триэтиленгликольдиамина при 50 С. Затем нагревают до 120 С и перемешивают при этой температуре два часа. После этого температуру поддерживают 2 ч, затем помещают в вакуум (0,1 бар) и перемешивают в вакууме при 170 С еще два часа. Затем насыщают воздухом до нормального давления, оставляют остывать до 120 С и разбавляют деминерализованной водой до примерно 50%. С помощью фосфорной кислоты нейтрализуют до рН 6, оставляют остывать и разбавляют до желаемой концентрации. Определено, что молекулярный вес составляет 1000 Да. Активное вещество поли(2-(2-этоксиэтоксиэтил)гуанидингидрохлорид) при пониженной токсичности и хорошей переносимости с фармакологической точки зрения обладает благоприятными фармакодинамическими свойствами и может поэтому применяться как лекарственное средство в антимикробной терапии. В частности, активное вещество отличается отличной антимикробной эффективностью, которую удалось продемонстрировать исследованиями на большом числе микроорганизмов, таких как полирезистентные бактерии (которые устойчивы к обычным антибиотикам), грибки (бластомицеты, дерматофиты, плесневые грибы) и вирусы, как простой герпес. Благодаря быстрому бактерицидному действию развитие резистентности маловероятно, что показали также исследования на большом числе штаммов бактерий (30 видов бактерий и 30 пассажей). После системного введения (внутривенно или внутрибрюшинно) поли(2-(2-этоксиэтоксиэтил)гуанидингидрохлорида) в количествах до 15 мг/кг веса тела измеренная через два часа концентрация в сыворотке крови у крыс составляла до 100 мкг/мл при одновременно хорошей переносимости. Эти концентрации намного превышают ожидаемый необходимый уровень при терапевтическом применении. В то же время хорошая переносимость наблюдалась и при этой высокой дозировке, смертности или серьезных побочных эффектов не наблюдалось. Показано, что поли(2-(2-этоксиэтоксиэтил)гуанидингидрохлорид) может применяться как антимикробное средство. В качестве лечебного средства активное вещество может вводиться в подходящих лечебных формах самостоятельно или вместе с неорганическими или органическими, фармакологически индифферентными вспомогательными веществами. Например, вещество может применяться как компонент мази или раствора, при этом концентрация в мази может составлять примерно от 0,01 до 5 г активного вещества на 1 г мази, а в растворе вплоть до концентрации 15 мг/кг веса тела. Благодаря названным благоприят-1 012620 ным фармакологическим свойствам применение в качестве мази или раствора может рассматриваться как благоприятное при множестве показаний. Речь идет, в частности, об инфекциях кожи, слизистой оболочки, глаз или желудочно-кишечного тракта. В этих областях активное вещество согласно изобретению может тем самым вносить существенный вклад в предотвращение резистентности к антибиотикам. Антимикробная активность. Для проверки на антимикробную активность были протестированы 334 микроорганизма, клинически релевантные изоляты и штаммы АТСС (как контрольные микроорганизмы) на их минимальную ингибирующую концентрацию (МНК). Далее проверяли концентрационно-временную зависимость уничтожения микроорганизмов (killing curves) и, кроме того, возможность развития резистентности. 1. Микроорганизмы. Всего использовали 323 бактерии различных видов, 10 бластомицетов, а также один дерматофит. Протестированные микроорганизмы выделяли из дыхательных путей, мочеполовых путей, из крови и другого биологического материала пациентов по стандартным лабораторным методам и точно охарактеризовывали. 2. Тестируемые вещества. В качестве маточного раствора применяли вышеописанный поли[С 2-(2-этокси)этоксиэтил)гуанидинхлорид] (молекулярная масса 1000 Да) в 25%-ном водном растворе. Его разбавляли стерильной водой до соответствующих готовых к употреблению концентраций. Тестируемые вещества хранили при комнатной температуре. 3. Определение минимальной ингибирующей концентрации (МИК). Проверка активности тестируемых веществ проводится методом микроразбавления в бульоне Мюллера-Хинтон по инструкции NCCLS. Микробный инокулюм содержит по меньшей мере 5105 КОЕ/мл, инкубирование проводят от 16 до 20 ч при 36 С в атмосфере окружающего воздуха. Активное вещество применяли в концентрациях от 1000 мкг/мл до 0,001 мг/мл. Самая низкая концентрация активного вещества, при которой бактериальный рост не наблюдался,определялась как МИК. С каждым тестируемым веществом одновременно тестировали контрольные штаммы АТСС-качества с известными МИК. 4. Развитие резистентности. Для экспериментов по развитию резистентности применяли 30 штаммов бактерий на основе значений МИК: грамположительные бактерии: MSSA (n=1), MRSA (n=2), MRSE (n=4), VRE (n=5), S. aureus ATCC 29213. Грамотрицательные бактерии: полирезистентные E.coli (n=4), Klebsiella pneumoniae (n=1), Klebsiellaoxytoca (n=1), Pseudomonas aeruginosa (n=4), полирезистентные Pseudomonas aeruginosa (n=4), Acinetobacter sp. (n=2) и E.coli ATCC 35218 и 25922. Все штаммы выдерживали в течение 24 ч с тестируемым веществом в концентрациях от 1000 до 0,001 мкг/мл. Пробирки, в которых был констатирован рост бактерий после первого пассажа,применяли как инокулюм для второго пассажа. Для каждого штамма бактерий проводили 30 пассажей,причем новую МИК всегда сравнивали с МИК в начале эксперимента (1-й пассаж). 5. Концентрационно-временная зависимость уничтожения бактерий. Чтобы определить бактерицидный потенциал активного вещества, применяли, соответственно, по два полирезистентных штамма стафилококков, энтерококков, E.coli и Pseudomonas aerugincsa. Скорость уничтожения проверяли после введения (время=0) бактериальной суспензии (от 1106 до 6 510 КОЕ/мл) и через 2, 5, 10 и 30 мин. В этих экспериментах определяли количественное уменьшение числа бактерий в каждый момент времени и при каждой концентрации. Активное вещество применяли в концентрациях 10, 1, 0,1 и 0,001%. В качестве контроля всегда имели также ряд без активного вещества. 6. Минимальная ингибирующая концентрация (МИК). Результаты проверки МИК приведены в табл. 1-5. В случае Staphylococcus aureus и Staphylococcus epidermidis активное вещество независимо от профиля резистентности изолята к антибиотикам показывает очень хорошее действие со значениями МИК от 4 до 32 мкг/мл. Полирезистентные стафилококки (MRSA) также обнаруживают МИК в этом диапазоне (табл. 1). Аналогично, тестирование показало для Enterococcus faecalis значения МИК от 16 до 32 мкг/мл(табл. 1), причем опять полирезистентные и резистентные к ванкомицину штаммы энтерококка (n=5) не отличались от чувствительных изолятов.Enterobacteriacae: активное вещество показало очень хорошие результаты против E.coli, Klebsiellaspecies, Enterobacter species и Proteus mirabilis со значениями МИК от 4 до 32 мкг/мл (табл. 2). Очень хорошее влияние было также на протестированные сальмонеллы, шигеллы и Yersinia enterocolitica (табл. 3). Неферментная группа, Pseudomonas aeruginosa и Acinetobacter species, также показали себя чувстви-2 012620 тельными к активному веществу со значениями МИК от 4 до 32 мкг/мл (табл. 3). Здесь также на пяти изолятах Pseudomonas, которые были резистентны ко всем клинически релевантным антибиотикам, была обнаружена хорошая эффективность активного вещества, применяемого согласно изобретению. Также активное вещество было эффективным от микобактерий tuberculosis, avium complex, kansaii иgordonae (табл. 4) при значениях МИК от 16 до 32 мг/мл. Тестирование клинически релевантных видов грибов как Candida albicans, Candida tropicalis и Candida parapsilosis (бластомицет), а также Trichophyton mentagrophytes (дерматофит) показало очень хорошее противогрибковое действие (значения МИК от 8 до 32 мкг/мл) (табл. 5). 7. Развитие резистентности. Использовали всего 30 возбудителей из девяти различных видов патогенных бактерий: грамположительные бактерии как Staphylococcus aureus и epidermidis, а также грамотрицательные бактерии какE.coli, Klebsiella spp., Pseudomonas aeruginosa и Acinetobacter spp. Были протестированы как чувствительные АТСС-штаммы, так и полирезистентные клинические изоляты. В обеих группах после 30 пассажей можно было наблюдать отсутствие развития резистентности,т.е. не было установлено повышения значений МИК. 8. Концентрационно-временная зависимость уничтожения возбудителей. Чтобы оценить бактерицидные свойства активного вещества, определяли скорость уничтожения бактерий. Для эксперимента применяли по два штамма Staphylococcus aureus, Enterococcus faecalis, E.coli иPseudomonas aeruginosa. В случае Staphylococcus aureus, E.coli и Pseudomonas aeruginosa способность активного вещества к уничтожению до концентрации 0,01% указывается непосредственно после приема иноклюма (от 0 до 30 с). В случае энтерококков для уничтожения микробов при концентрации активного вещества 0,01% требуется время от 10 до 30 мин. Таблица 1 Активность в отношении грамположительных бактерий Клиническая эффективность. Чтобы хорошую in-vitro активность активного вещества подтвердить in-vivo, вещество применяли в клинических условиях на пациентах-добровольцах с проблемными инфекциями. Вещество применяли в виде водного раствора или в гелевой форме с 0,5%-ной концентрацией. Пациенты. Лечение активным веществом получили 12 пациентов в возрасте от 35 до 62 лет: 2 пациента с хроническим гастритом (Helicobacter pylori положительные) 3 пациента с хроническим воспалением десен и слизистой оболочки рта 3 пациента с хроническим воспалением слизистой оболочки влагалища 1 пациент с гангреной ноги 3 пациента с онихомикозом (1 пациент с микозом рук, 2 пациента с микозом ног) Результаты. Клиническая эффективность активного вещества у 12 выбранных пациентов обобщенно представлена в табл. 6. Также можно видеть вид лечения, продолжительность лечения, клинические ведущие симптомы и клинический успех.-4 012620 Показано, что во всех 12 случаях после лечения в течение от 2 до 28 дней наблюдалась убедительная клиническая эффективность. Доходило до отчетливого улучшения ведущих симптомов при одновременно отличной местной переносимости. Ни в одном из случаев не встречались побочные эффекты, такие как покраснения, раздражения или тошнота. Таблица 6 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение полимерного производного гуанидина на основе диамина, где диамин содержит оксиалкиленовые цепи между двумя аминогруппами, причем производное гуанидина является продуктом поликонденсации кислотно-аддитивной гуанидиновой соли с диамином, где диамин содержит полиоксиалкиленовые цепи между двумя аминогруппами, для получения лекарственного средства, эффективного в отношении микробов. 2. Применение по п.1, отличающееся тем, что представителями ряда полиоксиалкиленгуанидиновых солей являются соли с применением триэтиленгликольдиамина (относительная молекулярная масса 148), полиоксипропилендиамина (относительная молекулярная масса 230), а также полиоксиэтилендиамина (относительная молекулярная масса 600). 3. Применение по одному из пп.1 или 2, отличающееся тем, что поли[2-(2-этоксиэтоксиэтил)гуанидингидрохлорид] содержит по меньшей мере 3 гуанидиновых остатка. 4. Применение по п.3, отличающееся тем, что средняя молекулярная масса активного вещества находится в интервале от 500 до 3000. 5. Применение по одному из пп.1-4, отличающееся тем, что лекарственное средство выполнено в виде ветеринарно-медицинского лекарственного средства.
МПК / Метки
МПК: A61P 31/10, A61P 31/04, A61K 31/155
Метки: гуанидина, действием, производные, основе, диамина, антимикробным
Код ссылки
<a href="https://eas.patents.su/6-12620-proizvodnye-guanidina-s-antimikrobnym-dejjstviem-na-osnove-diamina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные гуанидина с антимикробным действием на основе диамина</a>