Применение cd23 антагонистов для лечения опухолевых заболеваний
Номер патента: 7467
Опубликовано: 27.10.2006
Авторы: Патхан Нузхат, Харихаран Кундасуми, Ханна Набил, Браславски Гари Р.
Формула / Реферат
1. Способ лечения опухолевого заболевания у млекопитающего, нуждающегося в этом, включающий введение терапевтически эффективного количества CD23 антагониста указанному млекопитающему.
2. Способ по п.1, где указанный CD23 антагонист выбирают из группы, состоящей из CD23 реактивных полипептидов, CD23 реактивных пептидов, CD23 реактивных небольших молекул и их комбинаций.
3. Способ по п.2, где указанный CD23 реактивный полипептид включает моноклональное антитело или поликлональное антитело.
4. Способ по п.3, где указанный CD23 реактивный полипептид включает моноклональное антитело.
5. Способ по п.4, где указанное моноклональное антитело выбирают из группы, состоящей из химерных антител и антител, подобных антителам человека.
6. Способ по п.5, где указанное моноклональное антитело является химерным антителом и указанное химерное антитело является антителом, подобным антителу человека.
7. Способ по п.6, где указанным антителом, подобным антителу человека, является IDЕС-152.
8. Способ по п.7, где указанное опухолевое заболевание выбирают из группы, состоящей из повторного заболевания Ходкина, резистентного заболевания Ходкина, лимфомы высокой степени, низкой степени и средней степени, отличной от лимфомы Ходкина, В-клеточной хронической лимфоцитной лейкемии (B-CLL), лимфоплазмацитозной лимфомы (LPL), покрытой клеточной лимфомы (MCL), фолликулярной лимфомы (FL), диффузионной обширной клеточной лимфомы (DLCL), лимфомы Буркитта (BL), связанной со СПИДом лимфомы, моноцитной В-клеточной лимфомы, ангиоиммунобластомной лимфоаденопатии, небольшой лимфоцитной, фолликулярной, диффузионной обширной клеточной, диффузионной небольшой расщепляющейся клеточной, обширной клеточной иммунобластомной лимфобластомной, небольшой, нерасщепляющейся, Буркитта и не Буркитта, фолликулярной, преимущественно обширной клеточной, фолликулярной, преимущественно небольшой расщепляющейся клеточной и фолликулярной, смешанной небольшой расщепляющейся и обширной клеточной лимфомы.
9. Способ по п.8, где указанным опухолевым заболеванием является В-клеточная хроническая лимфоцитная лейкемия (B-CLL).
10. Способ по п.1, где указанное опухолевое заболевание выбирают из группы, состоящей из повторного заболевания Ходкина, резистентного заболевания Ходкина, лимфомы высокой степени, низкой степени и средней степени, отличной от лимфомы Ходкина, В-клеточной хронической лимфоцитной лейкемии (B-CLL), лимфоплазмацитозной лимфомы (LPL), покрытой клеточной лимфомы (MCL), фолликулярной лимфомы (FL), диффузионной обширной клеточной лимфомы (DLCL), лимфомы Буркитта (BL), связанной со СПИДом лимфомы, моноцитной В-клеточной лимфомы, ангиоиммунобластомной лимфоаденопатии, небольшой лимфоцитной; фолликулярной, диффузионной обширной клеточной, диффузионной небольшой расщепляющейся клеточной, обширной клеточной иммунобластомной лимфобластомной, небольшой, нерасщепляющейся, Буркитта и не Буркитта, фолликулярной, преимущественно обширной клеточной, фолликулярной, преимущественно небольшой расщепляющейся клеточной и фолликулярной, смешанной небольшой расщепляющейся и обширной клеточной лимфомы.
11. Способ по п.10, где указанным опухолевым заболеванием является В-клеточная хроническая лимфоцитная лейкемия (B-CLL).
12. Способ по п.1, где указанный CD23 антагонист связан с цитотоксическим агентом.
13. Способ по п.12, где указанный цитотоксический агент является радиоизотопом.
14. Способ по п.1, также включающий стадию введения химиотерапевтического агента.
15. Способ по п.14, где указанный химиотерапевтический агент включает антитело.
16. Способ по п.15, где указанное антитело реагирует или связывается с CD19, CD20, CD22, CD40, CD40L, CD52 или В7.
17. Способ по п.14, где указанный химиотерапевтический агент включает флударабин.
18. Способ лечения опухолевого заболевания у млекопитающего, включающий следующие стадии:
введение терапевтически эффективного количества по крайней мере одного химиотерапевтического агента указанному млекопитающему; и
введение терапевтически эффективного количества по крайней мере одного CD23 антагониста указанному пациенту,
где указанный химиотерапевтический агент и указанный CD23 антагонист могут вводиться в любом порядке или конкурентно.
19. Способ по п.18, где указанный CD23 антагонист выбирают из группы, состоящей из CD23 реактивных полипептидов, CD23 реактивных пептидов, CD23 реактивных небольших молекул и их комбинаций.
20. Способ по п.19, где указанный CD23 реактивный полипептид включает моноклональное антитело или поликлональное антитело.
21. Способ по п.20, где указанный CD23 реактивный полипептид включает моноклональное антитело.
22. Способ по п.21, где указанное моноклональное антитело выбирают из группы, состоящей из химерных антител и антител, подобных антителам человека.
23. Способ по п.22, где указанным моноклональным антителом является IDEC-152.
24. Способ по п.18, где указанный химиотерапевтический агент включает антитело.
25. Способ по п.24, где указанное антитело реагирует или связывается с CD19, CD20, CD22, CD40, CD40L, CD52 или В7.
26. Способ по п.18, где указанное опухолевое заболевание выбирают из группы, состоящей из повторного заболевания Ходкина, резистентного заболевания Ходкина, лимфомы высокой степени, низкой степени и средней степени, отличной от лимфомы Ходкина, В-клеточной хронической лимфоцитной лейкемии (B-CLL), лимфоплазмацитозной лимфомы (LPL), покрытой клеточной лимфомы (MCL), фолликулярной лимфомы (FL), диффузионной обширной клеточной лимфомы (DLCL), лимфомы Буркитта (BL), связанной со СПИДом лимфомы, моноцитной В-клеточной лимфомы, ангиоиммунобластомной лимфоаденопатии, небольшой лимфоцитной, фолликулярной, диффузионной обширной клеточной, диффузионной небольшой расщепляющейся клеточной, обширной клеточной иммунобластомной лимфобластомной, небольшой, нерасщепляющейся, Буркитта и не Буркитта, фолликулярной, преимущественно обширной клеточной, фолликулярной, преимущественно небольшой расщепляющейся клеточной и фолликулярной, смешанной небольшой расщепляющейся и обширной клеточной лимфомы.
27. Способ по п.18, где указанным опухолевым заболеванием является В-клеточная хроническая лимфоцитная лейкемия (B-CLL).
28. Способ лечения В-клеточной хронической лимфоцитной лейкемии (B-CLL) у млекопитающего, нуждающегося в этом, включающий введение терапевтически эффективного количества CD23 антагониста указанному млекопитающему.
29. Способ по п.28, где указанный CD23 антагонист выбирают из группы, состоящей из CD23 реактивных полипептидов, CD23 реактивных пептидов, CD23 реактивных небольших молекул и их комбинаций.
30. Способ по п.29, где указанный CD23 реактивный полипептид включает моноклональное антитело или поликлональное антитело.
31. Способ по п.30, где указанный CD23 реактивный полипептид включает моноклональное антитело.
32. Способ по п.31, где указанное моноклональное антитело выбирают из группы, состоящей из химерных антител и антител, подобных антителам человека.
33. Способ по п.32, где указанным моноклональным антителом является IDEC-152.
34. Способ по п.28, также включающий стадию введения химиотерапевтического агента.
35. Способ по п.32, где указанный химиотерапевтический агент включает антитело.
36. Способ по п.35, где указанное антитело реагирует или связывается с CD19, CD20, CD22, CD40, CD40L, CD52 или В7.
37. Способ по п.34, где указанный химиотерапевтический агент включает флударабин.
38. Способ лечения опухолевого заболевания у млекопитающего, включающий следующие стадии:
введение терапевтически эффективного количества ритуксана указанному млекопитающему и
введение терапевтически эффективного количества IDEC-152 указанному млекопитающему,
где указанный Ритуксан и указанный IDEC-152 могут вводиться в любом порядке или конкурентно.
39. Способ по п.38, где указанное опухолевое заболевание выбирают из группы, состоящей из повторного заболевания Ходкина, резистентного заболевания Ходкина, лимфомы высокой степени, низкой степени и средэхщ степени, отличной от лимфомы Ходкина, В-клеточной хронической лимфоцитной лейкемии (B-CLL), лимфоплазмацитозной лимфомы (LPL), покрытой клеточной лимфомы (MCL), фолликулярной лимфомы (FL), диффузионной обширной клеточной лимфомы (DLCL), лимфомы Буркитта (BL), связанной со СПИДом лимфомы, моноцитной В-клеточной лимфомы, ангиоиммунобластомной лимфоаденопатии, небольшой лимфоцитной, фолликулярной, диффузионной обширной клеточной, диффузионной небольшой расщепляющейся клеточной, обширной клеточной иммунобластомной лимфобластомной, небольшой, нерасщепляющейся, Буркитта и не Буркитта, фолликулярной, преимущественно обширной клеточной, фолликулярной, преимущественно небольшой расщепляющейся клеточной и фолликулярной, смешанной небольшой расщепляющейся и обширной клеточной лимфомы.
40. Способ по п.38, где указанным опухолевым заболеванием является В-клеточная хроническая лимфоцитная лейкемия (B-CLL).
41. Способ индуцирования апоптоза в злокачественных клетках, включающий контактирование указанных злокачественных клеток с индуцирующим апоптоз количеством CD23 антагониста.
42. Способ по п.41, где указанный CD23 антагонист выбирают из группы, состоящей из CD23 реактивных полипептидов, CD23 реактивных пептидов, CD23 реактивных небольших молекул и их комбинаций.
43. Способ по п.41, где указанный CD23 реактивный полипептид включает моноклональное антитело или поликлональное антитело.
44. Способ по п.43, где указанный CD23 реактивный полипептид включает моноклональное антитело.
45. Способ по п.44, где указанное моноклональное антитело выбирают из группы, состоящей из химерных антител и антител, подобных антителам человека.
46. Способ по п.44, где указанным моноклональным антителом является IDEC-152.
47. Способ по п.41, также включающий стадию контактирования указанных злокачественных клеток с химиотерапевтическим агентом.
48. Способ по п.47, где указанный химиотерапевтический агент включает антитело.
49. Способ по п.48, где указанное антитело реагирует или связывается с CD19, CD20, CD22, CD40, CD40L, CD52 или В7.
50. Способ по п.41, где указанные злокачественные клетки контактируют in vivo.
51. Набор, пригодный для лечения млекопитающего, страдающего или предрасположенного к опухолевому заболеванию, включающий по крайней мере одну емкость с расположенным в нем CD23 антагонистом и этикеткой или инструкцией, указывающей, что указанный CD23 антагонист может использоваться для лечения указанного опухолевого заболевания.
52. Набор по п.51, где указанным опухолевым заболеванием является В-клеточная хроническая лимфоцитная лейкемия (B-CLL).
53. Набор по п.51, где указанным CD23 антагонистом является моноклональное антитело.
54. Набор по п.53, где указанным моноклональным антителом является IDEC-152.
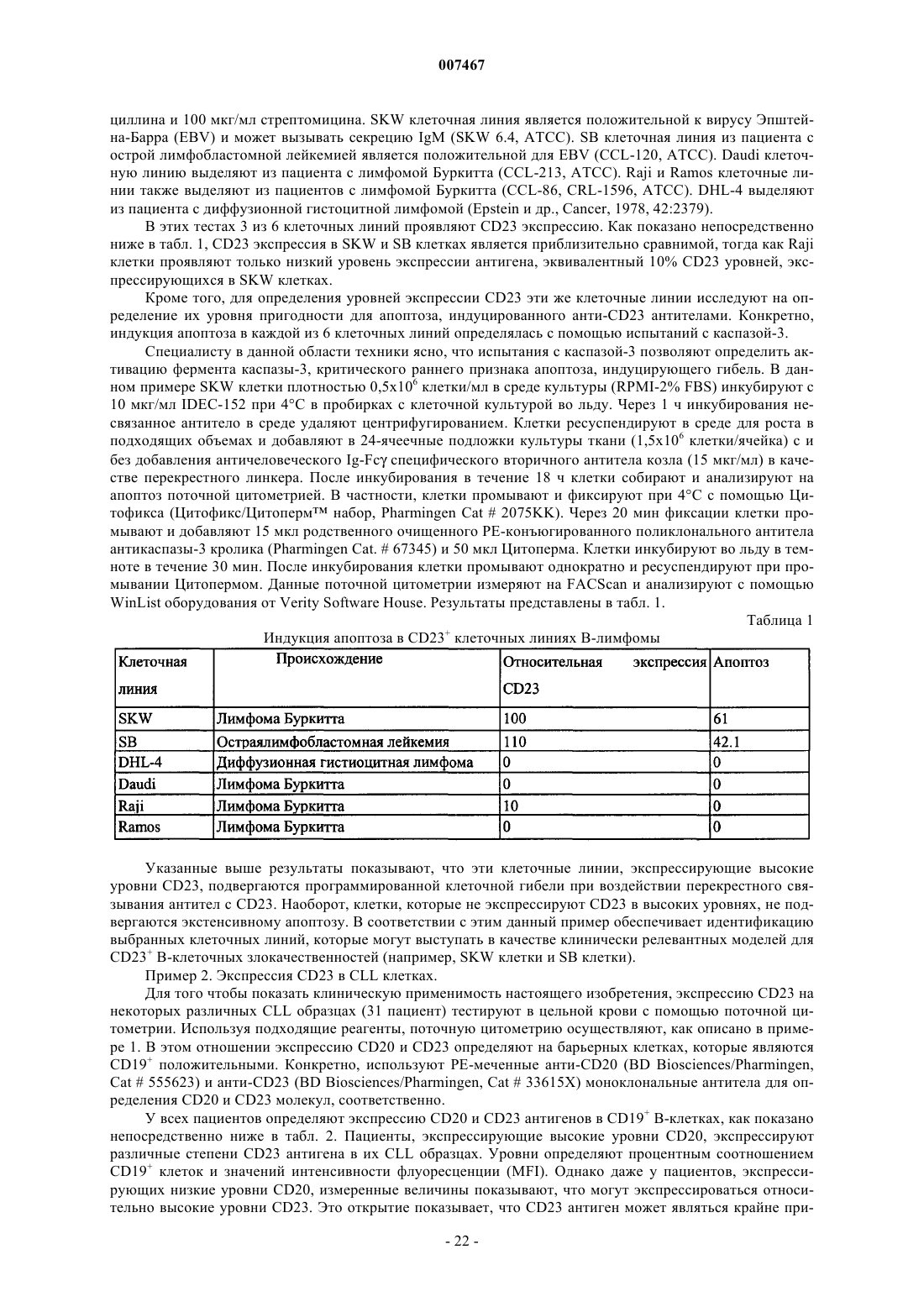
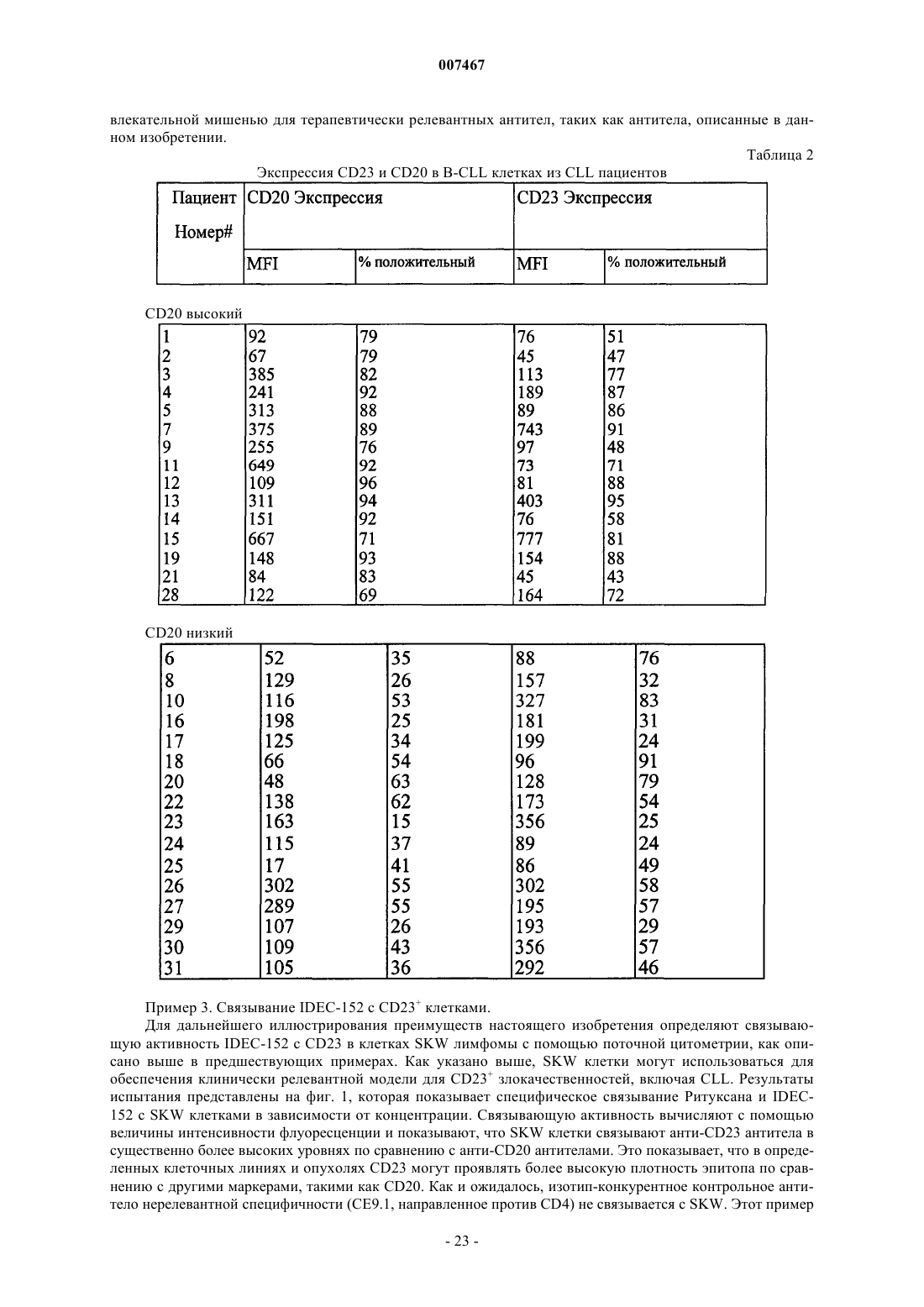
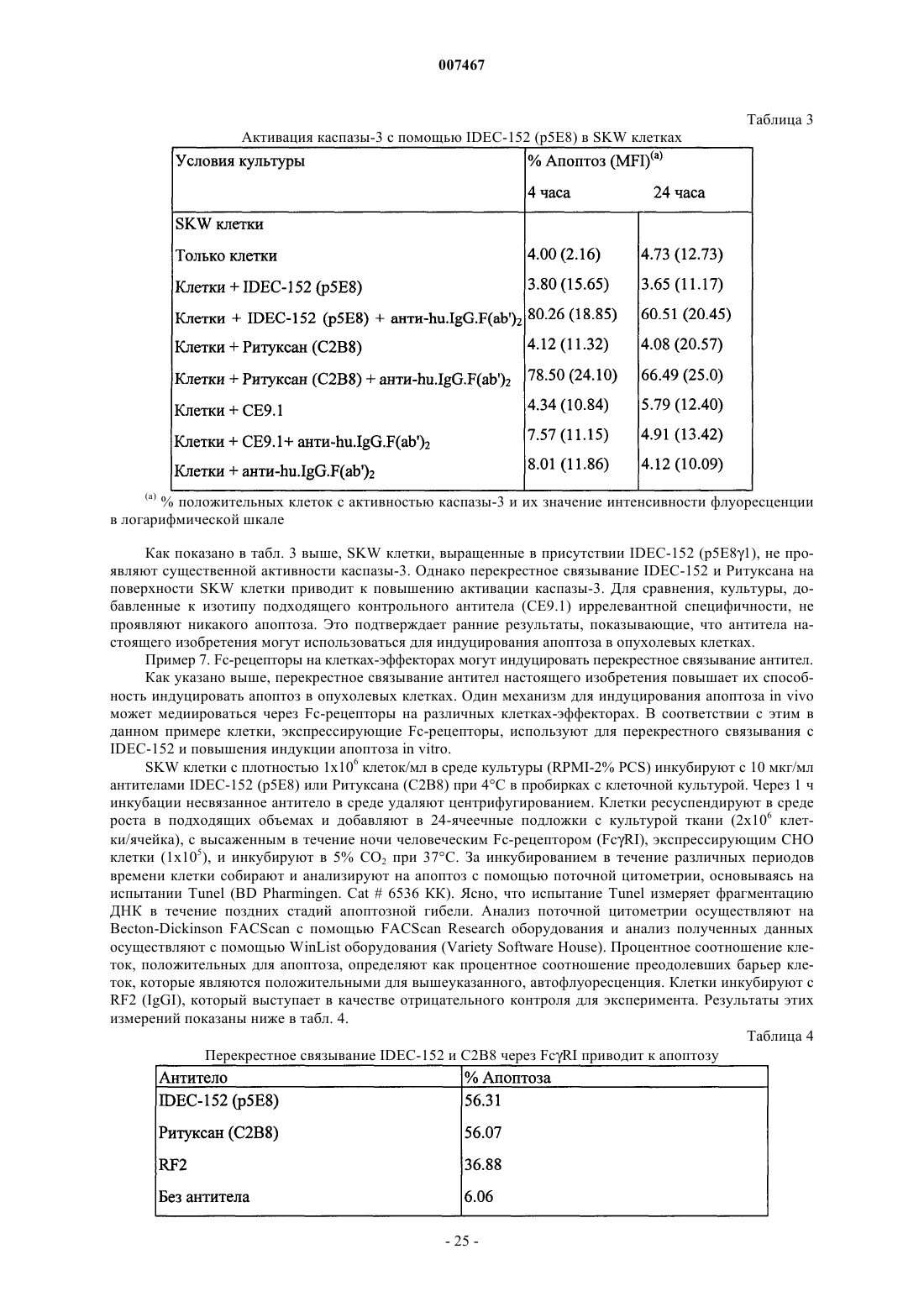
Текст
007467 Ссылки на приоритетные заявки Эта заявка является продолжением заявки US 09/772,938, поданной 31.01.2001, US 09/855,717, поданной 16.05.2001, и US 09/985,646, поданной 05.11.2001, каждая из которых приведена во всей ее полноте в качестве ссылки. Область изобретения В широком аспекте настоящее изобретение относится к применению CD23 антагонистов для лечения опухолевых заболеваний. В предпочтительных воплощениях настоящее изобретение относится к применению анти-СD23 антител для иммунотерапевтического лечения злокачественностей, включая Вклеточную хроническую лимфоцитную лейкемию (B-CLL). Предпосылки изобретения Пациенты, страдающие от относительно различных злокачественных опухолей, заинтересованы в успехе при лечении рака в течение последних нескольких декад. К сожалению, хотя современное лечение имеет значительно повышенные скорости облегчения и увеличение времени жизни, большинство пациентов продолжают погибать от болезни. Барьеры для достижения хотя бы небольших улучшенных результатов включают резистентность раковых клеток и неприемлемую токсичность (например, токсичность в отношении костного мозга) доступного лечения, что ограничивает оптимальную цитотоксическую дозировку и часто делает текущее лечение неприемлемым для иммунокомпромиссных, ослабленных или пожилых пациентов. Эти ограничения являются особенно существенными при попытке защитить пациентов, которые подвергались предшествующему лечению или имеют рецидив. Следовательно,остается потребность разработки менее токсичных, но более эффективных селективных лекарственных средств. Одна попытка повышения эффективности таких лекарственных средств включает применение терапевтических антител для уменьшения нежелательной перекрестной реактивности и увеличения локализации в клетках опухоли одного или более цитотоксических агентов. Идея привлечения антител к использованию для лечения опухолевых заболеваний возникла, по меньшей мере, в 1953 году, когда было показано, что антитела могут использоваться для специфической мишени раковых клеток. Однако это была плодотворная работа Kohler и Milsteim в гибридомной технологии, которая позволила в дальнейшем предложить моноклональные антитела, которые специфически связываются с определенным антигеном. До 1979 года моноклональные антитела (МАт) использовались для лечения злокачественных заболеваний у человека. Позднее были получены три неконъюгированных моноклональных антитела:Rituxan и Herceptin для лечения лимфомы, отличной от лимфомы Ходкина и рака груди, соответственно. В настоящее время множество моноклональных антител, конъюгированных с различными цитотоксическими агентами (например, радиоизотопами или белковыми токсинами), проходят клинические испытания в отношении лечения различных злокачественных опухолей. За последнюю декаду был получен широкий ряд специфичных к опухоли антител и фрагментов антител, а также были разработаны способы конъюгирования антител с лекарственными средствами, токсинами, радионуклидами или другими агентами для введения конъюгатов пациентам. Эти попытки выглядят многообещающими, однако, множество различных неожиданных проблем ограничивают диагностику и терапевтическую применимость некоторых реагентов, требуя дальнейшей разработки. Например, среди наиболее трудных проблем существует проблема, которая вызывается самой иммунной системой человека. Во многих случаях иммунная система человека может реагировать на конъюгат-мишень как на чужеродный антиген. Это доказывается пациентами, которых лечили лекарственными средствами или радионуклидами в комплексе с мышиными моноклональными антителами (которые наиболее широко используются в качестве антител-мишеней для человека, проявляют циркулирование человеческих антимышиных антител (НАМА) и общую немедленную реакцию гиперчувствительности III типа к группе антитела конъюгата). Более того, даже когда неблагоприятные побочные эффекты являются минимальными (например, в случае однократного введения), циркулирование НАМА снижает эффективную концентрацию агента-мишени у пациента и, следовательно, ограничивает достижение диагностического или терапевтического агента сайта-мишени. Одним рядом особенно привлекательных мишеней для направленной иммунотерапии являются гематологические злокачественности. Гематологические злокачественности включают лимфомы и лейкемии, которые, во многих случаях, являются более доступными для разносимых кровью химиотерапевтических средств, таких как моноклональные антитела, по сравнению с другими типами опухолей. В то время как ритуксан, как было показано, является эффективным для лечения некоторых из этих типов злокачественностей (особенно лимфомы, отличной от лимфомы Ходкина), остается множество гематологических злокачественностей, для которых не существует общедоступного эффективного лечения. Среди этих злокачественностей находится хроническая лимфоцитная лейкемия. Хроническая лимфоцитная лейкемия (CLL или B-CLL) является, прежде всего, заболеванием людей преклонного возраста, которое усиливается после пятидесятилетнего возраста и достигает пика в конце шестидесятилетнего возраста. Обычно включает пролиферацию опухолевых периферических лимфоцитов крови. В США было установлено, что в 1998 году было диагностировано 7300 новых случаев CLL и 4900 пациентов умерло от этого заболевания, составляя 30% лейкемий в западных странах (Young иPercy и др., 1981 NIH Monograph 57; Cancer Facts and Figures, 1988, American Cancer Society Publication,Atlanta GA). Клиническое проявление CLL включает лимфоцитоз, лимфоденопатию, спленомегалию,анемию и тромбоцитопению. Характерной особенностью CLL является моноклональная В-клеточная пролиферация и накопление В-лимфоцитов, задерживаемых в промужеточном состоянии дифференциации (Dighiero и Travade и др., 1991, Blood 78:1901: Gale and Foon. 1985. Ann. Intern. Med. 103:101). Такие В-клетки экспрессируют поверхностный IgM (sIgM) или оба sIgM и sIgD и единичную легкую цепь с более низкой плотностью по сравнению с нормальными В-клетками. CLL В-клетки также отражают некоторые антигены лейкоцита человека, включая CD5, CD19, CD20, CD21, CD23, CD38 и CD64 (Foon иTodd. 986. Blood 1:1). Хотя aнти-CD20 антитело Ритуксан используется с некоторым успехом, анализ пациентов с CLL показывает, что плотность CD20 антигена на CLL В-клетках сильно отличается от некоторых В-клеток пациента, экспрессирующих очень низкие уровни CD20 антигена. Наоборот, экспрессия CD23, как было обнаружено, соответственно присутствует в более высоких уровнях в B-CLL. Антиген CD23 дифференциации лейкоцита представляет собой 45 кДа трансмембранный гликопротеин II типа, экспрессирующийся на некоторых клетках гематопоэтического происхождения, который действует как рецептор низкого сродства для IgE (FcRII) (Spkigelberg, 1984. Adv. Immunol. 35:61; Kikulani и Siiemura и др. 1986, J. Exp. Med. 164; 1455; Delespesse и Suter и др. 1991. Adv. Immunol. 49:149; Delespesse и Sarfati и др. 1992. Immunol. Rev.125:77). Он является членом лектинового семейства С-типа и содержит-спиральную виток-виточную основу между связующим доменом внеклеточного лецитина и трансмембранной областью. Предполагается, что структура основы способствует олигомеризации мембранного связывания CD23 в тример в процессе связывания с его лигандом (например, IgE). В процессе протеолиза мембранное связывание CD23 приводит к некоторым растворимым типам CD23 (sCD23) молекулярного веса (37 кДа, 29 кДа и 16 кДа). Циркулирование sCD23 обнаружено в области клинических состояний при низких концентрациях в сыворотке (5 нг/мл), включая CLL, ревматоидный артрит и аллергию. При CLL уровни sCD23 в сыворотке соотносятся с тяжестью опухоли и, следовательно, с клиническим состоянием заболевания (Sarfati и Вrоn и др. 1988. Blood 71:94). Было показано, что sCD23, особенно типы 25 кДа, а) действуют в качестве аутокринного фактора в некоторых вирусах Эпштейна-Барра,трансформированных зрелыми В-клеточными линиями, b) действуют в качестве дифференцирующего фактора для протимоцитов и с) предотвращают апоптоз (программируемую смерть клетки) зародышевых центральных В-клеток, возможно посредством индукции bcl-2 экспрессии. Кроме обычного лечения Ритуксаном для В-клеточных злокачественностей применяют введение радиационной терапии и химиотерапевтических агентов. В случае CLL для уничтожения злокачественных клеток используют обычную внешнюю радиационную терапию. Однако побочные эффекты являются ограничивающим фактором для лечения. Другим широко использующимся лечением гематологической злокачественности является химиотерапия. Комбинированная химиотерапия имеет некоторый успех для достижения частичного или полного облегчения. К сожалению, эти полученные облегчения от химиотерапии часто являются непродолжительными. Таким образом, объектом настоящего изобретения являются низкотоксичные соединения и способы, которые могут использоваться для доставки к опухолевым клеткам. Другим объектом изобретения являются соединения и способы, которые могут эффективно использоваться для лечения опухолевых заболеваний и особенно хронической лимфоцитной лейкемии у пациентов, нуждающихся в этом. Сущность изобретения Эти и другие объекты относятся к настоящему изобретению, которое, в широком смысле, относится к способам, изделиям производства, соединениям и композициям, которые могут использоваться для лечения опухолевых заболеваний. С этой стороны настоящее изобретение относится к CD23 антагонистам, которые могут использоваться для лечения пациентов, страдающих от различных видов рака. Так,одним аспектом настоящего изобретения является способ лечения опухолевого заболевания у млекопитающего, нуждающегося в этом, включающий введение терапевтически эффективного количества CD23 антагониста указанному млекопитающему. Как будет подробно описано ниже, CD23 антагонисты могут включать любой лиганд, полипептид, пептид, антитело или небольшую молекулу, которая взаимодействует, связывается или ассоциирует с CD23 антигеном, экспрессирующимся на В-клетках, и устраняет,понижает, ингибирует или контролирует рост опухолевых клеток. В предпочтительных воплощенияхCD23 антагонисты настоящего изобретения включают анти-СD23 антитела, такие как IDЕС-152. В этом отношении неожиданно было обнаружено, что такие антагонисты могут использоваться для индуцирования апоптоза в опухолевых клетках. В соответствии с этим другой аспект настоящего изобретения включает способ индуцирования апоптоза в злокачественных клетках, включающий контактирование указанных злокачественных клеток с индуцирующим апоптоз количеством CD23 антагониста. Кроме того, подробно описанные ниже CD23 антагонисты могут использоваться в неконъюгированном состоянии или конъюгироваться с цитотоксическими агентами, такими как радиоизотопы. Хотя CD23 антагонисты являются эффективными противоопухолевыми агентами сами по себе, они могут также использоваться синергетически в сочетании с различными химиотерапевтическими агента-2 007467 ми. Так, другой аспект изобретения включает способ лечения опухолевых заболеваний у млекопитающего, включающий следующие стадии: введение терапевтически эффективного количества по крайней мере одного химиотерапевтического агента указанному млекопитающему; и введение терапевтически эффективного количества по крайней мере одного CD23 антагониста указанному пациенту, где указанный химиотерапевтический агент и указанный CD23 антагонист могут вводиться в любом порядке или конкурентно. Хотя CD23 антагонисты могут использоваться в сочетании с рядом химиотерапевтических агентов,предпочтительные воплощения изобретения включают применение выбранного CD23 антагониста с анти-СD20 антителом Ритуксаном. В этом отношении другой аспект изобретения включает способ лечения опухолевых заболеваний у млекопитающего, включающий следующие стадии: введение терапевтически эффективного количества Ритуксана указанному млекопитающему; и введение терапевтически эффективного количества IDEC-152 указанному млекопитающему, где указанный Ритуксан и указанный IDEC-152 могут вводиться в любом порядке или конкурентно. Вообще, антагонисты настоящего изобретения могут успешно использоваться в сочетании с антителами, которые реагируют или связываются с антигенами, ассоциированными со злокачественностями,для лечения опухолевых заболеваний. Они включают, но не ограничиваются ими, CD19, CD20, CD22,CD40, CD40L, CD52 и В 7 антигены. Специалисту в данной области техники ясно, что настоящее изобретение может применяться для лечения любых CD23+ злокачественностей. Использующийся здесь термин CD23+ злокачественность обозначает любое новообразование, в котором опухолевые клетки экспрессируют или ассоциируются сCD23 антигеном. Примеры CD23+ новообразований, которые могут излечиваться в соответствии с настоящим изобретением, включают повторное заболевание Ходкина, резистентное заболевание Ходкина высокой степени, низкой степени и средней степени, лимфомы, отличные от лимфомы Ходкина, В-клеточную хроническую лимфоцитную лейкемию (B-CLL), лимфоплазмацитозную лимфому (LPL), покрытую клеточную лимфому (MCL), фолликулярную лимфому (FL), диффузионную обширную клеточную лимфому (DLCL), лимфому Буркитта (BL), лимфомы, связанные со СПИДом, моноцитную В-клеточную лимфому, ангиоиммунобластомную лимфоаденопатию, небольшую лимфоцитную, фолликулярную,диффузионную обширную клеточную, диффузионную малую расщепляющуюся клеточную, обширную клеточную иммунобластомную лимфобластому, небольшую, нерасщепляющуюся, Буркитта и не Буркитта, фолликулярную, преобладающе обширную клеточную, фолликулярную, преобладающе небольшую расщепляющуюся клеточную и фолликулярную, смешанную небольшую расщепляющуюся и обширную клеточную лимфомы. Другие новообразования, которые могут излечиваться композициями настоящего изобретения, включают Т-клеточные лимфомы, острые Т-клеточные лейкемии и мастоцитомы. Хотя способы настоящего изобретения могут использоваться для лечения ряда CD23+ злокачественностей, неожиданно было обнаружено, что они являются особенно эффективными для лечения Вклеточной хронической лимфоцитной лейкемии (B-CLL). Еще один важный аспект настоящего изобретения включает способ лечения В-клеточной хронической лимфоцитной лейкемии (B-CLL) у млекопитающего, нуждающегося в этом, включающий введение терапевтически эффективного количества CD23 антагониста указанному млекопитающему. Еще один существенный аспект настоящего изобретения включает изделия производства, такие как наборы, содержащие описанные CD23 антагонисты. В этом отношении настоящее изобретение включает набор, пригодный для лечения млекопитающего, страдающего или предрасположенного к опухолевому заболеванию, включающий по крайней мере одну емкость с расположенным в ней CD23 антагонистом и этикетку или вкладку, указывающую, что указанный CD23 антагонист может применяться для лечения указанного опухолевого заболевания. Другие объекты, особенности и преимущества настоящего изобретения станут ясны специалисту в данной области техники из следующего подробного описания его предпочтительных примерных воплощений. Краткое описание фигур Фиг. 1 графически представляет специфическое связывание Ритуксана и CD23 антагониста с клетками лимфомы в зависимости от концентрации. Фиг. 2 графически представляет антителозависимую клеточную цитотоксическую (ADCC) активность CD23 антагониста и Ритуксана на клетки лимфомы. Фиг. 3 А и 3 В показывают, соответственно, действия комбинации CD23 антагониста с pитуксаном на ADCC-опосредованную in vitro гибель клеток опухоли с низкими концентрациями антагониста и с высокими концентрациями антагониста. Фиг. 4 А и 4 В показывают, соответственно, индукцию апоптоза CD23 антагонистом отдельно и с Ритуксаном в клетках лимфомы. Фиг. 5 показывает индукцию апоптоза CD23 антагонистом и Ритуксаном с поперечным связыванием специфического антитела вторичного IgG против человека в клетках лимфомы. Фиг. 6 А и 6 В показывают, соответственно, индукцию апоптоза CD23 антагонистом и Ритуксаном и-3 007467 их комбинацией SKW в клетках лимфомы после поперечного связывания со специфическим антителомIgG против человека. Фиг. 7 показывает индукцию апоптоза в клетках лимфомы CD23 антагонистом и Ритуксаном и их комбинацией в различных концентрациях. Фиг. 8 графически иллюстрирует синергетическую индукцию апоптоза в клетках лимфомы комбинацией CD23 антагониста и aдриамицина. Фиг. 9 показывает синергетическую индукцию апоптоз в клетках лимфомы комбинацией CD23 антагониста и флударабина. Фиг. 10 А и 10 В иллюстрируют, соответственно, индукцию апоптоза в CLL клетках отдельно CD23 антагонистом и индукцию апоптоза в CLL клетках CD23 антагонистом и Ритуксаном и их комбинацией в различных концентрациях. Фиг. 11 показывает индукцию апоптоза в CLL клетках комбинацией CD23 антагониста и флударабина. Фиг. 12 показывает противоопухолевую активность CD23 антагониста как отдельного агента в модели лимфома/SCID мышь. Фиг. 13 графически иллюстрирует противоопухолевую активность CD23 антагониста в сочетании с Ритуксаном в модели лимфома/SCID мышь. Подробное описание изобретения Хотя настоящее изобретение может воплощаться в различных формах, здесь описаны его конкретные показательные воплощения, которые иллюстрируют принципы изобретения. Следует заметить, что настоящее изобретение не ограничивается конкретными представленными воплощениями. Как указано выше, настоящее изобретение относится к применению CD23 антагонистов для лечения и/или профилактики любой из CD23+ злокачественностей. Описанные антагонисты могут использоваться отдельно или в сочетании с широким рядом химиотерапевтических агентов. В этом отношении было неожиданно обнаружено, что антагонисты настоящего изобретения являются особенно эффективными при использовании в сочетании с Ритуксаном. Было также неожиданно обнаружено, что CD23 антагонисты настоящего изобретения являются особенно эффективными для лечения хронической лимфоцитной лейкемии. Кроме того, никаким образом не ограничивая объем изобретения, также было установлено, что описанные здесь CD23 антагонисты могут эффективно индуцировать апоптоз в опухолевых клетках. Это прежде неизвестное свойство CD23 антагонистов может использоваться в соответствии с описанными здесь методиками для получения терапевтически эффективных композиций. В соответствии с настоящим изобретением CD23 антагонисты могут включать любой лиганд, полипептид, пептид, антитело или небольшую молекулу, которая реагирует, взаимодействует, связывается или ассоциирует с CD23 антигеном, экспрессирующимся на В-клетках, и устраняет, понижает, ингибирует или контролирует рост опухолевых клеток. Как известно из уровня техники, CD23 является рецептором низкого сродства для IgE, экспрессирующегося В-клетками и другими клетками. Более конкретно,CD23 антагонист представляет собой молекулу, которая при связывании с маркером поверхности CD23 клетки разрушает или истощает CD23+ клетки у млекопитающего и/или повреждает одну или более клеточных функций, например, путем снижения или предотвращения гуморального ответа, вызываемого клеткой. Антагонист предпочтительно способен истощать В-клетки (например, снижая циркулирование Вклеточного уровня) у млекопитающего, подвергающегося лечению. Такое истощение может достигаться различными механизмами, такими как антителозависимая опосредованная клеткой цитотоксичность(ADCC), апоптоз и/или комплементзависимая цитотоксичность (CDC), ингибирование В-клеточной пролиферации и/или индукция В-клеточной гибели (например, из-за апоптоза). Антагонисты, входящие в объем настоящего изобретения, включают антитела, пептиды и полипептиды с синтетической или природной последовательностью, лиганды и небольшие молекулярные антагонисты, которые связываются с CD23 клеточным маркером, необязательно конъюгированным или конденсированным с цитотоксическим агентом. В объеме настоящего изобретения особенно предпочтительным CD23 антагонистом является IDEC152 (IDEC Pharmaceuticals, Сан-Диего, Калифорния). IDEC-152 является моноклональным анти-СD23 антителом, подобным антителу примата (также обозначаемым как р 5 Е 8), против CD23 антигена, который был разработан для различных экспериментов (Nakumura и Kloetzer и др. 2000. 22:131). Моноклональнoе антитело р 5 Е 8 получают из 5 Е 8, гибридомы, секретирующей CD23 антитела примата против человека, из павиановых макак и молекулярно клонируют и экспрессируют как мономер IgG в 150 кДа в СНО клетки с помощью подходящей векторной технологии. Моноклональное р 5 Е 8 сохраняет вариабельную область 5 Е 8 примата, соединенную с константными областями 1 тяжелой цепи человека и k легкой цепи человека. Оно также сохраняет C1q связывание. Последовательность и получение IDEC-152 и других возможных антагонистов описаны в патенте US 6,011,138, который приведен здесь в качестве ссылки. Специалисту в данной области техники ясно, что соединения, композиции и способы настоящего изобретения пригодны для лечения любого опухолевого заболевания, опухоли или злокачественности,-4 007467 которая проявляет CD23 (CD23+ злокачественности). Как описано выше, антагонисты настоящего изобретения являются иммунореактивными с CD23. В предпочтительных воплощениях, где антагонисты являются антителами, они могут получаться с помощью стандартных технологий генной инженерии, где,по крайней мере, часть одного или более доменов константной области делетирована, замещена или изменена так, чтобы обеспечить желаемые биохимические характеристики, такие как пониженная иммуногенность. Далее будет понятно, что антагонистические антитела или их иммунореактивные фрагменты могут экспрессироваться и получаться в клиническом или коммерческом масштабе с помощью хорошо известных методик. В некоторых воплощениях может потребоваться применение только антигенсвязывающей области(например, вариабельной области или комплементарно определяемых областей) антагонистического антитела и объединение его с модифицированной константной областью для обеспечения нужных свойств. Подходящие конструкции одиночной цепи могут получаться тем же способом. В любом случае, ясно,что антитела настоящего изобретения могут также разрабатываться для улучшения сродства или снижения иммуногенности, что обычно применяется в уровне техники. Например, CD23 антитела, подходящие для настоящего изобретения, могут получаться или вырабатываться из антител, которые являются подобными антителам человека или химеризованными. Так, антитела в соответствии с настоящим изобретением могут получаться и/или включать встречающиеся в природе мышиные антитела, антитела примата (включая человека) или моноклональные антитела других млекопитающих, химерные антитела, антитела, подобные антителам человека, антитела, подобные антителам примата, биспецифические антитела или конструкции одиночной цепи антитела, а также иммунореактивные фрагменты каждого типа. Использующийся здесь термин "антитело" в широком смысле и конкретно обозначает интактные моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), полученные из по крайней мере двух интактных антител и фрагментов антитела такой длины, какая требуется для проявления нужной биологической активности."Фрагменты антитела" включают часть интактного антитела, предпочтительно включающую его антигенсвязывающую или вариабельную область. Примеры фрагментов антител включают Fab, Fab',F(ab')Z и Fv фрагменты; диатела; линейные антитела; молекулы антитела с одиночной цепью и мультиспецифические антитела, полученные из фрагментов антител. Антитела с делетированным доменом,включающие иммуноглобулины, в которых, по крайней мере, часть одной или более константных областей изменена или делетирована для обеспечения модифицированных физиологических свойств (например, пониженный период полувыведения из сыворотки), могут также считаться фрагментами антител в целях настоящего описания. В предпочтительных воплощениях антитела с делетированным доменом включают константные области без СH2 домена. Антагонистами, которые "индуцируют апоптоз", являются антагонисты, которые индуцируют программируемую смерть клетки, например В-клетки, что определяется связыванием аннексина V, фрагментацией ДНК, сокращением клетки, расширением эндоплазматического ретикулума, клеточной фрагментацией и/или образованием мембранных везикул (называемых телами апоптоза)."Антителозависимая опосредованная клеткой цитотоксичность" и "ADCC" относятся к опосредованной клеткой реакции, в которой неспецифические цитотоксические клетки, экспрессирующие Fcрецепторы (FcR) (например, природные клетки-киллеры (NK), нейтрофилы и макрофаги), распознают связавшееся антитело на клетке-мишени и впоследствии вызывают лизис клетки-мишени. Исходные клетки для опосредования ADCC, NK клетки, экспрессируют только FcyRIII, тогда как моноциты экспрессируют FcyRI, FcyRII и FcyRIII. FcR экспрессия на гематопоэтических клетках представлена в табл. 3 на стр. 464 Ravetch и Kinet. Аnnu. Rev. Immunol. 9:457-92 (1991). Для определения ADCC активности интересующей молекулы могут проводиться испытания ADCC in vitro, такие как описаны в US 5,500,362 или 5,821,337. Пригодные клетки-эффекторы для таких испытаний включают периферические моноядерные клетки крови (РВМС) и природные клетки-киллеры (NK). Альтернативно или дополнительно, ADCC активность интересующей молекулы может оцениваться in vivo, например, на животной модели, такой как модели, описанные у Clynes и др. PNAS (USA) 95:652-656 (1998). Как указывалось выше, особенно предпочтительные воплощения данного изобретения содержатCD23 антагонисты, включающие антитела для CD23, такие как IDEC-152. Хотя для настоящего изобретения могут использоваться существующие антитела, могут разрабатываться новые антитела, которые подходят для описанных способов. Используя методики, известные из уровня техники, антитела предпочтительно получают у млекопитающих множественными подкожными или внутрибрюшинными инъекциями соответствующего антигена (например, очищенных антигенов, ассоциирующихся с опухолью,или клеток или клеточных экстрактов, включающих такие антигены) и адъюванта. Эта иммунизация обычно вызывает иммунный ответ, который включает производство антиген-реактивных антител из активированных спленоцитов или лимфоцитов. Хотя полученные антитела могут собираться из сыворотки животного для получения поликлональных составов, часто требуется выделение индивидуальных лимфоцитов из селезенки, лимфатических узлов или периферической крови для получения гомогенных составов моноклональных антител (МАт). Предпочтительно, лимфоциты получают из селезенки. В этом хорошо известном способе (Коhlеr и др., Nature, 256:495 (1975 относительно молодые или-5 007467 мертвые лимфоциты из млекопитающего, которые инъецировались с антигеном, соединяют с бессмертной клеточной линией опухоли (например, клеточная линия миеломы), таким образом получая гибридные клетки или "гибридомы", которые являются бессмертными и способны производить генетически кодируемые антитела к В-клеткам. Полученные гибриды расщепляются на одиночные генетические цепи с помощью селекции, разбавления и повторного выращивания каждой индивидуальной цепи, содержащей специфические гены для образования единого антитела. Они, следовательно, производят антитела,которые гомогенны против желаемого антигена и, учитывая их чистое генетическое родство, называются"моноклональными". Таким образом полученные гибридомные клетки высаживают и выращивают в подходящей среде культуры, которая предпочтительно содержит одно или более веществ, которые ингибируют рост или выживаемость необработанных родственных клеток миеломы. Специалисту в данной области техники ясно, что реагенты, клеточные линии и среды для образования, селекции и роста гибридом являются коммерчески доступными из ряда источников и стандартные методики являются хорошо известными. В основном, среда культуры, в которой выращиваются клетки гибридомы, анализируется на производство моноклональных антител против желаемого антигена. Предпочтительно специфичность связывания моноклональных антител, производимых клетками гибридомы, определяется иммуноосаждением или испытаниями in vitro, такими как радиоиммуноанализ (RIA) или ферментсвязанный иммуноабсорбентный анализ (ELISA). После того как клетки гибридомы идентифицируют на желаемую специфичность, аффинность и/или активность полученных антител, клоны могут субклонироваться путем ограничения процедур разбавления и роста стандартными методами (Goding, Monoclonal Antibodies: Principles andPractice, pp. 59-103 (Academic Press, 1986. Далее станет понятно, что моноклональные антитела, секретируемые субклонами, могут выделяться из среды культуры, асцитной жидкости или сыворотки обычными методами очистки, такими как, например, протеин-А, гидроксилапатитная хроматография, гельэлектрофорез, диализ или аффинная хроматография. В других сходных воплощениях ДНК, кодирующая требуемые моноклональные антитела, может быть легко выделена и секвенирована обычными способами (например, c использованием олигонуклеотидных проб, которые способны специфично связываться с генами, кодирующими тяжелую и легкую цепи мышиных антител). Выделенные и субклонированные гибридомные клетки выступают предпочтительным источником такой ДНК. Однажды выделенная ДНК может быть помещена в векторы экспрессии, которые затем трансфецируются в прокариотические или эукариотические клетки-хозяева, такие как клетки Е. coli, COS клетки обезьяны, клетки яичников китайского хомячка (СНО) или клетки миеломы,которые иначе производят иммуноглобулины. Более конкретно, выделенная ДНК (которая может быть модифицирована, как здесь описано) может использоваться для клонирования последовательностей константной и вариабельной области для производства антител, как описано Newman и др. в заявке США с серийным номером 379,072, поданной 25.01.1995, приведенной здесь в качестве ссылки. По существу,это вызывает экстракцию РНК из выбранных клеток, конверсию в кДНК и распространение ее с помощью PCR с использованием Ig-специфичных праймеров. Подходящие праймеры описаны в US 5,658,570,приведенном здесь в качестве ссылки. Как будет показано более подробно ниже, трансформированные клетки, экспрессирующие желаемое антитело, могут выращиваться в относительно больших количествах для обеспечения клинического и коммерческого получения иммуноглобулина. Специалисту в данной области техники также ясно, что ДНК-кодирующие антитела или фрагменты антител могут также производиться из фаговых библиотек антител, которые указаны, например, в ЕР 368 684 В 1 и US 5,969,108, каждый из которых приведен здесь в качестве ссылки. Некоторые публикации (например, Marks и др. Bio/Technology 10:779-783 (1992 описывают производство высокоаффинных антител человека путем цепочечной перестановки, а также комбинированного заражения и in vitro рекомбинации как стратегии для конструирования больших фаговых библиотек. Такие процедуры обеспечивают жизнеспособные альтернативы традиционным гибридомным технологиям для выделения и последующего клонирования моноклональных антител и как таковые станут ясны при дальнейшем описании настоящего изобретения. Еще одно воплощение настоящего изобретения включает выработку, по существу, человеческих антител в трансгенных животных (например, мыши), которые не способны к эндогенному производству иммуноглобулинов (см., например, US 6,075,181, 5,939,598, 5,591,669 и 5,589,369, каждый из которых приведен здесь в качестве ссылки). Например, было описано, что гомозиготное удаление связывающей области тяжелой цепи антитела в химерной и зародышевой линии мутантных мышей приводит к полному ингибированию эндогенного производства антитела. Перенос ряда генов человеческого иммуноглобулина в такой зародышевой линии мутантных мышей приведет к производству человеческих антител при появлении антигена. Другое предпочтительное значение выработки человеческих антител с помощью SCID мышей описанo в US 5,811,524, приведенном здесь в качестве ссылки. Понятно, что генетический материал, ассоциированный с этими человеческими антителами, может быть также выделен и изменен, как здесь описано. Еще одно другое высокоэффективное значение для выработанных рекомбинантных антител описано Newman, Biotechnology, 10:1455-1460 (1992). Конкретно, эта технология приводит к выработке анти-6 007467 тел, подобных антителам примата, которые содержат вариабельные домены обезьяны и константные последовательности человека. Этот документ приведен здесь в качестве ссылки во всей его полноте. Более того, эта технология также описана в US 5,658,570, 5,693,780 и 5,756,096, каждый из которых приведен здесь в качестве ссылки. В одном предпочтительном воплощении настоящего изобретения IDEC-152 получают с помощью методик, которые, по существу, описаны в указанных выше документах. Как ясно из настоящего описания, генетические последовательности, полезные для получения производных антител CD23 антагонистов настоящего изобретения, могут быть получены из ряда различных источников. Например, как описано выше, различные гены антител человека являются доступными в виде депозитов свободного доступа. Многие последовательности антител и кодирующих антитела генов опубликованы, и подходящие гены антител могут быть синтезированы из этих последовательностей, как описано ранее. Альтернативно, производящие антитело клеточные линии могут отбираться и выращиваться с использованием методик, хорошо известных специалисту в данной области техники. Такие методики описаны в различных лабораторных практикумах и ранних публикациях. В этом отношении методики, подходящие для использования в изобретении, как описано ниже, приведены в Current Protocolsin Immunology, Coligan и др., Eds., Green Publishing Associates and Wiley-Interscience, John Wiley and Sons,New York (1991), приведенном здесь в качестве ссылки во всей полноте, включая приложения. Далее станет ясно, что объем настоящего изобретения включает все аллели, варианты и мутации описанных здесь последовательностей ДНК. Хорошо известно, что РНК может быть выделена из исходных гибридомных клеток или из других трансформированных клеток стандартными методиками, такими как экстракция гуанидинизотиоцианатом и осаждением с последующим центрифугированием или хроматографией. При необходимости мРНК может быть выделена из общей РНК стандартными методиками, такими как хроматография на oлигоdT целлюлозе. Методики, пригодные для этих целей, являются известными из уровня техники и описаны в предшествующих ссылках. кДНК, кодирующие легкие и тяжелые цепи антител, могут быть получены одновременно или раздельно с помощью обратной транскриптазы и ДНК полимеразы в соответствии с хорошо известными способами. Это может инициироваться согласованными праймерами константной области или более специфическими праймерами, основанными на опубликованных последовательностях тяжелой и легкой цепи ДНК и аминокислот. Как описано выше, PCR также может использоваться для выделения ДНК клонов, кодирующих легкие и тяжелые цепи антитела. В этом случае библиотеки могут быть подвержены скринингу согласованными праймерами или большими гомологичными пробами, такими как пробы константной области мыши. ДНК, обычно плазмидная ДНК, может выделяться из клеток, как здесь описано, ограниченно распределяться и секвенироваться с помощью стандартных, хорошо известных методик, описанных подробно в указанных выше документах, касающихся технологий рекомбинантной ДНК. Конечно, ДНК может быть модифицирована в соответствии с настоящим изобретением в любой момент в процессе выделения или последующего анализа. Здесь описаны предпочтительные последовательности антитела. Методики синтеза олигонуклеидов, относящиеся к этому аспекту изобретения, хорошо известны специалисту в данной области техники и могут осуществляться с использованием любых коммерчески доступных автоматических синтезаторов. Кроме того, последовательности ДНК, кодирующие несколько типов тяжелых и легких цепей, приведенных здесь, могут быть получены с помощью услуг коммерческих фирм синтеза ДНК. Генетический материал, полученный любыми из вышеуказанных методов, может затем изменяться или модифицироваться для получения антител в соответствии с настоящим изобретением. Хотя множество различных типов антител может быть получено и модифицировано в соответствии с настоящим изобретением, модифицированные антитела настоящего изобретения определяют различные общие черты. С этой стороны термин "иммуноглобулин" обозначает тетрамер или его агрегат, независимо от того, обладает он или не обладает любой релевантной специфической иммунореактивностью."Антитела" обозначают такие комплексы, которые имеют значительную известную специфическую иммунореактивную активность по отношению к антигену (например, ассоциированному с опухолью антигену), содержащие легкую и тяжелую цепи, с или без ковалентной связи между ними. Антитела могут быть модифицированы для обеспечения улучшенных физиологических характеристик. "Модифицированные антитела" в соответствии с настоящим изобретением обозначают антитела или их иммунореактивные фрагменты или рекомбинанты, в которых, по крайней мере, часть одного или более доменов константной области делетирована или иначе изменена так, чтобы обеспечить необходимые биохимические характеристики, такие как повышение локализации в опухоли или снижение периода полувыведения из сыворотки по сравнению с цельным, неизмененным антителом приблизительно с той же иммуногенностью. В целях настоящего описания иммунореактивные конструкции антитела с одной цепью, имеющие измененные или не включающие домены константной области, могут считаться модифицированными антителами. Основные иммуноглобулиновые структуры у позвоночных относительно хорошо изучены. Как будет более подробно описано ниже, генный термин "иммуноглобулин" включает пять различных классов-7 007467 антитела, которые различаются биохимически. Хотя все пять классов подходят под объем настоящего изобретения, следующее описание будет, в основном, направлено на класс IgG молекул. В отношенииIgG, иммуноглобулины включают две идентичные легкие полипептидные цепи с молекулярным весом приблизительно в 23000 Да и две идентичные тяжелые цепи с молекулярным весом 53000-70000. Четыре цепи связаны дисульфидными связями в "Y" конфигурацию, где легкие цепи соединяются с тяжелыми цепями в начале разветвления "Y" и продолжаются на протяжении вариабельной области. Более конкретно, легкие и тяжелые цепи разделены на две области, структурно и функционально гомологичные. Термины "константный" и "вариабельный" используются функционально. В этом отношении ясно, что вариабельные домены легкой (VL) и тяжелой (VH) цепей определяют распознавание и специфичность антигена. С другой стороны, константные домены легкой цепи (CL) и тяжелой цепи (СH1,СH2 или СH3) определяют важные биологические свойства, такие как секреция, прохождение через плаценту, связывание с Fc-рецептором, связывание с комплементом и им подобные. Обычно нумерация доменов константной области повышается при удалении от антигенсвязывающего сайта или аминоконца антитела. Так, СH3 и CL домены обычно включают карбокси-конец тяжелой и легкой цепей, соответственно. Легкие цепи классифицируются как каппа или лямбда (, ). Каждый класс тяжелой цепи может быть связан с каппа- или лямбда-легкой цепью. Вообще, легкая и тяжелая цепи ковалентно связаны друг с другом и "хвостовые" части двух тяжелых цепей связаны друг с другом ковалентными дисульфидными связями, когда иммуноглобулины вырабатываются гибридомами, В-клетками или генетически полученными клетками-хозяевами. Однако, если нековалентное связывание цепей достигается в правильной геометрии, агрегат несвязанных дисульфидными связями цепей остается способным реагировать с антигеном. В тяжелой цепи аминокислотные последовательности начинаются от N-конца у разветвленных концов Y-конфигурации до С-конца внизу каждой цепи. На N-конце расположена вариабельная область и на С-конце расположена константная область. Специалисту в данной области техники известно, что тяжелые цепи классифицируются как гамма, мю, альфа, дельта или эпсилон (, , , , ) с несколькими подклассами в них. Природа этой цепи определяет "класс" антитела как IgA, IgD, IgE, IgG или IgM. Подклассы иммуноглобулина (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1 и т.д., охарактеризованы и известны для подтверждения функциональной специфичности. Модифицированные версии каждого из этих классов и изотипов являются легко различимыми специалистом в данной области техники ввиду раннего описания и, соответственно, составляют часть настоящего изобретения. Как показано выше, вариабельная область позволяет антителу селективно распознавать и специфически связываться с эпитопами на иммунореактивных антигенах. Так, VL домен и VH домен антитела объединены с образованием вариабельной области, которая определяет трехмерный сайт связывания антигена. Эта четвертичная структура антитела обеспечивает наличие сайта связывания антигена на конце каждого рукава Y. Более конкретно, сайт связывания антигена определяется тремя комплементарно определяемыми областями (CDR) на каждой VH и VL цепях. Шесть CDR являются короткими, несмежными последовательностями аминокислот, которые расположены специфично с образованием сайта связывания антигена, который предполагает антиген в его трехмерной конфигурации в водном окружении. Остаток тяжелых и легких вариабельных доменов проявляет меньшую межмолекулярную вариабельность аминокислотной последовательности и называется основными областями. Основные области, в основном, принимают -складчатую конформацию и CDR образуют петлеобразные связывания и в некоторых случаях образуют часть -складчатой структуры. Так, эти основные области действуют с образованием скелета, который обеспечивает расположение шести CDR в правильной ориентации с помощью внутрицепочечных нековалентных взаимодействий. В любом случае, сайт связывания антигена, образованный расположением CDR, определяет поверхностную комплементарность к эпитопу на иммунореактивном антигене. Эта комплементарная поверхность вызывает нековалентное связывание антитела с эпитопом иммунореактивного антигена. В целях настоящего изобретения ясно, что раскрытые анти-СD23 антитела могут включать любой тип вариабельной области, который обеспечивает связывание антитела с CD23 маркером. В этом отношении вариабельная область может включать или быть произведена из любого типа млекопитающего,которое может вызывать гуморальный ответ и вырабатывать иммуноглобулины против CD23. Как таковая, вариабельная область антагонистических антител может быть, например, человеческой, мышиной,нечеловекоподобного примата (например, обезьян, макак и т.д.) или волчьего происхождения. В особенно предпочтительных воплощениях как вариабельная, так и константная области иммуноглобулинов являются человеческими. В других выбранных воплощениях вариабельные области похожих антител(обычно произведенных не из человека) могут производиться или специфично приспосабливаться для улучшения свойств связывания или снижения иммуногенности молекулы. В этом отношении, вариабельные области, полезные для настоящего изобретения, могут быть подобными областям человека или иначе изменены путем включения чужеродных аминокислотных последовательностей. Под "антителом, подобным антителу человека" понимают антитело, произведенное не из человека,обычно мышиное антитело, которое сохраняет или, в основном, сохраняет антигенсвязывающие свойст-8 007467 ва родственного антитела, но которое является менее иммуногенным для людей. Это может достигаться различными способами, включающими (а) трансплантацию полностью нечеловеческих вариабельных доменов в константную область человека для получения химерных антител; (b) трансплантацию, по крайней мере, части одной или более нечеловеческих комплементарно определяемых областей (CDR) в основные и константные области человека с или без удерживания критических основных остатков; или(с) перенос полностью нечеловеческих вариабельных доменов, но "накрывание" их с помощью человекоподобной секции путем замещения поверхностных остатков. Такие способы описаны Morrison и др.,Proc. Natl. Acad. Sci. 81: 6851-5 (1984); Morrison и др., Adv. Immunol. 44: 65-92 (1988); Verhoeyen и др.,Science 239: 1534-1536 (1988); Padlan, Molec. Immun. 28: 489-498 (1991); Padlan, Molec. Immun. 31: 169217 (1994) и US 5,585,089, 5,693,761 и 5,693,762, все приведены здесь в качестве ссылки. Специалисту в данной области техники ясно, что методики, описанные выше в группе (а), производят "классические" химерные антитела. В контексте настоящей заявки термин "химерные антитела" обозначает любое антитело, где иммунореактивную область или сайт получают или производят из первых типов и константную область (которая может быть интактной, частичной или модифицированной в соответствии с настоящим изобретением) получают из вторых типов. В предпочтительных воплощениях антигенсвязывающую область или сайт получают не из человека (например, примата или мыши) и константную область - из человека. Хотя иммуногенная специфичность вариабельной области обычно не зависит от ее источника, константная область человека с меньшей вероятностью вызывает иммунный ответ у человека по сравнению с константной областью, полученной не из человека. Предпочтительно вариабельные домены тяжелой и легкой цепей изменяют, по крайней мере, частичным замещением одного или более CDR и, при необходимости, частичным замещением основной области и изменением последовательности. Хотя CDR могут быть получены из антитела того же класса или подкласса, что и антитело, из которого произведены основные области, предусматривается, что CDR производят из антитела другого класса и, предпочтительно, из антитела других типов. Следует заметить,что может потребоваться замещение всех CDR на все CDR из донорной вариабельной области для переноса антигенсвязывающей способности одного вариабельного домена на другой. Скорее, может быть необходим только перенос тех остатков, которые необходимы для поддержания активности антигенсвязывающего сайта. Учитывая разъяснения, приведенные в US 5,585,089, 5,693,761 и 5,693,762, это возможно осуществить специалисту в данной области техники путем проведения обычных экспериментов или методом проб и ошибок с получением функционального антитела с пониженной иммуногенностью. Несмотря на изменения в вариабельной области, специалисту в данной области техники ясно, что в предпочтительном воплощении aнти-CD23 антитела данного изобретения могут включать антитела или их иммунореактивные фрагменты, в которых по крайней мере часть одного или более доменов константной области делетирована или изменена для обеспечения необходимых биохимических характеристик,таких как повышение локализации в опухоли или пониженный период полувыведения из сыворотки по сравнению с антителом приблизительно той же иммуногенности, включающим природную или неизмененную константную области. В предпочтительных воплощениях константная область этого типа aнтиCD23 антител содержит константную область человека. Модификации константных областей, пригодных для настоящего изобретения, включают добавления, делеции или замещения одной или более аминокислот в одном или более доменах. Так, описанные здесь aнти-CD23 антитела могут включать изменения или модификации в одном или более из трех константных доменов тяжелой цепи (СH1, СH2 или СH3) и/или константном домене легкой цепи (CL). В особенно предпочтительных воплощениях модифицированные антитела включают конструкции с делетированным доменом или их варианты, в которых полностью удален СH2 домен (СH2 конструкции). Помимо их конфигурации из уровня техники хорошо известно, что константная область медиирует некоторые эффекторные функции. Например, связывание С 1 компонента системы комплемента с антителами активирует систему комплемента. Активация комплемента важна для опсонизации и лизиса клеточных патогенов. Активация комплемента также стимулирует вспомогательный отклик и может также заключаться в аутоиммунной гиперчувствительности. Кроме того, антитела связываются с клетками через Fc-область, с сайтом Fc-рецептора на Fc-области антитела, связывающимся с Fc-рецептором (FcR) в клетке. Существует ряд Fc-рецепторов, которые являются специфичными для различных классов антител, включая IgG (гамма-рецепторы), IgE (эта-рецепторы), IgA (альфа-рецепторы) и IgM (мю-рецепторы). Связывание антитела с Fc-рецепторами на поверхностях клетки вызывает ряд важных и разнообразных биологических откликов, включающих поглощение и разрушение антителосвязанных частиц, апоптоз,выведение иммунных комплексов, лизис связанных с антителом клеток-мишеней клетками-киллерами(называемый антителозависимой опосредованной клетками цитотоксичностью, или ADCC), высвобождение вспомогательных медиаторов, перенос через плаценту и контроль производства иммуноглобулинов. Следуя методике выделенного генетического материала для получения CD23 антагонистов, таких как антитела и реактивные полипептиды, описанные выше, нуклеиновые кислоты обычно встраиваются в вектор экспрессии для введения в клетки-хозяева, которые могут использоваться для получения необходимого количества CD23 антагонистов. Термин "вектор" или "вектор экспрессии", который здесь используется в описании и формуле изо-9 007467 бретения, обозначает векторы, использующиеся в соответствии с настоящим изобретением как связующее вещество для введения и экспрессии желаемой последовательности нуклеиновой кислоты в клетку. Как известно специалисту в данной области техники, такие векторы могут легко выбираться из группы,состоящей из плазмид, фагов, вирусов и ретровирусов. Вообще, векторы для данного изобретения включают маркер селекции, подходящие сайты рестрикции для облегчения клонирования нужного гена и способности проникать и/или реплицировать в эукариотических или прокариотических клетках. В целях данного изобретения могут использоваться многочисленные системы векторов экспрессии. Например, один класс векторов использует элементы ДНК, которые получены из вирусов животных,таких как бычий папиллома-вирус, полиомавирус, аденовирус, вирус vaccinia, бакуловирус, ретровирусы(RSV, MMTV или MOMLV) или SV40 вирус. Кроме того, клетки, которые составляют ДНК в их хромосомы, могут выбираться введением одного или более маркеров, которые позволяют отобрать клеткихозяева для трансфекции. Маркер может обеспечивать прототрофность ауксотрофного хозяина, биоцидную резистентность (например, антибиотики) или резистентность к тяжелым металлам, таким как медь. Выбранный маркерный ген может либо напрямую связываться с экспрессирующимися ДНК-последовательностями, либо вводиться в ту же клетку сопутствующей трансформацией. Дополнительные элементы могут также потребоваться для оптимального синтеза мРНК. Эти элементы могут включать сдвоенные сигналы, а также промоторы транскрипции, энхансеры и терминальные сигналы. В особенно предпочтительных воплощениях для aнти-CD23 антител клонированные гены вариабельных областей встраивают в вектор экспрессии в гены тяжелой и легкой цепи константной области(предпочтительно человека), как описано выше. Предпочтительно это выполняется с помощью подходящего вектора экспрессии IDEC Pharmaceuticals, Inc. (Сан-Диего, Калифорния), называющегосяNEOSPLA. Этот вектор содержит цитомегаловирусный промотор/энхансер, бета-глобиновый главный промотор мыши, источник репликации SV40, полиаденилированную последовательность бычьего гормона роста, экзон 1 и экзон 2 неомизинфосфотранферазы, ген дегидрофолатредуктазы и лидерную последовательность. В примерах ниже показано, что этот вектор приводит к очень высокому уровню экспрессии антител при введении генов в вариабельную и константную область, трансфекции в СНО клетках с последующим отбором в содержащей G 418 среде и введением метотрексата. Эта система вектора,по существу, описана в общедоступных US 5,736,137 и 5,658,570, каждый из которых приведен здесь в качестве ссылки. Эта система обеспечивает высокие уровни экспрессии, а именно 30 пг/клетка/день. Вообще, однажды получив один вектор или ДНК-последовательность, содержащие реактивный полипептид или получаемое антитело, вектор экспрессии можно вводить в подходящую клетку-хозяина. Так клетки-хозяева могут быть трансформированы. Введение плазмиды в клетку-хозяина может осуществляться различными технологиями, хорошо известными специалисту в данной области техники. Они включают, но не ограничиваются, трансфекцию (включая электрофорез и электропорацию), вливание протопласты, осаждение фосфатом кальция, клеточное слияние с непокрытой ДНК, микроинъекцию и заражение интактным вирусом. Смотри Ridgway, A.A.G. "Mammalian Expression Vectors" Chapter 24.2,pp. 470-472; Vectors, Rodriguez and Denhardt, Eds. (Butterworths, Boston, Mass. 1988). Более предпочтительно, введение плазмиды в хозяина осуществляется с помощью электропорации. Трансформированные клетки выращиваются в подходящих условиях для получения легких цепей и тяжелых цепей, и проводится синтез протеина тяжелой и/или легкой цепи. Примерные методики эксперимента включают ферментсвязанный иммуносорбентный анализ (ELISA), радиоиммуноанализ (RIA) или сортировочный анализ клеток, активированных флуоресценцией (FACS), иммуногистохимию и им подобные. Использующийся здесь термин "трансформация" применяют в широком смысле для обозначения любого введения ДНК в реципиентную клетку хозяина, которое изменяет генотип и постепенно приводит к изменению реципиентной клетки. На протяжении всего описания "клетки-хозяева" обозначают клетки, которые трансформированы векторами, сконструированными с помощью технологий рекомбинантных ДНК, и содержащие по крайней мере один гетерологичный ген. Как здесь определено, антитело или его модификация, полученные с помощью клетки-хозяина, осуществляются благодаря этой трансформации. В описанных процессах для выделения антител из рекомбинантных хозяев термины "клетка" и "клеточная культура" используются поочередно для обозначения источника антитела, если это не указано иначе. Другими словами, извлечение антитела из "клеток" может означать либо из потока цельных клеток, либо из клеточной культуры,содержащей среду и суспендированные клетки. Линия клеток-хозяев, использующаяся для экспрессии протеина, является, наиболее предпочтительно, линией млекопитающего; специалист в данной области техники приписывает способности предпочтительно определять конкретные линии гостевых клеток, которые наилучшим образом подходят для нужного экспрессирующегося генетического продукта. Примерные линии клеток-хозяев включают, но не ограничиваются ими, DG44 и DUXB11 (линии яичников китайских хомяков, DHFR минус), HELA- 10007467 особо предпочтительными. Линии клеток-хозяев обычно доступны из коммерческих источников, AmericanTissue Culture Collection или из опубликованной литературы.In vitro производство позволяет получить большое количество нужных CD23 антагонистов. Методики культивации клеток млекопитающих в условиях культуры ткани известны из уровня техники и включают культуру гомогенной суспензии, например, в реакторе с воздушным мостом или в реакторе длительного перемешивания, или иммобилизованную или задерживающую клеточную культуру, например пустые волокна, микрокапсулы, на шариках агарозы или керамических пластинках. Для выделенияCD23 антагонистов экспрессирующиеся полипептиды в культуре супернатантов сначала концентрируют,например, осаждением сульфатом аммония, диализом через гигроскопичный материал, такой как PEG,фильтрацией через селективные мембраны, и им подобные. При необходимости и/или если требуется,концентрированные полипептиды очищают обычными хроматографическими способами, например гельфильтрацией, ионообменной хроматографией, хроматографией на DEAE-целлюлозе или (иммуно-)аффинной хроматографией. Гены реактивных полипептидов могут также экспрессироваться клетками немлекопитающих, такими как бактерии и дрожжи. В этом отношении понятно, что различные одноклеточные микроорганизмы немлекопитающих, такие как бактерии, могут также трансформироваться; а именно они способны выращиваться в культурах или ферментироваться. Бактерии, которые пригодны для трансформирования,включают ряд энтеробактерий, таких как штаммы Escherichia coli; Salmonella; Bacillaceae, такая как Bacillussubtilis; Pneumococcus; Streptococcus и Haemophilus influenzae. Далее будет понятно, что при экспрессии в бактериях тяжелые цепи и легкие цепи анти-СD23 иммуноглобулина обычно становятся частью включенных тел. Цепи затем должны быть выделены, очищены и затем собраны в функциональные молекулы иммуноглобулина. Кроме прокариот могут также использоваться эукариотические микроорганизмы. Saccharomycescerevisiae, или обычные пекарские дрожжи, наиболее широко используются среди эукариотических микроорганизмов, хотя ряд других линий является общедоступным. Для экспрессии в Saccharomyces обычно используется плазмида YRp7, например (Stinchcomb и др.,Nature, 282:39 (1979); Kingsman и др., Gene, 7:141 (1979); Tschemper и др., Gene, 10:157 (1980. Эта плазмида уже содержит trpl ген, который является маркером селекции для мутированной линии дрожжей,потерявших способность расти в триптофане, например АТСС No. 44076 или РЕР 4-1 (Jones, Genetics,85:12 (1997. Наличие trpl группы в качестве характеристики генома клетки-хозяина дрожжей обеспечивает эффективное окружение для определения трансформации при росте в отсутствие триптофана. Несмотря на то, какие получаются клинически полезные количества, CD23 антагонисты настоящего изобретения могут использоваться в любой конъюгированной (т.е. иммуноконъюгат) или неконъюгированной формах. В частности, антитела настоящего изобретения могут конъюгироваться с цитотоксинами, такими как радиоизотопы, терапевтические агенты, цитостатические агенты, биологические токсины или пролекарства. Альтернативно, CD23 антагонисты данного изобретения могут использоваться в неконъюгированной или "открытой" форме для подавления природных защитных механизмов у субъекта,включающих комплементзависимую цитотоксичность (CDC) и зависящую от антитела клеточную токсичность (ADCC) или апоптоз для расщепления злокачественных клеток. В особо предпочтительных воплощениях CD23 антагонисты могут конъюгироваться с радиоизотопами, такими как 90Y, 125I, 131I, 123I,111In, 105Rh, 153Sm, 67Cu, 67Ga, 166Ho, 177Lu, 186Re и 188Re, с использованием любого из известных хелаторов или прямой метки. В других воплощениях описанные композиции могут включать CD23 антагонисты,соединенные с лекарственными средствами, пролекарствами или модификаторами биологического отклика, такими как метотрексат, адриамицин и лимфокины, такие как интерферон. Еще одно воплощение настоящего изобретения включает применение антител, конъюгированных со специфическими биотоксинами, такими как рицин или диптерия токсин. Еще в одном воплощении CD23 антагонисты могут образовывать комплекс с другими иммунологически активными лигандами (например, антитела или их фрагменты), где конечная молекула связана с опухолевой клеткой и клеткой-эффектором, такой как Тклетка. Выбор того, конъюгированные или неконъюгированные CD23 антагонисты использовать, зависит от типа и состояния рака, применения побочного лечения (например, химиотерапии или внешнего облучения) и состояния пациента. Понятно, что специалист в данной области техники легко может сделать такой выбор на основании данного описания. Использующийся здесь термин "цитотоксин или цитотоксический агент" обозначает любой агент,который может быть связан с описанными CD23 антагонистами, которые мешают росту и пролиферации клеток и могут снижать, ингибировать или разрушать злокачественные образования при воздействии. Примерные цитотоксины включают, но не ограничиваются ими, радионуклиды, биотоксины, цитостатические или цитотоксические терапевтические агенты, пролекарства, иммунологично активные лиганды и модификаторы биологического отклика, такие как цитокины. Как будет описано более подробно ниже,радионуклидные цитотоксины являются особенно предпочтительными для настоящего изобретения. Однако любой цитотоксин, который задерживает или замедляет рост злокачественных клеток или уничтожает злокачественные клетки и может связываться с описанными здесь CD23 антагонистами, подходит под объем настоящего изобретения.- 11007467 Из предшествующих исследований ясно, что противоопухолевые антитела, меченные изотопами,успешно использовались для разрушения клеток в твердых опухолях, а также в лимфома/лейкемии в животных моделях и, в некоторых случаях, у людей. Радионуклиды действуют путем выработки ионизирующего излучения, которое вызывает множественные витые разрывы в ядерной ДНК, приводящие к смерти клетки. Изотопы, использующиеся для получения терапевтических конъюгатов, обычно производят - или -частицы с высокой энергией, имеющие короткую длину волны. Такие радионуклиды убивают клетки, с которыми они тесно соприкасаются, например опухолевые клетки, к которым присоединяется конъюгат или в которые он вводится. Они обычно имеют незначительный или не имеют вообще действия на нелокализованные клетки. Радионуклиды, по существу, являются неиммуногенными. В отношении применения радиоактивно меченных конъюгатов согласно настоящему изобретениюCD23 антагонисты могут помечаться напрямую (например, через йодирование) или могут помечаться непрямо путем применения хелатирующих агентов. Используемые здесь фразы "непрямая метка" и "метод непрямой метки" означают, что хелатирующий агент ковалентно присоединен к антителу и по крайней мере один радионуклид связан с хелатирующим агентом. Особенно предпочтительными хелатирующими агентами являются бифункциональные хелатирующие агенты, и они включают, например, производные 1-изотиоцикматобензил-3-метилдиотелентриаминпентауксусной кислоты ("MX-DTPA") и циклогексилдиэтилентриаминпентауксусной кислоты ("CHX-DTPA"). Особенно предпочтительные радионуклиды для непрямой метки включают 111In и 90Y. Использующиеся здесь фразы "прямая метка" и "метод прямой метки" обозначают, что радионуклид ковалентно присоединен непосредственно к CD23 антагонисту (обычно через аминокислотный остаток). Более конкретно, эти методики связывания включают произвольную метку и направленную на сайт метку. В последнем случае мечение направлено на специфические сайты димера или тетрамера, таких как N-связанные остатки сахаров, присутствующие только в Fc-части конъюгатов. Кроме того, различные методики и практикумы прямого мечения подходят для данного изобретения. Например, технеций 99m меченные антитела могут быть получены способами с обменом лиганда путем восстановления пертехната (ТсО 4-) ионным раствором олова при хелатировании восстановленного технеция в колонке с сефадексом и использовании в колонке антитела или смешанными методиками мечения, например инкубированием пертехната, восстанавливающего агента, такого как SnCl2, буферного раствора, такого как раствор фталата натрия и калия, и CD23 антагонистов. В любом случае, предпочтительные радионуклиды для прямой метки CD23 антагонистов хорошо известны из уровня техники, и особенно предпочтительным радионуклидом для прямой метки является 131I, ковалентно присоединенный через тирозиновые остатки. CD23 антагонисты в соответствии с изобретением могут быть получены, например, с помощью радиоактивного йодида натрия или кальция и химического окислительного агента, такого как гипохлорит натрия, хлорамин Т или им подобные, или ферментного окислительного агента, такого как лактопироксидаза, глюкозооксидаза и глюкоза. Однако в целях настоящего изобретения особенно предпочтительным является метод непрямой метки. Из уровня техники известны патентные документы, раскрывающие хелаторы и конъюгаты хелаторов. Например, US 4,831,175 Gansow описывает полизамещенные хелаты диэтилентриаминпентауксусной кислоты и белковые конъюгаты, их содержащие, а также способы их получения. US 5,099,069,5,246,692, 5,286,850, 5,434,287 и 5,124,471 Gansow также относятся к полизамещенным хелатам DTPA. Эти патенты приведены здесь в качестве ссылки. Другими примерами приемлемых хелаторов металлов являются этилендиаминтетрауксусная кислота (EDTA), диэтилентриаминпентауксусная кислота (DPTA),1,4,8,11-тетраазатетрадекан, 1,4,8,11-тетраазатетрадекан-1,4,8,11-тетрауксусная кислота, 1-окса-4,7,12,15 тетраазопентадекан-4,7,12,15-тетрауксусная кислота или им подобные. Другие подходящие хелаторы,включающие уже описанные, могут легко отличаться специалистом в данной области техники и являются ясными в объеме настоящего изобретения. Подходящие хелаторы, включающие специфичный бифункциональный хелатор для облегчения хелатирования из родственных заявок 08/475,813, 08/475,815 и 08/478,967, предпочтительно выбираются для обеспечения высокого сродства с тривалентными металлами, проявления повышенного соотношения опухоль/не опухоль и снижения захвата костью, а также большего in vivo удерживания радионуклида в сайтах мишеней, то есть в сайтах В-клеток опухоли лимфомы. Однако другие бифункциональные хелаторы, которые обладают или не обладают этими характеристиками, известны из уровня техники и могут также успешно использоваться для терапии опухоли. Понятно, что в соответствии с приведенным здесь описанием CD23 антагонисты могут конъюгироваться с различными радиоактивными метками для диагностических и терапевтических целей. С этой стороны указанные выше родственные заявки, приведенные здесь в качестве ссылок, описывают радиоактивно меченные терапевтические конъюгаты для диагностической "визуализации" опухолей до введения терапевтического антитела. 111In является особенно предпочтительным в качестве радионуклида для диагностики благодаря тому, что примерно от 1 до примерно 10 мКи могут безопасно вводиться без заметной токсичности; и данные визуализации обычно предсказываются последующим распределением 90Y-меченного антитела. Большинство исследований с визуализацией используют 5 мКи 111In-меченного антитела, так как эта доза является безопасной и повышает эффективность визуализации по сравнению с- 12007467 более низкими дозами, с оптимальной визуализацией в период от 3 до 6 дней после введения антитела. Смотри, например, Murray, J. Nuc. Med. 26: 3328 (1985) и Carraguillo и др., J. Nuc. Med. 26:67 (1985). Как указано выше, множество радионуклидов являются применимыми для настоящего изобретения,и специалист в данной области техники способен легко определить, какой радионуклид наиболее подходит в определенных случаях. Например, 131I является хорошо известным радионуклидом, использующимся для проведения иммунотерапии. Однако клиническая пригодность 131I может ограничиваться некоторыми факторами, включающими физический период полувыведения - 8 дней; дегалогенирование иодированного антитела в крови и в сайтах опухоли и характеристики эмиссии (например, большой гамма-компонент), что является недостаточно оптимальным для накопления локализованной дозы в опухоли. С появлением превосходящих хелатирующих агентов возможность присоединения металлических хелатирующих групп к белкам повышает возможность использования других радионуклидов, таких как 111In и 90Y. 90Y обеспечивает некоторые преимущества для использования в радиоиммунотерапии: 64 часовой период полувыведения 90Y является достаточно продолжительным, позволяя накапливать антитело в опухоли, и, в противоположность, например, 131I, 90Y является источником чистого бета-излучения высокой энергии без сопровождающегося гамма-облучения при его распаде, в пределах от 100 до 1000 диаметра клетки в ткани. Кроме того, минимальное количество проникающей радиации позволяет вводить амбулаторному больному 90Y-меченные антитела. Дополнительно, поглощение клеткой меченого антитела не требует уничтожения клетки, и локальная эмиссия ионизирующего излучения будет летальной для смежных клеток опухоли с недостатком антигена-мишени. Эффективные однократные дозы для лечения (т.е. терапевтически эффективное количество) 90Yмеченных CD23 антагонистов колеблются в области от около 5 до около 75 мКи, более предпочтительно от около 10 до около 40 мКи. Эффективные однократные отдельные лечебные дозы, не вредные для костного мозга, для 131I-меченных антител колеблются от около 5 до около 70 мКи, более предпочтительно от около 5 до около 40 мКи. Эффективные однократные лечебные отдельные дозы (т.е. может потребоваться трансплантация взятого у той же особи костного мозга) 131I-меченных антител колеблются в области от около 30 до около 600 мКи, более предпочтительно от около 50 до менее чем 500 мКи. В сочетании с химерным антителом, благодаря более длительному периоду полувыведения при циркулировании по сравнению с мышиными антителами, эффективные однократные лечебные отдельные дозы, не вредные для костного мозга, 131I-меченных химерных антител колеблются в области от около 5 до около 40 мКи, более предпочтительно менее чем 30 мКи. Критерий визуализации, например, для 111In метки обычно меньше около 5 мКи. Хотя осуществлялось множество клинических испытаний с 131I и 90Y, из уровня техники известны другие радиоактивные метки, и они используются для похожих целей. Другие радиоизотопы используются для визуализации. Например, дополнительные радиоизотопы, которые подходят под объем данного изобретения, включают, но не ограничиваются ими: 123I, 125I, 32P, 57Co, 64Cu, 67Cu, 77Br, 81Rb, 81Kr, 87Sr,113At и 213Bi. В этом отношении альфа-, гамма- и бета-источники - все подходят для применения в данном изобретении. Кроме того, ввиду настоящего описания предполагается, что специалист в данной области техники может легко определить, какой радионуклид является приемлемым для выбранного курса лечения без проведения экспериментов. С этой стороны, дополнительные радионуклиды, которые уже используются для клинической диагностики, включают 125I, 123I, 99Tc, 43K, 52Fe, 67Ga, 68Ga и 111In. Антитела также помечают различными радионуклидами для возможного использования в направленной иммунотерапии, Peirersz и др., Immunol. Cell. Biol. 65: 111-125 (1987). Эти радионуклиды включают 188Re и 186Re,а также 199 Аu и 67 Сu в меньшей степени. US 5,460,785 раскрывает дополнительные данные, относящиеся к таким радиоизотопам, и приведен здесь в качестве ссылки. Кроме радионуклидов, CD23 антагонисты настоящего изобретения могут конъюгироваться или связываться с одним из ряда модификаторов биологического отклика, фармацевтическими агентами, токсинами или иммунологически активными лигандами. Специалисту в данной области техники ясно, что эти нерадиоактивные конъюгаты могут получаться при использовании различных методик в зависимости от выбранного цитотоксина. Например, конъюгаты с биотином получают, например, по реакции CD23 антагонистов (т.е. антител) с активированным эфиром биотина, таким как N-гидроксисукцинимидный эфир биотина. Аналогично, конъюгаты с флуоресцентным маркером могут получаться в присутствии связывающего агента, например такого, как представлено выше, или по реакции с изотиоцианатом, предпочтительно флуоресценизотиоцианатом. Конъюгаты химерных антител (т.е. IDEC-152) изобретения с цитостатическими/цитотоксическими соединениями и хелатами металлов получают аналогичным способом. Как указывалось ранее, приемлемые цитотоксины могут включать пролекарство. Использующийся здесь термин "пролекарство" относится к предшественнику или производной форме фармацевтически активного вещества, которая является менее токсичной по отношению к клеткам опухоли в сравнении с близким лекарственным средством и способна ферментативно активироваться или превращаться в более активную родственную форму. Пролекарства, пригодные для изобретения, включают, но не ограничиваются ими, фосфатсодержащие пролекарства, тиофосфатсодержащие пролекарства, сульфатсодержащие пролекарства, пептидсодержащие пролекарства, -лактамсодержащие пролекарства, необязательно за- 13007467 мещенные феноксиацетамидсодержащие пролекарства или необязательно замещенные фенилацетамидзамещенные пролекарства, 5-фторцитозин и другие пролекарства 5-фторуридина, которые могут превращаться в более активное цитотоксическое свободное лекарственное средство. Следующие примеры цитотоксических лекарственных средств, которые могут превращаться в пролекарственную форму для применения в настоящем изобретении, включают химиотерапевтические агенты, описанные выше. Независимо от того, являются ли описанные CD23 антагонисты конъюгированными или неконъюгированными, ясно, что главным преимуществом настоящего изобретения является возможность использовать эти антитела для пациентов с подавлением костного мозга, особенно для тех, кто подвергался или подвергается дополнительным терапиям, таким как радиотерапия или химиотерапия. В этом отношении уникальный профиль доставки CD23 антагонистов делает их очень эффективными для введения радиоактивно меченных конъюгатов пациентам с подавлением костного мозга, больных раком. Как таковые,CD23 антагонисты являются полезными в конъюгированной или неконъюгированной форме для пациентов, которые проходили предшествующие дополнительные терапии, такие как облучение внешним пучком или химиотерапия. В других предпочтительных воплощениях CD23 антагонисты (в конъюгированной и неконъюгированной форме) могут использоваться в совместных терапевтических режимах с химиотерапевтическими агентами. Специалисту в данной области техники ясно, что такие терапевтические режимы могут включать последовательное, одновременное, конкурентное или одинаково протяженное по времени введение описанных CD23 антагонистов и одного или более химиотерапевтических агентов. Хотя CD23 антагонисты могут вводиться, как описано выше, следует отметить, что в других воплощениях конъюгированные и неконъюгированные CD23 антагонисты могут вводиться пациентам,больным только раком, в качестве терапевтического агента первой линии. В таких воплощениях CD23 антагонисты могут вводиться пациентам, имеющим нормальные или средние запасы красного костного мозга, и/или пациентам, которые не подвергались и не подвергаются дополнительным терапиям, таким как облучение внешним пучком или химиотерапия. Однако, как описано выше, выбранные воплощения изобретения включают введение CD23 антагонистов пациентам с подавлением костного мозга в сочетании или соединении с одной или более дополнительными терапиями, такими как радиотерапия или химиотерапия (а именно, объединенные терапевтические режимы). Используемое здесь введение CD23 антагонистов в сочетании или в соединении с дополнительной терапией обозначает последовательное, одновременное, одинаково протяженное по времени, конкурентное, сопутствующее или объединенное введение или применение терапии и описанных антител. Специалисту в данной области техники ясно, что введение или применение различных компонентов объединенного терапевтического режима может привести к повышению общей эффективности лечения. Например, химиотерапевтические агенты могут вводиться стандартными, хорошо известными путями лечения в течение нескольких недель CD23 антагонистами настоящего изобретения. Наоборот, связанные с цитотоксином CD23 антагонисты могут вводиться внутривенно с последующим облучением внешним пучком локализованной опухоли. В других воплощениях антагонисты могут вводиться конкурентно с одним или более выбранными химиотерапевтическими агентами за один прием. Специалист в данной области техники (например, опытный онколог) может легко определить эффективные комбинированные терапевтические режимы без проведения экспериментов, на основании выбранной дополнительной терапии и описания настоящего изобретения. В этом отношении ясно, что комбинация CD23 антагонистов (с цитотоксином или без него) и химиотерапевтического агента может вводиться в любом порядке и в любой промежуток времени, которые обеспечивают терапевтическую пользу пациенту. Так, химиотерапевтический агент и CD23 антагонист могут вводиться в любом порядке или конкурентно. В выбранных воплощениях CD23 антагонисты настоящего изобретения вводят пациенту, который ранее подвергался химиотерапии. В других воплощениях CD23 антагонисты и химиотерапевтическое лечение проводят, по существу, одновременно или конкурентно. Например, пациенту можно вводить CD23 антагонисты, проводя курс химиотерапии. В предпочтительных воплощениях CD23 антагонисты вводят в течение одного года при любом химиотерапевтическом агенте или лечении. В других предпочтительных воплощениях CD23 антагонисты вводят в течение 10, 8, 6, 4 или 2 месяцев при любом химиотерапевтическом агенте или лечении. В других предпочтительных воплощениях CD23 антагонисты вводят в течение 4, 3, 2 или 1 недели при любом химиотерапевтическом агенте или лечении. Еще в одних предпочтительных воплощениях CD23 антагонисты вводят в течение 5, 4, 3, 2 или 1 дня при выбранном химиотерапевтическом агенте или лечении. Далее будет понятно, что два агента или типа лечения пациента могут проводиться в течение часов или минут (то есть, по существу, одновременно). Кроме того, в соответствии с настоящим изобретением пациент с подавлением костного мозга обозначает любого пациента, проявляющего пониженные компоненты крови. Специалисту в данной области техники ясно, что существуют определенные параметры компонентов крови, обычно использующиеся в качестве клинических индикаторов подавления костного мозга, и каждый может легко определить степень, в которой подавление костного мозга встречается у пациента. Примерами компонентов, использующих измерения подавления костного мозга, являются абсолютные нейтрофильные компоненты(ANC) или тромбоцитные компоненты. Такое подавление костного мозга или частичное удаление кост- 14007467 ного мозга может быть результатом различных биохимических расстройств или заболеваний или, более вероятно, результатом предшествующей химиотерапии или радиотерапии. В этом отношении специалисту в данной области техники ясно, что пациенты, которые подвергались обычной химиотерапии, обычно имеют пониженные запасы красного кровяного мозга. Более конкретно, конъюгированные или неконъюгированные CD23 антагонисты настоящего изобретения могут использоваться для эффективного лечения пациентов с показателем ANC менее чем около 2000/мм 3 или показателями тромбоцитов менее чем около 150000/мм 3. Более предпочтительно, CD23 антагонисты настоящего изобретения могут использоваться для лечения пациентов, имеющих ANC менее чем около 1500/мм 3, менее чем около 1000/мм 3 или, даже более предпочтительно, менее чем около 500/мм 3. Аналогично, CD23 антагонисты настоящего изобретения могут использоваться для лечения пациентов, имеющих показатель тромбоцитов менее чем около 75000/мм 3, менее чем около 50000/мм 3 или даже менее чем около 10000/мм 3. В общем смысле, специалист в данной области техники способен легко определить пациента с подавлением костного мозга, используя управляющие инструкции выполнения и процедуры. Как показано выше, многие пациенты с подавлением костного мозга подвергаются курсам лечения,включающим химиотерапию или радиотерапию внешним пучком. В последнем случае источник внешнего облучения предназначен для локального облучения злокачественности. Для способов имплантантной радиотерапии радиоактивные реагенты хирургически помещают в злокачественность, тем самым селективно облучая сайт заболевания. В любом случае, описанные антагонисты могут использоваться для лечения опухолевых заболеваний у пациентов с подавлением костного мозга независимо от причины. В этом отношении далее будет понятно, что CD23 антагонисты данного изобретения могут использоваться в сочетании или в соединении с любым химиотерапевтическим агентом или агентами (например, при проведении совместного терапевтического режима), которые расщепляют, понижают, ингибируют или контролируют рост опухолевых клеток in vivo. Использующиеся здесь термины'"химиотерапевтический агент" или "химиотерапевтические средства" обозначают любое терапевтическое соединение, которое вводят для лечения или предупреждения роста опухолевых клеток in vivo. В частности, химиотерапевтические агенты, подходящие для настоящего изобретения, включают "традиционные" химиотерапевтические агенты, такие как небольшие молекулы и позднее разработанные биологически активные вещества, такие как антитела, цитокины, антисенсорные молекулы и т.д., которые используются для снижения или подавления роста злокачественных клеток. Особенно предпочтительные химиотерапевтические агенты, которые подходят для использования с описанными CD23 антагонистами,включают коммерчески доступные антитела, направленные к антигенам, ассоциирующимся с опухолью,такие как Ритуксан, Зевалин, Герцептин, Лимфоцид, Кампат и т.д. В дополнительных предпочтительных воплощениях противоопухолевые антитела, подвергающиеся клиническим испытаниям, могут использоваться в сочетании с CD23 антагонистами. Например, IDEC-114 и IDEC-131 (IDEC Pharmaceuticals,Сан-Диего, СА), направленные против В 7 антигена и CD40L антигена, соответственно, могут использоваться с описанными антагонистами для лечения выбранных новообразований. В этом отношении Lym-1(Peregrin Phamaceuticals, Tustin СА) и Эрбитукс (Imclone Pharmaceuticals, Cambridge MA) также подходят для данного изобретения. Другие подходящие биологические химиотерапевтические агенты включают цитокины, такие как лимфокины, интерлейкины, факторы некроза опухоли и факторы роста. CD23 антагонисты также могут использоваться в сочетании с иммуносуппрессорными агентами, пролекарствами или цитотоксическими агентами для лечения выбранных злокачественностей. Химиотерапевтические антитела, которые являются особенно полезными в сочетании с CD23 антагонистами, включают Y2B8 и С 2 В 8 (Зевалин и Ритуксан), IDЕС-114 и IDEC-131 (IDEC Pharmaceuticals,Сан-Диего), Lym-1 и Lym-2, LL2 (Immunomedics Corp., Нью-Джерси), HER2 (Герцептин, Genentech Inc.,Южный Сан-Франциско), В 1 (Бексар, Coulter Pharm., Сан-Франциско), МВ 1, ВН 3, В 4, В 72.3 (CytogenCorp.), CC49 (National Cancer Institute) и 5 Е 10 (University of Iowa). Ритуксан представляет собой первоеFDA-подходящее моноклональные антитело для лечения В-клеточной лимфомы человека (см. US 5,843,439; 5,776,456 и 5,736,137, каждый из которых приведен здесь в качестве ссылки). Y2B8 является мышиным аналогом С 2 В 8. Ритуксан является химерным aнти-CD20 моноклональным антителом (МАт),которое ингибиторно к опухоли и сообщенно воспринимает определенные клеточные линии лимфомы при апоптозе химиотерапевтическими агентами in vitro. Антитело эффективно связывает систему комплемента человека, имеет высокое FcR связывание и может эффективно убивать лимфоциты человека invitro посредством комплементзависимого (CDC) и антителозависимого (ADCC) механизма (Reff и др.,Blood 83; 435-445 (1994. Специалисту в данной области техники ясно, что любое антитело, направленное против общих ассоциированных опухолей, или иммуномодулирующие антигены, такие как CD20,CD22, В 7 или CD40L, подходят для настоящего изобретения и могут использоваться в сочетании с описанными антагонистами. Более "традиционные" химиотерапевтические агенты, пригодные для настоящего изобретения,включают алкилирующие агенты, такие как тиотепа и циклофосфамид (CYTOXAN); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбокуон,метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленемеламин, три- 15007467 этиленфосфорамид, триэтилентиофосфаорамид и триметилолмеламин, горчичный азот, такой как хиорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлоретамин, гидрохлорид оксида мехлортамина, мелфалан, новембицин, фенестерин, преднимустин, трофосфамид, горчичный урацил; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как аклациномицины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, калихеамицин, карабицин, карминомицин; карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, епирубицин, езорубицин, идарубицин,маркелломицин, митомицины, микофенольная кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, куеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин,флоксуридин, 5-FU; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; антиадренергические средства, такие как аминоглутетимид, митотан, трилостан; наполнители фолиевой кислоты, такие как фролиновая кислота; ацеглатон; альдофосфамид гликозид; аминолевулиновая кислота; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазикуон; элформитин; эллиптиния ацетат; этоглуцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофилловая кислота; 2-этилгидразид; прокарбазин; PSK; разоксан; сизофиран; спирогерманий; тенуазоновая кислота; триазикуон; 2,2',2"-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Аrа-С"); циклофосфамид; тиотепа; таксоиды, например, паклитаксель (TAXOL, Bristol-Myers Squibb Oncology, Princeton, NJ) и доксетаксель (Taxotere, Rhone-Poulene Rorer, Antony, France); хлорамбуцил: гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; платиновые аналоги, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митомицин С; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; кселода; ибандронат; СРТ 11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноевая кислота; эсперамицины; капецитабин и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше соединений. В данное описание также включены антигормональные агенты, регулирующие или ингибирующие действие гормона на опухоли, такие как антиэстрогены, включая, например, тамоксифен, ралоксифен, 4(5)-имидазолы, ингибирующие ароматазу, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (Fareston); и антиандрогены, такие как флутамид, нилутамид, бикалутамид, леупролид и госерелин и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше соединений. Подходящие химиотерапевтические режимы включают комбинации лекарственных средств. Четырехчленная комбинация МОРР (мехлетамин (горчичный азот), винкристин (онковин), прокарбазин и преднизон) является очень эффективной для лечения различных типов лимфомы и составляет предпочтительное воплощение настоящего изобретения. Для МОРР-резистентных пациентов могут использоваться ABVD (например, адриамицин, блеомицин, винбластин и дакарбазин), ChlVPP (хлорамбуцил,винбластин, прокарбазин и преднизон), CABS (ломустин, доксорубицин, блеомицин и стрептозотоцин),МОРР плюс ABVD, МОРР плюс ABV (доксорубицин, блеомицин и винбластин) или BCVPP (кармустин,циклофосфамид, винбластин, прокарбазин и преднизон) комбинации. Arnold S. Freedman и Lee M.Isselbacher и др., eds., 13th ed. 1994), и V.Т. DeVita и др. (1997), и указанные здесь ссылки для стандартных доз и процедур. Эти терапии могут применяться в неизменном виде или могут быть изменены при необходимости для конкретного пациента, в сочетании с одним или более описанными здесь CD23 антагонистами. Дополнительные режимы, которые подходят для настоящего изобретения, включают применение одиночных алкилирующих агентов, таких как циклофосфамид или хлорамбуцил, или комбинаций, таких как CVP (циклофосфамид, винкристин и преднизон), CHOP (CVP и доксорубицин), С-МОРР (циклофосфамид, винкристин, преднизон и прокарбазин), CAP-ВОР (CHOP плюс прокарбазин и блеомицин), mBACOD (CHOP плюс метотрексат, блеомицин и лейковорин), ProMACE-МОРР (преднизон, метотрексат,доксорубицин, циклофосфамид, этопозид и лейковорин плюс стандартный MOPP), ProMACE-CytaBOM(преднизон, доксорубицин, циклофосфамид, этопозид, цитарабин, блеомицин, винкристин, метотрексат и лейковорин) и МАСОР-В (метотрексат, доксорубицин, циклофосфамид, винкристин, фиксированная доза преднизона, блеомицин и лейковорин). Специалист в данной области техники может легко определить стандартные дозы и схемы для каждого из этих режимов. CHOP также может объединяться с блеомицином, метотрексатом, прокарбазином, горчичным азотом, цитозинарабинозидом и этопозидом. Другие пригодные химиотерапевтические агенты включают, но не ограничиваются ими, 2-хлордезоксиаденозин (2-CDA), 2'-дезоксикоформицин и флударабин. Для пациентов с промежуточной или высокой степенью NHL, которые не могут достигать облегчения или спада, используется облегчающая терапия. В облегчающих терапиях используются такие лекар- 16007467 ственные средства, как цитозинарабинозид, цисплатин, этопозид и ифосфамид, вводимые отдельно или в комбинации. В рецидивных или агрессивных формах определенных опухолевых заболеваний часто используются следующие составы: IMVP-16 (ифосфамид, метотрексат и этопозид), MIME (метил-gag,ифосфамид, метотрексат и этопозид), DHAP (дексаметазон, высокая доза цитарабина и цисплатина),ESHAP (этопозид, метилпредизолон, HD цитарабин, цисплатин), СЕРР(В) (циклофосфамид, этопозид,прокарбазин, преднизон и блеомицин) и CAMP (ломустин, митоксантрон, цитарабин и преднизон), каждый с известными скоростями дозы и схемами. Количество химиотерапевтического агента, использующегося в сочетании с CD23 антагонистами данного изобретения, могут изменяться в зависимости от субъекта и могут вводиться известными из уровня техники способами. Смотри, например, Bruce A. Chabner и др., Antineoplastic Agents, в GOODMANGELMAN'S THE PHARMACOLOGICAL BASIS OF THERAPEUTICS 1233-1287 (Joel G. Hardman и др.,eds., 9th ed. 1996). Использующийся здесь термин "иммуносуппрессорный агент" для дополнительной терапии относится к веществам, которые подавляют или понижают действия иммунной системы млекопитающего при лечении. Они включают вещества, которые подавляют производство цитокинов, понижают или подавляют экспрессию полуантигена или маскируют МНС антигены. Примеры таких агентов включают 2 амино-6-арил-5-замещенные пиримидины (смотри US 4,665,077, описание которого приведено здесь в качестве ссылки), азатиоприн; циклофосфамид; бромкриптин; даназол; дапсон; глутаральдегид (который маскирует МНС антигены, как описано в US 4,120,649); антиидиотипические антитела для МНС антигенов и МНС фрагментов; циклоспорин А; стероиды, такие как глюкокортикостероиды, например преднизон, метилпреднизон и дексаметазон: цитокины или антагонисты цитокинового рецептора, включая антитела против интерферона, антитела против фактора- некроза опухоли, антитела против факторанекроза опухоли, антитела против интерлейкина-2 и антитела против IL-2 рецептора; антитела противLFA-1, включая антитела против CDl lа и антитела против CD18; антитела против L3T4; гетерологичный антилимфоцитный глобулин; pan-Т антитела, предпочтительно антитела против CD3 или противCD4/CD4a; растворимый пептид, содержащий LFA-3 связывающий домен (WO 90/08187, опубликованный 26.07.90), стрептоланаза: TGF-; стрептодорназа; РНК или ДНК из клетки-хозяина; FK506; RS61443; дезоксиспергуалин; рапамицин; Т-клеточный рецептор (Cohen и др. US 5,114,721); фрагменты Тклеточного рецептора (Offner и др. Science. 251: 430-432 (1991), WO 90/11294; Laneway, Nature, 341: 482(1989) и WO 91/01133) и антитела Т-клеточного рецептора (ЕР 340,109), такие как Т 10 В 9. Использующийся здесь термин "цитотоксический агент" относится к веществу, которое ингибирует или предотвращает функционирование клеток и/или вызывает разрушение клеток. Термин включают радиоактивные изотопы, химиотерапевтические агенты и токсины, такие как токсины небольших молекул или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, или их фрагменты. Термин "цитокин" является общим термином для белков, при котором одна клеточная популяция действует на другую клетку как межклеточные медиаторы. Примерами таких цитокинов являются лимфокины, монокины и обычные полипептидные гормоны. Цитокины включают гормон роста, такой как человеческий гормон роста, N-метионильный человеческий гормон роста и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны,такие как фолликулостимулирующий гормон (FSH), тироидстимулирующий гормон (TSH) и лютеинизирующий гормон (LH); фактор роста гепатита; фактор роста фибробласта; пролактин; плацентарный лактоген; фактор- и - некроза опухоли; муллерианингибирующее вещество; гонадотропинассоциированный пептид мыши; ингибин; активин; фактор сосудистого эндотелиального роста; интегрин; тромбопоэтин (ТРО); факторы роста нерва, такие как NGF-13; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF- и TGF-; инсулиноподобный фактoр-I и -II роста; эритропоэтин(ЕРО); остеоиндуктивные факторы; интерфероны, такие как интерферон-, - и -; колониестимулирующие факторы (CSF), такие как макрофаг-CSF (M-CSF); гранулоцитмакрофаг-CSF (GM-CSF) и гранулоцит-CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-1a, IL-2, IL-g, EL-4, EL-5, IL-6, EL-7, IL-8, IL9, IL-11, IL-12, IL-15; фактор некроза опухоли, такой как TNF- или TNF- и другие полипептидные факторы, включая LIF и наборный лиганд (KL). Использующийся здесь термин "цитокин" включает белки природных источников или из рекомбинантной клеточной культуры и биологически активные эквиваленты природных последовательностей цитокинов. Использующийся здесь термин "пролекарство" относится к предшественнику или производной форме фармацевтически активного вещества, которая является менее токсичной по отношению к клеткам опухоли в сравнении с близким лекарственным средством и способна ферментативно активироваться или превращаться в более активную родственную форму. См., например, Wilman, "Prodrugs in Cancer"Prodrugs: A Chemical Approach to Targeted Drug Delivery", Directed Drug Delivery, Borchardt и др., (ed.),pp.247-267, Humana Press (1985). Пролекарства, пригодные для изобретения, включают, но не ограничиваются ими, фосфатсодержащие пролекарства, тиофосфатсодержащие пролекарства, сульфатсодержащие- 17007467 пролекарства, пептидсодержащие пролекарства, D-аминокислотные модифицированные пролекарства, гликозилированные пролекарства, -лактамсодержащие пролекарства, необязательно замещенные феноксиацетамидсодержащие пролекарства или необязательно замещенные фенилацетамидзамещенные пролекарства, 5-фторцитозин и другие пролекарства 5-фторуридина, которые могут превращаться в более активное цитотоксическое свободное лекарственное средство. Следующие примеры цитотоксических лекарственных средств, которые могут превращаться в пролекарственную форму для применения в настоящем изобретении, включают, но не ограничиваются, химиотерапевтические агенты, описанные выше."Липосома" представляет собой маленькую везикулу, состоящую из различных типов липидов,фосфолипидов и/или сурфактантов, которые являются пригодными для направленного введения лекарственных средств (таких, как описанные здесь антагонисты и, необязательно, химиотерапевтические агенты) млекопитающему. Соединения для липосомы обычно располагаются в бислойной формации,подобной расположению липидов в биологических мембранах. Как указывалось выше, антагонисты настоящего изобретения, иммунореактивные фрагменты или их рекомбинанты могут вводиться в фармацевтически эффективном количестве для лечения злокачественностей у млекопитающего in vivo. В этом отношении ясно, что описанные антагонисты могут готовиться для облегчения введения и обеспечения стабильности активного агента. Предпочтительно фармацевтические композиции в соответствии с настоящим изобретением включают фармацевтически приемлемый нетоксичный стерильный носитель, такой как физиологический соляной раствор, нетоксичные буферные растворы, консерванты и им подобные. В целях данного изобретения фармацевтически эффективное количество модифицированного CD23 антагониста, иммунореактивного фрагмента или его рекомбинанты обозначает количество, достаточное для достижения эффективного связывания с CD23 антигеном в опухолевых клетках и обеспечения повышения гибели этих клеток. Конечно, фармацевтические композиции настоящего изобретения могут вводиться в единичной или нескольких дозах для обеспечения фармацевтически эффективного количества CD23 антагониста. Более конкретно, описанные антагонисты и способы могут быть полезны для уменьшения размера опухоли, ингибирования роста опухоли и/или пролонгирования времени жизни млекопитающих, больных раком. В соответствии с этим данное изобретение также относится к способу лечения опухолей у человека или другого млекопитающего путем введения такому человеку или млекопитающему эффективного нетоксичного количества CD23 антагониста. Специалист в данной области способен обычными экспериментами определить эффективное нетоксичное количество антагониста, необходимое для лечения злокачественностей. Например, терапевтически активное количество антагониста может изменяться в зависимости от факторов, таких как стадия болезни (например, стадия I или стадия IV), возраст, пол,медицинские осложнения (например, иммуносупрессорное состояние или заболевания) и вес субъекта и способность антагониста вызывать нужный отклик у субъекта. Дозовый режим может регулироваться для обеспечения оптимального терапевтического отклика. Например, несколько отдельных доз могут вводиться ежедневно или доза может быть пропорционально уменьшена, что определяется срочностью терапевтической ситуации. Вообще, однако, эффективная доза предполагается в области от около 0,05 до 100 мг на килограмм веса тела в день и, более предпочтительно, от около 0,5 до 10 мг на килограмм веса тела в день. Согласно объему настоящего описания антагонисты изобретения могут вводиться человеку или другому млекопитающему в соответствии с указанными выше способами лечения в количестве, достаточном для получения такого действия в терапевтической или профилактической степени. Антагонисты по изобретению могут вводиться такому человеку или другому млекопитающему в обычной дозированной форме, полученной при смешении антагониста по изобретению с обычным фармацевтически приемлемым носителем или разбавителем в соответствии с известными методиками. Специалисту в данной области техники известно, что форма и тип фармацевтически приемлемого носителя или разбавителя определяются количеством активного ингредиента, с которым он объединяется, способом введения и другими хорошо известными величинами. Специалист в данной области может предположить, что смесь,содержащая один и более типов антагонистов, в соответствии с настоящим изобретением может оказаться особенно эффективной. Способы получения и введения CD23 антагонистов хорошо известны или могут легко определяться специалистом в данной области. Способ введения антагониста по изобретению может быть оральным,парентеральным, ингаляционным или местным. Использующийся здесь термин "парентеральный" включает внутривенное, внутриартериальное, внутрибрюшинное, внутримышечное, подкожное, ректальное или вагинальное введение. Внутривенная, внутриартериальная, подкожная и внутримышечная формы парентерального введения являются общепредпочтительными. Хотя все эти формы введения подходят подобъем изобретения, предпочтительной формой введения является раствор для инъекции, особенно для внутривенной или внутриартериальной инъекции, или клизмы. Обычно подходящая фармацевтическая композиция для инъекции может включать буфер (например, ацетатный, фосфатный или цитратный буфер), сурфактант (например, полисорбат), необязательно стабилизирующий агент (например, альбумин человека) и т.д. Однако в других способах, подходящих под данное описание, антагонисты могут быть направлены непосредственно к сайту злокачественности, тем самым повышается влияние терапев- 18007467 тического агента на опухолевую ткань. Препараты для парентерального введения включают стерильные водные или неводные растворы,суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъекционные органические эфиры, такие как этилолеат. Водные носители включают воду, водные растворы спиртов, эмульсии или суспензии, включающие соляную и буферную среду. В указанном изобретении фармацевтически приемлемые носители включают, но не ограничиваются ими, 0,01-0,1 М и предпочтительно 0,05 М фосфатного буфера или 0,8% соляного раствора. Другие общие парентеральные связующие вещества включают растворы фосфата натрия, декстрозу Рингери, декстрозу и хлорид натрия, лактат Рингери или фиксированные масла. Внутривенные связующие вещества включают жидкие и питательные наполнители, электролитные наполнители, такие как наполнители на основе декстрозы Рингери, и им подобные. Могут также присутствовать консерванты и другие добавки, такие как, например, антимикробные, антиокислительные, хелатирующие агенты и инертные газы и им подобные. Специалисту в данной области техники известно, что фармацевтические композиции, пригодные для применения в качестве инъекций, включают стерильные водные растворы (где вещество водорастворимо) или дисперсии и стерильные порошки для немедленного приготовления стерильных инъекционных растворов или дисперсий. В таких случаях композиция должна быть стерильной и текучей в такой степени, чтобы легко впрыскиваться. Она должна быть стабильной в условиях получения и хранения и предпочтительно сохраняться при вредном воздействии микроорганизмов, таких как бактерии и грибки. Носителем может быть среда растворителя или дисперсии, содержащая, например, воду, этанол, полиол(например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и им подобные) и их подходящие смеси. Необходимая текучесть может достигаться, например, с помощью слоя, такого как лецитин, с поддержанием необходимого размера частиц в случае дисперсии и при использовании сурфактантов. Более конкретно, терапевтические составы, включающие используемые в соответствии с настоящим изобретением антагонисты, получают для хранения путем смешивания антагониста, имеющего необходимую степень чистоты, необязательно с фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol. A. Ed. (1980, в виде лиофилизованных составов или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для пациента в применяемых дозах и концентрациях и включают буферы,такие как фосфатные, цитратные и других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид, бензетония хлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и mкрезол); полипептиды низкого молекулярного веса (менее чем около 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводороды, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; сахара, такие как сахароза, манноза, трегалоза или сорбит; сольобразующие ионы, такие как натрий; комплексы металлов (например, Zn-белковые комплексы) и/или неионные сурфактанты, такие как TWEENTM, PLURONICSTM или полиэтиленгликоль (PEG). Лиофилизованные составы, подходящие для подкожного введения, описаны в W097/04801. Такие лиофилизованные составы могут составляться с различными разбавителями до высокой концентрации белка, и полученный состав может вводиться подкожно млекопитающему, находящемуся на лечении. Составы могут также включать более одного активного соединения, что необходимо для конкретного случая лечения, предпочтительно соединения с комплементарными активностями, которые не снижают действия друг друга. Например, для дальнейшего получения химиотерапевтического агента может потребоваться цитокин или иммуносупрессорный агент (например, один из которых действует на Тклетки, такой как циклоспорин, или антитело, которое связывается с Т-клетками, например один из которых связывает LFA-1). Эффективное количество таких других агентов зависит от количества антагониста, присутствующего в составе, типа заболевания или лечения и других факторов, описанных выше. Они обычно используются в тех же дозах и теми же путями введения, которые использовались ранее,или около от 1 до 99% использующихся здесь доз. Активные ингредиенты могут также помещаться в микрокапсулы, полученные, например, технологиями 30 коацервации или смежной полимеризацией, например гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы, соответственно, в коллоидных системах направленного транспорта лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсиях. Такие технологии описаны в Remington's Pharmaceutical Sciences 16th edition, Osol. A. Ed. (1980). Могут также получаться составы длительного высвобождения. Подходящие примеры составов длительного высвобождения включают полупроницаемые матриксы твердых гидрофобных полимеров, содержащие антагонист, где матриксы находятся в форме сформированных изделий, например пленок или микрокапсул. Примеры матриксов длительного высвобождения включают полиэфиры, гидрогели (на- 19007467 пример, поли(2-гидроксиэтилметакрилат) или поли(виниловые спирты, полилактиды (US 3,773,919),сополимеры L-глутаминовой кислоты и -этил-L-глутамат, недеградируемый этиленвинилацетат, деградируемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOT (инъектируемые микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и леупролидацетата) и поли-D-(-)-3-гидроксибутановая кислоту. Составы, использующиеся для введения in vivo, должны быть стерильными. Это легко осуществляется фильтрацией через стерильные фильтрационные мембраны. Предотвращение действия микроорганизмов может достигаться с помощью различных антибактериальных и противогрибковых средств, например парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимерозала и им подобных. Во многих случаях предпочтительно включение в композицию изотонических агентов, например сахаров, полиспиртов, таких как манноза, сорбит, или хлорида натрия. Пролонгированная абсорбция инъекционных композиций может достигаться путем включения в композицию агента, который замедляет абсорбцию, например моностеарата алюминия и желатина. В любом случае, стерильные инъекционные растворы могут получаться введением активного соединения (например, антагониста отдельно или в сочетании с другими активными агентами) в нужном количестве в подходящем растворителе с одним компонентом или с сочетанием перечисленных здесь компонентов, при необходимости с последующей стерилизацией после фильтрования. Вообще, дисперсии получают введением активного соединения в стерильное связующее вещество, которое содержит основную среду для дисперсии и необходимые другие ингредиенты из тех, которые перечислены выше. В случае стерильных порошков для получения стерильных инъекционных растворов предпочтительными способами получения являются вакуумная сушка и метод замораживания-высушивания, что приводит к образованию порошка активного ингредиента плюс любой дополнительный нужный ингредиент из его заранее простерилизованного-отфильтрованного раствора. Составы для полученных инъекций помещают в контейнеры, такие как ампулы, баллоны, бутылочки, шприцы, или запаивают в асептических условиях способами, известными из уровня техники. Емкости могут получаться из различных материалов, таких как стекло или пластик, и хранить, содержать внутри или включать дисперсию композиции, которая является эффективной для лечения выбранной болезни или заболевания. Кроме того, емкость может иметь стерильный вход доступа (например, емкостью может быть пакет для внутривенного раствора или ампула, имеющий стопор, протыкаемый гиподермальной инъекционной иглой). Эти составы могут упаковываться и продаваться в виде набора, такого как набор, описанный в заявках US 09/259,337 и US 09/259,338, каждая из которых приведена здесь в качестве ссылки. Такие изделия производства предпочтительно содержат этикетки или упакованную внутрь инструкцию, в которой указано, что композиции пригодны для лечения пациентов, страдающих или предрасположенных к раку, злокачественности или опухолевым заболеваниям (например, хронической лимфоцитной лейкемии). Использующийся термин "упакованный внутрь" обозначает инструкции,обычно включающиеся в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозе, введении, противопоказаниях и/или предостережениях, касающихся применения таких терапевтических продуктов. Изделие производства может также включать вторую емкость, включающую фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекции (BWFI), фосфорно-буферный соляной раствор, раствор Рингери и раствор декстрозы. Оно также может включать другие материалы, необходимые с коммерческой и потребительской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы. Как подробно описаны выше, настоящее изобретение относится к соединениям, композициям, наборам и способам для лечения опухолевых заболеваний у млекопитающего, нуждающегося в лечении. Предпочтительно субъектом является человек. Хотя настоящее изобретение является особенно эффективным для лечения CD23+ гематологических злокачественностей, включая хроническую лимфоцитную лейкемию, описанные антагонисты и способы могут использоваться для лечения любых CD23+ новообразований. В этом отношении CD23+ опухолевое заболевание (например, рак и злокачественности) может включать твердые опухоли, такие как меланомы, глиомы, саркомы и карциномы, а также миелоидные или гематологические злокачественности, такие как лимфомы и лейкемии. Описанное изобретение может использоваться для профилактики или терапевтического лечения любой опухоли, включающейCD23 антигенный маркер, который позволяет осуществить доставку антагониста к раковым клеткам. Примеры рака, который можно лечить, включают, но не ограничиваются ими, рак простаты, толстой кишки, кожи, грудной железы, яичников, легких и поджелудочной железы. В предпочтительных воплощениях выбранные антагонисты могут использоваться для лечения. Более конкретно, антитела настоящего изобретения могут использоваться для лечения саркомы Калоши, неоплазм ЦНС (капиллярные гемангиобластомы, менингиомы и церебральные метастазы), мастоцитомы, меланомы, гастрокишечных и почечных сарком, рабдомиосаркомы, глиобластомы (предпочтительно мультиформа глиобластомы),леиомиосаркомы, ретинобластомы, папиллярной цистоденокарциномы яичников, опухоли Вильма или небольшой клеточной карциномы легких. Понятно, что подходящие антитела могут вырабатываться дляCD23, по отношению к каждой из указанных выше опухолей без проведения экспериментов ввиду данного описания. В целях разъяснения "млекопитающее" обозначает любого животного, классифицирующегося как- 20007467 млекопитающее, включая людей, домашних животных, скот и животных зоопарка, спортивных или комнатных животных, таких как собаки, лошади, кошки, коровы и т.д., предпочтительно млекопитающим является человек."Лечение" обозначает терапевтическое лечение и профилактику или предупреждение. Пациенты,нуждающиеся в лечении, включают пациентов, уже имеющих заболевание или нарушение, а также пациентов, у которых нужно предотвратить заболевание или нарушение. Следовательно, млекопитающее может диагностироваться, как имеющее заболевание или нарушение или которое может быть предрасположено или подвержено заболеванию. Как описано ранее, способы, композиции и изделия производства настоящего изобретения являются особенно полезными для лечения хронической лимфоцитной лейкемии. Однако лечение других CD23+ гематологических злокачественностей может также быть эффективным для описанных способов и полностью подходит под объем данного изобретения. В этом отношении примерные гематологические злокачественности, которые можно лечить с помощью описанного изобретения, включают небольшие Тклеточные лимфомы, лимфоцитную лимфому, покрытую клеточную лимфому, лимфому Ходкина и лимфому, отличную от лимфомы Ходкина, а также лейкемии, включая ALL-L3 (лейкемия типа Буркитта), острую Т-клеточную лейкемию, хроническую лейкемию костного мозга и моноцитные клеточные лейкемии. Далее следует заметить, что соединения и способы настоящего изобретения являются особенно эффективными для лечения различных В-клеточных лимфом, включая фолликулярную клеточную лимфому низкой степени/(NHL) (FCC), клеточную лимфому коры головного мозга (MCL), диффузионную обширную клеточную лимфому (DLCL), небольшую лимфоцитную (SL) NHL, фолликулярную NHL средней степени, диффузионную NHL средней степени, иммунобластомную NHL сильной степени, лимфобластомную NHL сильной степени, малую нерасщепляющую клетки NHL сильной степени, массовую болезнь NHL и макроглобулинемию Вальденстрома, лимфоплазмацитоидную лимфому (LPL), клеточную лимфому коры головного мозга (MCL), фолликулярную лимфому (FL), диффузионную обширную клеточную лимфому (DLCL), лимфому Буркитта, лимфомы, связанные со СПИДом, моноцитную Вклеточную лимфому, ангиоиммунобластомную лимфоаденопатию, небольшую лимфоцитную, фолликулярную, диффузионную обширную клеточную, диффузионную небольшую расщепляющуюся клеточную, обширную клеточную иммунобластомную лимфобластому, небольшую, нерасщепляющуюся, Буркитта и не Буркитта, фолликулярную, преимущественно обширную клеточную, фолликулярную, преимущественно небольшую расщепляющуюся клеточную и фолликулярную, смешанную небольшую расщепляющуюся и обширную клеточную лимфомы. Смотри Gaidono и др., "Lymphomas", IN CANCER:PRINCIPLESPRACTICE OF ONCOLOGY, Vol. 2: 2131-2145 (DeVita и др., eds., 5th ed. 1997). Специалисту в данной области должно быть ясно, что эти лимфомы и лейкемии часто имеют различные названия из-за изменяющихся систем классификации и что пациенты с лимфомами, классифицированными под другими названиями, могут также лечиться объединенными терапевтическими режимами настоящего изобретения. В добавление к указанным выше опухолевым заболеваниям понятно, что раскрываемое изобретение может успешно использоваться для лечения других злокачественностей, экспрессирующихCD23 антиген. Данное описание станет более понятным при рассмотрении следующих примеров. Такие примеры,однако, демонстрируют предпочтительные способы применения настоящего изобретения и не ограничивают объем изобретения и прилагаемой здесь формулы изобретения. Некоторые антитела, использующиеся для проведения экспериментов, приведены ниже в примерах. Как указывалось выше, IDEC-152 (р 5 Е 8) является античеловеческим CD23 Мат, подобным антителу человека, которое содержит гамма 1 тяжелую цепь человека (LotZC152-02), и Ритуксан (ритуксимаб) является античеловеческим CD20 специфическим гамма 1 химерным антителом мыши-человека (LotE9107Al:Lot D9097A1). Другие использующиеся антитела включают мышиные античеловеческие CD23 Мат, меченные с помощью РЕ (Cat33615 Х, BD Pharmingen, Сан-Диего, СА), и античеловеческие CD4 Мат, подобные антителам человека, СЕ 9.1 с человеческой гамма 1 цепью (Lot M2CD4156). RF-2 полное человеческое антитело, специфичное к RSV белку слияния, использовалось в качестве изотипа (IgG1) контрольного антитела. Пример 1. Экспрессия CD23 в В-лимфоме и B-CLL клетках. Экспрессию CD23 в определенных клеточных линиях лимфомы определяют поточной цитометрией. Более конкретно, CD23 экспрессию определяют поточной цитометрией с помощью aнти-CD23 РЕмеченного антитела (BD Biosciences, Cat.No: 33615X). Относительную интенсивность флуоресценции(RFI) связавшегося антитела определяют по сравнению значения интенсивности флуоресценции антиСD23-РЕ антитела, связавшегося с клетками, со значением интенсивности флуоресценции РЕ-меченных калибровочных величин (QuantiBrile). Относительную экспрессию CD23 рассчитывают как RFI (образец)-RFI SKW клеток.CD20- и В 7-экспрессирующие клеточные линии В-лимфомы (SKW, SB, Daudi, Raji, Ramos и DHL-4 клетки) выращивают в полной среде. Полная среда представляет собой RPMI 1640 среду (Irvine Scientific,Santa Ana, CA) с 10% нагретым инактивированным FBS (Hyclone), 2 мМ 1-глутамином, 100 ед./мл пени- 21007467 циллина и 100 мкг/мл стрептомицина. SKW клеточная линия является положительной к вирусу Эпштейна-Барра (EBV) и может вызывать секрецию IgM (SKW 6.4, ATCC). SB клеточная линия из пациента с острой лимфобластомной лейкемией является положительной для EBV (CCL-120, ATCC). Daudi клеточную линию выделяют из пациента с лимфомой Буркитта (CCL-213, ATCC). Raji и Ramos клеточные линии также выделяют из пациентов с лимфомой Буркитта (CCL-86, CRL-1596, ATCC). DHL-4 выделяют из пациента с диффузионной гистоцитной лимфомой (Epstein и др., Cancer, 1978, 42:2379). В этих тестах 3 из 6 клеточных линий проявляют CD23 экспрессию. Как показано непосредственно ниже в табл. 1, CD23 экспрессия в SKW и SB клетках является приблизительно сравнимой, тогда как Raji клетки проявляют только низкий уровень экспрессии антигена, эквивалентный 10% CD23 уровней, экспрессирующихся в SKW клетках. Кроме того, для определения уровней экспрессии CD23 эти же клеточные линии исследуют на определение их уровня пригодности для апоптоза, индуцированного анти-CD23 антителами. Конкретно,индукция апоптоза в каждой из 6 клеточных линий определялась с помощью испытаний с каспазой-3. Специалисту в данной области техники ясно, что испытания с каспазой-3 позволяют определить активацию фермента каспазы-3, критического раннего признака апоптоза, индуцирующего гибель. В данном примере SKW клетки плотностью 0,5x106 клетки/мл в среде культуры (RPMI-2% FBS) инкубируют с 10 мкг/мл IDEC-152 при 4 С в пробирках с клеточной культурой во льду. Через 1 ч инкубирования несвязанное антитело в среде удаляют центрифугированием. Клетки ресуспендируют в среде для роста в подходящих объемах и добавляют в 24-ячеечные подложки культуры ткани (1,5 х 106 клетки/ячейка) с и без добавления античеловеческого Ig-Fc специфического вторичного антитела козла (15 мкг/мл) в качестве перекрестного линкера. После инкубирования в течение 18 ч клетки собирают и анализируют на апоптоз поточной цитометрией. В частности, клетки промывают и фиксируют при 4 С с помощью Цитофикса (Цитофикс/Цитоперм набор, Pharmingen Cat2075KK). Через 20 мин фиксации клетки промывают и добавляют 15 мкл родственного очищенного РЕ-конъюгированного поликлонального антитела антикаспазы-3 кролика (Pharmingen Cat.67345) и 50 мкл Цитоперма. Клетки инкубируют во льду в темноте в течение 30 мин. После инкубирования клетки промывают однократно и ресуспендируют при промывании Цитопермом. Данные поточной цитометрии измеряют на FACScan и анализируют с помощью Указанные выше результаты показывают, что эти клеточные линии, экспрессирующие высокие уровни CD23, подвергаются программированной клеточной гибели при воздействии перекрестного связывания антител с CD23. Наоборот, клетки, которые не экспрессируют CD23 в высоких уровнях, не подвергаются экстенсивному апоптозу. В соответствии с этим данный пример обеспечивает идентификацию выбранных клеточных линий, которые могут выступать в качестве клинически релевантных моделей дляCD23+ В-клеточных злокачественностей (например, SKW клетки и SB клетки). Пример 2. Экспрессия CD23 в CLL клетках. Для того чтобы показать клиническую применимость настоящего изобретения, экспрессию CD23 на некоторых различных CLL образцах (31 пациент) тестируют в цельной крови с помощью поточной цитометрии. Используя подходящие реагенты, поточную цитометрию осуществляют, как описано в примере 1. В этом отношении экспрессию CD20 и CD23 определяют на барьерных клетках, которые являютсяCD19+ положительными. Конкретно, используют РЕ-меченные анти-СD20 (BD Biosciences/Pharmingen,Cat555623) и aнти-CD23 (BD Biosciences/Pharmingen, Cat33615X) моноклональные антитела для определения CD20 и CD23 молекул, соответственно. У всех пациентов определяют экспрессию CD20 и CD23 антигенов в CD19+ B-клетках, как показано непосредственно ниже в табл. 2. Пациенты, экспрессирующие высокие уровни CD20, экспрессируют различные степени CD23 антигена в их CLL образцах. Уровни определяют процентным соотношениемCD19+ клеток и значений интенсивности флуоресценции (MFI). Однако даже у пациентов, экспрессирующих низкие уровни CD20, измеренные величины показывают, что могут экспрессироваться относительно высокие уровни CD23. Это открытие показывает, что CD23 антиген может являться крайне при- 22007467 влекательной мишенью для терапевтически релевантных антител, таких как антитела, описанные в данном изобретении. Таблица 2 Экспрессия CD23 и CD20 в B-CLL клетках из CLL пациентов Пример 3. Связывание IDEC-152 с CD23+ клетками. Для дальнейшего иллюстрирования преимуществ настоящего изобретения определяют связывающую активность IDEC-152 с CD23 в клетках SKW лимфомы с помощью поточной цитометрии, как описано выше в предшествующих примерах. Как указано выше, SKW клетки могут использоваться для обеспечения клинически релевантной модели для CD23+ злокачественностей, включая CLL. Результаты испытания представлены на фиг. 1, которая показывает специфическое связывание Ритуксана и IDEC152 с SKW клетками в зависимости от концентрации. Связывающую активность вычисляют с помощью величины интенсивности флуоресценции и показывают, что SKW клетки связывают aнти-CD23 антитела в существенно более высоких уровнях по сравнению с анти-СD20 антителами. Это показывает, что в определенных клеточных линиях и опухолях CD23 могут проявлять более высокую плотность эпитопа по сравнению с другими маркерами, такими как CD20. Как и ожидалось, изотип-конкурентное контрольное антитело нерелевантной специфичности (СЕ 9.1, направленное против CD4) не связывается с SKW. Этот пример- 23007467 и соответствующие результаты, представленные ниже на фиг. 1, подтверждают необходимость использования CD23 в качестве мишени для терапевтических антител при лечении выбранных новообразований. Пример 4. IDEC-152 медиирует ADCC активность в CD23+ клетках. Определяют способность IDEC-152 медиировать ADCC опухолевых клеток. В испытаниях ADCC лимфомы клетки (SKW или SB) и активированные человеческие периферические моноциты (РВМС) используют в качестве мишеней и эффекторов клетки, соответственно. РВМС выделяют из цельной крови здоровых доноров, используя Histopaque (Sigma-Aldrich Corp., St. Louis, МО). РВМС выращивают в концентрации 5x106 клетки/мл в полной среде с 20 U/мл рекомбинантного человеческого IL-2 (Invitrogen,Carlsbad, CA) в 75 см 2 колбах с культурой ткани при 37 С и 5% СO2. На следующий день культуру, 1 х 106SKW или SB целевые клетки помечают с помощью 150 мкКи 51 Сr (Amersham Pharmacia Biotech, Piscataway;NJ) в течение 1 ч при 37 С и 5% СО 2. Клетки промывают 4 раза и ресуспендируют в 5 мл полной среды; 50 мкл клеточной суспензии помещают в каждую ячейку, содержащую равный объем тестируемых или контрольных антител. Ритуксимаб (Lot E9107A1) или IDEC-152 (Lot ZC 152-02) используют в качестве тестируемых антител, изотип (IgGI), конкурентный с СЕ 9.1 (Lot M2CD4156), антитело иррелевантной специфичности используют в качестве контроля. Все ячейки помещают в тройном экземпляре в 96-ячеечную емкость с круглым дном для культуры ткани. Клетки-эффекторы собирают, однократно промывают полной средой и добавляют в 1 х 106 клеток в объеме 100 мкл на ячейку с получением соотношения эффектора к мишени 50:1. Следующие контрольные ячейки также включаются в тройном экземпляре: клетки-мишени инкубируют с 100 мкл полной среды для определения спонтанного высвобождения и клетки-мишени инкубируют с 100 мкл 0,5% Triton Х-100 (Sigma-Aldrich Corp.) для определения максимального высвобождения. Культуру инкубируют в течение 4 ч при 37 С и 5% СО 2 и высвобождение 51 Сr в супернатанте культуры из-за лизиса клетки определяют гамма-счетчиком (ISODATA). Цитотоксичность определяют как процентное соотношение специфического лизиса и рассчитывают следующим образом: На фиг. 2 показан результат этого испытания и особенно ADCC активность IDЕС-152 и Ритуксана на CD20+/CD23+ SKW клетки. IDEC-152 и Ритуксан вызывают зависимую от дозы гибель SKW клеток с максимальной гибелью 75%, достигаемой при 10 и 1 мкг/мл концентраций антитела, соответственно,показывающей, что ритуксан является более активным по сравнению с IDEC-152 в медиировании ADCC у этой конкретной клеточной линии. Однако антителосвязывающая активность показана на фиг. 1, предполагая, что различия в активности между IDEC-152 и Ритуксаном не полностью относятся к антителосвязывающей эффективности или к плотности эпитопа CD23 и CD20. Как и предполагалось, только низкие уровни (10%) ADCC наблюдались с изотипом, конкурентным с человеческими СЕ 9.1 контрольными антителами (не показано). Пример 5. Синергизм IDEC-152 с Ритуксаном для медиирования ADCC активности. Для того чтобы показать синергетические аспекты настоящего изобретения с различными антителами, исследуют комбинацию IDEC-152 и Ритуксана на ADCC медиированную гибель опухоли in vitro.SKW клетки инкубируют с IDEC-152 в двух концентрациях (0,625 и 2,5 мкг/мл) отдельно или в сочетании с различными концентрациями Ритуксана. Такие же концентрации Ритуксана отдельно подвергают контролю. Полученную ADCC активность на опухолевые клетки измеряют так, как описано в примере 4,и активность показана на фиг. 3 А (0,625 мкг/мл IDEC-152) и 3 В (2,5 мкг/мл IDEC-152). Результаты испытаний показывают, что комбинация IDEC-152 с Ритуксаном повышает ADCC активность по сравнению с активностью, достигаемой с отдельным агентом. Более конкретно, на фиг. 3 А показано, что комбинация антител приводит к существенно более высоким уровням лизиса клетки во всех концентрациях Ритуксана по сравнению с IDEC-152 или Ритуксаном отдельно. Наоборот, как показано на фиг. 3 В, IDEC-152 является таким эффективным медиатором ADCC, что в более высоких концентрациях (например, 2,5 мкг/мл) любое потенциальное синергетическое действие подавляется антиСD23 антителом. Так, как показано на фиг. 3 В, никаких изменений в цитотоксичности не наблюдалось при высоких концентрациях IDEC-152 или Ритуксана. Этот пример графически иллюстрирует способность настоящего изобретения сильно повышать эффективность известных химиотерапевтических агентов, таких как Ритуксан. Пример 6. IDEC-152 вызывает апоптоз в CD23+ опухолевых клетках. Чтобы показать, что настоящее изобретение может использоваться для эффективного медиированияADCC активности и лизиса опухолевых клеток, анти-СD23 антитела исследуют для определения того, в какой степень они могут использоваться для индукции апоптоза в злокачественных клетках. В этом отношении в табл. 3 непосредственно ниже показан апоптоз, измеренный с помощью испытания с активацией каспазы-3, по существу, приведенного в примере 1. Процентное соотношение апоптоза замеряют через 4 и 24 ч путем измерения интенсивности флуоресценции в логарифмической шкале (MFI).% положительных клеток с активностью каспазы-3 и их значение интенсивности флуоресценции в логарифмической шкале Как показано в табл. 3 выше, SKW клетки, выращенные в присутствии IDEC-152 (p5E81), не проявляют существенной активности каспазы-3. Однако перекрестное связывание IDEC-152 и Ритуксана на поверхности SKW клетки приводит к повышению активации каспазы-3. Для сравнения, культуры, добавленные к изотипу подходящего контрольного антитела (СЕ 9.1) иррелевантной специфичности, не проявляют никакого апоптоза. Это подтверждает ранние результаты, показывающие, что антитела настоящего изобретения могут использоваться для индуцирования апоптоза в опухолевых клетках. Пример 7. Fc-рецепторы на клетках-эффекторах могут индуцировать перекрестное связывание антител. Как указано выше, перекрестное связывание антител настоящего изобретения повышает их способность индуцировать апоптоз в опухолевых клетках. Один механизм для индуцирования апоптоза in vivo может медиироваться через Fc-рецепторы на различных клетках-эффекторах. В соответствии с этим в данном примере клетки, экспрессирующие Fc-рецепторы, используют для перекрестного связывания сIDEC-152 и повышения индукции апоптоза in vitro.SKW клетки с плотностью 1x106 клеток/мл в среде культуры (RPMI-2% PCS) инкубируют с 10 мкг/мл антителами IDEC-152 (р 5 Е 8) или Ритуксана (С 2 В 8) при 4 С в пробирках с клеточной культурой. Через 1 ч инкубации несвязанное антитело в среде удаляют центрифугированием. Клетки ресуспендируют в среде роста в подходящих объемах и добавляют в 24-ячеечные подложки с культурой ткани (2x106 клетки/ячейка), с высаженным в течение ночи человеческим Fc-рецептором (FcRI), экспрессирующим СНО клетки (1 х 105), и инкубируют в 5% СO2 при 37 С. За инкубированием в течение различных периодов времени клетки собирают и анализируют на апоптоз с помощью поточной цитометрии, основываясь на испытании Tunel (BD Pharmingen. Cat6536 КК). Ясно, что испытание Tunel измеряет фрагментацию ДНК в течение поздних стадий апоптозной гибели. Анализ поточной цитометрии осуществляют наBecton-Dickinson FACScan с помощью FACScan Research оборудования и анализ полученных данных осуществляют с помощью WinList оборудования (Variety Software House). Процентное соотношение клеток, положительных для апоптоза, определяют как процентное соотношение преодолевших барьер клеток, которые являются положительными для вышеуказанного, автофлуоресценция. Клетки инкубируют сRF2 (IgGI), который выступает в качестве отрицательного контроля для эксперимента. Результаты этих измерений показаны ниже в табл. 4. Таблица 4 Перекрестное связывание IDEC-152 и С 2 В 8 через FcRI приводит к апоптозу- 25007467 Представленные выше результаты показывают, что перекрестное связывание IDЕС-152 и Ритуксана через FcRI заставляет SKW клетки подвергаться апоптозу. Этот пример служит доказательством того,что встречающиеся в природе рецепторы на поверхности различных клеток-эффекторов могут приводить к перекрестному связыванию антитела и последующему апоптозу CD23+ злокачественных клеток in vivo. Пример 8. Индукция апоптоза с помощью IDEC-152 и Ритуксана в CD23+ клетках. Способность IDEC-152 индуцировать апоптоз в CD23+ злокачественных В-клетках далее показанаin vitro с помощью клеток SKW лимфомы. Апоптоз определяют испытанием с каспазой-3, по существу,описанным в примере 1. Для этого примера SKW клетки с плотностью 0,5 х 106 клетки/мл в среде культуры (RPMI-2% FBS) инкубируют с повышенными дозами антител IDEC-152 или Ритуксана при 4 С в пробирках с клеточной культурой во льду. Через 1 ч инкубирования несвязанное антитело в среде удаляют центрифугированием. Клетки ресуспендируют в среде роста в подходящих объемах и добавляют в 24 ячеечные подложки с культурой ткани (1,5 х 106 клетки/ячейка) с и без добавления античеловеческого IgG специфичного вторичного антитела козла (15 мкг/мл для перекрестного связывания). За инкубированием в течение 18 ч клетки собирают и анализируют на апоптоз поточной цитометрией, по существу, описанной в примере 1. На фиг. 4 А и 4 В показано, что анти-СD23 антитела могут использоваться для эффективного индуцирования апоптоза в CD23+ опухолевых клетках. Более конкретно, на фиг. 4 А показано, что повышенные концентрации перекрестно связанного IDEC-152 приводят к повышению апоптоза в SKW клетках. При концентрациях 5 мкг/мл IDEC-152 и более приблизительно 60% клеток подвергаются апоптозу в течение периода инкубирования. Аналогично, фиг. 4 В показывает, что перекрестное связывание антител с CD20 и CD23 может значительно повышать скорость индукции апоптоза в опухолевых клетках. Эти данные далее доказывают новый механизм, посредством которого настоящее изобретение может использоваться для удаления опухолевых клетох у пациента, нуждающегося в этом. Пример 9. IDEC-152 индуцирующий апоптоз в CD23+ клетках в различные периоды времени. Для дальнейшего прояснения механизмов настоящего изобретения измеряли изменения апоптоза вSKW клетки с плотностью 1x106 клетки/мл в среде культуры (RPMI-2% FBS) инкубируют с 10 мкг/мл антителами р 5 Е 8 (IDEC-152) или С 2 В 8 (Ритуксан) при 4 С в пробирках с клеточной культурой. Через 1 ч инкубирования несвязанное антитело в среде удаляют центрифугированием. Клетки ресуспендируют в среде роста в подходящих объемах и добавляют в 24-ячеечные подложки с культурой ткани (2x106 клетки/ячейка) с и без добавления античеловеческого IgG специфичного вторичного антитела козла (50 мкг/мл) для обеспечения поперечного связывания. За инкубированием в различные периоды времени клетки собирают и анализируют на апоптоз с помощью поточной цитометрии, основанной на испытании Tunel,описанном в примере 7. Результаты этого испытания графически представлены на фиг. 5. Как и в ранних примерах, приведенных выше, на фиг. 5 показано, что перекрестное связывание р 5 Е 8 (IDЕС-152) и Ритуксана с вторичным анти-Ig-специфичным антителом значительно повышает апоптоз CD23+ в SKW клетках. Удивительно, хотя степень апоптоза, как оказалось, со временем падает,она остается значительной в течение периода 2 полных дней. Как и ожидалось, существенный апоптоз не наблюдался в клетках, инкубированных с RF2 и вторичным антителом или вторичным антителом отдельно. Пример 10. IDEC-152 проявляет синергизм с Ритуксаном для повышения апоптоза в CD23+ клетках. Дополнительные неожиданные преимущества настоящего изобретения включают способность анти-СD23 антител повышать эффективность различных химиотерапевтических агентов, включая биологические соединения, такие как Ритуксан. Этот пример показывает такие преимущества. Более конкретно, этот пример показывает действия на апоптоз повышенных концентраций антиСD23 антитела на SKW клетки отдельно и в сочетании с Ритуксаном. С помощью испытания с каспазой 3, по существу, описанного в примере 8, перекрестно связанное aнти-CD23 антитело и ритуксан инкубируют с SKW клетками. В первом эксперименте повышают концентрации IDEC-152 и ритуксана и определяют апоптозную активность каждого конкретного антитела. Во втором эксперименте фиксированную концентрацию IDEC-152 объединяют с различными концентрациями Ритуксана для вызывания любого синергического действия. Эксперименты показаны на фиг. 6 А и 6 В, соответственно. Обзор фиг. 6 А и 6 В показывает, что IDEC-152 и Ритуксан индуцируют апоптоз в SKW клетках после перекрестного связывания с F(ab')2 античеловеческим IgG козла (GaHIg). Конкретно, на фиг. 6 А показано, что IDEC-152 индуцирует от 40 до 50% апоптоза в уровнях приблизительно 1 мкг/мл, хотя Ритуксан проявляет несколько меньшую активность. В добавление к активности конкретного антитела, на фиг. 6 В показано, что добавление повышенных количеств Ритуксана к фиксированной концентрацииIDEC-152 (0,1 мкг/мл) повышает апоптозную активность по сравнению с отдельными антителами. В этом отношении, добавление Ритуксана IDEC-152 в концентрациях 10 мкг/мл обеспечивает скорости апоптоза приблизительно 45%. Этот наблюдаемый синергетический эффект хорошо отражает преимущества данного изобретения. Пример 11. IDEC-152 повышает Ритуксан-опосредованный апоптоз в CD23+ клетках. Дополнительный эксперимент осуществляют для подтверждения синергетических эффектов, пока- 26007467 занных в примере 10, в отношении апоптоза SKW клеток, полученного комбинацией анти-СD23 антитела и анти-СD20 антитела. В этом примере SKW клетки плотностью 0,5x10 мкг/мл инкубируют во льду с повышенными концентрациями IDEC-152, Ритуксана или их комбинации. Через час клетки разрушают и ресуспендируют в 2% FCS RPMI и 15 мкг/мл F(ab')2 античеловеческом IgG козла для перекрестного связывания. Через 18 ч инкубирования при 37 С апоптоз измеряют с помощью испытания с каспазой-3, описанного в примере 1. Результаты показаны на фиг. 7. Фиг. 7 ясно показывает, что комбинация анти-СD23 антитела, такого как IDEC-152, с aнти-CD20 антителом, таким как ритуксан, обеспечивает повышение апоптоза в злокачественных клеточных линиях. Даже при относительно низких концентрациях IDEC-152 (например, 0,1 мкг/мл) скорость апоптоза приблизительно в 2 раза выше скорости апоптоза, когда клетки инкубируют с ритуксаном отдельно. На фиг. 7 показано, что это действие повышается при повышении концентраций IDEC-152. Пример 12. IDEC-152 проявляет синергизм с адриамицином при индуцировании апоптоза в CD23+ клетках. Для того чтобы показать разнообразие и широкую применимость настоящего изобретения, проведены эксперименты, показывающие, что способы настоящего изобретения подходят для ряда химиотерапевтических агентов. Более конкретно, данный пример показывает, что aнти-CD23 антитела могут эффективно использоваться для повышения эффективности клинически применяемых химиотерапевтических агентов (здесь адриамицин). Этот эксперимент осуществляют с помощью, по существу, той же процедуры, что и в примере 11,за исключением того, что используют адриамицин в сочетании с IDEC-152 вместо Ритуксана. Рецептурную степень адриамицина RDF (гидрохлорид доксорубицина - NDC 0013-1086-91) получают от Pharmacia иUpjohn. Различные концентрации адриамицина объединяют с тремя различными концентрациями IDEC152 и полученную скорость апоптоза SKW клетках измеряют с помощью поточной цитометрии на основании испытания с каспазой-3, описанного в примере 1. Результаты показаны на фиг. 8. На фиг. 8 графически показано, что добавление IDEC-152 существенно повышает апоптозную эффективность адриамицина во всех выбранных концентрациях. Эти синергетические действия сильно проявляются при относительно низких концентрациях адриамицина при 10-7 М, где добавление маленького количества 0,1 мкг/мл IDEC-152 повышает процентное соотношение клеточного апоптоза приблизительно на 70% по сравнению с менее чем 20% при отсутствии IDEC-152. Специалисту в данной области техники ясно, что это является существенным улучшением и может успешно применяться при клиническом лечении. Пример 13. IDEC-152 проявляет синергизм с флударабином при индуцировании апоптоза в CD23+ клетках. В другом представлении разнообразия настоящего изобретения эксперимент из примера 12 повторяют с широко использующимся химиотерапевтическим агентом флударабином вместо адриамицина. Рецептурную степень Fludara (флударабин фосфат -NDC 504-19-511-06) получают от Berlex Corporation. Полученные результаты представлены на фиг. 9, по существу, так же, как и в примере 12. Обзор фиг. 9 ясно показывает, что способы и композиции настоящего изобретения могут использоваться, по существу, для повышения скорости апоптоза в SKW клетках по сравнению с флударабином отдельно. В этом отношении, добавление небольшого количества 0,1 мкг/мл IDEC-152 к раствору 10-5 М флударабина повышает скорость апоптоза от менее чем 20% до более чем 50%. Как и в примере 12, этот пример ясно показывает эффективность настоящего изобретения для клинического применения химиотерапевтических агентов. Пример 14. Aнти-CD23 антитела индуцируют апоптоз в B-CLL клетках. Указанные здесь способы и композиции настоящего изобретения применимы для широкого ряда злокачественностей, включающих, в предпочтительных воплощениях, CLL. Для непосредственного иллюстрирования эффективности настоящего изобретения для лечения CLL была протестирована способность анти-СD23 антитела индуцировать апоптоз в таких клетках. Периферические моноциты крови (РВМС) выделяют из донорной крови пациента с CLL с помощью градиента Ficoll стандартными способами. Жизнеспособность клетки, определенная с помощью испытания исключения трипана голубого, является близкой к 100%, и все эксперименты проводят со свежимиCLL клетками. Клетки фенотипируют для CD19, CD20 и CD23 экспрессии поточной цитометрией. Клетки лейкемии из пациентов с CLL (0,5-1x106 клетки/мл) инкубируют с р 5 Е 8 (10 мкг/мл) или контрольным антителом (СЕ 9.1, aнти-CD4 антитело) во льду. Через 1 ч инкубирования клетки переливают для удаления несвязанных антител и ресуспендируют при 1x106 клетки/мл в среде роста (5% FCS-RPMI) и культурируют в пробирках с культурой ткани. Поверхность клеток связанных антител перекрестно связывают спариванием F(ab')2 фрагментов античеловеческих Ig-Fc специфичных антител козла при 15 мкг/мл и культуры инкубируют при 37 С до исследования на апоптоз. В этом отношении, в табл. 5 показан апоптоз, измеренный испытанием активации каспазы-3, по существу, описанным в примере 1. Процентное соотношение апоптоза измеряют через 4 и 24 ч с помощью интенсивности флуоресценции в логарифмической шкале (MFI).- 27007467 Таблица 5 Активация каспазы-3 IDЕС-152 (р 5 Е 8) на B-CLL клетках из пациентов с CLL Этот пример хорошо показывает, что способы и композиции настоящего изобретения являются эффективными для вызывания программируемой смерти клетки в новообразованиях лейкемии. Пример 15. Индукция апоптоза IDEC-152 и Ритуксаном в CLL клетках. Для того чтобы показать способность CD23 антагонистов, таких как IDEC-152, индуцировать апоптоз в CLL клетках, осуществлялись дополнительные эксперименты для определения эффективности антагониста самого по себе и в сочетании с биологическим химиотерапевтическим агентом (например, Ритуксаном). Как и в примере 14, клетки лейкемии от пациентов с CLL (1x106 клетки/мл) фенотипируют и инкубируют с различными концентрациями IDEC-152 или IDEC-152 и ритуксаном во льду. Через 1 ч инкубирования клетки переливают для удаления несвязанных антител и ресуспендируют в среде роста (2% FCSRPMI) и культурируют в 24-ячеечных подложках. Поверхность клеток связанных антител перекрестно связывают спариванием F(ab')2 фрагментов античеловеческих Ig-Fc специфичных антител козла при 15 мкг/мл и культуры инкубируют при 37 С в течение 18 ч до исследования на апоптоз с помощью испытания с каспазой, описанного в примере 1. Результаты показаны на фиг. 10 А и 10 В. Обзор фиг. 10 А подтверждает результаты, показанные в примере 14, в том, что CD23 антагонисты,такие как IDEC-152, могут использоваться для индуцирования апоптоза в клетках лейкемии. В 1 мкг/млIDEC-152 эффективно индуцирует апоптоз в приблизительно 30% CLL клеток. На фиг. 10 В показано,что, хотя IDEC-152 сами по себе могут индуцировать апоптоз в CLL клетках, это действие может повышаться благодаря добавлению Ритуксана. Более конкретно, на фиг. 10 В показано, что добавление различных концентраций Ритуксана, по существу, повышает процентное соотношение клеток, подвергающихся апоптозу, в трех тестируемых концентрациях IDEC-152. Этот наблюдаемый синергизм также доказывает возможную клиническую эффективность настоящего изобретения. Пример 16. Индукция апоптоза с помощью IDEC-152 и флударабина в CLL клетках. В другой иллюстрации полезности настоящего изобретения CD23 антагонисты используют в сочетании с обычным химиотерапевтическим агентом флударабином для индуцирования апоптоза в CLL клетках. Получают и исследуют очищенные В-клетки от пациентов с CLL, как описано ранее. Рецептурные степени Fludara (флударабин фосфат - NDC 504-19-511-06) получают от Berlex Corporation. Клетки обрабатывают IDEC-152 отдельно, или флударабином отдельно, или комбинацией обоих в различных дозах,как, по существу, описано в примере 15. Процентное соотношение апоптоза определяют поточной цитометрией, основываясь на испытании с каспазой-3, описанном в примере 1. Результаты этого эксперимента, представленные на фиг. 11, показывают, что, хотя и IDEC-152, и флударабин проявляют одинаковую индукцию апоптоза в зависимости от дозы, комбинация двух соединений заметно повышает скорость программируемой гибели клетки. Эти данные показывают, что IDEC152, отдельно или в комбинации с другими агентами, может быть эффективным для лечения пациентов,которые могут иметь устойчивость к флударабину или другим химиотерапевтическим средствам. Пример 17. Противоопухолевая активность IDEC-152 in vivo. После того как было показано, что CD23 антагонисты настоящего изобретения являются эффективными для медиирования ADCC и апоптозной активности в различных опухолевых клетках in vitro, были проведены эксперименты, показывающие, что антагонисты могут убивать злокачественные клетки invivo. Более конкретно, так как CD23 антиген экспрессируется с высокой плотностью у пациентов с CLL и часто экспрессируется с различными плотностями антигена у пациентов с В-клеточной NHL, было интересно узнать, могут ли CD23 антагонисты, отдельно или в сочетании с химиотерапевтическими агентами, медиировать противоопухолевый отклик в животной модели.IDEC-152 тестировали на противоопухолевую активность в мышиной модели человеческой В-лимфомы/SCID, которая обычно используется в уровне техники и имеет клинический успех. Животным вводят внутривенно SKW клетки (CD20+, CD23+). SKW клетки (4 х 106 в 100 мкл HBSS буфера) вводят (внут- 28007467 ривенно) в хвостовую вену 6-8 недельным самкам мышей СВ 17 SCID. Через 1 день после прививки опухоли мышам вводят (внутрибрюшинно) IDEC-152 в 200 мкл HBSS буфера. Лечение повторяют каждые 2 дня до общего количества инъекций МАт 6 раз (Q2dx6). Для каждого лечения используют 10 животных и контрольную (необработанную, с введением 200 мкл HBSS буфера) группу. Животных наблюдают до проявления заболевания и исследуют хирургически. У всех мышей, проявляющих симптомы заболевания, развивается паралитическая форма перед смертью. Мышей, которые умирали в периоды наблюдения, или мышей, у которых развивался тяжелый паралич в обеих ногах, сопровождающийся затрудненным дыханием, вскрывали и анализировали после смерти. Анализ Kaplan-Meier осуществляют с помощью Statistical Analysis System (SAS) и p-величины обрабатывают с помощью теста Log-rank. Результаты показаны на фиг. 12. Фиг. 12 ясно показывает, что CD23 антагонисты настоящего изобретения тормозят рост опухолей у мышей и приводят к значительному увеличению жизни по сравнению с необработанными контрольными группами. Конкретно, противоопухолевая активность доказана повышенной выживаемостью животных с опухолью по сравнению с необработанными контрольными группами во всех тестируемых дозах (100,200 и 400 мкг антитела за прием). В двойных дозах 50% животных в группах лечения оставались живы на 46 день, когда все животные контрольных групп умерли. Значительно, 30% животных на лечении в этих группах выживали, когда эксперимент длился более 20 дней после смерти последнего животного контрольной группы (например, день 66). Эти результаты являются значительным доказательством эффективности соединений настоящего изобретения при использовании отдельно. Пример 18. IDEC-152 проявляет синергизм с Ритуксаном в индуцировании противоопухолевой активности. Чтобы показать, что CD23 антагонисты являются крайне эффективными противоопухолевыми агентами при использовании отдельно, проводили эксперименты, объясняющие эффективность таких соединений совместно с известными химиотерапевтическими агентами. С этой стороны, CD23 антагонисты настоящего изобретения тестируют в сочетании с Ритуксаном с помощью SKW/SCID модели мыши,описанной в примере 17. Для этого эксперимента мышам вводят (внутрибрюшинно) IDEC-152, Ритуксан или IDEC-152 плюс Ритуксан в 200 мкл HBSS буфера в определенное время после прививки опухоли. Результаты эксперимента показаны на фиг. 13. На фиг. 13 показано, что противоопухолевая активность IDEC-152 плюс Ритуксан является большей, чем противоопухолевая активность каждого тестируемого антитела отдельно (р 0,01). При использовании одинаковой схемы приема комбинация IDEC-152 и Ритуксана заметно превосходит по противоопухолевой активности каждое отдельное моноклональное антитело. Это является доказательством того факта, что на 68 день живыми остаются 60% животных в группе с лечением комбинацией антител по сравнению с 20% выживаемости в группе с IDEC-152 и 30% выживаемости в группе с Ритуксаном. Значительно, 6 из 10 животных в группе с комбинированной терапией излечивались на 68 день, более чем через 20 дней после того, как умерли все животные в необработанной группе. Более того, больший опухолевый отклик наблюдался у мышей с 200 мкг за инъекцию IDЕС-152/Ритуксана по сравнению с 400 мкг за инъекцию IDEC-152 отдельно, предполагая синергетический отклик в комбинированной терапии. Все эти результаты на 46 день ясно показывают, что комбинация CD23 антагонистов плюс Ритуксан может обеспечить синергетический противоопухолевый отклик относительно злокачественностей человека в мышиной модели ксенографии распространяющегося заболевания. Специалисту в данной области техники ясно, что настоящее изобретение может воплощаться и в других конкретных формах. В данном описании настоящего изобретения описаны только его предпочтительные воплощения, понятно, что другие варианты подходят под объем настоящего изобретения. Соответственно,настоящее изобретение не ограничивается конкретными воплощениями, которые подробно описаны выше. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения опухолевого заболевания у млекопитающего, нуждающегося в этом, включающий введение терапевтически эффективного количества CD23 антагониста указанному млекопитающему. 2. Способ по п.1, где указанный CD23 антагонист выбирают из группы, состоящей из CD23 реактивных полипептидов, CD23 реактивных пептидов, CD23 реактивных небольших молекул и их комбинаций. 3. Способ по п.2, где указанный CD23 реактивный полипептид включает моноклональное антитело или поликлональное антитело. 4. Способ по п.3, где указанный CD23 реактивный полипептид включает моноклональное антитело. 5. Способ по п.4, где указанное моноклональное антитело выбирают из группы, состоящей из химерных антител и антител, подобных антителам человека. 6. Способ по п.5, где указанное моноклональное антитело является химерным антителом и указанное химерное антитело является антителом, подобным антителу человека. 7. Способ по п.6, где указанным антителом, подобным антителу человека, является IDЕС-152.- 29007467 8. Способ по п.7, где указанное опухолевое заболевание выбирают из группы, состоящей из повторного заболевания Ходкина, резистентного заболевания Ходкина, лимфомы высокой степени, низкой степени и средней степени, отличной от лимфомы Ходкина, В-клеточной хронической лимфоцитной лейкемии (B-CLL), лимфоплазмацитозной лимфомы (LPL), покрытой клеточной лимфомы (MCL), фолликулярной лимфомы (FL), диффузионной обширной клеточной лимфомы (DLCL), лимфомы Буркитта (BL),связанной со СПИДом лимфомы, моноцитной В-клеточной лимфомы, ангиоиммунобластомной лимфоаденопатии, небольшой лимфоцитной, фолликулярной, диффузионной обширной клеточной, диффузионной небольшой расщепляющейся клеточной, обширной клеточной иммунобластомной лимфобластомной, небольшой, нерасщепляющейся, Буркитта и не Буркитта, фолликулярной, преимущественно обширной клеточной, фолликулярной, преимущественно небольшой расщепляющейся клеточной и фолликулярной, смешанной небольшой расщепляющейся и обширной клеточной лимфомы. 9. Способ по п.8, где указанным опухолевым заболеванием является В-клеточная хроническая лимфоцитная лейкемия (B-CLL). 10. Способ по п.1, где указанное опухолевое заболевание выбирают из группы, состоящей из повторного заболевания Ходкина, резистентного заболевания Ходкина, лимфомы высокой степени, низкой степени и средней степени, отличной от лимфомы Ходкина, В-клеточной хронической лимфоцитной лейкемии (B-CLL), лимфоплазмацитозной лимфомы (LPL), покрытой клеточной лимфомы (MCL), фолликулярной лимфомы (FL), диффузионной обширной клеточной лимфомы (DLCL), лимфомы Буркитта(BL), связанной со СПИДом лимфомы, моноцитной В-клеточной лимфомы, ангиоиммунобластомной лимфоаденопатии, небольшой лимфоцитной; фолликулярной, диффузионной обширной клеточной,диффузионной небольшой расщепляющейся клеточной, обширной клеточной иммунобластомной лимфобластомной, небольшой, нерасщепляющейся, Буркитта и не Буркитта, фолликулярной, преимущественно обширной клеточной, фолликулярной, преимущественно небольшой расщепляющейся клеточной и фолликулярной, смешанной небольшой расщепляющейся и обширной клеточной лимфомы. 11. Способ по п.10, где указанным опухолевым заболеванием является В-клеточная хроническая лимфоцитная лейкемия (B-CLL). 12. Способ по п.1, где указанный CD23 антагонист связан с цитотоксическим агентом. 13. Способ по п.12, где указанный цитотоксический агент является радиоизотопом. 14. Способ по п.1, также включающий стадию введения химиотерапевтического агента. 15. Способ по п.14, где указанный химиотерапевтический агент включает антитело. 16. Способ по п.15, где указанное антитело реагирует или связывается с CD19, CD20, CD22, CD40,CD40L, CD52 или В 7. 17. Способ по п.14, где указанный химиотерапевтический агент включает флударабин. 18. Способ лечения опухолевого заболевания у млекопитающего, включающий следующие стадии: введение терапевтически эффективного количества по крайней мере одного химиотерапевтического агента указанному млекопитающему; и введение терапевтически эффективного количества по крайней мере одного CD23 антагониста указанному пациенту,где указанный химиотерапевтический агент и указанный CD23 антагонист могут вводиться в любом порядке или конкурентно. 19. Способ по п.18, где указанный CD23 антагонист выбирают из группы, состоящей из CD23 реактивных полипептидов, CD23 реактивных пептидов, CD23 реактивных небольших молекул и их комбинаций. 20. Способ по п.19, где указанный CD23 реактивный полипептид включает моноклональное антитело или поликлональное антитело. 21. Способ по п.20, где указанный CD23 реактивный полипептид включает моноклональное антитело. 22. Способ по п.21, где указанное моноклональное антитело выбирают из группы, состоящей из химерных антител и антител, подобных антителам человека. 23. Способ по п.22, где указанным моноклональным антителом является IDEC-152. 24. Способ по п.18, где указанный химиотерапевтический агент включает антитело. 25. Способ по п.24, где указанное антитело реагирует или связывается с CD19, CD20, CD22, CD40,CD40L, CD52 или В 7. 26. Способ по п.18, где указанное опухолевое заболевание выбирают из группы, состоящей из повторного заболевания Ходкина, резистентного заболевания Ходкина, лимфомы высокой степени, низкой степени и средней степени, отличной от лимфомы Ходкина, В-клеточной хронической лимфоцитной лейкемии (B-CLL), лимфоплазмацитозной лимфомы (LPL), покрытой клеточной лимфомы (MCL), фолликулярной лимфомы (FL), диффузионной обширной клеточной лимфомы (DLCL), лимфомы Буркитта(BL), связанной со СПИДом лимфомы, моноцитной В-клеточной лимфомы, ангиоиммунобластомной лимфоаденопатии, небольшой лимфоцитной, фолликулярной, диффузионной обширной клеточной,диффузионной небольшой расщепляющейся клеточной, обширной клеточной иммунобластомной лимфобластомной, небольшой, нерасщепляющейся, Буркитта и не Буркитта, фолликулярной, преимущест- 30
МПК / Метки
МПК: A61K 39/395, A61P 35/02, A61K 45/06, A61P 35/00, A61K 31/70, A61K 45/00
Метки: применение, заболеваний, опухолевых, лечения, антагонистов
Код ссылки
<a href="https://eas.patents.su/30-7467-primenenie-cd23-antagonistov-dlya-lecheniya-opuholevyh-zabolevanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Применение cd23 антагонистов для лечения опухолевых заболеваний</a>