Медиаторы путей передачи сигналов генами hedgehog, содержащие их композиции и способы применения указанных веществ
Номер патента: 7339
Опубликовано: 25.08.2006
Авторы: Прайс Стефен, Гейхерит Оивин М., Рубин Ли, Бойд Эдвард А.
Формула / Реферат
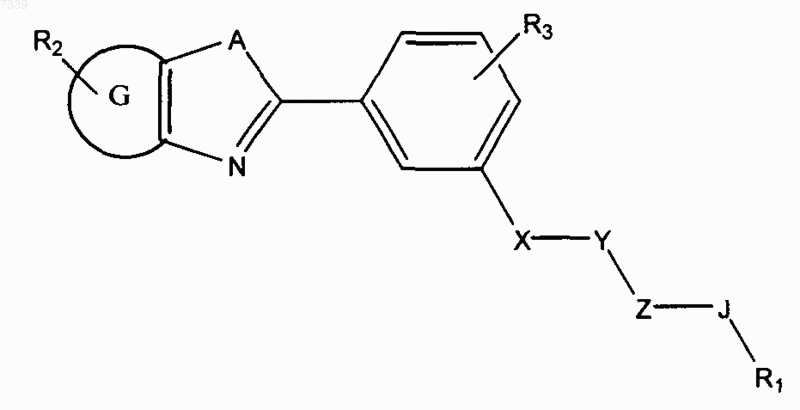
1. Способ ингибирования активации пути передачи сигналов геном hedgehog в клетке, предусматривающий контактирование клетки с соединением в количестве, достаточном для подавления передачи сигналов геном hedgehog, где соединение представлено общей формулой (I)
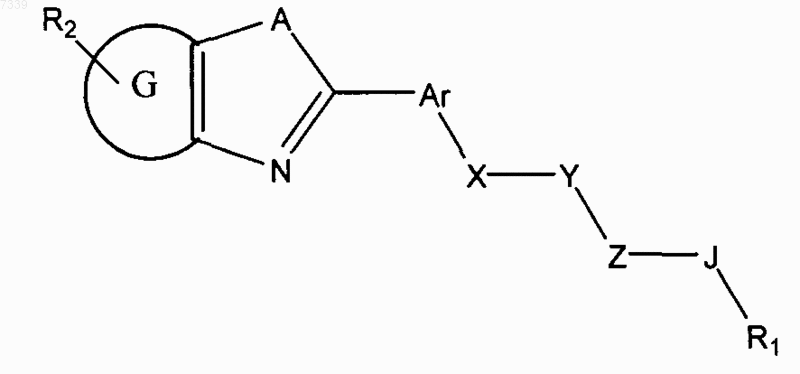
Формула I
где в зависимости от валентности и устойчивости соединения
X и Z независимо представляют -N(R7)-, -O-, -S-, -(R7)N-N(R7)-, -ON(R7)- или прямую связь;
Y представляет собой -С(=O)-, -C(=S)-, -C(=NR7)-, SO2 или SO;
А представляет собой О, S или NR7;
G представляет собой циклоалкильное, гетероциклильное, арильное или гетероарильное кольцо, конденсированное с кольцом, к которому оно присоединено;
Ar представляет собой замещенное или незамещенное арильное или гетероарильное кольцо;
R1 представляет собой Н, замещенный или незамещенный алкил, алкенил, алкинил, арил, гетероарил, гетероциклил или циклоалкил, включая полициклические группы;
R2 представляет собой 0-4 заместителя в кольце, к которому он присоединен;
R7 независимо представляет Н, низший алкил, J-циклоалкил, J-гетероциклил, J-арил, J-гетероарил;
R8 независимо представляет Н, низший алкил, циклоалкил, гетероциклил, арил или гетероарил; и
J независимо для каждого случая представляет цепь, имеющую 0-8 звеньев, выбранных из СK2, NK, О и S, где K независимо для каждого случая представляет Н или низший алкил,
или его фармацевтически приемлемая соль.
2. Способ ингибирования активации пути передачи сигналов геном hedgehog в клетке, предусматривающий контактирование клетки с соединением в количестве, достаточном для подавления передачи сигналов геном hedgehog, где соединение представлено общей формулой (II)
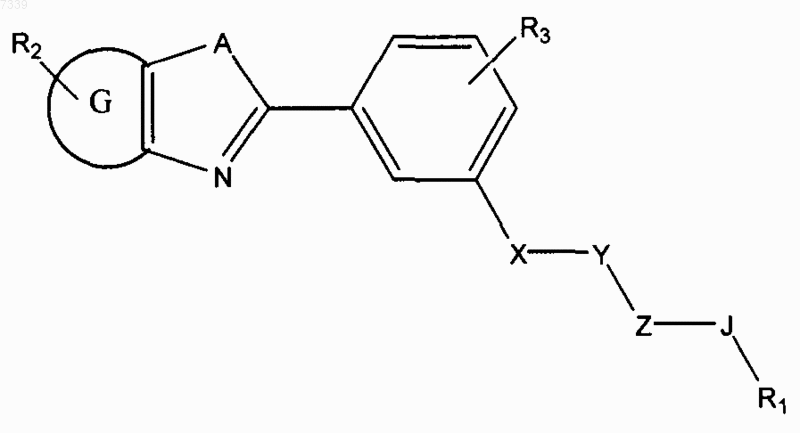
Формула II
где в зависимости от валентности и устойчивости соединения
X и Z независимо представляют собой -N(R7)-, -O-, -S-, -(R7) N-N (R7) -, -ON(R7)-, или прямую связь;
Y представляет собой -С(=O)-, -C(=S)-, -C(=NR7)-, SO2 или SO;
А представляет собой О, S, или NR7;
G представляет собой циклоалкильное, гетероциклильное, арильное или гетероарильное кольцо, конденсированное с кольцом, к которому оно присоединено;
R1 представляет собой Н или замещенный, или незамещенный алкил, алкенил, алкинил, арил, гетероарил, гетероциклил или циклоалкил, включая полициклические группы;
R2 представляет собой 0-4 заместителя в кольце, к которому он присоединен;
R3 представляет собой 0-4 заместителя в кольце, к которому он присоединен;
R7 независимо для каждого случая представляет Н, низший алкил, J-циклоалкил, J-гетероциклил, J-арил, J-гетероарил;
R8 независимо для каждого случая представляет Н, низший алкил, циклоалкил, гетероциклил, арил или гетероарил и
J независимо для каждого случая представляет цепь, имеющую 0-8 звеньев, выбранных из СK2, NK, О и S, где
K независимо для каждого случая представляет Н или низший алкил,
или его фармацевтически приемлемая соль.
3. Способ ингибирования активации пути передачи сигналов геном hedgehog в клетке, предусматривающий контактирование клетки с соединением в количестве, достаточном для подавления передачи сигналов геном hedgehog, где соединение представлено общей формулой (III)
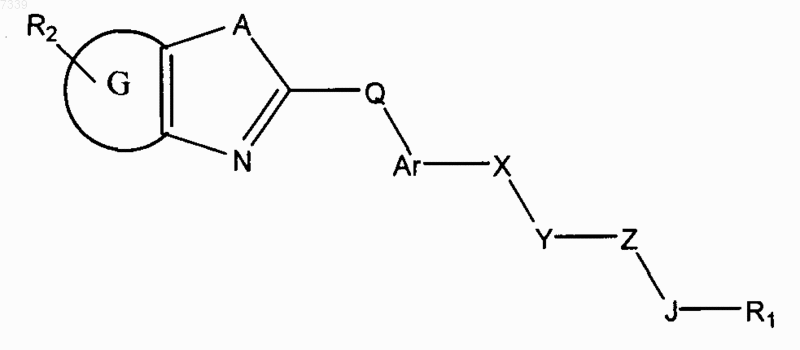
Формула III
где в зависимости от валентности и устойчивости соединения
X и Z независимо представляют собой -N(R7)-, -O-, -S-, -(R7)N-N(R7) -, -ON(R7)- или прямую связь;
Y представляет собой -С(=O)-, -C(=S)-, -C(=NR7)-, SO2 или SO;
А представляет собой О, S или NR7;
G представляет собой циклоалкильное, гетероциклильное, арильное или гетероарильное кольцо, конденсированное с кольцом, к которому оно присоединено;
Q отсутствует или представляет собой СK2, NK, О и S, где K независимо для каждого случая представляет собой Н или низший алкил;
Ar представляет собой замещенное или незамещенное арильное или гетероарильное кольцо;
R1 представляет собой Н или замещенный, или незамещенный алкил, алкенил, алкинил, арил, гетероарил, гетероциклил или циклоалкил, включая полициклические группы;
R2 представляет собой 0-4 заместителя в кольце, к которому он присоединен;
R7 независимо для каждого случая представляет собой Н, низший алкил, J-циклоалкил, J-гетероциклил, J-арил, J-гетероарил;
R8 независимо для каждого случая представляет собой Н, низший алкил, циклоалкил, гетероциклил, арил или гетероарил; и
J независимо для каждого случая представляет цепь, содержащую 0-8 звеньев, выбранных из СK2, NK, О и S, где
K независимо для каждого случая представляет Н или низший алкил;
или его фармацевтически приемлемая соль.
4. Способ ингибирования активации пути передачи сигналов геном hedgehog в клетке, предусматривающий контактирование клетки с соединением в количестве, достаточном для подавления передачи сигналов геном hedgehog, где соединение представлено общей формулой (IV)
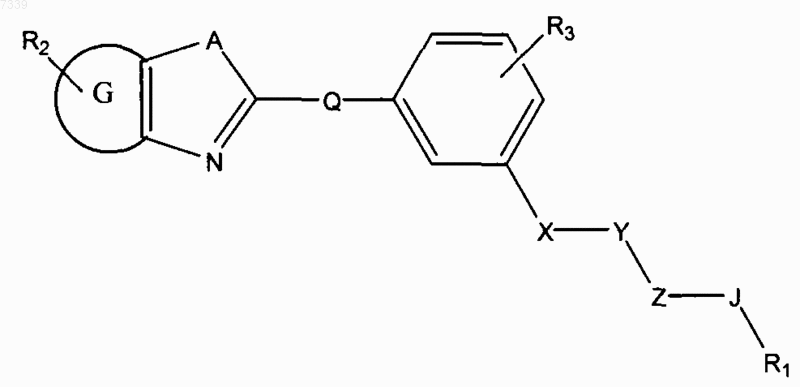
Формула IV
где в зависимости от валентности и устойчивости соединения
X и Z независимо представляют собой -N(R7)-, -О-, -S-, -(R7)N-N(R7)-, -ON(R7)- или прямую связь;
Y представляет собой -С(=O)-, -C(=S)-, -C(=NR7)-, SO2 или SO;
А представляет собой О, S или NR7;
G представляет собой циклоалкильное, гетероциклильное, арильное или гетероарильное кольцо, конденсированное с кольцом, к которому оно присоединено;
Q отсутствует или представляет собой СK2, NK, О и S, где K независимо для каждого случая представляет собой Н или низший алкил;
R1 представляет собой Н или замещенный, или незамещенный алкил, алкенил, алкинил, арил, гетероарил, гетероциклил или циклоалкил, включая полициклические группы;
R2 представляет собой 0-4 заместителя в кольце, к которому он присоединен;
R3 представляет собой 0-4 заместителя в кольце, к которому он присоединен;
R7 независимо для каждого случая представляет Н, низший алкил, J-циклоалкил, J-гетероциклил, J-арил, J-гетероарил;
R8 независимо для каждого случая представляет Н, низший алкил, циклоалкил, гетероциклил, арил или гетероарил; и
J независимо для каждого случая представляет цепь, имеющую 0-8 звеньев, выбранных из СK2, NK, О и S, где K независимо для каждого случая представляет Н или низший алкил,
или его фармацевтически приемлемая соль.
5. Способ лечения злокачественного новообразования у пациента, предусматривающий введение пациенту соединения, где соединение представлено общей формулой (I)
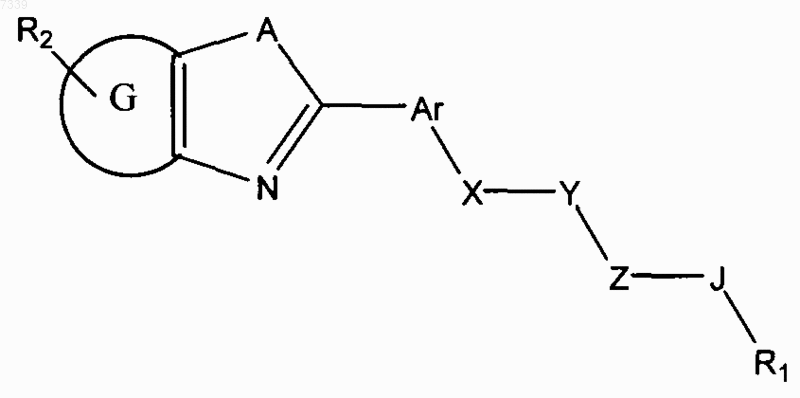
Формула I
где в зависимости от валентности и устойчивости соединения
X и Z независимо представляют -N(R7)-, -O-, -S-, -(R7)N-N(R7)-, -ON(R7)- или прямую связь;
Y представляет собой-С(=O)-, -C(=S)-, -C(=NR7)-, SO2 или SO;
А представляет собой О, S или NR7;
G представляет собой циклоалкильное, гетероциклильное, арильное или гетероарильное кольцо, конденсированное с кольцом, к которому оно присоединено;
Ar представляет собой замещенное или незамещенное арильное или гетероарильное кольцо;
R1 представляет собой Н, замещенный или незамещенный алкил, алкенил, алкинил, аршы, гетероарил, гетероциклил или циклоалкил, включая полициклические группы;
R2 представляет собой 0-4 заместителя в кольце, к которому он присоединен;
R7 независимо представляет Н, низший алкил, J-циклоалкил, J-гетероциклил, J-арил, J-гетероарил;
R8 независимо представляет Н, низший алкил, циклоалкил, гетероциклил, арил или гетероарил; и
J независимо для каждого случая представляет цепь, имеющую 0-8 звеньев, выбранных из СK2, NK, О и S, где K независимо для каждого случая представляет Н или низший алкил,
или его фармацевтически приемлемая соль.
6. Способ лечения злокачественного новообразования у пациента, предусматривающий введение пациенту соединения, где соединение представлено общей формулой (II)
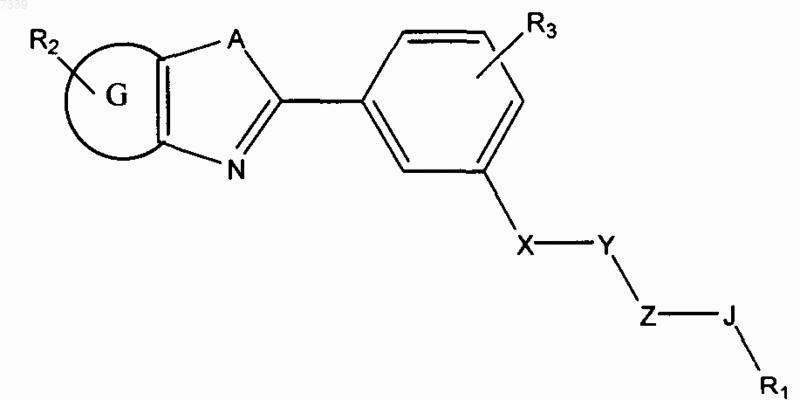
Формула II
где в зависимости от валентности и устойчивости соединения
X и Z независимо представляют собой -N(R7)-, -O-, -S-, -(R7)N-N(R7) -, -ON(R7)- или прямую связь;
Y представляет собой -C(=O)-, -C(=S)-, -C(=NR7)-, SO2 или SO;
А представляет собой О, S, или NR7;
G представляет собой циклоалкильное, гетероциклильное, арильное или гетероарильное кольцо, конденсированное с кольцом, к которому оно присоединено;
R1 представляет собой Н или замещенный, или незамещенный алкил, алкенил, алкинил, арил, гетероарил, гетероциклил или циклоалкил, включая полициклические группы;
R2 представляет собой 0-4 заместителя в кольце, к которому он присоединен;
R3 представляет собой 0-4 заместителя в кольце, к которому он присоединен;
R7 независимо для каждого случая представляет Н, низший алкил, J-циклоалкил, J-гетероциклил, J-арил, J-гетероарил;
R8 независимо для каждого случая представляет Н, низший алкил, циклоалкил, гетероциклил, арил или гетероарил; и
J независимо для каждого случая представляет цепь, имеющую 0-8 звеньев, выбранных из СK2, NK, О и S, где K независимо для каждого случая представляет Н или низший алкил,
или его фармацевтически приемлемая соль.
7. Способ лечения злокачественного новообразования у пациента, предусматривающий введение пациенту соединения, где соединение представлено общей формулой (III)
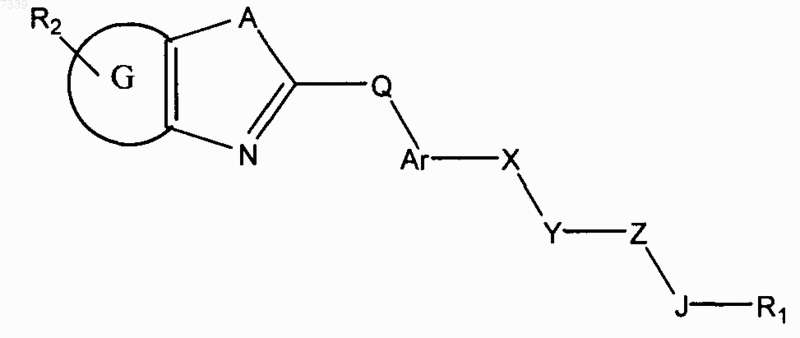
Формула III
где в зависимости от валентности и устойчивости соединения
X и Z независимо представляют собой -N(R7)-, -O-, -S-, -(R7)N-N(R7) -, -ON(R7)- или прямую связь;
Y представляет собой -С(=O)-, -C(=S)-, -C(=NR7)-, SO2 или SO;
А представляет собой О, S или NR7;
G представляет собой циклоалкильное, гетероциклильное, арильное или гетероарильное кольцо, конденсированное с кольцом, к которому оно присоединено;
Q отсутствует или представляет собой СK2, NK, О и S, где K независимо для каждого случая представляет собой Н или низший алкил;
Ar представляет собой замещенное или незамещенное арильное или гетероарильное кольцо;
R1 представляет собой Н или замещенный, или незамещенный алкил, алкенил, алкинил, арил, гетероарил, гетероциклил или циклоалкил, включая полициклические группы;
R2 представляет собой 0-4 заместителя в кольце, к которому он присоединен;
R7 независимо для каждого случая представляет собой Н, низший алкил, J-циклоалкил, J-гетероциклил, J-арил, J-гетероарил;
R8 независимо для каждого случая представляет собой Н, низший алкил, циклоалкил, гетероциклил, арил или гетероарил; и
J независимо для каждого случая представляет цепь, содержащую 0-8 звеньев, выбранных из СK2, NK, О и S, где K независимо для каждого случая представляет Н или низший алкил;
или его фармацевтически приемлемая соль.
8. Способ лечения злокачественного новообразования у пациента, предусматривающий введение пациенту соединения, где соединение представлено общей формулой (IV):
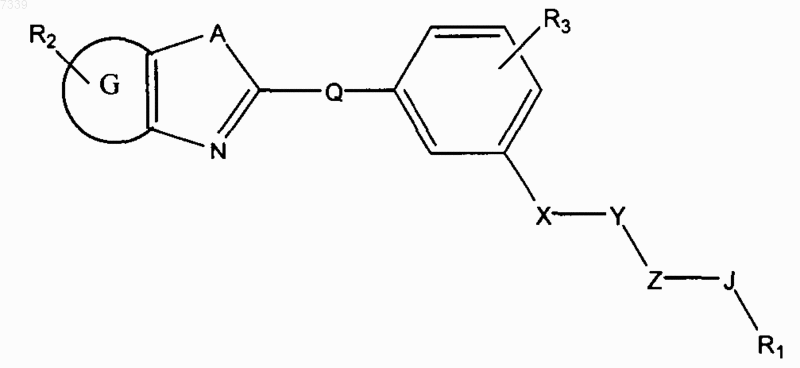
Формула IV
где в зависимости от валентности и устойчивости соединения
X и Z независимо представляют собой -N(R7)-, -O-, -S-, -(R7)N-N(R7)-, -ON(R7)- или прямую связь;
Y представляет собой -С(=O)-, -C(=S)-, -C(=NR7)-, SO2 или SO;
А представляет собой О, S или NR7;
G представляет собой циклоалкильное, гетероциклильное, арильное или гетероарильное кольцо, конденсированное с кольцом, к которому оно присоединено;
Q отсутствует или представляет собой СK2, NK, О и S, где K независимо для каждого случая представляет собой Н или низший алкил;
R1 представляет собой Н или замещенный, или незамещенный алкил, алкенил, алкинил, арил, гетероарил, гетероциклил или циклоалкил, включая полициклические группы;
R2 представляет собой 0-4 заместителя в кольце, к которому он присоединен;
R3 представляет собой 0-4 заместителя в кольце, к которому он присоединен;
R7 независимо для каждого случая представляет Н, низший алкил, J-циклоалкил, J-гетероциклил, J-арил, J-гетероарил;
R8 независимо для каждого случая представляет Н, низший алкил, циклоалкил, гетероциклил, арил или гетероарил; и
J независимо для каждого случая представляет цепь, имеющую 0-8 звеньев, выбранных из СK2, NK, О и S, где K независимо для каждого случая представляет Н или низший алкил,
или его фармацевтически приемлемая соль.
9. Способ по п.1-8, где по крайней мере один из элементов Z и X не является прямой связью.
10. Способ по п.1-9, где X-Y-Z включает амид, мочевину или сульфонамид.
11. Способ по п.1-10, где X выбран из -N(R8)-, -О- и -S-.
12. Способ по п.11, где X представляет собой NH.
13. Способ по любому из пп.1-12, где R1 включает арильное или гетероарильное кольцо, необязательно замещенное 1-5 заместителями.
14. Способ по п.13, где заместители R1 выбраны из группы азота, галогена, циано, низшего алкила, ациламино (например, R8-C(=O)NH-), алкокси, алкиламино, замещенного или незамещенного циклоалкила, гетероциклила, арила и гетероарила, конденсированного с арильным или гетероарильным кольцом.
15. Способ по п.1 или 5, где X и кольцо, содержащее А, присоединены к Ar в мета-положении.
16. Способ по пп.3-7, где X и Q присоединены к Ar в мета-положении.
17. Способ по пп.3-4 или 7-8, где Q представляет собой СK2.
18. Способ по п.17, где Q представляет собой СН2.
19. Способ по любому из пп.1-18, где R2 представляет собой 1-4 заместителя, выбранных из группы, включающей галоген, низший алкил, низший алкенил, арил, гетероарил, карбонил, тиокарбонил, кетон, альдегид, амино, ациламино, амидо, амидино, циано, нитро, азидо, сульфонил, сульфоксидо, сульфат, сульфонат, сульфамоил, сульфонамидо, фосфорил, фосфонат, фосфинат, J-R8, J-OH, J-низший алкил, J-низший алкенил, J-R8, J-SH, J-NH2, защищенные формы вышеуказанных групп, либо два любых элемента R2, встречающихся более одного раза в циклической или полициклической структуре, которые вместе взятые могут образовывать 4-8-членный циклоалкил, арил или гетероарил.
20. Способ по п.19, где R2 представляет 1-4 заместителя, выбираемых из группы, включающей галоген, циано, нитро, алкокси, амино, ациламино (например, R8-C(=O)NH-), замещенный или незамещенный циклоалкил, гетероциклил, арил или гетероарил, конденсированный с G, и замещенный или незамещенный низший алкил.
21. Способ по любому из пп.1-4, где клетка имеет фенотип с утраченной функцией гена ptc, приобретенной функцией гена hedgehog или приобретенной функцией гена smoothened.
22. Способ по любому из пп.1-4, где соединение ингибирует трансдукцию сигнала, опосредуемую утратой функции гена ptc, приобретением функции гена hedgehog или приобретением функции гена smoothened, при ED50, равной 1 мкМ или меньше.
23. Способ по любому из пп.1-4, где соединение ингибирует трансдукцию сигнала, опосредуемую утратой функции гена ptc, приобретением функции гена hedgehog или приобретением функции гена smoothened, при ED50, равной 1 нМ или меньше.
24. Способ по любому из пп.1-4, где клетка контактирует с соединением in vitro.
25. Способ по любому из пп.1-4, где клетка контактирует с антагонистом гена hedgehog in vivo.
26. Способ по любому из пп.1-4, где соединение вводят в составной части терапевтического или косметического применения.
27. Способ по п.26, ult терапевтическое или косметическое применение выбрано из регуляции нервных тканей, формирования и восстановления костей и хрящей, регуляции сперматогенеза, регуляции гладких мышц, регуляции легкого, печени и других органов, образующихся из первичной кишки, регуляции гемапоэтической функции и регуляции роста кожи и волос.
28. Фармацевтическая композиция, содержащая стерильный фармацевтический наполнитель и соединение, представленное общей формулой (I):

Формула I
где в зависимости от валентности и устойчивости соединения
X и Z независимо представляют -N(R7)-, -O-, -S-, -(R7)N-N(R7)-, -ON(R7)- или прямую связь;
Y представляет собой-С(=O)-, -C(=S)-, -C(=NR7)-, SO2 или SO;
А представляет собой О, S или NR7;
G представляет собой циклоалкильное, гетероциклильное, арильное или гетероарильное кольцо, конденсированное с кольцом, к которому оно присоединено;
Ar представляет собой замещенное или незамещенное арильное или гетероарильное кольцо;
R1 представляет собой Н, замещенный или незамещенный алкил, алкенил, алкинил, арил, гетероарил, гетероциклил или циклоалкил, включая полициклические группы;
R2 представляет собой 0-4 заместителя в кольце, к которому он присоединен;
R7 независимо представляет Н, низший алкил, J-циклоалкил, J-гетероциклил, J-арил, J-гетероарил;
R8 независимо представляет Н, низший алкил, циклоалкил, гетероциклил, арил или гетероарил; и
J независимо для каждого случая представляет цепь, имеющую 0-8 звеньев, выбранных из СK2, NK, О и S, где K независимо для каждого случая представляет Н или низший алкил,
или его фармацевтически приемлемая соль.
29. Фармацевтическая композиция, содержащая стерильный фармацевтический наполнитель и соединение, представленное общей формулой (III)

Формула III
где в зависимости от валентности и устойчивости соединения
X и Z независимо представляют собой -N(R7)-, -О-, -S-, -(R7)N-N(R7) -, -ON(R7)- или прямую связь;
Y представляет собой -С(=O)-, -C(=S)-, -C(=NR7)-, SO2 или SO;
А представляет собой О, S или NR7;
G представляет собой циклоалкильное, гетероциклильное, арильное или гетероарильное кольцо, конденсированное с кольцом, к которому оно присоединено;
Q отсутствует или представляет собой СK2, NK, О и S, где K независимо для каждого случая представляет собой Н или низший алкил;
Ar представляет собой замещенное или незамещенное арильное или гетероарильное кольцо;
R1 представляет собой Н или замещенный, или незамещенный алкил, алкенил, алкинил, арил, гетероарил, гетероциклил или циклоалкил, включая полициклические группы;
R2 представляет собой 0-4 заместителя в кольце, к которому он присоединен;
R7 независимо для каждого случая представляет собой Н, низший алкил, J-циклоалкил, J-гетероциклил, J-арил, J-гетероарил;
R8 независимо для каждого случая представляет собой Н, низший алкил, циклоалкил, гетероциклил, арил или гетероарил и
J независимо для каждого случая представляет цепь, содержащую 0-8 звеньев, выбранных из СK2, NK, О и S, где K независимо для каждого случая представляет Н или низший алкил;
или его фармацевтически приемлемая соль.
30. Способ лечения или профилактики базально-клеточного рака, предусматривающий введение пациенту фармацевтической композиции по пп.19-29 в количестве, достаточном для подавления прогрессирования базально-клеточного рака.
31. Фармацевтическая композиция, содержащая стерильный фармацевтический наполнитель и соединение, представленное общей формулой (II)
Формула II
где в зависимости от валентности и устойчивости соединения
X и Z независимо представляют собой -N(R7)-, -O-, -S-, -(R7)N-N(R7)-, -ON(R7)- или прямую связь;
Y представляет собой -С(=O)-, -C(=S)-, -C(=NR7)-, SO2 или SO;
А представляет собой О, S или NR7;
G представляет собой циклоалкильное, гетероциклильное, арильное или гетероарильное кольцо, конденсированное с кольцом, к которому оно присоединено;
R1 представляет собой Н или замещенный, или незамещенный алкил, алкенил, алкинил, арил, гетероарил, гетероциклил или циклоалкил, включая полициклические группы;
R2 представляет собой 0-4 заместителя в кольце, к которому он присоединен;
R3 представляет собой 0-4 заместителя в кольце, к которому он присоединен;
R7 независимо для каждого случая представляет Н, низший алкил, J-циклоалкил, J-гетероциклил, J-арил, J-гетероарил;
R8 независимо для каждого случая представляет Н, низший алкил, циклоалкил, гетероциклил, арил или гетероарил; и
J независимо для каждого случая представляет цепь, имеющую 0-8 звеньев, выбранных из СК2, NK, О и S, где K независимо для каждого случая представляет Н или низший алкил,
или его фармацевтически приемлемая соль.
32. Фармацевтическая композиция, содержащая стерильный фармацевтический наполнитель и соединение, представленное общей формулой (IV)

Формула IV
где в зависимости от валентности и устойчивости соединения
X и Z независимо представляют собой -N(R7)-, -O-, -S-, -(R7)N-N(R7)-, -ON(R7)- или прямую связь;
Y представляет собой -С(=O)-, -C(=S)-, -C(=NR7)-, SO2 или SO;
А представляет собой О, S или NR7;
G представляет собой циклоалкильное, гетероциклильное, арильное или гетероарильное кольцо, конденсированное с кольцом, к которому оно присоединено;
Q отсутствует или представляет собой СK2, NK, О и S, где K независимо для каждого случая представляет собой Н или низший алкил;
R1 представляет собой Н или замещенный, или незамещенный алкил, алкенил, алкинил, арил, гетероарил, гетероциклил или циклоалкил, включая полициклические группы;
R2 представляет собой 0-4 заместителя в кольце, к которому он присоединен;
R3 представляет собой 0-4 заместителя в кольце, к которому он присоединен;
R7 независимо для каждого случая представляет Н, низший алкил, J-циклоалкил, J-гетероциклил, J-арил, J-гетероарил;
R8 независимо для каждого случая представляет Н, низший алкил, циклоалкил, гетероциклил, арил или гетероарил; и
J независимо для каждого случая представляет цепь, имеющую 0-8 звеньев, выбранных из СK2, NK, О и S, где K независимо для каждого случая представляет Н или низший алкил,
или его фармацевтически приемлемая соль.
33. Способ лечения или профилактики базально-клеточного рака, предусматривающий введеэшх пациенту фармацевтической композиции по пп.31-32 в количестве, достаточном для подавления прогрессирования базально-клеточного рака.
34. Фармацевтическая композиция по любому из пп.28-29 или 31-32, где заместители замещенной группы выбраны из ациламино, алифатической, алкоксикарбонильной, формильной,ацильной, тиокарбонильной, тиоэфирной, тиоацетатной, тиоформиатной, фосфорильной, амидиновой, сульфатной, сульфонатной, сульфамоильной, селеналкильной групп, галогена, азидной, алкильной, аралкильной, арильной, алкенильной, алкинильной, циклоалкильной, гидроксильной, алкоксильной групп, амино, нитро, сульфгидрильной группы, имино, амидо, фосфатной, фосфонатной, фосфинатной, фосфонамидитной, фосфороамидитной, карбонильной, карбоксильной, силильной групп, группы простого эфира, алкилтиогруппы, сульфонильной, сульфонамидной групп, группы кетона, альдегида, сложного эфира, карбоциклильной, гетероциклильной, полициклильной, ароматической или гетероароматических групп, -CF3 или -CN.
35. Способ по любому из пп.1-8, 30 или 33, где заместители замещенной группы выбраны из ациламино, алифатической, алкоксикарбонильной, формильной, ацильной, тиокарбонильной, тиоэфирной, тиоацетатной, тиоформиатной, фосфорильной, амидиновой, сульфатной, сульфонатной, сульфамоильной, селеналкильной групп, галогена, азидной, алкильной, аралкильной, арильной, алкенильной, алкинильной, циклоалкильной, гидроксильной, алкоксильной групп, амино, нитро, сульфгидрильной группы, имино, амидо, фосфатной, фосфонатной, фосфинатной, фосфонамидитной, фосфороамидитной, карбонильной, карбоксильной, силильной групп, группы простого эфира, алкилтиогруппы, сульфонильной, сульфонамидной групп, группы кетона, альдегида, сложного эфира, карбоциклильной, гетероциклильной, полициклильной, ароматической или гетероароматических групп, -CF3 или -CN.
36. Соединение, выбранное из
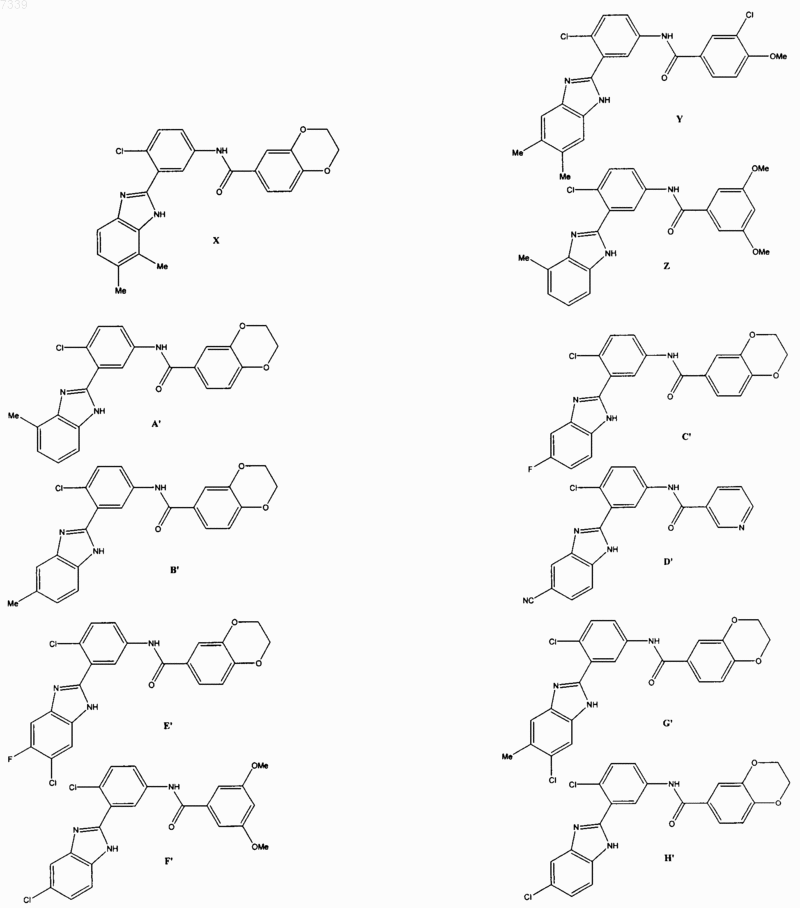
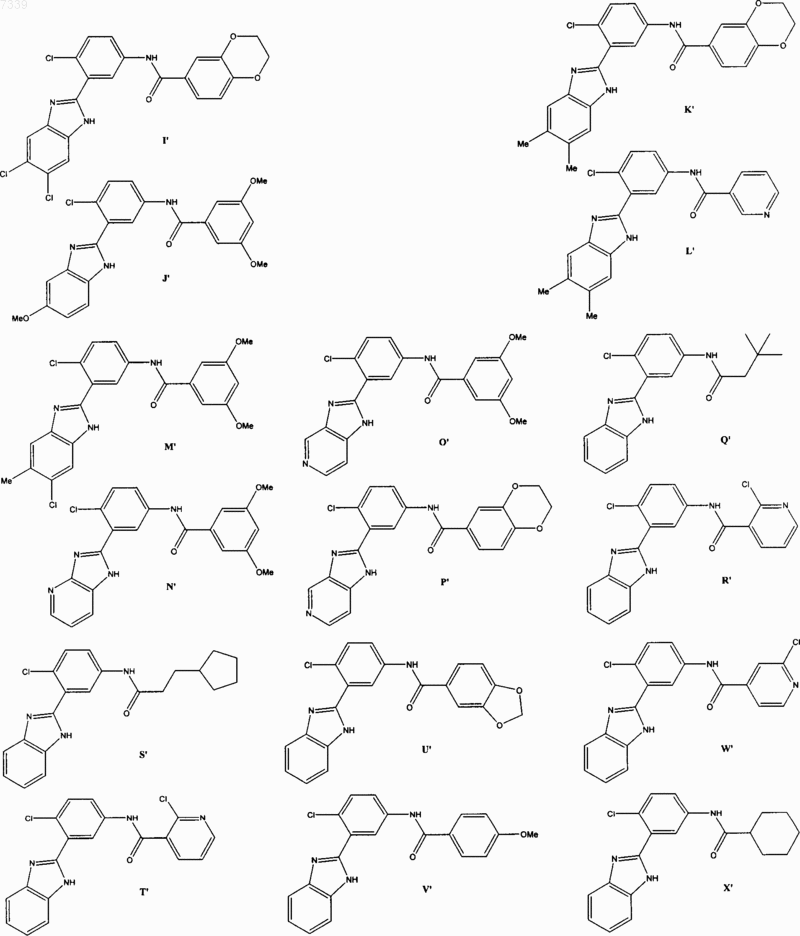
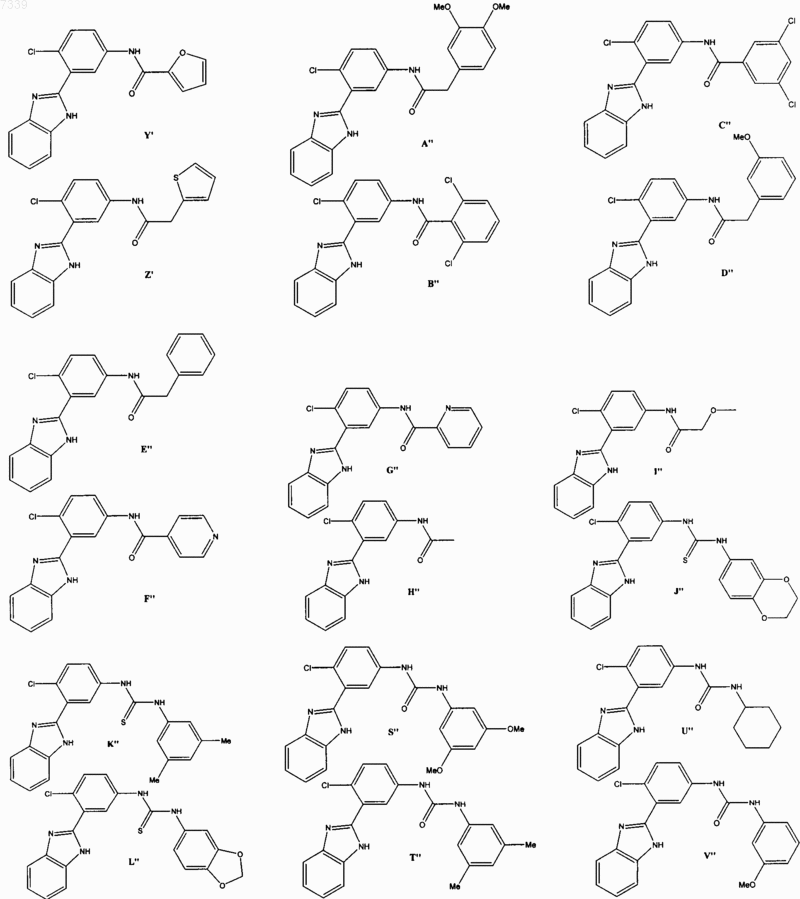

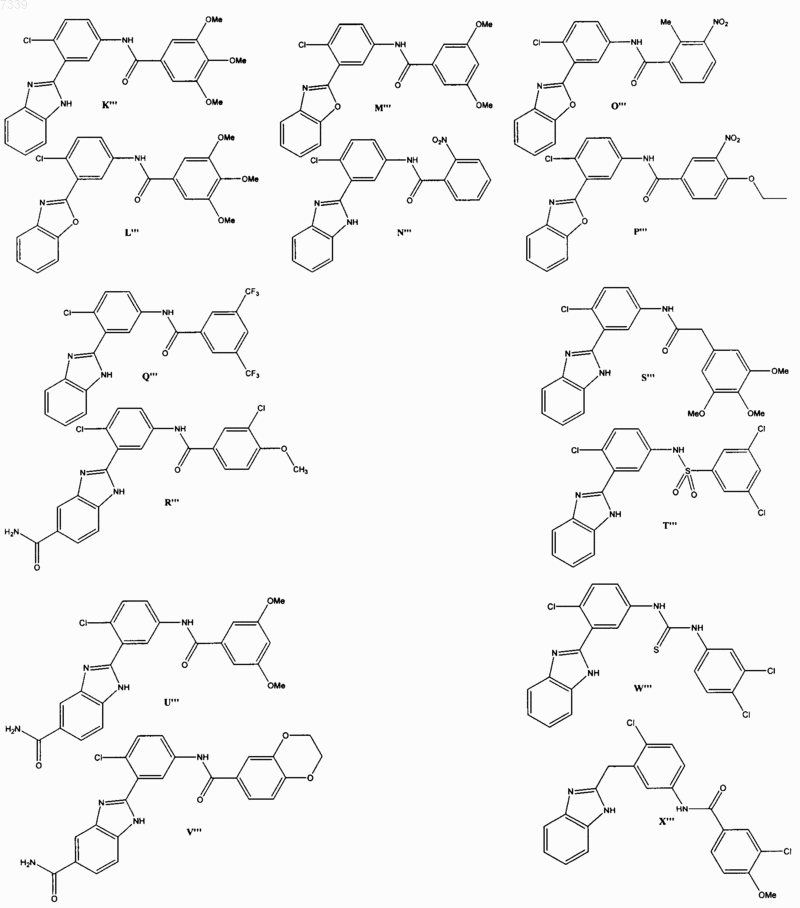
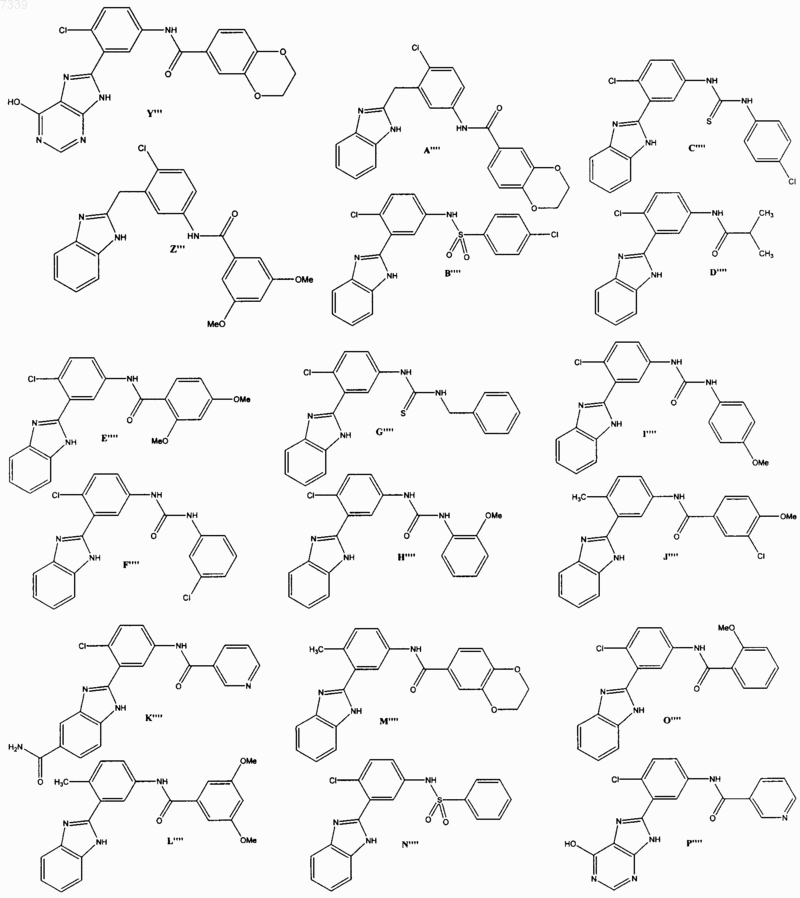

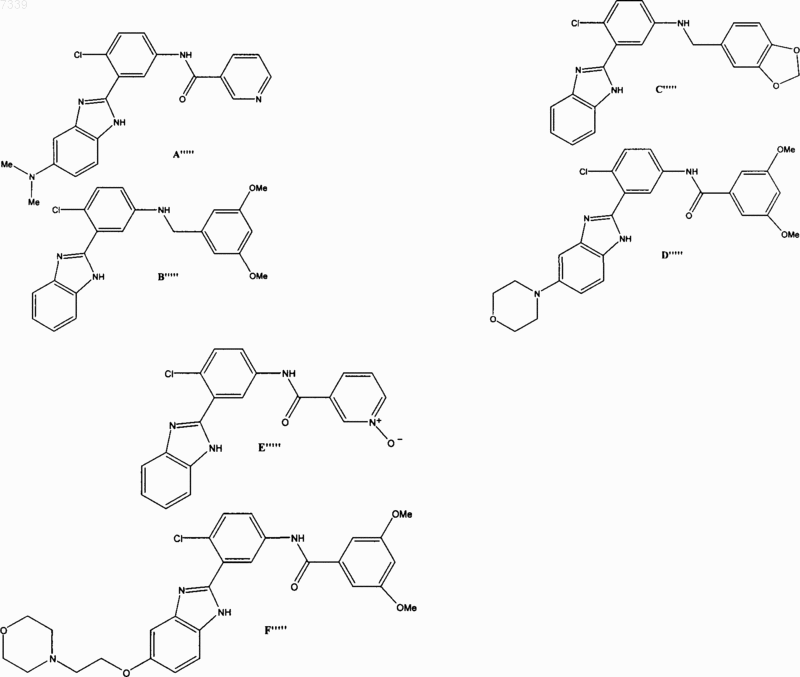
37. Фармацевтическая композиция, содержащая стерильный фармацевтический наполнитель и соединение по п. 36.
38. Способ ингибирования активации пути передачи сигналов геном hedgehog в клетке, предусматривающий контактирование клетки с соединением по п.36 или композицией по п.38 в количестве, достаточном для подавления передачи сигналов hedgehog.
40. Способ лечения злокачественного новообразования у пациента, предусматривающий введение пациенту соединения по п.36 или композицией по п.38.
41. Способ лечения или профилактики базально-клеточного рака, предусматривающий введение пациенту фармацевтической композиции по п.36 или композиции по п.37 в количестве, достаточном для подавления прогрессирования базально-клеточного рака.
Текст
007339 Формирование паттерна представляет процесс, в соответствии с которым эмбриональные клетки образуют упорядоченное пространственное расположение дифференцированных тканей. Физическая сложность высших организмов формируется в процессе эмбриогенеза при взаимодействии присущей клеткам направленной дифференцировки и не присущей клеткам функции передачи сигналов. Индуктивные взаимодействия имеют важное значение для эмбрионального паттерна в процессе развития позвоночных от первоначального планирования строения тела до паттерна систем органов и образования разных типов клеток во время дифференцировки тканей (Davidson, E., (1990) Development 108: 365-389; Gurdon, J.В., (1992) Cell 68:185-199; Jessell, T.M. et al., (1992) Cell 68:257-270). Развивающиеся клетки по-разному взаимодействуют друг с другом. Обычно реагирующие клетки меняют направление дифференцировки, с одного на другой с образованием клеток, отличающихся от неиндуцированных и индуцированных реагирующих клеток (индукция). Иногда клетки индуцируют аналогичную дифференцировку соседних клеток (гомогенная индукция); в других случаях клетка ингибирует аналогичную дифференцировку соседних клеток. Взаимодействие клеток на ранней стадии развития может быть последовательным, при этом первоначальная индукция двух типов клеток ведет к прогрессивному многообразию клеток. Кроме того, индуктивные взаимодействия происходят не только в эмбрионах, но и в клетках взрослых особей, и могут создавать и сохранять морфогенные структуры, а также индуцировать дифференцировку (J.B. Gurdon (1992) Cell 68:185-199). Члены семейства генов hedgehog сигнальных молекул опосредуют многие важные кратко- и долговременные процессы паттерна в ходе развития беспозвоночных и позвоночных. У мух единственный генhedgehog регулирует паттерн сегментного и имагинального диска. В отличие от этого у позвоночных семейство генов hedgehog управляет лево- и правосторонней асимметрией, полярностью в центральной нервной системе, развитием сомитов и конечностей, органогенезом, хондрогенезом и сперматогенезом. Первый ген hedgehog был обнаружен в результате генетического скрининга дрозофилы Drosophilamelanogaster (Nsslein-Volhard, С. and Wieschaus, E. (1980) Nature 287, 795-801). В результате указанного скрининга выявлен ряд мутаций, влияющих на развитие эмбриона и личинки. В 1992 и 1993 гг. была описана молекулярная структура гена hedgehog (hh) дрозофилы (C.F., Lee et al. (1992) Cell 71, 33-50), после чего у позвоночных разных видов было выделено несколько гомологов гена hedgehog. Несмотря на то, что у дрозофилы и других беспозвоночных был обнаружен только один ген hedgehog, у позвоночных присутствует множество таких генов. Семейство генов hedgehog у позвоночных включает по крайней мере четыре члена, например, паралоги единственного гена hedgehog дрозофилы. Типичные гены и белки hedgehog описаны в публикациях РСТ WO 95/18856 и WO 96/17924. Три члена указанного семейства, определяемые как Desert hedgehog(Dhh) , Sonic hedgehog (Shh) и Indian hedgehog (Ihh), по-видимому, имеются у всех позвоночных, включая рыб, птиц и млекопитающих. Четвертый член, определяемый как tiggie-winkle hedgehog (Thh), встречается только у рыб. Desert hedgehog (Dhh) экспрессирован в основном в яичках в процессе развития эмбриона у мышей, а также у взрослых грызунов и человека. Indian hedgehog (Ihh) участвует в образовании костей в процессе эмбриогенеза и развитии костей у взрослых особей; и вышеописанный ген Shh прежде всего участвует в морфогенезе и выполнении нейроиндуктивных функций. Учитывая важную индуктивную роль полипептидов гена hedgehog в развитии и поддержании органов у позвоночных, идентификация взаимодействующих белков гена hedgehog имеет первостепенное значение с точки зрения клинических и научных исследований. Разные белки гена hedgehog состоят из сигнального пептида, высоко консервативной N-концевой области и более дивергентного С-концевого домена. Помимо расщепления сигнальной последовательности в секреторном пути (Lee, J.J. et al. (1992) Cell 71:33-50; Tabata, Т. et al. (1992) Genes Dev, 2635-2645;Chang, D.E. et al. (1994) Development 120:3339-3353) белки-предшественники гена hedgehog подвергаются внутреннему аутопротеолитическому гидролизу, который зависит от консервативных последовательностей в С-концевой части (Lee et al. (1994) Science 266:1528-1537; Porter et al. (1995) Nature 374:363366). Такой аутогидролиз вызывает образование N-концевого пептида длиной 19 кДа и С-концевого пептида длиной 26-28 кДа (Lee et al. (1992) см. выше; Tabata et al. (1992) см. выше; Chang et al. (1994) см. выше; Lee. et al.(1994) см. выше; Bumcrot, D.A. et al. (1995) Mol. Cell. Biol. 15:2294-2303; Porter et al.(1995) см. выше; Ekker, S.C. et al. (1995) Curr. Biol. 5:944-955; Lai, C.J. et al. (1995) Development 121:23492360). N-концевой пептид остается прочно связанным с поверхностью клеток, в которых он был синтезирован, в то время как С-концевой пептид свободно диффундирует in vitro и in vivo (Porter et al. (1995)Development 121:2537-2547; Roelink, H. et al. (1995) Cell 81:445-455). Интересно отметить, что удерживание на поверхности клетки N-концевого пептида зависит от ауторасщепления, так как укороченная форма НН, кодируемая РНК, которая заканчивается непосредственно в нормальном положении внутреннего расщепления, диффундирует in vitro (Porter et al. (1995) см. выше) и in vivo (Porter, J.A. et al. (1996) Cell 86, 21-34). Биохимические исследования показывают, что аутопротеолитическое расщепление белкапредшественника НН происходит с участием внутреннего промежуточного сложного тиоэфира, который затем расщепляется в положении нуклеофильного замещения. Вполне вероятно, что нуклеофил представляет собой мелкую липофильную молекулу, которая ковалентно связывается с С-концом N-пептида(Porter et al. (1996) см. выше), сцепляя его с поверхностью клетки. Биологический смысл указанного явления имеет глубокое значение. В результате сцепления возникает высокая локальная концентрация Nконцевого пептида гена hedgehog на поверхности клеток, продуцирующих ген hedgehog. Именно этот Nконцевой пептид необходим для выполнения функции кратко- и долговременной передачи сигналов геном hedgehog в дрозофиле и позвоночных (Porter et al. (1995) см. выше; Ekker et al. (1995) см. выше; Laial. (1995) Curr. Biol. 5:643-651; Fan, C.-M. et al. (1995) Cell 81:457-465; Mart', E. et al. (1995) Nature 375:322-325; Lopez-Martinez et al. (1995) Curr. Biol. 5:791-795; Ekker, S.C. et al. (1995) Development 121:2337-2347; Forbes, A.J. et al. (1996) Development 122:1125-1135). Ген НН участвует в кратко- и долговременных процессах паттерна разных частей организма в ходе развития дрозофилы. При определении полярности сегментов на ранней стадии развития эмбриона указанный ген оказывает кратковременное влияние, непосредственно опосредуя данные явления, в то время как при формировании паттерна имагинальных дисков, указанный ген оказывает долговременное влияние благодаря индукции вторичных сигналов. В последние годы у позвоночных было клонировано несколько генов hedgehog. Среди клонированных генов особое внимание привлекает ген Shh, так как он экспрессирован в разных организующих центрах, являющихся источниками сигналов, определяющих паттерн соседних тканей. Недавно полученные данные показывают, что ген Shh участвует в указанных взаимодействиях. Экспрессия гена Shh начинается вскоре после гаструляции в предполагаемой мезодерме срединной линии в зародышевом узле у мышей (Chang et al. (1994) см. выше; Echelard, Y. et al. (1993) Cell 75:14171430), крыс (Roelink, H. et al. (1994) Cell 76: 761-775) и курицы (Riddle, R.D. et al. (1993) Cell 75:14011416) и зародышевом диске у полосатой перцины (Ekker et al. (1995) см. выше; Krauss, S. et al. (1993) Cell 75:1431-1444). В куриных эмбрионах экспрессия Shh гена в зародышевом узле вызывает лево- и правостороннюю асимметрию, которая имеет непосредственное отношение к лево- или правостороннему расположению сердца (Levin, M. et al. (1995) Cell 82:803-814). Оказалось, что в центральной нервной системе ген Shh, экспрессируемый в хорде и вентральной пластинке нервной трубки, определяет судьбу вентральных клеток. При эктопической экспрессии генShh вызывает вентрализацию больших областей среднего и заднего мозга у мышей (Echelard et al. (1993) см. выше; Goodrich, L.V. et al. (1996) Genes Dev. 10:301-312), Xenopus (Roelink, H. et al. (1994) см. выше;Ruizi Altaba, A. et al. (1995) Mol. Cell. Neurosci. 6:106-121) и у полосатой перцины (Ekker et al. (1995) см. выше; Krauss et al. (1993) см. выше; Hannerschmidt, M. et al. (1996) Genes Dev. 10:647-658). В эксплантатах промежуточной нейроэктодермы на уровне спинного мозга белок Shh вызывает образование вентральной пластинки нервной трубки и двигательных нейронов при разных пороговых концентрациях,причем вентральная пластинка нервной трубки образуется при высокой концентрации и двигательные нейроны образуются при более низких концентрациях (Roelink et al. (1995) см. выше; Mart' et al. (1995) см. выше; Tanabe, Y. et al. (1995) Curr. Biol. 5:651-658). Кроме того, блокирование антителами позволяет предположить, что ген Shh, продуцируемый хордой, необходим для опосредуемой хордой индукции типа двигательных нейронов (Mart' et al. (1995) см. выше). Таким образом, оказалось, что высокая концентрация гена Shh на поверхности Shh-продуцирующих клеток срединной линии, способствует контактно опосредуемой индукции вентральной пластинки нервной трубки, наблюдаемой in vitro (Placzek, M. et al.(1993) Development 117:205-218), и срединному расположению вентральной пластинки нервной трубки непосредственно над хордой in vivo. Ген Shh, высвобождаемый из хорды и вентральной пластинки нервной трубки в более низких концентрациях, по всей вероятности, индуцирует двигательные нейроны в более отдаленных вентролатеральных областях в ходе процесса, который, как установлено, не зависит от контактирования in vitro (Yamada, Т. et al. (1993) Cell 73:673-686). В эксплантатах, полученных на уровнях среднего и переднего мозга, ген Shh также индуцирует соответствующие типы вентролатеральных нервных клеток, соответственно допаминэргические (Heynes, M. et al. (1995) Neuron 15:35-44; Wang,M.Z. et al. (1995) Nature Med. 1:1184-1188) и холинэргические (Ericson, J. et al. (1995) Cell 81:747-756) предшественники, указывая на то, что Shh является общим индуктором вентральной специфичности на всем протяжении центральной нервной системы. В результате сделанных наблюдений возникает вопрос,чем определяется разная реакция на Shh в конкретных передне-задних положениях. Кроме того, ген Shh, продуцируемый в срединной линии, определяет паттерн параксиальных областей эмбриона позвоночного, сомитов туловища (Fan et al. (1995) см. выше) и клювовидную структуру сомитов мезенхимы головы (Hammerschmidt et al. (1996) см. выше). В эксплантатах параксиальной мезодермы курицы и мышей ген Shh стимулирует экспрессию специфических маркеров склеротома, подобных Paxl и Twist, за счет дермамиотомального маркера Рах 3. Кроме того, эксперименты с использованием фильтрующего барьера позволяют предположить, что Shh непосредственно опосредует индукцию склеротома, а не путем активации вторичного механизма передачи сигналов (Fan, C.-M. and TessierLavigne, M. (1994) Cell 79, 1175-1186).Shh индуцирует также экспрессию миотомного гена (Hammerschmidt et al. (1996) см. выше; Johnson,R.L. et al. (1994) Cell 79:1165-1173; Mnsterberg, A.E. et al. (1995) Genes Dev. 9:2911-2922; Weinberg, E.S.et al. (1996) Development 122: 271-280), хотя недавно выполненные эксперименты показывают, что для-2 007339 этой цели необходимы согласованно действующие члены семейства WNT, гомологи гена Drosophilawingless дрозофилы у позвоночных (Mnsterberg et al. (1995) см. выше). Не вполне понятен тот факт, что индукция миотома у курицы требует более высоких концентраций Shh, чем индукция склеротомных меток (Munsterberg et al. (1995) см. выше), хотя склеротом образуется из сомитных клеток, расположенных гораздо ближе к хорде. Аналогичные результаты получены у полосатой перцины, где высокие концентрации гена hedgehog индуцируют экспрессию гена миотомного маркера и подавляют экспрессию гена склеротомного маркера(Hammerschmidt et al. (1996) см. выше). Однако в отличие от амниотов указанные наблюдения совместимы со строением рыбного эмбриона, так как в данном случае миотом является главным и более аксиальным компонентом сомитов. Таким образом, модуляция передачи сигналов геном Shh и приобретение новых факторов передачи сигналов может изменять структуру сомита в процессе эволюции позвоночных. В зачатках конечностей позвоночных субпопуляция задних мезенхимных клеток, так называемая"зона поляризующей активности" (ZPA), регулирует идентичность пальцев передних и задних конечностей (в статье Honig. L.S. (1981) Nature 291: 72-73). Эктопическая экспрессия Shh или использование гранул, пропитанных пептидом Shh, имитирует эффект передних трансплантатов ZPA, создавая зеркальное отображение пальцев (Chang et al. (1994) см. выше; Lopez-Martinez et al. (1995) см. выше; Riddle et al.(1993) см. выше) (фиг. 2 д). Таким образом, оказалось, что идентичность пальцев, прежде всего зависит от концентрации Shh, хотя вполне возможно, что другие сигналы могут передавать указанную информацию на значительные расстояния, необходимые для паттерна передних и задних конечностей (100-150 мкм). Подобно взаимодействию НН и DPP в имагинальных дисках дрозофилы, Shh в зачатках конечностей позвоночных активирует экспрессию Bmp2 (Francis, P.H. et al. (1994) Development 120:209-218), гомологаdpp. Однако в отличие от DPP у дрозофилы, Bmp2 не имитирует поляризующий эффект Shh при эктопическом воздействии в зачатках конечностей курицы (Francis et al. (1994) см. выше). Помимо переднезаднего паттерна, оказалось, что Shh также участвует в регуляции проксимодистального отрастания конечностей, индуцируя синтез фактора роста фибробластов FGF4 в заднем апикальном эктодермальном гребне (Laufer, E. et al. (1994) Cell 79:993-1003; Niswander, L. et al. (1994) Nature 371:609-612). Тесная взаимосвязь между белками гена hedgehog и BMP, по-видимому, сохраняется на многих, но,вероятно, не на всех участках экспрессии гена hedgehog позвоночных. Например, установлено, что в задней кишке курицы Shh индуцирует экспрессию Bmp4, другого гомолога dpp позвоночных (Roberts, D.J.et al. (1995) Development 121:3163-3174). Кроме того, Shh и Bmp2, 4 и 6 характеризуются одинаковой экспрессией в эпителиальных и мезенхимных клетках желудка, мочеполовой системы, легких, зачатков зубов и волосяных фолликулах (Bitgood, M.J. and McMahon, A. P. (1995) Dev. Biol. 172:126-138). Кроме того, Ihh, один из двух других генов hedgehog у мышей, экспрессирован рядом с Bmpэкспрессирующими клетками в первичной кишке и развивающемся хряще (Bitgood and McMahon (1995) см. выше). Недавно полученные данные позволяют создать модель, в которой Ihh играет главную роль в регуляции хондрогенного развития (Roberts et al. (1995) см. выше). В процессе образования хряща хондроциты переходят из пролиферирующего состояния в промежуточное прегипертрофическое состояние с последующим образованием дифференцированных гипертрофических хондроцитов. Ihh экспрессирован в прегипертрофических хондроцитах и инициирует путь передачи сигналов, который блокирует дифференцировку хондроцитов. Непосредственной мишенью указанного гена является перихондрий вокруг экспрессирующего домена Ihh, который реагирует в результате экспрессии генов Gli и Patched (Ptc), консервативных транскрипционных мишеней для сигналов гена hedgehog (см. ниже). Наиболее вероятно,что указанный процесс индуцирует вторичную передачу сигналов, вызывая синтез белка, родственного паращитовидному гормону, (PTHrР) в околосуставном перихондрий. PTHrТ возвращает сигналы в прегипертрофические хондроциты, блокируя их дальнейшую дифференцировку. В то же время PTHrР подавляет экспрессию Ihh, образуя таким образом петлю с отрицательной обратной связью, которая модулирует скорость дифференцировки хондроцитов. Ген patched первоначально был идентифицирован у дрозофилы в качестве гена полярности сегмента, одного из группы генов развития, которые влияют на дифференцировку клеток в отдельных сегментах, присутствующих в гомологичном ряду наряду с передне-задней осью эмбриона. См. Hooper, J.E. etal. (1989) Cell 59:751: и Nakano, Y. et al. (1989) Nature 341:508. Паттерны экспрессии гомолога генаpatched у позвоночных позволяют предположить, что он участвует в развитии нервной трубки, скелета,конечностей, черепно-лицевой структуры и кожи. Генетические и функциональные исследования показывают, что ген patched является частью пути передачи сигналов геном hedgehog, эволюционно консервативного пути, который регулирует экспрессию ряда нижерасположенных генов. См. Perrimon, N. (1995) Cell 80:517; и Perrimon, N. (1996) Cell 86:513. Ген patched участвует в конститутивной транскрипционной репрессии генов-мишеней; активности данного гена противодействует секретированный гликопротеин, кодируемый геном hedgehog, или гомологом позвоночных, который активирует транскрипцию. К генам, управляемым данным путем передачи сигналов, относятся члены семейств Wnt и TGF-бета.-3 007339 Белки гена patched имеют два больших внеклеточных домена, двенадцать трансмембранных сегментов и несколько цитопламатических сегментов. См. Hooper, см. выше; Nakano, см. выше; Johnson,R.L. et al (1996) Science 272:1668; и Hahn, H. et al. (1996) Cell 85:841. Биохимическая роль гена patched в пути передачи сигналов геном hedgehog до сих пор неясна. Однако выявлено прямое взаимодействие с белком гена hedgehog (Chen, Y. et al. (1996) Cell 87:553), при этом ген patched может входить в комплекс рецептора гена hedgehog наряду с другим трансмембранным белком, кодируемым геном smoothened. См.Perrimon, см. выше; и Chen, см. выше. Недавно был клонирован гомолог гена patched человека и картирован до хромосомы 9q22.3. См.Johnson, см. выше; и Hahn, см. выше. Данная область имеет отношение к синдрому базально-клеточного невуса (BCNS), который характеризуется аномалией развития, включая деформацию ребер и черепнолицевой структуры, ладоней и стоп, расщелину позвоночника.BCNS является также причиной развития опухолей многих типов, среди которых наиболее часто встречается базально-клеточный рак (ВСС), который поражает многие части тела и возникает в первые двадцать лет жизни. Однако большинство случает ВСС не имеют отношения к указанному синдрому и возникают спорадически в небольшом количестве на подверженных воздействию солнца участках тела у лиц среднего и старшего возраста, проживающих в северной Европе. Недавно выполненные исследования BCNS-обусловленного и спорадического ВСС позволяют предположить, что функциональная потеря обоих аллелей гена patched вызывает возникновение ВСС. См. Johnson, см. выше; Hahn, см. выше; и Gailani, M.R. et al. (1996) Nature Genetics 14:78. Делеция одного аллеля из хромосомы 9q22.3 часто встречается как в спорадическом, так и наследственном ВСС. Анализ сцепления показывает, что дефектный наследованный аллель сохраняется, а нормальный аллель утрачивается в опухолях у субъектов с BCNS. В спорадических опухолях также наблюдается потеря обоих функциональных аллелей гена patched. Из двенадцати опухолей, в которых идентифицированы мутации геля patched при помощи анализа конформационного полиморфизма одной цепи, у девяти обнаружена хромосомная делеция второго аллеля и в остальных трех опухолях обнаружены инактивирующие мутации в обоих аллелях (Gailani, см. выше). Указанные изменения не происходят в соответствующей ДНК линии зародышевых клеток. Большая часть обнаруженных мутаций вызывает образование преждевременных терменирующих кодонов или сдвиг рамки считывания. Lench, N.J. et al. Hum. Genet. 1997 Oct; 100(5-6): 497-502. Однако в некоторых случаях обнаружены точечные мутации, вызывающие замену аминокислот во внеклеточных или цитоплазматических доменах. Указанные сайты мутации могут свидетельствовать о функциональном значении взаимодействия с внеклеточными белками или цитоплазматическими членами пути передачи сигналов в нижней области. Участие гена patched в ингибировании экспрессии генов и появление частых делеций аллелей генаpatched в ВСС подтверждает супрессорную функцию опухоли в отношении данного гена. Известно, что его роль в регуляции семейств генов, имеющая непосредственное отношение к передаче сигналов в клетки и межклеточному взаимодействию, представляет возможный механизм подавления опухолей. Краткое изложение существа изобретения Настоящее изобретение относится к способам и веществам, подавляющим активацию пути передачи сигналов геном hedgehog, например, к способам торможения аберрантного роста, возникающего в фенотипах с утраченной функцией гена patched, приобретенной функцией гена hedgehog или приобретенной функцией гена ptc, которые включают контактирование клетки с веществом, таким как малая молекула, в количестве, достаточном для агонистического воздействия на активность нормального гена ptc,антагонистического воздействия на активность нормального гена hedgehog или антагонистического воздействия на активность гена smoothened, например, для восстановления нормального роста или регуляции аберрантного роста. Краткое описание чертежей На фиг. 1-31 показаны реакции, используемые для синтеза соединений по настоящему изобретению; на фи. 32a-j показаны типичные соединения по настоящему изобретению; на фиг. 33 показано действие соединений по данному изобретению на передачу сигналов геномhedgehog в случае базально-клеточного рака (ВСС); на фиг. 34 показано действие соединений по настоящему изобретению на апоптоз ткани ВСС; на фиг. 35 показано действие соединений по настоящему изобретению на передачу сигналов геномhedgehog в клетках S-12 и НТ-29; на фиг. 36 показано действие соединений по данному изобретению на передачу сигналов геномhedgehog в клетках РС-3 и RT-4; на фи. 37 показаны последовательности зондов и затравок, используемых для оценки активности гена hedgehog в клетках; на фи. 38 и 40 показаны разные воздействия соединений по данному изобретению на экспрессиюGLI-1 и GAPDH в клетках, не имеющих гена pct;-4 007339 на фиг. 39 и 41 показаны разные воздействия соединений по данному изобретению на экспрессиюGLI-1 и GAPDH в клетках НЕРМ. Предпочтительные варианты осуществления изобретения Подробное описание изобретенияI. Обзор. В основе настоящего изобретения лежит открытие того, что пути трансдукции сигналов, регулируемые генами hedgehog, patched (ptc), gli и/или smoothened, можно по крайней мере частично ингибировать мелкими молекулами. Не связывая себя какой-либо конкретной теорией, можно отметить, что активация рецептора может представлять тот механизм, при помощи которого действуют данные вещества. Например, способность указанных веществ ингибировать пролиферацию клеток с утраченной функцией гена patched (ptclof) может быть связана со способностью таких молекул взаимодействовать с генамиhedgehog, patched или smoothened, или по крайней мере препятствовать способности указанных белков активировать путь трансдукции сигналов генами hedgehog, ptc и/или smoothened. Поэтому считается, что указанные мелкие молекулы, препятствующие трансдукции сигналов генами hedgehog, ptc или smoothened, способны ингибировать пролиферацию (или другие биологические последствия) нормальных клеток и/или клеток, имеющих фенотип с утраченной функцией гена patched,фенотип с приобретенной функцией гена hedgehog или фенотип с приобретенной функцией генаsmoothened. Таким образом, можно предположить, что в некоторых вариантах осуществления изобретения указанные соединения могут быть пригодны для подавления активности гена hedgehog в нормальных клетках, например, не имеющих генетической мутации, активирующего путь передачи сигналов геном hedgehog. В предпочтительных вариантах осуществления изобретения ингибиторы по данному изобретению представляют собой органические молекулы с молекулярной массой менее 2500 ат.ед., более предпочтительно менее 1500 ат.ед. и еще предпочтительнее менее 750 ат. ед. и могут ингибировать по крайней мере часть биологической активности белков гена hedgehog, предпочтительно непосредственно в клетках-мишенях. Таким образом, способы по настоящему изобретению включают использование мелких молекул,оказывающих агонистическое действие на подавление геном ptc передачи сигналов геном hedgehog, например, путем ингибирования активации гена smoothened или нижележащих компонентов пути передачи сигналов, для регуляции восстановления и/или функциональности целого ряда клеток, тканей и органов,включая нормальные клетки, ткани и органы, а также клетки, имеющие фенотип с утраченной функцией гена ptc, приобретенной функцией гена hedgehog или приобретенной функцией гена smoothened. Например, способ по данному изобретению имеет терапевтическое и косметическое применение, включающее регуляцию нервных тканей, формирование и восстановление костей и хрящей, регуляцию сперматогенеза, регуляцию гладких мышц, регуляцию легкого, печени и других органов, образующихся из первичной кишки, регуляцию гемопоэтической функции, регуляцию роста кожи и волос и т.д. Кроме того, способы по настоящему изобретению можно использовать для воздействия на клетки в культуре (in vitro) или в организме животного (in vivo). См., например, публикации РСТ WO 95/128856 и WO 96/17924 (которые включены в данное описание изобретения в качестве ссылки). В предпочтительном варианте осуществления изобретения способ по данному изобретению может быть использован для воздействия на эпителиальные клетки, имеющие фенотип с утраченной функцией гена ptc, приобретенной функцией гена hedgehog или приобретенной функцией гена smoothened. Например, способ по данному изобретению можно использовать для лечения или профилактики базальноклеточного рака или других нарушений, связанных с путем передачи сигналов геном hedgehog. В некоторых вариантах осуществления изобретения антагонист по данному изобретению может ингибировать активацию пути передачи сигналов геном hedgehog, связываясь с геном smoothened. В некоторых вариантах осуществления изобретения антагонист по данному изобретению может ингибировать активацию пути передачи сигналов геном hedgehog, связываясь с геном patched. В другом предпочтительном варианте осуществления изобретения способ по данному изобретению можно использовать в качестве составной части схемы лечения злокачественной медуллобластомы и других первичных злокачественных нейроэктодермальных опухолей центральной нервной системы. Другим объектом настоящего изобретения являются фармацевтические препараты, содержащие в качестве активного ингредиента антагонист гена hedgehog, агонист гена ptc или антагонист генаsmoothened в количестве, достаточном для ингибирования in vivo пролиферации или других биологических последствий утраты функции гена ptc, приобретения функции гена hedgehog или приобретения функции гена smoothened. Способ лечения по данному изобретению с использованием антагонистов гена hedgehog, агонистов гена patched или антагонистов гена smoothened, можно применять для лечения как людей, так и животных. Животными, которых можно лечить способом по данному изобретению, являются комнатные животные и домашние животные, выращиваемые в коммерческих целях. Примерами таких животных являются собаки, кошки, крупный рогатый скот, лошади, овцы, свиньи и козы.-5 007339 Для удобства ниже приведены некоторые термины, используемые в описании изобретения, примерах и прилагаемой формуле изобретения. Термин "аберрантная модификация или мутация" гена означает генетические повреждения, такие как, например, делеции, замены или добавления нуклеотидов к гену, а также значительные хромосомные перестройки гена и/или аномальное метилирование гена. Подобным образом неправильная экспрессия гена представляет аберрантные уровни транскрипции гена относительно уровней в нормальной клетке при одинаковых условиях, а также сплайсинг недикого типа мРНК, транскрибированной из гена."Базально-клеточный рак" существует в разных клинических и гистологических формах, таких как узелково-язвенный, поверхностный, пигментный, склеродермоподобный, фиброэпителиомный и невоидный синдром. Базально-клеточный рак представляет наиболее распространенные кожные новообразования, обнаруживаемые у человека. В данную категорию входит большинство новых случаев рака кожи кроме меланомы. Термин "ожоговые раны" относится ко всем случаям повреждения или утраты больших поверхностных участков кожи у субъекта под действием тепла и/или химических агентов. Термин "карцинома" относится к злокачественному новообразованию, состоящему из эпителиальных клеток, которое проникает в окружающие ткани и образует метастазы. Типичные карциномы включают: "базально-клеточный рак", представляющий собой эпителиальную опухоль кожи, которая, редко образуя метастазы, локально прорастает в окружающие ткани и разрушает их; "плоскоклеточный рак",представляющий карциному, образующуюся из плоского эпителия и имеющую кубовидные клетки;"карциносаркому", представляющую собой злокачественные опухоли, состоящие из карциномных и саркомных тканей; "аденокистозную карциному" - карциному, характеризующуюся наличием цилиндров или полос гиалина или слизистой стромы, разделенных или окруженных гнездами или полосками мелких эпителиальных клеток, образующимися в молочных и слюнных железах, а также в слизистых железах дыхательных путей; "эпидермоидный рак", относящийся к раковым клеткам, дифференцирующимся аналогично клеткам эпидермиса, то есть образующим шиповатые эпидермоциты и подвергающимся ороговению; "носоглоточный рак", представляющий злокачественную опухоль, образующуюся в эпителиальной выстилке пространства задней части носа; и "почечно-клеточный рак", представляющий карциному паренхимы почки, состоящую из произвольно расположенных трубчатых клеток. Другими карциномными эпителиальными новообразованиями являются "папилломы", которые представляют собой доброкачественные опухоли, образующиеся из эпителия и вызываемые вирусом папилломы; и "эпидермоидомы", которые представляют собой церебральную или менингеальную опухоль, образуемую включением эктодермальных элементов в процессе закрытия нервной борозды. Термин "кориум" или "дерма" означает слой кожи, доходящий до эпидермиса, который включает плотное ложе сосудистой соединительной ткани и содержит нервы и окончания органов восприятия. Волосяные корни, сальные и потовые железы являются структурами эпидермиса, которые глубоко погружены в дерму. Термин "дентин" означает ткань во рту, которая подобна эпителиальной ткани, например, ткань десны. Способ по настоящему изобретению пригоден для лечения периодонтита. Термин "кожные язвы" означает повреждения кожи, вызываемые поверхностной утратой ткани,обычно в результате воспалительного процесса. Кожные язвы, которые можно лечить способом по настоящему изобретению, включают язвы, вызванные лежачим положением, диабетические язвы, варикозные язвы и артериальные язвы. Язвы, вызванные лежачим положением представляют собой хронические язвы, возникающие в результате продолжительного надавливания на некоторые участки кожи. Раны данного типа называются пролежнями и наминами. Варикозные язвы возникают вследствие застоя крови или других жидкостей в плохих венах. Артериальные язвы представляют омертвевшую кожу вокруг артерий с плохим кровотоком. Термин "ED50" означает дозу лекарственного средства, эффективность которой равна 50% максимального ответа или действия."Эффективное количество", например, антагониста гена hedgehog с точки зрения способа лечения по данному изобретению означает количество антагониста в препарате, которое при введении в соответствии с требуемой схемой лекарственного лечения вызывает, например, изменение скорости пролиферации клеток, и/или состояния дифференцировки клетки и/или нормы выживания клетки, соответствующее клинически приемлемым стандартам при лечении заболевания или косметическом воздействии. Термины "эпителий" и "эпителиальный" относятся к клеточной выстилке внутренних и наружных поверхностей тела (кожной, слизистой и серозной), включающей железы и другие образуемые ими структуры, например, эпителиальные клетки роговицы, пищевода, эпидермиса и волосяных фолликул. Другие типичные эпителиальные ткани включают обонятельный эпителий, который представляет псевдомногослойный эпителий, выстилающий обонятельную область носовой полости и содержащий рецепторы, воспринимающие запах; железистый эпителий, который представляет эпителий, состоящий из секреторных клеток; плоский эпителий, состоящий из плоских пластинкообразных клеток. Термин "эпителий" может также означать переходный эпителий, такой как эпителий, выстилающий полые органы, под-6 007339 верженные большому механическому изменению вследствие сжатия и растяжения, например, ткани,представляющие переход между многослойным плоским и цилиндрическим эпителием. Термин "эпителизация" означает заживление раны в результате разрастания эпителиальной ткани на оголенной поверхности. Термин "эпидермальная железа" означает скопление клеток, связанных с эпидермисом, которые секретируют или выделяют вещества, не относящиеся к их обычным метаболическим нуждам. Например, "сальные железы" представляют голокринные железы в дерме, которые секретируют маслянистое вещество и кожное сало. Термин "потовые железы" означает железы, секретирующие пот, которые расположены в дерме или подкожной ткани и выходят через проток на поверхность тела. Термин "эпидермис" означает наружный и несосудистый слой кожи, образующийся из эмбриональной эктодермы, толщина которого равна 0,07-1,4 мм. На ладонях и подошвах стоп эпидермис состоит из пяти слоев, которые располагаются в следующем порядке от нижнего слоя к верхнему: базальный слой,состоящий из цилиндрических клеток, расположенных перпендикулярно; слой щипцовых клеток или шиповатый слой эпидермиса, состоящий из плоских многогранных клеток с короткими отростками или шипами; зернистый слой, состоящий из плоских зернистых клеток; прозрачный слой, состоящий из нескольких слоев прозрачных, светопроницаемых клеток, в которых ядра неразличимы или отсутствуют; и роговой слой плоских ороговевших безъядерных клеток. В эпидермисе общей поверхности тела прозрачный слой обычно отсутствует. Термин "резаные раны" означает разрывы, ссадины, порезы или проколы эпителиального слоя кожи, которые могут проникать в дермальный слой и даже в подкожный жировой слой и глубже. Резаные раны могут возникнуть в результате хирургического вмешательства или случайного повреждения кожи. Термин "рост" клетки означает скорость пролиферации и/или дифференцировки клетки. Термин"измененный рост" означает рост клетки, характеризующийся аномальной скоростью пролиферации,например, более высокой или более низкой скоростью пролиферации по сравнению с нормальной клеткой. Термин "волос" означает нитевидную структуру, в частности специализированную эпидермальную структуру, состоящую из кератина и развивающуюся из сосочка в дерме, которая образуется только у млекопитающих и характеризует указанную группу животных. Термин "волос" означает совокупность таких волос. Термин "волосяной фолликул" означает одну из трубчатых вытягиваний эпидермиса, из которой растет волос. Термин "эпителиальные клетки волосяного фолликула" означает эпителиальные клетки, окружающие дермальный сосочек в волосяном фолликуле, например, стволовые клетки, наружные клетки эпителиального влагалища корня волоса, клетки оболочки и внутренние клетки эпителиального влагалища корня волоса. Такие клетки могут быть нормальными незлокачественными клетками или трансформированными/иммортализованными клетками. Термин "антагонист гена hedgehog" означает вещество, которое усиливает или ослабляет биологическую активность гена patched, например, с целью подавления транскрипции генов-мишеней. Предпочтительные антагонисты гена hedgehog можно использовать для воздействия на утраченную функцию гена ptc и/или приобретенную функцию гена smoothened, причем указанный последним антагонист является также антагонистом гена smoothened. Термин "антагонист гена hedgehog" в используемом здесь значении означает не только вещество, которое может непосредственно ингибировать нормальную функцию белка гена hedgehog, но и любое вещество, которое ингибирует путь передачи сигналов геномhedgehog и таким образом восстанавливает функцию гена ptc. Термин "приобретение функции гена hedgehog" означает аберрантную модификацию или мутацию гена ptc, гена hedgdehog или гена smoothened либо уменьшение (или прекращение) экспрессии такого гена, в результате чего образуется фенотип, который напоминает контактирование клетки с белком генаhedgehog, например, аберрантную активацию пути передачи сигналов геном hedgehog. Приобретение функции может означать утрату способности генного продукта ptc регулировать уровень экспрессии генов Ci, например, Gli1, Gli2 и Gli3. Термин "приобретение функции гена hedgehog" используется также для обозначения любого подобного клеточного фенотипа (например, характеризующегося избыточной пролиферацией), который возникает вследствие изменения в пути трансдукции сигналов геном hedgehog,включая модификацию или мутацию самого гена hedgehog, но не ограничиваясь ею. Например, опухолевая клетка с аномально высокой скоростью пролиферации вследствие активации пути передачи сигналов геном hedgehog будет иметь фенотип с "приобретенной функцией гена hedgehog", даже если генhedgehog не мутировал в данной клетке. В используемом здесь значении термин "иммортализованные клетки" означает клетки, которые были изменены химическим и/или рекомбинантным методом, в результате чего указанные клетки приобрели способность расти вследствие неограниченного числа делений в культуре. Термин "внутренняя эпителиальная ткань" означает ткань внутри тела, которая обладает свойствами, подобными эпидермальному слою кожи. Примеры такой ткани включают выстилку кишечника. Способ по настоящему изобретению пригоден для стимуляции заживления некоторых внутренних ран, например, ран, возникающих вследствие хирургического вмешательства.-7 007339 Термин "кератоз" означает пролиферативное заболевание кожи, характеризующееся гиперплазией рогового слоя эпидермиса. Типичные кератолитические заболевания включают фолликулярный кератоз,ладонный и подошвенный кератоз, фарингеальный кератоз, волосистый кератоз и актинический кератоз. Термин "LD50" означает дозу лекарственного средства, которая является летальной для 50% испытуемых субъектов. Термин "ноготь" означает ороговевшую кожную пластинку на дорсальной поверхности конца пальца кисти или стопы. Термин "утрата функции гена patched" означает аберрантную модификацию или мутацию гена ptc или уменьшение экспрессии гена, в результате чего образуется фенотип, который напоминает контактирование клетки с белком гена hedgehog, например, аберрантную активацию пути передачи сигналов геном hedgehog. Утрата функции может означать потерю способности генного продукта ptc регулировать уровень экспрессии генов Ci, например, Gli1, Gli2 и Gli3. Термин "утрата функции гена ptc" используется также для обозначения любого подобного клеточного фенотипа (например, характеризующегося избыточной пролиферацией), который возникает вследствие изменения в пути трансдукции сигналов геномhedgehog, включая модификацию или мутацию самого гена ptc, но не ограничиваясь ею. Например, опухолевая клетка с аномально высокой скоростью пролиферации вследствие активации пути передачи сигналов геном hedgehog будет иметь фенотип с "утраченной функцией гена ptc", даже если ген ptc не мутировал в данной клетке."Пациент" или "субъект", подвергаемый лечению способом по данному изобретению, может означать человека или животное, не относящееся к человеку. Термин "пролекарство" означает соединения, которые в физиологических условиях превращаются в терапевтически активные вещества по настоящему изобретению. Обычным способом получения пролекарства является введение в молекулу выбранных групп, которые подвергаются гидролизу в физиологических условиях, высвобождая требуемую молекулу. В других вариантах осуществления изобретения превращение пролекарства происходит под действием ферментов животного-хозяина. В используемом здесь значении термин "пролиферация" относится к клеткам, подвергаемым митозу. В данной заявке на патент термин "пролиферативное заболевание кожи" означает любое заболевание/поражение кожи, характеризующееся нежелательной или аберрантной пролиферацией кожной ткани. Указанные заболевания обычно отличаются пролиферацией эпидермальных клеток или неполной дифференцировкой клеток и включают, например, Х-связанный ихтиоз, псориаз, атопический дерматит,аллергический дерматит, эпидермальный гиперкератоз и себорейную экзему. Например, эпидермодисплазия представляет одну из форм неправильного развития эпидермиса. Другим примером является"эпидермолиз", который относится к ослабленному состоянию эпидермиса с образованием волдырей или пузырей, происходящим спонтанно или в месте травмы. В используемом здесь значении термин "псориаз" означает гиперпролиферативное заболевание кожи, которое изменяет регуляторные механизмы кожи. В частности, при указанном заболевании образуются поражения, представляющие первичные и вторичные изменения пролиферации эпидермиса, воспалительные реакции кожи и экспрессию регуляторных молекул, таких как лимфокины и воспалительные факторы. Кожа, пораженная псориазом, морфологически характеризуется ускоренным обновлением эпидермальных клеток, утолщением эпидермиса, аномальной кератинизацией, инфильтратами воспалительных клеток в слое дермиса и инфильтрацией полиморфноядерных лейкоцитов в слой эпидермиса, вызывающей увеличение цикла базальных клеток. Кроме того, при данном заболевании присутствуют гиперкератолитические и паракератолитические клетки. Термин "кожа" означает наружное защитное покрытие тела, состоящее из дермы и эпидермиса и включающее потовые и сальные железы, а также волосяные фолликулы. В данной заявке может быть использовано прилагательное "кожный", которое служит для определения кожи в соответствующем контексте. Термин "приобретение функции гена smoothened" означает аберрантную модификацию или мутацию гена smo или увеличение уровня экспрессии гена, в результате чего образуется фенотип, напоминающий контактирование клетки с белком гена hedgehog, например, аберрантную активацию пути передачи сигналов геном hedgehog. He связывая себя какой-либо конкретной теорией, можно отметить, что ген ptc может не передавать сигнал непосредственно в клетку, а взаимодействовать с геном smoothened,другим мембраносвязанным белком, расположенным ниже от гена ptc в пути передачи сигналов геномhedgehog (Marigo et al., (1996) Nature 384:177-179). Ген smo представляет ген с сегментной полярностью,необходимый для формирования правильного паттерна каждого сегмента дрозофилы (Alcedo et al. (1996)Cell 86:221-232). Обнаружены гомологи гена smo у человека. См., например, Stone et al. (1996) Nature 384:129-134 и банк генов GenBank, номер доступа U84401. Ген smoothened кодирует мембранный белок со свойствами гетеротримерных рецепторов, связанных с G-белком, то есть 7-трансмембранные области. Указанный белок характеризуется гомологией с белком гена Frizzled (Fz) дрозофилы, являющегося членом пути передачи сигналов геном wingless. Первоначально считалось, что ген smo кодирует рецептор сигнального гена Hh. Однако затем данное утверждение было опровергнуто, так как были получены дан-8 007339 ные, свидетельствующие о том, что ген ptc является рецептором Hh. Клетки, экспрессирующие ген smo,не связываются с Hh, указывая на то, что ген smo не взаимодействует непосредственно с Hh (Nusse,(1996) Nature 384:119-120). Считается, что связывание Sonic hedgehog (SHH) с его рецептором РТСН предотвращает нормальное РТСН-ингибирование гена smoothened (SMO), семицикличного трансмембранного белка. Недавно в научной литературе появилось сообщение о том, что активирующие мутации генаsmoothened происходят при возникновении спорадического базально-клеточного рака, Xie et al. (1998)Nature 391:90-2, и первичных нейроэктодермальных опухолей центральной нервной системы,Reifenberger et al. (1998) Cancer Res. 58:1798-803. Термин "терапевтический индекс" означает терапевтический индекс лекарственного средства, определяемый как LD50/ED50. В используемом здесь значении термин "трансформированные клетки" означает клетки, которые спонтанно переходят в состояние неограниченного роста, то есть приобретают способность расти, производя неограниченное число делений в культуре. Трансформированные клетки могут быть охарактеризованы такими терминами, как неопластические, анапластические и/или гиперпластические, с точки зрения неконтролируемого роста. Термин "ациламино" известен в данной области и означает часть молекулы, которая может быть выражена общей формулой: где R9 имеет указанные ниже значения и R'11 означает водород, алкил, алкенил или -(CH2)m-R8, гдеm и R8 имеют указанные выше значения. Термин "алифатическая группа" означает алифатическую углеводородную группу с прямой или разветвленной целью или циклическую алифатическую углеводородную группу и включает насыщенные и ненасыщенные алифатические группы, такие как алкильная группа, алкенильная группа и алкинильная группа. Термины "алкенил" и "алкинил" означают ненасыщенные алифатические группы, аналогичные в отношении длины и возможного замещения вышеописанным алкилам, но имеющие по крайней мере одну двойную или тройную связь. Термины "алкоксил" или "алкокси" в используемом здесь значении означают вышеуказанную алкильную группу с присоединенным к ней кислородным радикалом. Типичные алкоксильные группы включают метокси, этокси, пропилокси, трет-бутокси и тому подобные. Термин "простой эфир" означает два углеводорода, ковалентно связанных кислородом. Поэтому заместитель алкила, который делает алкил простым эфиром, является или подобен алкоксилу, который может быть выражен одной из формул-О-алкил, -О-алкенил, -О-алкинил, -О- (CH2)m-R8, где m и R8 имеют указанные ниже значения. Термин "алкил" означает радикал насыщенных алифатических групп, включающих алкильные группы с прямой цепью, алкильные группы с разветвленной цепью, циклоалкильные (алициклические) группы, алкилзамещенные циклоалкильные группы и циклоалкилзамещенные алкильные группы. В предпочтительных вариантах осуществления изобретения алкил с прямой или разветвленной цепью имеет 30 или меньше атомов углерода в главной цепи (например, C1-C30 для прямых цепей, С 3-С 30 для разветвленных цепей) и более предпочтительно 20 или меньше атомов углерода. Аналогичным образом предпочтительные циклоалкилы имеют 3-10 атомов углерода в циклической структуре и более предпочтительно 5, 6 или 7 атомов углерода в циклической структуре. Кроме того, термин "алкил" (или "низший алкил") в значении, используемом в данном описании изобретения, примерах и формуле изобретения означает как "незамещенные алкилы", так и "замещенные алкилы", причем последние означают алкильные части с заместителями, замещающими атом водорода у одного или нескольких атомов углерода углеводородной цепи. Такие заместители могут включать, например, галоген, гидроксил, карбонил (такой как карбоксил, алкоксикарбонил, формил или ацил), тиокарбонил (такой как сложный тиоэфир, тиоацетат или тиоформиат), алкоксил, фосфорил, фосфат, фосфонат, фосфинат, амино, амидо, амидин, имин, циано, нитро, азидо, сульфгидрил, алкилтио, сульфат,сульфонат, сульфамоил, сульфонамидо, сульфонил, гетероциклил, аралкил либо ароматическую или гетероароматическую часть молекулы. Специалистам в данной области должно быть известно, что части молекулы, замещенные в углеводородной цепи, могут быть сами замещены, если это возможно. Например, заместители замещенного алкила могут включать замещенные и незамещенные формы амино, азидо, имино, амидо, фосфорила (включая фосфонат и фосфинат), сульфонила (включая сульфат, сульфонамидо, сульфамоил и сульфонат) и силильных групп, а также простые эфиры, алкилтио, карбонилы(включая кетоны, альдегиды, карбоксилаты и сложные эфиры), -CF3, -CN и тому подобные. Типичные замещенные алкилы описаны ниже. Циклоалкилы могут быть далее замещены алкилами, алкенилами,алкокси, алкилтио, аминоалкилами, карбонилзамещенными алкилами, -CF3, -CN и тому подобными.-9 007339 Если число атомов углерода не указано, "низший алкил" в используемом здесь значении означает вышеуказанную алкильную группу, имеющую от одного до десяти атомов углерода, более предпочтительно от одного до шести атомов углерода в главной цепи. Аналогичным образом "низший алкенил" и"низший алкинил" имеют цепи такой же длины. В данной заявке предпочтительными алкильными группами являются низшие алкилы. В предпочтительных вариантах осуществления изобретения заместитель,указанный здесь как алкил, является низшим алкилом. Термин "алкилтио" означает вышеуказанную алкильную группу с присоединенным к ней серным радикалом. В предпочтительных вариантах осуществления изобретения "алкилтиогруппа" представлена одной из следующих групп -S-алкил, -S-алкенил, -S-алкинил и -S-(CH2)m-R8, где m и R8 имеют указанные ниже значения. Типичные алкилтиогруппы включают метилтио, этилтио и тому подобные. Термин "амин" и "амино" известны в данной области и означают незамещенные и замещенные амины, например, часть молекулы, которая может быть выражена общей формулой: где R9, R10 и R'10 независимо означают водород, алкил, алкенил, -(CH2)m-R8 или R9 и R10 вместе с атомом N, к которому они присоединены, образуют гетероцикл, имеющий от 4 до 8 атомов в циклической структуре; R8 представляет арил, циклоалкил, циклоалкенил, гетероцикл или полицикл; и m является нулем или целым числом от 1 до 8. В предпочтительных вариантах осуществления изобретения только один элемент из R9 или R10 может быть карбонилом, например, R9, R10 вместе с атомом азота не образуют имид. В некоторых таких вариантах осуществления изобретения ни R9, ни R10 не присоединен к N карбонилом, например, амин не является амидом или имидом, причем амин предпочтительно является основным, например, его сопряженная кислота имеет рКа больше 7. В еще более предпочтительных вариантах осуществления изобретения R9 и R10 (и необязательно R'10) независимо означают водород, алкил,алкенил или -(CH2)m-R8-. Так, термин "алкиламин" в используемом здесь значении означает вышеуказанную аминогруппу с присоединенным к ней замещенным или незамещенным алкилом, то есть по крайней мере один элемент из R9 и R10 является алкильной группой. Термин "амидо" известен в данной области как аминозамещенный карбонил и включает часть молекулы, которая может быть выражена общей формулой: где R9, R10 имеют указанные выше значения. К предпочтительным типам амида не относятся неустойчивые имиды. Термин "аралкил" в используемом здесь значении означает алкильную группу, замещенную арильной группой (например, ароматической или гетероароматической группой). Термин "арил" в используемом здесь значении включает 5-, 6-и 7-членные одноциклические ароматические группы, которые могут содержать от нуля до четырех гетероатомов, например, бензол, пиррол,фуран, тиофен, имидазол, оксазол, тиазол, триазол, пиразол, пиридин, пиразин, пиридазин, пиримидин и тому подобные. Указанные арильные группы, имеющие гетероатомы в циклической структуре, могут быть также определены как "арильные гетероциклы" или "гетероароматические группы". Ароматическое кольцо может быть замещено в одном или более положениях в цикле вышеописанными заместителями,такими как, например, галоген, азид, алкил, аралкил, алкенил, алкинил, циклоалкил, гидроксил, алкоксил, амино, нитро, сульфгидрил, имино, амидо, фосфат, фосфонат, фосфинат, карбонил, карбоксил, силил, простой эфир, алкилтио, сульфонил, сульфонамидо, кетон, альдегид, сложный эфир, гетероциклил,ароматические или гетероароматические группы, -CF3, -CN или тому подобные. Термин "арил" означает также полициклические кольцевые системы, имеющие два или больше циклических колец, в которых два или больше атомов углерода являются общими для двух смежных колец (указанные кольца являются"конденсированными кольцами"), в которых по крайней мере одно из колец является ароматическим и другие циклические кольца могут представлять циклоалкилы, циклоалкенилы, циклоалкинилы, арилы и/или гетероциклилы. Термин "карбоцикл" в используемом здесь значении означает ароматическое или неароматическое кольцо, в котором все атомы являются атомами углерода. Термин "карбонил" известен в данной области и означает части молекулы, которые могут быть выражены общей формулой:- 10007339 где X означает связь или представляет кислород или серу, R11 означает водород, алкил, алкенил,-(CH2)m-R8 или фармацевтически приемлемую соль, R'11 означает водород, алкил, алкенил или -(CH2)mR8, где m и R8 имеют указанные выше значения. Когда X означает кислород и R11 или R'11 не является водородом, данная формула представляет"сложный эфир". Когда X означает кислород и R11 имеет указанные выше значения, такая часть молекулы представляет карбоксильную группу, и, когда R11 означает водород, данная формула представляет"формиат". Как правило, когда атом кислорода в вышеуказанной формуле заменен атомом серы, данная формула представляет "тиокарбонильную" группу. Когда X означает серу и R11 или R'11 не является водородом, данная формула представляет "сложный тиоэфир". Когда X означает серу и R11 означает водород, данная формула представляет "тиокарбоновую кислоту". Когда X означает серу и R'11 означает водород, данная формула представляет "тиоформиат". С другой стороны, когда X означает связь и R11 не является водородом, вышеуказанная формула представляет "кетоновую" группу. Когда X означает связь и R11 означает водород, вышеуказанная формула представляет "альдегидную" группу. Термин "гетероатом" в используемом здесь значении означает атом любого элемента кроме углерода или водорода. Предпочтительными гетероатомами являются бор, азот, кислород, фосфор, сера и селен. Термины "гетероциклил" или "гетероциклическая группа" означают 3-10-членные циклические структуры, более предпочтительно 3-7-членные кольца, циклические структуры которых содержат от одного до четырех гетероатомов. Гетероциклы могут быть также полициклами. Гетероциклильные группы включают, например, тиофен, тиантрен, фуран, пиран, изобензофуран, хромен, ксантен, феноксатиин,пиррол, имидазол, пиразол, изотиазол, изоксазол, пиридин, пиразин, пиримидин, пиридазин, индолизин,изоиндол, индол, индазол, пурин, хинолизин, изохинолин, хинолин, фталазин, нафтиридин, хиноксалин,хиназолин, циннолин, птеридин, карбазол, карболин, фенантридин, акридин, пиримидин, фенантролин,феназин, фенарсазин, фенотиазин, фуразан, феноксазин, пирролидин, оксолан, тиолан, оксазол, пиперидин, пиперазин, морфолин, лактоны, лактамы, такие как азетидиноны и пирролидиноны, сультамы, сультоны и тому подобные. Гетероциклическое кольцо может быть замещено в одном или более положениях вышеуказанными заместителями, такими как, например, галоген, алкил, аралкил, алкенил, алкинил, циклоалкил, гидроксил, амино, нитро, сульфгидрил, имино, амидо, фосфат, фосфонат, фосфинат, карбонил, карбоксил, силил, простой эфир, алкилтио, сульфонил, кетон, альдегид, сложный эфир, гетероциклил, ароматическая или гетероароматическая группа, -CF3, -CN или тому подобные. В используемом здесь значении термин "нитро" означает -NO2; термин "галоген" означает -F, -Cl,-Br или -I; термин "сульфгидрил" означает -SH; термин "гидроксил" означает -ОН; и термин "сульфонил" означает -SO2-."Фосфонамидит" может быть выражен общей формулой: где R9 и R10 имеют указанные выше значения, Q2 означает О, S или N и R48 означает низший алкил или арил, Q2 означает О, S или N."Фосфорамидит" может быть выражен общей формулой где R9 и R10 имеют указанные выше значения и Q2 означает О, S или N."Фосфорил" может быть выражен общей формулой: где Q1 означает S или О и R46 означает водород, низший алкил или арил. При использовании для замещения, например, алкила фосфорильная группа фосфорилалкила может быть выражена общей формулой:- 11007339 где Q1 означает S или О и все R46 независимо означают водород, низший алкил или арил, Q2 означает О, S или N. Когда Q1 означает S, фосфорильная часть молекулы представляет "фосфортиоат". Термины "полициклил" или "полициклическая группа" означают два или больше колец (например,циклоалкилы, циклоалкенилы, циклоалкинилы, арилы и/или гетероциклилы), в которых два или больше атомов углерода являются общими для двух смежных колец, например, такие кольца являются "конденсированными кольцами". Кольца, соединенные несмежными атомами, называются кольцами "с внутренним мостиком". Все кольца полицикла могут быть замещены вышеуказанными заместителями, такими как, например, галоген, алкил, аралкил, алкенил, алкинил, циклоалкил, гидроксил, амино, нитро, сульфгидрил, имино, амидо, фосфат, фосфонат, фосфинат, карбонил, карбоксил, силил, простой эфир, алкилтио, сульфонил, кетон, альдегид, сложный эфир, гетероциклил, ароматическая или гетероароматическая группа, -CF3, -CN или тому подобные. Термин "защитная группа" в используемом здесь значении означает временные заместители, защищающие потенциально реакционноспособную функциональную группу от нежелательных химических превращений. Примеры таких защитных групп включают сложные эфиры карбоновых кислот, силиловые эфиры спиртов, ацетали и кетали альдегидов и кетонов. Области применения защитных групп описаны в научной литературе (Greene, T.W.; Wuts, P.G.M. Protective Groups in Organic Synthesis, 2nd ed.;Wiley: New York, 1991). Термин "селеноалкил" означает алкильную группу с присоединенной к ней замещенной селеногруппой. Типичные "простые селеноэфиры", которые могут быть замещены в положении алкила, выбирают из -Se-алкила, -Se-алкенила, -Se-алкинила и -Se-(CH2)m-R8, где m и R8 имеют указанные выше значения. В используемом здесь значении термин "замещенный" означает все возможные заместители органических соединений. В широком понимании возможные заместители включают ациклические и циклические заместители, заместители с разветвленной и неразветвленной цепью, карбоциклические и гетероциклические, ароматические и неароматические заместители органических соединений. Типичными заместителями являются, например, вышеуказанные заместители. Приемлемыми заместителями могут быть один или более одинаковых или разных заместителей, пригодных для соответствующих органических соединений. В соответствии с целями данного изобретения гетероатомы, такие как азот, могут иметь водородные заместители и/или любые приемлемые заместители органических соединений, которые соответствуют валентностям гетероатомов. Настоящее изобретение не ограничено какими-либо приемлемыми заместителями органических соединений. Следует отметить, что термины "замещение" или замещенный подразумевают условие, заключающееся в том, что такое замещение соответствует допустимой валентности замещенного атома и заместителя и что указанное замещение позволяет получить устойчивое соединение, например, такое, которое не подвергается спонтанному превращению в результате перегруппировки, циклизации, элиминирования и т.д. Термин "сульфамоил" известен в данной области и означает часть молекулы, которая может быть выражена общей формулой: где R9 и R10 имеют указанные выше значения. Термин "сульфат" известен в данной области и означает часть молекулы, которая может быть выражена общей формулой: где R41 имеет указанные выше значения. Термин "сульфонамидо" известен в данной области и означает часть молекулы, которая может быть выражена общей формулой: где R9 и R'11 имеют указанные выше значения. Термин "сульфонат" известен в данной области и означает часть молекулы, которая может быть выражена общей формулой: где R41 означает электронную пару, водород, алкил, циклоалкил или арил. Термины "сульфоксидо" или "сульфинил" в используемом здесь значении означают часть молекулы, которая может быть выражена общей формулой: где R44 выбирают из группы, включающей водород, алкил, алкенил, алкинил, циклоалкил, гетероциклил, аралкил или арил. Аналогичным образом могут быть замещены алкенильные и алкинильные группы с образованием,например, аминоалкенилов, аминоалкинилов, амидоалкенилов, амидоалкинилов, иминоалкенилов, иминоалкинилов, тиоалкенилов, тиоалкинилов, карбонилзамещенных алкенилов или алкинилов. В используемом здесь значении определение таких терминов, как алкил, m, n и т.д., при многократком использовании в любой структуре не зависит от определения указанных терминов в других положениях той же структуры. Термины "трифлил, тозил, мезил и нонафлил" известны в данной области и означают соответственно трифторметансульфонильные, п-толуолсульфонильные, метансульфонильные и нонафторбутансульфонильные группы. Термины "трифлат, тозилат, мезилат и нонафлат" известны в данной области и означают функциональные группы сложного эфира трифторметансульфоновой кислоты, сложного эфира птолуолсульфоновой кислоты, сложного эфира метансульфоновой кислоты и сложного эфира нонафторбутансульфоновой кислоты и молекулы, содержащие указанные группы. Аббревиатуры Me, Et, Ph, Tf, Nf, Ts, Ms означает соответственно метил, этил, фенил, трифторметансульфонил, нонафторбутансульфонил, п-толуолсульфонил и метансульфонил. Более обширный список аббревиатур, используемых в органической химии, приведен в первом выпуске первого тома журнала Journal of Organic Chemistry; указанный список обычно представлен в таблице, озаглавленной "Стандартный список аббревиатур". Аббревиатуры, входящие в указанный список, и все аббревиатуры, используемые в органической химии, включены в данное описание изобретения в качестве ссылки. Некоторые соединения по настоящему изобретению могут существовать в конкретных геометрических или стереоизомерных формах. В объем настоящего изобретения входят все такие соединения, в том числе цис- и транс-изомеры, R- и S-энантиомеры, диастереомеры, (D)-изомеры, (L)-изомеры, их рацемические смеси и другие смеси. В заместителе, таком как алкильная группа, могут присутствовать дополнительные асимметричные атомыуглерода. Все такие изомеры, а также их смеси входят в объем данного изобретения. Например, определенный энантиомер соединения по настоящему изобретению можно получить асимметричным синтезом или при помощи хирального вспомогательного соединения, после чего полученную смесь диастереомеров разделяют и вспомогательную группу отщепляют, получая при этом чистые требуемые энантиомеры. Альтернативно, при наличии в молекуле основной функциональной группы, такой как амино, или кислотной функциональной группы, такой как карбоксил, диастереомерные соли можно получить при помощи соответствующей оптически активной кислоты или основания с последующим разделением образовавшихся диастереомеров методами фракционированной кристаллизации или хроматографии, хорошо известными в данной области, и выделением чистых энантиомеров. Предполагаемые эквиваленты вышеописанных соединений включают соединения, которые соответствуют указанным соединениям и обладают такими же общими свойствами (например, способностью ингибировать передачу сигналов геном hedgehog), но имеют один или более других заместителей, не оказывающих вредного влияния на эффективность соединения. В целом, соединения по настоящему изобретению могут быть получены способами, показанными, например, на приведенных ниже общих схемах реакций, или их модификациями с использованием легко доступных исходных веществ, реагентов и обычных методов синтеза. При выполнении реакций можно использовать разные варианты, которые хорошо известны, но не указаны в данном описании изобретения. В соответствии с целями данного изобретения химические элементы указаны согласно периодической таблице элементов, версия CAS, Handbook of Chemistry and Physics, 67th Ed., 1986-87, приведенной на внутренней стороне обложки. Кроме того, в соответствии с целями данного изобретения термин "углеводород" означает все возможные соединения, имеющие по крайней мере один атом водорода и один атом углерода. В широком понимании возможные углеводороды представляют ациклические и циклические соединения, соединения с разветвленной и неразветвленной цепью, карбоциклические и гетероциклические, ароматические и неароматические органические соединения, которые могут быть замещены или не замещены.III. Типичные соединения по данному изобретению.- 13007339 Как будет подробно описано ниже, при выполнении способов по настоящему изобретению могут быть использованы разнообразные мелкие молекулы, которые можно легко идентифицировать при помощи скрининговых анализов лекарственных средств, рассмотренных в данном описании изобретения. Например, соединения, пригодные для осуществления способов по настоящему изобретению, могут быть выражены общей формулой (I): где в зависимости от валентности и устойчивости соединения X и Z независимо означают -N(R7)-,-O-, -S-,- (R7)N-N(R7)-, -ON(R7)- или прямую связь, предпочтительно -N(R7)-, -О-, -S- или прямую связь;G означает циклоалкильное, гетероциклильное, арильное или гетероарильное кольцо, конденсированное с кольцом, к которому оно присоединено, предпочтительно арильное или гетероарильное кольцо;Ar означает замещенное или незамещенное арильное или гетероарильное кольцо, такое как замещенное или незамещенное фенильное кольцо;R1 означает Н, замещенный или незамещенный алкил, алкенил, алкинил, арил, гетероарил, гетероциклил или циклоалкил, в том числе полициклические группы;R2 представляет 0-4 заместителя в кольце, к которому они присоединены, такие как галоген, низший алкил, низший алкенил, арил, гетероарил, карбонил (например, сложный эфир, карбоксил или формил), тиокарбонил (например, сложный тиоэфир, тиокарбоксилат или тиоформиат), кетон, альдегид,амино, ациламино, амидо, амидино, циано, нитро, азидо, сульфонил, сульфоксидо, сульфат, сульфонат,сульфамоил, сульфонамидо, фосфорил, фосфонат, фосфинат, J-R8, J-OH, J-низший алкил, J-низший алкенил, J-R8, J-SH, J-NH2, защищенные формы вышеуказанных групп, либо два любых заместителя R2, несколько раз встречающихся в циклической или полициклической структуре, могут вместе взятые образовывать 4-8-членный циклоалкил, арил или гетероарил;J независимо означает цепь, имеющую 0-8 (предпочтительно 0-4) звеньев, выбираемых из СК 2, NK,О и S, где K независимо означает Н или низший алкил. В некоторых вариантах осуществления изобретения по крайней мере один из элементов Z и X не является прямой связью. В других вариантах осуществления изобретения X-Y-Z включает амид, мочевину или сульфонамид. В других вариантах осуществления изобретения X представляет -N(R8)-, -O-, -S-,предпочтительно NH. В некоторых вариантах осуществления изобретения R1 означает арильное или гетероарильное кольцо, необязательно замещенное 1-5 заместителями, такими как нитро, галоген, циано, низший алкил,ациламино (например, R8-C (=O)NH-), алкокси, алкиламино, замещенный или незамещенный циклоалкил, гетероциклил, арил или гетероарил, конденсированный с арильным или гетероарильным кольцом. В некоторых вариантах осуществления изобретения X и кольцо, содержащее А, присоединены к Ar в мета-положении (то есть в 1,3-положении). В некоторых вариантах осуществления изобретения G означает фенильное или пиперидиновое кольцо. В некоторых вариантах осуществления изобретения J отсутствует. В некоторых вариантах осуществления изобретения R2 представляет 1-4 заместителя, выбираемых из группы, включающей галоген, циано, нитро, алкокси, амино, ациламино (например, R8-C(=O)NH-),замещенный или незамещенный циклоалкил, гетероциклил, арил или гетероарил, конденсированный с G,и замещенный или незамещенный низший алкил. В некоторых вариантах осуществления изобретения соединение по данному изобретению выбирают из соединений, показанных на фиг. 32. В некоторых вариантах осуществления изобретения соединения, пригодные для использования в настоящем изобретении, могут быть выражены общей формулой (II) где в зависимости от валентности и устойчивости соединенияG означает циклоалкильное, гетероциклильное, арильное или гетероарильное кольцо, конденсированное с кольцом, к которому оно присоединено, предпочтительно арильное или гетероарильное кольцо;R1 означает Н, замещенный или незамещенный алкил, алкенил, алкинил, арил, гетероарил, гетероциклил или циклоалкил, в том числе полициклические группы;R2 представляет 0-4 заместителя в кольце, к которому они присоединены, такие как галоген, низший алкил, низший алкенил, арил, гетероарил, карбонил (например, сложный эфир, карбоксил или формил), тиокарбонил (например, сложный тиоэфир, тиокарбоксилат или тиоформиат), кетон, альдегид,амино, ациламино, амидо, амидино, циано, нитро, азидо, сульфонил, сульфоксидо, сульфат, сульфонат,сульфамоил, сульфонамидо, фосфорил, фосфонат, фосфинат, J-R8, J-OH, J-низший алкил, J-низший алкенил, J-R8, J-SH, J-NH2, защищенные формы вышеуказанных групп, либо два любых заместителя R2, несколько раз встречающихся в циклической или полициклической структуре, могут вместе взятые образовывать 4-8-членный циклоалкил, арил или гетероарил;R3 представляет 0-4 заместителя в кольце, к которому они присоединены, такие как галоген, гидроксил, алкокси, амино, алкиламино, циано, нитро, замещенный или незамещенный низший алкил и ацил,предпочтительно галоген, низший алкокси, замещенный или незамещенный низший алкил;J независимо означает цепь, имеющую 0-8 (предпочтительно 0-4) звеньев, выбираемых из СK2, NK,О и S, где K независимо означает Н или низший алкил. В некоторых вариантах осуществления изобретения по крайней мере один из элементов Z и X не является прямой связью. В других вариантах осуществления изобретения X-Y-Z включает амид, мочевину или сульфонамид. В других вариантах осуществления изобретения X представляет -N(R8)-, -O-, -S-,предпочтительно NH. В некоторых вариантах осуществления изобретения R1 означает арильное или гетероарильное кольцо, необязательно замещенное 1-5 заместителями, такими как нитро, галоген, циано, низший алкил,ациламино (например, R8-C(=O)NH-), алкокси, алкиламино, замещенный или незамещенный циклоалкил,гетероциклил, арил или гетероарил, конденсированный с арильным или гетероарильным кольцом. В некоторых вариантах осуществления изобретения G означает фенильное или пиперидиновое кольцо. В некоторых вариантах осуществления изобретения J отсутствует. В некоторых вариантах осуществления изобретения R2 представляет 1-4 заместителя, выбираемых из группы, включающей галоген, циано, нитро, алкокси, амино, ациламино (например, R8-C(=O)NH-),замещенный или незамещенный циклоалкил, гетероциклил, арил или гетероарил, конденсированный с G,и замещенный или незамещенный низший алкил. В некоторых вариантах осуществления изобретения R3 включает заместитель, такой как замещенный или незамещенный алкил или галоген, в пара-положении относительно X или кольца, содержащего А. В некоторых вариантах осуществления изобретения соединение по данному изобретению выбирают из соединений, показанных на фиг. 32. Как будет подробно описано ниже, при выполнении способов по настоящему изобретению могут быть использованы разнообразные мелкие молекулы, которые можно легко идентифицировать при помощи скрининговых анализов лекарственных средств, рассмотренных в данном описании изобретения. Например, соединения, пригодные для осуществления способов по настоящему изобретению, могут быть выражены общей формулой (III): где в зависимости от валентности и устойчивости соединенияG означает циклоалкильное, гетероциклильное, арильное или гетероарильное кольцо, конденсированное с кольцом, к которому оно присоединено, предпочтительно арильное или гетероарильное кольцо;Q отсутствует или представляет СK2, NK, О и S, где K независимо означает Н или низший алкил;Ar означает замещенное или незамещенное арильное или гетероарильное кольцо, такое как замещенное или незамещенное фенильное кольцо;R1 представляет Н, замещенный или незамещенный алкил, алкенил, алкинил, арил, гетероарил, гетероциклил или циклоалкил, в том числе полициклические группы;R2 представляет 0-4 заместителя в кольце, к которому они присоединены, такие как галоген, низший алкил, низший алкенил, арил, гетероарил, карбонил (например, сложный эфир, карбоксил или формил), тиокарбонил (например, сложный тиоэфир, тиокарбоксилат или тиоформиат), кетон, альдегид,амино, ациламино, амидо, амидино, циано, нитро, азидо, сульфонил, сульфоксидо, сульфат, сульфонат,сульфамоил, сульфонамидо, фосфорил, фосфонат, фосфинат, J-R8, J-OH, J-низший алкил, J-низший алкенил, J-R8, J-SH, J-NH2, защищенные формы вышеуказанных групп, либо два любых заместителя R2, несколько раз встречающихся в циклической или полициклической структуре, могут вместе взятые образовывать 4-8-членный циклоалкил, арил или гетероарил;J независимо означает цепь, имеющую 0-8 (предпочтительно 0-4) звеньев, выбираемых из СK2, NK,О и S. В некоторых вариантах осуществления изобретения по крайней мере один из элементов Z и X не является прямой связью. В других вариантах осуществления изобретения X-Y-Z включает амид, мочевину или сульфонамид. В других вариантах осуществления изобретения X представляет -N(R8)-, -O-, -S-,предпочтительно NH. В некоторых вариантах осуществления изобретения R1 означает арильное или гетероарильное кольцо, необязательно замещенное 1-5 заместителями, такими как нитро, галоген, циано, низший алкил,ациламино (например, R8-C(=O)NH-), алкокси, алкиламино, замещенный или незамещенный циклоалкил,гетероциклил, арил или гетероарил, конденсированный с арильным или гетероарильным кольцом. В некоторых вариантах осуществления изобретения X и кольцо, содержащее А, присоединены к кольцу Ar в мета-положении (то есть в 1,3-положении). В некоторых вариантах осуществления изобретения G означает фенильное или пиперидиновое кольцо. В некоторых вариантах осуществления изобретения J отсутствует. В некоторых вариантах осуществления изобретения R2 представляет 1-4 заместителя, выбираемых из группы, включающей галоген, циано, нитро, алкокси, амино, ациламино (например, R8-C(=O)NH-),замещенный или незамещенный циклоалкил, гетероциклил, арил или гетероарил, конденсированный с G,и замещенный или незамещенный низший алкил. В некоторых вариантах осуществления изобретения соединение по данному изобретению выбирают из соединений, показанных на фиг. 32. В некоторых вариантах осуществления изобретения соединения, пригодные для использования в настоящем изобретении, могут быть выражены общей формулой (IV): где в зависимости от валентности и устойчивости соединенияG означает циклоалкильное, гетероциклильное, арильное или гетероарильное кольцо, конденсированное с кольцом, к которому оно присоединено, предпочтительно арильное или гетероарильное кольцо;Q отсутствует или представляет СK2, NK, О и S, где K независимо означает Н или низший алкил;R1 представляет Н, замещенный или незамещенный алкил, алкенил, алкинил, арил, гетероарил, гетероциклил или циклоалкил, в том числе полициклические группы;R2 представляет 0-4 заместителя в кольце, к которому они присоединены, такие как галоген, низший алкил, низший алкенил, арил, гетероарил, карбонил (например, сложный эфир, карбоксил или формил), тиокарбонил (например, сложный тиоэфир, тиокарбоксилат или тиоформиат), кетон, альдегид,амино, ациламино, амидо, амидино, циано, нитро, азидо, сульфонил, сульфоксидо, сульфат, сульфонат,сульфамоил, сульфонамидо, фосфорил, фосфонат, фосфинат, J-R8, J-ОН, J-низший алкил, J-низший алкенил, J-R8, J-SH, J-NH2, защищенные формы вышеуказанных групп, либо два любых заместителя R2, несколько раз встречающихся в циклической или полициклической структуре, могут вместе взятые образовывать 4-8-членный циклоалкил, арил или гетероарил;R3 представляет 0-4 заместителя в кольце, к которому они присоединены, такие как галоген, гидроксил, алкокси, амино, алкиламино, циано, нитро, замещенный или незамещенный низший алкил и ацил,предпочтительно галоген, низший алкокси, замещенный или незамещенный низший алкил;J независимо означает цепь, имеющую 0-8 (предпочтительно 0-4) звеньев, выбираемых из СK2, NK,О и S. В некоторых вариантах осуществления изобретения по крайней мере один из элементов Z и X не является прямой связью. В других вариантах осуществления изобретения X-Y-Z включает амид, мочевину или сульфонамид. В других вариантах осуществления изобретения X представляет -N(R8)-, -O-, -S-,предпочтительно NH. В некоторых вариантах осуществления изобретения R1 означает арильное или гетероарильное кольцо, необязательно замещенное 1-5 заместителями, такими как нитро, галоген, циано, низший алкил,ациламино (например, R8-C(=O)NH-), алкокси, алкиламино, замещенный или незамещенный циклоалкил,гетероциклил, арил или гетероарил, конденсированный с арильным или гетероарильным кольцом. В некоторых вариантах осуществления изобретения G означает фенильное или пиперидиновое кольцо. В некоторых вариантах осуществления изобретения J отсутствует. В некоторых вариантах осуществления изобретения R2 представляет 1-4 заместителя, выбираемых из группы, включающей галоген, циано, нитро, алкокси, амино, ациламино (например, R8-C(=O)NH-),замещенный или незамещенный циклоалкил, гетероциклил, арил или гетероарил, конденсированный с G,и замещенный или незамещенный низший алкил. В некоторых вариантах осуществления изобретения R3 включает заместитель, такой как замещенный или незамещенный алкил или галоген, в пара-положении относительно X или кольца, содержащего А. В некоторых вариантах осуществления изобретения соединение по данному изобретению выбирают из соединений, показанных на фиг. 32. В некоторых вариантах осуществления изобретения антагонисты по данному изобретению могут быть выбраны с учетом их избирательности в отношении пути передачи сигналов геном hedgehog. Указанная избирательность может представлять избирательность в отношении пути передачи сигналов ге- 17007339 ном hedgehog в отличие от других путей передачи сигналов или избирательность в отношении определенных путей передачи сигналов геном hedgehog, например, ptc-1, ptc-2 и т.д. В некоторых предпочтительных вариантах осуществления изобретения ингибиторы по данному изобретению ингибируют трансдукцию сигналов, опосредуемую утратой функции гена ptc, приобретением функции гена hedgehog или приобретением функции гена smoothened, при ED50, равной 1 мМ или меньше, более предпочтительно 1 мкМ или меньше и еще предпочтительнее 1 нМ или меньше. Аналогичным образом, в некоторых предпочтительных вариантах осуществления изобретения ингибиторы по данному изобретению подавляют активность пути передачи сигналов геном hedgehog при Ki менее 10 нМ, предпочтительно менее 1 нМ и еще предпочтительнее менее 0,1 нМ. В конкретных вариантах осуществления изобретения малую молекулу выбирают с учетом того, что данная молекула является более избирательной в отношении одной изоформы гена patched по сравнению с другой, например, в 10 раз, более предпочтительно по крайней мере в 100 раз или даже в 1000 раз более избирательной в отношении одного пути передачи сигналов геном patched (ptc-1, ptc-2) по сравнению с другим. В некоторых вариантах осуществления изобретения соединение, являющееся антагонистом пути передачи сигналов геном hedgehog, выбирают с учетом избирательного антагонистического воздействия на активность гена hedgehog по сравнению с протеинкиназами, не являющимися РКА, такими как РКС,например, данное соединение модулирует активность пути передачи сигналов геном hedgehog по крайней мере на порядок величины сильнее, чем оно модулирует активность другой протеинкиназы, предпочтительно по крайней мере на два порядка величины сильнее, еще предпочтительнее по крайней мере на три порядка величины сильнее. Таким образом, предпочтительный ингибитор пути передачи сигналов геном hedgehog может подавлять активность гена hedgehog при Ki по крайней мере на один порядок величины меньше по сравнению с его значением Ki для ингибирования РКС, предпочтительно по крайней мере на два порядка величины меньше, еще предпочтительнее по крайней мере на три порядка величины меньше. В некоторых вариантах осуществления изобретения значение Ki для ингибирования РКА равно менее 10 нМ, предпочтительно менее 1 нМ, еще предпочтительнее менее 0,1 нМ.IV. Типичные применения способа и композиций. Другим объектом настоящего изобретения является способ модуляции дифференцированного состояния, выживания и/или пролиферации клеток с утраченной функцией гена ptc, приобретенной функцией гена hedghog или приобретенной функцией гена smoothened, который заключается в том, что указанные клетки вводят в соприкосновение с антагонистом гена hedgehog в соответствии со способом по данному изобретению и с учетом окружающих условий. Например, в свете открытий, указывающих на широкое участие генов hedgehog, ptc и smoothened в формировании упорядоченного пространственного расположения дифференцированных тканей у позвоночных, способ по настоящему изобретению можно использовать в виде составной части процесса образования и/или сохранения совокупности разных тканей позвоночного как in vitro, так и in vivo. Антагонистом гена hedgehog, индуцирующим или подавляющим пролиферацию или дифференцировку данной ткани, может быть любой из вышеописанных препаратов. Способ по настоящему изобретению, например, можно использовать для культивирования клеток в генетических или биохимических целях, в частности клеток, имеющих фенотип с утраченной функцией гена ptc, приобретенной функцией гена hedgehog или приобретенной функцией гена smoothened. Установлено, что системы культивирования нервных клеток in vitro представляют главное и совершенно необходимое средство для изучения развития нервной ткани, а также для идентификации нейротрофических факторов, таких как фактор роста нервной ткани (NGF), мерцательные трофические факторы(CNTF) и нейротрофический фактор головного мозга (BDNF). Одно применение способа по настоящему изобретению может быть связано с культивированием нервных стволовых клеток, например, с использованием таких культур для образования новых нейронов и глии. В таких вариантах осуществления способа по настоящему изобретению культивируемые клетки могут быть введены в соприкосновение с антагонистом гена hedgehog по настоящему изобретению для изменения скорости пролиферации нервных стволовых клеток в культуре и/или для изменения скорости дифференцировки или для сохранения целостности культуры некоторых дифференцированных нервных клеток. В типичном варианте осуществления изобретения способ по данному изобретению можно использовать, например, для культивирования чувствительных нейронов или альтернативно двигательных нейронов. Такие культуры нервных клеток можно использовать в качестве удобных систем для выполнения анализов, а также в качестве источников имплантируемых клеток для терапевтических целей. В соответствии с настоящим изобретением большие количества неонкогенных нервных клетокпредшественников можно сохранять in vitro и влиять на их скорость пролиферации и/или дифференцировки, вводя указанные клетки в соприкосновение с антагонистами гена hedgehog по настоящему изобретению. Для указанной цели обычно используют способ, включающий стадии выделения нервных клеток-предшественников у животного, сохранения таких клеток in vitro или in vivo, предпочтительно в присутствии факторов роста, и регуляции дифференцировки указанных клеток с образованием конкрет- 18007339 ных фенотипов нервных клеток, например, нейронов и глии, в результате введения клеток в соприкосновение с антагонистом гена hedgehog. Считается, что клетки-предшественники находятся под тонизирующим ингибирующим воздействием, которое позволяет сохранить клетки-предшественники в угнетенном состоянии, пока не потребуется индуцировать их дифференцировку. Однако недавно были разработаны способы, делающие возможной пролиферацию указанных клеток, и в отличие от нейронов, которые подвергаются терминальной дифференцировке и поэтому больше не делятся, такие клетки могут быть продуцированы в неограниченном количестве, благодаря чему они пригодны для трансплантации в гетерологичных и аутологичных хозяев,страдающих нейродегенеративными заболеваниями. Термин "предшественник" означает олигопотентную или полипотентную стволовую клетку, которая способна неограниченно делиться и в определенных условиях может продуцировать дочерние клетки, терминально дифференцирующиеся с образованием нейронов и глии. Указанные клетки можно использовать для трансплантации в гетерологичного или аутологичного хозяина. Термин "гетерологичный" служит для определения хозяина, который не является животным, у которого были первоначально получены клетки-предшественники. Термин "аутологичный" служит для определения идентичного хозяина, у которого были первоначально получены клетки-предшественники. Клетки могут быть получены из эмбриональной, послеродовой, ювенильной или взрослой нервной ткани любого животного. Термин "животное" означает любое многоклеточное животное, имеющее нервную ткань. В частности, таким животным могут быть рыбы, рептилии, птицы, амфибии или млекопитающие и тому подобные. Наиболее предпочтительными донорами являются млекопитающие, в частности, мыши и люди. В случае гетерологичного животного-донора такое животное может быть безболезненно умерщвлено, после чего в стерильных условиях удаляют головной мозг и представляющий интерес участок мозга. Можно использовать любой участок головного мозга, из которого можно получить клетки-предшественники, предназначенные для восстановления функции разрушенного участка головного мозга хозяина. Указанные области включают такие участки центральной нервной системы (ЦНС), как кора головного мозга, мозжечок, средний мозг, ствол мозга, спинной мозг и желудочковую ткань, а также такие участки периферической нервной системы (ПНС), как каротидное тельце и мозговое вещество надпочечника. В частности, указанные участки включают области в базальном ядре головного мозга, предпочтительно полосатое тело, которое состоит из хвостатого ядра и подушки, или разные группы клеток, такие как кора большого мозга, субталамическое ядро, базальное ядро, которое, как известно, разрушается у субъектов, страдающих болезнью Альцгеймера, или черное вещество головного мозга, которое, как известно, разрушается у субъектов, страдающих болезнью Паркинсона. Гетерологичные нервные клетки-предшественники человека могут быть выделены из зародышевой ткани, полученной в случае рекомендуемого аборта или из послеродового, ювенильного или взрослого донорского органа. Аутологичную нервную ткань можно получить путем биопсии или у субъектов, подвергаемых нейрохирургическому вмешательству, в процессе которого удаляют нервную ткань, в частности во время хирургической операции по поводу эпилепсии, а также височной лобэктомии и гиппокампоэктомии. Клетки могут быть получены из донорской ткани путем отделения отдельных клеток от соединительного внеклеточного матрикса ткани. Указанное отделение может быть произведено любым известным способом, включая обработку ферментами, такими как трипсин, коллагеназа и тому подобные, или при помощи физических методов отделения, например, соскабливания тупым инструментом или срезания скальпелем, благодаря чему становится возможным разрастание конкретных типов клеток из ткани. Зародышевые клетки можно отделять в среде тканевой культуры, причем предпочтительной средой для отделения ювенильных и взрослых клеток является искусственная цереброспинальная жидкость (aCSF). Обычная aCSF содержит 124 мМ NaCl, 5 мМ KСl, 1,3 мМ MgCl2, 2 мМ СаСl2, 26 мМ NaHCO3 и 10 мМ D-глюкозы. Цебероспинальная жидкость с низким содержанием Са 2+ включает те же ингредиенты за исключением того, что MgCl2 находится в концентрации 3,2 мМ и СаСl2 находится в концентрации 0,1 мМ. Отделенные клетки можно поместить в любую известную культуральную среду, способную поддерживать рост клеток, такую как MEM, DMEM, RPMI, F-12 и тому подобные, содержащую дополнительные вещества, необходимые для клеточного метаболизма, такие как глутамин и другие аминокислоты, витамины, минералы и полезные белки, такие как трансферрин и тому подобные. Среда может также содержать антибиотики, препятствующие загрязнению дрожжами, бактериями и грибами, такие как пенициллин, стрептомицин, гентамицин и тому подобные. В некоторых случаях среда может содержать сыворотку, полученную у крупного рогатого скота, лошадей, кур и подобных животных. Особенно предпочтительной средой для клеток является смесь DMEM и F-12. Условия культивирования должны быть близки к физиологическим условиям. Показатель рН культуральной среды должен быть близок к физиологическому показателю рН и предпочтительно должен быть равен рН 6-8, более предпочтительно около рН 7, еще предпочтительнее около рН 7,4. Клетки необходимо культивировать при температуре, близкой к физиологической температуре, предпочтительно в- 19007339 интервале 30-40 С, более предпочтительно в интервале 32-38 С и наиболее предпочтительно в интервале 35-37 С. Клетки можно выращивать в суспензии или на фиксированном субстрате, но пролиферацию клеток-предшественников предпочтительно выполняют в суспензии для получения большого количества клеток в результате образования "нейросфер" (см., например, Reynolds et al. (1992) Science 255:10701709; и публикации РСТ WO 93/01275, WO 94/09119, WO 94/10292 и WO 94/16718). В случае размножения (или разделения) клеток в суспензии колбы хорошо встряхивают и нейросферы осаждаются в нижнем углу колбы. Затем сферы переносят в 50 мл центрифужную пробирку и центрифугируют с медленной скоростью. Среду отсасывают и клетки вновь суспендируют в небольшом количестве среды с фактором роста, после чего клетки механически отделяют и вновь суспендируют в отдельных аликвотах сред. К суспензиям клеток в культуральной среде добавляют любой фактор роста, который способствует пролиферации клеток-предшественников, и засевают в любую емкость, способную сохранять клетки,хотя, как указывалось выше, предпочтительно в колбы для культур или вращающиеся флаконы. Клетки обычно пролиферируют в течение 3-4 дней в инкубаторе с 37 С, причем пролиферацию можно возобновить в любое время, для чего клетки отделяют и вновь суспендируют в свежей среде, содержащей факторы роста. При отсутствии субстрата клетки поднимаются с основания колбы и продолжают пролиферировать в суспензии, образуя полую сферу недифференцированных клеток. Примерно через 3-10 дней культивирования in vitro пролиферирующие кластеры (нейросферы) начинают подпитывать каждые 2-7 дней, более предпочтительно каждые 2-4 дня путем осторожного центрифугирования и повторного суспендирования в среде, содержащей фактор роста. Через 6-7 дней культивирования in vitro отдельные клетки в нейросферах могут быть отделены при помощи физического разрушения нейросфер тупым инструментом, более предпочтительно путем растирания нейросфер пипеткой. Отдельные клетки, полученные из разрушенных нейросфер, суспендируют в культуральной среде, содержащей факторы роста, причем дифференцировку клеток можно контролировать в культуре, выращивая (или вновь суспендируя) клетки в присутствии антагониста гена hedgehog. Для дальнейшей иллюстрации других применений антагонистов гена hedgehog по данному изобретению следует отметить, что дополнительным методом лечения центральной нервной системы является интрацеребральная трансплантация. Например, для восстановления поврежденных тканей головного мозга можно трансплантировать клетки, полученные у внутриутробных или новорожденных животных,в головной мозг взрослого субъекта (Dunnett et al. (1987) J. Exp. Biol. 123:265-289; and Freud et al. (1985)J. Neurosci. 5:603-616). Зародышевые нейроны из разных областей головного мозга можно успешно вводить в головной мозг взрослого субъекта, благодаря чему такие трансплантаты могут устранять поведенческие дефекты. Например, нарушение движений, вызванное поражением допаминэргических выростов в направлении базального ядра головного мозга, можно предотвратить, трансплантируя эмбриональные допаминэргические нейроны. Сложные познавательные функции, которые ухудшаются после поражения неокортекса, можно также части восстановить, трансплантируя эмбриональные клетки коры головного мозга. Способ по настоящему изобретению можно применять для регуляции роста клеток в культуре,либо при использовании зародышевой ткани, особенно нервных стволовых клеток, указанный способ можно применять для регуляции скорости дифференцировки стволовых клеток. Стволовые клетки, используемые в настоящем изобретении, хорошо известны. Например, обнаружено несколько типов клеток нервного гребня, из которых одни являются полипотентными и, повидимому, представляют некоммитированные клетки нервного гребня, и другие могут образовывать только один тип клетки, например, чувствительные нейроны, и, по-видимому, представляют коммитированные клетки-предшественники. Антагонисты гена hedgehog, используемые в способе по настоящему изобретению для культивирования таких стволовых клеток, могут служить для регуляции дифференцировки некоммитированной клетки-предшественника или ограничения дальнейшего развития коммутированной клетки-предшественника, в результате чего образуется терминально дифференцированная нервная клетка. Например, способ по настоящему изобретению можно использовать in vitro для регуляции дифференцировки клеток нервного гребня с образованием глиальных клеток, клеток Шванна, хромаффинных клеток, холинэргических симпатических или парасимпатических нейронов, а также пептидэргических и серотонэргических нейронов. Антагонисты гена hedgehog можно использовать отдельно или в комбинации с другими нейротрофическими факторами, которые способны еще более усиливать конкретную дифференцировку нервных клеток-предшественников. Помимо имплантации клеток, культивируемых в присутствии антагонистов гена hedgehog по настоящему изобретению, другим объектом настоящего изобретения является терапевтическое применение антагониста гена hedgehog для регуляции роста нейронов и других нервных клеток как в центральной нервной системе, так и в периферической нервной системе. Способность генов ptc, hedgehog иsmoothened регулировать дифференцировку нейронов в процессе развития нервной системы и предположительно во взрослом состоянии свидетельствует о том, что в некоторых случаях антагонисты генаhedgehog по данному изобретению могут облегчать осуществляемые нейронами взрослого субъекта процессы поддержания функциональной активности и замедления старения нормальных клеток; восстанав- 20007339 ливать и регенерировать химически или механически поврежденные клетки и лечить дегенеративные процессы в случае некоторых патологических заболеваний. В свете вышеизложенного настоящее изобретение предполагает возможность применения способа по данному изобретению для лечения (профилактики и/или ослабления тяжести) неврологических заболеваний, возникающих вследствие (i) острого,подострого или хронического поражения нервной системы, включая травматическое повреждение, химическое повреждение, сосудистое повреждение и нарушения (такие как ишемия вследствие инсульта),наряду с инфекционным/воспалительным поражением и поражением, вызванным опухолью; (ii) старения нервной системы, включая болезнь Альцгеймера; (iii) хронических нейродегенеративных заболеваний нервной системы, включающих болезнь Паркинсона, хорею Гантингтона, боковой амиотрофический склероз и тому подобные, а также дегенерацию спинного мозга; и (iv) хронических иммунологических заболеваний нервной системы или заболеваний, поражающих нервную систему, включая рассеянный склероз. Способ по настоящему изобретению можно также применять при создании нервных протезов для восстановления пораженной нервной ткани в центральной и периферической нервной системе. В частности, при интубировании разрушенного или поврежденного аксона с помощью протезирующего устройства антагонисты гена hedgehog можно вводить в протезирующее устройство для регуляции скорости роста и восстановления дендритных процессов. Типичные коммуникационные каналы нервной ткани описаны в патентах США 5092871 и 4955892. В другом варианте осуществления изобретения способ по данному изобретению можно применять для лечения неопластической и гиперпластической трансформации, которые могут возникнуть в центральной нервной системе. Например, антагонисты гена hedgehog можно использовать для того, чтобы такие трансформированные клетки стали постмитотическими или апоптозными. Поэтому способ по данному изобретению можно применять в качестве составной части схемы лечения таких заболеваний, как,например, злокачественной глиомы, менингиомы, медуллобластомы, нейроэктодермальной опухоли и эпендимомы. В предпочтительном варианте осуществления изобретения способ по данному изобретению можно применять в качестве составной части схемы лечения злокачественной медуллобластомы и других первичных злокачественных нейроэктодермальных опухолей ЦНС. В некоторых вариантах осуществления изобретения способ по данному изобретению можно применять в качестве составной части схемы лечения медуллобластомы. Медуллобластома, первичная опухоль головного мозга, является наиболее распространенной опухолью головного мозга у детей. Медуллобластома представляет неразвитую нейроэктодермальную опухоль, возникающую в задней черепной ямке. Указанные опухоли составляют примерно 25% всех опухолей головного мозга у детей (Miller). В гистологическом отношении указанные опухоли состоят из мелких круглых клеток, расположенных в виде настоящих розеток, но могут характеризоваться некоторой дифференцировкой с образованием астроцитов, эпендимных клеток или нейронов (Rorke; Kleihues). PNET может возникать в других областях головного мозга, включая шишковидное тело (пинеобластома) и сам головной мозг. Опухоли, образующиеся в области над мозжечковым наметом, обычно хуже опухолей, возникающих в задней черепной ямке. Известно, что медуллобластомы/PNET образуются в центральной нервной системе после резекции и могут давать метастазы в кости. Поэтому обследование, проводимое до начала лечения, должно включать исследование спинного мозга, чтобы исключить вероятность "падающих метастазов". Усиливаемая гадолинием MRI в значительной степени заменила миелографию, используемую для этой цели, и цитологию CSF производят после операции в виде обычной процедуры. В других вариантах осуществления изобретения способ по данному изобретению можно применять в качестве составной части схемы лечения эпендимом. Эпендимомы составляют примерно 10% опухолей головного мозга у детей. Указанные опухоли образуются из эпендимной выстилки желудочков и создают микроскопические розетки, протоки и периваскулярные розетки. В серии исследований по программеCHOP 51 ребенка, имеющего эпендимому, было установлено, чтоуказанных опухолей являются гистологически доброкачественными. Примерно 2/3 опухолей возникают в области 4-го желудочка. Третья часть опухолей возникает в области, расположенной над мозжечковым наметом. Наиболее часто указанное заболевание возникает у детей в период времени после рождения и до 4 лет, о чем свидетельствуют данные SEER, а также данные CHOP. Средний возраст заболевших составляет около 5 лет. Так как многие дети, страдающие указанным заболеванием, являются новорожденными, они часто нуждаются в комплексном лечении. Другой объект настоящего изобретения имеет непосредственное отношение к наблюдению, сделанному в данной области, что помимо вышеописанной дифференцировки нейронов гены ptc, hedgehog и/или smoothened участвуют в передаче морфогенных сигналов по другим органогенным путям позвоночных, которые играют важную роль в других процессах формирования эндодермы, в также процессах дифференцировки мезодермы и эндодермы. Таким образом, в соответствии с данным изобретением композиции, содержащие антагонисты гена hedgehog, можно также использовать как для культивирования- 21007339 клеток, так и в способах лечения, в которых задействовано образование и поддержание ткани, не являющейся нервной тканью. В основе одного варианта осуществления изобретения лежит открытие того, что гены ptc, hedgehog и smoothened, по-видимому, участвуют в регуляции развития стволовых клеток, ответственных за формирование желудочно-кишечного тракта, печени, легких и других органов, образующихся из первичной кишки. Ген Shh действует в качестве индуктивного сигнала, передаваемого от эндодермы к мезодерме,который имеет критическое значение для морфогенеза первичной кишки. Поэтому антагонисты генаhedgehog, используемые в способе по настоящему изобретению, могут служить для регуляции развития и поддержания искусственной печени, которая может выполнять несколько метаболических функций нормальной печени. В типичном варианте осуществления изобретения способ по данному изобретению можно применять для регуляции пролиферации и дифференцировки стволовых клеток пищеварительного тракта, образующих культуры гепатоцитов, которые можно использовать для заселения внеклеточного матрикса или которые могут быть инкапсулированы в биосовместимые полимеры с образованием имплантируемой и экстракорпоральной искусственной печени. В другом варианте осуществления изобретения терапевтические композиции, содержащие антагонисты гена hedgehog, можно использовать вместе с трансплантацией такой искусственной печени, а также эмбриональных структур печени для регуляции интраперитонеального приживления трансплантированного органа, васкуляризации, а также дифференцировки и поддержания трансплантированной ткани печени in vivo. В другом варианте осуществления изобретения способ по данному изобретению можно применять в лечебных целях для регуляции таких органов после физического, химического или патологического поражения. Например, терапевтические композиции, содержащие антагонисты гена hedgehog, можно использовать для восстановления печени после частичной гепатоктомии. Образование поджелудочной железы и тонкого кишечника из зародышевой кишки зависит от межклеточной передачи сигналов от эндодермальных к мезодермальным клеткам кишечника. В частности,предполагается, что дифференцировка кишечной мезодермы с образованием гладких мышц зависит от сигналов, поступающих от смежных эндодермальных клеток. Одним вероятным медиатором сигналов,поступающих из эндодермальных клеток в задней кишке эмбриона, является ген Sonic hedgehog. См.,например, Apelqvist et al. (1997) Curr Biol 7:801-4. Ген Shh экспрессирован в эндодерме зародышевой кишки за исключением эндодермы зачатка поджелудочной железы, в котором экспрессированы высокие уровни гомеодоменного белка Ipf1/Pdx1 (инсулинстимулирующий фактор 1/гомеобокс 1 поджелудочной железы и двенадцатиперстной кишки), главного регулятора развития поджелудочной железы на ранней стадии. Apelqvist et al., см. выше исследовали, действительно ли дифференциальная экспрессия гена Shh в кишечной трубке эмбриона регулирует дифференцировку окружающей мезодермы с образованием специализированных производных мезодермы тонкого кишечника и поджелудочной железы. При проведении данного исследования вышеуказанные ученые использовали стимулятор гена Ipf1/Pdxl для избирательной экспрессии Shh в эпителии развивающейся поджелудочной железы. У трансгенных мышей сIpf1/Pdx1-Shh из мезодермы поджелудочной железы развивались гладкие мышцы и интерстициальные клетки Кахаля, характерные для тонкого кишечника, а не мезенхима поджелудочной железы и селезенки. Кроме того, эксплантаты поджелудочной железы, подвергаемые воздействию Shh, выполняли аналогичную программу кишечной дифференцировки. Полученные результаты свидетельствуют о том, что дифференциальная экспрессия выделенного из эндодермы Shh контролирует дальнейшее развитие смежной мезодермы в разных областях кишечной трубки. В контексте настоящего изобретения можно сделать вывод о том, что антагонисты гена hedgehog по данному изобретению можно использовать для контроля или регуляции пролиферации и/или дифференцировки ткани поджелудочной железы как in vivo, так и in vitro. Существует целый ряд патологических состояний пролиферации и дифференцировки клеток, для восстановления которых можно эффективно использовать ингибиторы по настоящему изобретению, при этом общим направлением воздействия может быть, например, коррекция аберрантной экспрессии инсулина или модуляция дифференцировки. Более конкретно настоящее изобретение относится к способу индуцирования и/или поддержания дифференцированного состояния, повышения выживаемости клеток и/или воздействия на пролиферацию клеток поджелудочной железы в результате введения указанных клеток в соприкосновение с ингибиторами по данному изобретению. Например, с учетом явного участия генов ptc, hedgehog и smoothened в формировании упорядоченного пространственного расположения тканей поджелудочной железы способ по данному изобретению можно использовать в качестве составной части методики образования и/или поддержания такой ткани как in vitro, так и in vivo. Модуляцию функции гена hedgehog можно использовать как в культурах клеток, так и в качестве метода лечения,включающих образование и поддержание -клеток и, возможно, ткани, не являющейся тканью поджелудочной железы, например, при регуляции развития и поддержания ткани пищеварительного тракта, селезенки, легких, мочеполовых органов (например, мочевого пузыря) и других органов, образующихся из первичной кишки.- 22007339 В типичном варианте осуществления изобретения способ по настоящему изобретению можно применять для лечения гиперпластических или неопластических нарушений, которые поражают ткань поджелудочной железы, в частности, заболеваний, отличающихся аберрантной пролиферацией клеток поджелудочной железы. Например, разные типы рака поджелудочной железы характеризуются аномальной пролиферацией клеток поджелудочной железы, в результате чего происходит изменение секреции инсулина в поджелудочной железе. Некоторые гиперплазии поджелудочной железы, такие как карциномы,могут вызывать гипоинсулинемию вследствие дисфункции -клеток или уменьшения массы островковых клеток. Если свидетельством развития болезни является аберрантная передача сигналов генами ptc,hedgehog и smoothened, ингибиторы по данному изобретению могут быть использованы для усиления регенерации ткани после противоопухолевой терапии. Кроме того, изменение характеристик передачи сигналов геном hedgehog в разных частях организма может быть использовано в качестве составной части схемы лечения, направленного на изменение/восстановление ткани поджелудочной железы как in vivo, так и in vitro. В одном варианте осуществления изобретения использованы данные, свидетельствующие о явном участии генов ptc, hedgehog иsmoothened в регуляции развития ткани поджелудочной железы. Способ по данному изобретению может быть применен в лечебных целях для регуляции поджелудочной железы после физического, химического или патологического поражения. В другом варианте осуществления изобретения способ по данному изобретению может быть использован для культивирования клеток, в частности, указанный способ может служить для усиления первоначального образования ткани поджелудочной железы в устройствах для выращивания трансплантатов. Изменение пролиферации и дифференцировки ткани поджелудочной железы, например, в результате изменения активности гена hedgehog, может быть средством более тщательного контроля характеристик выращенной ткани. В типичном варианте осуществления изобретения способ по данному изобретению можно использовать для увеличения производительности устройств по выращиванию трансплантатов, которые требуют -инсулоцитов, аналогичных используемым в инкапсулирующих устройствах, описанных, например, в патентах США 4892538 и 5106627, выданныхSefton. Ранние клетки-предшественники, служащие для образования островковых клеток поджелудочной железы, являются полипотентными и, очевидно, коактивируют все специфические гены островковых клеток сразу же после своего появления. По мере развития экспрессия специфических гормонов островковых клеток, таких как инсулин, ограничивается паттерном экспрессии, характерным для зрелых островковых клеток. Однако фенотип зрелых островковых клеток является неустойчивым в культуре, так как в зрелых -клетках может наблюдаться появление эмбриональных признаков. Используя антагонисты гена hedgehog по данному изобретению, можно регулировать путь дифференцировки или индекс пролиферации клеток. Кроме того, изменение дифференцировки ткани поджелудочной железы можно использовать вместе с трансплантацией искусственной поджелудочной железы - с целью стимуляции имплантации, васкуляризации, а также дифференцировки и поддержания прижившейся ткани in vivo. Например, изменение функции гена hedgehog, влияющей на дифференцировку ткани, можно использовать в качестве средства поддержания жизнеспособности трансплантата.Bellusci et al. (1997) Development 124:53 установили, что ген Sonic hedgehog регулирует пролиферацию мезенхимных клеток легкого in vivo. Поэтому способ по данному изобретению можно применять для регуляции регенерации ткани легкого, например, при лечении эмфиземы и респираторного дистресссиндрома.Fujita et al. (1997) Biochem. Biophys. Res. Commun. 238:658 установили, что ген Sonic hedgehog экспрессирован в клетках плоскоклеточного рака легкого и аденокарциномы человека. Экспрессия генаSonic hedgehog обнаружена также в тканях плоскоклеточного рака легкого человека, но отсутствует в нормальной ткани легкого у того же субъекта. Вышеуказанные исследователи также обнаружили, что ген Sonic hedgehog стимулирует внедрение BrdU в клетки карциномы и рост клеток, в то время как антагонист Shh-N подавляет рост клеток. Полученные результаты позволяют предположить, что гены ptc,hedgehog и/или smoothened принимают участие в росте клеток такой трансформированной ткани легкого,из чего следует, что способ по настоящему изобретению можно использовать в качестве составной части лечения рака легкого, аденокарциномы и других пролиферативных заболеваний, поражающий эпителий легкого. С учетом данных, свидетельствующих об участии пути передачи сигналов геном hedgehog в возникновении указанных опухолей, или на основании обнаруженной экспрессии гена hedgehog или его рецептора в указанных тканях в процессе развития соединения по данному изобретению можно использовать для лечения многих других опухолей. Такие опухоли включают, не ограничиваясь ими, опухоли,связанные с синдромом Горлина (например, базально-клеточный рак, медуллобластома, менингиома и т.д.), опухоли, возникающие у мышей с отсутствием гена ptc (например, гемангиома, рабдомиосаркома и т.д.), опухоли, возникающие в результате амплификации gli-1 (например, глиобластома, саркома и т.д.),опухоли, обусловленные TRC8, гомологом гена ptc (например, рак почек, рак щитовидной железы и т.д.),- 23007339 опухоли, обусловленные Ext-1 (например, рак кости и т.д.), Shh-индуцируемые опухоли (например, рак легкого, хондросаркома и т.д.) и другие опухоли (например, рак молочной железы, рак мочеполовых органов (например, почек, мочевого пузыря, мочеточника, предстательной железы и т.д.), рак надпочечника, рак желудочно-кишечного тракта (например, желудка, тонкого кишечника и т.д. и т.д.). В другом варианте осуществления настоящего изобретения композиции, содержащие антагонисты гена hedgehog, можно использовать для формирования in vitro скелетной ткани из скелетогенных стволовых клеток, а также для лечения in vivo недостаточности скелетной ткани. Настоящее изобретение в частности относится к использованию антагонистов гена hedgehog для регуляции скорости хондрогенеза и/или остеогенеза. Термин "недостаточность скелетной ткани" означает недостаточность костной или другой соединительной ткани скелета в любом месте тела, где необходимо восстановить костную или соединительную ткань независимо от причины возникновения недостаточности, например, в результате хирургического вмешательства, удаления опухоли, образования язвы, введения имплантата, перелома или других травматических или дегенеративных нарушений. Например, способ по настоящему изобретению можно использовать в качестве составной части схемы восстановления функции хряща в соединительной ткани. Такие способы пригодны, например, для устранения дефектов или поражений хрящевой ткани, возникающих в результате дегенеративного разрушения вследствие артрита, а также других механических повреждений, вызванных травмированием ткани, таким как смещение ткани порванного мениска, менискэктомия, ослабление сустава из-за порванной связки, злокачественные новообразования в суставах, перелом кости или наследственное заболевание. Способ восстановления по настоящему изобретению можно также использовать для моделирования матрикса хряща при проведении восстановительных или пластических, а также периодонтальных хирургических операций. Способ по настоящему изобретению можно также использовать для улучшения результатов ранее проведенного восстановительного лечения, например, после хирургического восстановления мениска, связки или хряща. Кроме того, при применении указанного способа сразу же после травмы можно предотвратить возникновение или обострение дегенеративного заболевания. В одном варианте осуществления настоящего изобретения способ по данному изобретению относится к лечению пораженной соединительной ткани терапевтически эффективным количеством антагониста гена hedgehog, в частности, антагониста, избирательно воздействующего на трансдукцию сигнала геном Indian hedgehog, для регуляции восстановления хряща в соединительной ткани путем регуляции скорости дифференцировки и/или пролиферации хондроцитов, находящихся в указанной ткани. Такие соединительные ткани, как суставной хрящ, межсуставной хрящ (мениск), реберный хрящ (соединяющий истинные ребра и грудину), связки и сухожилия, особенно хорошо поддаются лечению методами восстановительной и/или регенеративной терапии с использованием способа по данному изобретению. В используемом здесь значении термин "регенеративная терапия" означает лечение дегенеративных заболеваний, в результате развития которых повреждение ткани не становится очевидным, а также профилактическое лечение ткани, дегенерация которой находится на ранней стадии или только представляет опасность. В иллюстративном варианте осуществления изобретения способ по данному изобретению можно использовать в качестве составной части терапевтического воздействия при лечении хряща в суставе,таком как коленный сустав, голеностопный сустав, локтевой сустав, тазобедренный сустав, запястный сустав, сустав пальца руки или стопы или нижнечелюстное соединение. Лечению может подвергаться мениск сустава, суставной хрящ сустава или оба вместе. Кроме того, способ по данному изобретению можно использовать для лечения дегенеративных заболеваний коленного сустава, возникающих в результате травмы (например, спортивной травмы или чрезмерной нагрузки), или остеоартрита. Антагонисты по данному изобретению можно вводить в виде инъекции в сустав при помощи артроскопической иглы. В некоторых случаях инъецируемое средство может представлять гидрогель или другой носитель с замедленным высвобождением для обеспечения более продолжительного и постоянного контактирования лекарственного средства с подвергаемой лечению тканью. Настоящее изобретение далее относится к применению способа по данному изобретению в области трансплантации хряща и протезирующей терапии. Проблемы, возникающие в данной области, связаны с тем, что хрящи и волокнистая хрящевая ткань имеют разные характеристики в разных тканях, таких как суставной хрящ, мениск, связки и сухожилия, между двумя концами одной связки или сухожилия и между поверхностными и внутренними частями ткани. Зональное расположение указанных тканей может отражать постепенное изменение механических свойств, при этом имплантированная ткань, которая должным образом не дифференцирована и не способна правильно реагировать на возникающие условия,может разрушаться. Например, при использовании хряща мениска для восстановления передних крестообразных связок ткань подвергается метаплазии с образованием чисто фиброзной ткани. Благодаря регуляции скорости хондрогенеза способ по данному изобретению можно использовать для решения вышеуказанной проблемы, так как с его помощью можно адаптивно контролировать имплантированные клетки в новом окружении и эффективно имитировать гипертрофические хондроциты, характерные для ранней стадии развития ткани.- 24007339 Аналогичным образом способ по данному изобретению можно применять для более интенсивного формирования искусственного хряща и для его имплантации. Необходимость более эффективного лечения стала стимулом для выполнения исследования, направленного на создание нового хряща на основе коллаген-гликозамино-гликановых матриц (Stone et al. (1990) Clin. Orthop. Relat. Red. 252:129), выделенных хондроцитов (Grande et al. (1989) J. Orthop. Res. 7:208; и Takigawa et al. (1987) Bone Miner. 2:449) и хондроцитов, присоединенных к природным или синтетическим полимерам (Walitani et al. (1989) J. BoneVacanti et al.). Например, хондроциты можно выращивать в культуре на биоразрушаемых, биосовместимых сильно пористых пластинах, образуемых из полимеров, таких как полигликолевая кислота, полимолочная кислота, агарозный гель или другие полимеры, которые разрушаются с течением времени в результате гидролиза главной цепи полимера с образованием безвредных мономеров. Создаваемые матрицы обеспечивают соответствующий обмен питательных веществ и газообмен с клетками, пока не произойдет приживление трансплантата. Клетки можно культивировать in vitro до достижения соответствующего объема и плотности клеток, предназначенных для имплантации. Одним преимуществом указанных матриц является то, что их можно отливать или формовать с приданием соответствующей индивидуальной формы, в результате чего конечный продукт близко напоминает, например, собственное ухо или нос субъекта, или можно использовать гибкие матрицы, которыми можно манипулировать во время имплантации подобно суставу. В одном варианте осуществления способа по данному изобретению имплантаты вводят в соприкосновение с антагонистом гена hedgehog на определенных стадиях культивирования для регуляции скорости дифференцировки хондроцитов и формирования гипертрофических хондроцитов в культуре. В другом варианте осуществления изобретения имплантированное устройство обрабатывают антагонистом гена hedgehog, чтобы смоделировать имплантированную матрицу и сделать ее более пригодной для выполнения предполагаемой функции. Как указано выше в отношении тканевого трансплантата, искусственные трансплантаты имеют такой же недостаток, выражающийся в отсутствии соответствия действительному механическому окружению, в которое имплантирована данная матрица. Возможность регулировать хондроциты в матрице при помощи способа по данному изобретению позволяет придать имплантату характеристики, присущие ткани, которую должен заменить данный имплантат. В другом варианте осуществления изобретения способ по данному изобретению используют для лучшего прикрепления протезов. В качестве примера, способ по данному изобретению можно использовать при имплантации периодонтального протеза, когда обработка окружающей соединительной ткани стимулирует образование периодонтальной связки вокруг протеза. В других вариантах осуществления изобретения способ по данному изобретению можно применять в качестве составной части схемы лечения при восстановлении кости (остеогенез) в области у животного,в которой отсутствует такая скелетная ткань. Ген Indian hedgehog имеет непосредственное отношение к гипертрофических хондроцитам, которые в конечном счете заменяются остеобластами. Например, антагонист гена hedgehog по настоящему изобретению можно вводить для регуляции скорости разрежения кости у субъекта. Например, препараты, содержащие антагонисты гена hedgehog, можно использовать для контроля эндохондрального окостенения при формировании "модели" для окостенения. В другом варианте осуществления изобретения антагонист гена hedgehog можно использовать для регуляции сперматогенеза. Установлено, что белки гена hedgehog, в частности Dhh, участвуют в дифференцировке и/или пролиферации и поддержании клеток семенных половых клеток. Ген Dhh экспрессируется в предшественниках клеток Сертоли вскоре после активации гена Sry (ген, определяющий функцию яичка) и сохраняется в яичке взрослого субъекта. Субъекты мужского пола остаются жизнеспособными, но становятся бесплодными из-за отсутствия зрелой спермы. Исследование развивающегося яичка в разных генетических средах позволяет предположить, что ген Dhh регулирует как раннюю, так и позднюю стадии сперматогенеза. Bitgood et al. (1996) Curr. Biol. 6:298. В предпочтительном варианте осуществления изобретения антагонист гена hedgehog можно использовать в качестве противозачаточного средства. Аналогичным образом антагонисты гена hedgehog по данному изобретению, можно эффективно использовать для модуляции нормальной функции яичника. Способ по данному изобретению можно широко применять при лечении или профилактике заболеваний, поражающих эпителиальную ткань, а также в косметических целях. Как правило, указанный способ может включать стадию введения животному антагониста гена hedgehog в количестве, достаточном для изменения скорости роста эпителиальной ткани. Способ введения и схемы приема лекарственного средства могут быть различными в зависимости от подвергаемой лечению эпителиальной ткани. Например, предпочтительны местные препараты, если подвергаемой лечению тканью является эпидермальная ткань, такая как дермальная или слизистая ткани. Способ, "стимулирующий заживление раны", обеспечивает более быстрое заживление раны, как результат лечения, чем заживление аналогичной раны при отсутствии лечения. Термин "стимуляция заживления раны" означает также, что данный способ позволяет регулировать пролиферацию и/или рост,помимо прочего, кератиноцитов или что рана заживляется при меньшем образовании рубцов, (меньшей- 25007339 контрактуре раны) меньшем отложении коллагена и лучшем внешнем виде поверхности. В некоторых случаях термин "стимуляция заживления раны" может также означать, что некоторые способы заживления ран обладают более высокой эффективностью (например, более высокими скоростями приживления кожных трансплантатов) при использовании вместе со способом по настоящему изобретению. Несмотря на значительный прогресс методов пластической хирургии, образование рубцов может быть существенным препятствием при восстановлении нормальной функции и внешнего вида вылеченной кожи. Это особенно верно, когда патологические рубцы, такие как келоиды или гипертрофические рубцы на руках или лице, вызывают функциональную неполноценность или физическую деформацию. В наиболее тяжелых случаях такие рубцы могут вызывать психологическое расстройство и ухудшение экономических условий жизни. Заживление раны включает стадии гемостаза, воспаления, пролиферации и реконструкции. Стадия пролиферации представляет увеличение фибробластов, эндотелиальных и эпителиальных клеток. Благодаря применению способа по данному изобретению можно контролировать скорость пролиферации эпителиальных клеток в самой ране и рядом с ней с целью ускорения закрытия раны и/или минимального образования рубцовой ткани. Лечение по настоящему изобретению может быть также эффективным в качестве составной части схемы терапевтического воздействия при лечении язв во рту и около рта, например, возникающих вследствие облучения и/или химиотерапии. Такие язвы обычно образуются через нескольких дней после химиотерапии или лучевой терапии. Указанные язвы обычно возникают в виде мелких, болезненных поражений неправильной формы, которые обычно покрыты тонкой серой некротической пленкой в окружении воспаленной ткани. Во многих случаях отсутствие лечения приводит к пролиферации воспаленной ткани по периферии поражения. Например, эпителий, окружающий язву, обычно характеризуется пролиферативной активностью, в результате чего утрачивается целостность поверхностного эпителия. Указанные поражения из-за их размера и отсутствия целостности эпителия подвергают тело возможным вторичным инфекциям. Обычное проглатывание пищи и воды становится очень болезненным, и, если указанные язвы распространяются в пищеварительный тракт, обычно возникает диарея со всеми возможными осложнениями. Лечение таких язв способом по настоящему изобретению, которое включает введение антагониста гена hedgehog, позволяет уменьшить аномальную пролиферацию и дифференцировку пораженного эпителия, в результате чего уменьшается тяжесть последующих воспалительных явлений. Способ и композиции по настоящему изобретению можно также использовать для лечения ран, образующихся в результате дерматологических заболеваний, таких как поражения, возникающие вследствие аутоиммунных нарушений, таких как псориаз. Атопический дерматит представляет поражение кожи в результате аллергии, обусловленной иммунной реакцией, вызываемой аллергенами, такими как пыльца, пищевые продукты, перхоть, яды насекомых и растительные токсины. В других вариантах осуществления изобретения антипролиферативные препараты, содержащие антагонисты гена hedgehog, можно использовать для ингибирования пролиферации эпителиальных клеток хрусталика для профилактики осложнений после операции по поводу удаления экстракапсулярной катаракты. Катаракта является трудноизлечимым глазным заболеванием, лечению которой были посвящены разные исследования. Но в настоящее время катаракту лечат хирургическим путем. Хирургическое лечение катаракты применяется в течение длительного времени, при этом были исследованы разные оперативные методы. Для удаления хрусталика преимущественно применяют метод экстракапсулярного удаления. Главным преимуществом данного метода по сравнению с интракапсулярным удалением является более низкая вероятность возникновения цистоидного отека при отсутствии хрусталика и отслойки сетчатки. Экстракапсулярное удаление необходимо также для имплантации хрусталика в заднюю камеру глаза, который в настоящее время считается наиболее предпочтительным в большинстве случаев. Однако недостатком экстракапсулярного удаления катаракты является высокая вероятность помутнения задней капсулы хрусталика, часто именуемого вторичной катарактой, которая возникает примерно в 50% случаев в течение трех лет после хирургической операции. Вторичная катаракта вызывается пролиферацией эпителиальных клеток средней и передней капсулы хрусталика, которые остаются после экстракапсулярного удаления хрусталика. Указанные клетки пролиферируют с образованием колец Соммерлинга и вместе с фибробластами, которые также осаждаются на задней капсуле, вызывают помутнение задней капсулы, в результате чего ухудшается зрение. Было бы весьма желательно предотвратить возникновение вторичной катаракты. Для предотвращения образования вторичной катаракты можно использовать способ по данному изобретению, который позволяет ингибировать пролиферацию оставшихся эпителиальных клеток хрусталика. Например, такие клетки будут находиться в пассивном состоянии при закапывании раствора, содержащего антагонист гена hedgehog, в переднюю камеру глаза после удаления хрусталика. Кроме того, указанный раствор может быть осмотически сбалансирован для достижения минимальной эффективной дозы при закапывании в переднюю камеру глаза, что позволяет специфически ингибировать рост субкапсулярного эпителия. Способ по данному изобретению можно также использовать для лечения корнеопатии, характеризующейся пролиферацией эпителиальных клеток роговицы, как это имеет место при нарушениях, свя- 26007339 занных с эпителием глаза, таких как замедление роста эпителия или плоскоклеточный рак поверхности глаза.Levine et al. (1997) J. Neurosci 17:6277 установили, что белки гена hedgehog могут регулировать митогенез и дифференцировку фоторецепторов в сетчатке глаза позвоночных, и ген Ihh является вероятным фактором, стимулирующим пролиферацию клеток-предшественников сетчатки и дифференцировку фоторецепторов из пигментированного эпителия. Jensen et al. (1997) Development 124:363 также установили, что обработка культур клеток сетчатки новорожденной мыши аминоконцевым фрагментом белкаSonic hedgehog вызывает увеличение количества клеток, содержащих бромдезоксуридин, от общего числа клеток, а также палочек фоторецепторов, клеток сетчатки, лишенных аксона, и глиальных клеток Мюллера, из чего следует, что ген Sonic hedgehog стимулирует пролиферацию клеток-предшественников сетчатки. Таким образом, способ по данному изобретению можно использовать для лечения пролиферативных заболеваний клеток сетчатки и для регуляции дифференцировки фоторецепторов. Другим объектом настоящего изобретения является применение способа по данному изобретению для контроля роста волос. Волос состоит в основном из кератина, плотного и нерастворимого белка; прочность волоса определяется наличием дисульфидной связи цистеина. Отдельный волос включает цилиндрический стержень и корень и находится в фолликуле, колбообразном углублении в коже. Основание фолликула имеет пальцеобразный выступ, заканчивающийся сосочком, который состоит из соединительной ткани, из которой растет волос и через которую кровеносные сосуды питают указанные клетки. Стержень может представлять часть волоса, частью волоса, погруженной частью волоса. Основание корня переходит в волосяную луковицу, которая расположена поверх сосочка. Клетки, из которых образуется волос, растут в луковице фолликула; они вытягиваются в форме волокон по мере пролиферации клеток в фолликуле. "Рост" волоса означает образование и удлинение волосяного волокна в результате деления клеток. Как хорошо известно в данной области, обычный цикл развития волоса делится на три стадии: анаген, катаген и телоген. Во время активной фазы (анаген) происходит быстрое деление эпидермальных стволовых клеток дермальной папилломы. Дочерние клетки перемещаются вверх и дифференцируют с образованием концентрических слоев самого волоса. Переходная стадия, катаген, характеризует прекращением митоза стволовых клеток в фолликуле. Стадия покоя известна как телоген, когда волос остается на волосистой части кожи головы в течение нескольких недель до начала развития нового волоса, который выталкивает находящийся в фазе телогена стержень из его фолликула. При рассмотрении вышеуказанной модели становится ясно, что чем больше пул делящихся стволовых клеток, дифференцирующих с образованием волосяных клеток, тем быстрее происходит рост волоса. Таким образом, способы усиления или ослабления роста волоса должны соответственно стимулировать или ингибировать пролиферацию указанных стволовых клеток. В некоторых вариантах осуществления изобретения способ по данному изобретению можно использовать для уменьшения роста волоса у человека в отличие от традиционного удаления волос путем стрижки, бритья или депиляции. Например, способ по настоящему изобретению можно использовать при лечении трихоза, для которого характерен аномально быстрый рост густых волос, например, гипертрихоз. В типичном варианте осуществления изобретения антагонисты гена hedgehog можно использовать для лечения гирсутизма, нарушения, характеризующегося избыточным оволосением. Способ по данному изобретению можно также использовать для увеличения продолжительности эффекта депиляции. Кроме того, поскольку антагонист гена hedgehog часто оказывает цитостатическое, а не цитотоксическое воздействие на эпителиальные клетки, такие средства можно использовать для защиты клеток волосяного фолликула от цитотоксических веществ, которые эффективно воздействуют только при переходе в S-фазу цикла развития клетки, например, вызывают гибель в результате облучения. Способ по настоящему изобретению можно применять для защиты волос, так как с его помощью можно сделать клетки волосяного фолликула пассивными, например, в результате ингибирования перехода клеток в Sфазу, и предотвратить таким образом митоз клеток фолликула или запрограммированную гибель клеток. Например, антагонисты гена hedgehog можно вводить субъектам, проходящих курс химиотерапии или лучевой терапии, которые обычно вызывают потерю волос. Ингибируя цикл развития клеток во время такой терапии, можно защитить клетки волосяного фолликула от гибели, которая в противном случае произошла бы вследствие активации программ гибели клеток. После окончания курса вышеуказанной терапии можно прекратить применение способа по данному изобретению, в результате чего возобновляется пролиферация клеток фолликула. Способ по данному изобретению можно также использовать для лечения фолликулита, такого как фолликулит, вызывающий разрушение волос, фолликулит, вызывающий рубцеваниекожи, или келоидный фолликулит. Например, косметический препарат, содержащий антагонист гена hedgehog, можно наносить местно при лечении псевдофолликулита, хронического нарушения, возникающего чаще всего в подчелюстной области шеи и обусловленного бритьем, при котором образуются характерные повреждения, представляющие эритематозные папулы и пустулы, содержащие скрытые внутри волосы. Другим объектом настоящего изобретения является способ индуцирования дифференцировки и/или ингибирования пролиферации эпителиальной ткани. Такие формы указанных молекул могут создавать- 27007339 основу для дифференцированной терапии, применяемой при лечении гиперпластических и/или неопластических состояний с участием эпителиальной ткани. Например, такие препараты можно использовать для лечения кожных заболеваний, при которых происходит аномальная пролиферация или рост клеток кожи. Например, фармацевтические препараты по данному изобретению предназначены для лечения гиперпластических эпидермальных заболеваний, таких как кератоз, а также для лечения неопластических эпидермальных заболеваний, которые характеризуются высокой скоростью пролиферации при возникновении разных типов рака кожи, таких как, например, базально-клеточный рак или плоскоклеточный рак. Способ по данному изобретению можно применять для лечения аутоиммунных заболеваний, поражающих кожу, в частности, дерматологических заболеваний, обусловленных патологической пролиферацией и/или кератинизацией эпидермиса, имеющими место, например, в случае псориаза или атопического дерматоза. Многие распространенные заболевания кожи, такие как псориаз, плоскоклеточный рак, кератоакантома и актинический кератоз, характеризуются локализованной аномальной пролиферацией и ростом клеток. Например, известно, что в случае псориаза, при котором на коже появляются чешуйчатые, красные, увеличенные бляшки, кератиноциты пролиферируют гораздо быстрее, чем нормальные клетки и недостаточно полно дифференцируют. В одном варианте осуществления изобретения препараты по настоящему изобретению можно использовать для лечения дерматологических заболеваний, связанных с кератинизацией, вызывающей аномальную пролиферацию клеток кожи, причем указанные заболевания могут сопровождаться воспалительными или невоспалительными явлениями. Для иллюстрации вышеизложенного следует отметить,что лекарственные препараты, содержащие антагонист гена hedgehog, например, который стимулирует состояние покоя или дифференцировку, можно использовать для ослабления разных форм псориаза, таких как кожный, слизистый или ногтевой псориаз. Псориаз, как было указано выше, обычно характеризуется наличием эпидермальных кератиноцитов, которые отличаются сильной пролиферативной активацией и дифференцировкой по всему пути "регенерации". Подавляющий пролиферацию способ по данному изобретению можно использовать для ослабления патологической эпидермальной активации, создавая таким образом основу для длительной ремиссии заболевания. Способом по данному изобретению можно также лечить целый ряд других поражений, вызываемых кератозом. Актинические кератозы, например, представляют поверхностные воспалительные предраковые опухоли, возникающие под воздействием солнечных лучей и облучения кожи. Указанные поражения имеют эритематозный характер с образованием коричневых пятен разной величины. Применяемые в настоящее время методы лечения включают иссечение и криохирургию. Такие методы лечения являются болезненными и часто вызывают образование косметически неприемлемых рубцов. Поэтому лечение кератоза, такого как актинический кератоз, может включать применение, предпочтительно местное, композиции, содержащей антагонист гена hedgehog, в количествах, достаточных для ингибирования гиперпролиферации эпидермальных/эпидермоидных клеток в месте поражения. Угри являются еще одним дерматологическим заболеванием, которое можно лечить способом по данному изобретению. Обыкновенные угри, например, представляют заболевание, вызываемое многочисленными факторами, которое возникает в подростковом и юношеском возрасте и характеризуется появлением воспалительных и невоспалительных поражений на лице и верхней части туловища. Основным нарушением, вызывающим появление обыкновенных угрей, является гиперкератинизация протока сверхактивной сальной железы. Гиперкератинизация блокирует нормальную подвижность кожи и микроорганизмов в фолликуле, что в свою очередь стимулирует высвобождение липазы бактериямиPropinobacterium acnes и Staphylococcus epidermidis и дрожжами Pitrosporum ovale. Лечение антипролиферативным антагонистом гена hedgehog, в частности местными препаратами, может быть полезно для профилактики возникновения переходных признаков протоков, например, гиперкератинизации, вызывающей формирование поражения. Лечение способом по данному изобретению может быть дополнено лечением антибиотиками, ретиноидами и антиандрогенами. Настоящее изобретение относится также к способу лечения разных форм дерматита. Дерматит является описательным термином, означающим плохо разграниченные поражения, которые вызывают зуд,эритему, шелушение, волдыри, мокнущие раны, трещины или струпья. Указанные поражения возникают по целому ряду причин. Наиболее распространенными типами дерматита являются атопический, контактный и пеленочный дерматит. Себорейная экзема, например, представляет хронический, обычно зудящий дерматит с эритемой, сухим, влажным или сальным шелушением и желтыми отслаивающимися бляшками в разных частях тела, особенно на волосистой части кожи головы, с отшелушиванием большого количества сухих чешуек. Способ по данному изобретению можно также использовать для лечения застойного дерматита, часто хронического, обычно экзематозного дерматита. Актинический дерматит является дерматитом, возникающим под действием актинических лучей, например, солнечного, ультрафиолетового, рентгеновского или гамма-излучения. Способ по настоящему изобретению можно использовать для лечения и/или профилактики некоторых симптомов дерматита, вызываемых нежелательной- 28007339 пролиферацией эпителиальных клеток. Такие методы лечения разных форм дерматита могут также включать применение местных и системных кортикостероидов, противозудных средств и антибиотиков. Например, способ по данному изобретению можно применять для ингибирования ангиогенеза. Известно, что ген hedgehog стимулирует ангиогенез. Тампоны из матригеля, пропитанные белком генаhedgehog и введенные мышам вызывают существенную неоваскуляризацию, в то время как тампоны из матригеля, не содержащие гена hedgehog, вызывают сравнительно небольшую васкуляризацию. Белок гена hedgehog может также увеличивать васкуляризацию обычно не имеющей сосудов роговой оболочки глаза у мыши. Ген ptc-1 экспрессирован в нормальных сосудистых тканях, включая эндотелиальные клетки аорты, клетки гладких мышц сосудов, адвентициальные фибробласты аорты, сосудистую сеть коронарных сосудов и кардиомиоциты предсердия и желудочков. Указанные ткани также чувствительны к воздействию белка гена hedgehog. Лечение экзогенным геном hedgehog повышает экспрессию гена ptc1. Кроме того, белки гена hedgehog стимулируют пролиферацию клеток гладких мышц сосудов in vivo. Белки гена hedgehog также увеличивают экспрессию фибробластами факторов роста новых сосудов, таких как VEGF, bFGF, Ang-1 и Ang-2. И, наконец, известно, что белки гена hedgehog способствуют выздоровлению после ишемического поражения и стимулируют образование коллатеральных сосудов. С учетом того, что ген hedgehog стимулирует ангиогенез, можно предположить, что антагонисты гена hedgehog являются ингибиторами ангиогенеза, особенно в тех случаях, когда для ангиогенеза необходим определенный уровень передачи сигналов геном hedgehog. Ангиогенез является определяющим фактором для многих заболеваний. Постоянный, нерегулируемый ангиогенез происходит в целом ряде заболеваний, при образовании метастазов и аномальном росте эндотелиальных клеток. Сосудистая сеть, образовавшаяся в результате ангиогенных процессов, поддерживает патологическое нарушение, имеющее место в случае вышеуказанных заболеваний. Разные патологические состояния, возникающие вследствие нерегулируемого ангиогенеза классифицируются как заболевания, зависящие от ангиогенеза или обусловленные ангиогенезом. Терапевтические методы, направленные на регулирование ангиогенных процессов, могут способствовать подавлению или ослаблению симптомов указанных заболеваний. Заболевания, вызываемые, поддерживаемые или обусловленные ангиогенезом, включают глазные неоваскулярные заболевания, возрастную дегенерацию желтого пятна, диабетическую ретинопатию, ретинопатию недоношенных, отторжение роговичного трансплантата, неоваскулярную глаукому, ретроленальную фиброплазию, эпидемический кератоконъюктивит, недостаточность витамина А, переутомление глаз контактными линзами, атопический кератит, лимбический кератит, кератит птеригия, розовые угри, филектенулоз, сифилис, микобактериальные инфекции, липидную дегенерацию, химические ожоги, бактериальные язвы, язвы, вызываемые грибами, простой герпес, опоясывающий лишай, протозойные инфекции, саркому Капоши, разъедающую язву роговицы Морена, маргинальную дегенерацию Террьена, маргинальный кератолиз, ревматоидный артрит, системную красную волчанку, полиартрит, травмы, саркоидоз Вегенерса, склерит, болезнь Стивенса-Джонсона, перифигоидную кератотомию, отторжение трансплантата роговицы, ревматоидный артрит, хронический воспалительный остеоартрит (например, неспецифический язвенный колит или болезнь Крона), гемангиому, болезнь Рандю-Вебера-Ослера и наследственную геморрагическую телеангиэктазию. Кроме того, ангиогенез имеет важное значение для развития рака. Опухоль не может увеличиваться без кровоснабжения, приносящего питательные вещества и удаляющего продукты жизнедеятельности клеток. Опухоли, для которых важен ангиогенез, включают солидные опухоли, такие как рабдомиосаркомы, ретинобластома, саркома Эвинга, нейробластома и остеосаркома, и доброкачественные опухоли,такие как акустическая неврома, нейрофиброма, трахома и пиогенная гранулема. Установлено, что ангиогенные факторы взаимосвязаны с некоторыми солидными опухолями. Предотвращение ангиогенеза может прекратить рост указанных опухолей и избавить животное от поражения, вызываемого опухолью. Ангиогенез также взаимосвязан с раком крови, таким как лейкоз, разные острые или хронические новообразования костного мозга, при возникновении которых происходит неконтролируемая пролиферация лейкоцитов, обычно сопровождающаяся анемией, плохим свертыванием крови и увеличением лимфотических узлов, печени и селезенки. Считается, что ангиогенез имеет непосредственное отношение к нарушениям в костном мозге, вызывающим возникновение лейкозоподобных опухолей. Помимо роста опухолей ангиогенез имеет важное значение при метастазировании. Первоначально,ангиогенез важен для васкуляризации опухоли, в результате которой раковые клетки попадают в кровоток и циркулируют по всему организму. После того, как опухолевые клетки покинули место первичной локализации и осели в месте вторичной локализации метастазов, росту и увеличению новой опухоли должен предшествовать ангиогенез. Поэтому предотвращение ангиогенеза может препятствовать образованию метастазов опухолей и, возможно, сдерживать рост опухоли в месте первичной локализации. Ангиогенез характерен также для нормальных физиологических процессов, таких как репродукция и заживление раны. Ангиогенез является важным этапом овуляции и имплантации бластулы после оплодотворения. Предотвращение ангиогенеза можно использовать для индуцирования аменореи, блокирования овуляции или предотвращения имплантации бластулы.- 29007339 Настоящее изобретение можно применять для лечения и/или профилактики респираторного дистресс-синдрома или других нарушений, возникающих в результате неправильного поверхностного натяжения легких. Респираторный дистресс-синдром возникает при недостатке поверхностно-активного вещества в альвеолах легких. В легких позвоночных находится поверхностно-активное вещество, представляющее комплексную смесь липидов и белка, которая вызывает увеличение поверхностного натяжения во время раздувания легкого и уменьшение во время спадения легкого. Во время спадения легкого поверхностно-активное вещество сокращается и уменьшает силы поверхностного натяжения, которые в противном случае стимулируют коллапс альвеолы. Аэрированные альвеолы, которые не спали во время выдоха, обеспечивают постоянный перенос кислорода и диоксида углерода между кровью и воздухом в альвеолах и требуют гораздо меньшую силу для раздувания легкого во время последующего вдоха. Во время раздувания легкого поверхностно-активное вещество легкого увеличивает поверхностное натяжение по мере увеличения площади поверхности альвеол. Возросшее поверхностное натяжение в расширенных альвеолах противодействует избыточному раздуванию легкого в воздушных пространствах и способствует переносу воздуха в менее аэрированные алвеолы, облегчая таким образом аэрацию легких. Респираторный дистресс-синдром особенно распространен у недоношенных младенцев. Поверхностно-активное вещество легких обычно синтезируется с очень низкой скоростью до последних шести недель внутриутробной жизни. Для ребенка, родившегося более чем за шесть недель до нормального срока окончания беременности, характерна высокая степень риска родиться с недостаточным количеством поверхностно-активного вещества легких и недостаточной скоростью синтеза поверхностноактивного вещества. Чем раньше родится ребенок, тем больше может быть недостаток поверхностноактивного вещества. Большая недостаточность поверхностно-активного вещества может вызывать нарушение дыхания в течение нескольких минут или часов после рождения. Недостаточность поверхностно-активного вещества вызывает прогрессирующий коллапс альвеол(ателектаз) из-за пониженной способности легких расширяться несмотря на максимальное дыхательное усилие. В результате этого недостаточное количество кислорода поступает в кровь новорожденного. Респираторный дистресс-синдром может возникать также у взрослых, обычно вследствие нарушения биосинтеза поверхностно-активного вещества. Легочная ткань недоношенных младенцев характеризуется высокой активностью пути передачи сигналов геном hedgehog. Ингибирование указанного пути антагонистами гена hedgehog увеличивает образование ламеллярных телец и повышает экспрессию генов, участвующих в биосинтезе поверхностно-активного вещества. Ламеллярные тельца представляют субклеточные структуры, связанные с биосинтезом поверхностно-активного вещества. По вышеуказанным причинам лечение недоношенных детей антагонистом гена hedgehog должно стимулировать биосинтез поверхностно-активного вещества и ослаблять симптомы респираторного дистресс-синдрома. В тех случаях, когда респираторный дистресссиндром взрослых связан с активацией пути передачи сигналов геном hedgehog, также должно быть эффективным лечение антагонистом гена hedgehog. Антагонисты гена hedgehog можно использовать для лечения специфических нарушений, в которых пораженная ткань и/или клетки свидетельствуют о высокой активации пути передачи сигналов геномhedgehog. Экспрессию генов gli активирует путь передачи сигналов геном hedgehog, включая gli-1, gli-2 иgli-3. Экспрессия gli-1 в значительной степени согласуется с активностью передачи сигналов геномhedgehog в целом ряде тканей и нарушений, в то время как экспрессия gli-3 согласуется в меньшей степени. Гены gli кодируют факторы транскрипции, которые активируют экспрессию многих генов, необходимых для устранения всех явлений, связанных с передачей сигналов геном hedgehog. Однако фактор транскрипции gli-3 может также действовать в качестве репрессора эффекторных генов hedgehog, и поэтому экспрессия gli-3 может уменьшать воздействие пути передачи сигналов геном hedgehog. Действиеgli-3 как активатора или репрессора транскрипции зависит от посттрансляционных событий, и поэтому вполне вероятно, что способы обнаружения активирующей формы (по сравнению с репрессирующей формой) белка gli-3 могут быть также надежным средством измерения активации пути передачи сигналов геном hedgehog. Считается, что экспрессия гена gli-2 является надежным маркером активации пути передачи сигналов геном hedgehog. Ген gli-1 сильно экспрессирован в целом ряде раковых опухолей,гиперплазии и недоразвитых легких и служит в качестве маркера для относительной активации пути передачи сигналов геном hedgehog. Кроме того, на ткани, такие как недоразвитое легкое, в которых наблюдается высокая экспрессия гена gli, сильно воздействуют ингибиторы гена hedgehog. Таким образом, обнаружение экспрессии гена gli может быть использовано в качестве эффективного прогностического средства для идентификации тканей и нарушений, особенно пригодных для лечения антагонистом генаhedgehog. В предпочтительных вариантах осуществления изобретения уровни экспрессии gli-1 определяют путем прямого обнаружения транскрипта или путем определения уровней белка или активности. Транскрипты можно обнаружить разными методами, в основе которых лежит главным образом гибридизация зондов с транскриптами gli-1 или синтезированной из них кДНК. Хорошо известные методы включают нозерн-блоттинг, ПЦР с обратной транскриптазой и микроматричный анализ уровней транскриптов. Методы определения уровней белка Gli включают вестерн-блоттинг, иммунопреципитацию, двумерный
МПК / Метки
МПК: A61K 31/415
Метки: генами, способы, содержащие, передачи, веществ, сигналов, путей, композиции, hedgehog, медиаторы, применения, указанных
Код ссылки
<a href="https://eas.patents.su/30-7339-mediatory-putejj-peredachi-signalov-genami-hedgehog-soderzhashhie-ih-kompozicii-i-sposoby-primeneniya-ukazannyh-veshhestv.html" rel="bookmark" title="База патентов Евразийского Союза">Медиаторы путей передачи сигналов генами hedgehog, содержащие их композиции и способы применения указанных веществ</a>
Предыдущий патент: Способы выявления мишеней в образце и наборы для их осуществления
Следующий патент: Способ газогидродинамического исследования газовых скважин без выпуска газа в атмосферу
Случайный патент: Скважинная струйная установка для каротажных работ и способ ее работы


































