Новые дигидроптеридиноны, способы их получения и их применение в качестве лекарственных средств
Номер патента: 7062
Опубликовано: 30.06.2006
Авторы: Поль Геральд, Грауэрт Маттиас, Айкмайер Кристиан, Леманн-Линтц Торстен, Брайтфельдер Штеффен, Редеманн Норберт, Квант Йенс Юрген, Бауер Эккхарт, Хоффманн Маттиас, Шнапп Гизела, Штегмайер Мартин
Формула / Реферат
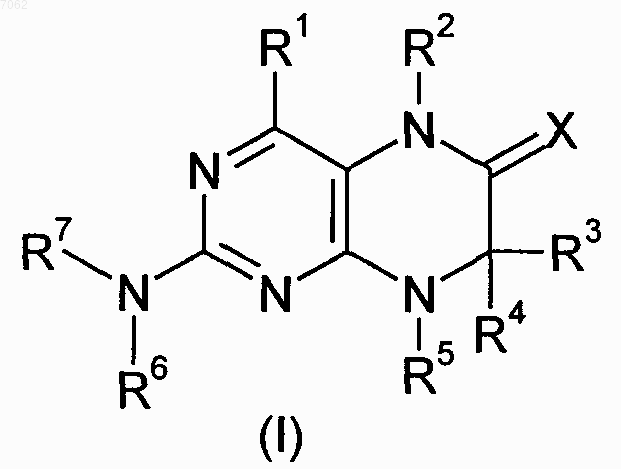
1. Соединения общей формулы (I)

в которой R1 представляет собой остаток, выбранный из группы, включающей водород, NH2 и необязательно замещенную одним либо несколькими атомами галогена C1-С3алкильную группу,
R2 представляет собой остаток, выбранный из группы, включающей водород или необязательно замещенную C1-С3алкильную группу,
R3 и R4 имеют идентичные или разные значения и представляют собой остаток, выбранный из группы, включающей необязательно замещенный C1-С10алкил, С2-С10алкенил или С2-С10алкинил, С6-С10арил или представляют собой остаток, выбранный из группы, включающей водород, COXR8, или
R3 и R4 вместе образуют 2-5-членный алкильный мостик,
R5 представляет собой водород или остаток, выбранный из группы, включающей необязательно замещенный C1-С10алкил, С2-С10алкенил, С6-С10арил или С3-С6циклоалкил, или
R3 и R5 либо R4 и R5 вместе образуют насыщенный или ненасыщенный С3-С4алкильный мостик,
R6 представляет собой необязательно замещенный С6-С10арил или гетероарил,
R7 представляет собой водород, и
Х обозначает в каждом случае независимо от других его значений О или S,
R8 представляет собой в каждом случае независимо от других его значений водород или остаток, выбранный из группы, включающей необязательно замещенный С1-С4алкил, С2-С4алкенил, С2-С4алкинил и фенил, необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей.
2. Соединения по п.1, где
X, R6 и R7 имеют указанные выше значения, а
R1 представляет собой водород,
R2 представляет собой СН3,
R3 и R4 имеют идентичные или разные значения и представляют собой остаток, выбранный из группы, включающей водород, необязательно замещенный C1-С6алкил, С2-С6алкенил или С2-С6алкинил, или
R3 и R4 вместе образуют С2-С5алкильный мостик,
R5 представляет собой остаток, выбранный из группы, включающей необязательно замещенный C1-С10алкил, С2-С10алкенил и С3-С6циклоалкил, или
R3 и R5 либо R4 и R5 вместе образуют насыщенный или ненасыщенный С3-С4алкильный мостик, необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей.
3. Соединения по п.1 или 2, при этом
R1-R5, R7, R8 и Х имеют указанные выше значения, а
R6 представляет собой остаток общей формулы

где n обозначает 1, 2, 3 или 4,
R9 представляет собой остаток, выбранный из группы, включающей необязательно замещенный C1-С6алкил, С2-С6алкенил, С2-С6алкинил, -CONH-C1-С10алкилен, -O-арил, -O-гетероарил, -O-циклоалкил, -O-гетероциклоалкил, арил, гетероарил, циклоалкил и гетероциклоалкил, или представляет собой остаток, выбранный из группы, включающей -O-С1-С6алкил-Q1, -CONR8-C1-С10алкил-Q1, -CONR8-C2-C10алкенил-Q1, -CONR8-Q2, галоген, ОН, -SO2R8, -SO2N(R8)2, -COR8, -COOR8, -N(R8)2, -NHCOR8, СОNR8O-С1-С10алкил-Q1 и CONR8O-Q2, где
Q1 обозначает водород, -NHCOR8 или остаток, выбранный из группы, включающей необязательно замещенную -NH-арильную, -NH-гетероарильную, арильную, гетероарильную, С3-С8циклоалкильную и гетероциклоалкильную группу, а
Q2 обозначает водород или остаток, выбранный из группы, включающей необязательно замещенную арильную, гетероарильную, С3-С8гетероциклоалкильную, С3-С8циклоалкильную и С1-С4алкил-С3-С8циклоалкильную группу,
R10 имеет идентичные или разные значения и представляет собой остаток, выбранный из группы, включающей необязательно замещенный C1-С6алкил, С2-С6алкенил и С2-С6алкинил, -O-C1-С6алкил, -O-С2-С6алкенил, -O-С2-С6алкинил, С3-С6гетероциклоалкил и С3-С6циклоалкил, или представляет собой остаток, выбранный из группы, включающей водород, -СОNH2, -COOR8, -OCON(R8)2, -N(R8)2, -NHCOR8, -NHCON(R8)2, -NO2 и галоген, или
расположенные рядом друг с другом остатки R9 и R10 вместе образуют мостик общей формулы
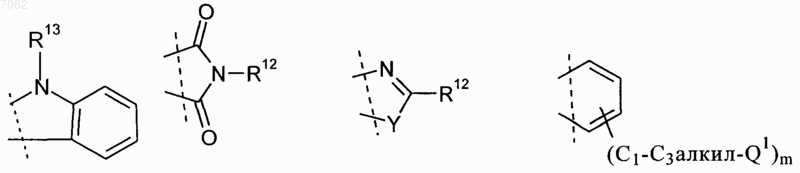
где Y обозначает О, S или NR11,
m обозначает 0, 1 или 2, а
R11 представляет собой водород или C1-С2алкил и
R12 представляет собой водород или остаток, выбранный из группы, включающей необязательно замещенный фенил, пиридил, пиразинил, пиримидинил, пиридазинил, -C1-С3алкилфенил, -C1-С3алкилпиридил, -C1-С3алкилпиразинил, -C1-С3алкилпиримидинил и -С1-С3алкилпиридазинил,
R13 представляет собой C1-С6алкил, необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей.
4. Соединения по одному из пп.1-3, где
R3-R6, R8 и Х имеют указанные выше значения, а
R1 представляет собой водород,
R2 представляет собой СН3 и
R7 представляет собой водород, необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей.
5. Соединение формулы (I) по одному из пп.1-4 для применения в качестве лекарственного средства.
6. Соединение формулы (I) по одному из пп.1-4 для применения в качестве лекарственного средства, обладающего антипролиферативным действием.
7. Применение соединения формулы (I) для получения лекарственного средства, предназначенного для лечения и/или предупреждения рака, инфекционных заболеваний, воспалительных заболеваний и аутоиммунных заболеваний.
8. Способ лечения и/или предупреждения рака, инфекционных заболеваний, воспалительных заболеваний и аутоиммунных заболеваний, отличающийся тем, что пациенту вводят эффективное количество соединения формулы (I) по одному из пп.1-4.
9. Фармацевтические композиции, содержащие в качестве действующего вещества одно либо несколько соединений общей формулы (I) по одному из пп.1-4 шыш его(их) физиологически приемлемые соли, при необходимости, совместно с обычными вспомогательными веществами и/или носителями.
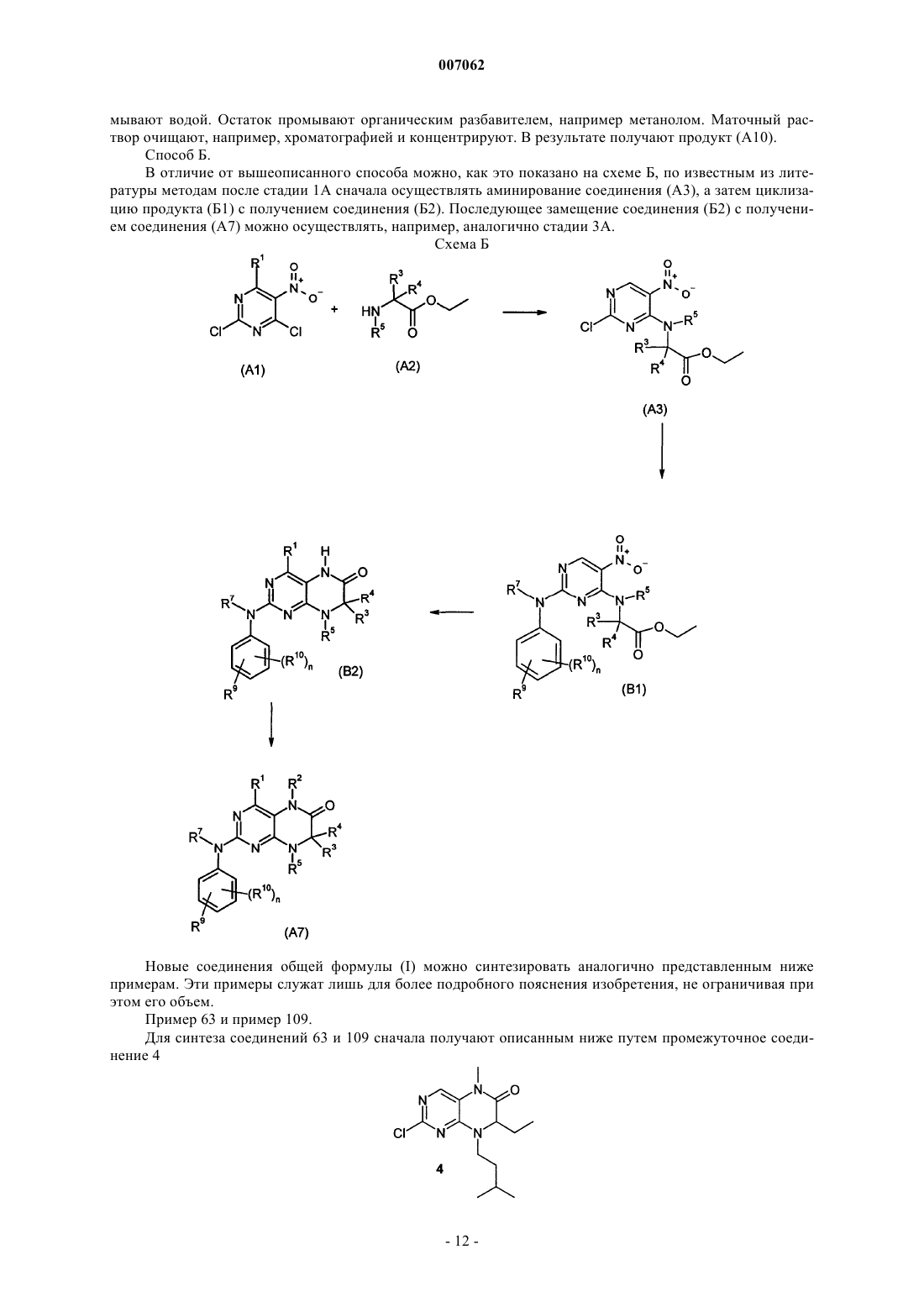
10. Способ получения соединения общей формулы (I)
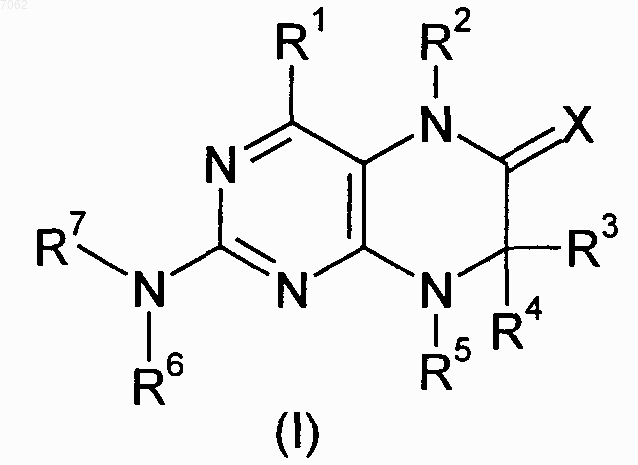
где R1-R7 и Х имеют значения, указанные в пп.1-4, отличающийся тем, что соединение общей формулы (II)
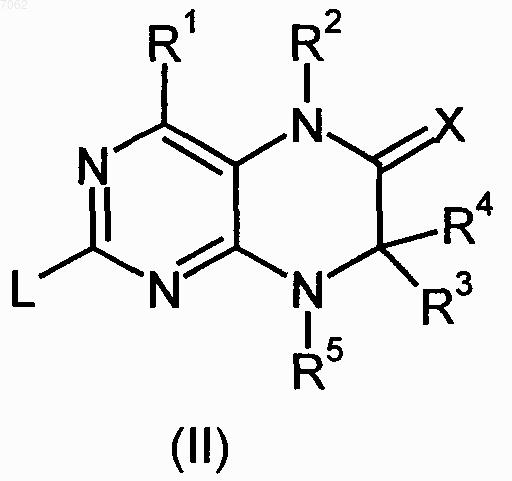
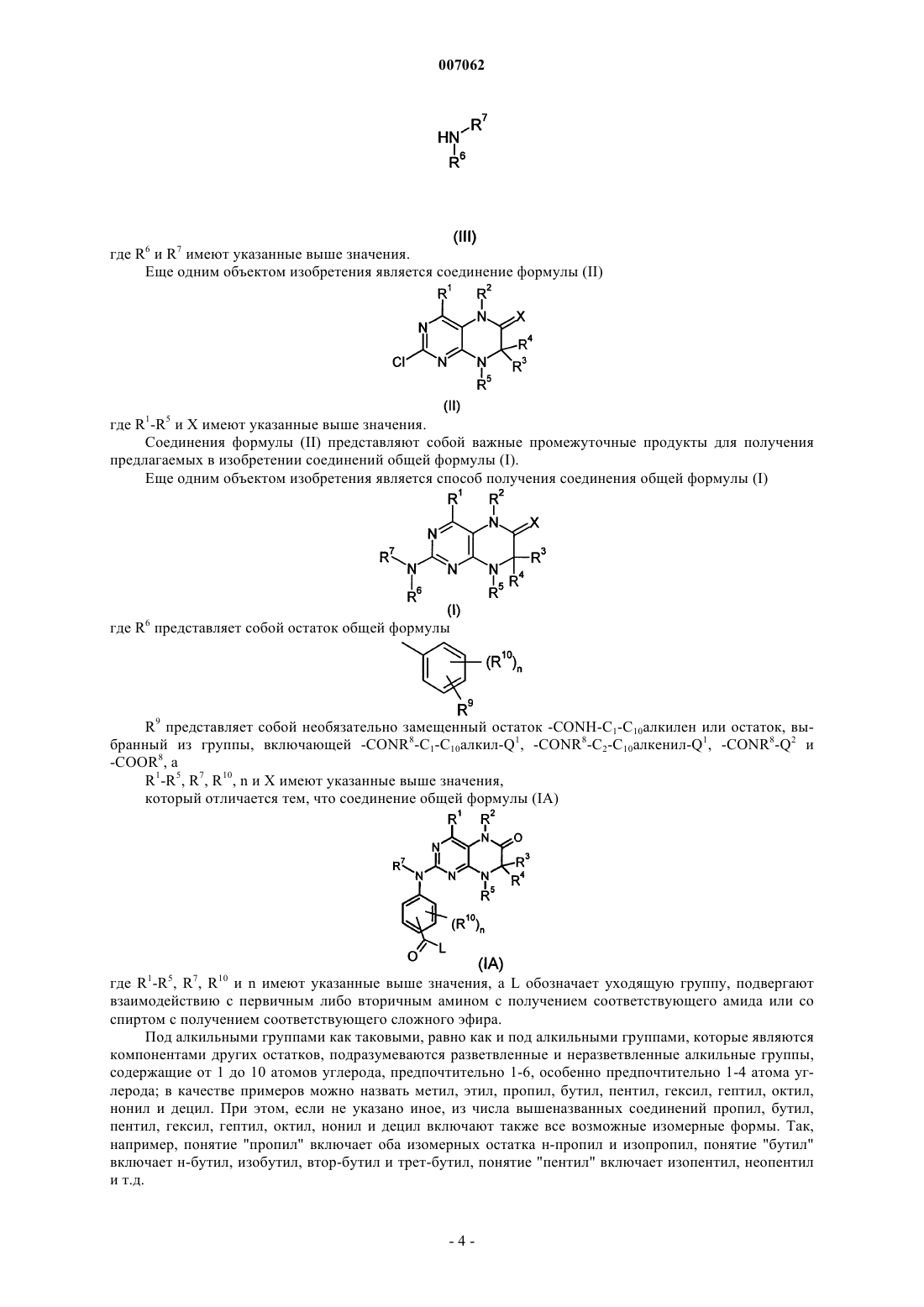
где R1-R5 и Х имеют значения, указанные в пп.1-4, a L обозначает уходящую группу, подвергают взаимодействию с необязательно замещенным соединением общей формулы (III)

где R6 и R7 имеют значения, указанные в пп.1-4.
11. Соединение формулы (II)
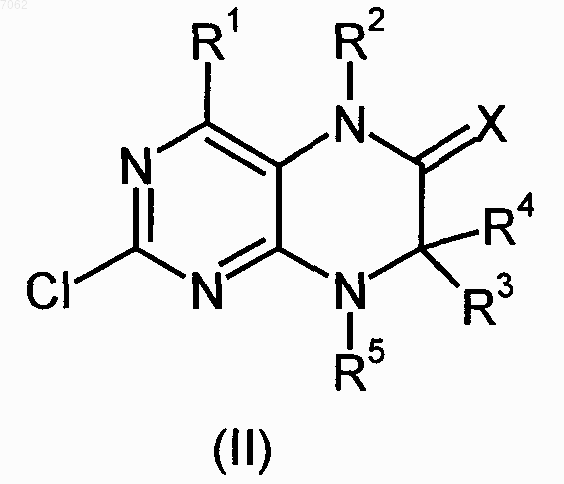
где R1-R5 и Х имеют значения, указанные в пп.1-4.
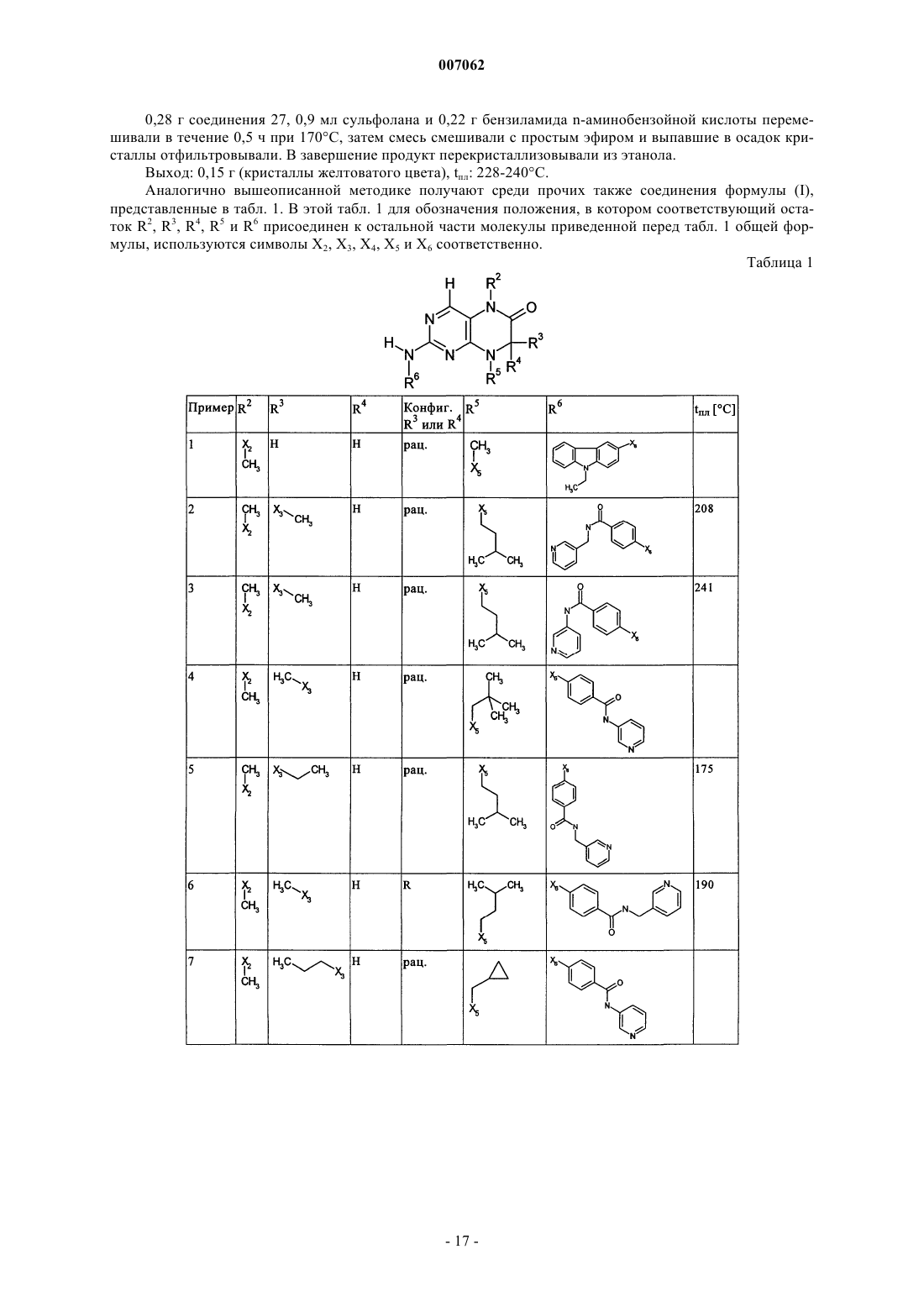
12. Способ получения соединения общей формулы (I)
где R6 представляет собой остаток общей формулы
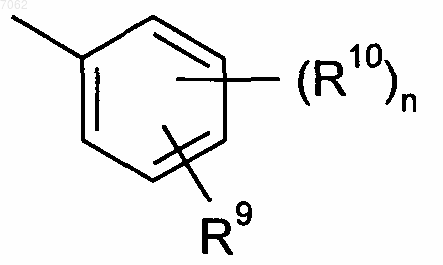
R9 представляет собой необязательно замещенный остаток -CONH-C1-С10алкилен или остаток, выбранный из группы, включающей -СОNR8-С1-С10алкил-Q1, -СОNR8-С2-С10алкенил-Q1, -CONR8-Q2 и -COOR8, а
R1-R5, R7, R10, n и Х имеют значения, указанные в пп.1-4, отличающийся тем, что соединение общей формулы (IA)
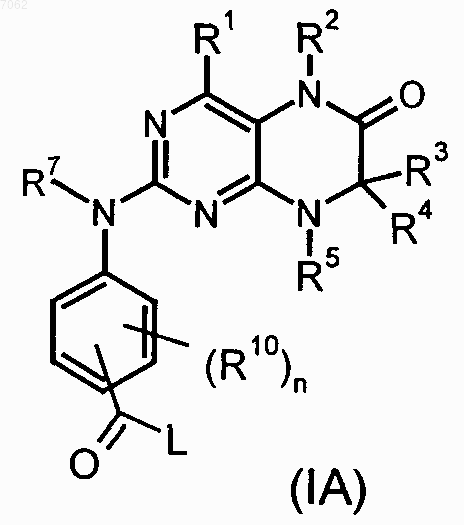
где R1-R5, R7, R10 и n имеют значения, указанные в пп.1-4, a L обозначает уходящую группу, подвергают взаимодействию с первичным либо вторичным амином с получением соответствующего амида или со спиртом с получением соответствующего сложного эфира.
Текст
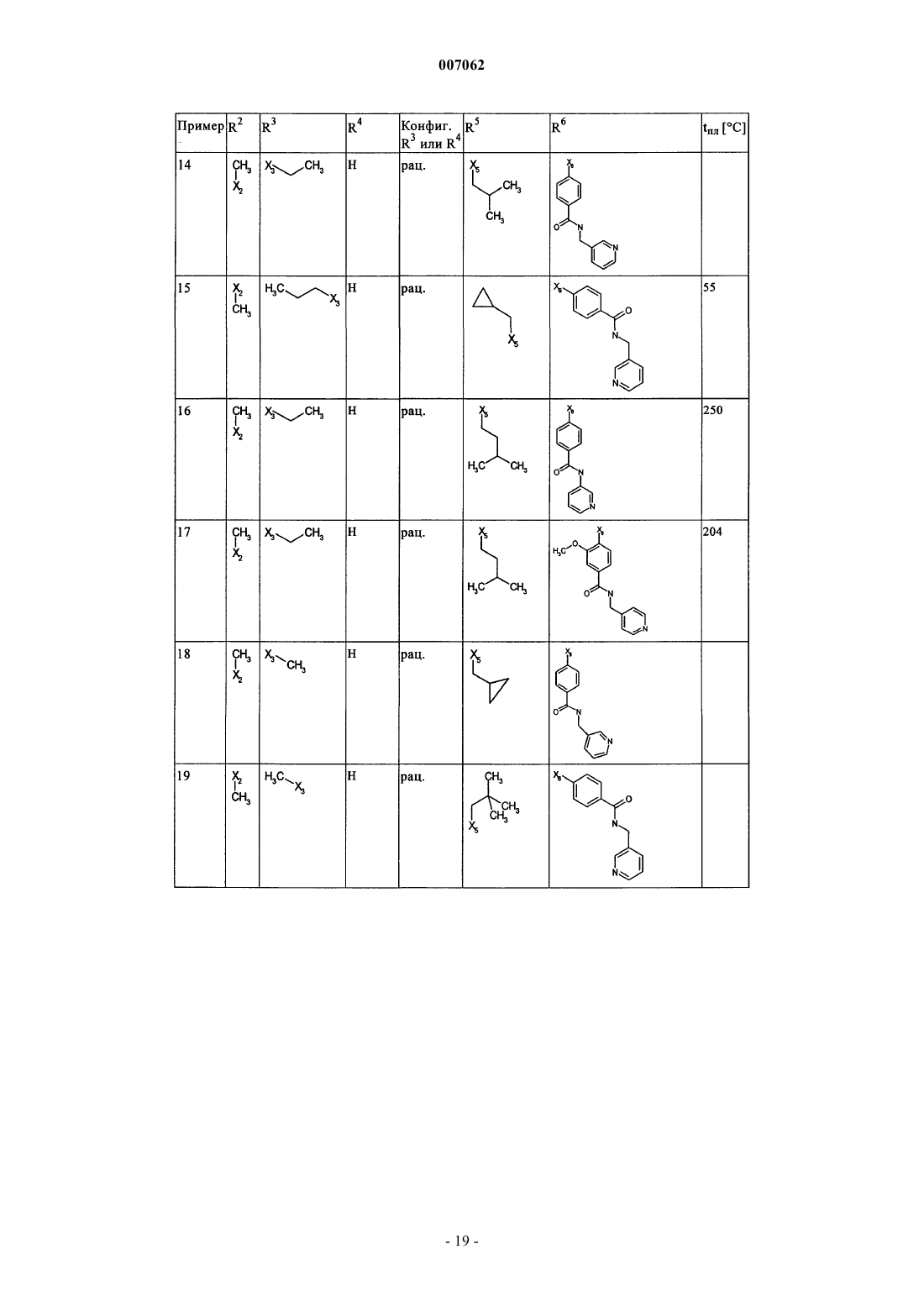
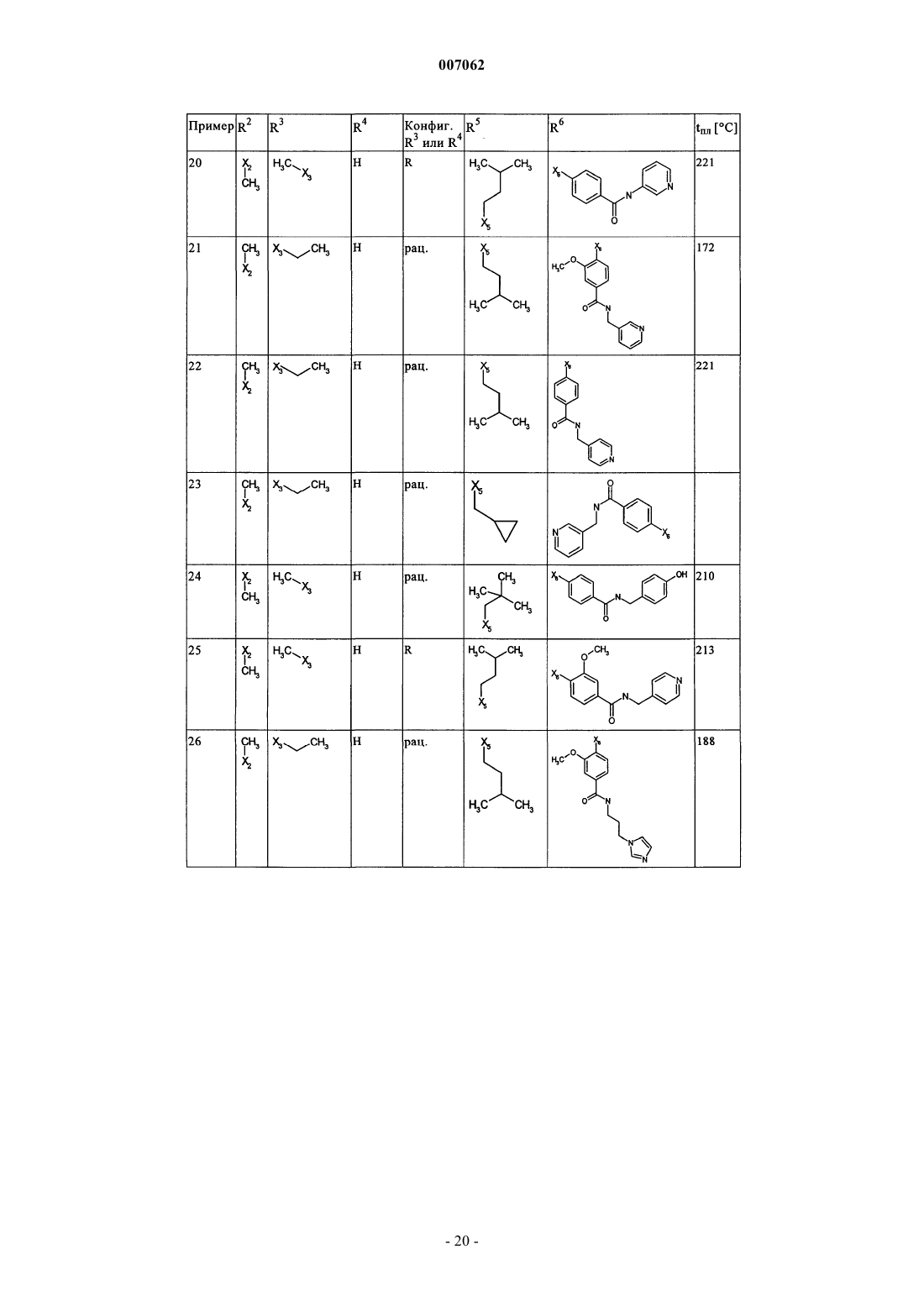
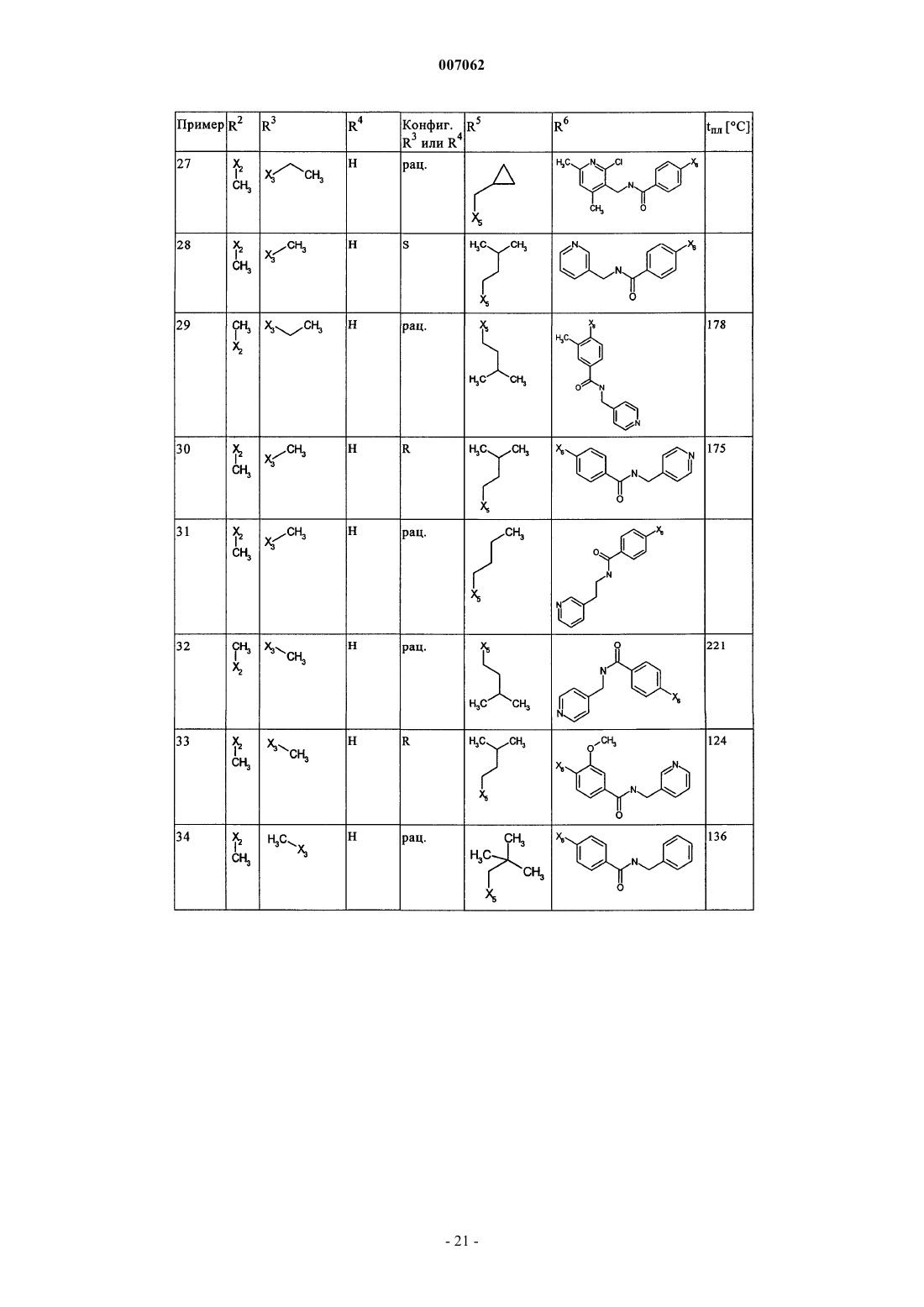
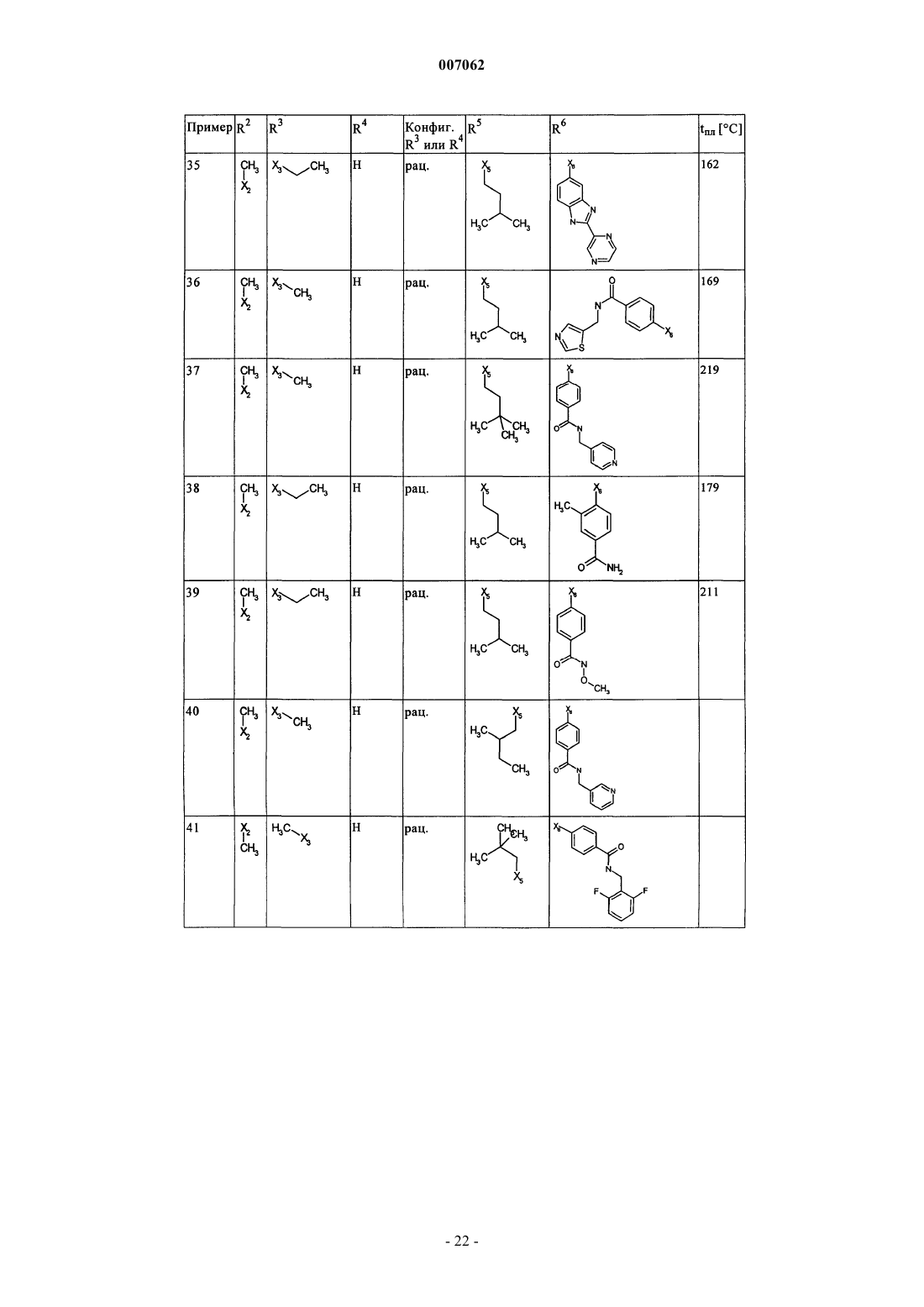
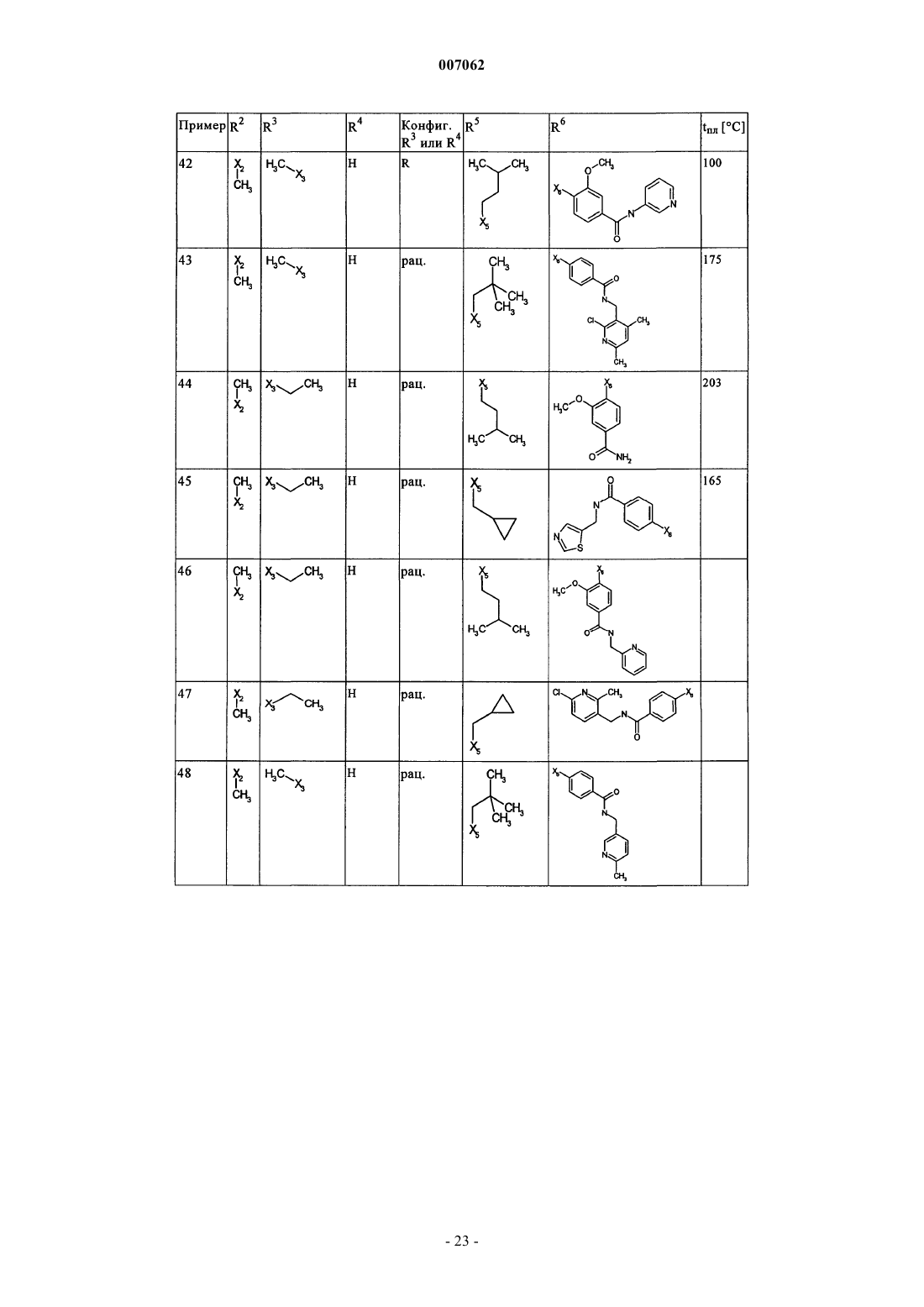
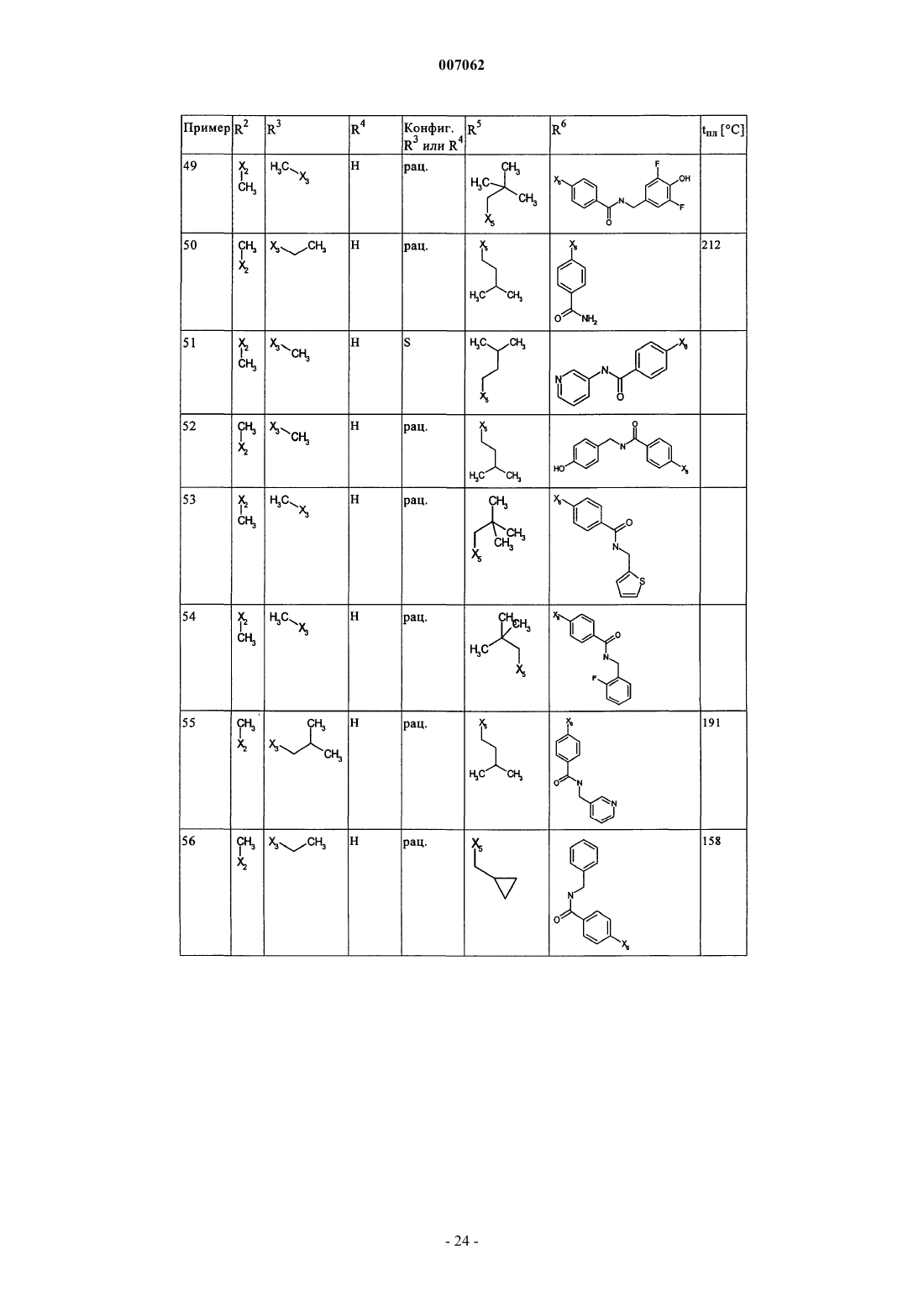
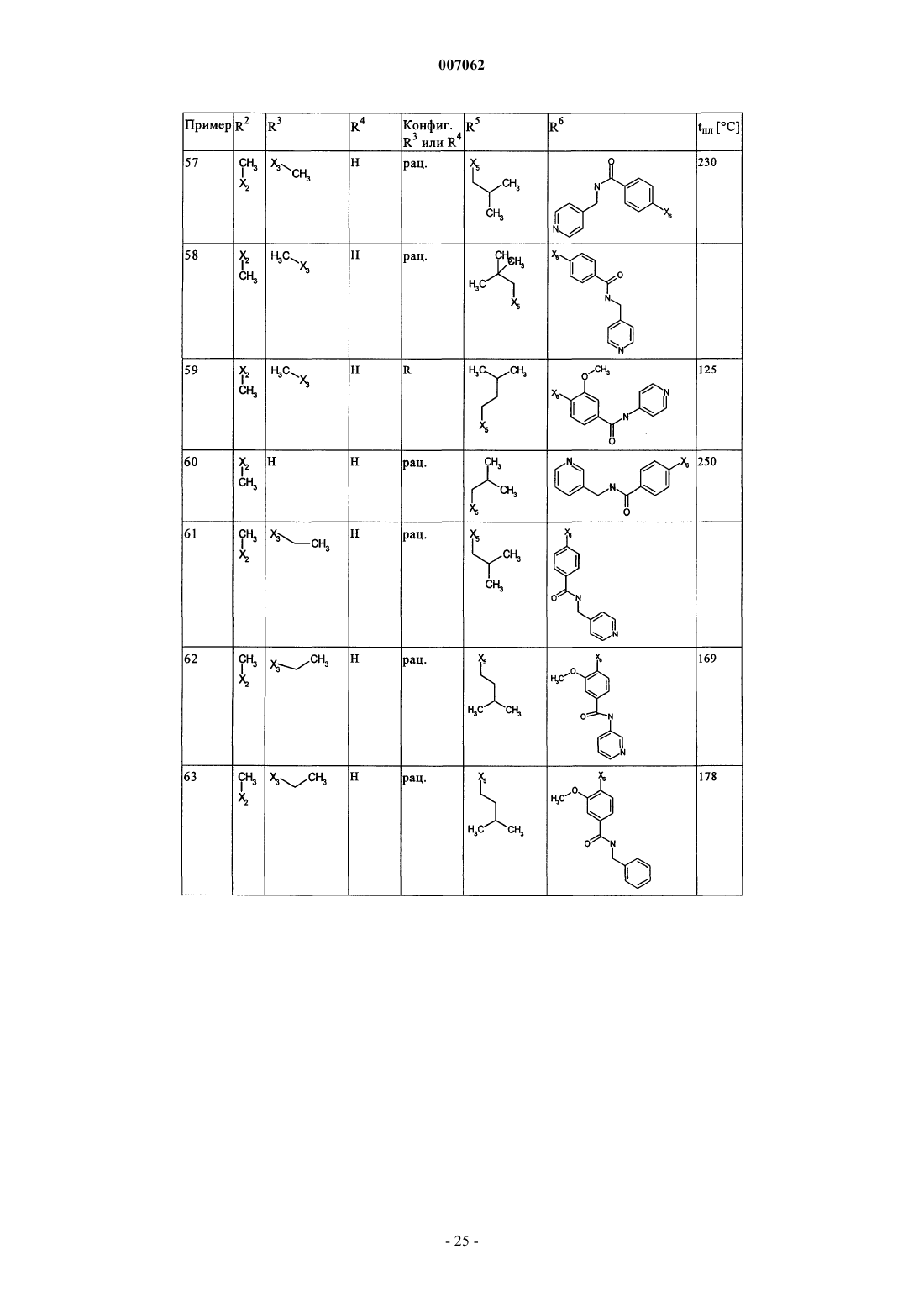
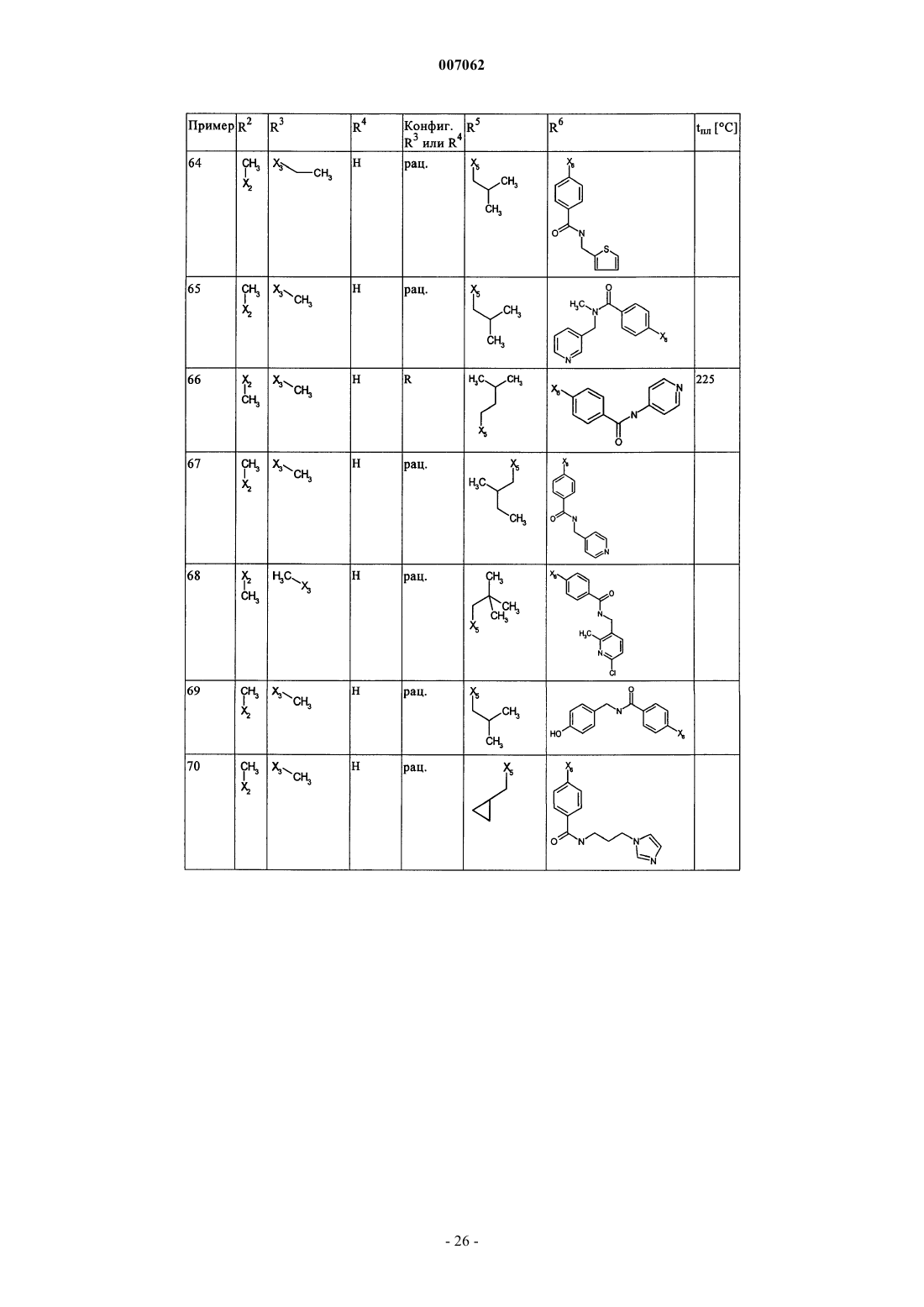
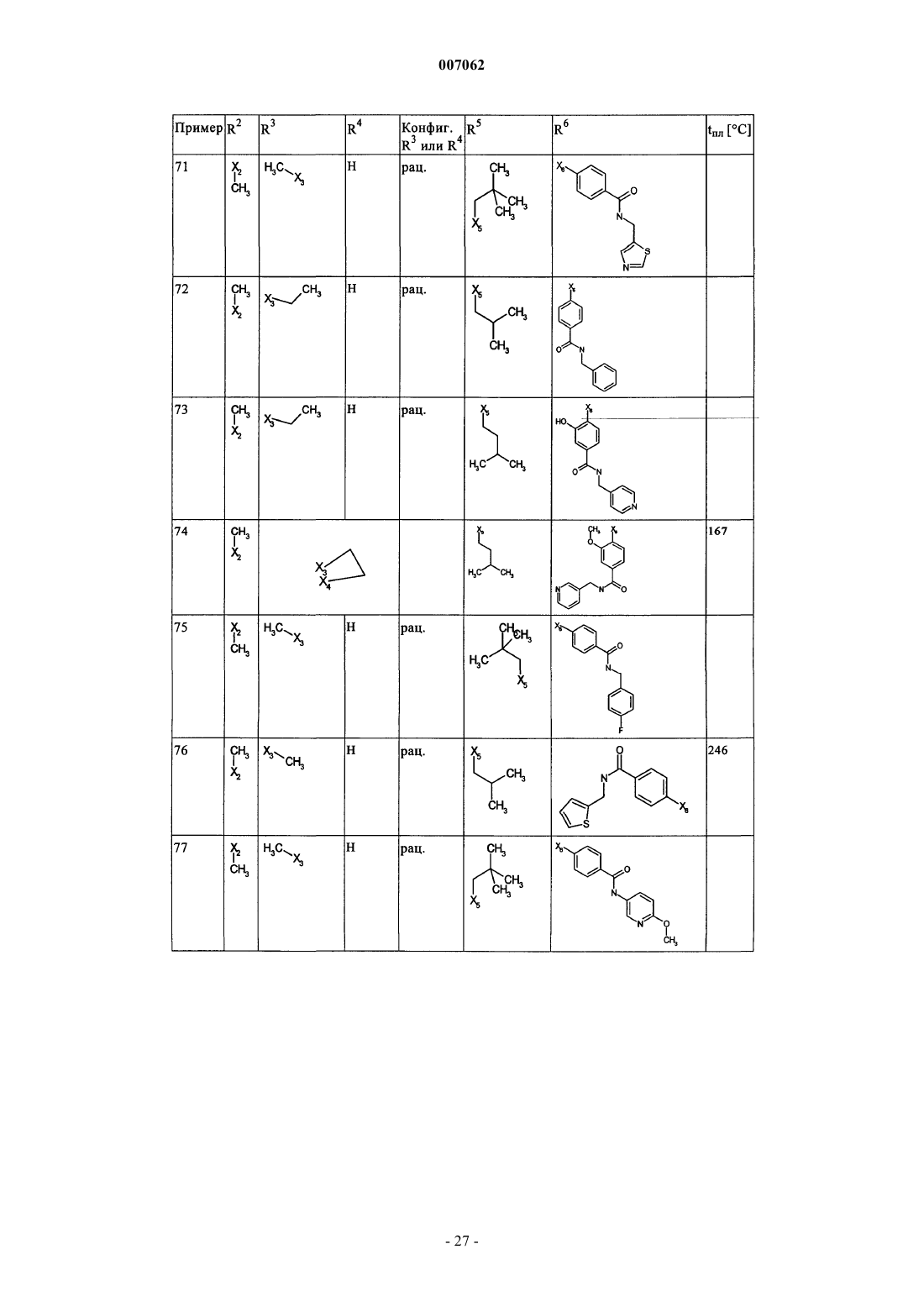
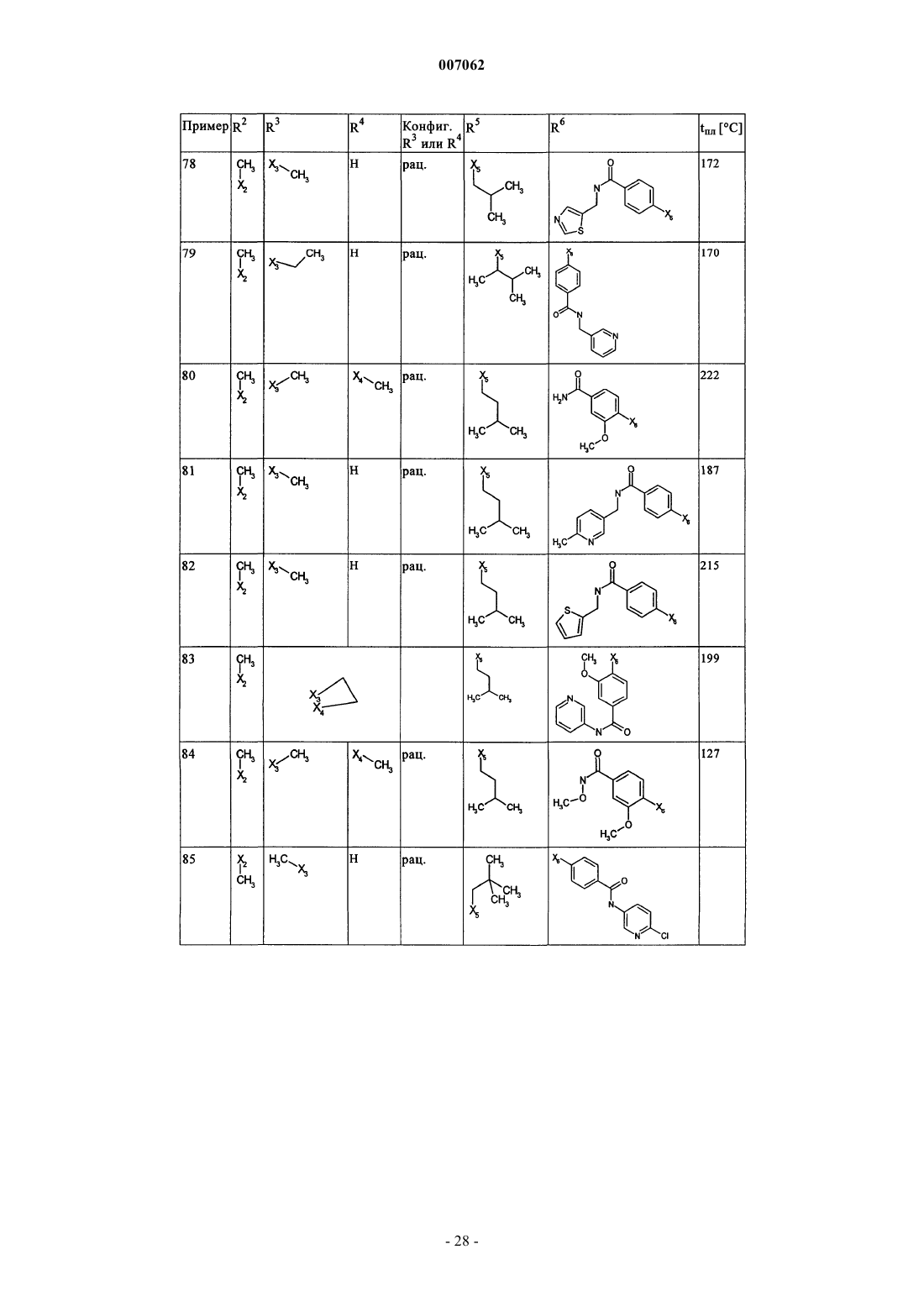
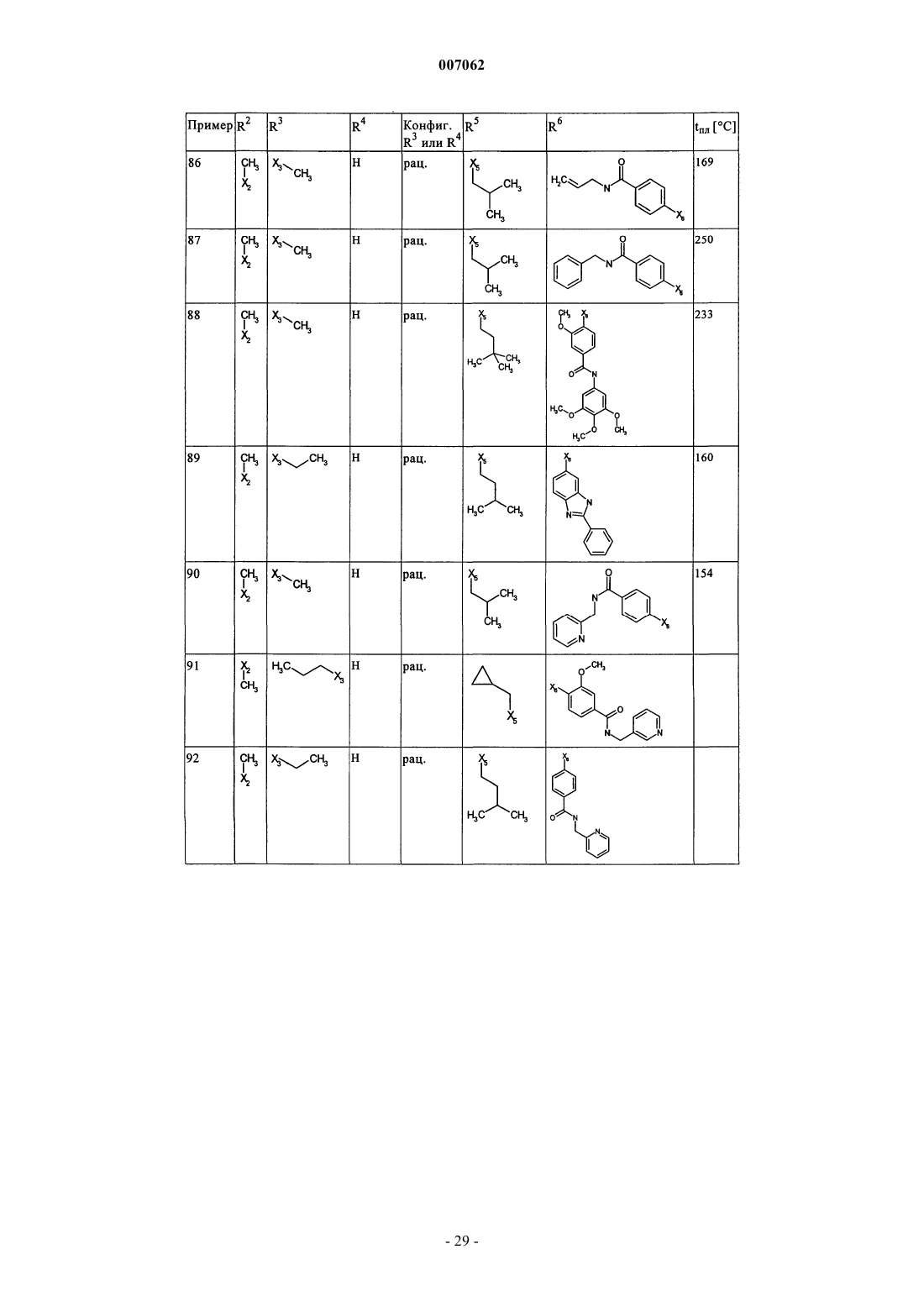
007062 Настоящее изобретение относится к новым дигидроптеридинонам общей формулы (I) в которой остатки X, R1, R2, R3, R4, R5, R6 и R7 имеют указанные в формуле изобретения и в описании значения, к их изомерам, к способам получения этих дигидроптеридинонов, а также к их применению в качестве лекарственных средств. Предпосылки создания изобретения Производные птеридинонов известны из уровня техники в качестве действующих веществ, обладающих антипролиферативным действием. Так, в частности, в заявке WO 01/019825 описывается применение производных птеридинонов для лечения онкологических и вирусных заболеваний. Устойчивость многих видов опухолей обусловливает необходимость разработки и создания новых высокоэффективных противоопухолевых лекарственных средств. Исходя из вышеизложенного, в основу настоящего изобретения была положена задача получить новые соединения, обладающие противовоспалительным и антипролиферативным действием. Подробное описание изобретения Настоящее изобретение относится к соединениям общей формулы (I)R1 представляет собой остаток, выбранный из группы, включающей водород, NH2 и необязательно замещенную одним либо несколькими атомами галогена C1-С 3 алкильную группу,R2 представляет собой остаток, выбранный из группы, включающей водород или необязательно замещенную C1-С 3 алкильную группу,R3 и R4 имеют идентичные или разные значения и представляют собой остаток, выбранный из группы, включающей необязательно замещенный C1-С 10 алкил, С 2-С 10 алкенил или С 2-С 10 алкинил, С 6 С 10 арил, или представляют собой остаток, выбранный из группы, включающей водород, COXR8, илиR3 и R4 вместе образуют 2-5-членный алкильный мостик,R5 представляет собой водород или остаток, выбранный из группы, включающей необязательно замещенный C1-С 10 алкил, С 2-С 10 алкенил, С 6-С 10 арил или С 3-С 6 циклоалкил, илиR3 и R5 либо R4 и R5 вместе образуют насыщенный или ненасыщенный С 3-С 4 алкильный мостик,R6 представляет собой необязательно замещенный С 6-С 10 арил или гетероарил,R7 представляет собой водород, и Х обозначает в каждом случае независимо от других его значений О или S,R8 представляет собой в каждом случае независимо от других его значений водород или остаток,выбранный из группы, включающей необязательно замещенный С 1-С 4 алкил, С 2-С 4 алкенил, С 2-С 4 алкинил и фенил,необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей. При создании изобретения было установлено, что перечисленные выше, составляющие предмет настоящего изобретения соединения общей формулы (I), а также другие соединения общей формулы (I),где остатки Х и R1-R7 имеют указанные ниже значения, а именно,R1 представляет собой остаток, выбранный из группы, включающей водород, NH2, XH, галоген и необязательно замещенную одним либо несколькими атомами галогена C1-С 3 алкильную группу,R2 представляет собой остаток, выбранный из группы, включающей водород, СНО, XH, -X-C1 С 2 алкил и необязательно замещенную C1-С 3 алкильную группу,R3 и R4 имеют идентичные или разные значения и представляют собой остаток, выбранный из группы, включающей необязательно замещенный С 1-С 10 алкил, С 2-С 10 алкенил, С 2-С 10 алкинил, арил, гетероарил, С 3-С 8 циклоалкил, С 3-С 8 гетероциклоалкил, -Х-арил, -Х-гетероарил, -Х-циклоалкил, -Х-гетероциклоалкил, -NR8-арил, -NR8-гетероарил, -NR8-циклоалкил и -NR8-гетероциклоалкил, или представляют собой остаток, выбранный из группы, включающей водород, галоген, COXR8, CON(R8)2, COR8 и XR8,илиR3 и R4 вместе образуют 2-5-членный алкильный мостик, который может содержать 1-2 гетероатома,R5 представляет собой водород или остаток, выбранный из группы, включающей необязательно замещенный C1-С 10 алкил, С 2-С 10 алкенил, С 2-С 10 алкинил, арил, гетероарил и С 3-С 6 циклоалкил, илиR3 и R5 либо R4 и R5 вместе образуют насыщенный или ненасыщенный С 3-С 4 алкильный мостик, который может содержать 1-2 гетероатома,R6 представляет собой необязательно замещенный арил или гетероарил,R7 представляет собой водород или -СО-Х-С 1-С 4 алкил и Х обозначает в каждом случае независимо от других его значений О или S,R8 представляет собой в каждом случае независимо от других его значений водород или остаток,выбранный из группы, включающей необязательно замещенный С 1-С 4 алкил, С 2-С 4 алкенил, С 2-C4 алкинил и фенил,необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей, неожиданно проявляют эффективность в качестве ингибиторов особых киназ, участвующих в регуляции клеточного цикла. Благодаря этому предлагаемые в изобретении соединения могут применяться, например, для лечения заболеваний, которые так или иначе связаны с активностью специфических киназ, участвующих в регуляции клеточного цикла, и при которых характерна избыточная или аномальная пролиферация клеток. Предпочтительными являются те соединения формулы (I), где Х и R6 имеют указанные выше значения, аR1 представляет собой водород,R2 представляет собой остаток, выбранный из группы, включающей группу СНО, ОН и СН 3,R3 и R4 имеют идентичные или разные значения и представляют собой остаток, выбранный из группы, включающей водород, необязательно замещенный C1-С 6 алкил, С 2-С 6 алкенил, С 2-С 6 алкинил и С 3-С 7 циклоалкил, илиR3 и R4 вместе образуют С 2-С 5 алкильный мостик,R5 представляет собой остаток, выбранный из группы, включающей необязательно замещенный C1 С 10 алкил, С 2-С 10 алкенил, С 2-С 10 алкинил, С 3-С 5 циклоалкил и С 3-С 6 циклоалкенил, илиR3 и R5 либо R4 и R5 вместе образуют насыщенный или ненасыщенный С 3-С 4 алкильный мостик, который может содержать 1-2 гетероатома, иR7 представляет собой водород,необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей. К особенно предпочтительным относятся те соединения формулы (I), гдеR1-R5, R7, R8 и Х имеют указанные выше значения, аR6 представляет собой остаток общей формулы где n обозначает 1, 2, 3 или 4,R9 представляет собой остаток, выбранный из группы, включающей необязательно замещенный C1 С 6 алкил, С 2-С 6 алкенил, С 2-С 6 алкинил, -CONH-C1-С 10 алкилен, -O-арил, -O-гетероарил, -O-циклоалкил,-O-гетероциклоалкил, арил, гетероарил, циклоалкил и гетероциклоалкил, или представляет собой остаток, выбранный из группы, включающей -O-С 1-С 6 алкил-Q1, -CONR8-C1-C10 алкил-Q1, -CONR8-С 2C10 алкенил-Q1, -CONR8-Q2, галоген, ОН, -SO2R8, -SO2N(R8)2, -COR8, -COOR8, -N(R8)2, -NHCOR8,CONR8O-C1-C10aлкил-Ql и CONR8O-Q2, гдеQ1 обозначает водород, -NHCOR8 или остаток, выбранный из группы, включающей необязательно замещенную -NH-арильную, -NH-гетероарильную, арильную, гетероарильную, С 3-С 8 циклоалкильную и гетероциклоалкильную группу, аQ2 обозначает водород или остаток, выбранный из группы, включающей необязательно замещенную арильную, гетероарильную, С 3-С 8 гетероциклоалкильную, С 3-С 8 циклоалкильную и С 1-С 4 алкил-С 3 С 8 циклоалкильную группу,R10 имеет идентичные или разные значения и представляет собой остаток, выбранный из группы,включающей необязательно замещенный C1-С 6 алкил, С 2-С 6 алкенил и С 2-С 6 алкинил, -O-C1-С 6 алкил, -OС 2-С 6 алкенил, -O-С 2-С 6 алкинил, С 3-С 6 гетероциклоалкил и С 3-С 6 циклоалкил, или представляет собой остаток, выбранный из группы, включающей водород, -СОNН 2, -COOR8, -OCON(R8)2, -N(R8)2, -NHCOR8,-NHCON(R8)2, -NO2 и галоген, или расположенные рядом друг с другом остатки R9 и R10 вместе образуют мостик общей формулыR11 представляет собой водород или С 1-С 2 алкил иR12 представляет собой водород или остаток, выбранный из группы, включающей необязательно замещенный фенил, пиридил, пиразинил, пиримидинил, пиридазинил, -C1-С 3 алкилфенил, -C1-С 3 алкилпиридил, -C1-С 3 алкилпиразинил, -C1-С 3 алкилпиримидинил и -C1-С 3 алкилпиридазинил,R13 представляет собой C1-С 6 алкил,необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей. Наиболее предпочтительны те соединения формулы (I), гдеR3-R6, R8 и Х имеют указанные выше значения, аR1 представляет собой водород,R2 представляет собой СН 3 иR7 представляет собой водород,необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей. Еще одним объектом изобретения являются соединения формулы (I), где Х и R1-R7 имеют указанные выше значения, для применения в качестве лекарственных средств. Особое значение придается согласно изобретению соединениям формулы (I), где Х и R1-R7 имеют указанные выше значения, для их применения в качестве лекарственных средств с антипролиферативным действием. Еще одним объектом изобретения является применение соединения формулы (I), где Х и R1-R7 имеют указанные выше значения, для получения лекарственного средства, предназначенного для лечения и/или предупреждения рака, инфекционных, воспалительных и аутоиммунных заболеваний. Еще одним объектом изобретения является способ лечения и/или предупреждения рака, инфекционных, воспалительных и аутоиммунных заболеваний, который отличается тем, что пациенту вводят эффективное количество соединения формулы (I), где Х и R1-R7 имеют указанные выше значения. Еще одним объектом изобретения являются фармацевтические композиции, содержащие в качестве действующего вещества одно либо несколько соединений общей формулы (I), где Х и R1-R7 имеют указанные выше значения, или его (их) физиологически приемлемые соли, при необходимости совместно с обычными вспомогательными веществами и/или носителями. Еще одним объектом изобретения является способ получения соединения общей формулы (I) где Х и R1-R7 имеют указанные выше значения, который отличается тем, что соединение общей формулы где R1-R5 и Х имеют указанные выше значения, a L обозначает уходящую группу, подвергают взаимодействию с необязательно замещенным соединением общей формулы (III) где R6 и R7 имеют указанные выше значения. Еще одним объектом изобретения является соединение формулы (II) где R1-R5 и X имеют указанные выше значения. Соединения формулы (II) представляют собой важные промежуточные продукты для получения предлагаемых в изобретении соединений общей формулы (I). Еще одним объектом изобретения является способ получения соединения общей формулы (I) где R6 представляет собой остаток общей формулыR9 представляет собой необязательно замещенный остаток -CONH-C1-С 10 алкилен или остаток, выбранный из группы, включающей -СОNR8-С 1-С 10 алкил-Q1, -СONR8-С 2-С 10 алкенил-Q1, -CONR8-Q2 иR1-R5, R7, R10, n и Х имеют указанные выше значения,который отличается тем, что соединение общей формулы (IA) где R1-R5, R7, R10 и n имеют указанные выше значения, a L обозначает уходящую группу, подвергают взаимодействию с первичным либо вторичным амином с получением соответствующего амида или со спиртом с получением соответствующего сложного эфира. Под алкильными группами как таковыми, равно как и под алкильными группами, которые являются компонентами других остатков, подразумеваются разветвленные и неразветвленные алкильные группы,содержащие от 1 до 10 атомов углерода, предпочтительно 1-6, особенно предпочтительно 1-4 атома углерода; в качестве примеров можно назвать метил, этил, пропил, бутил, пентил, гексил, гептил, октил,нонил и децил. При этом, если не указано иное, из числа вышеназванных соединений пропил, бутил,пентил, гексил, гептил, октил, нонил и децил включают также все возможные изомерные формы. Так,например, понятие "пропил" включает оба изомерных остатка н-пропил и изопропил, понятие "бутил" включает н-бутил, изобутил, втор-бутил и трет-бутил, понятие "пентил" включает изопентил, неопентил и т.д.-4 007062 В вышеназванных алкильных группах один или несколько атомов водорода при определенных условиях могут быть заменены на другие остатки. Так, например, эти алкильные группы могут быть замещены атомами галогена: фтора, хлора, брома или иода. Предпочтительны в качестве заместителей фтор и хлор, особенно предпочтителен из них хлор. При определенных условиях возможна также замена всех атомов водорода алкильной группы. В равной степени в вышеназванных алкильных группах, если не указано иное, возможна при определенных условиях замена одного или нескольких атомов водорода, например, на необязательно замещенный остаток, выбранный из группы, включающей CN, ОСОСН 3, арил, предпочтительно фенил, гетероарил, предпочтительно тиенил, тиазолил, имидазолил, пиридил, пиримидил или пиразинил, насыщенный либо ненасыщенный гетероциклоалкил, предпочтительно пиразолил, пирролидинил, пиперидинил,пиперазинил или тетрагидрооксазинил, аминный остаток, предпочтительно метиламин, бензиламин, фениламин или гетероариламин, насыщенные либо ненасыщенные бициклические кольцевые системы,предпочтительно бензимидазолил, и циклоалкил, предпочтительно циклогексил или циклопропил. Понятием "алкильный мостик" обозначаются, если не указано иное, разветвленные либо неразветвленные алкильные группы, содержащие 2-5 атомов углерода, например пропиленовые, изопропиленовые, н-бутиленовые, изобутильные, втор-бутильные, трет-бутильные и тому подобные мостики. Особенно предпочтительными являются пропиленовые и бутиленовые мостики. В названных алкильных мостиках 1-2 С-атома при определенных условиях могут быть заменены на один или несколько гетероатомов,выбранных из группы, включающей кислород, азот и серу. Под алкенильными группами (включая и те случаи, когда эти группы являются фрагментом других остатков) подразумеваются разветвленные либо неразветвленные алкенильные группы, содержащие от 2 до 10 атомов углерода, предпочтительно от 2 до 6, особенно предпочтительно 2-3 атома углерода, при условии, что они имеют по меньшей мере одну двойную связь. В качестве примера можно назвать этенил, пропенил, бутенил, пентенил и т.п. Если не указано иное, то из числа вышеназванных понятий пропенил, бутенил и т.п. включают все возможные изомерные формы. Так, например, понятие "бутилен" включает н-бутенил, 1-метилпропенил, 2-метилпропенил, 1,1-диметилэтенил, 1,2-диметилэтенил и т.д. В вышеназванных алкенильных группах, если не указано иное, один или несколько атомов водорода при определенных условиях могут быть заменены на другие остатки. Так, например, эти алкенильные группы могут быть замещены атомами галогена: фтора, хлора, брома или иода. Предпочтительны в качестве заместителей фтор и хлор, особенно предпочтителен из них хлор. При определенных условиях возможна также замена всех атомов водорода алкенильной группы. Под алкинильными группами (включая и те случаи, когда эти группы являются компонентами других остатков) подразумеваются разветвленные либо неразветвленные алкинильные группы, содержащие от 2 до 10 атомов углерода, при условии, что они имеют по меньшей мере одну тройную связь, в качестве примера можно назвать этинил, пропаргил, бутинил, пентинил, гексинил и т.п., предпочтительны из них этинил и пропинил. В вышеназванных алкинильных группах, если не указано иное, один или несколько атомов водорода при определенных условиях могут быть заменены на другие остатки. Так, например, эти алкинильные группы могут быть замещены атомами галогена, такого как фтор, хлор, бром или иод. Предпочтительны в качестве заместителей фтор и хлор, особенно предпочтителен из них хлор. При определенных условиях возможна также замена всех атомов водорода алкинильной группы. Понятием "арил" обозначается ароматическая циклическая система, содержащая от 6 до 14 атомов углерода, предпочтительно 6 или 10 атомов углерода, предпочтительно фенил, который, если не указано иное, может нести, например, один или несколько следующих заместителей: группу ОН, NO2, CN,-OCHF2, -ОСF3, -NH2, галоген, например фтор, хлор, бром либо иод, предпочтительно фтор либо хлор,C1-С 10 алкил, предпочтительно С 1-С 5 алкил, более предпочтительно C1-С 3 алкил, особенно предпочтительно метил или этил, -O-C1-С 3 алкил, предпочтительно -O-метил или -O-этил, -N-метилтетрагидрооксазинил, группу -СООН, -СОО-С 1-С 4 алкил, предпочтительно -СООСН 2 СН 3, -СОО-С(СН 3)3 или-СООСН 3, группу -CONH2, -CONH-C1-С 10 алкил, причем этот алкил в свою очередь при определенных условиях может быть замещен, необязательно замещенный -CONH-С 3-С 6 циклоалкил, предпочтительно необязательно замещенный -CONH-циклопентил, необязательно замещенный -CONH-гетероциклоалкил,предпочтительно пиперидинил, пирролидинил или пиперазинил, необязательно замещенный -CONHгетероарил, предпочтительно необязательно замещенный -CONH-пиридил, необязательно замещенный-CONH-арил, предпочтительно необязательно замещенный -CONH-фенил, -CONMeC1-С 3 алкил, причем этот алкил в свою очередь при определенных условиях может быть замещен, предпочтительно-СОNМеСН 2-пиридил, бензимидазол или остаток формулы В качестве 5-10-членных моно- или бициклических гетероарильных колец, в которых вплоть до трех С-атомов могут быть заменены на один или несколько гетероатомов, выбранных из группы, включающей кислород, азот и серу, можно назвать, например, фуран, тиофен, пиррол, пиразол, имидазол,триазол, тетразол, пиридин, пиридазин, пиримидин, пиразин, триазин, оксазол, изоксазол, тиазол, тиадиазол и оксадиазол, при этом каждый из вышеназванных гетероциклов может быть в свою очередь при определенных условиях аннелирован с бензольным кольцом, предпочтительно бензимидазолом, и, кроме того, эти гетероциклы, если не указано иное, могут нести, например, один или несколько следующих заместителей: группу ОН, NO2, CN, -OCHF2, -ОСF3, -NH2, галоген, предпочтительно фтор либо хлор, C1 С 10 алкил, предпочтительно С 1-С 5 алкил, более предпочтительно C1-С 3 алкил, особенно предпочтительно метил или этил, -O-C1-С 3 алкил, предпочтительно -O-метил или -O-этил, -N-метилтетрагидрооксазинил,группу -СООН, -СОО-С 1-С 4 алкил, предпочтительно -СОО-С(СН 3)3 или -СООСН 3, группу -CONH2, необязательно замещенный фенил, необязательно замещенный гетероарил, предпочтительно необязательно замещенный пиридил или пиразинил, -CONH-C1-С 10 алкил, причем этот алкил в свою очередь при определенных условиях может быть замещен, необязательно замещенный -CONH-С 3-С 6 циклоалкил, предпочтительно необязательно замещенный -CONH-циклопентил, необязательно замещенный -CONHгетероарил, предпочтительно необязательно замещенный -CONH-пиридил, необязательно замещенный-CONH-арил, предпочтительно необязательно замещенный -CONH-фенил, -CONMeC1-С 3 алкил, причем этот алкил в свою очередь при определенных условиях может быть замещен, предпочтительно-CONMeCH2-пиридил, бензимидазол или остаток формулы Под циклоалкильными остатками подразумеваются насыщенные либо ненасыщенные циклоалкильные остатки, содержащие от 3 до 8 атомов углерода, например циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил или циклооктил, предпочтительно циклопропил, циклопентил или циклогексил, при этом каждый из вышеназванных циклоалкильных остатков в свою очередь может нести при определенных условиях один или несколько заместителей, предпочтительно =O, или может быть аннелирован с каким-либо бензольным кольцом. "=O" обозначает присоединенный двойной связью атом кислорода. Под гетероциклоалкильными остатками подразумеваются, если не указано иное, 5-, 6- или 7 членные насыщенные либо ненасыщенные гетероциклы, которые могут содержать в качестве гетероатомов азот, кислород либо серу, например тетрагидрофуран, тетрагидрофуранон, -бутиролактон, -пиран,-пиран, диоксолан, тетрагидропиран, диоксан, дигидротиофен, тиолан, дитиолан, пирролин, пирролидин, пиразолин, пиразолидин, имидазолин, имидазолидин, тетразол, пиперидин, пиридазин, пиримидин,пиразин, пеперазин, триазин, тетразин, морфолин, тиоморфолин, диазепан, оксазин, тетрагидрооксазинил, изотиазол и пиразолидин, предпочтительно пиразолил, пирролидинил, пиперидинил, пиперазинил или тетрагидрооксазинил, при этом такой гетероцикл в свою очередь может быть при определенных условиях замещен. Понятием "галоген" обозначается, как правило, фтор, хлор, бром или иод. Под уходящей группой L, имеющей идентичные либо разные значения, подразумевается такая уходящая группа, как, например, хлор, бром, иод, метансульфонил, трифторметансульфонил или nтолуолсульфонил, предпочтительно хлор. Предлагаемые в изобретении соединения могут быть представлены в виде отдельных оптических изомеров, смесей отдельных энантиомеров, диастереомеров или рацематов, в виде таутомеров, а также в виде свободных оснований или соответствующих кислотно-аддитивных солей, образованных с фармакологически приемлемыми кислотами, например кислотно-аддитивных солей с галогеноводородными кислотами, такими как хлористо- или бромисто-водородная кислота, либо с органическими кислотами, такими как щавелевая, фумаровая, дигликолевая или метансульфоновая кислота. Заместитель R1 может представлять собой остаток, выбранный из группы, включающей водород,группу NH2, XH, предпочтительно группу ОН, галоген, предпочтительно фтор или хлор, и необязательно замещенную одним или несколькими, предпочтительно одним, двумя либо тремя атомами галогена,-6 007062 предпочтительно атомами фтора или хлора, C1-С 3 алкильную группу, предпочтительно метил или этил. Наиболее предпочтителен в качестве заместителя R1 водород. Заместитель R2 может представлять собой остаток, выбранный из группы, включающей водород,группу СНО, XH, предпочтительно группу ОН, -Х-С 1-С 2 алкил, предпочтительно -O-СН 3 или -O-СН 2 СН 3,и необязательно замещенную C1-С 3 алкильную группу, причем эта алкильная группа содержит предпочтительно 1-2 атома углерода, прежде всего один атом углерода, и при определенных условиях может быть замещена предпочтительно атомами галогена, прежде всего атомами фтора. Наиболее предпочтителен в качестве заместителя R2 метил. Заместители R3 и R4 могут быть идентичными или разными и представлять собой остаток, выбранный из группы, включающей необязательно замещенный C1-С 10 алкил, предпочтительно C1-С 6 алкил,прежде всего С 1-С 4 алкил, особенно предпочтительно метил, этил или пропил, прежде всего метил или этил, С 2-С 10 алкенил, предпочтительно этенил или пропенил, более предпочтительно этенил, С 2 С 10 алкинил, предпочтительно этинил или пропинил, арил, предпочтительно необязательно замещенный фенил, гетероарил, С 3-С 8 циклоалкил, предпочтительно циклопропил и циклобутил, С 3 С 8 гетероциклоалкил, -Х-арил, -Х-гетероарил, -Х-циклоалкил, -X-гетероциклоалкил, -NR8-арил, -NR8 гетероарил, -NR8-циклоалкил и -NR8-гетероциклил, или могут представлять собой остаток, выбранный из группы, включающей водород, галоген, COXR8, CON(R8)2, COR8 и XR8, предпочтительно водород, илиR3 и R4 могут совместно образовывать 2-5-членный алкильный мостик, предпочтительно этиленовый,пропиленовый или бутиленовый мостик, при этом пропиленовый, соответственно бутиленовый, мостик могут содержать 1-2 гетероатома, предпочтительно кислород, азот или серу, особенно предпочтителен из названных этиленовый мостик. Наиболее предпочтительным в качестве заместителя R3 является метил или этил, а в качестве заместителя R4 наиболее предпочтителен водород или метил. К особенно предпочтительным относятся такие соединения, в которых R3 и R4 обозначают метил. Все остатки, указанные в качестве значений заместителей R3 и R4, при определенных условиях могут быть замещены. Заместитель R5 может представлять собой водород или остаток, выбранный из группы, включающей необязательно замещенный C1-С 10 алкил, например C1-С 6 алкиларил или C1-С 6 алкилгетероарил,предпочтительно C1-С 6 алкил, прежде всего С 1-С 5 алкил, особенно предпочтительно пропил, бутил, пентил, гексил, -СН 2-циклогексил, (СН 2)1-2 циклопропил или (СН 2)4-ОСОСН 3, С 2-С 10 алкенил, предпочтительно пропенил, бутенил, пентенил или гексенил, прежде всего пропенил или гексенил, С 2-С 10 алкинил,предпочтительно пропинил, бутинил или пентинил, предпочтительно пропинил, арил, предпочтительно фенил, гетероарил, С 3-С 6 циклоалкил, предпочтительно циклопропил, циклобутил, циклопентил или циклогексил, и С 3-С 6 циклоалкенил, предпочтительно циклогексенил или циклопентенил, или заместители R3 и R5 либо R4 и R5 совместно образуют насыщенный либо ненасыщенный С 3-С 4 алкильный мостик, который может содержать 1-2 гетероатома, предпочтительно кислород, серу или азот. Все остатки, указанные в качестве значений заместителя R5, при определенных условиях могут быть замещены. Заместитель R6 может представлять собой необязательно замещенный арил или гетероарил, предпочтительно арил, прежде всего фенил. Наиболее предпочтителен в качестве заместителя R6 фенильный остаток, который может быть замещен одним из описанных ниже остатков R9 и R10, при этом фенильное кольцо может нести один из остатков R9, предпочтительно в пара-положении, и один, два, три либо четыре, предпочтительно один или два остатка R10, предпочтительно в орто- либо мета-положении. Заместитель R может представлять собой водород или -СО-Х-С 1-С 4 алкил, предпочтительно водород. Х в каждом случае независимо от других значений обозначает О или S, предпочтительно О. Остатки R8, указанные при раскрытии значений заместителей R3 и R4, представляют собой каждый независимо друг от друга водород или остаток, выбранный из группы, включающей необязательно замещенный С 1-С 4 алкил, С 2-С 4 алкенил, С 2-С 4 алкинил и фенил, предпочтительно водород и С 1-С 2 алкил. Заместитель R9 может представлять собой остаток, выбранный из группы, включающей необязательно замещенный C1-С 6 алкил, предпочтительно С 1-С 4 алкил, прежде всего метил, этил или пропил,особенно предпочтительно метил, С 2-С 6 алкенил, С 2-С 6 алкинил, -CONH-C1-С 10 алкилен, предпочтительно-CONH-C1-С 3 алкилен, прежде всего -CONH-C1-С 2 алкилен, -O-арил, предпочтительно О-С 6-С 10 арил, особенно предпочтительно O-фенил, -O-гетероарил, -O-циклоалкил, прежде всего O-С 3-С 6 циклоалкил, особенно предпочтительно O-циклопропил, -O-гетероциклоалкил, арил, предпочтительно С 6-С 10 арил, особенно предпочтительно фенил, гетероарил, циклоалкил, прежде всего С 3-С 6 циклоалкил, наиболее предпочтительно циклопропил, и гетероциклоалкил, или может представлять собой остаток, выбранный из группы, включающей -O-C1-С 6 алкил-Q1, -СОNR8-С 1-С 10 алкил-Q1, -CONR8-С 1-С 10 алкенил-Q1, -CONR8-Q2,галоген, например фтор, хлор, бром либо иод, группу ОН, -SO2R8, -SO2N(R8)2, -COR8, -COOR8, -N(R8)2,-NHCOR8, CONR8 ОС 1-С 10 алкил-Q1 и CONR8O-Q2, при этом Q1 и Q2 имеют указанные выше значения. Предпочтительно R9 представляет собой один из следующих остатков: -CONH-C1-С 10 алкил, прежде всего -CONH-C1-С 3 алкил, особенно предпочтительно -CONH-C1-C2 алкил, причем этот алкил в свою очередь при определенных условиях может быть замещен группой CN, необязательно замещенный арил, предпочтительно необязательно замещенный фенил, гетероарил, предпочтительно тиенил, тиазолил, имида-7 007062 золил, пиридил, пиримидил или пиразинил, насыщенный либо ненасыщенный гетероциклоалкил, предпочтительно пиразолил, пирролидинил, пиперидинил, пиперазинил или тетрагидрооксазинил, аминный остаток, предпочтительно метиламин, бензиламин, фениламин или гетероариламин, насыщенные либо ненасыщенные бициклические кольцевые системы, предпочтительно бензимидазолил и циклоалкил,прежде всего циклогексил. Кроме того, R9 представляет собой предпочтительно -CONH-гетероарил, предпочтительно -CONHпиридил, -CONH-С 3-С 10 циклоалкил, предпочтительно -СONН-циклопропил, -СONН-циклобутил или-CONH-циклопентил, наиболее предпочтительно -CONH-циклопропил; -CONH-С 3-С 10 гетероциклоалкил,-CONH-С 6-С 10 арил, предпочтительно -CONH-фенил, COO-C1-С 3 алкил, особенно предпочтительно СООСН 3, СООН, галоген, предпочтительно F или хлор, группу ОН или остаток формулы Все остатки, указанные при раскрытии значений заместителя R9, при определенных условиях могут быть замещены, предпочтительно одним или несколькими остатками, выбранными из группы, включающей ОН, ОСН 3, Сl, F, СН 3, СООН, CONHCH2Ph и СОNНСН 2-пиразинил-СН 3. Заместитель R10 может иметь соответственно идентичные либо разные значения и может представлять собой остаток, выбранный из группы, включающей необязательно замещенный C1-С 6 алкил, предпочтительно C1-С 3 алкил, С 2-С 6 алкенил, предпочтительно С 2-С 3 алкенил, и С 2-С 6 алкинил, предпочтительно С 2-С 3 алкинил, -O-C1-С 6 алкил, предпочтительно -O-C1-С 3 алкил,-O-С 2-С 6 алкенил, -O-С 2-С 6 алкинил, С 3 С 6 гетероциклоалкил и С 3-С 6 циклоалкил, или может представлять собой остаток, выбранный из группы,включающей водород, -CONH2, -COOR8, -OCON(R8)2, -N(R8)2, -NHCOR8)2, -NHCON(R8), -NO2 и галоген,например фтор, хлор, бром или иод. Предпочтительны в качестве заместителя R9 водород, метил, метоксигруппа, фтор или хлор, особенно предпочтительно водород или метоксигруппа, прежде всего метоксигруппа. Расположенные рядом друг с другом остатки R9 и R10 совместно могут образовывать мостик общей формулы где Y обозначает О, S или NR11, предпочтительно NR11,m обозначает 0, 1 или 2, предпочтительно 1,R11 представляет собой водород или C1-С 2 алкил, предпочтительно водород или метил, особенно предпочтительно водород,R12 представляет собой водород или остаток, выбранный из группы, включающей необязательно замещенный фенил, пиридил, пиразинил, пиримидинил, пиридазинил, -C1-С 3 алкилфенил, -C1-С 3 алкилпиридил, -C1-С 3 алкилпиразинил, -C1-С 3 алкилпиримидинил и -C1-С 3 алкилпиридазинил, предпочтительно фенил, пиридил и пиразинил, аR13 представляет собой C1-С 6 алкил, предпочтительно метил или этил. Предлагаемые в изобретении соединения можно синтезировать с помощью описанных ниже способов синтеза А и Б, при этом заместители в общих формулах (А 1)-(А 6) имеют указанные выше значения. Представленные способы служат лишь для более подробного пояснения изобретения, не ограничивая при этом его объем. Способ А. Стадия 1 А. Соединение формулы (А 1) взаимодействием с соединением формулы (А 2) превращают в соединение формулы (A3) (схема 1 А). Данную реакцию можно проводить согласно WO 00/43369 или WO 00/43372. Соединение (А 1) является коммерчески доступным продуктом и поставляется, в частности,фирмой City Chemical LLC, расположенной по адресу: 139 Allings Crossing Road, West Haven, CT, 06516,USA. Соединение (А 2) можно получать по известной из литературы методике: a) F. Effenberger, U. На стадии 1 А 1 экв. соединения (А 1) и 1-1,5 экв., предпочтительно 1,1 экв., соответствующего основания, предпочтительно карбоната калия, гидрокарбоната калия, карбоната натрия либо гидрокарбоната натрия, карбоната кальция, особенно предпочтительно карбоната калия, перемешивают в разбавителе,например в ацетоне, водном ацетоне, тетрагидрофуране, диэтиловом эфире или диоксане, предпочтительно в ацетоне или диэтиловом эфире, особенно предпочтительно в ацетоне. Далее при температуре в интервале от 0 до 15 С, предпочтительно от 5 до 10 С, по каплям добавляют 1 экв. аминокислоты формулы (А 2), растворенный в органическом растворителе, например в ацетоне, тетрагидрофуране, диэтиловом эфире или диоксане, предпочтительно в ацетоне. Реакционную смесь нагревают при перемешивании до температуры в интервале от 18 до 30 С, предпочтительно до примерно 22 С, и затем продолжают перемешивание в течение последующих 10-24 ч, предпочтительно примерно в течение 12 ч. После этого разбавитель отгоняют, остаток смешивают с водой и смесь дважды или трижды экстрагируют с помощью органического растворителя, например диэтилового эфира или этилацетата, предпочтительно этилацетата. Объединенные органические экстракты сушат, а растворитель отгоняют. Остаток (соединение(A3 можно без предварительной очистки использовать на стадии 2. Стадия 2 А. Полученное на стадии 1 А соединение (A3) восстанавливают по нитрогруппе и циклизуют с образованием соединения (А 4) (схема 2 А) Схема 2 А На стадии 2 А 1 экв. нитросоединения (A3) растворяют в соответствующей кислоте, предпочтительно в ледяной уксусной кислоте, муравьиной кислоте либо соляной кислоте, прежде всего в ледяной уксусной кислоте, и нагревают до 50-70 С, предпочтительно до примерно 60 С. Затем вплоть до завершения экзотермической реакции добавляют восстановитель, например цинк, олово или железо, предпочтительно железный порошок, и в течение 0,2-2 ч, предпочтительно в течение 0,5 ч, перемешивают при температуре в интервале от 100 до 125 С, предпочтительно при температуре порядка 117 С. После охлаждения до комнатной температуры соль железа отфильтровывают, а растворитель отгоняют. Остаток растворяют в соответствующем растворителе либо в смеси растворителей, например в этилацетате или в смеси дихлорметана/метанола, взятых в соотношении 9:1, и полунасыщенного раствора NaCl, и фильтруют, например, через кизельгур. Органическую фазу сушат и концентрируют. Остаток (соединение(А 4 можно очищать с помощью хроматографии или путем кристаллизации либо использовать его в качестве сырого продукта на стадии 3 А синтеза. Стадия 3 А. Полученное на стадии 2 А соединение (А 4) можно путем электрофильного замещения согласно схеме 3 А превращать в соединение формулы (А 5)-9 007062 На стадии 3 А 1 экв. амида формулы (А 4) растворяют в соответствующем органическом растворителе, например в диметилформамиде либо диметилацетамиде, предпочтительно в диметилацетамиде, и охлаждают до температуры в интервале от примерно -5 до +5 С, предпочтительно до 0 С. Затем добавляют 0,9-1,3 экв. гидрида натрия и 0,9-1,3 экв. алкилгалогенида, например метилиодида. Реакционную смесь в течение 0,1-3 ч, предпочтительно в течение 1 ч, перемешивают при 0-10 С, предпочтительно при температуре порядка 5 С, после чего в случае необходимости ее можно выдерживать в указанном интервале температур в течение последующих 12 ч. Затем реакционную смесь концентрируют и экстрагируют водой и органическим растворителем, предпочтительно дихлорметаном или этилацетатом. Органические фазы концентрируют. Остаток (соединение (А 5 можно очищать с помощью хроматографии предпочтительно на силикагеле. Стадия 4 А. Аминирование полученного на стадии 3 А соединения (А 5) с получением соединения формулы (А 7)(схема 4 А) можно осуществлять по известным из литературы методам, а именно, в соответствии со следующими вариантами: 4.1 А (a) M.P.V. Boarland, J.F.W. McOmie, J. Chem. Soc. (1951), сс. 1218-1221; б) Например, согласно варианту 4.1 А 1 экв. соединения (А 5) и 1-3 экв., предпочтительно 2 экв., соединения (А 6) без использования растворителя либо в соответствующем органическом растворителе,таком, например, как сульфолан, диметилформамид, диметилацетамид, толуол, N-метилпирролидон,диметилсульфоксид или диоксан, предпочтительно в сульфолане, нагревают до 100-220 С, предпочтительно до примерно 160 С, выдерживая при этой температуре в течение 0,1-4 ч, предпочтительно в течение 1 ч. После охлаждения добавлением органических растворителей либо смесей растворителей, например диэтилового эфира/метанола, этилацетата, метиленхлорида или диэтилового эфира, предпочтительно смеси диэтилового эфира/метанола в соотношении 9:1, продукт (А 7) кристаллизуют либо очищают его с помощью хроматографии. Согласно варианту 4.2 А 1 экв. соединения (А 5) и 1-3 экв. соединения (А 6) перемешивают с обратным холодильником в течение 1-48 ч, предпочтительно в течение примерно 5 ч, совместно с соответствующей кислотой, например с 1-10 экв. 10-38%-ной соляной кислоты, и/или с соответствующим спиртом, например этанолом, пропанолом, бутанолом, предпочтительно с этанолом. Выпавший в осадок продукт (А 7) отфильтровывают, при необходимости промывают водой, сушат и кристаллизуют из соответствующего органического растворителя. В том случае, когда R6 представляет собой необязательно замещенный бензимидазол, соединения(А 6) можно получать по методам, известным из литературы, например согласно следующей схеме: В соответствии с этим, например, 33 ммоль соединения (Z1), 49 ммоль соединения (Z2) и 49 ммоль 1-этоксикарбонил-2-этоксидигидрохинолина (ЭЭДХ) перемешивают в 50 мл органического растворителя, предпочтительно диметилформамида, при температуре в интервале от 100 до 130 С, предпочтительно порядка 115 С, в течение 1-4 ч, предпочтительно в течение примерно 3 ч. Затем охлажденный реакционный раствор сливают в 50-400 мл, предпочтительно в примерно 200 мл, смеси воды и этилацетата (их соотношение в смеси примерно 1:1). Образующиеся кристаллы (Z3) удаляют вакуум-фильтрацией и промывают. После этого 4,2 ммоль соединения (Z3) перемешивают с 12,5 ммоль хлорида олова(II) и 30- 10007062 ммоль карбоната калия в примерно 50 мл органического разбавителя, предпочтительно этилацетата, при температуре порядка 22 С в течение 4-48 ч, предпочтительно в течение примерно 24 ч. После добавления 22 г кизельгура экстрагируют органическим разбавителем либо смесью разбавителей, предпочтительно смесью дихлорметана и метанола (при их соотношении 9:1), объединенные экстракты концентрируют и образовавшийся осадок (Z4) или образовавшиеся кристаллы (Z4) выделяют. Стадия 5 А. В том случае, когда R9 представляет собой -CONR8-С 1-С 10 алкил-Q1, -СОNН-С 1-С 5 алкилен или-CONR8-Q2, при этом заместители имеют указанные выше значения, предлагаемые в изобретении соединения можно получать по методам, известным из литературы, например согласно схеме 5 А. Полученное на стадии 4 А соединение (А 7) можно либо путем омыления и последующего аминирования превращать в амид общей формулы (А 10) (схема (5 А), вариант 5.1 А), либо превращать путем омыления с последующим переводом в хлорангидрид кислоты (А 9) и завершающим аминированием Вариант 5.1 А. Согласно варианту 5.1 А, например 20 ммоль сложного эфира (А 7') в примерно 100 мл основания,предпочтительно 1 н. раствора гидроксида натрия или раствора гидроксида лития, и примерно 500 мл спирта, например этанола, диоксана или метанола, предпочтительно метанола, нагревают до момента полного превращения указанного эфира. Затем спирт отгоняют. Остаток растворяют в примерно 200 мл воды и при охлаждении подкисляют соответствующей кислотой, например соляной кислотой, предпочтительно 2 н. соляной кислотой. После этого продукт (А 8) отфильтровывают и сушат. Далее, например, приблизительно 0,5 ммоль соединения (А 8) растворяют вместе с примерно 0,5 ммоль тетрафторбората O-бензотриазол-N,N,N',N'-тетраметилурония (ТБТУ) и примерно 1,4 ммоль диизопропилэтиламина (ДИПЭА) в примерно 5 мл органического растворителя, такого, например, как тетрагидрофуран, диметилформамид, N-метилпирролидон или диметилацетамид. После добавления примерно 0,75 ммоль образующего заместитель R9 амина реакционную смесь в течение 0,1-24 ч, предпочтительно в течение примерно 12 ч, перемешивают при температуре в интервале от 20 до 100 С. В результате, например, кристаллизации или хроматографической очистки получают продукт формулы (А 10). Вариант 5.2 А. Согласно варианту 5.2 А, например, приблизительно 1 ммоль кислоты (А 8) суспендируют в примерно 2,7 мл тионилхлорида. Затем смесь нагревают до 40-80 С, предпочтительно до порядка 50 С, и поддерживая температуру на этом уровне, к реакционной смеси при перемешивании добавляют от 2 до 10 капель, предпочтительно 3 капли диметилформамида. Далее смесь до завершения реакции перемешивают при 90 С. Избыточный тионилхлорид отгоняют. Затем примерно 1 ммоль образовавшегося хлорангидрида кислоты (А 9) растворяют в примерно 30 мл органического разбавителя, например дихлорметана. После добавления образующего заместитель R9 амина перемешивают при температуре порядка 22 С. Образовавшийся осадок отфильтровывают и про- 11007062 мывают водой. Остаток промывают органическим разбавителем, например метанолом. Маточный раствор очищают, например, хроматографией и концентрируют. В результате получают продукт (А 10). Способ Б. В отличие от вышеописанного способа можно, как это показано на схеме Б, по известным из литературы методам после стадии 1 А сначала осуществлять аминирование соединения (A3), а затем циклизацию продукта (Б 1) с получением соединения (Б 2). Последующее замещение соединения (Б 2) с получением соединения (А 7) можно осуществлять, например, аналогично стадии 3 А. Схема Б Новые соединения общей формулы (I) можно синтезировать аналогично представленным ниже примерам. Эти примеры служат лишь для более подробного пояснения изобретения, не ограничивая при этом его объем. Пример 63 и пример 109. Для синтеза соединений 63 и 109 сначала получают описанным ниже путем промежуточное соединение 4- 12007062 38,9 мл (0,263 моль) этилового эфира 2-броммасляной кислоты и 36,4 г (0,263 моль) карбоната калия предварительно помещали в 350 мл этилацетата, а затем быстро добавляли по каплям 46,7 мл (0,402 моль) изоамиламина, растворенных в 70 мл этилацетата. Далее в течение 20 ч кипятили с обратным холодильником. Образовавшуюся соль отфильтровывали, фильтрат упаривали, смешивали с 50 мл толуола и повторно упаривали досуха. Выход: 54,3 г соединения 1 (масло красного цвета). 54,3 г соединения 1, растворенных в 400 мл ацетона, и 30,7 г (0,222 моль) карбоната калия охлаждали при перемешивании до 8 С, смешивали с 43,1 г (0,222 моль) 2,4-дихлор-5-нитропиримидина в 250 мл ацетона, после чего перемешивали в течение 24 ч при комнатной температуре. Образовавшуюся суспензию упаривали, остаток экстрагировали водой и этилацетатом, органическую фазу промывали водой и раствором NaCl, сушили над MgSO4 и упаривали досуха. Выход: 87,3 г соединения 2 (масло коричневого цвета). 44,1 г соединения 2 растворяли в 800 мл ледяной уксусной кислоты, нагревали до 65 С и смешивали порциями с 36 г железного порошка. После этого в течение 3 ч перемешивали при 70 С, осадок отфильтровывали и фильтрат упаривали. Остаток экстрагировали смесью дихлорметана и метанола (в их соотношении 90:10) с использованием силикагеля, упаривали и очищали хроматографией на колонке(элюент: этилацетат/циклогексан в соотношении 1:1). Остаток осаждали из смеси этилацетата и петролейного эфира. Выход: 16,1 г соединения 3 (порошок бежевого цвета). 16,1 г соединения 3 растворяли в 75 мл диметилацетамида и в атмосфере азота охлаждали при перемешивании до 5 С. Затем добавляли 2,51 г (0,063 моль) NaH, 60%-ная дисперсия в минеральном масле,при этом температура временно возрастала до 16 С. По истечении 30 мин добавляли 3,94 мл (0,063 моль) метилиодида, растворенных в 75 мл диметилацетамида и перемешивали в течение 24 ч при 22 С. Затем растворитель выпаривали, к смеси примешивали 200 мл воды, образовавшийся осадок отделяли вакуумфильтрацией и в завершение выделяли размешиванием с петролейным эфиром. Выход: 15,1 г соединения 4 (порошок желтого цвета). 1 Н-ЯМР (250 МГц): 7,80 (1 Н, s), 4,35 (m, 1H), 3,92 (m, 1H), 3,22 (s, 3H), 3,14 (m, 1H), 1,81 (m, 2H),1,60-1,40 (m, 3H), 0,90 (m, 6H), 0,70 (t, 3H). Синтез соединения из примера 63. 2,5 г соединения 4, 1,43 г 4-амино-3-метоксибензойной кислоты, 1,25 мл концентрированной соляной кислоты, 150 мл дистиллированной воды и 37,5 мл этанола кипятили в течение 10 ч с обратным холодильником. Осадок отфильтровывали, промывали водой и выделяли размешиванием в метаноле. Затем осадок перекристаллизовывали с помощью петролейного эфира и диэтилового эфира. Выход: 1,6 г соединения 5 (порошок белого цвета). 0,2 г соединения 5, 5 мл бензиламина, 0,16 ТБТУ и 0,17 г ДИПЭА растворяли в 2 мл диметилформамида (ДМФ) и перемешивали в течение 48 ч при комнатной температуре. Затем реакционную смесь растворяли в метиленхлориде, промывали водой и органическую фазу концентрировали. При добавлении петролейного эфира/этилацетата (в соотношении 9:1) продукт выпадал в осадок в виде кристаллов светло-бежевого цвета. Выход: 0,18 г, tпл: 178 С. Синтез соединения из примера 109. 5 г 2-амино-5-нитроанилина, 6,03 г 4-пиридилкарбоновой кислоты и 12,1 г ЭЭДХ растворяют в 50 мл ДМФ и перемешивают при 115 С в течение 1,75 ч, после чего ДМФ отгоняют в вакууме и реакционную смесь нагревают затем до 180 С, выдерживая ее при этой температуре в течение 1 ч. Остаток растворяют в 30 мл ДМФ и смешивают с 200 мл воды и 100 мл этилацетата. Образовавшуюся кристаллическую кашеобразную массу отфильтровывают и промывают водой, этилацетатом и простым эфиром. Выход: 5,8 г соединения 6. 2 г соединения 6 смешивают с 0,2 г 5%-ного Pd/C в 30 мл этанола и гидрируют в присутствии водорода. Затем концентрируют и кристаллизуют из этанола и толуола. Выход: 1,75 г соединения 7 в виде порошка белого цвета. 0,2 г соединения 5, 0,28 г соединения 7, 0,001 г трет-бутилата натрия, 2,5 мл диметилового эфира этиленгликоля, 0,006 г ацетата палладия(II) и 0,22 г 2-(ди-трет-бутилфосфин)бифенила растворяют в 1,5 мл N-метилпирролидона (N-МП). Затем раствор нагревают до 160 С с выдержкой при этой температуре в течение 0,5 ч. После этого реакционную смесь очищают с помощью 20 г силикагеля и целевой продукт кристаллизуют из простого эфира, этилацетата и петролейного эфира. Выход: 0,04 г кристаллов желтого цвета, tпл: 180 С. Примеры 218, 58 и 4. Для синтеза соединений 218, 58 и 4 сначала получают описанным ниже путем промежуточное соединение 11 55,8 г гидрохлорида метилового эфира DL-аланина растворяли в 500 мл метанола, после чего добавляли 76,1 мл 30%-ного раствора метилата натрия и соль отфильтровывали. К фильтрату добавляли 37,8 г триметилацетальдегида и затем оставляли стоять на 22 ч. Далее добавляли 9,5 г 10%-ного Pd/C и в течение 3,1 ч гидрировали при давлении 0,5 бара и 20 С. Реакционную смесь отфильтровывали через кизельгур вакуум-фильтрацией и упаривали. Остаток растворяли в диэтиловом эфире, соли фильтровали через кизельгур и фильтрат упаривали. Выход: 55,8 г соединения 8 (прозрачная жидкость). 48,5 г 2,4-дихлор-5-нитропиримидина предварительно помещали в 400 мл диэтилового эфира, затем добавляли 41,0 г гидрокарбоната калия в 400 мл воды и охлаждали до -5 С. Далее 43,3 г соединения 8 растворяли в 400 мл диэтилового эфира и по каплям добавляли при -5 С к первой смеси. Сначала в течение 1 ч перемешивали при -5 С, а затем в течение 2 ч при 0 С. После этого реакционную смесь нагревали до комнатной температуры и оставляли стоять на 24 ч. Органическую фазу отделяли, сушили над MgSO4 и упаривали досуха. Выход: 79,2 г соединения 9 (смола желтого цвета). 79,0 г соединения 9 растворяли в 1000 мл ледяной уксусной кислоты и нагревали до 70 С. После удаления источника нагрева порциями добавляли 52 г железа. Температура при этом поднималась до примерно 110 С и при такой температуре перемешивали в течение 1 ч. Суспензию фильтровали в горячем состоянии и фильтрат упаривали. Остаток растворяли в этилацетате и смешивали с 150 мл концентрированной НСl, затем органическую фазу отделяли, а водную фазу несколько раз экстрагировали дихлорметаном. Объединенные органические фазы упаривали, экстрагировали с использованием силикагеля и очищали хроматографией на колонке (элюент: петролейный эфир/этилацетат в соотношении 1:1). Поскольку, однако, выделенное вещество содержало еще значительное количество примесей, его повторно очищали с помощью силикагеля. Требуемое соединение выпадало в виде кристаллов и эти кристаллы отделяли вакуум-фильтрацией. Маточный раствор упаривали и перекристаллизовывали из смеси этилацетата и диэтилового эфира. Выход: 17,63 г соединения 10. 7,6 г соединения 10 и 6,4 мл метилиодида предварительно помещали в 75 мл диметилацетамида(ДМА) и охлаждали до -15 С. Затем порциями добавляли 1,25 г NaH, 60%-ная дисперсия в минеральном масле, и в течение 30 мин перемешивали при температуре в интервале от -10 до -5 С. Далее добавляли 150 мл смеси воды со льдом, образовавшиеся кристаллы отделяли вакуум-фильтрацией и промывали водой и петролейным эфиром. Затем кристаллы растворяли в дихлорметане, фильтровали через кизельгур и фильтрат упаривали досуха. В завершение перекристаллизовывали из петролейного эфира. Выход: 6,3 г соединения 11 (кристаллы бежевого цвета). 1 Н-ЯМР (250 МГц): 7,73 (1 Н, s), 4,35 (d, 1H), 4,25 (m, 1H), 3,35 (s, 3H), 2,55 (d, 1H), 1,3l (d, 3H), 0,95(s, 9H). Синтез соединения из примера 218. 0,2 г соединения 11, 3,5-дифтор-4-гидроксианилин и 0,75 мл сульфолана нагревали в течение 15 мин до 130 С, в течение 15 мин до 140 С и в течение 10 мин до 170 С. Затем смешивали с простым эфиром, надосадочный раствор декантировали, а остаток кристаллизовали из метанола/простого эфира и повторно перекристаллизовывали из метанола. Выход: 0,15 г кристаллов белого цвета, tпл: 250 С. Синтез соединения из примера 4. 6,3 г соединения 11 растворяли в 25 мл сульфолана при 100 С, после чего смешивали с 4,0 г этилового эфира 4-аминобензойной кислоты и нагревали в течение 1 ч до 170 С. Затем к смеси примешивали 50 мл простого эфира. После начавшейся кристаллизации добавляли еще 50 мл простого эфира и 50 мл метанола. Образовавшиеся кристаллы перекристаллизовывали из метанола. Выход: 6,6 г соединения 12 (кристаллы желтоватого цвета), tпл: выше 65 С начинается разложение. 3,55 г соединения 12 суспендировали в 250 мл метанола и смешивали при 60 С с 25 мл 4 н. едкого натра. По истечении 6 ч добавляли 15 мл ледяной уксусной кислоты, образовавшиеся кристаллы отфильтровывали и промывали смесью метанола и простого эфира. Выход: 1,2 г соединения 13 (кристаллы белого цвета). 1,5 г соединения 13 растворяли в 7,5 мл тионилхлорида и нагревали в течение 1 ч до 80 С. Затем отгоняли от тионилхлорида, остаток размешивали с простым эфиром, кристаллы отделяли вакуумфильтрацией и промывали простым эфиром. Выход: 1,7 г соединения 14 (кристаллы желтого цвета).- 14007062 0,18 г 3-аминопиридина растворяли в 10 мл тетрагидрофурана (ТГФ) и смешивали с 0,4 мл триэтиламина. После этого добавляли 0,22 г соединения 14 и в течение 16 ч перемешивали при комнатной температуре. Затем смесь упаривали досуха, растворяли в этилацетате, экстрагировали водой, повторно упаривали и продукт кристаллизовали из этилацетата. Выход: 0,07 г (кристаллы бежевого цвета), tпл: 215-216C. Синтез соединения из примера 58. 0,05 г соединения 13 суспендировали в 10 мл дихлорметана и затем смешивали с 0,15 мл ДИПЭА и 0,05 г ТБТУ. Далее раствор перемешивали в течение 30 мин и смешивали с 0,01 мл 4-пиколиламина. По истечении 18 ч смесь смешивали с 20 мл воды, органическую фазу отделяли и продукт очищали хроматографией на силикагеле, в завершение перекристаллизовывая его из этилацетата/петролейного эфира. Выход: 0,044 г (кристаллы белого цвета), tпл: 238-240 С. Примеры 65 и 125. Для синтеза соединений 65 и 125 сначала получают описанным ниже путем промежуточное соединение 18 28,3 г изобутиламина, 36 г этилового эфира R,S-2-бромпропионовой кислоты и 28 г карбоната калия кипятили в 150 мл этилацетата в течение 6 ч с обратным холодильником. После охлаждения соль отделяли вакуум-фильтрацией, а маточный раствор упаривали. Остаток смешивали со 100 мл толуола и упаривали досуха. Выход: 37,2 г соединения 15 (масло желтого цвета). 38,4 г 2,4-дихлор-5-нитропиримидина предварительно помещали в 300 мл диэтилового эфира, добавляли 30 г гидрокарбоната калия в 300 мл воды и охлаждали до 0 С. Далее 37,0 г соединения 15 растворяли в 300 мл диэтилового эфира и при 0-3 С добавляли по каплям к первой смеси. По истечении 3 ч фазы разделяли, органическую фазу сушили и упаривали досуха. Выход: 71,6 г соединения 16. 40,0 г соединения 16 растворяли в 300 мл ледяной уксусной кислоты и нагревали до 70 С. После удаления источника нагрева порциями добавляли 30 г железа. Температура при этом поднималась до 110 С. Далее реакционную смесь охлаждали до 90 С и в течение 20 мин перемешивали при этой температуре. Затем смесь фильтровали в горячем состоянии и фильтрат упаривали. Остаток размешивали с 300 мл воды и 300 мл дихлорметана и фильтровали через кизельгур. Фазы разделяли. Органическую фазу промывали водой, сушили над MgSO4 и упаривали досуха. В завершение продукт выделяли путем перемешивания из петролейного эфира. Выход: 26,7 г соединения 17. 15,0 г соединения 17 предварительно помещали в 100 мл ДМА, после чего добавляли 4,13 мл метилиодида и охлаждали до 5 С. Далее порциями добавляли 2,60 г NaH в виде 60%-ной дисперсии в минеральном масле. Температура при этом поднималась до 13 С. По истечении 30 мин добавляли 300 мл смеси воды со льдом, выпавшие в осадок кристаллы отделяли вакуум-фильтрацией и промывали петролейным эфиром. Выход: 13,9 г соединения 18. 1H-ЯМР (250 МГц): 7,95 (1 Н, s), 4,30 (m, 1H), 3,95 (m, 1H), 3,24 (s, 3H), 2,95 (m, 1H), 2,05 (m, 1H),1,30 (d, 3H), 0,96 (d, 3H), 0,92 (d, 3H). Синтез соединения из примера 65. 2,1 г соединения 18 смешивали в 10 мл сульфолана с этиловым эфиром 4-аминобензойной кислоты и перемешивали в течение 2 ч при 160 С. Затем смешивали с простым эфиром и выпавшие в осадок кристаллы промывали простым эфиром. Выход: 3,0 г соединения 19. 3 г соединения 19 смешивали с 200 мл метанола и 25 мл 4 н. NaOH и в течение 4 ч перемешивали при 60 С. Затем примешивали ледяную уксусную кислоту, выпавшие в осадок кристаллы отфильтровывали и промывали простым эфиром. Выход: 2,3 г соединения 20 (кристаллы белого цвета). 0,1 г соединения 20 суспендировали в 3 мл дихлорметана и 3 мл ДМФ и затем смешивали с 0,13 г ДИПЭА, 0,095 г ТБТУ и 0,045 г гидроксибензотриазола (ГОБТ). Далее раствор перемешивали в течение 30 мин и смешивали с 0,035 г N-метил-3-пиколиламина. По истечении 0,5 ч к смеси примешивали воду и 1 г карбоната калия, водную фазу дважды экстрагировали этилацетатом его порциями по 50 мл и продукт очищали хроматографией на силикагеле, в завершение перекристаллизовывая из этанола/ацетона.- 15007062 Выход: 0,08 г. Синтез соединения из примера 125. 3,7 г соединения 20, 3,8 г ТБТУ, 1,6 г ГОБТ и 5 мл ДИПЭА растворяли в 40 мл ДМФ и в течение 4 ч перемешивали при комнатной температуре. Затем смесь концентрировали, растворяли в 200 мл этилацетата и дважды экстрагировали 5%-ным раствором карбоната калия его порциями по 5 мл. Органическую фазу концентрировали, выпавшие в осадок кристаллы отфильтровывали и промывали этилацетатом и простым эфиром. Выход: 1,65 г соединения 21 (кристаллы желтоватого цвета). 0,486 г соединения 21 совместно с 0,33 г 1,2-фенилендиамина кипятили в 10 мл толуола в течение 0,5 ч с обратным холодильником, после чего смесь концентрировали. Остаток смешивали со 100 мл этилацетата и органическую фазу дважды экстрагировали водой. Затем органическую фазу концентрировали, выпавшие в осадок кристаллы отделяли вакуум-фильтрацией и промывали небольшим количеством этилацетата. Выход: 0,25 г соединения 22 (кристаллы белого цвета). 0,22 г соединения 22 перемешивали в 20 г полифосфорной кислоты в течение 0,5 ч при 150 С, после чего сливали на лед и смешивали с аммиаком. Затем дважды экстрагировали этилацетатом его порциями по 100 мл, органическую фазу промывали водой и концентрировали. Выпавший в осадок продукт (кристаллы) отделяли вакуум-фильтрацией и промывали этилацетатом и простым эфиром. Выход: 0,115 г кристаллов желтоватого цвета, tпл: 287 С (разложение). Пример 171. Для синтеза соединения 171 сначала получают описанным ниже путем промежуточное соединение 27 34,4 г N-изопентилбензиламина, 36,2 г этилового эфира 2-бромпропионовой кислоты и 42,0 г карбоната калия предварительно помещали в 250 мл ДМФ и перемешивали в течение 3 ч при 110 С. После охлаждения неорганические соли отфильтровывали и фильтрат упаривали. Остаток экстрагировали водой и диэтиловым эфиром, органическую фазу промывали водой, сушили и упаривали досуха. Выход: 55,5 г соединения 23. 55,5 г соединения 23 предварительно помещали в 600 мл этанола и в течение 20 мин гидрировали с помощью 20 мл 32%-ной НСl и 6 г 10%-ного Pd/C при 20 С и давлении 5 бар. Затем фильтровали через силикагель и упаривали. Остаток смешивали с 400 мл диэтилового эфира, осадок отделяли вакуумфильтрацией и промывали диэтиловым эфиром. Выход: 23,5 г соединения 24, tпл: 105C. 23,5 г соединения 24 растворяли в 200 мл воды и смешивали с 20,0 г (0,103 моль) 2,4-дихлор-5 нитропиримидина в 400 мл диэтилового эфира. После охлаждения реакционной смеси до -10 С порциями добавляли 50,0 г (0,499 моль) карбоната калия. Далее в течение 1 ч перемешивали при -5 С и в течение 1 ч при 0 С и затем нагревали до комнатной температуры. Водную фазу отделяли, а органическую фазу промывали водой, сушили и упаривали досуха. Выход: 36,9 г соединения 25. 20,0 г соединения 25 растворяли в 280 мл ледяной уксусной кислоты и нагревали до 70 С. После удаления источника нагрева добавляли 17 г железа. Температура при этом поднималась до 100 С, затем в течение 30 мин перемешивали при этой температуре. Далее смесь фильтровали в горячем состоянии и фильтрат упаривали. Остаток смешивали с 300 мл дихлорметана и 30 мл 32%-ной НСl, фазы разделяли,водную фазу экстрагировали дихлорметаном, объединенные органические фазы промывали водой и водным раствором аммиака, сушили и упаривали досуха. Остаток выделяли путем перемешивания с диэтиловым эфиром. Выход: 10,5 г соединения 26, tпл: 182-185 С. 2,7 г соединения 26 и 2,5 мл метилиодида предварительно помещали в 27 мл ДМА и охлаждали до-10 С. Далее добавляли 0,45 г NaH, 60%-ная дисперсия в минеральном масле, и в течение 30 мин перемешивали при -5 С. Затем добавляли 10 г льда и 5 мл 2 н. НСl и упаривали. Остаток экстрагировали этилацетатом и водой, органическую фазу сушили, упаривали досуха и фильтровали через силикагель. Выход: 3,0 г соединения 27 (масло). 1(d, 3H), 0,95 (m, 6H). Синтез соединения из примера 171.- 16007062 0,28 г соединения 27, 0,9 мл сульфолана и 0,22 г бензиламида n-аминобензойной кислоты перемешивали в течение 0,5 ч при 170 С, затем смесь смешивали с простым эфиром и выпавшие в осадок кристаллы отфильтровывали. В завершение продукт перекристаллизовывали из этанола. Выход: 0,15 г (кристаллы желтоватого цвета), tпл: 228-240 С. Аналогично вышеописанной методике получают среди прочих также соединения формулы (I),представленные в табл. 1. В этой табл. 1 для обозначения положения, в котором соответствующий остаток R2, R3, R4, R5 и R6 присоединен к остальной части молекулы приведенной перед табл. 1 общей формулы, используются символы Х 2, Х 3, Х 4, Х 5 и Х 6 соответственно. Таблица 1
МПК / Метки
МПК: A61P 35/00, A61P 31/18, A61K 31/505, C07D 487/04
Метки: применение, способы, дигидроптеридиноны, получения, новые, качестве, средств, лекарственных
Код ссылки
<a href="https://eas.patents.su/30-7062-novye-digidropteridinony-sposoby-ih-polucheniya-i-ih-primenenie-v-kachestve-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Новые дигидроптеридиноны, способы их получения и их применение в качестве лекарственных средств</a>