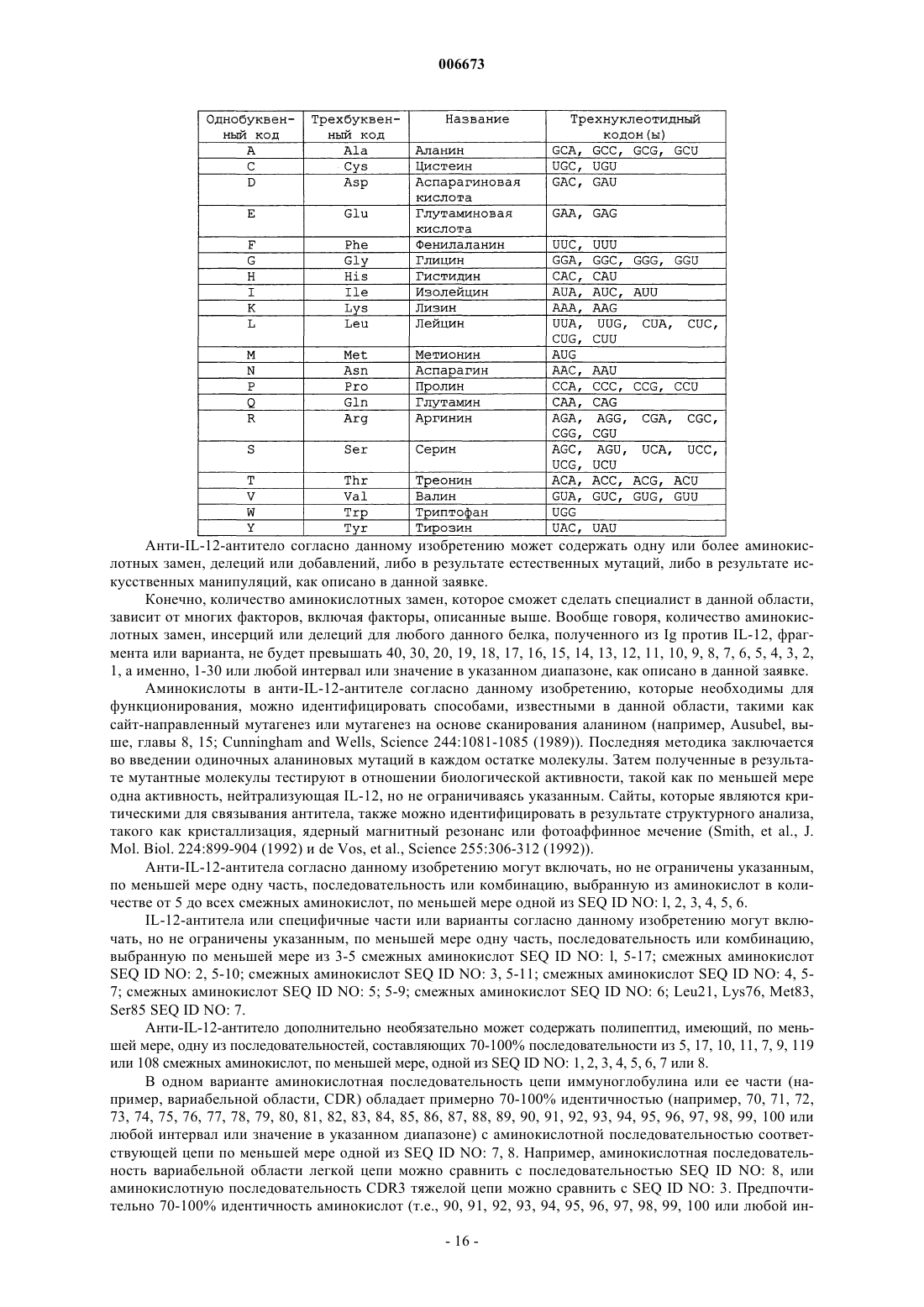
Антитела против il-12 и способы их применения
Номер патента: 6673
Опубликовано: 24.02.2006
Авторы: Перитт Дэвид, Шили Дэвид, Скэллон Бернард, Джайлс-Комар Джилл, Найт Дэвид М.
Формула / Реферат
1. Выделенное антитело против IL-12 млекопитающего, содержащее по меньшей мере одну вариабельную область, включающую по меньшей мере одну аминокислотную последовательность тяжелой цепи SEQ ID NO: 7 и одну аминокислотную последовательность легкой цепи SEQ ID NO: 8, причем указанное антитело специфично связывается по меньшей мере с одним эпитопом, включающим от 1-3 аминокислот до полной последовательности SEQ ID NO: 9.
2. Выделенная молекула нуклеиновой кислоты, кодирующая антитело по п.1.
3. Прокариотическая или эукариотическая клетка-хозяин, содержащая выделенную молекулу нуклеиновой кислоты по п.2.
4. Композиция, включающая антитело по п.1 и по меньшей мере один фармацевтически приемлемый носитель или разбавитель.
5. Способ диагностики или лечения связанного с IL-12 состояния в организме животном, предусматривающий введение указанному животному композиции по п.4 в эффективном количестве.
6. Выделенное антитело против IL-12 млекопитающего, содержащее все аминокислотные последовательности гипервариабельных областей (CDR) тяжелой цепи SEQ ID NO: 1, 2 и 3 и/или все аминокислотные последовательности CDR легкой цепи SEQ ID NO: 4, 5 и 6, причем указанное антитело специфично связывается по меньшей мере с одним эпитопом, включающим от 1-3 аминокислот до полной последовательности SEQ ID NO: 9.
7. Выделенная молекула нуклеиновой кислоты, кодирующая антитело по п.6.
8. Прокариотическая или эукариотическая клетка-хозяин, содержащая выделенную молекулу нуклеиновой кислоты по п.7.
9. Композиция, включающая антитело по п.6 и по меньшей мере один фармацевтически приемлемый носитель или разбавитель.
10. Способ диагностики или лечения связанного с IL-12 состояния в организме животного, предусматривающий введение указанному животному композиции по п.9 в эффективном количестве.
11. Выделенное антитело против IL-12 млекопитающего, содержащее по меньшей мере одну CDR-последовательность тяжелой цепи SEQ ID NO: 1, 2 и 3 и/или по меньшей мере одну CDR-последовательность легкой цепи SEQ ID NO: 4, 5 и 6, причем указанное антитело специфично связывается по меньшей мере с одним эпитопом, включающим от 1-3 аминокислот до полной последовательности SEQ ID NO: 9.
12. Выделенная молекула нуклеиновой кислоты, кодирующая антитело по п.11.
13. Прокариотическая или эукариотическая клетка-хозяин, содержащая выделенную молекулу нуклеиновой кислоты по п.12.
14. Композиция, включающая антитело по п.11 и по меньшей мере один фармацевтически приемлемый носитель или разбавитель.
15. Способ диагностики или лечения связанного с IL-12 состояния в организме животного, предусматривающий введение указанному животному композиции по п.14 в эффективном количестве.
16. Выделенное антитело против IL-12 млекопитающего, которое связывается с тем же самым эпитопом белка IL-12, что и антитело по п.11.
17. Выделенная молекула нуклеиновой кислоты, кодирующая антитело по п.16.
18. Прокариотическая или эукариотическая клетка-хозяин, содержащая выделенную молекулу нуклеиновой кислоты по п.17.
19. Композиция, включающая антитело по п.16 и по меньшей мере один фармацевтически приемлемый носитель или разбавитель.
20. Способ диагностики или лечения связанного с IL-12 состояния в организме животного, предусматривающий введение указанному животному композиции по п.19 в эффективном количестве.
Текст
006673 Область изобретения Данная заявка частично основана на, и имеет приоритет от предварительных заявок США 60/223358, поданной 7 августа 2000 г., и 60/236827, поданной 29 сентября 2000 г., каждая из которых включена в данную заявку в виде ссылки в полном объеме. Данное изобретение относится к антителам, включая определенные части или варианты, специфичные, по меньшей мере, по отношению к одному белку интерлейкина-12 (IL-12) или его фрагменту, а также к нуклеиновым кислотам, кодирующим такие анти-IL-12-антитела, комплементарным нуклеиновым кислотам, векторам, клеткам-хозяевам, способам их получения и применения, включая приготовление терапевтических композиций, введение и устройства. Область техники Интерлейкин-12 (IL-12)является гетеродимерным цитокином, состоящим из гликозилированных полипептидных цепей с молекулярной массой 35 и 40 кД, которые связаны дисульфидной связью. Цитокин синтезируется и секретируется антигенпрезентирующими клетками, включая дендритные клетки,моноциты, макрофаги, В-клетки, клетки Лангерганса и кератиноциты, а также природные клеткикиллеры (NK). IL-12 опосредует множество биологических процессов и был назван стимулирующим фактором NK-клеток (NKSF), стимулирующим фактором Т-клеток, фактором созревания цитотоксических Т-лимфоцитов и фактором линии В-клеток, трансформированных EBV (Curfs, J.H.A.J., et al., ClinicalMicrobiology Reviews, 10:742-780 (1997. Интерлейкин-12 может связываться с рецептором IL-12, экспрессированным на плазматической мембране клеток (например, Т-клеток, клеток NK), изменяя тем самым (например, инициируя, предотвращая) биологические процессы. Например, связывание IL-12 с рецептором IL-12 может стимулировать пролиферацию предварительно активированных Т-клеток и NK-клеток, усиливать цитолитическую активность цитотоксических Т-клеток (CTL), NK-клеток и клеток LAK (лимфокинактивированные клеткикиллеры), индуцировать продукцию гамма-интерферона (IFN-гамма) Т-клетками и NK-клетками и индуцировать дифференцировку нативных клеток Th0 в клетки Th1, которые продуцируют IFN-гамма и IL2 (Trinchieri, G., Annual Review of Immunology, 13:251-276 (1995. В частности, IL-12 необходим для образования цитолитических клеток (например, NK, CTL) и для усиления клеточного иммунного ответа(например, иммунного ответа, опосредованного Th1-клетками). Таким образом, IL-12 чрезвычайно важен для формирования и регуляции как защитного иммунитета (например, эрадикации инфекций), так и патологических иммунных ответов (например, аутоиммунитета) (Hendrzak, J. A. and Brunda, M.J., Laboratory Investigation, 72:619-637 (1995. Следовательно, иммунный ответ (например, защитный или патогенный) можно усилить, подавить или предотвратить, манипулируя биологической активностью IL-12 in vivo, например, с помощью антитела. Химерные, поликлональные (например, антисыворотка) и/или моноклональные антитела (мАт) и фрагменты (например, продукты их протеолитического расщепления или продукты гибридных белков) млекопитающего, отличного от человека, являются потенциальными терапевтическими средствами, которые исследуют в некоторых случаях, пытаясь лечить определенные заболевания. Однако такие антитела или фрагменты при введении человеку могут вызывать иммунный ответ. Такой иммунный ответ может приводить к опосредованному иммунными комплексами клиренсу антител или фрагментов из кровотока и делает повторное введение неприемлемым для терапии, тем самым снижая терапевтическую пользу для пациента и ограничивая повторное введение антитела или фрагмента. Например, повторное введение антител или фрагментов, содержащих части нечеловеческих антител, может приводить к сывороточной реакции и/или анафилаксии. Чтобы избежать указанных и других проблем, использовали ряд способов для того, чтобы уменьшить иммуногенность таких антител и их частей, включая химеризацию и гуманизацию, которые известны в данной области. Однако указанные и другие способы еще могут давать антитела или фрагменты, обладающие некоторой иммуногенностью, низкой аффинностью, низкой авидностью или вызывать проблемы, связанные с культивированием клеток, увеличением масштаба,продуктивностью и/или низкими выходами. Таким образом, такие антитела или фрагменты могут далеко не идеально подходить для производства или применения в качестве терапевтических белков. Таким образом, существует потребность в получении анти-IL-12-антител или фрагментов, которые позволяют преодолеть еще одну из указанных проблем, а также в улучшении известных антител или их фрагментов. Сущность изобретения Данное изобретение относится к выделенным химерным, гуманизированным и/или CDR-привитым анти-IL-12-антителам человека, примата, грызуна, млекопитающего, иммуноглобулинам, продуктам расщепления и их другим конкретным частям или вариантам, а также композициям анти-IL-12-антитела,кодирующим или комплементарным нуклеиновым кислотам, векторам, клеткам-хозяевам, композициям,составам, устройствам, трансгенным животным, трансгенным растениям и способам их получения и применения, которые описаны и объясняются в данной заявке в комбинации с тем, что известно в данной области.-1 006673 Данное изобретение также относится по меньшей мере к одному выделенному анти-IL-12-антителу,которое описано в данной заявке. Антитело согласно данному изобретению включает любой белок или пептид, содержащий молекулу, которая включает по меньшей мере часть молекулы иммуноглобулина,без ограничения, такую как по меньшей мере одна гипервариабельная область (CDR) тяжелой или легкой цепи или его лиганд-связывающая часть, вариабельная область тяжелой цепи или легкой цепи, константная область тяжелой цепи или легкой цепи, каркасная область или любая их часть, которая может быть включена в антитело согласно данному изобретению. Антитело согласно изобретению может включать или может быть получено из антитела любого млекопитающего, такого как человек, мышь, кролик, крыса, грызун, примат, или из любых их комбинаций и тому подобное, но не ограничено указанным. В одном аспекте данное изобретение относится к выделенным молекулам нуклеиновой кислоты,содержащим, комплементарным или гибридизующимся с полинуклеотидом, кодирующим по меньшей мере одно IL-12-антиидиотипическое антитело, содержащее по меньшее мере одну специфичную последовательность, домен, часть или вариант указанного антитела. Данное изобретение, кроме того, относится к рекомбинантным векторам, содержащим указанные молекулы нуклеиновых кислот, кодирующие IL12-антиидиотипическое антитело, клеткам-хозяевам, содержащим такие нуклеиновые кислоты и/или рекомбинантные векторы, а также к способам получения и/или применения таких нуклеиновых кислот антиидиотипических антител, векторов и/или клеток-хозяев. Данное изобретение также относится по меньшей мере к одному способу экспрессии по меньшей мере одного анти-IL-12-антитела или IL-12-антиидиотипического антитела в клетке-хозяине, включающему культивирование клетки-хозяина, которая описана в данной заявке, в условиях, при которых, по меньшей мере, одно анти-IL-12-антитело экспрессируется в регистрируемых и/или выделяемых количествах. Данное изобретение также относится по меньшей мере к одной композиции, содержащей (а) выделенную нуклеиновую кислоту, кодирующую анти-IL-12-антитело, и/или антитело, которое описано в данной заявке; и (b) подходящий носитель или разбавитель. Носитель или разбавитель может быть необязательно фармацевтически приемлемым, в соответствии с известными носителями и разбавителями. Композиция дополнительно необязательно может содержать по меньшей мере одно дополнительное соединение, белок или композицию. Данное изобретение, кроме того, относится по меньшей мере к одному способу или композиции анти-IL-12-антитела для введения терапевтически эффективного количества, чтобы модулировать или лечить по меньшей мере одно связанное с IL-12 состояние клетки, ткани, органа, животного или пациента перед и/или после, и/или во время связанного состояния, которое описано в данной заявке. Данное изобретение также относится по меньшей мере к одной композиции, устройству и/или способу доставки терапевтически или профилактически эффективного количества по меньшей мере одного анти-IL-12-антитела согласно данному изобретению. Данное изобретение, кроме того, относится по меньшей мере к одному способу или композиции анти-IL-12-антитела для диагностики по меньшей мере одного связанного с IL-12 состояния клетки, ткани,органа, животного или пациента до и/или после, и/или во время связанного состояния, как описано в данной заявке. Данное изобретение также относится по меньшей мере к одной композиции, устройству и/или способу доставки с целью диагностики по меньшей мере одного анти-IL-12-антитела согласно данному изобретению. Описание фигур Фиг. 1 А и 1 В представляют собой графики, показывающие зависимое от концентрации связывание анти-IL-12-мАт с иммобилизованным IL-12 человека. Анти-1L-12-антитела серийно разводили в 1% БСА/ФСБ и инкубировали на планшетах, покрытых rhIL-12, в течение 1 ч при 37 С. Планшеты дважды промывали 0,02% твином 20 (полиоксиэтилен(20)сорбитанмонолаурат), 0,15 М физиологическим раствором и затем исследовали с помощью меченного пероксидазой хрена (HRP)антитела козы, специфичного против каппа IgG человека, в течение 1 ч при комнатной температуре. Планшеты снова промывали, проявляли с помощью субстрата орто-фенилендиамина (OPD) и измеряли оптическую плотность (OD) каждой лунки при 490 нм. Фиг. 2: Дорожки слева направо на фиг. А и В содержат IL-12 человека, р 40 IL-12 человека, мышиный IL-12 и предварительно окрашенные маркеры молекулярной массы. На фиг. 2 А показаны полосы окрашенного суммарного белка. Основные полосы для каждой дорожки представляют собой IL-12 человека (75 кД), р 40 IL-12 человека (40 кД) и мышиный IL-12 (75 кД). На фиг. 2 В показан вестерн-блот, полученный из геля, идентичного гелю, показанному на фиг. 2 А. Блот подвергали реакции с С 340, затем с меченным HRP антителом козы против IgG человека и специфично выявляли только IL-12 (мономер или мультимеры) и р 40 IL-12 человека. На контрольном блоте (не показан), который подвергали реакции с меченным HRP антителом козы против IgG человека, не наблюдали никаких полос. Фиг. 3: Анализ с помощью обратной транскрипции-ПЦР экспрессии гена IFN в PBL человека, обработанных IL-2, IL-12, IL-2+IL-12 в присутствии или без анти-IL-12-антитела С 340, 8.6.2, изотипического контрольного антитела. Суммарную РНК обратно транскрибировали, амплифицировали в ПЦР,-2 006673 используя геноспецифичные праймеры. Также определяли уровень мРНК -актина в каждом образце,который служил в качестве контроля целостности и содержания мРНК. Фиг. 4 является гистограммой, показывающей, что анти-IL-12-мАт человека (С 340) ингибирует продукцию интерферона- (IFN) истощенными по моноцитам мононуклеарными клетками периферической крови (РВМС) CD3+, стимулированным IL-2 плюс IL-12. PBMC культивировали в течение 5 ч в контрольных средах (без добавления цитокинов), средах с добавлением IL-12 (0,1 нг/мл) плюс IL-2 (50IU/мл) (IL-12/IL-2), контрольных средах, содержащих мАт С 340 (10 мкг/мл) и IL-12/IL-2-средах, содержащих мАт С 340 (10 мкг/мл). Внутриклеточный IFN измеряли с помощью двойного иммунного окрашивания CD3-PE и IFN-ФИТЦ. Показаны данные для одного донора. Фиг. 5 представляет собой график, на котором показано зависимое от дозы ингибирование секрецииIFN лимфоцитами периферической крови, стимулированными IL-2 плюс IL-12, двумя разными партиями анти-IL-12-мАт человека (С 340). PBL человека (8 х 106/мл) культивировали в течение 24 ч с 10 U/млIL-2, IL-2 плюс 400 пг/мл IL-12 или IL-2 плюс IL-12 и мАт С 340, как указано. Извлекали надосадки культур и анализировали в отношении IFN посредством ИФА. Фиг. 6 представляет собой гистограмму, на которой показано зависимое от дозы ингибирование клеточной цитотоксичности LAK, индуцированной IL-12 плюс IL-2, с помощью анти-IL-12-мАт человека (С 340). Эффекторные клетки LAK (PBL человека, 8 х 106/мл) культивировали в течение 24 ч с IL-12LAK промывали и культивировали с 51Cr-мечеными клетками-мишенями Raji в течение 4 ч при соотношении эффектор:мишень (Е:Т), равном 80:1, и измеряли количество 51Cr, высвободившегося в среду в результате лизиса клеток Raji. Результаты выражены в виде среднего значения для трех здоровых доноров стандартной ошибки. Позитивным в отношении IL-12 контролем (IL-12) являются эффекторные клетки, инкубированные с IL-12 в отсутствие антитела. Фон (BKGD) представляет собой эффекторные клетки, инкубированные без IL-12 или антитела. Фиг. 7 А и 7 В являются гистограммами, показывающими, что индуцированная IL-12 плюс IL-2 экспрессия CD95 на мононуклеарных клетках периферической крови CD3+ ингибируется анти-IL-12-мАт человека (С 340). РВМС культивировали в течение 72 ч в средах, содержащих 0,1 нг/мл IL-12 и субоптимальную дозу IL-2 (50 IU/мл), в присутствии или в отсутствие мАт С 340 (10 мкг/мл). Экспрессию CD95 измеряли проточной цитометрией клеток, окрашенных анти-CD95-ФИТЦ. Пропускание осуществляли,используя анализ с двумя красителями (CD3 или CD56-PE по сравнению с CD95-ФИТЦ) и прямое светорассеяние по сравнению с ортогональным. Фиг. 8 представляет собой график, показывающий, что рекомбинантные антитела человека противIL-12 человека (rC340) связываются с иммобилизованным IL-12 таким образом, который не отличается от очищенного мАт С 340. Определяли концентрацию rС 340 в надосадке трех продуцирующих rC340 рекомбинантных клеточных линий, и надосадки оценивали в отношении связывания IL-12 в ELISA. Планшеты покрывали 2 мкг/мл IL-12 человека и инкубировали с очищенным мАт С 340 из исходной гибридомы (стандарт) или с надосадками рекомбинантных клеточных линий. Связанное с IL-12 антитело выявляли, используя конъюгированное со щелочной фосфатазой антитело козы против IgG человека(тяжелая цепь + легкая цепь). Фиг. 9 А-9 С представляют собой графики, на которых показаны кинетики роста и количество антитела, секретированного тремя независимо полученными субклонами рекомбинантных клеток, продуцирующих rC340 (фиг. 9 А, субклон С 379 В; фиг. 9 В, субклон С 381 А; фиг. 9 С, субклон С 389 А). Рекомбинантные клетки высевали во флаконы Т 75 при исходной плотности 2 х 105 клеток/мл в стандартных средах. В разных временных точках клетки ресуспендировали и определяли количество живых клеток и количество (мкг/мл) rC340 в средах. Описание изобретения Данное изобретение относится к выделенным, рекомбинантным и/или синтетическим анти-IL-12 антителам человека, примата, грызуна, млекопитающего, химерным, гуманизированным или CDRпривитым антителам и, кроме того, к IL-12-антиидиотипическим антителам, а также композициям и молекулам кодирующих нуклеиновых кислот, содержащим по меньшей мере один полинуклеотид, кодирующий по меньшей мере одно анти-IL-12-антитело или антиидиотипическое антитело. Данное изобретение, кроме того, включает, но не ограничено указанным, способы получения и применения таких нуклеиновых кислот и антител и антиидиотипических антител, включая диагностические и терапевтические композиции, способы и устройства. В используемом в данном описании смысле термины антитело против интерлейкина-12, антиIL-12-антитело, часть анти-IL-12-антитела или фрагмент анти-IL-12-антитела и/или вариант антиIL-12-антитела и тому подобное включают любой белок или пептид, содержащий молекулу, которая включает по меньшей мере часть молекулы иммуноглобулина, без ограничения, такую как по меньшей мере одна гипервариабельная область (CDR) тяжелой или легкой цепи или его лиганд-связывающая часть, вариабельная область тяжелой цепи или легкой цепи, константная область тяжелой цепи или легкой цепи, каркасная область или любая их часть, или по меньшей мере одна часть рецептора IL-12 или-3 006673 связывающего белка, которая может быть включена в антитело согласно данному изобретению. Такое антитело дополнительно необязательно оказывает влияние на специфичный лиганд, без ограничения,такое как влияние, при котором такое антитело модулирует, уменьшает, увеличивает, оказывает антагонистическое действие, агонистическое действие, ослабляет, смягчает, блокирует, ингибирует, отменяет и/или препятствует по меньшей мере одной активности или связыванию IL-12 или активности или связыванию рецептора IL-12 in vitro, in situ и/или in vivo. В качестве неограничивающего примера подходящее анти-IL-12-антитело, специфичная часть или вариант согласно данному изобретению может связывать по меньшей мере один IL-12 или его специфичные части, варианты или домены. Подходящее антиIL-12-антитело, специфичная часть или вариант также необязательно может влиять по меньшей мере на одну активность или функцию IL-12, без ограничения, такую как синтез РНК, ДНК или белка, высвобождение IL-12, передачу сигнала рецептора IL-12, расщепление мембранного IL-12, активность IL-12,продукцию и/или синтез IL-12. Кроме того, подразумевается, что термин антитело охватывает антитела, фрагменты расщепления, их специфичные части и варианты, включая антитело, имитирующее или содержащее части антител, которые имитируют структуру и/или функцию антитела или его специфичного фрагмента или части, включая одноцепочечные антитела и их фрагменты. Функциональные фрагменты включают антигенсвязывающие фрагменты, которые связываются с IL-12 млекопитающих. Например, изобретение охватывает фрагменты антител, способные связываться с IL-12 или его частями, включая, но не ограничиваясь указанным, фрагменты Fab (например, при расщеплении папаином), Fab' (например, при расщеплении пепсином и частичном восстановлении) и F(ab')2 (например, при расщеплении пепсином), facb (например, при расщеплении плазмином), pFc' (например, при расщеплении пепсином или плазмином), Fd (например, при расщеплении пепсином, частичном восстановлении и повторной агрегации), Fv или scFv (например, способами молекулярной биологии) (см., например, Colligan, Immunology, выше). Указанные фрагменты можно получить ферментативным расщеплением, синтетическими или рекомбинантными способами, которые известны в данной области и/или описаны в данной заявке, антитела также можно получить в различных укороченных формах, используя гены антител, в которые были введены один или более стоп-кодонов выше естественного стоп-сайта. Например, можно сконструировать комбинированный ген, кодирующий часть тяжелой цепи F(ab')2 включающую последовательности ДНК, кодирующие домен СН 1 и/или шарнирную область тяжелой цепи. Различные части антител можно химически соединять вместе обычными способами или можно получать в виде непрерывного белка, используя способы генной инженерии. В используемом в данном описании смысле термин антитело человека относится к антителу, в котором по существу каждая часть белка (например, CDR, каркас, домены CL, Сн (например, Сн 1, Сн 2,Сн 3), шарнир, (VL, Vн) ) по существу не иммуногенна у человека и имеет только незначительные изменения последовательности или вариации. Подобным образом, антитела, называемые антителами приматов(обезьяна, бабуин, шимпанзе и т.д.), грызунов (мышь, крыса, кролик, морская свинка, хомячок и тому подобное) и других млекопитающих, обозначают антитела, специфичные для таких видов, подродов,родов, подсемейств, семейств. Кроме того, химерные антитела включают любую комбинацию указанных выше антител. Такие изменения или вариации необязательно и предпочтительно сохраняют или уменьшают иммуногенность у человека или других видов по сравнению с немодифицированными антителами. Таким образом, антитело человека отличается от химерного или гуманизированного антитела. Показано,что антитело человека может продуцироваться животным, отличным от человека, или прокариотической или эукариотической, клеткой, которая способна экспрессировать функционально реаранжированные гены иммуноглобулинов человека (например, тяжелой цепи и/или легкой цепи). Кроме того, в том случае, когда антитело человека является одноцепочечным антителом, оно может содержать линкерный пептид, который не встречается в нативных антителах человека. Например, Fv может содержать линкерный пептид, такой как пептид, имеющий от двух до примерно восьми глицинов или других аминокислотных остатков, который связан с вариабельной областью тяжелой цепи и вариабельной областью легкой цепи. Считают, что такие линкерные пептиды имеет человеческое происхождение. Также можно использовать биспецифичные, гетероспецифичные, гетероконъюгированные или сходные антитела, которые являются моноклональными, предпочтительно человеческими или гуманизированными антителами, которые обладают специфичностями связывания по отношению, по меньшей мере, к двум разным антигенам. В данном случае одна из специфичностей связывания относится, по меньшей мере, к одному белку IL-12, а другая относится к любому другому антигену. Способы получения биспецифичных антител известны в данной области. Традиционно рекомбинантная продукция биспецифичных антител основана на совместной экспрессии двух пар тяжелая цепь-легкая цепь иммуноглобулина, в которых две тяжелые цепи обладают разными специфичностями (Milstein and Cuello, Nature 305:537 (1983. Вследствие случайной сортировки тяжелых и легких цепей иммуноглобулина указанные гибридомы (квадромы) продуцируют потенциальную смесь из 10 разных молекул антител, из которых только одно имеет правильную биспецифичную структуру. Очистка правильной молекулы, которую обычно осуществляют в несколько стадий аффинной хроматографии, является довольно громоздкой, а выходы продукта низкими. Подобные методики описаны, например в WO 93/08829, патентах США No-4 006673 6210668, 6193967, 6132992, 6106833, 6060285, 6037453, 6010902, 5989530, 5959084, 5959083, 5932448,5833985, 5821333, 5807706, 5643759, 5601819, 5582996, 5496549, 4676980, WO 91/00360, WO 92/00373,ЕР 03089, Traunecker et al., EMBO J. 10:3655 (1991), Suresh et al., Methods in Enzymology 121:210 (1986),каждая публикация включена в данное описание в виде ссылки в полном объеме. Анти-IL-12-антитела (также называемые IL-12-антителами), применимые в способах и композициях согласно данному изобретению, необязательно могут характеризоваться высоко аффинным связыванием с IL-12 и необязательно, но предпочтительно обладать низкой токсичностью. В частности, в данном изобретении применимо антитело, специфичный фрагмент или вариант согласно изобретению, в котором отдельные компоненты, такие как вариабельная область, константная область и каркас, отдельно и/или совместно необязательно, но предпочтительно обладают низкой иммуногенностью. Характерной особенностью антител, которые можно использовать в изобретении, необязательно является их способность оказывать лечебное действие на пациентов в течение длительных периодов времени при измеряемом ослаблении симптомов и низкой и/или приемлемой токсичностью. Низкая или приемлемая иммуногенность и/или высокая аффинность, а также другие подходящие свойства могут вносить вклад в достигаемые терапевтические результаты. Низкую иммуногенность в данном описании определяют как появление значительных ответов НАНА, НАСА или НАМА менее чем у 75% или предпочтительно менее чем у 50% пациентов, подвергаемых лечению, и/или появление низких титров у пациентов, подвергаемых лечению (примерно менее 300, предпочтительно примерно менее 100, при измерении в иммуноферментном анализе на основе двойных антигенов) (см. Elliott et al., Lancet 344:1125-1121 (1994), работа включена в данное описание в виде ссылки в полном объеме). Полезность Выделенные нуклеиновые кислоты согласно данному изобретению можно использовать для получения по меньшей мере одного анти-IL-12-антитела или его специфичного варианта, который можно использовать для характеристики или воздействия на клетку, ткань, орган или животного (включая млекопитающих и людей), для того чтобы диагностировать, проводить мониторинг, модулировать, лечить,ослаблять, помогать, предотвращать появление или уменьшать симптомы по меньшей мере одного связанного с IL-12 состояния, выбранного по меньшей мере из одного иммунного расстройства или заболевания, сердечно-сосудистого нарушения или заболевания, инфекционного, злокачественного и/или неврологического нарушения или заболевания или другого известного или установленного связанного с IL12 состояния, но не ограниченного указанным. Такой способ может включать введение эффективного количества композиции или фармацевтической композиции, содержащей по меньшей мере одно анти-IL-12-антитело, в клетку, ткань, орган, животному или пациенту, нуждающемуся в таком модулировании, лечении, ослаблении, предотвращении или снижении симптомов, эффектов или механизмов. Эффективное количество может составлять количество примерно от 0,001 до 500 мг/кг при однократном (например, болюсном) многократном или непрерывном введении, или достигать концентрации в сыворотке, составляющей 0,01-5000 мкг/мл при однократном, многократном или непрерывном введении, или любого эффективного предела или значения,которое получают и определяют, используя известные способы, которые описаны в данной заявке или известны в соответствующих областях техники. Ссылки Все цитированные в данном описании публикации или патенты включены в данное описание в виде ссылки в полном объеме, так как они показывают существующий уровень техники на момент данного изобретения и/или для того, чтобы дать описание и объяснение данного изобретения. Публикации относятся к любым научным или патентным публикациям или любым другим источникам информации, доступным в любых формах средств информации, включая все записанные, электронные или печатные формы. В данное описание в виде ссылок в полном объеме включены следующие источники информации: Ausubel, et al., ed., Current Protocols in Molecular Biology, John Wiley and Sons, Inc., NY, NY (19872001); Sambrook, et al., Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor, NY (1989);Protein Science, John Wiley and Sons, NY, NY, (1997-2001). Антитела согласно данному изобретению По меньшей мере одно анти-IL-12-антитело согласно данному изобретению необязательно может продуцироваться клеточной линией, смешанной линией клеток, иммортализованной клеткой или клональной популяцией иммортализованных клеток, которые известны в данной области. См., например,Ausubel, et al., ed., Current Protocols in Molecular Biology, John Wiley and Sons, Inc., NY, NY (1987-2001);Protein Science, John Wiley and Sons, NY, NY, (1997-2001), при этом каждый источник информации включен в данное описание в виде ссылки в полном объеме.-5 006673 Антитела человека, которые специфичны по отношению к белкам IL-12 человека или их фрагментам, могут вырабатываться против соответствующего иммуногенного антигена, такого как выделенный белок IL-12 и/или его часть (включая синтетические молекулы, такие как синтетические пептиды). Подобным образом могут продуцироваться другие специфичные или общие антитела млекопитающих. Получение иммуногенных антигенов и получение моноклональных антител можно выполнять, используя любой подходящий способ. В одном способе получают гибридому путем слияния подходящей линии иммортализованных клеток (например, линии клеток миеломы, без ограничения, такой как Sp2/0, Sp2/0-AG14, NSO, NS1, NS2,AE-1, L.5, 243, P3X63Ag8.653, Sp2 SA3, Sp2 MAI, Sp2 SS1, Sp2 SA5, U937, MLA 144, ACT IV, MOLT4,DA-1, JURKAT, WEHI, K-562, COS, RAJI, NIH 3T3, HL-60, MLA 144, NAMAIWA, NEURO 2A или тому подобной, или гетеромиелом, продуктов их слияния или любой полученной из них клетки или слитой клетки, или любой другой подходящей линии клеток, известной в данной области, см., например,www.atcc.org, www.lifetech.com. и тому подобные) с антителопродуцирующими клетками, без ограничения, такими как выделенные или клонированные клетки селезенки, периферической крови, лимфы, миндалины или другие клетки, содержащие иммунные или В-клетки, или любыми другими клетками, экспрессирующими константные или вариабельные, или каркасные, или CDR-последовательности тяжелой или легкой цепи, либо в виде эндогенной, либо в виде гетерологичной нуклеиновой кислоты, в виде рекомбинантной или эндогенной геномной ДНК, кДНК, рДНК, митохондриальной ДНК или РНК, хлоропластной ДНК или РНК, гяРНК, мРНК, тРНК, одноцепочечной, двухцепочечной или трехцепочечной,гибридизующейся и тому подобной вирусов, бактерий, водорослей, прокариот, земноводных, насекомых,рептилий, рыб, млекопитающих, грызунов, лошадей, баранов, коз, овец, приматов, эукариот или в виде любой их комбинации. См., например, Ausubel, выше, и Colligan, Immunology, выше, глава 2, включенные в данное описание в виде ссылок в полном объеме. Клетки, продуцирующие антитела, также можно получить из периферической крови или предпочтительно селезенки или лимфатических узлов человека или других подходящих животных, которые были иммунизированы представляющим интерес антигеном. Также можно использовать любые другие подходящие клетки-хозяева для экспрессии гетерологичной или эндогенной нуклеиновой кислоты, кодирующей антитело, его специфичный фрагмент или вариант согласно данному изобретению. Слитые клетки (гибридомы) или рекомбинантные клетки можно выделить, используя селективные условия культивирования или другие подходящие известные способы, и клонировать посредством лимитирующего разведения или сортировки клеток или другими известными способами. Клетки, которые продуцируют антитела требуемой специфичности, можно отобрать посредством подходящего анализа (например,ELISA). Можно использовать другие подходящие способы получения или выделения антител требуемой специфичности, включая, но не ограничиваясь указанным, способы, в которых рекомбинантное антитело отбирают из пептидной или белковой библиотеки (например, без ограничения, из дисплейной библиотеки на основе бактериофагов, рибосом, олигонуклеотидов, РНК, кДНК или тому подобного, например,доступной из Cambridge antibody Technologies, Cambridgeshire, UK; MorphoSys, Martinsreid/Planegg, DE;(Xoma); ЕР 229046; PCT/US9107149 (Ixsys); или стохастически созданные пептиды или белки - патенты США 5723323, 5763192, 5814476, 5817483, 5824514, 5976862, WO 86/05803, ЕР 590689 (Ixsys, now Applied Molecular Evolution (ANIE), каждая публикация включена в данное описание в виде ссылки в полном объеме), или способы, основанные на иммунизации трансгенных животных (например, мышей(1996); Eren et al., Immunol. 93:154-161 (1998), каждая публикация включена в данное описание в виде ссылки в полном объеме, а также связанные патенты и заявки), которые способны продуцировать спектр антител человека, которые известны в данной области и/или описаны в данной заявке. Такие способы включают, но не ограничены указанным, рибосомный дисплей (Hanes et al., Proc. Natl. Acad. Sci. USA,94:4937-4942 (May 1997); Hanes et al., Proc. Natl. Acad. Sci. USA, 95:14130-14135 (Nov. 1998; способы продуцирования антител отдельными клетками (например, способ продуцирования антител отобранными лимфоцитами (SLAM) (патент США No. 5627052, Wen et al., J. Immunol. 17:887-892 (1987); Babcooket al., Proc. Natl. Acad. Sci. USA 93:7843-7848 (1996; способ на основе микрокапель геля и проточной цитометрии (Powell et al., Biotechnol. 8:333-337 (1990); One Cell Systems, Cambridge, MA; Gray et al., J.-6 006673 Также можно применять способы конструирования или гуманизации нечеловеческих или человеческих антител, которые хорошо известны в данной области. Как правило, гуманизированное или сконструированное антитело имеет один или более аминокислотных остатков из источника, который не является человеком, например, мышь, крыса, кролик, примат, отличный от человека, или другое млекопитающее, но не ограничен указанным. Указанные аминокислотные остатки антитела человека часто называют импортированными остатками, которые обычно берут из импортированного вариабельного, константного или другого домена известной последовательности человека. Известные последовательности Ig человека описаны, например, вKabat et al., Sequences of Proteins of Immunological Interest, U.S. Dept. Health (1983), каждая публикация включена в данное описание в виде ссылки в полном объеме. Такие импортированные последовательности можно использовать для уменьшения иммуногенности или уменьшения, усиления или модификации связывания, аффинности, скорости связывания, скорости распада, авидности, специфичности,времени полужизни или любого другого подходящего свойства, которые известны в данной области. Как правило, часть или все нечеловеческие или человеческие последовательности CDR сохраняют, тогда как нечеловеческие последовательности вариабельных и константных областей заменяют человеческими или другими аминокислотами. Антитела также необязательно можно гуманизировать при сохранении высокой аффинности по отношению к антигену и других подходящих биологических свойств. Для достижения указанной цели гуманизированные антитела необязательно можно получать посредством способа анализа родительских последовательностей и различных умозрительных гуманизированных продуктов,используя трехмерные модели родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов общедоступны и известны специалистам в данной области. Имеются компьютерные программы, которые иллюстрируют и представляют возможные трехмерные конформационные структуры выбранных для исследования последовательностей иммуноглобулинов. Просмотр указанных изображений позволяет проанализировать вероятную роль остатков в функционировании выбранной для исследования последовательности иммуноглобулина, т.е. проанализировать остатки, которые влияют на способность выбранного для исследования иммуноглобулина связываться со своим антигеном. Таким образом, можно выбрать и комбинировать остатки FR из консенсусной и импортированной последова-7 006673 тельностей так, чтобы получить требуемые характеристики антитела, такие как повышенная аффинность по отношению к антигену(нам)-мишени. В общем, остатки CDR прямо и в наиболее значительной степени оказывают влияние на связывание антигена. Гуманизацию или конструирование антител согласно данному изобретению можно выполнить, используя известный способ, без ограничения, такой как способы, описанные в Winter (Jones et al., Nature 321:522 (1986); Riechmann et al., Nature 332:323 (1988); Verhoeyen et al., Science 239:1534 (1988, Sims et al., J. Immunol. 151:2296 (1993); Chothia and Lesk, J. Mol.WO90/14443, WO90/14424, WO90/14430, ЕР 229246, каждая публикация включена в данное описание в виде ссылки в полном объеме, включая цитированные в указанных работах ссылки. Анти-IL-12-антитело также необязательно можно получить посредством иммунизации трансгенного животного (например, мыши, крысы, хомячка, примата, отличного от человека, и тому подобное),способного продуцировать спектр антител человека, которые описаны в данной заявке и/или известны в данной области. Клетки, которые продуцируют анти-IL-12-антитело человека, можно выделить из организма таких животных и иммортализовать, используя подходящие способы, такие как способы, описанные в данной заявке. Трансгенных мышей, которые могут продуцировать спектр антител человека, которые связываются с антигенами человека, можно получить известными способами (например, но не ограничиваясь указанным, патенты США 5770428, 5569825, 5545806, 5625126, 5625825, 5633425, 5661016 и 5789650, выданные Lonberg et al.; Jakobovits et al. WO 98/50433, Jakobovits et al. WO 98/24893, Lonberg et al. WO 98/24884, Lonberg et al. WO 97/13852, Lonberg et al. WO 94/25585, Kucherlapate et al. WO 96/34096,Kucherlapate et al. EP 0463151 Bl, Kucherlapate et al. EP 0710719 Al, патент США No. 5545807, выданныйUSA 90(8)3720-3724 (1993), Lonberg et al., Int Rev Immunol 13(1):65-93 (1995) и Fishwald et al., Nat Biotechnol 14(7):845-851 (1996), каждая публикация включена в данное описание в виде ссылки во всей своей полноте). Как правило, указанные мыши содержат по меньшей мере один трансген, включающий ДНК, по меньшей мере, из одного локуса иммуноглобулина человека, который функционально реаранжирован, или который может подвергаться функциональной реаранжировке. Эндогенный локус иммуноглобулина у таких мышей может быть нарушен или делетирован, чтобы лишить животное способности продуцировать антитела, кодируемые эндогенными генами. Скрининг антител в отношении специфичного связывания со сходными белками или фрагментами удобно можно проводить с использованием дисплейных библиотек пептидов. Указанный способ заключается в скрининге больших коллекций пептидов в отношении отдельных представителей, обладающих требуемой функцией или структурой. Скрининг антител в дисплейных библиотеках пептидов хорошо известен в данной области. Представляемые с помощью дисплея пептидные последовательности могут иметь длину от 3 до 5000 или более аминокислот, часто длиной 5-100 аминокислот и часто длиной примерно от 8 до 25 аминокислот. Кроме способов прямого химического синтеза для создания пептидных библиотек описано несколько способов рекомбинантной ДНК. Один вид дисплея представляет собой представление пептидной последовательности на поверхности бактериофага или клетки. Каждый бактериофаг или клетка содержит нуклеотидную последовательность, кодирующую конкретную представляемую с помощью дисплея пептидную последовательность. Такие способы описаны в РСТ патентных заявках 91/17271, 91/18980, 91/19818 и 93/08278. Другие системы для создания библиотек пептидов используют подходы как химического синтеза in vitro, так и рекомбинантные способы. См. РСТ патентные заявки 92/05258, 92/14843 и 96/19256. Также см. патенты США No. 5658754 и 5643768. Дисплейные библиотеки пептидов, вектор и наборы для скрининга коммерчески доступны от таких поставщиков, какInvitrogen (Carlsbad, CA) и Cambridge Antibody Technologies Cambridgeshire, UK). См., например, патенты США No. 4704692, 4939666, 4946778, 5260203, 5455030, 5518889, 5534621, 5656730, 5763733, 5767260,5856456, переуступленные Enzon; 5223409, 5403484, 5571698, 5837500, переуступленные Dyax, 5427 908,5580717, переуступленные Affymax; 5885793, переуступленный Cambridge antibody Technologies; 5750373, переуступленный Genentech, 5618920, 5595898, 5576195, 5698435, 5693493, 5698417, переуступленные Xoma, Colligan, выше; Ausubel, выше; или Sambrook, выше, каждый из указанных выше патентов и публикаций включен в данное описание в виде ссылки в полном объеме. Антитела согласно данному изобретению также можно получить, используя по меньшей мере одну нуклеиновую кислоту, кодирующую анти-IL-12-антитело, чтобы получить трансгенных животных или млекопитающих, таких как козы, коровы, лошади, овцы и тому подобное, которые продуцируют такие антитела в своем молоке. Таких животных можно получить, используя известные способы. См. не ограничивающие примеры в патентах США 5827690; 5849992; 4873316; 5849992; 5994616; 5565362;-8 006673 5304489 и тому подобное, каждый из которых включен в данное описание в виде ссылки в полном объеме. Антитела согласно данному изобретению, кроме того, можно получить с использованием по меньшей мере одной нуклеиновой кислоты, кодирующей анти-IL-12-антитело, чтобы получить трансгенные растения или культивируемые растительные клетки (например, но не ограничиваясь указанным, табак или кукурузу), которые продуцируют такие антитела, специфичные части или варианты в частях растения или в полученных из них культивируемых клетках. В качестве неограничивающего примера успешно использовали листья трансгенного табака, экспрессирующего рекомбинантные белки, чтобы получить большие количества рекомбинантных белков, используя, например, индуцируемый промотор. См., например, Cramer et al., Curr. Top. Microbiol. Immunol. 240:95-118 (1999) и цитированные в указанной работе ссылки. Также использовали трансгенную кукурузу, чтобы экспрессировать белки млекопитающих на коммерческом уровне продуктивности, с биологическими активностями, эквивалентными активностям,продуцируемым в других рекомбинантных системах или очищенными из природных источников. См.,например, Hood et al., Adv. Exp. Med. Biol. 464:127-147 (1999) и цитированные в указанной работе ссылки. Антитела в больших количествах также получали из семян трансгенных растений, включая фрагменты антител, такие как одноцепочечные антитела (scFv), включая семена табака и клубни картофеля. См.,например, Conrad et al., Plant Mol. Biol. 38:101-109 (1998) и цитированные в указанной работе ссылки. Таким образом, антитела согласно данному изобретению также можно получить, используя трансгенные растения в соответствии с известными способами. См., например, также Fischer et al., Biotechnol. Appl.Biochem. 30:99-108 (Oct., 1999); Ma et al., Trends Biotechnol. 13:522-7 (1995); Ma et al., Plant Physiol. 109:341-6 (1995); Whitelam et al., Biochem. Soc. Trans. 22:940-944 (1994); и цитированные в указанной работе ссылки. Также см. вообще работы по экспрессии антител в растениях, не ограниваясь указанным. Каждый из указанных источников информации включен в данное описание в виде ссылки в полном объеме. Антитела согласно изобретению могут связывать IL-12 человека с широким диапазоном аффинности (KD). В предпочтительном варианте по меньшей мере одно мАт человека согласно данному изобретению необязательно может связывать IL-12 человека с высокой аффинностью. Например, мАт человека может связывать IL12 человека с КD примерно равной или меньше 10-7 М, без ограничения, такой как 0,1-9,9 (или находиться в любом интервале, или иметь любое значение в указанном диапазоне) X 10-7, 10-8, 10-9, 10-10, 10-11, 10-12, 10-13, или находиться в любом интервале, или иметь любое значение в указанном диапазоне. Аффинность или авидность антитела в отношении антигена можно определить экспериментально,используя любой подходящий способ. (См., например, Berzofsky, et al., Antibody-Antigen Interactions, InFundamental Immunology, Paul, W. E., Ed., Raven Press: New York, NY (1984); Kuby, Janis Immunology,W.H. Freeman and Company: New York, NY (1992); и способы, описанные в указанных публикациях). Измеренная аффинность конкретного взаимодействия антитело-антиген может варьировать, если его измеряют в разных условиях (например, концентрация соли, рН). Таким образом, измерения аффинности и других параметров связывания антигена (например, KD, Ka, Кd) предпочтительно осуществляют с использованием стандартизованных растворов антитела и антигена и стандартизованного буфера, такого как буфер, описанный в данной заявке. Молекулы нуклеиновой кислоты Используя представленную в данном описании информацию, такую как информация о нуклеотидных последовательностях, кодирующих по меньшей мере 70-100% смежных аминокислот по меньшей мере одной из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, специфичных фрагментов, вариантов или их консенсусных последовательностей, или депонированный вектор, содержащий по меньшей мере одну из указанных последовательностей, можно получить молекулу нуклеиновой кислоты согласно данному изобретению,кодирующую по меньшей мере одно анти-IL-12-антитело, с использованием способов, описанных в данной заявке или известных в данной области. Молекулы нуклеиновой кислоты согласно данному изобретению могут быть в форме РНК, а именно мРНК, гяРНК, тРНК или в любой другой форме, или в форме ДНК, включая, но не ограничиваясь указанным, кДНК или геномной ДНК, полученной клонированием или полученной путем синтеза, или представлять собой любые их комбинации. ДНК может быть трехцепочечной, двухцепочечной или одноцепочечной, или представлять собой любые их комбинации. Любая часть по меньшей мере одной цепи ДНК или РНК может быть кодирующей цепью, также известной как смысловая цепь, или она может представлять собой некодирующую цепь, также называемую антисмысловой цепью. Выделенные молекулы нуклеиновой кислоты согласно данному изобретению могут включать молекулы нуклеиновой кислоты, содержащие открытую рамку считывания (ОРС), необязательно с одним или более нитронами, например, но не ограничиваясь указанным, по меньшей мере одну конкретную часть по меньшей мере одного CDR, как, например, CDR1, CDR2 и/или CDR3, по меньшей мере одной тяжелой цепи (например, SEQ ID NO: 1-3) или легкой цепи (например, SEQ ID NO: 4-6); молекулы нуклеиновой кислоты, содержащие кодирующую последовательность анти-IL-12-антитела или вариабельной области (например, SEQ ID NO: 7, 8) и молекулы нуклеиновой кислоты, которые содержат нуклеотидную последовательность в значительной степени отличную от последовательностей, описанных выше,-9 006673 но которая вследствие вырожденности генетического кода кодирует по меньшей мере одно анти-IL-12 антитело, которое описано в данной заявке и/или известно в данной области. Конечно, генетический код хорошо известен в данной области. Таким образом, для специалиста в данной области обычной практикой будет создание таких вырожденных вариантов нуклеиновой кислоты, которые кодируют специфичные анти-IL-12-антитела согласно данному изобретению. См., например, Ausubel, et al., выше, и такие варианты нуклеиновой кислоты включены в данное изобретение. Неограничивающие примеры выделенных молекул нуклеиновой кислоты согласно данному изобретению включают SEQ ID NO: 10-15, соответствующие неограничивающим примерам нуклеиновой кислоты, кодирующей, соответственно НС CDR1, НС CDR2, НС CDR3, LC CDR1, LC CDR2, LC CDR3,вариабельную область НС и вариабельную область LC. В другом аспекте изобретение относится к выделенным молекулам нуклеиновой кислоты, кодирующим анти-IL-12-антитело, имеющее аминокислотную последовательность, которая кодируется нуклеиновой кислотой, находящейся в плазмиде, депонированной с названием клона и No. депозита АТСС, соответственно, депонированной . Как указано в данном описании, молекулы нуклеиновой кислоты согласно данному изобретению,которые содержат нуклеиновую кислоту, кодирующую анти-IL-12-антитело, могут включать, но не ограничены указанным, молекулы, кодирующие аминокислотную последовательность фрагмента антитела; последовательность, кодирующую все антитело или его часть; кодирующую последовательность антитела, фрагмента или части, а также дополнительные последовательности, такие как кодирующая последовательность по меньшей мере одного сигнального, лидерного или слитого пептида, в присутствии или без вышеуказанных дополнительных кодирующих последовательностей, таких как по меньшей мере один интрон, вместе с дополнительными некодирующими последовательностями, включая, но не ограничиваясь указанным, некодирующие 5'- и 3'-последовательности, такие как транскрибируемые, нетранслируемые последовательности, которые играют роль в транскрипции, процессинге мРНК, включая сигналы сплайсинга и полиаденилирования (например - для связывания с рибосомой и стабильности мРНК); дополнительную кодирующую последовательность, которая кодирует дополнительные аминокислоты, такие как аминокислоты, которые обеспечивают дополнительные функции. Таким образом,последовательность, кодирующая антитело, может быть слита с маркерной последовательностью, такой как последовательность, кодирующая пептид, который облегчает очистку слитого антитела, содержащего фрагмент или часть антитела. Полинуклеотиды, которые избирательно гибридизуются с описанным в данной заявке полинуклеотидом. Данное изобретение относится к выделенным нуклеиновым кислотам, которые в выбранных условиях гибридизации гибридизуются с описанным в данной заявке полинуклеотидом. Таким образом, полинуклеотиды согласно данному варианту можно использовать для выделения, обнаружения и/или количественного анализа нуклеиновых кислот, содержащих такие полинуклеотиды. Например, полинуклеотиды согласно данному изобретению можно использовать для идентификации, выделения или амплификации частичных или полноразмерных клонов в депонированной библиотеке. В некоторых вариантах полинуклеотиды представляют собой геномные или кДНКпоследовательности, выделенные или же комплементарные кДНК из библиотеки нуклеиновых кислот человека или млекопитающего. Предпочтительно библиотека кДНК содержит по меньшей мере 80% полноразмерных последовательностей, предпочтительно по меньшей мере 85% или 90% полноразмерных последовательностей и более предпочтительно по меньшей мере 95% полноразмерных последовательностей. Библиотеки кДНК можно нормализовать, чтобы увеличить представление редких последовательностей. По отношению к последовательностям, имеющим более низкую идентичность последовательностей по сравнению с комплементарными последовательностями, обычно применяют условия гибридизации низкой или умеренной жесткости, но не только такие. Условия умеренной и высокой жесткости необязательно можно использовать в отношении последовательностей с более высокой идентичностью. Условия низкой жесткости позволяют проводить избирательную гибридизацию последовательностей, обладающих примерно 70% идентичностью последовательностей, и могут использоваться для идентификации ортологичных или паралогичных последовательностей. Необязательно полинуклеотиды согласно данному изобретению будут кодировать по меньшей мере часть антитела, кодируемого описанными в данной заявке полинуклеотидами. Полинуклеотиды согласно данному изобретению охватывают последовательности нуклеиновых кислот, которые можно использовать для избирательной гибридизации с полинуклеотидом, кодирующим антитело согласно данному изобретению. См., например, Ausubel, выше; Colligan, выше, каждая публикация включена в данное описание в виде ссылки в полном объеме. Конструирование нуклеиновых кислот Выделенные нуклеиновые кислоты согласно данному изобретению можно получить, используя (а) способы рекомбинации, (b) способы синтеза, (с) способы очистки или их комбинацию, которые хорошо известны в данной области.- 10006673 Нуклеиновые кислоты в дополнение к полинуклеотиду согласно данному изобретению могут содержать подходящие последовательности. Например, в нуклеиновую кислоту можно встроить сайт множественного клонирования, содержащий один или более сайтов рестрикции эндонуклеазами, для облегчения выделения полинуклеотида. Также можно встроить транслируемые последовательности, способствующие выделению транслируемого полинуклеотида согласно данному изобретению. Например, маркерная последовательность гексагистидина обеспечивает удобный способ очистки белков согласно данному изобретению. Нуклеиновая кислота согласно данному изобретению, за исключением кодирующей последовательности, необязательно представляет собой вектор, адаптер или линкер для клонирования и/или экспрессии полинуклеотида согласно данному изобретению. К таким последовательностям для клонирования и/или экспрессии можно добавить дополнительные последовательности, чтобы оптимизировать их функции при клонировании и/или экспрессии, обеспечить выделение полинуклеотида или повысить введение полинуклеотида в клетку. Применение клонирующих векторов, экспрессирующих векторов, адаптеров и линкеров хорошо известно в данной области.(См., например, Ausubel, выше; или Sambrook, выше). Рекомбинантные способы конструирования нуклеиновых кислот Композиции выделенных нуклеиновых кислот согласно данному изобретению, таких как РНК,кДНК, геномная ДНК или любая их комбинация, можно получить из биологических источников с использованием ряда методик клонирования, известных специалистам в данной области. В некоторых вариантах используют олигонуклеотидные зонды, которые в жестких условиях избирательно гибридизуются с полинуклеотидами согласно данному изобретению, чтобы идентифицировать требуемую последовательность в библиотеке кДНК или геномной ДНК. Выделение РНК и конструирование библиотек кДНК и геномных библиотек хорошо известно специалистам в данной области (См., например, Ausubel,выше; или Sambrook, выше). Способы скрининга и выделения нуклеиновых кислот Скрининг библиотеки кДНК или геномной библиотеки можно проводить, используя зонд, основанный на последовательности полинуклеотида согласно данному изобретению, такому как полинуклеотиды, описанные в данной заявке. Зонды можно использовать для гибридизации с последовательностями геномной ДНК или кДНК, чтобы выделить гомологичные гены того же самого или других организмов. Специалистам в данной области будет понятно, что в анализе можно использовать гибридизацию разной степени жесткости; и жесткой может быть либо среда для гибридизации, либо среда для промывки. По мере того, как условия гибридизации становятся более жесткими, должна быть более высокая степень комплементарности между зондом и мишенью для того, чтобы происходило образование дуплекса. Степень жесткости можно контролировать одним или более условиями: температурой, ионной силой, рН и наличием частично денатурирующего растворителя, такого как формамид. Например, жесткость гибридизации соответствующим образом варьируют, изменяя полярность раствора реагента, например, манипулируя концентрацией формамида в пределах от 0 до 50%. Степень комплементарности (идентичности последовательностей), необходимая для регистрируемого связывания, будет варьировать в соответствии с жесткостью среды для гибридизации и/или среды для промывки. Степень комплементарности оптимально будет составлять 100 или 70-100%, или любой интервал или значение в указанном диапазоне. Однако следует понимать, что небольшие вариации последовательности в зондах и праймерах могут компенсироваться снижением жесткости среды для гибридизации и/или промывки. Способы амплификации РНК или ДНК хорошо известны в данной области и могут быть использованы согласно данному изобретению без ненужного экспериментирования на основании представленных в данном описании принципов и руководств. Известные способы амплификации ДНК или РНК включают, но не ограничены указанным, полимеразную цепную реакцию (ПЦР) и сходные способы амплификации (см., например, патенты США 4683195, 4683202, 4800159, 4965188, Mullis, et al.; 4795699 и 4921794 Tabor, et al.; 5142033 Innis; 5122464Wilson, et al.; 5091310 Innis; 5066584 Gyllensten, et al.; 4889818 Gelfand, et al.; 4994370 Silver, et al.; 4766067 Biswas; 4656134 Ringold) и амплификацию, опосредованную РНК, в которой используют антисмысловую РНК к последовательности-мишени в качестве матрицы для синтеза двухцепочечной ДНК(патент США 5130238 Malek, et al., торговое название NASBA), полное содержание указанных источников информации включено в данное описании в виде ссылки (См., например, Ausubel, выше; или Sambrook, выше). Например, способ полимеразной цепной реакции (ПЦР) можно использовать для амплификации. последовательностей полинуклеотидов согласно данному изобретению и родственных генов непосредственно из библиотек геномной ДНК или кДНК. ПЦР и другие способы амплификации in vitro также могут быть применимы, например, для того, чтобы клонировать последовательности нуклеиновых кислот, кодирующих белки, которые необходимо экспрессировать, чтобы получить нуклеиновые кислоты для применения в качестве зондов для выявления наличия требуемой мРНК в образцах, для секвенирования нуклеиновых кислот или для других целей. Примеры способов, достаточных для того, чтобы сориентировать специалистов в способах амплификации in vitro, встречаются в Berger, выше, Sambrook, выше и Ausubel,выше, а также в Mullis, et al., патент США 4683202 (1987); и Innis, et al., PCR Protocols A Guide toMethods and Applications, Eds., Academic Press Inc., San Diego, CA (1990). Коммерчески доступные наборы для ПЦР-амплификации геномной ДНК известны в данной области. См., например, набор для ПЦР преимущественно GC-геномной ДНК (Clontech). Для повышения выхода длинных продуктов ПЦР, кроме того, можно, например, использовать белок 32 гена Т 4 (Boehringer Mannheim). Синтетические способы синтеза для конструирования нуклеиновых кислот Выделенные нуклеиновые кислоты согласно данному изобретению также можно получить прямым химическим синтезом известными способами (см., например, Ausubel, et al., выше). Химический синтез,как правило, дает одноцепочечный олигонуклеотид, который можно превратить в двухцепочечную ДНК посредством гибридизации с комплементарной последовательностью или посредством полимеризации ДНК-полимеразой с использованием одной цепи в качестве матрицы. Специалисту в данной области будет понятно, что хотя химический синтез ДНК может быть ограничен последовательностями длиной 100 или более оснований, более длинные последовательности можно получить лигированием более коротких последовательностей. Рекомбинантные экспрессирующие кассеты Данное изобретение, кроме того, относится к рекомбинантным экспрессирующим кассетам, содержащим нуклеиновую кислоту согласно данному изобретению. Последовательность нуклеиновой кислоты согласно данному изобретению, например, кДНК или геномную последовательность, кодирующую антитело согласно данному изобретению, можно использовать для конструирования рекомбинантной экспрессирующей кассеты, которую можно ввести по меньшей мере в одну требуемую клетку-хозяина. Рекомбинантная экспрессирующая кассета, как правило, будет содержать полинуклеотид согласно данному изобретению, функционально связанный с регуляторными последовательностями инициации транскрипции, которые будут управлять транскрипцией полинуклеотида в предназначенной для этого клеткехозяине. Можно использовать как гетерологичные, так и негетерологичные (т.е. эндогенные) промоторы для управления экспрессией нуклеиновых кислот согласно данному изобретению. В некоторых вариантах выделенные нуклеиновые кислоты, которые служат в качестве промотора,энхансера или других элементов, можно ввести в соответствующее положение (выше, ниже или в. интрон) негетерологичной формы полинуклеотида согласно данному изобретению, так чтобы осуществлять повышающую или понижающую регуляцию экспрессии полинуклеотида согласно данному изобретению. Например, эндогенные промоторы можно изменить in vivo или in vitro посредством мутации, делеции и/или замены. Векторы и клетки-хозяева Данное изобретение также относится к векторам, которые содержат выделенные молекулы нуклеиновой кислоты согласно данному изобретению, клеткам-хозяевам, которые сконструированы генноинженерным способом с рекомбинатными векторами, и получению по меньшей мере одного анти-IL-12 антитела рекомбинантными способами, которые хорошо известны в данной области. См., например,Sambrook, et al., выше; Ausubel, et al., выше, каждая публикация включена в данное описание в виде ссылки в полном объеме. Полинуклеотиды необязательно можно связывать с вектором, содержащим селектируемый маркер для размножения в клетке. Как правило, плазмидный вектор вводят в виде преципитата, такого, как преципитат фосфата кальция, или в комплексе с заряженными липидами. Если вектор представляет собой вирус, его можно упаковать in vitro с использованием соответствующей линии пакующих клеток и затем трансдуцировать в клетки-хозяева. Вставка ДНК должна быть функционально связана с подходящим промотором. Экспрессирующие конструкции, кроме того, будут сдержать сайты инициации транскрипции, терминации транскрипции и в транскрибируемой области сайт связывания рибосомы для трансляции. Кодирующая часть зрелых транскриптов, экспрессированных конструкциями, предпочтительно будет содержать в начале кодон инициации трансляции и кодон терминации (например, UAA, UGA или UAG), соответствующим образом расположенный на конце транслируемой мРНК, при этом для экспрессии в клетках млекопитающих или эукариот предпочтительны UAA и UAG. Экспрессирующие векторы предпочтительно, но не обязательно будут содержать, по меньшей мере,один селектируемый маркер. Такие маркеры включают, но не ограничены указанным, ген устойчивости к мето.трексату (МТХ), ген дигидрофолатредуктазы (DHFR, патенты США 4399216; 4634665; 4656134; 4956288; 5149636; 5179017), устойчивости к ампициллину, неомицину (G418), микофенольной кислоте или ген глутаминсинтетазы (GS, патенты США 5122464; 5770359; 5827739) для культуры эукариотических клеток, и гены устойчивости к тетрациклину или ампициллину для культивирования в случае Е. coli и других бактерий или прокариот (при этом указанные выше патенты включены в виде ссылки в полном объеме). Соответствующие среды для культивирования и условия для описанных выше клеток-хозяев известны в данной области. Подходящие векторы будут очевидны для специалистов в данной области. Введение векторной конструкции в клетку-хозяина можно осуществлять трансфекцией с фосфатом кальция, трансфекцией, опосредованной DEAE-декстраном, трансфекцией, опосредованной катионными липидами, электропорацией, трансдукцией, инфицированием или другими известными спо- 12006673 собами. Такие способы описаны в данной области, а именно Sambrook, выше, главы 1-4 и 16-18; Ausubel,выше, главы 1, 9, 13, 15, 16. По меньшей мере одно антитело согласно данному изобретению можно экспрессировать в модифицированной форме, такой как слитый белок, и оно может содержать не только сигналы секреции, но также дополнительные гетерологичные функциональные области. Например, область дополнительных аминокислот, в частности заряженных аминокислот, можно добавить к N-концу антитела, чтобы повысить стабильность и продолжительность существования в клетке-хозяине, во время очистки или во время последующих манипуляций и хранении. Также пептидные фрагменты можно добавить к антителу согласно данному изобретению, чтобы облегчить очитку. Такие области могут быть удалены перед окончательным получением антитела или по меньшей мере одного его фрагмента. Такие способы описаны во многих стандартных лабораторных руководствах, таких как Sambrook, выше, главы 17.29-17.42 и 18.1-18.74;Ausubel, выше, главы 16, 17 и 18. Специалисты в данной области хорошо осведомлены относительно многочисленных экспрессирующих систем, имеющихся для экспрессии нуклеиновой кислоты, кодирующей белок согласно данному изобретению. Альтернативно, нуклеиновые кислоты согласно данному изобретению можно экспрессировать в клетке-хозяине в результате введения в действие (посредством манипулирования) в клетке-хозяине, которая содержит эндогенную ДНК, кодирующую антитело согласно данному изобретению. Такие способы хорошо известны в данной области, например, способы, описанные в патентах США 5580734,5641670, 5733746 и 5733761, включенных в данное описание в виде ссылки в полном объеме. Иллюстративными культурами клеток, пригодными для продуцирования антител, его специфичных частей или вариантов, являются клетки млекопитающих. Системы клеток млекопитающих часто будут иметь форму монослоя клеток, хотя также можно использовать суспензии клеток млекопитающих или биореакторы с клетками млекопитающих. В данной области разработан ряд подходящих линий клетокхозяев, способных экспрессировать интактные гликозилированные белки, и к ним относятся линии клеток COS-1 (например, АТСС CRL 1650), COS-7 (например, АТСС CRL-1651), HEK293, ВНK21 (например, АТСС CRL-10), СНО (например, АТСС CRL 1610) и BSC-1 (например, АТСС CRL-26), клетки Cos7, клетки СНО, клетки hep G2, P3X63Ag8.653, SP2/0-Ag14, клетки 293, клетки HeLa и тому подобные,которые легко доступны, например, из Американской коллекции типов культур, Manassas, Va(www.atcc.org). Предпочтительные клетки-хозяева включают клетки лимфоидного происхождения, такие как клетки миеломы и лимфомы. Особенно предпочтительными клетками являются клетки Р 3X63Ag8.653 (депозитарный номер АТСС CRL-1580) и клетки SP2/0-Ag14 (депозитарный номер АТССCRL-1851). В особенно предпочтительном варианте рекомбинантной клеткой является клетка Р 3 Х 63 Аb8.653 или SP2/0-Ag14. Экспрессирующие векторы для таких клеток могут включать одну или более из следующих регуляторных последовательностей экспрессии, без ограничения, такие, как начало репликации; промотор (например, поздний или ранний промоторы SV40; промотор CMV (патенты США 5168062; 5385839),промотор tk HSV, промотор pgk (фосфоглицераткиназы), промотор EF-1 альфа (патент США 5266491), по меньшей мере один промотор иммуноглобулина человека; энхансер и/или информационные сайты процессинга, такие как сайты связывания рибосом, сайты сплайсинга РНК, сайты полиаденилирования (например, сайт присоединения поли А большого Т-Аг SV40) и последовательности терминатора транскрипции. См., например, Ausubel et al., выше; Sambrook, et al., выше. Другие клетки, пригодные для получения нуклеиновых кислот или белков согласно данному изобретению, известны и/или доступны,например, по каталогу линий клеток и гибридом Американской коллекции типов культур (www.atcc.org) или других известных или коммерческих источников. При использовании эукариотических клеток-хозяев последовательности полиаденилирования или терминации транскрипции обычно включают в состав вектора. Примером последовательности терминации является последовательность полиаденилирования гена гормона роста быка. Также можно включать последовательности для точного сплайсинга транскрипта. Примером последовательности сплайсинга является интрон VP1 из SV40 (Sprague, et al., J. Virol. 45:773-781 (1983. Дополнительно в вектор можно включать последовательности гена для регулирования репликации в клетке-хозяине, которые известны в данной области. Очистка антитела Анти-IL-12-антитело можно извлечь и очистить из культур рекомбинантных клеток хорошо известными, способами, включая, но не ограничиваясь указанным, очистку с белком А, осаждение сульфатом аммония или этанолом, экстракцию кислотой, анионо- или катионообменную хроматографию, хроматографию на фосфоцеллюлозе, хроматографию на основе гидрофобного взаимодействия, аффинную хроматографию, хроматографию на гидроксилапатите и хроматографию на пектине. Для очистки также можно использовать высокоэффективную жидкостную хроматографию (ВЭЖХ). См., например, Colligan, Current Protocols in Immunology, или Current Protocols in Protein Science, John Wiley and Sons, NY,NY, (1997-2001), например главы 1, 4, 6, 8, 9, 10, каждая из которых включена в данное описание в виде ссылки в полном объеме.- 13006673 Антитела согласно данному изобретению включают продукты, очищенные из природных источников, продукты, полученные способами химического синтеза и продукты, полученные рекомбинантными способами из эукариотического хозяина, включая, например, клетки дрожжей, высших растений, насекомых и млекопитающих. В зависимости от хозяина, используемого в рекомбинантном способе получения, антитело согласно данному изобретению может быть гликозилированным или может быть негликозилированным, при этом предпочтительно гликозилированное антитело. Такие способы описаны во многих стандартных лабораторных руководствах, таких как Sambrook, выше, разделы 17.37-17.42; Ausubel,выше, главы 10, 12, 13, 16, 18 и 20, Colligan, Protein Science, выше, главы 12-14, все публикации включены в данное описание в виде ссылки в полном объеме. Анти-IL-12-антитела Выделенные антитела согласно данному изобретению содержат антитело, кодируемое любым из полинуклеотидов согласно данному изобретению, которые более полно обсуждаются в данном описании, или любое выделенное или полученное антитело. Предпочтительно антитело человека или антигенсвязывающий фрагмент связывает IL-12 человека и при этом частично или в значительной степени нейтрализует, по меньшей мере, одну биологическую активность белка. Антитело, его специфичная часть или вариант, которое частично или предпочтительно в значительной степени нейтрализует по меньшей мере одну биологическую активность по меньшей мере одного белка IL-12 или фрагмента, может связывать белок или фрагмент, тем самым ингибируя активности, опосредованные связыванием IL-12 с рецептором IL-12 или осуществляемые посредством других зависимых или опосредованных IL-12 механизмов. В используемом в данном описании смысле термин нейтрализующее антитело относится к антителу, которое может ингибировать зависимую от IL-12 активность примерно на 20-120%, предпочтительно, по меньшей мере, примерно на 10, 20, 30, 40, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96,97, 98, 99, 100% или более, в зависимости от анализа. Способность анти-IL-12-антитела ингибировать зависимую от IL-12 активность предпочтительно исследуют по меньшей мере посредством одного подходящего анализа белка или рецептора IL-12, как описано в данной заявке и/или известно в данной области. Антитело человека согласно изобретению может относиться к любому классу (IgG, IgA, IgM, IgE,IgD и т.д.) или изотипу и может содержать легкую цепь каппа или лямбда. В одном варианте антитело человека содержит тяжелую цепь IgG или определенный фрагмент, например по меньшей мере одного из изотипов IgG1, IgG2, IgG3 или IgG4. Антитела данного типа можно получить, используя трансгенную мышь или другое трансгенное млекопитающее, отличное от человека, содержащее по меньшей мере один трансген легкой цепи человека (например, IgG, IgA и IgM (например, l, 2, 3, 4, который описан в данной заявке и/или известен в данной области. В другом варианте антитело человека против IL-12 человека содержит тяжелую цепь IgGl и легкую цепь IgGl. По меньшей мере одно антитело согласно изобретению связывает по меньшей мере один конкретный эпитоп, специфичный по меньшей мере для одного белка, субъединицы, фрагмента, части IL-12, или их комбинации. По меньшей мере один эпитоп может содержать по меньшей мере одну область связывания антитела, которая включает по меньшей мере одну часть указанного белка, и указанный эпитоп предпочтительно состоит по меньшей мере из одной внеклеточной, растворимой, гидрофильной, наружной или цитоплазматической части указанного белка. По меньшей мере один конкретный эпитоп может содержать любую комбинацию по меньшей мере одной аминокислотной последовательности, по меньшей мере состоящую из от 1-3 аминокислот до полной конкретной части смежных аминокислот SEQ IDNO: 9. Вообще, антитело человека или антигенсвязывающий фрагмент согласно данному изобретению будет содержать антигенсвязывающую область, которая включает по меньшей мере одну гипервариабельную область человека (CDR1, CDR2 и CDR3), или вариант по меньшей мере одной вариабельной области тяжелой цепи и по меньшей мере одну гипервариабельную область человека (CDR1, CDR2 и CDR3),или вариант по меньшей мере одной вариабельной области легкой цепи. В качестве неограничивающего примера антитело или антигенсвязывающая часть или вариант, может содержать по меньшей мере одинCDR3 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 3, и/или CDR3 легкой цепи, имеющий аминокислотную последовательность SEQ ID NO: 6. В конкретном варианте антитело или антигенсвязывающий фрагмент может иметь антигенсвязывающую область, которая содержит по меньшей мере часть по меньшей мере одного CDR тяжелой цепи (т.е. CDR1, CDR2 и/или CDR3), имеющего аминокислотную последовательность соответствующего CDR 1, 2 и/или 3 (например, SEQ ID NO: 1, 2, и/или 3). В другом конкретном варианте антитело или антигенсвязывающая часть или вариант может содержать по меньшей мере антигенсвязывающую область, которая включает по меньшей мере часть по меньшей мере одной CDR легкой цепи (т.е. CDR1, CDR2 и/или CDR3), имеющей аминокислотную последовательность соответствующих CDR 1, 2 и/или 3 (например, SEQ ID NO: 4, 5 и/или 6). В предпочтительном варианте три CDR тяжелой цепи и три CDR легкой цепи антитела или антигенсвязывающего фрагмента имеют аминокислотную последовательность соответствующей CDR по меньшей мере одного из мАт 12 В 75, С 340 или любых других, которые описаны в данной заявке. Такие антитела можно получить посредством химического связывания друг с другом разных частей (например, CDR,каркаса) антитела с использованием обычных способов, путем получения и экспрессии (например, одной- 14006673 или более) молекул нуклеиновой кислоты, которые кодируют антитело, используя обычные способы на основе технологии рекомбинантной ДНК или используя любой другой подходящий способ. Анти-IL-12-антитело может содержать по меньшей мере одну вариабельную область тяжелой или легкой цепи, имеющую определенную аминокислотную последовательность. Например, в предпочтительном варианте анти-IL-12-антитело содержит по меньшей мере одну вариабельную область тяжелой цепи, необязательно имеющую аминокислотную последовательность SEQ ID NO: 7, и/или по меньшей мере одну вариабельную область легкой цепи, необязательно имеющую аминокислотную последовательность SEQ ID NO: 8. Антитела, которые связываются с IL-12 человека и которые содержат определенную вариабельную область тяжелой или легкой цепи, можно получить, используя подходящие способы, такие как фаговый дисплей (Katsube, Y., et al., Int J. Mol. Med, 1(5):863-868 (1998, или способы, в которых используют трансгенных животных, которые известны в данной области и/или описаны в данной заявке. Например, трансгенную мышь, содержащую функционально реаранжированный трансген тяжелой цепи иммуноглобулина человека и трансген, включающий ДНК из локуса легкой цепи иммуноглобулина человека, который может подвергаться функциональной реаранжировке, можно иммунизировать IL-12 человека или его фрагментом, чтобы вызвать продуцирование антител. При желании антитело-продуцирующие клетки можно выделить и можно получить гибридомы или другие иммортализованные антитело-продуцирующие клетки, как описано в данной заявке и/или известно в данной области. Альтернативно, антитело, конкретную часть или вариант можно экспрессировать с использованием кодирующей нуклеиновой кислоты или ее части, в подходящей клетке-хозяине. Изобретение также относится к антителам, антигенсвязывающим фрагментам, цепям иммуноглобулинов и CDR, содержащим аминокислоты в последовательности, которая по существу является такой же,как аминокислотная последовательность, описанная в данной заявке. Предпочтительно такие антитела или антигенсвязывающие фрагменты и антитела, содержащие такие цепи или CDR, могут связывать IL12 человека с высокой аффинностью (например, при KD меньше или равном примерно 10-9 М). Аминокислотные последовательности, которые по существу являются такими же, как последовательности, описанные в данной заявке, включают последовательности, содержащие консервативные аминокислотные замены, а также делеции и/или инсерции аминокислот. Консервативные аминокислотные замены относятся к замене первой аминокислоты второй аминокислотой, которая обладает химическими и/или физическими свойствами (например, зарядом, структурой, полярностью, гидрофобностью/гидрофильностью),которые сходны со свойствами первой аминокислоты. Консервативные замены включают замену одной аминокислоты другой в пределах следующих групп: лизин (K), аргинин (R) и гистидин (Н); аспартат (D) и глутамат (Е); аспарагин (N), глутамин (Q), серин (S), треонин (Т), тирозин (Y); K, R, H, D и Е; аланин(А), валин (V), лейцин (L), изолейцин (I), пролин (Р), фенилаланин (F), триптофан (W), метионин (М),цистеин (С) и глицин (G); F, W и Y; С, S и Т. Коды аминокислот Аминокислоты, которые составляют анти-IL-12-антитела согласно данному изобретению, часто обозначают сокращенно. Названия аминокислот можно указывать, обозначая аминокислоту однобуквенным кодом, трехбуквенным кодом, наименованием или трехнуклеотидным кодоном(ами), которые хорошо известны в данной области (см., Alberts, В., et al., Molecular Biology of The Cell, Third Ed., Garland Анти-IL-12-антитело согласно данному изобретению может содержать одну или более аминокислотных замен, делеций или добавлений, либо в результате естественных мутаций, либо в результате искусственных манипуляций, как описано в данной заявке. Конечно, количество аминокислотных замен, которое сможет сделать специалист в данной области,зависит от многих факторов, включая факторы, описанные выше. Вообще говоря, количество аминокислотных замен, инсерций или делеций для любого данного белка, полученного из Ig против IL-12, фрагмента или варианта, не будет превышать 40, 30, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2,1, а именно, 1-30 или любой интервал или значение в указанном диапазоне, как описано в данной заявке. Аминокислоты в анти-IL-12-антителе согласно данному изобретению, которые необходимы для функционирования, можно идентифицировать способами, известными в данной области, такими как сайт-направленный мутагенез или мутагенез на основе сканирования аланином (например, Ausubel, выше, главы 8, 15; Cunningham and Wells, Science 244:1081-1085 (1989. Последняя методика заключается во введении одиночных аланиновых мутаций в каждом остатке молекулы. Затем полученные в результате мутантные молекулы тестируют в отношении биологической активности, такой как по меньшей мере одна активность, нейтрализующая IL-12, но не ограничиваясь указанным. Сайты, которые являются критическими для связывания антитела, также можно идентифицировать в результате структурного анализа,такого как кристаллизация, ядерный магнитный резонанс или фотоаффинное мечение (Smith, et al., J.Mol. Biol. 224:899-904 (1992) и de Vos, et al., Science 255:306-312 (1992. Анти-IL-12-антитела согласно данному изобретению могут включать, но не ограничены указанным,по меньшей мере одну часть, последовательность или комбинацию, выбранную из аминокислот в количестве от 5 до всех смежных аминокислот, по меньшей мере одной из SEQ ID NO: l, 2, 3, 4, 5, 6.IL-12-антитела или специфичные части или варианты согласно данному изобретению могут включать, но не ограничены указанным, по меньшей мере одну часть, последовательность или комбинацию,выбранную по меньшей мере из 3-5 смежных аминокислот SEQ ID NO: l, 5-17; смежных аминокислотSEQ ID NO: 2, 5-10; смежных аминокислот SEQ ID NO: 3, 5-11; смежных аминокислот SEQ ID NO: 4, 57; смежных аминокислот SEQ ID NO: 5; 5-9; смежных аминокислот SEQ ID NO: 6; Leu21, Lys76, Met83,Ser85 SEQ ID NO: 7. Анти-IL-12-антитело дополнительно необязательно может содержать полипептид, имеющий, по меньшей мере, одну из последовательностей, составляющих 70-100% последовательности из 5, 17, 10, 11, 7, 9, 119 или 108 смежных аминокислот, по меньшей мере, одной из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7 или 8. В одном варианте аминокислотная последовательность цепи иммуноглобулина или ее части (например, вариабельной области, CDR) обладает примерно 70-100% идентичностью (например, 70, 71, 72,73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100 или любой интервал или значение в указанном диапазоне) с аминокислотной последовательностью соответствующей цепи по меньшей мере одной из SEQ ID NO: 7, 8. Например, аминокислотная последовательность вариабельной области легкой цепи можно сравнить с последовательностью SEQ ID NO: 8, или аминокислотную последовательность CDR3 тяжелой цепи можно сравнить с SEQ ID NO: 3. Предпочтительно 70-100% идентичность аминокислот (т.е., 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100 или любой ин- 16006673 тервал или значение в указанном диапазоне) определяют с использованием подходящего компьютерного алгоритма, известного в данной области. Примеры последовательностей вариабельных областей тяжелой цепи и легкой цепи представлены вSEQ ID NO: 7 и 8. Антитела согласно данному изобретению или их конкретные варианты могут содержать любое количество смежных аминокислотных остатков представляющего интерес антитела, причем это количество выбрано из группы целых чисел, составляющих 10-100% количества смежных остатков в анти-IL-12-антителе. Необязательно указанная субпоследовательность смежных аминокислот составляет в длину, по меньшей мере, примерно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160,170, 180, 190, 200, 210, 220, 230, 240, 250 или больше аминокислот, или любой интервал или значение в указанном диапазоне. Кроме того, количество таких субпоследовательностей может равняться любому целому числу, выбранному из группы, состоящей из от 1 до 20, а именно по меньшей мере 2, 3, 4 или 5. Как будет понятно специалистам в данной области, данное изобретение включает по меньшей мере одно биологически активное антитело согласно данному изобретению. Биологически активные антитела имеют удельную активность, составляющую по меньшей мере 20, 30 или 40% и предпочтительно по меньшей мере 50, 60, или 70%, и наиболее предпочтительно по меньшей мере 80, 90 или 95-100% активности нативного (несинтетического), эндогенного или родственного и известного антитела. Способы анализа и количественных измерений ферментативной активности и субстратной специфичности хорошо известны специалистам в данной области. В другом аспекте изобретение относится к антителам человека и антигенсвязывающим фрагментам,которые описаны в данной заявке, которые модифицируют посредством ковалентного связывания с органическим фрагментом. Такая модификация может давать антитело или антигенсвязывающий фрагмент с улучшенными фармакокинетическими свойствами (например, увеличенным временем полужизни в сыворотке in vivo). Органический фрагмент может представлять собой неразветвленную или разветвленную гидрофильную полимерную группу, группу жирной кислоты или группу эфира жирной кислоты. В конкретном варианте гидрофильная полимерная группа может иметь молекулярную массу, составляющую примерно от 800 до 120000 Да, и может являться полиалкангликолем (например, полиэтиленгликолем (ПЭГ), полипропиленгликолем (ППГ, углеводным полимером, полимером аминокислот или поливинилпирролидоном, и группа жирной кислоты или эфира жирной кислоты может содержать примерно от восьми до сорока атомов углерода. Модифицированные антитела и антигенсвязывающие фрагменты согласно изобретению могут содержать один или более органических фрагментов, которые прямо или опосредованно ковалентно связаны с антителом. Каждый органический фрагмент, который связывают с антителом или антигенсвязывающим фрагментом согласно изобретению, независимо может представлять собой гидрофильную полимерную группу, группу жирной кислоты или группу эфира жирной кислоты. В используемом здесь смысле термин жирная кислота охватывает монокарбоновые кислоты и дикарбоновые кислоты. Гидрофильная полимерная группа в качестве используемого в данном описании термина относится к органическому полимеру, который растворим в воде лучше, чем в октане. Например, полилизин лучше растворим в воде, чем в октане. Таким образом, данное изобретение охватывает антитело, модифицированное ковалентным связыванием с полилизином. Гидрофильные полимеры, подходящие для модифицирования антител согласно изобретению, могут быть неразветвленными или разветвленными и включают,например, полиалкангликоли (например, ПЭГ, монометоксиполиэтиленгликоль (мПЭГ), ППГ и тому подобное), углеводы (например, декстран, целлюлоза, олигосахариды, полисахариды и тому подобное),полимеры гидрофильных аминокислот (например, полилизин, полиаргинин, полиаспартат и тому подобное), оксиды полиалканов (например, оксид полиэтилена, оксид полипропилена и тому подобное) и поливинилпирролидон. Предпочтительно гидрофильный полимер, которым модифицируют антитело согласно данному изобретению, имеет молекулярную массу примерно от 800 до 150000 дальтон в виде отдельной молекулярной единицы. Например, можно использовать ПЭГ 5000 и ПЭГ 20000, где подстрочный индекс означает среднюю молекулярную массу полимера в дальтонах. Гидрофильная полимерная группа может быть замещена одной-шестью алкильными группами, группами жирных кислот и эфиров жирных кислот. Гидрофильные полимеры, которые замещены группой жирной кислоты или эфира жирной кислоты, можно получить, используя подходящие способы. Например, полимер, содержащий аминогруппу,можно связать с карбоксилатом жирной кислоты или эфира жирной кислоты, и активированный карбоксилат (например, активированный N,N-карбонилдиимидазолом) жирной кислоты или эфира жирной кислоты может быть связан с гидроксильной группой полимера. Жирные кислоты и эфиры жирных кислот, подходящие для модифицирования антител согласно изобретению, могут быть насыщенными или могут содержать одну или более единиц для насыщения. Жирные кислоты, которые подходят для модифицирования антител согласно изобретению, включают,например, н-додеканоат (C12, лаурат), н-тетрадеканоат (С 14, миристат), н-октадеканоат (C18, стеарат), нэйкозаноат (С 20, арахидат), н-докозаноат (С 22, бегенат), н-триаконтаноат (С 30), н-тетраконтаноат (С 40),цис-9-октадеканоат (C18, олеат), полностью цис-5,8,11,14-эйкозатетраеноат (С 20, арахидонат), октандикарбоновая кислота, тетрадекандикарбоновая кислота, октадекандикарбоновая кислота, докозандикарбоновая кислота и тому подобное. Подходящие эфиры жирных кислот включают моноэфиры дикарбоно- 17006673 вых кислот, которые содержат неразветвленную или разветвленную группу низшего алкила. Группа низшего алкила может содержать от одного до примерно двенадцати, предпочтительно от одного до примерно шести атомов углерода. Модифицированные антитела человека и антигенсвязывающие фрагменты можно получить, используя подходящие способы, такие как реакцию с одним или более модифицирующими агентами. Модифицирующий агент в качестве используемого в данном описании термина относится к подходящей органической группе (например, гидрофильному полимеру, жирной кислоте, эфиру жирной кислоты),которая содержит активирующую группу. Активирующая группа означает химический фрагмент или функциональную группу, которая в соответствующих условиях может реагировать со второй химической группой, образуя при этом ковалентную связь между модифицирующим агентом и второй химической группой. Например, реагирующие с амином активирующие группы включают электрофильные группы, такие как тозилат, мезилат, галоген (хлор, бром, фтор, иод), сложные Nгидроксисукцинимидные эфиры (NHS) и тому подобное. Активирующие группы, которые могут реагировать с тиолами, включают, например, малеимид, иодацетил, акрилолил, пиридилдисульфиды, тиол 5 тиол-2-нитробензойной кислоты (TNB-тиол) и тому подобное. Альдегидная функциональная группа может быть связана с молекулами, содержащими амин или гидразид, и азидная группа может реагировать с группой трехвалентного фосфора с образованием фосфорамидатной или фосфоримидной связей. Подходящие способы введения активирующих групп в молекулы известны в данной области (см., например, Hermanson, G.T.,Bioconjugate Techniques, Academic Press: San Diego, CA (1996. Активирующая группа может быть связана непосредственно с органической группой (например, гидрофильным полимером, жирной кислотой, эфиром жирной кислоты) или через линкерный фрагмент, например, дивалентную C1-C12-группу, в которой один или более атомов углерода могут быть замещены гетероатомом, таким как кислород, азот или сера. Подходящие линкерные фрагменты включают, например, тетраэтиленгликоль, -(СН 2)3-, -NH-(CH2)6-NH-, -(CH2)2-NH- и -CH2-O-CH2CH2-O-CH2-CH2-O-CH-NH-. Модифицирующие агенты, которые содержат линкерный фрагмент, можно, например, получить взаимодействием моно-Вос-алкилдиамина (например, моно-Вос-этилендиамина, моно-Восдиаминогексана) с жирной кислотой в присутствии 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) с образованием амидной связи между свободным амином и карбоксилатом жирной кислоты. Защитную Восгруппу можно удалить из продукта обработкой трифторуксусной кислотой (ТФУ), чтобы открыть первичный амин, который можно связать с другим карбоксилатом, которые описаны, или можно подвергнуть реакции с малеиновым ангидридом, и полученный в результате продукт циклизовать с получением активированного малеимидного производного жирной кислоты. (См., например, Thompson, et al., WO 92/16221, инструкции,приведенные в указанной работе, включены в данное описание в виде ссылки в полном объеме). Модифицированные антитела согласно изобретению можно получить взаимодействием антитела человека или антигенсвязывающего фрагмента с модифицирующим агентом. Например, с антителом можно связать органические компоненты не сайт-специфичным образом, используя модифицирующий агент, реагирующий с амином, например, сложный NHS-эфир ПЭГ. Модифицированные антитела человека или антигенсвязывающие фрагменты также можно получить восстановлением дисульфидных связей(например, внутрицепочечных дисульфидных связей) антитела или антигенсвязывающего фрагмента. Затем восстановленное антитело или антигенсвязывающий фрагмент можно подвергнуть взаимодействию с модифицирующим агентом, реагирующим с тиолом, чтобы получить модифицированное антитело согласно изобретению. Модифицированные антитела человека или антигенсвязывающие фрагменты,содержащие органический компонент, который связывается со специфичными сайтами антитела согласно данному изобретению, можно получить, используя подходящие способы, такие как обратимый протеолиз (Fisch et al., Bioconjugate Chem., 3:147-153 (1992); Werlen et al., Bioconjugate Chem., 5:411-417 (1994);al., Biotechnol. Bioeng. 56(4):456-463 (1997 и способы, описанные в Hermanson, G. T. Bioconjugate Techniques, Academic Press: San Diego, CA (1996). Антиидиотипические антитела к белковым композициям, полученным из IG против IL-12 Кроме моноклональных или химерных анти-IL-12-антител данное изобретение также относится к антиидиотипическому (анти-Id)-антителу, специфичному для таких антител согласно изобретению. Анти-Id-антитело представляет собой антитело, которое узнает уникальные детерминанты, обычно связанные с антигенсвязывающей областью другого антитела. Анти-Id можно получить иммунизацией животного того же вида и генетического типа (например, линии мышей), что и источник Id-антитела, антителом или его областью, содержащей CDR. Иммунизированное животное будет распознавать и отвечать на идиотипические детерминанты иммунизирующего антитела и продуцировать анти-Id-антитело. Aнти-Idантитело также можно использовать в качестве иммуногена, чтобы индуцировать иммунный ответ еще и у другого животного, продуцирующего так называемое анти-анти-Id-антитело. Белковые композиции, полученные из IG против IL-12 Данное изобретение также относится по меньшей мере к одной композиции анти-IL-12-антитела,содержащей по меньшей мере одно, по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть или более анти-IL-12-антител, которые описаны в данной заявке и/или известны в данной области, которые представлены композицией, смесью или фор- 18006673 мой неприродного происхождения. Такие композиции включают композиции неприродного происхождения, содержащие по меньшей мере один или два полноразмерных, С- или N-усеченных варианта, домены, фрагменты или специфические варианты аминокислотной последовательности анти-IL-12 антитела, выбранные из группы, состоящей из 70-100% смежных аминокислот SEQ ID NO: 1, 2, 3, 4, 5, 6,7 или 8 или их специфичных фрагментов, доменов или вариантов. Предпочтительно композиции полученного из анти-IL-12 белка, фрагмента или варианта включают по меньшей мере одну или две последовательности анти-IL-12-антитела полной длины, фрагментов, доменов или вариантов, как например по меньшей мере одной части, содержащей CDR, составляющие 70-100% SEQ ID NO: 1, 2, 3, 4, 5, 6 или их специфичных фрагментов, доменов или вариантов. Кроме того, предпочтительные композиции содержат 40-99% по меньшей мере одной из последовательностей, составляющей 70-100% SEQ ID NO: 1, 2, 3, 4, 5,6 или их специфичных фрагментов, доменов или вариантов. Процентное содержание таких композиций означает содержание по массе, объему, концентрации, молярности или моляльности в виде жидких или сухих растворов, смесей, суспензий, эмульсий или коллоидов, известных в данной области или описанных в данной заявке. Композиции анти-IL-12-антитела согласно данному изобретению могут дополнительно содержать по меньшей мере одно из любого подходящего и эффективного количества композиции или фармацевтической композиции, включающей по меньшей мере одно анти-IL-12-антитело, для клетки, ткани, органа,животного или пациента, который нуждается в таком модулировании, обработке или терапии, кроме того, необязательно дополнительно включающей по меньшей мере один компонент, выбранный из группы,состоящей по меньшей мере из одного TNF-антагониста (например, TNF-антитела или фрагмента, растворимого рецептора TNF или фрагмента, их слитых белков или малой молекулы TNF-антагониста),противоревматического средства (например, метотрексата, ауранофина, ауротиоглюкозы, азатиоприна,этанерцепта, натрий-тиомалата золота, гидроксихлорохинсульфата, лефлуномида, сульфазальцина), миорелаксанта, наркотического, нестероидного противовоспалительного лекарственного средства (НПВС),анальгезирующего, анестезирующего, седативного средства, местного анестетика, нейромышечного блокатора, противомикробного средства (например, аминогликозида, противогрибкового, противопаразитического, противовирусного средства, карбапенема, цефалоспорина, флурорхинолона, макролида, пенициллина, сульфонамида, тетрациклина, других противомикробных средств), противопсориазного средства, кортикостероида, анаболического стероида, средства, имеющего отношение к диабету, минерального,пищевого, тиреоидного средства, витамина, связанного с кальцием гормона, противодиарейного, противокашлевого, противорвотного, противоязвенного, слабительного, антикоагулянтного средства, эритропоэтина (например, эпоэтина альфа), филграстима (например, G-CSF, неупоген), сарграмостима (GMCSF, лейкин), средства для иммунизации, иммуноглобулина, иммуносупрессора (например, базиликсимаб, циклоспорин, даклизумаб), гормона роста, гормонозамещающего лекарственного средства, модулятора рецептора эстрогена, мидриатического, расширяющего, алкилирующего агента, антиметаболита,ингибитора митотического деления, радиофармацевтического средства, антидепрессанта, антиманиакального средства, антипсихотического, анксиолитического, гипнотического, симпатомиметического средства, стимулятора, донепезила, такрина, антиастматического средства, бета-агониста, стероида для ингаляции, ингибитора лейкотриена, метилксантина, кромолина, эпинефрина или аналога, дорназы альфа (пульмозим), цитокина или антагониста цитокина. Неограничивающие примеры таких цитокинов включают, но не ограничены указанным, любой из интерлейкинов с IL-1 по IL-23. Подходящие дозы известны в данной области. См., например, Wells et al., eds., Pharmacotherapy Handbook, 2nd Edition,Appleton and Lange, Stamford, CT (2000); PDR Pharmacopoeia, Tarascon Pocket Pharmacopoeia 2000, DeluxeEdition, Tarascon Publishing, Loma Linda, CA (2000), каждая из указанных публикаций включена в данное описание в виде ссылки в полном объеме. Такие противораковые и антимикробные средства также могут включать молекулы токсинов, которые ассоциируют, связывают, готовят в виде совместной композиции или совместно вводят по меньшей мере с одним антителом согласно данному изобретению. Токсин необязательно может действовать, избирательно уничтожая патологическую клетку или ткань. Патологической клеткой может быть раковая клетка или другая клетка. Такие токсины могут быть представлены без ограничения очищенным или рекомбинантным токсином или фрагментом токсина, содержащим по меньшей мере один функциональный цитотоксичный домен токсина, например, выбранный по меньшей мере из одного рицина, дифтерийного токсина, змеиного токсина или бактериального токсина. Термин токсин также включает как эндотоксины, так и экзотоксины, продуцируемые любыми бактериями или вирусами природного происхождения, мутантными или рекомбинантными, которые могут вызывать любое патологическое состояние у людей и других млекопитающих, включая токсический шок, который может приводить к смерти. Такие токсины могут включать, но не ограничены указанным, термолабильный энтеротоксин энтеротоксигенной Е. Coli (LT), термостабильный энтеротоксин (ST), цитотоксин Shigella, энтеротоксины Aeromonas,токсин 1 синдрома токсического шока (TSST-1), стафилококковый энтеротоксин A (SEA), В (SEB) или С(SEC), стрептококковые энтеротоксины и тому подобное. Указанные бактерии включают, но не ограничены указанным, штаммы или виды энтеротоксигенной Е. coli (ЕТЕС), энтерогеморрагической Е. Colied., pp 1-13, Little, Brown and Co., Boston, (1990); Evans et al., eds., Bacterial Infections of Humans: Epidemiology and Control, 2d. Ed., pp 239-254, Plenum Medical Book Co., New York (1991); Mandell et al., Principles and Practice of Infectious Diseases, 3d. Ed., Churchill Livingstone. New York (1990); Berkow et al., eds.,The Merck Manual, 16th edition, Merck and Co., Rahway, N.J., 1992; Wood et al., FEMS Microbiology Immunology, 76: 121-134 (1991); Marrack et al., Science, 248:705-711 (1990), содержание каждой публикации включено в данное описание в виде ссылки в полном объеме. Соединения, композиции или комбинации анти-IL-12-антитела согласно данному изобретению могут дополнительно содержать по меньшей мере одно из любых подходящих вспомогательных средств,без ограничения, таких как разбавитель, связывающий агент, стабилизатор, буферы, соли, липофильные растворители, консервант, адъювант и тому подобное. Предпочтительны фармацевтически приемлемые вспомогательные средства. Неограничивающие примеры способов получения таких стерильных растворов хорошо известны в данной области, без ограничения, такие как способы, описанные Gennaro, Ed., Rentington's PharmaceuticalSciences, 18h Edition, Mack Publishing Co. (Easton, PA) 1990. Обычным способом можно выбрать фармацевтически приемлемые носители, которые подходят для способа введения, растворимости и/или стабильности композиции анти-IL-12-антитела, фрагмента или варианта, которые хорошо известны в данной области или описаны в данной заявке. Фармацевтические эксципиенты и добавки, пригодные в данной композиции, включают, но не ограничены указанным, белки, пептиды, аминокислоты, липиды и углеводы (например, сахара, включая моносахариды, ди-, три-, тетра- и олигосахариды; производные сахара, такие как альдиты, альдоновые кислоты, зтерифицированные сахара, и тому подобное; и полисахариды или полимеры сахаров), которые могут присутствовать отдельно или в комбинации, составляя отдельно или в комбинации 1-99,99% по массе или объему. Примеры белковых эксципиентов включают сывороточный альбумин, такой как сывороточный альбумин человека (HSA), рекомбинантный альбумин человека (rНА), желатин, казеин и тому подобное. Типичные компоненты аминокислот/антитела, которые также могут функционировать в качестве средства, обладающего буферными свойствами, включают аланин, глицин, аргинин, бетаин,гистидин, глутаминовую кислоту, аспарагиновую кислоту, цистеин, лизин, лейцин, изолейцин, валин,метионин, фенилаланин, аспартам и тому подобное. Одной предпочтительной аминокислотой является глицин. Углеводные эксципиенты, подходящие для применения в изобретении, включают, например, моносахариды, такие как фруктоза, мальтоза, галактоза, глюкоза, D-манноза, сорбоза и тому подобные; дисахариды, такие как лактоза, сахароза, трегалоза, целлобиоза и тому подобное; полисахариды, такие как раффиноза, мелезитоза, мальтодекстрины, декстраны, крахмалы и тому подобное; и альдиты, такие как маннит, ксилит, мальтит, лактит, ксилит сорбит (глюцит), миоинозит и тому подобное. Предпочтительными углеводными эксципиентами для применения в данном изобретении являются маннит, трегалоза и раффиноза. Композиции анти-IL-12-антитела также могут включать буфер или средство корректировки рН; обычно буфером является соль, полученная из органической кислоты или основания. Типичные буферы включают соли органических кислот, такие как соли лимонной кислоты, аскорбиновой кислоты, глюконовой кислоты, угольной кислоты, винной кислоты, янтарной кислоты, уксусной кислоты или фталевой кислоты; трис-буфер, буфер на основе гидрохлорида трометамина или фосфатный буфер. Предпочтительными буферами для применения в данных композициях являются соли органических кислот, такие как цитрат. Кроме того, композиции анти-IL-12-антитела согласно изобретению могут включать полимерные эксципиенты/добавки, такие как поливинилпирролидоны, фиколы (полимерный сахар), декстраты (например, циклодекстрины, такие как 2-гидроксипропилциклодекстрин), полиэтиленгликоли, отдушки,антимикробные средства, подсластители, антиоксиданты, антистатические средства, поверхностноактивные вещества (например, полисорбаты, такие как твин 20 и твин 80), липиды (например, фосфолипиды, жирные кислоты), стероиды (например, холестерин) и хелатирующие агенты (например,EDTA). Указанные и дополнительные известные фармацевтические эксципиенты и/или добавки, подходящие для применения в композициях анти-IL-12-антитела, части или варианта согласно изобретению, известны в данной области, например, перечислены в Remington: The Science and Practice of Pharmacy,19th ed., Williams and Williams, (1995), и в Physician's Desk Reference, 52nd ed., Medical Economics, Montvale, NJ (1998), описания которых в полном объеме включены в данное описание в виде ссылки. Пред- 20006673 почтительными материалами носителей или эксципиентов являются углеводы (например, сахариды и альдиты) и буферы (например, цитрат) или полимерные агенты. Составы Как указано выше, изобретение относится к стабильным составам, которые предпочтительно представляют собой фосфатный буфер с физиологическим раствором или выбранной солью, а также сохраняемые растворы и составы, содержащие консервант, а также составы с консервантом множественного применения, подходящие для фармацевтического или ветеринарного применения, содержащие по меньшей мере одно анти-IL-12-антитело в фармацевтически приемлемом составе. Составы для хранения содержат по меньшей мере один известный консервант или необязательно консервант, выбранный из группы, состоящей по меньшей мере из одного фенола, мета-крезола, пара-крезола, орто-крезола, хлоркрезола, бензилового спирта, нитрита фенилртути, феноксиэтанола, формальдегида, хлорбутанола, хлорида магния (например, гексагидрата), алкилпарабена (метил-, этил-, пропил-, бутил- и тому подобное), хлорида бензалкония, хлорида бензэтония, дегидроацетата натрия и тимеросала, или их смесей в водном разбавителе. Можно использовать любую подходящую концентрацию или смесь, которые известны в данной области, такие как 0,001-5%, или любой интервал или значение в указанном диапазоне, а именно,без ограничения, 0,001; 0,003; 0,005; 0,009; 0,01; 0,02; 0,03; 0,05; 0,09; 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9; 1,0; 1,1; 1,2; 1,3; 1,4; 1,5; 1,6; 1,7; 1,8; 1,9; 2,0; 2,1; 2,2; 2,3; 2,4; 2,5; 2,6; 2,7; 2,8; 2,9; 3,0; 3,1; 3,2; 3,3; 3,4; 3,5; 3,6; 3,7; 3,8; 3,9; 4,0; 4,3; 4,5; 4,6; 4,7; 4,8; 4,9 или любой интервал или значение в указанном диапазоне. Неограничивающие примеры включают составы без консервантов, и составы, содержащие 0,12% мета-крезола (например, 0,2; 0,3; 0,4; 0,5; 0,9; 1,0%), 0,1-3% бензилового спирта (например, 0,5; 0,9; 1,1; 1,5; 1,9; 2,0; 2,5%), 0,001-0,5% тимеросала (например, 0,005; 0,01), 0,001-2,0% фенола (например,0,05; 0,25; 0,28; 0,5; 0,9; 1,0%), 0,0005-1,0% алкилпарабена(ов) (например, 0,00075; 0,0009; 0,001; 0,002; 0,005; 0,0075; 0,009; 0,01; 0,02; 0,05; 0,075; 0,09; 0,1; 0,2; 0,3; 0,5; 0,75; 0,9; 1,0%) и тому подобное. Как указано выше, изобретение относится к продукту производства, содержащему упаковочный материал и по меньшей мере один флакон, содержащий раствор по меньшей мере одного анти-IL-12 антитела с входящими в рецептуру буферами и/или консервантами, необязательно в водном разбавителе,где указанный упаковочный материал содержит метку, на которой указано, что такой раствор можно хранить в течение периода времени, равного 1, 2, 3, 4, 5, 6, 9, 12, 18, 20, 24, 30, 36, 40, 48, 54, 60, 66, 72 часам или более. Изобретение, кроме того, включает продукт производства, содержащий упаковочный материал, первый флакон, содержащий по меньшей мере одно лиофилизованное анти-IL-12-антитело, и второй флакон, содержащий водный разбавитель входящего в рецептуру буфера или консерванта, при этом указанный упаковочный материал имеет метку, в которой дана инструкция для пациента о том, как перерастворить по меньшей мере одно анти-IL-12-антитело в водном разбавителе, чтобы получить раствор, который можно хранить в течение периода времени, равного двадцати четырем часам или более. По меньшей мере одно анти-IL-12-антитело, используемое согласно данному изобретению, можно получить рекомбинантными способами, в том числе из клеток млекопитающих или трансгенных препаратов, или можно получить из других биологических источников, которые описаны в данной заявке или известны в данной области. Диапазон по меньшей мере одного анти-IL-12-антитела в продукте согласно данному изобретению,включает количества, которые при перерастворении в случае влажной/сухой системы дают концентрации примерно от 1,0 мкг/мл до примерно 1000 мг/мл, хотя пригодными являются более низкие и более высокие концентрации, которые зависят от запланированного носителя для доставки, например состав в виде растворов будет отличаться от композиций трансдермального пластыря, композиций для введения легочным, трансмукозальным или посредством осмотического или микронасоса. Предпочтительно водный разбавитель дополнительно необязательно содержит фармацевтически приемлемый консервант. Предпочтительные консерванты включают консерванты, выбранные из группы,состоящей из фенола, мета-крезола, пара-крезола, орто-крезола, хлоркрезола, бензилового спирта, алкилпарабена (метил-, этил-, пропил-, бутил- и тому подобное), хлорида бензалкония, хлорида бензэтония, дегидроацетата натрия и тимеросала, или их смесей. Концентрация консерванта, используемого в композиции, представляет собой концентрацию, достаточную для получения антимикробного эффекта. Такие концентрации зависят от выбранного консерванта и легко могут быть определены специалистом в данной области. Необязательно, но предпочтительно к разбавителю можно добавлять другие эксципиенты, например агенты изотоничности, буферы, антиоксиданты, усилители консервантов. Агент изотоничности, такой как глицерин, широко используется в известных концентрациях. Предпочтительно добавляют физиологически допустимый буфер, чтобы обеспечить лучший контроль рН. Композиции могут охватывать широкие пределы рН, такие как примерно от рН 4 до рН 10, и предпочтительно находятся в пределах примерно от рН 5 до рН 9, и наиболее предпочтительно в пределах примерно от 6,0 до 8,0. Предпочтительно композиции согласно данному изобретению имеют значение рН примерно от 6,8 до 7,8. Предпочтительные буферы включают фосфатные буферы, наиболее предпочтительно фосфат натрия, особенно фосфатно-солевой буфер (ФСБ).- 21006673 Другие добавки, такие как фармацевтически приемлемые солюбилизаторы, подобные твину 20 (монолаурат полиоксиэтилен (20)сорбитана), твину 40 (монопальмитат полиоксиэтилен(20)сорбитана), твину 80 (моноолеат полиоксиэтилен(20)сорбитана), плюронику F68 (блок-сополимер полиэксиэтилена и полиоксипропилена) и ПЭГ (полиэтиленгликоль), или неионные поверхностно-активные вещества, такие как полисорбат 20 или 80 или полоксамер 184 или 188, Pluronic полил, другие блок-сополимеры и хелатирующие агенты, такие как EDTA и EGTA, необязательно можно добавлять в составы или композиции,чтобы уменьшить агрегацию. Указанные добавки особенно пригодны в случае использования для введения композиции насоса или пластмассовой емкости. Присутствие фармацевтически приемлемого поверхностно-активного вещества уменьшает склонность белка к агрегации. Композиции согласно данному изобретению можно получить с использованием методики, которая состоит в смешивании по меньшей мере одного анти-IL-12-антитела и консерванта, выбранного из группы, состоящей из фенола, мета-крезола, пара-крезола, орто-крезола, хлоркрезола, бензилового спирта,алкилпарабена (метил-, этил-, пропил-, бутил- и тому подобное), хлорида бензалкония, хлорида бензэтония, дегидроацетата натрия и тимеросала, или их смесей в водном разбавителе. Смешивание по меньшей мере одного анти-IL-12-антитела и консерванта в водном разбавителе выполняют, используя обычные методики растворения и смешивания. Например, чтобы получить подходящую композицию, измеренное количество по меньшей мере одного анти-IL-12-антитела в забуференном растворе объединяют с требуемым консервантом в забуференном растворе в количествах, достаточных для обеспечения требуемых концентраций белка и консерванта. Специалисту в данной области будут понятны изменения указанной методики. Например, порядок добавления компонентов, использование дополнительных добавок, температура и рН, при которых готовят композицию, все это относится к факторам, которые можно оптимизировать для используемой концентрации и способов введения. Заявляемые композиции можно предоставлять пациентам в виде прозрачных растворов или в виде двух флаконов, включая флакон по меньшей мере с одним лиофилизованным анти-IL-12-антителом, которое перерастворяют во втором флаконе, содержащем воду, консервант и/или эксципиенты, предпочтительно фосфатный буфер и/или физиологический раствор, и выбранную соль, в водном разбавителе. Либо один флакон с раствором, либо два флакона, когда требуется перерастворение, можно повторно использовать множество раз, и они могут быть достаточными для однократного или многократных циклов лечения пациента и таким образом могут обеспечивать более удобную схему лечения, чем имеющаяся в настоящее время. Заявляемые в пунктах формулы изобретения продукты производства применимы для введения в течение периода времени в диапазоне от немедленного введения до двадцати четырех часов или более. Следовательно, заявляемые в данном изобретении продукты производства предоставляют значительные преимущества для пациента. Композиции согласно изобретению необязательно могут безопасно храниться при температурах примерно от 2 до 40 С и сохранять биологическую активность белка в течение длительных периодов времени, таким образом, допустима метка на упаковке, указывающая, что раствор можно хранить и/или использовать в течение периода времени, равного 6, 12, 18, 24, 36, 48, 72 или 96 часам или более. В том случае, если используют разбавитель с консервантом, то в такой метке может быть указано применение до 1-12 месяцев, полгода, полтора года и/или два года. Растворы по меньшей мере одного анти-IL-12-антитела согласно изобретению можно приготовить по методике, которая включает смешивание по меньшей мере одного антитела в водном разбавителе. Смешивание выполняют, используя обычные способы растворения и перемешивания. Например, для приготовления подходящий разбавитель, измеренное количество по меньшей мере одного антитела в воде или буфере смешивают в количествах, достаточных для обеспечения требуемых концентраций белка и необязательно консерванта или буфера. Специалисту в данной области будут понятны вариации данной методики. Например, порядок добавления компонентов, использование дополнительных добавок,температура и рН, при которых готовят композицию, все это относится к факторам, которые можно оптимизировать в отношении используемой концентрации и способов введения. Заявляемые продукты можно предоставлять пациентам в виде прозрачных растворов, либо в виде двух флаконов, включая флакон по меньшей мере с одним лиофилизованным анти-IL-12-антителом, которое перерастворяют во втором флаконе, содержащем водный разбавитель. Либо один флакон с раствором, либо два флакона, когда требуется перерастворение, можно повторно использовать множество раз,и они могут быть достаточными для однократного или многократных циклов лечения пациента и таким образом могут обеспечивать более удобную схему лечения, чем имеющаяся в настоящее время. Заявляемые продукты можно непосредственно предоставлять пациентам, поставляя в аптеки, клиники или другие подобные учреждения и заведения прозрачные растворы или пары флаконов, включая флакон по меньшей мере с одним лиофилизированным анти-IL-12-антителом, которое перерастворяют во втором флаконе, содержащем водный разбавитель. Прозрачный раствор в данном случае может иметь объем до одного литра или даже больше, при условии большой емкости, из которой в аптеке или клинике можно брать небольшие части раствора по меньшей мере одного антитела один раз или множество раз для переноса в меньшие флаконы, и предоставлять их покупателям и/или пациентам.- 22006673 Общеизвестные устройства, содержащие такие системы отдельных флаконов, включают закрытые инжекторные устройства для доставки раствора, такие как BD Pens, BD Autojector, Humajecte, NovoPen, B-DPen, AutoPen и OptiPen, GenotropinPen, Genotronorm Pen, Humatro Pen, Reco-Pen,Roferon Pen, Biojector, inject, безыгольный инжектор с J-наконечником, Intraject, Medi-Ject, например,производимые или разработанныеLakes,NJ,www.bectondickenson.com), Disetronic (Burgdorf, Switzerland, www.disetronic.com), Bioject, Portland, Oregon (www.bioject.com); National Medical Products, Weston Medical (Peterborough, UK, www.westonmedical.com), Medi-Ject Corp (Minneapolis, MN, www.mediject.com). Общеизвестные устройства, содержащие систему двойных флаконов, включают закрытые инжекторные системы для перерастворения лиофилизированного лекарственного средства в картридже для доставки перерастворенного раствора,такие как HumatroPen. Продукты, описанные в данной заявке, включают упаковочный материал. На упаковочном материале кроме информации, требуемой органами государственного регулирования, указывают условия,при которых продукт можно использовать. Упаковочный материал согласно данному изобретению снабжен инструкциями для пациента о том, что следует перерастворить по меньшей мере одно анти-ILантитело в водном разбавителе, чтобы получить раствор, и использовать раствор в течение периода времени, равного 2-24 ч или более в случае влажного/сухого продукта в двух флаконах. В случае продукта в виде раствора в одном флаконе метка указывает, что такой раствор можно использовать в течение периода времени, равного 2-24 ч или более. Описанные в данной заявке продукты пригодны для применения в качестве фармацевтического продукта для человека. Композиции согласно данному изобретению можно приготовить по методике, которая включает смешивание по меньшей мере одного анти-IL-12-антитела и выбранного буфера, предпочтительно фосфатного буфера, содержащего физиологический раствор или выбранную соль. Смешивание по меньшей мере одного антитела и буфера в водном разбавителе выполняют, используя стандартные способы растворения и смешивания. Например, чтобы приготовить подходящую композицию, измеренное количество по меньшей мере одного антитела в воде или буфере объединяют с требуемым буферным агентом в воде в количествах, достаточных для обеспечения требуемых концентраций белка и буфера. Специалисту в данной области будут понятны вариации данной методики. Например, порядок добавления компонентов, использование дополнительных добавок, температура и рН, при которых готовят композицию,все это относится к факторам, которые можно оптимизировать для используемой концентрации и способов введения. Заявляемые стабильные композиции или композиции с консервантами можно предоставлять пациентам в виде прозрачных растворов или в виде двух флаконов, включая флакон по меньшей мере с одним лиофилизированным анти-IL-12-антителом, которое перерастворяют во втором флаконе, содержащем консервант или буфер и эксципиенты в водном разбавителе. Либо один флакон с раствором, либо два флакона, когда требуется перерастворение, можно повторно использовать множество раз, и они могут быть достаточными для однократного или многократных циклов лечения пациента и таким образом обеспечивают более удобную схему лечения, чем имеющаяся в настоящее время. По меньшей мере одно анти-IL-12-антитело либо в стабильных или содержащих консерванты композициях, либо в растворах, которые описаны в данной заявке, можно вводить пациенту согласно данному изобретению посредством множества способов доставки, включая п/к- или в/м-инъекцию; трансдермальный, легочный, трансмукозальный способы, имплантат, посредством осмотического насоса, картриджа, микронасоса или другими способами, которые понятны специалисту и хорошо известны в данной области техники. Терапевтические применения Данное изобретение также относится к способу модулирования или лечения по меньшей мере одного связанного с иммунной системой заболевания в клетке, ткани, органе, животном или у пациента,включая, но не ограничиваясь указанным, по меньшей мере, одно из следующих заболеваний - ревматоидный артрит, юношеский ревматоидный артрит, системный юношеский ревматоидный артрит, псориатический артрит, анкилозирующий спондилит, язва желудка, серонегативная артропатия, остеоартрит,воспалительное заболевание кишечника, язвенный колит, системная красная волчанка, антифосфолипидный синдром, иридоциклит/увеит/неврит зрительного нерва, идиопатический фиброз легких, системный васкулит/гранулематоз Вегенера, саркоидоз, орхит/процедуры обратной вазэктомии, аллергические/атопические заболевания, аллергический ринит, экзема, аллергический контактный дерматит, аллергический конъюнктивит, гиперчувствительный пневмонит, трансплантаты, отторжение трансплантата органа, реакция трансплантат против хозяина, синдром системного воспалительного ответа, синдром сепсиса, грамположительный сепсис, грамотрицательный сепсис, сепсис при отрицательных результатах посева культуры, грибковый сепсис, нейтропеническая лихорадка, уросепсис, менингококкемия, травма/геморрагия, ожоги, воздействие ионизирующего излучения, острый панкреатит, респираторный дистресс-синдром взрослых, ревматоидный артрит, индуцированный алкоголем гепатит, хронические воспалительные патологии, саркоидоз, патология Крона, серповидно-клеточная анемия, диабет, нефроз, атопические заболевания, реакции гиперчувствительности, аллергический ринит, сенная лихорадка, кругло- 23006673 годичный ринит, конъюнктивит, эндометриоз, астма, крапивница, системная анафилаксия, дерматит,злокачественная анемия, гемолитическая болезнь, тромбоцитопения, отторжение трансплантата любого органа или ткани, отторжение трансплантата почки, отторжение трансплантата сердца, отторжение трансплантата печени, отторжение трансплантата поджелудочной железы, отторжение трансплантата легкого, отторжение трансплантата костного мозга (ВМТ), отторжение аллотрансплантата кожи, отторжение трансплантата хряща, отторжение трансплантата кости, отторжение трансплантата тонкой кишки,отторжение трансплантата плодной вилочковой железы, отторжение трансплантата паращитовидной железы, отторжение ксенотрансплантата любого органа или ткани, отторжение аллотрансплантата, антирецепторные реакции гиперчувствительности, базедова болезнь, виброболезнь, инсулинзависимый диабет типа В, астма, бульбоспинальный паралич, опосредованная антителами цитотоксичность, реакции гиперчувствительности типа III, системная красная волчанка, синдром POEMS (полиневропатия, органомегалия, эндокринопатия, моноклональная гаммапатия, и синдром изменений кожи), полинейропатия,органомегалия, эндокринопатия, моноклональная гаммапатия, синдром изменений кожи, антифосфолипидный синдром, пемфигус, склеродерма, смешанное соединительно-тканное заболевание, идиопатическая Аддисонова болезнь, сахарный диабет, хронический активный гепатит, первичный билиарный цирроз печени, витилиго, васкулит, синдром постинфарктной кардиотомии, гиперчувствительность типа IV,контактный дерматит, гиперчувствительный пневмонит, отторжение аллотрансплантата, гранулема вследствие внутриклеточных организмов, чувствительность к лекарственным средствам, метаболическая/идиопатическая болезнь Вильсона, гемохроматоз, дефицит альфа-1-антитрипсина, диабетическая ретинопатия, тиреоидит Хашимото, остеопороз, оценка гипоталамо-гипофизарно-надпочечниковой оси,первичный билиарный цирроз печени, тиреоидит, энцефаломиелит, кахексия, муковисцидозоз, хроническая легочная болезнь новорожденных, хроническое обструктивное легочное заболевание (COPD), семейный гемофагоцитарный лимфогистиоцитоз, дерматологические состояния, псориаз, алопеция, нефротический синдром, нефрит, гломерулярный нефрит, острая почечная недостаточность, гемодиализ, уремия, токсичность, предэклампсия, okt3-терапия, анти-cd3-терапия, терапия цитокинами, химиотерапия,лучевая терапия (например, включая, но не ограничиваясь указанным, астению, анемию, кахексию и тому подобное), хроническая интоксикация салицилатами и тому подобное. См., например, the Merck Manual, 12th-17th Editions, Merck and Company, Rahway, NJ (1972, 1977, 1982, 1987, 1992, 1999), Pharmacotherapy Handbook, Wells et al., eds., Second Edition, Appleton and Lange, Stamford, Conn. (1998, 2000), каждая публикация включена в виде ссылки в полном объеме. Данное изобретение также относится к способу модулирования или лечения, по меньшей мере, одного сердечно-сосудистого заболевания на уровне клетки, ткани, органа, животного или у пациента,включая, но не ограничиваясь указанным, введением одновременно, и/или после, по меньшей мере, одного компонента, выбранного из группы, состоящей, по меньшей мере, из одного TNF-антагониста (например, без ограничения, из TNF-антитела или фрагмента, растворимого рецептора TNF или фрагмента,их слитых белков или малой молекулы TNF-антагониста), противоревматического средства (например,метотрексата, ауранофина, ауротиоглюкозы, азатиоприна, этанерцепта, натрий-тиомалата золота, гидроксихлорохинсульфата, лефлуномида, сульфазальцина), миорелаксанта, наркотического, нестероидного противовоспалительного лекарственного средства (НПВС), анальтезирующего, анестезирующего, седативного средства, местного анестетика, нейромышечного блокатора, противомикробного средства (например, аминогликозида, противогрибкового, противопаразитического, антивирусного средства, карбапенема, цефалоспорина, флурорхинолона, макролида, пенициллина, сульфонамида, тетрациклина, других противомикробных средств), противопсориазного средства, кортикостероида, анаболического стероида, средства, имеющего отношение к диабету, минерального, пищевого, тиреоидного средства, витамина, связанного с кальцием гормона, средства против диареи, противокашлевого, противорвотного,противоязвенного, слабительного средства, антикоагулянта, эритропоэтина (например, эпоэтина альфа),филграстима (например, G-CSF, неупоген), сарграмостима (GM-CSF, лейкин), средства для иммунизации, иммуноглобулина, иммуносупрессора (например, базиликсимаб, циклоспорин, даклизумаб), гормона роста, гормонозамещающего лекарственного средства, модулятора рецептора эстрогена, мидриатического, расширяющего, алкилирующего агента, антиметаболита, ингибитора митотического деления, радиофармацевтического средства, антидепрессанта, антиманиакального средства, антипсихотического,анксиолитического, гипнотического, симпатомиметического средства, стимулятора, донепезила, такрина,антиастматического средства, бета-агониста, стероида для ингаляции, ингибитора лейкотриена, метилксантина, кромолина, эпинефрина или аналога, дорназы альфа (пульмозим), цитокина или антагониста цитокина. Подходящие дозы известны в данной области. См., например, Wells et al., eds., Pharmacotherapy Handbook, 2nd Edition, Appleton and Lange, Stamford, CT (2000); PDR Pharmacopoeia, Tarascon PocketPharmacopoeia 2000, Deluxe Edition, Tarascon Publishing, Loma Linda, CA (2000), каждая из указанных публикаций включена в данное описание в виде ссылки в полном объеме. Антагонисты TNF, подходящие для композиций, комбинированной терапии, совместного введения,устройств и/или способов согласно данному изобретению (дополнительно содержащих по меньшей мере одно антитело, его специфичную часть и вариант согласно данному изобретению), включают, но не ограничены указанным, анти-TNF-антитела, их антигенсвязывающие фрагменты и молекулы рецепторов,- 24006673 которые специфично связываются с TNF; соединения, которые предотвращают и/или подавляют синтезTNF, высвобождение TNF или его действие на клетки-мишени, такие как талидомид, тенидап, ингибиторы фосфодиэстеразы (например, пентоксифиллин и ролипрам), агонисты рецептора аденозина А 2b и усилители рецептора аденозина А 2b; соединения, которые предотвращают и/или ингибируют передачу сигнала рецептором TNF, такие как ингибиторы протеинкиназ, активируемых митогеном (MAP); соединения, которые блокируют и/или ингибируют расщепление мембранного TNF, такие как ингибиторы металлопротеиназы; соединения, которые блокируют и/или ингибируют активность TNF, такие как ингибиторы фермента превращения ангиотензина (АСЕ) (например, каптоприл); и соединения, которые блокируют и/или ингибируют продуцирование и/или синтез TNF, такие как ингибиторы МАР-киназы. В используемом в данном описании смысле антитело фактора некроза опухоли, TNF-антитело или фрагмент и тому подобное уменьшает, блокирует, ингибирует, отменяет или препятствует активности TNF in into, in situ и/или предпочтительно in vivo. Например, подходящее TNF-антитело человека согласно данному изобретению может связывать TNF и включает анти-TNF-антитела, их антигеновязывающие фрагменты и их специфичные мутанты или домены, которые специфично связываются сTNF. Подходящее TNF-антитело или фрагмент также может снижать, блокировать, отменять, препятствовать, предотвращать и/или ингибировать синтез РНК, ДНК или белка TNF, высвобождение TNF, передачу сигнала через рецептор TNF, расщепление мембранного TNF, активность TNF, продуцирование и/или синтез TNF. Химерное антитело сА 2 состоит из антигенсвязывающей вариабельной области высоко аффинного нейтрализующего IgG1-антитела мыши против TNF человека, обозначенного А 2, и константных областей каппа иммуноглобулина IgG1 человека. Fc-область IgG1 человека улучшает эффекторную функцию аллогенного антитела, увеличивает время полужизни в циркулирующей сыворотке и снижает иммуногенность антитела. Авидность и эпитопную специфичность химерного антитела сА 2 получают благодаря вариабельной области мышиного антитела А 2. В конкретном варианте предпочтительным источником нуклеиновых кислот, кодирующих вариабельную область мышиного антитела А 2, является линия клеток гибридомы А 2. Химерное антитело А 2 (сА 2) нейтрализует цитотоксическое действие как природного, так и рекомбинантного TNF дозо-зависимым образом. На основании анализа связывания химерного антитела сА 2 и рекомбинантного TNF человека, рассчитали константу аффинности химерного антитела сА 2, равную 1,04 х 1010 М-1. Предпочтительные способы определения специфичности и аффинности моноклонального антитела посредством конкурентного ингибирования можно найти в Harlow, et al., antibodies: A Laboratory Manual,Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1988; Colligan et al., eds., Current Protocols in Immunology, Greene Publishing Assoc, and Wiley Interscience, New York, (1992-2000); Kozbor et al.,Immunol. Today, 4:72-79 (1983); Ausubel et al., eds. Current Protocols in Molecular Biology, Wiley Interscience, New York (1987-2000); и Muller, Meth. Enzymol., 92:589-601 (1983), указанные публикации включены в данное описание в виде ссылки в полном объеме. В конкретном варианте мышиное моноклональное антитело А 2 продуцируется линией клеток, обозначенной с 134 А. Химерное антитело сА 2 продуцируется линией клеток, обозначенной с 168 А. Дополнительные примеры моноклональных анти-TNF-антител, которые можно использовать в данном изобретении, описаны в данной области (см., например, патент США 5231024; Mller, A. et al.,Cytokine 2(3):162-169 (1990); заявку на выдачу патента США 07/943852 (подана 11 сентября 1992);Rathjen et al., международная публикация WO 91/02078 (опубликована 21 февраля 1991); Rubin et al., патентная публикация ЕРО 0218868 (опубликована 22 апреля 1987); Yone et al., патентная публикация ЕРО 0288088 (26 октября 1988) Liang, et al., Biochem. Biophys. Res. Comm. 137:847-854 (1986); Meager,et al., Hybridoma 5:305-311 (1987); Fendly et al., Hybridoma 5:359-369 (19S7); Bringman, et al., Hybridoma 5:489-507 (1987); и Hirai, et al., J. Immunol. Meth. 96:51-62 (1987), указанные публикации включены в данное описание в виде ссылки в полном объеме). Молекулы рецептора TNF Предпочтительными молекулами рецептора TNF, применимыми в данном изобретении, являются молекулы, которые с высокой аффинностью связывают TNF (см., например, Feldmann et al., международная публикация WO 92/07076 (опубликована 30 апреля 1992); Schall et al., Cell 51:361-370 (1990); иLoetscher et al., Cell 51:351-359 (1990), указанные публикации включены в данное описание в виде ссылки в полном объеме) и необязательно обладают низкой иммуногенностью. В частности, в данном изобретении применимы рецепторы TNF клеточной поверхности с молекулярной массой 55 кД (р 55 TNF-R) и 75 кД (р 75 TNF-R). Усеченные формы указанных рецепторов, содержащие внеклеточные домены (ECD) рецепторов или их функциональные части (см., например, Corcoran et al., Eur. J. Biochem. 223:831-840(1994, также применимы в данном изобретении. Усеченные формы рецепторов TNF, содержащие ECD,обнаружены в моче и сыворотке в виде связывающих ингибирующих TNF белков с молекулярной массой 30 кД и 40 кД (Engelmann, H. et al., J. Biol. Chem. 255:1531-1536 (1990. Мультимерные молекулы рецепторов TNF и слитые молекулы иммунорецепторов TNF и их производные и фрагменты или части- 25006673 являются дополнительными примерами молекул рецепторов TNF, которые применимы в способах и композициях согласно данному изобретению. Молекулы рецепторов TNF, которые можно использовать в изобретении, характеризуются тем, что ими можно лечить пациентов в течение длительных периодов времени, получая хорошее или отличное ослабление симптомов при низкой токсичности. Низкая иммуногенность и/или высокая аффинность, а также другие неопределенные свойства, могут вносить вклад в достигаемые терапевтические результаты. Мультимерные молекулы рецептора TNF, применимые в данном изобретении, содержат весь или функциональную часть ECD двух или более рецепторов TNF, связанные посредством одного или более полипептидных линкеров или других непептидных линкеров, таких как полиэтиленгликоль (ПЭГ). Мультимерные молекулы дополнительно могут содержать сигнальный пептид секретируемого белка,чтобы направлять экспрессию мультимерной молекулы. Указанные мультимерные молекулы и способы их получения описаны в заявке на выдачу патента США 08/437533 (подана 9 мая 1995), содержание которой включено в данное описание в виде ссылки в полном объеме. Слитые молекулы иммунорецепторов TNF, применимые в способах и композициях согласно данному изобретению, содержат, по меньшей мере, одну часть одной или более молекул иммуноглобулина и весь или функциональную часть одного или более рецепторов TNF. Указанные слитые молекулы иммунорецепторов могут быть собраны в виде мономеров или гетероили гомомультимеров. Слитые молекулы иммунорецепторов также могут быть моновалентными или поливалентными. Примером такой слитой молекулы иммунорецептора TNF является слитый белок рецептор TNF/IgG. Слитые молекулы иммунорецептора TNF и способы их получения описаны в данной области (Lesslauer et al., Eur. J. Immunol. 21:2883-2886 (1991); Ashkenazi et al., Proc. Natl. Acad. Sci. USA 88:10535-10539 (1991); Peppel et al., J. Exp. Med. 174:1483-1489 (1991); Kolls et al., Proc. Natl. Acad. Sci.USA 91:215-219 (1994); Butler et al., Cytokine 6(6):616-623 (1994); Baker et al., Eur. J. Immunol. 24:20402048 (1994); Beutler et al., патент США 5447851; и заявка на выдачу патента США 08/442133 (подана 16 мая 1995), каждая публикация включена в данное описание в виде ссылки в полном объеме). Способы получения слитых молекул иммунорецепторов также можно найти в Capon et al., патент США 5116964; Capon et al., патент США 5225538; и Capon et al., Nature 337:525-531 (1989), каждая публикация включена в данное описание в виде ссылки в полном объеме. Функциональный эквивалент, производное, фрагмент или область молекулы рецептора TNF относится к части молекулы рецептора TNF или части последовательности молекулы рецептора TNF, которая кодирует молекулу рецептора TNF, которая имеет достаточный размер и последовательности, чтобы функционально быть похожей на молекулы рецепторов TNF, которые можно использовать в данном изобретении (например, связывать TNF с высокой аффинностью и обладать низкой иммуногенностью). Функциональный эквивалент молекулы рецептора TNF также включает модифицированные молекулы рецептора TNF, которые функционально похожи на молекулы рецепторов TNF, которые можно использовать в данном изобретении (например, связывают TNF с высокой эффективностью и обладают низкой иммуногенностью). Например, функциональный эквивалент молекулы рецептора TNF может содержать молчащий кодон или одну или более аминокислотных замен, делеций или добавлений (например, замену одной кислой аминокислоты другой кислой аминокислотой; или замену одного кодона, кодирующего гидрофобную аминокислоту, другим кодоном, кодирующим ту же самую или другую гидрофобную аминокислоту). См., Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Assoc. and,Wiley-Interscience, New York (1987-2000). Цитокины включают любые известные цитокины. См., например, www.CopewithCytokines.com. Антагонисты цитокинов включают, но не ограничены указанным, любое антитело, фрагмент или миметик,любой растворимый рецептор, фрагмент или миметик, любую малую молекулу антагониста или любую их комбинацию. Терапевтические лечения Любой способ согласно данному изобретению может включать способ лечения заболевания, опосредованного IL-12, включающий введение эффективного количества композиции или фармацевтической композиции, содержащей по меньшей мере одно анти-IL-12-антитело, в клетку, ткань, орган, животному или пациенту, нуждающемуся в таком модулировании, обработке или терапии. Такой способ необязательно может дополнительно включать совместное введение или комбинированную терапию для лечения таких иммунных заболеваний, при которой введение указанного по меньшей мере одного антиIL-12-антитела, его специфичной части или варианта, кроме того, включает введение до, одновременно и/или после указанного введения по меньшей мере одного компонента, выбранного из группы, состоящей из по меньшей мере одного антагониста TNF (например, без ограничения, из TNF-антитела или фрагмента, растворимого рецептора, TNF или фрагмента, их слитых белков или малой молекулы TNFантагониста), противоревматического средства (например, метотрексата, ауранофина, ауротиоглюкозы,азатиоприна, этанерцепта, натрий-тиомалата золота, гидроксихлорохинсульфата, лефлуномида, сульфазальцина), миорелаксанта, наркотического, нестероидного противовоспалительного лекарственного средства (НПВС), анальгезирующего, анестезирующего, седативного средства, местного анестетика,нейромышечного блокатора, противомикробного средства (например, аминогликозида, противогрибко- 26006673 вого, противопаразитического, антивирусного средства, карбапенема, цефалоспорина, флурорхинолона,макролида, пенициллина, сульфонамида, тетрациклина, другого противомикробного средства), противопсориазного средства, кортикостероида, анаболического стероида, средства, имеющего отношение к диабету, минерального, пищевого, тиреоидного средства, витамина, связанного с кальцием гормона, противодиарейного, противокашлевого, противорвотного, противоязвенного, слабительного средства, антикоагулянта, зритропоэтина (например, эпоэтина альфа), филграстима (например, G-CSF, неупоген), сарграмостима (GM-CSF, лейкин), средства для иммунизации, иммуноглобулина, иммуносупрессора (например, базиликсимаб, циклоспорин, даклизумаб), гормона роста, гормонозамещающего лекарственного средства, модулятора рецептора эстрогена, мидриатического, расширяющего, алкилирующего агента,антиметаболита, ингибитора митотического деления, радиофармацевтического средства, антидепрессанта, антиманиакального средства, антипсихотического, анксиолитического, гипнотического, симпатомиметического средства, стимулятора, донепезила, такрина, антиастматического средства, бета-агониста,стероида для ингаляции, ингибитора лейкотриена, метилксантина, кромолина, эпинефрина или аналога,дорназы альфа (пульмозим), цитокина или антагониста цитокина. Обычно лечение патологических состояний осуществляют посредством введения эффективного количества или дозы по меньшей мере одной композиции анти-IL-12-антитела, которое всего в среднем составляет в пределах по меньшей мере примерно от 0,01 до 500 мг по меньшей мере одного анти-IL-12 антитела на килограмм массы пациента на дозу и предпочтительно по меньшей мере примерно от 0,1 до 100 мг антитела/килограмм массы пациента при однократном или многократном введении в зависимости от удельной активности, входящей в композицию. Альтернативно, эффективная концентрация в сыворотке может иметь концентрацию 0,1-5000 мкг/мл в сыворотке при однократном или многократном введении. Подходящие дозы известны практикующим врачам и конечно будут зависеть от конкретного патологического состояния, удельной активности вводимой композиции и конкретного пациента, подвергаемого лечению. В некоторых случаях для того, чтобы достичь требуемого терапевтического количества, может быть необходимо повторное введение, т.е. многократные отдельные введения конкретной контролируемой или измеряемой дозы, при этом отдельные введения повторяют вплоть до достижения требуемой суточной дозы или эффекта. Предпочтительные дозы необязательно включают 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5,б, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36,37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 62, 63, 64, 65, 66, 67,68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97,98, 99 и/или 100-500 мг/кг/введение, или любой диапазон, значение или долю; или дозу для достижения концентрации в сыворотке, равной 0,1; 0,5; 0,9; 1,0; 1,1; 1,2; 1,5; 1,9; 2,0; 2,5; 2,9; 3,0; 3,5; 3,9; 4,0; 4,5; 4,9; 5,0; 5,5; 5,9; 6,0; 6,5; 6,9; 7,0; 7,5; 7,9; 8,0; 8,5; 8,9; 9,0; 9,5; 9,9; 10; 10,5; 10,9; 11; 11,5; 11,9; 20, 12,5; 12,9; 13,0; 13,5; 13,9; 14,0; 14,5; 4,9; 5,0; 5,5; 5,9; 6,0; 6,5; 6,9; 7,0; 7,5; 7,9; 8,0; 8,5; 8,9; 9,0; 9,5; 9,9; 10; 10,5; 10,9; 11; 11,5; 11,9; 12; 12,5; 12,9; 13,0; 13,5; 13,9; 14; 14,5; 15; 15,5; 15,9; 16; 16,5; 16,9; 17; 17,5; 17,9; 18; 18,5; 18,9; 19; 19,5; 19,9; 20; 20,5; 20,9; 21; 22; 23; 24; 25; 26; 27; 28; 29; 30; 35; 40; 45; 50; 55; 60; 65; 70; 75; 80; 85; 90; 96; 100; 200; 300; 400; 500; 600; 700; 800; 900; 1000; 1500; 2000; 2500; 3000; 3500; 4000; 4500 и/или 5000 мкг/мл в сыворотке при однократном или многократном введении, или любой диапазон,значение или долю указанной концентрации. Альтернативно, вводимая доза может варьировать в зависимости от известных факторов, таких как фармакодинамические характеристики конкретного агента и способ и путь его введения; возраст, состояние здоровья и масса реципиента; природа и степень проявления симптомов, вид одновременно проводимого лечения, частота лечения и требуемый эффект. Обычно доза активного ингредиента может составлять примерно от 0,1 до 100 мг на килограмм массы тела. Обычно доза от 0,1 до 50 и предпочтительно от 0,1 до 10 мг на килограмм на введение или поступающая в случае применения формы замедленного высвобождения является эффективной для получения требуемых результатов. В качестве неограничивающего примера лечение людей или животных можно проводить в виде единовременной или периодической дозы по меньшей мере одного антитела согласно данному изобретению, составляющей от 0,1 до 100 мг/кг, а именно, 0,5, 0,9, 1,0, 1,1, 1,5, 2, 3, 4, 5, б, 7, 8, 9, 10, 11, 12, 13,14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 40, 45, 50, 60, 70, 80, 90 или 100 мг/кг в сутки,по меньшей мере, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25,26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 дней, или альтернативно или дополнительно, по меньшей мере, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26,27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51 или 52 недель, или альтернативно или дополнительно, по меньшей мере, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15,16, 17, 18, 19 или 20 лет, или при любой комбинации указанного, используя однократные, инфузионные или многократные дозы. Дозированные формы (композиция), подходящие для внутреннего введения, обычно содержат примерно от 0,1 до 500 мг активного ингредиента на единицу или емкость. В указанных фармацевтических композициях активный ингредиент, как правило, будет присутствовать в количестве, примерно составляющем 0,5-99,999% по массе, исходя из общей массы композиции.- 27006673 Для парентерального введения антитело можно приготовить в виде раствора, суспензии, эмульсии или лиофилизованного порошка, приготовленного в ассоциации с фармацевтически приемлемым парентеральным носителем, или отдельно. Примерами таких носителей являются вода, физиологический раствор, раствор Рингера, раствор декстрозы и 1-10% сывороточный альбумин человека. Также можно использовать липосомы и неводные носители, такие как жирные масла. Носитель или лиофилизованный порошок могут содержать добавки, которые поддерживают изотоничность (например, хлорид натрия,манит) или химическую стабильность (например, буферы и консерванты). Композиции стерилизуют известными подходящими способами. Подходящие фармацевтические носители описаны в самом последнем выпуске Remington's Pharmaceutical Sciences, A. Osol, стандартном в данной области справочнике. Альтернативное введение согласно данному изобретению можно использовать многие известные и разработанные способы введения фармацевтически эффективных количеств по меньшей мере одного анти-IL-12-антитела согласно данному изобретению. Хотя в последующем описании используют легочное введение, можно использовать другие способы введения согласно данному изобретению с приемлемыми результатами.IL-12-антитела согласно данному изобретению можно доставлять в носителе в виде раствора,эмульсии, коллоида или суспензии, или в виде сухого порошка, используя множество устройств и способов, подходящих для введения путем ингаляции или другими описанными в данной заявке способами или способами, известными в данной области. Парентеральные композиции и введение Композиции для парентерального введения могут содержать в качестве обычных эксципиентов стерильную воду или физиологический раствор, полиалкиленгликоли, такие как полиэтиленгликоль, масла растительного происхождения, гидрогенизированные нафталины и тому подобное. Водные или масляные суспензии для инъекции можно получить с использованием соответствующего эмульгатора или увлажнителя и суспендирующего средства согласно известным способам. Средствами для инъекции могут быть нетоксичные неперорально вводимые разбавляющие агенты, такие как водный раствор или стерильный инъекционный раствор или суспензия в растворителе. В качестве применяемого носителя или растворителя допустимы вода, раствор Рингера, физиологический раствор и т.д.; в качестве обычного растворителя или суспендирующего растворителя можно использовать стерильное нелетучее масло. С этой целью можно использовать любой вид нелетучего масла и жирной кислоты, включая природные или синтетические или полусинтетические жирные масла или жирные кислоты; природные или синтетические или полусинтетические моно- или ди- или триглицериды. Парентеральное введение известно в данной области и включает, но не ограничено указанным, обычные способы инъекций, устройство для безигольной инъекции под давлением газа, которое описано в патенте США 5851198, и лазерное перфорирующее устройство, которое описано в патенте США 5839446, включенном в данное описание в виде ссылки в полном объеме. Альтернативная доставка Изобретение, кроме того, относится к введению по меньшей мере одного анти-IL-12-антитела парентеральным, подкожным, внутримышечным, внутривенным, внутрисуставным, внутрибронхиальным,внутрибрюшинным, внутрикапсулярным, внутрихрящевым, внутриполостным, внутричревным, внутримозжечковым, интрацеребровентрикулярным способом, внутрь ободочной кишки, интрацервикальным,внутрижелудочным, внутрипеченочным, внутримиокрадиальным, внутрикостным, внутритазовым, внутриперикардиальным, внутрибрюшинным, внутриплевральным способом, внутрь простаты, внутрилегочным, внутриректальным, внутрипочечным, внутриретинальным, интраспинальным, интрасиновиальным,интраторакальным, внутриматочным, внутрипузырным, болюсным, вагинальным, ректальным, буккальным, подъязычным, интраназальным или трансдермальным способами. Можно приготовить по меньшей мере одну композицию анти-IL-12-антитела для применения при парентеральном (подкожном, внутримышечном или внутривенном) или любом другом введении, в частности, в форме жидких растворов или суспензий; для применения в вагинальном или ректальном введении, в частности, в полутвердых формах, таких как кремы и суппозитории, но не ограниченных ими; для буккального или подъязычного введения в таких формах, как таблетки или капсулы, но не ограниченных указанным; или интраназально в таких неограничивающих формах, как в форме порошков, назальных капель или аэрозолей или некоторых агентов; или трансдермально в таких неограничивающих формах, как гель, мазь, лосьон, суспензия или система доставки на основе пластыря с химическими усилителями, такими как диметилсульфоксид,чтобы либо модифицировать структуру кожи, либо увеличить концентрацию лекарственного средства в трансдермальном пластыре (Junginger, et al. В Drug Permeation Enhancement; Hsieh, D. S., Eds., pp. 5990 (Marcel Dekker, Inc. New York 1994, включенной в данное описание в виде ссылки в полном объеме),или с окислителями, которые позволяют наносить композиции, содержащие белки и пептиды, на кожу(WO 98/53847), или с применением электрических полей, чтобы создать временные транспортные пути, а именно, посредством электропорации, или чтобы увеличить подвижность заряженных лекарственных средств через кожу, например, ионтофорезом, или с применением ультразвука, например, ультразвуково- 28006673 го фореза, (патенты США 4309989 и 4767402) (указанные выше публикации и патенты включены в данное описание в виде ссылки в полном объеме). Легочное/назальное введение Что касается легочного введения, предпочтительно по меньшей мере одну композицию анти-IL-12 антитела доставляют в виде частиц такого размера, при котором эффективно достигаются нижние дыхательные пути легкого или синусы. Согласно изобретению по меньшей мере одно анти-IL-12-антитело можно доставлять любым из множества устройств для ингаляции или назальных устройств, известных в данной области для введения терапевтического средства посредством ингаляции. Указанные устройства,способные депонировать аэрозольные композиции в полости синуса или альвеолах пациента, включают дозирующие ингаляторы, распылители, генераторы сухого порошка, разбрызгиватели и тому подобное. Другие устройства, подходящие для направленного легочного или назального введения антител, также известны в данной области. В случае всех указанных устройств можно использовать композиции, подходящие для введения дозируемого антитела в аэрозоле. Такие аэрозоли могут либо состоять из растворов(как водных, так и неводных), либо из твердых частиц. В дозирующих ингаляторах, подобных дозирующему ингалятору Ventolin, обычно используют газ-вытеснитель, и их необходимо встряхивать во время вдыхания (см., например, WO 94/16970, WO 98/35888). Ингаляторы сухих порошков, подобные Turbuhaler (Astra), Rotahaler (Glaxo), Diskus (Glaxo), ингалятор Spiros (Dura), устройства, продаваемые Inhale Therapeutics, и порошковый ингалятор Spinhaler (Fisons) приводятся в действие вдыханием смешанного порошка (патент США 4668218 Astra, ЕР 237507 Astra, WO 97/25086 Glaxo, WO 94/08552Dura, патент США 5458135 Inhale, WO 94/06498 Fisons, которые включены в данное описание в виде ссылки в полном объеме). Распылители, подобные AERxAradigm, распылитель Ultravent (Mallinckrodt) и распылитель Acorn II (Marquest Medical Products) (патент США 5404871 Aradigm, WO 97/22376),при этом указанные выше публикации включены в данное описание в виде ссылок в полном объеме, вырабатывают аэрозоли из растворов, тогда как дозирующие ингаляторы, ингаляторы сухих порошков и т.д. образуют аэрозоли, состоящие из мелких частиц. Имеется в виду, что указанные конкретные примеры коммерчески доступных устройств для ингаляции являются типичными примерами конкретных устройств, пригодных для практического применения данного изобретения, и не предназначены в качестве примеров, ограничивающих рамки изобретения. Предпочтительно композицию, содержащую по меньшей мере одно анти-IL-12-антитело, доставляют с помощью ингалятора сухого порошка или распылителя. Имеется несколько требуемых параметров устройства для ингаляции для введения по меньшей мере одного антитела согласно данному изобретению. Например, доставка устройством для ингаляции преимущественно является надежной, воспроизводимой и точной. Устройство для ингаляции для обеспечения хорошего вдыхания необязательно может доставлять мелкие частицы сухого вещества, например,примерно менее 10 мкм, предпочтительно примерно 1-5 мкм. Введение композиций IL-12-антитела в виде спрея Спрей, содержащий белковую композицию, содержащую IL-12-антитело, можно получить путем принудительной подачи суспензии или раствора по меньшей мере одного анти-IL-12-антитела через выпускное отверстие под давлением. Можно выбрать размер и конфигурацию выпускного отверстия, применяемое давление и скорость подачи жидкости, чтобы добиться требуемого выхода и размера частиц. Электроспрей, например, можно получить с помощью электрического поля и подачи через капилляр или выходное отверстие. Преимущественно частицы по меньшей мере одного белка, составляющего анти-IL12-антитело, доставляемые с помощью разбрызгивателя, имеют размер частиц примерно меньше 10 мкм,предпочтительно в пределах примерно от 1 до 5 мкм, и наиболее предпочтительно примерно от 2 до 3 мкм. Составы по меньшей мере одной белковой композиции, включающей анти-IL-12-антитело, подходящей для применения с использованием распылителя, обычно включают белковую композицию антитела в водном растворе в концентрации, составляющей примерно от 0,1 мг до 100 мг по меньшей мере одной белковой композиции анти-IL-12-антитела на мл раствора или мг/г, или любой интервал или значение в указанном диапазоне, например, без ограничения 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9; 1; 2; 3; 4; 5; 6; 7; 8; 9; 10; 11; 12; 13; 14; 15; 16; 17; 18; 19; 20; 21; 22; 23; 24; 25; 26; 27; 28; 29; 30; 40; 45; 50; 60; 70; 80; 90 или 100 мг/мл или мг/г. Состав может включать такие агенты, как эксципиент, буфер, средство для изотоничности, консервант, поверхностно-активное вещество, и предпочтительно цинк. Состав также может включать эксципиент или средство для стабилизации белковой композиции антитела, такой как буфер, восстанавливающий агент, белок основной массы или углевод. Белки основной массы, используемые в белковой композиции антитела, включают альбумин, протамин и тому подобные. Типичными углеводами, используемыми в белковой композиции антитела, включают сахарозу, манит, лактозу, трегалозу, глюкозу и тому подобное. Белковая композиция антитела также может содержать поверхностноактивное вещество, которое может уменьшать или предотвращать поверхностно-индуцируемую агрегацию белковой композиции антитела, вызванную распылением раствора при образовании аэрозоля. Можно использовать различные обычные поверхностно-активные вещества, такие как эфиры полиоксиэтилена и жирной кислоты и спирты и эфиры полиоксиэтиленсорбита и жирной кислоты. Количества, как правило, будут в пределах от 0,001 до 14% от массы композиции. Особенно предпочтительными поверх- 29006673 ностно-активными веществами для целей данного изобретения являются моноолеат полиоксиэтиленсорбитана, полисорбат 80, полисорбат 20 и тому подобное. В композицию также могут быть включены дополнительные агенты, известные в области приготовления белковых композиций, таких как IL-12 антитела, или их конкретные части или варианты. Введение композиций IL-12-антитела с помощью распылителя Белковую композицию антитела можно вводить с помощью распылителя, такого как инжекторный распылитель или ультразвуковой распылитель. Обычно в инжекторном распылителе используют источник сжатого воздуха, чтобы создать высокоскоростную струю воздуха, проходящую через отверстие.По мере того, как газ расширяется за пределами выходного отверстия, создается область пониженного давления, которая втягивает раствор белковой композиции антитела через капиллярную трубку, связанную с емкостью с жидкостью. Поток жидкости из капиллярной трубки рассекается на нестойкие крупицы и капельки по мере того, как он выходит из трубки, создавая аэрозоль. Можно использовать ряд конфигураций, скоростей потока и типов рассекателя, чтобы получить требуемые эксплуатационные характеристики данного инжекторного распылителя. В ультразвуковом распылителе используют высокочастотную электрическую энергию, чтобы создать вибрационную, механическую энергию, обычно используя пьезоэлектрический преобразователь. Полученную энергию передают составу белковой композиции антитела либо непосредственно, либо через соединяющую жидкость, образуя аэрозоль, содержащий белковую композицию антитела. Преимущественно частицы белковой композиции антитела, доставляемые распылителем, имеют размер частиц примерно менее 10 мкм, предпочтительно в пределах примерно от 1 до 5 мкм, и наиболее предпочтительно примерно от 2 до 3 мкм. Составы по меньшей мере одного анти-IL-12-антитела, пригодные для применения с помощью распылителя, либо инжекторного, либо ультразвукового, обычно содержат по меньшей мере один белок анти-IL-12-антитела в концентрации примерно от 0,1 до 100 мг на мл раствора. Состав может включать агенты, такие как эксципиент, буфер, средство для изотоничности, консервант, поверхностно-активное вещество и предпочтительно цинк. Состав также может включать эксципиент или средство для стабилизации по меньшей мере одного белка, составляющего анти-IL-12-антитело, такое как буфер, восстанавливающий агент, белок основной массы или углевод. Белки основной массы, используемые при приготовлении состава одной белковой композиции анти-IL-12-антитела, включают альбумин, протамин и тому подобное. Типичными углеводами, используемыми при приготовлении композиций по меньшей мере одного анти-IL-12-антитела, включают сахарозу, манит, лактозу, трегалозу, глюкозу и тому подобное. Состав, по меньшей мере, одного анти-IL-12-антитела также может содержать поверхностноактивное вещество, которое может уменьшать или предотвращать поверхностно-индуцируемую агрегацию, по меньшей мере, одного анти-IL-12-антитела, вызванную распылением раствора при образовании аэрозоля. Можно использовать различные подходящие поверхностно-активные вещества, такие как эфиры полиоксиэтилена и жирной кислоты и спирты и эфиры прлиоксиэтиленсорбита и жирной кислоты. Количества, как правило, будут в пределах от 0,001 до 4% от массы состава. Особенно предпочтительными поверхностно-активными веществами для целей данного изобретении являются моноолеат полиоксиэтиленсорбитана, полисорбат 80, полисорбат 20 и тому подобное. В состав также могут быть включены дополнительные агенты, известные в области приготовления составов белков, таких белок антитела. Введение композиций IL-12-антитела с помощью дозирующего ингалятора В дозирующем ингаляторе (MDI) газ-вытеснитель, по меньшей мере одно анти-IL-12-антитело и любые эксципиенты или другие добавки находятся в контейнере в виде смеси, включая сжиженный сжатый газ. Приведение в действие дозирующего клапана высвобождает смесь в виде аэрозоля, предпочтительно содержащего частицы размером в пределах примерно менее 10 мкм, предпочтительно примерно от 1 до 5 мкм, и наиболее предпочтительно примерно от 2 до 3 мкм. Требуемый размер частиц аэрозоля можно получить, используя состав белковой композиции антитела, получаемый различными способами,известными специалистам в данной области, включая струйное измельчение, распылительную сушку,конденсацию в критической точке или тому подобное. Предпочтительные дозирующие ингаляторы включают ингаляторы, производимые 3 М или Glaxo и использующие в качестве газа-вытеснителя гидрофторуглерод. Составы, включающие по меньшей мере одно анти-IL-12-антитело, для применения с помощью дозирующего ингаляторного устройства в основном будут содержать тонко диспергированный порошок,содержащий по меньшей мере одно анти-IL-12-антитело в виде суспензии в неводной среде, например,суспендированное в газе-вытеснителе с помощью поверхностно-активного вещества. Газомвытеснителем может быть любое обычное вещество, используемое для этой цели, такое как хлорфторуглерод, гидрохлорфторуглерод, гидрофторуглерод или углеводород, включая трихлорфторметан, дихлордифторметан, дихлортетрафторэтанол и 1,1,1,2-тетрафторэтан, HFA-134a (гидрофторалкан-134 а), HFA227 (гидрофторалкан-227) или тому подобное. Предпочтительно газом-вытеснителем является гидрофторуглерод. Можно выбрать поверхностно-активное вещество, чтобы стабилизировать по меньшей мере одно анти-IL-12-антитело в виде суспензии в газе-вытеснителе, чтобы защитить активный агент от химической деградации, и тому подобное. Подходящие поверхностно-активные вещества включают триолеат
МПК / Метки
МПК: G01N 33/50, C07K 16/24, A61P 37/00, A61K 39/395, C12N 15/13, C07K 16/42, C12N 15/79, G01N 33/577, C12N 5/10
Метки: применения, способы, антитела, il-12, против
Код ссылки
<a href="https://eas.patents.su/30-6673-antitela-protiv-il-12-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Антитела против il-12 и способы их применения</a>
Предыдущий патент: Устройство высокочувствительной взрывной реактивной защиты
Следующий патент: Андрогенные 7-замещенные-11-галогенированные стероиды
Случайный патент: Биокомплекс для производства парфюмерно-косметических средств