Гуманизированное антитело и его фрагмент, взаимодействующие с бета-амилоидным пептидом, и способы их применения
Номер патента: 6606
Опубликовано: 24.02.2006
Авторы: Бейлз Келли Р., Пол Стивен М., Васкес Максимильяно, Дематтос Рональд, Цурусита Наоя, Хольцман Дэвид М.
Формула / Реферат
1. Гуманизированное антитело или его фрагмент, которые способны связываться с эпитопом пептида Ab, содержащие:
a) легкую цепь, включающую в себя три определяющих комплементарность области легкой цепи (CDR), имеющие следующие аминокислотные последовательности:
CDR1 легкой цепи:

и константную последовательность легкой цепи из гуманизированной легкой цепи иммуноглобулина; и
b) тяжелую цепь, включающую в себя три CDR тяжелой цепи, имеющие следующие аминокислотные последовательности:
CDR1 тяжелой цепи:


и константную последовательность тяжелой цепи из гуманизированной тяжелой цепи иммуноглобулина.
2. Гуманизированное антитело или его фрагмент по п.1, в которых CDR1 легкой цепи представляет собой

CDR2 тяжелой цепи представляет собой

3. Гуманизированное антитело или его фрагмент по п.1, содержащие гуманизированную вариабельную область легкой цепи, имеющую следующую последовательность:
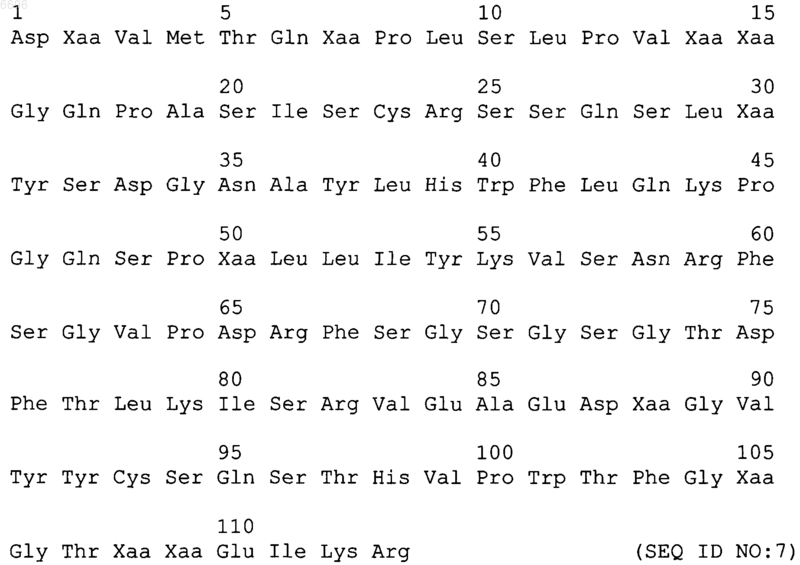
где Xaa в положении 2 означает Val или Ile;
Xaa в положении 7 означает Ser или Thr;
Xaa в положении 14 означает Thr или Ser;
Xaa в положении 15 означает Leu или Pro;
Xaa в положении 30 означает Ile или Val;
Xaa в положении 50 означает Arg, Gln или Lys;
Xaa в положении 88 означает Val или Leu;
Xaa в положении 105 означает Gln или Gly;
Xaa в положении 108 означает Lys или Arg и
Xaa в положении 109 означает Val или Leu;
и вариабельную область тяжелой цепи, имеющую следующую последовательность:
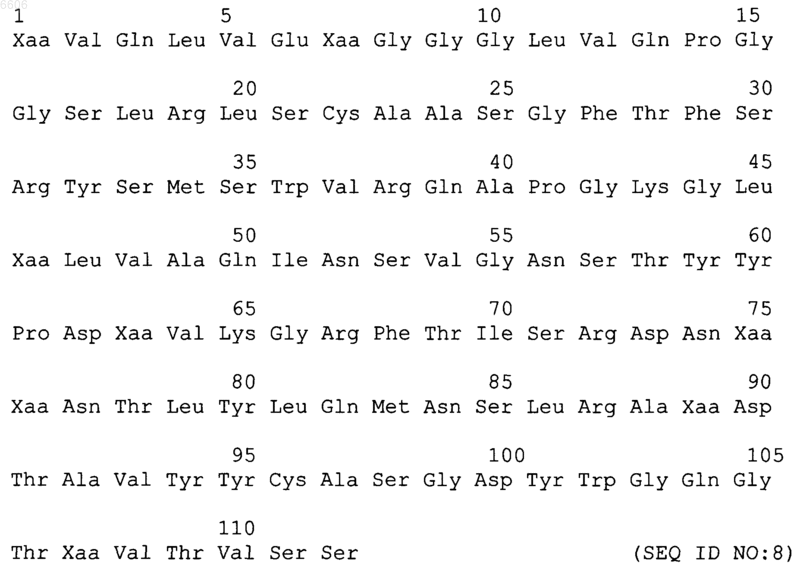
где Xaa в положении 1 означает Glu или Gln;
Xaa в положении 7 означает Ser или Leu;
Xaa в положении 46 означает Glu, Val, Asp или Ser;
Xaa в положении 63 означает Thr или Ser;
Xaa в положении 75 означает Ala, Ser, Val или Thr;
Xaa в положении 76 означает Lys или Arg;
Xaa в положении 89 означает Glu или Asp и
Xaa в положении 107 означает Leu или Thr.
4. Гуманизированное антитело или его фрагмент по п.1, имеющие вариабельную область легкой цепи с последовательностью SEQ ID NO: 9 и вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 10.
5. Гуманизированное антитело или его фрагмент по п.4, имеющие легкую цепь с последовательностью SEQ ID NO: 11 и тяжелую цепь с последовательностью SEQ ID NO: 12.
6. Фрагмент гуманизированного антитела по п.1 или 5.
7. Гуманизированное антитело или фрагмент по п.1, которые принадлежат к изотипу IgG1.
8. Гуманизированное антитело или фрагмент по п.1, полученные в клетке-хозяине, выбранной из группы, состоящей из клетки миеломы, клетки яичника китайского хомячка, клетки яичника сирийского хомячка и клетки эмбриональной почки человека.
9. Полинуклеотид, содержащий последовательность, кодирующую легкую цепь или тяжелую цепь гуманизированного антитела или его фрагмента по п.1.
10. Полинуклеотид по п.9, содержащий последовательность, кодирующую вариабельную область легкой цепи с последовательностью SEQ ID NO: 7 или SEQ ID NO: 9.
11. Полинуклеотид по п.9, содержащий последовательность, кодирующую вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 8 или SEQ ID NO: 10.
12. Полинуклеотид по п.9, содержащий последовательность, кодирующую легкую цепь с последовательностью SEQ ID NO: 11.
13. Полинуклеотид по п.9, содержащий последовательность, кодирующую тяжелую цепь с последовательностью SEQ ID NO: 12.
14. Полинуклеотид, содержащий последовательность, кодирующую легкую цепь или тяжелую цепь гуманизированного антитела по п.5 или его фрагмента.
15. Вектор для экспрессии антитела или фрагмента по п.1, содержащий полинуклеотиды по пп.9-13.
16. Клетка, трансфицированная вектором по п.15.
17. Клетка, трансфицированная двумя векторами по п.15, причем первый вектор содержит полинуклеотидную последовательность, кодирующую легкую цепь, а второй вектор содержит последовательность, кодирующую тяжелую цепь.
18. Вектор для экспрессии антитела или фрагмента по п.5, содержащий полинуклеотид по п.14.
19. Клетка, трансфицированная вектором по п.18.
20. Клетка, трансфицированная двумя векторами по п.18, при этом первый вектор содержит полинуклеотидную последовательность, кодирующую легкую цепь, а второй вектор содержит последовательность, кодирующую тяжелую цепь.
21. Клетка по любому из пп.16, 17, 19 и 20, которая способна экспрессировать гуманизированное антитело или его фрагмент по п.1 или 5.
22. Фармацевтическая композиция, которая содержит гуманизированное антитело или фрагмент по п.1 или 5 и фармацевтически приемлемый наполнитель.
23. Применение гуманизированного антитела или его фрагмента по п.1 или 5 для производства лекарственного средства для лечения клинической или доклинической болезни Альцгеймера, синдрома Дауна или клинической или доклинической церебральной амилоидной ангиопатии.
24. Применение гуманизированного антитела или фрагмента по п.1 или 5 для производства лекарственного средства для лечения, профилактики или корригирования снижения познавательной способности при клинической или доклинической болезни Альцгеймера, синдроме Дауна или клинической или доклинической церебральной амилоидной ангиопатии.
25. Применение моноклонального антитела или фрагмента по п.1 или 5 для производства лекарственного средства для лечения болезни Альцгеймера.
Текст
006606 Перекрестная ссылка на родственные заявки По данной заявке испрашивается приоритет в соответствии с предварительными заявками на патент США 60/184601, поданной 24 февраля 2000 г., 60/254465, поданной 8 декабря 2000 г., и 60/254498, поданной 8 декабря 2000 г., содержание каждой из которых включено сюда в качестве ссылки. Область техники Изобретение относится к гуманизированным антителам, которые связываются с эпитопом пептида А между аминокислотами 13 и 28, и к профилактическому или терапевтическому лечению состояний,связанных с -амилоидом, таких как болезнь Альцгеймера, синдром Дауна и церебральная амилоидная ангиопатия. Более конкретно изобретение касается применения гуманизированных моноклональных антител для того, чтобы секвестрировать пептид -амилоида (А) в плазме, головном мозге и цереброспинальной жидкости, чтобы предотвратить накопление или чтобы ликвидировать отложение А-пептида в головном мозге и сосудах головного мозга, и для улучшения познавательной способности. Предпосылки Ряд симптомокомплексов, результатом которых являются нарушения познавательной способности,инсульт, кровоизлияние в головной мозг и общая деменция, связаны с нейритными и цереброваскулярными бляшками в головном мозге, содержащими пептид -амилоид (А). Среди таких состояний доклиническая и клиническая стадии болезни Альцгеймера, синдром Дауна и доклиническая и клиническая стадии церебральной амилоидной ангиопатии (САА). Амилоидные бляшки образуются из пептидов амилоида. Указанные пептиды циркулируют в крови и в цереброспинальной жидкости (ЦСЖ), обычно в форме комплексов с липопротеидами. Пептид А в циркулирующей форме состоит из 39-43 аминокислот (главным образом, из 40 или 42 аминокислот), образующихся в результате расщепления общего белка-предшественника, белка-предшественника амилоида, часто обозначаемого АРР. Некоторые формы растворимого А сами по себе нейротоксичны и могут определять тяжесть нейродегенерации и/или снижения познавательной способности (McLean, С.A., et al., Ann. Neurol. (1999) 46: 860-866; Lambert, M.P.,et al. (1998) 95: 6448-6453; Naslund, J., J. Am. Med. Assoc. (2000) 283: 1571). Полученные доказательства свидетельствуют о том, что А может транспортироваться из головного мозга в кровь и обратно (Ghersi-Egea, J-F., et al., J Neurochem. (1996) 67: 880-883; Zlokovic, В.V., et al.,Biochem. Biophys. Res. Comm. (1993) 67: 1034-1040; Shibata M., et al., J. Clin. Invest. (2000) 106: 14891499). Кроме того, А в бляшках находится в равновесии с растворимым А в головном мозге и крови(Kawarabayashi Т., et al., J Neurosci. (2001) 21: 372-381). Как описано в заявке РСТ США 00/35681 и патенте США с регистрационным 09/153130, обе публикации включены здесь в виде ссылки, общие уровни циркулирующего пептида А в ЦСЖ сходны у нормальных здоровых субъектов и субъектов, предрасположенных к проявлению симптомов болезни Альцгеймера. Однако уровни А 42 в среднем ниже у субъектов с болезнью Альцгеймера (Nitsch, R.M., etal., Ann. Neurol. (1995) 37: 512-518). Известно, что А 42 более подвержен агрегации, чем А 40, и когда это происходит, в результате возникают неблагоприятные последствия, такие как отложение А в амилоидных бляшках, превращение А в токсичные растворимые формы, повреждение нервных клеток и поведенческие расстройства, такие как деменция. (Golde, Т.Е., et al., Biochem. Biophys. Acta. (2000) 1502: 172187). Способы индуцирования иммунного ответа для того, чтобы уменьшить амилоидные отложения,описаны в заявке РСТ WO 99/27944, опубликованной 10 июня 1999 г. В описании предполагается, что полноразмерный агрегированный пептид А был бы полезным иммуногеном. Введение фрагмента А (аминокислоты 13-28), конъюгированного с антителом овцы против IgG мыши, не вызывало изменения в накоплении амилоида в коре головного мозга, и только у одного из девяти животных, которые получали инъекции конъюгата фрагмента А 13-28, наблюдалась некоторая лимфопролиферативная активность в ответ на A40. В заявке также показано, что антитела, которые специфично связываются с пептидом А, можно использовать в качестве терапевтических средств. Однако очевидно, что это предположение, поскольку подтверждающие данные отражают протоколы, в которые вовлечена активная иммунизация с использованием, например, А 42. Пептиды доставляют с использованием адъювантов и определяют титры антител, образованных в результате иммунизации, а также уровни пептида А и пептидапредшественника. В заявке строго показано, что бляшки А должны быть уменьшены для того, чтобы ослабить симптомы болезни Альцгеймера, и что для успешного уменьшения бляшек А необходимы процессы, опосредованные клетками. Заявка на выдачу патента 99/60024, опубликованная 25 ноября 1999 г., направлена на способы удаления амилоида с использованием антиамилоидных антител. Однако сформулирован механизм использования способности анти-А-антител связываться с предварительно образованными амилоидными отложениями (т.е. бляшками) и в результате получать последующее локальное очищение микроглии от локализованных бляшек. Этот механизм не доказан in vivo. В данной заявке, кроме того, указывается,что для того, чтобы быть эффективными против бляшек А анти-А-антитела должны получить доступ к паренхиме головного мозга и преодолеть гематоэнцефалический барьер.-1 006606 Несколько заявок РСТ, которые относятся к попыткам контролировать амилоидные бляшки, были опубликованы 7 декабря 2000 г. В заявке на выдачу патента WO 00/72880 описано значительное уменьшение бляшек в коре головного мозга и гиппокампе на модели болезни Альцгеймера на трансгенных мышах при обработке с использованием N-концевых фрагментов пептидов А и антител, которые с ними связываются, но не при обработке фрагментом А 13-28, конъюгированным с антителом овцы противIgG мыши, или с антителом против фрагмента 13-28, антителом 266. Было доказано, что антитела, направленные к N-концу, проходят гематоэнцефалический барьер и индуцируют фагоцитоз амилоидных бляшек в исследованиях in vitro. Заявка WO 00/72876 фактически имеет то же самое описание, что и WO 00/72880, и направлена на иммунизацию самими компонентами фибрилл амилоида. В заявке WO 00/77178 описаны антитела, которые были разработаны для того, чтобы катализировать гидролиз -амилоида, включая антитела, вырабатываемые против смеси соединений переходного состояния на основе фенилаланин-статина, Суs-А 10-25-статин-Рhе 19-Рhе 20 и Суs-А 10-25-статин-Рhe20Ala21, и антитела, вырабатываемые против А 10-25, имеющего восстановленную амидную связь междуPhe19 и Phe20. В указанном документе упоминается о секвестрации А, но это является предположением,поскольку не представлены доказательства такой секвестрации. Кроме того, в документе не представлены доказательства in vivo того, что введение антител вызывает вывод A из центральной нервной системы, препятствует образованию бляшек, снижает накопление бляшек, формирует комплексы между антителами и А в образцах тканей или воздействует на познавательную способность. Было показано, что один путь метаболизма А осуществляется посредством транспорта из ЦНС в плазму (Zlokovic, В.V., et al., Proc. Natl. Acad. Sci (USA) (1996) 93: 4229-4234; Ghersi-Egea, J-F., et al., J.Neurochem. (1996) 67: 880-883). Кроме того, было показано, что А в плазме может проходить через гематоэнцефалический барьер и поступать в головной мозг (Zlokovic, В.V., et al., Biochem. Biophys. Res.Comm. (1993) 67: 1034-1040). Также было показано, что введение некоторых поликлональных и моноклональных А-антител снижает отложение А в амилоидных бляшках у трансгенных мышей АРРV717F,которые являются моделью болезни Альцгеймера (Bard, F., et al. Nature Med. (2000) 6 : 916-919); однако,было указано, что это происходит благодаря некоторым анти-А-антителам, проникающим через гематоэнцефалический барьер, стимулирующих фагоцитоз амилоидных бляшек микроглиальными клетками. В экспериментах Барда анализы срезов головного мозга ех vivo показали, что присутствие добавленного А-антитела вместе с экзогенно добавленной микроглией индуцировало фагоцитоз А, что приводило к удалению отложений А. Содержание растворимых А 40 и А 42 в ЦСЖ и крови можно легко определить стандартными анализами с использованием антител, направленных против эпитопов цепи А. О таких анализах сообщалось, например, в патентах США 5766846; 5837672 и 5593846. В указанных патентах описано получение мышиных моноклональных антител к центральному домену пептида А и сообщается о наличии эпитопов вокруг, включая положения 16 и 17. Также описаны антитела, направленные против N-концевой области. Показано, что несколько моноклональных антител вступали в иммунную реакцию с положениями 13-28 пептида А; указанные антитела не связывались с пептидом, представляющим положения 17-28,таким образом, согласно цитированным патентам установлено, что это именно та область, включающая положения 16-17 (сайт -секретазы), которая была мишенью указанных антител. Среди антител, которые, как известно, связываются с А между аминокислотами 13 и 28, мышиные антитела 266, 4G8 и 1 С 2. В настоящее время авторы данного изобретения неожиданно обнаружили, что введение антитела 266 очень быстро и почти полностью восстанавливает познавательную способность (объектную память) у гемизиготных трансгенных мышей (APPV717F) 24-месячного возраста. Однако антитело не обладает свойствами, которые, как считается в данной области, необходимы для антитела, чтобы оно было эффективным при лечении болезни Адьцгеймера, синдрома Дауна и других состояний, связанных с пептидом А. Далее неожиданно авторы данного изобретения обнаружили, что антитела, которые связываются с А между положениями 13 и 28 (266 и 4G8), способны секвестрировать растворимые формы А из их связанных, циркулирующих форм в крови, и что периферическое введение антитела 266 в результате приводит к быстрому выходу относительно больших количеств пептида А из ЦНС в плазму. Результатом этого является измененный клиренс растворимого А, профилактика образования бляшек, и, что наиболее неожиданно, улучшение познавательной способности, даже без обязательного уменьшения отложения амилоидных бляшек А, прохождения гематоэнцефалического барьера в какой-либо значительной степени, покрывания бляшек, активирующего клеточные механизмы, или связывания с большим сродством с агрегированным А. Сущность изобретения Изобретение относится к гуманизированным антителам или их фрагментам, которые позитивно влияют на познавательную способность при заболеваниях и состояниях, в которые может быть вовлечен А, таких как клиническая или доклиническая стадия болезни Альцгеймера, синдром Дауна и клиническая или доклиническая стадия церебральной амилоидной ангиопатии. Антитела или их фрагменты не-2 006606 требуют прохождения гематоэнцефалического барьера, покрывания амилоидной бляшки, активирования клеточных ответов или даже необходимого снижения накопления амилоидных бляшек. В другом аспекте данное изобретение относится к гуманизированным антителам и их фрагментам, которые секвестрируют пептид А из его связанной циркулирующей формы в крови и изменяют клиренс растворимой и связанной форм А в центральной нервной системе и плазме. В другом аспекте данное изобретение относится к гуманизированным антителам и их фрагментам, при этом гуманизированные антитела специфично связываются с эпитопом между аминокислотами 13 и 28 молекулы А. В другом аспекте изобретение относится к гуманизированным антителам и их фрагментам, в которых CDR получены из мышиного моноклонального антитела 266, и при этом антитела почти сохраняют связывающие свойства мышиного антитела и in vitro и in vivo обладают свойствами, функционально эквивалентными мышиному антителу(последовательности с SEQ ID NO: 1 по SEQ ID NO: 6). В другом аспекте данное изобретение относится к гуманизированным антителам и их фрагментам, в которых вариабельные области имеют последовательности, содержащие CDR из мышиного антитела 266 и специфичные константные последовательности человека (последовательности SEQ ID NO: 7-SEQ ID NO: 10), при этом антитела почти сохраняют связывающие свойства мышиного антитела и in vitro и in vivo обладают свойствами, функционально эквивалентными свойствам мышиного антитела 266. В другом аспекте данное изобретение относится к гуманизированным антителам и их фрагментам, в которых легкая цепь представляет собой SEQ ID NO: 11, а тяжелая цепь представляет собой SEQ ID NO: 12. Также частью изобретения являются полинуклеотидные последовательности, которые кодируют гуманизированные антитела или их фрагменты, описанные выше, векторы, содержащие полинуклеотидные последовательности, кодирующие гуманизированные антитела или их фрагменты, клетки-хозяева,трансформированные векторами или содержащие полинуклеотиды, которые экспрессируют гуманизированные антитела или их фрагменты, фармацевтические композиции гуманизированных антител и их фрагментов, раскрытых здесь, и способы их получения и применения. Такие гуманизированные антитела и их фрагменты пригодны для секвестрации А у человека; для лечения и профилактики заболеваний и состояний, характеризующихся бляшками А или Атоксичностью в головном мозге, таких как болезнь Альцгеймера, синдром Дауна и церебральная амилоидная ангиопатия у человека; для диагностики указанных заболеваний у человека и для определения того, будет ли субъект (человек) отвечать на лечение с использованием антител человека против А. Введение соответствующего гуманизированного антитела in vivo для того, чтобы секвестрировать пептид А, циркулирующий в биологических жидкостях, полезно для профилактического и терапевтического лечения состояний, связанных с образованием содержащих А диффузных, нейритных и цереброваскулярных бляшек в головном мозге. Гуманизированное антитело, включая его иммунологически активный фрагмент, в результате приводит к удалению пептида А из макромолекулярных комплексов,которые в нормальных условиях важны для транспортировки пептида в жидкостях организма к месту и от места, где могут формироваться бляшки, и где он может быть токсичным. Кроме того, секвестрация пептида А плазмы антителом или его фрагментом, ведет себя как слив эффективно секвестрирующий растворимый пептид А в компартменте плазме и индуцирующий выход А в плазму из мест локализации в центральной нервной системе (ЦНС). При секвестрации А в крови усиливается суммарный отток из головного мозга и предотвращается депонирование растворимого А в нерастворимых бляшках и формирование токсичных растворимых форм в головном мозге. Кроме того, нерастворимый А в бляшках, который находится в равновесии с растворимым А, может удаляться из головного мозга в результате секвестрирующего действия в крови. Секвестрация пептида А антителом также усиливает его выведение из организма и ингибирует токсичные действия растворимого А в головном мозге и образование и дальнейшее накопление нерастворимого А в виде амилоида в бляшках. Антитела, пригодные согласно данному изобретению, не проходят гематоэнцефалический барьер в большом количестве (0,1% уровней в плазме). Кроме того, гуманизированные антитела, используемые в данном изобретении, при периферическом введении для целебного действия не требуют того, чтобы был вызван клеточный иммунный ответ в головном мозге в том случае, когда они связываются с пептидом А или когда они свободно циркулируют. Кроме того, при периферическом введении антитела не требуют значительного связывания агрегированного пептида А в головном мозге для своего целебного действия. Таким образом, в одном аспекте изобретение направлено на способ лечения и профилактики состояний, характеризующихся образованием у человека бляшек, содержащих белок бета-амилоид, и указанный способ включает в себя введение предпочтительно периферическое, человеку, который нуждается в таком лечении, терапевтически или профилактически эффективного количества гуманизированного моноклонального антитела или его иммунологически активного фрагмента, при этом указанное антитело специфично связывается со средней областью пептида А. В другом аспекте изобретение направлено на способ ингибирования образования амилоидных бляшек и на очищение от амилоидных бляшек у человека, при этом указанный способ включает в себя введение субъекту-человеку, который нуждается в таком ингибировании, эффективного количества гуманизированного антитела, которое секвестрирует пеп-3 006606 тид А из циркулирующей формы в крови и индуцирует отток из головного мозга, а также изменяет клиренс А в плазме и головном мозге. В дополнительных аспектах направлением изобретения являются такие гуманизированные антитела, включая их иммунологически эффективные части, и способы их получения. Изобретение также включает в себя способы реверсии познавательной способности при ее снижении, улучшения познавательной способности, лечения снижения познавательной способности и профилактики снижения познавательной способности у субъекта, которому поставлен диагноз клинической или доклинической болезни Альцгеймера, синдрома Дауна или клинической или доклинической церебральной амилоидной ангиопатии, включающие в себя введение субъекту эффективного количества гуманизированного антитела согласно изобретению. Изобретение также включает в себя применение гуманизированного антитела согласно изобретению для производства лекарственного средства, включая длительную экспрессию рекомбинантных последовательностей антитела или фрагмента антитела в тканях человека, для лечения, профилактики или обратного процесса восстановления состояния при болезни Альцгеймера, синдроме Дауна или церебральной амилоидной ангиопатии; для лечения, профилактики или реверсии познавательной способности при ее снижении в случае клинической или доклинической болезни Альцгеймера, синдрома Дауна или клинической или доклинической церебральной амилоидной ангиопатии; или для ингибирования образования амилоидных бляшек или эффектов токсичных растворимых форм А у людей. Изобретение связано с неожиданным наблюдением, что за короткий период времени после введения антитела согласно данному изобретению происходит отток относительно больших количеств А из центральной нервной системы в кровь. Краткое описание чертежей На фиг. 1 показан процент пептида А, выведенного посредством мАт 266 из цереброспинальной жидкости через диализную мембрану, как функция отсечения по молекулярной массе диализной мембраны. На фиг. 2 показана концентрация Аобщ, выявленная в плазме трансгенной мыши APPV717F после инъекции либо 200, либо 600 мкг мАт 266, как функция времени. На фиг. 3 А показано количество отложения пептида А в коре головного мозга у трансгенных мышей АРРV717F, обработанных физиологическим раствором, мышиным IgG или мАт 266. На фиг. 3 В показана корреляция этих результатов с происхождением от определенных родителей. На фиг. 4 показаны полинуклеотидные последовательности для экспрессии легкой цепи гуманизированного 266 из плазмиды pVk-Hu266 и однобуквенные коды аминокислот экспрессированной легкой цепи гуманизированного 266 (соответствующие SEQ ID NO: 11 в случае зрелого состояния). На фиг. 5 показаны полинуклеотидные последовательности для экспрессии тяжелой цепи гуманизированного 266 из плазмиды pVg-Hu266 и однобуквенные коды аминокислот экспрессированной тяжелой цепи гуманизированного 266 (соответствующие SEQ ID NO: 12 в случае зрелого состояния). Фиг. 6 представляет собой карту плазмиды pVk-Hu266. Фиг. 7 представляет собой карту плазмиды pVgl-Hu266. Способы выполнения изобретения Пептиды А, которые циркулируют в биологических жидкостях человека, представляют собой область карбоксильного конца белка-предшественника, кодируемого хромосомой 21. На основании результатов экспериментов in vitro сообщалось, что пептид А обладает плохой растворимостью в физиологических растворах, поскольку он содержит участок гидрофобных аминокислот, которые являются частью области, которая заякоривает его длинный предшественник в липидных мембранах клеток. Таким образом, не является неожиданным тот факт, что циркулирующий пептид А обычно образует комплексы с другими компонентами, которые предотвращают его агрегацию. Вследствие этого существовали трудности в определении циркулирующего пептида А в биологических жидкостях. В упоминаемых выше патентных документах (патенты США 5766846, 5837672 и 5593846) описано получение антител, включая моноклональное антитело, названное клоном 266, которое вырабатывали против пептида, содержащего аминокислоты 13-28 пептида А, и для которого показано, что он специфично связывается с указанным пептидом. Авторы данной заявки обнаружили, что антитела, которые связываются с этой областью, в противоположность антителам, которые связываются где-либо в другом месте аминокислотной последовательности А, способны очень эффективно секвестрировать растворимый пептид А из макромолекулярных комплексов. Результатом такой секвестрации будет отток суммарного пептида А из ЦНС, изменение его клиренса в ЦНС и плазме, и снижение его способности к образованию бляшек. Таким образом, антитела указанной специфичности, модифицированные для снижения их иммуногенности путем их превращения в гуманизированную форму, открывают возможность как для профилактического, так и для терапевтического лечения состояний, которые связаны с образованием бета-амилоидных бляшек. Такие состояния включают, как указано выше, доклиническую и клиническую болезнь Альцгеймера, синдром Дауна и клиническую и доклиническую церебральную амилоидную ангиопатию.-4 006606 В использованном здесь смысле слово лечить включает в себя терапевтическое лечение, когда уже известно о наличии состояния, которое предстоит лечить, и профилактику, т.е. предотвращение или ослабление возможного появления состояния в будущем. Под моноклональным антителом, которое связывается со средней областью пептида А имеют в виду моноклональные антитела (мАТ), которые связывают аминокислотную последовательность, представляющую собой эпитоп, находящийся между положениями 13-28 пептида А. Не требуется, чтобы мишенью была полная область. При условии, что антитело связывает, по меньшей мере, эпитоп в данной области (в частности, например, включающей сайт -секретазы 16-17 или сайт, с которым связывается антитело 266), такие антитела являются эффективными в способе согласно изобретению. Под антителом понимают моноклональное антитело как таковое, или его иммунологически эффективный фрагмент, такой как его Fab-, Fab'- или F(аb')2-фрагмент. В некоторых контекстах в данном описании фрагменты будут указаны специально для того, чтобы акцентировать внимание; тем не менее, будет понятно, что безотносительно от того, какой из фрагментов указывается, термин антитело включает в себя такие фрагменты, а также одноцепочечные формы. При условии, что белок сохраняет способность специфично связываться с предназначенной для него мишенью, и в этом случае секвестрировать пептид А из его белков-носителей в крови, указанный белок включен в термин антитело. Также в определение антитело включены, например, одноцепочечные формы антител такой специфичности,обычно называемые областями Fv. Предпочтительно, но не обязательно, антитела, пригодные в данном изобретении, получают рекомбинантным способом, так как требуется обработка обычно мышиных или других антител, не являющихся антителами человека, обладающих соответствующей специфичностью,для того, чтобы превратить их в гуманизированную форму. Антитела могут быть гликозилированными или негликозилированными, хотя гликозилированные антитела предпочтительны. Как хорошо известно,антитела, по существу, перекрестно сшиты дисульфидными связями. Известно, что основная структурная единица антител содержит тетрамер. Каждый тетрамер состоит из двух идентичных частей полипептидных цепей, каждая пара имеет одну легкую (около 25 кД) и одну тяжелую цепь (около 50-70 кД). Аминоконцевая часть каждой цепи включает в себя вариабельную область длиной примерно от 100 до 110 или больше аминокислот, главным образом, ответственную за распознавание антигена. Часть карбоксильного конца каждой цепи определяет константную область,главным образом, ответственную за эффекторную функцию. Легкие цепи классифицируют как гамма, мю, альфа и лямбда. Тяжелые цепи классифицируют как гамма, мю, альфа, дельта или эпсилон, и они определяют изотип антитела, соответственно, IgG, IgM, IgA,IgD и IgE. В пределах легкой и тяжелой цепей вариабельные и константные области связаны областьюJ длиной примерно 12 или более аминокислот, при этом тяжелая цепь также включает в себя областьD длиной примерно 10 или более аминокислот. Вариабельные области каждой пары легкой/тяжелой цепей образуют связывающий сайт антитела. Таким образом, интактное антитело имеет два связывающих сайта. Все цепи имеют одну и ту же общую структуру из относительно консервативных константных областей (FR), связанных тремя гипервариабельными областями, также называемыми областями, определяющими комплементарность, или CDR.CDR-области из двух цепей каждой пары выровнены константными областями, способными связываться со специфичным эпитопом. От N-конца к С-концу как легкая, так и тяжелая цепь содержит домены FR1,CDR1, FR2, CDR2, FR3, CDR3 и FR4. Указания аминокислот каждого домена даны в соответствии с хорошо известными правилами [Kabat "Sequences of Proteins of Immunological Interest" National Institutes ofHealth, Bethesda, Md., 1987 and 1991; Chothia, et al., J. Mol. Biol. 196: 901-917 (1987); Chothia, et al., Nature 342: 878-883 (1989)]. Как хорошо известно в данной области, моноклональные антитела соответствующей специфичности можно легко создать стандартными способами иммунизации млекопитающих, образования гибридом из антителопродуцирующих клеток указанного млекопитающего или их иммортализации другим способом, и культивирования гибридом или иммортализованных клеток для того, чтобы определить их соответствующую специфичность. В данном случае такие антитела можно создать посредством иммунизации человека, кролика, крысы или мыши, например, пептидом, соответствующим эпитопу, охватывающему область 13-28 пептида А или его субрайон. Материалы для рекомбинантной обработки можно получить путем извлечения нуклеотидных последовательностей, кодирующих требуемое антитело из гибридомы или другой клетки, которая его продуцирует. Затем полученные нуклеотидные последовательности можно обрабатывать, чтобы придать им гуманизированную форму. Под гуманизированным антителом подразумевается антитело, которое частично или полностью состоит из аминокислотных последовательностей, полученных из антитела гаметического типа человека путем изменения последовательности антитела, включающего в себя области, определяющие комплементарность (CDR), отличные от таковых антител человека. Самое простое подобное изменение может просто заключаться в замене константной области антитела мыши константной областью антитела человека, приводя, таким образом, к образованию химеры человек/мышь, которая может обладать достаточно низкой иммуногенностью для того, чтобы быть приемлемой для фармацевтического применения. Однако-5 006606 предпочтительно вариабельную область антитела и даже CDR также гуманизируют способами, которые в настоящее время хорошо известны в данной области. Константные области вариабельных областей заменяют соответствующими константными областями человека, оставляя CDR, отличные от человеческих, по существу, интактными, или даже заменяя CDR последовательностями, полученными из генома человека. Полностью человеческие антитела получают у генетически модифицированных мышей, иммунная система которых была изменена так, чтобы соответствовать иммунной системе человека. Как указано выше, для применения в способах согласно изобретению достаточно использовать иммунологически специфичный фрагмент антитела, включая фрагменты, представляющие собой одноцепочечные формы. С другой стороны, гуманизированное антитело относится к антителу, содержащему каркас антитела человека, по меньшей мере один CDR из антитела, не являющегося антителом человека, и в котором любая присутствующая константная область в основном идентична константной области иммуноглобулина человека, т.е., по меньшей мере, идентична примерно на 85-90%, предпочтительно идентична по меньшей мере на 95%. Следовательно, все части гуманизированного антитела, за исключением может быть областей CDR, в основном идентичны соответствующим частям одной или нескольких последовательностей нативного иммуноглобулина человека. Например, гуманизированный иммуноглобулин, как правило, не будет охватывать химерное антитело - вариабельная область мыши/константная область человека. Гуманизированные антитела обладают по меньшей мере тремя возможными преимуществами по сравнению с антителами, отличными от человеческих, и химерными антителами при применении для терапии человека. 1) Поскольку эффекторная часть является человеческой, антитело может лучше взаимодействовать с другими частями иммунной системы человека (например, более эффективно разрушать клетки-мишени за счет зависимой от комплемента цитотоксичности (CDC) или антителозависимой клеточной цитотоксичности (ADCC). 2) Иммунная система человека не должна распознавать константную или С-область гуманизированного антитела как чужеродную, и поэтому гуморальный ответ против такого инъецированного антитела должен быть меньше, чем против полностью чужеродного антитела, отличного от человеческого,или частично чужеродного химерного антитела. 3) Сообщалось, что инъецированные антитела, отличные от человеческих, имеют период полужизни в циркуляции у человека намного короче, чем период полужизни антител человека. Инъецированные гуманизированные антитела будут иметь период полужизни, по существу, идентичный антителам человека природного происхождения, позволяя вводить меньшие и менее частые дозы. Конструирование гуманизированных иммуноглобулинов можно выполнять следующим образом. В том случае, когда аминокислота попадает в одну из ниже перечисленных категорий, аминокислоту каркаса иммуноглобулина человека, который необходимо использовать (акцепторный иммуноглобулин),заменяют аминокислотой каркаса из отличного от человеческого иммуноглобулина, предоставляющегоa) аминокислота в константной области человека акцепторного иммуноглобулина необычна для иммуноглобулина человека в таком положении, тогда как соответствующая аминокислота в донорном иммуноглобулине типична для иммуноглобулина человека в данном положении;b) положение аминокислоты находится непосредственно рядом с CDR; илиc) какой-либо атом боковой цепи аминокислоты каркаса находится на расстоянии в пределах 5-6 ангстрем (от центра до центра) от какого-либо атома аминокислоты CDR в трехмерной модели иммуноглобулина [Queen, et al., цитированная работа и Со, et al., Proc. Natl. Acad. Sci. USA 88, 2869 (1991)]. В том случае, когда каждая из аминокислот в константной области человека акцепторного иммуноглобулина и соответствующая аминокислота в донорном иммуноглобулине необычна для иммуноглобулина человека в данном положении, такую аминокислоту заменяют аминокислотой, типичной для иммуноглобулина человека в данном положении. Предпочтительным гуманизированным антителом является гуманизированная форма мышиного антитела 266. Области CDR гуманизированного 266 имеют следующие аминокислотные последовательности: Предпочтительная вариабельная область легкой цепи гуманизированного антитела согласно данному изобретению имеет следующую аминокислотную последовательность, в которой каркас получен изVk-участков человека DPK18 и J-участка Jk1 с несколькими заменами аминокислот на консенсусные аминокислоты из той же подгруппы V человека, чтобы уменьшить потенциальную иммуногенность: где Хаа в положении 2 означает Val или Ilе; Хаа в положении 7 означает Ser или Thr; Хаа в положении 14 означает Thr или Ser; Хаа в положении 15 означает Leu или Pro; Хаа в положении 30 означает Ilе или Val; Хаа в положении 50 означает Arg, Gln, или Lys; Хаа в положении 88 означает Val или Leu; Хаа в положении 105 означает Gln или Gly; Хаа в положении 108 означает Lys или Аrg; и Хаа в положении 109 означает Val или Leu. Предпочтительная вариабельная область тяжелой цепи гуманизированного антитела согласно данному изобретению имеет следующую аминокислотную последовательность, в которой каркас получен изVH-участков человека DP53 и J-участка JH4 с несколькими заменами аминокислот на консенсусные аминокислоты из той же подгруппы человека, чтобы уменьшить потенциальную иммуногенность: где Хаа в положении 1 означает Glu или Gln; Хаа в положении 7 означает Ser или Leu; Хаа в положении 46 означает Glu, Val, Asp, или Ser; Хаа в положении 63 означает Thr или Ser; Хаа в положении 75 означает Ala, Ser, Val, или Thr; Хаа в положении 76 означает Lys или Аrg; Хаа в положении 89 означает Glu или Asp; и Хаа в положении 107 означает Leu или Thr. Особенно предпочтительная вариабельная область легкой цепи гуманизированного антитела согласно данному изобретению имеет следующую аминокислотную последовательность, в которой каркас получен из Vk-участков человека DPK18 и J-участка Jk1 с несколькими заменами аминокислот на консенсусные аминокислоты из той же подгруппы V человека, чтобы уменьшить потенциальную иммуногенность: Особенно предпочтительная вариабельная область тяжелой цепи гуманизированного антитела согласно данному изобретению имеет следующую аминокислотную последовательность, в которой каркас получен из VH-участков человека DP53 и J-участка JH4: Предпочтительная легкая цепь гуманизированного антитела согласно данному изобретению имеет аминокислотную последовательность Предпочтительная тяжелая цепь гуманизированного антитела согласно данному изобретению имеет аминокислотную последовательность Возможны другие последовательности легкой и тяжелой цепей гуманизированных антител согласно данному изобретению и гуманизированного антитела 266. Иммуноглобулины могут иметь две части комплексов легкая цепь/тяжелая цепь, при этом по меньшей мере одна цепь содержит один или несколько мышиных областей, определяющих комплементарность, функционально связанных с участками константных областей человека. В другом аспекте данное изобретение направлено на рекомбинантные полинуклеотиды, кодирующие антитела, которые в случае экспрессии содержат CDR тяжелой и легкой цепи из антитела согласно данному изобретению. Что касается константной области человека, аминокислотную последовательность константной или вариабельной области, отличной от человеческого иммуноглобулина, предоставляющего CDR, сравнивают с соответствующими последовательностями в коллекции последовательностей вариабельных областей иммуноглобулинов человека, и отбирают последовательность, имеющую высокое процентное содержание идентичных аминокислот. Примеры полинуклеотидов, которые при экспрессии кодируют полипептидные цепи, содержащие CDR тяжелой и легкой цепей моноклонального антитела 266, представлены на фиг. 4 и 5. Вследствие вырожденности кодонов и несущественных аминокислотных замен указанные последовательности легко можно заменить другими полинуклеотидными последовательностями. Особенно предпочтительные полинуклеотиды согласно данному изобретению кодируют антитела, которые в случае экспрессии содержат CDR SEQ ID NO: 1-SEQ ID NO: 6, или любые вариабельные области SEQ ID NO: 7-SEQ ID NO: 10, или легкие и тяжелые цепи SEQ ID NO: 11 и SEQID NO: 12. Кроме того, полинуклеотиды, как правило, будут включать в себя полинуклеотидную последовательность регуляции экспрессии, оперативно сцепленную с последовательностями, кодирующими гуманизированный иммуноглобулин, включая естественно связанные или гетерологичные области промоторов. Предпочтительно последовательности регуляции экспрессии будут представлять собой эукариотические промоторные системы в векторах, способных трансформировать и трансфицировать эукариотические клетки-хозяев, но также можно использовать регуляторные последовательности прокариотических хозяев. После того, как вектор был включен в соответствующую линию клеток-хозяев, клетку-хозяина размножают в условиях, подходящих для экспрессии нуклеотидных последовательностей на высоком уровне, и при желании далее могут следовать сбор и очистка легких цепей, тяжелых цепей, димеров легкой/тяжелой цепи или интактных антител, связывающих фрагментов или других форм иммуноглобулина. Нуклеотидные последовательности согласно данному изобретению, способные в конечном итоге экспрессировать требуемые гуманизированные антитела, можно создать из множества различных полинуклеотидов (геномной или кДНК, РНК, синтетических олигонуклеотидов и т.д.) и компонентов (например, областей V, J, D и С), а также множеством различных способов. Связывание соответствующих геномных и синтетических последовательностей является обычным способом получения, но также можно использовать последовательности кДНК. Последовательности ДНК константной области человека можно выделить в соответствии с хорошо известными способами из различных клеток человека, но предпочтительно из иммортализованных Вклеток. CDR-области для получения иммуноглобулинов согласно данному изобретению будут получены сходным образом из моноклональных антител, отличных от человеческих, способны связываться с эпитопом между аминокислотами 13 и 28 пептида А, и указанные моноклональные антитела получают из любого подходящего источника - млекопитающего, включая мышей, крыс, кроликов или других позвоночных, способных продуцировать антитела, хорошо известными способами, которые описаны выше. Подходящие клетки, являющиеся источником полинуклеотидных последовательностей, и клеткихозяева для экспрессии и секреции иммуноглобулина можно получить из ряда источников, хорошо известных в данной области. Кроме гуманизированных иммуноглобулинов, которые здесь особо описаны, можно легко разработать и получить другие существенно гомологичные модифицированные иммуноглобулины с использованием различных технологий рекомбинантной ДНК, хорошо известных специалистам в данной области. Например, константные области могут отличаться от нативных последовательностей на уровне первичной структуры несколькими аминокислотными заменами, концевыми и внутренними присоединениями и делениями, и тому подобным. Кроме того, множество константных областей человека можно использовать по отдельности или в комбинации в качестве основы для гуманизированных иммуноглобу- 11006606 линов согласно данному изобретению. В общем, модификации генов можно легко выполнить множеством хорошо известных способов, таких как сайт-направленный мутагенез. Альтернативно, можно получить фрагменты полипептида, содержащие только часть первичной структуры антитела, и при этом указанные фрагменты обладают одной или несколькими активностями иммуноглобулина (например, фиксирующей комплемент активностью). Указанные фрагменты полипептида можно получить протеолитическим расщеплением интактных антител способами, хорошо известными в данной области, или встраиванием стоп-кодонов в нужные положения в векторах, используя сайт-направленный мутагенез, а именно после СН 1, чтобы получить Fab-фрагменты, или после шарнирного района, чтобы получить F(ab')2-фрагменты. Одноцепочечные антитела можно получить связыванием VL и VH ДНК-линкером. Как указано ранее кодирующие нуклеотидные последовательности будут экспрессированы в хозяевах после того, как последовательности были оперативно связаны (т.е. расположены в определенном месте, чтобы обеспечить функционирование) с последовательностью регуляции экспрессии. Указанные экспрессирующие векторы обычно способны к репликации в организмах хозяев либо в виде эписом, либо в виде интегрированной части хромосомной ДНК хозяина. В большинстве случаев экспрессирующие векторы будут содержать маркеры селекции, например, тетрациклином или неомицином, чтобы обеспечить возможность выявления тех клеток, которые трансформированы требуемыми последовательностями ДНК. Е.coli является прокариотическим хозяином, в частности, пригодным для клонирования полинуклеотидов согласно данному изобретению. Другие микроорганизмы-хозяева, пригодные для применения,включают бациллы, такие как Bacillus subtilus и другие энтеробактерии, такие как Salmonella, Serratia и различные виды Pseudomonas. В указанных хозяевах-прокариотах также можно получить экспрессирующие векторы, которые, как правило, будут содержать последовательности регуляции экспрессии,совместимые с клеткой-хозяином (например, начало репликации). Кроме того, может присутствовать любое количество хорошо известных промоторов, таких как лактозная промоторная система, триптофановая (trp) промоторная система, промоторная система бета-лактамазы или промоторная система из фага лямбда. Промоторы, как правило, будут контролировать экспрессию необязательно с последовательностью оператора, и иметь последовательности сайта связывания рибосом и тому подобные, для инициации и завершения транскрипции и трансляции. Для экспрессии также можно использовать другие микроорганизмы, такие как дрожжи. Saccharomyces является предпочтительным хозяином с подходящими векторами, имеющими последовательности регуляции экспрессии, такие как промоторы, включая промоторы 3-фосфоглицераткиназы или других гликолитических ферментов, и при необходимости начало репликации, последовательности терминации и тому подобные. Кроме микроорганизмов также можно использовать культуру клеток тканей млекопитающих, чтобы экспрессировать и продуцировать полипептиды согласно данному изобретению. В действительности эукариотические клетки являются предпочтительными, поскольку в данной области был разработан ряд подходящих линий клеток-хозяев, способных секретировать интактные иммуноглобулины, и такие линии включают линии клеток СНО, различные линии клеток COS, линии клеток яичника сирийского хомячка, клетки HeLa, предпочтительно линии клеток миеломы, трансформированные В-клетки, линии клеток эмбриональной почки человека или гибридомы. Экспрессирующие векторы для указанных клеток могут включать в себя последовательности регуляции экспрессии, такие как начало репликации, промотор, энхансер и необходимые информационные сайты процессинга, такие как сайт связывания рибосомы,сайты сплайсинга РНК, сайты полиаденилирования и последовательности терминаторов транскрипции. Предпочтительными последовательностями регуляции экспрессии являются промоторы, полученные из генов иммуноглобулинов, SV40, аденовируса, вируса папилломы быка, цитомегаловируса и тому подобные. Векторами, содержащими представляющие интерес нуклеотидные последовательности (например,последовательности, кодирующие тяжелую и легкую цепь, и последовательности регуляции экспрессии),можно трансфицировать клетку-хозяина хорошо известными способами, которые варьируют в зависимости от типа клеточного хозяина. Например, трансфекцию с помощью хлорида кальция обычно используют для прокариотических клеток, тогда как для других клеточных хозяев можно использовать обработку фосфатом кальция или электропорацию. После экспрессии целые антитела, их димеры, отдельные легкие и тяжелые цепи или другие формы иммуноглобулинов согласно данному изобретению можно очистить стандартными для данной области способами, включая преципитацию сульфатом аммония, ионообменную, аффинную, обращеннофазовую, основанную на гидрофобном взаимодействии колоночную хроматографию, гель-электрофорез и тому подобное. Для фармацевтических применений наиболее предпочтительны в значительной степени очищенные иммуноглобулины, гомогенность которых составляет по меньшей мере от 90 до 95% и наиболее предпочтительна от 98 до 99% или большая гомогенность. После частичной очистки или очистки до гомогенного состояния в зависимости от потребностей, затем полипептиды можно использовать терапевтически или профилактически, как здесь указано.- 12006606 Антитела (включая иммунологически активные фрагменты) вводят субъекту, который подвержен риску или у которого проявляются симптомы, связанные с А, или такая патология как клиническая или доклиническая стадия болезни Альцгеймера, синдром Дауна или клиническая или доклиническая стадия амилоидной ангиопатии, с использованием стандартных способов введения, предпочтительно периферически (т.е. не вводя в центральную нервную систему) посредством внутривенного, внутрибрюшинного,подкожного, легочного, трансдермального, внутримышечного, интраназального, буккального, подъязычного введения или введения посредством суппозитория. Хотя антитела можно вводить непосредственно в систему желудочков, цереброспинальную жидкость или паренхиму головного мозга и способы адресного введения в указанные места хорошо известны в данной области, нет необходимости использовать эти более сложные процедуры. Антитела согласно данному изобретению эффективны при введении более простыми способами, которые основаны на введении в периферическую систему циркуляции. Преимущества данного изобретения заключаются в способности антитела проявлять свои целебные действия даже несмотря на то, что как таковые они не поступают непосредственно в центральную нервную систему. Действительно, в данной работе было показано, что количество антитела, которое проходит гематоэнцефалический барьер, составляет 0,1% от уровней в плазме, и что антитела согласно изобретению проявляют свою способность секвестрировать А в периферической циркуляции, а также изменять клиренс в центральной нервной системе и растворимого А в плазме. Фармацевтические композиции для введения разрабатывают так, чтобы они соответствовали выбранному способу введения, и используют соответствующие фармацевтически приемлемые наполнители, такие как диспергирующие агенты, буферы, поверхностно-активные вещества, консерванты, солюбилизирующие агенты, средства изотоничности, стабилизирующие агенты и тому подобное. В последнем выпуске Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton PA, включенном здесь в виде ссылки, представлен справочник способов приготовления композиций, которые в основном известны практикам. Справочник может быть особенно полезен для того, чтобы изменить параметры растворимости антител согласно изобретению, сделать их более липофильными, например, посредством их инкапсулирования в липосомы или посредством блокирования полярных групп. Предпочтительна доставка в периферическую систему путем внутривенной, или внутрибрюшинной, или подкожной инъекции. Подходящие носители для таких инъекций указаны далее. Однако, кроме того, введение также можно проводить через мембраны слизистой оболочки посредством назальных аэрозолей и суппозиториев. Подходящие композиции для таких способов введения хорошо известны и обычно включают в себя поверхностно-активные вещества, которые способствуют переносу через мембраны. Такие поверхностно-активные вещества часто являются производными стероидов или являются катионными липидами,такими как хлоридN-[1-(2,3-диолеоил)пропил-N,N,Nтриметиламмония (DOTMA) или различными соединениями, такими как гемисукцинат холестерина,фосфатидилглицеролы и тому подобное. Концентрация гуманизированного антитела в композициях составляет примерно от 0,1 до 15 или 20 мас.% и будет выбрана, главным образом, на основе объемов жидкости, вязкости и так далее, в соответствии с конкретным выбранным способом введения. Таким образом, обычную фармацевтическую композицию для инъекции можно приготовить так, чтобы она содержала 1 мл стерильной забуференной воды или фосфатно-солевого буфера и 1-100 мг гуманизированного антитела согласно данному изобретению. После приготовления композицию можно стерильно фильтровать или другим способом сделать микробиологически приемлемой. Типичная композиция для внутривенной инфузии может иметь объем до 250 мл такой жидкости, как раствор Рингера, и концентрацию антитела 1-100 мг/мл или больше. Терапевтические средства согласно данному изобретению можно заморозить или лиофильно высушить для хранения и перерастворения в подходящем стерильном носителе перед использованием. Лиофилизация и перерастворение могут привести к потере активности антитела в разной степени (например, в случае обычных иммуноглобулинов IgM-антитела имеют способность к большей потере активности, чем IgGантитела). Дозы можно скорректировать, чтобы компенсировать потерю. Значение рН композиции будет выбрано так, чтобы сбалансировать стабильность антитела (химическую и физическую) и комфорт для пациента при введении. Как правило, допустимы значения рН от 4 до 8. Хотя приведенные выше способы представляются наиболее удобными и наиболее подходящими для введения белков, таких как гуманизированные антитела, при соответствующей адаптации можно использовать другие способы введения, такие как трансдермальное введение или пероральное введение,при условии, что разработана правильная композиция. Кроме того, желательным может быть применение композиций с контролируемым высвобождением при использовании биоразрушаемых пленок и матриц, или осмотических мини-насосов, или систем доставки, основанных на шариках декстрана, альгинате или коллагене. В заключение, имеются и хорошо известные в данной области композиции для введения антител согласно изобретению и их можно выбрать из множества вариантов. Типичные уровни доз можно оптимизировать, используя стандартные клинические способы, и они будут зависеть от способа введения и состояния пациента.- 13006606 Следующие далее примеры предназначены для иллюстрации, но не для ограничения изобретения. В примерах, изложенных далее, наряду с другими используют мышиное моноклональное антитело,обозначенное 266, которое было первоначально получено путем иммунизации пептидом, состоящим из остатков 13-28 пептида А человека. Было подтверждено, что антитело вступает в иммунную реакцию с данным пептидом, а ранее было показано, что оно не реагирует с пептидом, содержащим только остатки 17-18 пептида А человека или какие-либо другие эпитопы в пределах пептида А. Получение указанного антитела описано в патенте США 5766846, включенном здесь в виде ссылки. Так как здесь в примерах описаны эксперименты, проведенные на мышиных системах, применение мышиных моноклональных антител является удовлетворительным. Однако в способах лечения согласно изобретению,предназначенных для применения на человеке, предпочтительны гуманизированные формы антител с иммуноспецифичностью, соответствующей иммуноспецифичности антитела 266. Пример 1. Секвестрация добавленного пептида А в жидкостях человека. Образцы цереброспинальной жидкости (ЦСЖ) человека (50 мкл) и плазмы человека (50 мкл) инкубировали в течение 1 ч при комнатной температуре следующим образом: 1. отдельно; 2. вместе с 5 нг пептида А 40 или 3. 5 нг пептида А 40 плюс 1 мг моноклонального антитела 266 (описанного, например, в патенте США 5766846, включенном здесь в виде ссылки). Затем образцы подвергали электрофорезу в 4-25% неденатурирующем градиентном геле, т.е. градиентному электрофорезу в неденатурирующих условиях (NDGGE) и переносили на нитроцеллюлозу. Затем блоты красили Ponceau S или в случае вестерн-блота обрабатывали меченым биотином моноклональным антителом (3D6), которое направлено против первых пяти аминокислот пептида А, выявляли стрептавидином-пероксидазой хрена и регистрировали посредством усиленной хемилюминесценции(ECL). Диаметры гидратных оболочек материалов, находящихся в полосах на блотах, оценивали с использованием маркеров молекулярной массы Pharmacia. Таким образом, если пептид А связан с другими молекулами, он будет разгоняться в области размера полученного в результате комплекса. Вестерн-блоты ЦСЖ либо в присутствии, либо без 5 нг пептида А не выявили признаков пептида А при регистрации, опосредованной антителом 3D6. Сходные результаты были получены для плазмы человека. Полученный результат был достоверным, несмотря на тот факт, что пептид А можно было зарегистрировать посредством SDS-ПААГ с последующим вестерн-блотом, используя тот же самый способ и те же образцы ЦСЖ. Вероятно выявлению пептида А препятствуют взаимодействия между указанным пептидом и другими факторами в тестируемых жидкостях. Однако в том случае, когда к инкубационной смеси добавляют мАт 266, как в плазме, так и в ЦСЖ присутствуют характерные полосы, представляющие секвестрированный пептид А в комплексе с антителом. Основная полоса имеет диаметр гидратной оболочки, равный примерно 11 нм, соответствующий мономеру антитела, при этом дополнительная меньшая полоса находится в области диаметра 13 нм, соответствующего димеру антитела. Пример 2. Специфичность секвестрирующего антитела. Использовали образцы, содержащие 50 мкл ЦСЖ человека или 10 мкл ЦСЖ АРРV717F. АРРV717F являются трансгенными мышами, представляющими собой мышиную модель болезни Альцгеймера, у которых экспрессируется трансген белка-предшественника амилоида человека с наследственной мутацией болезни Альцгеймера, в результате чего происходит продукция пептида А человека в центральной нервной системе. Образцы инкубировали с различными мАт (1 мкг) в течение 1 ч при комнатной температуре и затем подвергали электрофорезу на 4-25% NDGGE и получали блоты на нитроцеллюлозе, как описано в примере 1. Использовали следующие антитела: мАт 266 (связывается с положениями 13-28); мАт 4G8 (связывается с положениями 17-24);QCBpan (кроличьи поликлональные для положений 1-40); мышиный IgG (не специфичный); мАт 3D6 (связывается с положениями 1-5); мАт 21F12 (связывается с положениями 33-42); мАт 6 Е 10 (связывается с положениями 1-17); иQCB40,42 (кроличьи поликлональные к А 40 и А 42). Выявление комплекса пептида А и антитела проводили как описано в примере 1 - меченое биотином 3D6 (к N-концу пептида А), после чего стрептавидин-HRP и ECL. В процессе сходного выявления в ЦСЖ человека, инкубированной с мАт 266,в некоторых случаях 3D6 заменяли QCB40,42, которое связывается с карбоксильным концом пептида А. Результаты показали, что из тестированных антител только мАт 4G8 и мАт 266 позволяют выявлять пептид А. Результаты показали, что в случае ЦСЖ человека только мАт 266 и мАт 4G8 обладали способностью секвестрировать заметные количества комплекса антитело-А (кроме того, в отсутствии какого- 14006606 либо антитела А не регистрировали). мАт 266 также было способно давать результаты на ЦСЖ человека, сходные с результатами, полученными для ЦСЖ трансгенных мышей АРРV717F. Пептид А можно было секвестрировать в ЦСЖ человека с использованием мАт 266 независимо от того, использовали ли для обработки вестерн-блота антитело 3D6, или QCB40,42. Пример 3. Демонстрация комплекса пептид А-266 двумерным электрофорезом. Образец, содержащий 50 нг пептида А 40, инкубировали с 2 мкг мАт 266 при 37 С в течение 3 ч. Соответствующую инкубацию одного мАт 266 использовали в качестве контроля. Затем образцы подвергали 2-мерному гель-электрофорезу. В первом направлении инкубированные образцы подвергали NDGGE, как описано в примере 1. Затем полиакриламидный гель разрезали на отдельные полосы перпендикулярно направлению первого направленного потока и проводили разделение в геле во втором направлении при денатурирующих/восстанавливающих условиях посредством электрофореза в SDS-ПААГ (гель с трицином и мочевиной). Наличие полос регистрировали либо окрашиванием Ponceau-S (любого белка), либо специфичной обработкой с использованием мАт 6 Е 10 (Senetek, Inc.) и биотинилированного антитела против мышиного А в системе регистрации на основе HRP. Окрашивание нитроцеллюлозных блотов Ponceau-S после переноса позволяло отдельно увидеть тяжелые и легкие цепи мАт 266. Было подтверждено, что пептид А был в комплексе с мАт 266, так как была видна полоса в области 4 кД, которая соответствует размеру полноразмерного мАт 266, видимого после NDGGE в первом направлении. Пример 4. Демонстрация неравнозначности связывания и секвестрации. Так как пептид А циркулирует в плазме и ЦСЖ, полагают, что он находится в комплексе с белками, включая аполипопротеид Е. Данный пример показывает, что антитела к ароЕ, хотя и способны связываться с комплексом, не секвестрируют ароЕ из остальной части комплекса. Комплексы ароЕ (500 нг) инкубировали с мАт или поликлональными антителами к ароЕ (2 мкг) при 37 С в течение 1 ч. Затем инкубированные образцы подвергали NDGGE, используя способ, описанный в примере 1. После NDGGE проводили вестерн-блоттинг с аффинно очищенными антителами козы против ароЕ с использованием регистрации ECL. В случае отсутствия антитела ароЕ можно выявить в области 8-13 нм, что согласуется с его присутствием в липопротеидных частицах. Наличие моноклональных или поликлональных антител к ароЕ приводит к сдвигу популяции ароЕ в сторону более крупных молекулярных форм, суперсдвиг. Это свидетельствует о том, что антитела к ароЕ не секвестрируют, т.е. не удаляют ароЕ из липопротеидной частицы, точнее они связываются с ароЕ на липопротеидах, образуя более крупные молекулярные формы. Пример 5. Секвестрация А не нарушается анти-ароЕ-антителами. Образец ЦСЖ человека объемом 100 мкл инкубировали либо с одним мАт 266, либо с поликлональным анти-ароЕ, либо с обоими антителами в течение 60 мин при 37 С. Затем образцы анализировали посредством NDGGE, как описано в примере 1, и регистрацию полос выполняли, как описано в примере 1. Результаты показывают, что тогда, когда к образцу добавлено мАт 266, видна полоса в области диаметра примерно 11 нм, характерная для секвестрированного комплекса 266-пептид А. Такое положение имеет место в любом случае, добавлено или не добавлено анти-ароЕ-антитело. Указанная полоса,демонстрирующая секвестрированный А, также появляется, если к инкубационной смеси добавляют 50 нг пептида А в присутствии мАт 266. Таким образом, изменение молекулярной массы ароЕ в присутствии анти-ароЕ-антител не препятствует секвестрации пептида А антителом мАт 266. Пример 6. Секвестрация пептида A in vivo. А. Трансгенные мыши АРРV717F, также называемые мышами PDAPP, сверхэкспрессируют мутантную форму белка АРР человека. Указанные мыши продуцируют А человека в ЦСЖ и имеют повышенные уровни пептида А человека, циркулирующего в ЦСЖ и плазме. Мышам восьмимесячного возраста внутривенно инъецировали физиологический раствор или 100 мкг мАт 266. У них брали кровь через 10 мин после начальной инъекции и еще раз через 20 ч после начальной инъекции. Образцы, содержащие 20 мкл плазмы от каждого животного, анализировали с помощью NDGGE и вестерн-блота с помощью антитела 3D6, как описано в примере 1. У животных, которым инъецировали физиологический раствор, не выявлено наличие полосы 11 нм, характерной для секвестрированного пептида А, ни через 10 мин, ни через 20 ч. Однако у двух животных, которым инъецировали мАт 266, выявили появление указанной полосы через 20 ч. В. В данном исследовании использовали мышей APPV717F двухмесячного возраста. В нулевой день мыши либо не получали мАт 266, либо получали 1 мг мАт 266 или 100 мкг указанного антитела. Образцы плазмы брали за два дня до введения антител и в 1, 3, 5 и 7 день. Образцы плазмы подвергалиNDGGE с последующим вестерн-блоттингом и регистрировали с использованием 3D6, как описано в примере 1. Во всех временных точках после введения мАт 266 регистрировали комплекс 266/А, если образец плазмы не был обработан белком G, который связывается с иммуноглобулином, таким образом эффективно удаляя мАт 266. Были обнаружены соответствующие уровни комплекса на протяжении тестированного периода времени за исключением небольшого снижения на седьмой день у животных, кото- 15006606 рым инъецировали 100 мкг мАт 266; в общем, уровни у животных, которым вводили по 100 мкг антитела, были соответственно ниже, чем уровни, обнаруженные у мышей, которым вводили 1 мг указанного антитела. С. Мышам АРРV717F двухмесячного возраста внутривенно вводили 1 мг мАт 266 и у каждой мыши брали образец плазмы объемом 25 мкл. Образец плазмы подвергали NDGGE с последующим вестернблоттингом, как описано выше, за исключением того, что после связывания с биотинилированным 3D6 проводили регистрацию со стрептавидином-125I (Amersham) и экспонировали с люминесцирующим экраном. Уровень комплекса оценивали в сравнении со стандартной кривой, для которой использовали известные количества А 40 в комплексе с насыщающими уровнями мАт 266, и выявляли сходство. Количество пептида A, связанного с мАт 266, оценили примерно на уровне 100 нг/мл, что представляет собой примерно 1000-кратное повышение, по сравнению с количеством эндогенного пептида А у этих мышей,которое, как было определено, равняется примерно 100 пг/мл. Указанный уровень также подобен уровню пептида А в головном мозге мышей АРРV717F до отложения Ар (50-100 нг/г); АРР человека и А человека у Тg-мышей АРРV717F продуцируются почти исключительно только в головном мозге. Таким образом,очевидно, что наличие мАт 266 в плазме действует как слив пептида А, способствующий общему оттоку пептида А из ЦНС в плазму. Такой повышенный общий отток, по-видимому, является результатом как повышенного оттока А из ЦНС в плазму, так и результатом предотвращения повторного перехода А из плазмы в головной мозг. Соответствующий размер секвестрированного пептида А подтвердили, разгоняя образцы плазмы объемом 20 мкл, полученные от мышей APPV717F через 24 ч после инъекции 1 мг мАт 266, в SDS-ПААГгелях с трис-трицином, с последующим вестерн-блоттингом с использованием анти-А-антитела 6 Е 10,до или после экспозиции с белком G с применением шариков, связанных с белком G. Полосу, которая уменьшалась в присутствии белка G, регистрировали в области 4-8 кД, что согласуется с наличием мономеров и возможно димеров пептида А.D. Мышей АРРV717F двухмесячного возраста внутрибрюшинно обрабатывали либо PBS (n=7), либо 500 мкг биотинилированного мАт 266, т.е. m266B (n=9). Перед инъекцией и через 24 ч после инъекции анализировали плазму в отношении суммарного пептида А, используя модификацию способа ELISA,предложенную Johnson-Wood, K., et al., Proc. Natl. Acad. Sci. USA (1997) 94: 1550-1555; и Bales, K.R., etal., Nature Genet (1997) 17: 263-264. Суммарный А, связанный с m266B, измеряли, используя 96 луночные планшеты Optiplates (Packard, Inc.), покрытые m3D6. Разбавленные образцы плазмы и стандарты (варьирующие концентрации А 40 и m266 В) инкубировали в течение ночи в покрытых планшетах, и количество комплекса суммарного А/m266 В определяли с использованием 125 Т-стрептавидина. Кроме того, во временной точке, равной 24 ч, образцы плазмы сначала обрабатывали белком G, чтобы количественно определить пептид А, не связанный с мАт 266, и Аобщ и A42 определяли в ЦСЖ методомELISA. У животных, которым инъецировали PBS, уровни пептида А в плазме составляли 140 пг/мл как до, так и после инъекции. Уровни в плазме до инъекции были сходными у мышей, которым инъецировали мАт 266, но уровни пептида А, не связанного с мАт 266, не регистрировались через 24 ч после инъекции. Также измеряли уровни в ЦСЖ, ЦСЖ представляет собой внеклеточный компартмент в пределах ЦНС, и концентрация молекул в ЦСЖ в некоторой степени отражает концентрацию веществ во внеклеточном пространстве головного мозга. ЦСЖ выделяли из компартмента cisterna magna (мостомозжечковой цистерны). Мышей анестезировали пентобарбиталом и удаляли мускулатуру от основания черепа до первого позвонка. ЦСЖ собирали путем осторожного пунктирования арахоидной мембраны, покрывающей цистерну, микроиглой под анатомическим микроскопом и отсасывали ЦСЖ в микропипетку из полипропилена. Через 24 ч после инъекции обнаружили повышение суммарного пептида А в ЦСЖ мышей, которым инъецировали мАт 266, и в ЦСЖ получили примерно двукратное увеличение А 42 по сравнению с мышами, которым инъецировали PBS. Это подтвердили, используя денатурирующий гельэлектрофорез с последующим вестерн-блоттингом со специфичным по отношению к А 42 антителом 21F12. В дополнительном эксперименте Тg-мышам APPV717F внутривенно инъецировали либо PBS, либо мАт 266, и в ЦСЖ оценивали уровни как А 40, так и А 42 следующим образом. Для измерения А 40 использовали моноклональное антитело m2G3, специфичное по отношению к А 40. Описанный способ ELISA (Johnson-Wood, K., et al., Proc. Natl. Acad. Sci. USA (1997) 94: 1550-1555) модифицировали в РИА заменой реагента стрептавидин-HRP на 125I-стрептавидин. Для образцов плазмы и ЦСЖ процедуру выполняли в неденатурирующих условиях, при которых в буферах отсутствовал гуанидин. Для оценки растворимого и нерастворимого в карбонатном буфере А в гомогенате головного мозга образцы гомогенизировали в 100 мМ карбонате, 40 мМ NaCl, pH 11,5 (4 С), центрифугировали при 10000 х g в течение 15 мин и А оценивали во фракциях надосадка (растворимый) и осадка (нерастворимый), как описано (Johnson-Wood, K., et al., Proc. Natl. Acad. Sci. USA (1997) 94: 1550-1555) и указано выше. Измерение комплекса А/мАт 266 в плазме выполняли модифицированным РИА. Мышам инъе- 16006606 цировали биотинилированное мАт 266 (мАт 266 В) и выделяли плазму в различных временных точках. Суммарный А, связанный с мАт 266, измеряли, используя 96-луночные планшеты Optiplates (Packard,Inc.), покрытые m3D6. Разбавленные образцы плазмы и стандарты (варьирующие концентрации А 40 и мАт 266 В) инкубировали в течение ночи в покрытых антителом планшетах, и количество комплекса суммарного А/мАт 266 В определяли с использованием 125I-стрептавидина. Через 3 ч после внутривенной инъекции мАт 266 имело место двукратное увеличение уровней А 40 в ЦСЖ и незначительное увеличение А 42. Однако как через 24 ч, так и через 72 ч имело место трехкратное увеличение уровней как А 40 так и А 42 в ЦСЖ. Сходные результаты получили с использованием анализа объединенной ЦСЖ в денатурирующем геле с последующим вестерн-блоттингом А. Отток А через тканевую жидкость головного мозга, на который в некоторой степени влияют уровни в ЦСЖ, по видимому является причиной наблюдаемого увеличения А в ЦСЖ. Важно, что изменения уровней А в ЦСЖ не может быть следствием перехода мАт в ЦСЖ, поскольку уровни, измеренные через 24 ч после инъекции, которые составляли менее 0,1% уровней мАт 266 в плазме, не достаточны для того, чтобы быть причиной изменений. Полученные результаты свидетельствуют о том, что в присутствии антитела в кровяном русле происходит отток пептида А из паренхимы головного мозга в ЦСЖ. Формы пептида А, которые являются растворимыми в PBS или карбонатном буфере, измеряли в гомогенатах коры головного мозга таких же мышей, которым инъецировали мАт 266 и у которых ЦСЖ анализировали так же, как описано выше. Наблюдали сходное увеличение количества указанных растворимых форм в гомогенатах коры головного мозга. Пример 7. мАт 266 действует как слив для пептида А in vitro. Сконструировали диализную камеру в качестве системы in vitro для того, чтобы проверить способность мАт 266 действовать как слив для пептида А. Один мл ЦСЖ человека помещали в верхнюю камеру полипропиленовой пробирки, отделенную диализной мембраной, которая специфично отсекает в пределах 10-100 кД, от нижней камеры, содержащей 75 мкл PBS в присутствии или без 1 мкг мАт 266. Очевидно, что равновесие было достигнуто через 3 ч, что определяли, подвергая материал в нижней камере электрофорезу в кислом геле с мочевиной с последующим вестерн-блоттингом для оценки пептида А с помощью 6 Е 10 в разных временных точках. Образцы денатурировали в муравьиной кислоте в конечной концентрации 80% (об./об.) и восстанавливали -меркаптоэтанолом (1%). Образцы подвергали электрофорезу (от анода к катоду) в рабочем буфере, содержащем 0,9 М уксусную кислоту, в градиенте от 4 до 35% полиакриламидного геля, содержащего 6 М мочевину, 5% (об./об.) ледяной уксусной кислоты и 2,5% TEMED. Кислое значение рН геля нейтрализовали перед переносом на нитроцеллюлозу. Затем использовали стандартный способ вестерн-блоттинга для того, чтобы идентифицировать А. Выявленные полосы соответствовали 4 кД. Таким образом, количество А, извлеченного из верхней камеры, определяли с помощью анализаELISA как в верхней, так и в нижней камерах (n=4) через 3 ч. Результаты в случае различных отсечений по молекулярной массе в присутствии и в отсутствии мАт 266 показаны на фиг. 1. Как видно, в то время как только минимальные количества пептида А проходят через мембрану в том случае, когда в нижнюю камеру помещали PBS, 50% пептида А было секвестрировано в нижней камере в том случае, когда присутствовало мАт 266 и отсечение по молекулярной массе составляло 25 кД; мембрану пересекали возрастающие количества по мере того, как отсечение по молекулярной массе увеличивалось до 100 кД,когда почти 100% пептида А перемещалось через мембрану. Также обнаружили, что антитела против N-конца А, 3D6 и 10D5, обладали способностью перемещать пептид А через мембрану в данной системе, однако, не были способны секвестрировать пептид А в анализах, описанных в примере 1. Полученные результаты свидетельствуют, что антитела к пептиду А имеют достаточное сродство при указанных условиях для того, чтобы в физиологических растворах секвестрировать пептид от других, связывающих белков, но что мАт, такие как 266, которые иммунореактивны по отношению к эпитопу в положениях 13-28, существенно более эффективны и связываются с большей аффинностью. В сходных исследованиях ароЕ 4, секретируемый астроцитами, который очищали, как описано DeMattos, R.В., et al., J. Biol. Chem. (1998) 273: 4206-4212; Sun, Y., et al., J. Neurosci. (1998) 18: 3261-3272,оказывал небольшое, но статистически значимое влияние на увеличение массы пептида А в нижней камере. Не наблюдали заметного влияния в том случае, когда мАт 266 заменяли поликлональным IgG или БСА. Пример 8. Отток пептида А из ЦНС в плазму. А. Один мкг А 40 растворяли в 5 мкл ЦСЖ крыс, чтобы сохранить его в растворимой форме, и затем инъецировали в субарахноидное пространство cisterna magna мышей Swiss-Webster дикого типа, которые предварительно получали в/в инъекции либо PBS (n=3), либо 200 мкг биотинилированного мАт 266 (n=3). В разных временных точках после обработки определяли Аобщ в плазме мышей посредством анализа А методом ELISA, используя 3D6 в качестве покрывающего антитела и стандарты А, смешан- 17006606 ные с избытком биотинилированного 266. В каждый образец плазмы после извлечения из каждого животного для выявления А методом ELISA впрыскивали избыток биотинилированного 266. У мышей,которым инъецировали PBS, регистрировали мало различимые количества пептида на уровне 15 нг/мл в виде пиковых значений через 30-60 мин, после которых уровни становились, по существу, нулевыми. Однако у мышей, которым вводили мАт 266, количество пептида А в плазме через 60 мин достигало уровней в 330 раз более высоких, чем уровни, регистрируемые у мышей, которым инъецировали PBS(примерно 50 нг/мл), и достигали значений примерно 90 нг/мл через 180 мин. В. Указанную процедуру повторяли с использованием 200 мкг (n=3) или 600 мкг (n=3), инъецированных в/в мышам АРРV717F двухмесячного возраста. мАт 266 в/в инъецировали мышам АРРV717F +/+ 3 месячного возраста в указанных выше дозах. Перед в/в инъекцией и в разные временные точки после инъекции методом РИА в плазме определяли концентрацию А, связанного мАт 266. Подробные результаты, полученные от одной показательной мыши, показаны на фиг. 2. Обнаружено, что концентрация А, связанного с моноклональным антителом мАт 266, возрастала от исходных уровней в 150 пг/мл до уровней более 100 нг/мл на четвертый день. Путем анализа ранних временных точек на кривой было определено, что суммарная скорость поступления Аобщ в плазму Тgмышей APPV717F в присутствии насыщающих уровней антитела составляла 42 пг/мл/мин. Влияние мАт 266 на уровни А в плазме как мышей дикого типа, так и Тg-мышей АРРV717F, а также влияние антитела на концентрацию А в ЦСЖ свидетельствует о том, что присутствие циркулирующего мАт 266 приводит к изменению в равновесии потока или транспорта А между ЦНС и плазмой. Пример 9. мАт 266 влияет на А в головном мозге. Мышей АРРV717F +/+ четырехмесячного возраста обрабатывали каждые 2 недели в течение 5 месяцев в/б инъекциями физиологического раствора, мАт 266 (500 мкг) или контрольного мышиного IgG(100 мкг, Pharmigen). Мышей забивали в девятимесячном возрасте и определяли отложения А в коре головного мозга. Рассчитывали процент площади, покрытой А-иммунореактивным материалом, который идентифицировали с помощью кроличьего пан-А-антитела (QCB, Inc.), в коре головного мозга,расположенной непосредственно над дорсальным гиппокампом, как описано Holtzman, D.M., et al., Ann.Neurol. (2000) 97: 2892-2897. Результаты показаны на фиг. 3 А. В этом возрасте примерно у половины мышей в каждой группе еще не начинали развиваться отложения А. Однако процент мышей с накоплением 50% А в коре головного мозга был значительно ниже (р=0,02, тест хи-квадрат) в группе мышей,обработанных 266. Хотя у мышей АРРV717F к девяти месяцам могут формироваться большие количества отложений А, имеет место высокая изменчивость, при этом у 50% мышей не проявляются отложения и примерно у 50% выявляются значительные отложения. У мышей, обработанных PBS и IgG, 6/14 и 5/13 мышей более 50% коры головного мозга было покрыто А, выявляемом при окрашивании, тогда как только у одной из 14 мышей, обработанных мАт 266 был такой уровень окрашивания. Почти у 50% животных во всех группах к 9-месячному возрасту еще не развивалось отложение А. Последнее, повидимому, является следствием происхождения отдельных животных в используемой авторами группе от разных родителей, так как даже несмотря на то, что было подтверждено, что все исследуемые мыши являлись АРРV717F+/+, высокие уровни отложения А наблюдали только у мышей полученных от 4/8 скрещиваемых пар (потомство с высокой степенью патологии). Мыши, полученные от 4 других скрещиваемых пар, практически не имели отложений А (потомство с низкой степенью патологии). Используя происхождение от разных родителей как ковариату, показано строгое значительное влияние m266 на уменьшение отложения А (р=0,0082, фиг. 3 В). Пример 10. Периферически инъецированное мАт 266 не связывается с бляшками у Тg-мышейAPPV717F. Чтобы определить, связывалось ли мАт 266, инъецированное в/б на протяжении 5 месяцев, с А в головном мозге, использовали срезы головного мозга Тg-мышей APPV717F+/+ 9-месячного возраста, которые содержали отложения А и были обработаны либо мАт 266, физиологическим раствором, либо контрольным IgG. Обработку тканей и иммуноокрашивание выполняли, как описано (Bales, K.R., et al., Nature Genet. (1997) 17: 263-264). Ткани всех групп животных инкубировали с меченым флуоресцеином антителом против IgG мыши (Vector, Inc.), и затем исследовали под флуоресцентным микроскопом. Ни в одной из групп не было видно специфичного окрашивания отложений А. Напротив, в том случае, когда на срезах до инкубации срезов с антителом против IgG мыши использовали мАт 266, четко выявляли отложения А. Пример 11. Влияние введения антитела 266 на познавательную способность трансгенных гемизиготных мышей PDAPP 24-месячного возраста. Использовали шестнадцать гемизиготных трансгенных мышей (АРРV717F). В начале исследования возраст мышей составлял примерно 24 месяца. Все инъекции были внутрибрюшинными (в/б). Половина мышей получала еженедельные инъекции фосфатно-солевого буфера (PBS, контроль), а другая половина получала 500 мкг мышиного антитела 266, растворенного в PBS. Инъекции проводили на протяжении периода времени, равного семи неделям (42 дня), всего 6 инъекций. Через три дня после последней- 18006606 инъекции оценивали поведение, используя задание по распознаванию объектов, в основном как описано в J.-C. Dodart, et al., Behavioral Neuroscience, 113 (5) 982-990 (1999). Рассчитывали индекс распознавания(ТB100)/(ТB-ТД). Результаты показаны ниже в табл. 1. Таблица 1 Описательная статистика индекса распознавания Индекс распознавания (минуты) Еженедельное введение гемизиготным трансгенным мышам 24-месячного возраста 500 мкг антитела 266 было связано со значительным изменением в поведении. Трансгенные мыши, обработанные антителом, имели индексы распознавания, которые были сходны с индексами контрольных животных дикого типа [J.-C. Dodart, et al.]. Отличие в индексе распознавания было статически значимым при уровне вероятности 0,001. Увеличенный индекс распознавания является свидетельством того, что обработка антителом, которое связывается с пептидом бета-амилоида в области аминокислот 13-28, будет отменять нарушения в поведении, которые были документально подтверждены в данной модели болезни Альцгеймера на мышах. Поэтому введением антител, которые связывают пептид бета-амилоида в области аминокислот 13-28, можно будет лечить такие заболевания, как болезнь Альцгеймера и синдром Дауна, и останавливать снижение познавательной способности, обычно связанное с прогрессированием заболевания. Количественно оценивали накопление амилоида (процент площади, покрытой иммунореактивным материалом после окрашивания анти-А-антителами 3D6 или 21F12) в коре головного мозга, непосредственно расположенной над гиппокампом, включая площади поясной извилины и теменной области коры головного мозга животных 24-месячного возраста, обработанных мышиным антителом 266 в течение семи недель, как описано выше. Результаты представлены в таблице ниже. Отличия между обрабатываемыми группами не являются статистически значимыми. Таблица 2 Накопление амилоидных бляшек у мышей APPV717F+/+ после обработки мышиным анти-А-антителом 266 Для этих очень старых животных обработка мышиным антителом 266 не приводила к значительному отличию в накоплении амилоида по сравнению с группой, обработанной PBS, которое измеряли либо с использованием 3D6, либо с использованием 21F12. Кроме того, накопление А было значительно выше и значимо увеличенным по сравнению с накоплением амилоида у более молодых животных (см. далее), которые не обладали способностью отличать новый объект от знакомого объекта в задании распознавания объектов. Наиболее неожиданным является то, что представленные результаты свидетельствуют, что анти-А-антитела могут отменять нарушение познавательной способности без необходимости уменьшать накопление амилоида как такового. После 7 недель обработки индекс распознавания в группе, обработанной m266, не значимо отличался от индекса, который ожидался для группы мышей 24-месячного возраста дикого типа. Это свидетельствует о полной отмене снижения познавательной способности у исследованных трансгенных мышей. Пример 12. Влияние введение антитела 266 на познавательную способность молодых трансгенных гемизиготных мышей PDAPP. Использовали пятьдесят четыре (54) гомозиготных трансгенных мыши (АРРV717F). Двадцать три(23) мыши в начале исследования имели возраст, примерно равный двум месяцам. Остальные мыши в начале исследования были примерно четырехмесячного возраста. Продолжительность обработки составляла пять месяцев. Таким образом, к концу исследования мыши были примерно семимесячного (7) возраста или примерно девятимесячного (9) возраста.- 19006606 Все инъекции были внутрибрюшинными (в/б). Каждая мышь в контрольных группах PBS еженедельно получала инъекцию фосфатно-солевого буфера (PBS; 200 мкл). Каждая мышь в контрольных группах IgG еженедельно получала инъекцию контрольного антитела изотипа IgG1K1 (100 мкг/мышь/неделю). Каждая мышь в группах высокая доза еженедельно получала инъекцию 500 мкг антитела 266, растворенного в PBS (ВД). Каждая мышь в группе низкая доза еженедельно получала 100 мкг антитела 266, растворенного в PBS (НД). Через три дня после последней инъекции оценивали поведение животных, используя задание распознавания объектов, как описано в примере 10 выше, и индекс распознавания рассчитывали как различие между временем, потраченным на новый объект, и временем, потраченным на знакомый объект. Результаты показаны ниже в табл. 3. Данные сгруппированы по возрасту мышей в конце исследования. Таблица 3 Описательная статистика индекса распознавания Вместе взятые представленные данные подтверждают вывод о том, что введение антитела 266, антитела, направленного против центрального домена А, ослабляет отложение бляшек у трансгенных мышей APPV717F 7-9-месячного возраста, а также приводит к реверсии нарушений поведения, охарактеризованных ранее. Лечение пациентов антителом, направленным против центрального домена пептида А будет ингибировать или предотвращать снижение познавательной способности обычно связанное с прогрессированием заболевания, и будет его отменять. Индекс распознавания для обработанных животных значимо не отличался от индекса, который ожидался для мышей дикого типа такого же возраста. Таким образом, точно так же, как и у старых животных (пример 11), обработка m266 приводила к полной реверсии снижения познавательной способности у исследованных молодых трансгенных животных. Пример 13. Синтез гуманизированного антитела 266. Клетки и антитела. Линию клеток миеломы мышей Sp2/0 получали из АТСС (Manassas, VA) и поддерживали в среде DME, содержащей 10% FBS (катал.SH32661.03, HyClone, Logan, UT) при 37 С в СО 2-инкубаторе. Клетки гибридомы мышей 266 сначала выращивали в среде RPMI-1640, содержащей 10% FBS (HyClone), 10 мМ HEPES, 2 мМ глутамина, 0,1 мМ несущественных аминокислот, 1 мМ пирувата натрия, 25 мкг/мл гентамицина, и затем наращивали в бессывороточной среде (Hybridoma SFM, катал.12045-076, Life Technologies, Rockville, MD), содержащей 2% FBS с низким содержанием Ig (катал.30151.03, HyClone) до объема, равного 2,5 л в роллерных флаконах. Мышиное моноклональное антитело 266 (Mu266) очищали из надосадка культуры аффинной хроматографией, используя колонку с белок-G-сефарозой. Биотинилированное Mu266 получали, используя биотин EZ-Link Sulfo-NHS-LC-LCBiotin (катал.21338ZZ, Pierce, Rockford, IL). Клонирование кДНК вариабельных областей. Суммарную РНК экстрагировали примерно из 107 клеток гибридомы, используя реагент TRIzol (Life Technologies), и пoли(A)+-PHK выделяли с помощью системы выделения мРНК PolyATract (Promega, Madison, WI), согласно протоколам поставщика. Двунитевую кДНК синтезировали с использованием набора для амплификации кДНК SMART RACE (Clontech, Palo Alto, CA), следуя протоколу поставщика. кДНК вариабельной области для легкой и тяжелой цепей амплифицировали посредством полимеразной цепной реакции (ПЦР), используя 3'-праймеры, которые специфично отжигаются с константными областями каппа- и гамма-цепи мышей, и универсальный 5'-праймер, поставляемый в наборе для амплификации кДНК SMARTRACE. Для ПЦР VL 3'праймер имел последовательность с остатками 17-50, гибридизующимися с СН 1 гамма-цепи мыши. кДНК VL и VH субклонировали в векторе pCR4Blunt-TOPO (Invitrogen, Carlsbad, CA) для определения последовательности. Секвенирование ДНК выполняли посредством реакций секвенирования в цикле ПЦР с флуоресцентными дидезоксинуклеотидными терминаторами цепи (Applied Biosystems, Foster City, CA) в соответствии с инструкцией производителя. Реакции секвенирования анализировали на секвенаторе ДНК модели 377 (Applied Biosystems). Конструирование вариабельных областей гуманизированного 266 (Hu266). Гуманизацию Vобластей антитела мыши выполняли как описано Queen et al. [Proc. Natl. Acad. Sci. USA 86: 10029-10033(1988)]. Каркас V-области человека, использованный в качестве акцептора для CDR Mu266, выбирали на основании гомологии последовательностей. Использовали компьютерные программы ABMOD и ENCAD[Levitt, M., J. Mol. Biol. 168: 595-620 (1983)] для того, чтобы сконструировать молекулярную модель вариабельных областей. Аминокислоты в гуманизированных V-областях, которые согласно расчетам контактируют с CDR, заменяли соответствующими остатками Mu266. Это было проведено для остатков 46,47, 49 и 98 тяжелой цепи и остатка 51 в легкой цепи. Обнаруженные необычные для подгруппы таких жеV-областей аминокислоты в гуманизированной V-области заменяли на консенсусные аминокислоты,чтобы исключить возможную иммуногенность. Это было проведено для остатков 42 и 44 в легкой цепи. Конструировали и амплифицировали гены вариабельных областей легкой и тяжелой цепи, используя восемь перекрывающихся синтетических олигонуклеотидов, занимающих в длину примерно от 65 до 80 оснований [Не, X.Y., et al., J. Immunol. 160: 029-1035 (1998)]. Олигонуклеотиды отжигали попарно и элонгировали фрагментом Кленова ДНК-полимеразы I, получая двунитевые фрагменты. Полученные в результате фрагменты денатурировали, отжигали попарно и элонгировали фрагментом Кленова, получая два фрагмента. Полученные фрагменты денатурировали, отжигали попарно и снова элонгировали, получая полноразмерный ген. Полученный в результате продукт амплифицировали в ПЦР, используя систему ПЦР повышенной точности (Roche Molecular Biochemicals, Indianapolis, IN). ПЦР-амплифицированные фрагменты очищали в геле и клонировали в векторе pCR4Blunt-TOPO. После подтверждения последовательности гены VL и VH расщепляли MIuI и XbaI, очищали в геле и субклонировали соответственно в двух векторах для экспрессии легкой и тяжелой цепей, получая pVk-Hu266 и pVg1-Hu266 (см. фиг. 6 и 7 соответственно в данной заявке) [Со, М.S., et al., J. Immunol. 148: 1149-1154 (1992)]. Зрелое гуманизированное антитело 266, экспрессированное полученными плазмидами, имело легкую цепь SEQ ID NO: 11 и тяжелую цепь SEQ ID NO: 12. Стабильная трансфекция. Стабильную трансфекцию линии клеток миеломы мышей Sp2/0 проводили электропорацией, используя прибор Gene Pulser (BioRad, Hercules, CA) при 360 в и 25 мкФ, как описано (Со et al., 1992). Перед трансфекцией ДНК плазмид pVk-Hu266 и pVgl-Hu266 переводили в линейную форму с использованием FspI. Примерно 107 клеток Sp2/0 трансфицировали 20 мкг pVk-Hu266 и 40 мкг pVgl-Hu266. Трансфицированные клетки суспендировали в среде DME, содержащей 10% FBS и высевали в несколько 96-луночных планшетов. Через 48 ч вносили селективную среду (среда DME, содержащая 10% FBS, добавку к средам НТ, 0,3 мг/мл ксантина и 1 мкг/мл микофенольной кислоты). Примерно через 10 дней после начала селекции исследовали надосадки культур в отношении продукции антитела посредством ELISA, как показано ниже. Высокопродуктивные клоны размножали в среде DME, содержащей 10% FBS, и далее анализировали экспрессию антитела. Затем отобранные клоны адаптировали к росту в среде SFM для гибридом. Измерение экспрессии антитела методом ELISA. Лунки 96-луночного планшета для ELISA (планшет Nunc-Immuno, катал.439454, NalgeNunc, Naperville, IL) в течение ночи при 4 С покрывали 100 мкл поликлональных антител козы против IgG человека, специфичных по отношению к фрагменту Fcy, в концентрации 1 мкг/мл (катал.109-005-098, Jackson ImmunoResearch, West Grove, PA) в 0,2 М буфере на основе карбоната-бикарбоната натрия (рН 9,4). После промывки промывочным буфером (PBS, содержащий 0,1% твин 20) лунки блокировали 400 мкл блокирующего буфера Superblock (катал.37535,Pierce) в течение 30 мин, и затем промывали промывочным буфером. Образцы, содержащие Hu266, соответствующим образом разбавляли в буфере для ELISA (PBS, содержащий 1% БСА и 0,1% твин 20) и вносили в планшеты для ELISA (100 мкл на лунку). В качестве стандарта использовали гуманизированное анти-СD33 IgG1 моноклональное антитело НuМ 195 (Со, et al., 1992, выше). Планшеты для ELISA инкубировали в течение 2 ч при комнатной температуре, и лунки промывали промывочным буфером. Затем в каждую лунку вносили 100 мкл конъюгированных с HRP поликлональных антител козы против цепи каппа человека (катал.1050-05, Southern Biotechnology, Birmingham, AL), разведенных 1/1000 в- 21006606 буфере для ELISA. После инкубации в течение 1 ч при комнатной температуре и промывки промывочным буфером в каждую лунку добавляли 100 мкл субстрата ABTS (катал.507602 и 506502,Kirkegaard and Perry Laboratories, Gaithersburg, MD). Развитие окраски останавливали добавлением 100 мкл 2% щавелевой кислоты на лунку. Оптическую плотность регистрировали при 415 нм в устройстве для считывания микропланшетов OPTImax (Molecular Devices, Menlo Park, CA). Очистка Hu266. Один из стабильных трансфектантов Sp2/0 с высокой экспрессией Hu266 (клон 1D9) адаптировали к росту на Hybridoma SFM и размножали до объема, равного 2 л в роллерных флаконах. Истощенный надосадок культуры собирали, когда жизнеспособность клеток достигала 10% или была ниже, и загружали в колонку с белок-А-сефарозой. Колонку промывали PBS перед тем, как элюировать антитело 0,1 М глицином-НСl (рН 2,5), 0,1 М NaCl. Элюированный белок диализовали против 3 смен по 2 л PBS и фильтровали сквозь фильтр с диаметром пор 0,2 мкм, после чего хранили при 4 С. Концентрацию антител определяли измерением оптической плотности при 280 нм (1 мг/мл = 1,4 A280).SDS-ПААГ в трис-глициновом буфере выполняли в соответствии со стандартными процедурами в 4-20% градиентном геле (катал.ЕС 6025, Novex, San Diego, CA). Очищенное гуманизированное антитело 266 восстанавливали и разгоняли в SDS-ПААГ-геле. В случае полного антитела были видны две полосы с примерными молекулярными массами 25 и 50 кД. Полученные результаты согласуются с молекулярными массами легкой цепи и тяжелой цепи или фрагмента тяжелой цепи, рассчитанной на основании состава аминокислот. Пример 14. Связывающие свойства гуманизированного антитела 266 in vitro. Эффективность связывания гуманизированного антитела 266, синтезированного и очищенного как описано выше, сравнивали с мышиным антителом 266, используя биотинилированное мышиное антитело 266 в сравнительном ELISA. Лунки 96-луночного планшета для ELISA (планшет Nunc-Immuno, катал.439454, NalgeNunc) покрывали 100 мкл пептида -амилоида (1-42), конъюгированного с БСА, в 0,2 М буфере на основе карбоната/бикарбоната натрия (рН 9,4) (10 мкг/мл) в течение ночи при 4 С. КонъюгатA1-42-БCA готовили растворением 7,5 мг A1-42-Cys43 (A1-42 с С-концевым цистеином, AnaSpec) в 500 мкл диметилсульфоксида и затем немедленным добавлением 1500 мкг дистиллированной воды. Два (2) мг активированного малеимидом бычьего сывороточного альбумина (Pierce) растворяли в 200 мкл дистиллированной воды. Два раствора объединяли, тщательно перемешивали и оставляли при комнатной температуре на два (2) часа. Гель-хроматографическую колонку использовали для отделения не прореагировавшего пептида от конъюгата A1-42-Cys-БСА. После промывки лунок фосфатно-солевым буфером (PBS), содержащим 0,1% твина 20 (промывочный буфер), с использованием устройства для промывки планшетов ELISA лунки блокировали добавлением 300 мкл реагента SuperBlock (Pierce) на лунку. После 30-минутного блокирования лунки промывали промывочным буфером и удаляли избыток жидкости. Смесь биотинилированного Мu266 (конечная концентрация 0,3 мкг/мл) и конкурентного антитела(Мu266 или Нu266; начиная с конечной концентрации 750 мкг/мл и делая серийные 3-кратные разведения) в буфере для ELISA добавляли в трех повторах в конечном объеме 100 мкл на лунку. В качестве неконкурентного контрольного антитела добавляли 100 мкл биотинилированного Mu266, имеющего концентрацию 0,3 мкг/мл. В качестве фонового контроля добавляли 100 мкл ELISA-буфера. Планшет дляELISA инкубировали при комнатной температуре в течение 90 мин. После промывки лунок промывочным буфером в каждую лунку добавляли 100 мкл конъюгированного с HRP стрептавидина в концентрации 1 мкг/мл (катал.21124, Pierce). Планшет инкубировали при комнатной температуре в течение 30 мин и промывали промывочным буфером. Для развития окраски добавляли 100 мкл/лунку субстрата пероксидазы ABTS (Kirkegaard and Perry Laboratories). Развитие окраски останавливали добавлением 100 мкл/лунку 2% щавелевой кислоты. Оптическую плотность регистрировали при 415 нм. Значения оптической плотности наносили против log концентрации конкурента, кривые подгоняли к нанесенным точкам данных (используя Prism) и для каждого антитела определяли IC50, используя способы, хорошо известные в данной области. Среднее значение IC50 для мышиного 266 составляло 4,7 мкг/мл (три отдельных эксперимента,стандартное отклонение = 1,3 мкг/мл) и для гуманизированного 266 составляло 7,5 мкг/мл (три отдельных эксперимента, стандартное отклонение = 1,1 мкг/мл). Вторую серию из трех экспериментов выполняли в основном как описано выше, и определили среднее значение IC50 для мышиного 266, равное 3,87 мкг/мл (SD = 0,12 мкг/мл), и определили IC50 для 266 человека, равную 4,0 мкг/мл (SD = 0,5 мкг/мл). На основе полученных результатов авторы сделали вывод, что гуманизированное антитело 266 обладает связывающими свойствами, которые очень сходны со свойствами мышиного антитела 266. Поэтому авторы предполагают, что гуманизированное антитело 266 обладает очень похожими активностями in vitro и in vivo при сравнении с мышиным 266 и будет оказывать у людей такое же влияние, которое выявлено с мышиным 266 у мышей. Пример 15. Связывающие свойства мышиных антител 266 и 4G8 in vitro. Аффинность антител (KD = Kd/Ka) определяли, используя биосенсор 2000 BIAcore, и данные анализировали с помощью компьютерной программы BIAevaluation (v. 3.1). Улавливающие антитела (кро- 22006606 личьи антимышиные антитела) связывали посредством аминогрупп с карбоксильными группами на проточной ячейке 2 биосенсорного чипа (СМ 5), используя N-этил-N-диметиламинопропилкарбодиимид и Nгидроксисукцинимид (EDC/NHS). Неспецифичный IgG кролика связывали с проточной ячейкой 1 в качестве фонового контроля. Улавливали моноклональные антитела, получая 300 резонансных единиц (RU). Затем через чип пропускали поток амилоида-бета 1-40 или 1-42 (Biosource International, Inc.) в понижающихся концентрациях (от 1000- до 0,1-кратной KD). Для регенерации чипа связанное анти-А-антитело элюировали с чипа, используя промывку глицином-НСl (рН 2). Контрольная инъекция, не содержащая амилоида-бета, служила в качестве контроля для вычитания фона. Анализировали сенсорограммы, демонстрирующие фазы ассоциации и диссоциации, чтобы определить Kd и Kа. Используя указанный способ было найдено, что аффинность мышиного антитела 266 как для A1-40, так и для A1-42 составляла 4 пМ. Аффинность 4G8 для A1-40 составляла 23 нМ, а для A1-42 - 24 нМ. Несмотря на 6000-кратное различие в аффинностях в отношении А антитела 266 и 4G8, которые связываются с эпитопами между аминокислотами А 13 и 28, эффективно секвестрируют А из ЦСЖ человека. Поэтому положение эпитопа является более важным, чем аффинность связывания в определении способности антитела секвестрировать А и обеспечивать целебное действие и неожиданные преимущества данного изобретения. Пример 16. Картирование эпитопа мышиного антитела 266 с использованием методики BiAcore и растворимых пептидов.BIAcore представляет собой автоматическую биосенсорную систему для измерения молекулярных взаимодействий [Karlsson R., et al. J. Immunol. Methods 145: 229-240 (1991)]. Преимущество BIAcore над другими анализами связывания состоит в том, что связывание антигена можно измерить без необходимости метить или иммобилизовать антиген (т.е. антиген сохраняет более нативную конформацию). Методику BIAcore использовали для того, чтобы оценить связывание различных фрагментов пептида амилоида-бета с мышиным антителом 266, в основном как описано выше в примере 12, за исключением того, что все разведения делали в физиологическом растворе, забуференном HEPES, содержащем твин 20,инъецировали множество фрагментов AD (BioSource International), причем инъецировали одну концентрацию каждого фрагмента (440 нМ). Фрагменты амилоида-бета 1-28, 12-28, 17-28 и 16-25 связывались с мышиным антителом 266, тогда как фрагменты А 1-20, 10-20 и 22-35 не связывались. Фрагменты 1-20, 10-20 и 22-35 связывались с другими мАт с известной эпитопной специфичностью в отношении указанных областей А. Используя данную методику установлено, что связывающийся эпитоп для мышиного антитела 266, по-видимому, расположен между аминокислотами А 17 и 25. Поскольку связывание обычно происходит по меньшей мере 3 остатками данного эпитопа, можно далее сделать вывод, что эпитоп находится в пределах остатков 19-23. Пример 17. Связывающие свойства гуманизированного антитела 266 in vitro. Аффинность (KD = Kd/Ka) гуманизированного антитела 266, синтезированного и очищенного как описано выше, определяли в основном как описано выше в примере 15. Используя данный способ нашли, что аффинность гуманизированного 266 по отношению к A1-42 составляет 4 пМ.
МПК / Метки
МПК: A61P 25/28, C07K 16/18, A61K 39/00, C12N 15/13, C12N 5/10
Метки: фрагмент, beta-амилоидным, пептидом, способы, применения, антитело, гуманизированное, взаимодействующие
Код ссылки
<a href="https://eas.patents.su/30-6606-gumanizirovannoe-antitelo-i-ego-fragment-vzaimodejjstvuyushhie-s-beta-amiloidnym-peptidom-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Гуманизированное антитело и его фрагмент, взаимодействующие с бета-амилоидным пептидом, и способы их применения</a>
Предыдущий патент: Способ очистки рекомбинантного чхг
Следующий патент: Замещенные 8-арилхинолины в качестве ингибиторов фосфодиэстеразы-4
Случайный патент: Машина для приготовления горячих напитков, в частности, супов


































