Соединения, оказывающие влияние на системы, связанные с серотонином
Номер патента: 620
Опубликовано: 29.12.1999
Авторы: Аудиа Джеймс Э., Ниссен Джеффри С., Крушински Джозеф Х., Хибшман Дэвид Дж., Мабри Томас Э., Шаус Джон М., Томпсон Деннис Ч., Вонг Дэвид Т., Расмуссен Курт, Рокко Винсент П.
Формула / Реферат
1. Соединение формулы
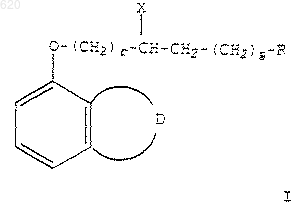
где r представляет 0-4;
s представляет 0-1;
D представляет остаток, который вместе с углеродными атомами, к которым он присоединен, образует пирролильную, имидазолильную, пиразинильную, пиридазинильную или пиримидинильную группу;
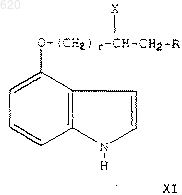
где Х представляет фенил, гидрокси или метокси;
при условии, что Х представляет фенил, когда r=0;
R представляет

пунктирная линия представляет необязательную двойную связь;
R1 представляет пиперидинил, пиперазино, морфолино или пирролил, замещенный 0-1 фенильной или бензильной группой или 0-4 C1-С3 алкильными, С1-С3 алкокси- или галогруппами;
причем фенильная или бензильная группа является замещенной 0-2 С1-С3 алкильными, гало-, трифторметильными или С1-С3 алкоксигруппами;
или R1 представляет
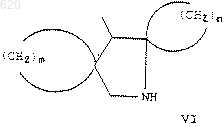
n и m независимо представляют 4-5, причем группа формулы VI может быть замещенной 0-1 оксогруппой и 0-2 С1-С3 алкильными, С1-С3 алкокси- или галогруппами;
или R1 представляет C1-С4 алкил, замещенный пирролилом, фурилом, тиенилом, пиридинилом, морфолинилом, пиперидинилом, тетрагидропирролилом, пиперазинилом, тетрагидрофурилом, бензазепинилом, дибензазепинилом или хинолинилом, замещенным 0-4 С1-С3 алкильными, С1-С3 алкокси- или галогруппами;
R2 представляет гидрокси, водород, циано, C1-С4 алкил или фенил или бензил, замещенный 0-2 С1-С3 алкильными, С1-С3 алкокси- или галогруппами;
или R2 представляет амино, замещенный фенилом или бензилом, замещенным 0-2 С1-С3 алкильными, С1-С3 алкокси-, гало- или трифторметильными группами;
или R2 отсутствует, когда пунктирная линия означает двойную связь;
R3 представляет С1-С4 алкил, замещенный 0-2 фенильными группами, замещенными 0-2 С1-C3 алкильными, С1-С3 алкокси- или галогруппами;
или R3 представляет С1-C4 алкил, замещенный гидроксиимино или гидрокси;
или R3 представляет фенокси, замещенный 0-1 метилендиокси или 0-2 C1-C3 алкильными, C1-C3 алкокси-, трифторметильными или галогруппами;
или R3 представляет дибензоциклогептенил, бензодиоксолил, бензодиоксинил или дибензоциклогексенил;
или R3 представляет фенил, нафтил, тетралинил, тетразолил, бензимидазолил, индолил, бензофурил, бензотиенил, пиперидино или морфолино, замещенный 0-2 С1-С3 алкильными, C1-C3 алкокси-, С4-С8 циклоалкилалкокси-, гало-, нитро-, трифторметильными, дифторметильными, гидрокси- или трифторметоксигруппами;
или замещенный 0-1 фенильной, пиперидинонильной, гексагидропиридазинонильной или пиперазинонильной группой, замещенной 0-2 С1-С3 алкильными, оксо-, C1-C3 алкокси-, гало- или трифторметильными группами;
при условии, что R3 не является галоген- или трифторметилзамещенным фенилом, когда R2 представляет гидрокси;
или R2 и R3 вместе образуют С1-С4 алкилиден, замещенный 0-2 фенильными группами, замещенными 0-2 С1-С3 алкильными, С1-С3 алкокси-, гало- или трифторметильными группами;
R5 представляет С1-C6 алкил или С1-С4 ацил;
или R5 представляет С1-С3 алкил, замещенный бензодиоксинилом или бензодиоксолилом, замещенным в фенильном кольце 0-2 С1-С3 алкильными, С1-С3 алкокси- или галогруппами;
или R5 представляет пиридинил, пиримидинил, индолил, бензофурил, бензотиенил, пиразинил, хинолинил, изохинолинил, пиридазинил или хиназолинил, замещенный 0-2 С1-С3 алкильными, трифторметильными, С1-С3 алкокси- или галогруппами, или R5 представляет
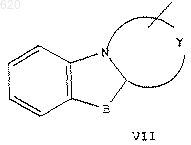
В представляет кислород или серу;
Y представляет остаток, который вместе с атомами, к которым он присоединен, образует триазолильное, имидазолильное, тиазолильное или пирролильное кольцо;
А представляет остаток, который вместе с атомом азота, к которому он присоединен, образует
а) азабицикло (октильную, нонильную или децильную) группу;
b)
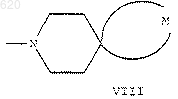
с)
или
d)

М представляет остаток, который вместе с углеродным атомом, к которому он присоединен, образует инданильную, инденильную, пирролидинильную, тетралинильную, бензопиранильную, дигидро-индолильную, нафтодигидрофуранильную, бензодигидротиенильную, бензодигидрофуранильную, бензодигидропиранильную, нафтодигидротиенильную или нафтодигидропирролильную группу, в которой спиросвязь образована не с ароматическим кольцом, замещенную 0-2 С1-С3 алкильными, оксо-, С1-С3 алкокси-, пирролидинил- или пиперидинил-С1-С3-алкокси-, С1-С2 алкилендиокси-, фенокси-, бензилокси-, фенильными или галогруппами;
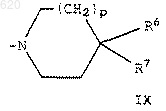
р представляет 0-2;
R6 и R7 независимо представляют фенильные группы, замещенные 0-2 C1-C3 алкильными, C1-С3 алкокси- или галогруппами;
или R6 и R7 вместе с атомом, к которому они присоединены, образуют флуоренильную или дигидроантраценильную группу;
или R6 и R7 представляют водород, при условии, что р не должно быть равно 1;
q представляет 0-2;
Q представляет остаток, который вместе с атомами, к которым он присоединен, образует фенильную или нафтильную группу, замещенную 0-2 С1-С3 алкильными, С1-С3 алкокси- или галогруппами;
R8 представляет водород или С1-С3 алкил;
или его фармацевтически приемлемая соль.
2. Соединение по п.1 формулы
где r представляет 0-3;
Х представляет гидрокси;
R представляет

пунктирная линия означает необязательную двойную связь;
R2 представляет гидрокси или водород или отсутствует, когда пунктирная линия представляет двойную связь;
R3 представляет С1-С4 алкил,
замещенный 1-2 фенильными группами, замещенными 0-2 галогруппами;
или R3 представляет дибензоциклогептенил или бензодиоксинил;
или R3 представляет фенил, бензотиенил, нафтил, индолил или пиперидино,
замещенный 0-2 С1-С3 алкокси-, гидрокси-, циано-, С1-С3 алкильными, C4-C8 циклоалкилалкокси-, гало-, нитро-, трифторметильными или трифторметоксигруппами;
или R2 и R3 вместе образуют С1-С4 алкилиден, замещенный 1-2 фенильными группаьш, замещенными 0-2 галогруппами;
при условии, что R3 не является галоген- или трифторметилзамещенным фенилом, когда R2 представляет гидрокси;
А представляет остаток, который вместе с атомом азота, к которому он присоединен, образует
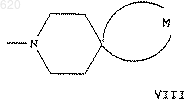
М представляет остаток, который вместе с атомом углерода, к которому он присоединен, образует бензопиранильную, нафтодигидрофуранильную, бензодигидротиенильную или бензодигидрофуранильную группу, в которой спиросвязь образована не с ароматическим кольцом,
замещенную 0-2 С1-С3 алкокси-, бензилокси-, фенильными или галогруппами;
или его фармацевтически приемлемая соль.
3. Соединение по п.1, где Х представляет гидрокси и D образует пирролильную группу.
4. Соединение по п.1, где r = 1-3.
5. Соединение по п.4, где s = 0.
6. Соединение по п.3, где R представляет группу формулы III.
7. Соединение по п.6, где R2 представляет водород или гидрокси.
8. Соединение по п.7, где R3 представляет бензодиоксолил или бензодиоксинил; или R3 представляет фенил, нафтил, индолил или бензотиенил, замещенный 0-2 С1-С3 алкильными, С1-С3 алкокси-, С4-C8 циклоалкилалкокси-, гало-, нитро-, трифторметильными, дифторметильными, гидрокси- или трифторметоксигруппами;
или замещенный 0-1 фенильной, пиперидинонильной, гексагидропиридазинонильной или пиперазинонильной группой,
замещенной 0-2 С1-С3 алкильными, оксо-, C1-С3 алкокси-, гало- или трифторметильными группами.
9. Соединение по п.8, где R3 представляет фенил или нафтил, замещенный 0-2 C1-С3 алкильными, С1-С3 алкокси-, С4-С8 циклоалкилалкокси-, гало-, нитро-, трифторметильными, дифторметильными, гидрокси- или трифторметоксигруппами;
или замещенный 0-1 фенильной, пиперидинонильной, гексагидропиридазинонильной или пиперазинонильной группой, замещенной 0-2 С1-С3 алкильными, оксо-, С1-С3 алкокси-, гало- или трифторметильными группами.
10. Соединение по п.8, где R3 представляет индолил или бензотиенил,
замещенный 0-2 C1-С3 алкильными, С1-С3 алкокси-, С4-С8 циклоалкилалкокси-, гало-, нитро-, трифторметильными, дифторметильными, гидрокси- или трифторметоксигруппами;
или замещенный 0-1 фенильной, пиперидинонильной, гексагидропиридазинонильной или пиперазинонильной группой, замещенной 0-2 С1-С3 алкильными, оксо-, С1-С3 алкокси-, гало- или трифторметильными группами.
11. Соединение по п.10, где R3 представляет бензотиенил, замещенный 1-2 С1-С3 алкокси-, С1-С3 алкильными, C4-C8 циклоалкилалкокси-, гало-, нитро-, трифторметильными или трифторметоксигруппами.
12. Соединение по п.10, где R3 представляет индолил, замещенный 1-2 С1-С3-алкокси-, С1-С3 алкильными, C4-C8 циклоалкилалкокси-, гало-, нитро-, трифторметильными или трифторметоксигруппами.
13. Соединение по п. 1, где R представляет группу формулы V и А представляет группу формулы VIII.
14. Соединение по п.13, где М образует бензопиранильную, бензодигидропиранильную, нафтодигидрофуранильную, бензодигидрофуранильную, инданильную, инденильную или тетралинильную группу, замещенную 0-2 C1-С3 алкильными, оксо-, С1-С3 алкокси-, пирролидинил- или пиперидинил-С1-С3-алкокси-, С1-С2 алкилендиокси-, фенокси-, бензилокси-, фенильными или галогруппами.
15. Соединение по п.14, где группа, образованная группой М, является замещенной 0-2 алкильными, алкокси-, оксо-, фенильными, гало-, фенокси- или бензилоксигруппами.
16. Соединение по п.15, где М образует бензопиранильную, бензодигидропиранильную, нафтодигидрофуранильную или бензодигидрофуранильную группу, замещенную 0-2 оксо-, алкокси- или феноксигруппами.
17. Соединение по п.14, где М образует инденильную, тетралинильную, бензодигидрофуранильную или нафтодигидрофуранильную группу, замещенную 0-2 С1-С3 алкильными, оксо-, С1-С3 алкокси-, пирролидинил- или пиперидинил-С1-С3-алкокси-, С1-С2 алкилендиокси-, фенокси-, бензилокси-, фенильными или галогруппами.
18. Соединение по п.17, где группа, образованная группой М, является замещенной 0-2 алкильными, оксо-, алкокси-, фенильными, гало-, фенокси- или бензилоксигруппами.
19. Соединение по п.18, где группа, образованная группой М, является замещенной 0-2 оксо-, алкокси- или феноксигруппами.
20. Соединение по п.1, которое представляет собой (2S)-(-)-1-(4-индолилокси)-3-(4-(3,4-метилендиоксифенил)пиперидин-1-ил)-2-пропанол, (2S)-(-)-1-(4-индолилокси)-3-(спиро-[1Н-инден-1,4'-пиперидин]-1'-ил)-2-пропанол или (2S)-(-)-1-(4-индолилокси)-3-(5-метоксиспиро[бензодигидрофуран-1(3Н),4'-пиперидин]-1'-ил)-2-пропанол, или его фармацевтически приемлемая соль.
21. Соединение по п.1, которое представляет собой (2S)-(-)-1-(4-индолилокси)-3-(4-(3,4-этилендиоксифенил)пиперидин-1-ил)-2-пропанол, (2S)-(-)-1-(4-индолилокси)-3-(3,4-дигидро-2-оксоспиро[нафталин-1(2Н),4'-пиперидин]-1'-ил)-2-пропанол или (2S)-(-)-1-(4-индолилокси)-3-(4-метоксиспиро[бензодигидрофуран-1 (3Н),4'-пиперидин]-3-он-1'-ил)-2-пропанол, или его фармацевтически приемлемая соль.
22. Соединение по п.1, которое представляет собой (2S)-(-)-1-(4-индолилокси)-3-(4-метоксиспиро[бензодигидрофуран-1(3Н),4'-пиперидин]-1'-ил)-2-пропанол, 1-(4-индолилокси)-3-(4-метоксиспиро[бензодигидрофуран-1(3Н),4'-пиперидин]-1'-ил)пропан или (2S)-(-)-1-(4-индолилокси)-3-(5-метилспиро-[бензодигидрофуран-1(3Н),4'-пиперидин]-1'-ил)-2-пропанол, или его фармацевтически приемлемая соль.
23. Соединение по п.2, которое представляет собой (2S)-(-)-1-(4-индолилокси)-3-(4-(2-нафтил)пиперидин-1-ил)-2-пропанол, (2S)-(-)-1-(4-индолилокси)-3-(бензо[е]спиро[бензодигидрофуран-1(3Н),4'-пиперидин]-1'-ил)-2-пропанол или (2S)-(+)-3-[4-(7-хлор-3-индолил)-пиперидин-1-ил]-1-(4-индолилокси)-2-пропанол, или его фармацевтически приемлемая соль.
24. Соединение по п.2, которое представляет собой 3-[4-(6-хлор-3-индолил)пиперидин-1-ил]-1-(4-индолилокси)пропан, 3-[4-(6-хлор-3-индолил)-1,2,3,6-тетрагидропиридин-1-ил]-1-(4-индолилокси)-2-пропанол или 3-[4-(6-нитро-3-индолил)-1,2,3,6-тетрагидропиридин-1-ил]-1-(4-индолилокси)пропан, или его фармацевтически приемлемая соль.
25. Соединение по п.2, которое представляет собой (2S)-(-)-3-[4-(6-нитро-3-индолил)-1,2,3,6-тетрагидропиридин-1-ил]-1-(4-индолилокси)-2-пропанол или (2S)-(-)-3-[4-(6-трифторметил-3-индолил)пиперидин-1-ил]-1-(4-индолилокси)-2-пропанол, или его фармацевтически приемлемая соль.
26. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель или наполнитель и соединение по п.1.
27. Способ воздействия на серотониновый lA-рецептор, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения формулы (I), определенной в п.1, или его фармацевтически приемлемой соли.
28. Способ по п.27 , в котором указанным соединением является соединение, где r = 1-3, s = 0, Х представляет гидрокси и D образует пирролильную группу.
29. Способ по п.28, в котором указанным соединением является соединение, где R представляет группу формулы III или формулы V.
30. Способ по п.29, в котором указанным соединением является соединение, где R представляет группу формулы V и А представляет группу формулы VIII.
31. Способ по п.30., в котором указанным соединением является соединение, где М образует бензопиранильную, бензодигидропиранильную, нафтодигидрофуранильную, бензодигидрофуранильную, инданильную, инденильную или тетралинильную группу, замещенную 0-2 C1-С3 алкильными, оксо-, С1-С3 алкокси-, пирролидинил- или пиперидинил-С1-С3-алкокси-, С1-С2 алкилендиокси-, фенокси-, бензилокси-, фенильными или галогруппами.
32. Способ по п.31, в котором указанным соединением является соединение, где М образует группу, замещенную 0-2 алкильными, алкокси-, оксо-, фенильными, гало-, фенокси- или бензилоксигруппами.
33. Способ по п.29, в котором указанным соединением является соединение, где R представляет группу формулы III и R3 представляет бензодиоксолил или бензодиоксинил; или R3 представляет фенил, нафтил, индолил или бензотиенил, замещенный 0-2 С1-С3 алкильными, C1-С3 алкокси-, C4-C8 циклоалкилалкокси-, гало-, нитро-, трифторметильными, дифторметильными, гидрокси- или трифторметоксигруппами;
или замещенный 0-1 фенильной, пиперидинонильной, гексагидропиридазинонильной или пиперазинонильной группой, замещенной 0-2 С1-С3 алкильными, оксо-, С1-С3 алкокси-, гало- или трифторметильными группами.
34. Способ по п.27, в котором соединение представляет собой (2S)-(-)-1-(4-индолилокси)-3-(4-(3,4-метилендиокси)-фенил)пиперидин-1-ил)-2-пропанол, (2S)-(-)-1-(4-индолилокси)-3-(спиро[1Н-инден-1,4'-пиперидин]-1'-ил)-2-пропанол или (2S)-(-)-1- (4-индолилокси)-3-(5-метоксиспиро[бензодигидрофуран-1(3Н),4'-пиперидин]-1'-ил)-2-пропанол или его фармацевтически приемлемую соль.
35. Способ по п.27, в котором соединение представляет собой (2S)-(-)-1-(4-индолилокси)-3-(4-(3,4-этилендиокси-фенил)-пиперидин-1-ил)-2-пропанол, (2S)-(-)-1-(4-индолилокси)-3-(3,4-дигидро-2-оксоспиро[нафталин-1(2Н),4'-пиперидин]-1'- ил)-2-пропанол или (2S)-(-)-1-(4-индолилокси)-3-(4-метоксиспиро[бензодигидрофуран-1(3Н),4'-пиперидин]-3-он-1'-ил)-2-пропанол или его фармацевтически приемлемую соль.
36. Способ по п.27, в котором соединение представляет собой (2S)-(-)-1-(4-индолилокси)-3-(4-метоксиспиро[бензодигидрофуран-1(3Н),4'-пиперидин]-1'-ил)-2-пропанол, 1-(4-индолилокси)-3-(4-метоксиспиро[бензодигидрофуран-1(3Н),4 -пиперидин]-1'-ил)пропан или (2S)-(-)-1-(4-индолилокси)-3-(5-метилспиро[бензодигидрофуран-1(3Н),4'-пиперидин]-1'-ил)-2-пропанол или его фармацевтически приемлемую соль.
37. Способ ингибирования обратного захвата серотонина, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения формулы (I), определенной в п.1, или его фармацевтически приемлемой соли.
38. Способ по п.37, в котором указанным соединением воздействуют также на серотониновый lA-рецептор субъекта.
39. Способ по п.38, в котором указанным соединением является соединение, где r = 1-2.
40. Способ по п.39, в котором указанным соединением является соединение, где R представляет группу формулы III или формулы V и А представляет группу формулы VIII.
41. Способ по п.40, в котором указанным соединением является соединение, где R представляет группу формулы III и R3 представляет фенил, нафтил, бензотиенил или индолил, замещенный 0-2 С1-С3 алкокси-, С1-С3 алкильными, C4-C8 циклоалкилалкокси-, гало-, нитро-, трифторметильными или трифторметоксигруппами.
42. Способ по п.40, в котором указанным соединением является соединение, где А представляет группу формулы VIII и М образует нафтодигидрофуранильную или бензодигидрофуранильную группу, замещенную 0-2 С1-С3 алкокси-, бензилокси-, фенильными или галогруппами.
43. Способ по п.41, в котором указанным соединением является соединение, где R3 представляет индолил или бензотиенил, замещенный 1-2 С1-С3 алкокси-, C1-С3 алкильными, C4-C8 циклоалкилалкокси-, гало-, нитро-, трифторметильными или трифторметоксигруппами.
44. Способ по п.38, в котором соединение представляет собой (2S)-(-)-1-(4-индолилокси)-3-(4-(2-нафтил)пиперидин-1-ил)-2-пропанол, (2S)-(-)-1-(4-индолилокси)-3-(бензо[е]спиро[бензодигидрофуран-1(3Н),4'-пиперидин]-1'-ил)-2-пропанол или (2S)-(+)-3-[4-(7-хлор-3-индолил)-пиперидин-1-ил]-1-(4-индолилокси)-2-пропанол или его фармацевтически приемлемую соль.
45. Способ по п.38, в котором соединение представляет собой 3-[4-(6-хлор-3-индолил)пиперидин-1-ил]-1-(4-индолил-окси)пропан, 3-[4-(6-хлор-3-индолил)-1,2,3,6-тетрагидропиридин-1-ил]-1-(4-индолилокси)-2-пропанол или 3-[4-(6-нитро-3-индолил)-1,2,3,6-тетрагидропиридин-1-ил]-1-(4-индолилокси)-пропан или его фармацевтически приемлемую соль.
46. Способ по п.38, в котором соединение представляет собой (2S)-(-)-3-[4-(6-нитро-3-индолил)-1,2,3,6-тетрагидропиридин-1-ил]-1-(4-индолилокси)-2-пропанол или (2S)-(-)-3-[4-(6-трифторметил-3-индолил)пиперидин-1-ил]-1-(4-индолилокси)-2-пропанол или его фармацевтически приемлемую соль.
47. Способ предотвращения или ослабления симптомов, вызванных отказом или частичным отказом от употребления табака или никотина, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения общей формулы (I), определенной в п.1, или его фармацевтически приемлемой соли.
48. Способ по п.47, в котором указанным соединением является соединение, где r = 1-3, s = 0, Х представляет гидрокси и D образует пирролильную группу.
49. Способ по п.48, в котором указанным соединением является соединение, где R представляет группу формулы III или формулы V.
50. Способ по п.49, в котором указанным соединением является соединение, где R представляет группу формулы V и А представляет группу формулы VIII.
51. Способ по п.50, в котором указанным соединением является соединение, где М образует бензопиранильную, бензодигидропиранильную, нафтодигидрофуранильную, бензодигидрофуранильную, инданильную, инденильную или тетралинильную группу, замещенную 0-2 С1-С3 алкильными, оксо-, С1-С3 алкокси-, пирролидинил- или пиперидинил-С1-С3-алкокси-, C1-C2 алкилендиокси-, фенокси-, бензилокси-, фенильными или галогруппами.
52. Способ по п.51, в котором указанным соединением является соединение, где М образует группу, замещенную 0-2 алкильными, алкокси-, оксо-, фенильными, гало-, фенокси или бензилоксигруппами.
53. Способ по п.49, в котором указанным соединением является соединение, где R представляет группу формулы III и R3 представляет бензодиоксолил или бензодиоксинил; или R3 представляет фенил, нафтил, индолил или бензотиенил, замещенный 0-2 С1-С3 алкильными, С1-С3 алкокси-, С4-С8 циклоалкилалкокси-, гало-, нитро-, трифторметильными, дифторметильными, гидрокси- или трифторметоксигруппами;
или замещенный 0-1 фенильной, пиперидинонильной, гексагидропиридазинонильной или пиперазинонильной группой, замещенной 0-2 С1-С3 алкильными, оксо-, C1-С3 алкокси-, гало- или трифторметильными группами.
54. Способ по п.47, в котором соединение представляет собой (2S)-(-)-1-(4-индолилокси)-3-(4-(3,4-метилендиокси-фенил)пиперидин-1-ил)-2-пропанол, (2S)-(-)-1-(4-индолилокси)-3-(спиро[1Н-инден-1,4'-пиперидин]-1'-ил)-2-пропанол или (2S) (-)-1-(4-индолилокси)-3-(5-метоксиспиро[бензодигидрофуран-1(3Н),4'-пиперидин]-1'-ил)-2-пропанол или его фармацевтически приемлемую соль.
55. Способ по п.47, в котором соединение представляет собой (2S)-(-)-1-(4-индолилокси)-3-(4-(3,4-этилендиокси-фенил)пиперидин-1-ил)-2-пропанол, (2S)-(-)-1-(4-индолилокси)-3-(3,4-дигидро-2-оксоспиро[нафталин-1(2Н),4'-пиперидин]-1' -ил)-2-пропанол или (2S)-(-)-1-(4-индолилокси)-3-(4-метоксиспиро[бензодигидрофуран-1(3Н),4'-пиперидин]-3-он-1'-ил)-2-пропанол или его фармацевтически приемлемую соль.
56. Способ по п. 47, в котором соединение представляхт собой-(2S)-(-)-1-(4-индолилокси)-3-(4-метоксиспиро[бензодигидрофуран-1(3Н),4'-пиперидин]-1'-ил)-2-пропанол, 1-(4-индолилокси)-3-(4-метоксиспиро[бензодигидрофуран-1(3Н),4'-пиперидин]-1'-ил)-пропан или (2S)-(-)-1-(4-индолилокси)-3-(5-метилспиро[бензодигидрофуран-1(3Н),4'-пиперидин]-1'-ил)-2-пропанол или его фармацевтически приемлемую соль.
57. Способ лечения депрессии, включающий в себя введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения общей формулы (I), или его фармацевтически приемлемой соли.
58. Способ по п.57, в котором указанным соединением является соединение, где r = 1-2.
59. Способ по п.58, в котором указанным соединением является соединение, где R представляет группу формулы III или формулы V и Апредставляет группу формулы VIII.
60. Способ по п.59, в котором указанным соединением является соединение, где R представляет группу формулы V, А представляет группу формулы VIII и М образует нафтодигидрофуранильную или бензодигидрофуранильную группу, замещенную 0-2 С1-С3 алкокси-, бензилокси-, фенильными или галогруппами.
61. Способ по п.59, в котором указанным соединением является соединение, где R представляет группу формулы III и R3 представляет фенил, нафтил, бензотиенил или индолил, замещенный 0-2 С1-С3 алкокси-, С1-С3 алкильными, C4-C8 циклоалкилалкокси-, гало-, нитро-, трифторметильными или трифторметоксигруппами.
62. Способ по п.61, в котором указанным соединением является соединение, где R3 представляет бензотиенил или индолил, замещенный 0-2 С1-С3 алкокси-, С1-С3 алкильными, C4-C8 циклоалкилалкокси-, гало-, нитро-, трифторметильными или трифторметоксигруппами.
63. Способ по п.62, в котором указанным соединением является соединение, где R3 представляет бензотиенил или индолил, замещенный 1-2 С1-С3 алкокси-, С1-С3 алкильными, гало-, нитро-, трифторметильными или трифторметоксигруппами.
64. Способ по п.57, в котором соединение представляет собой (2S)-(-)-1-(4-индолилокси)-3-(4-(2-нафтил)пиперидин-1-ил)-2-пропанол, (2S)-(-)-1-(4-индолилокси)-3-(бензо[е]спиро[бензодигидрофуран-1(3Н),4'-пиперидин]-1'-ил)-2-пропанол или (2S)-(+)-3-[4-(7-хлор-3-индолил)-пиперидин-1-ил]-1-(4-индолилокси)-2-пропанол или его фармацевтически приемлемую соль.
65. Способ по п.57, в котором соединение представляет собой 3-[4-(6-хлор-3-индолил)пиперидин-1-ил]-1-(4-индолилокси) пропан, 3-[4-(6-хлор-3-индолил)-1,2,3,6-тетрагидропиридин-1-ил]-1-(4-индолилокси)-2-пропанол или 3-[4-(6-нитро-3-индолил)-1,2,3,6-тетрагидропиридин-1-ил]-1-(4-индолилокси)-пропан или его фармацевтически приемлемую соль.
66. Способ по п.57, в котором соединение представляет собой (2S)-(-)-3-[4-(6-нитро-3-индолил)-1,2,3,6-тетрагидропиридин-1-ил]-1-(4-индолилокси)-2-пропанол или (2S)-(-)-3-[4-(6-трифторметил-3-индолил)пиперидин-1-ил]-1-(4-индолилокси)-2-пропанол или его фармацевтически приемлемую соль.
67. Способ лечения страха, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения общей формулы (I), определенной в п.1, или его фармацевтически приемлемой соли.
68. Способ по п.27, в котором указанным соединением является соединение, где r = 1-3, s = 0, Х представляет гидрокси и D образует пирролильную группу.
69. Способ по п.68, в котором указанным соединением является соединение, где R представляет группу формулы III или формулы V и А представляет группу формулы VIII.
70. Способ по п.69, в котором указанным соединением является соединение, где R3 представляет бензодиоксолил или бензодиоксинил; или R3 представляет фенил, нафтил, индолил или бензотиенил, замещенный 0-2 С1-С3 алкильными, С1-С3 алкокси-, C4-C8 циклоалкилалкокси-, гало-, нитро-, трифторметильными, дифторметильными, гидрокси- или трифторметоксигруппами;
или замещенный 0-1 фенильной, пиперидинонильной, гексагидропиридазинонильной или пиперазинонильной группой, замещенной 0-2 С1-С3 алкильными, оксо-, С1-С3 алкокси-, гало- или трифторметильными группами.
71. Способ по п.69, в котором указанным соединением является соединение, где R представляет группу формулы V, А представляет группу формулы VIII и М образует бензопиранильную, бензодигидропиранильную, нафтодигидрофуранильную, бензодигидрофуранильную, индонильную, инденильную или тетралинильную группу, замещенную 0-2 С1-С3 алкильными, оксо-, С1-С3 алкокси-, пирролидинил- или пиперидинил-С1-С3-алкокси-, С1-С2 алкилендиокси-, фенокси-, бензилокси-, фенильными или галогруппами.
72. Способ лечения и страха, и депрессии, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения общей формулы (I), определенной в п.1, или его фармацевтически приемлемой соли.
73. Способ по п.72, в котором г = 1-2.
74. Способ по п.73, в котором указанным соединением является соединение, где R представляет группу формулы III или формулы V и А представляет группу формулы VIII.
75. Способ по п.74, в котором указанным соединением является соединение, где R представляет группу формулы III и R3 представляет фенил, нафтил, индолил или бензотиенил, замещенный 0-2 С1-С3 алкокси-, C4-C8 циклоалкилалкокси-, гало-, нитро-, трифторметильными или трифторметоксигруппами.
76. Способ по п.75, в котором указанным соединением является соединение, где R3 представляет индолил или бензотиенил, замещенный 1-2 С1-С3 алкокси-, C4-C8 циклоалкилалкокси-, гало-, нитро-, трифторметильными или трифторметоксигруппами.
77. Способ лечения состояния, выбранного из группы, состоящей из гипертензии, расстройств познавательной способности, психоза, нарушений сна, нарушений двигательной функции желудка, сексуальной дисфункции, мозговой травмы, потери памяти, расстройств с приемом пищи и ожирения, злоупотребления веществами, обсессивно-компульсивного заболевания (навязчивого состояния), панического расстройства и мигрени, включающий в себя способ по п.27.
78. Способ лечения состояния, выбранного из группы, состоящей из обсессивно-компульсивного заболевания, ожирения, мигрени, боли (в частности, невропатической боли), булимии, предменструального синдрома или синдрома поздней лютеиновой фазы, алкоголизма, табакокурения, панического расстройства, страха, посттравматического синдрома, потери памяти, старческого слабоумия, социальной фобии, гиперактивности при дефиците внимания, деструктивных расстройств поведения, расстройств импульсивного контроля, пограничного личностного расстройства, синдрома хронической усталости, преждевременного семяизвержения, затруднения с эрекцией, нервно-психической анорексии, расстройства сна, аутизма, мутизма и трихотилломании, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения общей формулы (I), определенной в п.1, или его фармацевтически приемлемой соли.
79. Способ потенцирования действия ингибитора обратного захвата серотонина для увеличения доступности серотонина, норэпинефрина и дофамина в головном мозге, включающий введение субъекту, нуждающемуся в таком лечении, ингибитора обратного захвата серотонина в сочетании с эффективным количеством соединения общей формулы (I), определенной в п.1, или его фармацевтически приемлемой соли.
80. Способ по п.47, в котором субъекту вводят также ингибитор обратного захвата серотонина.
Текст
1 Настоящее изобретение относится к области фармакологии и медицинской химии и дает новые лекарственные средства, полезные для лечения заболеваний, которые вызваны или протекают с нарушениями неврологических систем, подверженных воздействию серотонина, в частности тех, которые имеют отношение к серотониновому 1A-рецептору, и тем, которые имеют отношение к обратному захвату серотонина. Исследователи в области фармацевтики открыли в последние годы, что нейроны головного мозга, которые содержат моноамины,очень важны во множестве физиологических процессов, оказывающих очень сильное влияние на многие психологические процессы и процессы, воздействующие на личность. В частности, как было установлено, причиной очень большого числа процессов, влияющих как на физиологические, так и на психологические функции, является серотонин (5 гидрокситриптамин; 5-НТ). Лекарственные средства, воздействующие на функцию серотонина в головном мозге, являются поэтому очень важными и используются в настоящее время для проведения необычайно большого числа различных терапевтических мероприятий. Ранние поколения лекарственных средств, действующих на серотонин, обладали множеством разнообразных физиологических функций как с точки зрения механизма действия, так и с точки зрения терапевтического эффекта. Например, многие из трициклических антидепрессантов действуют, как теперь известно, как ингибиторы обратного захвата серотонина, а также обладают антихолинергической, антигистаминной или анти-адренергической активностью. Не так давно стало возможным исследовать действие лекарственных средств в области индивидуальных рецепторов in vitro или ex vivo и стало понятно, что лекарственные средства, свободные от посторонних механизмов действия,благоприятны для больного. Поэтому задачей поиска теперь является открытие средств,которые воздействуют лишь на функции серотонина, например, у единичного распознаваемого рецептора. В соответствии с настоящим изобретением предлагается длинный ряд лекарственных средств, некоторые из которых обладают высокоизбирательной активностью как антагонисты и частичные агонисты серотонинового 1A-рецептора. Некоторые из предлагаемых лекарственных средств обладают второй активностью как ингибиторы обратного захвата серотонина. Наиболее известным лекарственным средством с этой полезной активностью является флуоксетин, и важность его применения для лечения депрессии и других состояний очень хорошо подтверждена опубликованными документами. Недавние научные статьи, например Artigas, TIPS, 14, 262 (1993),подтвердили, что эффективность ингибитора обратного захвата может быть снижена путем активирования серотониновых 1A-рецепторов с результирующим снижением степени возбуждения серотониновых нейронов. Поэтому проводимое сейчас исследование центральной нервной системы сосредоточено на эффекте комбинирования ингибиторов обратного захвата с соединениями, влияющими на рецептор 5 НТ-1A. Неожиданно было обнаружено, что определенная часть предлагаемых лекарственных средств является мощными ингибиторами обратного захвата серотонина, а также вызывает эффекты в области рецептора 5 НТ 1A. Такие соединения, кажется, не были известны до сих пор. В соответствии с настоящим изобретением предлагаются ряд новых соединений,способы их применения для фармацевтических целей и фармацевтические композиции,обеспечивающие удобное введение соединений в организм. Объем охватываемых соединений, пригодных для использования в упомянутых способах, несколько более широк,чем объем новых соединений. В соответствии с настоящим изобретением предлагаются следующие соединения формулы I:D представляет остаток, который вместе с углеродными атомами, к которым он присоединен, образует пирролильную, имидазолильную, пиразинильную, пиридазинильную или пиримидинильную группу; где Х представляет фенил, гидрокси или метокси; при условии, что Х представляет фенил, когда r=0; пунктирная линия представляет необязательную двойную связь;R1 представляет пиперидинил, пиперазино, морфолино или пирролил, замещенный 0-1 фенильной или бензильной группой или 0-4 С 1-С 3 алкильными, С 1-С 3 алкокси- или галогруппами; причем фенильная или бензильная группа является замещенной 0-2 С 1-С 3 алкильными, гало-, трифторметильными или С 1-С 3 алкоксигруппами; или R1 представляетn и m независимо представляют 4-5,причем группа формулы VI может быть замещенной 0-1 оксогруппой и 0-2 С 1-С 3 алкильными, С 1-С 3 алкокси- или галогруппами; или R1 представляет С 1-С 4 алкил, замещенный пирролилом, фурилом, тиенилом,пиридинилом, морфолинилом, пиперидинилом, тетрагидропирролилом, пиперазинилом,тетрагидрофурилом, бензазепинилом, дибензазепинилом или хинолинилом, замещенным 0-4 С 1-С 3 алкильными, С 1-С 3 алкокси- или галогруппами;R2 представляет гидрокси, водород,циано, С 1-С 4 алкил или (фенил или бензил,замещенный 0-2 С 1-С 3 алкильными, С 1-С 3 алкокси- или галогруппами); или R2 представляет амино, замещенный фенилом или бензилом, замещенным 0-2 С 1 С 3 алкильными, С 1-С 3 алкокси-, гало- или трифторметильными группами; или R2 отсутствует, когда пунктирная линия означает двойную связь;R3 представляет С 1-С 4 алкил, замещенный 0-2 фенильными группами, замещенными 0-2 C1-C3 алкильными, С 1-С 3 алкокси- или галогруппами; или R3 представляет С 1-С 4 алкил, замещенный гидроксиимино или гидрокси; или R3 представляет фенокси, замещенный 0-1 метилендиокси или 0-2 С 1-С 3 алкильными, C1-С 3 алкокси-, трифторметильными или галогруппами; или R3 представляет дибензоциклогептенил, бензодиоксолил, бензодиоксинил или дибензоциклогексенил; или R3 представляет фенил, нафтил, тетралинил, тетразолил, бензимидазолил, индолил, бензофурил, бензотиенил, пиперидино или морфолино, замещенный 0-2 С 1-С 3 алкильными, С 1-С 3 алкокси-, C4-С 8 циклоалкилалкокси-, гало-, нитро-, трифторметильными, дифторметильными, гидрокси- или трифторметоксигруппами; или замещенный 0-1 фенильной, пиперидинонильной, гексагидропиридазинонильной или пиперазинонильной группой, замещенной 0-2 С 1-С 3 алкильными,оксо-, С 1-С 3 алкокси-, гало- или трифторметильными группами; при условии, что R3 не является галогенили трифторметилзамещенным фенилом, когда R2 представляет гидрокси; или R2 и R3 вместе образуют С 1-С 4 алкилиден, замещенный 0-2 фенильными группами, замещенными 0-2 C1-С 3 алкильными, C1 С 3 алкокси-, гало- или трифторметильными группами;R5 представляет C1-C6 алкил; или R5 представляет C1-C3 алкил, замещенный бензодиоксинилом или бензодиоксолилом, замещенным в фенильном кольце 0-2 С 1-С 3 алкильными, C1-С 3 алкокси- или галогруппами; или R5 представляет пиридинил, пиримидинил, индолил, бензофурил, бенэотиенил,пиразинил, хинолинил, изохинолинил, пиридазинил или хиназолинил, замещенный 0-2 С 1-С 3 алкильными, трифторметильными, С 1 С 3 алкокси- или галогруппами; или R5 представляет В представляет кислород или серу;Y представляет остаток, который вместе с атомами, к которым он присоединен, образует триазолильное, имидазолильное, тиазолильное или пирролильное кольцо; А представляет остаток, который вместе с атомом азота, к которому он присоединен,образует а) азабицикло (октильную, нонильную или децильную) группу; М представляет остаток, который вместе с углеродным атомом, к которому он присоединен, образует инданильную, инденильную,пирролидинильную, тетралинильную, бензопиранильную, дигидроиндолильную, нафтодигидрофуранильную, бензодигидротиенильную, бензодигидрофуранильную, бензодигидропиранильную, нафтодигидротиенильную или нафтодигидропирролильную группу,у которой спиросвязь образована не с ароматическим кольцом, замещенную 0-2 С 1-С 3 алкильными, оксо-, С 1-C3 алкокси-, пирролидинил- или пиперидинил-С 1-C3 алкокси-, С 1 С 2 алкилендиокси-, фенокси-, бензилокси-,фенильными или галогруппами; р представляет 0-2;R6 и R7 независимо представляют фенильные группы, замещенные 0-2 С 1-C3 алкильными, С 1-C3 алкокси- или галогруппами; или R6 и R7 вместе с атомом, к которому они присоединены, образуют флуоренильную или дигидроантраценильную группу; или R6 и R7 представляют водород, при условии, что р не должно быть равно 1;Q представляет остаток, который вместе с атомами, к которым он присоединен, образует фенильную или нафтильную группу,замещенную 0-2 С 1-C3 алкильными, С 1-C3 алкокси- или галогруппами;R8 представляет водород или С 1-C3 алкил; или их фармацевтически приемлемые соли. Эффективны как ингибиторы обратного захвата серотонина, а также обладают активностью в области рецептора 5-НТ-1 А соединения следующего вида, входящие в число соединений формулы I пунктирная линия означает необязательную двойную связь;R2 представляет гидрокси или водород или отсутствует, когда пунктирная линия представляет двойную связь;R3 представляет С 1-С 4 алкил, замещенный 1-2 фенильными группами, замещенными 0-2 галогруппами; или R3 представляет дибензоциклогептенил или бензодиоксинил; или R3 представляет фенил, бензотиенил, нафтил, индолил или пиперидино, замещенный 0-2 С 1-C3 алкокси-, гидрокси-, циано-, С 1-C3 алкильными, C4-C8 циклоалкилалкокси-, гало-, нитро-, трифторметильными или трифторметоксигруппами; или R2 и R3 вместе образуют C1-C4 алкилиден, замещенный 1-2 фенильными группами, замещенными 0-2 галогруппами; при условии, что R3 не является галогенили трифторметилзамещенным фенилом, когда R2 представляет гидрокси; А представляет остаток, который вместе с атомом азота, к которому он присоединен,образует М представляет остаток, который вместе с атомом углерода, к которому он присоединен, образует бензпиранильную, нафтодигидрофуранильную, бензодигидротиенильную или бензодигидрофуранильную группу,в которой спиросвязь образована не с ароматическим кольцом, замещенную 0-2 С 1-C3 алкокси-, бензилокси-, фенильными или галогруппами; или их фармацевтически приемлемые соли. В соответствии с настоящим изобретением предлагаются также фармацевтические композиции, содержащие описанные выше соединения. Предлагаются также фармацевтические способы применения, включающие введение больным, нуждающимся в таких способах 7 применения, соединения общей формулы (I),приведенной выше, или соединения следующей формулы:D представляет остаток, который вместе с углеродными атомами, к которым он присоединен, образует пирролильную, имидазолильную, пиразинильную, пиридазинильную или пиримидинильную группу; где Х представляет фенил, гидрокси или метокси; при условии, что Х представляет фенил,когда r=0; пунктирная линия представляет необязательную двойную связь;R1 представляет пиперидинил, адамантил, пиперазино, морфолино или пирролил,замещенный 0-1 фенильной или бензильной группой или 0-4 С 1-C3 алкильными, С 1-C3 алкокси- или галогруппами; причем фенильная или бензильная группа является замещенной 0-2 С 1-C3 алкильными, гало-, трифторметильными или С 1-C3 алкоксигруппами; или R1 представляетn и m независимо представляют 4-5,причем группа формулы VI может быть замещенной 0-1 оксогруппой и 0-2 С 1-C3 алкильными, C1-C3 алкокси- или галогруппами; или R1 представляет С 1-С 4 алкил, замещенный пирролилом, адамантилом, фурилом,тиенилом, пиридинилом, морфолинилом, пиперидинилом, тетрагидропирролилом, пиперазинилом, тетрагидрофурилом, бензазепинилом, дибензазепинилом или хинолинилом,замещенным 0-4 С 1-C3 алкильными, С 1-C3 алкокси- или галогруппами; замещенный 0-2 С 1-C3 алкильными, С 1-C3 алкокси- или галогруппами); или R2 представляет амино, замещенный фенилом или бензилом, замещенным 0-2 С 1C3 алкильными, С 1-C3 алкокси-, гало- или трифторметильными группами; или R2 отсутствует, когда пунктирная линия означает двойную связь;R3 представляет С 1-С 4 алкил, замещенный 0-2 фенильными группами, замещенными 0-2 С 1-C3 алкильными, С 1-C3 алкокси- или галогруппами; или R3 представляет С 1-С 4 алкил, замещенный гидроксиимино или гидрокси; или R3 представляет фенокси, замещенный 0-1 метилендиокси или 0-2 С 1-C3 алкильными, С 1-C3 алкокси-, трифторметильными или галогруппами; или R3 представляет дибензоциклогептенил, бензодиоксолил, бензодиоксинил или дибензоциклогексенил; или R3 представляет фенил, нафтил, тетралинил, тетразолил, бензимидазолил, индолил, бензофурил, бензотиенил, пиперидино или морфолино, замещенный 0-2 C1-C3 алкильными, С 1-C3 алкокси-, C4-C8 циклоалкилалкокси-, гало-, нитро-, трифторметильными, дифторметильными, гидрокси- или трифторметоксигруппами; или замещенный 0-1 фенильной, пиперидинонильной, гексагидропиридазинонильной или пиперазинонильной группой, замещенной 0-2 С 1-C3 алкильными, оксо-, С 1-C3 алкокси-, гало- или трифторметильными группами; или R2 и R3 вместе образуют С 1-С 4 алкилиден, замещенный 0-2 фенильными группами, замещенными 0-2 С 1-C3 алкильными, С 1C3 алкокси-, гало- или трифторметильными группами; В представляет кислород или серу;Y представляет остаток, который вместе с атомами, к которым он присоединен, образует триазолильное, имидазолильное, тиазолильное или пирролильное кольцо; А представляет остаток, который вместе с атомом азота, к которому он присоединен,образует а) азабицикло (октильную, нонильную или децильную) группу; или R6 и R7 представляют водород, при условии, что р не должно быть равно 1;Q представляет остаток, который вместе с атомами, к которым он присоединен, образует фенильную или нафтильную группу,замещенную 0-2 С 1-C3 алкильными, С 1-C3 алкокси- или галогруппами;R8 представляет водород или С 1-C3 алкил; или их фармацевтически приемлемые соли. Кроме того, фармацевтические способы применения с объединением активности, связанной с 1A-рецептором, и ингибирования обратного захвата серотонина осуществляют путем введения соединений общей формулы(I), приведенной выше, или соединений следующей формулы XIII М представляет остаток, который вместе с углеродным атомом, к которому он присоединен, образует инданильную, инденильную,пирролидинильную, тетралинильную, бензопиранильную, дигидроиндолильную, нафтодигидрофуранильную, бензодигидротиенильную, бензодигидрофуранильную, бензодигидропиранильную, нафтодигидротиенильную или нафтодигидропирролильную группу,в которой спиросвязь образована не с ароматическим кольцом, замещенную 0-2 С 1-C3 алкильными, оксо-, С 1-С 3 алкокси-, пирролидинил- или пиперидинил-С 1-C3-алкокси-, С 1 С 2 алкилендиокси-, фенокси-, бензилокси-,фенильными или галогруппами; р представляет 0-2;R6 и R7 независимо представляют фенильные группы, замещенные 0-2 С 1-C3 алкильными, С 1-C3 алкокси- или галогруппами; или R6 и R7 вместе с атомом, к которому они присоединены, образуют флуоренильную или дигидроантраценильную группу; пунктирная линия означает необязательную двойную связь;R2 представляет гидрокси или водород или отсутствует, когда пунктирная линия представляет двойную связь;R3 представляет С 1-С 4 алкил, замещенный 1-2 фенильными группами, замещенными 0-2 галогруппами; или R3 представляет дибензоциклогептенил или бензодиоксинил; или R3 представляет фенил, бензотиенил, нафтил, индолил или пиперидино, замещенный 0-2 C1-C3 алкокси-, гидрокси-, C1-C3 алкильными, циано-, C4-C8 циклоалкилалкокси-, гало-, нитро-, трифторметильными или трифторметоксигруппами; или R2 и R3 вместе образуют С 1-С 4 алкилиден, замещенный 1-2 фенильными группами, замещенными 0-2 галогруппами;R5 представляет фенил, фенил-С 1-C3 алкил или дифенил-С 1-C3-алкил, замещенный 1-2 гало-, С 1-C3 алкокси или трифторметильными группами; А представляет остаток, который вместе с атомом азота, к которому он присоединен,образует М представляет остаток, который вместе с атомом углерода, к которому он присоединен, образует бензопиранильную, нафтодигидрофуранильную, бензодигидротиенильную или бензодигидрофуранильную группу,в которой спиросвязь образована не с ароматическим кольцом, замещенную 0-2 С 1-C3 алкокси-, бензилокси-, фенильными или галогруппами; или их фармацевтически приемлемых солей. Еще в соответствии с настоящим изобретением предлагается способ воздействия на серотониновый 1A-рецептор, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения формулы (I) или (XII). Более конкретные способы лечения включают способ облегчения симптомов, вызванных отказом или частичным отказом от табака или никотина, способ лечения страха и способ лечения состояния, выбранного из группы, состоящей из депрессии, гипертензии, расстройств познавательной способности, психоза, нарушений сна, нарушений двигательной функции желудка, сексуальной дисфункции, мозговой травмы, потери памяти, расстройств с приемом пищи и ожирения, злоупотребления веществами, навязчивого состояния, панического расстройства и мигрени, и эти способы включают введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения формулы (I) или (XII). Кроме того, в соответствии с настоящим изобретением предлагаются способ облегчения симптомов,вызванных отказом или частичным отказом от потребления табака или никотина, и способ потенцирования (усиления) действия ингибитора обратного захвата серотонина для увеличения содержания серотонина, норэпинефрина и дофамина в головном мозге, включающие введение субъекту, нуждающемуся в таком лечении, соединения формулы (I) или(XII) в сочетании с ингибитором обратного захвата серотонина. В соответствии с настоящим изобретением предлагается также способ ингибирования обратного захвата серотонина, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения формулы (I) или (XII), причем введение эффективного количества одного из указанных соединений дает также способ ингибирования обратного захвата серотонина с обеспечением при этом воздействия на серотониновый 1A-рецептор субъекта. Предлагаются также способ лечения депрессии и способ лечения страха и депрессии путем введения субъекту, нуждающемуся в таком лечении, эффективного количества соединения формулы (I) или (XII). И еще, введение соединения формулы(I) или (XII), дает также способ лечения состояния, выбранного из группы, состоящей из обсессивно-компульсивного заболевания (навязчивого состояния), ожирения, мигрени,боли (особенно невропатической боли), булимии, предменструального синдрома или позднего лютеинового синдрома, алкоголизма, злоупотребления табаком, панического расстройства, страха, посттравматического стрессового расстройства, потери памяти,старческого слабоумия, социальной фобии,гиперфункционального расстройства с дефицитом внимания, деструктивных поведенческих расстройств, расстройств импульсивного контроля, пограничного личностного расстройства, синдрома хронической усталости,преждевременного семяизвержения, затруднения с эрекцией, нервно-психической анорексии, расстройств сна, аутизма, мутизма и трихотилломании. В данном описании все концентрации,количества, отношения и тому подобное выражены в единицах массы, если не указано иное. Все температуры даны в градусах Цельсия. Думается, что данное выше основное описание соединений достаточно для объяснения их природы читающему это описание специалисту в данной области, чему способствуют также следующие далее примеры. Чтобы гарантированно не было никакого недопонимания, ниже дано дополнительное описание. В основном описании все основные химические термины использованы в их нормальных, привычных значениях. Например,небольшие алкильные и алкоксигруппы включают, в зависимости от величины групп,метильные, этильные, пропильные, изопропильные, н-бутильные, втор-бутильные, третбутильные, пентильные, 3-метилбутильные,гексильные и разветвленные гексильные группы и соответствующие алкоксигруппы,когда это позволяют индивидуально названные группы. Когда группа может иметь несколько замещающих групп, таких как 0-4 алкильные, алкокси- и галогруппы, которые разрешается иметь морфолиногруппе R1, понятно, что подразумевается лишь замещение,которое является химически, электронно и стерически возможным. Используемый термин "гало" относится к фтору, хлору, брому или йоду. Группа D образует бициклический азотосодержащий гетероцикл, который в большинстве случаев является индолилом, но мо 13 жет быть также хинолинилом, изохинолинилом, бензимидазолилом, хиназолинилом и тому подобным. Нижние индексы r и s показывают, что в линейной алкиленовой цепи может быть до 7 метиленовых групп. Таким образом, цепь представляет собой неразветвленный алкил от этила до гептила, который может быть, как показано, замещен группой X. Предпочтительными группами являются водород и гидрокси. Термин "С 4-С 8 циклоалкилалкокси" охватывает группы, такие как циклопропилметокси, циклогексилэтокси, циклопентилметокси и тому подобное. В приведенной выше формуле составные части соединений, например группа формулы IV, показаны так, чтобы было видно место соединения с основной структурой. В формуле IV, например, соединение должно быть в положении 1 пиперазинильного кольца, а заместитель R5 находится в положении 4. Группа формулы III является пиперидином или тетрагидропиридином с группами R2 и R3 в положении 4 и необязательной группойR8 в любом другом положении кольца. Хотя группа R3 может представлять любое из данных ей определений, но обе группы R2 и R3 относительно просты, и читатель может легко понять их природу. Следует, однако, отметить, что новые соединения по настоящему изобретению не включают некоторых комбинаций заместителей R2 и R3, как разъяснено выше в кратком описании сущности изобретения. Можно также отметить, что большие группы R3, такие как дибензоциклогептен или нафтил, могут быть присоединены в любой приемлемой ориентации, как и заместители группы R3, такие как пиперазинонил. Когда ориентация группы, например пирролильной группы, замещенной в алкиле,в определении R1, не указана, то подразумевается, что может быть использована любая приемлемая ориентация. Так, пирролильная группа может быть введена в положение 2 или 3 и при желании сама может быть замещена алкильными, алкокси- или галогруппами. Опять же, нет необходимости описывать неприемлемые или маловероятные замещенные группы. Типичными структурами групп формулы VI, соединенных спиросвязью, являются следующие: Конденсированная арильная гетероциклическая группа формулы VII представляет,например, следующие структуры: Группа формулы V имеет четыре определения, из которых предпочтительным является группа формулы VIII. Формула VIII представляет спиросистему, в которой М представляет атомы, необходимые для довершения образования одной из указанных циклических групп. Некоторые из групп М представляют собой многоядерные структуры, такие как нафтодигидропирролил, где одно или несколько колец ароматические и одно кольцо неароматическое. Специалист в данной области поймет, конечно, что спиросвязь обязательно образуется неароматическим кольцом группы М. Например, в нафтодигидропирролиле спиросвязь должна быть образована дигидропирролильной группой. Неароматическое кольцо таких групп М может быть ориентировано любым приемлемым образом, при котором гетероатом не находится в месте спиросвязи. В соответствии с некоторыми номенклатурными схемами бензодигидротиенильной группой называют группу, в которой атом серы находится в положении 1, и называют ее изодигидробензотиенильной, если атом серы находится в положении 2. Но в данном описании все такие соединения называют бензодигидротиенилом, а положение атома серы показывают числом в химическом названии. Этот же принцип номенклатуры применен при наименовании всех групп М. Данные ниже примеры иллюстрируют многочисленные типичные группы М и некоторые из комплексов, в частности спиро, причем для лучшего понимания в примерах нарисованы группы R. Понятно, что, когда циклическая структура замещена оксогруппой, как, например,группа формулы VIII, замещенная оксогруппой, оксогруппа не может занимать ароматическое кольцо циклической структуры. Понятно также, что такие группы могут образовывать таутомерные структуры, где кислород находится в форме гидрокси и в циклической структуре образована двойная связь. Данные ниже примеры показывают синтез многочисленных соединений, имеющих спирогруппу М. Можно видеть, что одна группа таких предпочтительных соединений включает соединения, в которых спирокольцом является дигидрофуран, часто несущий на себе оксогруппу и сконденсированный с фенильной или нафтильной группой. Понятно, что в каждом случае указание предпочтительного соединения охватывает и его фармацевтически приемлемые соли. Подходящие заместители в таких соединениях, в частности в фенильной или нафтильной части группы,включают алкокси, бензилокси и галоген. Спиро-конденсированная группа формулы VIII представляет такие группы, как показанные далее. Опять предполагается, что гетероциклические группы, образованные группой, достроенной группой М, могут иметь любую приемлемую ориентацию, при условии, что ароматическая группа не может образовывать спиросвязь, и также нет смысла описывать невероятные группы или группы,которые не могут быть синтезированы знающим органохимиком. Группа формулы IX представляет собой состоящий из 4-6 метиленовых групп полиметиленимино, имеющий заместители R6 и R7 у одного и того же углеродного атома. Эти заместители могут представлять фенильные или замещенные фенильные группы или водород или R6 и R7 могут вместе образовывать присоединенную спиросвязью флуоренильную или дигидроантраценильную группу. Группа формулы Х представляет собой состоящую из 4-6 метиленовых групп полиметиленовую группу, сконденсированную с фенильной или нафтильной группой. Соединения формул XI и XIII составляют особый класс описанных в данном описании соединений, необычных по причине их двойной активности как антагонистов 5-НТ 1 А-рецептора и как ингибиторов обратного захвата серотонина. Очевидно, что соединения с двойной активностью охвачены формулами I и XII и описаны так же, как более широкие группы соединений. Следует отметить,что соединения формулы XIII включают класс, в котором группа R представляет пиперазин формулы IV, который не включен в группу соединений формулы XI, и, следовательно, группа R5 формулы IV также включена в формулу XIII. Соединения, раскрытые в данном описании, очень активны, важны и особенно полезны в способах лечения по настоящему изобретению, но некоторые классы соединений являются предпочтительными. В следующих абзацах описаны такие предпочтительные классы. Понятно, что предпочтительные классы имеют отношение как к спо 17 собам лечения, так и к новым соединениям по настоящему изобретению, за исключением случаев, когда какой-то класс включен только в какой-нибудь способ лечения и не включен в определение новых соединений. Понятно также, что, когда какую-то группу называют предпочтительной, это относится также и к ее разрешенным заместителям; например, предпочтительный класс, в котором R1 представляет C1-C4 алкил, замещенный адамантилом,следует понимать как включающий такие возможные заместители, как алкильные, алкокси- или галогруппы, показанные в общей формуле. Первая группа предпочтительных классов соединений относится к соединениям формул XI и XIII: 1) r = 1-2; 2) r = 1; 3) X представляет гидрокси; 4) R представляет группу формулы III; 5) R представляет группу формулы IV; 6) R представляет группу формулы V; 7) пунктирная линия не представляет двойную связь и R2 представляет водород; 8) R3 представляет С 1-С 2 алкил, замещенный 1-2 фенильными группами; 9) R3 представляет фенил или нафтил; 10) R3 представляет бензотиенил или индолил; 11) R3 представляет пиперидино; 12) R3 представляет бензотиенил, замещенный 1-2 C1-C3 алкокси-, С 1-C3 алкильными; C4-C8 циклоалкилалкокси-, гало-, нитро-,трифторметильными или трифторметоксигруппами; 13) R3 представляет индолил, замещенный 1-2 C1-C3 алкокси-, С 1-C3 алкильными,C4-C8 циклоалкилалкокси-, гало-, нитро-,трифторметильными или трифторметоксигруппами; 14) M образует бензопиранильную группу; 15) M образует нафтодигидрофуранильную группу; 16) М образует бензодигидротиенильную группу; 17) М образует бензодигидрофуранильную группу; 18) группа, образованная группой М,является замещенной 1-2 алкокси- или бензилоксигруппами; 19) группа, образованная группой М,является замещенной 1-2 фенильными группами; 20) группа, образованная группой М,является замещенной 1-2 алкокси-, бензилокси- или галогруппами; 21) R5 представляет фенил; 22) R5 представляет фенил-С 1-C3-алкил; 23) группа, образованная группой М,является дифенил-С 1-C3-алкилом; 24) соединение представляет собой фармацевтически приемлемую соль. Следующие предпочтительные определения относятся к соединениям формул I иd) R1 представляет группу формулы VI; е) R1 представляет C1-C2 алкил, замещенный пирролилом, адамантилом, фурилом,тиенилом, пиридинилом, морфолинилом, пиперидинилом, тетрагидропирролилом, пиперазинилом, тетрагидрофурилом, бензазепинилом, дибензазепинилом или хинолинилом;j) R2 представляет гидрокси или водород;n) R3 представляет фенокси; о) R3 представляет фенил; р) R3 представляет нафтил или пиперидино;v) R представляет группу формулы II;w) R представляет группу формулы III; х) R представляет группу формулы IV;y) R представляет группу формулы V;z) R5 представляет группу формулы VII;ab) А представляет группу формулы IX;ac) А представляет группу формулы X;ad) M образует бензопиранильную, бензодигидропиранильную, нафтодигидрофура 19 нильную или бензодигидрофуранильную группу;ae) М образует бензодигидротиенильную или нафтодигидротиенильную группу;af) M образует пирролидинильную, дигидроиндолильную или нафтодигидропропирролильную группу; аg) М образует инданильную, инденильную или тетралинильную группу;ah) соединение представляет собой соль;aj) пунктирная линия не представляет двойную связь и R2 присутствует;an) D образует пиразинильную, пиридазинильную или пиримидинильную группу; ао) r = 1-3; ар) r = 1;aq) X представляет гидрокси или метокси;as) R1 представляет тетралинил или нафтил;at) R3 представляет бензодиоксолил или бензодиоксинил;au) R3 представляет нафтил или тетралинил;av) R3 представляет тетразолил или бензимидазолил;az) R5 представляет нафтил или тетралинил;bb) R5 представляет бензофурил или бензотиенил;bc) R5 представляет хинолинил или изохинолинил; Кроме того, предпочтительный класс соединений формулы I включает следующий подкласс: где Х представляет гидрокси или метокси;R1 представляет пиперидинил, пиперазино, морфолино или пирролил, замещенный 01 бензильной группой или 0-4 С 1-C3 алкильными, С 1-C3 алкокси- или галогруппами; или R1 представляетn и m независимо представляют 4-5,причем группа формулы VI может быть замещенной 0-1 оксогруппой и 0-2 C1-C3 алкильными, С 1-C3 алкокси- или галогруппами; или R1 представляет С 1-С 4 алкил, замещенный пирролилом, фурилом, тиенилом,пиридинилом, морфолинилом, пиперидинилом, тетрагидропирролилом, пиперазинилом,тетрагидрофурилом, бензазепинилом, дибензазепинилом или хинолинилом, замещенным 0-4 С 1-C3 алкильными, С 1-C3 алкокси- или галогруппами;R3 представляет С 1-С 4 алкил, замещенный 0-2 фенильными группами, замещенными 0-2 С 1-C3 алкильными, C1-C3 алкокси- или галогруппами; или R3 представляет фенокси, замещенный 0-1 метилендиокси или 0-2 C1-C3 алкильными, С 1-C3 алкокси-, трифторметильными или галогруппами; или R3 представляет дибензоциклогептен или дибензоциклогексен; или R3 представляет фенил, нафтил, пиперидино или морфолино, замещенный 0-2 21 или замещенный 0-1 фенильной, пиперидинонильной, гексагидропиридазинонильной или пиперазинонильной группой, замещенной 0-2 C1-C3 алкильными, оксо-, C1-C3 алкокси-, гало- или трифторметильными группами; при условии, что R3 не является галогенили трифторметилзамещенным фенилом, когда R2 представляет гидрокси;R5 представляет C1-C6 алкил или С 1-С 4 ацил; или R5 представляет C1-C3 алкил, замещенный бензодиоксинилом или бензодиоксолилом, замещенным в фенильном кольце 0-2 В представляет кислород или серу;Y представляет остаток, который вместе с атомами, к которым он присоединен, образует триазолильное, имидазолильное, тиазолильное или пиррролильное кольцо; А представляет остаток, который вместе с атомом азота, к которому он присоединен,образует а) азабицикло (октильную, нонильную или децильную) группу;M представляет остаток, который вместе с углеродным атомом, к которому он присоединен, образует инданильную, инденильную,пирролидинильную, тетралинильную, бензопиранильную, дигидроиндолильную, нафтодигидрофуранильную, бензодигидротиенильную, бензодигидрофуранильную, бензодигидропиранильную, нафтодигидротиенильную или нафтодигидропирролильную группу,в которой спиросвязь образована не с ароматическим кольцом, замещенную 0-2 С 1-С 3 алкильными, оксо-, C1-C3 алкокси-, фенильными или галогруппами; р представляет 0-2;R6 и R7 независимо представляют фенильные группы, замещенные 0-2 C1-C3 алкильными, C1-C3 алкокси- или галогруппами; или R6 и R7 вместе с атомом, к которому они присоединены, образуют флуоренильную или дигидроантраценильную группу; или R6 и R7 представляют водород, при условии, что р не должно быть равно 1;Q представляет остаток, который вместе с атомами, к которым он присоединен, образует фенильную или нафтильную группу,замещенную 0-2 C1-C3 алкильными, C1-C3 алкокси- или галогруппами;R8 представляет водород или С 1-C3 алкил; или их фармацевтически приемлемые соли. Другой предпочтительный вид осуществления настоящего изобретения включает способы применения соединений формулыR1 представляет пиперидинил, адамантил, пиперазино, морфолино или пирролил,замещенный 0-1 бензильной группой или 0-4 С 1-C3 алкильными, C1-C3 алкокси- или галогруппами; или R1 представляетn и m независимо представляют 4-5,причем группа формулы VI может быть замещенной 0-1 оксогруппой и 0-2 С 1-C3 алкильными, C1-C3 алкокси- или галогруппами; или R1 представляет С 1-С 4 алкил, замещенный пирролилом, адамантилом, фурилом,тиенилом, пиридинилом, морфолинилом, пиперидинилом, тетрагидропирролилом, пиперазинилом, тетрагидрофурилом, бензазепинилом, дибензазепинилом или хинолинилом,замещенным 0-4 C1-C3 алкильными, С 1-C3 алкокси- или галогруппами;R3 представляет C1-С 4 алкил, замещенный 0-2 фенильными группами, замещенными 0-2 C1-C3 алкильными, C1-C3 алкокси- или галогруппами; или R3 представляет бензимидазолил или индолил, замещенный 0-2 фенильными,оксо-, С 1-C3 алкильными, C1-C3 алкокси- или галогруппами; или R3 представляет фенокси, замещенный 0-1 метилендиокси или 0-2 C1-C3 алкильными, C1-C3 алкокси-, трифторметильными или галогруппами; или R3 представляет дибензоциклогептен или дибензоциклогексен; или R3 представляет фенил, нафтил, пиперидино или морфолино, замещенный 0-2 С 1-С 3 алкильными, С 1-C3 алкокси-, гало-, С 1 С 2 алкилендиокси-, трифторметильными,гидрокси- или трифторметоксигруппами; или замещенный 0-1 фенильной, пиперидинонильной, гексагидропиридазинонильной или пиперазинонильной группой, замещенной 0-2 С 1-C3 алкильными, оксо-, C1-C3 алкокси-, гало- или трифторметильными группами; В представляет кислород или серу;Y представляет остаток, который вместе с атомами, к которым он присоединен, образует триазолильное, имидазолильное, тиазолильное или пирролильное кольцо; А представляет остаток, который вместе с атомом азота, к которому он присоединен,образует а) азабицикло (октильную, нонильную или децильную) группу;M представляет остаток, который вместе с углеродным атомом, к которому он присоединен, образует инданильную, инденильную,пирролидинильную, тетралинильную, бензопиранильную, дигидроиндолильную, нафтодигидрофуранильную, бензодигидротиенильную, бензодигидрофуранильную, бензодигидропиранильную, нафтодигидротиенильную или нафтодигидропирролильную группу,в которой спиросвязь образована не с ароматическим кольцом, замещенную 0-2 C1-C3 алкильными, оксо-, C1-C3 алкокси-, фенильными или галогруппами; р представляет 0-2;R6 и R7 независимо представляют фенильные группы, замещенные 0-2 C1-C3 алкильными, С 1-C3 алкокси- или галогруппами; или R6 и R7 вместе с атомом, к которому они присоединены, образуют флуоренильную или дигидроантраценильную группу; или R6 и R7 представляют водород, при условии, что р не должно быть равно 1;Q представляет остаток, который вместе с атомами, к которым он присоединен, образует фенильную или нафтильную группу,замещенную 0-2 C1-C3 алкильными, С 1-C3 алкокси- или галогруппами;R8 представляет водород или С 1-C3 алкил; или их фармацевтически приемлемые соли. Описанные выше соединения применяют в способах воздействия (в частности, способах осуществления антагонистического воздействия) на 5 НТ-1 А-рецептор и терапевтических способах, связанных с их эффектом на 5 НТ-1 А-рецептор. Такие способы лечения охватывают, в частности, способы облегчения симптомов, вызванных отказом или частичным отказом от табака или никотина, включающие введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения формулы I. Кроме того, такие терапевтические способы включают способы лечения страха, депрессии, гипертензии, расстройств познавательной способности, психоза, нарушений сна, нарушений двигательной функции желудка, сексуальной дисфункции, мозговой травмы, потери памяти, расстройств с приемом пищи и ожирения, злоупотребления веществами, навязчивого состояния, панического расстройства и мигрени. И еще таким способом является усиление действия ингибитора обратного захвата серотонина путем введения соединения описанного выше подкласса в сочетании с ингибитором обратного захвата. Понятно, что описанные выше предпочтительные классы соединений можно объединять для образования дополнительных,более широких или более узких, классов предпочтительных соединений. Некоторые соединения по настоящему изобретению особенно активны или избирательны и потому являются еще более предпочтительными, чем другие соединения и классы соединений. Наиболее предпочтительными соединениями для применения с целью создания требуемых эффектов в области 5-НТ 1A-рецептора являются соединения примеров 63, 71, 78, 79, 82, 88, 94, 126 и 189 в следующем далее разделе. Наиболее предпочтительные соединения с двойной активностью, действующие в области 1A-рецептора и как ингибиторы обратного захвата серотонина, включают соединения примеров 64, 89,193, 197, 196, 205, 154 и 151. Так как соединения по настоящему изобретению по своей природе основны, то они взаимодействуют с любым числом неорганических и органических кислот с образованием фармацевтически приемлемых кислотно 000620 аддитивных солей. Поскольку некоторые из свободных аминов соединений по настоящему изобретению при комнатной температуре обычно представляют собой масла, то является предпочтительным преобразовывать свободные амины в их фармацевтически приемлемые кислотно-аддитивные соли для облегчения обращения с ними и введения в организм, поскольку эти соли при комнатной температуре тверды. Кислотами, обычно используемыми для образования таких солей,являются неорганические кислоты, такие как хлороводородная, бромоводородная, иодоводородная, серная, фосфорная и тому подобное, и органические кислоты, такие как птолуолсульфоновая, метансульфоновая, щавелевая, п-бромфенилсульфоновая, угольная,янтарная, лимонная, бензойная, уксусная и тому подобное. Примерами таких фармацевтически приемлемых солей являются сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид,бромид, иодид, ацетат, пропионат, деканоат,каприлат, акрилат, формиат, изобутират, капроат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат, себацат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, сульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат,лактат, -гидроксибутират, гликоллат, тартрат, метансульфонат, пропансульфонат,нафталин-1-сульфонат, нафталин-2-сульфонат, манделат и тому подобное. Предпочтительными фармацевтически приемлемыми солями являются те, что образованы с хлороводородной или малеиновой кислотой. Многие из соединений формулы I могут образовывать оптические изомеры. В частности, соединения, в которых Х представляет гидрокси или метокси, имеют асимметрический центр у углеродного атома, к которому присоединена группа X. Кроме того, многие из групп R могут существовать в нескольких оптических формах. Обычно для асимметрического центра, к которому присоединена группа X, является предпочтительным существовать в S-(-) форме. Однако если в названии соединения по настоящему изобретению отсутствует указание асимметрической формы, то подразумеваются любые и все возможные асимметрические формы. Синтез предлагаемых соединений осуществляют методами, традиционными для синтеза родственных известных соединений. Синтез, как правило, включает взаимодействие одного интермедиата, который представляет собой Het-оксипропановую группу, с интермедиатом, который представляет собой аминогруппу R. Используемый здесь термин В случае необходимости получения соединения, в котором Х представляет гидрокси, наиболее полезным интермедиатом является 4-оксиранилалкокси-Неt, легко взаимодействующий с аминосоединением группы R. Оксиранильный интермедиат легко получают известными способами в виде рацемата или любого энантиомера. Когда нужно получить соединения, в котором R является группой формулы II, в качестве реагента используют простой амин, такой как адамантиламин, а если нужно получить более сложную группу,то легко осуществляют взаимодействие оксиранильной группы с азотом соответствующего гетероцикла с получением целевого продукта с хорошим выходом. Удовлетворительными являются умеренные условия реакции,такие как температура от температуры окружающей среды до примерно 100C, причем может быть использован любой растворитель,который инертен к реагентам и обладает достаточной растворяющей способностью по отношению к ним. Как было установлено,реакцию предпочтительно нужно проводить при температуре кипения с обратным холодильником и давлении окружающей среды в спирте, таком как метанол. Не нужен никакой катализатор или активирующий агент, а для выделения используют традиционные методы. Описанные ниже примеры иллюстрируют синтез многих соединений по настоящему изобретению указанными способами. Когда процесс осуществляют с использованием интермедиатов в единственной асимметрической форме, рацемизация незначительна или отсутствует, в результате чего продукт получают в требуемой единственной асимметрической форме. Другой подходящий способ синтеза предлагаемых соединений заключается в использовании 1-хлор(Het-окси)алкана, который может, хотя и не обязательно, быть замещен фенильной, гидрокси- или метоксигруппой. В соответствии с другим вариантом можно, конечно, в Het-оксиалкане использовать кроме хлора и другие уходящие группы,такие как сульфонат, в частности метансульфонат или толуолсульфонат, бром и тому подобное. Het-оксиалкановый интермедиат вводят во взаимодействие с аминосодержащим интермедиатом, составляющим группу R, в присутствии любого подходящего акцептора кислоты. Полезными акцепторами кислоты являются обычные основания, такие как карбонаты, бикарбонаты и гидроксиды щелоч 000620 ных или щелочно-земельных металлов, а также органические основания, такие как триалкиламины и триалканоламины. Реакционной средой для таких реакций может служить любой подходящий органический растворитель, инертный к основным условиям,например, как могут легко понять органохимики, подходящими растворителями являются ацетонитрил, сложные эфиры, такие как этилацетат и тому подобное, и галогенированные алканы. Обычно реакции проводят при повышенных температурах в пределах от температуры окружающей среды до температуры кипения реакционной смеси с обратным стоком, в частности от примерно 50 до примерно 100C. Способы синтеза Het-интермедиатов,как и способы получения их выделенных энантиомеров, описаны в литературе, и читатель может легко ее получить. Интермедиаты,в которых Х представляет метокси, (Hetокси)метоксиалканы, лучше всего получать из диметилметоксиалкандикарбоновой кислоты, которую сначала обрабатывают литийалюминийгидридом с получением (после резкого охлаждения избыточного реагента) дигидроксиметоксиалкана. Этот интермедиат преобразуют в дитозилат, который подвергают взаимодействию с гидрокси-Het с получением целевого интермедиата, имеющего тозил-защитную группу на конце алкана. Реакцию с интермедиатом, составляющим группуR, осуществляют, как обычно при использовании этого интермедиата. Аналогичным образом, все интермедиаты, представляющие собой аминосодержащие группы R, получают традиционными методами, которые можно найти в литературе. Особо следует упомянуть о несколько необычных спирогруппах формулы V, где А представляет группу формулы VIII. Способы их получения найдены в литературе, в связи с чем можно указать следующие полезные статьи:Marxer, et al., J. Org. Chem., 40, 14271433, (1975),Parham, et al., J. Огg. Chem., 41, 26282635, (1976),Yamato, et al., J. Med. Chem., 24, 194-198,(1981),Evans, еt al., J. Med. Chem., 35, 39193927, (1992),Efange, et al., J. Med. Chem., 37, 25742582, (1994),Chambers, et al., J. Med. Chem., 35, 20332039, (1992). Спиропиперидиновые интермедиаты получают, как правило, путем осуществления взаимодействия 4-пиперидинона или пиперидина, имеющего активированную группу в положении 4, с реагентом, который может атаковать положение 4 пиперидина с образованием обязательно циклической структуры. 29 Например, когда группа, присоединенная спиросвязью к пиперидину, представляет собой дигидрофурановое кольцо, исходным материалом является N-алкилированный-4 пиперидинон, который подвергают взаимодействию с N,N-двухзамещенным бензамидом или нафтиламидом, несущим необходимые заместители на фенильных или нафтильных кольцах. Сначала реагируют амид с алкиллитиевым реагентом с образованием металлированного производного. Взаимодействие этого производного с пиперидиноном приводит к атаке на кетон пиперидинона. Вторая стадия резкого охлаждения протонным источником, в частности разбавленной минеральной кислотой, циклизирует дигидрофурановое кольцо с сохранением в нем присоединенной оксогруппы. При необходимости продукт может быть восстановлен, например, путем обработки бораном, а азот пиперидина деалкилируют избытком 1 хлорэтилхлорформиатом. Затем спироинтермедиат подвергают взаимодействию непосредственно с индольным интермедиатом. Когда группой, присоединяющей пиперидин, является дигидротиенильная группа,способ синтеза используют тот же самый, но исходным материалом является фенильное или нафтильное соединение, имеющее 1 меркаптометильную группу. Бром или другая сильная уходящая группа находится в положении орто по отношению к меркаптометильной группе. Реакция с пиперидиноном с последующим резким охлаждением кислотой Льюиса или протонной кислотой дает целевую бензодигидротиенильную или нафтодигидротиенильную спирогруппу. Способ получения пирановой и дигидропирановой спирогрупп осуществляют по существу так же,но начинают с соединения, имеющего 1 гидроксиметильную, а не 1-меркаптометильную группу. Заместители в спиропиперидиновых группах формулы VIII, если процесс начинают не с фенильного или нафтильного исходного материала, могут быть введены на более поздних стадиях в соответствии с традиционными способами. Спиросоединения формулы VIII, содержащие инданильную, инденильную или тетралинильную группу, получают непосредственно из соответствующего индана, индена или тетралина, активированного в требуемом месте присоединения путем образования соли, обработкой сильным основанием, таким,как гексаметилдисилиламид калия, которое подвергают взаимодействию с ди(2 хлорэтил)амином, несущим защитную группу, такую как трет-бутоксикарбонил, на атоме азота. Целевой спиропиперидин получают в одну стадию, но с сохранением защитной группы на азоте пиперидина. Снятие защиты традиционным способом дает целевой интермедиат. Аналогичным образом, спироинтермедиаты, имеющие пирролидинильную, дигидроиндолинильную или нафтодигидропирролильную группу, получают путем осуществления взаимодействия 2-оксопирролидина,имеющего защитную группу на азоте, такую как трет-бутоксикарбонил, с защищенным ди(2-хлорэтил)амином. Получают целевой спиропиперидин с оксогруппой на 5-членном кольце и защитной группой на азоте пиперидина. Сняв традиционным способом защиту,можно при желании восстановить оксогруппу литийалюминийгидридом или другим традиционным агентом. Следующие далее"Получения" дополнительно иллюстрируют синтез таких интермедиатов. Важную группу соединений, в которыхR представляет пиперидин или тетрагидропиридин формулы III и R3 представляет циклическую группу, такую как нафтил или индол,легко получают путем достраивания группыR, защиты азота пиперидина или тетрагидропиридина, когда необходимо во время синтеза, и осуществления, как описано выше,взаимодействия ее с оксиранильным интермедиатом или алкокси-Het, несущим атом хлора или другую уходящую группу. Таким образом, общий способ получения предлагаемых соединений имеет два основных варианта, которые коротко можно описать следующим образом: где Z представляет уходящую группу соединения формул I, XI, XII и XIII соединения формул I, XI, XII и XIII,где s представляет О и X представляет гидрокси. Думается, что все химические названия,использованные в данном описании, недвусмысленны. Однако в примерах, в которых сложная структура, приведенная в качестве примера, появляется впервые, даны рисунки различных сложных групп R. 31 В следующих далее "Примерах" и "Получениях" сокращение ПДМС означает массспектроскопию с полевой десорбцией. Первая группа получений иллюстрирует процессы синтеза спиропиперидиновых интермедиатов, используемых для получения соединений, в которых R имеет формулу V и А имеет формулу VIII. Получение 1. Получение 4-метоксиспиро[бензодигидрофуран-1(3 Н),4'-пиперидин]-3-она. В трехгорлую колбу загружали 2 метокси-N,N-диэтилбензамид (11,45 г, 55,3 ммоль), 90 мл тетрагидрофурана (ТГФ) иN,N,N',N'-тетраметилэтилендиамин (TMEDA,ТМЭДА) (1,0 эквивалент). Смесь охлаждали до 78 С, добавляли по каплям вторбутиллитий (1,5 эквив. 1,3 М раствора в циклогексане) и перемешивали смесь в течение часа. Медленно добавляли (при низкой температуре) раствор 1-метил-4-пиперидона(6,57 г, 1 эквив.) в 45 мл ТГФ. Убирали охлаждающую баню и давали смеси постоять при комнатной температуре в течение 12 ч. Добавляли 5 н. хлороводородную кислоту (60 мл) и разделяли водный и органический слой. Органический слой опять промывали 1 н. хлороводородной кислотой, водные слои объединяли, обрабатывали насыщенным водным раствором гидроксида аммония и экстрагировали хлороформом. Органический слой промывали рассолом и сушили над сульфатом натрия. Смесь концентрировали и очищали путем колоночной хроматографии на силикагеле (градиент элюента: 2-5% метанол в дихлорметане) с получением N-метилированного производного указанного в заголовке соединения. Его растворяли в 1,2 дихлорэтане, охлаждали до 0 С и, обработав избыточным 1-хлорэтилхлорформиатом, давали согреться до комнатной температуры,после чего нагревали с обратным холодильником в течение 12 ч. Смесь охлаждали до 0 С и концентрировали в растворе, добавляли метанол (50 мл) и продолжали нагревать еще 3,5 ч, после чего смесь охлаждали до комнатной температуры, разбавляли водой, обрабатывали насыщенным водным раствором гидроксида аммония и экстрагировали хлороформом. Органический слой отделяли, промывали рассолом, сушили над сульфатом натрия, концентрировали и очищали путем колоночной хроматографии на силикагеле(2% метанол в дихлорметане), получив в результате 4,5 г (выход 31% за две стадии) указанного в заголовке соединения в виде смолистого твердого вещества. ПДМС (м/е = 233). Получение 2. Получение 4-метоксиспиро[бензодигидрофуран-1(3 Н),4'-пиперидина]. В трехгорлую колбу загружали 2 метокси-N,N-диэтилбензамид (11,45 г, 55,3 ммоль), 90 мл тетрагидрофурана (ТГФ) иN,N,N',N'-тетраметилэтилендиамин (TMEDA,ТМЭДА) (1,0 эквивалент). Смесь охлаждали до 78 С, добавляли по каплям вторбутиллитий (1,5 эквив. 1,3 М раствора в циклогексане) и перемешивали смесь в течение часа. Медленно добавляли (при низкой температуре) раствор 1-метил-4-пиперидона(6,57 г, 1 эквив.) в 45 мл ТГФ. Убирали охлаждающую баню и давали смеси постоять при комнатной температуре в течение 12 ч. Добавляли 5 н. хлороводородную кислоту (60 мл) и разделяли водный и органический слои. Органический слой опять промывали 1 н. хлороводородной кислотой, водные слои объединяли, обрабатывали насыщенным водным раствором гидроксида аммония и экстрагировали хлороформом. Органический слой промывали рассолом и сушили над сульфатом натрия. Смесь концентрировали и очищали путем колоночной хроматографии на силикагеле (градиент элюента: 2-5% метанол в дихлорметане) с получением N-метил-3 кетопроизводного указанного в заголовке соединения, которое растворяли в 70 мл безводного тетрагидрофурана, охлаждали до 0 С и обрабатывали 2,5 эквивалентами борана (1 М раствор в ТГФ). Смеси давали согреться до комнатной температуры, после чего нагревали с обратным холодильником в течение 12 ч. Смесь охлаждали до 0 С, добавляли к охлажденной смеси 5 н. хлороводородную кислоту(14 мл) и затем продолжали нагревание смеси с обратным холодильником в течение еще 5 ч. Смесь охлаждали, концентрировали и распределяли между водой и диэтиловым эфиром. Отделяли органическую фазу и водную фазу обрабатывали концентрированным раствором гидроксида аммония и экстрагировали эфиром. Объединенный органический слой промывали рассолом, сушили над сульфатом натрия и очищали путем колоночной хроматографии на силикагеле (элюент: 2% метанол в дихлорметане),с получениемNметилированного производного указанного в заголовке соединения, которое растворяли в 1,2-дихлорэтане, охлаждали до 0 С и, обработав избыточным 1-хлорэтилхлорформиатом,давали согреться до комнатной температуры,после чего нагревали с обратным холодильником в течение 12 ч. К смеси добавляли метанол (50 мл) и продолжали нагревать ее еще 3,5 ч, после чего смесь охлаждали до комнатной температуры, разбавляли водой, обрабатывали насыщенным водным раствором гидроксида аммония и экстрагировали хлороформом. Органический слой отделяли, промывали рассолом, сушили над сульфатом натрия, концентрировали и очищали путем колоночной хроматографии на силикагеле(2% метанол в дихлорметане), получив в результате 2,25 г (выход 19% за три стадии) указанного в заголовке соединения в виде смолистого твердого вещества. ПДМС (м/е = 219). Получения 3-18. Следующие производные получали так же, как в получениях 1 и 2, использовав в качестве исходного материала соответственно замещенное производное Пример 1. Получение (2S)-(-)-1-(4-индолилокси)-3(4-[1-бензил]-пиперидиниламино)-2 пропанола. Раствор (S)-(+)-4-(оксиранилметокси)1H-индола (400 мг, 2,1 ммоль) и 4-амино-1 бензилпиперидина (443 мг, 2,1 ммоль) в 10 мл метанола нагревали с обратным холодильником в течение 18 ч. Раствор охлаждали, концентрировали и очищали путем колоночной хроматографии (градиент растворителя: дихлорметан-5% метанол в дихлорметане), получив в результате 618 мг (78%) указанного в заголовке соединения в виде аморфного твердого вещества. ПДМС m/е = 379 (М+ свободного основания). [D]589 = 8,90 (с = 0,52,хлороформ). Анализ Вычислено Найдено С 72,79 72,69 Н 7,70 7,42N 11,07 11,02 Пример 2. Получение (2S)-(-)-1-(4-индолилокси)-3(6-(12-азадиспиро-[4.1.4.2]тридекан-13 он)амино)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 6-амино-12 азадиспиро[4.1.4.2]тридекан-13-она. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 68%. Т. пл. 115-117 С. ПДМС m/е = 397 (М+ свободного основания). [D]589 = 5,11 (с = 1,02, метанол). Анализ Вычислено Найдено С 61,59 61,44 Н 6,82 7,04 группа R Пример 3. Получение (2S)-(-)-1-(4-индолилокси)-3(4-[2,2,6,6-тетраметил]пиперидиниламино)-2 пропанола. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-амино 2,2,6,6-тетраметилпиперидина с выходом 68%. ПДМС m/e = 345 (М+ свободного основания). [D]589 = 2,54 (с = 0,9, метанол). Анализ Вычислено Найдено С 69,53 69,77 Н 9,04 9,17 35 Пример 4. Получение (2S)-(-)-1-(4-инолилокси)-3(3-(10,11-дигидро-5 Н-дибенз[b,f]азепин-5 ил)пропиламино)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 3-(10,11 дигидро-5 Н)-дибенз[b,f]азепин-5-ил-пропанамина с общим выходом 53%. ПДМС m/e = 441 (М+ свободного основания). [D]589 = 19,48 (с = 0,62, метанол). Пример 5. Получение (2S)-(-)-1-(4-индолилокси)-3(2-тетрагидрофурфуриламино)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 2-тетрагидрофурфуриламина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 49%. Т. пл. 112-114 С. ПДМС m/e = 290 (М+ свободного основания). [D]589 = 12,79 (с = 1,0,метанол). Анализ Вычислено Найдено С 56,84 56,59 Н 6,36 6,39N 7,36 7,66 Пример 6. Получение (2S)-(-)-1-(4-индолилокси)-3(3-[N-морфолино]-пропиламино)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 3-(Nморфолино)пропиламина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 33%. Т. пл. 120-121 С. ПДМС m/e = 333 (М+ свободного основания). [D]589 = 20,8 (с = 0,6, метанол). Анализ Вычислено Найдено С 56,73 56,87 Н 6,90 6,96N 9,92 9,77 Пример 7. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(формил)-пиперазин-1-ил)-2-пропанола. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 1-формилпиперазина с выходом 86%. Т. пл. 106-107C. ПДМС m/e = 303 (М+ свободного основания).[D]589 = 1,98 (с = 1,0, метанол). Анализ Вычислено Найдено С 63,35 62,13 Н 6,98 7,11 Пример 8. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(2-пиридил)пиперазин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 1-(2 пиридил)пиперазина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 90%. ПДМС= 31,14 (с = 0,86, метанол). Анализ Вычислено Найдено С 59,72 59,43 Н 5,92 6,13N 12,66 12,79 Пример 9. Получение (2S)-(-)-1-(4-индолилокси)-3(4-[(2,3-дигидро-1,4-бензодиоксин-2-ил)метил]пиперазин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 1-[(2,3 дигидро-1,4-бензодиоксин-2-ил)метил]пиперазина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 77%. ПДМС m/e = 423(с = 0,82, метанол). Анализ Вычислено Найдено С 60,81 60,59 Н 6,08 6,19N 8,18 7,79 Пример 10. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(2,6-диметилфенил)пиперазин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 1-(2,6 диметилфенил)пиперазина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 50%. ПДМС m/e = 379 (М+ свободного основания). [D]589 = 11,89 (с = 0,47, метанол). Анализ Вычислено Найдено С 63,95 63,93 Н 6,65 6,36N 8,95 8,64 Пример 11. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(2,3-диметилфенил)пиперазин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 1-(2,3 диметилфенил)пиперазина. Полученное свободное основание растворяли в этилацетате и 37 осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 83%. ПДМС m/e = 379 (М+ свободного основания). [D]589 = 9,84 (с = 0,75, метанол). Анализ Вычислено Найдено С 63,95 63,60 Н 6,65 6,72N 8,95 8,91 Пример 12. Получение (2S)-(-)-1-(4-индолилокси)-3(4-бис(4-фторфенил)метиленпиперидин-1 ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(бис(4 фторфенил)метиленпиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 88%. ПДМС m/e = 474 (М+ свободного основания). [D]589 = 8,49 (с = 0,71, метанол). Анализ Вычислено Найдено С 65,95 65,75 Н 5,36 5,55N 4,96 4,61 Пример 13. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(4-хинолинил)пиперазин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 1-(4 хинолинил)пиперазина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 64%. Т. пл. 150-151C. ПДМС m/e = 402 (М+ свободного основания). [D]589 = 12,41 (с = 0,76, метанол). Анализ Вычислено Найдено С 63,40 63,10 Н 5,73 5,50N 11,37 11,25 Пример 14. Получение (2S)-(-)-1-(4-индолилокси)-3(4-бис(4-хлорфенил)метилпиперазин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1 Н-индола и 1-(бис(4 хлорфенил)метилпиперазина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 82%. Т. пл. 123-124C. ПДМС m/e = 510 (М+ свободного основания). [D]589 = 8,46 (с = 0,89, метанол). Анализ Вычислено Найдено С 60,00 59,72 Н 5,20 5,50 Пример 15. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(4-трифторметилфенил)пиперазин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 1-(4 трифторметилфенил)пиперазина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 89%. ПДМС m/e = 419 (М+ свободного основания). [D]589 = 7,78 (с = 0,72, метанол). Анализ Вычислено Найдено С 56,58 56,51 Н 5,14 5,44N 8,25 7,96 Пример 16. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(2-трифторметилфенил)пиперазин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 1-(2 трифторметилфенил)пиперазина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 70%. Т. пл. 123-124C. ПДМС m/e = 419 (М+ свободного основания). [D]589 = 7,01 (с = 0,66, метанол). Анализ Вычислено Найдено С 56,58 56,82 Н 5,14 5,32N 8,25 8,05 Пример 17. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(3-бромфенил)пиперазин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 1-(3-бромфенил)пиперазина. Полученное своободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 84%. Т. пл. 144-145 С. ПДМС m/e = 429 (М+ свободного основания). [D]589 = 8,12 (с = 0,81, метанол). Анализ Вычислено Найдено С 53,09 53,07 Н 5,04 5,29N 8,07 7,99 Пример 18. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(трет-бутил)пиперазин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 1-(4-третбутил)пиперазина. Полученное свободное 39 основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 75%. Т. пл. 179-180C. ПДМС m/e = 331 (М+ свободного основания). [D]589 = 4,73 (с = 0,93, метанол). Анализ Вычислено Найдено С 59,84 59,70 Н 7,41 7,17N 9,97 9,74 Пример 19. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(3,4-дихлорфенил)пиперазин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 1-(3,4 дихлорфенил)пиперазина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 87%. ПДМС m/e = 419 (М+ свободного основания). [D]589 = 7,76 (с = 0,82, метанол). Анализ Вычислено Найдено С 54,13 54,43 Н 4,94 5,03N 8,23 8,32 Пример 20. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(изопропил)пиперазин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 1-(4 изопропил)пиперазина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 65%. Т. пл. 150-152C. ПДМС m/e = 317 (М+ свободного основания). [D]589 = 6,63 (с = 0,99, метанол). Анализ Вычислено Найдено С 58,96 58,68 Н 7,17 6,87N 10,31 10,07 Пример 21. Получение (2S)-(-)-1-(4-индолилокси)-3(4-фенилпиперидин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-фенилпиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 80%. ПДМС m/e = 351 (М+ свободного основания). [D]589 = 15,49 (с = 0,86, метанол). Анализ Вычислено Найдено С 65,44 65,48N 6,36 6,06 Пример 22. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(3-фенилпропил)пиперидин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(3-фенилпропил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 73%. ПДМС= 13,53 (с = 0,58, метанол). Анализ Вычислено Найдено С 67,20 67,50 Н 7,10 7,14N 5,80 5,62 Пример 23. Получение (2S)-(-)-1-(4-индолилокси)-3([4-(пиридазин-3-он-6-ил)фенил]пиперидин 1-ил)-2-пропанола. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-[4-(пиридазин-3-он-6-ил)фенил]пиперидина с выходом 72%. Т. пл. 202-203C. ПДМС m/e = 446= 0,84, метанол). Анализ Вычислено Найдено С 69,93 69,84 Н 6,77 6,92N 12,55 12,80 Пример 24. Получение (2S)-(-)-1-(4-индолилокси)-3(4-гидрокси-4-(3-трифторметилфенил)пиперидин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-гидрокси 4-(3-трифторметилфенил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 59%. ПДМС m/e = 426 (М+ свободного основания). [D]589 = 11,39 (с = 0,56,метанол). Анализ Вычислено Найдено С 57,25 57,11 Н 5,19 4,98N 5,34 5,14 Пример 25. Получение (2S)-(-)-1-(4-индолилокси)-3(4,4-дифенилпиперидин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4,4 дифенилпиперидина. Полученное свободное основание растворяли в этилацетате и осаж 41 дали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 60%. Т. пл. 198-199C. ПДМС m/e = 426 (М+ свободного основания). [D]589 = 17,80 (с = 0,66, метанол). Анализ Вычислено Найдено С 69,75 69,83 Н 6,24 6,29N 5,42 5,08 Пример 26. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(10,11-дигидро-5 Н-дибензо[а,d]циклогептен-5-ил)пиперидин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(10,11 дигидро-5 Н-дибензо[a,d]циклогептен-5 ил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 89%. ПДМС= 10,02 (с = 0,72, метанол). Анализ Вычислено Найдено С 71,20 71,03 Н 6,52 6,84N 5,03 4,72 Пример 27. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(3-(1,2,4-триазоло-[3,4-b]бензотиазолил)пиперазин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 1-(3-(1,2,4 триазоло[3,4-b]бензотиазолил)пиперазина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 56%. ПДМС m/e = 448 (М+ свободного основания). [D]589 = 10,42 (с = 0,50, метанол). Анализ Вычислено Найдено С 55,75 55,72 Н 4,87 4,98 Пример 28. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(дифенилметил)пиперидин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(дифенилметил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 81%. Т. пл. 160-161C. ПДМС m/e = 441 (М+ свободного основания). [D]589 = 8,71 (с = 0,89, метанол). Анализ Вычислено Найдено С 70,17 69,98 Н 6,46 6,75N 5,28 4,93 Пример 29. Получение (2S)-(-)-1-(4-индолилокси)-3(4-гидрокси-4-(4-фторфенил)пиперидин-1 ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-гидрокси 4-(4-фторфенил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 77%. ПДМС m/e = 384 (М+ свободного основания). [D]589 = 11,40 (с = 0,66, метанол). Анализ Вычислено Найдено С 60,75 60,46 Н 5,74 5,79N 5,90 5,64 Пример 30. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(4-метоксифенил)пиперидин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(4 метоксифенил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 66%. ПДМС m/e = 380 (М+ свободного основания). [D]589 = 11,77 (с = 0,61, метанол). Анализ Вычислено Найдено С 63,82 63,61 Н 6,43 6,65N 5,95 5,67 Пример 31. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(3-трифторметилфенил)пиперидин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(3 трифторметилфенил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 50%. ПДМС m/e= 419 (М+ свободного основания). [D]589 = 11,62 (с = 0,45, метанол). Анализ Вычислено Найдено С 59,05 59,15N 5,51 5,26 Пример 32. Получение (2S)-(-)-1-(4-индолилокси)-3(4-бис(4-фторфенил)метилпиперидин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(бис(4 фторфенил)метилпиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 64%. ПДМС m/e= 476 (М+ свободного основания). [D]589 = 9,85 (с = 0,89, метанол). Анализ Вычислено Найдено С 65,71 65,46 Н 5,69 5,95N 4,94 4,74 Пример 33. Получение (2S)-(-)-1-(4-индолилокси)-3(4-гидрокси-4-фенилпиперидин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-гидрокси 4-фенилпиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 69%. ПДМС= 10,45 (с = 0,61, метанол). Анализ Вычислено Найдено С 63,15 62,81 Н 6,18 6,08N 6,14 5,99 Пример 34. Получение (2S)-(-)-1-(4-индолилокси)-3(4-гидрокси-4-(3-метоксифенил)пиперидин-1 ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-гидрокси 4-(3-метоксифенил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 76%. ПДМС m/e = 396 (М+ свободного основания). [D]589 = 8,13 (с = 0,69, метанол). Анализ Вычислено Найдено С 61,73 61,51 Н 6,21 6,18N 5,76 5,59 Пример 35. Получение (2S)-(-)-1-(4-индолилокси)-3(4-пиперидин-1-ил)-пиперидин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(пиперидин-1-ил)пиперидина. Полученное свобод 000620 ное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 60%. Т. пл. 220-221C. ПДМС m/e = 358 (M+ свободного основания). Анализ Вычислено Найдено С 61,73 61,33 Н 7,43 7,06N 9,39 8,96 Пример 36. Получение (2S)-(-)-1-(4-индолилокси)-3(спиро[бензодигидрофуран-3-он-1(3 Н),4'пиперидин]-1'-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и спиро[бензодигидрофуран-3-он-1(3 Н),4'-пиперидина]. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 73%. Т. пл. 198-199C. ПДМС= 12,04 (с = 0,85, метанол). Анализ Вычислено Найдено С 62,23 62,10 Н 5,43 5,39 группа R Пример 37. Получение (2S)-(-)-1-(4-индолилокси)-3(спиро[бензодигидрофуран-1(3 Н),4'-пиперидин]-1'-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и спиро[бензодигидрофуран-1(3 Н),4'-пиперидина]. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 85%. ПДМС m/e = 378 (М+ свободного основания). [D]589 = 10,28 (с = 0,45, метанол). Анализ Вычислено Найдено С 64,09 63,92 Н 6,02 6,26N 5,98 5,93 Пример 38. Получение (2S)-(-)-1-(4-индолилокси)-3(4-феноксипиперидин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(фенокси)пиперидина. Полученное свободное осно 45 вание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 69%. ПДМС= 14,29 (с = 0,5, метанол). Анализ Вычислено Найдено С 63,15 63,89 Н 6,18 6,08N 6,14 5,94 Пример 39. Получение (2S)-(-)-1-(4-индолилокси)-3(4-[1-(2-фенил)-бензимидазолил]пиперидинил-1)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(1-(2 фенил)бензимидазолил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 71%. Т. пл. 168-170C. ПДМС m/e = 466 (М+ свободного основания). [D]589 = 8,44 (с = 0,59, метанол). Анализ Вычислено Найдено С 66,89 66,51 Н 5,80 5,87N 10,07 9,77 Пример 40. Получение (2S)-(-)-1-(4-индолилокси)-3(4-[5-хлор-1-индол-2-он]пиперидин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(5-хлор-1 индол-2-он)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 59%. Т. пл. 230-231C. ПДМС m/e = 439 (М+ свободного основания). Анализ Вычислено Найдено С 58,93 59,13 Н 5,33 5,41N 7,93 8,10 Пример 41. Получение (2S)-(-)-1-(4-индолилокси)-3(4-[2-(1-метил)-бензимидазолил]пиперидин 1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(2-(1 метил)бензимидазолил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 70%. ПДМС m/e = 404 (М+ свободного основания). [D]589 = 6,04 (с = 0,53,метанол). Анализ Вычислено Найдено С 63,15 63,09N 11,33 11,43 Пример 42. Получение (2S)-(-)-1-(4-индолилокси)-3(4-фенил-4-(4-трифторметилфенокси)пиперидин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-фенил-4(4-трифторметилфенокси)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 49%. ПДМС m/e = 510 (М+ свободного основания). [D]589 = 11,99 (с = 0,42,метанол). Анализ Вычислено Найдено С 62,00 61,82 Н 5,20 5,43N 4,66 4,58 Пример 43. Получение (2S)-(-)-1-(4-индолилокси)-3(1-гептаметиленимино-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и гептаметиленимина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 62%. ПДМС m/e = 302 (М+ свободного основания). [D]589 = 13,48 (с = 0,61, метанол). Анализ Вычислено Найдено С 61,21 60,98 Н 7,19 7,35N 7,14 6,89 Пример 44. Получение (2S)-(-)-1-(4-индолилокси)-3(1-азабицикло[3,2,2]нонанил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 1-азабицикло[3,2,2]нонана. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 85%. ПДМС= 20,39 (с = 0,48, метанол). Анализ Вычислено Найдено С 62,36 62,09 Н 6,98 6,94N 6,93 6,59 Пример 45. Получение (2S)-(-)-1-(4-индолилокси)-3(4-гидрокси-4-(4-хлорфенил)пиперидин-1 ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-гидрокси 47 4-(4-хлорфенил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 83%. ПДМС m/e = 401 (М+ свободного основания). [D]589 = 14,17 (с = 0,45, метанол). Анализ Вычислено Найдено С 58,72 59,06 Н 5,54 5,66N 5,71 5,54 Пример 46. Получение (2S)-(-)-1-(4-индолилокси)-3(4-[1-бензимидазол-2-он]пиперидин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(1-бензимидазол-2-он)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 88%. Т. пл. 123-125C. ПДМС m/e = 406 (М+ свободного основания). [D]589 = 17,22 (с = 0,48, метанол). Анализ Вычислено Найдено С 60,48 60,38 Н 5,68 5,86N 11,28 11,32 Пример 47. Получение (2S)-(-)-1-(4-индолилокси)-3(4-циано-4-фенилпиперидин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-циано-4 фенилпиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 57%. ПДМС= 12,76 (с = 0,48, метанол). Анализ Вычислено Найдено С 64,51 64,37 Н 5,85 6,00N 9,03 8,71 Пример 48. Получение (2S)-(-)-1-(4-индолилокси)-3(4-гидрокси-4-(4-бромфенил)пиперидин-1 ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-гидрокси 4-(4-бромфенил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 80%. ПДМС m/e = 444, 446 (М+ свободного основания). [D]589 = 7,52 (с = 0,45,метанол). Анализ Вычислено Найдено С 59,33 59,54 Н 5,66 5,56N 6,29 5,98 Пример 49. Получение (2S)-(-)-1-(4-индолилокси)-3(4-гидрокси-4-(3-трифторметил-4-хлорфенил)пиперидин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-гидрокси 4-(3-трифторметил-4-хлорфенил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 85%. ПДМС m/e = 469 (М+ свободного основания). [D]589 = 11,53 (с = 0,54, метанол). Анализ Вычислено Найдено С 53,72 53,53 Н 4,69 5,01N 5,01 4,83 Пример 50. Получение (2S)-(-)-1-(4-индолилокси)-3(4-спиро[9 Н-флуорен-9,4']гексаметиленимино-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-спиро[9 Нфлуорен-9,4']гексаметиленимина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 64%. ПДМС m/e = 438 (М+ свободного основания). Т. пл. 131-133 С. [D]589 = 10,78(с = 0,43, метанол). Анализ Вычислено Найдено С 70,44 70,38 Н 6,10 6,34 Пример 51. Получение (2S)-(-)-1-(4-индолилокси)-3(транс-4-(3-гидроксифенил)-3-метил-4 пропилпиперидин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и транс-4-(3 гидроксифенил)-3-метил-4-пропилпиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 79%. Т. пл. 116-118C.[D]589 = 9,85 (с = 1,02, метанол). Анализ Вычислено Найдено С 65,61 65,77 Н 7,08 7,09N 5,46 5,17 Пример 52. Получение (2S)-(-)-1-(4-индолилокси)-3(3,3-дифенилпирролидин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 3,3 дифенилпирролидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 68%. ПДМСm/e = 412 (М+ свободного основания). Т. пл. 193-194C. [D]589 = 9,11 (с = 0,33, метанол). Анализ Вычислено Найдено С 69,31 69,06 Н 6,02 5,94N 5,57 5,43 Пример 53. Получение (2S)-(-)-1-(4-индолилокси)-3(4,4-дифенилгексаметиленимино-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4,4 дифенилгексаметиленимина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 60%. ПДМС m/e= 440 (М+ свободного основания). Т. пл. 103-104 С. [D]589 = 9,11 (с = 0,39, метанол). Анализ Вычислено Найдено С 70,17 70,04 Н 6,46 6,71N 5,28 4,93 Пример 54. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(4-метилфенил)пиперидин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(4 метилфенил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 78%. ПДМС m/e = 364 (М+ свободного основания). [D]589 = 11,77 (с = 0,34, метанол). Анализ Вычислено Найдено С 66,06 66,19 Н 6,65 6,81 Пример 55. Получение (2S)-(-)-1-(4-индолилокси)-3(2,3,4,5-тетрагидро-1H-3-бензазепин-3-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 2,3,4,5 тетрагидро-1H-3-бензазепина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 73%. ПДМС m/e= 336 (М+ свободного основания). [D]589 = 14,17 (с = 0,61, метанол). Анализ Вычислено Найдено С 64,78 64,48 Н 6,14 5,84N 6,57 6,64 Пример 56. Получение (2S)-(-)-1-(4-индолилокси)-3(7,8-диметокси-2,3,4,5-тетрагидро-1 Н-3 бензазепин-3-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 7,8 диметокси-2,3,4,5-тетрагидро-1 Н-3-бензазепина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 48%. ПДМС m/e = 396 (М+ свободного основания). [D]589 = -9,34 (с = 0,47, метанол). Анализ Вычислено Найдено С 61,72 61,76 Н 6,21 6,60N 5,76 5,91 Пример 57. Получение (2S)-(-)-1-(4-индолилокси)-3(6,7-дихлор-2,3,4,5-тетрагидро-1H-3-бензазепин-3-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 6,7-дихлор 2,3,4,5-тетрагидро-1 Н-3-бензазепина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 77%. ПДМС m/e = 405 (М+ свободного основания). [D]589 = 6,87 (с = 0,44,метанол). Анализ Вычислено Найдено С 55,77 55,70 Н 4,88 5,14N 5,65 5,69 Пример 58. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(2-фторфенил)пиперидин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(2 фторфенил)пиперидина. Полученное свобод 51 ное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 40%. ПДМС m/e = 368 (М+ свободного основания). [D]589 = 12,31 (с = 0,61, метанол). Анализ Вычислено Найдено С 62,87 62,93 Н 5,94 6,13N 6,11 5,96 Пример 59. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(2-метоксифенил)пиперидин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(2 метоксифенил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 37%. ПДМС m/e = 380 (М+ свободного основания). [D]589 = 14,83 (с = 0,81, метанол). Анализ Вычислено Найдено С 63,82 63,87 Н 6,43 6,58N 5,95 5,53 Пример 60. Получение (2S)-(-)-1-(4-индолилокси)-3(бензо[с]спиро[бензодигидрофуран-1(3 Н),4'пиперидин]-3-он-1'-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и бензо[с]спиро[бензодигидрофуран-1(3 Н),4'пиперидин]-3-она. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 87%. ПДМС= 2,92 (с = 1,02, метанол). Анализ Вычислено Найдено С 65,41 65,31 группа R Пример 61. Получение (2S)-(-)-1-(4-индолилокси)-3(5-метоксиспиро-[бензодигидрофуран-1(3 Н),4'-пиперидин]-3-он-1'-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 5-меток 000620 сиспиро[бензодигидрофуран-1(3 Н),4'-пиперидин]-3-она. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 40%. Т. пл. 195-197 С. ПДМС m/e = 422 (М+ свободного основания). Анализ Вычислено Найдено С 60,93 60,61 Н 5,51 5,89N 5,47 5,71 Пример 62. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(4-трифторметоксифенил)пиперидин-1 ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(4 трифторметоксифенил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 76%. ПДМС m/e = 434 (М+ свободного основания). [D]589 = 13,45 (с = 1,04,метанол). Анализ Вычислено Найдено С 57,25 56,99 Н 5,19 5,43N 5,34 5,04 Пример 63. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(3,4-метилендиокси)-фенил)пиперидин-1 ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(3,4 метилендиоксифенил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 71%. ПДМС m/e = 394 (М+ свободного основания). [D]589 = 15,73 (с = 1,02, метанол). Анализ Вычислено Найдено С 61,98 61,65 Н 5,82 5,89N 5,78 5,44 Пример 64. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(2-нафтил)пиперидин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(2 нафтил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 74%. Т. пл. 171-172 С. ПДМС m/e = 400 (М+ свободного основания). [D]589 = 13,51 (с = 1,04, метанол). 53 Анализ Вычислено Найдено С 68,56 68,28 Н 6,16 6,45N 5,71 5,51 Пример 65. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(4-трифторметилфенил)пиперидин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(4 трифторметилфенил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 34%. ПДМС m/e = 419 (М+ свободного основания). [D]589 = 10,15 (с = 0,47, метанол). Анализ Вычислено Найдено С 59,05 59,04 Н 5,35 5,32N 5,51 5,03 Пример 66. Получение (2S)-(-)-1-(4-индолилокси)-3(3,3-диметилспиро-[бензодигидрофуран 1(3 Н),4'-пиперидин]-1'-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 3,3 диметилспиро[бензодигидрофуран-1(3 Н),4'пиперидина]. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 52%. ПДМС m/e = 406 (М+ свободного основания). [D]589 = 11,87 (с = 0,72, метанол). Анализ Вычислено Найдено С 65,31 65,28 Н 6,50 6,58N 5,64 5,43 Пример 67. Получение (2S)-(-)-1-(4-индолилокси)-3(спиро[бензодигидротиофен-1(3 Н),4'-пиперидин]-1'-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и спиро[бензодигидротиофен-1(3 Н),4'-пиперидина]. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 70%. ПДМС m/e = 394 (М+ свободного основания). [D]589 = 10,86 (с = 0,40, метанол). Анализ Вычислено Найдено С 61,97 61,73 Н 5,82 5,89 Пример 68. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(4-фторфенил)пиперидин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(4 фторфенил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 30%. ПДМС m/e = 369 (М+ свободного основания). [D]589 = 2,49 (с = 0,24, метанол). Анализ Вычислено Найдено С 62,87 62,61 Н 5,94 5,73N 6,11 5,82 Пример 69. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(3-метоксифенил)пиперидин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(3 метоксифенил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 30%. Т. пл. 121-123C. ПДМС m/e = 381 (М+ свободного основания). [D]589 = 12,69 (с=0,53, метанол). Анализ Вычислено Найдено С 63,82 63,59 Н 6,43 6,51N 5,95 5,90 Пример 70. Получение (2S)-(-)-1-(4-индолилокси)-3(спиро[индан-1,4'-пиперидин]-1'-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и спиро[индан-1,4'-пиперидина]. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 76%. Т. пл. 110-112C. ПДМС m/e = 376(М+ свободного основания). [D]589 = 11,60 (с = 0,46, метанол). Анализ Вычислено Найдено С 66,94 66,64 Пример 71. Получение (2S)-(-)-1-(4-индолилокси)-3(спиро[1H-инден-1,4'-пиперидин]-1'-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и спиро[1 Нинден-1,4'-пиперидина]. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 80%. Т. пл. 119-120 С. ПДМС m/e = 374 (М+ свободного основания). [D]589 = 5,51 (с = 0,47, метанол). Анализ Вычислено Найдено С 67,23 66,91 Н 6,08 6,11 группа R Пример 72. Получение (2S)-(-)-1-(4-индолилокси)-3(4-спиро[9 Н-флуорен-9,4']-пиперидин-1-ил)2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и спиро-[9 Нфлуорен-9,4'-пиперидина]. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 57%. Т. пл. 133-134C. ПДМС m/e = 424 (М+ свободного основания). [D]589 = 9,15 (с = 0,50, метанол). Анализ Вычислено Найдено С 70,02 69,85 Н 5,88 6,08N 5,44 5,29 Пример 73. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(3,4-диметоксифенил)пиперидин-1-ил)-2 пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(3,4 диметоксифенил)пиперидина. Полученное свободное основание растворяли в этилацета 000620 те и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 82%. ПДМС m/e = 410 (М+ свободного основания). [D]589 = 11,84 (с = 0,46, метанол). Анализ Вычислено Найдено С 62,39 62,12 Н 6,44 6,48N 5,60 5,37 Пример 74. Получение (2S)-(-)-1-(4-индолилокси)-3(6-хлорспиро[бензодигидрофуран-1(3 Н),4'пиперидин]-1'-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 6-хлорспиро[бензодигидрофуран-1,(3 Н),4'-пиперидина]. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 68%. ПДМС m/e = 412 (М+ свободного основания). [D]589 = 5,60 (с = 0,36, метанол). Анализ Вычислено Найдено С 59,70 59,62 Н 5,41 5,19N 5,57 5,59 Пример 75. Получение 1-(4-индолилокси)-3-(8-[1 фенил-1,3,8-триазаспиро[4.5]декан-4-он])-2 пропанола. Указанное в заголовке соединение получали аналогичным образом из 4(оксиранилметокси)-1H-индола и 1-фенил 1,3,8-триазаспиро[4.5]декан-4-она с выходом 47%. ПДМС m/e = 420. Т. пл. 213-214C. группа R Пример 76. Получение 1-(4-индолилокси)-3-([2-(1 метил-1 Н-пиррол-2-ил)-этил]амино)-2-пропанола. Указанное в заголовке соединение получали аналогичным образом из 4(оксиранилметокси)-1H-индола и 2-(1-метил 1 Н-пиррол-2-ил)этиламина с выходом 60%. ПДМС m/e = 313. Т. пл. 105-106 С. Пример 77. Получение 1-(4-индолилокси)-3-(4 фенилметилпиперидин-1-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из 4(оксиранилметокси)-1H-индола и 4 фенилметилпиперидина. Полученное свободное основание растворяли в этилацетате и 57 осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 52%. ПДМС m/e = 364 (М+ свободного основания). Т. пл. 105-107C. Пример 78. Получение (2S)-(-)-1-(4-индолилокси)-3(5-метоксиспиро-[бензодигидрофуран 1(3 Н),4'-пиперидин]-1'-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 5-метоксиспиро[бензодигидрофуран-1(3 Н),4'-пиперидина]. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 86%. ПДМС m/e = 408 (М+ свободного основания). [D]589 = 23,58 (с = 0,51, метанол). Анализ Вычислено Найдено С 62,64 62,81 Н 6,07 6,31N 5,62 5,90 Пример 79. Получение (2S)-(-)-1-(4-индолилокси)-3(4-(3,4-этилендиокси)фенил)пиперидин-1 ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-(3,4 этилендиоксифенил)пиперидина. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 66%. ПДМС m/e = 408 (М+ свободного основания). [D]589 = 9,39 (с = 0,53, метанол). Анализ Вычислено Найдено С 62,64 62,46 Н 6,07 5,96N 5,62 5,39 Пример 80. Получение (2S)-(-)-1-(4-индолилокси)-3(4-фторспиро[бензодигидрофуран-1(3 Н),4'пиперидин]-3-он-1'-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4-фторспиро[бензодигидрофуран-1(3 Н),4'-пиперидин]3-она. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 88%. Т. пл. 222-223C. ПДМС m/e = 410 (М+ свободного основания).[D]589 = 94,9 (с = 0,52, метанол). Анализ Вычислено Найдено С 62,52 62,35 Н 5,25 5,29 Пример 81. Получение (2S)-(-)-1-(4-индолилокси)-3(бензо[с]спиро-[бензодигидрофуран-1(3 Н),4'пиперидин]-1'-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и бензо[с]спиро[бензодигидрофуран-1(3 Н),4'пиперидина]. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 73%. ПДМС m/e = 428 (М+ свободного основания). [D]589 = 31,5 (с = 0,54, метанол). Анализ Вычислено Найдено С 67,17 67,42 Н 5,83 6,04N 5,40 5,55 Пример 82. Получение (2S)-(-)-1-(4-индолилокси)-3(3,4-дигидро-2-оксоспиро[нафталин-1(2 Н),4'пиперидин]-1'-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 3,4 дигидро-2-оксоспиро[нафталин-1(2 Н),4'пиперидина]. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 68%. ПДМС m/e = 404 (М+ свободного основания). [D]589 = 15,81 (с = 0,51, метанол). Анализ Вычислено Найдено С 65,58 65,33 Н 6,11 5,91 Пример 83. Получение (2S)-(-)-1-(4-индолилокси)-3(3,4-дигидро-2-оксо-7-метоксиспиро[нафталин-1(2 Н),4'-пиперидин]-1'-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 3,4-дигидро-2-оксо-7-метоксиспиро[нафталин 1(2 Н),4'-пиперидина]. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 55%. ПДМС= 5,55 (с = 0,54, метанол). Анализ Вычислено Найдено С 64,11 64,40 Н 6,15 6,38N 5,34 5,29 Пример 84. Получение (2S)-(-)-1-(4-индолилокси)-3(4-хлорспиро[бензодигидрофуран-1(3 Н),4'пиперидин]-3-он-1'-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 4 хлорспиро[бензодигидрофуран-1(3 Н),4'-пиперидин]-3-она. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 49%. Т. пл. 222224 С. ПДМС m/e = 426 (М+ свободного основания). [D]589 = 14,95 (с = 0,54, метанол). Анализ Вычислено Найдено С 58,09 58,19 Н 4,87 4,97N 5,42 5,53 Пример 85. Получение (2S)-(-)-1-(4-индолилокси)-3(6-хлорспиро[бензодигидрофуран-1(3 Н),4'пиперидин]-3-он-1'-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и 6-хлорспиро[бензодигидрофуран-1(3 Н),4'-пиперидин]3-она. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 45%. Т. пл. 147-148 С. ПДМС m/e = 426 (М+ свободного основания).[D]589 = 9,74 (с = 0,72, метанол). Анализ Вычислено Найдено С 58,09 58,31 Н 4,87 4,73N 5,42 5,79 Пример 86. Получение (2S)-(-)-1-(4-индолилокси)-3(бензо[е]спиро-[бензодигидрофуран-1(3 Н),4'пиперидин]-3-он-1'-ил)-2-пропанола. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и бензо[е]спиро[бензодигидрофуран-1(3 Н),4'пиперидина]-3-она с выходом 80%. Т. пл. 170-172C. ПДМС m/e = 442 (М+ свободного основания). [D]589 = 38,1 (с = 0,55, метанол). Анализ Вычислено Найдено С 73,29 72,97 Н 5,92 5,83 Пример 87. Получение (2S)-(-)-1-(4-индолилокси)-3(1,5-дигидроспиро-[4 Н-2-бензопиран-1,4'пиперидин]-1'-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1 Н-индола и 1,5-дигидроспиро[4 Н-2-бензопиран-1,4'-пиперидина]. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 58%. ПДМС m/e = 392 (М+ свободного основания). [D]589 = 23,56 (с = 0,51, метанол). Анализ Вычислено Найдено С 64,72 65,09 Н 6,27 6,44 группа R Пример 88. Получение (2S)-(-)-1-(4-индолилокси)-3(4-метоксиспиро-[бензодигидрофуран 1(3 Н),4'-пиперидин]-3-он-1'-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1 Н-индола и 4-метоксиспиро[бензодигидрофуран-1(3H),4'-пиперидин]-3-она. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 83%. Т. пл. 204-205 С. ПДМС m/e = 422 (М+ свободного основания).[D]589 = 8,62 (с = 0,58, метанол). Анализ Вычислено Найдено С 60,93 61,13 Н 5,51 5,55N 5,47 5,69 Пример 89. Получение (2S)-(-)-l-(4-индолилокси)-3(бензо[е]спиро-[бензодигидрофуран-1(3 Н),4'пиперидин]-1'-ил)-2-пропанолэтандиоата. Указанное в заголовке соединение получали аналогичным образом из (S)-(+)-4(оксиранилметокси)-1H-индола и бензо[е]спиро[бензодигидрофуран-1(3 Н),4'пиперидина]. Полученное свободное основание растворяли в этилацетате и осаждали одним эквивалентом щавелевой кислоты в этилацетате с общим выходом 83%. ПДМС m/e = 428 (М+ свободного основания). [D]589 = 5,65 (с = 0,53, метанол). Анализ Вычислено Найдено С 67,17 66,99
МПК / Метки
МПК: C07D 405/00, A61K 31/55
Метки: серотонином, связанные, системы, влияние, оказывающие, соединения
Код ссылки
<a href="https://eas.patents.su/30-620-soedineniya-okazyvayushhie-vliyanie-na-sistemy-svyazannye-s-serotoninom.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, оказывающие влияние на системы, связанные с серотонином</a>


































