Долгоживущий глюкагоноподобный пептид 2(glp-2, гпп-2) для лечения желудочно-кишечных заболеваний и расcтройств
Номер патента: 6160
Опубликовано: 27.10.2005
Авторы: Буджеллаб Ниссаб, Робитай Мартин, Тибодо Карен, Каретт Жюли, Леже Роже, Бридон Доминик П.
Формула / Реферат
1. Стимулятор роста желудочно-кишечных тканей, способный связываться ковалентной связью in vivo с функциональной группой компонента крови, содержащий пептид, имеющий последовательность
R1-(Y1)m-X1-X2-X3-X4-X5-Phe6-Ser7-Asp8-(P1)-X14-Asp15-X16-X17-Ala18-X19-X20-X21-Phe22-(P2)-Trp25-Leu26-X27-X28-Thr29-Lys30-P3-(Y2)n-R2
где X1 обозначает His или Tyr;
X2 обозначает Ala, Gly, D-Ala, Pro, Ile, Nor-Val, a-аминомасляную кислоту или Ala-замещающую аминокислоту, придающую указанному аналогу устойчивость к ферменту DPP-IV;
X3 обозначает Asp, Glu, Pro, HPro; или X2-X3 обозначают X2y(CH(OH)CH2)X3, X2y(CH2NH2)X3 или X2y(CHCH)X3, где X2 и X3 имеют значение по определению выше;
X4 обозначает Gly или Ala;
X5 обозначает Ser или Ala;
P1 обозначает Glu-X10-Asn-Thr-Ile, Gly-X10-Asn-Thr-Val или Tyr-Ser-Lys-Tyr,
X10 обозначает Met, Leu, Ile или устойчивую к окислению Met-замещающую аминокислоту;
X14 обозначает Leu или Lys;
X16 обозначает Asn, Lys или Ala;
X17 обозначает Leu или Lys;
X19 обозначает Ala или Thr;
X20 обозначает Arg, Lys, His или Ala;
X21 обозначает Asp или Lys;
X27 обозначает Ile или Leu;
X28 обозначает Gln или His;
P2 обозначает Ile-Asp, Ile-Ala или Val-Gln;
P3 обозначает ковалентную связь или Ile, Ile-Thr, Ile-Thr-Asp или Ile-Thr-Asn;
R1 обозначает NH2 или N-концевую блокирующую группу;
R2 обозначает COOH, CONH2 или C- концевую блокирующую группу;
Y1 обозначает один или два остатка из Arg, Lys и His;
Y2 обозначает один или два остатка из Arg, Lys и His и
m и n независимо обозначают 0 или 1;
или его аналог, или его фрагмент, обладающий активностью, стимулирующей рост желудочно-кишечных тканей; и реакционноспособную группу, связанную с пептидом.
2. Стимулятор по п.1, у которого реакционноспособной группой является малеинимидная или малеинимидосодержащая группа.
3. Стимулятор по п.1, у которого X1 обозначает His; X2 обозначает Ala или Gly, X3 обозначает Asp; X4 обозначает Gly; X5 обозначает Ser; P1 обозначает Glu-X10-Asn-Thr-Ile; X10 обозначает Met; X16 обозначает Asn или Lys; X19 обозначает Ala; X20 обозначает Arg; X27 обозначает Ile; X28 обозначает Gln; P2 обозначает Ile-Asn; P3 обозначает Ile-Thr-Asp и R2 обозначает CONH2.
4. Стимулятор по п.3, у которого пептид выбирают из группы, состоящей из

5. Стимулятор по п.1, у которого пептид выбирают из группы, состоящей из

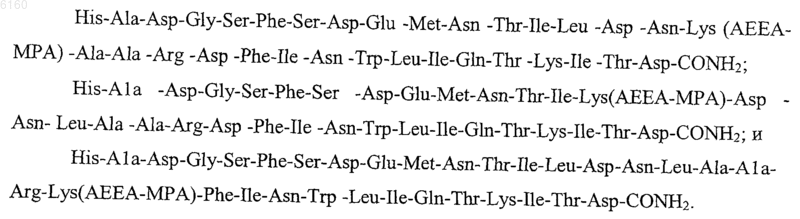
6. Стимулятор по п.1, способный связываться с компонентом крови, представляющим собой белки крови.
7. Фармацевтическая композиция, содержащая стимулятор роста желудочно-кишечных тканей по п.1 в комбинации с фармацевтически приемлемым носителем.
8. Композиция по п.7, предназначенная для лечения или предупреждения желудочно-кишечных расстройств или заболеваний.
9. Способ лечения или предупреждения желудочно-кишечных расстройств или заболеваний у субъекта, заключающийся во введении субъекту эффективного количества стимулятора роста желудочно-кишечных тканей по п.1, индивидуально или в комбинации с фармацевтически приемлемьм носителем.
10. Способ стимулирования роста желудочно-кишечных тканей у субъекта, заключающийся во введении субъекту эффективного количества стимулятора роста желудочно-кишечных тканей по п.1, индивидуально или в комбинации с фармацевтически приемлемым носителем.
11. Конъюгат, содержащий стимулятор роста желудочно-кишечных тканей по п.1, связанный ковалентной связью с компонентом крови.
12. Конъюгат по п.11, отличающийся тем, что реакционноспособная группа представляет собой малеинимидную группу или малеинимидосодержащую группу, а компонент крови представляет собой белок крови.
13. Конъюгат по п.12, отличающийся тем, что белок крови представляет собой сывороточный альбумин.
14. Конъюгат по п.11, отличающийся тем, что стимулятор роста желудочно-кишечных тканей представляет собой стимулятор по п.5.
15. Способ увеличения in vivo времени полужизни глюканоподобного пептида 2, обладающего активностью, стимулирующей рост желудочно-кишечных тканей, заключающийся в связывании ковалентной связью пептида с компонентом крови.
16. Способ по п.15, отличающийся тем, что пептид представляет собой аналог или фрагмент глюканоподобного пептида 2, обладающий активностью, стимулирующей рост желудочно-кишечных тканей.
17. Способ по п.15, отличающийся тем, что пептид представляет собой пептид по п.4.
18. Способ лечения или предупреждения желудочно-кишечных расстройств или заболеваний у субъекта, заключающийся во введении субъекту эффективного количества конъюгата по п.11, индивидуально или в комбинации с фармацевтическим носителем.
Текст
006160 Область, к которой относится изобретение Данное изобретение относится к производным глюкагоноподобного пептида 2 (ГПП 2). В частности, данное изобретение относится к производным пептида ГПП-2, имеющим продолжительный период полужизни in vivo, для лечения или предупреждения желудочно-кишечных расстройств или заболеваний, таких как воспалительное заболевание кишечника, и нарушений других желудочно-кишечных функций любого сегмента желудочно-кишечного тракта от пищевода до ануса. Предпосылки создания изобретения ГПП-2 представляет собой пептид, содержащий 33 аминокислоты, тканеспецифически экспрессирующийся при использовании плейотропного гена проглюкагона, и, следовательно, принадлежит к пептидньм гормонам суперсемейства глюкагона. Альтернативный посттрансляционный процессинг проглюкагона происходит в поджелудочной железе, кишечнике и тканях мозга. Ферментативное расщепление проглюкагона дат многочисленные полифункциональные пептидные гормоны, участвующие в процессе обмена питательных веществ. Основные биоактивные гормоны, образующиеся из проглюкагона, находятся в панкреатических -клетках, а ГПП-1 и ГПП-2 находятся в интестинальных L-клетках и клетках мозга. Drucher et al. (см. Proc. Natl. Acad. Sci., 1996, 93, (115), 7911-7916) первые открыли, что он оказывает сильное трофическое действие на кишечник. Показано, что ГПП-2, будучи натуральным образующимся в кишечнике пептидом, обладает значительной репаративной активностью в отношении эпителия слизистой оболочки тонкого и толстого кишечника. Показано также, что он повышает способность кишечника гидролизовать и всасывать питательные вещества, что предполагает возможное участие в терапии кишечной недостаточности. Действительно, в некоторых исследованиях недавно подтверждено, что введение ГГШ-2 уменьшает вероятность или предупреждает поражение кишечника при колите, энтерите, полном парентеральном питании и обширной резекции на моделях грызунов. Также совсем недавно появились сообщения о 2 фазе клинических испытаний ГПП-2, в которых было показано, что у пациентов с синдромом укороченной тонкой кишки повышается способность всасывать питательные вещества в тонком кишечнике после 30-дневного применения ГПП-2 при видимом отсутствии вредных побочных явлений. Основным путм метаболического клиренса ГПП-2 является ферментативный гидролиз (расщепление). Показано, что ГПП-2 быстро распадается при удалении двух его N-концевых аминокислот с помощью дипептидилпептидазы-IV (DPP-IV), что является главным ограничением, так как это ведт к полной инактивации пептида. В результате период полужизни ГПП-2 чрезвычайно короток, и в настоящее время при терапии ГПП-2 требуется вливание или частые инъекции. Было также показано, что в клиренсе ГПП 2 принимает участие почечный клиренс. Основное действие ГПП-2 включает стимуляцию роста клеток,а механизм, прямо или косвенно связывающий активацию рецептора ГПП-2 с пролиферацией клеток, не изучен. Было показано, что пептидные аналоги нативного ГПП-2 обладают повышенной трофической активностью в тонком кишечнике в качестве антагонистов рецептора ГПП-2 (см., например, патент США 5990077). Будучи очень полезными, ГПП-2 пептиды и аналоги, как указано выше, имеют важный недостаток,- очень короткое время полужизни in vivo, как правило, не более 2 мин. Воспалительные заболевания кишечника (ВЗК, IBD) представляют собой группу хронических расстройств, которые вызывают воспаление или образование язв в тонком и толстом кишечнике. Они могут даже угрожать жизни, и в настоящее время неизвестен способ их лечения. Понятие ВЗК, как правило,относится к язвенным колитам (UC), ограниченным толстой кишкой, и к болезни Крона (CD), которая может включать весь желудочно-кишечный тракт, вызывая хронические циклы, состоящие из ремиссий и обострений. Известны многие фармацевтические продукты для лечения ВЗК, например для ослабления воспаления, для предупреждения внезапного обострения болезни, для регуляции симптомов, таких как боль или диарея, или для замены основных питательных веществ, или в качестве дополнения к основным питательным веществам, которые плохо всасываются вследствие обширного заболевания или в результате хирургической операции. Современные варианты лечения включают большое разнообразие фармацевтических продуктов, таких как аминосалицилаты, кортикостероиды, иммуномодуляторы и агент против TNF-, и предназначенных, помимо замены утраченных жидкостей и питательных веществ, для ослабления воспаления и облегчения симптомов. Однако большая часть этих продуктов имеет ограниченное применение для ВЗК из-за их нежелательного побочного действия в целом на организм. Около одного миллиона больных лечится каждый год от ВЗК в Соединнных Штатах и в Европе,большинство из них, как правило, страдает либо болезнью Крона, либо язвенным колитом. На самом деле, для страдающих ВЗК не является необычной радикальная хирургическая операция, включающая удаление основных отделов кишечника. Прямые затраты на лечение ВЗК составляют около 700 миллионов US, а общие экономические последствия как прямых, так и косвенных затрат во всм мире составляют примерно 2-3 миллиардав год. Существующее лечение, несмотря на то что часто приносит облегчение, оказывает кратковременное действие.-1 006160 Патентом США 5789379 охватываются аналоги ГПП-2, среди которых один получен как соединение пролонгированного действия (ALX-600) и в настоящее время проходит клинические испытания. Однако, даже если удастся предотвратить расщепление ГПП-2 с помощью DPP-IV, его период полужизни по-прежнему ограничен почечным клиренсом и не превышает 2 мин, как говорится выше. Химерное антитело (Remicade) получено с целью специфического связывания с человеческим фактором некроза опухолевых клеток (TNF-) для краткосрочного лечения болезни Крона. Это антитело показано для уменьшения симптомов болезни Крона, в форме от умеренной до тяжлой, у больных, проявляющих неадекватную реакцию на обычную терапию кортикостероидами, другими иммунодепрессантами и/или антибиотиками. Тем не менее, при таком лечении наблюдаются опасные побочные эффекты. Например, его связывают с реакцией сверхчувствительности, опасными инфекциями, включая сепсис, а также с летальными инфекциями. Его применение может в дальнейшем вызвать предрасположение больного к инфекциям вследствие блокирования TNF. В связи с увеличением в последние годы распространнности ВЗК было бы желательно получить производные или аналоги пептида ГПП-2, способные практически сохранять такой же уровень активности, низкую токсичность и терапевтические преимущества ГПП-2, но со значительно более продолжительным in vivo периодом полужизни, тем самым позволяя избегать длительного их введения при лечении различных заболеваний, таких как воспалительные заболевания кишечника, при этом болезнь Крона и язвенный колит представляют собой два основных воспалительных заболевания кишечника. Сущность изобретения Согласно данному изобретению предлагается производное ГПП-2 стимулятора роста желудочнокишечных тканей с продолжительным in vivo временем полужизни по сравнению с соответствующим немодифицированным ГПП-2 стимулятором роста желудочно-кишечных тканей. Более конкретно, производное ГПП-2 содержит реакционноспособную группу, соединнную с ним и способную реагировать с функциональными группами компонента крови in vivo или ех vivo, с образованием прочной ковалентной связи. Связывание производного ГПП-2 и компонента крови ковалентной связью предотвращает нежелательное расщепление ГПП-2 ферментами, такими как дипептидилпептидаза IV, тем самым продлевается его in vivo период полужизни и активность. Реакционноспособная группа может быть на N- конце ГПП-2 пептида, на С-конце ГПП-2 пептида или в любом другом доступном сайте вдоль пептидной цепи. Предпочтительные компоненты крови включают белки, такие как иммуноглобулины, включая IgG и IgM, сывороточный альбумин, ферритин, стероид-связывающие белки, трансферрин, тироксинсвязывающий белок, -2-макроглобулин, галтоглобин и т.д., причм более предпочтительными являются сывороточный альбумин и IgG, а наиболее предпочтительным является сывороточный альбумин. Предпочтительные реакционноспособные группы способны образовывать ковалентную связь с компонентами крови, реагируя с находящимися в них аминогруппами, гидроксильными группами или тиольньми группами либо in vivo, либо in vitro (или ex vivo). В наиболее предпочтительном варианте изобретения функциональная группа белка может представлять собой тиольную группу, а реакционноспособный фрагмент может являться акцептором Михаэля, таким как акролеиновые производные, галогенацетаты, галогенацетамиды, ,-ненасыщенные кетоны, ,-ненасыщенные сложные эфиры, ,ненасыщенные амиды, ,-ненасыщенные тиоэфиры и т.п., малеинимид или малеинимидсодержащая группа, такая как -малеинимидбутириламид (GMBA) или малеинимидпропионовая кислота (МРА), причм МРА является наиболее предпочтительной. В другом аспекте изобретения охватывается фармацевтическая композиция, содержащая производное ГПП-2 стимулятора роста желудочно-кишечной ткани по данному изобретению в комбинации с фармацевтически приемлемым носителем. Такая композиция применима для лечения или предупреждения кишечных расстройств или заболеваний, таких как воспалительные заболевания кишечника и нарушение других желудочно-кишечных функций. Композицию можно также использовать в генной терапии для того, чтобы стимулировать эндогенное продуцирование клетками пептидного производного стимулятора роста желудочно-кишечных тканей, которое затем можно имплантировать в субъекта с целью вызвать желаемый биологический эффект. Наконец, композицию можно также применять для промышленного получения фармацевтических или ветеринарных композиций, улучшающих рост тканей толстого кишечника. В другом варианте данного изобретения предлагается способ лечения или предупреждения расстройств или заболеваний кишечника, таких как воспалительное заболевание кишечника и нарушение желудочно-кишечных функций. Способ заключается во введении субъекту, предпочтительно млекопитающему, животному или человеку, эффективного количества производного ГПП-2 стимулятора роста желудочно-кишечных тканей или его конъюгата, индивидуально или в сочетании с фармацевтически приемлемым носителем. В другом аспекте данного изобретения предлагается конъюгат, содержащий производное ГПП-2 стимулятора роста желудочно-кишечных тканей, ковалентно связанное с компонентом крови. Ещ в одном аспекте настоящего изобретения создан способ продления in vivo периода полужизни производного ГПП-2 стимулятора роста желудочно-кишечных тканей в организме субъекта, причм спо-2 006160 соб включает связывание производного ГПП-2 стимулятора роста желудочно-кишечных тканей с компонентом крови ковалентной связью. Связывание ковалентной связью может осуществляться in vivo и invitro. Предпочтительными соединениями - стимуляторами роста желудочно-кишечных тканей - являются пептиды, такие как ГПП-2 и аналоги ГПП-2, фрагменты ГПП-2, при условии, что такой аналог или фрагмент обладает активностью стимуляции роста желудочно-кишечных тканей. Детали последовательностей этих пептидов, аналогов и фрагментов иллюстрируются ниже. Ещ одним применением соединения по данному изобретению может быть применение для определения трофической активности гормона в кишечнике при использовании его (гормона) вместе с производным соединением по данному изобретению и, в частности, когда это соединение представляет собой ГПП-2 и аналог ГПП-2 или фрагмент ГПП-2. Такие методы включают стадии: (1) совместное введение испытуемому субъекту гормона с обладающим трофической активностью в кишечнике количеством производного ГПП-2; (2) оценка последующего роста тканей тонкого и толстого кишечника у испытуемого субъекта и (3) определение, действительно ли увеличивается рост тканей тонкого и/или толстого кишечника по сравнению с контрольным субъектом, получавшим немодифицированные ГПП-2, аналог ГПП-2 или производное ГПП-2. Если присутствует связывающая группа, она предпочтительно определяется, но без ограничения,как линейный или разветвлнный алкил C1-10; частично или полностью (пер)фторированный линейный или разветвлнный алкил С 1-10; C1-10-алкил или фторалкил, в котором один или более атомов углерода замещены на О, N или S с образованием простого эфира или тиоэфира; о-, м- или п-дизамещнный фенил, заместители в котором одинаковы или различны и представляют собой CH2, О, S, NH, NR, где R обозначает Н, C1-10-алкил или C1-10-ацил; или дизамещнные гетероциклы, такие как фуран, тиофен, пиран, оксазол или тиазол. Описание фигур Фиг. 1 иллюстрирует изменения сырого веса тонкого кишечника у мышей, получавших физиологический раствор или 5 мкг соединений из примеров 1-8 дважды в день в течение 10 дней (n = 10/группа). Результаты выражаются как средняя разница (дельта) в весе по сравнению с контрольнымSEM. Фиг. 2 иллюстрирует изменения сырого веса тонкого и толстого кишечника у мышей, получавших физиологический раствор или 5, 25 или 50 мкг соединений из примеров 5, 7 и 8 дважды в день в течение 10 дней (n = 10/группа). Результаты выражаются как средний весSEM. Фиг. 3 иллюстрирует средние концентрации соединений из примеров 5 и 8 у крыс Sprague-Dawley после однократной внутривенной или подкожной дозы 500 нмоль/кг (n = 4/группа). Фиг. 4 иллюстрирует обнаружение соединения из примера 8, конъюгированного с белками плазмы крыс, с применением поликлонального антитела к антителу против ГПП-2 и сравнением со структурой,полученной с антителом к альбумину крыс. Подробное описание изобретенияIn vivo биоконъюгация обозначает процесс ковалентного связывания в организме молекулы, такой как молекула производного стимулятора роста желудочно-кишечных тканей по данному изобретению, с нацеленными компонентами крови, предпочтительно с белками, таким образом, что становится возможным в значительной степени сохранить или в некоторых случаях повысить биологическую активность исходного немодифицированного ГПП-2 пептидного стимулятора роста желудочно-кишечных тканей, в то же время достигается продолжительная биологическая активность за счт придания производному ГПП-2 биофизических характеристик нацеленного компонента крови. Для целей настоящего изобретения предполагается, что термины "аналог" или "фрагмент" включают аминокислотные последовательности, содержащие пептиды с различными аминокислотными последовательностями нативной последовательности, такой как последовательность ГПП-2, но со сходной или сравнимой активностью. Такие аналоги, предпочтительно, имеют аминокислотную последовательность по меньшей мере на 60%, более предпочтительно по меньшей мере на 80% и наиболее предпочтительно по меньшей мере на 95% идентичной либо последовательности ГПП-2, либо последовательности фрагмента ГПП-2, содержащей такое же число аминокислотных остатков. В более предпочтительном варианте изобретения производное пептидного стимулятора роста желудочно-кишечных тканей содержит ГПП-2 пептидный стимулятор роста желудочно-кишечных тканей,который модифицирован за счт связывания с реакционноспособной группой либо непосредственно,либо через связывающую группу (мостик), причм реакционноспособная группа способна образовывать ковалентную связь с компонентом крови, предпочтительно с белками крови. Реакционноспособная группа должна быть устойчивой в водной среде, а е предпочтительные варианты включают карбоксильную группу, фосфорильную группу, имидатную группу или ацильную группу либо в виде сложного эфира,либо в виде смешанного ангидрида. Ковалентная связь обычно образуется между реакционноспособной группой и аминогруппой, гидроксигруппой или тиольной группой компонента крови. Аминогруппа,предпочтительно, образует ковалентную связь с реакционноспособными группами, такими как карбоксигруппа, фосфорильная или ацильная группа; гидроксигруппа, предпочтительно, образует ковалентную связь с реакционноспособными соединениями, такими как активированные сложные эфиры; а тиольная-3 006160 группа, предпочтительно, образует ковалентную связь с реакционноспособными соединениями, такими как сложные эфиры или смешанные ангидриды. Предпочтительный компонент крови представляет подвижный компонент крови, такой как сывороточный альбумин, иммуноглобулины или их комбинация, а предпочтительные реакционноспособные группы представляют собой аналогичные ангидридным малеинимидные группы. В наиболее предпочтительном варианте изобретения компонент крови представляет собой сывороточный альбумин. Компоненты крови, предпочтительно, являются подвижными, это означает, что они не имеют фиксированного положения в любой продолжительный период времени, обычно не превышающий 5 мин и,более обычно, одну минуту. Эти компоненты крови не являются мембрано-связанными и присутствуют в крови в течение продолжительного времени в минимальной концентрации, по меньшей мере 0,1 мкг/мл. Предпочтительные подвижные компоненты крови включают сывороточный альбумин, трансферрин,ферритин и иммуноглобулины, такие как IgM и IgG. Период полужизни подвижных (несвязанных) компонентов крови составляет по меньшей мере около 12 ч. Так как производное стимулятора роста желудочно-кишечных тканей по данному изобретению представляет собой ГПП-2 пептид, то в процессе синтеза производного ГПП-2 могут потребоваться защитные группы. Эти защитные группы являются обычными в области пептидного синтеза и в целом могут быть описаны как химические группы, способные защитить пептидное производное от реакции с другими функциональными группами. Соединения, содержащие различные защитные группы, выпускаются промышленностью, и их примеры можно найти в патенте США 5493007. Типичные примеры подходящих защитных групп включают ацетил, фторфенилметилоксикарбонил (FMOC), трет.бутилоксикарбонил (ВОС), бензилоксикарбонил (CBZ) и т.д. В табл. 1 приводятся как трхбуквенные,так и однобуквенные аббревиатуры для аминокислот. Таблица 1 Производное ГПП-2 по данному изобретению после конъюгации с компонентом крови образует пептид, стабилизированный в отношении пептидазы. Также рассматривается, что перед присоединением реакционноспособного фрагмента к пептиду можно добавлять одну или более аминокислот, чтобы облегчить присоединение фрагмента к пептиду. Такое добавление или замену можно делать на N-конце,С-конце, или между ними. Полученное таким образом пептидное производное можно вводить субъекту,животному или человеку таким образом, что конъюгация с компонентами крови происходит in vivo, или сначала может происходить конъюгация пептида с компонентами крови субъекта, человека или животного in vitro, и образующийся конъюгат или стабилизированное в отношении пептидазы пептидное производное по определению ниже вводят субъекту. Аминокислота, присутствующая, заменяемая или добавляемая к последовательности ГПП-2, может быть D-аминокислотой, или L-аминокислотой, или их комбинацией. Обычно предпочтительными явля-4 006160 ются L-аминокислоты. Замена глицина в положении 2 последовательности нативного ГПП-2 дат предпочтительный вариант изобретения, так как эта замена придат аналогу большую устойчивость к ферменту DP-IV. Глицин может быть также заменн на D-аланин или пролин для той же самой цели. Кроме того, замена Nметиласпарагиновой кислоты в положении 3 последовательности нативного ГПП-2 может дать такой же результат, так же как другие пептидные миметики, такие как метиламино,гидроксиэтил, гидразино, этилен или сульфонамид, в качестве изотерической замены амидной связи. Изобретение также включает фрагменты ГПП-2, в которых, хотя они и содержат последовательность, практически гомологичную последовательности природного пептида ГПП-2, может на амино и/или карбоксильном конце отсутствовать одна или более дополнительная аминокислота, которая имеется в природе в нативном пептиде ГПП-2. Следовательно, изобретение относится к полипептидным фрагментам ГПП-2, в которых может отсутствовать одна или более аминокислот, которые обычно имеются в природной последовательности ГПП-2, при условии, что такие полипептиды имеют активность, стимулирующую рост желудочно-кишечных тканей, которая предпочтительно, по меньшей мере, практически равна активности ГПП-2. Изобретение также охватывает очевидные или тривиальные варианты вышеописанных аналогов или фрагментов, которые содержат незначительные аминокислотные замены (и, следовательно, имеют аминокислотные последовательности, которые отличаются от природной последовательности), при условии, что такие варианты имеют активность, стимулирующую рост желудочно-кишечных тканей, которая практически равна активности ГПП-2. Примеры очевидных или тривиальных замен включают замену одного основного остатка на другой (т.е. Arg на Lys), замену одного гидрофобного остатка на другой(т.е. Leu на Ilе) или замену одного ароматического остатка на другой (т.е. Phe на Тyr) и т.д. Далее, другие тривиальные варианты включают аналоги, в случае которых получают консервативные замены, приводящие к значительной структурной аналогии с первоначальной последовательностью. Примеры таких консервативных замен, без ограничения, включают замену глутаминовой кислоты на аспарагиновую кислоту и наоборот; глутамина на аспарагин и наоборот; серина на треонин и наоборот; лизина на аргинин и наоборот; или любого остатка из группы изолейцин, валин или лейцин друг на друга. Стабилизированное в отношении пептидазы ГПП-2 производное более устойчиво в присутствии пептидаз in vivo, чем соответствующий нестабилизированный ГПП-2 аналог. Устойчивость в отношении пептидаз определяется сравнением периода полужизни нативного ГПП-2 аналога в сыворотке или крови с периодом полужизни соответствующего производного, содержащего реакционноспособную группу, в сыворотке или в крови. Период полужизни определяют, отбирая образцы сыворотки или крови после введения производного или немодифицированного пептида и определяя активность каждого компонента. Более подробно, настоящее изобретение направлено на модификацию ГПП-2 и его аналогов и фрагментов с целью повышения их биодоступности, продления in vivo их периода полужизни и распределения за счт селективной конъюгации с компонентом крови при практическом сохранении или улучшении их отличительных терапевтических свойств. Известно, что человеческий ГПП-2 имеет следующую последовательность: His-Ala-Asp-Gly-SerPhe-Ser-Asp-Glu-Met-Asn-Thr-Ile-Leu-Asp-Asn-Leu-Ala-Ala-Arg-Asp-Phe-Ile-Asn-Trp-Leu-Ile-Gln-Thr-LysIle-Thr-Asp. Данное изобретение относится к терапевтической и родственным областям применения производных ГПП-2, имеющих продолжительный период полужизни, в частности к применению для стимулирования роста тканей тонкого и/или толстого кишечника; повышения уровней производного ГПП-2 в крови; восстановления или сохранения желудочно-кишечной функции; стимулирования заживления и возобновления роста поражнной или изъязвлнной/воспалнной слизистой кишечника; снижения риска заболевания тонкого кишечника; повышения состояния питания; лечения или предупреждения пищевых или желудочно-кишечных расстройств или заболеваний; уменьшения потери веса; уменьшения экспрессии интерлейкина-1; увеличения длины толстой кишки, поверхности слизистой и целостности толстой кишки и глубины крипты; стимулирования роста кишечных ворсинок у субъектов, страдающих такими заболеваниями, как глютеновая болезнь, синдром послеинфекционной атрофии кишечных ворсинок и синдром укороченной тонкой кишки; стимулирования пролиферации тонкого и толстого кишечника у здоровых субъектов, например для увеличения всасывания питательных веществ у крупного рогатого скота, что позволяет раньше отлучать детнышей от матерей или повышать количество получаемого молока или мяса и т.д. Влияние, оказываемое производными ГПП-2 на рост, проявляется как увеличение веса тонкого кишечника по сравнению с псевдопролеченным (псевдообработанным) контролем. В частности, полагают,что производные ГПП-2 по данному изобретению обладают "интестинотрофической" активностью (ак-5 006160 тивностью в отношении интестинальных тканей), если при оценке приведнной в данном описании мышиной модели аналог опосредует увеличение веса тонкого кишечника по меньшей мере на 10% по сравнению с контрольным животным, получающим один носитель. Особенно пригодны для терапевтического применения такие производные, которые опосредуют увеличение веса тонкого кишечника по меньшей мере на 20%, тогда как наиболее предпочтительные производные обусловливают увеличение веса тонкого кишечника на 50% или более. Отмечают, что интестинотрофическая активность наиболее высока в отношении тощей кишки, включая дистальную тощую кишку и, в особенности, проксимальную тощую кишку, и также в отношении подвздошной кишки. Помимо "интестинотрофической" активности, производные ГПП-2 по данному изобретению включают аминокислотную замену в одном или более сайтов "остова" пептида ГПП-2, который представляет собой либо непосредственно ГПП-2 млекопитающих, либо является вариантом ГПП-2 млекопитающих, в котором С-конец и/или N-изменн добавлением одного или двух основных остатков или модифицирован за счт введения блокирующей группы того типа, который обычно применяют в технике химии пептидов для защиты пептидных концов от нежелательной биохимической атаки и расщепления in vivo. Следовательно, пептидные производные по данному изобретениювводят аминокислотную замену в контекст ГПП-2 любого вида млекопитающих, включая, но без ограничения, ГПП-2 человека, ГПП-2 коровы,ГПП-2 крысы, ГПП-2 собаки, ГПП-2 буйвола, ГПП-2 свиньи, ГПП-2 морской свинки и ГПП-2 хомяка,последовательности которых описаны многими авторами, включая Buhl et al., J. Biol. Chem., 1988,263(18):8621. В более предпочтительном варианте изобретения на С-конце ГПП-2 пептидной последовательности добавляют остаток лизина. В одном аспекте изобретения интестинотрофические аналоги ГПП-2, пригодные для дериватизации по данному изобретению, имеют следующую последовательность:X1 обозначает His или Тyr; Х 2 обозначает Ala, Gly, D-Ala, Pro, Ile, Nor-Val, -аминомасляную кислоту или Ala-замещающую аминокислоту, придающую указанному аналогу устойчивость к ферменту DPP-IV; Х 3 обозначает Asp, Glu, Pro, HPro; или Х 2-Х 3 обозначают Х 2(СН(ОН)СН 2)Х 3, Х 2(СН 2NН 2)Х 3 или Х 2(СНСН)Х 3, где Х 2 и Х 3 по определению выше; Х 4 обозначает Gly или Ala; Х 5 обозначает Ser или Ala;P2 обозначает Ile-Asp, Ile-Ala или Val-Gln; Р 3 обозначает ковалентную связь или Ilе, Ile-Thr, Ile-Thr-Asp или Ile-Thr-Asn;Y1 обозначает один или два остатка из Arg, Lys и His;Y2 обозначает один или два остатка из Arg, Lys и His; and m и n независимо обозначают 0 или 1. В предпочтительном варианте изобретения X1 обозначает His; Х 2 обозначает Аlа или Gly; Х 3 обозначает Asp; X4 обозначает Gly; X5 обозначает Ser; P1 обозначает Glu-Х 10-Asn -Thr-Ile; Х 10 обозначаетMet; X16 обозначает Asn или Lys; X19 обозначает Ala; Х 20 обозначает Arg; X27 обозначает Ile; X28 обозначает Gln; Р 2 обозначает Ile-Asn; Р 3 обозначает Ile-Thr-Asp; R2 обозначает CONH2 и m обозначает 0. Ещ в одном предпочтительном варианте изобретения n обозначает 1 и Y2 обозначает Lys. В предпочтительном варианте изобретения функциональной группой в молекуле белка является тиольная группа, а реакционноспособной группой является малеинимид или малеинимидосодержащая группа, такая как -малеинимидбутириламид (GMBA), малеинимидопропионовая кислота (МРА), (2 амино) этоксиуксусная кислота (АЕА)-МРА, этилендиамин (EDA)-MPA или 2-[2-(2-амино)этокси)] этоксиуксусная кислота (АЕЕА)-МРА и их комбинации. Примеры комбинаций включают, но без ограничения, (AEEA-EDA)-MPA, (AEEA-AEEA)-MPA, (АЕА-АЕЕА)-МРА и т.п. Малеинимидные группы являются наиболее селективными для сульфгидрильных групп в пептидах,когда выдерживаются значения рН реакционной смеси 6,5-7,4. При рН 7,0 скорость реакции малеиними-6 006160 догрупп с сульфгидрильными группами в 1000 раз быстрее, чем с аминогруппами. При реакции между малеинимидной и сульфгидрильной группами образуется устойчивая тиоэфирная связь, которая не расщепляется в физиологических условиях. Производные стимулятора роста желудочно-кишечных тканей по изобретению обеспечивают специфическое мечение компонентов крови. Такое специфическое мечение, в частности, малеинимидом,дат ряд преимуществ. Свободные тиольные группы менее распространены in vivo, чем аминогруппы, и в результате, малеинимидные производные связываются ковалентной связью с меньшим количеством белков. Например, на одну молекулу сывороточного альбумина приходится только одна свободная тиольная группа. Поэтому молярное соотношение пептида и альбумина в конъюгате ГПП-2 - малеинимид альбумин стремится к 1:1. Помимо альбумина свободные тиольные группы содержатся также в молекулах IgG (класс II). Так как молекулы IgG и сывороточного альбумина составляют основную часть растворимых белков в крови, т.е 99%, они также содержат основную часть тиольных групп, способных связываться ковалентной связью с малеинимидо-замещнными ГПП-2. Далее, даже среди содержащих свободные тиольные группы белков крови специфическое мечение малеинимидом приводит к преимущественному образованию конъюгатов пептидмалеинимид - альбумин вследствие уникальных особенностей самого альбумина. Единственная свободная тиольная группа альбумина, высококонсервативная среди этих групп, расположена в аминокислотном остатке Суs34. Недавно было показано, что Суs34 альбумина обладает повышенной реакционной способностью по сравнению со свободными тиолами других тиолсодержащих белков. Это частично объясняется необычным значением рК для Cys34 альбумина, равным 5,5. Эта величина значительно ниже, чем типичные значения рК для цистеиновых остатков в целом, равные, как правило, примерно, 8. Из-за низкого значения рК Суs34 альбумина в обычных физиологических условиях находится преимущественно в анионной форме, что резко повышает е реакционную способность. Помимо низкого значения рК Суs34 другим фактором, который повышает реакционную способность Суs34, является его локализация в кармане около поверхности одной петли области V альбумина. Это местоположение делает Cys34 очень доступным для лигандов всех видов и является важным фактором, определяющим биологическую роль Суs34 в качестве ловушки свободных радикалов и скавенджера свободных тиольных групп. В результате скорость реакции может увеличиваться в 1000 раз по сравнению со скоростью реакции пептид - малеинимидов с другими белками, содержащими свободные тиольные группы. Другим преимуществом конъюгатов пептид - малеинимид - альбумин является воспроизводимость,обусловленная соотношением пептида к альбумину 1:1 специфически по остатку Cys34. Обычные методы активации, например, с помощью глутаральдегида, DCC, EDC и других химических активаторов, например свободных аминов, не дают возможности достичь такой селективности. Например, альбумин содержит 52 остатка лизина, 25-30 из которых локализовано на поверхности альбумина и доступно для конъюгирования. Активирование этих остатков лизина или же модификация пептида в пару за счт этих остатков лизина приводит к гетерогенной популяции конъюгатов. Даже если применяется эквимолярное соотношение пептид: альбумин (т.е. 1:1), конечный результат - это случайные продукты конъюгации, причм некоторые из них содержат неопределнное число пептидов, связанных с каждой молекулой альбумина,и каждый конъюгат содержит пептиды, произвольно соединнные по любому из 25-30 подходящих сайтов лизина. Соответственно, точная характеристика композиции фактически невозможна, не говоря об отсутствии воспроизводимости. Кроме того, хотя может показаться, что конъюгация за счт лизиновых остатков альбумина дат, по меньшей мере, преимущество при доставке большего количества терапевтического агента на молекулу альбумина, исследования показали, что предпочтительным является соотношение терапевтического агента и альбумина, равное 1:1. В статье Stehle, et al. в Anticancer Drugs, 1997,8, 677-685 сообщается, что отношение противоракового метотрексата к альбумину, конъюгированному через глутаральдегид, дат наиболее обещающие результаты. Эти конъюгаты поглощаются опухолевыми клетками, тогда как конъюгаты, несущие молекулы метотрексата от 5:1 до 20:1, изменяют ВЭЖХхроматограмму и быстро поглощаются в печени in vivo. Следовательно, по-видимому, при более высоких соотношениях эффективность альбумина в качестве носителя терапевтического агента уменьшается. С помощью регулируемого введения производного пептида ГПП-2 по данному изобретению, и в особенности пептида ГПП-2, содержащего реакционноспособный малеинимидный фрагмент, можно регулировать специфическое in vivo мечение или связывание альбумина и IgG. Показано, что при типичном введении 80-90% вводимого пептидного производного связывается с альбумином и менее 5% связывается с IgG. Также имеются следовые количества связывания свободных тиолов, таких как глутатион. Такое специфическое связывание предпочтительно для применения in vivo, так как оно позволяет точно рассчитывать оцениваемый период полужизни вводимого терапевтического агента. Малеинимид - замещнные пептиды ГПП-2, как правило, совершенно устойчивы в водных растворах и в присутствии свободных аминов. Так как малеинимид - замещнные пептиды ГПП-2 реагируют со свободными тиолами, для предотвращения их реакции с самими собой не нужны защитные группы. Нужные конъюгаты производных ГПП-2 с компонентами крови можно получать in vivo, вводя производные непосредственно субъекту, который может быть животным или человеком. Введение можно-7 006160 осуществлять в виде болюса или можно вводить медленно во времени с помощью инфузии с определнной скоростью тока и т.п. Или же конъюгат можно получать также ех vivo, объединяя кровь или продажные очищенные компоненты крови с производным ГПП-2 по данному изобретению, что дат возможность ковалентного связывания производного ГПП-2 по функциональным группам компонентов крови, а затем "возвращение" или введение конъюгированной крови или конъюгированного очищенного компонента крови хозяину. Кроме того, вышеописанное можно выполнять, сначала очищая индивидуальный компонент или ограниченное число компонентов, таких как эритроциты, иммуноглобулины, сывороточный альбумин и т.п., и объединяя этот компонент или эти компоненты с соединением по данному изобретению ех vivo. Меченая кровь или меченый компонент крови можно затем "возвратить" субъекту, чтобы в условиях in vivo иметь терапевтически эффективные конъюгаты. Кровь можно также обработать, чтобы предотвратить коагуляцию во время операций ех vivo. Пептидный синтез Пептиды ГПП-2 можно синтезировать стандартными методами тврдофазного пептидного синтеза,хорошо известными любому рядовому специалисту в данной области техники. Например, пептид можно синтезировать методами твердофазного пептидного синтеза, описанными Steward et al. в Solid Phase Peptide Synthesis, 2nd Ed., Pierce Chemical Company, Rockford, III., (1984), используя синтезатор Rainin PTISymphony. Аналогично пептидные фрагменты можно синтезировать, а затем объединить или связать вместе с образованием более протяжнного пептида (сегментная конденсация). Эти синтетические пептидные фрагменты также можно получать с аминокислотными заменами в специфических положениях. Обзор многих методов твердофазного пептидного синтеза можно найти в Steward et al. в Solid PhasePeptide Synthesis, W.H. Freeman Co. (San Francisco), 1963 и Meienhofer, Hormonal Proteins and Peptides,1973, 2 46. О классическом синтезе в растворе см., например, Schroder et al., в "The Peptides", volume 1,Academic Press (New York). Как правило, такие методы включают последовательное присоединение одной или более аминокислот или защищнных соответствующим образом аминокислот к наращиваемой пептидной цепи полимера. Обычно либо аминогруппу, либо карбоксильную группу первой аминокислоты защищают с помощью соответствующей защитной группы. Защищнную и/или дериватизированную аминокислоту затем либо иммобилизуют на инертном тврдом носителе, либо используют в растворе,добавляя следующую аминокислоту в последовательности, содержащую комплементарную (амино или карбоксильную) группу, соответствующим образом защищнную и в условиях, подходящих для образования амидной связи. Затем защитную группу удаляют с этого вновь образованного остатка добавляемой аминокислоты и добавляют следующую аминокислоту (соответствующим образом защищнную) и т.д. После того как все нужные аминокислоты соединены в соответствующей последовательности, последовательно или одновременно удаляют все оставшиеся защитные группы (и весь тврдый носитель) и получают конечный полипептид. Простой модификацией этой общей методики можно добавлять к наращиваемой цепи более одной аминокислоты за определнное время, например, соединяя (в условиях, в которых хиральные центры не рацемизируются) защищнный трипептид с защищнным соответствующим образом дипептидом, при этом образуется после депротекции пенталептид (сегментная конденсация). Особенно предпочтительный способ получения производных ГПП-2 по данному изобретению включает тврдофазный пептидный синтез, причм аминокислотный -N-конец защищн группой, чувствительной к кислоте или к основанию. Такие защитные группы должны быть устойчивыми к условиям образования пептидной связи, в то же время они должны легко сниматься без нарушения растущей пептидной цепи или рацемизации какого-либо хирального центра, содержащегося в ней. Примеры Nзащитных групп и карбокси-защитных групп приведены в монографии Greene, "Protective Groups In Organic Synthesis", (John WileySons, New York pp. 152-186 (1981, которая вводится в данное описание в качестве ссылки. Примеры N-защитных групп включают, без ограничения, низшие алканоильные группы, такие как формил, ацетил ("Ас"), пропионил, пивалоил, трет.-бутилацетил и т.п.; другие ацильные группы включают 2-хлорацетил, 2-бромацетил, трифторацетил, трихлорацетил, фталил, о-нитрофеноксиацетил, -хлорбутирил, бензоил, 4-хлорбензоил, 4-бромбензоил, 4-нитробензоил и т.п.; сульфонильные группы, такие как бензолсульфонил, п-толуолсульфонил, о-нитрофенилсульфонил, 2,2,5,7,8 пентаметилхроман-6-сульфонил (pmc) и т.п.; группы, образующие карбаматы, такие как третамилоксикарбонил, бензилоксикарбонил, п-хлорбензилоксикарбонил, п-метоксибензилоксикарбонил, пнитробензилоксикарбонил, 2-нитробензилоксикарбонил, п-бромбензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, 3,5-диметоксибензилоксикарбонил, 2,4-диметоксибензилоксикарбонил, 4-этоксибензилоксикарбонил, 2-нитро-4,5-диметоксибензилоксикарбонил, 3,4,5-триметоксибензилоксикарбонил,1-(п-бифенилил)-1-метилэтоксикарбонил, ,-диметил-3,5-диметоксибензилоксикарбонил, бензгидрилоксикарбонил, трет-бутоксикарбонил (boc), диизопропилметоксикарбонил, изопропил-оксикарбонил,этоксикарбонил, метоксикарбонил, аллилоксикарбонил, 2,2,2-трихлорэтоксикарбонил, феноксикарбонил,4-нитрофеноксикарбонил, фторфенил-9-метоксикарбонил, изоборнилоксикарбонил, циклопентилоксикарбонил, адамантилоксикарбонил, циклогексилоксикарбонил, фенилтиокарбонил и т.п.; арилалкильные-8 006160 группы, такие как бензил, бифенилизопропилоксикарбонил, трифенилметил, бензилоксиметил, 9-флуоренилметилоксикарбонил (Fmoc) и т.п., и силильные группы, такие как триметилсилил и т.п. Предпочтительными -N-защитными группами являются о-нитрофенилсульфенил; 9-флуоренилметилоксикарбонил; трет-бутоксикарбонил (bос), изоборнилоксикарбонил; 3,5-диметоксибензилоксикарбонил; трет-амилоксикарбонил; 2-циано-трет-бутилоксикарбонил и т.п., более предпочтительной группой является 9-фторфенилметилоксикарбонил (Fmoc), тогда как предпочтительными N-защитными группами боковой цепи являются 2,2,5,7,8-пентаметилхроман-6-сульфонил (pmc), нитро, п-толуолсульфонил, 4 метоксибензолсульфонил, Cbz, Воc и адамантилоксикарбонил - для аминогрупп боковых цепей, таких как лизин и аргинин; бензил, о-бромбензилоксикарбонил, 2,6-дихлорбензил, изопропил, трет-бутил(трет-Вu), циклогексил, циклопентил и ацетил (Ас) для тирозина; трет-бутил, бензил и тетрагидропиранил для серина; тритил, бензил, Cbz, п-толуолсульфонил и 2,4-динитрофенил для гистидина; формил для триптофана; бензил и трет-бутил для аспарагиновой кислоты и глутаминовой кислоты; и трифенилметил(тритил) для цистеина. Выражение "защитная группа для карбоксильной группы" обычно относится к защитной сложноэфирной или амидной группе. Такие карбокси-защитные группы хорошо известны специалистам в данной области техники, они широко применяются для защиты карбоксильных групп в химии пенициллина и цефалоспоринов, как описано в патентах США 3840556 и 3719667. Репрезентативные карбоксизащитные группы включают, без ограничения, низший алкил C1-C8; арилалкил, такой как фенетил или бензил, и их замещнные производные, такие как алкоксибензильная или нитробензильная группы; арилалкенил, такой как фенилэтенил; арил и его замещнные производные, такие как 5-инданил; диалкиламиноалкил, такой как диметиламиноэтил; алканоилоксиалкильные группы, такие как ацетоксиметил,бутирилоксиметил, валерилоксиметил, изобутирилоксиметил, изовалерилоксиметил, 1-(пропионилокси)1-этил, 1-(пивалоилоксил)-1-этил, 1-метил-1-(пропионилокси)-1-этил, пивалоилоксиметил, пропионилоксиметил; циклоалканоилоксиалкильные группы, такие как циклопропилкарбонилоксиметил, циклобутилкарбонилоксиметил, циклопентилкарбонилоксиметил циклогексилкарбонилоксиметил; ароилоксиалкил, такие как бензоилоксиметил, бензоилоксиэтил; арилалкилкарбонилоксиалкил, такой как бензилкарбонилоксиалкил, 2-бензилкарбонилоксиэтил; алкоксикарбонилалкил или циклоалкилоксикарбонилалкил,такой как метоксикарбонилметил, циклогексилоксикарбонилметил, 1-метоксикарбонил-1-этил; алкоксикарбонилоксиалкил или циклоалкилоксикарбонилоксиалкил, такой как метоксикарбонилоксиметил,трет-бутилоксикарбонилоксиметил, 1-этоксикарбонил-1-этил, 1-циклогексилоксикарбонилокси-1-этил; арилоксикарбонилоксиалкил, такой как 2-(феноксикарбонил-окси)этил, 2-(5-инданилоксикарбонилокси) этил; алкоксиалкилкарбонилоксиалкил, такой как 2-(1-метокси-2-метилпропан-2-оилокси)этил; арилалкилоксикарбонилоксиалкил, такой как 2-(бензилоксикарбонилокси)этил; арилалкенилоксикарбонилоксиалкил, такой как 2-(3-фенилпропен-2-илоксикарбонилокси)этил; алкоксикарбониламиноалкил, такой как трет-бутоксикарбониламинометил; алкиламинокарбониламиноалкил, такой как метиламинокарбониламинометил; алканоиламиноалкил, такой как ацетиламинометил; гетероциклилкарбонилоксиалкил,такой как 4-метилпиперазинилкарбонилоксиметил; диалкиламинокарбонилалкил, такой как диметиламинокарбонилметил, диэтиламинокарбонилметил; (5-(низший алкил)-2-оксо-1,3-диоксолен-ил)алкил,такой как (5-трет-бутил-2-оксо-1,3-диоксолен-4-ил)метил; и (5-фенил-2-оксо-1,3-диоксолен-4-ил)алкил,такой как (5-фенил-2-оксо-1,3-диоксолен-4-ил)метил. Репрезентативные амидные карбоксизащитные группы включают, без ограничения, аминокарбонильные и низшие алкиламинокарбонильные группы. Из вышеприведнных карбокси-защитных групп предпочтительными являются сложноэфирные группы,низшие алкиловые, циклоалкиловые или арилалкиловые, например метиловый эфир, этиловый эфир,пропиловый эфир, изопропиловый эфир, бутиловый эфир, вт-бутиловый эфир, изобутиловый эфир, амиловый эфир, изоамиловый эфир, октиловый эфир, циклогексиловый эфир, фенилэтиловый эфир и т.п.,или алканоилоксиалкиловый эфир, циклоалканоилоксиалкиловый эфир, ароилоксиалкиловый эфир или арилалкилкарбонилоксиалкиловый эфир. Предпочтительными амидными карбокси-защитными группами являются (низший алкил)аминокарбонильные группы. По методу твердофазного пептидного синтеза -С-концевую аминокислоту прикрепляют (иммобилизуют) к соответствующему тврдому носителю или полимеру. Подходящие тврдые носители, применимые для вышеуказанного синтеза, представляют собой материалы, инертные в отношении реагентов и условий постадийного проведения реакций конденсации - снятия защиты, а также нерастворимые в применяемых средах. Предпочтительным тврдым носителем (подложкой) для синтеза -С-концевых карбоксипептидов является сополимер 4-гидроксиметилфеноксиметила с 4'-метилбензгидриламином (полимер НМР). Предпочтительным тврдым носителем (подложкой) для синтеза -С-концевых амидопептидов является полимер Fmoc-защищнный полимер Ramage. Если тврдым носителем является полимер 4-(2',4'-диметоксифенил-Fmос-аминометил)феноксиацетамидоэтила, Fmoc-группа отщепляется вторичным амином, предпочтительно, пиперидином, прежде,чем полимер соединится с -С-концевой аминокислотой, как описано выше. Предпочтительным методом присоединения к полимеру 4-(2',4'-диметоксифенил-Fmос-аминометил)феноксиацетамидоэтила после снятия защиты является реакция в присутствии O-бензотриазол-1-ил-N,N,N',N'-тетраметилуроний-9 006160 гексафторфосфата (HBTU, 1 экв.), диизопропилэтиламина (DIEA, 1 экв.) и, необязательно, 1-гидроксибензотриазола (НОВТ, 1 эквив.), в ДМФА. Присоединение последовательно защищаемых аминокислот можно проводить в автоматическом синтезаторе полипептидов обычным методом, хорошо известным в технике. Снятие Fmoc-защитной группы с -N-концевой стороны наращиваемого пептида выполняют обычным способом, например обработкой вторичным амином, предпочтительно пиперидином. Каждую защищнную аминокислоту затем вводят примерно в 3 х-кратном молярном избытке и присоединение предпочтительно проводят в ДМФА. Конденсирующим агентом обычно является O-бензотриазол-1-илN,N,N',N'-тетраметилуронийгексафторфосфат (HBTU, 1 экв.), диизопропилэтиламин (DIEA, 1 экв.) и,необязательно, 1-гидроксибензотриазол (НОВТ, 1 экв.). В конце твердофазного синтеза пептид снимают с полимера и снимают защиту либо последовательно, либо одновременно. Удаление полипептида и снятие защиты можно осуществлять обычным способом в виде одной операции обработкой связанного с полимером полипептида расщепляющим реагентом, содержащим тиоанизол, триизопропилсилан, фенол и трифторуксусную кислоту. В случаях, когда-С-конец полипептида представляет собой алкиламид, смолу отщепляют аминолизом алкиламином. Или же пептид можно удалять переэтерификацией, например, метанолом с последующим аминолизом или прямым переамидированием. Защищнный пептид можно очищать на этой стадии или непосредственно брать в следующую стадию. Удаление защитных групп боковой цепи выполняют, используя описанную выше смесь для отщепления. Полностью защищнный пептид можно очищать с помощью последовательных хроматографических операций, используя все приведнные ниже виды хроматографии или любой из них: ионообменную хроматографию на слабоосновных смолах (ацетатная форма); гидрофобную адсорбционную хроматографию на недериватизированном сополимере полистирола с дивинилбензолом (таком как Amberlite XAD); адсорбционную хроматографию на силикагеле; ионообменную хроматографию на карбоксиметилцеллюлозе; распределительную хроматографию, например, наSephadex G-25, LH-2- или противоточное распределение; высокоэффективную жидкостную хроматографию (ВЭЖХ), в особенности обращнно-фазовую ВЭЖХ на колонке с октил- или октадецилсилил силикагелем в качестве наполнителя. Любой рядовой специалист в данной области техники способен легко определить, какие предпочтительные хроматографические стадии или последовательности требуются для получения приемлемой степени очистки ГПП-2 пептида. Молекулярные веса этих пептидов определяют квадрупольной масс-спектрометрией с ионизацией электрораспылением. Процесс синтеза производных ГПП-2 по данному изобретению меняется в широких пределах в зависимости от природы различных элементов, т.е. последовательности ГПП-2, связывающей группы и реакционноспособной группы, имеющейся в производном ГПП-2. Методики синтеза выбирают так, чтобы обеспечить простоту, высокий выход и воспроизводимость, а также получить продукт высокой степени чистоты. Обычно присоединение за счт химически реакционноспособной группы происходит на последней стадии синтеза, например в случае карбоксильной группы осуществляют этерификацию с образованием активного сложного эфира. Конкретные методы получения производных ГПП-2 по данному изобретению приводятся ниже. Требованием является то, что химически реакционноспособная группа должна быть расположена в таком сайте, который дат возможность пептиду связываться ковалентной связью с компонентом крови,сохраняя при этом основную часть активности и/или полезного действия, если не всю активность и не все полезные свойства, нативного ГПП-2 пептида. В более предпочтительном варианте каждое производное ГПП-2 синтезируют в соответствии со следующими критериями: если концевая карбоксильная группа пептида доступна и не является важной для сохранения фармакологической активности и никакой другой чувствительной функциональной группы в пептиде не имеется, тогда в качестве места прикрепления модификации "связывающая группа реакционноспособная группа" выбирают карбоксильную группу. Если концевая карбоксильная группа связана с фармакологической активностью или ни одна из карбоновых кислот не доступна, тогда в качестве места прикрепления модификации "связывающая группа - реакционноспособная группа" выбирают любую другую чувствительную функциональную группу, не являющуюся важной для сохранения фармакологической активности. Если в пептиде доступными являются несколько чувствительных функциональных групп, используют сочетание защитных групп таким образом, чтобы после соединения связывающей группы/реакционноспособной группы и депротекции всех чувствительных функциональных групп по-прежнему сохранялась фармакологическая активность. Если в пептиде отсутствуют доступные чувствительные функциональные группы, то применяют синтетические методы для такой модификации исходного пептида, которая бы позволила сохранить биологическую активность исходного пептида и рецепторную специфичность и специфичность в отношении мишени. В этом случае модификацию,предпочтительно, осуществляют на противоположном конце пептида. В соответствии с данным изобретением производные ГПП-2 можно вводить больным, которым помогает рост тканей верхних отделов желудочно-кишечного тракта. Кроме того, больных, которым помо- 10006160 гает улучшение функции верхних отделов желудочно-кишечного тракта в результате повышения роста тканей или по другой причине, также можно лечить методами по данному изобретению. Как правило,больные, которым помогает повышенная масса верхних отделов желудочно-кишечного тракта и/или повышенная функция слизистой верхних отделов желудочно-кишечного тракта, являются кандидатами на лечение производными ГПП-2 пептида ГПП-2. Конкретные состояния, которые можно лечить с помощью производных пептида ГПП-2 по данному изобретению, включают различные формы воспалительных заболеваний желудка или пищевода, а также можно лечить больных, перенесших частичную или неполную резекцию верхних отделов желудочно-кишечного тракта. Неполный список состояний верхних отделов желудочно-кишечного тракта, включающих желудок и пищевод, которые можно лечить производными ГПП-2 по данному изобретению или их смесями, содержит заболевания желудка, такие как острый гастрит, острый геморрагический гастрит, острый гастрит при стрессе, вирусный гастрит,гастрит при паразитарных инфекциях, грибковый гастрит, гастропатия (острая), геморрагическая гастропатия, острый геликобактерный гастрит (вызванный Helicobacter pylori), гастрит типа А, В и С, гиперсекреторный гастрит, неспецифический гастрит, вторичный по отношению к геликобактерному (Helicobacter pylori), химический гастрит, реактивный гастрит, рефлюкс-гастрит, желчный гастрит, метапластический атрофический гастрит, метапластический атрофический гастрит под влиянием окружающей среды,идиопатический пангастрит, диффузный гастрит тела желудка, аутоиммунный хронический гастрит, аутоиммунно-связанный гастрит, бактериальный гастрит, иной нежели геликобактерный (Gasrospirillumhominis, флегмонозный, вызванный микобактериальной инфекцией, сифилитический), атрофический гастрит после антрэктомии, эозинофилический гастрит и любые другие острые инфекционные гастриты; болезнь Крона, саркоидоз, отдельный гранулматозный гастрит, лимфоцитарный гастрит, болезнь Менетрие и т.д., и болезни пищевода, такие как инфекционный эзофагит, вызванный грибками, такими какdermatitides, или вирусами, такими как вирус простого герпеса (типа 1), цитомегало-вирус, вирус Varicella-zoster, или бактериями, такими как Micobacterium tuberculosis, Actinomyces Israelii, Streptococcusviridans, Lactobacillus acidophilus, и Treponema palladium. Другие нарушения пищевода включают, без ограничения, неинфекционный эзофагит, рефлюкс кислоты, рефлюкс желчи, химическое поражение (вызванное лекарственными препаратами, токсинами, кислотами, щелочами и т.д.), саркоидоз, болезнь Крона, болезнь Бехчета, гомологичная болезнь, инфекции, родственные СПИД (Criptosporidium sp., Microsporidium sp., Isospora belli, Glardia Lamblia, Salmonella sp., Campylobacter sp., Mycobacterium tuberculosis,Mycobacterium avium comlex, Clostridium difficile, цитомегаловирус и вирус простого герпеса). Другие заболевания или состояния, которые можно лечить производными пептида ГПП-2 по данному изобретению, включают нарушения слизистой тонкого кишечника, которые охватывают язвы и воспаления; нарушения врожднного или приобретнного переваривания и всасывания пищи, включая синдромы мальабсорбции; и заболевания и состояния, вызванные утратой функции слизистой тонкого кишечника, в частности у больных, которых в течение длительного времени кормили парентерально, или у больных, у которых с помощью хирургической операции проведена резекция тонкого кишечника и которые страдают синдромом укороченного тонкого кишечника и синдромом слепого мешка. Как правило, больные, которым становится лучше при любом увеличении интестинальной массы и последующем повышении функции слизистой тонкого кишечника, являются кандидатами на лечение с помощью производных пептида ГПП-2. Конкретные состояния, которые можно лечить производными ГПП-2 по данному изобретению, включают различные формы мальабсорбции, включая брюшную мальабсорбцию,которая является результатом токсической реакции на глиадин пшеницы и отличается значительной потерей ворсинок в тонком кишечнике; тропический синдром мальабсорбции, являющийся результатом инфекции и отличающийся частичным сглаживанием ворсинок; спру (мальабсорбцию), которую обычно наблюдают у больных с общим изменчивым иммунодефицитом или с агаммаглобулинемией и которая отличается значительным уменьшением высоты кишечной ворсинки. Другие состояния, которые можно лечить производными по данному изобретению или для профилактики которых эти производные могут применяться, включают радиационный энтерит, инфекционный или послеинфекционный энтерит, регионарный энтерит (болезнь Крона), поражение тонкого кишечника в результате действия токсических или других химиотерапевтических агентов, а также синдром укороченного тонкого кишечника. В другом аспекте больными, которых можно лечить производными ГПП-2 пептида по данному изобретению, являются такие больные, которым становится лучше в результате роста панкреатических островков и, в частности, в результате пролиферации или регенерации панкреатических островков. Такие пациенты включают больных, страдающих заболеваниями или состояниями, отмеченными отсутствием или уменьшением панкреатических островков или пониженной функцией панкреатических островков. Особую группу кандидатов на такое лечение представляют собой больные, страдающие диабетом типа 1 или типа 2, а также больные со вторичными формами диабета вследствие инфильтрации, воспаления или разрушения поджелудочной железы. Производные ГПП-2 по данному изобретению можно применять индивидуально или в комбинации для оптимизации их терапевтического действия. Их можно вводить в физиологически приемлемой среде,например в деионизированной воде, физиологическом растворе с фосфатньм буфером (PBS), физиологи- 11006160 ческом растворе, водном этаноле или водном растворе другого спирта, плазме, белковых растворах, манните, водной глюкозе, спирте, растительном масле и т.п. Другие добавки, которые могут быть включены,содержат буферы, рН среды которых обычно забуферивают таким образом, чтобы значения их рН были в примерном интервале от 5 до 10, в которых концентрация буфера составляет около 50-250 мМ, а концентрация соли обычно находится в интервале около 5-500 мМ, физиологически приемлемые стабилизаторы и т.п. Композиции могут быть лиофилизированы для удобства хранения и транспортировки. Пептидные производные по данному изобретению можно вводить перорально, парентерально, например интраваскулярно (внутрисосудистая инъекция, IV, ВС), внутриартериально (IA, ВА), внутримышечно (IM, ВМ), подкожно (SC) и т.п. В соответствующих ситуациях можно вводить в виде вливания. В некоторых случаях, когда функциональная группа реагирует довольно медленно, можно применять пероральное, назальное, ректальное, трансдермальное введение, введение в виде аэрозолей, если природа конъюгата позволяет перенос в сосудистую систему. Обычно применяют единичную инъекцию, хотя, в случае необходимости, можно делать более одной инъекции. Пептидное производное можно вводить обычными средствами, включая шприц, троакар, катетер и т.п. Конкретный способ введения меняется в зависимости от вводимого количества, от того, нужна ли единичная болюсная инъекция или продолжительное введение и т.п. Предпочтительно, введение является внутрисосудистым, если место введения не является важным для данного изобретения, предпочтительно в место, где быстрый ток крови, например,внутривенно, в периферическую или центральную вену. Могут найти применение другие способы, при которых используют пролонгированное введение или защитную матрицу. Целью является эффективное распределение пептидов в крови так, чтобы они могли реагировать с компонентами крови. Концентрация конъюгата изменяется в очень широких пределах, как правило, около 1 пг/мл - 50 мг/мл. При внутрисосудистом введении общее количество вводимого пептида составляет, как правило, около 0,1 мг/мл - 10 мг/мл, более часто около 1 мг/мл - 5 мг/мл. Связывание с долгоживущими компонентами крови, такими как иммуноглобулин, сывороточный альбумин, эритроциты и тромбоциты, обеспечивает ряд преимуществ. Активность ГПП-2 производных по данному изобретению пролонгируется до дней и, возможно, до недель. В течение этого времени требуется лишь однократное введение. Можно достичь более высокой специфичности, так как активное соединение сначала связывается с большой молекулой, которая с меньшей вероятностью поглощается клеткой, чтобы помешать другим физиологическим процессам. Кровь хозяина - млекопитающего можно проверять на активность ГПП-2 и/или присутствие производных ГПП-2. Беря часть или пробу крови хозяина в разное время, можно определить, связался ли ГПП 2 с долгоживущими компонентами крови в достаточном количестве, чтобы быть терапевтически активным, а затем, уровень ГПП-2 в крови. Если требуется, можно также определить, с каким из компонентов крови ковалентно связан ГПП-2 пептид. Для конкретных малеинимидзамещнных пептидов значительно проще вычислить период полужизни сывороточного альбумина и IgG. Мониторинг также можно осуществлять, применяя анализы пептидной активности, ВЭЖХ - масс-спектрометрию (MS) или антитела к пептидам. Другой аспект данного изобретения относится к способам определения концентрации ГПП-2 пептида или его конъюгата в биологических образцах (таких как кровь) с применением антител, специфических в отношении ГПП-2 пептидов, и к применению таких антител для преодоления токсичности, вероятно, обусловленной такими ГПП-2 пептидами или конъюгатами. Это является преимуществом, так как повышенная устойчивость и продолжительное существование производных ГПП-2 in vivo в организме больного может вызвать новые проблемы в процессе лечения, включая повышенную вероятность токсичности. Применение антител против ГПП-2, моноклональных или поликлональных, специфических в отношении ГПП-2, может помочь решить любую подобную проблему. Антитело может быть генерировано или получено от хозяина, иммунизированного конкретным производным ГПП-2, или иммуногенным фрагментом агента, или синтезированным иммуногеном, соответствующим антигенной детерминанте агента. Предпочтительные антитела обладают высокой специфичностью и сродством (аффинностью) к нативной, дериватизированной и конъюгированной формам ГПП-2 пептидного производного. Такие антитела можно также метить ферментами, флуорохромами или радиоактивными метками. Антитела, специфические в отношении производных ГПП-2, можно получать, используя очищенные пептиды для индукции антител, специфических в отношении дериватизированных ГПП-2. Под индукцией антител понимается не только стимуляция иммунного ответа с помощью инъекции животному,но аналогичные стадии при получении синтетических антител или других специфических связывающих молекул, например скрининг библиотек рекомбинантных иммуноглобулинов. Как моноклональные, так и поликлональные антитела можно получать по методикам, хорошо известным в технике. Антитела могут также использоваться для мониторинга присутствия ГПП-2 пептида в кровотоке. Образцы крови и/или сыворотки можно анализировать методом SDS-PAGE и вестерн-блоттингом. Такие методы позволяют анализировать кровь или сыворотку для определения связывания производного ГПП 2 с компонентами крови. Антитела к антитерапевтическому агенту можно также использовать для лечения токсичности, вызванной введением производного ГПП-2, их можно вводить ex vivo или in vivo. Методы ех vivo включа- 12006160 ют иммунно-диализное лечение токсичности с применением антител к антитерапевтическому агенту,иммобилизованных на тврдом носителе. Методы in vivo включают введение антител к антитерапевтическому агенту в количествах, эффективных для индукции клиренса комплексов антитело-агент. Антитела можно использовать для удаления производных ГПП-2 и их конъюгатов из крови больных ех vivo при контактировании крови с антителами в стерильных условиях. Например, антитела можно прикреплять или иным образом иммобилизовать на носителе в колонке, и у больного можно взять кровь и пропустить через колонку. Производные ГПП-2 свяжутся с антителами, и кровь, содержащую небольшую концентрацию производного ГПП-2, можно затем снова ввести в кровоток больного. Количество отбираемого производного ГПП-2 можно контролировать, регулируя давление и скорость тока. Предпочтительного удаления производного ГПП-2 из компонента плазмы крови больного можно достигнуть, например, используя полупроницаемую мембрану или, иначе, сначала отделяя компонент плазмы от клеточного компонента способами, известными в технике, перед тем как пропускать компонент плазмы через колонку с носителем, содержащим антитела к терапевтическим агентам. Или же предпочтительного удаления производного ГПП-2, конъюгированного с клетками крови, включая эритроциты, можно достичь, собирая и концентрируя клетки крови больного и затем осуществляя контактирование этих клеток с фиксированными антителами против пептида для исключения компонента сыворотки крови больного. Антитела против ГПП-2 можно вводить in vivo, парентерально, больному, который получал в качестве лечения ГПП-2 производное или конъюгат. Антитела связываются с ГПП-2 производным или конъюгатами. Связывание ГПП-2 производного препятствует его активности, если не полностью блокирует е, тем самым уменьшая биологически активную концентрацию производного ГПП-2 в кровотоке больного и сводя к минимуму побочные эффекты. Кроме того, связанный комплекс антитело -ГПП-2 облегчает клиренс производного ГПП-2 и конъюгатов из кровотока больного. Следующие примеры приводятся для иллюстрации предпочтительных вариантов изобретения, и их ни в коей мере нельзя рассматривать как ограничивающие его объм. Если не указано иначе, используют оптически активные защищнные аминокислоты в L-конфигурации. Синтез Синтез пептидов ГПП-2 и их производных осуществляют по методике автоматизированной твердофазной реакции в синтезаторе пептидов Symphony с "ручным" вмешательством при получении производных ГПП-2. Синтез проводят на Fmoc-защищнной Ramage амидной линкерной смоле, используяFmoc удаляют с помощью 20% раствора пиперидина в ДМФА. При необходимости, для получения свободного N-конца после отщепления пептида от полимера на N конце используют Воc-защищнную аминокислоту. Если не указано иначе, все используемые в синтезе аминокислоты имеют Lконфигурацию. Для синтеза используют стеклянные реакционные сосуды, которые покрывают раствором для силиконизирования (Sigmacoted). Пример 1.His-Ala-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile-Leu-Asp-Asn-Leu-Ala-Ala-Arg-Asp-Phe-IleAsn-Trp-Leu-Ile-Gln-Thr-Lys-Ile-Thr-Asp-CONH2 Стадия 1. Твердофазный пептидный синтез проводят в масштабе 100 мкмоль. К смоле последовательно добавляют следующие защищнные аминокислоты: Fmoc Asp(tBu)-OH, Fmoc-Thr(tBu)-OH, FmocIle-OH, Fmoc-Lys(Boc)-OH, Fmoc-Thr(tBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Ile-OH, Fmoc-Leu-OH, FmocTrp(Boc)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Ile-OH, Fmoc-Phe-OH, Fmoc-Asp(tBu)-OH, Fmoc-Arg(Pbf)-OH,Fmoc-Ala-OH, Fmoc Ala-OH, Fmoc-Leu-OH, Fmoc-Asn(Trt)-OH, Fmoc-Asp(t-Bu)-OH, Fmoc-Leu-OH,Fmoc-Ile-OH, Fmoc-Thr(tBu)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Met-OH, Fmoc-Glu(tBu)-OH, Fmoc-Asp(tBu)OH, Fmoc-Ser(tBu)-OH, Fmoc-Phe-OH, Fmoc-Ser(tBu)-OH, Fmoc-Gly-OH, Fmoc-Asp(tBu)-OH, Fmoc-AlaOH, Boc-His(Boc)-OH. Их растворяют в N,N-диметилформамиде (ДМФА) и в, соответствии с последовательностью, активируют, используя O-бензотриазол-1-ил-N,N,N',N'-тетраметилуроний-гексафторфосфат(HBTU) или диизопропилэтиламин (DIEA). Удаление Fmoc защитной группы осуществляют с помощью 20 об.% раствора пиперидина в N,N-диметилформамиде (ДМФА) в течение 20 мин. Стадия 2. Пептид снимают с полимерной подложки, используя смесь 85% ТФК/5% TIS/5% тиоанизола и 5% фенола, с последующим осаждением охлаждаемым сухим льдом (0-4 С) Et2O. Сырой пептид собирают на воронке из полипропилена, сушат, снова растворяют в смеси ацетонитрила (40%) с водой(0,1% ТФК) и лиофилизируют, получая соответствующий сырой продукт, используемый в процессе очистки. Пример 2. МРА -His-Ala-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asp-Thr-Ile-Leu-Asp-Asn-Leu-Ala-Ala-Arg-Asp-PheIle-Asn-Trp-Leu-Ile-Gln-Thr-Lys-Ile-Thr-Asp-CONH2 Стадия 1. Твердофазный пептидный синтез проводят в масштабе 100 мкмоль. К смоле последовательно добавляют следующие защищнные аминокислоты: Fmoc-Asp(tBu)-OH, Fmoc-Thr(tBu)-OH, Fmoc- 13006160Ile-OH, Fmoc-Lys(Boc)-OH, Fmoc-Thr(tBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Ile-OH, Fmoc-Leu-OH, FmocTrp(Boc)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Ile-OH, Fmoc-Phe-OH, Fmoc-Asp(tBu)-OH, Fmoc-Arg(Pbf)-OH,Fmoc-Ala-OH, Fmoc-Ala-OH, Fmoc-Leu-OH, Fmoc-Asn(Trt)-OH, Fmoc Asp(tBu)-OH, Fmoc-Leu-OH, FmocIle-OH, Fmoc-Thr(tBu)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Met-OH, Fmoc-Glu(tBu)-OH, Fmoc-Asp(tBu)-OH,Fmoc-Ser(tBu)-OH, Fmoc-Phe-OH, Fmoc-Ser(tBu)-OH, Fmoc-Gly-OH, Fmoc-Asp(tBu)-OH, Fmoc-Ala-OH,Boc -His(Boc)-OH, MPA-OH. Стадия 2. Эту стадию осуществляют аналогично стадии 2 из примера 1. Пример 3.His-Ala-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile-Leu-Asp-Asn-Leu-Ala-Ala-Arg-Asp-Phe-IleAsn-Trp-Leu-Ile-Gln -Thr-Lys-Ile-Thr-Asp-Lys(MPA)-CONH2 Стадия 1. Эту стадию осуществляют так же как стадию 1 примера 1, см. выше, за исключением того, что первая кислота, добавляемая к полимерному носителю, представляет собой Fmoc-Lys(Aloc)-OH. Стадия 2. Селективную депротекпию Lys (Aloc) группы осуществляют вручную и выполняют, обрабатывая полимер раствором 3 экв. Pd(PPh3)4 в 5 мл С 6 Н 6:СНСl3 (1:1): 2,5 об.% NMM: 5 об.% АсОН в течение 2 ч. Затем полимер промывают СНСl3 (6 х 5 мл), 20% АсОН в DCM (в хлористом метилене, 6 х 5 мл) DCM (6 х 5 мл) и ДМФА (6 х 5 мл). Стадия 3. Синтез снова автоматизируют для прибавления 3-малеинимидо-пропионовой кислоты(МРА). Между прибавлениями (присоединениями) смолу три раза промывают N,N-диметилформамидом(ДМФА) и три раза изопропанолом. Стадия 4. Производное снимают с полимерной подложки, используя смесь 85% ТФК/5% TIS/5% тиоанизола и 5% фенола, с последующим осаждением охлаждаемым сухим льдом (0-4 С) Еt2 О. Сырой продуктпроизводное - собирают на воронке из полипропилена, сушат, снова растворяют в смеси ацетонитрила (40%) с водой (0,1% ТФК) и лиофилизируют, получая соответствующий сырой продукт, используемый для очистки. Пример 4.His-Ala-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile-Leu-Asp-Lys(MPA)-Leu-Ala-Ala-Arg-Asp-PheIle-Asn-Trp-Leu-Ile-GIn -Thr-Lys-Ile-Thr-Asp- ONH2 Стадия 1. Твердофазный пептидный синтез проводят в масштабе 100 мкмоль. К смоле последовательно добавляют следующие защищнные аминокислоты в соответствии с методикой, описанной на стадии 1 примера 1: Fmoc-Asp(tBu)-OH, Fmoc-Thr(tBu)-OH, Fmoc-Ile-OH, Fmoc-Lys(Boc)-OH, FmocThr(tBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Ile-OH, Fmoc-Leu-OH, Fmoc-Trp(Boc)-OH, Fmoc-Asn(Trt)-OH,Fmoc-Ile-OH, Fmoc-Phe-OH, Fmoc-Asp(tBu)-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Ala-OH, Fmoc Ala-OH, FmocLeu-OH, Fmoc-Lys(Aloc)-OH, Fmoc-Asp(t-Bu)-OH, Fmoc-Leu-OH, Fmoc-Ile-OH, Fmoc-Thr(tBu)-OH, FmocAsn(Trt)-OH, Fmoc-Met-OH, Fmoc-Glu(tBu)-OH, Fmoc-Asp(tBu)-OH, Fmoc-Ser(tBu)-OH, Fmoc-Phe-OH,Fmoc- Ser(tBu)-OH, Fmoc-Gly-OH, Fmoc-Asp(tBu)-OH, Fmoc-Ala-OH, Boc-His(Boc)-OH. Стадии 2-4. Эти стадии проводят как описано в примере 3, стадии 2-4. Пример 5. His-Gly-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile-Leu-Asp-Asn-Leu-Ala-Ala-Arg-AspPhe-Ile-Asn-Trp-Leu-Ile-Gln -Thr-Lys-Ile-Thr-Asp-CONH2 Стадия 1. Твердофазный пептидный синтез проводят в масштабе 100 мкмоль. К смоле последовательно добавляют следующие защищнные аминокислоты в соответствии с методикой, описанной на стадии 1 примера 1: Fmoc-Asp(tBu)-OH, Fmoc-Thr(tBu)-OH, Fmoc-Ile-OH, Fmoc-Lys(Boc)-OH, FmocThr(tBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Ile-OH, Fmoc-Leu-OH, Fmoc-Trp(Boc)-OH, Fmoc-Asn(Trt)-OH,Fmoc-Ile-OH, Fmoc-Phe-OH, Fmoc-Asp(tBu)-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Ala-OH, Fmoc Ala-OH, FmocLeu-OH, Fmoc-Asn(Trt)-OH, Fmoc-Asp(t-Bu)-OH, Fmoc-Leu-OH, Fmoc-Ile-OH, Fmoc-Thr(tBu)-OH, FmocAsn(Trt)-OH, Fmoc-Met-OH, Fmoc-Glu(tBu)-OH, Fmoc-Asp(tBu)-OH, Fmoc-Ser(tBu)-OH, Fmoc-Phe-OH,Fmoc- Ser(tBu)-OH, Fmoc-Gly-OH, Fmoc-Asp(tBu)-OH, Fmoc-Ala-OH, Fmoc-Gly-OH, Boc-His(Boc)-OH. Стадия 2. Эту стадию осуществляют аналогично стадии 2 из примера 1. Пример 6. МРА-His-Gly-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile-Leu-Asp-Asn-Leu-Ala-Ala-Arg-Asp-PheIle-Asn-Trp-Leu-He-Gln-Thr -Lys-Ile-Thr-Asp-CONH2 Стадия 1. Эту стадию проводят так же, как стадию 1 из примера 2, за исключением того, что остаток аланина в положении 2 заменяют на глицин. Стадия 2. Эту стадию осуществляют аналогично стадии 2 из примера 1. Пример 7.His-Gly-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile-Leu-Asp-Lys(MPA)-Leu-Ala-Ala-Arg-Asp-PheIle-Asn-Trp-Leu-Ile-GIn-Thr-Lys-Ile- Thr-Asp-CONH2 Стадия 1. Твердофазный пептидный синтез проводят в масштабе 100 мкмоль. К смоле последовательно добавляют следующие защищнные аминокислоты в соответствии с методикой, описанной на стадии 1 примера 1: Fmoc-Asp(tBu)-OH, Fmoc-Thr(tBu)-OH, Fmoc-Ile-OH, Fmoc-Lys(Boc)-OH, FmocThr(tBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Ile-OH, Fmoc-Leu-OH, Fmoc-Trp(Boc)-OH, Fmoc-Asn(Trt)-OH,Fmoc-Ile-OH, Fmoc-Phe-OH, Fmoc-Asp(tBu)-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Ala-OH, Fmoc Ala-OH, FmocLeu-OH, Fmoc-Lys(Aloc)-OH, Fmoc-Asp(t-Bu)-OH, Fmoc-Leu-OH, Fmoc-Ile-OH, Fmoc-Thr(tBu)-OH, Fmoc- 14006160Asn(Trt)-OH, Fmoc-Met-OH, Fmoc-Glu(tBu)-OH, Fmoc-Asp(tBu)-OH, Fmoc-Ser(tBu)-OH, Fmoc-Phe-OH,Fmoc-Ser(tBu)-OH, Fmoc-Gly-OH, Fmoc-Asp(tBu)-OH, Fmoc-Gly-OH, Boc-His(Boc)-OH. Стадии 2-4. Эти стадии проводят как описано в примере 3, стадии 2-4. Пример 8.His-Gly-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile-Leu-Asp-Asn-Leu-Ala-Ala-Arg-Asp-Phe-IleAsn-Trp-Leu-Ile-GIn-Thr-Lys-He-Thr-Asp-Lys(MPA)-CONH2 Стадия 1. Эту стадию проводят так же как стадию 1 из примера 5, см. выше, за исключением того,что первая кислота, добавляемая к полимерному носителю, представляет собой Fmoc-Lys(Aloc)-OH. Стадии 2-4. Эти стадии проводят аналогично стадиям 2-4 из примера 3. Пример 9.His-Gly-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile-Leu-Asp-Lys(AEEA-MPA)-Leu -Ala- Ala -ArgAsp -Phe-Ile-Asn-Trp -Leu -Ile -Gln-Thr -Lys -Ile -Thr-Asp-CONH2 Стадия 1. Эту стадию проводят так же, как стадию 1 из примера 7. Стадия 2. Селективную депротекцию Lys (Aloc) группы осуществляют вручную и выполняют, обрабатывая полимер раствором 3 экв. Рd(РРh3)4 в 5 мл С 6 Н 6:СНСl3 (1:1): 2,5 об.% NMM: 5 об.% АсОН в течение 2 ч. Затем полимер промывают СНСl3 (6 х 5 мл), 20% АсОН в DCM (в хлористом метилене, 6 х 5 мл) DCM (6 х 5 мл) и ДМФА (6 х 5 мл). Стадия 3. Синтез снова автоматизируют для прибавления Fmoc-AEEA-OH (Fmoc-аминоэтоксиэтоксиуксусной кислотой). Между прибавлениями (присоединениями) смолу три раза промывают N,Nдиметилформамидом (ДМФА) и три раза изопропанолом. После соответствующей депротекции к спейсеру прикрепляют МРА (3-малеинимидопропионовую кислоту) и смолу снова три раза промывают N,Nдиметилформамидом (ДМФА) и три раза изопропанолом. Стадия 4. Пептид снимают с полимерной подложки, используя смесь 85% ТФК/5% TIS/5% тиоанизола и 5% фенола, с последующим осаждением охлаждаемым сухим льдом (0-4 С) Et2O. Сырой пептид собирают на воронке из полипропилена, сушат, снова растворяют в смеси ацетонитрила (40%) с водой(0,1% ТФК) и лиофилизируют, получая соответствующий сырой продукт, используемый для очистки. Пример 10.His-Gly-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile -Leu-Asp -Asn-Leu -Ala-Ala-Arg-Asp-Phe-IleAsn-Trp-Leu-Ile-Gln-Thr-Lys-Ile-Thr-Asp-Lys(AEEA-MPA)-CONH2 Стадия 1. Эту стадию проводят так же как стадию 1 из примера 5, см. выше, за исключением того,что первая кислота, добавляемая к полимерному носителю, представляет собой Fmoc-Lys(Aloc)-OH. Стадии 2-4: Эти стадии проводят аналогично стадиям 2-4 из примера 9. Пример 11. МРА-AEEA-His-Gly-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile-Leu-Asp-Asn-LeuAla-Ala-Arg-Asp-Phe-Ile-Asn-Trp-Leu-Ile-Gln-Thr-Lys-Ile-Thr-Asp-CONH2 Стадия 1. Эту стадию проводят так же как стадию 1 из примера 6, за исключением того, что в конце синтеза перед добавлением МРА-ОН к полимеру добавляют Fmoc-AEEA-OH. Стадия 2. Эту стадию осуществляют аналогично стадии 2 из примера 1. Пример 12. МРА -AEEA-His-Ala-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile -Leu-Asp-Asn-Leu -Ala-Ala-ArgAsp-Phe-Ile-Asn-Trp-Leu-Ile-Gln-Thr-Lys-Ile-Thr-Asp-CONH2 Стадия 1. Эту стадию проводят так же, как стадию 1 из примера 1, за исключением того, что в конце синтеза перед добавлением МРА-ОН к полимеру добавляют Fmoc-AEEA-OH. Стадия 2. Эту стадию осуществляют аналогично стадии 2 из примера 1. Пример 13.His-Ala-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile-Leu-Asp-Asn-Leu-Ala-Ala-Arg-Asp-Phe-IleAsn-Trp-Leu-Ile-Gln-Thr-Lys-Ile-Thr-Asp-Lys(AEEA-MPA)-CONH2 Стадия 1. Эту стадию проводят так же, как стадию 1 из примера 1, см. выше, за исключением того,что первая кислота, добавляемая к полимерному носителю, представляет собой Fmoc-Lys(Aloc)-OH. Стадии 2-4. Эти стадии проводят аналогично стадиям 2-4 из примера 9. Пример 14.His-Ala-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile-Leu-Asp-Lys(AEEA-МРА)-Leu-Ala-Ala-ArgAsp-Phe-Ile-Asn-Trp-Leu-Ile-Gln-Thr-Lys-Ile-Thr-Asp-CONH2 Стадия 1. Эту стадию проводят так же, как стадию 1 из примера 4. Стадии 2-4. Эти стадии проводят аналогично стадиям 2-4 из примера 9. Пример 15.His-Ala-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile-Leu-Asp-Asn-Lys(MPA)-Ala-Ala-Arg-Asp-PheIle-Asn-Trp-Leu-Ile-Gln-Thr-Lys-Ile-Thr-Asp-CONH2 Стадия 1. Твердофазный пептидный синтез проводят в масштабе 100 мкмоль. К полимерной подложке (смоле) последовательно добавляют следующие защищнные аминокислоты в соответствии с методикой, описанной на стадии 1 примера 1: Fmoc-Asp(tBu)-OH, Fmoc-Thr(tBu)-OH, Fmoc -Ile-OH, FmocLys(Boc)-OH, Fmoc-Thr(tBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Ile-OH, Fmoc-Leu-OH, Fmoc-Trp(Boc)-OH,Fmoc-Asn(Trt)-OH, Fmoc-Ile-OH, Fmoc-Phe-OH, Fmoc-Asp(tBu)-OH, Fmoc-Arg(Pbf)-OH, Fmo-Ala-OH,- 15006160Fmoc Ala-OH, Fmoc-Lys(Aloc)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Asp(t-Bu)-OH, Fmoc-Leu-OH, Fmoc-Ile-OH,Fmoc-Thr(tBu)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Met-OH, Fmoc-Glu(tBu)-OH, Fmoc-Asp(tBu)-OH, FmocSer(tBu)-OH, Fmoc-Phe-OH, Fmoc-Ser(tBu)-OH, Fmoc-Gly-OH, Fmoc-Asp(tBu)-OH, Fmoc-Ala-OH, BocHis(Boc)-OH. Стадии 2-4. Эти стадии проводят как описано в примере 3, стадии 2-4. Пример 16.His-Ala-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile-Lys(MPA)-Asp-Asn-Leu-Ala-Ala-Arg-Asp-PheIle-Asn-Trp-Leu-Ile-GIn-Thr-Lys-Ile-Thr-Asp-CONH2 Стадия 1. Твердофазный пептидный синтез проводят в масштабе 100 мкмоль. К полимерной подложке (смоле) последовательно добавляют следующие защищнные аминокислоты в соответствии с методикой, описанной на стадии 1 примера 1: Fmoc-Asp(tBu)-OH, Fmoc-Thr(tBu)-OH, Fmoc-Ile-OH, FmocLys(Boc)-OH, Fmoc-Thr(tBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Ile-OH, Fmoc-Leu-OH, Fmoc-Trp(Boc)-OH,Fmoc-Asn(Trt)-OH, Fmoc-Ile-OH, Fmoc-Phe-OH, Fmoc-Asp(tBu)-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Ala-OH,Fmoc Ala-OH, Fmoc-Leu-OH, Fmoc-Asn(Trt)-OH, Fmoc-Asp(t-Bu)-OH, Fmoc -Lys(Aloc)-OH, Fmoc-Ile-OH,Fmoc-Thr(tBu)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Met-OH, Fmoc-Glu(tBu)-OH, Fmoc-Asp(tBu)-OH, FmocSer(tBu)-OH, Fmoc-Phe-OH, Fmoc-Ser(tBu)-OH, Fmoc-Gly-OH, Fmoc-Asp(tBu)-OH, Fmoc-Ala-OH, BocHis(Boc)-OH. Стадии 2-4. Эти стадии проводят как описано в примере 3, стадии 2-4. Пример 17.His-Ala-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile-Leu-Asp-Asn-Leu-Ala-Ala-Arg-Lys(MPA)-PheIle-Asn-Trp -Leu-Ile-Gln-Thr-Lys-Ile-Thr-Asp-CONH2 Стадия 1. Твердофазный пептидный синтез проводят в масштабе 100 мкмоль. К полимерной подложке (смоле) последовательно добавляют следующие защищнные аминокислоты в соответствии с методикой, описанной на стадии 1 примера 1: Fmoc-Asp(tBu)-OH, Fmoc-Thr(tBu)-OH, Fmoc-Ile-OH, FmocLys(Boc)-OH, Fmoc-Thr(tBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Ile-OH, Fmoc-Trp(Boc)-OH, Fmoc-Asn(Trt)OH, Fmoc-Ile-OH, Fmoc-Phe-OH, Fmoc-Lys(Aloc)-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Ala-OH, Fmoc Ala-OH,Fmoc-Leu-OH, Fmoc-Asn(Trt)-OH, Fmoc-Asp(t-Bu)-OH, Fmoc-Leu-OH, Fmoc-Ile-OH, Fmoc-Thr(tBu)-OH,Fmoc-Asn(Trt)-OH, Fmoc-Met-OH, Fmoc-Glu(tBu)-OH, Fmoc-Asp(tBu)-OH, Fmoc-Ser(tBu)-OH, Fmoc-PheOH, Fmoc-Ser(tBu)-OH, Fmoc-Gly-OH, Fmoc-Asp(tBu)-OH, Fmoc-Ala-OH, Boc-His(Boc)-OH. Стадии 2-4. Эти стадии проводят как описано в примере 3, стадии 2-4. Пример 18.His-Ala-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile-Leu-Asp-Asn-Lys(AEEA-MPA)-Ala-Ala-ArgAsp-Phe-Ile-Asn-Trp-Leu-Ile-Gln-Thr-Lys-Ile-Thr-Asp-CONH2 Стадия 1. Эту стадию проводят так же, как стадию 1 из примера 15. Стадии 2-4. Эти стадии проводят аналогично стадиям 2-4 из примера 9. Пример 19.His-Ala-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile-Lys(AEEA-MPA)-Asp-Asn-Leu-Ala-Ala-ArgAsp-Phe-Ile-Asn-Trp-Leu -Ile-Gln-Thr-Lys-Ile-Thr-Asp-CONH2 Стадия 1. Эту стадию проводят так же, как стадию 1 из примера 16. Стадии 2-4. Эти стадии проводят аналогично стадиям 2-4 из примера 9. Пример 20.His-Ala-Asp-Gly-Ser-Phe-Ser-Asp-Glu-Met-Asn-Thr-Ile-Leu-Asp-Asn-Leu-Ala-Ala-Arg-Lys(AEEAMPA)-Phe-Ile-Asn-Trp-Leu-Ile-Gln-Thr-Lys-Ile-Thr-Asp-CONH2 Стадия 1. Эту стадию проводят так же, как стадию 1 из примера 17. Стадии 2-4. Эти стадии проводят аналогично стадиям 2-4 из примера 9. Методика очистки Каждое соединение очищают препаративной обращнно-фазовой ВЭЖХ, используя систему препаративной бинарной ВЭЖХ Varian (Dynamax). Очистку производят на колонке Phenomenex Luna 10 мк фенил - гексил, 50 мм х 250 мм (частицы 10 мк), уравновешенной смесью вода/ТФК (0,1% ТФК в H2O(растворитель А и ацетонитрил/ТФК (0,1% ТФК в CH3CN (растворитель В. Элюирование проводят,пропуская смесь в градиенте 28-38% растворителя В со скоростью 50 мл/мин в течение 180 мин. Фракции, содержащие пептид, определяют УФ спектроскопией по поглощению при 214 и 254 нм (Varian Dynamax UVD II). Фракции собирают в виде аликвот по 25 мл. Фракции, содержащие нужный продукт, идентифицируют, определяя массу с помощью непосредственной инъекции в LC/MS. Отобранные фракции последовательно анализируют методом аналитической ВЭЖХ (20-60% В в течение 20 мин; колонка PhenomenexLuna 5 мк фенил - гексил, 10 мм х 250 мм, 0,5 мл/мин), идентифицируют фракции с чистотой 90% и объединяют эти фракции. Пул замораживают в жидком азоте и сушат, а затем лиофилизируют по меньшей мере в течение 2 дней, получая белый порошок. Результаты in vivo Активность соединений из примеров 1-8 в отношении кишечника ("интестинотрофическую" активность) оценивают на нормальной мышиной модели. Самцам мышей CD-1 в возрасте пять недель (20-25- 16006160 г) дважды в день в течение 10 дней подряд вводят дозу 5 мг каждого соединения в виде раствора в 0,9% водном растворе NaCl. Соединения вводят в виде подкожных инъекций в дорсальный - латеральный участок поясничной области. Контрольным животным вводят дозу 0,25 мл 0,9% NaCl. На 11 день мышей не кормят в течение 4 ч и анестезируют с помощью СO2. Тонкие кишечники удаляют, чистят и взвешивают. У животных, получавших соединения из примеров 1, 3, 5, 7 и 8, наблюдается значительное увеличение веса тонкого кишечника. Результаты показаны на фиг. 1. Как можно видеть,более явно выраженное действие на кишечник получено при использовании соединений из примеров 5, 7 и 8, стабилизированных остатком глицина в положении 2, по сравнению с нативными пептидами ГПП-2 из примеров 1 и 3. Эффект дозы выбранных Gly2-ГПП-2 аналогов. Самки мышей CD-1 в возрасте шесть недель (20-25 г) дважды в день в течение 10 дней подряд получают дозу 5, 25 или 50 мкг соединений из примеров 5, 7 и 8. Соединения растворяют в 0,083 натрийфосфатном буфере, рН 6,8, и вводят в виде подкожных инъекций в дорсальный - латеральный участок поясничной области. Контрольным животным вводят дозу 0,25 мл натрий-фосфатного буфера. На 11 день накормленных мышей анестезируют с помощью Halothane и после лапаротомии отбирают тонкий кишечник, толстый кишечник и желудок каждой мыши. Затем ткани чистят и взвешивают. Статистически значимое увеличение веса тонкого кишечника по сравнению с контрольными мышами (от 53 до 88%) демонстрируют все группы (см. фиг. 2). Однако никакого эффекта дозы не наблюдается при использовании соединений из примеров 5 и 7, хотя возможный эффект дозы наблюдается для соединения из примера 8. Вес толстого кишечника увеличивается на 27-48% во всех пролеченных группах. Опять же в случае соединений из примеров 5 и 7 не наблюдается никакого эффекта дозы, тогда как в случае соединения из примера 8 (см. фиг. 2) отмечается возможный эффект дозы. Эти результаты показывают, что производные ГПП-2 из примеров 7 и 8 проявляют "интестинотрофическую" активность, сходную с активностью соответствующего свободного пептида из примера 5. Фармакокинетический профиль у крыс Фармакокинетические характеристики соединений из примеров 5 и 8 изучают на нормальных крысах после однократной внутривенной или подкожной инъекции. Концентрации в плазме определяют радиоиммунноанализом с продажным антителом к ГПП-2 человека. Эксперименты на животных Анализируемые органы растворяют в 0,083 М натрий - фосфатном буфере, рН 6,8, и вводят самцам крыс Sprague - Dawley в возрасте восьми - одиннадцати недель в виде однократной внутривенной или подкожной инъекции при уровне дозы 500 нмоль/кг. Серийные пробы крови (150-200 мкл) отбирают в пробирки, содержащие EDTA ингибитор DPP-IV, в следующих временных точках: перед введением дозы, через 5 и 30 мин и через 1, 2, 4, 8, 24, 48, 72 и 96 ч после введения испытуемого агента. Цельную кровь центрифугируют, а затем отбирают образцы плазмы и хранят до момента анализа при -80 С. Анализ плазмы Концентрацию соединений из примеров 5 и 8 в плазме определяют радиоиммуноанализом, используя кроличье поликлональное антитело к ГПП-2 человека (Peninsula Laboratories, RGG7176) и йодированный человеческий ГПП-2 в качестве метки. Фармакокинетический анализ Дескриптивные фармакокинетические параметры определяют стандартными независимыми от модели методами (Gibaldi and Perrier, 1982), основанными на анализе данных концентрации в плазме во времени. Фармакокинетический анализ осуществляют, используя макросы, написанные для MicrosoftExcel 97. Рассчитываются следующие параметры: Сmax обозначает максимальную концентрацию в плазме; Тmax обозначает время, когда наблюдается Сmах; Т 1/2 обозначает конечное время полужизни;AUC(0 - бесконечность) обозначает площадь под кривой концентрация в плазме - время от времени 0 до времени бесконечность;MRT обозначает среднее время пребывания (в организме) иVss обозначает объм распределения препарата в стационарном состоянии. Кривые концентрации в плазме показаны на фиг. 3, а соответствующие фармакокинетические параметры представлены в табл. 2, см. ниже. Эти результаты показывают, что ГПП-2, дериватизированный по данному изобретению, эффективно уменьшает элиминирование и распределение соответствующего свободного пептида Gly2-GLP (ГПП)-2, тем самым продуцируя более высокую концентрацию в плазме и более продолжительное время полужизни в большом круге кровообращения.- 17006160 Таблица 2. Сравнение средних фармакокинетических параметров соединений из примеров 5 и 8 у крысSprague-Dawley после однократной дозы 500 нмоль/кг Иммуноблоттинг Образцы плазмы для фармакокинетических исследований на крысах анализируют методом иммуноблоттинга. Белки плазмы разделяют в невосстанавливающих условиях, применяя электрофорез в акриламидном геле в присутствии додецилсульфата натрия (SDS - PAGE) no Laemmi (1970). Образцы плазмы сначала разводят 1:10 дистиллированной водой и 20 мкл смешивают с 10 мкл 3 Х буфера Laemmi(30 мМ TrisCl, 3 мМ EDTA, 15% SDS, pH 6,8) и 2 мкл раствора бромфенолового синего (0,1% бромфенолового синего, 50 % глицерина). Смеси помещают в кипящую водяную баню на 3 мин и наносят на гель. Белки сначала концентрируются в 3% концентрирующем геле, а затем мигрируют в 8% разделяющем геле, при этом используется мини-гель система с 10-луночными гребнками (1,5 х 4,8 мм). Электрофорез проводят при постоянном токе 15 мА/гель для концентрирования белков в концентрирующем геле и при 20 мА/гель в разделяющем геле примерно в течение 1,5 ч. Белки последовательно переносят на нитроцеллюлозную мембрану с помощью устройства для переноса полужидких веществ на 1 ч при 100 мА/гель. Эффективность переноса проверяют с помощью обратимого окрашивания мембраны 1%-ным раствором Ponceau. Иммунохимическое обнаружение Мембраны в течение ночи насыщают при 4 С физиологическим раствором, забуференным трисом(Tris) (TBS), содержащим 5% нежирного молока. После трх отмываний TBS-0,5% Tween 20 в течение 5 мин блоты инкубируют 90 мин при комнатной температуре с кроличьим поликлональным антителом против ГПП-2 (Peninsula Laboratories, RGG7176), разведнным 1:2500 в TBS- 0,5% Tween 20, содержащем 1% плазмы крыс. Блоты отмывают 3 раза в течение 10 мин TBS- 0,05% Tween 20 и затем инкубируют в течение одного часа при комнатной температуре с меченым пероксидазой антителом осла к кроличьему IgG (Jackson, 711-036-152), разведнным 1:100000 в TBS- 0,05% Tween 20. После 3 отмываний осуществляют проявление, используя хемилюминесцентный субстрат пероксидазы (набор ECLAmersham Pharmacia Biotech). Плнки экспонируют в течение 5-10 мин. Или же мембраны в течение 1 ч инкубируют с антителом кролика к альбумину крыс (AccurateChemical, YN - RRaALBP), разведнным 1:400000 в TBS- 0,05% Tween 20. После 3 отмываний TBS0,05% Tween 20 проявление осуществляют как описано выше. Результаты Предварительный скрининг показывает, что продажное антитело против ГПП-2 недостаточно чувствительно для того, чтобы обнаруживать соединение из примера 7, конъюгированное с белками, методом вестерн-блоттинга. Поэтому этим методом анализируют только образцы плазмы крыс, инъецируемые с соединением из примера 8. Результаты, проиллюстрированные на фиг. 4, показывают, что соединение из примера 8 эффективно связывается (образует конъюгаты) с альбумином крыс после внутривенного введения. Слабый сигнал также наблюдается после подкожного (sc) введения альбумина (не показан). Сравнение с антителом к альбумину крыс показывает, что большинство полос, обнаруживаемых с помощью антитела против ГПП-2, за исключением одной, можно отнести к различным видам альбумина (мономеры, димеры и полимеры). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Стимулятор роста желудочно-кишечных тканей, способный связываться ковалентной связью invivo с функциональной группой компонента крови, содержащий пептид, имеющий последовательностьR1-(Y1)m-X1-X2-X3-X4-X5-Phe6-Ser7-Asp8-(P1)-X14-Asp15-X16-X17-Ala18-X19-X20-X21-Phe22-(P2)-Trp25Leu26-X27-X28-Thr29-Lys30-P3-(Y2)n-R2 где X1 обозначает His или Туr; Х 2 обозначает Ala, Gly, D-Ala, Pro, Ile, Nor-Val, -аминомасляную кислоту или Ala-замещающую аминокислоту, придающую указанному аналогу устойчивость к ферменту DPP-IV; Х 3 обозначает Asp, Glu, Pro, HPro; или Х 2-Х 3 обозначают Х 2(СН(ОН)СН 2)Х 3, Х 2(СН 2NН 2)Х 3 или Х 2(СНСН)Х 3, где Х 2 и Х 3 имеют значение по определению выше; Х 4 обозначает Gly или Ala; Х 5 обозначает Ser или Ala;P3 обозначает ковалентную связь или Ilе, Ile-Thr, Ile-Thr-Asp или Ile-Thr-Asn;Y1 обозначает один или два остатка из Arg, Lys и His;Y2 обозначает один или два остатка из Arg, Lys и His иm и n независимо обозначают 0 или 1; или его аналог, или его фрагмент, обладающий активностью, стимулирующей рост желудочно-кишечных тканей; и реакционноспособную группу, связанную с пептидом. 2. Стимулятор по п.1, у которого реакционноспособной группой является малеинимидная или малеинимидосодержащая группа. 3. Стимулятор по п.1, у которого X1 обозначает His; X2 обозначает Аlа или Gly; Х 3 обозначает Asp;X4 обозначает Gly; X5 обозначает Ser; P1 обозначает Glu-X10-Asn-Thr-Ile; Х 10 обозначает Met; X16 обозначает Asn или Lys; X19 обозначает Ala; X20 обозначает Arg; X27 обозначает Ile; X28 обозначает Gln; P2 обозначает Ile-Asn; Р 3 обозначает Ile-Thr-Asp и R2 обозначает CONH2. 4. Стимулятор по п.3, у которого пептид выбирают из группы, состоящей из 5. Стимулятор по п.1, у которого пептид выбирают из группы, состоящей из 6. Стимулятор по п.1, способный связываться с компонентом крови, представляющим собой белки крови. 7. Фармацевтическая композиция, содержащая стимулятор роста желудочно-кишечных тканей по п.1 в комбинации с фармацевтически приемлемым носителем. 8. Композиция по п.7, предназначенная для лечения или предупреждения желудочно-кишечных расстройств или заболеваний. 9. Способ лечения или предупреждения желудочно-кишечных расстройств или заболеваний у субъекта, заключающийся во введении субъекту эффективного количества стимулятора роста желудочнокишечных тканей по п.1, индивидуально или в комбинации с фармацевтически приемлемьм носителем. 10. Способ стимулирования роста желудочно-кишечных тканей у субъекта, заключающийся во введении субъекту эффективного количества стимулятора роста желудочно-кишечных тканей по п.1, индивидуально или в комбинации с фармацевтически приемлемым носителем. 11. Конъюгат, содержащий стимулятор роста желудочно-кишечных тканей по п.1, связанный ковалентной связью с компонентом крови. 12. Конъюгат по п.11, отличающийся тем, что реакционноспособная группа представляет собой малеинимидную группу или малеинимидосодержащую группу, а компонент крови представляет собой белок крови.- 20006160 13. Конъюгат по п.12, отличающийся тем, что белок крови представляет собой сывороточный альбумин. 14. Конъюгат по п.11, отличающийся тем, что стимулятор роста желудочно-кишечных тканей представляет собой стимулятор по п.5. 15. Способ увеличения in vivo времени полужизни глюканоподобного пептида 2, обладающего активностью, стимулирующей рост желудочно-кишечных тканей, заключающийся в связывании ковалентной связью пептида с компонентом крови. 16. Способ по п.15, отличающийся тем, что пептид представляет собой аналог или фрагмент глюканоподобного пептида 2, обладающий активностью, стимулирующей рост желудочно-кишечных тканей. 17. Способ по п.15, отличающийся тем, что пептид представляет собой пептид по п.4. 18. Способ лечения или предупреждения желудочно-кишечных расстройств или заболеваний у субъекта, заключающийся во введении субъекту эффективного количества конъюгата по п.11, индивидуально или в комбинации с фармацевтическим носителем. Список последовательностей
МПК / Метки
МПК: A61K 38/26, A61P 1/00, C07K 14/605
Метки: глюкагоноподобный, 2(glp-2, желудочно-кишечных, лечения, расcтройств, гпп-2, заболеваний, долгоживущий, пептид
Код ссылки
<a href="https://eas.patents.su/30-6160-dolgozhivushhijj-glyukagonopodobnyjj-peptid-2glp-2-gpp-2-dlya-lecheniya-zheludochno-kishechnyh-zabolevanijj-i-rasctrojjstv.html" rel="bookmark" title="База патентов Евразийского Союза">Долгоживущий глюкагоноподобный пептид 2(glp-2, гпп-2) для лечения желудочно-кишечных заболеваний и расcтройств</a>
Предыдущий патент: Катализатор для очистки выхлопного газа дизельного двигателя
Следующий патент: Тестирование чувствительности вирусов к лекарству
Случайный патент: Гидравлический дозировочный клапан для управления скважинным инструментом


































