Способы лечения инфекций, вызываемых вирусом гепатита дельта, с использованием β-l-2′-дезоксинуклеозидов
Формула / Реферат
1. Способ лечения хозяина, инфицированного вирусом гепатита D, предусматривающий введение эффективного для лечения количества 2'-дезокси-b -L-эритропентофуранонуклеозида формулы
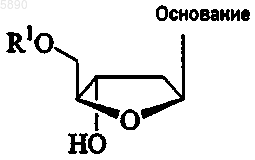
или его фармацевтически приемлемой соли, где
R1 выбран из группы, состоящей из H, прямого, разветвленного или циклического алкила, CO-алкила, CO-арила, CO-алкоксиалкила, CO-арилоксиалкила, CO-замещенного арила, алкилсульфонила, арилсульфонила, аралкилсульфонила, аминокислотного остатка, моно-, ди- или трифосфата или фосфатного производного; и
"основание" представляет пуриновое или пиримидиновое основание, которое может быть, но необязательно, замещенным; и
где углеводород в составе радикалов представляет собой прямой, разветвленный или циклический первичный углеводород, содержащий до 18 и предпочтительно до 6 атомов углерода, необязательно замещенный одной или несколькими группами, выбранными из числа гидроксила, амино, алкиламино, ариламино, алкокси, арилокси, нитро, циано, сульфоновой кислоты, сульфата, фосфоновой кислоты, фосфата или фосфоната, либо незащищенных, либо защищенных.
2. Способ по п.1, где 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-2'-дезоксипурин формулы
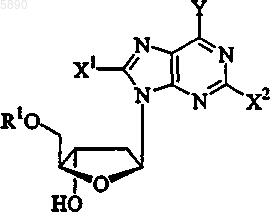
или его фармацевтически приемлемую соль, где
R1 выбран из группы, состоящей из H, прямого, разветвленного или циклического алкила, CO-алкила, CO-арила, CO-алкоксиалкила, CO-арилоксиалкила, CO-замещенного арила, алкилсульфонила, арилсульфонила, аралкилсульфонила, аминокислотного остатка, моно-, ди- или трифосфата или фосфатного производного;
Y представляет OR3, NR3R4 или SR3;
X1 и X2 независимо выбраны из группы, состоящей из H, прямого, разветвленного или циклического алкила, CO-алкила, CO-арила, CO-алкоксиалкила, галогена, OR5, NR5NR6 или SR5; и
R3, R4, R5 и R6 независимо представляют H, прямой, разветвленный или циклический алкил, CO-алкил, CO-арил, CO-алкоксиалкил, CO-арилоксиалкил, CO-замещенный арил, алкилсульфонил, арилсульфонил, аралкилсульфонил, аминокислотный остаток, моно-, ди- или трифосфат или фосфатное производное.
3. Способ по п.2, где 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-2'-дезоксиаденозин формулы
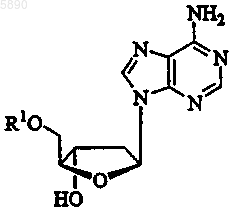
или его фармацевтически приемлемую соль, где R1 представляет H, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное.
4. Способ по п.3, где R1 представляет водород.
5. Способ по п.3, где R1 представляет ацил.
6. Способ по п.5, где указанный ацил происходит от аминокислоты.
7. Способ по п.6, где указанной аминокислотой является валин.
8. Способ по п.2, где указанный 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-2'-дезоксигуанозин формулы
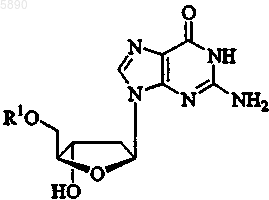
или его фармацевтически приемлемую соль, где R1 представляет H, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное.
9. Способ по п.2, где указанный 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-2'-дезоксиинозин формулы
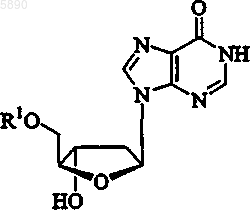
или его фармацевтически приемлемую соль, где R1 представляет H, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное.
10. Способ по п.1, где указанный 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-2'-дезоксипиримидин формулы
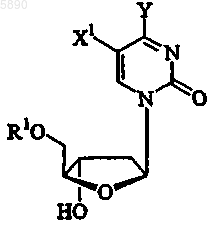
или его фармацевтически приемлемую соль, или пролекарство, где
R1 выбран из группы, состоящей из H, прямого, разветвленного или циклического алкила, CO-алкила, CO-арила, CO-алкоксиалкила, CO-арилоксиалкила, CO-замещенного арила, алкилсульфонила, арилсульфонила, аралкилсульфонила, аминокислотного остатка, моно-, ди- или трифосфата или фосфатного производного;
Y представляет OR3, NR3R4 или SR3;
X1 выбран из группы, состоящей из H, прямого, разветвленного или циклического алкила, CO-алкила, CO-арила, CO-алкоксиалкила, галогена, OR5, NR5NR6 или SR5; и
R3, R4, R5 и R6 независимо представляют H, прямой, разветвленный или циклический алкил, CO-алкил, CO-арил, CO-алкоксиалкил, CO-арилоксиалкил, CO-замещенный арил, алкилсульфонил, арилсульфонил, аралкилсульфонил, аминокислотный остаток, моно-, ди- или трифосфат или фосфатное производное.
11. Способ по п.10, где указанный 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-2'-дезоксицитидин формулы
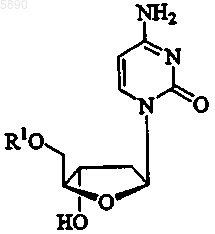
или его фармацевтически приемлемую соль, где R1 представляет H, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное.
12. Способ по п.11, где R1 представляет водород.
13. Способ по п.11, где R1 представляет ацил.
14. Способ по п.13, где указанный ацил происходит от аминокислоты.
15. Способ по п.14, где указанной аминокислотой является валин.
16. Способ по п.10, где указанный 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-2'-дезоксиуридин формулы
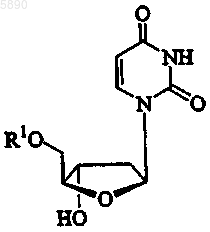
или его фармацевтически приемлемую соль, где R1 представляет H, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное.
17. Способ по п.10, где указанный 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-тимидин формулы
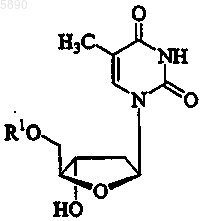
или его фармацевтически приемлемую соль, где R1 представляет H, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное.
18. Способ по п.17, где R1 представляет водород.
19. Способ по п.17, где R1 представляет ацил.
20. Способ по п.19, где указанный ацил происходит от аминокислоты.
21. Способ по п.20, где указанной аминокислотой является валин.
22. Способ лечения хозяина, инфицированного вирусом гепатита D, предусматривающий введение эффективного для лечения гепатита D количества по крайней мере двух 2'-дезокси-b -L-эритропентофуранонуклеозидов в комбинации или поочередно, где каждый 2'-дезокси-b -L-эритропентофуранонуклеозид независимо представляет соединение формулы
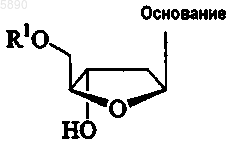
или его фармацевтически приемлемую соль, где
R1 выбран из группы, состоящей из H, прямого, разветвленного или циклического алкила, CO-алкила, CO-арила, CO-алкоксиалкила, CO-арилоксиалкила, CO-замещенного арила, алкилсульфонила, арилсульфонила, аралкилсульфонила, аминокислотного остатка, моно-, ди- или трифосфата или фосфатного производного; и
"основание" представляет собой пуриновое или пиримидиновое основание, которое может быть, но необязательно, замещенным; и
уфх углеводород в составе радикалов представляет собой прямой, разветвленный или циклический первичный углеводород, содержащий до 18 и предпочтительно до 6 атомов углерода, необязательно замещенный одной или несколькими группами, выбранными из числа гидроксила, амино, алкиламино, ариламино, алкокси, арилокси, нитро, циано, сульфоновой кислоты, сульфата, фосфоновой кислоты, фосфата или фосфоната, либо незащищенных, либо защищенных.
23. Способ лечения хозяина, инфицированного вирусом гепатита D, предусматривающий введение эффективного для лечения гепатита D количества биологически активного 2'-дезокси-b -L-эритро-пентофуранонуклеозида или его фармацевтически приемлемой соли в комбинации или поочередно с агентом против гепатита B, где указанный дополнительный агент против гепатита B выбран из группы, состоящей из FTC, L-FMAU, DAPD, фамцикловира, пенцикловира, BMS-200475, bis-pom-PMEA (адефовира, дипивоксила); лобукавира, ганцикловира или рибавирина.
24. Применение 2'-дезокси-b -L-эритропентофуранонуклеозида формулы
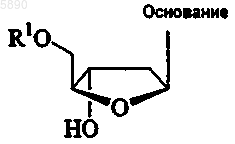
или его фармацевтически приемлемой соли для лечения или профилактики хозяина, инфицированного вирусом гепатита D, где
R1 выбран из группы, состоящей из H, прямого, разветвленного или циклического алкила, CO-алкила, CO-арила, CO-алкоксиалкила, CO-арилоксиалкила, CO-замещенного арила, алкилсульфонила, арилсульфонила, аралкилсульфонила, аминокислотного остатка, моно-, ди- или трифосфата или фосфатного производного; и
"основание" представляет собой пуриновое или пиримидиновое основание, которое может быть, но необязательно, замещенным; и
где углеводород в составе радикалов представляет собой прямой, разветвленный или циклический первичный углеводород, содержащий до 18 и предпочтительно до 6 атомов углерода, необязательно замещенный одной или несколькими группами, выбранными из числа гидроксила, амино, алкиламино, ариламино, алкокси, арилокси, нитро, циано, сульфоновой кислоты, сульфата, фосфоновой кислоты, фосфата или фосфоната, либо незащищенных, либо защищенных.
25. Применение по п.24, где указанным 2'-дезокси-b -L-эритропентофуранонуклеозидом является b -L-2'-дезоксипурин формулы
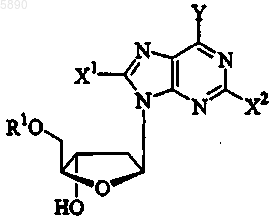
или его фармацевтически приемлемую соль, где
R1 выбран из группы, состоящей из H, прямого, разветвленного или циклического алкила, CO-алкила, CO-арила, CO-алкоксиалкила, CO-арилоксиалкила, CO-замещенного арила, алкилсульфонила, арилсульфонила, аралкилсульфонила, аминокислотного остатка, моно-, ди- или трифосфата или фосфатного производного;
Y представляет OR3, NR3R4 или SR3;
X1 и X2 независимо выбраны из группы, состоящей из H, прямого, разветвленного или циклического алкила, CO-алкила, CO-арила, CO-алкоксиалкила, галогена, OR5, NR5NR6 или SR5; и
R3, R4, R5 и R6 независимо представляют H, прямой, разветвленный или циклический алкил, CO-алкил, CO-арил, CO-алкоксиалкил, CO-арилоксиалкил, CO-замещенный арил, алкилсульфонил, арилсульфонил, аралкилсульфонил, аминокислотный остаток, моно-, ди- или трифосфат или фосфатное производное.
26. Применение по п.25, где указанным 2'-дезокси-b -L-эритропентофуранонуклеозидом является b -L-2'-дезоксиаденозин формулы
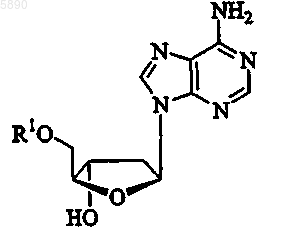
или его фармацевтически приемлемая соль, где R1 представляет H, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное.
27. Применение по п.26, где R1 представляет водород.
28. Применение по п.26, где R1 представляет ацил.
29. Применение по п.28, где указанный ацил происходит от аминокислоты.
30. Применение по п.29, где указанной аминокислотой является валин.
31. Применение по п.25, где указанный 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-2'-дезоксигуанозин формулы
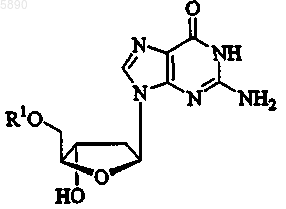
или его фармацевтически приемлемую соль, где R1 представляет H, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное.
32. Применение по п.25, где указанный 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-2'-дезоксиинозин формулы
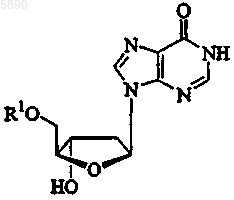
или его фармацевтически приемлемую соль, где R1 представляет H, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное.
33. Применение по п.24, где указанный 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-2'-дезоксипиримидин формулы
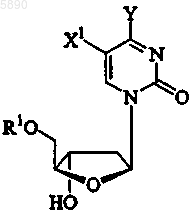
или его фармацевтически приемлемую соль, где
R1 выбран из группы, состоящей из H, прямого, разветвленного или циклического алкила, CO-алкила, CO-арила, CO-алкоксиалкила, CO-арилоксиалкила, CO-замещенного арила, алкилсульфонила, арилсульфонила, аралкилсульфонила, аминокислотного остатка, моно-, ди- или трифосфата или фосфатного производного;
Y представляет OR3, NR3R4 или SR3;
X1 выбран из группы, состоящей из H, прямого, разветвленного или циклического алкила, CO-алкила, CO-арила, CO-алкоксиалкила, галогена, OR5, NR5NR6 или SR5; и
R3, R4, R5 и R6 независимо представляют H, прямой, разветвленный или циклический алкил, CO-алкил, CO-арил, CO-алкоксиалкил, CO-арилоксиалкил, CO-замещенный арил, алкилсульфонил, арилсульфонил, аралкилсульфонил, аминокислотный остаток, моно-, ди- или трифосфат или фосфатное производное.
34. Применение по п.33, где указанный 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-2'-дезоксицитидин формулы
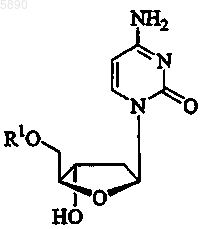
или его фармацевтически приемлемую соль, где R1 представляет H, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное.
35. Применение по п.34, где R1 представляет водород.
36. Применение по п.34, где R1 представляет ацил.
37. Применение по п.36, где указанный ацил происходит от аминокислоты.
38. Применение по п.37, где указанной аминокислотой является валин.
39. Применение по п.33, где указанный 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-2'-дезоксиуридин формулы
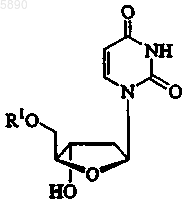
или его фармацевтически приемлемую соль, где R1 представляет H, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное.
40. Применение по п.33, где указанный 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-тимидин формулы
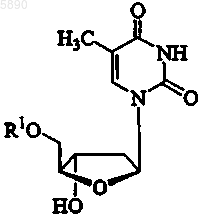
или его фармацевтически приемлемую соль, где R1 представляет H, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное.
41. Применение по п.40, где R1 представляет водород.
42. Применение по п.40, где R1 представляет ацил.
43. Применение по п.42, где указанный ацил происходит от аминокислоты.
44. Применение по п.43, где указанной аминокислотой является валин.
45. Применение 2'-дезокси-b -L-эритропентофуранонуклеозида формулы

или его фармацевтически приемлемой соли в целях изготовления лекарственного средства для лечения или профилактики хозяина, инфицированного вирусом гепатита D, где
R1 выбран из группы, состоящей из H, прямого, разветвленного или циклического алкила, CO-алкила, CO-арила, CO-алкоксиалкила, CO-арилоксиалкила, CO-замещенного арила, алкилсульфонила, арилсульфонила, аралкилсульфонила, аминокислотного остатка, моно-, ди- или трифосфата или фосфатного производного; и
"основание" представляет собой пуриновое или пиримидиновое основание, которое может быть, но необязательно, замещенным; и
где углеводород в составе радикалов представляет собой прямой, разветвленный или циклический первичный углеводород, содержащий до 18 и предпочтительно до 6 атомов углерода, необязательно замещенный одной или несколькими группами, выбранными из числа гидроксила, амино, алкиламино, ариламино, алкокси, арилокси, нитро, циано, сульфоновой кислоты, сульфата, фосфоновой кислоты, фосфата или фосфоната, либо незащищенных, либо защищенных.
46. Применение по п.45, где указанным 2'-дезокси-b -L-эритропентофуранонуклеозидом является b -L-2'-дезоксипурин формулы
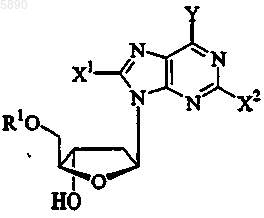
или его фармацевтически приемлемая соль, где
R1 выбран из группы, состоящей из H, прямого, разветвленного или циклического алкила, CO-алкила, CO-арила, CO-алкоксиалкила, CO-арилоксиалкила, CO-замещенного арила, алкилсульфонила, арилсульфонила, аралкилсульфонила, аминокислотного остатка, моно-, ди- или трифосфата или фосфатного производного;
Y представляет OR3, NR3R4 или SR3;
X1 и X2 независимо выбраны из группы, состоящей из H, прямого, разветвленного или циклического алкила, CO-алкила, CO-арила, CO-алкоксиалкила, галогена, OR5, NR5NR6 или SR5; и
R3, R4, R5 и R6 независимо представляют H, прямой, разветвленный или циклический алкил, CO-алкил, CO-арил, CO-алкоксиалкил, CO-арилоксиалкил, CO-замещенный арил, алкилсульфонил, арилсульфонил, аралкилсульфонил, аминокислотный остаток, моно-, ди- или трифосфат или фосфатное производное.
47. Применение по п.46, где указанным 2'-дезокси-b -L-эритропентофуранонуклеозидом является b -L-2'-дезоксиаденозин формулы
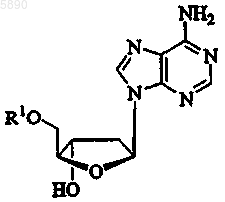
или его фармацевтически приемлемая соль, где R1 представляет H, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное.
48. Применение по п.47, где R1 представляет водород.
49. Применение по п.47, где R1 представляет ацил.
50. Применение по п.49, где указанный ацил происходит от аминокислоты.
51. Применение по п.50, где указанной аминокислотой является валин.
52. Применение по п.46, где указанный 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-2'-дезоксигуанозин формулы
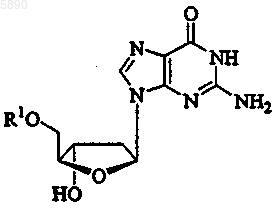
или его фармацевтически приемлемую соль, где R1 представляет H, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное.
53. Применение по п.46, где указанный 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-2'-дезоксиинозин формулы
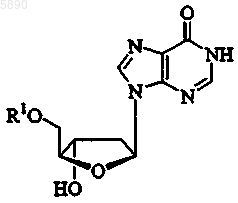
или его фармацевтически приемлемую соль, где R1 представляет H, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное.
54. Применение по п.45, где указанный 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-2'-дезоксипиримидин формулы
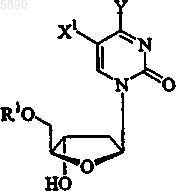
или его фармацевтически приемлемую соль, где
R1 выбран из группы, состоящей из H, прямого, разветвленного или циклического алкила, CO-алкила, CO-арила, CO-алкоксиалкила, CO-арилоксиалкила, CO-замещенного арила, алкилсульфонила, арилсульфонила, аралкилсульфонила, аминокислотного остатка, моно-, ди- или трифосфата или фосфатного производного;
Y представляет OR3, NR3R4 или SR3;
X1 выбран из группы, состоящей из H, прямого, разветвленного или циклического алкила, CO-алкила, CO-арила, CO-алкоксиалкила, галогена, OR5, NR5NR6 или SR5; и
R3, R4, R5 и R6 независимо представляют H, прямой, разветвленный или циклический алкил, CO-алкил, CO-арил, CO-алкоксиалкил, CO-арилоксиалкил, CO-замещенный арил, алкилсульфонил, арилсульфонил, аралкилсульфонил, аминокислотный остаток, моно-, ди- или трифосфат или фосфатное производное.
55. Применение по п.54, где указанный 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-2'-дезоксицитидин формулы
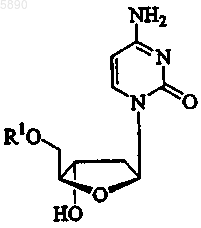
или его фармацевтически приемлемую соль, где R1 представляет H, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное.
56. Применение по п.55, где R1 представляет водород.
57. Применение по п.55, где R1 представляет ацил.
58. Применение по п.57, где указанный ацил происходит от аминокислоты.
59. Применение по п.58, где указанной аминокислотой является валин.
60. Применение по п.54, где указанный 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-2'-дезоксиуридин формулы
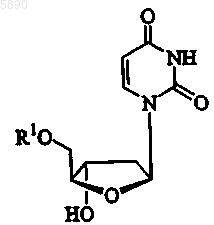
или его фармацевтически приемлемую соль, где R1 представляет H, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное.
61. Применение по п.54, где указанный 2'-дезокси-b -L-эритропентофуранонуклеозид представляет b -L-тимидин формулы
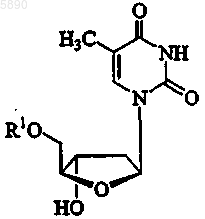
или его фармацевтически приемлемую соль, где R1 представляет H, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное.
62. Применение по п.61, где R1 представляет водород.
63. Применение по п.61, где R1 представляет ацил.
64. Применение по п.63, где указанный ацил происходит от аминокислоты.
65. Применение по п.64, где указанной аминокислотой является валин.
Текст
005890 В настоящей заявке испрашивается приоритет предварительно рассматриваемой заявки США 60/207538, поданной 26 мая 2000 г. Область, к которой относится изобретение Настоящее изобретение относится к способам и композициям для лечения хозяина, инфицированного вирусом гепатита дельта (также обозначаемым "HDV"), где указанный способ предусматривает введение хозяину эффективного количества определенного -L-2'-дезоксинуклеозида или его фармацевтически приемлемой соли или пролекарства. Предпосылки создания изобретения Гепатит типа D представляет собой наиболее тяжелую форму вирусного гепатита, вызываемого вирусом гепатита D (дельта) (HDV), субвирусным сателлитом вируса гепатита В (HBV) (Smedile, A. et al.Prog. Liver.Dis. 1994, 12, 157-75). По сравнению с другими патогенами вирусного гепатита, острая HDVвирусная инфекция наиболее часто ассоциируется с внезапно и быстро развивающимся гепатитом, быстро прогрессирующей и в большинстве случаев летальной формой заболевания, при которой поражаются обширные участки печени. Хронический гепатит D обычно характеризуется некровоспалительными поражениями, аналогичными хронической HBV-инфекции, но является более тяжелым и в большинстве случаев быстро прогрессирующим заболеванием, приводящим к циррозу и печеночной недостаточности,обусловленной диспропорциональной ассоциацией хронической HDV-инфекции с болезнью печени на терминальной стадии (Smedile A. et al. Prog. Liver. Dis. 1994, 12, 157-75; Rizzetto M. et al. Ann. Intern.Med. 1983, 98, 437-41). Хотя в европейских странах, а также в Северной Америке HDV-инфекцией поражается меньшее число людей, чем одним вирусом HBV, возникающая в результате этой инфекции острая или хроническая печеночная недостаточность является главным показанием к трансплантации печени (Smedile A.Rizzetto, M. Int. J. Clin. Lab. Res. 1992, 22, 211-215; Wright T.L.Pereira, B. Liver Transplant. Surgery 1995, 1, 30-42). Во всем мире хроническим заболеванием печени страдает 15 миллионов человек, и из них приблизительно 70000 случаев приходится на США. По оценкам Центра по контролю заболеваемости, в США от HDV-инфекции ежегодно умирает 1000 человек (Alter M.J.Hadler S.C.Prog. Clin. Biol. Res. 1993, 382, 243-50; Alter, M.J.Mast E.E. Gastroenterol. Clin. North. Am. 1994, 23,437-55). В настоящее время фактически не существует приемлемой эффективной терапии гепатита D, и трансплантация печени остается единственным средством при заболевании печени на терминальной стадии. Хотя использование интерферона-альфа имело определенный успех при лечении некоторых случаев гепатита D, необходимость введения очень высоких доз, вариабельность ответов, частота рецидивов после прекращения лечения и трудности, связанные с введением лекарственного средства, требуют разработки более эффективных способов лечения (Thomas, Н.С. et al. Prog. Clin. Biol. Res. 1987, 234, 277-90;HDV-вирион состоит из рибонуклеопротеиновой сердцевины и оболочки. Сердцевина содержитHDV-PHK и антиген гепатита дельта (HDVAg), который представляет собой лишь белок, кодируемых этим вирусом (Wang K.S. et al. Nature 1986, 323, 508-14). Оболочка этого вируса образована поверхностным антигенным белком (поверхностным антигеном гепатита В или HBsAg) вируса-помощника, то есть вируса гепатита В (Bonino F. Infect. Immun. 1984, 43, 1000-5; Bonino F. et al. Hepatology 1981, 1, 127-31;Bonino F. et al. J.Virol. 1986, 58, 945-50). Указанная оболочка выполняет лишь одну хелперную функцию,обеспечиваемую вирусом HBV. HDV способен реплицировать свою РНК в клетках и в отсутствии HBV(Kuo M.Y. et al. J. Virol. 1989, 63, 1945-50), но для упаковки и высвобождения HDV-вирионов .(Wu, J.C.et al. J.Virol. 1991, 65, 1099-104; Ryu, W.S. et al. J.Virol. 1992, 66, 2310-2315), а также для обеспечения инфекционности этих вирионов (Sureau С. et al. J.Virol. 1992, 66, 1241-5) требуется HBsAg. ПосколькуHDV зависит от HBV, то HDV инфицирует индивидуумов только в ассоциации с HBV. Было показано, что ламивудин (-L-2',3'-дидезокси-3'-тиацитидин, 3 ТС), который представляет собой синтетический нуклеозид, является эффективным средством для лечения ВИЧ- и HBV-инфекции. См. патент США 5539116, Liotta et al. Известно, что ламивудин вызывает пролонгированную супрессию репликации HBV в процессе лечения (Nevens F. et al. Gastroenterology 1997, 113, 1258-1263). Однако ламивудин не уменьшает активного заболевания или не снижает уровни HDV-PHK у пациентов с хроническим гепатитом дельта (Lau D.T. et al. Hepatology 1999, 30, 546-9). Недавно в США и в некоторых других странах, ламивудин был разрешен к применению для лечения хронической HBV-инфекции. Продолжительное лечение индивидуумов-носителей хронической HBV-инфекции ламивудином приводит к снижению уровней HBV в сыворотке и к улучшению гистологии печени (Lai, C.L. et al. N. Engl.J.Med. 1998, 339, 61-8; Tyrrell, D. et al. Hepatology 1993, 18, 112A; Nevens, F. et al., Gastroenterology, 1997, 113,1258-63; Dienstag J.L. et al. N.Engl.J.Med. 1995, 333, 1657-61). Несмотря на сильное воздействие ламивудина на HBV, лечение ламивудином пациентов с хронической инфекцией HBV и HDV дает незначительный эффект в отношении уровней HDV в кровотоке, и что более важно, оно не дает положительной ди-1 005890 намики при активном заболевании даже в случае снижения уровней HBV (Honkoop P. et al., Hepatology 1997, 24 (Suppl), 1219 (Abstract); Lau D.T. et al. Hepatology, 1999, 30, 546-9). Были предприняты попытки применения других форм лечения. Так, например, сурамин блокируетin vitro проникновение вириона в гепатоциты, но он является слишком токсичным, чтобы его можно было длительно использовать для введения человеку (Smedile A. et al. Prog. Liver. Dis. 1994, 12, 157-75). Ацикловир усиливает репликацию HDV in vitro (Smedile A. et al. Prog. Liver. Dis. 1994, 12, 157-75). Рибавирин не оказывает значительного воздействия на вирологические или биохимические параметры и дает серьезные побочные эффекты (Smedile A. et al. Prog. Liver. Dis. 1994, 12, 157-75). Синтетические аналоги тимозина также являются неэффективными для лечения HDV-инфекции (Smedile A. et al. Prog. Liver. Dis. 1994, 12, 157-75). Вообще говоря, ни один из вышеописанных способов лечения HDV-инфекции не может быть признан эффективным. Поскольку вирус гепатита североамериканского лесного сурка (WHV) является близкородственным вирусу HBV (их нуклеиновые кислоты имеют примерно 85%-ную гомологию), то он широко использовался в качестве модели HBV-инфекции и заболевания в его природном хозяине, то есть в восточном североамериканском лесном сурке (М.monax) (Gerin J.L. Gastroenterol. Jpn. 1990, 25, Supp, 38-42; TennantB.C. et al. Viral Hepatitis and Liver Disease, 1988, 462-464). Экспериментально инфицированные лесные сурки были также широко использованы для анализа и разработки aнти-HBV-вирусной терапии (Zahm,F.E. et al. Ital. J. Gastroenterol. Hepatol. 1998, 30, 510-6; Tennant, В. С et al. Hepatology 1998, 28, 179-91;et al. Antiviral Therapy 2000, 5(2), 95-104; Korba, В. Е. et al. Antimicrobial Agents and Chemotherapy 2000,44(6), 1757-60; Korba, В. Е. et al. Antimicrobial Agents and Chemotherapy 2000, 44(7), 1964-1969). Эффективность некоторых анти-HBV агентов, используемых экспериментально для лечения хроническойWHV-инфекции у лесных сурков (аrаАМР, рибавирин, AZT, ACV, 3 ТС, фамцикловир, FTC), четко коррелировала с эффективностью этих агентов, вводимых пациентам с HBV, подвергнутым лечению в процессе клинических испытаний. Аналогичная эффективность, наблюдаемая у WHV-инфицированных лесных сурков и у HBV-инфицированных пациентов, подвергаемых лечению анти-HBV агентами, продемонстрировала, что использование лесного сурка в качестве модели может иметь прогностическое значение для анти-HBV терапии для человека (Zahm, F.E. et al. Ital. J. Gastroenterol Hepatol 1998, 30, 510-6;Gangemi, J. et al. Antivir Therap 1997, 1, 64-70; Genovesi, E. V. et al. Antimicrob Agents Chemother 1998, 42,3209-17; Korba, В. Е. et al. Antiviral Res. 2000, 45(1), 19-32; Korba, В. Е. et al. Hepatology 2000, 32(4 Pt 1),807-817; Korba, В. Е. et al. Hepatology 2000, 31(5), 1165-1175; Korba, В. Е. et al. Antiviral Therapy 2000,5(2), 95-104). Аналогично HBV, WHV может обеспечивать образование HDV-частиц и инфицирование, и восточный североамериканский лесной сурок был использован в качестве модели HDV-инфекции (Negro, F. et al. J. Virol 1989, 63, 1612-8; Parana, R., Gerard, F., Lesbordes, J. L., Pichoud, C, Vitvitski, L., Lyra, L.Ponzetto, A. et al. Prog. Clin. Biol. Res. 1987, 234, 37-46). Принимая во внимание зависимость HDV от его вируса-помощника HBV, можно предположить,что успешное лечение HDV-инфекций должно приводить к успешному лечению поддерживающей HBVинфекции, хотя этот факт не очевиден, как это продемонстрировали результаты, недавно полученные с использованием лекарственного средства ламивудина (Glaxo-Wellcome, Inc.) (Honkoop P. et al. Hepatology 1997, 24 (Suppl), 1219 (Abstract); Lau D.T. et al. Hepatology, 1999, 30, 546-9). Отсутствие эффекта при лечении ламивудином заболеваний у HBV-HDV-инфицированных пациентов указывает на прямую рольHDV в развитии тяжелого заболевания у таких пациентов. Хотя ламивудин ингибирует репликациюHBV и WHV, однако, он не влияет на продуцирование поверхностного вирусного антигена (Lau D.T. etal. Hepatology 2000, 32(4 Pt 1), 807-817; Korba B.E. et al. Hepatology 2000, 31(5), 1165-1175). Жизненный цикл HBV и других представителей этого семейства вирусов (например, WHV) является уникальным в том смысле, что процесс репликации геномных копий этого вируса и продуцирования вирусных белков(например, поверхностных антигенов HBV или WHV) дифференциально регулируется (Ganem D. Hepadnaviridae In "Fields Virology", Fields BN, Knipe D.M. Howley P. ed. Lippincott-Raven 1996, Philadelphia,2703-2737). Поэтому антивирусные агенты, такие как синтетические нуклеозиды (например, ламивудин),которые нацелены на вирусные полимеразы, могут в значительной степени ингибировать репликациюHBV (например, как было измерено по снижению уровня виремии), но не влияют не уровень продуцирования вирусной мРНК или вирусного белка (например, как было измерено по уровням поверхностного-2 005890 антигена HBV в плазме или в сыворотке). Поскольку образование вирусной оболочки поверхностным антигенным белком является лишь функцией HBV и WHV, важной для HDV, то отсутствие ингибирования продуцирования HBsAg может играть определенную роль в неспособности лимивудина воздействовать на репликацию HDV и вызываемого им заболевания. В патенте США 5747044 описаны рекомбинантно продуцированные иммуногенные полипептиды HDV, которые могут быть использованы в качестве вакцин. В патенте США 5932219, Chiron, описаны полный геном вируса гепатита D, семейство кДНКкопий полного генома HDV, и показано, что фрагменты этих кДНК-последовательностей могут быть использованы в качестве зондов для диагностики присутствия вируса в клинических образцах. В этом патенте также описаны белки, кодируемые кДНК, которые могут быть использованы для продуцирования вакцин. В частности, в патенте '219 описана вакцина для гепатита D, которая содержит вирусные полипептиды р 24 и р 27. В патенте США 5750350, Chiron, заявлен набор, используемый в анализе на вирус гепатита D, который включает пептид, кодируемый ОРС 5 генома HDV. В патенте США 5747044 заявлена рекомбинантно продуцированная иммуногенная частица, которая способствует вырабатыванию антител против HDV, где указанная частица включает иммуногенный полипептид, кодируемый в ОРС 5 нуклеотидной последовательности HDV или ее комплементарной последовательности. В патенте США 6020167, переуступленном Medeva Holdings B.V., описан метод лечения хронического гепатита, а в частности, гепатита В, предусматривающий введение композиции, содержащейHBsAg. В патенте США 5770584 описан метод лечения инфекции, вызываемой вирусом гепатита, предусматривающий введение алкиллипидов или производных алкиллипидов. В патенте США 4619896 описан способ демаскировки дельта-антигена в крови животного, предусматривающий обработку сыворотки поверхностно-активным веществом и, необязательно, агентом,диссоциирующим комплекс "антитело-антиген". Дельта-антиген, выделенный из кровотока, используют в качестве диагностического агента для детекции и определения различных классов антител против вируса гепатита D. В изобретении, зарегистрированном в соответствии с федеральным Патентным законом США,H1,345, описан метод предупреждения или лечения вирусного гепатита путем введения ингибитора протеин-пренилтрансферазы. В работе Sureau et al. "Production of Infectious Hepatitis Delta Virus In Vitro and Neutralization withAntibodies Directed against Hepatitis В Virus Pre-S Antigens" Journal of Virology 1992, 1241-1245, указано,что HDV-частицы, продуцируемые in vitro, являются инфекционными, и что (i) инфекционные частицы покрыты белками оболочки HBV, которые содержат пре-S1 и пре-S2-области, (ii) эпитопы пpe-S1 и пpeS2-доменов белков оболочки HBV находятся на поверхности HDV-частиц, и (iii) антитела, нацеленные на эти эпитопы, обладают нейтрализующей активностью против HDV. Недавно сообщалось, что L-FMAU является сильным ингибитором HDV у хронически инфицированных животных (Casey J.L. et al., Antiviral Therapy, 2000, 5 (Suppl.1), 32, Abstract 057). Синтетические нуклеозиды, -L-2'-дезоксицитидин (-L-2'-dC), -L-2'-дезокситимидин (-L-dT) иSeries" Collect. Czech. Chem. Commun. 1972, 37(12), 4072-87, впервые были описаны -L-dC и -L-dT.Morris S.Zedeck и др. впервые описали использование -L-dA для ингибирования синтеза индуцированных ферментов в Pseudomonas testosteroni (Mol. Phys. 1967, 3(4), 386-95). Известно, что некоторые 2'-дезоксиL-эритропентофуранонуклеозиды обладают противоопухолевой и селективной противовирусной активностью. Verri и др. описали использование 2'-дезоксиLэритропентофуранонуклеозидов в качестве противоопухолевых агентов и агентов против вируса герпеса(Mol. Pharmacol. 1997, 51(1), 132-138Biochem J. 1997, 328(1), 317-20). Saneyoshi и др. продемонстрировали использование 2'-дезокси-L-рибонуклеозидов в качестве ингибиторов обратной транскриптазы (I) для ингибирования ретровирусов и для лечения СПИД'a, Japanese Kokai Tokyo Koho JP 06293645 (1994).Giovanni и др. протестировали действие 2'-дезоксиL-эритропентофуранонуклеозидов частично против псевдорабивируса (PRV) (Biochem J. 1993, 294(2), 381-5). Хемотерапевтическое применение 2'-дезоксиL-эритропентофуранонуклеозидов было исследовано Tyrsted et al., Biochem Biophys Acta 1968, 155(2), 619-22 и Bloch et al, J. Med. Chem. 1967, 10(5), 908-12. Известно, что -L-2'-дезокситимидин (-L-dT) ингибирует тимидинкиназу (ТК) вируса простого герпеса типа 1 (HSV-1). В WO 92/08727, Iotti et al., указывается, что -L-dT селективно ингибирует фосфорилирование D-тимидина тимидинкиназой (ТК) HSV-1, но не человеческой ТК. Spaldari и др. сообщали, что L-тимидин фосфорилируется тимидинкиназой вируса простого герпеса типа 1 и ингибирует размножение вируса, J.Med.Chem., 1992, 35(22), 4214-20. Недавно сообщалось об использовании синтетических нуклеозидов, -L-2'-дезоксицитидина (-L2'-dC), -L-2'-дезокситимидина (-L-dT), -L-2'-дезоксиинозина (-L-dI) и -L-2'-дезоксиаденозина (-L2'-dA) для лечения вирусного гепатита. В. Gilles Gosselin и др. в WO 00/09531 (PCT/US 99/18149) описа-3 005890 ли использование -L-dT, -L-dA, -L-dC и -L-dI и их фармацевтически приемлемых солей и пролекарств для лечения вирусного гепатита В. В PCT/US 01/09987, поданной Фондом научных исследований Джорджтаунского университета,Корнельского университета и Университета штата Джорджия, указывается, что введение нуклеозида или нуклеозидного аналога, который значительно снижает уровень поверхностного антигена вируса гепатита В (обозначенного HBsAg) у хозяина, может быть использован для лечения инфицирования вирусом гепатита дельта у данного хозяина. В одном из вариантов PCT/US 01/09987 указано, что 2'-фтор-5-метилбета-L-арабинофуранозилуридин (L-FMAU) значительно снижает уровень поверхностного антигена вируса гепатита В, а поэтому он может быть использован для лечения инфекционного гепатита-дельта. Если учесть, что вирусом гепатита-дельта инфицировано большое число людей, а также принять во внимание разрушающее действие инфекций, вызываемых вирусом гепатита дельта на индивидуума, и отсутствие эффективных методов лечения, то очевидно, что разработка новых и эффективных средств для лечения инфекции, вызываемой вирусом гепатита дельта, является крайней необходимой. Поэтому целью настоящего изобретения является разработка способов лечения хозяина, включая человека, инфицированного вирусом гепатита дельта. Краткое описание изобретения Описан способ лечения инфекционного гепатита дельта у человека и других хозяев, предусматривающий введение эффективного количества биологически активного 2'-дезоксиL-эритропентофуранонуклеозида (иначе называемого здесь -L-d-нуклеозидом или -L-2'-d-нуклеозидом) или его фармацевтически приемлемой соли или пролекарства, либо отдельно, либо в комбинации, либо поочередно, необязательно в фармацевтически приемлемом носителе. Термин "2'-дезокси", используемый в данном описании, относится к нуклеозиду, который не имеет заместителей во 2' положении. Описанные 2'-дезоксиL-эритропентофуранонуклеозиды или их фармацевтически приемлемые пролекарства, или соли, или их фармацевтически приемлемые композиции, содержащие эти соединения,могут быть использованы для предупреждения и лечения инфекционного гепатита D и других родственных состояний, таких как хроническое воспаление печени, вызываемое HDV, цирроз, острый гепатит,молниеносный гепатит, хронический персистентный гепатит и усталость. Эти соединения или композиции могут быть также использованы в профилактических целях для предупреждения или замедления прогрессирования клинических патологий у индивидуумов, которые были инфицированы HDV или которые подвергались контакту с HDV. В одном из вариантов настоящего изобретения, производное 2'-дезоксиL-эритропентофуранонуклеозида представляет собой соединение формулы где R1 выбран из группы, состоящей из Н, прямого, разветвленного или циклического алкила, СОалкила, СО-арила, СО-алкоксиалкила, СО-арилоксиалкила, СО-замещенного арила, алкилсульфонила,арилсульфонила, аралкилсульфонила, аминокислотного остатка, моно-, ди- или трифосфата или фосфатного производного; и"основание" представляет собой пуриновое или пиримидиновое основание, которое может быть, но необязательно, замещенным. В другом варианте настоящего изобретения, производное 2'-дезоксиL-эритропентофуранонуклеозида представляет собой -L-2'-дезоксипурин, или его фармацевтически приемлемую соль,или пролекарство формулы где R1 выбран из группы, состоящей из Н, прямого, разветвленного или циклического алкила, СОалкила, СО-арила, СО-алкоксиалкила, СО-арилоксиалкила, СО-замещенного арила, алкилсульфонила,арилсульфонила, аралкилсульфонила, аминокислотного остатка, моно-, ди- или трифосфата или фосфатного производного;X1 и X2 независимо выбраны из группы, состоящей из Н, прямого, разветвленного или циклического алкила, СО-алкила, СО-арила, СО-алкоксиалкила, галогена, OR5, NR5NR6 или SRs; иR3, R4, R5 и R6 независимо представляют Н, прямой, разветвленный или циклический алкил, СО-4 005890 алкил, СО-арил, С 0-алкоксиалкил, СО-арилоксиалкил, СО-замещенный арил, алкилсульфонил, арилсульфонил, аралкилсульфонил, аминокислотный остаток, моно-, ди- или трифосфат или фосфатное производное. В конкретном варианте осуществления изобретения производное 2'-дезоксиL-эритропентофуранонуклеозида представляет собой -L-2'-дезоксиаденозин, или его фармацевтически приемлемую соль, или пролекарство формулы где R1 представляет Н, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное (для образования стабилизированного нуклеотидного пролекарства). В предпочтительном варианте осуществления изобретения R1 представляет Н. В другом конкретном варианте осуществления изобретения производное 2'-дезоксиLэритропентофуранонуклеозида представляет собой -L-2'-дезоксигуанозин, или его фармацевтически приемлемую соль, или пролекарство формулы где R1 представляет Н, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное (для образования стабилизированного нуклеотидного пролекарства). В другом конкретном варианте осуществления изобретения производное 2'-дезоксиLэритропентофуранонуклеозида представляет собой -L-2'-дезоксиинозин, или его фармацевтически приемлемую соль, или пролекарство формулы где R1 представляет Н, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное (для образования стабилизированного нуклеотидного пролекарства). В другом конкретном варианте осуществления изобретения производное 2'-дезоксиLэритропентофуранонуклеозида представляет собой -L-2'-дезоксипиримидин, или его фармацевтически приемлемую соль, или пролекарство формулы где R1 выбран из группы, состоящей из Н, прямого, разветвленного или циклического алкила, СОалкила, СО-арила, СО-алкоксиалкила, СО-арилоксиалкила, СО-замещенного арила, алкилсульфонила,арилсульфонила, аралкилсульфонила, аминокислотного остатка, моно-, ди- или трифосфата или фосфатного производного;X1 выбран из группы, состоящей из Н, прямого, разветвленного или циклического алкила, СОалкила, СО-арила, СО-алкоксиалкила, галогена, OR5, NR5NR6 или SR5; иR3, R4, R5 и R6 независимо представляют Н, прямой, разветвленный или циклический алкил, СОалкил, СО-арил, СО-алкоксиалкил, СО-арилоксиалкил, СО-замещенный арил, алкилсульфонил, арил-5 005890 сульфонил, аралкилсульфонил, аминокислотный остаток, моно-, ди- или трифосфат или фосфатное производное. В одном конкретном варианте осуществления изобретения производное 2'-дезоксиL-эритропентофуранонуклеозида представляет собой -L-2'-дезоксицитидин, или его фармацевтически приемлемую соль, или пролекарство формулы где R1 представляет Н, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное (для образования стабилизированного нуклеотидного пролекарства). В предпочтительном варианте осуществления изобретения R1 представляет Н. В другом конкретном варианте осуществления изобретения производное 2'-дезоксиL-эритропентофуранонуклеозида представляет собой -L-2'-дезоксиуридин, или его фармацевтически приемлемую соль, или пролекарство формулы где R1 представляет Н, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное (для образования стабилизированного нуклеотидного пролекарства). В другом конкретном варианте осуществления изобретения производное 2'-дезоксиL-эритропентофуранонуклеозида представляет собой -L-тимидин, или его фармацевтически приемлемую соль,или пролекарство формулы где R1 представляет Н, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное (для образования стабилизированного нуклеотидного пролекарства). В предпочтительном варианте осуществления изобретения R1 представляет Н. В другом варианте осуществления изобретения 2'-дезоксиL-эритропентофуранонуклеозид, его фармацевтически приемлемую соль или пролекарство вводят поочередно или в комбинации с одним или несколькими другими 2'-дезоксиL-эритропентофуранонуклеозидами, их фармацевтически приемлемыми солями, или пролекарствами, или с одним или несколькими другими соединениями, обладающими активностью против вируса гепатита D. Вообще говоря, при альтернирующей терапии эффективную дозу каждого агента вводят последовательно, тогда как при комбинированной терапии, эффективную дозу двух или нескольких агентов вводят вместе. Эти дозы зависят от скорости абсорбции, инактивации и экскреции лекарственного средства, а также от других факторов, известных специалистам. Следует отметить, что величины доз могут также варьироваться в зависимости от тяжести состояния, подвергаемого лечению. Кроме того, следует отметить, что для любого конкретного индивидуума конкретные схемы приема и введения лекарственного средства должны быть скорректированы в зависимости от времени в соответствии с потребностью индивидуума и в соответствии с назначением врача, осуществляющего введение или наблюдение за введением данных композиций. В другом варианте осуществления изобретения, настоящее изобретение относится к способу лечения HDV-инфицированного человека, предусматривающему введение необходимого для лечения HDVинфекций количества пролекарства описанных производных 2'-дезоксиL-эритропентофуранонуклеозида. Используемый здесь термин "пролекарство" означает соединение, которое превращается в нужный нуклеозид после введения in vivo. Неограничивающими примерами является фармацевтическиN6(аденозин)-ацилированные или алкилированные производные активного соединения, 5'-фосфолипиды и/или 5'-эфиролипиды активного соединения. В предпочтительном варианте осуществления изобретения 2'-дезоксиL-эритропентофуранонуклеозид имеет форму фармацевтически приемлемого пролекарства, в котором 5'-гидроксил ацилирован аминокислотой. В еще более предпочтительном варианте изобретения указанной аминокислотой является валин. Краткое описание графического материала Фиг. 1 иллюстрирует общий способ получения -L-эритропентофуранонуклеозидов (-L-dN) с использованием L-рибозы или L-ксилозы в качестве исходного материала; фиг. 2 иллюстрирует неограничивающий пример синтеза L-дезоксиаденозина с использованием Lрибозы в качестве исходного материала; фиг. 3 иллюстрирует неограничивающий пример синтеза -L-dC (3 а) и -L-dT (3b) с использованием L-арабинозы в качестве исходного материала; фиг. 4 представляет собой график, который иллюстрирует метаболизм L-dA, L-dC и L-dT в клеткахHepG2 человека, направленный на аккумуляцию и распад. Эти клетки инкубировали с 10 мкМ соединения; фиг. 5 представляет собой график, который иллюстрирует противовирусное действие p-L-dA, p-LdT и -L-dC у лесного американского сурка, используемого в качестве модели хронического гепатита. Подробное описание изобретения Описан способ лечения инфекционного гепатита дельта у человека и других хозяев, предусматривающий введение эффективного количества биологически активного 2'-дезоксиL-эритропентофуранонуклеозида (иначе называемого здесь -L-d-нуклеозидом или -L-2'-d-нуклеозидом) или его фармацевтически приемлемой соли или пролекарства, либо отдельно, либо в комбинации, необязательно в фармацевтически приемлемом носителе. Термин "2'-дезокси", используемый в данном описании, относится к нуклеозиду, который не имеет заместителей в 2' положении. Описанные 2'-дезоксиL-эритропентофуранонуклеозиды, или их фармацевтически приемлемые пролекарства, или соли, или их фармацевтически приемлемые композиции, содержащие эти соединения,могут быть использованы для предупреждения и лечения инфекционного гепатита D и других родственных состояний, таких как хроническое воспаление печени, вызываемое HDV, цирроз, острый гепатит,молниеносный гепатит, хронический персистентный гепатит и усталость. Эти соединения или композиции могут быть также использованы в профилактических целях для предупреждения или замедления прогрессирования клинических патологий у индивидуумов, которые были инфицированы HDV или которые подвергались контакту с HDV. В одном из вариантов настоящего изобретения производное 2'-дезоксиL-эритропентофуранонуклеозида представляет собой соединение формулы где R1 выбран из группы, состоящей из Н, прямого, разветвленного или циклического алкила, СОалкила, СО-арила, СС-алкоксиалкила, СО-арилоксиалкила, СО-замещенного арила, алкилсульфонила,арилсульфонила, аралкилсульфонила, аминокислотного остатка, моно-, ди- или трифосфата или фосфатного производного; и"основание" представляет собой пуриновое или пиримидиновое основание, которое может быть, но необязательно, замещенным. В другом варианте настоящего изобретения, производное 2'-дезоксиL-эритропентофуранонуклеозида представляет собой -L-2'-дезоксипурин, или его фармацевтически приемлемую соль, или пролекарство формулы где R1 выбран из группы, состоящей из Н, прямого, разветвленного или циклического алкила, СОалкила, СО-арила, СО-алкоксиалкила, СО-арилоксиалкила, СО-замещенного арила, алкилсульфонила,арилсульфонила, аралкилсульфонила, аминокислотного остатка, моно-, ди- или трифосфата или фосфатного производного;X1 и X2 независимо выбраны из группы, состоящей из Н, прямого, разветвленного или циклического алкила, СО-алкила, СО-арила, СО-алкоксиалкила, галогена, OR5, NR5NR6 или SR5; иR3, R4, R5 и R6 независимо представляют Н, прямой, разветвленный или циклический алкил, СОалкил, СО-арил, СО-алкоксиалкил, СО-арилоксиалкил, СО-замещенный арил, алкилсульфонил, арилсульфонил, аралкилсульфонил, аминокислотный остаток, моно-, ди- или трифосфат или фосфатное производное; В конкретном варианте осуществления изобретения производное 2'-дезоксиL-эритропентофуранонуклеозида представляет собой -L-2'-дезоксиаденозин, или его фармацевтически приемлемую соль, или пролекарство формулы где R1 представляет Н, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное (для образования стабилизированного нуклеотидного пролекарства). В предпочтительном варианте осуществления изобретения R1 представляет Н. В другом конкретном варианте осуществления изобретения производное 2'-дезоксиL-эритропентофуранонуклеозида представляет собой -L-2'-дезоксигуанозин, или его фармацевтически приемлемую соль, или пролекарство формулы где R1 представляет Н, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное (для образования стабилизированного нуклеотидного пролекарства). В другом конкретном варианте осуществления изобретения производное 2'-дезоксиLэритропентофуранонуклеозида представляет собой -L-2'-дезоксиинозин, или его фармацевтически приемлемую соль, или пролекарство формулы где R1 представляет Н, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное (для образования стабилизированного нуклеотидного пролекарства). В другом конкретном варианте осуществления изобретения производное 2'-дезоксиLэритропентофуранонуклеозида представляет собой -L-2'-дезоксипиримидин, или его фармацевтически приемлемую соль, или пролекарство формулы где R1 выбран из группы, состоящей из Н, прямого, разветвленного или циклического алкила, СОалкила, СО-арила, СО-алкоксиалкила, СО-арилоксиалкила, СО-замещенного арила, алкилсульфонила,арилсульфонила, аралкилсульфонила, аминокислотного остатка, моно-, ди- или трифосфата или фосфатного производного;X1 выбран из группы, состоящей из Н, прямого, разветвленного или циклического алкила, СОалкила, СО-арила, СО-алкоксиалкила, галогена, OR5, NR5NR6 или SR5;R3, R4, R5 и R6 независимо представляют Н, прямой, разветвленный или циклический алкил, СО-8 005890 алкил, СО-арил, СО-алкоксиалкил, СО-арилоксиалкил, СО-замещенный арил, алкилсульфонил, арилсульфонил, аралкилсульфонил, аминокислотный остаток, моно-, ди- или трифосфат или фосфатное производное. В одном конкретном варианте осуществления изобретения производное 2'-дезоксиL-эритропентофуранонуклеозида представляет собой -L-2'-дезоксицитидин, или его фармацевтически приемлемую соль, или пролекарство формулы где R1 представляет Н, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное (для образования стабилизированного нуклеотидного пролекарства). В предпочтительном варианте осуществления изобретения R1 представляет Н. В другом конкретном варианте осуществления изобретения производное 2'-дезоксиL-эритропентофуранонуклеозида представляет собой -L-2'-дезоксиуридин, или его фармацевтически приемлемую соль, или пролекарство формулы где R1 представляет Н, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное (для образования стабилизированного нуклеотидного пролекарства). В другом конкретном варианте осуществления изобретения производное 2'-дезоксиLэритропентофуранонуклеозида представляет собой -L-тимидин, или его фармацевтически приемлемую соль, или пролекарство формулы где R1 представляет Н, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное (для образования стабилизированного нуклеотидного пролекарства). В предпочтительном варианте осуществления изобретения R1 представляет Н. В другом варианте осуществления изобретения 2'-дезоксиL-эритропентофуранонуклеозид, его фармацевтически приемлемую соль или пролекарство вводят поочередно или в комбинации с одним или несколькими другими 2'-дезоксиL-эритропентофуранонуклеозидами, их фармацевтически приемлемыми солями или пролекарствами, или с одним или несколькими другими соединениями, обладающими активностью против вируса гепатита D. Вообще говоря, при альтернирующей терапии эффективную дозу каждого агента вводят последовательно, тогда как при комбинированной терапии, эффективную дозу двух или нескольких агентов вводят вместе. Эти дозы зависят от скорости абсорбции, инактивации и экскреции лекарственного средства, а также от других факторов, известных специалистам. Следует отметить, что величины доз могут также варьироваться в зависимости от тяжести состояния, которое подвергается лечению. Кроме того, следует отметить, что для любого конкретного индивидуума, конкретные схемы приема и введения лекарственного средства должны быть скорректированы в зависимости от времени в соответствии с потребностью индивидуума и в соответствии с назначением врача, осуществляющего введение или наблюдение за введением данных композиций. В другом варианте осуществления изобретения настоящее изобретение относится к способу лечения HDV-инфицированного человека, предусматривающему введение необходимого для лечения HDVинфекций количества пролекарства описанных производных 2'-дезоксиL-эритропентофуранонуклеозида. Используемый здесь термин "пролекарство" означает соединение, которое превращается в нужный нуклеозид после введения in vivo. Неограничивающими примерами является фармацевтически приемлемая соль (иначе называемая "физиологически приемлемой солью"), 5',N4(цитидин) и/илиN6(аденозин)ацилированные или алкилированные производные активного соединения, 5'-фосфолипиды-9 005890 и/или 5'-эфиролипиды активного соединения. В предпочтительном варианте осуществления изобретения 2'-дезоксиL-эритропентофуранонуклеозид имеет форму фармацевтически приемлемого пролекарства, в котором 5'-гидроксил ацилирован аминокислотой. В еще более предпочтительном варианте изобретения указанной аминокислотой является валин. Стереохимия Как показано ниже, нуклеозид содержит по крайней мере два критических хиральных атома углерода . Вообще говоря, заместители на этих хиральных атомах углерода [а конкретно, пуриновое или пиримидиновое основание (обозначаемое С 1-заместителем в случае использования промежуточной нумерации сахарного кольца) и СН 2 ОН (обозначаемого С 4-заместителем)] нуклеозида могут быть либо в цис-положении (с одной и той же стороны), либо в транс-положении (с противоположных сторон) по отношению к системе сахарного кольца. Как цис-, так и транс-рацематы состоят из пары оптических изомеров. Поэтому каждое соединение имеет четыре отдельных стереоизомера. Эти четыре стереоизомера представлены нижеследующими конфигурациями (если сахарная группа ориентирована в горизонтальной плоскости так, что -О-часть находится сзади): (1) цис-конфигурация, в которой обе группы находятся "вверху", и которую обозначают -D; (2) зеркальное отображение, т.е. цис-конфигурация, в которой обе группы находятся "внизу", и такое зеркальное отображение обозначают -L; (3) трансконфигурация, в которой С 4-заместитель находится "вверху", а С 1-заместитель находится "внизу" (и которую обозначают -D) и (4) транс-конфигурация, в которой С 4-заместитель находится "внизу", а С 1 заместитель находится "вверху" (и которую обозначают -L). Два цис-энантиомера, взятых вместе, называют рацемической смесью -энантиомеров, а два транс-энантиомера, взятых вместе, называют рацемической смесью -энантиомеров. Четыре возможных стереоизомера заявленных соединений проиллюстрированы ниже. Определения Используемый здесь термин "по существу в форме одного изомера" или "в изолированной форме" относится к 2'-дезоксиL-эритропентофуранонуклеозиду, который по крайней мере приблизительно на 95%, а предпочтительно по крайней мере на 98 или 99% находится в конкретно определенной стереоконфигурации. В предпочтительном варианте осуществления изобретения хозяину, нуждающемуся в лечении, вводят активное соединение, имеющее, по крайней мере, вышеуказанный уровень чистоты. Используемый здесь термин "гепатит D и состояния, родственные гепатиту D", означает инфекционный гепатит D, хроническое воспаление печени, ассоциированное с HDV, цирроз, острый гепатит,молниеносный гепатит, хронический персистентный гепатит и усталость. Способ настоящего изобретения предусматривает использование производных 2'-дезоксиL-эритропентофуранонуклеозидов, их фармацевтически приемлемых солей или пролекарств в профилактических целях для предупреждения или замедления прогрессирования клинических патологий у индивидуумов, которые были инфицированы HDV или которые подвергались контакту с HBV. Используемый здесь термин "алкил", если это не оговорено особо, означает насыщенный прямой,- 10005890 разветвленный или циклический первичный, вторичный или третичный углеводород, обычно C1-C18, а предпочтительно C1-С 6 углеводород, а в частности, означает, но не ограничивается ими, метил, трифторметил, этил, пропил, бутил, пентил, гексил, изопропил, изобутил, втор-бутил, трет-бутил, изопентил,амил, трет-пентил, циклопентил и циклогексил. Алкильная группа может быть, но необязательно замещена одной или несколькими группами, выбранными из ряда, состоящего из гидроксила, амино, алкиламино, ариламино, алкокси, арилокси, нитро, циано, сульфонозой кислоты, сульфата, фосфоновой кислоты, фосфата или фосфоната, либо незащищенных, либо защищенных, если это необходимо, как очевидно каждому специалисту, и как описано, например, в работе Greene et al., Protective Groups in Organic Syntesis, John WileySons, Second Edition, 1991, которая вводится в настоящее описание посредством ссылки. Термин "ацил" означает группу формулы -C(O)R', где R' представляет алкил, арил, алкарил, аралкил, гетероароматическую группу, алкоксиалкил (включая метоксиметил), арилалкил (включая бензил),арилоксиалкил (такой как феноксиметил) или арил (включая фенил), необязательно замещенный галогеном, С 1-С 4 алкилом или C1-C4 алкокси, или остаток аминокислоты. Термин "ацил" конкретно означает, но не ограничивается ими, ацетил, пропионил, бутирил, пентаноил, 3-метилбутирил, бисукцинат, 3 хлорбензоат, бензоил, ацетил, пивалоил, мезилат, пропионил, валерил, и капроновую, каприловую, каприновую, лауриловую, миристиновую, пальмитиновую, стеариновую и олеиновую кислоту, а также может означать остаток аминокислоты. Термин "пуриновое или пиримидиновое основание" означает, но не ограничивается ими, аденин,N6-алкилпурины, N6-ацилпурины (где ацил представляет С(О) (алкил, арил, алкиларил или арилалкил),N6-бензилпурин, N6-галогенпурин, N6-винилпурин, N6-ацетиленпурин, N6-ацилпурин, N6-гидроксиалкилпурин, N6-тиоалкилпурин, N2-алкилпурины, N2-алкил-6-тиопурины, тимин, цитозин, 5 фторцитозин, 5-метилцитозин, 6-азапиримидин, включая 6-азацитозин, 2- и/или 4-меркаптопиримидин,урацил, 5-галогенурацил, включая 5-фторурацил, С 5-алкилпиримидины, С 5-бензилпиримидины, С 5 галогенпиримидины,С 5-винилпиримидин,С 5-ацетиленпиримидин,С 5-ацилпиримидин,С 55 5 5 5 гидроксиалкилпурин, С -амидопиримидин, С -цианопиримидин, С -нитропиримидин, С -аминопиримидин, N2-алкилпурины, N2-алкил-6-тиопурины, 5-азацитидинил, 5-азаурацилил, тиазолопиридинил, имидазолопиридинил, пирролопиримидинил и пиразолопиримидинил. Примерами оснований являются цитозин, 5-фторцитозин, 5-бромцитозин, 5-иодцитозин, 5 хлорцитозин, урацил, 5-фторурапил, 5-бромурацил, 5-иодурацил, 5-метилурацил, тимин, аденин, гуанин,инозин, ксантин, 2,6-диаминопурин, 6-аминопурин, 6-хлорпурин, 2,6-дихлорпурин, 6-бромпурин, 2,6 дибромпурин, 6-иодпурин, 2,6-дииодпурин, гипоксантин, 2-(Br, F, Cl или I)-пурин, необязательно замещенный заместителем, включая амино или карбонильную группу в 6-положении, и 6-(Br, Cl или I)пурин, необязательно замещенный заместителем, включая амино или карбонильную группу в 2 положении, 5-бромвинилцитозин, 5-бромвинилурацил, 5-бромэтенилцитозин, 5-бромэтенилурацил, 5-трифторметилцитозин и 5-трифторметилурацил. Используемый здесь термин "пролекарство" означает соединение, которое превращается в нужный нуклеозид после введения in vivo. Неограничивающими примерами являются фармацевтически приемлемые соли (иначе называемые "физиологически приемлемыми солями"), 5'- и/или N4- или N6-ацилированные или алкилированные производные активного соединения, 5'-фосфолипидные и 5'-эфиролипидные производные активного соединения. Используемый здесь термин "хозяин" относится к одноклеточному или многоклеточному организму, в котором может реплицироваться данный вирус, включая клеточные линии и животных, а предпочтительно человека. Альтернативно, указанный хозяин может содержать часть генома вируса гепатита дельта, репликация или функция которого может быть изменена под действием соединений настоящего изобретения. Термин "хозяин" конкретно означает инфицированные клетки; клетки, трансфецированные полным геномом HDV или его частью, и животные, в частности, приматы (включая шимпанзе) и человека. В большинстве применений настоящего изобретения хозяином является человек. Однако очевидно,что при некоторых показаниях, настоящее изобретение может быть использовано в ветеринарии (для таких животных, как шимпанзе). Фармацевтически приемлемые соли и пролекарства Используемый в настоящем описании термин "фармацевтически приемлемые соли или комплексы" означает соли или комплексы 2'-дезоксиL-эритропентофуранонуклеозидов, которые сохраняют нужную биологическую активность исходного соединения и обладают минимальным, если вообще обладают, нежелательным токсическим воздействием. Неограничивающими примерами таких солей являются(а) кислотно-аддитивные соли, образованные неорганическими кислотами (например, соляной кислотой,бромисто-водородной кислотой, серной кислотой, фосфорной кислотой, азотной кислотой и т.п.), и соли,образованные органическими кислотами, такими как уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, яблочная кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, пальмовая кислота, альгиновая кислота, полиглутаминовая кислота, нафталинсульфоновая кислота,нафталиндисульфоновая кислота и полигалактуроновая кислота; (b) основно-аддитивные соли, образованные катионами, такими как натрий, калий, цинк, кальций, висмут, барий, магний, алюминий, медь,кобальт, никель, кадмий, натрий, калий и т.п., или органическими катионами, такими как N,N- 11005890 дибензилэтилендиамин, аммоний или этилендиамин; или (с) комбинации солей (а) и (b), например, соль дубильной кислоты и цинка или т.п. 2'-ДезоксиL-эритропентофуранонуклеозид может быть получен в виде 5'-фосфолипида или 5'эфиролипида, как описано в следующих работах: Kucera, L.S.; Lyer, N.; Leake, E.; Raben, A.; Modest, E.J.;activity of phospholipid analogs of azidothymidine and other antiviral nucleosides" J. Biol. Chem. 1990, 265,6112-7. 2'-ДезоксиL-эритропентофуранонуклеозид может быть превращен в фармацевтически приемлемый сложный эфир посредством реакции с подходящим этерифицирующим агентом, например, галогенангидридом или ангидридом. Нуклеозид или его фармацевтически приемлемое пролекарство могут быть превращены в их фармацевтически приемлемую соль стандартным способом, например, путем обработки подходящим основанием или кислотой. Сложный эфир или соль могут быть превращены в исходный нуклеозид, например, путем гидролиза. Модификации активных соединений, а в частности, в N4, N6 и 5'-О-положениях, могут влиять на биологическую доступность и скорость метаболизма активных молекул, что позволяет осуществлять контроль за доставкой активных молекул. В своем предпочтительном варианте настоящее изобретение относится к способу лечения HDVинфекций у человека и других животных-хозяев, предусматривающему введение эффективного количества одного или нескольких производных 2'-дезоксиL-эритропентофуранонуклеозида, выбранных из группы, состоящей из -L-2'-дезоксиаденозина, -L-2'-дезоксицитидина, -L-2'-дезоксиуридина, -L-2'гуанозина, -L-2'-дезоксиинозина и -L-2'-дезокситимидина или их физиологически приемлемого пролекарства, включая фосфат, 5' и/или N4- или N6-алкилированное или ацилированное производное, или его физиологически приемлемая соль, необязательно, в фармацевтически приемлемом носителе. Соединения настоящего изобретения либо обладают прямой анти-HDV активностью, либо подвергаются метаболизму с образованием соединения или соединений, обладающих анти-HDV активностью. В предпочтительном варианте осуществления изобретения 2'-дезоксиL-эритропентофуранонуклеозид вводят, в основном, в форме одного изомера, то есть имеющего по крайней мере на 95% определенную стереоконфигурацию. Любые описанные здесь нуклеозиды могут быть введены в виде стабилизированного пролекарства для увеличения активности, биологической доступности, стабильности или других свойств, которыми обладает указанный нуклеозид. Известен ряд лигандов нуклеотидных пролекарств. Вообще говоря, алкилирование, ацилирование или другие липофильные модификации моно-, ди- или трифосфата указанного нуклеозида повышают стабильность этого нуклеотида. Примерами групп-заместителей, которые могут замещать один или несколько атомов водорода на фосфатной части, являются алкил, арил, стероиды, углеводы (включая сахара), 1,2-диацилглицерин и спирты. Многие из них описаны в работе R. JonesN. Bischofberger, Antiviral Research, 1995, 27, 1-17. Любые из них могут быть использованы в комбинации с описанными нуклеозидами в целях достижения нужного эффекта. В одном из вариантов настоящего изобретения 2'-дезоксиL-эритропентофуранонуклеозид получают в виде липофильного 5'-гидроксил-пролекарства. Неограничивающими примерами патентов США,где описаны подходящие липофильные заместители, которые могут быть ковалентно введены в нуклеозид, предпочтительно в 5'-ОН-положение нуклеозидного или липофильного препаратов, являются патенты США 5149794 (Sep. 22, 1992, Yatvin et al.);5194654 (Mar. 16, 1993, Hostetler et al.), 5223263 (June 29, 1993, Hostetler et al.); 5256641 (Oct. 26, 1993, Yatvin et al.); 5411947 (May 2, 1995, Hostetler et al.); 5463092 (Oct. 31, 1995, Hostetler et al.); 5543389 (Aug. 6, 1996, Yatvin et al.); 5543390 (Aug. 6, 1996, Yatvinet al.); 5543391 (Aug. 6, 1996, Yatvin et al.) и 5554728 (Sep. 10, 1996; Basava et al.). Иностранными патентными заявками, где описаны липофильные заместители, которые могут быть присоединены к производному 2'-дезоксиL-эритропентофуранонуклеозида настоящего изобретения,или липофильные препараты, являются WO 89/02733, WO 90/00555, WO 91/16920, WO 91/18914, WO 93/00910, WO 94/26273, WO 96/15132, ЕР 0350287, ЕР 93917054,4 и WO 91/19721. Дополнительными неограничивающими примерами 2'-дезоксиL-эритропентофуранонуклеозидов являются соединения, которые содержат заместители, описанные в нижеследующих публикациях. Эти производные 2'-дезоксиL-эритропентофуранонуклеозиды могут быть использованы в случаях, указанных в настоящем описании или в других целях в качестве противовирусных агентов, включая анти-HBVHIV; studies on the carboxyl terminus" Antiviral Chem. Chemother. 1993a, 4, 97-101; McGuigan, C, Pathirana,R.N., Balzarini, J. and De Clercq, E. "Intracellular delivery of bioactive AZT nucleotides by aryl phosphate derivatives of AZT" J. Med. Chem, 1993b, 36, 1048-1052. Обсуждаемое равновесие между конформацией "кресла" и скрученной конформацией для фосфат- 13005890 ных колец нуклеозидных циклических 3',5'-монофосфатов было проанализировано посредством 1 Н-ЯМР и рентгеновской кристаллографии диастереомеров тимидинфенил-3',5'-циклического монофосфата (J.their an.tileukemic activities" Chem. Pharm. Bull., 1988, 36, 209-217. Одной из предпочтительных групп фосфатного пролекарства является S-ацил-2-тиоэтильная группа, обозначаемая также "SATE". Фармацевтические композиции На основе производных 2'-дезоксиL-эритропентофуранонуклеозида настоящего изобретения могут быть получены фармацевтические композиции, включающие вышеуказанное соединение, или его соль, или пролекарство в количестве, которое является терапевтически эффективным для лечения инфекций гепатита D, необязательно в комбинации с фармацевтически приемлемыми добавками, носителем или наполнителем. Терапевтически эффективное количество может варьироваться в зависимости от конкретной инфекции или состояния, подвергаемого лечению, его тяжести, от применяемой схемы лечения, фармакокинетики используемого агента, а также от конкретного пациента, подвергаемого лечению. В одном из аспектов настоящего изобретения соединение настоящего изобретения предпочтительно смешивают с фармацевтически приемлемым носителем. Вообще говоря, предпочтительно фармацевтическую композицию вводят перорально, но она может быть введена парентерально, внутривенно, внут- 14005890 римышечно, чрескожно, интрабуккально, подкожно, в виде суппозитория или другим способом. Внутривенные и внутримышечные композиции предпочтительно вводят в стерильном физиологическом растворе. Для получения множества композиций, предназначенных для конкретного способа введения, указанная композиция может быть модифицирована любым специалистом в соответствии с настоящим описанием, но при этом композиции настоящего изобретения не должны терять свою стабильность или свою терапевтическую активность. В частности, модификацией нужного соединения может быть придание ей лучшей растворимости в воде или в другом носителе, что может быть, например, легко осуществлено посредством рутинной модификации (получения солевой формы композиции, этерификации и т.п.). Из некоторых фармацевтических разовых лекарственных форм предпочтительной является пролекарственная форма данного соединения, включая, в частности, ацилированные (ацетилированные или другие) и эфирные производные, эфиры фосфорной кислоты и различные солевые формы соединений настоящего изобретения. Каждому специалисту известно, каким образом можно легко модифицировать соединение настоящего изобретения для получения формы пролекарства в целях облегчения доставки активного соединения в нужный участок организма хозяина или пациента. Специалист также может использовать предпочтительные фармакокинетические параметры пролекарственной формы, если она применима, для доставки нужного соединения в нужный участок организма-хозяина или пациента в целях максимизации желаемого эффекта указанного соединения при лечении инфекционного гепатита D. Количество соединения, содержащегося в терапевтически активных композициях настоящего изобретения, представляет собой количество, эффективное для лечения инфекций или состояний, а в предпочтительных вариантах изобретения, для лечения инфекционного гепатита D. В общих чертах, терапевтически эффективное количество соединения настоящего изобретения в фармацевтической лекарственной форме обычно составляет примерно от 0,1 до 100 мг/кг или более в зависимости от используемого соединения, состояний или инфекций, подвергаемых лечению и от способа введения. Для осуществления настоящего изобретения, профилактически или превентивно, эффективное количество композиций настоящего изобретения используют в том же самом интервале концентраций, которые были указаны для терапевтически эффективного количества, и это количество обычно аналогично терапевтически эффективному количеству. Введение активного соединения может быть осуществлено непрерывно (капельное внутривенное вливание) или перорально несколько раз в день (например, четыре раза в день (QID), два раза в день(BID) и т.п.) и таким введением может быть пероральное, местное, парентеральное, внутримышечное,внутривенное, подкожное, чрескожное (при котором может быть использован агент для улучшения пенетрации) и трансбуккальное введение, а также введение в виде суппозиториев и т.п. Таблетки для перорального введения, покрытые энтеросолюбильным покрытием, могут быть также использованы для повышения биологической доступности и стабильности данных соединений при пероральном введении. Наиболее эффективная доза лекарственного средства зависит от фармакокинетики конкретно выбранного агента, а также от тяжести заболевания пациента. Пероральные лекарственные формы являются особенно предпочтительными из-за простоты их введения и удобства, способствующего соблюдению пациентом режима лечения. Для получения фармацевтических композиций настоящего изобретения, терапевтически эффективное количество одного или нескольких соединений настоящего изобретения, предпочтительно, смешивают с фармацевтически приемлемым носителем стандартными методами, обычно используемыми в фармацевтической практике для получения соответствующей дозы. Носитель может иметь различные формы в зависимости от формы препарата, необходимого для введения, например, перорального или парентерального введения. Для получения фармацевтических композиций в виде пероральной лекарственной формы может быть использована любая стандартная фармацевтическая среда. Так, например, для жидких пероральных препаратов, таких как суспензии, эликсиры и растворы, могут быть использованы подходящие носители и добавки, включая воду, гликоли, масла, спирты, отдушки, консерванты, красители и т.п. Для твердых пероральных препаратов, таких как порошки, таблетки, капсулы, и для таких твердых препаратов, как суппозитории, могут быть использованы подходящие носители и добавки, включая крахмалы, носители-сахара, такие как декстроза, маннит, лактоза и родственные носители, разбавители,гранулирующие агенты, замасливатели, связующие агенты, дезинтегрирующие агенты и т.п. Для пролонгированного высвобождения, если это необходимо, таблетки или капсулы могут иметь энтеросолюбильное покрытие, наносимое стандартными методами. Использование таких лекарственных форм может значительно влиять на биологическую доступность данных соединений в организме пациента. В случае парентеральных препаратов носитель обычно включает стерильную воду или водный раствор хлорида натрия, хотя он может также содержать и другие ингредиенты, включая ингредиенты, способствующие диспергированию. При использовании стерильной воды и поддержании ее в стерильном состоянии, композиции и носители также должны быть стерилизованы. Могут быть также получены суспензии для инъекций и в этом случае могут быть использованы подходящие жидкие носители, суспендирующие агенты и т.п. Липосомные суспензии (включая липосомы, нацеливаемые на вирусные антигены) могут быть также приготовлены стандартными методами, используемыми для получения фармацевтически приемлемых- 15005890 носителей. Эти носители могут быть использованы для доставки свободных нуклеозидов, ацилнуклеозидов или пролекарственных форм нуклеозидных соединений настоящего изобретения в виде эфиров фосфорной кислоты. В особенно предпочтительных вариантах осуществления изобретения указанные соединения и композиции используют для лечения, предупреждения или замедления развития инфекционного гепатита D. Предпочтительно для лечения, предупреждения или замедления развития инфекций указанные композиции могут быть введены в виде пероральной лекарственной формы в количестве, составляющем в пределах примерно от 250 микрограммов до 1 грамма или более по крайней мере один раз в день, а предпочтительно вплоть до четырех раз в день. Соединения настоящего изобретения предпочтительно вводят перорально, но они могут быть также введены парентерально, местно или в форме суппозиториев. В некоторых случаях соединения настоящего изобретения, благодаря их низкой токсичности для клеток-хозяев, могут быть преимущественно использованы в профилактических целях для предупреждения инфекционного гепатита D или для предупреждения случаев возникновения клинических симптомов, ассоциированных с указанной вирусной инфекцией. Таким образом, настоящее изобретение также относится к способам профилактического лечения вирусной инфекции, а в частности, инфекционного гепатита D. В этом аспекте настоящего изобретения, композиции настоящего изобретения используют для предупреждения или замедления развития инфекционного гепатита D. Этот профилактический метод предусматривает введение пациенту, нуждающемуся в таком лечении, или пациенту с риском развития заболевания, вызываемого HDV, определенного количества соединения настоящего изобретения, эффективного для ослабления, предупреждения или замедления развития вирусного инфекционного заболевания. При профилактическом лечении по настоящему изобретению предпочтительно, чтобы используемое противовирусное соединение обладало низкой токсичностью, а более предпочтительно, чтобы оно вообще не оказывало токсического действия на пациента. В этом аспекте настоящего изобретения особенно предпочтительно, чтобы используемое соединение обладало максимальной противовирусной эффективностью и минимальной токсичностью для пациента. Соединения настоящего изобретения, которые могут быть использованы для лечения указанных патологических состояний, могут быть введены в интервале доз, аналогичном интервалу доз для терапевтического лечения (то есть примерно от 250 мкг до 1 г или более от 1 до 4 раз в день для пероральной лекарственной формы), в качестве профилактического агента для предупреждения пролиферации инфекции гепатита D, или альтернативно, для замедления развития инфекции гепатита D, которая сама по себе проявляется в клинических симптомах. Кроме того, соединения настоящего изобретения могут быть введены в комбинации или поочередно с одним или несколькими противовирусными агентами, агентами против HBV, против HCV, противHDV или против вируса герпеса или с интерфероном, а также с противораковыми или антибактериальными агентами, включая другие соединения настоящего изобретения. Некоторые соединения настоящего изобретения могут оказаться эффективными для повышения биологической активности некоторых агентов настоящего изобретения в результате ослабления метаболизма, катаболизма или инактивации других соединений, и эти соединения вводят вместе с указанными агентами для достижения нужного эффекта. Комбинированная или альтернирующая терапия Было установлено, что после продолжительного лечения противовирусным агентом, могут развиваться резистентные к лекарственному средству варианты вируса гепатита. Вследствие того, что вирус гепатита В играет важную роль в жизненном цикле вируса гепатита D, соединения, обладающие активностью против вируса гепатита В, могут быть введены в комбинации или поочередно с вышеописанными -2'-L-дезоксинуклеозидами, их фармацевтически приемлемыми солями или пролекарствами. Резистентность к лекарственному средству наиболее часто возникает в результате мутации в гене, кодирующем фермент, используемый вирусом в его жизненном цикле, а наиболее часто в случае HBV в ДНКполимеразе. Недавно было продемонстрировано, что действие лекарственного средства против HBVинфекции может быть продлено, усилено или восстановлено путем введения соединения в комбинации или поочередно со вторым, а вероятно, и с третьим противовирусным соединением, которое индуцирует другую мутацию, вызываемую главным лекарственным средством. Альтернативно, фармакокинетика,биологическое распределение или другие параметры лекарственного средства могут быть изменены путем применения такой комбинированной или альтернирующей терапии. В основном, комбинированная терапия является предпочтительной по сравнению с альтернирующей терапией, поскольку она индуцирует одновременные множественные стрессовые воздействия на вирус. Активность -L-2'-dA, -L-2'-dC, p-L-2'-dU, -L-2'-dG, -L-2'-dT, -L-dI или других описанных здесь-L-2'-нуклеозидов или их пролекарств, фосфатов или солей против вируса гепатита D может быть усилена путем введения двух или нескольких указанных нуклеозидов в комбинации друг с другом или поочередно. Альтернативно, например, один или несколько -L-2'-dA, -L-2'-dC, -L-2'-dU, -L-2'-dG, -L2'-dT, -L-dl или других описанных здесь -L-2'-нуклеозидов могут быть введены в комбинации или поочередно с 3 ТС, FTC, L-FMAU, DAPD, фамцикловиром, пенцикловиром, BMS-200475, bis-pom-PMEA(адефовир, дипивоксил); лобукавиром, ганцикловиром или рибавирином. В любом из описанных здесь вариантов осуществления изобретения, в случае, если -L-2'- 16005890 нуклеозид настоящего изобретения вводят в комбинации или поочередно со вторым нуклеозидным или ненуклеозидным ингибитором полимеразы, который фосфорилируется до его активной формы, то предпочтительно, чтобы это второе соединение было фосфорилировано ферментом, который отличается от фермента, фосфорилирующего выбранный -L-2'-нуклеозид настоящего изобретения in vivo. Примерами киназных ферментов являются тимидинкиназа, цитозинкиназа, гуанозинкиназа, аденозинкиназа, дезоксицитидинкиназа, 5'-нуклеотидаза и дезоксигуанозинкиназа. Получение активных соединений Производные 2'-дезоксиL-эритропентофуранонуклеозида настоящего изобретения известны специалистам и могут быть получены методом, описанным Holy, Collect.Czech.Chem.Commun. 1972, 37(12),4072-87 и Mol.Phys, 1967, 3(4), 386-95. Общий способ получения -L-эритропентафуранонуклеозидов (-L-dN) с использованием L-рибозы или L-ксилозы в качестве исходного материала проиллюстрирован на фиг. 1. Моно-, ди- и трифосфатные производные активных нуклеозидов могут быть получены в соответствии с ранее опубликованными методами. Указанный монофосфат может быть получен в соответствии с процедурой, описанной Imai et al., J.Org.Chem. 1969, 34(6), 1547-1550. Указанный дифосфат может быть получен в соответствии с процедурой, описанной Davisson et al., J.Org.Chem. 1987, 52(9), 1794-1801. Указанный трифосфат может быть получен в соответствии с процедурой, описанной Hoard et al.,J.Am.Chem.Soc., 1965, 87(8), 1785-1788. Примеры Экспериментальные схемы Температуры плавления были определены в открытых капиллярных трубках на аппарате Gallenkamp MFB-595-010 М и не были скорректированы. Спектры УФ-поглощения регистрировали на спектрофотометре Uvikon 931 (KONTRON) в этаноле. 1 Н-ЯМР-спектры регистрировали при комнатной температуре в ДМСО-d6 на спектрометре Bruker AC 250 или 400. Химические сдвиги даны в м.д., ДМСО-d6 использовали в качестве эталона при концентрации 2,49 м.д. Для подтверждения отнесения протонов осуществляли дейтерообмен, эксперименты по развязке или 2D-COSY. Мультиплетность сигналов обозначена с (синглет), д (дублет), дд (дублет дублетов), т (триплет), кв. (квадруплет), шир. (широкий), м(FAB0) или отрицательных (FAB0) ионах с использованием масс-спектрометра JEOL DX 300. Матрицей служил 3-нитробензиловый спирт (NBA) или смесь (50:50, об./об.) глицерина и тиоглицерина (GT). Удельные вращения измеряли на спектрополяриметре Perkin-Elmer 241 (длина пробега 1 см) и выражали в единицах 10-1 см 2 г-1. Элементный анализ проводили в соответствии с описанием в "Service de Microanalyеes du CNRS, Division de Vernaison" (France). Величины, полученные в анализах с указанием символов элементов или функций, составляли в пределах 0,4% от теоретических величин. Тонкослойную хроматографию осуществляли на алюминиевых пластинах, покрытых силикагелем 60 F254 (Merck Art. 5554), визуализацию продуктов осуществляли по УФ-поглощению с последующей карбонизацией 10% этаноловым раствором серной кислоты и нагреванием. Колоночную хроматографию осуществляли на силикагеле 60 (Merck Art. 9385) при атмосферном давлении. Пример 1. 9-(3,5-ди-O-бензоилL-ксилофуранозил)аденин (3). Раствор 9-(2-О-ацетил-3,5-ди-О-бензоилL-ксилофуранозил)аденина 2 [cм. Gosselin, G. Bergogne,M.-C; Imbach, J.L. "Synthesis and Antiviral Evaluation of -L-Xylofuranosyl Nucleosides of the Five NaturallyOccuring Nucleic Acid Bases" Journal of Heterocyclic Chemistry, 1993, 30, 1229-1233] (8,30 г, 16,05 ммоль) и 98% гидрата гидразина (234 мл, 48,5 ммоль) в смеси пиридин/ледяная уксусная кислота (4/1, об./об., 170 мл) перемешивали при комнатной температуре в течение 22 ч. Реакцию гасили добавлением ацетона (40 мл) и продолжали перемешивать еще 1 ч. Объем реакционной смеси снижали наполовину, разбавляли водой (250 мл) и экстрагировали хлороформом (2150 мл). Органический слой последовательно промывали водным насыщенным раствором NаНСО 3 (3100 мл) и водой (3100 мл), а затем сушили, фильтровали, концентрировали и подвергали азеотропной отгонке с толуолом и метанолом. Остаток очищали колоночной хроматографией на силикагеле (0-3% МеОН в дихлорметане) с получением соединения 3(5,2 г, 68%), осажденного из диизопропилового эфира: 1 Н ЯМР (ДМСО-d6)4,5-4,9 (м, 4 Н, Н-2', Н-4', Н-5' и Н-5"), 5,64 (т, 1 Н, Н-3', J2',3' = J3',4'=3,5 Гц), 6,3(шир.с, 1 Н, ОН-2'), 6,45 (д, 1 Н, Н-1', J1',2' = 4,6 Гц), 7,3 (шир.с, 2 Н, NH2-6), 7,4-7,9 (м, 10 Н, 2 бензоила),8,07 и 8,34 (2 с, 2 Н, Н-2 и Н-8); МС: матрица G/T, (FAB+) m/z 476 [М+Н]+, 136 [ВН 2]+, (FAB-) m/z 474 [М-Н]-, 134 [В]-; УФ (95% этанол): max=257 нм ( 16400), 230 нм ( 29300), min=246 нм ( 14800); []D20=-64 (с 1,07, СНСl3). Анализ для C24H21N5O4 (М=475,45): вычислено: С, 60,43; Н, 4,45; N, 14,73; найдено: С, 60,41; Н, 4,68; N, 14,27. Пример 2. 9-(3,5-ди-O-бензоил-2-дезоксиL-треопентафуранозил)аденин (4). К раствору соединения 3 (1,00 г, 2,11 ммоль) в сухом ацетонитриле (65 мл) добавляли 4(диметиламино)пиридин (0,77 г, 6,32 ммоль) и фенокситиокарбонилхлорид (0,44 мл, 3,16 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч. После концентрирования остаток растворяли в дихлорметане (50 мл) и последовательно промывали водой (230 мл), водным раствором 0,5 н. соляной- 17005890 кислоты (30 мл) и водой (330 мл). Органический слой сушили, фильтровали и концентрировали досуха. Неочищенное тиокарбонилированное промежуточное соединение непосредственно обрабатывали гидридом трис-(триметилсилил)силана (0,78 мл, 5,23 ммоль) и ,'-азоизобутиронитрилом (AIBN, 0,112 г, 0,69 ммоль) в сухом диоксане (17 мл) при кипячении с обратным холодильником в течение 2 ч. Растворитель удаляли в вакууме, и остаток очищали колоночной хроматографией на силикагеле (0-5% МеОН в дихлорметане) с получением чистого соединения 4 (0,93 г, 96%) в виде пены: 1 Н ЯМР (ДMCO-d6)2,9-3,1 (м, 2 Н, Н-2' и Н-2"), 4,6-4,7 (м, 3 Н, Н-4', Н-5' и Н-5"), 5,8 (шир.с, 1 Н, Н 3'), 6,43 (дд, 1 Н, Н-1', J1',2'=3,1 Гц, J1',2'=7,6 Гц), 7,3 (шир.с, 2 Н, NH2-6), 7,4-7,9 (м, 10 Н, 2 бензоила), 8,05 и 8,33 (2 с, 2 Н, Н-2 и Н-8); МС: матрица G/T, (FAB+) m/z 460 [М+Н]+, 325 [S]+, 136 [ВН 2]+, (FAB-) m/z 458 [М-Н]-, 134 [В]-; УФ(95% этанол): max=261 нм ( 14400), 231 нм ( 26300), max=249 нм ( 12000); []D20=-38 (с 1,04, ДМСО). Пример 3. 6-N-(4-монометокситритил)-9-(3,5-ди-O-бензоил-2-дезоксиL-треопентофуранозил) аденин (5). К раствору соединения 4 (0,88 г, 1,92 ммоль) в сухом пиридине (40 мл) добавляли 4 монометокситритилхлорид (1,18 г, 3,84 ммоль). Смесь перемешивали при 60 С в течение 24 ч. После добавления метанола (5 мл), раствор концентрировали досуха, остаток растворяли в дихлорметане (50 мл) и последовательно промывали водой (30 мл), водным насыщенным NаНСО 3 (30 мл) и водой (30 мл). Органический слой сушили, фильтровали, концентрировали и выпаривали вместе с толуолом с получением чистого соединения 5 (1,01 г, 72%) в виде пены. 1 Н ЯМР (CDCl3)2,9-3,0 (м, 2 Н, Н-2' и Н-2"), 3,62 (с,3 Н, ОСН 3), 4,6-4,8 (м, 3 Н, Н-4', Н-5' и Н-5"),5,85 (пт, 1 Н, Н-3'), 6,44 (дд, 1 Н, Н-1', J1',2' = 3,1 Гц, J1',2' = 7,3 Гц), 6,9 (шир.с, 1 Н, NH-6), 6,7-6,8 и 7,2-7,4(2 м, 24 Н, 2 бензоила и ММТr), 7,97 и 8,13 (2 с, 2 Н, Н-2 и Н-8); МС: матрица G/T, (FAB+) m/z 732 [М+Н]+, (FAB-) m/z 730 [М-Н]-; УФ (95% этанол): max=274 нм ( 12100), 225 нм ( 24200), min=250 нм ( 5900); []D20=-16 (c 1,12, ДМСО). Пример 4. 6-N-(4-монометокситритил)-9-(2-дезоксиL-треопентофуранозил)аденин (6). Соединение 5 (0,95 г, 1,30 ммоль) обрабатывали метаноловым раствором аммиака (насыщенным при -10 С) (40 мл) при комнатной температуре в течение ночи. После концентрирования остаток растворяли в дихлорметане (60 мл) и промывали водой (30 мл). Водный слой дважды экстрагировали дихлорметаном (10 мл). Объединенный органический слой сушили, фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (0-5% МеОН в дихлорметане) с получением чистого соединения 6 (0,67 г, 98%) в виде пены: 1 Н ЯМР (CDCl3)2,6-2,9 (м, 2 Н, Н-2' и Н-2"), 3,5 (шир.с, 1 Н, ОН-5'), 3,55 (с, 3H, ОСН 3), 3,9-4,0 (м,3H, Н-4', Н-5' и Н-5"), 4,5-4,6 (м, 1 Н, Н-3'), 6,03 (дд, 1 Н, Н-1', J1',2'=4,0 Гц, J1',2=8,8 Гц), 7,0 (шир.с, 1 Н, NH6), 6,7-6,8 и 7,1-7,4 (2 м, 14 Н, ММТr), 7,40 (д, 1 Н, ОН-3', JH,OH=10,6 ГЦ), 7,80 и 7,99 (2 с, 2 Н, Н-2 и Н-8); МС: матрица G/T, (FAB+) m/z 524 [М+Н]+, 408 [ВН 2]+, (FAB-) m/z 1045 [2 М-Н]", 522 [М-Н]-, 406[В] ; УФ (95% этанол): max=275 нм ( 12300), min=247 нм ( 3600); []D20=+28 (с 0,94, ДМСО). Пример 5. 6-N-(4-монометокситритил)-9-(2-дезокси-5-O-(4-монометокситритил)L-треопентофуранозил)аденин (7). Соединение 6 (0,62 г, 1,24 ммоль) в сухом пиридине (25 мл) обрабатывали 4-монометокситритилхлоридом (0,46 г, 1,49 ммоль) при комнатной температуре в течение 16 ч. После добавления метанола (5 мл), смесь концентрировали досуха. Остаток растворяли в дихлорметане (60 мл) и последовательно промывали водой (40 мл), насыщенным водным раствором NаНСО 3 (40 мл) и водой (340 мл). Органический слой сушили, фильтровали, концентрировали и выпаривали вместе с толуолом и метанолом. Остаток очищали колоночной хроматографией на силикагеле (0-10% МеОН в дихлорметане) с получением соединения 7 (0,71 г, 72%) в виде пены: 1 Н ЯМР (ДMCO-d6)2,21 (д, 1 Н, Н-2' J2',2 = 14,3 Гц), 2,6-2,7 (м, 1 Н, Н-2"), 3,1-3,3 (2 м, 2 Н, Н-5' и Н 5"), 3,64 и 3,65 (2 с, 6 Н, 2 ОСН 3), 4,1-4,2 (м, 1 Н, Н-4'), 4,2-4,3 (м, 1 Н, Н-3'), 5,68 (д, 1 Н, ОН-3', JH,OH=5,2 ГЦ), 6,24 (д, 1 Н, Н-1', J1',2=7,0 Гц), 6,7-6,8 и 7,1-7,3 (2 м, 29 Н, 2 ММТr и NH-6), 7,83 и 8,21 (2 с, 2 Н, Н-2 и Н-8); МС: матрица G/T, (FAB+) m/z 796 [М+Н]+ 408 [ВН 2]+, (FAB") m/z 794 [М-Н]-, 406 [В]-; УФ (95% этанол) : mах=215 нм ( 30900), min=246 нм ( 12800); []D20=+14 (с 1,03, ДМСО). Пример 6. 6-N-(4-монометокситритил)-9-(3-O-бензоил-2-дезокси-5-O-(4-монометокситритил)Lэритропентофуранозил)аденин (8). Раствор диэтилазодикарбоксилата (0,38 мл, 2,49 ммоль) в сухом тетрагидрофуране (20 мл) по каплям добавляли к охлажденному раствору (0 С) нуклеозида 7 (0,66 г, 0,83 ммоль), трифенилфосфина (0,66 г, 2,49 ммоль) и бензойной кислоты (0,30 г, 2,49 ммоль) в сухом ТГФ (20 мл). Смесь перемешивали при комнатной температуре в течение 18 ч и добавляли метанол (1 мл). Растворители удаляли при пониженном давлении и неочищенный продукт очищали колоночной хроматографией на силикагеле (0-5% этилацетат в дихлорметане) с получением соединения 8 с небольшой примесью оксида трифенилфосфина. Пример 7. 6-N-(4-монометокситритил)-9-(2-дезокси-5-O-(4-монометокситритил)L-эритропенто- 18005890 фуранозил)аденин (9). Соединение 8 обрабатывали метаноловым раствором аммиака (насыщенным при -10 С) (20 мл) при комнатной температуре в течение 24 ч, а затем реакционную смесь концентрировали досуха. Остаток растворяли в дихлорметане (30 мл) и промывали водой (20 мл). Водный слой экстрагировали дихлорметаном (220 мл) и объединенную органическую фазу сушили, фильтровали и концентрировали. После очистки колоночной хроматографией на силикагеле (0-2% МеОН в дихлорметане) получали чистое соединения 9 (0,50 г, 76% из соединения 7) в виде пены: 1 Н ЯМР (ДMCO-d6)2,2-2,3 (м, 1 Н, Н-2'), 2,8-2,9 (м, 1 Н, Н-2"), 3,1-3,2 (м, 2 Н, Н-5' и Н-5"), 3,64 и 3,65 (2 с, 6 Н, 2 ОСН 3), 3,97 (пкв, 1 Н, Н-4'), 4,4-4,5 (м, 1 Н, Н-3'), 5,36 (д, 1 Н, ОН-3', JH,OH=4,5 Гц), 6,34 (т,1 Н, Н-1', J1',2'=J1',2= 6,4 Гц), 6,8-6,9 и 7,1-7,4 (2 м, 29 Н, 2 ММТr и NH-6), 7,81 и 8,32 (2 с, 2 Н, Н-2 и Н-8); МС: матрица G/T, (FAB+) m/z 796 [М+Н]+, 408 [ВН 2]+, (FAB-) m/z 794 [М-Н]-, 406 [В]-; УФ (95% этанол): max=276 нм ( 42600), min=248 нм ( 23300); []D20=+29 (с 1,05, ДМСО). Пример 8. 2'-ДезоксиL-аденозин -L-dA). Соединение 9 (0,44 г, 0,56 ммоль) обрабатывали водным 80%-ным раствором уксусной кислоты (17 мл) при комнатной температуре в течение 5 ч. Смесь концентрировали досуха, остаток растворяли в воде(20 мл) и промывали диэтиловым эфиром (215 мл). Водный слой концентрировали и выпаривали вместе с толуолом и метанолом. После очистки колоночной хроматографией на силикагеле (0-12% МеОН в дихлорметане) и фильтрации через фильтр Millex HV-4 (0,45 мк, Millipore) получали нужный 2'-дезокси-L-аденозин (-L-dA) (0,12 г, 83%): т.пл. 193-194 С (кристаллизованный из воды) (теор. 184-185 С для Lэнантиомера [см. Robins, M.J. Khwaja, Т.A. Robins, R.K. J.Org.Chem. 1970, 35, 636-639] и 187-189 С дляC10H13N5O3+1,5 H2O (M=278,28): вычислено С, 43,16; H, 5,80; N, 25,17; найдено: С, 43,63; Н, 5,45; N,25,33. Пример 9. 1-О-ацетил-2,3,5-три-O-бензоилL-рибофураноза (143). Как показано на схеме 1, раствор L-рибозы 140 (150 г, 1 моль; Cultor Science Food, CAS [24259-594], серия RIB9711013) в метаноле (2 л; P.A. Prolabo; см. 20847,295) обрабатывали 95-97% серной кислотой (12 мл; Merck; см. 1,00731,1000) и оставляли при +4 С на 12 ч, а затем нейтрализовали пиридином(180 мл, 99% от Acros; см. 131780025). После выпаривания получали ,-смесь метилрибофуранозидов 141 в виде сиропа. Раствор этой аномерной смеси в пиридине (1,3 л) обрабатывали бензоилхлоридом(580 мл, 5 моль; Fluka; см. 12930) при охлаждении и механическом перемешивании. Раствор оставляли на 12 ч при комнатной температуре, а затем выливали на лед (примерно 10 л) при непрерывном перемешивании. Смесь (масло в воде) фильтровали через прокладку из целита. Полученное масло на прокладке из целита промывали водой (33 л), а затем растворяли этилацетатом (3 л). Органическую фазу промывали 5% раствором NаНСО 3 (2 л) и водой (2 л), сушили над сульфатом натрия (Prolabo; см. 28111.365),фильтровали и выпаривали с получением 1-O-метил-2,3,5-три-O-бензоил-/-L-рибофуранозы 142 в виде густого сиропа. Это масло растворяли в уксусном ангидриде (560 мл; Fluka; см. 45830) и в уксусной кислоте (240 мл; P.A. Carlo Erba; см. 20104298). Этот раствор, после добавления по каплям концентрированной серной кислоты (80 мл), выдерживали в течение 10 ч на холоде (+4 С) при механическом перемешивании. Затем раствор выливали на лед (примерно 10 л) при непрерывном перемешивании. Смесь(маслянистое соединение в воде) фильтровали через прокладку из целита. Полученное смолистое твердое вещество на прокладке из целита промывали водой (33 л), а затем растворяли в дихлорметане (2,5 л,Р.А. Merck; см. 1.06050.6025). Органическую фазу промывали 5% раствором NаНСО 3 (1 л) и водой (22 л), сушили над сульфатом натрия, фильтровали и выпаривали с получением смолистого твердого соединения 143, которое кристаллизовали из этанола 95 (Prolabo; см. 20823.293) с получением 225 г продукта Пример 10. -L-аденозин (145). Как показано на схеме 2, аденин (19,6 г, 144 ммоль; Pharma-Waldhof; см. 400134.001 серия 45276800) суспендировали в ацетонитриле (400 мл; Riedel-de Hean; см. 33019, перегнанный над СаН 2) с 1-О-ацетил-2,3,5-три-О-бензоилL-рибофуранозой 143 (60 г, 119 ммоль). К этой суспензии добавляли дымящий хлорид олова (22 мл, 187 ммоль; Fluka; см. 96558). Через 12 ч реакционную смесь концентрировали до небольшого объема (примерно 100 мл) и добавляли бикарбонат натрия (110 г) и воду (120 мл). Полученное белое твердое вещество (соли олова) экстрагировали горячим хлороформом (5200 мл, Acros; см. 22706463). Объединенные экстракты фильтровали на слое целита. Органическую фазу промывали 5% раствором NaHCO3 и водой, сушили над сульфатом натрия (Prolabo; см. 28111.365), фильтровали и выпаривали с получением соединения 144 (60 г, бесцветная пена). Полученную пену обрабатывали метанолом, насыщенным аммиаком (220 мл), в герметично закрытом сосуде при комнатной температуре и при перемешивании в течение 4 дней. Растворитель выпаривали при пониженном давлении и полученный порошок суспендировали в этилацетате (400 мл; Carlo Erba; см. 528299) при кипячении с обратным холодильником в течение 1 ч. После фильтрации порошок перекристаллизовывали из воды (220 мл) с получением L-аденозина 145 (24 г, кристаллы, 75%): т.пл. 233-234 С. (Saneyoshi, M., and Satoh, E. "Synthetic Nucleosides and Nucleotides. XIII. Stannic Chloride Catalyzed Ribosylation of Several 6-Substituted Purines" Chem. Pharm. Bull, 1979, 27, 2518-2521; Nakayama, C, and Saneyoshi, M. "Synthetic Nucleosides andNucleotides, 1982, 1, 139-146 указана температура плавления 235-238 С); 1 Пример 11. 3',5'-О-(1,1,3,3-тетраизопропил-1,3-дисилоксанил)L-аденозин (146). Как показано на схеме 3, L-аденозин 145 (47,2 г, 177 ммоль) суспендировали в пиридине (320 мл,99% из Acros; см. 131780025) и добавляли 1,3-дихлор-1,1,3,3-тетраизопропилдисилоксан (63 мл, 201 ммоль; Fluka; см. 36520), и смесь перемешивали при комнатной температуре в течение 12 ч. Пиридин выпаривали и остаток распределяли между этилацетатом (1 л; Carlo Erba; см. 528299) и 5% растворомNaHCO3 (600 мл). Органическую фазу промывали 0,5 н. раствором НСl (2500 мл) и водой (500 мл), сушили над сульфатом натрия (Prolabo; см. 28111.365), фильтровали и выпаривали досуха. Полученное твердое вещество кристаллизовали из ацетонитрила (Riedel-de Haen; см. 33019) с получением соединения 146 (81 г, 90%): т.пл. 97-98 С. (В работе Robins M.J. et al. "Nucleic Acid Related Compounds. 42. A General Пример 12. 3',5'-О-(1,1,3,3-тетраизопропил-1,3-дисилоксанил)-2'-дезоксиL-аденозин (148). К соединению 146 (34 г, 67 ммоль) добавляли ацетонитрил (280 мл; Riedel-de Haen; см. 33019),DMAP (16,5 г, 135 ммоль 99% от Acros; см. 1482702050) и фенилхлортионокарбонат (10,2 мл, 73 ммоль; 99% от Acros; см. 215490050), как показано на схеме 4. Раствор перемешивали при комнатной температуре в течение 12 ч. Растворитель выпаривали и остаток распределяли между этилацетатом (400 мл;Carlo Erba; см. 528299) и 0,5 н. раствором НСl (400 мл). Органический слой промывали 0,5 н. раствором НСl (400 мл) и водой (2400 мл), сушили над сульфатом натрия (Prolabo; см. 28111.365), фильтровали и выпаривали досуха с получением промежуточного соединения в виде светло-желтого твердого вещества. Неочищенное соединение 147 растворяли в диоксане (Merck; см. 1.09671.1000) и добавляли AIBN (3,3 г,20 ммоль; ,'-азаизобутиронитрил от Fluka; см. 11630) и TTMSS (33 мл, 107 ммоль; трис(триметилсилил)силан от Fluka; см. 93411). Раствор постепенно нагревали до температуры дефлегмации и перемешивали в течение 2 ч. Реакционную смесь концентрировали с получением желтого масла,которое подвергали хроматографии (элюент: дихлорметан Merck; см. 1.06050.6025):метанол(Carlo Erba; см. 309002)=95:5) и получали соединение 148 (23 г, бесцветная пена, 70%). Аликвоту кристаллизовали из смеси этанол/петролейный эфир: т.пл. 110-111 С. (В работе Robins M.J., Wilson J.S.Hansske F. "NucleicFunctions with Ammonium Fluoride in Methanol" Tetrahedron Lett, 1992, 33, 1177-1180, раствор 3',5'-О(1,1,3,3-тетраизопропил-1,3-дисилоксанил)-2'-дезокси-L-аденозина 148 (32 г, 65 ммоль) и фторида аммония (32 г, ммоль; Fluka, см. 09742) в метаноле (Prolabo; см. 20847.295) перемешивали при кипячении с обратным холодильником в течение 2 ч (схема 5). Затем добавляли силикагель (Merck; см. 1.07734.2500) и смесь осторожно выпаривали с получением белого порошка. Этот порошок добавляли на верхнюю часть колонки с двуокисью кремния, которую элюировали дихлорметаном (Merck; см. 1.06050.6025)/метанол, 9/1. Соответствующие фракции объединяли и выпаривали с получением белого порошка, который кристаллизовали из этанола 95 (Prolabo; см. 20823.293) с получением 12,1 г продуктаChemistry, 1993, 30, 1229-1233] (4,79 г, 9,68 ммоль) в пиридине (60 мл) и уксусной кислоте (1-5 мл). Раствор перемешивали в течение ночи при комнатной температуре. Затем добавляли ацетон (35 мл) и смесь перемешивали 30 мин. Реакционную смесь выпаривали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент: ступенчатый градиент метанола (0-4%) в дихлорметане] с получением соединения 11 (3,0 г, 68%), который кристаллизовали из смеси циклогексан/дихлорметан, т.пл.=111-114 С; 1 Н-ЯМР (ДМСО-d)11,35 (шир.с, 1 Н, NH), 7,9-7,4 (м, 11 Н, 2 С-Н-СО, Н-6), 6,38 (д, 1 Н, ОН-2',JOH-2'=4,2 Гц), 5,77 (д, 1 Н, Н-1', J1',2' = 1,9 Гц), 5,55 (д, 1 Н, Н-5, J5-6=8 Гц), 5,54 (дд, 1 Н, Н-3', J3'-2'=3,9 Гц и(С 6 Н 5 СО 2)-, 111 (В)-. Анализ для C23H20N2O8 Н 2 О: вычислено С, 58,09; Н, 4,76; N, 5,96. Найдено: С,57,71; Н, 4,42; N, 5,70. Пример 15. 1-(3,5-ди-O-бензоилL-арабинофуранозил)урацил (12). К раствору 1-(3,5-ди-O-бензоилL-ксилофуранозил)урацила 11 (8 г, 17,7 мл) в смеси безводного бензола и ДМСО (265 мл, 6:4, об./об.) добавляли безводный пиридин (1,4 мл), дициклогексилкарбодиимид (10,9 г, 53 ммоль) и дихлоруксусную кислоту (0,75 мл). Полученную смесь перемешивали при комнатной температуре в течение 4 ч, а затем разбавляли этилацетатом (400 мл) и добавляли раствор щавелевой кислоты (4,8 г, 53 ммоль) в метаноле (14 мл). После перемешивания в течение 1 ч раствор фильтровали. Фильтрат промывали насыщенным раствором NaCl (2500 мл), 3% раствором NaHCO3 (2500 мл) и водой (2500 мл). Органическую фазу сушили над Na2SO4 и выпаривали при пониженном давлении. Полученный остаток солюбилизировали в смеси абсолютный EtOH/бензол (140 мл, 2:1, об./об.). К этому раствору при 0 С добавляли NaBH4 (0,96 г, 26,5 ммоль). После перемешивания в течение 1 ч раствор разбавляли этилацетатом (400 мл), а затем фильтровали. Фильтрат промывали насыщенным раствором NaCl (400 мл) и водой (400 мл). Органическую фазу сушили над Na2SO4 и выпаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле[элюент: ступенчатый градиент метанола (0-3%) в дихлорметане] с получением соединения 12 (5,3 г,66%), который кристаллизовали из ацетонитрила, т.пл.=182-183 С; 1 Н ЯМР (ДMCO-d6)11,35 (шир.с, 1 Н, NH), 8,0-7,5 (м, 11 Н, 2 С 6 Н 5 СО, Н-6), 6,23 (шир.с, 1 Н, ОН 2'), 6,15 (д, 1 Н, Н-1', J1'-2' = 4 Гц), 5,54 (д, 1 Н, Н-5, J5-6=8,1 Гц), 5,37 (т, 1 Н, Н-3', J3'-2'=J3'-4'=2,6 Гц), 4,7-4,6GT) m/z 451 (М-Н)-, 121 (С 6 Н 5 СО 2), 111 (В)-. Анализ для C23H20N2O8: вычислено С, 61,06; Н, 4,46; N, 6,19. Найдено: С, 60,83; Н, 4,34; N, 6,25. Пример 16. 1-(3,5-ди-O-бензоил-2-дезоксиL-эритропентофуранозил)урацил (13). К раствору 1-(3,5-ди-О-бензоилL-арабинофуранозил)урацила 12 (5,2 г, 11,4 ммоль) в безводном 1,2-дихлорэтане (120 мл) добавляли фенокситиокарбонилхлорид (4,7 мл, 34,3 мл) и 4-(диметиламино) пиридин (DMAP, 12,5 г, 102,6 ммоль). Полученный раствор перемешивали при комнатной температуре в атмосфере аргона в течение 1 ч, а затем выпаривали при пониженном давлении. Остаток растворяли в дихлорметане (300 мл) и органический раствор последовательно промывали охлажденным льдом 0,2 н. раствором соляной кислоты (3200 мл) и водой (2200 мл), сушили над Nа 2SO4 и выпаривали при пониженном давлении. Неочищенный продукт несколько раз выпаривали вместе с безводным диоксаном и растворяли в этом растворителе (110 мл). К полученному раствору в атмосфере аргона добавляли гидрид трис-(триметилсилил)силана (4,2 мл, 13,7 ммоль) и ,'-азоизобутиронитрил (AIBN, 0,6 г, 3,76 ммоль). Реакционную смесь нагревали и перемешивали при 100 С в течение 1 ч в атмосфере аргона, а затем охлаждали до комнатной температуры и выпаривали при пониженном давлении. Остаток очищали коло- 22005890 ночной хроматографией на силикагеле [элюент: ступенчатый градиент метанола (0-5%)] с получением соединения 13 (2,78 г, 56%), который кристаллизовали из EtOH, т.пл.=223-225 С; 1H ЯМР (ДМСО-d6)11,4 (шир.с, 1 Н, NH), 8,0-7,5 (м, 11 Н, 2 С 6 Н 5 СО, Н-6), 6,28 (т, 1 Н, Н-1', J=7 Гц), 5,5 (м, 2 Н, Н-1' и Н-5), 4,6-4,4 (м, 3H, Н-4', Н-5' и Н-5"), 2,6 (м, 2 Н, Н-2' и Н-2"); МС: FAB0 (матрица GT) m/z 437 (М+Н)+, 3325 (S)+; FAB0 (матрица GT) m/z 4 35 (М-Н)-, 111 (В)-. Анализ для C23H20N2O7: вычислено: С, 63,30; Н, 4,62; М, 6,42. Найдено: С, 62,98; Н, 4,79; N, 6,40. Пример 17. 2'-ДезоксиL-цитидин (-L-dC). К раствору 1-(3,5-ди-O-бензоилдезоксиL-эритропентофуранозил)урацила 13 (2,66 г, 6,1 ммоль) в безводном 1,2-дихлорэтане (120 мл) в атмосфере аргона добавляли реагент Лавессона (1,72 г, 4,26 ммоль) и реакционную смесь перемешивали при кипячении с обратным холодильником в течение 2 ч. Затем растворитель выпаривали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле [элюент: ступенчатый градиент этилацетата (0-8%) в дихлорметане] с получением промежуточного 4-тиосоединения в виде желтой пены. Раствор этого промежуточного тиосоединения(1,5 г, 3,31 ммоль) в метаноловом растворе аммиака (предварительно насыщенном при -10 С и плотно закрытом) (50 мл) нагревали при 100 С в автоклаве из нержавеющей стали в течение 3 ч, а затем охлаждали до 0 С. Раствор выпаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле [элюент: ступенчатый градиент метанола (0-20%) в дихлорметане]. И, наконец, соответствующие фракции объединяли, фильтровали через фильтр MillexHV-4 (0,45 мкм, Millipore) и выпаривали при пониженном давлении с получением нужного 2'-дезокси-L-цитидина (p-L-dC) в виде пены (0,6 г, 80%), которую кристаллизовали из абсолютного EtOH: т.пл. 198199 С; 1 Н ЯМР (ДMCO-d6)7,77 (д, 1 Н, Н-6, J6-5=7,4 Гц), 7,10 (шир.д, 2 Н, NH-2), 6,13 (т, 1 Н, Н-1', J=6,7 Гц), 5,69 (д, 1 Н, Н-5, J5-6=7,4 Гц), 5,19 (д, 1 Н, ОН-3', JOH-3'=4,1 ГЦ), 4,96 (т, 1 Н, OH-5', JOH-5'=JOH-5"=5,2 Гц),4,1 (м, 1 Н, Н-3'), 3,75 (м, 1 Н, Н-4'), 3,5 (м, 2 Н, Н-5' и Н-5"), 2,0 (м, 1 Н, Н-2'), 1,9 (м, 1 Н, Н-2"); МС: FAB0 (матрица GT) m/z 228 (М+Н)+, 112 (BH2)+; FAB0 (матрица GT) m/z 226 (М-Н)-; []D20=-69 (с 0,52, ДМСО) ]D20=+76 (с 0,55, ДМСО) для коммерчески доступной гидрохлоридной соли Dэнантиомера]. Анализ для C9H13N3O4: вычислено С, 47,57; Н, 5,77; N, 18,49. Найдено: С, 47,35; Н, 5,68; N,18,29. Пример 18. 2-АминоL-арабинофурано [1',2':4,5]оксазолин (151). Смесь L-арабинозы (170 г, 1,13 моль; Fluka, 99,5%, см. 10839), цианамида (100 г, 2,38 моль; Fluka,98%, см. 28330), метанола (300 мл) и 6M-NH4OH (50 мл) перемешивали при комнатной температуре в течение 3 дней, а затем выдерживали при -10 С в течение ночи. Продукт собирали путем вакуумной фильтрации, последовательно промывали метанолом и эфиром и сушили в вакууме. Выход 130 г (66,0%) аналитически чистого соединения 151, т.пл. 170-172 С; 1 Н ЯМР (ДМСО-d6)м.д. 6,35 (шир.с, 2 Н, NH2), 5,15 (д, 1 Н, Н-1, J=5,6 Гц), 5,45 (шир.с, 1 Н, ОН-3),4,70 (шир.с, 1 Н, ОН-5), 4,55 (д, 1 Н, Н-2, J=5,6 Гц), 4,00 (шир.с, 1 Н, Н-3), 3,65 (м, 1 Н, Н-4), 3,25 (м, 2 Н, Н 5, Н-5'). Пример 19. 02,2'-ангидроL-уридин (152). Раствор соединения 151 (98,8 г, 0,57 моль) и метилпропиолата (98 мл, Fluka, 97%, см. 81863) в 50% водном этаноле (740 мл) кипятили с обратным холодильником в течение 5 ч, а затем охлаждали и концентрировали при пониженном давлении до половины от его первоначального объема. После осаждения ацетоном (600 мл), продукт собирали путем вакуумной фильтрации, промывали этанолом и эфиром и сушили. Маточный раствор частично концентрировали, концентрат осаждали ацетоном (1000 мл), а затем твердое вещество собирали путем вакуумной фильтрации, промывали ацетоном и эфиром и получали второй сбор продукта. Общий выход 80 г (62%) соединения 152, т.пл. 236-240 С. 1 Н ЯМР (ДМСО-d6)м.д. 7,87 (д, 1 Н, Н-6, J=7,4 Гц), 6,35 (д, 1 Н, Н-1', J=5,7 Гц), 5,95 (д, 1 Н, Н-5,J=7,4 Гц), 5,90 (д, 1 Н, ОН-3'), 5,20 (д, 1 Н, Н-2', J=5,7 Гц), 5,00 (м, 1 Н, ОН-3'), 4,44 (шир.с, 1 Н, Н-3'), 4,05(м, 1 Н, Н-4'), 3,25 (м, 2 Н, Н-5, Н-51). Пример 20. 3',5'-ди-О-бензоил-О 2,2' -ангидроL-уридин (153). К раствору соединения 152 (71,1 г, 0,31 моль) в безводном пиридине (1200 мл) добавляли бензоилхлорид (80,4 мл, Fluka, р.а., см. 12 930) при 0 С в атмосфере аргона. Реакционную смесь перемешивали при комнатной температуре в течение 5 ч при полном отсутствии атмосферной влаги и реакцию прекращали добавлением этанола. Растворители выпаривали при пониженном давлении и полученный остаток выпаривали вместе с толуолом и абсолютным этанолом. Неочищенную смесь разбавляли этанолом и осадок собирали вакуумной фильтрацией, последовательно промывали этанолом и эфиром и сушили. Выход 129 г (95,8%) соединения 153, т.пл. 254 С; 1 Н ЯМР (ДМСО-d6)м.д. 8,1-7,4 (м, 11 Н, С 6 Н 5 СО, Н-6), 6,50 (д, 1 Н, Н-1', J=5,7 Гц), 5,90 (д, 1 Н, Н-5,J=7,5 Гц), 5,80 (д, 1 Н, Н-2', J=5,8 Гц), 5,70 (д, 1 Н, Н-3') 4,90 (м, 1 Н, Н-4'), 4,35 (м, 2 Н, Н-5, Н-5'). Пример 21. 3',5'-ди-O-бензоил-2'-хлор-2'-дезокси, L-уридин (154). К раствору соединения 153 (60,3 г, 0,13 9 моль) в диметилформамиде (460 мл) добавляли при 0 С 3,2 н. раствор НСl/ДМФ (208 мл, полученный in situ путем добавления 47,2 мл ацетилхлорида (Fluka, p.а.,- 23005890 см. 00990) при 0 С к раствору 27,3 мл метанола и 133,5 мл диметилформамида). Реакционную смесь перемешивали при 100 С в течение 1 ч при полном отсутствии атмосферной влаги, охлаждали и выливали в воду (4000 мл). Осадок соединения 154 собирали вакуумной фильтрацией, промывали водой и перекристаллизовывали из этанола. Кристаллы собирали, промывали холодным этанолом и эфиром и сушили при пониженном давлении. Выход 60,6 г (92,6%) соединения 154, т.пл. 164-165 С; 1 Н ЯМР (ДMCO-d6)м.д. 8,7 (шир.с, 1 Н, NH), 8,1-7,3 (м, 11 Н, С 6 Н 5 СО, Н-6), 6,15 (д, 1 Н, Н-1', J=4,8 Гц), 5,5 (м, 2 Н, Н-5, Н-2'), 4,65 (м, 4 Н, Н-3', Н-4', Н-5', Н-5). Пример 22. 3',5'-ди-O-бензоил-2'-дезокси-,L-уридин (155). Смесь соединения 154 (60,28 г, 0,128 моль), гидрида три-н-бутилолова (95 мл, Fluka, 98%, см. 90915) и азабисизобутиронитрила (0,568 г; Fluka, 98%, см. 11630) в сухом толуоле (720 мл) кипятили с обратным холодильником при перемешивании в течение 5 ч и охлаждали. Твердое вещество собирали вакуумной фильтрацией и промывали холодным толуолом и петролейным эфиром. Фильтрат концентрировали при пониженном давлении и разбавляли петролейным эфиром, в результате чего получали дополнительный сбор соединения 155. Выход 54,28 г (97,2%) соединения 155; т.пл. 220-221 С; 1 Н-ЯМР (CDCl3)м.д. 8,91 (шир.с, 1 Н, NH), 8,1-7,5 (м, 11 Н, С 6 Н 5 СО и Н-6), 6,43 (кв, 1 Н, Н-1',J1',2'=5,7 Гц и J1',2'= 8,3 Гц), 5,7-5,6 (м, 2 Н, Н-3' и Н-5), 4,8-4,6 (м, 3H, Н-5', Н-5" и Н-4'), 2,8-2,7 (м, 1 Н, Н 2'), 2,4-2,3 (м, 1 Н, Н-2"). Пример 23. 3',5'-ди-O-бензоил-2'-дезоксиL-4-тиоуридин (156). Раствор соединения 155 (69 г, 0,158 моль) и реагента Лавессона (74 г, Fluka, 98%, см. 61750) в безводном метиленхлориде (3900 мл) кипятили с обратным холодильником в атмосфере аргона в течение ночи. После выпаривания растворителя, неочищенный остаток очищали колоночной хроматографией на силикагеле [элюент: градиент метанола (0-2%) в метиленхлориде] с получением чистого соединения 156(м, 1 Н, Н-4'), 2,8 (м, 1 Н, Н-2'), 2,3 (м, 1 Н, Н-2"). Пример 24. 2'-ДезоксиL-цитидин. Раствор соединения 156 (7,3 г, 0,016 моль) в метаноле, насыщенным аммиаком (73 мл), нагревали при 100 С в цилиндре из нержавеющей стали в течение 3 ч. После осторожного охлаждения, растворитель выпаривали при пониженном давлении. Водный раствор остатка промывали этилацетатом и выпаривали досуха. Эту процедуру осуществляли для 9 других образцов (7,3 г каждого) соединения 156 (выход 2'-дезоксиL-цитидина: 73 г). 10 остатков объединяют, разбавляют абсолютным этанолом и охлаждали с получением 2'-дезоксиL-цитидина в виде кристаллов. Следовые количества бензамида удаляли из кристаллов 2'-дезоксиL-цитидина путем экстракции в системе твердое тело-жидкость (при кипячении с обратным холодильником в этилацетате в течение 1 ч). Выход 28,75 г (78,6%) соединения 2'дезоксиL-цитидина; т.пл. 141-145 С; 1 Н ЯМР (ДМСО)м.д. 8,22 и 8,00 (2 шир.с, 2 Н, NH2), 7,98 (д, 1 Н, Н-6, J=7,59 Гц), 6,12 (т, 1 Н, Н-1',J=6,5 Гц и J=7,6 Гц), 5,89 (д, 1 Н, Н-5, J=7,59 Гц), 5,3 (шир.с, 1 Н, ОН-3'), 5,1 (шир.с, 1 Н, ОН-5'), 4,2 (м, 1 Н,Н-3'), 3,80 (кв, 1 Н, Н-4', J=3,6 Гц и J=6,9 Гц), 3,6-3,5 (м, 2 Н, Н-5', Н-5"), 2,2-2,0 (м, 2 Н, Н-2', Н-2");FAB0 (GT) m/e 226 (M-H)', 110 (В)'; FAB0 (GT) 228 (М+Н)+, 112 (В+2 Н)+; [] D20=-56,48 (с=1,08 в ДМСО); УФ (рН 7) max=270 нм (=10000). Пример 25. 3',5'-ди-O-бензоил-2'-дезокси-5-иодL-уридин (157). Смесь соединения 155 (105,8 г, 0,242 моль) иода (76,8 г; Fluka, 99,8%, см. 57650), CAN (66,4 г; нитрат церия-аммония от Aldrich, 98,5%, см. 21547-3) и ацетонитрила (2550 мл) перемешивали при 80 С в течение 3 ч, а затем реакционную смесь охлаждали при комнатной температуре, что приводило к кристаллизации соединения 157 (86,6 г, 63,5%); т.пл. 192-194 С; 1 Н ЯМР (ДМСО)м.д. 8,34 (с, 1 Н, NH), 8,2-7,2 (м, 11 Н, 2 С 6 Н 5 СО, Н-6), 6,31 (кв, 1 Н, Н-1', J=5,5 Гц и J=8,7 Гц), 5,5 (м, 1 Н, Н-3')/4,7 (м, 2 Н, Н-5', Н-5"), 4,5 (м, 1 Н, Н-4'), 2,7 (м, 1 Н, Н-2'), 2,3 (м, 1 Н, Н-2"),FAB0, (GT) m/e 561 (М-Н)-, 237 (В)-; FAB0 (GT) 563 (M+H+); []D2O=+39, 05 (с=1,05 в ДМСО); УФ(EtOH 95) Umax=281 нм (=9000), Umin=254 нм (=4000) , Umax=229 нм (=31000). Анализ для C23H19IN2O7: вычислено С, 49,13; Н, 3,41; N, 4,98, I, 22,57. Найдено: С, 49,31; Н, 3,53; N, 5,05, I, 22,36. Пример 26. 3',5'-ди-O-бензоил-2'-дезокси-3-N-толуолL-тимидин (159). К раствору соединения 157 (86,6 г, 0,154 моль) в безводном пиридине (1530 мл), содержащем Nэтилдиизопропиламин (53,6 мл; Aldrich, 99,5%, см. 38764-9), порциями добавляли при 0 С nтолуоилхлорид (40,6 мл; Aldrich, 98%, см. 10663-1). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем добавляли воду для прекращения реакции и реакционную смесь экстрагировали метиленхлоридом. Органическую фазу промывали водой, сушили над сульфатом натрия и выпаривали досуха с получением неочищенного 3',5'-ди-О-бензоил-2'-дезокси-3-N-толуоил-5-иодLуридина (158), который может быть использован в следующей стадии без дополнительной очистки. Раствор неочищенной смеси 158, ацетата палладия (3,44 мл; Aldrich, 99,98%, см. 37987-5), трифе- 24005890 нилфосфина (8,0 г; Fluka, 97%, см. 93092) в N-метилпиролидиноне (1375 мл; Aldrich, 99%, см. 443778) с триэтиламином (4,3 мл) перемешивали при комнатной температуре в течение 45 мин. Затем по каплям, при 0 С, в атмосфере аргона, добавляли тетраметилолово (42,4 мл; Aldrich, 99%, см. 14647-1). После перемешивания при 100-110 С в течение ночи, смесь выливали в воду и экстрагировали диэтиловым эфиром. Органический раствор сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле [элюент: ступенчатый градиент этилацетата (0-10%) в толуоле] с получением соединения 159 в виде пены (42,3 г, 48,3% для 2 стадий). 1 Н ЯМР (ДМСО)м.д. 8,3-7,2 (м, 15 Н, 2 С 6 Н 5 СО, 1 СН 3 С 6 Н 4 СО, Н-6), 6,29 (т, 1 Н, Н-1', J=7,0 Гц),5,7 (м, 1 Н, Н-3'), 4,7-4,5 (м, 3H, Н-5', Н-5", Н-4/), 2,7-2,6 (м, 2 Н,"Н-2', Н-2");(2 М+Н)+, 569 (М+Н), 325 (М-В)-, 245 (3+2 Н)+, 119 (СН 3 С 6 Н 5 СО)+. Пример 27. 2'-ДезоксиL-тимидин. Раствор соединения 159 (42,3 г, 0,074 моль) в метаноле, насыщенным аммиаком (1850 мл), перемешивали при комнатной температуре в течение двух дней. После выпаривания растворителя остаток разбавляли водой и несколько раз промывали этилацетатом. Водный слой отделяли, выпаривали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле [элюент: ступенчатый градиент метанола (0-10%) в метиленхлориде] с получением чистого 2'-дезоксиL-тимидина (11,62 г,64,8%), который перекристаллизовывали из этанола; т.пл. 185-188 С; 1 Н ЯМР (ДМСО)м.д. 11,3 (с, 1 Н, NH), 7,70 (с, 1 Н, Н-6), 6,2 (пт, 1 Н, Н-1'), 5,24 (д, 1 Н, ОН-3', J=4,2 Гц), 5,08 (т, 1 Н, ОН-5', J=5,l Гц), 4,2 (м, 1 Н, Н-3'), 3,7 (м, 1 Н, Н-4'), 3,5-3,6 (м, 2 Н, Н-5', Н-5"), 2,1-2,0 (м,2 Н, Н-2', Н-2");L-dI синтезировали посредством дезаминирования 2'-дезоксиL-аденозина (-L-dA) в соответствии с процедурой, описанной в 9-D-глюкопиранозильной серии (см. I.Iwai, T.NishimuraB.Shimizu Так, например, раствор -L-dA (200 мг) в смеси уксусной кислоты (0,61 мл) и воды (19 мл) нагревали с нитритом натрия (495 мг) и смесь перемешивали при комнатной температуре в течение ночи. Затем раствор выпаривали досуха при пониженном давлении. Водный раствор остатка наносили на колонку IR120 (Н+) с ионообменной смолой и колонку элюировали водой. Соответствующие фракции собирали и выпаривали досуха с получением чистого -L-dI, который перекристаллизовывали из метанола (106 мг,выход 53%, не оптимизирован); т.пл. 209-211 С; УФ (Н 2 О), max=247 нм; 1 Н ЯМР (ДМСО-d6) = 8,32 и 8,07 (2 с, 1 Н каждый, Н-2 и Н-8), 6,32 (пт, 1 Н, Н-1; J=6,7 Гц), 4,4 (м, 1 Н,Н-3'), 3,9 (т, 1 Н, Н-4'), 3,7-3,4 (м, 2 Н частично скрытый HOD, Н-5',5"), 2,6 и 2,3 (2 м, 1 Н каждый, Н-2' и Н 2"); масс-спектр (зрелый, глицерин-тиоглицерин, 1:1, об./об.), FAB0: 253 (М+Н)+, 137 (основание ++ 2 Н) ; FAB0: 251 (М-Н)-, 135 (основание)"; []D20=+19,3 (-с 0,88, Н 2 О). Пример 29. Токсичность соединений. Анализы на токсичность осуществляли для того, чтобы определить, являются ли какие-либо из наблюдаемых противовирусных эффектов следствием их общего воздействия на жизнеспособность клеток. Используемый способ предусматривает определение влияния -L-dA, -L-dC и -L-dT на рост клеток в клоногенных анализах проб костного мозга человека, по сравнению с ламивудином, с использованием в анализах колоннеобразующих гранулоцитарно-макрофаговых (CFU-GM) и формирующих "взрыв" эритроидных (BFU-E) клеточных линий. Результаты представлены в табл. 1. Пример 30. Биологическая активность фосфорилированных соединений. Была протестирована способность трифосфатных производных -L-dA, -L-dC, -L-dU, -L-2'-dG,-L-dI и -L-dT ингибировать гепатит В. В табл. 2 проиллюстрировано сравнительное ингибирующее действие трифосфатов -L-dT (-L-dT-TP), -L-dC (-L-dC-TP), -L-dU (-L-dU-TP), -L-dA (-L-dA-TP) на ДНК-полимеразу вируса гепатита лесного сурка (WHV), ДНК-полимераз ,ичеловека. Таблица 2IC50: 50%-ная ингибирующая концентрация значение Ki определяли с использованием активированной ДНК тимуса теленка в качестве матрицыпраймера и dATP в качестве субстрата. Ингибиторы анализировали с помощью графика Диксона. В этих условиях вычисленное среднее значение Km ДНК-полимеразычеловека для dATP составляет приблизительно 2,6 мкМ. ДНК-полимеразачеловека имела постоянное значение Km=3,33 мкМ для dATP. ДНК-полимеразачеловека имела постоянное значение Km=5", 2 мкМ. Пример 31. Противовирусная активность соединений. Активность -L-dA, -L-dC, -L-dU, -L-2'-dG и -L-dT против вируса гепатита В тестировали в трансфецированных клетках Hep G-2 (2.2.15). В табл. 3 проиллюстрировано действие -L-dA, -L-dC, L-dU и -L-dT, направленное против репликации вируса гепатита В в трансфецированных клетках Hep внеклеточная ДНК репликативные промежуточные соединения (внутриклеточная ДНК) Пример 32. Комбинированная терапия с использованием соединений. Действие -L-dA, -L-dC и -L-dT, взятых в комбинации, на размножение вируса гепатита В измеряли в клетках 2.2.15. Результаты представлены в табл. 4. Каждая комбинация обнаруживала синергическую активность против HBV. Кроме того, в этой модели, комбинация L-dA+L-dC+L-dT также обнаруживала синергическую активность. Пример 33. Определяли ингибирование репликации вируса гепатита В в клетках 2.2.15 соединениями -L-dA и -L-dC, взятыми отдельно и в комбинации. Результаты представлены в табл. 5. Таблица 5-L-2'-дезоксицитидин: IС 50=О,О 6 мкМ с Величины индексов комбинаций указывают на синергический эффект (1), аддитивный эффект (=1) и антагонистический эффект (1). Пример 35. Эффективность соединений. Определяли эффективность L-dA, L-dT и L-dC против гепаднавирусной инфекции у североамериканских лесных сурков (Marmota monax), хронически инфицированных вирусом гепатита лесного сурка(WHV). Это животное широко используется в качестве модели HBV-инфекции и его использование было разрешено для оценки противовирусных агентов с активностью против HBV. Было использовано 3 животных на группу, которой вводили лекарственное средство, и 4 животных в качестве контроля. Животным группы 1 давали носитель в качестве контроля; животным группы 2 давали ламивудин (3 ТС) (10 мг/кг/день); животным групп 3-6 давали L-dA (0,01; 0,1; 1,0; 10 мг/кг/день соответственно); животным групп 7-10 давали L-dT (0,01; 0,1; 1,0; 10 мг/кг/день соответственно); а животным групп 11-14 давали L-dC (0,01; 0,1; 1,0; 10 мг/кг/день). Лекарственные средства вводили один раз в день перорально через желудочный зонд, и пробы крови брали в дни 0, 1, 3, 7, 14, 21, 28 и после введения в дни +1, +3, +7, +14, +28 и +56. Оценку активности и токсичности проводили, исходя из снижения уровня ДНК WHV в сыворотке, в дот-блот-анализе и количественной ПЦР.- 27005890 Результаты представлены на фиг. 5 и в табл. 6. Таблица 6 Противовирусная активность LdA, LdT, LdC у лесного сурка с моделью инфекцииLdA, LdT, LdC вводили перорально один раз в день при 10 мг/кг детекция была ограничена 1 нг/мл WHV-ДНК на мл сыворотки. Полученные данные показали, что в этой in vivo-модели, L-dA, L-dT и L-dC являются в высокой степени активными. Во-первых, вирусная нагрузка снижалась до недетектируемых (L-dT) или почти недетектируемых (L-dA, L-dC) уровней. Во-вторых, было показано, что в этой модели L-dA, L-dT и L-dC являются более активными, чем 3 ТС (ламивудин). В третьих, восстановление уровней вируса не детектировалось в течение по крайней мере двух недель после удаления L-dT. В-четвертых, кривые зависимости "доза-ответ" дают основание предположить, что с возрастанием дозы L-dA и L-dC их противовирусная активность должна возрастать так же, как и в случае L-dT. В-пятых, все животные, получавшие лекарственные средства, прибавляли в весе, и какой-либо токсичности, связанной с лекарственным средством, не наблюдалось. Пример 34. Получение фармацевтических композиций. Человек или другие хозяева, инфицированные вирусом гепатита D, могут быть подвергнуты лечению путем введения эффективного количества -2'-дезоксиL-эритропентофуранонуклеозида, например -L-2'-дезоксиаденозина, -L-2'-дезоксицитидина, -L-2'-дезоксиуридина, -L-2'-дезоксигуанозина или -L-2'-дезокситимидина, или его фармацевтически приемлемого пролекарства, или соли в присутствии фармацевтически приемлемого носителя или разбавителя. Активные материалы могут быть введены любым подходящим способом, например, перорально, парентерально, внутривенно, внутрикожно, подкожно или местно в виде жидкой или твердой формы. Активное соединение включено в фармацевтически приемлемый носитель или разбавитель в количестве, достаточном для доставки пациенту терапевтически эффективного количества соединения, которое ингибирует репликацию вируса in vivo и не оказывает серьезного токсического действия на пациента, подвергаемого лечению. Термин "ингибирующее количество" означает количество активного ингредиента, достаточное для достижения ингибирующего эффекта, измеряемого, например, в анализе, таком как анализы, описанные в настоящей заявке. Предпочтительная доза соединения для всех вышеуказанных состояний составляет в пределах примерно от 1 до 50 мг/кг, предпочтительно 1-20 мг/кг массы тела в день, а обычно от 0,1 до около 100 мг на килограмм массы тела реципиента в день Диапазон эффективных доз фармацевтически приемлемого пролекарства может быть вычислен исходя массы исходного нуклеозида, необходимого для доставки. Если само пролекарство обладает активностью, то эффективная доза может быть определена как описано выше по массе пролекарства, или другими способами, известными специалистам. Данное соединение обычно вводят в виде подходящей разовой лекарственной формы, включая, но не ограничиваясь ею, форму, содержащую 7-3000 мг, а предпочтительно 70-1400 мг активного ингредиента на одну разовую лекарственную форму. Подходящая пероральная доза обычно составляет 50-1000 мг. В идеальном случае, активный ингредиент должен быть введен так, чтобы максимальная концентрация активного соединения в плазме составляла примерно 0,2-70 мкМ, а предпочтительно примерно 1,0-10 мкМ. Это может быть достигнуто, например, путем внутривенной инъекции 0,1-5% раствора активного ингредиента, необязательно, в физиологическом растворе или путем введения болюса, содержащего активный ингредиент. Концентрация активного соединения в лекарственной композиции зависит от абсорбции, инактивации и скорости экскреции лекарственного средства, а также от других известных специалистам факторов. Следует отметить, что величины доз могут также варьироваться в зависимости от тяжести состояния, подвергаемого лечению. Кроме того, следует отметить, что для любого отдельного индивидуума конкретные схемы введения лекарственного средства должны быть скорректированы в зависимости от времени в соответствии с потребностью индивидуума и назначением врача, осуществляющего введение или наблюдение за введением данных композиций; и интервалы концентраций, указанные выше, приво- 28005890 дятся лишь в целях иллюстрации и не ограничивают объема или практического применения заявленной композиции. Активный ингредиент может быть введен один раз или несколько раз в день в виде более мелких дробных доз, вводимых через различные интервалы времени. Предпочтительным способом введения активного соединения является пероральное введение. Пероральные композиции обычно включают инертный разбавитель или пищевой носитель. Они могут быть заключены в желатиновые капсулы или спрессованы в таблетки. Для перорального терапевтического введения активное соединение может быть введено вместе с наполнителями и использовано в форме таблеток, пастилок или капсул. Фармацевтически совместимые связующие агенты и/или адъюванты могут быть включены как часть композиции. Указанные таблетки, драже, капсулы, пастилки и т.п. могут содержать любой из нижеследующих ингредиентов или соединения аналогичной природы: связующее вещество, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; наполнитель, такой как крахмал или лактоза; дезинтегрирующий агент, такой как альгиновая кислота, Примогель или кукурузный крахмал; замасливатель,такой как стеарат магния или cтероты; агент, увеличивающий скольжение, такой как коллоидальный диоксид кремния; подслащивающий агент, такой как сахароза или сахарин; или ароматизирующий агент,такой как перечная мята, метилсалицилат или апельсиновая отдушка. Если разовая лекарственная форма представляет собой капсулу, то она, помимо ингредиентов вышеуказанного типа, может содержать жидкий носитель, такой как жирное масло. Кроме того, разовые лекарственные формы могут содержать другие различные ингредиенты, которые модифицируют физическую форму разовой лекарственной формы,например, покрытия из сахара, шеллака или других энтеросолюбильных веществ. Указанное соединение может быть введено как компонент эликсира, суспензии, сиропа, облатки,жевательной резинки или т.п. Сироп, помимо активных соединений, может содержать сахарозу в качестве подсластителя и некоторые консерванты, красители и подкрашивающие вещества и отдушки. Соединение или его фармацевтически приемлемое производное или соли могут быть также смешаны с другими активными веществами, которые не влияют на желаемый эффект, или с веществами, которые дополняют желаемый эффект, такими как антибиотики, противогрибковые средства, противовоспалительные средства, ингибиторы протеазы или другие нуклеозидные или ненуклеозидные противовирусные агенты. Растворы или суспензии, используемые для парентерального, внутрикожного, подкожного или местного введения, могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, физиологический раствор, жирные масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатообразующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и агенты для корректировки тоничности, такие как хлорид натрия или декстроза. Препарат для парентерального введения может быть заключен в ампулы, в одноразовые шприцы или во флаконы для многократных доз, изготовленные из стекла или пластика. При внутривенном введении предпочтительными носителями являются физиологический раствор или забуференный фосфатом физиологический раствор (PBS). В предпочтительном варианте осуществления изобретения активные соединения смешивают вместе с носителями, которые защищают указанное соединение от быстрого выведения из организма, например,приготавливают в виде препарата с регулируемым высвобождением, включая имплантаты и микроинкапсулированные системы доставки. При этом могут быть использованы биологически разлагаемые и биологически совместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полиуксусная кислота. Методы получения указанных композиций известны каждому специалисту. Указанные материалы могут быть также закуплены у Alza Corporation. В качестве фармацевтически приемлемых носителей также предпочтительными являются липосомные суспензии (включая липосомы, нацеленные на инфицированные клетки с помощью моноклональных антител против вирусных антигенов). Они могут быть получены методами, известными специалистам,например, как описано в патенте США 4522811. Так, например, липосомные композиции могут быть получены путем растворения соответствующего липида(ов) (такого как стеароилфосфатидилэтаноламин,стеароилфосфатидилхолин, арахадоилфосфатидилхолин и холестерин) в неорганическом растворителе,который затем выпаривают, в результате чего на поверхности контейнера остается тонкая пленка осушенного липида. Затем в этот контейнер вводят водный раствор активного соединения или его монофосфатного, дифосфатного и/или трифосфатного производных. После этого контейнер встряхивают вручную для удаления со стенок этого контейнера липидного материала и для диспергирования липидных агрегатов, в результате чего получают липосомную суспензию. Настоящее изобретение описано со ссылками на его предпочтительные варианты. В настоящее изобретение могут быть внесены изменения и модификации, которые, исходя из вышеприведенного подробного описания изобретения, очевидны для любого специалиста. Следует отметить, что все такие изменения и модификации входят в объем настоящего изобретения.- 29005890 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения хозяина, инфицированного вирусом гепатита D, предусматривающий введение эффективного для лечения количества 2'-дезоксиL-эритропентофуранонуклеозида формулы или его фармацевтически приемлемой соли, гдеR1 выбран из группы, состоящей из Н, прямого, разветвленного или циклического алкила, СОалкила, СО-арила, СО-алкоксиалкила, СО-арилоксиалкила, СО-замещенного арила, алкилсульфонила,арилсульфонила, аралкилсульфонила, аминокислотного остатка, моно-, ди- или трифосфата или фосфатного производного; и"основание" представляет пуриновое или пиримидиновое основание, которое может быть, но необязательно, замещенным; и где углеводород в составе радикалов представляет собой прямой, разветвленный или циклический первичный углеводород, содержащий до 18 и предпочтительно до 6 атомов углерода, необязательно замещенный одной или несколькими группами, выбранными из числа гидроксила, амино, алкиламино, ариламино, алкокси, арилокси, нитро, циано, сульфоновой кислоты, сульфата, фосфоновой кислоты, фосфата или фосфоната, либо незащищенных, либо защищенных. 2. Способ по п.1, где 2'-дезоксиL-эритропентофуранонуклеозид представляет -L-2'-дезоксипурин формулы или его фармацевтически приемлемую соль, гдеR1 выбран из группы, состоящей из Н, прямого, разветвленного или циклического алкила, СОалкила, СО-арила, СО-алкоксиалкила, СО-арилоксиалкила, СО-замещенного арила, алкилсульфонила,арилсульфонила, аралкилсульфонила, аминокислотного остатка, моно-, ди- или трифосфата или фосфатного производного;X1 и X2 независимо выбраны из группы, состоящей из Н, прямого, разветвленного или циклического алкила, СО-алкила, СО-арила, СО-алкоксиалкила, галогена, OR5, NR5NR6 или SR5; иR3, R4, R5 и R6 независимо представляют Н, прямой, разветвленный или циклический алкил, СОалкил, СО-арил, СО-алкоксиалкил, СО-арилоксиалкил, СО-замещенный арил, алкилсульфонил, арилсульфонил, аралкилсульфонил, аминокислотный остаток, моно-, ди- или трифосфат или фосфатное производное. 3. Способ по п.2, где 2'-дезоксиL-эритропентофуранонуклеозид представляет -L-2'-дезоксиаденозин формулы или его фармацевтически приемлемую соль, где R1 представляет Н, моно-, ди- или трифосфат, ацил, алкил или стабилизированное фосфатное производное. 4. Способ по п.3, где R1 представляет водород. 5. Способ по п.3, где R1 представляет ацил. 6. Способ по п.5, где указанный ацил происходит от аминокислоты. 7. Способ по п.6, где указанной аминокислотой является валин. 8. Способ по п.2, где указанный 2'-дезоксиL-эритропентофуранонуклеозид представляет -L-2'дезоксигуанозин формулы
МПК / Метки
МПК: A61K 31/706, A61P 31/12
Метки: лечения, использованием, beta;-l-2'-дезоксинуклеозидов, гепатита, дельта, инфекций, вызываемых, способы, вирусом
Код ссылки
<a href="https://eas.patents.su/30-5890-sposoby-lecheniya-infekcijj-vyzyvaemyh-virusom-gepatita-delta-s-ispolzovaniem-beta-l-2-dezoksinukleozidov.html" rel="bookmark" title="База патентов Евразийского Союза">Способы лечения инфекций, вызываемых вирусом гепатита дельта, с использованием β-l-2′-дезоксинуклеозидов</a>
Предыдущий патент: Производные тиенопиримидина и тиенопиридина, полезные в качестве противораковых агентов
Следующий патент: Катализаторы циглера-натта процессов полимеризации в растворе при высоких температурах
Случайный патент: Пустотелая лопасть судового гребного винта