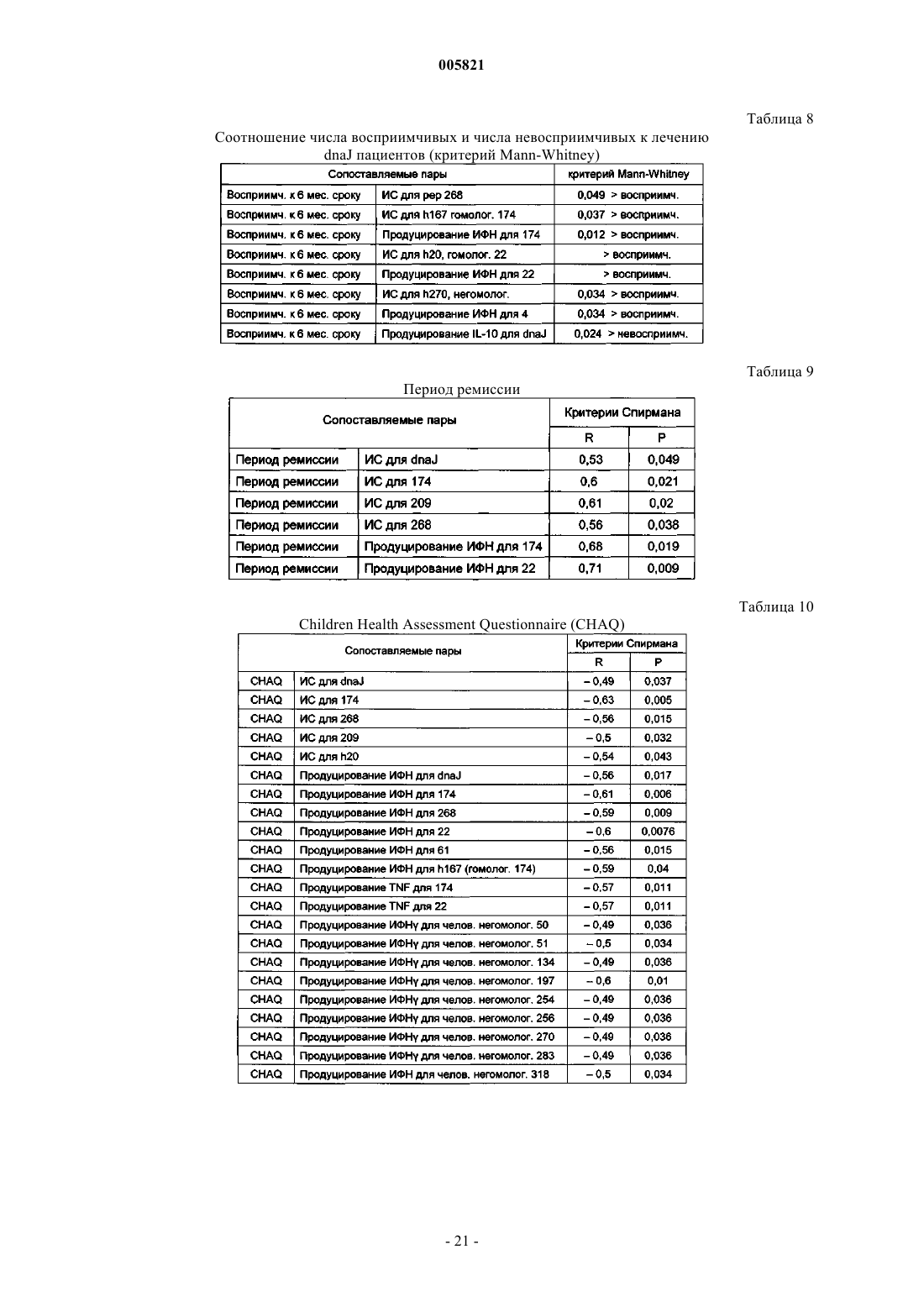
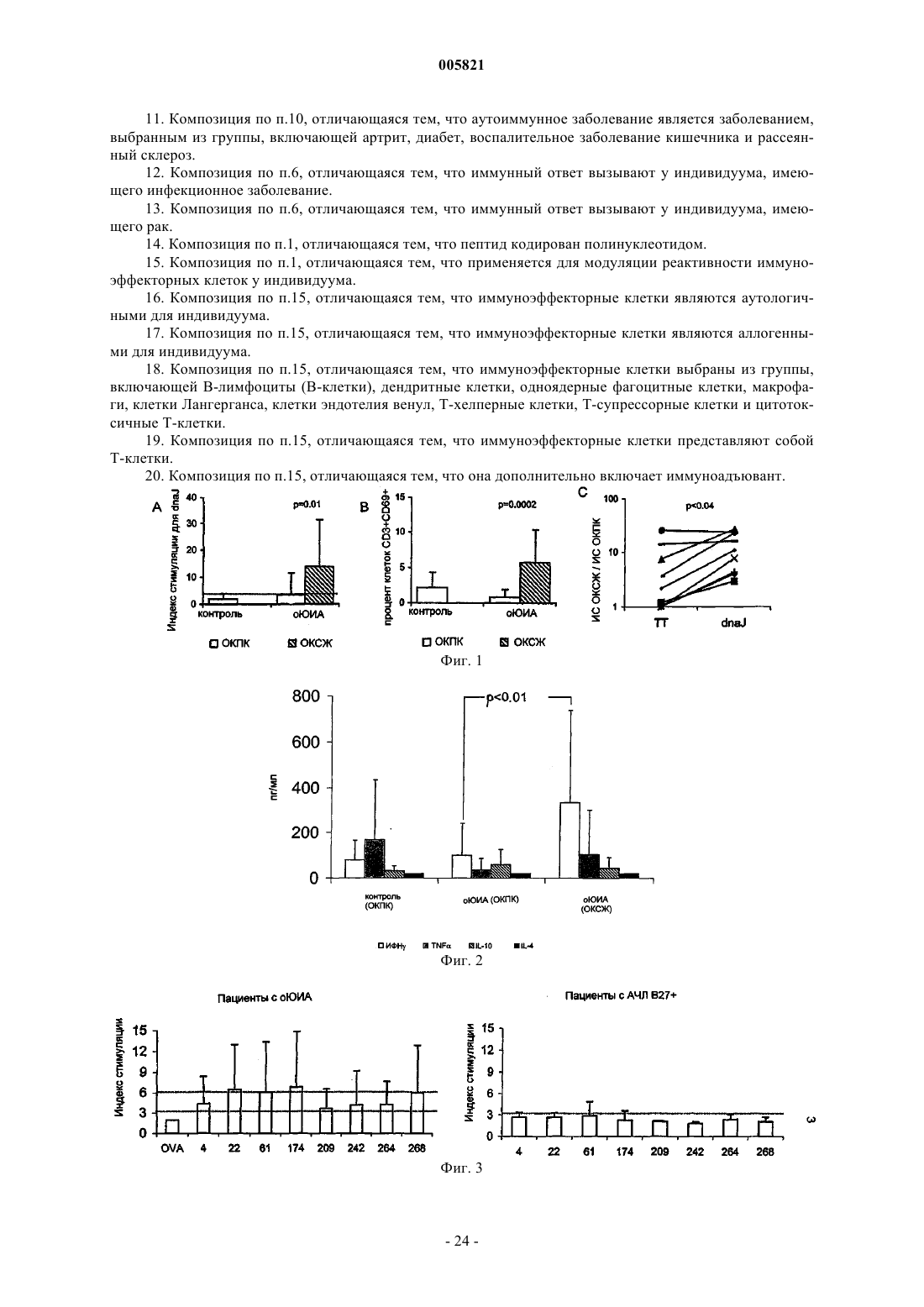
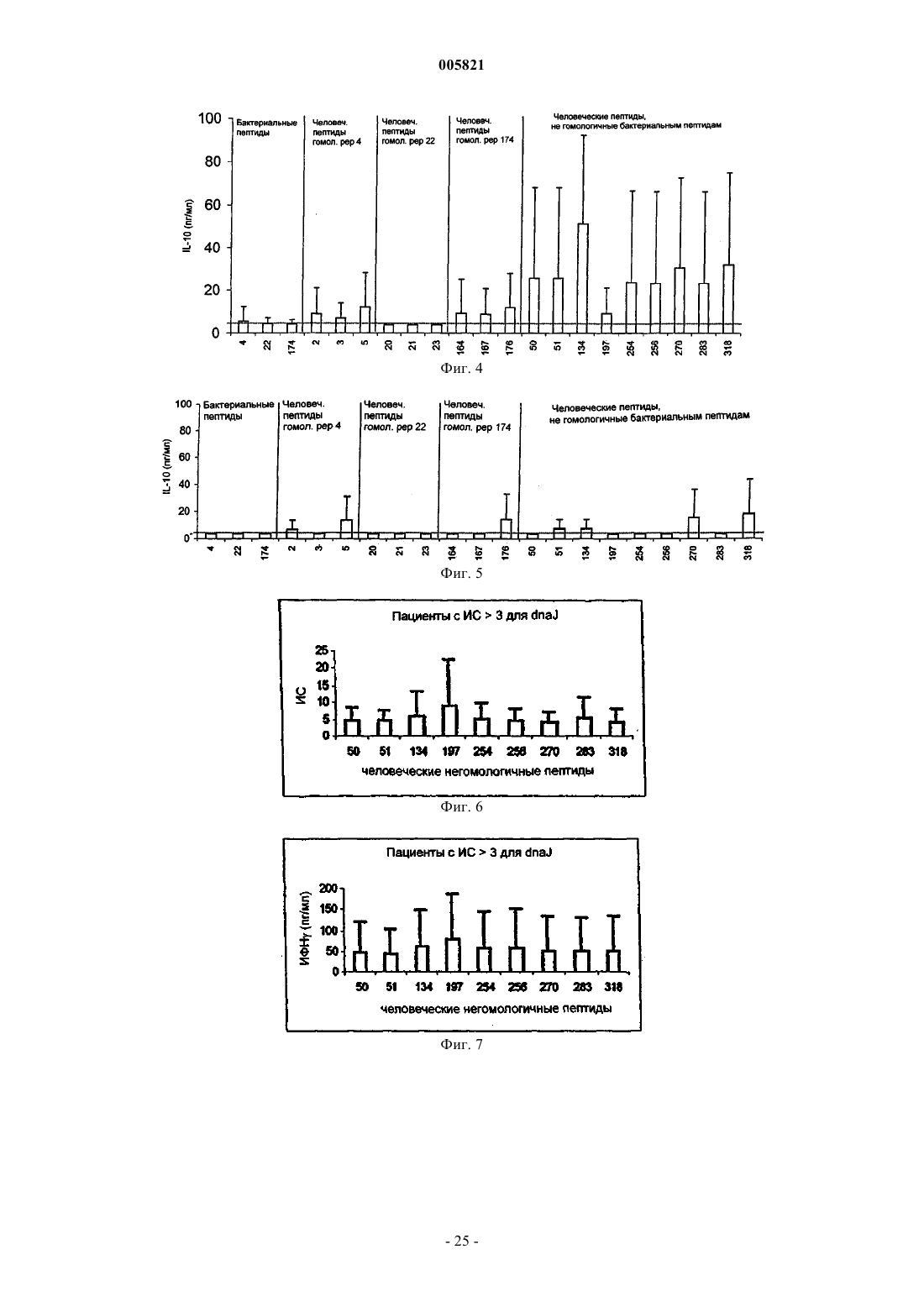
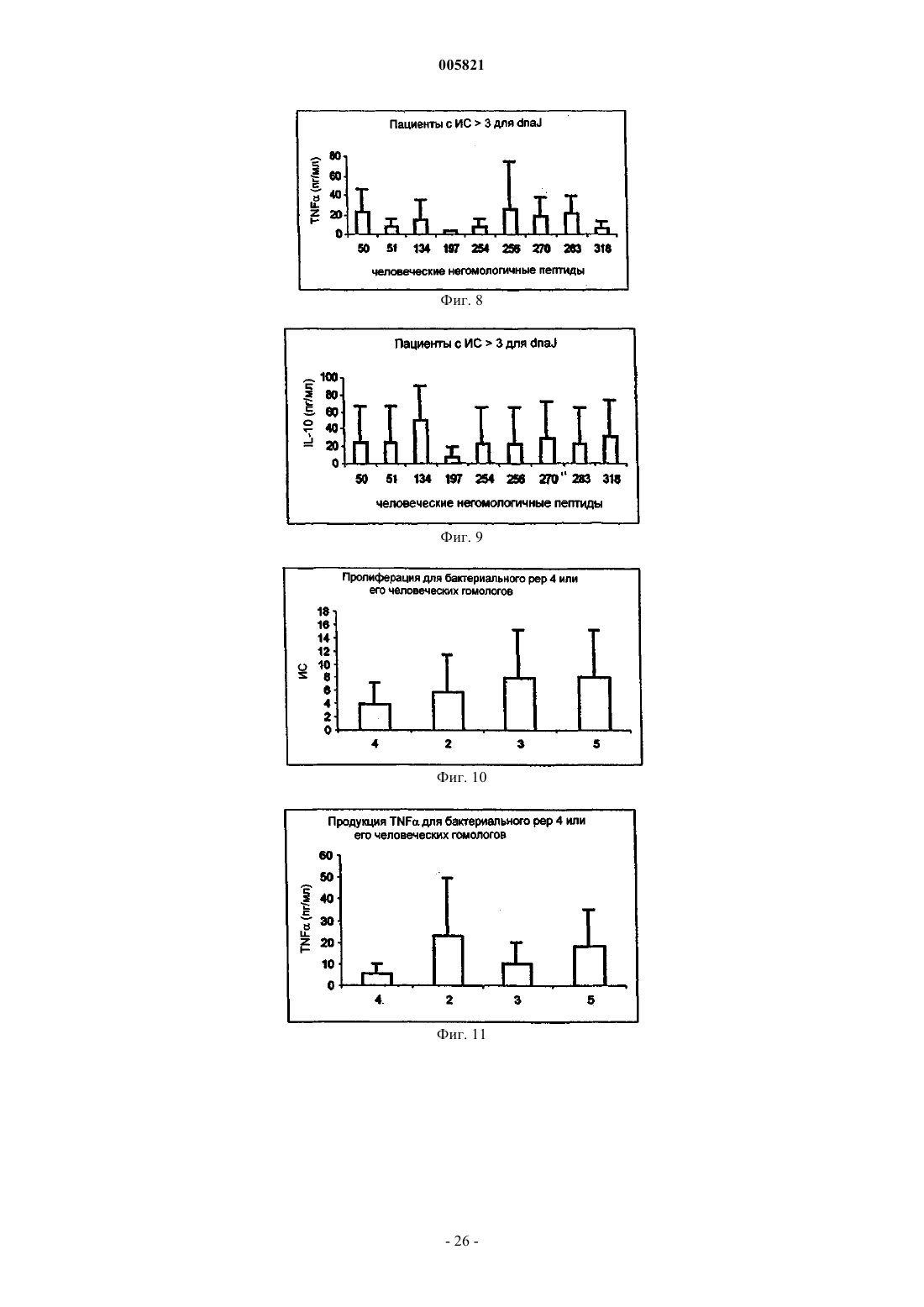
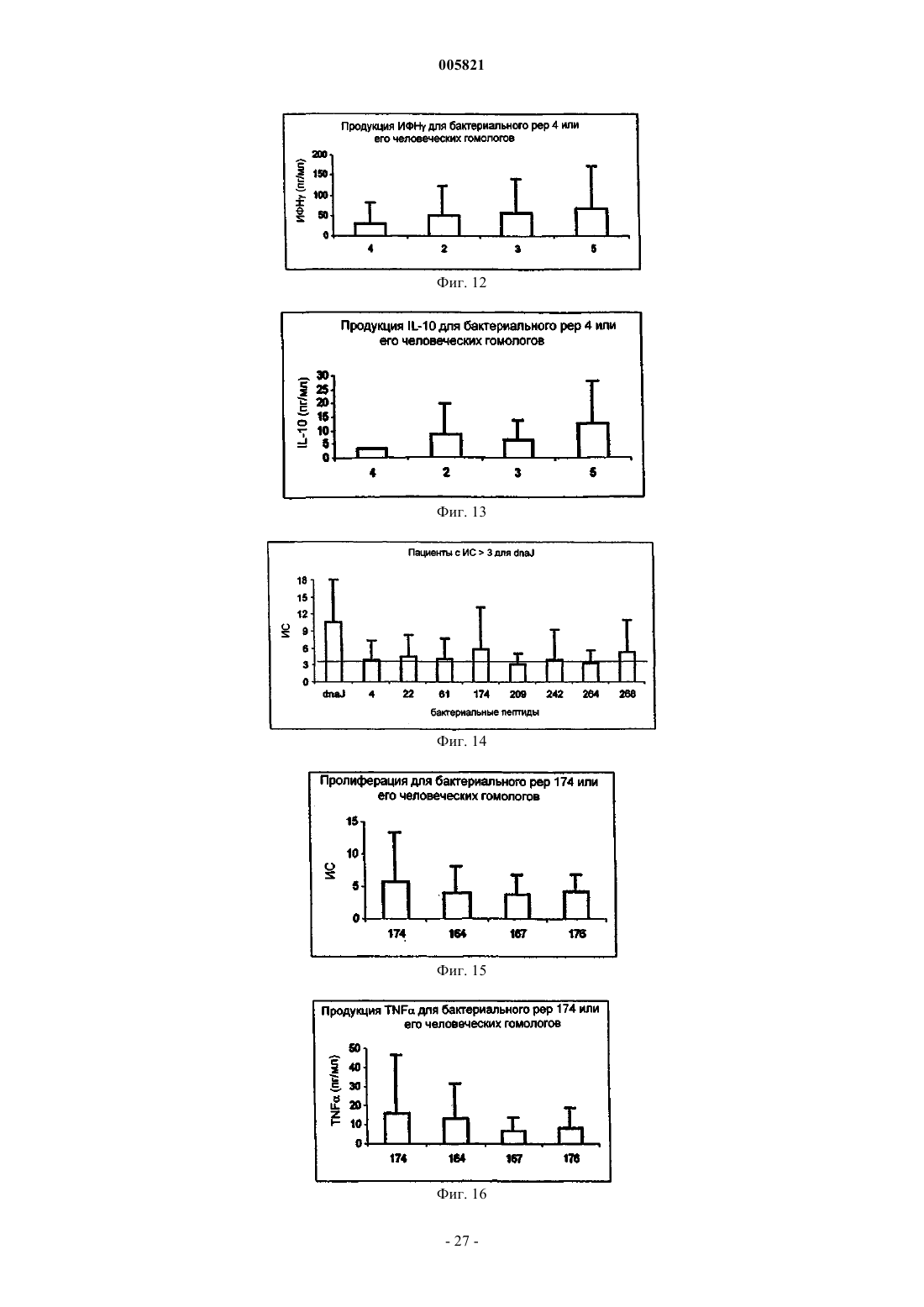
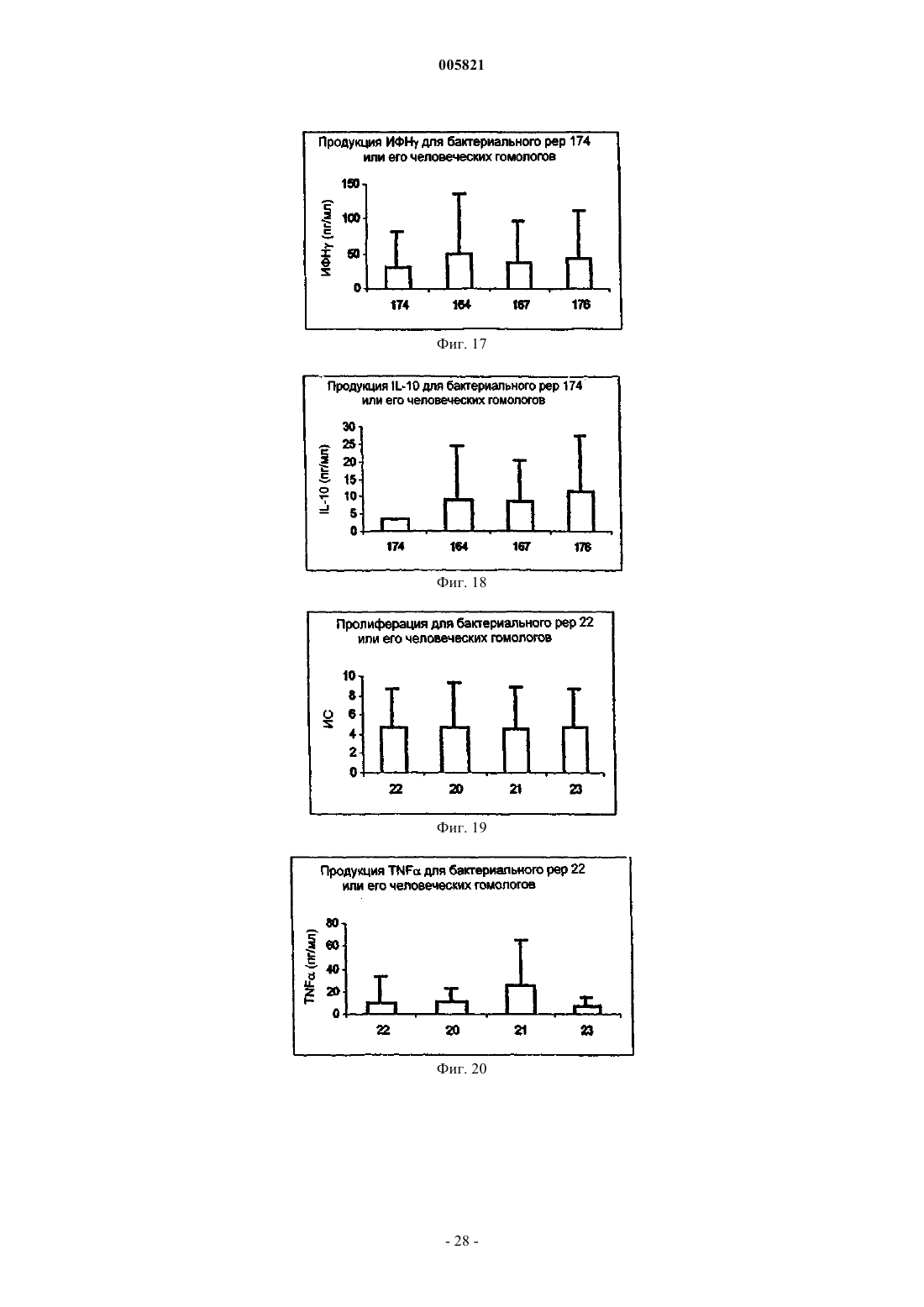
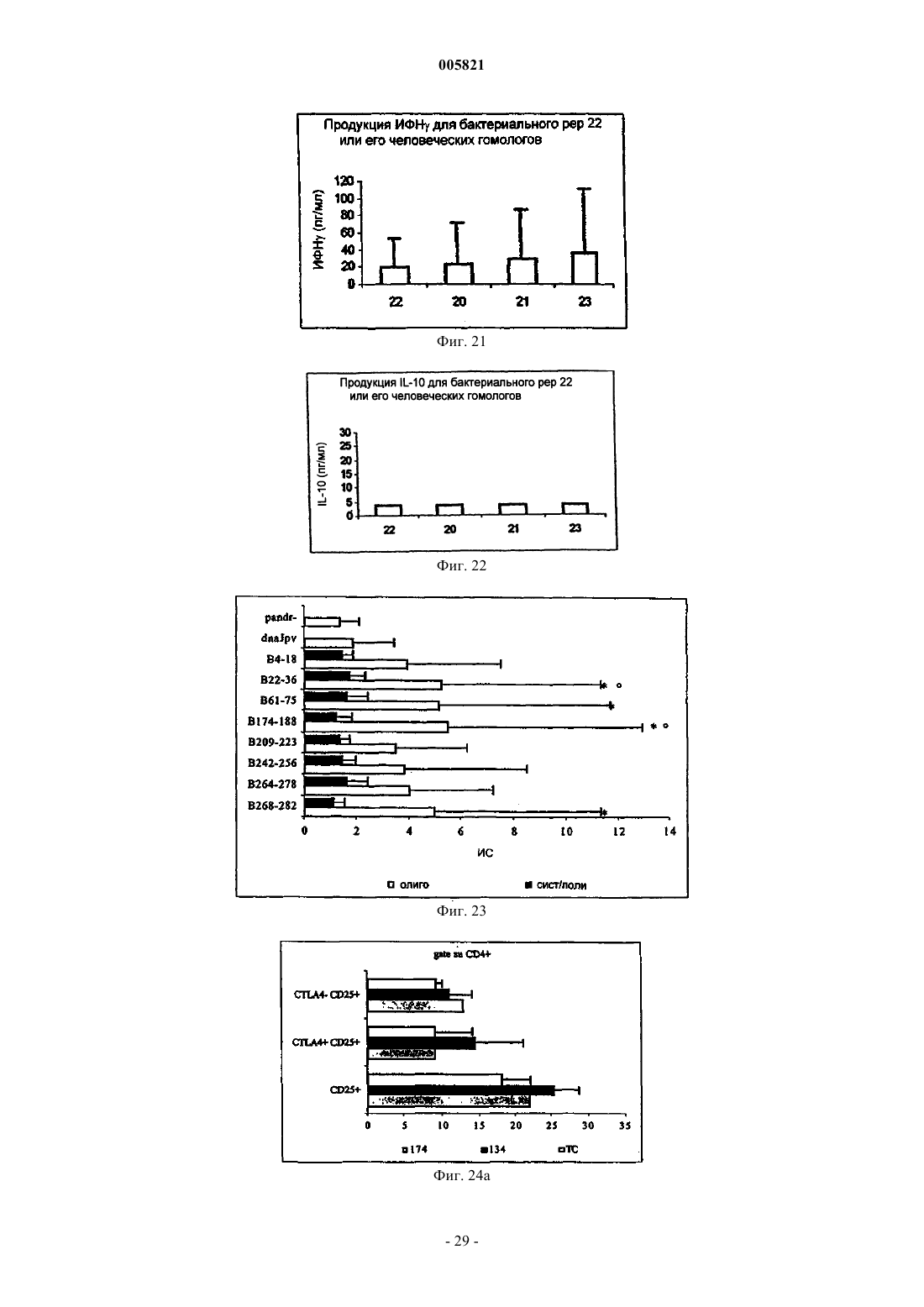
Иммуномодулирующие пептиды, полученные из белков теплового шока, и их применение
Номер патента: 5821
Опубликовано: 30.06.2005
Авторы: Карсон Деннис, Праккен Берент Дж., Мартини Альберто, Альбани Сальваторе
Формула / Реферат
1. Композиция, включающая физиологически приемлемый носитель и по меньшей мере один вид существенно очищенного пептида, включающего аминокислотную последовательность, выбранную из любой из последовательностей с SEQ ID NO: 1 по SEQ ID NO: 26.
2. Химерный полипептид, включающий пептид, как он определен в п.1, связанный по меньшей мере с одним гетерологичным полипептидом.
3. Композиция по п.1, отличающаяся тем, что дополнительно включает иммуноадъювант.
4. Композиция по п.3, отличающаяся тем, что иммуноадъювант представляет собой цитокин.
5. Композиция по п.1, отличающаяся тем, что вид существенно очищенного пептида имеет аминокислотную последовательность, по существу состоящую из QKRAAYDQYGHAAFEQ (SEQ ID NO: 3).
6. Композиция по п.1, отличающаяся тем, что применяется для модуляции иммунного ответа.
7. Композиция по п.6, отличающаяся тем, что модуляция иммунного ответа включает усиление или индуцирование воспалительной реакции у индивидуума.
8. Композиция по п.6, отличающаяся тем, что модуляция иммунного ответа включает ослабление или подавление воспалительной реакции у индивидуума.
9. Композиция по п.6, отличающаяся тем, что иммунный ответ вызывают у индивидуума, имеющего иммунологическое расстройство.
10. Композиция по п.9, отличающаяся тем, что иммунологическое расстройство представляет собой аутоиммунное заболевание.
11. Композиция по п.10, отличающаяся тем, что аутоиммунное заболевание является заболеванием, выбранным из группы, включающей артрит, диабет, воспалительное заболевание кишечника и рассеянный склероз.
12. Композиция по п.6, отличающаяся тем, что иммунный ответ вызывают у индивидуума, имеющего инфекционное заболевание.
13. Композиция по п.6, отличающаяся тем, что иммунный ответ вызывают у индивидуума, имеющего рак.
14. Композиция по п.1, отличающаяся тем, что пептид кодирован полинуклеотидом.
15. Композиция по п.1, отличающаяся тем, что применяется для модуляции реактивности иммуноэффекторных клеток у индивидуума.
16. Композиция по п.15, отличающаяся тем, что иммуноэффекторные клетки являются аутологичными для индивидуума.
17. Композиция по п.15, отличающаяся тем, что иммуноэффекторные клетки являются аллогенными для индивидуума.
18. Композиция по п.15, отличающаяся тем, что иммуноэффекторные клетки выбраны из группы, включающей B-лимфоциты (B-клетки), дендритные клетки, одноядерные фагоцитные клетки, макрофаги, клетки Лангерганса, клетки эндотелия венул, T-хелперные клетки, T-супрессорные клетки и цитотоксичные Т-клетки.
19. Композиция по п.15, отличающаяся тем, что иммуноэффекторные клетки представляют собой T-клетки.
20. Композиция по п.15, отличающаяся тем, что она дополнительно включает иммуноадъювант.
Текст
005821 Область техники Настоящее изобретение относится вообще к способам и составам для модуляции иммунного ответа у индивидуума, а более конкретно - к композициям, содержащим бактериальный пептид dnaJ или его человеческий гомолог, или его негомологичную человеческую изоформу, и к способам применения таких композиций для стимулирования иммунного ответа или для создания толерантности к иммуногену. По существу, настоящее изобретение предусматривает различные способы регулирования воспалительной реакции, в том числе способы повышения толерантности слизистой оболочки, ДНК-вакцинации,индуцирования анергии (отсутствия реакции на раздражители) и активной иммунизации. Предшествующий уровень техники Стратегии лечения многих заболеваний направлены скорее на смягчение симптомов заболевания,чем на удаление причины составляющих проблему симптомов. Например, в случае воспалительных заболеваний основные способы лечения направлены на ослабление воспаления, в основном с помощью стероидных или нестероидных противовоспалительных агентов. Воспаление часто является следствием иммунного ответа. Хотя иммунный ответ (иммунная реакция) и последующая воспалительная реакция, как правило, полезны для индивидуума, например, если это реакция на бактериальную инфекцию, но в некоторых случаях иммунный ответ и воспалительная реакция приводят к пагубным последствиям. В частности, пациенты с аутоиммунными заболеваниями,такими как ревматоидный артрит, системная красная волчанка и подобные им, часто страдают острым и в некоторых случаях системным поражением тканей. Хотя введение, например, стероидного лекарства может снизить у таких пациентов остроту иммунной реакции, длительное применение таких лекарств может привести к побочным эффектам, в том числе снизить качество жизни пациента. Более того, применение таких лекарств, вообще говоря, снижает способность индивидуума формировать иммунный ответ, в результате чего индивидуум подвержен кратковременным инфекциям, которые могут иметь серьзные последствия. Таким образом, существует потребность в композициях и способах, которые применимы для специфической модуляции иммунного ответа и связанной с ним воспалительной реакции. Настоящее изобретение удовлетворяет этой потребности и обеспечивает дополнительные преимущества. Сущность изобретения Настоящее изобретение относится к иммуногенным пептидам, происходящим из белка теплового шока (БТШ, англоязычное сокращение - hsp) dnaJ, и способам применения таких пептидов в качестве способа модуляции иммунного ответа у индивидуума. Как описано в настоящей заявке, иммуногенные пептиды настоящего изобретения, действующие через опосредованный Т-клетками иммунный ответ,включают провоспалительные пептиды (стимулирующие воспаление), результатом действия которых является усиление экспрессии провоспалительных цитокинов, таких как интерферон-гамма, и антивоспалительные пептиды (подавляющие воспаление), результатом действия которых является усиление экспрессии антивоспалительных цитокинов, таких как интерлейкин-10. Пептиды в общем случае могут быть охарактеризованы так же, как гомологичные пептиды, имеющие аминокислотную последовательность, которая относительно консервативна для БТШ dnaJ различных видов, и негомологичные пептиды, имеющие аминокислотную последовательность, которая не является существенно консервативной. В соответствии с этим настоящее изобретение относится к способу модуляции иммунного ответа у индивидуума. Способ настоящего изобретения может быть осуществлн, например, путм введения индивидууму иммуногенной пептидной части БТШ dnaJ и модуляции таким путм иммунного ответа у индивидуума. БТШ dnaJ может быть прокариотным или эукариотным БТШ dnaJ, в том числе, например,бактериальным БТШ dnaJ, таким как БТШ dnaJ Е. coli; БТШ dnaJ беспозвоночных, таким как БТШ dnaJ дрожжей; или БТШ dnaJ позвоночных, таким как БТШ dnaJ млекопитающих, в том числе БТШ dnaJ человека, такой как человеческий белок HSJ1, HDJ1 или HDJ2. Иммуногенным пептидом может быть любая иммуногенная часть БТШ dnaJ, в том числе гликозилированная форма такого пептида, и в общем виде это пептид, который может связываться с рецептором молекул II класса главной системы тканевой совместимости (ГСТС, англоязычное сокращение - МНС) или с рецептором Т-клеток и который представляет собой эпитоп, который является существенно специфичным для полипептида dnaJ. Например, пептид может быть иммуногенной пептидной частью БТШdnaJ E. сoli, таким как пептид, имеющий аминокислотную последовательность QDYYEILGVSKTAEE(SEQ ID NO: 6), YCEVPINFAMAALGG (SEQ ID NO: 7) или PINFAMAALGGEIEV (SEQ ID NO: 8); или иммуногенной пептидной частью БТШ dnaJ человека HSJ1, HDJ1 HDJ2, такой как пептид с аминокислотной последовательностью ASYYEILDVPRSASA (SEQ ID NO: 9), KDYYQTLGLARGASD (SEQ IDDGQLKSVTINGVPDD (SEQ ID NO: 21), DLQLAMAYSLSEMEA (SEQ ID NO: 22), EDLFMCMDIQLVEAL (SEQ ID NO: 23), LCGFQKPISTLDNRT (SEQ ID NO: 24), RTIVITSHPGQIVKH (SEQ ID NO: 25) или GRLIIEFKVNFPENG (SEQ ID NO: 26). Способ по настоящему изобретению может модулировать иммунный ответ путм усиления или ослабления воспалительной реакции, связанной с иммунным ответом. Так, в одном из вариантов осуществления способ по настоящему изобретению предусматривает путь усиления или индуцирования у индивидуума воспалительной реакции. В одном из аспектов способ усиления или индуцирования у индивидуума воспалительной реакции осуществляется введением индивидууму пептида, имеющего провоспалительную активность, т.е. провоспалительного пептида, в условиях иммунизации. В другом аспекте способ осуществляется введением индивидууму антивоспалительного пептида в условиях стимуляции толерантности. Еще в одном аспекте способа вводят комбинацию иммуногенных пептидов, например, в условиях иммунизации вводят два или более провоспалительных пептида или в условиях стимуляции толерантности вводят два или более антивоспалительных пептида, или по меньшей мере один провоспалительный пептид в условиях иммунизации и по меньшей мере один антивоспалительный пептид в условиях стимуляции толерантности. Результатом действия такого способа усиления или индуцирования воспалительной реакции является повышение у индивидуума уровня провоспалительного цитокина, такого как интерферон-гамма (IFN, ИФН), фактор- некроза опухолей (ФНО, TNF), интерлейкин-1(IL-1), IL-6, IL-12 или IL-23, или снижение у индивидуума уровня антивоспалительного цитокина, такого как IL-4, IL-10, или фактора- трансформации роста (TGF), или же их комбинаций. В другом варианте осуществления способ по настоящему изобретению предусматривает пути ослабления или подавления у индивидуума воспалительной реакции. В одном из аспектов способ ослабления или подавления у индивидуума воспалительной реакции осуществляется введением индивидууму в условиях иммунизации пептида, имеющего антивоспалительную активность. В другом аспекте способ осуществляется введением индивидууму в условиях стимуляции толерантности провоспалительного пептида. Еще в одном аспекте способа вводят комбинацию иммуногенных пептидов, например, в условиях стимуляции толерантности вводят два или более провоспалительных пептида или в условиях иммунизации вводят два или более антивоспалительных пептида, или же по меньшей мере один провоспалительный пептид в условиях стимуляции толерантности и по меньшей мере один антивоспалительный пептид в условиях иммунизации. Результатом действия такого способа ослабления или подавления воспалительной реакции является повышение у индивидуума уровня антивоспалительного цитокина, такого как IL-4, IL-10 или TGF, или понижение у индивидуума уровня провоспалительного цитокина, такого как IFN, TNF, IL-1, IL-6, IL-12 или IL-23, или же их комбинаций. Как раскрыто в настоящем описании, можно ввести одну иммуногенную пептидную часть БТШdnaJ или их комбинацию, в том числе, например, любой из иммуногенных пептидов, примеры которых представлены SEQ ID NO: 1 - SEQ ID NO: 26, или любую их комбинацию. Как будет видно из представленного описания, пептид по настоящему изобретению вводят индивидууму в условиях иммунизации или в условиях стимуляции толерантности, в зависимости от того, является ли пептид провоспалительным пептидом или антивоспалительным пептидом, и в зависимости от того, вводится ли пептид для усиления или индуцирования воспалительной реакции, или же для ослабления или подавления воспалительной реакции. Пептид может вводиться в условиях иммунизации путм введения иммуногенного количества пептида, например, внутрикожно, подкожно или внутримышечно, и, при необходимости, в составе композиции, в состав которой входит иммуноадъювант, такой как полный или неполный адъювант Фрейнда. Пептид может вводиться в условиях стимуляции толерантности путм введения вызывающего толерантность количества пептида, например, в слизистую оболочку или же внутрикожно,подкожно или внутримышечно. Способ по настоящему изобретению может применяться на практике по отношению к индивидууму, имеющему или предрасположенному, или восприимчивому к любому состоянию, в котором необходимо модулировать иммунный ответ, включая индивидуума, имеющего иммунологическое расстройство или восприимчивому или предрасположенному к иммунологическому расстройству. В общем случае индивидуум представляет собой позвоночное существо, в частности млекопитающее, в том числе домашнее животное, такое как кошка, собака или лошадь; сельскохозяйственное животное, такое как овца,корова или свинья; а также это может быть человек. Иммунологическое расстройство может представлять собой расстройство иммунной системы, такое как аутоиммунное заболевание (например, артрит,такой как олигоартикулярный (развивающийся в малом числе суставов) юношеский идиопатический артрит), или сопровождающееся иммунодефицитом заболевание, такое как заболевание с приобретнным иммунодефицитом (СПИД). Дополнительные болезненные состояния, при которых может быть необходимо модулировать иммунный ответ, включают состояния, при которых у индивидуума не развивается нормальная иммунная реакция, например, в ответ на инфекционное заболевание или рак, или состояние, при котором иммунный ответ индивидуума слишком силн, например у индивидуума, страдающего воспалительным заболеванием кишечника, отличающимся от аутоиммунного заболевания, или у индивидуума с бактериальным сепсисом.-2 005821 Настоящее изобретение относится также к способу модуляции реакционной способности (реактивности) иммуноэффекторных клеток. Такой способ может быть осуществлн, например, приведением иммуноэффекторных клеток индивидуума в контакт с пептидной частью БТШ dnaJ. БТШ dnaJ, из которого получен пептид, может быть любым БТШ dnaJ, как они раскрыты здесь, или известным иначе в данной области, включая прокариотный или эукариотный БТШ dnaJ. Пептид может быть включн, но не обязательно, в состав композиции, которая может также содержать, при необходимости, иммуноадъювант или иной иммуномодулирующий агент, например один или несколько цитокинов. Иммуноэффекторные клетки, которые могут быть любыми клетками, участвующими в опосредованном Т-клетками иммунном ответе, в частности Т-клетками, могут быть приведены в контакт с пептидом in vivo путм введения пептида индивидууму или могут быть приведены в контакт in vitro. В том случае, когда иммуноэффекторные клетки приведены в контакт in vitro (или ex vivo), способ может дополнительно включать введение контактирующих иммуноэффекторных клеток индивидууму,что обеспечивает способ модуляции у индивидуума иммунного ответа. Сами по себе иммуноэффекторные клетки могут быть аутологичными (собственными) по отношению к индивидууму, т.е. клетки, извлечнные из пациента, приводились в контакт с пептидом ex vivo, затем вводились индивидууму, при необходимости, после роста клеток в культуре. Иммуноэффекторные клетки могут также быть аллогенными по отношению к индивидууму, например, это клетки, которые по отношению к индивидууму могут быть хотя бы частично гаплотипными. Поэтому такой способ обеспечивает путь модуляции иммунного ответа путм усиления или индуцирования у индивидуума воспалительной реакции или путм ослабления или подавления у субъекта воспалительной реакции. Настоящее изобретение относится также к иммуногенной пептидной части БТШ dnaJ, имеющей провоспалительную или антивоспалительную активность. Примерами таких иммуногенных пептидов настоящего изобретения являются пептиды, приведнные далее как последовательности SEQ ID NO: 1 SEQ ID NO: 26. Кроме того, настоящее изобретение относится к химерному полипептиду, который содержит пептид настоящего изобретения, функционально (оперативно) связанный по меньшей мере с одним гетерологичным полипептидом. Композицию, содержащую по меньшей мере один пептид настоящего изобретения, предусматривает, например, композиция, содержащая любой из пептидов, представленных среди последовательностей SEQ ID NO: 1 - SEQ ID NO: 26, и композиция, содержащая любую комбинацию таких пептидов, в частности, композиция, содержащая комбинацию провоспалительных пептидов, и композиция, содержащая комбинацию антивоспалительных пептидов. Композиция по настоящему изобретению обычно входит в состав физиологически приемлемого раствора и при необходимости может дополнительно содержать один или несколько иммуноадъювантов, например,один или несколько цитокинов, полный адъювант Фрейнда, неполный адъювант Фрейнда, квасцы или подобное им. Вообще, если композиция содержит один или несколько цитокинов, цитокины имеют воспалительную активность, такую же, как воспалительная активность пептидов настоящего изобретения,или дополняющую ее (комплементирующую). Далее настоящее изобретение относится к полинуклеотиду, кодирующему иммуногенный пептид настоящего изобретения. Полинуклеотид может быть однонитевым или двунитевым, и он может быть молекулой рибонуклеиновой кислоты (РНК), молекулой дезоксирибонуклеиновой кислоты (ДНК) или их гибридом. Предлагается также рекомбинантная молекула нуклеиновой кислоты, которая содержит полинуклеотид настоящего изобретения, оперативно связанный по меньшей мере с одной гетерологичной нуклеотидной последовательностью. Гетерологичной нуклеотидной последовательностью может быть любая нуклеотидная последовательность, которая обыкновенно обнаруживается в природе в непосредственном соединении с полинуклеотидом настоящего изобретения. Например, гетерологичной нуклеотидной последовательностью может быть последовательность контроля экспрессии, такая как регуляторный элемент транскрипции или регуляторный элемент трансляции или их комбинация; или эта последовательность может кодировать полипептид, такой как цитокин или иной иммуномодулирующий агент,пептидную метку (tag) экспрессированной последовательности, домен клеточной локализации, или подобный им. Предлагается также вектор, содержащий полинуклеотид настоящего изобретения, например,экспрессирующий вектор, и клетка, содержащая полинуклеотид или вектор настоящего изобретения. Способ модуляции иммунного ответа по настоящему изобретению основан на том открытии, что эффективная терапевтическая стратегия ослабления связанных с воспалением симптомов опосредованного иммунитетом заболевания (такого как артрит) может быть достигнута преимущественно модуляцией лежащего в основе иммунного ответа, а не просто воздействием на являющееся результатом воспаление. Эта стратегия может быть использована для регуляции воспалительной реакции и применима во многих ситуациях, при которых необходима иммуномодуляция, в том числе, например, повышение толерантности слизистых оболочек, ДНК-вакцинация, индуцирование анергии, активная иммунизация и модуляция ex vivo антигенспецифических Т-клеток. В различных примерах осуществления модуляция может включать повышение у индивидуума уровней провоспалительных цитокинов, таких как ИФН или фактор некроза опухолей TNF; стимуляцию пролиферации одноядерных клеток; или повышение у индивидуума уровней антивоспалительных-3 005821 цитокинов, таких как IL-10, IL-4 или TGF. В других вариантах осуществления модуляция может включать снижение или подавление уровней цитокинов у индивидуума. Как таковые, композиция или способ по настоящему изобретению предусматривает путь усиления провоспалительной реакции или толерогенной реакции в соответствии с особенностями подлежащего лечению индивидуума. Способ настоящего изобретения полезен для лечения индивидуума, страдающего заболеванием, которое включает или опосредовано иммунным ответом, например аутоиммунным заболеванием, инфекционным заболеванием или онкологическим заболеванием. Примеры аутоиммунного заболевания, которое можно лечить в соответствии со способом настоящего изобретения, включают артрит, в частности олигоартикулярный юношеский идиопатический артрит (оЮИА), диабет и рассеянный склероз. Композиция или способ по настоящему изобретению могут быть также полезны как часть схемы лечения с помощью комбинированного воздействия, например, как вспомогательное средство в противораковой терапии или в терапии, направленной против инфекционного агента. Краткое описание графических материалов ФИГ. 1 А-1 С. Фиг. 1 А показывает пролиферативные реакции одноядерных клеток периферической крови (ОКПК) и одноядерных клеток синовиальной жидкости (ОКСЖ) здоровых индивидуумов (контроль) и пациентов с олигоартикулярным юношеским идиопатическим артритом (оЮИА), стимулированных в течение 96 ч рекомбинантным БТШ dnaJ E. coli. Результаты, выраженные значениями индекса стимуляции (ИС),представлены как средние значения + стандартное отклонение. Фиг. 1 В дат оценку типов Т-клеток CD69+ от здоровых индивидуумов (Контроль) и пациентов с оЮИА после инкубации в течение 72 ч с рекомбинантным БТШ dnaJ E. coli. Результаты, выраженные в виде процентного содержания клеток CD3+CD69+, представлены как средние значениястандартное отклонение. Фиг. 1 С дат результаты определения отношения индексов стимуляции (ИС) в парных образцах клеток ОКПК-ОКСЖ от пациентов с оЮИА, стимулированных в течение 96 ч рекомбинантным БТШdnaJ E. coli. Фиг. 2 показывает продуцирование цитокинов (ИФН, TNF, IL-10 и IL-4, как указано) в надосадочных жидкостях культур ОКПК или ОКСЖ здоровых индивидуумов (контроль) или пациентов с оЮИА, стимулированных в течение 72 ч рекомбинантным БТШ dnaJ E. coli. Результаты, выраженные значениями с размерностью пг/мл, представлены как средние значениястандартное отклонение. Фиг. 3 А и 3 В показывают пролиферативные реакции ОКСЖ пациентов с оЮИА (фиг. 3 А) и пациентов с антигеном лейкоцитов человека (АЛЧ) В 27+ (фиг. 3 А), инкубированных в течение 72 ч с пептидами рекомбинантного БТШ dnaJ E. coli и повторно стимулированных с аутологичными облучнными подпитывающими (feeder) клетками в присутствии или в отсутствие постороннего контрольного пептида(OVA) или полученных из БТШ Е. coli пептидов, как указано. Результаты, выраженные значениями индекса стимуляции (ИС), представлены как средние значениястандартное отклонение. На фиг. 4 показано продуцирование IL-10 в надосадочных жидкостях культур ОКСЖ пациентов с оЮИА, стимулированных в течение 72 ч пептидами БТШ dnaJ E. coli и повторно стимулированных с аутологичными облучнными подпитывающими клетками, предъявляющими человеческий пептид, гомологичный или не гомологичный бактериальным пептидам. Результаты, выраженные значениями с размерностью пг/мл, представлены как средние значениястандартное отклонение. Фиг. 5 показывает продуцирование IL-10 в надосадочных жидкостях культур ОКСЖ пациентов с оЮИА, стимулированных в течение 72 ч БТШ dnaJ E. coli и повторно стимулированных с аутологичными облучнными подпитывающими клетками, предъявляющими гомологичные или негомологичные человеческие пептиды (как указано). Результаты, выраженные значениями с размерностью пг/мл, представлены как средние значениястандартное отклонение. Фиг. 6 показывает значения ИС для негомологичных пептидов человека 50, 51, 134, 197, 254, 256,270, 283 и 318 (соответственно последовательности SEQ ID NO: 18-SEQ ID NO: 26). На фиг. с 7 пo 9 показаны уровни соответственно ИФН, TNF и IL-10 в ответ на действие пептидов,представленных на фиг. 6. Фиг. 10 показывает значения ИС в ответ на действие бактериального БТШ dnaJ (4) (SEQ ID NO: 1) и его человеческих гомологов: (2) (HSJ1, SEQ ID NO: 9), (3) (HDJ1, SEQ ID NO: 10) и (5) (HDJ2, SEQ IDNO: 11). На фиг. с 11 по 13 показаны уровни соответственно ИФН, TNF и IL-10 в ответ на действие пептидов, представленных на фиг. 10. Фиг. 14 показывает значения ИС в ответ на действие бактериальных пептидов dnaJ 4, 22, 61, 174,209, 242, 264 и 268 (соответственно последовательности SEQ ID NO: 1 - SEQ ID NO: 8). Фиг. с 15 по 18 показывают соответственно ИС и уровни TNF, ИФН, и IL-10 в ответ на действие бактериального dnaJ 174 (SEQ ID NO: 4) и его человеческих гомологов 164 (SEQ ID NO: 15, HSJ1), 167(SEQ ID NO: 16, HDJ2) и 176 (SEQ ID NO: 17,HSJ1). Фиг. с 19 по 22 показывают соответственно ИС и уровни TNF, ИФН, и IL-10 в ответ на действие-4 005821 бактериального dnaJ 22 и его человеческих гомологов 20 (HSJ1), 21 (HDJ1) и 23 (HDJ2). Фиг. 23 показывает пролиферативные реакции клеток на различные пептиды у пациентов с оЮИА(олиго) в сравнении с пациентами с иными, чем оЮИА, формами ЮИА (сист / поли). Результаты представлены как значения ИС (усы показывают стандартное отклонение). Контрольными пептидами являются pandr и dnaJpv. Фиг. 24 А показывает процентное содержание CTLA4/CD25 позитивных клеток в ответ на стимуляцию пептидами 174 и 134. ТС обозначает нестимулированную культуру ткани. Усы показывают стандартное отклонение. Фиг. 24 В показывает выраженное в пг/мл продуцирование IL-10 клетками ОКСЖ пациентов с оЮИА, стимулированными пептидами 174 и 134. Фиг. с 25 А по 25 С показывают пролиферативную реакцию (ИС, фиг. 25 А) и продуцирование ИФН(фиг. 25 В) или IL-10 (фиг. 25 С) клетками ОКСЖ пациентов с оЮИА, стимулированными различными пептидами, согласно обозначениям. Фиг. с 26 А по 26 Е показывают результаты индуцированной обработкой модуляции реакций Тклеток на dnaJPI. На фиг. 26 А показаны пролиферативные реакции Т-клеток в ОКПК, стимулированных в течение 5 дней 10 мкг/мл пептида dnaJPI (SEQ ID NO: 3). Определения производили с месячными интервалами. В контролях использовали фитогемагглютинин (ФГА) как общий митоген и dnaJpv (SEQ IDNO: 28). Методом FACS с месячными интервалами проводили определения внутриклеточного продуцирования цитокина (провоспалительногофиг. 26 В, С и D; толерогенного - фиг. 26 Е) клетками ОКПК тех пациентов, которые при предварительном обследовании (скрининге) давали позитивную реакцию. Результаты выражены процентным отношением содержания клеток CD3+ в стимулированных dnaJPI и нестимулированных культурах. Сведения, подтверждающие возможность осуществления изобретения Настоящее изобретение предусматривает способ модуляции иммунного ответа у индивидуума. Как здесь описано, эффективная терапевтическая стратегия ослабления симптомов, связанных с воспалением, опосредованного иммунитетом заболевания (такого как артрит) может быть достигнута преимущественно модуляцией лежащего в основе иммунного ответа, а не просто воздействием на являющееся результатом воспаление. Эта стратегия может быть использована для регуляции воспалительной реакции и применима во многих ситуациях, при которых необходима иммуномодуляция, в том числе, например,повышение толерантности слизистых оболочек, ДНК-вакцинация, индуцирование анергии, активная иммунизация и модуляция ex vivo антигенспецифических Т-клеток. Настоящее изобретение предусматривает пептиды для применения в модуляции иммунного ответа. Пептиды настоящего изобретения являются иммуногенными пептидами, выбранными по их способности связываться с наиболее общими аллелями человеческого АЧЛ II класса. Как здесь описано, иммуногенным пептидом может быть любая иммуногенная часть БТШ dnaJ, и обычно это пептид, который может связываться с рецептором II класса молекул главной системы тканевой совместимости (ГСТС, англоязычное сокращение - МНС) или с рецептором Т-клетки и который обеспечивает эпитоп, существенно специфичный для полипептида dnaJ. Иммуногенные пептиды, приведнные здесь в качестве примеров, происходили из белков теплового шока (БТШ, англоязычное сокращение - hsp) микробов и млекопитающих, в том числе БТШ dnaJ E.coli (см. GenBank,доступа NP308042), и гомологи белка dnaJ человека, такие как HSJ1 (GenBank,доступа ХР 010863), HDJ1 (GenBank,доступа Р 25685) и HDJ2 (GenBank,доступа Р 31689). Однако необходимо учитывать, что белки, гомологичные dnaJ E. coli, или гомологи dnaJ человека также могут быть использованы в качестве источника для получения из них иммуногенного пептида, пригодного для применения в способе по настоящему изобретению. Такие гомологи dnaJ хорошо известны в данной области и включают, например, гомологи, кодируемые молекулами нуклеиновой кислоты, которые клонированы из различных прокариотных и эукариотных организмов, таких как Yersinia pestis (GenBank,доступа САС 89325), Saccharomyces cerevisiae (GenBank,доступа NP013884), полосатый данио(GenBank,доступа NP064662). Понятно, что и в других организмах могут быть идентифицированы дополнительные БТШ dnaJ; они могут быть получены поиском молекулы нуклеиновой кислоты или белковой последовательности в нуклеотидных или белковых банках данных, таких как банк данных Национального Центра Биотехнологической Информации США (National Center for Biotechnology Information,NCBI), с помощью таких обозначений, как "dnaJ", "HSJ1" или подобных им, и способа поиска и параметров поиска, раскрытых здесь. Как здесь описано, пептидные части белка бактериального БТШ dnaJ и человеческих БТШ HSJ1,HDJ1 и HDJ2, в том числе пептиды, гомологичные пептидным последовательностям бактериального БТШ dnaJ (гомологичные человеческие пептиды), и пептиды, негомологичные пептидным последовательностям бактериального БТШ dnaJ (негомологичные человеческие пептиды), могут модулировать иммунный ответ индивидуума. Типичные пептиды бактериального БТШ dnaJ и гомологичные и негомологичные человеческие пептиды включают пептиды бактериального dnaJ гомологичные человеческие пептиды 2 (HSJ1) ASYYEILDVPRSASA Иммуногенные пептиды настоящего изобретения включают провоспалительные пептиды, результатом действия которых является повышенная экспрессия провоспалительных цитокинов, таких как интерферон-гамма, и антивоспалительные пептиды, результатом действия которых является повышенная экспрессия антивоспалительных цитокинов, таких как интерлейкин-10. Определение того, имеет ли пептид настоящего изобретения провоспалительную активность или антивоспалительную активность,удобно проводить с помощью анализов in vitro, как раскрывается здесь (см. примеры 1 и 2), или можно проводить с помощью любого метода, обычно используемого в данной области для определения, например, идентичности и количества цитокинов, экспрессируемых вследствие контакта пептида с иммуноэффекторными клетками. В том смысле, как он использован здесь, термин иммуноэффекторные клетки относится к клеткам, непосредственно вовлечнным в создание или действие иммунного ответа. Такие клетки хорошо известны в данной области и включают В-лимфоциты (В-клетки); предъявляющие антиген клетки, такие как дендритные клетки, одноядерные фагоцитные клетки, макрофаги, в том числе клетки Лангерганса, и (у человека) клетки эндотелия венул (и В-клетки); и в особенности Т-клетки, например Т-хелперные клетки, Т-супрессорные клетки и цитотоксичные Т-клетки. По характеристикам иммуногенные пептиды настоящего изобретения можно разделить на две основные категории, а именно пептиды, имеющие аминокислотную последовательность, относительно сохраняемую (консервативную) для БТШ dnaJ различных видов (гомологичные пептиды), и пептиды,имеющие аминокислотную последовательность, существенно не сохраняемую среди БТШ dnaJ (негомологичные пептиды). Термин гомология, как он использован здесь, относится к аминокислотной последовательности или нуклеотидной последовательности, которая имеет степень идентичности последо-6 005821 вательности с референтной последовательностью не менее 50%, если располагается и сопоставляется для максимального соответствия в пределах окна сравнения или обозначенной области и если эта степень идентичности измеряется с помощью любого числа алгоритмов сопоставления или путм выравнивания последовательностей вручную и их визуального обследования. Для целей определения степени идентичности последовательностей считают идентичными консервативные аминокислотные замещения, такие как взаимные замещения аминокислот, имеющих алифатическую гидрофобную боковую цепь (например, аланин, лейцин, изолейцин, валин), или аминокислот, имеющих кислотную боковую цепь (например, аспарагиновая кислота, глутаминовая кислота), или аминокислот, имеющих основную боковую цепь(аргинин, лизин), или подобные замещения. Кроме того, определение гомологии может допускать одну или несколько вставок или делеций, предпочтительно одну или две вставки или делеции, при условии,что такие вставки или делеции учитываются для целей сравнения как аминокислоты, не являющиеся идентичными. Как таковые, гомологичные пептиды могут различаться по длине на одну, две или несколько аминокислот, при условии, что сохраняется минимальная степень идентичности последовательностей. Как раскрывается в данном описании, гомологичные пептиды или полинуклеотиды настоящего изобретения имеют степень идентичности последовательностей не менее чем приблизительно 50%; как правило, они имеют степень идентичности последовательностей не менее чем приблизительно 60%, и степень идентичности их последовательностей с последовательностью референтного пептида или полинуклеотида может быть соответственно по меньшей мере не менее чем приблизительно 70% или не менее чем приблизительно 80%. Например, пептид 4 бактериального dnaJ (SEQ ID NO: 1), содержащий 15 аминокислот, гомологичен пептиду 2 человеческого HSJ1 (SEQ ID NO: 9), содержащему 15 аминокислот и по отношению к SEQ ID NO: 1 имеющему 7 идентичных аминокислот и 2 консервативных замещения(9/15, 60%); он гомологичен пептиду 3 человеческого HDJ1 (SEQ ID NO: 10), содержащему 15 аминокислот, причм по отношению к SEQ ID NO: 1 шесть аминокислот идентичны и имеются 3 консервативных замещения (9/15, 60%); и он гомологичен также пептиду 5 человеческого HDJ2 (SEQ ID NO: 11),имеющему в сравнении с SEQ ID NO: 1 восемь идентичных аминокислот (8/15, 53,3%). Негомологичные пептиды настоящего изобретения включают такие пептиды, которые не являются гомологичными пептидами, но тем не менее имеют характеристики иммуногенного пептида настоящего изобретения. Определить, достаточно ли гомологичен для целей нестоящего изобретения пептид или полинуклеотид, можно путм визуального сопоставления двух или нескольких последовательностей или с помощью компьютерного метода, который может быть также полезен для идентификации гомологичных последовательностей среди множества последовательностей, имеющихся в банках данных для молекул белков или нуклеиновых кислот. Например, степень гомологии или идентичности может быть измерена с помощью компьютерной программы анализа последовательностей, такой как Sequence Analysis Software Package of the Genetics Computer Group (University of Wisconsin Biotechnology Center, 1710 UniversityAvenue, Madison, Wl 53705, USA). Такая программа подбирает похожие последовательности, приписывая степени гомологии различным делециям, замещениям и другим модификациям. При использовании алгоритма сопоставления последовательностей испытуемую и референтную последовательности вводят в компьютер, при необходимости задают координаты последовательности и устанавливают параметры программы алгоритма сопоставления последовательностей. Могут быть использованы программные параметры определения неполного соответствия (значение default - по умолчанию) или могут быть заданы альтернативные параметры. Затем алгоритм сопоставления последовательностей на основании программных параметров рассчитывает для испытуемой последовательности процент идентичности последовательности по отношению к референтной последовательности. Термин окно сравнения используется здесь в широком смысле, чтобы ввести обозначение сегмента из любого числа соседствующих позиций, например, приблизительно от 9 до 50 аминокислотных позиций или приблизительно от 20 до 200 нуклеотидных позиций, в котором может быть произведено сравнение последовательности с референтной последовательностью из такого же числа соседствующих позиций, после того как обе последовательности оптимальным образом расположены параллельно(aligned). Методы параллельного расположения сравниваемых последовательностей хорошо известны и включают, например, алгоритм локальной гомологии Смита и Уотермана (Smith and Waterman//Adv.Appl. Math. 1981. т. 2. с. 482), алгоритм выровненного расположения по гомологиям (Needleman andWunsch//J. Mol. Biol. 1970. т. 48. с. 443), метод поиска подобия (Person and Lipman//Proc. Natl. Acad. Sci.USA. 1988. т. 85. с. 2444), каждый из которых включн сюда ссылкой. Сопоставление последовательностей может быть произведено путм компьютеризованного введения этих алгоритмов (GAP, BESTFIT,FASTA и TFASTA в Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, Wl, USA) или путм выровненного расположения этих последовательностей вручную и визуального сопоставления. Кроме программы BLAST (Basic Local Alignment Search Tool, National Center for Biological Information) могут быть использованы другие алгоритмы для определения степени гомологии или идентичности, включающие, например, ALIGN, AMAS (Analysis of Multiply Aligned Sequences), AMPSAlignment Tool), Framealign, Framesearch, DYNAMIC, FILTER, FSAP (Fristensky Sequence Analysis Package), GAP (Global Alignment Program), GENAL, GIBBS, GenQuest, ISSC (Sensitive Sequence Comparison),LALIGN (Local Sequence Alignment), LCP (Local Content Program), MACAW (Multiple Alignment ConstructionAnalysis Workbench), MAP (Multiple Alignment Program), MBLKP, MBLKN, PIMA (PatternInduced Multi-sequence Alignment), SAGA (Sequence Alignment by Genetic Algorithm) и WHAT-IF. Такие программы выровненного расположения могут также использоваться для первичного просмотра (скрининга) геномных банков данных, чтобы идентифицировать полинуклеотидные последовательности,имеющие в основном идентичные последовательности. Примерами полезных алгоритмов являются алгоритмы BLAST и BLAST 2.0, описанные соответственно в работах Altschul и др.//Nucleic Acids Res. 1977. Т. 25. С. 3389-3402 и Altschul и др.//J. Mol. Biol. 1990. т. 215. с. 403-410, каждая из которых включена сюда ссылкой. Программа для осуществления анализов с помощью BLAST открыто предоставляется National Center for Biotechnology Information (URL в Интернете www.ncbi.nlm.nih.gov). Этот алгоритм вначале проводит идентификацию пар нуклеотидов с высокой степенью регистрируемости (high scoring sequence pairs, HSP) по идентификации в исследуемой последовательности коротких слов длиной W, которые либо полностью соответствуют слову той же длины в последовательности из банка данных, либо удовлетворяют некоторому, имеющему положительную величину, пороговому значению отсчта Т. Величину Т называют порогом прочтения соседствующего слова (Altschul и др., 1977, 1990, см. выше). Эти исходные попадания на соседствующие слова служат отправными центрами для инициирования перебора с поиском содержащих их более длинных HSP. Найденные слова удлиняются в обоих направлениях вдоль каждой последовательности, пока не достигается увеличение значения кумулятивного параллельного подобия (cumulative alignment score). Кумулятивные значения вычисляются с использованием для нуклеотидных последовательностей параметров М(премиальное значение за пару соответствующих друг другу нуклеотидов всегда 0). Для аминокислотных последовательностей для расчта величины кумуляции используется счтная матрица. Удлинение слов в каждом из направлений прекращается, если кумулятивный отсчт параллельного соответствия падает на величину X ниже максимального достигнутого значения; кумулятивный отсчт падает до нуля и ниже вследствие появления одного или нескольких нуклеотидных сопоставлений, дающих отрицательный отсчт; или же достигнут конец каждой последовательности. Параметры алгоритма BLAST W, Т и X определяют чувствительность и скорость параллельного выравнивания. Программа BLASTN (для нуклеотидных последовательностей) использует как предел несовпадения длину слова (W), равную 11, ожидание (Е), равное 10, М = 5, N = 4 и сопоставление обеих нитей. Для аминокислотных последовательностей программа BLASTP использует как пределы несовпадения длину слова 3 и ожидание (Е) 10, а для счтной матрицы BLOSUM62 (см. Henikoff and Henikoff//Proc. Natl. Acad. Sci. USA. 1989. т. 89. с. 10915) используют масштаб выравнивания (В), равный 50, ожидание (Е), равное 10, М = 5, N = 4 и сопоставление обеих нитей. Алгоритм BLAST производит также статистический анализ подобия между двумя последовательностями (см., например, работу Karlin and Altschul//Proc. Natl. Acad. USA, 1993. т. 90. с. 5873, включнную сюда ссылкой). Одной из мер подобия, даваемой алгоритмом BLAST, является наименьшая суммарная вероятность (P(N, которая указывает вероятность, с которой совпадение между двумя нуклеотидными или аминокислотными последовательностями может являться случайным. Например, нуклеиновая кислота считается подобной по последовательности референтной последовательности, если при сравнении тестируемой нуклеиновой кислоты с референтной нуклеиновой кислотой наименьшая суммарная вероятность ниже чем приблизительно 0,2, более предпочтительно ниже чем приблизительно 0,01 и наиболее предпочтительно ниже чем приблизительно 0,001. В одном из вариантов осуществления изобретения степень гомологии последовательностей белка и нуклеиновой кислоты оценивают с помощью программы Basic Local Alignment Search Tool ("BLAST)". В частности, для решения следующих задач используют пять специфических программ BLAST:(1) BLASTP и BLAST3 сопоставляют исследуемую аминокислотную последовательность с банком банных для белковых последовательностей;(2) BLASTN сопоставляет исследуемую нуклеотидную последовательность с банком банных для нуклеотидных последовательностей;(3) BLASTX сопоставляет рассчитанные продукты шестикодонной (six-frame) трансляции исследуемой нуклеотидной последовательности (обе нити) с банком банных для белковых последовательностей;(4) TBLASTN сопоставляет исследуемую белковую последовательность с взятыми из банка данных нуклеотидными последовательностями, транслируемыми по всем шести рамкам считывания (обе нити); и(5) TBLASTX сопоставляет продукты шестикодонной трансляции исследуемой нуклеотидной последовательности с продуктами шестикодонной трансляции нуклеотидных последовательностей из банка данных для нуклеотидных последовательностей.-8 005821 Программы BLAST идентифицируют гомологичные последовательности путм идентификации похожих сегментов, которые здесь обозначены как пары сегментов с высокой регистрируемостью, при сопоставлении исследуемой аминокислотной или нуклеотидной последовательности с референтной последовательностью, предпочтительно получаемой из банка банных для аминокислотной или нуклеотидной последовательности. Пары сегментов с высокой регистрируемостью предпочтительно идентифицируют (то есть располагают параллельно) с помощью счтной матрицы, многие из которых известны в данной области. Предпочтительно в качестве счтной матрицы используют матрицу BLOSUM62 (см. работы Gonnet и др.//Science/1992. т. 256. с. 1443-1445; Henikoff and Henikoff//Proteins. 1993. т. 7. с. 49-61,каждая из которых включена сюда ссылкой). Менее предпочтительно могут быть также использованы матрицы РАМ и РАМ 250 ("Matrices for Detecting Distance Relationships: Atlas of Protein Sequence andwww.ncbi.nlm.nih.gov. Параметры, используемые в указанных выше алгоритмах, могут быть адаптированы в зависимости от исследуемой длины последовательности и степени гомологии. В некоторых вариантах осуществления при отсутствии инструкций разработчика в качестве параметров алгоритмов могут быть использованы параметры пределов несовпадения (default parameters). Такие методы поиска могут также быть использованы для идентификации белков теплового шока dnaJ в банках данных. Пептид настоящего изобретения может быть приготовлен с помощью методов химического синтеза пептидов, может быть экспрессирован с кодирующего полинуклеотида или выделен после расщепления БТШ dnaJ. Методы очистки, синтеза или получения пептидов в рекомбинантной форме удобны и хорошо известны в данной области, они пригодны для получения иммуногенных пептидов достаточной степени чистоты для применения в способе настоящего изобретения. В этом отношении термин выделенный или существенно чистый обозначает пептид или полинуклеотид, который существенно освобождн от других компонентов, с которыми он в естественном состоянии может быть ассоциирован in vivo. В контексте способа настоящего изобретения термин существенно чистый относится к существенно гомогенным пептидам или полинуклеотидам, где степень гомогенности определяется по отношению к известным в данной области стандартам чистоты. Так, это может быть степень чистоты, достаточная для получения N-концевой аминокислотной последовательности белка. Предпочтительно степень очистки пептида или полинуклеотида должна быть настолько достаточной, чтобы этот пептид или полинуклеотид мог быть использован для введения индивидууму. Как таковой, выделенный пептид или полинуклеотид обычно составляет не менее чем примерно 50% образца, содержащего пептид, обычно не менее чем приблизительно 75%, в частности, не менее чем приблизительно 90% и предпочтительно приблизительно от 95 до 99% и более. Необходимо осознавать, что такая мера чистоты относится к самому пептиду или как к исходному материалу, например, для рецептур в составе композиции, в случае чего выделенный пептид настоящего изобретения может представлять собой компонент композиции, которая может кроме него содержать дополнительные компоненты, как здесь описано, в том числе добавочные выделенные пептиды настоящего изобретения. Существенно чистые белки и пептиды могут быть получены из интактных микроорганизмов, конкретно бактерий, при экспрессии в микробах путм химического или биологического синтеза, или используя обычные методы очистки, известные в данной области, включая, например, аффинную хроматографию. Такой метод может быть использован для получения иммуногенных пептидных фрагментов БТШ dnaJ. Например, белки или пептиды, пригодные для приготовления вакцинной композиции настоящего изобретения, могут быть получены путм химического синтеза методом, включающим защиту альфа-аминогрупп группами tBOC (трет-бутилоксикарбонил) или FMOC. Оба метода включают ступенчатый синтез, где на каждом этапе добавляется одна аминокислота, начиная с С-конца пептида (см., например, Coligan и др.//Current Protocols in Immunology, Unit 9. Wiley Interscience, 1991). Пептиды настоящего изобретения могут быть также синтезированы одним из различных хорошо известных методов твердофазного синтеза пептидов (см., например, Merrifield//J. Am. Chem. Soc. 1962. т. 85. с. 2149; Stewartand Young//Solid Phase Peptides Synthesis. Freeman. San Francisco, 1969. с. 27-62) с использованием, например, сополимера стирола с дивинилбензолом, содержащего приблизительно 0,1-1,0 ммоль аминов на 1 г полимера. По завершении химического синтеза защита может быть снята, а пептиды отщеплены от смолы обработкой жидким HF с 10% анизолом при 0 С в течение приблизительно от 15 мин до 1 ч. После выпаривания реагентов пептиды экстрагируют из полимера 1% раствором уксусной кислоты,экстракт затем подвергают лиофильной сушке, получая неочищенный материал, который может быть очищен с помощью такого метода, как гель-фильтрационная хроматография, например, на аффинной колонке с модифицированным сефадексом SEPHADEX.RTM G-15 или модифицированной сефарозойSEPHAROSE.RTM, с использованием в качестве растворителя 5% уксусной кислоты. Лиофилизация подходящих фракций из элюата с колонки дат существенно гомогенные пептид или производные пептида, которые могут быть охарактеризованы с помощью стандартных методик, таких как аминокислотный анализ, тонкослойная хроматография, высокоэффективная жидкостная хроматография, спектроскопия поглощения в УФ области, измерение молярного вращения или растворимости, а также может быть произведено их секвенирование, например, методом твердофазной деструкции по Эдману.-9 005821 При необходимости иммуногенный пептид настоящего изобретения может быть модифицирован,например, для повышения способности пептида действовать как иммуноген или толераген, для повышения стабильности пептида в организме индивидуума или в другой среде, или для любой другой необходимой цели. Например, пептид может быть модифицирован путм гликозилирования, что может быть осуществлено пришивкой углеводной части молекулы к реакционноспособной боковой цепи аминокислоты пептида или введением одной или нескольких дополнительных аминокислот на N-конце или Сконце пептида и пришивкой углеводной части молекулы к дополнительной аминокислоте. Образуемая связь может быть любой связью, обнаруживаемой в гликопротеине, например пришивка углевода Nконцом или О-концом соответственно к остатку аспарагина или остатку серина, или же это может быть любая другая связь, которую удобно осуществить. Иммуногенный пептид настоящего изобретения может быть также модифицирован, будучи функционально (оперативно) связан с одним или более других пептидов или полипептидов. По существу настоящее изобретение предусматривает также химерный полипептид, который включает пептид настоящего изобретения, оперативно связанный по меньшей мере с одним гетерологичным полипептидом. В том смысле, как он использован здесь, термин оперативно связанный означает, что два или более пептидов (или два или более полинуклеотида) соединены вместе так, что функции связанных пептидов(или полинуклеотидов) сохраняются, и так, что химерный полипептид (или молекула рекомбинантной нуклеиновой кислоты) проявляет функции каждого пептидного (или полинуклеотидного) компонента. Например, химерный полипептид настоящего изобретения может включать пептид настоящего изобретения, оперативно связанный с пептидной меткой ("tag"), такой как полигистидиновая метка, так, что пептид может быть идентифицирован в образце или выделен из смеси с помощью реагента, хелатно связывающегося с никелем. Пептид настоящего изобретения может быть также связан, например, с доменом клеточной компартментализации, который может обеспечивать локализацию пептида в определнном секторе клетки, например, пептида, экспрессированного после введения индивидууму молекулы рекомбинантной нуклеиновой кислоты, кодирующей химерный полипептид. Домен клеточной компартментализации может обеспечить локализацию пептида в цитозоле, ядре, плазматической мембране, эндоплазматическом ретикулуме, срединных полостях в аппарате Гольджи, или в лизосоме или эндосоме; или это может быть переносящий через мембрану пептид, который может обеспечить транспорт иммуногенного пептида сквозь клеточную мембрану; или это секреторный пептид, который может обеспечить секрецию пептида из клетки (см., например, работы Hancock и др.//EMBO J. 1991. т. 10. с. 4033-4039; Buss и др.//Mol. Cell. Вiol. 1988. т. 8. с. 3960-3963; патент США 5776689, каждая из которых включена сюда ссылкой). Настоящее изобретение предусматривает также полинуклеотид, кодирующий иммуногенный пептид настоящего изобретения. Полинуклеотид может быть однонитевым или двунитевым и может быть молекулой рибонуклеиновой кислоты (РНК), молекулой дезоксирибонуклеиновой кислоты (ДНК) или их гибридом. Кроме того, настоящее изобретение предусматривает молекулу рекомбинантной нуклеиновой кислоты, которая содержит полинуклеотид настоящего изобретения, оперативно связанный по меньшей мере с одной гетерологичной нуклеотидной последовательностью. Гетерологичная нуклеотидная последовательность может быть любой нуклеотидной последовательностью, которая в норме обнаруживается в природе в близлежащей связи с полинуклеотидом настоящего изобретения. Например, гетерологичной нуклеотидной последовательностью может быть последовательность контроля экспрессии, такая как элемент регуляции транскрипции или элемент регуляции трансляции, или их комбинация; или она может кодировать полипептид, такой как цитокин или иной иммуномодулирующий агент, пептидная метка(tag), домен клеточной локализации и т.п. Если рекомбинантная нуклеиновая кислота кодирует пептид настоящего изобретения и второй (или более) функциональный пептид, такой как один или несколько добавочных пептидов настоящего изобретения, или один или несколько цитокинов или подобных им,тогда молекула рекомбинантной нуклеиновой кислоты может дополнительно кодировать сайт распознавания протеазой, расположенный между всеми кодируемыми пептидами, так что после экспрессии каждый из кодируемых пептидов высвобождается в форме, свободной от других кодируемых пептидов или полипептидов. Настоящее изобретение предлагает также вектор, содержащий полинуклеотид настоящего изобретения, и дополнительно предлагает клетку, которая содержит полинуклеотид или вектор настоящего изобретения. Вектором может быть клонирующий вектор, который может быть пригоден для получения больших количеств содержащихся в нм полинуклеотида или молекулы рекомбинантной нуклеиновой кислоты настоящего изобретения, или им может быть экспрессирующий вектор, который может быть пригоден, если полинуклеотид должен быть введн в клетку или индивидууму с целью экспрессии кодируемого пептида. Такие векторы хорошо известны в данной области и включают, например, плазмидные векторы и вирусные векторы, в том числе векторы, полученные из ретровируса, аденовируса, аденоассоциированного вируса, вируса коровьей оспы или подобных им. Обычно используемым плазмидным вектором, который функционально кодирует вставки чужеродного структурного гена, является плазмида pBR322. Плазмида pBR322 содержит в качестве маркера ген для придания устойчивости к ампициллину; однако, для использования у людей такой устойчивости к- 10005821 ампициллину следует избегать. Модифицированные векторы, которые пригодны для процедур генной иммунизации, но не придают устойчивости к ампициллину, описаны, например, в заявке на патент США 08/593554, поданной 30 января 1996 г., которая включена сюда ссылкой. В настоящем изобретении могут быть использованы различные вирусные векторы, включая аденовирус, вирус герпеса, вирус коровьей оспы или РНК-содержащий вирус, такой как ретровирус. Предпочтительно ретровирусный вектор является производным мышиного или птичьего ретровируса. Примеры ретровирусных векторов, в которые может быть вставлен один чужеродный ген, включают (но не ограничиваются ими) вирус мышиной саркомы Молони (Moloney) (MoMuLV), вирус мышиной саркомы Harvey (HaMuS-V), вирус опухоли молочных желез мыши (MuMTV) и вирус саркомы Рауса (RSV). В большое количество дополнительных ретровирусных векторов можно ввести несколько генов. Все эти векторы могут переносить или содержать ген селектирующего маркера, так что можно идентифицировать и создавать трансдуцированные (преобразованные) клетки. Поскольку рекомбинантные вирусы дефектны, для продуцирования инфекционных векторных частиц им необходима помощь. Такую помощь можно обеспечить, например, путм использования линий клеток-помощников (хелперов), которые содержат плазмиды, кодирующие все структурные гены ретровируса под контролем регуляторных последовательностей внутри длинного концевого повтора (LTR). Эти плазмиды не содержат нуклеотидных последовательностей, обеспечивающих механизм упаковки путм распознавания РНК-транскрипта для инкапсулирования. Линии клеток-помощников, имеющих делеции сигнала упаковки, включают, например (но не ограничиваются ими), 2, РА 317 и РА 12. Эти линии клеток продуцируют пустые вирионы, поскольку геном не упаковывается. Если в такие клеткипомощники вводится ретровирусный вектор, в котором сигнал упаковки интактен, но структурные гены заменены другими целевыми генами, вектор может упаковываться, и может продуцироваться векторный вирион. Определнные преимущества могут быть получены при введении в виде вакцины полинуклеотида, кодирующего пептид настоящего изобретения, вместо введения пептида в качестве традиционной вакцины. Эти преимущества включают, например, то, что существенно исключается риск потенциальной токсичности (типа анафилактического шока), присущей белковой вакцине. При контакте с клеткой или введении индивидууму полинуклеотид или молекула рекомбинантной нуклеиновой кислоты настоящего изобретения, или вектор, содержащий полинуклеотид, могут вводиться как голая ДНК или могут входить в состав носителя для доставки, такого как липосомы или коллоидные частицы, которые могут усиливать захват полинуклеотида и могут снижать склонность полинуклеотида к разрушению до захвата клеткой. Настоящее изобретение предусматривает также композицию, которая содержит по меньшей мере один пептид настоящего изобретения и может содержать несколько различных иммуногенных пептидов настоящего изобретения. Например, это может быть композиция, содержащая любой из пептидов, перечисленных далее как последовательности SEQ ID NO: 1 - SEQ ID NO: 26, или композиция, содержащая любую комбинацию таких пептидов, в частности композиция, содержащая комбинацию провоспалительных пептидов, и композиция, содержащая комбинацию антивоспапительных пептидов. Композиция по настоящему изобретению, как правило, составляется в физиологически приемлемом растворе, и при необходимости может дополнительно содержать один или несколько иммуноадъювантов, например,один или несколько цитокинов, полный адъювант Фрейнда, неполный адъювант Фрейнда, квасцы или подобное им. Вообще, если композиция содержит один или несколько цитокинов, цитокины имеют активность по отношению к воспалению такую же, как активность пептидов настоящего изобретения, или дополняющую ее (комплементирующую). Композиция может также содержать любой иммуноадъювант,в том числе иммуностимулятор или, если необходимо, иммуноподавитель, который может модулировать иммунный ответ организма индивидуума. Подходящие вещества, имеющие такую активность, хорошо известны в данной области и включают IL-6, который может стимулировать супрессорные или цитотоксичные Т-клетки, и циклоспорин А и антитела к CD4, которые могут подавлять иммунный ответ. Такие вещества могут вводиться отдельно или в виде смеси с вакциной настоящего изобретения. Термин цитокин используется здесь широко для обозначения растворимых гликопротеинов, высвобождаемых клетками иммунной системы и действующих не по ферментному типу через специфические рецепторы, регулируя иммунные ответы. Как таковой, термин цитокин, как он использован здесь,включает хемокины, интерлейкины, лимфокины, монокины, интерфероны, стимулирующие образование колоний факторы, активирующие тромбоциты факторы, фактор- некроза опухолей и связанные с рецепторами белки, а также их функциональные фрагменты. Термин функциональный фрагмент, как он использован здесь, относится к пептидной или полипептидной части белка, которая обладает биологической функцией или активностью, характерной для нативного белка. Например, функциональный фрагмент IL-10 или IL-4 имеет, например, существенно такую же антивоспалительную активность, как существующий в природе или полученный путм рекомбинации соответственно IL-10 или IL-4, тогда как функциональный фрагмент ИФН или TNF имеет, например, существенно такую же антивоспалительную активность, как существующий в природе или полученный путм рекомбинации соответственно- 11005821 ИФН или TNF. Цитокины хорошо известны в данной области и включают, например, активирующий моноциты эндотелия полипептид II (ЕМАР-II), стимулирующий образование колоний гранулоцитов-макрофагов фактор (GM-CSF), стимулирующий образование колоний гранулоцитов фактор (G-CSF), стимулирующий образование колоний макрофагов фактор (M-CSF), IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-10, IL-12, IL13 и т.д., интерфероны, в том числе ИФН, ИФН и ИФН, и TNF, каждый из которых связан с конкретным биологическим, морфологическим или фенотипическим изменением клетки или клеточного механизма. Дополнительными примерами цитокинов являются члены подсемейства хемокина СХС (или), которые имеют вставленную аминокислоту между двумя сохраняемыми цистеинами; члены подсемейства СС (или ), которые не содержат такой вставки аминокислоты; и хемокины С (или ), у которых отсутствуют первый и третий остатки цистеина. Вообще члены подсемейства цитокиновактивны по отношению к нейтрофилам и Т-лимфоцитам (Т-клеткам), а хемокины подсемействаактивны по отношению к моноцитам, макрофагам и Т-клеткам. Некоторые члены подсемейств цитокиновиактивны также по отношению к дендритным клеткам, представляющим собой мифирующие клетки, которые проявляют выраженные антиген-предъявляющие свойства и, как считают, участвуют в патофизиологии многих воспалительных заболеваний (Хu и др.//J. Leuk. Biol. 1996. т. 60. с. 365-371; и Sozzani и др.//J. Immunol. 1997. Т. 159. С. 1993-2000). Был также описан четвртый хемокин человека типа СХЗС, фракталкин(Bazan и др.//Nature. 1997. т. 385. с. 640-644; Imai и др.//Cell. 1997. т. 91. с. 521-530; Маскау//Сurr.Biol. 1997. т. 7. с. R384-R386). В отличие от других хемокинов, фракталкин существует в мембранной и растворимой формах. Растворимая форма является активным хемоаттрактантом для моноцитов и Т-клеток. Рецептор на поверхности клеток для этого хемокина обозначается CX3CR1. Примерами -хемокинов (известных также как IL-8) являются хемотактный для гранулоцитов белок-2 (GCP-2); связанные с ростом онкогены: онкоген- (GRO-), GRO- и GRO-; активирующий нейтрофилы пептид-78 из клеток эпителия (ENA-78); основной белок тромбоцитов (РВР); активирующий соединительную ткань пептид III (СТАР III); активирующий нейтрофилы пептид-2 (NAP-2); фактор-4 тромбоцитов с низким сродством (LAPF-4); индуцированный ИФН монокин (MIG); фактор 4 тромбоцитов (PF4); индуцируемый интерфероном белок 10 (IP-10); полученные из клеток стромы факторы SDF1, SDF-1 и SDF-2. Примерами хемокиновявляются хемотактные для моноцитов белки МСР-1, МСР 2, МСР-3, МСР-4 и МСР-5; ингибирующие макрофаги белки MIP-1, MIP-1, MIP-1, MIP-2, MIP-2,MIP-2, MIP-3, MIP-3, MIP-4 и MIP-5; хемокин из макрофагов (MDC); хемокин 1 человека (НСС-1);LD78P, RANTES; эотаксин 1; эотаксин 2; TARC; SCYA17 и I-309; хемокин-1 дендритных клеток (DCCK-1). Примером хемокиновявляется лимфотактин. Композиция по настоящему изобретению может быть приготовлена для введения индивидууму путм комбинирования иммуногенного пептида или иммуногенных пептидов с физиологически приемлемыми носителями. Такие носители должны быть нетоксичными для реципиентов при применяемых дозах и концентрациях. Обычно при приготовлении таких композиций объединяют конкретный вакцинный антиген с физиологическим раствором, буферами, антиоксидантами, такими как аскорбиновая кислота,низкомолекулярными (менее 10 аминокислотных остатков) полипептидами, белками, аминокислотами,углеводами, включая глюкозу или декстраны, или хелатными агентами, такими как EDTA (этилендиаминтетраацетат), глютатионом и другими стабилизаторами и наполнителями. Такие композиции могут быть в виде суспензии, эмульсии или в лиофилизованной форме и составляются при таких условиях,чтобы они были соответствующим образом приготовлены и готовы для использования при требуемом применении. Физиологически приемлемым носителем может быть любой материал, который при комбинировании с иммуногенным пептидом или полинуклеотидом настоящего изобретения обеспечивает сохранение биологической активности ингредиента и не нарушает нежелательным образом его реакцию с иммунной системой индивидуума. Примеры включают (но не ограничиваются ими) любые стандартные физиологически приемлемые носители, такие как забуференный фосфатом солевой физиологический раствор,вода, эмульсии (такие как эмульсия масло/вода) и различного типа увлажняющие агенты. Предпочтительными разбавителями для аэрозольного или парентерального введения являются забуференный фосфатом солевой физиологический раствор или нормальный (0,9%) солевой физиологический раствор. Композиции, содержащие такие носители, составляют хорошо известными общепринятыми методамиPA 18042, USA). Как правило, для введения индивидууму пептид или кодирующий полинуклеотид включают в состав композиции. Поэтому настоящее изобретение предлагает композицию, которая обычно кроме пептида или полинуклеотида настоящего изобретения содержит носитель, в который удобно внедрить пептид или полинуклеотид для введения индивидууму. Например, носителем может быть водный раствор,такой как забуференный физиологический солевой раствор, или другой растворитель или носитель, как гликоль, глицерин, масло (такое как оливковое масло) или пригодные для инъекции органические эфиры. Носитель может включать также физиологически приемлемое соединение, которое действует, например,- 12005821 таким образом, что стабилизирует пептид или кодирующий полинуклеотид или усиливает его адсорбцию. Физиологически приемлемые соединения включают, например, углеводы (такие как глюкоза, сахароза или декстраны), антиоксиданты (такие как аскорбиновая кислота или глутатион), хелатные агенты,низкомолекулярные белки и другие стабилизаторы или наполнители. Подобным же образом клетка, которая претерпела в культуре обработку в целях практического применения способов настоящего изобретения (например, одноядерные клетки синовиальной жидкости, дендритные клетки или подобные им),также может быть введена в состав композиции, если клетки надлежит вводить индивидууму. Специалистам в клинической работе понятно, что выбор носителя, в том числе физиологически приемлемого соединения, зависит, например, от способа, которым следует ввести пептид или кодирующий полинуклеотид, а также от пути введения композиции. Если композиция вводится в условиях иммунизации, то есть как вакцина, е обычно вводят внутримышечно, внутрикожно или подкожно, но е можно вводить также парентерально, например внутривенно, и она может быть введена путм инъекции,интубации или иным подобным методом, известным в данной области. Если желательной модификацией иммунной системы является создание толерантности, композицию предпочтительно вводят орально или же е можно ввести так, как указано выше. Композиция настоящего изобретения может также содержать второй реагент, такой как диагностический реагент, питательное вещество, токсин или терапевтический агент (например, агент для противораковой терапии). Предпочтительно второй реагент представляет собой иммуномодулирующий агент,например иммуностимулирующий агент (такой как цитокин или молекула В 7). Кроме того, если необходимо стимулировать иммунный ответ, композиция может содержать адъювант, например, квасцы, адъювант DETOX (Ribi Immunochemi Research, Inc.; Hamilton, MT, USA); или полный или неполный адъювант Фрейнда. Добавление адъюванта может усиливать иммуногенность пептида настоящего изобретения,снижая таким путм количество антигена, необходимого для стимуляции иммунного ответа. Адъюванты могут усиливать иммунный ответ, продлевая персистенцию антигена, усиливая совместно стимулирующие сигналы, индуцируя образование гранулмы, неспецифически стимулируя пролиферацию лимфоцитов или улучшая контакт между Т-клетками и антиген-предъявляющими клетками (АПК). Композиция, содержащая пептид или полинуклеотид настоящего изобретения, может быть также включена внутрь инкапсулирующего материала, например в эмульсию масла в воде, микроэмульсию,мицеллы, смешанные мицеллы, липосомы, микросферы или в иной полимерный матрикс (см., например,работы Gregoriadis//Liposome Technology, т. 1. CRC Press. Boca Raton, FL, 1984; Fraley и др.//Trends Biochem. Sci. 1981. т. 7. с. 77, каждая из которых включена сюда ссылкой). Липосомы, например, состоящие из фосфолипидов или других липидов, - это нетоксичные, физиологически переносимые и подвергающиеся метаболизму носители, которые сравнительно легко готовить и вводить. Примером такого инкапсулирующего материала являются так называемые скрытные ("stealth") липосомы (см., например, патенты США 5882679, 5395619 и 5225212, каждый из которых включн сюда ссылкой). Катионные липосомы, например, могут быть также модифицированы специфическими рецепторами или лигандами(работа Motishita и др.//J. Clin. Invest. 1993. т. 91, с. 2580-2585, которая включена сюда ссылкой). Кроме того, полинуклеотидный агент может быть введн в клетку с помощью, например, комплексов ДНК аденовируса с полилизином (см., например, работу Michael и др.//J. Biol. Спет. 1993, т. 268, с. 6866-6869,которая включена сюда ссылкой). В соответствии с этим настоящее изобретение предлагает способ модуляции иммунного ответа у индивидуума путм введения индивидууму иммуногенной пептидной части БТШ dnaJ или полинуклеотида, кодирующего такой пептид. Как раскрывается здесь, БТШ dnaJ может быть прокариотным или эукариотным БТШ dnaJ, в том числе, например, бактериальным БТШ dnaJ, таким как БТШ dnaJ E. coli; БТШ dnaJ беспозвоночных, таким как БТШ dnaJ дрожжей; или БТШ dnaJ позвоночных, таким как БТШdnaJ млекопитающих, в том числе БТШ dnaJ человека, таким как человеческий HSJ1, HDJ1 или HDJ2. Как таковой, пептид настоящего изобретения, который может представлять собой компонент композиции по настоящему изобретению, может быть полезен как лекарственное средство, в том числе лекарственное средство для лечения человеческого индивидуума и лекарственное средство для ветеринарных целей. Способ по настоящему изобретению может модулировать иммунный ответ путм усиления воспалительной реакции, связанной с иммунным ответом, или путм ослабления воспалительной реакции,связанной с иммунным ответом. Так, в одном из вариантов осуществления способ по настоящему изобретению предусматривает путь усиления или индуцирования у индивидуума воспалительной реакции. Такой способ может быть осуществлн путм введения индивидууму в условиях иммунизации пептида,имеющего провоспалительную активность, т.е. провоспалительного пептида; путм введения индивидууму в условиях стимуляции толерантности антивоспалительного пептида; или путм введения комбинации таких пептидов, например, в условиях иммунизации вводят два или более провоспалительных пептида или в условиях стимуляции толерантности вводят два или более антивоспалительных пептида,или же по меньшей мере один провоспалительный пептид в условиях иммунизации и по меньшей мере один антивоспалительный пептид в условиях стимуляции толерантности. Результатом действия такого способа усиления или индуцирования воспалительной реакции может являться повышение у индиви- 13005821 дуума уровня провоспалительного цитокина, такого как ИФН, TNF, IL-1, IL-6, IL-12 или IL-23, или снижение у индивидуума уровня антивоспалительного цитокина, такого как IL-4, IL-10 или TGF, или их комбинаций. Способ по настоящему изобретению предусматривает также пути ослабления или подавления у индивидуума воспалительной реакции путм введения индивидууму в условиях иммунизации пептида,имеющего антивоспалительную активность; или путм введения индивидууму в условиях стимуляции толерантности провоспалительного пептида; или путм введения комбинации таких пептидов, например,в условиях стимуляции толерантности вводят два или более провоспалительных пептида или в условиях иммунизации вводят два или более антивоспалительных пептида, или же по меньшей мере один провоспалительный пептид в условиях стимуляции толерантности и по меньшей мере один антивоспалительный пептид в условиях иммунизации. Результатом действия такого способа может быть повышение у индивидуума уровня антивоспалительного цитокина, такого как IL-4, IL-10 или TGF, или понижение у индивидуума уровня провоспалительного цитокина, такого как ИФН, TNF, IL-1, IL-6, IL-12 или IL23 или же их комбинаций. Как раскрыто в данной заявке, может быть введена одна иммуногенная пептидная часть БТШ dnaJ или их комбинация, в том числе, например, любой один из иммуногенных пептидов или любая комбинация иммуногенных пептидов, примеры которых представлены последовательностями SEQ ID NO: 1 SEQ ID NO: 26. Опытным клиницистам в свете данного описания понятно, что пептид настоящего изобретения вводят индивидууму в условиях иммунизации или в условиях стимуляции толерантности, в зависимости от того, является ли пептид провоспалительным пептидом или антивоспалительным пептидом, и от того, вводится ли пептид для усиления или индуцирования воспалительной реакции, или для снижения или подавления воспалительной реакции. Термин в условиях иммунизации, как он использован здесь, означает, что пептид настоящего изобретения приводится в контакт с клеткой или вводится субъекту таким образом, что он может проявлять свою иммуногенную активность. Сам по себе пептид, который является иммуногенным для Тклеток, вводят в иммуногенном количестве, обычно вначале в дозе для первоначальной затравки(priming), за которой через некоторое время следует введение одной или нескольких бустерных доз. Пептид вводится внутрикожно, подкожно или внутримышечно и при необходимости включается в состав композиции, которая содержит иммуноадъювант, такой как полный или неполный адъювант Фрейнда. Термин в условиях стимуляции толерантности, как он использован здесь, означает, что пептид настоящего изобретения приводится в контакт с клеткой или вводится субъекту таким образом, что он может индуцировать образование состояния толерантности к проявляющейся в иных условиях иммуногенной активности. В результате индивидуум, например, становится толерантным к пептиду, так что последний распознатся индивидуумом как свой и не может воздействовать на иммунный ответ. Пептид может вводиться в условиях стимуляции толерантности путм введения вызывающего толерантность количества пептида, обычно малого количества, в течение некоторого периода времени, внутрикожно,подкожно или внутримышечно или, что предпочтительно, в слизистую оболочку, например, он распыляется в нос или съедается. Способ настоящего изобретения может применяться на практике по отношению к индивидууму,имеющему или предрасположенному, или восприимчивому к любому состоянию, в котором необходимо модулировать иммунный ответ, включая индивидуума, имеющего иммунологическое расстройство, или восприимчивого или предрасположенного к иммунологическому расстройству. В общем виде индивидуум представляет собой позвоночное существо, в частности млекопитающее, в том числе домашнее животное, такое как кошка, собака или лошадь; сельскохозяйственное животное, такое как овца, корова или свинья; а также это может быть человек. Иммунологическое расстройство может представлять собой расстройство иммунной системы, такое как аутоиммунное заболевание (например, артрит, такой как олигоартикулярный юношеский идиопатический артрит) или сопровождающееся иммунодефицитом заболевание, такое как заболевание с приобретнным иммунодефицитом (СПИД). Дополнительные болезненные состояния, при которых может быть необходимо модулировать иммунный ответ, включают состояния, при которых у индивидуума не развивается нормальная иммунная реакция, например, в ответ на инфекционное заболевание или рак, или состояние, при котором иммунный ответ индивидуума слишком силн, например, у индивидуума, страдающего воспалительным заболеванием кишечника, отличающимся от аутоиммунного заболевания, или у индивидуума с бактериальным сепсисом. Общее количество композиции, которая должна вводиться при практическом применении способа настоящего изобретения, может быть введено индивидууму в виде единичной дозы, либо как импульсное введение (в форме пилюли), либо вливанием в течение относительно короткого периода времени, и за этим может следовать введение одной или нескольких бустерных доз в течение некоторого периода времени. Количество композиции, необходимой для стимуляции иммунного ответа у индивидуума, зависит от различных факторов, среди которых возраст и общее состояние здоровья индивидуума, а также путь введения и число лечебных воздействий, которые необходимо произвести. В свете этих факторов опытный клиницист сумеет установить необходимую конкретную дозировку. Как правило, рецептуру компо- 14005821 зиции и пути и частоту введения определяют первоначально с помощью клинических испытаний фазы I(см. пример 8) и фазы II. Иммуногенный пептид настоящего изобретения предпочтительно вводят в соответствии с процедурой, достаточной для селективной стимуляции продуцирования IgA в желудочно-кишечном тракте индивидуума и для индуцирования оральной толерантности. Методы индуцирования оральной толерантности скармливанием антигена индивидууму - человеку или животному - хорошо известны (см., например,работу Husby и др.//J. Immunol. 1994. т. 152. с. 4663-4670, которая включена в настоящее описание посредством ссылки). Таким образом, если необходима стимуляция толерантности, пептиды настоящего изобретения можно вводить совместно с иммуностимулятором IgA, индуцирующим переключение с IgM на IgA; это, например, TGF, который может также в организме подавлять активность хелперных Тклеток. Предпочтительно вводить иммуногенный пептид и, если он присутствует, стимулятор образования IgA в тонкий кишечник, чтобы локализовать эффект вакцины в желудочно-кишечном тракте. Однако пептиды настоящего изобретения можно вводить любым другим способом, принятым в иммунотерапии,например, внутрисосудистым, внутрикожным, подкожным, внутримышечным или внутрибрюшинным. Полинуклеотид можно вводить любым путм, обычно используемым для иммунологической процедуры, в частности внутрикожно (см., например, заявку на патент США, регистрационный 08/446691, поданную 7 июня 1995 г., включнную в настоящее описание ссылкой; см. также заявку 08/593554). Согласно приведнным в них описаниям рекомбинантные векторы генной экспрессии вводят путм инъекции, абсорбции или черезкожного переноса в кожу или слизистую хозяина. Условия введения пептида или полинуклеотида настоящего изобретения варьируют в зависимости от их состава, а также от возраста, веса и состояния здоровья пациента. Однако предпочтительный протокол введения пептида включает ежедневное оральное (или в тонкий кишечник) введение иммунологически эффективных доз вакцины, в сочетании с другими формами или без других форм терапии, как описано выше, или в сочетании с обычными противовоспалительными лекарствами (например, использование стероидных или нестероидных противовоспалительных лекарств и/или анальгетиков). В зависимости от частоты дозировок, иммунологически эффективная доза каждой пептидной вакцины настоящего изобретения составляет от приблизительно 10 мкг до 100 мг, в общем случае приблизительно от 100 мкг до 100 мг, обычно приблизительно от 1 мг до 50 мг и, в частности, приблизительно 25 мг антигенного белка или пептида. Суточная дозировка антигенного пептида обычно вводится в количестве приблизительно 1 мг в день. Дозировка полинуклеотида, подлежащего введению согласно способу настоящего изобретения,варьируется в зависимости от необходимой реакции хозяина и уровней генной экспрессии, достижимой с используемым вектором. Обычно для введения голого полинуклеотида внутрикожным путм можно вводить в единичной дозе количество полинуклеотида, достигающее приблизительно от 100 до 200 мкг,хотя для индуцирования длительного иммунного ответа достаточно введения через кожу или слизистую всего лишь приблизительно 0,3 мкг полинуклеотида. Для целей настоящего изобретения достаточно,однако, чтобы голые векторы генной экспрессии были введены в достаточной дозировке, чтобы обеспечить экспрессию кодируемого иммуногенного пептида. Эти дозировки можно менять для достижения различных уровней экспрессии, обеспечивая таким образом иммунизирующее количество или обеспечивающее толерантность количество. Способы проверки наличия и количества экспрессированных пептидов хорошо известны специалистам в данной области и включают, например, иммунологические анализы, такие как твердофазные иммуносорбентные анализы с участием фермента (enzyme-linked immunosorbent assay, ELISA), методы с применением полимеразной цепной реакции (ПЦР) и иммуногистологические анализы. Дозировки вводимого полинуклеотида могут быть установлены таким образом, чтобы достигнуть необходимого уровня экспрессии на основании результатов этих методов детектирования и количественного определения, а также по клиническим признакам in vivo, известным имеющим опыт специалистам в клинической практике. В композицию вместе с пептидом или полинуклеотидом настоящего изобретения могут быть включены традиционные дозировки иммуностимулятора или иммуносупрессора или они могут быть введены отдельно до, одновременно или после введения пептида. Это может быть, например, IL-6 в дозировке от 1 до 100 мкг/кг. Такие дозировки будут основаны на информации, известной в данной области, или они легко могут быть установлены с помощью обычно используемых на практике методов. Лечение пациентов, начатое на ранней стадии болезни, может быть проведено до суррогатной конечной точки, может быть проведено через не или продолжено за не. Введение пептида или полинуклеотида настоящего изобретения индивидууму, предрасположенному к болезни, но ещ не болевшему, может быть осуществлено кратковременным введением одной или нескольких дозировок композиции, достаточных для того, чтобы вызвать заметное повышение количества, например, IgA к пептиду dnaJ в жидкости желудочно-кишечного тракта или кровотоке в периферических сосудах пациента. Обычно вакцины настоящего изобретения предпочтительно используются у пациентов с заболеванием на ранней его стадии. Эффективность терапевтического способа настоящего изобретения на протяжении времени может быть идентифицирована по отсутствию симптомов или клинических признаков иммунологического рас- 15005821 стройства у индивидуума, предрасположенного к данному расстройству, но ещ не имевшего признаков или симптомов расстройства к моменту начала терапии. У пациентов, имевших по диагнозу иммунологическое расстройство или иное болезненное состояние, при котором требуется модулировать иммунный ответ, эффективность способа настоящего изобретения может быть оценена путм измерения снижения у индивидуума остроты признаков или симптомов или по достижению суррогатной конечной точки заболевания. Что касается иммунологического расстройства (такого как аутоиммунный артрит), обычные параметры клинических признаков и симптомов артрита, а также суррогатных точек окончания заболевания,хорошо известны специалистам в данной области и включают, например, проведение измерений показателя Ритчи для болезненности суставов (Ritchie и др.//Quart. J. Med. 1968. т. 37, с. 393-406), измерение числа распухших суставов, суточную длительность утренней тугоподвижности суставов, силу внезапной резкой боли или интенсивность боли по визуальной аналоговой шкале (Huskisson//Lancet. 1974, т, 2. с. 1127-1131) и измерение пациентом относительных уровней полезности антивоспалительного агента или анальгетика. Дополнительные удобные клинические параметры, за которыми можно следить, включают,например, длительность заболевания, скорость осаждения эритроцитов (РОЭ), уровень С-реактивного белка (CRP), число активных суставов (NAA), величину (остроту) суставного индекса (CSA), интервал ремиссии, данные анкетирования Children's Health Assessment Questionnaire (CHAQ) и реакцию на лечение пептидом dnaJ (отношение числа восприимчивых к лечению к числу невосприимчивых). На основании результатов клинических испытаний с двойной шифровкой экстракта Е. coli (Brackerts и др.//J. Rheum. 1989, т. 16, с. 19-23) было сделано заключение, что следует ожидать, что введение композиции настоящего изобретения может вызвать минимальные побочные эффекты или же вообще их не вызвать. Например, может возникать раздражение желудочно-кишечного тракта, но можно ожидать,что оно будет слабым. Токсичность этих композиций можно отслеживать обычными способами, такими как периодическое лабораторное обследование путм анализа таких переменных, как гематокрит, уровни гемоглобина, тромбоцитов и ревматоидного фактора, а также химия крови. Для других иммунологических нарушений или других болезненных состояний, при которых необходимо модулировать иммунный ответ индивидуума, следует отслеживать характерные для этого заболевания признаки и симптомы. Настоящее изобретение предлагает также способ модуляции способности к реагированию (реактивности) иммуноэффекторных клеток. Такой способ может быть осуществлн, например, приведением иммуноэффекторных клеток в контакт с пептидной частью БТШ dnaJ или с полинуклеотидом, кодирующим такой пептид. БТШ dnaJ, из которого получен пептид, может быть любым БТШ dnaJ, как раскрывается здесь или известно из данной области, и может (но не обязательно) быть включн в состав композиции, которая может содержать также при необходимости иммуноадъювант или иной иммуномодулирующий агент, например один или несколько цитокинов. Иммуноэффекторные клетки, которыми могут быть любые клетки, участвующие в опосредованном Т-клетками иммунном ответе, в том числе антигенпредъявляющие клетки, такие как дендритные клетки, и, в особенности, Т-клетки, могут быть приведены в контакт с пептидом in vivo введением пептида индивидууму или же могут быть приведены в контакт invitro. В том случае, когда иммуноэффекторные клетки приведены в контакт in vitro (или ex vivo), способ может дополнительно включать введение контактированных иммуноэффекторных клеток индивидууму,что обеспечивает способ модуляции у индивидуума иммунного ответа. Иммуноэффекторные клетки могут быть аутологичными (собственными) клетками, которые были извлечены из пациента, приведены в контакт с пептидом ex vivo, а затем введены обратно индивидууму. Такой способ имеет то преимущество, что можно при необходимости предоставить возможность иммуноэффекторным клеткам пролиферировать in vitro, а затем размноженные клетки могут быть введены индивидууму. Иммуноэффекторные клетки могут также быть аллогенными по отношению к индивидууму, например, это могут быть клетки,отобранные у индивидуума, родственного данному индивидууму и имеющего с ним общие гаплотипы,или клетки, отобранные из популяции клеточных линий, для которых гаплотипы известны и которые по отношению к индивидууму могут быть хотя бы частично гаплотипными. Такие клетки при введении индивидууму могут модулировать иммунный ответ у индивидуума путм усиления или индуцирования у индивидуума воспалительной реакции, или путм ослабления или подавления у индивидуума воспалительной реакции. Следующие далее примеры предназначены для иллюстрации изобретения, но не ограничивают его. Описание примеров осуществления изобретения Пример 1. Клеточный иммунный ответ на рекомбинантный dnaJ E. Coli. Пролиферативные реакции одноядерных клеток периферической крови (ОКПК) от 10 здоровых индивидуумов (контроль) и 21 пациента с олигоартикулярным юношеским идиопатическим артритом(оЮИА) на рекомбинантный БТШ dnaJ E. coli (dnaJ) не были достоверно различными (фиг. 1 А). Чтобы определить, повышается ли содержание специфических к dnaJ Т-клеток в синовиальных центрах воспаления, одноядерные клетки синовиальной жидкости (ОКСЖ) всех пациентов с оЮИА стимулировали белком dnaJ в течение 96 ч. Средний индекс стимуляции (ИС) ОКСЖ был достоверно выше, чем ИС соответствующих ОКПК (р = 0,01; фиг. 1 А). Кроме того, после стимуляции dnaJ процент активированных- 16005821 Т-клеток, идентифицированных как клетки CD3+CD69+ был в ОКСЖ достоверно выше (р = 0,0002), чем в ОКПК (фиг. 1 В). Чтобы подтвердить, что повышенная реакция ОКСЖ на dnaJ не является вторичным эффектом неспецифического повышения реактивности ОКСЖ, определяли пролиферативные реакции клеток обоих подразделений на посторонний для данного процесса анатоксин столбняка (ТТ). Пролиферативная реакция на ТТ имела тенденцию быть выше в ОКСЖ (средний ИС = 6,0) по сравнению с ОКПК (средний ИС= 12,3). Чтобы сравнить различия в реакциях ОКПК и ОКСЖ на dnaJ и ТТ, рассчитывали соотношение значений индекса стимуляции, полученных в двух подразделениях для каждого из двух антигенов. Как показано на фиг. 1 С, отношение ИС ОКСЖ/ИС ОКПК было существенно (р = 0,038) выше после стимуляции dnaJ, чем после стимуляции ТТ. Продуцирование провоспалительных цитокинов интерферона-гамма (ИФН) и фактора-альфа некроза опухолей (TNF), а также антивоспалительных цитокинов интерлейкина-4 (IL-4) и IL-10 оценивали в надосадочных жидкостях культур ОКПК от здоровых контрольных индивидуумов и в спаренных образцах ОКПК-ОКСЖ от пациентов с оЮИА, инкубированных в течение 72 ч с и без dnaJ. Как показано на фиг. 2, не было разницы в продуцировании цитокинов в ОКПК пациентов и контрольных индивидуумов. Анализ парных образцов ОКПК-ОКСЖ на продуцирование цитокинов показал, что стимуляция dnaJ индуцировала значительно более высокое продуцирование (р 0,01) ИФН в ОКСЖ, чем в ОКПК от пациентов с оЮИА; продуцирование ИФН имело достоверную обратную корреляцию с длительностью заболевания (R = -0,40, р = 0,034). Продуцирование TNF и IL-10 было сопоставимо в обоих подразделениях. Уровни IL-4 были ниже предела обнаружения в надосадочных жидкостях ОКПК и ОКСЖ как у контрольных индивидуумов, так и у пациентов. В табл. 1 представлены результаты измерения продуцирования провоспалительных и антивоспалительных цитокинов в надосадочной жидкости культур ОКСЖ от пациентов с оЮИА, инкубированных в течение 72 ч в присутствии рекомбинантного белка dnaJ E coli, затем повторно стимулированных с аутологичными облучнными подпитывающими клетками в присутствии или в отсутствие не имеющего отношения к данному процессу контрольного пептида - овальбумина OVA, или в присутствии полученных из БТШ dnaJ E. coli пептидов в течение 72 ч. Результаты приведены с размерностью пг/мл как средние значениястандартное отклонение. Таблица 1 Продуцирование провоспалительных и антивоспалительных цитокинов Эти результаты показывают, что пролиферативная реакция и продуцирование ИФН в ответ на действие dnaJ выше в синовиальном подразделении, чем в периферической крови пациентов с оЮИА, и указывают на то, что БТШ dnaJ E. сoli, или гомологичный белок, или его пептидная часть могут играть роль в воспалительном процессе в суставах. Пример 2. Клеточный иммунный ответ на синтетические пептиды, полученные из рекомбинантного белка dnaJ Е. coli. Чтобы идентифицировать возможные имеющие отношение к делу эпитопы на бактериальном белкеdnaJ, ОКПК и ОКСЖ пациентов с оЮИА инкубировали в течение 72 ч с dnaJ и повторно стимулировали в течение 96 ч с аутологичными подпитывающими клетками в присутствии или в отсутствие полученных из dnaJ E. coli пептидами, связывающимися с молекулами II класса главной системы тканевой совместимости (ГСТС). Всего были испытаны 8 пептидов, в том числе три пептида (рер 4, рер 22, рер 174), полученные из N-концевой области dnaJ Е. coli и имеющих гомологии аминокислотной последовательности с каждой из трх изоформ человеческого dnaJ (HDJ1, HDJ2, HSJ1; гомологичные пептиды), и пять пептидов, полученных из С-концевой области dnaJ E. coli и не имеющих никакой гомологии с человеческими двойниками (рер 61, рер 209, рер 242, рер 264, рер 268; негомологичные пептиды). Результатом стимуляции ОКПК полученными из dnaJ E. coli пептидами явились очень слабые пролиферативные реакции (ИС 1) и практическое отсутствие продуцирования провоспалительных и антивоспалительных цитокинов. Наоборот, ОКСЖ давали пролиферацию в ответ на все пептиды, хотя и в- 17005821 различной степени, со средним ИС 6 в присутствии пептидов 22, 61, 174 или 268 (фиг. 3). Чтобы оценить специфичность реакций, ОКСЖ инкубировали с dnaJ, затем повторно стимулировали в присутствии не относящегося к данному процессу пептида OVA. ОКСЖ от пациентов АЧЛ В 27+ (n = 4), не имевших оЮИА, имели среднее значение ИС 3 в ответ на каждый из бактериальных пептидов. Результаты позволяют предположить, что сильный пролиферативный ответ на пептиды, полученные из dnaJ E. coli,являются специфичными по отношению к заболеванию. Продуцирование цитокинов в ответ на те же пептиды было определено в надосадочных жидкостях культур ОКСЖ от пациентов с оЮИА. Как показано в табл. 1, продуцирование провоспалительных цитокинов было заметным после контакта с полученными из dnaJ E. coli пептидами. ОКСЖ только у одного из 21 пациента с оЮИА продуцировали заметные количества антивоспалительного цитокина IL-10, и ни одна из культур не продуцировала заметных количеств IL-4. Из всех испытанных провоспалительных цитокинов продуцирование ИФН достоверно коррелировалось с пролиферативными реакциями на все бактериальные пептиды, кроме пептидов 4 и 264 (табл. 2). Корреляция была сильнее для пептидов 22, 61, 174 и 268, которые индуцировали ИС 6, что указывает на то, что эти пептиды могут доставлять нужные мишенные эпитопы в центры воспаления. Кроме того,продуцирование ИФН в ответ на стимуляцию пептидами 209, 242 или 264 достоверно коррелировалось с величинами CRP и РОЭ. Табл. 2 показывает корреляцию между уровнями продуцирования ИФН в надосадочных жидкостях культур ОКСЖ пациентов с оЮИА, стимулированных рекомбинантным dnaJE. coli, затем повторно стимулированных с облучнными аутологичными подпитывающими клетками в присутствии или в отсутствие полученных из БТШ dnaJ E. coli, и индексом стимуляции (ИС) после стимуляции ОКСЖ теми же пептидами и величинами РОЭ и CRP. Таблица 2 Корреляции (по тесту Спирмана) обозначает бактериальные пептиды, имеющие гомологию последовательности с пептидами, полученными из трх человеческих изоформ БТШ dnaJ E. coli; НД - нет достоверной корреляции Пример 3. Клеточные иммунные реакции на пептиды человека HSJ1, HDJ1 или HDJ2, гомологичные или негомологичные БТШ dnaJ E. сoli. Чтобы оценить, могут ли человеческие гомологичные пептиды быть мишенью для перекрстного распознавания, ведущего к способности реагировать на свои белки, были изучены человеческие пептиды, полученные из участков HSJ1, HDJ1 или HDJ2, имеющих гомологию последовательности с dnaJ E.coli. ОКСЖ 14 пациентов с оЮИА, дающие ИС более 3 при стимуляции рекомбинантным БТШ dnaJ Е.coli, повторно стимулировали в течение 96 ч с аутологичными клетками в присутствии или в отсутствие человеческих пептидов 2, 3 или 5 - гомологов бактериального пептида 4; человеческих пептидов 20, 21 или 23 - гомологов бактериального пептида 22; или человеческих пептидов 164, 167 или 176 - гомологов бактериального пептида 174. Пролиферативные реакции ОКСЖ, продуцирование провоспалительных цитокинов и уровни антивоспалительного IL-4 были полностью подобны для пептидов, полученных из человеческих белков dnaJ, и гомологичных бактериальных пептидов. Табл. 3 показывает пролиферативные реакции и продуцирование цитокинов в ОКСЖ пациентов с оЮИА, инкубированных в течение 72 ч с рекомбинантным БТШ dnaJ Е. coli и затем повторно стимулированных с аутологичными подпитывающими клетками в присутствии или в отсутствие полученных изdnaJ E. coli пептидов или гомологичных пептидов, полученных из изоформ человеческого dnaJ (HSJ1,HDJ1 или HDJ2). Результаты представлены как ИС или величинами с размерностью пг/мл (средние значениястандартное отклонение). Единственное отличие наблюдалось для пептида 5, который индуцировал пролиферативную реакцию и продуцирование ИФН, значительно большие (соответственно р 0,03 и р 0,05), чем были обнаружены в ответ на действие его бактериальных гомологов. Похожие результаты наблюдались, когда оценивали реактивность 9 человеческих пептидов, полученных из областей белков HSJ1, HDJ1 или HDJ2,которые не имеют гомологий с БТШ dnaJ Е. coli. В противоположность результатам, полученным с бактериальными пептидами, продуцирование IL-10 было заметным, хотя и в разной степени, в надосадочных жидкостях культур ОКСЖ, стимулированных человеческими пептидами, в том числе пептидами,гомологичными или негомологичными бактериальному пептиду. Среднее продуцирование IL-10 после стимуляции негомологичными человеческими пептидами было выше (27,110,3 пг/мл), чем гомологичными человеческими пептидами (7,77,0 пг/мл, фиг. 4), и было особенно очевидно для гомологичных человеческих пептидов 20, 21 и 23, которые подобно их бактериальному гомологу (пептид 22) не индуцировали заметных уровней IL-10 (фиг. 4). Эти опыты с картированием эпитопов показывают, что с различными пептидами получаются различные биологические эффекты, и что эффекты специфичны для заболевания. Эти результаты показывают, что иммунные реакции на пептиды из различных изоформ человеческих белков dnaJ, индуцированные в сравнении с dnaJ Е. coli, могут играть регуляторную роль, опосредованную продуцированием антивоспалительного IL-10, тогда как провоспалительная реакция на БТШdnaJ E. coli может быть осуществлена бактериальными пептидами и гомологичными, имеющими отношение к этому процессу эпитопами на пептидах из их человеческих аналогов. Этот результат был подтверждн при исследовании продуцирования IL-10 у трх пациентов, имевших в момент отбора образцов развитый олигоартрит, причм в надосадочных жидкостях культур, стимулированных бактериальными или человеческими пептидами, обнаруживалось сниженное продуцирвоание IL-10, в особенности в ответ на человеческие пептиды 50, 254, 256 и 283, которые не гомологичны пептидам, полученным из БТШdnaJ E. coli. Пример 4. Пролиферация и продуцирование цитокинов в ответ на человеческие негомологичные пептиды. Дополнительные пептиды, в том числе набор человеческих пептидов из негомологичных областей изоформ для пептидов бактериального dnaJ, были испытаны как описано выше. На фиг. 6 показаны ИС для негомологичных пептидов 50, 51, 134, 197, 254, 256, 270, 283 и 318. Уровни образования ИФН,TNF и IL-10 в ответ на эти пептиды показаны соответственно на фиг. с 7 по 9. Пример 5. Пролиферация и продуцирование цитокинов в ответ на бактериальные пептиды и их человеческие гомологи. Исследовали пролиферацию и продуцирование цитокинов в ответ на стимуляцию различными бактериальными пептидами и сравнивали это с реакцией на стимуляцию человеческими гомологами этих бактериальных пептидов. Фиг. 10 показывает ИС в ответ на бактериальный dnaJ 4 и человеческие гомологичные пептиды 2 (HSJ1), 3 (HDJ1) и 5 (HDJ2). На фиг. с 11 по 13 показаны соответственно уровниTNF, ИФН и IL-10 в ответ на эти пептиды. Для сравнения на фиг. 14 представлен ИС в ответ на бактериальные пептиды dnaJ 4, 22, 61, 174, 209, 242, 264 и 268. На фиг. с 15 по 18 представлены соответственно ИС и уровни TNF, ИФН и IL-10 в ответ на бактериальный dnaJ 174 и на гомологичные человече- 19005821 ские пептиды 164 (HSJ1), 167 (HDJ2) и 176 (HSJ1). На фиг. с 19 по 22 представлены соответственно ИС и уровни TNF, ИФН и IL-10 в ответ на бактериальный dnaJ 22 и на гомологичные человеческие пептиды 20 (HSJ1), 21 (HDJ1) и 23(HDJ2). Пример 6. Корреляция между анализами in vitro и клиническими последствиями. Результаты определения пролиферации и индуцирования цитокинов, приведнные выше, были сопоставлены с клиническими параметрами у тех же пациентов, в том числе с длительностью заболевания,скоростью осаждения эритроцитов (РОЭ), уровнями С-реактивного белка (C-reactive protein, CRP), числом активных суставов (NAA), величиной суставного индекса (CSA), длительностью периода ремиссии,данными анкетирования Children's Health Assessment Questionaire (CHAQ) и реакцией на лечение пептидом dnaJ (соотношение восприимчивых к лечению и невосприимчивых). Как показано в табл. с 4 по 10, у пациентов с артритом, у которых был эффект лечения пептидом dnaJ, были также получены хорошие результаты при определении пролиферации in vitro и индуцирования цитокинов с использованием их собственных одноядерных клеток со стимуляцией пептидами, которые находятся только в человеческих изоформах (т.е. негомологичными человеческими пептидами). В согласии с этими наблюдениями обследование пациентов, которых лечили пептидами dnaJ и артрит у которых развился до большей степени,чем наличие небольшого числа болезненных суставов (развитый Pauci), показало, что пациенты с развитым Pauci не давали хорошего ответа на негомологичные человеческие пептиды (табл. 11). Таблица 4 Суммарные данные и корреляция с клиническими параметрами у пациентов (n = 21) Таблица 6 Число активных суставов (NAA) Таблица 7 Величина суставного индекса (CSA)- 20005821 Таблица 8 Соотношение числа восприимчивых и числа невосприимчивых к лечению Пример 7. Иммунные реакции на эпитопы бактериального БТШ dnaJ в одноядерных клетках синовиальной жидкости пациентов с оЮИА. Реакции Т-клеток на полный белок теплового шока dnaJ E. coli были преимущественно типа ТН-1(ТН - Т-хелперные клетки) и были ограничены ареалом синовиальной жидкости. Пролиферация Т-клеток(ИС) и продуцирование ИФН были существенно выше для ОКСЖ пациентов с оЮИА по сравнению с ОКПК того же происхождения. Реакции в ОКСЖ пациентов с оЮИА были существенно выше, чем в контрольных культурах ОКСЖ от пациентов с другими заболеваниями, в том числе 14 пациентов с системным и полиартикулярным (многосуставным) ЮИА, для 4 из 8 полученных из бактериального dnaJ пептидов, связывающихся с подтипами DR антигена человеческих лейкоцитов (АЧЛ) (human leukocyteantigen, HLA), испытанных в качестве антигенов для Т-клеток (фиг. 23). Эти реакции имели также провоспалительную природу, что подчркивалось продуцированием ИФН и практическим отсутствием продуцирования регуляторных цитокинов в ответ на действие индивидуальных пептидов in vitro. Такая реактивность была специфичной по отношению к ареалу, антигену и заболеванию, поскольку в ОКПК и ОКСЖ 14 пациентов с другими типами ЮИА, а также контрольной группы здоровых индивидуумов того же возраста реакции были ничтожными. В том случае, когда способность к реакции на испытуемые антигены сравнивали с действием контрольных посторонних пептидов, в том числе связывающегося с подтипами DR антигена человеческих лейкоцитов модельного пептида (pandr) и полученного из E. coli изменнного пептидного лиганда(dnaJpv; см. фиг. 23), были обнаружены достоверные различия. Повышенная реакция ОКСЖ на рекомбинантный dnaJ не была вторичной реакцией на неспецифическое повышение реактивности ОКСЖ. У 7 пациентов с оЮИА испытывали также пролиферативные реакции клеток из обоих ареалов на столбнячный анатоксин (ТТ, посторонний антиген памяти). Чтобы сравнить различия в реакциях ОКПК и ОКСЖ на рекомбинантный dnaJ и ТТ, рассчитывали отношение индексов стимуляции, полученных для двух ареалов в ответ на каждый из двух антигенов. Отношение ИС ОКСЖ к ИС ОКПК было достоверно выше(р 0,02) после стимуляции рекомбинантным dnaJ, чем после стимуляции ТТ. Эти результаты показывают заметную реактивность на эпитопы dnaJ Е. coli в синовиальном ареале пациентов с оЮИА, что указывает на то, что эта реакция может играть роль в месте воспаления. Такая роль может быть связана с модуляцией аутоиммунного воспаления и может быть основана на взаимодействии между различными эпитопами на бактериальном белке и его человеческих эквивалентах, которые могут быть сверхэкспрессированы в синовии. По существу, была испытана идентичность таких предполагаемых эпитопов. Поскольку 2 из 4 иммуногенных бактериальных пептидов (22 и 174) были получены из участков БТШ dnaJ E. coli, имеющих гомологию последовательности с человеческими белками dnaJ (HSJ1, HDJ1 или HDJ2), была оценена возможность перекрстного распознавания, приводящего к реакции на свои белки. Испытывали гомологичные человеческие пептиды 20, 21 и 23 (гомологи бактериального пептида 22), пептиды 164, 167-181 и 176 (гомологи бактериального пептида 174) и негомологичные человеческие пептиды. Эти пептиды выявили реактивность Т-клеток с пролиферацией и продуцированием ИФН, сопоставимыми с таковыми, полученными после стимуляции соответствующими гомологичными бактериальными пептидами. Была обнаружена высокая степень корреляции между ИС и продуцированием ИФН в ответ на эти человеческие пептиды и ИС и продуцированием ИФН в ответ на бактериальные гомологи. Эти результаты указывают на то, что корреляция между реакциями Т-клеток на бактериальные пептиды и их человеческие гомологи основываются на перекрстном распознавании. В противоположность результатам, полученным с бактериальными пептидами, в надосадочных жидкостях культур ОКСЖ, стимулированных полученными из человеческого dnaJ пептидами, были обнаружены заметные уровни IL-10; IL-4 не обнаруживался. Результаты дополнительно демонстрируют, что собственные антигены могут запускать качественно иную реакцию Т-клеток. Для оценки процентного количества CTLA+/CD25/CD4 позитивных клеток после стимуляции типичных ОКСЖ от пациентов с персистирующим оЮИА негомологичным человеческим пептидом 134 был использован анализ методом FACS. Процентное содержание CTLA+/CD25/CD4 позитивных клеток,- 22005821 которые, как полагают, имеют регуляторную функцию, было выше в обработанных пептидом клетках,чем в контрольных клетках (фиг. 24 А). Повышение доли регуляторных клеток в ответ на действие пептида 134 хорошо коррелировало с продуцированием IL-10 при тех же самых условиях культивирования(фиг. 24 В). Эти результаты показывают, что распознавание пептида 134 человеческого dnaJ приводит к развитию регуляторных клеток и продуцированию IL-10. Чтобы проверить наличие корреляции между клиническими проявлениями и развитием индуцированной пептидами иммуномодуляции, пациенты с оЮИА были в зависимости от хода заболевания разделены на группы, содержащие пациентов с персистентным заболеванием (n = 16) и с развитым заболеванием (n= 15) (фиг. 25). Пролиферативные реакции на пептид 134 были достоверно ниже (р = 0,05) в образцах от пациентов с развитым заболеванием, чем в образцах от пациентов с персистентным оЮИА(фиг. 25 А и 25 В). Что касается продуцирования ИФН, то степень достоверности различий была минимальной (р = 0,076). Если же рассматривалось продуцирование IL-10, то степень достоверности различий была высокой (р = 0,0012; см. фиг. 25 С). Чтобы дополнительно проанализировать возможные связи с более мягкой степенью заболевания, в качестве меры степени воспалительной активности в индивидуальных суставах была выбрана длительность клинической ремиссии исследуемого сустава после внутрисуставного введения пригодного к инъекции стероида ТХА. Была обнаружена высокая степень корреляции между продуцированием IL-10 в ответ на негомологичный человеческий пептид 134 и длительностью клинической ремиссии индивидуального сустава (R = 0,537, р = 0,026). Эти результаты показывают, что с временным ослаблением заболевания связано распознавание иммуномодулирующих собственных эпитопов. Пример 8. Пептид dnaJP1 обеспечивает наличие провоспалительного эпитопа у пациентов с ревматоидным артритом. Был идентифицирован пептид из белка теплового шока dnaJ, действующий как агент (триггер),приводящий в действие пролиферацию Т-клеток и продуцирование провоспалительных цитокинов клетками периферической крови и синовиальной жидкости пациентов с ревматоидным артритом (РА). Этот пептид dnaJP1 (QKRAAYDQYGHAAFE; SEQ ID NO: 27) имеет гомологию последовательности с общим эпитопом, который является общим участком из 5 аминокислот среди аллелей АЧЛ, связанных с РА (работа Albani и др.//Nat. Med. 1995, т. 1, с. 448-452, включнная в настоящее описание посредством ссылки). Было предпринято изучение того, действительно ли взаимодействие между АЧЛ и полученными из dnaJ пептидами при РА поддерживает и стимулирует Т-клетки, участвующие в аутоиммунном воспалении. Такая популяция Т-клеток была объектом исследования в 1-й фазе клинического изучения стимуляции иммунной толерантности. В 1-й фазе клинического изучения 15 пациентов с РА получали три различных дозы dnaJPI (4 раза в день перорально) в течение 6 месяцев. Исходные критерии требовали наличия клинически активной стадии болезни и провоспалительной реакции Т-клеток на пептид in vitro. Как показано на фиг. 26, формирование в слизистой оболочке толерантности к dnaJPI индуцировало резкий иммунный сдвиг от провоспалительных цитокинов к цитокинам регуляторного типа. Иммунные изменения индуцировались введением препарата и были специфичными к введению препарата. Хотя описание настоящего изобретения основывается на приведнных выше примерах, понятно,что возможные модификации и изменения охватываются идеей и объемом изобретения. Соответственно,объем изобретения определяется следующей формулой изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Композиция, включающая физиологически приемлемый носитель и по меньшей мере один вид существенно очищенного пептида, включающего аминокислотную последовательность, выбранную из любой из последовательностей с SEQ ID NO: 1 по SEQ ID NO: 26. 2. Химерный полипептид, включающий пептид, как он определен в п.1, связанный по меньшей мере с одним гетерологичным полипептидом. 3. Композиция по п.1, отличающаяся тем, что дополнительно включает иммуноадъювант. 4. Композиция по п.3, отличающаяся тем, что иммуноадъювант представляет собой цитокин. 5. Композиция по п.1, отличающаяся тем, что вид существенно очищенного пептида имеет аминокислотную последовательность, по существу состоящую из QKRAAYDQYGHAAFEQ (SEQ ID NO: 3). 6. Композиция по п.1, отличающаяся тем, что применяется для модуляции иммунного ответа. 7. Композиция по п.6, отличающаяся тем, что модуляция иммунного ответа включает усиление или индуцирование воспалительной реакции у индивидуума. 8. Композиция по п.6, отличающаяся тем, что модуляция иммунного ответа включает ослабление или подавление воспалительной реакции у индивидуума. 9. Композиция по п.6, отличающаяся тем, что иммунный ответ вызывают у индивидуума, имеющего иммунологическое расстройство. 10. Композиция по п.9, отличающаяся тем, что иммунологическое расстройство представляет собой аутоиммунное заболевание.- 23005821 11. Композиция по п.10, отличающаяся тем, что аутоиммунное заболевание является заболеванием,выбранным из группы, включающей артрит, диабет, воспалительное заболевание кишечника и рассеянный склероз. 12. Композиция по п.6, отличающаяся тем, что иммунный ответ вызывают у индивидуума, имеющего инфекционное заболевание. 13. Композиция по п.6, отличающаяся тем, что иммунный ответ вызывают у индивидуума, имеющего рак. 14. Композиция по п.1, отличающаяся тем, что пептид кодирован полинуклеотидом. 15. Композиция по п.1, отличающаяся тем, что применяется для модуляции реактивности иммуноэффекторных клеток у индивидуума. 16. Композиция по п.15, отличающаяся тем, что иммуноэффекторные клетки являются аутологичными для индивидуума. 17. Композиция по п.15, отличающаяся тем, что иммуноэффекторные клетки являются аллогенными для индивидуума. 18. Композиция по п.15, отличающаяся тем, что иммуноэффекторные клетки выбраны из группы,включающей В-лимфоциты (В-клетки), дендритные клетки, одноядерные фагоцитные клетки, макрофаги, клетки Лангерганса, клетки эндотелия венул, Т-хелперные клетки, Т-супрессорные клетки и цитотоксичные Т-клетки. 19. Композиция по п.15, отличающаяся тем, что иммуноэффекторные клетки представляют собой Т-клетки. 20. Композиция по п.15, отличающаяся тем, что она дополнительно включает иммуноадъювант.
МПК / Метки
МПК: A61K 38/10, C12N 15/00, C07K 7/08
Метки: применение, пептиды, теплового, шока, иммуномодулирующие, полученные, белков
Код ссылки
<a href="https://eas.patents.su/30-5821-immunomoduliruyushhie-peptidy-poluchennye-iz-belkov-teplovogo-shoka-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Иммуномодулирующие пептиды, полученные из белков теплового шока, и их применение</a>
Предыдущий патент: Агонисты и антагонисты рецепторов 5-ht2c
Следующий патент: Терапия глиобластомы тимозином -α-1
Случайный патент: Композиция для предупреждения или восстановления возрастных функциональных дефицитов у млекопитающих и способ ее применения