Агонисты и антагонисты рецепторов 5-ht2c
Номер патента: 5820
Опубликовано: 30.06.2005
Авторы: Тор Маркус, Пелькман Беньямин, Рингберг Эрик, Йенссон Маттиас, Нильссон Йонас, Нильссон Бьерн, Тейбрант Ян
Формула / Реферат
1. Соединение общей формулы (Ib)

где X1 представляет -O-, -S- или -N(R27)-;
Y1 представляет -O-, -S-, -N(R27)- или -CH2-;
Ra представляет C3-8-циклоалкил, арил или гетероарил, каждый из которых может быть, необязательно, замещен в одном или в нескольких положениях независимо друг от друга C1-6-алкилом, C1-6-алкокси, фтор-C1-6-алкокси, 2,2,2-трифторэтокси, C3-5-алкинилокси, C3-5-алкенилокси, диметиламино-C1-6-алкокси, метиламино-C1-6-алкокси, C1-6-алкилтио, фторметилом, дифторметилом, трифторметилом, фторметилтио, дифторметокси, дифторметилтио, трифторметокси, трифторметилтио, галогеном, гидрокси, нитро, циано, трифторметилсульфонилокси, C1-6-алкилсульфонамидо, C2-6-алкенилом, C2-6-алкинилом, C1-6-ацилом, C1-6-алкилкарбонил-C1-6-алкилом, C1-6-алкилсульфонилом, C1-6-алкилсульфонилокси, C1-6-алкокси-C1-6-алкилом, C1-6-алкоксикарбонилом, C1-6-алкоксикарбонил-C1-6-алкилом, C1-6-ацилокси-C1-6-алкилом, гидрокси-C1-6-алкилом, гидрокси-C1-6-алкокси, C1-6-алкокси-C1-6-алкокси, C1-6-алкокси-C1-6-алкилтио, гидрокси-C1-6-алкилтио, гетероарил-C1-6-алкилтио, арил-C1-6-алкилтио, C1-6-алкокси-C1-6-алкиламино, N-(C1-6-алкокси-C1-6-алкил)-N-метиламино, C3-6-циклоалкил-C1-6-алкокси, арил-C1-6-алкокси, гетероциклил-C1-6-алкокси, C3-8-циклоалкилом, C3-8-циклоалкилокси, арилом, арилокси, арилтио, арилсульфонилом, арил-C1-6-ацилом, арил-C1-6-алкилом, арил-C2-6-алкенилом, арил-C2-6-алкинилом, гетероциклил-C1-6-алкилом, гетероциклил-C2-6-алкенилом, гетероциклил-C2-6-алкинилом, гетероциклилом, гетероциклилокси, гетероциклилтио, гетероциклилсульфонилом, гетероциклиламино, гетероциклил-C1-6-ацилом, -N(R2)(R3) или -CON(R7)(R8), где любые циклоалкильные, арильные и гетероциклильные остатки в качестве заместителей на ариле или гетероариле или в качестве частей заместителей на ариле или гетероариле, в свою очередь, могут быть замещенными в одном или нескольких положениях, независимо друг от друга, C1-4-алкилом, C1-4-алкокси, метансульфонамидо, C1-4-алкилтио, C1-4-алкилсульфонилом, C1-4-ацилом, гетероциклилом, гетероциклилокси, гетероциклилтио, арилокси, арилтио, фторметилом, трифторметилом, трифторметокси, трифторметилтио, галогеном, гидрокси, нитро, циано, -N(R2)(R3) или для C3-8-циклоалкила и частично или полностью насыщенного гетероциклила, оксо или гидрокси;
R2 и R3 независимо друг от друга представляют водород, C1-6-алкил, C1-6-ацил, -CON(R7)(R8), арил, гетероциклил, арил-C1-6-алкил, гетероциклил-C1-6-алкил, арил-C1-6-ацил или гетероциклил-C1-6-ацил, где любые арильные или гетероциклильные остатки, в свою очередь, могут быть замещены в одном или нескольких положениях, независимо друг от друга, галогеном, C1-4-алкилом, C1-4-алкокси, C1-4-алкилтио, C1-4-алкилсульфонилом, метансульфонамидо, нитро, циано, гидрокси, трифторметилом, трифторметокси, трифторметилтио или -N(R2)(R3); или R2 и R3 вместе с атомом азота, с которым они связаны, образуют насыщенное гетероциклическое кольцо, имеющее 4-7 членов в кольце и необязательно содержащее дополнительный гетероатом, и это кольцо может быть замещено C1-6-алкилом, C1-6-алкокси, оксо или гидрокси;
R7 и R8 независимо друг от друга представляют водород, C1-6-алкил, арил, гетероарил, арил-C1-4-алкил или гетероарил-C1-4-алкил, где арильные и гетероарильные остатки, в свою очередь, могут быть замещены в одном или нескольких положениях независимо друг от друга галогеном, C1-6-алкилом, C1-6-алкокси, C1-6-алкилтио, C1-6-алкилсульфонилом, метансульфонамидо, нитро, циано, гидрокси, трифторметилом, трифторметокси, трифторметилтио или -N(R2)(R3); или R7 и R8 вместе с атомом азота, с которым они связаны, образуют насыщенное гетероциклическое кольцо, имеющее 4-7 членов в кольце и необязательно содержащее дополнительный гетероатом;
R20 и R21 независимо друг от друга представляют водород, галоген или C1-4-алкил; или R20 и R21 вместе с атомами углерода, с которыми они связаны, образуют бензол с получением хиноксалинового кольца, необязательно моно- или дизамещенные галогеном, или образуют тиофен, с получением тиено[3,4-b]пиразинового кольца;
R22 представляет водород, гидрокси, C1-4-алкил или C1-4-алкоксикарбонил;
R23 и R24 независимо друг от друга представляют водород или C1-4-алкил;
R25 представляет водород или C1-4-алкил;
R26 представляет водород, C1-4-алкил или связан с углеродным атомом в Ra, соседним с атомом, связанным с Y1, образуя 5- или 6-членное кольцо, которое может содержать 0, 1 или 2 гетероатома, причем указанное кольцо необязательно замещено метилом;
R27 представляет водород или C1-4-алкил, предпочтительно метил или этил; и
y и z независимо друг от друга равны 1 или 2,
причем принимается, что в вышеуказанных определениях
термин "арил" означает моноциклические или бициклические ароматические кольца, содержащие от 6 до 10 атомов углерода в кольце;
термин "гетероарил" означает моноциклическую, бициклическую или трициклическую ароматическую структуру, в которой только одно кольцо является ароматическим, а замещения возможны в любом кольце, содержащую от 5 до 14 атомов в кольце, в которой 1 или несколько атомов в кольце(ах) являются иными, чем углерод, и выбираются из азота, серы, кислорода и селена;
термин "гетероциклил" означает полностью ненасыщенные (т.е. ароматические), а также частично или полностью насыщенные моно-, би- и трициклические структуры, содержащие от 4 до 14 атомов в кольце и содержащие 1 или несколько гетероатомов, выбранных из кислорода, серы и азота;
и его фармацевтически приемлемые соли, гидраты, геометрические изомеры, таутомеры, оптические изомеры, N-оксиды и пролекарственные формы.
2. Соединение по п.1, где Ra выбирают из арила и гетероарила.
3. Соединение по п.2, где Ra выбирают из фенила и пиридила.
4. Соединение по любому из пп.1-3, где R22 представляет водород.
5. Соединение по любому из пп.1-4, где R23 представляет метил, z равно 1 и R24 представляет водород, предпочтительно в (R)-конфигурации.
6. Соединение по любому из пп.1-5, где R25 представляет водород.
7. Соединение по п.1, которое представляет собой
2-(2-фенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2-фторфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(3-цианофенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(3-метоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-[3-(2-гидроксиэтокси)фенокси]этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2,3-дигидро-1,4-бензодиоксин-2-илметил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2-метоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2,5-дифторфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(3,5-диметоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(3,4-дигидро-2H-пиридо[3,2-b]-1,4-оксазин-2-илметокси)-3-(1-пиперазинил)пиразин;
2-метил-1-[3-(2-феноксиэтокси)-2-пиразинил]пиперазин, в частности его (R)-энантиомер;
2-метил-1-{3-[2-(3-пиридинилокси)этокси]-2-пиразинил}пиперазин, в частности его (R)-энантиомер;
2-(хиназолинил-8-илокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(изохинолинил-5-илокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-[2-(3-пиридинилокси)этокси]-3-(1-пиперазинил)-6,7-дифторхиноксалин;
2-[2-(3-пиридинилокси)этокси]-3-(1-пиперазинил)тиено[3,4-b]пиразин,;
2-(3,4-дигидро-2H-1,4-бензоксазин-2-илметокси)-3-(1-пиперазинил)пиразин;
2-метил-1-{3-[2-(2-амино-8-хинолинилокси)этокси]-2-пиразинил}пиперазин, в частности его (R)-энантиомер;
1-{3-[2-(2-метокси-3-пиридинилокси)этокси]-2-пиразинил}пиперазин;
2-метил-1-{3-[2-(2-метокси-3-пиридинилокси)этокси]-2-пиразинил}пиперазин, в частности его (R)-энантиомер;
2-{2-[(2-хлор-3-пиридинил)окси]этокси}-3-(1-пиперазинил)пиразин;
2-{2-[(2-этокси-3-пиридинил)окси]этокси}-3-(1-пиперазинил)пиразин;
1-(3-{2-[(2-этокси-3-пиридинил)окси]этокси}-2-пиразинил)-2-метилпиперазин, в частности его (R)-энантиомер;
2-(2-{[2-(метилсульфанил)-3-пиридинил]окси}этокси)-3-(1-пиперазинил)пиразин;
2-метил-1-[3-(2-{[2-(метилсульфанил)-3-пиридинил]окси}этокси)-2-пиразинил]пиперазин, в частности его (R)-энантиомер;
2-{2-[(2-бром-3-пиридинил)окси]этокси}-3-(1-пиперазинил)пиразин;
1-(3-{2-[(2-бром-3-пиридинил)окси]этокси}-2-пиразинил)-2-метилпиперазин, в частности его (R)-энантиомер;
2-(1-пиперазинил)-3-(2-{3-[2-(2-пиридинил)этокси]фенокси}этокси)пиразин;
2-(2-{3-[2-(4-метил-1,3-тиазол-5-ил)этокси]фенокси}этокси)-3-(1-пиперазинил)пиразин;
2-(1-пиперазинил)-3-{2-[3-(тетрагидро-3-фуранилметокси)фенокси]этокси}пиразин;
2-(1-пиперазинил)-3-{2-[3-(тетрагидро-3-фуранилокси)фенокси]этокси}пиразин;
1-{2-[3-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)фенокси]этил}-2-пирролидинон;
2-{2-[3-(2-метоксиэтокси)фенокси]этокси}-3-(1-пиперазинил)пиразин;
2-{[3-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)фенокси]метил}бензонитрил;
2-(1-пиперазинил)-3-{2-[3-(тетрагидро-2H-пиран-4-илокси)фенокси]этокси}пиразин;
N,N-диметил-N-{2-[3-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)фенокси]этил}амин;
7-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)-2H-хромен-2-он;
1-(3-{2-[(2-хлор-3-пиридинил)окси]этокси}-2-пиразинил)-2-метилпиперазин, в частности его (R)-энантиомер;
7-изохинолинил (2-{[3-(1-пиперазинил)]-2-пиразинил}окси)этиловый эфир;
2-(2-хлор-4-метоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
4-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)-2-хинолинамин,
или его фармакологически приемлемая соль или сольват.
8. Соединение общей формулы (Ib) по п.1
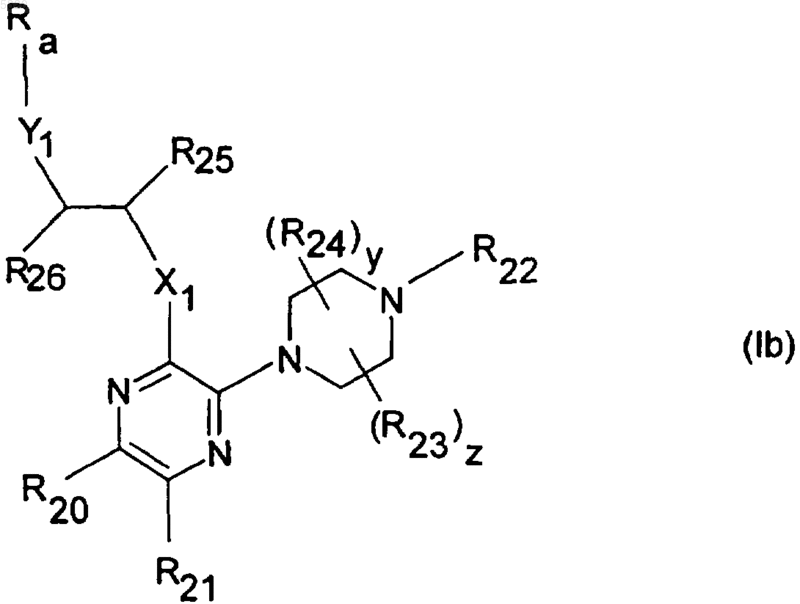
где X1, Y1, R2, R3, R7, R8, R20, R21, R22, R23, R24, R25, R27, y и z определены, как указано в п.1; независимо друг от друга, равны 1 или 2, и
Ra представляет арил или гетероарил, необязательно замещенные группой метил, метокси, галоген, циано, трифторметил, нитро, амино или ацетамидо, и
R26 связан с углеродным атомом в Ra, соседним с атомом, связанным с Y1, таким образом, что образуется 5- или 6-членное кольцо, которое может содержать 0, 1 или 2 гетероатома, причем указанное кольцо необязательно замещено метилом;
и его фармацевтически приемлемые соли, гидраты, геометрические изомеры, таутомеры, оптические изомеры, N-оксиды и пролекарственные формы.
9. Соединение по п.8, где Ra выбирают из фенила и пиридила.
10. Соединение по п.8, где указанная бициклическая кольцевая система, образованная Ra и R26, связанным с углеродным атомом в Ra, соседним с атомом, связанным с Y1, представляет собой 2,3-дигидро-1,4-бензодиоксин, 3,4-дигидро-2H-1,4-бензоксазин, 2,3-дигидро-1,4-бензоксатиин, 3,4-дигидро-2H-пиридо[3,2-b]-1,4-оксазин, 2,3-дигидробензофуран, бензофуран, хроман и тетрагидронафталин.
11. Соединение по п.1, которое представляет собой
2-(2-феноксиэтокси)-3-(1-пиперазинил)хиноксалин;
2-[2-(2-нафтилокси)этокси]-3-(1-пиперазинил)пиразин;
2-(4-бромфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2-хлорфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(4-хлорфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-фенокси-1-метилэтил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2-метоксифенокси)-1-метилэтил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(3-метоксифенокси)-1-метилэтил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2-метилфенокси)-1-метилэтил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(4-метилфенокси)-1-метилэтил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(фенилтио)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
3-фенилпропил 3-(1-пиперазинил)-2-пиразиниловый эфир;
4-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)-1,3-бензоксазол-2-амин;
2-(фенокси)этил 3-(3-метил-1-пиперазинил)-2-пиразиниловый эфир;
2-(4-хлорфенокси)этил 3-(3-метил-1-пиперазинил)-2-пиразиниловый эфир;
2-(2-метоксифенокси)-1-метилэтил 3-(3-метил-1-пиперазинил)-2-пиразиниловый эфир;
2-(фенокси)этил 3-(4-этил-1-пиперазинил)-2-пиразиниловый эфир;
2-(2-хлорфенокси)этил 3-(4-этил-1-пиперазинил)-2-пиразиниловый эфир;
2-(4-хлорфенокси)этил 3-(4-этил-1-пиперазинил)-2-пиразиниловый эфир;
2-(2-метоксифенокси)-1-метилэтил 3-(4-этил-1-пиперазинил)-2-пиразиниловый эфир;
2-(3-бромфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-[2-(2-хлорфенокси)этокси]-3-(1-пиперазинил)хиноксалин;
2-[2-(4-хлорфенокси)этокси]-3-(1-пиперазинил)хиноксалин;
2-[2-(фенилтио)этокси]-3-(1-пиперазинил)хиноксалин;
2-(1-метил-2-феноксиэтокси)-3-(1-пиперазинил)хиноксалин;
2-[1-метил-2-(4-метилфенокси)этокси]-3-(1-пиперазинил)хиноксалин;
2-[2-(2-метоксифенокси)-1-метилэтокси]-3-(1-пиперазинил)хиноксалин;
2-[2-(2-нафтилокси)этокси]-3-(1-пиперазинил)хиноксалин;
2-(4-н-бутоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2-изопропоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(1-нафтилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-[2-(2-метокси-5-нитрофенокси)этокси]-3-(1-пиперазинил)пиразин;
2-(2,3-диметоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2-ацетилфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2-ацетил-5-метоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2-ацетил-3,5-диметоксифенокси)этил (1-пиперазинил)-2-пиразиниловый эфир;
2-(5,6,7,8-тетрагидро-2-нафтилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2-фтор-6-метоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2-метокси-4-метилфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-{2-[2-фтор-5-(трифторметил)фенокси]этокси}-3-(1-пиперазинил)пиразин;
8-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)-2H-1,4-бензоксазин-3(4H)-он;
2-(2,3,6-трифторфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2,4,5-трифторфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2-гидроксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(3-гидроксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-[3-(4-морфолинил)фенокси]этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(1,3-бензодиоксол-4-илокси)этил (1-пиперазинил)-2-пиразиниловый эфир;
2-(2,3-дигидро-1,4-бензодиоксин-5-илокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2-аллилфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(3-аминофенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(1-оксоинданил-4-илокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2,6-дифторфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
5-нитро-8-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)хинолин;
6-метокси-7-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)-2H-хромен-2-он;
4-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)-2,1,3-бензотиадиазол;
5-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)хиноксалин;
1-[7-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)-1-бензофуран-2-ил]-1-этанон;
2-(2-трифторметилфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2-метилтиофенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2-метилфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2,5-диметилфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2-цианофенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-[(1,1'-бифенил)-2-илокси]этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-[2-(2-фтор-5-метилфенокси)этокси]-3-(1-пиперазинил)пиразин;
2-[2-(5-фтор-2-метоксифенокси)этокси]-3-(1-пиперазинил)пиразин;
2-[2-(3-фторфенокси)этокси]-3-(1-пиперазинил)пиразин;
2-[2-(3-ацетилфенокси)этокси]-3-(1-пиперазинил)пиразин;
2-[2-(2,3-дифторфенокси)этокси]-3-(1-пиперазинил)пиразин;
2-[2-(2,3,5-трифторфенокси)этокси]-3-(1-пиперазинил)пиразин;
N-фенил-3-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)анилин;
[3-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)фенил]метанол;
2-{2-[3-(метоксиметил)фенокси]этокси}-3-(1-пиперазинил)пиразин;
3-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)бензамид;
N-фенил-4-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)анилин;
N-[4-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)фенил]ацетамид;
2-(1-пиперазинил)-3-{2-[3-(трифторметокси)фенокси]этокси}пиразин;
2-[2-(3,5-дифторфенокси)этокси]-3-(1-пиперазинил)пиразин;
2-[2-(1,3-бензодиоксол-5-илокси)этокси]-3-(1-пиперазинил)пиразин;
2-[2-(3-ацетамидофенокси)этокси]-3-(1-пиперазинил)пиразин;
2-[4-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)фенокси]этанол;
2-(1-пиперазинил)-3-[3-(2-пиридинил)пропокси]пиразин;
2-(1-пиперазинил)-3-[3-(3-пиридинил)пропокси]пиразин;
2-(1-пиперазинил)-3-[3-(4-пиридинил)пропокси]пиразин;
2-[3-(6-метил-2-пиридинил)пропокси]-3-(1-пиперазинил)пиразин;
2-(5-хинолинилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(6-хинолинилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(7-хинолинилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(8-хинолинилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
5-хлор-8-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)-2-хинолин;
2-(бензофуран-7-илокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
7-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)-1H-индол;
6-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)-1H-индол;
2-метил-5-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)-1,3-бензотиазол;
2-[2-(2-метокси-5-метилфенокси)этокси]-3-(1-пиперазинил)пиразин;
7-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)-1-нафтиламин;
2-(3-пиридилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(4-пиридилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2-пиридилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(6-метил-3-пиридилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2-метил-3-пиридилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(5-хлор-3-пиридилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-[2-(1-бензотиен-3-илокси)этокси]-3-(1-пиперазинил)пиразин;
2-(3-тиенилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(2,3-дигидро-2,2-диметил-7-бензофуранилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-(1,3-бензоксазол-4-илокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
2-[2-(3-пиридинилокси)этокси]-3-(1-пиперазинил)хиноксалин;
2-[2-(3-пиридинилокси)этокси]-3-(1-пиперазинил)-6,7-дифторхиноксалин;
2-[2-(3-пиридинилокси)этокси]-3-(1-пиперазинил)-6,7-дихлорхиноксалин;
2-[2-(5-пиримидинилокси)этокси]-3-(1-пиперазинил)хиноксалин;
(2R)-2-метил-1-(3-{2-[(6-метил-3-пиридинил)окси]этокси}-2-пиразинил)пиперазин;
2-этил-1-{3-[2-(3-пиридинилокси)этокси]-2-пиразинил}пиперазин;
цис-2,6-диметил-1-{3-[2-(3-пиридинилокси)этокси]-2-пиразинил}пиперазин;
N-[8-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)-2-хинолинил]ацетамид;
N-метил-8-(2-{[3-(1-пиперазинил)-2-пиразинил]окси}этокси)-2-хинолинамин;
2-[2-(1,3-бензодиоксол-4-илокси)этокси]-3-(2-метил-1-пиперазинил)хиноксалин;
5,6-диметил-2-(2-феноксиэтокси)-3-(1-пиперазинил)пиразин;
2-(2,3-дигидробензофуран-7-илокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;
5-хлор-2-(1-пиперазинил)-3-[2-(3-пиридинилокси)этокси]пиразин;
5-бром-2-(1-пиперазинил)-3-[2-(3-пиридинилокси)этокси]пиразин;
5-метил-2-(1-пиперазинил)-3-[2-(3-пиридинилокси)этокси]пиразин;
2-{2-[(3-метокси-2-пиразинил)окси]этокси}-3-(1-пиперазинил)пиразин;
5-этокси-3-пиридинил 2-({3-[(2R)-2-метилпиперазинил]-2-пиразинил}окси)этиловый эфир;
3-[(2R)-2-метилпиперазинил]-2-пиразинил 2-(5-пиримидинилокси)этиловый эфир;
2-{2-[(6-хлор-3-пиридинил)окси]этокси}-3-(1-пиперазинил)пиразин;
2-{2-[(6-метокси-3-пиридинил)окси]этокси}-3-(1-пиперазинил)пиразин;
4-метокси-N,N-диметил-3-[2-({3-[(2R)-2-метилпиперазинил]-2-пиразинил}окси)этокси]анилин;
(2R)-метил-1-[3-(2,5-диметоксифеноксиэтокси)-2-пиразинил]пиперазин;
2-[2-(2,3-дигидро-1,4-бензодиоксин-6-илокси)этокси]-3-(1-пиперазинил)пиразин;
2-[3-(2-метоксифенил)пропокси]-3-(1-пиперазинил)пиразин;
(2R)-метил-1-(3-{2-[(1-оксидо-3-пиридинил)окси]этокси}-2-пиразинил)пиперазин;
2-[(2-феноксиэтил)сульфанил]-3-(1-пиперазинил)пиразин;
2-{2-[3-(2-фторэтокси)фенокси]этокси}-3-(1-пиперазинил)пиразин;
2-{2-[3-(циклопропилметокси)фенокси]этокси}-3-(1-пиперазинил)пиразин;
2-{2-[3-(3-бутенилокси)фенокси]этокси}-3-(1-пиперазинил)пиразин;
2-{2-[3-(бензилокси)фенокси]этокси}-3-(1-пиперазинил)пиразин;
2-(фенокси)этил-3-(4-метил-1-пиперазинил)-2-пиразиниловый эфир,
или его фармакологически приемлемая соль или сольват.
Текст
005820 Область техники Настоящее изобретение относится к новым соединениям, фармацевтическим композициям, включающим данные соединения, к способам их получения, а также к использованию соединений для получения лекарственного средства, которое, в частности, оказывает воздействие на центральную нервную систему. Предшествующий уровень техники На многие заболевания центральной нервной системы оказывают влияние системы адренергического, допаминергического и серотонинергического нейротрансмиттера(ов). Например, серотонин причастен к целому ряду заболеваний и состояний, которые возникают в центральной нервной системе. Ряд фармакологических и генетических экспериментов с рецепторами для серотонина указывают на вовлечение в регуляцию поглощения пищи подтипа 5-НТ 2 с указанного рецептора (Obes. Res. 1995, 3, Suppl. 4,449S-462S). Подтип 5-НТ 2 с рецептора транскрибируется и экспрессируется в структурах гипоталамуса,участвующих в регуляции аппетита. Было продемонстрировано, что неспецифический агонист 5-НТ 2 с рецептора, м-хлорфенилпиперазин (мХФП, mСРР), который имеет сродство к 5-НТ 2 с рецептору, вызывает потерю массы тела у мышей, которые экспрессируют нормальный 5-НТ 2 с рецептор, в то время как вышеуказанное соединение не обладает активностью в отношении мышей, экспрессирующих мутированную неактивную форму 5-НТ 2 с рецептора (Nature 1995, 374, 542-546). В недавно проведенном клиническом исследовании было получено небольшое, однако, устойчивое (пролонгированное) уменьшение массы тела после 2-недельного лечения с помощью мХФП у субъектов, страдающих ожирением(Psychopharmacology 1997, 133, 309-312). Об уменьшении массы тела сообщается также для клинических испытаний с другими "серотонинергическими" средствами (см., например, Idrugs, 1998, 1, 456-470). Например, ингибитор обратного захвата 5-НТ, флуоксетин, и агент высвобождения 5-НТ/ингибитор обратного захвата 5-НТ, дексфенфлурамин, продемонстрировали уменьшение массы в проведенных под контролем исследованиях. Однако доступные в настоящее время лекарственные средства, которые увеличивают серотонинергическую трансмиссию, по-видимому, оказывают лишь умеренное и, в некоторых случаях, кратковременное воздействие на массу тела. Было предположено также, что подтип 5-НТ 2 с рецептора вовлечен в расстройства ЦНС (CNS), такие как депрессия и тревожное состояние (страх) (Exp. Opin. Invest. Drugs 1998, 7, 1587-1599; IDrugs, 1999, 2,109-120). В дальнейшем было высказано предположение, что подтип 5-НТ 2 с вовлечен в расстройства мочеиспускания, такие как недержание мочи (IDrugs, 1999, 2, 109-120). Следовательно соединения, которые обладают селективным действием на рецептор 5-HT2c, могут иметь терапевтический потенциал при лечении расстройств, подобных тем, о которых упоминалось выше. Разумеется, селективность действия снижает также вероятность нежелательных действий, опосредованных другими серотониновыми рецепторами. Источники предшествующего уровня техники Патент США 3253989 раскрывает использование мХФП (mСРР) в качестве лекарственного средства, понижающего аппетит. ЕР-А 1-863136 раскрывает производные азетидина и пирролидина, которые являются селективными агонистами рецептора 5-НТ 2 с, имеющими антидепрессивную активность, и которые могут быть использованы для лечения или профилактики заболеваний, связанных с дисфункцией серотонина, включая расстройства, связанные с регулированием потребления пищи, и тревожное состояние (страх). ЕР-А-657426 раскрывает трициклические производные пиррола, имеющие активность по отношению к рецептору 5-НТ 2 с, которые, между прочим, могут использоваться для лечения расстройств, связанных с потреблением пищи. ЕР-А-655440 раскрывает 1-аминоэтилиндолы, имеющие активность в отношении рецептора 5-НТ 2c,которые могут быть использованы для лечения расстройств, связанных с потреблением пищи. ЕР-А-572863 раскрывает пиразиноиндолы, имеющие активность в отношении рецептора 5-НТ 2 с, которые могут использоваться для лечения расстройств, связанных с потреблением пищи.J. Med. Chem. 1978, 21, 536-542 и US-A-4081542 раскрывает ряд пиперазинилпиразинов, имеющих центральную серотонин-миметическую активность. В J. Med. Chem. 1981, 24, 93-101 раскрывается ряд пиперазинилхиноксалинов с центральной серотонин-миметической активностью. В международной публикации WO 00/12475 раскрываются производные индолина в качестве лигандов рецептора 5-НТ 2b и/или рецептора 5-HT2c, особенно для лечения ожирения. В международной публикации WO 00/12510 раскрываются пирролоиндолы, пиридоиндолы и азепиноиндолы в качестве агонистов рецептора 5-НТ 2 с, в частности для лечения ожирения. В международной публикации WO 00/12482 раскрываются производные индазола в качестве селективных, непосредственно активных лигандов рецептора 5-НТ 2 с, предпочтительно агонистов рецептора 5HT2c, в частности для использования в качестве средств против ожирения. В международной публикации WO 00/12502 раскрываются пирролохинолины в качестве агонистов рецептора 5-НТ 2 с, в частности для использования в качестве средств против ожирения.-1 005820 В международной публикации WO 00/12475 раскрываются производные индолина в качестве лигандов рецептора 5-НТ 2b и/или рецептора 5-HT2c, особенно для лечения ожирения.GB-B-1457005 раскрывает производные 1-пиперазинил-2-[2-(фенил)этенил]хиноксалина, которые демонстрируют противовоспалительную активность. В Chem. Pharm. Bull. 1993, 41(10) 1832-1841 раскрываются антагонисты 5-НТ 3, включая 2-(4-метил 1-пиперазинил)-4-феноксихиноксалин.GB-B-1440722 раскрывает соединения 2-(1'-пиперазинил)хиноксалина, имеющие фармацевтическую активность против депрессии. В международной публикации WO 96/11920 раскрываются ЦНС-активные производные пиридинилмочевины. В международной публикации WO 95/01976 раскрываются производные индолина, активные в качестве антагонистов 5-НТ 2 с и имеющиe потенциал для использования при лечении расстройств ЦНС. В международной публикации WO 97/14689 раскрываются арилпиперазиновые производные циклических аминов, которые являются селективными антагонистами рецептора 5-HT1d. В международной публикации WO 98/42692 раскрываются пиперазины, полученные из циклических аминов, которые являются селективными антагонистами человеческих рецепторов 5-HT1a, 5-HT1d и 5-HT1b.GB-B-1465946 раскрывает замещенные пиридазинильные, пиримидинильные и пиридильные соединения, которые являются активными в качестве средств, блокирующих -рецептор. ЕР-А-711757 раскрывает производные [3-(4-фенилпиперазин-1-ил)пропиламино]пиридина, пиримидина и бензола в качестве антагонистов -адренорецептора. В международной публикации WO 99/03833 раскрываются производные арилпиперазина, которые являются антагонистами рецептора 5-НТ 2 и агонистами рецептора 5-HT1a и поэтому являются полезными в качестве лекарственных средств и профилактических средств для лечения психоневроза. В международной публикации WO 96/02525 раскрываются производные пиперазида, полученные из арилпиперазина, имеющие антагонистическую активность в отношении рецептора 5-НТ. В международной публикации WO 99/58490 раскрываются арилгидронафталиналканамины, которые могут осуществлять частичную или полную блокаду серотонинергических рецепторов 5-НТ 2 с в организме. Сущность изобретения Согласно настоящему изобретению разработан класс новых соединений, которые связываются с рецептором 5-НТ 2 с (агонисты и антагонисты) и которые в соответствии с этим могут быть использованы для лечения расстройств, связанных с дисфункцией серотонина. В одном аспекте изобретение обеспечивает новые соединения общей формулы где Аr представляет арил или гетероарил, который может быть независимо замещенным в одном или нескольких положениях C1-6-алкилом, C1-6-алкокси, C1-6-алкилтио, C1-6-ацилом, С 1-6-алкилсульфонилом,циано, нитро, гидрокси, С 2-6-алкенилом, С 2-6-алкинилом, фторметилом, дифторметилом, трифторметилом, дифторметокси, трифторметокси, дифторметилтио, трифторметилтио, галогеном, -N(R2)(R3), арилом, арилокси, арилтио, арил-С 1-4-алкилом, арил-С 2-4-алкенилом, арил-С 2-4-алкинилом, гетероциклилом,гетероциклилокси, гетероциклилтио или гетероциклил-С 1-4-алкилом, где любые арильные и гетероциклильные остатки как заместители или часть заместителей на ариле или гетероариле, в свою очередь, могут быть замещенными в одном или нескольких положениях, независимо друг от друга, галогеном, C1-6 алкилом, C1-6-алкокси, C1-6-алкилтио, C1-6-ацилом, C1-6-алкилсульфонилом, нитро, трифторметилом,трифторметилтио, циано, гидрокси, амино, C1-6-алкиламино, ди(C1-6-алкил)амино или C1-6-ациламино; А представляет (i) -О-, -S-, -SO2- или -NH-; (ii) C1-4-алкилзамещенный атом азота, или (iii) C1-8 алкиленовую цепь или гетероалкиленовую цепь, имеющую от 2 до 8 атомов в цепи, которая необязательно содержит одну или несколько ненасыщенных связей, где C1-8-алкилен и гетероалкилен могут быть независимо замещенными в одном или нескольких положениях C1-4-алкилом или оксо, и где два соседних или расположенных на расстоянии друг от друга атома цепи в C1-8-алкилене или гетероалкилене необязательно связаны через алкиленовый мостик, имеющий от 1 до 5 углеродных атомов в цепи, или гетероалкиленовый мостик, имеющий от 2 до 5 атомов в цепи, или два расположенных на расстоянии друг от друга в составе цепи атома в C1-8-алкилене или гетероалкилене необязательно связаны через мостиковую связь, образуя насыщенное или частично или полностью ненасыщенное карбоциклическое или гетероциклическое кольцо, имеющее от 3 до 8 членов в кольце; В представляет -C(R4)(R5)-, -ОС(R4)(R5)-, -N(R6)С(R4)(R5)-, -N(R6)-, -О-, -S- или -SO2-;R представляет С 3-8-циклоалкил, арил или гетероарил, каждый из которых может быть замещенным в одном или в нескольких положениях, независимо друг от друга, C1-6-алкилом, C1-6-алкокси, фтор-С 1-6-2 005820 алкокси, 2,2,2-трифторэтокси, С 3-5-алкинилокси, С 3-5-алкенилокси, диметиламино-С 1-6-алкокси, метиламино-С 1-6-алкокси, C1-6-алкилтио, фторметилом, дифторметилом, трифторметилом, фторметилтио, дифторметокси, дифторметилтио, трифторметокси, трифторметилтио, галогеном, гидрокси, нитро, циано,трифторметилсульфонилокси, C1-6-алкилсульфонамидо, С 2-6-алкенилом, С 2-6-алкинилом, C1-6-ацилом, С 1-6 алкилкарбонил-С 1-6-алкилом, C1-6-алкилсульфонилом, C1-6-алкилсульфонилокси, С 1-6-алкокси-С 1-6-алкилом, C1-6-алкоксикарбонилом, С 1-6-алкоксикарбонил-С 1-6-алкилом, С 1-6-ацилокси-С 1-6-алкилом, гидроксиС 1-6-алкилом, гидрокси-C1-6-алкокси, С 1-6-алкокси-С 1-6-алкокси, С 1-6-алкокси-С 1-6-алкилтио, гидрокси-С 1-6 алкилтио, гетероарил-С 1-6-алкилтио, арил-С 1-6-алкилтио, С 1-6-алкокси-С 1-6-алкиламино, N-(С 1-6-алкоксиС 1-6-алкил)-N-метиламино, С 3-6-циклоалкил-С 1-6-алкокси, арил-С 1-6-алкокси, гетероциклил-С 1-6-алкокси,С 3-8-циклоалкилом, C3-8-циклoaлкилoкcи, арилом, арилокси, арилтио, арилсульфонилом, арил-С 1-6-ацилом, арил-С 1-6-алкилом, арил-С 2-6-алкенилом, арил-С 2-6-алкинилом, гетероциклил-С 1-6-алкилом, гетероциклил-С 2-6-алкенилом, гетероциклил-С 2-6-алкинилом, гетероциклилом, гетероциклилокси, гетероциклилтио, гетероциклилсульфонилом, гетероциклиламино, гетероциклил-С 1-6-ацилом, -N-(R2)(R3), -CON(R7)(R8) или, когда R представляет необязательно замещенный С 3-8-циклоалкил, группой оксо, где любые циклоалкильные, арильные и гетероциклильные остатки в качестве заместителей на С 3-8-циклоалкиле, ариле или гетероариле или в качестве части заместителей на С 3-8-циклоалкиле, ариле или гетероариле, в свою очередь, могут быть замещенными в одном или нескольких положениях, независимо друг от друга, C1-4 алкилом, C1-4-алкокси, метансульфонамидо, C1-4-алкилтио, C1-4-алкилсульфонилом, C1-4-ацилом, гетероциклилом, гетероциклилокси, гетероциклилтио, арилокси, арилтио, фторметилом, трифторметилом,трифторметокси, трифторметилтио, галогеном, гидрокси, нитро, циано, N(R2)(R3) или, для С 3-8 циклоалкила и частично или полностью насыщенного гетероциклила, оксо, или гидрокси;R1 представляет (i) насыщенную или ненасыщенную азациклическую или аминоазациклическую структуру, или насыщенную диазациклическую или аминодиазациклическую структуру, которая имеет от 4 до 7 членов в структуре, или насыщенную аминоазабициклическую, азабициклическую или диазабициклическую структуру, которая имеет от 7 до 10 членов в цикле, и эти моно- или бициклические структуры могут быть моно- или дизамещенными в одном или нескольких положениях, независимо друг от друга, предпочтительно связанным с углеродным атомом C1-4-алкилом, C1-4-алкокси, фторметилом,трифторметилом, дифторметилом, гидроксиметилом или метоксиметилом или -N(R6)2, или предпочтительно связанным с атомом азота кольца гидроксилом, 2-гидроксиэтилом или 2-цианоэтилом, или связанным с атомом азота кольца C1-6-ацилом, C1-4-алкоксикарбонилом или тетрагидропиран-2-илом, и где насыщенная азациклическая структура может содержать дополнительный гетероатом, выбранный из кислорода и серы; или (ii) группу -[C(R4)(R5)]xN(R2a)(R3 а);R2 и R3, независимо друг от друга, представляют водород, C1-6-алкил, C1-6-ацил, -CON(R7)(R8), арил,гетероциклил, арил-C1-6-алкил, гетероциклил-С 1-6-алкил, арил-С 1-6-ацил или гетероциклил-C1-6-ацил, где любые арильные или гетероциклильные остатки, в свою очередь, могут быть замещенными в одном или нескольких положениях, независимо друг от друга, галогеном, C1-4-алкилом, C1-4-алкокси, C1-4-алкилтио,C1-4-алкилсульфонилом, метансульфонамидо, нитро, циано, гидрокси, трифторметилом, трифторметокси,трифторметилтио или -N(R2)(R3); или R2 и R3 вместе с атомом азота, с которым они связаны, образуют насыщенное гетероциклическое кольцо, имеющее 4-7 членов в кольце и необязательно содержащее дополнительный гетероатом, и это кольцо может быть замещено C1-6-алкилом, C1-6-алкокси, оксо или гидрокси;R2 а и R3 а, независимо друг от друга, представляют водород, метил или этил, или R2a и R3 а вместе с атомом азота, с которым они связаны, образуют пирролидиновое, пиперазиновое, морфолиновое, тиоморфолиновое или пиперидиновое кольцо;R4 и R5, независимо друг от друга и независимо относительно каждого замещенного углеродного атома, представляют водород или C1-6-алкил;R6 представляет водород или C1-6-алкил;R7 и R8, независимо друг от друга, представляют водород, C1-6-алкил, арил, гетероарил, арил-С 1-4 алкил или гетероарил-С 1-4-алкил, где арильные и гетероарильные остатки, в свою очередь, могут быть замещены в одном или нескольких положениях, независимо друг от друга, галогеном, C1-6-алкилом, C1-6 алкокси, C1-6-алкилтио, C1-6-алкилсульфонилом, метансульфонамидо, нитро, циано, гидрокси, трифторметилом, трифторметокси, трифторметилтио или -N(R2)(R3); или R7 и R8 вместе с атомом азота, с которым они связаны, образуют насыщенное гетероциклическое кольцо, имеющее 4-7 членов в кольце и необязательно содержащее дополнительный гетероатом;n равно 0 или 1, и х равно 2, 3 или 4; с условием, что (i) когда -A-R представляет фенокси или фенилтио, тогда Аr является иным, чем хиноксалинил или пиридил, и (ii) когда А представляет этенилен, тогда Аr является иным, чем хиноксалинил; и их фармацевтически приемлемые соли, гидраты, геометрические изомеры, таутомеры, оптические изомеры, N-оксиды и пролекарственные формы.-3 005820 Ограниченная группа соединений изобретения включает соединения формулы (I), определенные выше, но с дополнительным условием, что, когда Аr представляет необязательно замещенный фенил,пиридил или хиноксалинил, тогда А представляет группу -Het-CH(R6)-СН(R6)-Het-, где каждый Het независимо выбран из О, S и N(R6) и R6 такой, как определено выше. В случае, если соединения формулы (I) могут находиться в форме оптических изомеров, изобретение включает рацемическую смесь, а также индивидуальные энантиомеры, как таковые. В случае, если соединения формулы (I) содержат группы, которые могут существовать в таутомерных формах, изобретение включает таутомерные формы соединений, а также их смеси, например 2 гидроксипиридин и его таутомер 1H-2-пиридон. В случае, если соединения формулы (I) могут находиться в форме геометрических изомеров, изобретение включает геометрические изомеры, а также их смеси. В другом аспекте в изобретении предлагаются соединения, представленные формулой (I), для использования в лечении. В следующем аспекте изобретения предлагается фармацевтическая композиция, включающая соединение, представленное вышеуказанной формулой (I), в качестве активного компонента, предпочтительно вместе с фармацевтически приемлемым носителем и, если требуется, другие фармакологически активные средства. Еще в одном аспекте в изобретении предлагается способ лечения человека или животного, страдающего заболеванием, связанным с дисфункцией серотонина, в частности связанным с дисфункцией рецептора 5-НТ 2, особенно расстройств, связанных с потреблением пищи, в частности ожирения; расстройств памяти; шизофрении; расстройств, характеризующихся изменением настроения; расстройств,характеризующихся тревожным состоянием (страхом); боли, половых дисфункций, и нарушений, связанных с мочеиспусканием. В другом аспекте изобретения предлагается использование вышеупомянутых соединений, представленных формулой (I), для получения лекарственного средства для лечения заболевания, связанного с дисфункцией серотонина, в частности связанного с дисфункцией рецептора 5-НТ 2 с, особенно расстройств, связанных с потреблением пищи, в частности ожирения; расстройств памяти; шизофрении; расстройств, характеризующихся нарушениями настроения; расстройств, характеризующихся тревожным состоянием (страхом); боли, половых дисфункций и нарушений, связанных с мочеиспусканием. Еще в одном аспекте изобретения предлагается способ получения соединений, представленных формулой (I). Подробное описание изобретения Прежде всего, будут разъяснены различные термины, используемые, раздельно или в сочетаниях, в вышеупомянутых определениях соединений, имеющих общую формулу (I). Под термином "гетероатом" подразумеваются азот, кислород, сера, а в гетероциклических кольцах(включая гетероароматические, а также насыщенные и частично насыщенные гетероциклические кольца) также селен. Предполагается, что термин "арил" включает ароматические кольца (моноциклические или бициклические), имеющие от 6 до 10 кольцевых углеродных атомов, такие как фенил, нафтил и 1,2,3,4 тетрагидронафтил (замещения могут быть в любом кольце). Термин "гетероарил" означает моноциклическую, би- или трициклическую ароматическую структуру (только одно кольцо должно быть ароматическим, и замещения могут быть в любом кольце),имеющую от 5 до 14, предпочтительно от 5 до 10 кольцевых атомов (моно- или бициклическое), в которой один или несколько атомов в кольце(ах) являются иными, чем углерод, такими как азот, сера, кислород и селен. Примерами таких гетероарильных колец являются пиррол, имидазол, тиофен, фуран, тиазол,изотиазол, тиадиазол, оксазол, изоксазол, оксадиазол, пиридин, пиразин, пиримидин, пиридазин, пиразол, триазол, тетразол, хроман, изохроман, кумарин, хинолин, хиноксалин, изохинолин, фталазин, циннолин, хиназолин, индол, изоиндол, индолин, изоиндолин, бензтиофен, бензофуран, 2,3-дигидробензофуран, изобензофуран, бензоксазол, 2,1,3-бензоксадиазол, бензотиазол, 2,1,3-бензотиадиазол, 2,1,3-бензоселенадиазол, бензимидазол, индазол, 2,3-дигидро-1,4-бензодиоксин, индан, 1,3-бензодиоксол, 1,2,3,4 тетрагидрохинолин, 3,4-дигидро-2 Н-1,4-бензоксазин, 1,5-нафтиридин, 1,8-нафтиридин, акридин, феназин, ксантен, 3,4-дигидро-2 Н-пиридо[3,2-b]-1,4-оксазин и 2,3-дигидро-1,4-бензоксатиин. Гетероарильное кольцо может быть связано с дивалентной группой А в формуле (I) через ее атом углерода или азота. Если би- или трициклическая структура замещена, то замещение возможно в любом ее кольце. Термин "гетероалкилен" означает алкиленовую группу, которая содержит концевой гетероатом на одном или обоих концах и/или один или несколько прерывающих углеродную цепь гетероатом(ов), выбранных из N, О и S. Число гетероатомов составляет, по крайней мере, 1, и обычно от 1 до 3, особенно 1 или 2. Когда гетероалкилен является замещенным, он обычно замещен при атоме углерода C1-4-алкилом или оксо, но альтернативно или дополнительно он может быть замещен при азоте C1-4-алкилом или при атоме серы оксо (S=O или O=S=O), если таковые имеются. Предполагается, что термин "гетероциклил" включает полностью ненасыщенные (т.е. ароматические), а также частично или полностью насыщенные моно-, би- и трициклические структуры, имеющие-4 005820 от 4 до 14, предпочтительно от 4 до 10 атомов в кольце и содержащие один или несколько гетероатомов,выбранных из кислорода, серы и азота, такие как, например, гетероарильные группы, упомянутые выше,а также их соответствующие частично насыщенные или полностью насыщенные гетероциклические кольца. Иллюстративными примерами насыщенных гетероциклических колец являются азетидин, пирролидин, пиперидин, пиперазин, морфолин и тиоморфолин.C1-6-Алкил, который может быть линейным или разветвленным, представляет предпочтительно C1-4 алкил. Типичные алкильные группы включают метил, этил, пропил, изопропил, бутил, втор-бутил, третбутил, пентил, изопентил, гексил и изогексил.C1-6-Алкокси, которая может быть линейной или разветвленной, представляет предпочтительно C1-4 алкокси. Типичные алкоксигруппы включают метокси, этокси, пропокси, изопропокси, бутокси, вторбутокси, трет-бутокси, пентилокси, изопентилокси, гексилокси и изогексилокси. С 2-6-Алкенил, который может быть линейным или разветвленным, представляет предпочтительно С 2-4-алкенил, например 1-пропенил, 2-пропенил, винил. С 2-6-Алкинил, который может быть линейным или разветвленным, представляет предпочтительно С 2-4-алкинил, например пропаргил, этинил. С 3-8-Циклоалкил представляет предпочтительно С 4-7-циклоалкил. Типичные циклоалкильные групппы включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил.C1-6-Ацил может быть насыщенным или ненасыщенным и представляет предпочтительно C1-4-ацил. Типичные ацильные группы включают формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, бутеноил (например, 3-бутеноил), гексеноил (например, 5-гексеноил).C1-8-Алкилен (где 1-8 обозначает число атомов углерода в цепи) и гетероалкилен, содержащий от 2 до 8 атомов в цепи, которые могут содержать одну или несколько ненасыщенных связей (двойные и/или тройные связи), представляют предпочтительно C1-4-алкилен и гетероалкилен с 2-4 атомами в цепи соответственно. Типичные алкиленовые группы включают метилен, этилен, пропилен, бутилен и их изомеры(например, 1,3-бутилен, 2-метил-1,3-пропилен). Типичные гетероалкиленовые группы включают оксиметилен (и метиленокси), оксиэтилен (и этиленокси), оксипропилен (и пропиленокси), оксибутилен (и бутиленокси), этилендиокси, пропилендиокси, бутилендиокси, оксиаллил (и аллилокси) и т.д. Типичной алкилзамещенной гетероалкиленовой группой является метилэтилендиокси. Гидрокси-С 1-6-алкил может быть линейным или разветвленным. Типичные гидроксиалкильные группы включают гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 2-гидроксибутил, 3-гидроксибутил, 4-гидроксибутил. Типичные арил-С 1-6-ацильные группы включают бензоил, 1-нафтоил, 2-нафтоил, циннамоил и фенилацетил. Типичные С 1-6-алкилкарбонил-С 1-6-алкильные группы включают 2-оксобутил. Типичные С 1-6-алкокси-С 1-6-алкильные группы включают 2-этоксиэтил. Типичные С 1-6-алкоксикарбонил-С 1-6-алкильные группы включают этоксикарбонилбутил. Типичные С 1-6-ацилокси-С 1-6-алкильные группы включают пропаноилоксипропил. Типичные насыщенные и ненасыщенные (частично или полностью) азациклические и насыщенные азабициклические структуры включают азетидин, пирролидин, пиперидин, морфолин, гексагидроазепин,тетрагидропиридин, пиридин и 1-азабицикло[2,2,2]октан. Азациклические и азабициклические структуры связаны через атом углерода кольца, когда n=0. Типичные насыщенные и ненасыщенные аминоазациклические кольца включают аминопиперидин(например, 4-аминопиперидин), аминоазетидин (например, 3-аминоазетидин), аминопирролидин (например, 3-аминопирролидин) и аминопиридин (например, 4-аминопиридин). Аминоазациклические кольца предпочтительно связаны с В или Аr в формуле (I) либо через азаатом азота, либо через атом азота в аминогруппе. Примером насыщенной аминоазабициклической структуры является 3-аминоазабицикло[2,2,2]октан, и связывание осуществляется предпочтительно через атом азота 3-амино. Примером насыщенного аминодиазациклического кольца является 1-аминопиперазин, и связывание осуществляется предпочтительно либо через атом азота 4-аза, либо через атом азота 1-амино. Типичные насыщенные диазациклические кольца включают пиперазин и гомопиперазин, и примером диазабициклической структуры является диазабицикло[2,2,1]гептан. Диазациклические и диазабициклические структуры предпочтительно связаны через один из атомов азота кольца. Группа -[С(R4)(R5)]xN(R2a)(R3 а) предпочтительно связана с Аr в формуле (I) через гетероатом (т.е.,когда n=1 и В представляет кислород, азот или серу). Под выражением "независимо для каждого замещенного углеродного атома" в отношении заместителей R4 и R5 имеется в виду, что каждый отдельный атом углерода в цепи -[C(R4)(R5)]x- может быть замещенным иначе, чем соседний(е) атом(ы) углерода. Типичной цепью, где х=3, иллюстрирующей это,является -СН(СН 3)-СН 2-С(СН 3)(СН 3)-. Галоген включает фтор, хлор, бром и иод. Там, где заявлено выше, что арил, гетероарил и гетероциклил могут быть замещенными, это относится к арилу, гетероарилу и гетероциклилу per se, а также к любым комбинированным (сложным) груп-5 005820 пам, содержащим арильные, гетероарильные или гетероциклильные остатки, таким как арил-С 1-6-ацил,гeтepoapил-C2-4-алкенил, гетероциклилтио, и т.д. Термин "N-оксиды" означает, что один или несколько атомов азота, если они присутствуют в соединении, находятся в форме N-оксида (NO). Термин "пролекарственные формы" означает фармакологически приемлемое производное, такое как сложный эфир или амид, и это производное биотрансформируется в организме с образованием активного лекарственного средства. Ссылаются на Goodman and Gilman's, The Pharmacological basis of"Фармацевтически приемлемый" означает пригодный для получения фармацевтической композиции, т.е. безопасный, нетоксичный и не являющийся недопустимым ни по биологическим показателям,ни каким-либо другим образом, и включает пригодность для использования в качестве компонента фармацевтического средства как в ветеринарии, так и для лечения человека."Фармацевтически приемлемые соли" подразумевают соли, которые являются фармацевтически приемлемыми, как определено выше, и которые обладают требуемой фармакологической активностью. Такие соли включают аддитивные соли кислоты, полученные с органическими и неорганичскими кислотами, такие как хлористо-водородная кислота, бромисто-водородная кислота, иодисто-водородная кислота, серная кислота, фосфорная кислота, уксусная кислота, гликолевая кислота, малеиновая кислота,малоновая кислота, щавелевая кислота, толуолсульфокислота, метансульфокислота, трифторуксусная кислота, фумаровая кислота, янтарная кислота, винная кислота, лимонная кислота, бензойная кислота,аскорбиновая кислота и т.п."А" в формуле I представляет предпочтительно C2-8-алкиленовую цепь или гетероалкиленовую цепь, имеющую по крайней мере 2 атома в цепи. Более предпочтительно, "А" в формуле I представляет дивалентную группу общей формулы (II) где R9, R10, R11 и R12, независимо друг от друга и независимо для каждого замещенного углеродного атома, представляют водород, C1-4-алкил, трифторметил или оксо; Х представляет -С(R13)(R14)-, -О-, -S-, -SO2- или -N(R15)-;R13, R14, R16, R17, R18 и R19, независимо друг от друга и независимо для каждого замещенного углеродного атома, представляют водород, C1-4-алкил или трифторметил или оксо; или два из R13, R14, R16,R17, R18 и R19 вместе представляют межсоединяющую связь или алкиленовый мостик из 1-5 углеродных атомов в цепи или гетероалкиленовый мостик из 2-5 атомов в цепи, образуя вместе с атомом(ами), с которым(ми) они связаны, циклическую структуру, имеющую 3-8 членов в кольце;R15 представляет водород, C1-4-алкил или C1-6-ацил; о, р, q и r, независимо друг от друга, равны 0-3; и четыре штриховые линии, независимо друг от друга, представляют необязательную углеродуглеродную связь; с условием, что (i) А не содержит двух соседних гетероатомов О или S в открытой цепи, и (ii) о, р, q и r вместе равны не больше чем 8. Выражение "независимо для каждого замещенного углеродного атома" означает, что если в формуле (II) целые числа о и/или q равны 2 или 3, то каждый из рассматриваемых атомов углерода может быть замещенным по-разному. Так, в случае R9 и R10, например, если о равно 2 или 3, для каждого из двух или трех атомов углерода, значения R9 и R10 могут быть выбраны независимо от значений R9 и R10 на других двух или трех атомах углерода. Например, в том случае, когда о=2, связывание с Х осуществляется через простую связь и R9 и R10 независимо выбраны из водорода и метила, тогда, например, R9 может быть водородом и R10-метилом у первого атома углерода, а у второго атома углерода как R9, так и R10 могут быть водородом, т.е. группой 1-метилэтилен. Если R9 и R10 у первого атома углерода представляют водород и у второго атома углерода R9 представляет водород, a R10 представляет метил, то получается группа 2-метилэтилен. Типичными группами для о=3, когда R9 и R10 независимо выбраны из, например, водорода, метила и оксо, являются 2-oкco-1,3-бутандиил, 1-оксо-2-метил-1,3-пропандиил, 1-oксo-1,3-бутандиил и 1-оксо-2-метил-1,3-бутандиил. Аналогичные рассуждения распространяются, разумеется, и на Y и Z в формуле (II), когда Y и Z являются иными, чем -О- или -S-, и целые числа р и r соответственно равны 2 или 3. В тех случаях, когда формула (II) содержит углерод-углеродную двойную связь(и) и/или тройную связь(и), один или оба заместителя у каждого участвующего (в образовании этой связи) атома углерода,-6 005820 разумеется, опускаются (для двойных связей: R9 и R13 и/или R11 и R16 соответственно; и для тройных связей: R9, R10, R13 и R14, и R11, R12, R16 и R17, соответственно). В предпочтительном варианте воплощения А в формуле (I) представляет группу -Het-CH(R6)CH(R6)-Het-, где каждый Het независимо выбран из О, S и N(R6) и R6 такой, как определено выше, предпочтительно водород или метил, в частности водород. Наиболее предпочтительной группой А является -O-СН 2-СН 2-O-. Другие предпочтительные группы А включают -S-CH2-CH2-O-, -O-CH2-CH2-S- и -O-СН 2-СН 2-СН 2-. В другом предпочтительном варианте воплощения А представляет -О-СН 2- и R представляет необязательно замещенный гетероарил, например 2,3-дигидро-1,4-бензодиоксин, 3,4-дигидро-2 Н-1,4-бензоксазин, 2,3-дигидро-1,4-бензоксатиин, хинолин, бензофуран, 3,4-дигидро-2 Н-пиридо(3,2-b)-1,4-оксазин.R в формуле (I) представляет предпочтительно необязательно замещенный арил или гетероарил. Когда R представляет арил, то это предпочтительно фенил, который является замещенным или незамещенным, предпочтительно замещенным. Если R представляет замещенный фенил, то он предпочтительно замещен в мета-положении. Когда R представляет гетероарил, то он предпочтительно выбран из пиридина, изохинолина, хинолина, хиноксалина, 2,3-дигидро-1,4-бензодиоксина, бензоксазола, 2,1,3-бензотиадиазола, кумарина, 3,4-дигидро-2 Н-1,4-бензоксазина и хиназолина. Главным образом, R представляет замещенное (особенно метазамещенное) фенильное кольцо или незамещенное или замещенное пиридиновое кольцо. Аr в формуле (I) представляет предпочтительно назамещенный или замещенный пиразин, хиноксалин, 1,2,5-тиадиазол, пиридил или фенил. Когда Аr замещен, то он обычно является моно- или (независимо) дизамещенным. Предпочтительные заместители на Аr выбраны из C1-4-алкила, C1-4-алкокси, C1-4-алкилтио, C1-4-алкилсульфонила, циано,гидрокси, С 2-4-алкенила, С 2-4-алкинила, трифторметила, трифторметилтио, галогена, амино, метиламино,диметиламино, ацетамино, ацетамидо, арила, арилокси, арилтио, гетероциклила, гетероциклилокси, гетероциклилтио, где любые арильные и гетероциклильные остатки, в свою очередь, могут быть замещенными в одном или нескольких положениях, независимо друг от друга, галогеном, метилом, метокси, метилтио, метилсульфонилом, нитро, трифторметилом, циано, гидрокси, амино, метиламино и диметиламино или ацетамидо.R1 в формуле (I) представляет предпочтительно насыщенное диазациклическое кольцо, особенно пиперазин, незамещенный или замещенный C1-4-алкилом, например монозамещенный, в частности, метилом (в любом положении). Целое число n в формуле (I) предпочтительно равно 0. Когда n=1, В предпочтительно представляетR9-R12 представляют предпочтительно водород. В предпочтительной подгруппе соединений формулы I Аr представляет пиразиновое кольцо, т.е. соединения формулы (Ia) где R20 и R21, независимо друг от друга, представляют водород, C1-4-алкил, C1-4-алкокси, C1-4-алкилтио,C1-4-ацил, C1-4-алкилсульфонил, циано, нитро, гидрокси, C2-4-алкенил, С 2-4-алкинил, трифторметил, трифторметокси, трифторметилтио, галоген, амино, диметиламино, метиламино, ацетамидо, арил, арилокси,арилтио, гетероциклил, гетероциклилокси или гетероциклилтио, где любые арильные и гетероциклильные остатки, в свою очередь, могут быть замещенными в одном или нескольких положениях, независимо друг от друга, галогеном, метилом, метокси, метилтио, метилсульфонилом, нитро, циано, гидрокси,трифторметилом, амино, метиламино, диметиламино или ацетамидо; или R20 и R21 вместе с атомами углерода, с которыми они связаны, образуют 5- или 6-членное ароматическое или гетероароматическое кольцо, которое необязательно является независимо замещенным в одном или нескольких положениях галогеном, метилом, метокси, метилтио, метилсульфонилом, нитро, циано, гидрокси, трифторметилом,трифторметилтио, амино, метиламино, диметиламино или ацетамидо;m1 и m2 равны, независимо друг от друга, 0 или 1 и-7 005820 А, В, R, R1 и n определены, как указано выше. В тех случаях, когда R20 и R21 в формуле (Iа) образуют 5-или 6-членное ароматическое или гетероароматическое кольцо вместе с углеродами пиразинового кольца, такое кольцо может, например, быть выбрано из арильных и гетероарильных колец, упомянутых выше.R20 и R21 представляют предпочтительно (независимо) водород, галоген или метил. В тех случаях,когда R20 и R21 образуют кольцо вместе с углеродами кольца, с которыми они связаны, таким кольцом является предпочтительно бензол (чтобы получить хиноксалин) или тиофен (чтобы получить тиено[3,4b]пиразин). Будучи замещенными, кольца являются предпочтительно моно- или (независимо) дизамещенными, например, галогеном или метилом. Целые числа m1 и m2 предпочтительно равны оба 0 (т.е. атомы азота пиразина находятся не в окисленной форме). Подгруппа соединений формулы (Iа) состоит из соединений формулы (Ib)Ra представляет арил или гетероарил, необязательно замещенный, как определено для R в п.1;R23 и R24, независимо друг от друга, представляют водород, C1-4-алкил, гидроксиметил, C1-4-алкоксиметил или фторметил;R25 представляет водород или C1-4-алкил;R26 представляет водород, C1-4-алкил или связан с углеродным атомом в Ra, соседним с атомом, связанным с Y1, образуя (вместе с углеродным атомом, с котором он связан, Y1 и двумя атомами в Ra) 5- или 6-членное кольцо, которое может содержать дополнительный гетероатом;R27 представляет водород или C1-4-алкил, предпочтительно метил или этил; и у и z, независимо друг от друга, равны 1 или 2. Типичные кольцевые системы, образованные в случаях, когда R26 связан с Ra, представляют 2,3 дигидро-1,4-бензодиоксин, 3,4-дигидро-2 Н-1,4-бензоксазин, 2,3-дигидро-1,4-бензоксатиин и бензофуран. В формуле (Ib) R22 представляет предпочтительно водород, а R23 и R24 представляют предпочтительно C1-4-алкил, особенно метил, или водород. В частности, R23 представляет метил (особенно в 2 положении пиперазинового кольца, и предпочтительно с (R)-конфигурацией при хиральном углеродном атоме), z равно 1 и R24 представляет водород. В тех случаях, когда R23 или R24 являются иными, чем водород, и по крайней мере один из у и z равен 2, или у и z оба равны 1, тогда R23 или R24 соответственно могут принадлежать одному и тому же или различным атомам углерода.R25 представляет предпочтительно водород. Предпочтительными соединениями вышеупомянутой общей формулы (I) являются 2-(2-фенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир; 2-(2-фторфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир; 2-(3-цианофенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир; 2-(3-метоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир; 2-[3-(2-гидроксиэтокси)фенокси]этил 3-(1-пиперазинил)-2-пиразиниловый эфир; 2,3-дигидро-1,4-бензодиоксин-2-илметил 3-(1-пиперазинил)-2-пиразиниловый эфир; 2-(2-метоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир; 2-(2,5-дифторфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир; 2-(3,5-диметоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир; 2-(3,4-дигидро-2 Н-пиридо[3,2-b]-1,4-оксазин-2-илметокси)-3-(1-пиперазинил)пиразин; 2-метил-1-[3-(2-феноксиэтокси)-2-пиразинил]пиперазин, в частности его (R)-энантиомер; 2-метил-1-3-[2-(3-пиридинилокси)этокси]-2-пиразинилпиперазин, в частности его (R)-энантиомер; 2-(хиназолинил-8-илокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир; 2-(изохинолинил-5-илокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир;N,N-диметил-N-2-[3-(2-[3-(1-пиперазинил)-2-пиразинил]оксиэтокси)фенокси]этиламин; 7-(2-[3-(1-пиперазинил)-2-пиразинил]оксиэтокси)-2 Н-хромен-2-он; 1-(3-2-[(2-хлор-3-пиридинил)окси]этокси-2-пиразинил)-2-метилпиперазин, в частности его (R)энантиомер; 7-изохинолинил 2-[3-(1-пиперазинил)]-2-пиразинилокси)этиловый эфир; 2-(2-хлор-4-метоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир; 4-(2-[3-(1-пиперазинил)-2-пиразинил]оксиэтокси)-2-хинолинамин; и их фармакологически приемлемые соли и сольваты. Как упоминалось выше, соединения настоящего изобретения используют для лечения (включая профилактическое лечение) расстройств, связанных с дисфункцией серотонина, особенно связанных с рецептором 5-НТ 2, у человека или животного (включая, например, домашних животных), таких как нарушения, связанные с потреблением пищи, особенно ожирения; расстройства памяти, такие как болезнь Альцгеймера; шизофрения; нарушения, характеризующиеся изменением (эмоционального) настроения,включая, но не ограничиваясь ими, основную депрессию и биполярную депрессию, включая как расстройство легкой степени, так и маниакальное биполярное расстройство, периодическое (сезонное) аффективное расстройство; расстройства, характеризующиеся тревожным состоянием (страхом), включая ситуативное проявление тревожного состояния, расстройство генерализованной тревоги, первичные проявления тревожного состояния (паника, навязчивый страх (фобия), обессивно-компульсивные расстройства и посттравматическое стрессовое расстройство), и вторичные проявления тревожного состояния(например, состояние тревоги, связанное со злоупотреблением теми или иными веществами); боль; половые дисфункции; и нарушения, связанные с мочеиспусканием, такие как недержание мочи. Соединения настоящего изобретения в меченой форме, например, меченные изотопным индикатором, могут быть использованы в качестве диагностического средства. Вышеупомянутые соединения общей формулы (I) можно получить стандартными способами или по аналогии с ними, и особенно нижеследующими способами или аналогичными им. Способ А. Вышеупомянутые соединения формулы (I), где А связан с Аr через атом О, S или N в А, и (i) n=0 иR1 представляет остаток насыщенного аминоазацикла, аминодиазацикла, диазацикла или диазабицикла,или (ii) n=1, В представляет -N(R6)- или -N(R6)С(R4)(R5)-, где R4, R5 и R6 определены, как указано выше,и R1 представляет насыщенный или ненасыщенный азациклический или насыщенный азабициклический остаток, получают взаимодействием соединения структурной формулы (III)-9 005820 где Аr такой, как определено выше, и Hal представляет галоген, с соединением R-A'-X'-H или его соответствующим анионом, где X' представляет -О-, -S- или -N(R15)-, A' представляет C1-8-алкилен, где углеродная цепь может прерываться одним или несколькими гетероатомами и может иметь концевой гетероатом, связанный с R, причем указанные гетероатомы выбраны из N, О и S, a R и R15 такие, как определено выше, с получением соединения формулы (IV) где Аr, X', А', R и Hal определены, как указано выше. Соединение R-A'-X'-H может быть превращено полностью или частично в его соответствующий анион обработкой основаниями, такими как триэтиламин,1,8-диазабицикло[5,4,0]ундец-7-ен, K2 СО 3, NaOH, NaH, KО-трет-Bu, диизопропиламид лития и т.п. Реакцию осуществляют в растворителе, таком как диоксан, тетрагидрофуран или N,N-диметилформамид (ДМФА),при 0-200 С в течение 1-24 ч. Соединение формулы (IV) подвергают взаимодействию с 1-10 мол.экв. соответствующего амина в растворителе, таком как ацетонитрил, диоксан, тетрагидрофуран, н-бутанол,ДМФА, или в смеси растворителей, такой как смесь ДМФА/диоксан, необязательно в присутствии основания, такого как K2 СО 3, Kа 2 СО 3, Сs2 СО 3, NaOH, триэтиламин, пиридин или т.п., при 0-200 С в течение 1-24 ч, с получением соединения формулы (I). Типичные амины имеют следующие структуры: где R23, R24, у и z определены, как указано выше, и Z имеет значения, определенные для R22 в вышеуказанной формуле (Ib) или представляет подходящую защитную группу, такую как трет-бутоксикарбонил,тритил или бензил. Способ В. Соединения формулы (I), где n=1, В представляет кислород, серу и R1 представляет остаток насыщенного азацикла или азабицикла или группу -[С(R4)(R5)]xN(R2a)(R3 а)-, где R2a, R3 а, R4, R5 и х такие, как определено выше, получают взаимодействием соединения вышеуказанной формулы (IV) с соответствующим гидрокси- или меркаптозамещенным азациклическим или азабициклическим соединением или с соединением HO-R1 или HS-R1, где R1 представляет -[С(R4)(R5)]xN(R2a)(R3 а). Типичные гидрокси- и меркаптозамещенные соединения имеют нижеследующие структуры: где Z такой, как определено выше. Реакцию осуществляют в растворителе, таком как толуол, ДМФА или диоксан, в присутствии основания, такого как 1,8-диазабицикло[5,4,0]ундец-7-ен, KОН, KО-трет-Bu, NaH или т.п., при 0-200 С в течение 1-24 ч. Способ С. Соединения формулы (I), где А связан с R через атом кислорода или серы в А, получают взаимодействием соединения формулы (V) где Аr, R1, В и n определены, как указано выше, А" представляет C1-8-алкилен, где углеводородная цепь может прерываться одним или несколькими гетероатомами и которая может иметь концевой гетероатом,связанный с Аr, причем указанные гетероатомы выбраны из N, О и S, и L представляет гидрокси или удаляемую группу, такую как, например, галоген, тозилокси, мезилокси и т.п., с соединением R-OH илиR-SH, где R такой, как определено выше, с получением соединения формулы (I).- 10005820 В тех случаях, когда L представляет свободную гидроксигруппу, реакцию можно осуществить в присутствии диэтилазодикарбоксилата (ДЭАД) или 1,1'-азобис(N,N-диметилформамида) (сравни Tetrahedron Lett. 1995, 36, 3789-3792), предпочтительно ДЭАД, и трифенилфосфина (РРh3) в растворителе,таком как тетрагидрофуран или дихлорметан (реакция Мицунобу; смотри Org. React. 1992. 42, 335-656). В тех случаях, когда L является удаляемой группой, реакцию можно осуществить в присутствии подходящего основания, такого как Kа 2 СО 3, K2 СО 3, Сs2 СО 3, KОН, триэтиламин, 1,8-диазабицикло[5,4,0] ундец-7-ен или т.п., в растворителе, таком как ацетонитрил или ДМФА, при 0-200 С в течение 1-24 ч. В том случае, если группа -(B)nR1 в формуле (V) содержит первичную или вторичную аминогруппу,азот может быть защищен подходящей защитной группой, предпочтительно трет-бутоксикарбонильной,тритильной или бензильной. Снятие защиты с N осуществляют обычными способами, такими, как описано в Protective Groups in Organic Synthesis, John WileySons, 1991. Способ D. Соединения формулы (I), в которой А связан с Аr через атом О, S или N в А, и где n=0, или п=1 и В представляет кислород, азот, серу, -N(R6)C(R4)(R5)-, где R4, R5 и R6 такие, как определено выше, получают взаимодействием соединения вышеупомянутой формулы (III) с соответствующим амином или соответствующим гидрокси- или меркаптозамещенным соединением с получением соединения формулы (VI) где Аr, В, R1, Hal и n определены, как указано выше. Условия реакции могут быть такими же, как описаны для вышеупомянутых способов А и В. Соединение формулы (VI) подвергают взаимодействию с соединением R-A'-X'-H или его соответствующим анионом, где X' представляет -О-, -S- или -N(R15)-, А' представляет C1-8-алкилен, где углеродная цепь может прерываться одним или несколькими гетероатомами и может иметь концевой гетероатом, связанный с R, причем указанные гетероатомы выбраны из N,О и S, a R и R15 такие, как определено выше, получая соединение формулы (I). Условия реакции могут быть такими же, как описаны для вышеупомянутого способа А. Типичные амины, гидрокси- и меркаптозамещенные соединения включают соединения, представленные в связи со способами А и В выше, а также соединение HO-R1 или HS-R1, где R1 представляет-[C(R4)(R5)]xN(R2a)(R3 а) и где R2a, R3 а, R4, R5 и х такие, как определено выше. Соединения формулы (I), в которой Аr представляет необязательно замещенный фенил, нафтил,пиридил или хинолинильное кольцо и (i) А представляет кислород или (ii) A связан с Аr через атом кислорода в А, могут быть получены способами, хорошо известными в данной области, как иллюстрировано в примерах 184 и 185 ниже. Полученное соединение формулы (I) может быть превращено в другое соединение формулы (I) способами, хорошо известными в данной области (иллюстрированными, например, в примере 216). Описанные выше способы можно осуществить, чтобы получить соединение изобретения в форме свободного основания или в виде аддитивной соли кислоты. Фармацевтически приемлемую аддитивную соль кислоты можно получить растворением свободного основания в подходящем органическом растворителе и обработкой раствора кислотой в соответствии с обычными методиками получения аддитивных солей кислоты из основных соединений. Примерами кислот, образующих аддитивную соль, являются малеиновая кислота, фумаровая кислота, янтарная кислота, метансульфокислота, трифторуксусная кислота, уксусная кислота, щавелевая кислота, бензойная кислота, хлористо-водородная кислота, серная кислота, фосфорная кислота и т.п. Соединения формулы (I) могут иметь один или несколько хиральных углеродных атомов, и поэтому их можно получить в форме оптических изомеров, например в виде чистого энантиомера, или в виде смеси энантиомеров (рацемат), или в виде смеси, содержащей диастереомеры. Разделение смесей оптических изомеров с целью получения чистых энантиомеров хорошо известно в данной области, и этого разделения можно достигнуть, например, фракционированной (дробной) кристаллизацией солей с оптически активными (хиральными) кислотами или хроматографическим разделением на хиральных колонках. Необходимые исходные вещества для получения соединений формулы (I) либо известны, либо их можно получить по аналогии с получением известных соединений. Например, используемые для получения новых соединений формулы (I) арилокси- и гетероарилоксиэтанолы можно получить, используя способы, изображенные на схеме 1 ниже.- 11005820 Схема 1. Получение некоторых исходных веществ. В соответствии с настоящим изобретением соединения формулы (I), в форме свободных оснований или солей с физиологически приемлемыми кислотами, могут быть переведены в подходящие формы галеновых препаратов, такие как композиции для перорального использования, для инъекций, для введения назальным распылением (аэрозоль) или т.п., в соответствии с общепринятыми приемами фармацевтического производства. Такие фармацевтические композиции согласно изобретению включают эффективное количество соединений формулы (I) в сочетании с совместимыми фармацевтически приемлемыми веществами-носителями или разбавителями, что хорошо известно в данной области. Носители могут представлять любое инертное вещество, органическое или неорганическое, подходящее для энтерального, чрескожного, подкожного или парентерального введения, такое как вода, желатин, аравийская камедь, лактоза, микрокристаллическая целлюлоза, крахмал, натрийкрахмалгликолят, гидрофосфат кальция, стеарат магния, тальк, коллоидный диоксид кремния и т.п. Такие композиции могут дополнительно содержать другие фармакологически активные средства и обычные вспомогательные добавки, такие как стабилизаторы, увлажнители, эмульгаторы, ароматизаторы, буферы и т.п. Композиции согласно изобретению могут, например, быть составлены в твердой или жидкой форме для перорального введения, такой как таблетки, пилюли, капсулы, порошки, сиропы, эликсиры, диспергируемые гранулы, (крахмальные) облатки, суппозитории и т.п.; в форме стерильных растворов, суспензий или эмульсий для парентерального введения; аэрозолей, например назальный аэрозоль; трансдермальных препаратов, например пилюли, и т.п. Как упоминалось выше, соединения изобретения могут быть использованы для лечения заболеваний, связанных с дисфункцией серотонина, у человека или животного, таких как расстройства, связанные с потреблением пищи, особенно ожирения, расстройства памяти; шизофрения, расстройства, характеризующиеся изменением настроения; расстройства, характеризующиеся тревожным состоянием (страхом); боль, половые дисфункции и расстройства, связанные с мочеиспусканием. Соединения, кроме того,можно использовать для лечения желудочно-кишечных расстройств, таких как расстройства желудочнокишечной подвижности, например синдром раздраженного кишечника (IBS), или глаукома. Уровень дозы и частота дозирования конкретного соединения обычно варьируются в зависимости от ряда факторов,включая активность конкретного используемого соединения, метаболическую стабильность и продолжительность действия такого соединения, возраст пациента, массу тела, общее состояние здоровья, пол,диету, способ и время введения, скорость выделения, комбинацию лекарственных средств, тяжесть состояния (заболевания), подлежащего лечению, и особенности лечения, которому подвергается пациент. Суточная доза может, например, составлять от около 0,001 до около 100 мг на килограмм массы тела,- 12005820 вводимая однократно или многократно в дозах, например, от около 0,01 до около 25 мг каждая. Обычно такая доза вводится перорально, однако, может быть выбрано и парентеральное введение. Далее изобретение более подробно иллюстрируется нижеследующими не ограничивающими его примерами. Примеры Общие сведения Структуры полученных соединений подтверждают стандартными спектроскопическими методами и элементным анализом и/или МС высокого разрешения. Данные ЯМР получают на спектрометре типаJEOL JNM-EX 270, Bruker 400 DPX или Bruker DRX 500. ИК-спектры получают на инфракрасном спектрометре типа Perkin Elmer SPECTRUM 1000 с Фурье-преобразованием. Данные МС высокого разрешения получают на Micromass LCT спектрометре. Элементный анализ осуществляют на оборудовании MicroKemi AB, Uppsala, Sweden. Температуры плавления, если представлены, получают на приборе для определения температуры плавления Buchi или Gallenkamp, и они представлены без учета поправки. Пример 1. 2-(2-Фенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, малеат. Стадия 1. 2-Хлор-3-(2-феноксиэтокси)пиразин.NaO-трет-Вu (2,91 г, 30,29 ммоль) добавляют к смеси 2,3-дихлорпиразина (4,75 г, 31,9 ммоль) и 2 феноксиэтанола (4,18 г, 30,3 ммоль) в диоксане (25 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение 1,5 ч и затем фильтруют. Фильтрат концентрируют при пониженном давлении и полученный кристаллический остаток сушат в вакуумном сушильном шкафу, получая 4,4 г(62%) указанного в заголовке соединения в виде белых восковых кристаллов: т.пл. 55-54 С. Элементный анализ (C12H11ClN2O2) С, Н, N. Стадия 2. 2-(2-Фенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, малеат. Смесь продукта со стадии 1 (1,705 г, 6,80 ммоль), пиперазина (1,75 г, 20,3 ммоль) и K2 СО 3 (1,16 г,8,39 ммоль) в ацетонитриле (10 мл) перемешивают при 50 С в течение 1,5 ч и в течение дополнительных 3 ч при 80 С. Реакционную смесь разбавляют CH2Cl2, фильтруют и концентрируют. Очистка полутвердого остатка хроматографией на силикагеле с использованием смеси СНСl3/МеОН (9:1) в качестве элюента дает бежевое масло. Это вещество повторно растворяют в смеси простой эфир/СНСl3 (9:1), сушат над K2 СО 3 и фильтруют через короткую (3 см) пробку из оксида алюминия. Фильтрат концентрируют в вакууме, получая 1,33 г (65%) указанного в заголовке соединения в виде свободного основания. Свободное основание превращают в малеат и перекристаллизовывают из смеси МеОН/простой эфир: т.пл. 155157 С; ВРМС (HRMS) m/z вычислено для C16H20N4O2 (M+) 300,1586; найдено 300,1573. Элементный анализ (C16H20N4O2 С 4 Н 4O4) С, Н, N. Пример 2. 2-(2-Фурилметокси)-3-(1-пиперазинил)пиразин, малеат. Стадия 1. 2-Хлор-3-(2-фурилметокси)пиразин. Указанное в заголовке соединение получают по способу, описанному в примере 1, стадия 1, исходя из 2-фуранметанола (4,18 г, 42,7 ммоль), 2,3-дихлорпиразина (2,05 г, 13,8 ммоль) и KО-трет-BuO (1,82 г,16,2 ммоль). Продукт, который получают в виде желтоватого масла с выходом 68%, используют непосредственно на следующей стадии. Стадия 2. 2-(2-Фурилметокси)-3-(1-пиперазинил)пиразин, малеат. Указанное в заголовке соединение получают по способу, описанному в примере 1, стадия 2, исходя из 2-хлор-3-(2-фурилметокси)пиразина (1,47 г, 7,0 ммоль): выход 0,62 г (34%) в виде свободного основания. Часть свободного основания превращают в малеатную соль: т.пл. 118-120 С; ВРМС m/z вычислено для C13H16N4 О 2 (М+) 260,1273; найдено 260,1270. Элементный анализ (C13H16N4 О 2 С 4 Н 4 О 4) С, Н, N. Пример 3. 2-(2-Феноксиэтокси)-3-(1-пиперазинил)хиноксалин, гидрохлорид. Стадия 1. 2-Хлор-3-(2-феноксиэтокси)хиноксалин. Указанное в заголовке соединение получают по способу, описанному в примере 1, стадия 1, исходя из 2-феноксиэтанола (3,7 г, 26,8 ммоль), 2,3-дихлорхиноксалина (1,33 г, 6,7 ммоль) и KО-трет-Вu (0,75 г,6,7 ммоль): выход 0,74 г (37%); т.пл. 99,5-101,5 С; ВРМС m/z вычислено для С 16 Н 13 СlN2O2 (M+) 300,0666; найдено 300,0672. Элементный анализ (C16H13ClN2O2) С, Н, N. Стадия 2. 2-(2-Феноксиэтокси)-3-(1-пиперазинил)хиноксалин, гидрохлорид. Указанное в заголовке соединение получают по способу, описанному в примере 1, стадия 2, исходя из 2-хлор-3-(2-феноксиэтокси)хиноксалина (0,65 г, 2,15 ммоль): выход 0,44 г (58%) в виде свободного основания. Часть свободного основания превращают в гидрохлоридную соль: т.пл. 123-126C; ВРМС m/z вычислено для C20H22N4O2 (M+) 350,1743; найдено 350,1748. Элементный анализ(С 20 Н 22N4O21,75 НСl0,5 Н 2 О) С, Н, N. Пример 4. 2-[2-(2-Нафтилокси)этокси]-3-(1-пиперазинил)пиразин, трифторацетат. Стадия 1. 2-Хлор-3-[2-(2-нафтилокси)этокси]пиразин. Гидрид натрия (55%-ная суспензия в минеральном масле; 44 мг, 1,0 ммоль) добавляют в смесь 2-(2 нафтокси)этанола (188 мг, 1,00 ммоль) и 2,3-дихлорпиразина (149 мг, 1,00 ммоль) в диоксане (0,5 мл), и реакционную смесь перемешивают при 40 С в течение 15 ч. Неочищенное вещество используют непосредственно на стадии 2.- 13005820 Стадия 2. 2-[2-(2-Нафтилокси)этокси]-3-(1-пиперазинил)пиразин, трифторацетат. Раствор пиперазина (430 мг, 5,00 ммоль) в смеси диоксана (0,5 мл) и ДМФА (1 мл) добавляют к неочищенному веществу со стадии 1. Реакционную смесь перемешивают при 60 С в течение 15 ч, затем разбавляют EtOAc, промывают водой, сушат (МgSO4) и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, используя смесь EtOAc/MeOH/HOAc/H2O (20:3:3:2) в качестве элюента. Фракции, содержащие продукт, объединяют и концентрируют. Остаток дополнительно очищают С-18 ВЭЖХ (HPLC), используя смесь СН 3 СN/Н 2O/ТФУК (градиент: СН 3 СN от 0 до 100%,ТФУК 0,1%), получая 34,5 мг (10%) указанного в заголовке продукта. ВРМС m/z вычислено для- 14005820 Пример 21. 4-(2-[3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)-1,3-бензоксазол-2-амин, фумарат. Стадия 1. 4-(2-Гидроксиэтокси)-2-амино-1,3-бензоксазол. Указанное в заголовке соединение получают по способу примера 91, стадия 1, исходя из 4 гидрокси-2-амино-1,3-бензоксазола (0,97 г, 6,5 ммоль) и этиленкарбоната (0,63 г, 7,1 ммоль). Твердое вещество; выход 46%; т.пл. 124-126 С. Элементный анализ (С 9 Н 10N2O3) С, Н, N. Ранее описан в J. Chem. Soc. 1960, 2369-2370. Стадия 2. 4-2-[(3-Хлор-2-пиразинил)окси]этокси-1,3-бензоксазол-2-амин. Указанное в заголовке соединение получают по способу примера 4, стадия 1, за исключением того,что используют 4 экв. как NaH, так и 2,3-дигидропиразина, исходя из продукта со стадии 1. Температура реакции составляет 90 С. Неочищенный продукт используют непосредственно на следующей стадии. Стадия 3. 4-(2-[3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)-1,3-бензоксазол-2-амин, фумарат. Указанное в заголовке соединение получают по способу примера 1, стадия 2, исходя из продукта с вышеупомянутой стадии 2. Выход свободного основания 24%. Свободное основание превращают в фумаратную соль: т.пл. 138-140 С. Элементный анализ (C17H20N6 О 3 С 4 Н 4 О 40,25 Н 2 О) С, Н, N. Пример 22. 2-(Фенокси)этил 3-(3-амино-1-пирролидинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу, описанному в примере 4, стадия 2, исходя из 2-хлор-3-(2-феноксиэтокси)пиразина (150 мг, 0,60 ммоль; из примера 1, стадия 1) и 3-аминопирролидина (270 мг, 3,13 ммоль), за исключением того, что конечную стадию экстракции осуществляют междуEtOAc и 5%-ным водным NaOH. Это дает 121 мг (67%) указанного в заголовке продукта. Элементный анализ (C16H20N4 О 2) С, Н; N: вычислено 18,65; найдено 18,0. Пример 23. 2-(2-Хлорфенокси)этил 3-(3-амино-1-пирролидинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу, описанному в примере 4, стадия 2, исходя из 2-хлор-3-[2-(2-хлорфенокси)этокси]пиразина (150 мг, 0,53 ммоль) и 3-аминопирролидина (252 мг,2,92 ммоль), за исключением того, что конечную стадию экстракции осуществляют между EtOAc и 5%ным водным NaOH. Это дает 100 мг (56%) указанного в заголовке продукта. Элементный анализ(C16H19ClN4 О 2) С, Н; N: вычислено 16,73; найдено 16,0. Полученный по способу, описанному в примере 4, стадия 1. Пример 24. 2-(4-Хлорфенокси)этил 3-(3-амино-1-пирролидинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу, описанному в примере 4, стадия 2, исходя из 2-хлор-3-[2-(4-хлорфенокси)этокси]пиразина (150 мг, 0,53 ммоль) и 3-аминопирролидина (247 мг,2,87 ммоль), за исключением того, что конечную стадию экстракции осуществляют между EtOAc и 5%ным водным NaOH. Это дает 123 мг (69%) указанного в заголовке продукта. Элементный анализ(C16H19ClN4 О 2) H, N; С: вычислено 57,40; найдено 56,9. Полученный согласно способу, описанному в примере 4, стадия 1. Пример 25. 2-(Фенокси)этил 3-(1,4-диазепан-1-ил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу, описанному в примере 4, стадия 2, исходя из 2-хлор-3-(2-феноксиэтокси)пиразина (150 мг, 0,60 ммоль; из примера 1, стадия 1) и гомопиперазина(250 мг, 2,5 ммоль), за исключением того, что конечную стадию экстракции проводят между EtOAc и 5%-ным водным NaOH. Это дает 141 мг (75%) указанного в заголовке продукта. Элементный анализ(C17H22N4 О 20,35EtOAc) С, H, N. Пример 26. 2,3-Дигидро-1,4-бензодиоксин-2-илметил 3-(1,4-диазепан-1-ил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу, описанному в примере 4, стадия 2, исходя из 2-хлор-3-(2,3-дигидро-1,4-бензодиоксин-2-илметокси) пиразина (150 мг, 0,54 ммоль) и гомопиперазина (266 мг, 2,66 ммоль), за исключением того, что конечную стадию экстракции осуществляют междуEtOAc и 5%-ным водным NaOH. Это дает 105 мг (57%) указанного в заголовке продукта. Элементный анализ (C18H22N4 О 3) H, N; С: вычислено 63,14; найдено 62,70. Полученный по способу, описанному в примере 4, стадия 1. Пример 27. 2-(4-Хлорфенокси)этил 3-(1,4-диазепан-1-ил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу, описанному в примере 4, стадия 2, исходя из 2-хлор-3-[2-(4-хлорфенокси)этокси]пиразина (150 мг, 0,53 ммоль) и гомопиперазина (287 мг, 2,87 ммоль),за исключением того, что конечную стадию экстракции осуществляют между EtOAc и 5%-ным водным(M+) 348,1353; найдено 348,1353. Элементный анализ (C17H21ClN4 О 2) С, Н, N. Получен по способу, описанному в примере 4, стадия 1. Пример 28. 2-(Фенокси)этил 3-(3-метил-1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу, описанному в примере 4, стадия 2, исходя из 2-хлор-3-(2-феноксиэтокси)пиразина (150 мг, 0,54 ммоль; из примера 1, стадия 1) и 2-метилпиперазина (250 мг, 2,5 ммоль), за исключением того, что конечную стадию экстракции осуществляют между- 15005820 Пример 29. 2-(4-Хлорфенокси)этил 3-(3-метил-1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу, описанному в примере 4, стадия 2, исходя из 2-хлор-3-[2-(4-хлорфенокси)этокси]пиразина (150 мг, 0,53 ммоль) и 2-метилпиперазина (256 мг, 2,56 ммоль),за исключением того, что конечную стадию экстракции осуществляют между EtOAc и 5%-ным водным(M+) 348,1353; найдено 348,1370. Элементный анализ (C17H21ClN4 О 2) С, Н, N. Полученный согласно методике, описанной в примере 4, стадия 1. Пример 30. 2-(2-Метоксифенокси)-1-метилэтил 3-(3-метил-1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу, описанному в примере 4, стадия 2, исходя из 2-хлор-3-[2-(2-метоксифенокси)-1-метилэтокси]пиразина (150 мг, 0,51 ммоль) и 2-метилпиперазина(260 мг, 2,6 ммоль), за исключением того, что конечную стадию экстракции осуществляют между EtOAc и 5%-ным водным NaOH. Это дает 118 мг (65%) указанного в заголовке продукта. ВРМС m/z вычислено для С 19 Н 26N4O3 (М+) 358,2005; найдено 358,2018. Элементный анализ (C19H26N4O3) С, Н, N. Полученный согласно методике, описанной в примере 4, стадия 1. Пример 31. 2,3-Дигидро-1,4-бензодиоксин-2-илметил 3-(3-метил-1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу, описанному в примере 4, стадия 2, исходя из 2-хлор-3-(2,3-дигидро-1,4-бензодиоксин-2-илметокси)пиразина (150 мг, 0,54 ммоль) и 2-метилпиперазина (293 мг, 2,92 ммоль), за исключением того, что конечную стадию экстракции осуществляют между EtOAc и 5%-ным водным NaOH. Это дает 118 мг (64%) указанного в заголовке продукта. ВРМС m/z вычислено для C18H22N4O3 (M+) 342,1692; найдено 342,1678. Элементный анализ (С 18 Н 22N4O3) Н, N; С: вычислено 63,14; найдено 62,30. Получен по способу, описанному в примере 4, стадия 1. Пример 32. 2-(Фенокси)этил 3-(4-этил-1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу, описанному в примере 4, стадия 2, исходя из 2-хлор-3-(2-феноксиэтокси)пиразина (150 мг, 0,60 ммоль; из примера 1, стадия 1) и N-этилпиперазина(250 мг, 2,19 ммоль), за исключением того, что конечную стадию экстракции осуществляют междуEtOAc и 5%-ным водным NaOH. Это дает 127 мг (64%) указанного в заголовке продукта. Элементный анализ (C18H24N4 О 2) С, Н, N. Пример 33. 2-(2-Хлорфенокси)этил 3-(4-этил-1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают способом, аналогичным способу примера 4, стадия 2,исходя из 2-хлор-3-[2-(2-хлорфенокси)этокси]пиразина (150 мг, 0,53 ммоль) и N-этилпиперазина(221 мг, 1,93 ммоль), за исключением того, что конечную стадию экстракции осуществляют междуEtOAc и 5%-ным водным NaOH. Это дает 100 мг (52%) указанного в заголовке продукта. Элементный анализ (C18H23ClN4 О 2) С, Н, N. Получен по способу, описанному в примере 4, стадия 1. Пример 34. 2-(4-Хлорфенокси)этил 3-(4-этил-1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу, описанному в примере 4, стадия 2, исходя из 2-хлор-3-[2-(4-хлорфенокси)этокси]пиразина (150 мг, 0,53 ммоль) и N-этилпиперазина (221 мг,1,93 ммоль), за исключением того, что конечную стадию экстракции осуществляют между EtOAc и 5%ным водным NaOH. Это дает 138 мг (72%) указанного в заголовке продукта. ВРМС m/z вычислено дляC18H23ClN4 О 2 (М) + 362,1510; найдено 362,1526. Элементный анализ (C18H23ClN4 О 2) С, Н, N. Получен согласно методике, описанной в примере 4, стадия 1. Пример 35. 2,3-Дигидро-1,4-бензодиоксин-2-илметил 3-(4-этил-1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу, описанному в примере 4, стадия 2, исходя из 2-хлор-3-(2,3-дигидро-1,4-бензодиоксин-2-илметокси)пиразина (150 мг, 0,54 ммоль) и N-этилпиперазина (219 мг, 1,92 ммоль), за исключением того, что конечную стадию экстракции осуществляют междуEtOAc и 5%-ным водным NaOH. Это дает 128 мг (66%) указанного в заголовке продукта. ВРМС m/z вычислено для С 19 Н 24N4O3 (М+) 356,1848; найдено 356,1848. Элементный анализ (C19H24N4O3) С, Н, N. Полученный согласно методике, описанной в примере 4, стадия 1. Пример 36. 2-(2-Метоксифенокси)-1-метилэтил 3-(4-этил-1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу, описанному в примере 4, стадия 2, исходя из 2-хлор-3-[2-(2-метоксифенокси)-1-метилэтокси]пиразина (150 мг, 0,51 ммоль) и N-этилпиперазина(222 мг, 1,94 ммоль), за исключением того, что конечную стадию экстракции осуществляют междуEtOAc и 5%-ным водным NaOH. Это дает 127 мг (67%) указанного в заголовке продукта. ВРМС m/z вычислено для С 20H28N4 О 3 (М+) 372,2161; найдено 372,2174. Элементный анализ (С 20H28N4 О 3) С, Н, N. Полученный согласно методике, описанной в примере 4, стадия 1. Пример 37. 2-(3-Бромфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Стадия 1. 2-(3-Бромфенокси)этил 3-хлор-2-пиразиниловый эфир. Смесь 3-бромфенола (1,73 г, 10,0 ммоль), этиленоксида (0,44 г, 10 ммоль), Et3N (3 капли) и диоксана (4 мл) нагревают при 100 С в герметизированной пробирке в течение 2 дней. Раствор охлаждают на бане со льдом и добавляют KО-трет-Вu (1,07 г, 9,50 ммол), а затем 2,3-дихлорпиразин (1,34 г, 9 ммоль)- 16005820 вместе с диоксаном (1 мл). Смесь перемешивают при комнатной температуре в течение 90 мин, разбавляют СН 2 Сl2 и фильтруют. Фильтрат концентрируют и остаток очищают хроматографией на силикагеле(градиент: изогексан до 25% EtOAc/изогексан), получая 2,21 г (75%) указанного в заголовке продукта в виде белого твердого вещества: т.пл. 57-58 С. Элементный анализ (C12H10BrClN2O2) С, Н, N. Стадия 2. 2-(3-Бромфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Пиперазин (1,29 г, 15,0 ммоль) и K2 СО 3 (0,69 г, 5,0 ммоль) добавляют в раствор 2-(3-бромфенокси) этил 3-хлор-2-пиразинилового эфира (1,65 г, 5,00 ммоль) в ацетонитриле (25 мл) при комнатной температуре. Смесь кипятят с обратным холодильником в течение 21 ч, дают возможность охладиться, концентрируют и остаток распределяют между водой и EtOAc. Слои разделяют и органическую фазу промывают водой и насыщенным раствором соли и сушат над MgSО 4. Очистка хроматографией на силикагеле(градиент: от PhMe до PhMe/MeOH/Et3N, 8:1:1) дает 1,61 г (85%) указанного в заголовке соединения в виде бледно-желтого масла, которое медленно отверждается при стоянии: т.пл. 62-63 С. Элементный анализ (C16H19BrN4 О 2) С, Н, N. Пример 38. 2-[2-(2-Хлорфенокси)этокси]-3-(1-пиперазинил)хиноксалин. Стадия 1. 2-Хлор-3-[2-(2-хлорфенокси)этокси]хиноксалин. 2-(2-Хлорфенокси)этанол (0,229 г, 1,33 ммоль) обрабатывают NaH (55%-ная дисперсия в минеральном масле; 0,058 г, 1,33 ммоль) в диоксане (2 мл). После перемешивания при комнатной температуре в течение 3 ч смесь добавляют по каплям в суспензию 2,3-дихлорхиноксалина (0,320 г, 1,60 ммоль) в диоксане (1 мл). Полученную смесь перемешивают при комнатной температуре в течение 15 ч, получая интермедиат, 2-хлор-3-[2-(2-хлорфенокси)этокси]хиноксалин, который используют непосредственно на следующей стадии. Стадия 2. 2-[2-(2-Хлорфенокси)этокси]-3-(1-пиперазинил)хиноксалин. Пиперазин (0,580 г, 6,65 ммоль) добавляют к неочищенному веществу со стадии 1 и полученную смесь перемешивают при комнатной температуре в течение 5 ч. Растворитель выпаривают и неочищенную смесь растворяют в ДМСО и осаждают водой. Осадок очищают хроматографией на силикагеле, используя смесь EtOAc/HOAc/MeOH/H2O (40:3:3:2) в качестве элюента, получая 0,100 г (22%) указанного в заголовке соединения в виде желтого масла. ВРМС m/z вычислено для C20H21ClN4O2 (M+) 384,1353; найдено 384,1334. Примеры 39-45 получают по методике примера 38, исходя из 2,3-дихлорхиноксалина и соответствующего спирта. Пример 39. 2-[2-(4-Хлорфенокси)этокси]-3-(1-пиперазинил)хиноксалин. Указанное в заголовке соединение получают, исходя из 2-(4-хлорфенокси)этанола (0,229 г, 1,33 ммоль),получая 0,250 г (56%) желтого твердого вещества: т.пл. 108-112 С; ВРМС m/z вычислено дляC20H21ClN4 О 2 (М+) 384,1353; найдено 384,1347. Пример 40. 2-[2-(Фенилтио)этокси]-3-(1-пиперазинил)хиноксалин. Указанное в заголовке соединение получают, исходя из 2-(фенилтио)этанола (0,205 г, 1,33 ммоль),получая 0,045 г (9%) желтого масла. ВРМС m/z вычислено для C20H22N4OS (М+) 366,1514; найдено 366,1509. Пример 41. 2-(1-Метил-2-феноксиэтокси)-3-(1-пиперазинил)хиноксалин. Указанное в заголовке соединение получают, исходя из 1-метил-2-феноксиэтанола (0,202 г, 1,33 ммоль),получая 0,084 г (17%) желтого масла. ВРМС m/z вычислено для C21H24N4O2 (М+) 364,1899; найдено 364,1908. Пример 42. 2-[1-Метил-2-(4-метилфенокси)этокси]-3-(1-пиперазинил)хиноксалин. Указанное в заголовке соединение получают, исходя из 1-метил-2-(4-метилфенокси)этанола (0,221 г,1,33 ммоль), получая 0,047 г (9%) желтого масла. Элементный анализ для С 22 Н 26N4O2 С, Н, N. Пример 43. 2-[2-(2-Метоксифенокси)-1-метилэтокси]-3-(1-пиперазинилхиноксалин. Указанное в заголовке соединение получают, исходя из 1-метил-2-(2-метоксифенокси)этанола(2,67 г, 19,3 ммоль) в ацетонитриле (8 мл) перемешивают в герметизированной пробирке в течение 12 ч при комнатной температуре и в течение дополнительных 9,5 ч при 80 С. Реакционную смесь разбавляют простым эфиром, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле, ис- 17005820 пользуя смесь н-гексан/EtOAc (7:3) в качестве элюента, получая 2,36 г (49%) указанного в заголовке соединения в виде желтоватого масла, которое отверждается при стоянии: т.пл. 51-53 С; ВРМС m/z вычислено для C12H12ClN3O (M+) 249,0669; найдено 249,0659. Элементный анализ (C12H12ClN3O) С, Н, N. Стадия 2. 2-(2-Феноксиэтиламино)-3-(1-пиперазинил)пиразин. Смесь продукта с вышеупомянутой стадии 1 (1,59 г, 6,37 ммоль), пиперазина (1,56 г, 18,2 ммоль) иK2 СО 3 (0,88 г, 6,4 ммоль) в ацетонитриле (10 мл) перемешивают при 140 С в течение 12 ч в герметизированной пробирке. После охлаждения реакционную смесь разбавляют СН 2 Сl2, фильтруют и концентрируют. Полутвердый остаток очищают хроматографией на силикагеле, используя смесь СНСl3/МеОН (9:1) в качестве элюента, получая бежевое масло. Это масло вновь растворяют в СНСl3 и фильтруют через короткую (3 см) пробку из оксида алюминия, покрытую K2 СО 3. Рыхлый слой промывают несколькими порциями СНСl3 и полученный фильтрат концентрируют, получая 1,48 г (78%) указанного в заголовке продукта в виде бледно-желтого масла. ВРМС m/z вычислено для C16H21N5O (M+) 299,1746; найдено 299,1753. Элементный анализ (C16H21N5O1/3 Н 2 О) С, Н, N. Пример 47. N-Метил-N-(2-феноксиэтил)-3-(1-пиперазинил)-2-пиразинамин, фумарат. Стадия 1. 3-Хлор-N-метил-N-(2-феноксиэтил)-2-пиразинамин. Смесь 2,3-дихлорпиразина (6,64 г, 44,6 ммоль) и N-метил-N-(2-феноксиэтил)амина (4,5 г, 29,8 ммоль) в ДМФА (5 мл) помещают в герметизированную пробирку из пирекса и нагревают в микроволновой печи (Labwell MW10) в течение 1 х 2 мин, а затем 2 х 1 мин при 75 Вт. Смесь концентрируют и полученное масло очищают колоночной хроматографией на диоксиде кремния, используя смесь гексан/EtOAc (95:5 с последующим 93:7), получая 5,56 г (71%) указанного в заголовке продукта в виде бесцветного масла. ВРМС m/z вычислено для С 13 Н 14 СlN3 О (M+) 263,0825; найдено 263,0824. Ранее описан в J. Chem. Soc. 1963, 1385-1400. Стадия 2. N-Meтил-N-(2-феноксиэтил)-3-(1-пиперазинил)-2-пиразинамин, фумарат. Смесь продукта, полученного на стадии 1 (5,0 г, 19 ммоль), и пиперазина (5,0 г, 59,4 ммоль) в ДМФА (10 мл) помещают в герметизированную пробирку из пирекса и нагревают в микроволновой печи(Labwell MW10) в течение 2,5 мин при 75 Вт. Смесь концентрируют и оставшееся желтое масло распределяют между водой и СНСl3. Водную фазу экстрагируют СНСl3 (х 2) и объединенные органические фазы экстрагируют 0,5 М водной НСl (х 2). Объединенные водные фазы подщелачивают (11 М NaOH) и экстрагируют СНСl3 (х 3). Объединенные органические фазы промывают водой и насыщенным раствором соли, сушат (MgSO4) и концентрируют, получая свободное основание указанного в заголовке продукта в виде светло-желтого масла. Свободное основание превращают в его фумаратную соль. Выход 1,38 г(17%) не совсем белых кристаллов из метанола; т.пл. 154 С. Элементный анализ (C17H23N5 ОC4H4 О 4) H,N, С: вычислено 58,7; найдено 58,05. Пример 48. 2-(Фенокси)этил 3-(3-пирролидинилокси)-2-пиразиниловый эфир. 2-Хлор-3-(2-феноксиэтокси)пиразин (150 мг, 0,60 ммоль; из примера 1, стадия 1) добавляют к перемешиваемой смеси 3-пирролидинола (260 мг, 2,99 ммоль) и NaH (55%-ная дисперсия в минеральном масле; 110 мг, 2,50 ммоль) в диоксане (2 мл) и реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Добавляют EtOAc и смесь промывают водой, сушат (MgSО 4) и концентрируют. Остаток очищают хроматографией на силикагеле, используя смесь EtOAc/MeOH/HOAc/H2 О (50:40:9:1) в качестве элюента, получая 38 мг (22%) указанного в заголовке соединения. Элементный анализN-Вос-(R)-3-пирролидинола (225 мг, 1,20 ммоль) и KО-трет-Bu (140 мг, 1,25 ммоль) в толуоле (5 мл) и реакционную смесь перемешивают при 95 С в течение 30 мин. Реакционную смесь разбавляют толуолом, промывают водой, сушат (MgSO4) и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, используя смесь толуол/EtOAc (9:1) в качестве элюента, получая 261 мг(65%) указанного в заголовке продукта, который используют в следующей стадии без дополнительной идентификации. Стадия 2. 2-(Фенокси)этил 3-[(3R)-пирролидинилокси]-2-пиразиниловый эфир. Продукт с вышеупомянутой стадии 1 обрабатывают смесью СН 2 Сl2/трифторуксусная кислота/Н 2 О(50:45:5; 4 мл) в течение 30 мин. Смесь концентрируют и остаток распределяют между 5%-ным воднымNaOH и СН 2 Сl2. После разделения органический слой сушат (МgSО 4) и концентрируют. Остаток очищают хроматографией на силикагеле, используя смесь CH2Cl2/MeOH (8:2) в качестве элюента, получая 44 мг(15%) указанного в заголовке продукта: []D=-4,6 (с 0,017, МеОН); ВРМС m/z вычислено для С 16 Н 19N3 О 3 (M+) 301,1425; найдено 301,1427. Пример 50. 2-(Фенокси)этил 3-(4-пиперидинилокси)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу, описанному в примере 49, исходя из 2 хлор-3-(2-феноксиэтокси)пиразина (250 мг, 1,00 ммоль; из примера 1, стадия 1) и N-Boc-4-гидроксипипе- 18005820 ридина (234 мг, 1,16 ммоль), получая 112 мг (35%) указанного в заголовке продукта. ВРМС m/z вычислено для C17H23N3O3 (M+) 315,1583; найдено 315,1570. Пример 51. 2-(Фенокси)этил 3-[(2S)-пирролидинилметокси]-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу, описанному в примере 49, исходя из 2 хлор-3-(2-феноксиэтокси)пиразина (250 мг, 1,00 ммоль; из примера 1, стадия 1) и N-Boc-L-пролинола(250 мг, 1,24 ммоль). Промежуточный продукт, 2-(фенокси)этил 3-[N-трет-бутоксикарбонил(2S)-пирролидинилметокси]-2-пиразиниловый эфир, не был охарактеризован. Выход 23 мг (7%); []D=+13,2 (с 0,016, МеОН). ВРМС m/z вычислено для C17H21N3O3 (M+) 315,1583; найдено 315,1598. Пример 52. 2-(2-Метоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Стадия 1. 2-Хлор-3-(4-трет-бутоксикарбонил-1-пиперазинил)пиразин. Смесь N-Boc-пиперазина (11,47 г, 61,5 ммоль), K2 СО 3 (8,5 г, 61 ммоль) и 2,3-дихлорпиразина (9,20 г,61,7 ммоль) в ацетонитриле (100 мл) перемешивают при 100 С в течение 40 ч. Реакционную смесь концентрируют, растворяют в толуоле, промывают водой, сушат (МgSО 4) и концентрируют. Остаток очищают хроматографией на силикагеле, используя смесь толуол/EtOAc (7:3) в качестве элюента, получая 18,3 г (100%) указанного в заголовке продукта. ВРМС m/z вычислено для С 13 Н 19 СlN4 О 2 (М+) 298,1197; найдено 298,1206. Стадия 2. 2-[3-(4-трет-Бутоксикарбонил-1-пиперазинил)-2-пиразинилокси]этанол.KО-трет-Bu (9,92 г, 103 ммоль) добавляют к смеси продукта, полученного на стадии 1 (18,14 г,60,7 ммоль), и этиленгликоля (25 мл, 448 ммоль) в пиридине (125 мл) при 85 С. Реакционную смесь перемешивают в течение 15 ч и затем выливают в смесь лед-вода и экстрагируют толуолом. Органическую фазу сушат (МgSO4) и концентрируют. Остаток очищают хроматографией на силикагеле, используя смесь толуол/EtOAc (1:1) в качестве элюента, получая 16,9 г (85%) указанного в заголовке продукта. ВРМС m/z вычислено для C15H24N4 О 4 (M+) 324,1798; найдено 324,1784. Стадия 3. 2-(2-Метоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. 1,1'-Азо-бис(N,N-диметилформамид) (TMAD; 60 мг, 0,35 ммоль) растворяют в ТГФ (1 мл) и ДМФА(0,5 мл) и добавляют к перемешиваемому раствору продукта со стадии 2 (100 мг, 0,31 ммоль), 2-метоксифенола (124 мг, 1,00 ммоль) и трифенилфосфина (92 мг, 0,35 ммоль) в ТГФ (1 мл). Реакционную смесь перемешивают в течение 15 ч и затем концентрируют при пониженном давлении. Остаток пропускают через слой силикагеля, используя смесь толуол/EtOAc/MeOH (45:45:10) в качестве элюента, и чистые фракции объединяют, концентрируют и обрабатывают смесью СН 2 Сl2/ТФУK/Н 2 О (50:45:5; 5 мл) в течение 30 мин. Смесь концентрируют и остаток очищают хроматографией на силикагеле, используя смесьEtOAc/HOAc/MeOH/H2O (20:3:3:2) в качестве элюента. Объединенные, содержащие продукт фракции концентрируют и распределяют между 5%-ным водным NaOH и CH2Cl2. Органическую фазу концентрируют и остаток очищают хроматографией на силикагеле, используя смесь CH2Cl2/MeOH (8:2) в качестве элюента, получая 11,2 мг (11%) указанного в заголовке продукта. ВРМС m/z вычислено для C17H22N4O3(1 ммоль, если не оговорено особо). Пример 53. 2-(4-н-Бутоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, трифторацетат. Указанное в заголовке соединение получают, исходя из п-бутоксифенола, но без экстракции NaOH и без третьей хроматографической стадии, получая 92 мг (19%) в виде трифторацетатной соли. ВРМСm/z вычислено для C20H22N4 О 2 (M+)350,1743; найдено 350,1758. Пример 56. 2- (2,5-Дифторфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, трифторацетат. Указанное в заголовке соединение получают, исходя из 2,5-дифторфенола, но без экстракции NaOH и без третьей хроматографической стадии, получая 21 мг (6%) в виде трифторацетатной соли. ВРМС mz вычислено для C16H18N4O2 (M+) 336,1398; найдено 336,1407. Пример 57. 2-(3,5-Диметоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают, исходя из 3,5-диметоксифенола, получая 52 мг (14%). ВРМС m/z вычислено для C18H24N4 О 4 (М+) 360,1798; найдено 360,1808. Пример 58. 2-[2-(2-Метокси-5-нитрофенокси)этокси]-3-(1-пиперазинил)пиразин, гидрохлорид. Указанное в заголовке соединение получают, исходя из 2-метокси-5-нитрофенола (0,524 г, 3,08 ммоль),получая 0,53 мг (42%). Пол-ЭИ-МС (Pos-EI-MS) [масс-спектрометрия с положительной электронной ионизацией] показывает М+ и 10 ионов, подтверждающих заявляемую структуру. ВРМС m/z вычислено для(31%). ВРМС m/z вычислено для C18H24N4 О 4 (M+) 360,1798; найдено 360,1800. Пример 61. 2-(2-Ацетилфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, трифторацетат. Указанное в заголовке соединение получают, исходя из 2-гидроксиацетофенона (170 мг, 1,25 ммоль) и 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)-2-пиразинилокси]этанола (325 мг, 1 ммоль; полученного в примере 52, стадия 2), но без экстракции NaOH и без третьей хроматографической стадии, получая 170 мг(37%) в виде трифторацета. ВРМС m/z вычислено для C18H22N4 О 3 (M+) 342,1692; найдено 342,1704. Пример 62. 2-(2-Ацетил-5-метоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, трифторацетат. Указанное в заголовке соединение получают, исходя из 2-гидрокси-4-метоксиацетофенона (208 г,1,25 ммоль) и 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)-2-пиразинилокси]этанола (325 мг, 1 ммоль; полученного в примере 52, стадия 2), но без экстракции NaOH и без третьей хроматографической стадии,получая 128 мг (26%) трифторацетата. ВРМС m/z вычислено для C19H24N4 О 4 (M+) 372,1798; найдено 372,1810. Пример 63. 2-(2-Ацетил-3,5-диметоксифенокси)этил (1-пиперазинил)-2-пиразиниловый эфир, трифторацетат. Указанное в заголовке соединение получают, исходя из 2-гидрокси-4,6-диметоксиацетофенона (245 мг,1,25 ммоль) и 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)-2-пиразинилокси]этанола (325 мг, 1,00 ммоль; полученного в примере 52, стадия 2), но без экстракции NaOH и без третьей хроматографической стадии,получая 216 мг (42%) трифторацетата. ВРМС m/z вычислено для С 20 Н 26N4O5 (M+) 402,1903; найдено 402,1886. Пример 64. 2-(5,6,7,8-Тетрагидро-2-нафтилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, трифторацетат. Указанное в заголовке соединение получают, исходя из 5,6,7,8-тетрагидро-2-нафтола (185 мг, 1,25 ммоль) и 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)-2-пиразинилокси]этанола (325 мг, 1,00 ммоль; полученного в примере 52, стадия 2), но без экстракции NaOH и без третьей хроматографической стадии, получая 155 мг (33%) трифторацетата. ВРМС m/z вычислено для C20H26N4O2 (M+) 354,2056; найдено 354,2068. Пример 65. 2-(2-Фтор-6-метоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают, исходя из 2-фтор-6-метоксифенола (178 мг, 1,25 ммоль) и 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)-2-пиразинилокси]этанола (1,17 ммоль; полученного в примере 52, стадия 2), получая 230 мг (66%) желтого масла. ВРМС m/z вычислено для C17H21FN4 О 3 (M+) 348,1598; найдено 348,1602. Пример 66. 2-(2-Метокси-4-метилфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают, исходя из 2-метокси-4-метилфенола (162 мг, 1,25 ммоль) и 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)-2-пиразинилокси]этанола (1,00 ммоль; полученного в примере 52, стадия 2), получая 233 мг (67%) желтого твердого вещества. ВРМС m/z вычислено дляC18H24N4O3 (M+) 344,1848; найдено 344,1839. Пример 67. 7-Изохинолинил 2-[3-(1-пиперазинил)]-2-пиразинилокси)этиловый эфир, дифумарат. Указанное в заголовке соединение получают, исходя из 7-гидроксиизохинолина (435 мг, 3,00 ммоль) и 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)-2-пиразинилокси]этанола (1,00 ммоль; полученного в примере 52, стадия 2). Свободное основание указанного в заголовке соединения превращают в его фумаратную соль. Выход 45 мг (2%); т.пл. 157 С (разл). ВРМС m/z вычислено для C19H21N5O2 (M+) 351,1695; найдено 351,1695. Элементный анализ (C19H21N5O22,3 С 4 Н 4O4). Пример 68. 2-(2-Хлор-4-метоксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают, исходя из 2-хлор-4-метоксифенола (103 мг, 0,65 ммоль) и 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)-2-пиразинилокси]этанола (0,61 ммоль; полученного в примере 52, стадия 2), по способу, описанному в примере 52, стадия 3, но используя диэтилазодикарбоксилат (ДЭАД) вместо TMAD. Выход 50 мг (21%). ВРМС m/z вычислено для C17H21ClN4O3 (М+) 364,1302; найдено 364,1307. Пример 69. 2-(2-[2-Фтор-5-(трифторметил)фенокси]этокси-3-(1-пиперазинил)пиразин. 2-Фтор-5-(трифторметил)фенол (0,54 г, 3,0 ммоль) добавляют к перемешиваемому раствору ДЭАД(0,52 г, 3,0 ммоль), РРh3 (0,79 г, 3,0 ммоль) и 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)-2-пиразинилокси]этанола (0,49 г, 1,5 ммоль; полученного в примере 52, стадия 2) в ТГФ (50 мл). Реакционную смесь перемешивают при комнатной температуре на протяжении ночи. Растворитель выпаривают и остаток очищают колоночной хроматографией на диоксиде кремния, используя смесь изогексан/EtOAc(80:20) в качестве элюента. Полученный N-Boc защищенный интермедиат обрабатывают смесью СН 2 Сl2/ТФУК (75:25; 5 мл) в течение 1 ч при комнатной температуре и концентрируют. Остаток очищают колоночной хроматографией на диоксиде кремния, используя смесь EtOAc/MeOH/Et3N (80:15:5) вm/z вычислено для C17H18F4N4O2 (M+) 386,1366; найдено 386,1367. Пример 70. 8-(2-[3-(1-Пиперазинил)-2-пиразинил]окси)этокси)-2 Н-1,4-бензоксазин-3(4 Н)-он, малеат. Стадия 1. 8-Гидрокси-2 Н-1,4-бензоксазин-3(4 Н)-он. Указанное в заголовке соединение получают по способу, описанному в J. Med. Chem. 1996, 39,3533-3538, заменяя 2-амино-м-крезол 3-аминопирокатехолом. Неочищенный продукт очищают колоночной хроматографией на силикагеле, используя смесь EtOAc/изогексан (от 1:2 до 2:1) в качесте элюента. Твердое вещество; выход 70%. МС m/z 165 (М+). Элементный анализ (С 8 Н 7NО 3) С, Н, N. Ранее упомянут в Liebigs Ann. Chem. 1957, 608, 128 и Synth. Commun. 1997, 27, 1661-1668. Стадия 2. 8-(2-[3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)-2 Н-1,4-бензоксазин-3(4 Н)-он, малеат. Указанное в заголовке соединение получают по способу примера 69, исходя из вышеуказанного продукта стадии 1. Выход 42%. МС m/z 372 (М+Н)+. Элементный анализ (C18H21N5 О 4 С 4 Н 4 О 4) С, Н, N. Пример 71. 2-2-[3-(Метилсульфонил)фенокси]этокси-3-(1-пиперазинил)пиразин. Стадия 1. 3-(Метилсульфонил)фенол. Указанное в заголовке соединение получают незначительно модифицированным, опубликованным ранее способом. 3-Аминофенилметилсульфонгидрохлорид (1,18 г, 5,70 ммоль) суспендируют в смеси вода/СН 2 Сl2. Смесь нейтрализуют 25%-ным водным NaOH. СН 2 Сl2-слой отделяют и упаривают досуха. К остатку добавляют водную H2SO4 (60%; 10 мл) и раствор охлаждают до 0 С. Добавляют по каплям раствор NaNO2 (0,345 г, 5,00 ммоль) в воде (5 мл). Раствор перемешивают при 0 С в течение 30 мин и при 90 С в течение 30 мин. Реакционной смеси дают возможность достигнуть комнатной температуры. Экстракция СН 2 Сl2, сушка (МgSO4) и концентрирование дают 0,39 г (40%) указанного в заголовке соединения в виде твердого вещества. МС m/z 172 (М+). ВРМС m/z вычислено для С 7 Н 8 О 3S (М+) 172,0194; найдено 172,0198.J. Chem. Soc. 1938, 899-905. Стадия 2. 2-2-[3-(Метилсульфонил)фенокси]этокси-3-(1-пиперазинил)пиразин. Указанное в заголовке соединение получают по способу примера 69, исходя из продукта стадии 1. Выход 26%. МС m/z 379 (М+Н)+. ВРМС m/z вычислено для C17H22N4O4S (M+) 378,1362; найдено 378,1343. Пример 72. 7-(2-[3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)-2 Н-хромен-2-он. Указанное в заголовке соединение получают по способу примера 69, исходя из 7-гидрокси-2 Нхромен-она. Выход 29%. МС m/z 369 (M+H)+. BPMC m/z вычислено для C19H20N4 О 4 (M+) 368,1485; найдено 368,1478. Пример 73. 2-(2,3,6-Трифторфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу примера 69, исходя из 2,3,6-трифторфенола. Выход 46%. МС m/z 355 (М+Н)+. ВРМС m/z вычислено для С 16H17F3N4O2 (М+) 354,1304; найдено 354,1288. Пример 74. 2-(2,4,5-Трифторфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу примера 69, исходя из 2,4,5-трифторфенола. Выход 43%. МС m/z 355 (М+Н)+. ВРМС m/z вычислено для C16H17F3N4O2 (M+) 354,1304; найдено 354,1304. Пример 75. 2-(2-Гидроксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу примера 69, исходя из катехола. Выход 37%. МС m/z 317 (М+Н)+. BPMC m/z вычислено для С 16 Н 20N4 О 3 (M+) 316,1535; найдено 316,1535. Пример 76. 2-(3-Гидроксифенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по способу примера 69, исходя из резорцина. Выход 36%. МС m/z 317 (М+Н)+. BPMC m/z вычислено для C16H20N4 О 3 (M+) 316,1535; найдено 316,1525. Пример 77. 2-[3-(4-Морфолинил)фенокси]этил 3-(1-пиперазинил)-2-пиразиниловый эфир. 1,1'-Азо-бис(N,N-диметилформамид) (TMAD; 256 мг, 1,50 ммоль) добавляют в раствор 2-[3-(4-третбутоксикарбонил-1-пиперазинил)-2-пиразинилокси]этанола (400 мг, 1,24 ммоль; полученного в примере 52, стадия 2), 3-(4-морфолинил)фенола (441 мг, 1,23 ммоль) и трифенилфосфина (646 мг, 2,46 ммоль) в ТГФ (3 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2,5 ч и затем концентрируют. Остаток очищают многократной хроматографией на силикагеле, используя толуол и смесь толуол/EtOAc (8:2) в качестве элюентов. Растворители выпаривают и остаток обрабатывают смесью СН 2 Сl2/ТФУК/Н 2O (1:0,9:0,1; 5 мл) при комнатной температуре в течение 0,5 ч. После концентрирования добавляют 5 М NaOH, за которым следует экстракция СН 2 Сl2. Органическую фазу сушат (K2 СО 3), фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле, используя смесь СНСl3/МеОН(9:1) в качестве элюента, получая 50 мг (10%) указанного в заголовке продукта в виде масла. BPMC m/z вычислено для С 20 Н 27N5 О 3 (M+) 385,2114; найдено 385,2100. Примеры 78-82 получают по методике примера 77, исходя из 2-[3-(4-тpeт-бyтoкcикapбoнил-1 пипepaзинил)-2-пиразинилокси]этанола и необходимого фенольного соединения.- 21005820 Пример 78. 2-(1,3-Бензодиоксол-4-илокси)этил(1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают, исходя из 1,3-бензодиоксол-4-ола (340 мг, 1,24 ммоль),получая 125 мг (29%) масла. ВРМС m/z вычислено для C17H20N4O4 (M+) 344,1485; найдено 344,1487. Получен, как описано в Chem. Pharm. Bull. 1980, 28, 2414-2421. Пример 79. 2-(2,3-Дигидро-1,4-бензодиоксин-5-илокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают, исходя из 2,3-дигидро-1,4-бензодиоксин-5-ола (374 мг,1,24 ммоль), получая 260 мг (59%) твердого вещества. ВРМС m/z вычислено для C18H22N4O4 (M+) 358,1641; найдено 358,1648. Получен, как описано в J. Am. Chem. Soc. 1959, 57, 5199-5201. Пример 80. 2-(2-Аллилфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают, исходя из 2-аллилфенола (330 мг, 1,24 ммоль), получая 200 мг (47%) масла. ВРМС m/z вычислено для C19H24N4 О 2 (M+) 340,1899; найдено 340,1888. Пример 81. 2-(3-Аминофенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают, исходя из 3-аминофенола (268 мг, 1,24 ммоль), получая 49 мг (13%) масла. ВРМС m/z вычислено для C16H21N5O2 (M+) 315,1695; найдено 315,1705. Пример 82. 2-(1-Oксоинданил-4-илокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают, исходя из 4-гидрокси-1-инданона (365 мг, 1,24 ммоль),получая 19 мг (4%) масла. ВРМС m/z вычислено для C19H22N4O3 (M+) 354,1692; найдено 354,1705. Пример 83. 2-(2,6-Дифторфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Указанное в заголовке соединение получают по методике примера 11, исходя из 2,6-дифторфенолаC16H18F2N4O2 (M+) 336,1398; найдено 336,1403. Пример 84. 5-Нитро-8-(2-[3-(1-пиперазинил)-2-пиразинил]оксиэтокси)хинолин, гидрохлорид. ДЭАД (0,485 мл, 3,08 ммоль) добавляют к перемешиваемому раствору 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)-2-пиразинилокси]этанола (1,00 г, 3,08 ммоль; полученного в примере 52, стадия 2),8-гидрокси-5-нитрохинолина (0,589 г, 3,08 ммоль) и РРh3 (0,85 г, 3,24 ммоль) в ТГФ (10 мл). Смесь перемешивают при комнатной температуре в течение 2 ч и концентрируют. Остаток пропускают через колонку с диоксидом кремния, используя смесь толуол/EtOAc (1:1) в качестве элюента. Полученный N-Bocзащищенный интермедиат обрабатывают смесью СН 2 Сl2/ТФУК/Н 2O (50:45:5; 15 мл) в течение 30 мин при комнатной температуре и концентрируют. Остаток растворяют в 0,1 М водной НС 1 и промывают толуолом. Водную фазу концентрируют, получая 0,206 г (15%) указанного в заголовке продукта. ПолЭИ-МС демонстрирует М+ и 7 ионов, подтверждающих заявляемую структуру; ВРМС m/z вычислено для C19H20N6O4 (M+) 396,1546; найдено 396,1557. Пример 85. 6-Метокси-7-(2-[3-(1-пиперазинил)-2-пиразинил]оксиэтокси)-2 Н-хромен-2-он, дигидрохлорид. ДЭАД (0,50 мл, 3,2 ммоль) добавляют по каплям к перемешиваемой смеси 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)-2-пиразинилокси]этанола (1,00 г, 3,08 ммоль; полученного в примере 52, стадия 2), скополетина (0,60 г, 3,1 ммоль) и трифенилфосфина (0,87 г, 3,3 ммоль) в ТГФ (10 мл) при комнатной температуре. Спустя 1 ч реакционную смесь разбавляют EtOAc и промывают водой. Органическую фазу сушат (MgSО 4), концентрируют и остаток очищают хроматографией на колонке с диоксидом кремния,используя смесь толуол/EtOAc (7:3) в качестве элюента. Чистые фракции объединяют и обрабатывают смесью СН 2 Сl2/ТФУК/Н 2 О (50:45:5; 5 мл) в течение 30 мин при комнатной температуре. Смесь разбавляют 0,2 М водной НСl и промывают EtOAc (х 3). Водный слой концентрируют, получая 0,075 г (5%) указанного в заголовке продукта. Пол-ЭИ-МС демонстрирует М+ и 15 ионов, подтверждающих заявляемую структуру. Элементный анализ (С 20H22N4 О 51,3 НСl1,4 Н 2 О) С, Н, N. Пример 86. 4-(2-[3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)-2,1,3-бензотиадиазол, дигидрохлорид. Стадия 1. трет-Бутил 4-3-[2-(2,1,3-бензотиадиазол-4-илокси)этокси]-2-пиразинил-1-пиперазинкарбоксилат. ДЭАД (0,52 мл, 3,3 ммоль) добавляют к суспензии 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)-2 пиразинилокси]этанола (1,00 г, 3,08 ммоль; полученного в примере 52, стадия 2), 4-гидрокси-2,1,3 бензотиадиазола (0,46 г, 3,0 ммоль) и связанного на полимере РРh3 (1,1 г, 3,3 ммоль) и встряхивают до тех пор, пока ВЭЖХ (HPLC) не покажет отсутствие исходного вещества. Смесь фильтруют, чтобы удалить полимер, концентрируют и очищают хроматографией на колонке с диоксидом кремния, получая 0,163 г (12%) указанного в заголовке соединения. Пол-ЭИ-МС демонстрирует М+ и 11 ионов, подтверждающих заявляемую структуру. ВРМС m/z вычислено для C21H26N6 О 4S (М+) 458,1736; найдено 458,1716. Исходное вещество 4-гидрокси-2,1,3-бензотиадиазол, получают, как описано в Khim. Geterotsikl.- 22005820 Стадия 2. 4-(2-[3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)-2,1,3-бензотиадиазол, дигидрохлорид. Продукт с вышеупомянутой стадии 1 (0,163 г, 0,356 ммоль) обрабатывают смесью СН 2 Сl2/ТФУК/Н 2 О(50:45:5; 5 мл) при комнатной температуре в течение 30 мин. Реакционную смесь концентрируют и разбавляют 0,1 М водной НСl и промывают толуолом. Водную фазу концентрируют и остаток перекристаллизовывают из смеси МеОН/диэтиловый эфир, получая 0,088 г (57%) указанного в заголовке продукта. Пол-ЭИ-МС демонстрирует М+ и 7 ионов, подтверждающих указанную структуру; ВРМС m/z вычислено для С 16 Н 18N6O2S (М+) 358,1212; найдено 358,1207. Элементный анализ (C16H18N6O2S2 НСlН 2O) С, Н, N. Пример 87. 8-(2-[3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)хиназолин, малеат. ДЭАД (0,657 мл, 4,00 ммоль) добавляют к перемешиваемому раствору 8-хиназолинола (0,55 г,3,76 ммоль), 2-[3-(4-трет-бутоксикарбонил-1-пиперазинил)-2-пиразинилокси]этанола (1,216 г, 3,75 ммоль; полученного в примере 52, стадия 2) и РРh3 (1,048 г, 4,00 ммоль) в ТГФ (12 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч и затем выливают в 5% водный NaOH и экстрагируютEtOAc. Органический слой сушат (MgSO4) и концентрируют. Остаток очищают хроматографией на колонке с диоксидом кремния, используя смесь толуол/EtOAc/MeOH (49:50:1). Чистые фракции объединяют и обрабатывают смесью СН 2 Сl2/ТФУК/Н 2O (50:45:5; 5 мл) при комнатной температуре в течение 30 мин,выливают в 0,5 М водную НСl и промывают EtOAc. Водную фазу подщелачивают до рН 12 и экстрагируют EtOAc, сушат (MgSO4) и концентрируют, получая 0,499 г (1,40 ммоль) свободного основания указанного в заголовке соединения. Свободное основание растворяют в диоксане (10 мл) и добавляют малеиновую кислоту (0,162 г, 1,40 ммоль) в диоксане (2 мл), и раствор концентрируют, получая 0,65 гTMAD (0,55 г, 3,20 ммоль) добавляют к перемешиваемому раствору 2-[3-(4'-трет-бутоксикарбонил 1-пиперазинил)-2-пиразинилокси]этанола (1,00 г, 3,08 ммоль; полученного в примере 52, стадия 2), 5 гидроксихиноксалина (0,45 г, 3,08 ммоль) и РРh3 (0,85 г, 3,24 ммоль) в ТГФ (20 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1,5 ч и при 65 С в течение 2 ч. Реакционную смесь концентрируют и остаток очищают хроматографией на колонке с диоксидом кремния, используя смесь толуол/EtOAc (1:1) в качестве элюента. Полученное твердое вещество перекристаллизовывают дважды из смеси диэтиловый эфир/петролейный эфир, чтобы удалить РРh3 О. Перекристаллизованное вещество(0,50 г) растворяют в МеОН (15 мл) и добавляют 1 М НСl (3,5 мл). Полученную смесь перемешивают при комнатной температуре в течение 4 ч (согласно данным ВЭЖХ/МС, снятие защиты N-Boc происходило только на 10%) Смесь концентрируют и остаток обрабатывают смесью СН 2 Сl2/ТФУК/Н 2 О (50:45:5; 20 мл) в течение 1 ч. После концентрирования в вакууме остаток растворяют в 0,1 М водной НСl и промывают толуолом. Водную фазу лиофилизуют, получая желтое масло, которое растворяют в 1 М НСl. Раствор концентрируют и добавляют МеОН и диэтиловый эфир. Образовавшийся осадок собирают и сушат в вакууме, получая 0,32 г (76%) указанного в заголовке продукта. Пол-ЭИ-МС демонстрирует М+ и 8 ионов,подтверждающих заявляемую структуру. ВРМС m/z вычислено для C18H20N6O2 (М+) 352,1648; найдено 352,1662. Исходное вещество 5-гидроксихиноксалин получают, как описано в J. Org. Chem. 1951,76, 438-442. Пример 89. 1-[7-(2-[3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)-1-бензофуран-2-ил]-1-этанон, гидрохлорид. ДЭАД (0,787 мл, 5,00 ммоль) добавляют к перемешиваемому раствору 2-[3-(4-третбутоксикарбонил-1-пиперазинил)-2-пиразинилокси]этанола (1,50 г, 4,63 ммоль; полученного в примере 52, стадия 2), 2-ацетил-7-гидроксибензофурана (0,88 г, 5,0 ммоль) и РРh3 (1,31 г, 5,0 ммоль) в ТГФ (3 мл) при слабом нагревании. После перемешивания в течение 30 мин при комнатной температуре реакционную смесь выливают в воду, экстрагируют EtOAc, сушат (МgSO4) и концентрируют. Остаток очищают хроматографией на колонке с диоксидом кремния, используя смесь толуол/EtOAc (7:3) в качестве элюента. Чистые фракции объединяют и обрабатывают смесью CH2Cl2/TФУK/H2O (50:45:5; 5 мл) в течение 30 мин при комнатной температуре. Смесь выливают в 0,5 М водную НСl и промывают EtOAc. Водный слой подщелачивают, добавляя NaOH, до рН 12 и экстрагируют EtOAc. Органический слой сушат (МgSО 4),фильтруют и концентрируют. Остаток (0,250 г, 0,65 ммоль) и гидрохлорид пиридиния (0,075 г, 0,65 ммоль) растворяют в МеОН. Смесь концентрируют и остаток неоднократно растворяют в EtOH и концентрируют еще 3 раза, получая 0,27 г (14%) указанного в заголовке соединения. Пол-ЭИ-МС демонстрирует М+ и 19 ионов, подтверждающих заявляемую структуру. ВРМС m/z вычислено для C20H22N4O4 (M+) 382,1641; найдено 382,1631. Пример 90. 3-(Фенокси)пропил 3-(1-пиперазинил)-2-пиразиниловый эфир, дигидрохлорид. Стадия 1. 2-Хлор-3-(1-пиперазинил)пиразин. Смесь 2,3-дихлорпиразина (1,35 г, 15,32 ммоль), пиперазина (2,34 г, 27,2 ммоль) и K2 СО 3 (1,25 г,9,04 ммоль) в ацетонитриле (5,5 мл) перемешивают при 110 С в течение 1,25 ч в герметизированной пробирке. Реакционную смесь разбавляют СН 2 Сl2, фильтруют и концентрируют, получая желтоватый- 23005820 полутвердый остаток, который очищают хроматографией на силикагеле, используя смесь СНСl3/МеОН(9:1) в качестве элюента. Полученное твердое вещество повторно растворяют в СНСl3 и наносят на короткую (3 см) пробку из оксида алюминия. Элюирование смесью простой эфир/СНСl3 (9:1) дает 1,24 г(69%) указанного в заголовке продукта в виде белого твердого вещества: т.пл. 47-53 С. ВРМС m/z вычислено для С 8 Н 11 СlN4 (М+) 198,0672; найдено 198,0673. Ранее упоминалось в J. Med. Chem. 1978, 21, 536-542. Стадия 2. 3-(Фенокси)пропил 3-(1-пиперазинил)-2-пиразиниловый эфир, дигидрохлорид. 2-Хлор-3-(1-пиперазинил)пиразин (608 мг, 3,1 ммоль; с вышеупомянутой стадии 1) и 3-феноксипропанол (570 мг, 3,7 ммоль) растворяют в диоксане (10 мл). Добавляют KО-трет-Вu (870 мг, 7,7 ммоль) и смесь перемешивают при 95 С в течение 6 ч. Растворитель выпаривают и остаток очищают хроматографией на силикагеле, используя смесь СН 2 Сl2/МеОН (9:1) в качестве элюента, получая свободное основание указанного в заголовке соединения в виде желтого масла. Свободное основание превращают в дигидрохлоридную соль: выход 0,380 г (32%); т.пл. 146-146,5 С. Элементный анализ (C17H22N4O22HCl) С, Н, N. Примеры 91-161 получают по методике примера 90, стадия 2, исходя из 2-хлор-3-(1 пиперазинил)пиразина и соответствующего спирта. Очистку осуществляют колоночной хроматографией на силикагеле, используя смесь СНСl3/МеОН (9:1) или смесь СНСl3/МеОН/NН 4OН (95:5:0,5) или другую систему соответствующих растворителей. Пример 91. 2-(2-Трифторметилфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Стадия 1. 2-(2-Трифторметилфенокси)этанол. Смесь 2-трифторметилфенола (2,00 г, 12,3 ммоль), K2 СО 3 (1,71 г, 12,3 ммоль) и этиленкарбоната(1,20 г, 13,6 ммоль) в сухом ДМФА (30 мл) нагревают при 150 С в течение 1 ч. После охлаждения реакцию гасят добавлением воды (10 мл). Смесь концентрируют в вакууме и остаток распределяют между водой (30 мл) и EtOAc (30 мл). Водную фазу экстрагируют дополнительными порциями EtOAc (3 х 30 мл). Объединенные органические слои обрабатывают углем, сушат над МgSO4 и фильтруют через целит. Фильтрат концентрируют в вакууме и оставшееся масло очищают хроматографией на силикагеле, используя смесь н-гексан/EtOAc (80:20) в качестве элюента, получая 0,50 г (20%) указанного в заголовке продукта в виде белых кристаллов: т.пл. 74-77 С. Элементный анализ (С 9 Н 9F3 О 2) С, Н. Стадия 2. 2-(2-Трифторметилфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Выход 48%; т.пл. 79-80 С. Элементный анализ (C17H19F3N4 О 2) С, Н, N. Пример 92. 2-(2-Метилтиофенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, малеат. Стадия 1. 2-(2-Метилтиофенокси)этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 2-(метилтио)фенола. Выход 63%; т.пл. 47-49 С. Элементный анализ (C9H12O2S) С, Н. Ранее описан в патенте США 3932498. Стадия 2. 2-(2-Метилтиофенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, малеат. Выход 68%; т.пл. 160-162 С. Элементный анализ (C17H22N4 О 2SС 4 Н 4 О 40,1 ТГФ) С, Н, N. Пример 93. 2-(2-Метилфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, малеат. Стадия 1. 2-(2-Метилфенокси)этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из о-крезола. Масло; выход 59%. ВРМС m/z вычислено для C9H12O2 (M+) 152,0837; найдено 152,0840. Ранее описан в Tetrahedron 1996, 52, 177-184. Стадия 2. 2-(2-Метилфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, малеат. Выход 33%; т.пл. 151-152 С. Элементный анализ (C17H22N4 О 2 С 4 Н 4 О 40,5H2O) С, Н, N. Пример 94. 2-(2,5-Диметилфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Стадия 1. 2- (2,5-Диметилфенокси)этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 2,5-диметилфенола. Выход 60%. т.пл. 45-48 С. Элементный анализ (С 10 Н 14 О 2) С, Н. Ранее описан в J. Chem. Sос. 1914, 2117-2139. Стадия 2. 2-(2,5-Диметилфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Масло; выход 65%. Элементный анализ (C18H24N4 О 2) С, Н, N. Пример 95. 2-(2-Фторфенокси)этил 3-1-пиперазинил)-2-пиразиниловый эфир, малеат. Стадия 1. 2-(2-Фторфенокси)этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 2-фторфенола. Масло; выход 71%. МС m/z 156 (М+). Ранее описан в J. Indian Chem. Soc. 1962, 39, 5-8. Стадия 2. 2-(2-Фторфенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, малеат. Выход 46%; т.пл. 171-173 С. Элементный анализ (C16H19FN4 О 2 С 4 Н 4 О 4) С, Н, N. Пример 96. 2-(2-Цианофенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, малеат. Стадия 1. 2-(2-Цианофенокси)этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 2-цианофенола. Масло; выход 26%. МС m/z 163 (М+).- 24005820 Ранее описан в J. Chem. Soc. 1914, 2117-2139. Стадия 2. 2-(2-Цианофенокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, малеат. Выход 40%; т.пл. 165-166 С. Элементный анализ (C17H19N5 О 2 С 4 Н 4 О 4) С, Н, N. Пример 97. 2-[(1,1'-Бифенил)-2-илокси]этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Стадия 1. 2-[(1,1'-Бифенил)-2-илокси]этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 2-фенилфенола. Выход 52%; т.пл. 71-75 С. Элементный анализ (C14H14 О 2) С, Н. Ранее описан в J. Med. Chem. 1987, 30, 939-943. Стадия 2. 2-[(1,1'-Бифенил)-2-илокси]этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Выход 53%; т.пл. 101-103 С. Элементный анализ (C22H24N4 О 2) С, Н, N. Пример 98. 4-(Фенокси)бутил 3-(1-пиперазинил)-2-пиразиниловый эфир, дигидрохлорид. Выход 49%; т.пл. 129-131 С. Элементный анализ (C18H24N4 О 22 НСl) С, Н, N. Исходное вещество 4-феноксибутанол получают, как описано в J. Оrg. Chem. 1965, 30, 2441-2447. Пример 99. 2-[2-(2-Фтор-5-метилфенокси)этокси]-3-(1-пиперазинил)пиразин, фумарат. Стадия 1. 2-(2-Фтор-5-метилфенокси)этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 2-фтор-5-метилфенола. Масло; выход 94%. МС m/z 170 (М+). Стадия 2. 2-[2-(2-Фтор-5-метилфенокси)этокси]-3-(1-пиперазинил)пиразин, фумарат. Выход 71%; т.пл. 145-146 С. Элементный анализ (C21H25FN4 О 60,3 Н 2 О) С, Н, N. Пример 100. 2-[2-(5-Фтор-2-метоксифенокси)этокси]-3-(1-пиперазинил)пиразин, фумарат. Стадия 1. 2-(5-Фтор-2-метоксифенокси)этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 5-фтор-2-метоксифенола. Выход 89%. МС m/z 186 (М+). Элементный анализ (С 9 Н 11FО 3) С, Н. Ранее описан в ЕP 331943.Получен, как описано в Bull. Soc. Chim. Belg. 1993, 102, 217-226. Стадия 2. 2-[2-(5-Фтор-2-метоксифенокси)этокси]-3-(1-пиперазинил)пиразин, фумарат. Выход 76%; т.пл. 172-176 С. Элементный анализ (C17H21FN4O3 С 4 Н 4O40,3 Н 2O) С, Н, N. Пример 101. 2-[2-(3-Фторфенокси)этокси]-3-(1-пиперазинил)пиразин, малеат. Стадия 1. 2-(3-Фторфенокси)этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 3-фторфенола. Масло; выход 83%. МС m/z 156 (М+). Ранее описан в Маgn. Reson. Chem. 1992, 30, 723-732. Стадия 2. 2-[2-(3-Фторфенокси)этокси]-3-(1-пиперазинил)пиразин, малеат. Твердое вещество, выход 51%; т.пл. 141-143 С. Элементный анализ (C16H19FN4O2 С 4 Н 4 О 4) С, Н, N. Пример 102. 2-[2-(3-Метоксифенокси)этокси]-3-(1-пиперазинил)пиразин, п-толуолсульфонат. Стадия 1. 2-(3-Метоксифенокси)этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 3-метоксифенола. Масло; выход 64%. МС m/z 168 (М+). Элементный анализ (С 9H12 О 3) C, H. Ранее описан в J. Chem. Soc. 1935, 1098-1101 и патенте США 5025031. Стадия 2. 2-[2-(3-Метоксифенокси)этокси]-3-(1-пиперазинил)пиразин, п-толуолсульфонат. Твердое вещество; выход 20%; т.пл. 131-133 С. Элементный анализ (C17H22N4 О 3 С 7 Н 8 О 3S) С, Н, N. Пример 103. 2-[2-(3-Ацетилфенокси)этокси]-3-(1-пиперазинил)пиразин. Стадия 1. 2-(3-Ацетилфенокси)-1-этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 3-гидроксиацетофенона. Масло; выход 82%. МС m/z 180 (М+). ВРМС m/z вычислено для С 10 Н 12 О 3(M+) 180,0786; найдено 180,0787. Ранее описан в Helv. Chim. Acta 1989, 72, 1216-1224. Стадия 2. 2-[2-(3-Ацетилфенокси)этокси]-3-(1-пиперазинил)пиразин, малеат. Выход свободного основания 68%. Часть свободного основания превращают в малеатную соль. МСm/z 343 (М+Н)+. Элементный анализ (C18H22N4 О 3 С 4H4 О 4) С, Н, N. Пример 104. 2-[2-(3-Цианофенокси)этокси]-3-(1-пиперазинил)пиразин. Стадия 1. 2-(3-Цианофенокси)-1-этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 3-цианофенола. Масло; выход 63%. МС m/z 163 (M+). Элементный анализ (C9H9NO2) С, Н, N. Ранее описан в J. Chem. Soc. 1914, 2117-2139 и Pharmazie 1975, 30, 353-357. Стадия 2. 2-[2-(3-Цианофенокси)этокси]-3-(1-пиперазинил)пиразин. Твердое вещество; выход 74%. МС m/z 326 (М+Н)+. Элементный анализ (C17H19N5O2) С, Н, N. Пример 105. 2-[2-(2,3-Дифторфенокси)этокси]-3-(1-пиперазинил)пиразин, фумарат. Стадия 1. 2-(2,3-Дифторфенокси)-1-этанол. Указанное а заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 2, 3-дифторфенола. Масло; выход 92%. МС m/z 174 (М+). Элементный анализ (C8H8F2O2) С, Н.- 25005820 Стадия 2. 2-[2-(2,3-Дифторфенокси)этокси]-3-(1-пиперазинил)пирaзин, фумарат. Выход 35%; т.пл. 125-130 С. Элементный анализ (C16H18F2N4 О 2C4H4 О 4) С, Н, N. Пример 106. 2-[2-(2,3,5-Трифторфенокси)этокси]-3-(1-пиперазинил)пиразин, фумарат. Стадия 1. 2-(2,3,5-Трифторфенокси)-1-этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 2,3,5-трифторфенола. Масло; выход 83%. МС m/z 192 (М+). Элементный анализ (C8H7F3O2) С, Н. Стадия 2. 2-[2-(2,3,5-Трифторфенокси)этокси]-3-(1-пиперазинил)пиразин, фумарат. Выход 35%; т.пл. 158-159 С. МС m/z 354 (М+). BPMC m/z вычислено для C16H17F3N4 О 2 (М+) 354,1304; найдено 354,1303. Элементный анализ (C16H17F3N4 О 2 С 4H4O4) С, Н, N. Пример 107. N-Фенил-3-(2-[3-(1-пиперазинил)-2-пиразинил]оксиэтокси)анилин, фумарат. Стадия 1. 2-(3-Анилинофенокси)-1-этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 3-анилинофенола. Масло; выход 75%. BPMC m/z вычислено для C14H15NО 2 (M+) 229,1103; найдено 229,1111. Ранее описан в патенте США 2077322 и ЕP 585500. Стадия 2. N-Фенил-3-(2-[3-(1-пиперазинил)-2-пиразинил]оксиэтокси)анилин, фумарат. Выход свободного основания 24%. Часть свободного основания превращают в его фумаратную соль: т.пл. 78-81 С; BPMC m/z вычислено для C22H25N5 О 2 (M+) 391,2008; найдено 391,2001. Элементный анализ (С 22H25N5O2 С 4 Н 4 О 4) С, Н, N. Пример 108. [3-(2-[3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)фенил]метанол, малеат. Стадия 1. 3-(2-Гидроксиэтокси)бензальдегид. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 3-гидроксибензальдегида. Масло; выход 88%. МС m/z 166 (М+). Элементный анализ (С 9 Н 10 О 30,2 Н 2 О) С, Н, N. Ранее описан в WO 9733202. Стадия 2. 2-[3-(Диметоксиметил)фенокси]-1-этанол. п-TsOH (165 мг, 0,87 ммоль) добавляют к раствору продукта, полученного на стадии 1 (1,45 г,8,73 ммоль), в безводном МеОН (60 мл). После перемешивания в течения 23 ч при комнатной температуре добавляют еще п-TsOH (170 мг, 0,89 ммоль). После дополнительного 4-часового перемешивания реакцию гасят добавлением NaHCО 3 (насыщенный водный раствор, 70 мл) и H2O (50 мл). Водную фазу экстрагируют EtOAc (3 х 100 мл). Объединенные органические фазы промывают насыщенным раствором соли и сушат (MgSО 4). Выпаривание растворителей дает желтое масло, которое используют на следующей стадии без очистки. Выход 1,59 г (86%). Продукт содержал около 5% исходного вещества (1 Н-ЯМР). Стадия 3. 2-2-[3-(Диметоксиметил)фенокси]этокси-3-(1-пиперазинил)пиразин. Масло; выход 63%; МС m/z 344 (М-СН 2 О)+. ВРМС m/z вычислено для C18H24N4 О 3(M-CH2 О)+ 344,1848, найдено 344,1847. Стадия 4. 3-(2-[3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)бензальдегид. НОАс (12 мл) и Н 2 О (4 мл) добавляют в раствор продукта, полученного на стадии 3 (858 мг,2,29 ммоль), в ТГФ (4 мл). Реакционную смесь перемешивают при 45 С в течение 1,5 ч и затем разбавляют EtOAc (150 мл). Органическую фазу промывают насыщенным раствором соли (х 2), водным насыщенным NаНСО 3 и насыщенным раствором соли. Сушка (МgSO4) с последующим выпариванием растворителей дает указанный в заголовке продукт (0,41 г) в виде ацетатной соли (1,7 НОАс, как определено методом 1H-ЯМР). Этот продукт используют на следующей стадии без очистки. Стадия 5. [3-(2-[3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)фенил]метанол, малеат. Продукт, полученный на стадии 4 (408 мг, 1,24 ммоль), растворяют в EtOH (99%, 35 мл). Сразу после добавления NaBH4 (293 мг, 7,75 ммоль) раствор становится белым. Реакционную смесь перемешивают при комнатной температуре в течение 5 ч и затем реакцию гасят, добавляя H2O (7 мл). Смесь фильтруют и фильтрат разбавляют водным насыщенным NaCl (30 мл) и Н 2 О (20 мл). Водный раствор экстрагируют EtOAc (x4). Объединенные органические фазы промывают насыщенным раствором соли и сушат(MgSО 4). Выпаривание растворителей дает полутвердый остаток (330 мг), который очищают хроматографией на колонке с диоксидом кремния, используя градиентное элюирование смесью EtOAc/MeOH(9:1)+1% NН 3 до EtOAc/MeOH (8:2)+1% NH3. Эта операция дает 76 мг (16%) свободного основания указанного в заголовке продукта в виде полутвердого вещества, которое превращают в его малеатную соль: т.пл. 123,2-123,5 С; МС m/z 331 (М+Н)+. ВРМС m/z вычислено для C17H22N4O3 (М+) 330,1692; найдено 330,1692. Пример 109. 2-2-[3-(Метоксиметил)фенокси]этокси-3-(1-пиперазинил)пиразин, малеат. Стадия 1. 2-[3-(Метоксиметил)фенокси]-1-этанол.Et3SiH (4,0 мл, 25,0 ммоль) добавляют в раствор продукта примера 108, стадия 1 (1,33 г, 8,00 ммоль) в МеОН (14 мл). Смесь охлаждают до 0 С и добавляют по каплям концентрированную H2SО 4 (1,5 мл) на протяжении 1,5 мин. Реакционную смесь перемешивают при комнатной температуре в течение 4,5 ч. Добавляют еще Et3SiH (1,5 мл, 9,4 ммоль) и продолжают перемешивание в течение 1 ч. После удаления- 26005820 растворителя в вакууме к остатку добавляют Н 2 О и доводят рН до 4 добавлением 2 М водного NaOH. Водный раствор экстрагируют CH2Cl2 (х 3). Объединенные органические фазы промывают насыщенным раствором соли, сушат (MgSО 4) и концентрируют, получая масло (1,8 г). Анализ методом ЯМР неочищенного продукта указывает только на 40% превращение. Поэтому повторяют процедуру обработки остатка Et3SiH (3 мл), МеОН (8 мл) и концентрированной H2SCО 4 (1,2 мл). После перемешивания в течение 4 ч при комнатной температуре добавляют еще H2SО 4 (1,2 мл). Перемешивание продолжают в течение еще 1 ч и проводят обработку, как указано выше. Неочищенный продукт очищают хроматографией на колонке с диоксидом кремния [градиент от 100% изогексана до изогексан/EtOAc (1:1)], получая указанное в заголовке соединение в виде бесцветного масла. Выход 0,98 г (67%); МС m/z 182 (М+). Элементный анализ (С 10 Н 14 О 30,1 Н 2O) С, Н. Стадия 2. 2-2-[3-(Метоксиметил)фенокси]этокси-3-(1-пиперазинил)пиразин, малеат. Выход свободного основания указанного в заголовке соединения 0,61 г (80%). Часть этого вещества превращают в малеатную соль: т.пл. 114-115 С; МС m/z 345 (М+Н)+. Элементный анализ(С 18 Н 24N4O3 С 4 Н 4O4) С, Н, N. Пример 110. 3-(2-[3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)бензамид, малеат. Стадия 1. 3-(2-Гидроксиэтокси)бензамид. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 3-гидроксибензамида. Выход 62%. МС m/z 181 (М+). ВРМС m/z вычислено для С 9 Н 11NО 3 (М+) 181,0739; найдено 181,0739. Ранее описан в WO 8606628. Стадия 2. 3-(2- [3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)бензамид, малеат. Выход свободного основания указанного в заголовке соединения 43%. Получают малеатную соль: т.пл. 134-137 С; МС m/z 344 (М+Н)+. Элементный анализ (C17H21N5O3 С 4 Н 4O4) С, Н, N. Пример 111. N-Фенил-4-(2-[3-(1-пиперазинил)-2-пиразинил]окси)этокси)анилин, малеат. Стадия 1. 2-(4-Анилинофенокси)этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 4-анилинофенола. Твердое вещество; выход 0,85 г (75%). МС m/z 156 (M+). Элементный анализ(C14H15NO2) С, Н, N. Ранее описан в ЕP 420790. Стадия 2. N-Фенил-4-(2-[3-(1-пиперазинил)-2-пиразинил]оксиэтокси)анилин, малеат. Выход свободного основания указанного в заголовке соединения 44%. Получают малеатную соль: т.пл. 132-133 С; МС m/z 392 (М+Н)+. Элементный анализ (C22H25N5 О 2C4H4O4) С, Н, N. Пример 112. Стадия 1. N-[4-(2-Гидроксиэтокси)фенил]ацетамид. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 4-ацетамидофенола. Твердое вещество; выход 1,38 г (52%); МС m/z 195 (М+). Элементный анализ(С 10 Н 13NO30,1 Н 2O) С, Н, N. Ранее описан в J. Heterocycl. Chem. 1994, 31, 457-480. Стадия 2. N-[4-(2-[3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)фенил]ацетамид. Твердое вещество; выход 0,47 г (53%); МС m/z 357 (М+). ВРМС m/z вычислено для C18H23N5 О 3 (M+) 357,1801, найдено 357,1810. Пример 113. 2-(1-Пиперазинил)-3-2-[3-(трифторметокси)фенокси]этоксипиразин, малеат. Стадия 1. 2-[3-(Трифторметокси)фенокси]этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 3-фторметоксифенола. Масло; выход 0,75 г (60%). МС m/z 222 (M+). Элементный анализ (С 9 Н 9F3 О 3) С, Н. Стадия 2. 2-(1-Пиперазинил)-3-2-[3-(трифторметокси)фенокси]этоксипиразин, малеат. Выход свободного основания указанного в заголовке соединения 61%. Получают малеатную соль: МС m/z 385 (М+Н)+. Элементный анализ (C17H19F3N4 О 3 С 4 Н 4 О 40,03Et2O) С, Н, N. Пример 114. 2-[2-(3,5-Дифторфенокси)этокси]-3-(1-пиперазинил)пиразин, п-толуолсульфонат. Стадия 1. 2-(3,5-Дифторфенокси)-1-этанол. В герметизированной пробирке из пирекса, смесь 3,5-дифторфенола (2,19 г, 16,8 ммоль), этиленкарбоната (1,0, 11,4 ммоль), каталитического количества NaH (60% в минеральном масле) в ДМФА (1 мл) подвергают взаимодействию в Labwell MW-10 микроволновом реакторе при 50 Вт в течение 3 мин. Реакционную смесь разбавляют толуолом и промывают 5%-ным водным NaOH. Органическую фазу сушат(MgSО 4) и концентрируют. Эта операция дает 1,59 г (80%) указанного в заголовке соединения в виде светло-красного масла. МС m/z 174 (М+). Стадия. 2-[2-(3,5-Дифторфенокси)этокси]-3-(1-пиперазинил)пиразин, п-толуолсульфонат. Выход 14%; т.пл. 118-119 С. Элементный анализ (C16H18F2N4 О 2 С 7 Н 8 О 3S) С, Н, N.- 27005820 Пример 115. 2-[2-(1,3-Бензодиоксол-5-илокси)этокси]-3-(1-пиперазинил)пиразин. Стадия 1. 2-(1,3-Бензодиоксол-5-илокси)этанол. Указанное в заголовке соединение получают по способу примера 114, стадия 1, исходя из сезамола(2,0 г, 14,5 ммоль) и этиленкарбоната (1,0 г, 11,4 ммоль): твердое вещество; выход 99%. МС m/z 182 (М+). Ранее описан в J. Org. Chem. 1960, 25, 626-632. Стадия 2. 2-[2-(1,3-Бензодиоксол-5-илокси)этокси]-3-(1-пиперазинил)пиразин. Твердое вещество; выход 71%. МС m/z 345 (М+Н)+. Элементный анализ (C17H20N4 О 4) С, Н, N. Пример 116. 2-[2-(3-Бутоксифенокси)этокси]-3-(1-пиперазинил)пиразин, малеат. Стадия 1. 2-(3-Бутоксифенокси)этанол. Указанное в заголовке соединение получают по способу примера 114, стадия 1, исходя из 3-н-бутоксифенола (2,0 г, 12 ммоль) и этиленкарбоната (0,88 г, 10 ммоль). Масло; выход 85%. МС m/z 210 (М+). Стадия 2. 2-[2-(3-Бутоксифенокси)этокси]-3-(1-пиперазинил)пиразин, малеат. Выход свободного основания указанного в заголовке соединения 77%. Часть свободного основания превращают в малеатную соль. МС m/z 373 (М+Н)+. Элементный анализ (C20 Н 28N4 О 3 С 4 Н 4O4) С, Н, N. Пример 117. 2-[2-(3-Трифторметилфенокси)этокси]-3-(1-пиперазинил)пиразин. Стадия 1. 2-(3-Трифторметилфенокси)этанол. Указанное в заголовке соединение получают по способу примера 114, стадия 1, исходя из 3-трифторметилфенола (3,89 г, 24 ммоль) и этиленкарбоната (1,76 г, 20 ммоль), за исключением того, что не используют ДМФА. Масло; выход 64%. МС m/z 206 (М+). Стадия 2. 2-[2-(3-Трифторметилфенокси)этокси]-3-(1-пиперазинил)пиразин, малеат. Выход свободного основания указанного в заголовке соединения 65%. Часть свободного основания превращают в малеатную соль. МС m/z 369 (М+Н)+. ВРМС m/z вычислено для C17H19F3N4O2 (M+) 368,1460; найдено 368,1460. Пример 118. 2-[2-([1,1'-Бифенил]-3-илокси)этокси]-3-(1-пиперазинил)пиразин, малеат. Стадия 1. 2-(3-Фенилфенокси)этанол. Указанное в заголовке соединение получают по способу примера 114, стадия 1, исходя из 3-фенилфенола (1,72 г, 10,1 ммоль) и этиленкарбоната (0,80 г, 9,1 ммоль) и ДМФА (3 мл). Полутвердое вещество; выход 86%. МС m/z 214 (М+). Ранее описан в патенте США 2140824. Стадия 2. 2-[2-([1,1'-Бифенил]-3-илокси)этокси]-3-(1-пиперазинил)пиразин, малеат. Выход свободного основания 65%. Часть свободного основания превращают в малеатную соль. МСm/z 377 (М+Н)+. ВРМС m/z вычислено для (C22H24N4 О 2 С 4 Н 4 О 4) С, Н, N. Пример 119. 2-[2-(3-Ацетамидофенокси)этокси]-3-(1-пиперазинил)пиразин, малеат. Стадия 1. 2-(3-Ацетамидофенокси)-1-этанол. Указанное в заголовке соединение получают по способу примера 114, стадия 1, исходя из 3 ацетамидофенола (2,10 г, 13,9 ммоль) и этиленкарбоната (0,88 г, 10 ммоль). Неочищенный продукт очищают хроматографией на колонке с диоксидом кремния, используя смесь толуол/EtOAc/MeOH (49:49:2). Масло; выход 99%. МС m/z 195 (М+). Ранее описан в J. Am. Chem. Soc. 1939, 61, 355-357. Стадия 2. 2-[2-(3-Ацетамидофенокси)этокси]-3-(1-пиперазинил)пиразин, малеат. Выход 38%; т.пл. 154-155 С. Элементный анализ (C18H23N5 О 3 С 4 Н 4 О 4) С, Н, N. Пример 120. 2-[4-(2-[3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)фенокси]этанол, малеат. Указанный в заголовке продукт получают из 1,4-бис(2-гидроксиэтокси)бензола. Выход свободного основания указанного в заголовке соединения 51%. Получают малеатную соль: т.пл. 127-129 С. МС m/z 361 (М+Н)+. Элементный анализ (C18H24N4 О 4 С 4 Н 4 О 4) С, Н, N. Пример 121. 2-[3-(2-[3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)фенокси]этанол, малеат. Указанный в заголовке продукт получают из 1,3-бис(2-гидроксиэтокси)бензола. Выход свободного основания указанного в заголовке соединения 45%. Получают малеатную соль: т.пл. 111-114 С; МС m/z 361 (М+Н)+. Элементный анализ (C18H24N4 О 4 С 4 Н 4 О 40,1 Н 2 О) С, Н, N. Пример 122. 2-(Бензофуран-2-илметокси)-3-(1-пиперазинил)пиразин, гидрохлорид. Выход 44%; т.пл. 160-161 С. Элементный анализ (C17H18N4 О 2 НСl) С, Н, N. Исходное вещество, бензофуран-2-илметанол, получают из бензофуран-2-карбоксальдегида восстановлением боргидридом натрия. Пример 123. 2-(2,3-Дигидробензофуранил-2-илметокси)-3-(1-пиперазинил)пиразин, дигидрохлорид. Выход 33%; т.пл. 172-174 С. Элементный анализ (C17H20N4 О 22 НСl) С, Н, N. Исходное вещество,2,3-дигидробензофуран-2-илметанол, получают из бензофуран-2-карбоксальдегида восстановлением боргидридом натрия и последующим каталитическим гидрированием. Ранее описан в Bioorg. Mod. Chem. Lett. 1999, 9, 401-406. Пример 124. 2-(1-Пиперазинил)-3-(тетрагидро-2-фуранилметокси)пиразин, гидрохлорид. Указанное в заголовке соединение получают, исходя из тетрагидрофурфурилового спирта. Выход 65%; т.пл. 130-136 С. Элементный анализ (C13H20N4 О 2 НСlH2O) С, Н, N.- 28005820 Пример 125. 2-(1-Пиперазинил)-3-[3-(2-пиридинил)пропокси]пиразин, малеат. Указанное в заголовке соединение получают, исходя из 2-пиридинпропанола. Выход 51%; т.пл. 147-148 С. Элементный анализ (C16H21N5O1,05 С 4 Н 4O4) С, Н, N. Пример 126. 2-(1-Пиперазинил)-3-[3-(3-пиридинил)пропокси]пиразин, малеат. Указанное в заголовке соединение получают из 3-пиридинпропанола. Выход 43%; т.пл. 128-130 С. Элементный анализ (C16H21N5 ОС 4H4O4) С, Н, N. Пример 127. 2-(1-Пиперазинил)-3-[3-(4-пиридинил)пропокси]пиразин, малеат. Указанное в заголовке соединение получают из 4-пиридинпропанола. Выход 41%; т.пл. 90-91 С. Элементный анализ (C16H21N5 ОС 4 Н 4 О 40,7 Н 2 О) С, Н, N. Пример 128. 2-[3-(6-Метил-2-пиридинил)пропокси]-3-(1-пиперазинил)пиразин, малеат. Указанное в заголовке соединение получают, исходя из 6-метил-2-пиридинпропанола. Выход 30%; т.пл. 134-136 С. Элементный анализ (C17H23N5OС 4H4 О 4) С, Н, N. Пример 129. 2-[(Е)-3-Фенил-2-пропенилокси]-3-(1-пиперазинил)пиразин. Указанное в заголовке соединение получают, исходя из циннамилового спирта. Масло; выход 39%. Элементный анализ (C17H20N4O0,2 Н 2O) С, Н, N. Пример 130. 2-(3,4-Дигидро-2 Н-1,4-бензоксазин-2-илметокси)-3-(1-пиперазинил)пиразин, дигидрохлорид. Выход 22%; т.пл. 171-175 С. Элементный анализ (C17H21N5 О 22 НСl) С, Н, N. Исходное вещество, 3,4-дигидро-2 Н-1,4-бензоксазин-2-илметанол, получают, как описано в J.Heterocycl. Chem. 1996, 33, 191-196. Пример 131. 2-(4-Метил-3,4-дигидро-2 Н-1,4-бензоксазин-2-илметокси)-3-(1-пиперазинил)пиразин,гидрохлорид. Выход 49%; т.пл. 119 С (разл). Элементный анализ (C18H23N5 О 21,33 НСl) С, Н, N. Исходное вещество, 3,4-дигидро-4-метил-2 Н-1,4-бензоксазин-2-илметанол, был описан ранее в J.(0,97 г, 7,1 ммоль) в ДМФА (6 мл) нагревают при 155 С в течение 1,5 ч при перемешивании в герметизированной пробирке. После охлаждения смесь разбавляют СНСl3 и фильтруют через подушку целита. Коричневатый фильтрат концентрируют в вакууме и остаток очищают хроматографией на силикагеле, используя EtOAc в качестве элюента, получая 1,8 г (67%) указанного в заголовке продукта в виде бежевого масла, которое отверждается при стоянии: т.пл. 64-67 С; ВРМС m/z вычислено для C11H11NО 2 (M+) 189,0790; найдено 189,0789. Элементный анализ (C11H11NO2) С, Н, N. Стадия 2. 2-(5-Изохинолинилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, малеат. Выход 55% в виде свободного основания. Свободное основание превращают в малеатную соль: т.пл. 178-180,5 С; ВРМС m/z вычислено для C19H21N5 О 2 (M+) 351,1695; найдено 351,1694. Элементный анализ (C19H21ClN5O2 С 4H4O4) С, Н, N. Пример 135. 2-(5-Хинолинилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, малеат. Стадия 1. 2-(5-Хинолинилокси)этанол. Указанное в заголовке соединение получают по способу, описанному в примере 134, стадия 1, исходя из 5-гидроксихинолина (0,93 г, 6,40 ммоль). Выход 1,19 г (91%); т.пл. 109-111 С; ВРМС m/z вычислено для C11H11NО 2 (M+) 189,0790; найдено 189,0786. Элементный анализ (C11H11NO2) С, Н, N. Стадия 2. 2-(5-Хинолинилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, малеат. Выход 61% в виде свободного основания. Свободное основание превращают в малеатную соль: т.пл. 132-135 С; ВРМС m/z вычислено для C19H21N5 О 2 (М+) 351,1695; найдено 351,1681. Элементный анализ (C19H21N5 О 21,8 С 4 Н 4 О 4) С, Н, N. Пример 136. 2-(6-Хинолинилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, малеат. Стадия 1. 2-(6-Хинолинилокси)этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 6-гидроксихинолина. Выход (78%); т.пл. 68-70 С. Элементный анализ (C11H11NО 2) С, Н, N. Стадия 2. 2-(6-Хинолинилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, малеат. Выход 33%; т.пл. 167-169 С. Элементный анализ (C19H21N5 О 2 С 4 Н 4 О 4) С, Н, N.- 29005820 Пример 137. 2-(7-Хинолинилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, малеат. Стадия 1. 2 -(7-Хинолинилокси)этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 7-гидроксихинолина. Выход (76%); т.пл. 93-95 С. Элементный анализ (С 11 Н 11NO2) С, Н, N. Стадия 2. 2-(7-Хинолинилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, малеат. Выход 39%; т.пл. 156-158 С. Элементный анализ (C19H21N5 О 2 С 4 Н 4 О 4) С, Н, N. Пример 138. 2-(8-Хинолинилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Стадия 1. 2-(8-Хинолинилокси)этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 8-гидроксихинолина. Выход (48%); т.пл. 82-84 С. Элементный анализ (C11H11NO2) С, Н, N. Ранее описан в Pharm. Chem. J. 1994, 28, 934-936. Стадия 2. 2-(8-Хинолинилокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир. Выход 62%; т.пл. 98-100 С. Элементный анализ (C19H21N5 О 20,05 EtOAc) С, Н, N. Пример 139. 5-Хлор-8-(2-[3-(1-пиперазинил)-2-пиразинил]оксиэтокси)-2-хинолинамин, фумарат. Стадия 1. 2-[(5-Хлор-8-хинолинил)окси]-1-этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 5-хлор-8-гидроксихинолина (3,59 г, 20 ммоль). Выход 48%. Пол-ЭИ-МС демонстрирует М+ и 5 ионов,подтверждающих заявляемую структуру; ВРМС m/z вычислено для C11H10ClNO2 (M+) 223,0400; найдено 223,0392. Элементный анализ (С 11 Н 10 СlNO2) С, Н, N. Стадия 2. 5-Хлор-8-(2-[3-(1-пиперазинил)-2-пиразинил]-оксиэтокси)-2-хинолинамин, фумарат. Неочищенный продукт очищают хроматографией на колонке с диоксидом кремния, используя смесь СНСl3/МеОН/NН 4OН (90:10:0,3) в качестве элюента. После выпаривания растворителей из объединенных чистых фракций полученное свободное основание превращают в его соль фумаровой кислоты. Перекристаллизация из воды дает 1,22 г (50%) указанного в заголовке продукта в виде белых кристаллов: т.пл. 178 С (разл). Элементный анализ (C19H20N5O2 С 4H4 О 4) С, Н, N. Пример 140. 2-(Бензофуран-7-илокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, малеат. Стадия 1. 2-(Бензофуран-7-илокси)этанол. Указанное в заголовке соединение получают по способу, описанному в примере 91, стадия 1, исходя из 7-гидроксибензофурана, и выделяют в виде полутвердого вещества; выход 79%. Получен, как описано в J. Med. Chem. 1987, 30, 62-67. Стадия 2. 2-(Бензофуран-7-илокси)этил 3-(1-пиперазинил)-2-пиразиниловый эфир, малеат. Выход 42% в виде свободного основания. Часть свободного основания превращают в малеатную соль: т.пл. 177-179 С; МС m/z 341 (М+Н)+. Элементный анализ (C18H20N4 О 3 С 4H4O4) С, Н, N. Пример 141. 7-(2-[3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)-1H-индол. Стадия 1. 2-(1 Н-Индол-7-илокси)-1-этанол. Смесь 7-гидроксииндола (1,00 г, 7,51 ммоль) и этиленоксида (0,33 г, 7,50 ммоль) в диоксане (3 мл) помещают в реакционную пробирку. Добавляют NaH (60% в масле; 0,100 г, 2,45 ммоль) и реакционную смесь перемешивают при 100 С в течение 5 дней. Реакционную смесь выливают в воду, экстрагируютEtOAc, сушат (МgSO4) и концентрируют. Остаток очищают хроматографией на силикагеле, используя смесь толуол/EtOAc (1:1) в качестве элюента, получая 0,45 г (34%) указанного в заголовке продукта. Пол-ЭИ-МС демонстрирует М+ и 5 ионов, подтверждающих заявляемую структуру, ВРМС m/z вычислено для C10H11NO2 (М+) 177,0790; найдено 177,0799. Стадия 2. 7-(2-[3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)-1H-индол. Продукт, полученный в вышеупомянутой стадии 1 (0,200 г, 1,13 ммоль), и диоксан (4 мл) помещают в реакционную пробирку и добавляют NaH (60% в масле; 0,060 г, 1,50 ммоль). После прекращения выделения газа добавляют 2-хлор-3-(1-пиперазинил)пиразин (0,228 г, 1,15 ммоль; из примера 90, стадия 1) и пробирку герметизируют. Смесь перемешивают при 100 С в течение 3 ч. После охлаждения реакционную смесь выливают в воду и экстрагируют EtOAc. Органический слой экстрагируют 0,5 М водной НСl. рН водной фазы доводят до рН 11 с помощью NaOH и экстрагируют EtOAc. Органический слой сушат (MgSO4) и концентрируют, получая 0,31 г (81%) указанного в заголовке продукта. Пол-ЭИ-МС демонстрирует М+ и 9 ионов, подтверждающих заявляемую структуру. ВРМС m/z вычислено дляC18H21N5O2 (M+) 339,1695, найдено 339,1696. Пример 142. 6-(2-[3-(1-Пиперазинил)-2-пиразинил]оксиэтокси)-1H-индол. Стадия 1. 2-(1 Н-Индол-6-илокси)-1-этанол. Смесь 6-гидроксииндола (2,66 г, 20 ммоль) и K2 СО 3 (3,04 г, 22 ммоль) перемешивают в ДМФА (10 мл) при 80 С в течение 10 мин. Добавляют раствор этиленкарбоната (1,94 г, 22 ммоль) в ДМФА (4 мл) и смесь нагревают при 125 С в течение 3 ч. Смесь концентрируют, разбавляют водой и экстрагируют толуолом. Органическую фазу промывают 1 М водным Nа 2 СО 3 и насыщенным раствором соли. Органический слой cушат (Na2SO4) и концентрируют. Остаток очищают флэш-хроматографией на диоксиде кремния, используя смесь EtOAc/толуол (1:436:65) в качестве элюента. Выход 1,02 г (29%); т.пл. 74-77 С;
МПК / Метки
МПК: C07D 241/18, A61K 31/497, A61P 25/00
Метки: 5-ht2c, антагонисты, агонисты, рецепторов
Код ссылки
<a href="https://eas.patents.su/30-5820-agonisty-i-antagonisty-receptorov-5-ht2c.html" rel="bookmark" title="База патентов Евразийского Союза">Агонисты и антагонисты рецепторов 5-ht2c</a>
Предыдущий патент: Фармацевтически активные производные сульфонамида, содержащие как липофильные, так и ионизируемые фрагменты, в качестве ингибиторов jun-протеинкиназ
Следующий патент: Иммуномодулирующие пептиды, полученные из белков теплового шока, и их применение
Случайный патент: Производные пипередин-4-ил-пиридазин-3-иламина как быстро диссоциирующие антагонисты рецептора дофамина 2


































