Арилзамещенные пиридины, пиримидины, пиразины или триазины (варианты), фармацевтическая композиция, способ лечения нарушения у млекопитающего, связанного с блокадой натриевых каналов, способ лечения,профилактики или снижения интенсивности различных нарушений или состояний, способ снижения интенсивности или профилактики приступов судороги у животного
Формула / Реферат
1. Арилзамещенные пиридины, пиримидины, пиразины или триазины формулы I
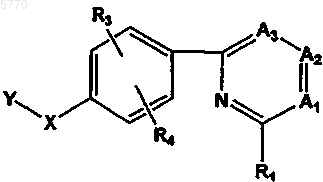
или их фармацевтически приемлемые соль, пролекарство или сольват, где
Y означает  или R7;
или R7;
при условии, что если Y означает радикал R7, то R1 означает аминокарбонил;
A1, A2 и A3 независимо выбирают из группы, включающей в себя CR2 или N, при условии, что A1, A2 и A3 все одновременно не означают N;
R1 выбирают из группы, включающей в себя C1-6алкил, необязательно замещенный OH или галогеном, амино, C1-6алкилтио, C(O)R8, SO2R8, 2-имидазолинил, 3-пиразолил, необязательно замещенный C1-6алкилом, 5-изоксазолил и 3-(1,2,4)-триазолил;
каждый радикал R2 независимо выбирают из группы, включающей в себя водород, C1-6алкил, необязательно замещенный OH или галогеном, C2-6алкенил, C2-6алкинил, галоген, гидрокси, C3-8циклоалкил, циано, амино, C1-6алкиламино, ди(C1-6)алкиламино, C1-6алкокси, аминокарбонил и C1-6алкиламинокарбонил;
R3 и R4 независимо означают водород, галоген или галоген(C1-6)алкил;
R5 и R6 независимо выбирают из группы, включающей в себя водород, C1-6алкил, C2-6алкенил, C2-6алкинил, галоген, галоген(C1-6)алкил, нитро, амино, циано, C1-6алкокси;
R7 означает C1-6алкил, необязательно замещенный галогеном;
R8 выбирают из группы, включающей в себя C1-6алкил, C2-6алкенил, C2-6алкинил, OR9, амино, C1-6алкиламино, необязательно замещенный гидрокси или галогеном, ди(C1-6)алкиламино, C2-6алкениламино, ди(C1-6)алкиламино(C2-6)алкенил, ди(C1-6)алкиламино(C1-6)алкиламино, гидроксиметиленамино, метиламинометиленамино, диметиламинометилен и гетероцикло(C1-6)алкиламино, где гетероцикл представлен насыщенной или ненасыщенной шестичленной кольцевой системой, содержащей атомы углерода и один или два гетероатома, выбранных из группы, состоящей из O и N, при условии, что R8 не является OR9, если R1 означает SO2R8, где
R9 выбирают из группы, включающей в себя водород, C1-6алкил и щелочной металл; и
X выбирают из группы, включающей в себя O, S, NH или CH2, если Y отличен от R7; или
X выбирают из группы, включающей в себя O, S, NH, CH2, или отсутствует, если Y означает R7;
при условии, что
1) R2 не означает NH2, если R1 означает метилтио, X означает O и два из A1, A2 и A3 означают N;
2) R2 не означает CCl3, если R1 означает CCl3, X означает S и два из A1, A2 и A3 означают N; или
3) R1 и R2 оба не означают NH2, если X означает O или S и любые два заместителя из A1, A2 и A3 означают N.
2. Арилзамещенные пиридины, пиримидины, пиразины или триазины формулы II

или их фармацевтически приемлемые соль, пролекарство или сольват, где
A1, A2 и A3 независимо означают CR2 или N, при условии, что A1, A2 и A3 все одновременно не означают N;
R1 выбирают из группы, включающей в себя C1-6алкил, необязательно замещенный OH или галогеном, амино, C1-6алкилтио, C(O)R8, SO2R8, 2-имидазолинил, 3-пиразолил, необязательно замещенный C1-6алкилом, 5-изоксазолил и 3-(1,2,4)-триазолил;
каждый R2 выбирают из группы, включающей в себя водород, C1-6алкил, необязательно замещенный OH или галогеном, C2-6алкенил, C2-6алкинил, галоген, гидрокси, C3-8циклоалкил, циано, амино, C1-6алкиламино, ди(C1-6)алкиламино, C1-6алкокси, аминокарбонил и C1-6алкиламинокарбонил;
R3 и R4 независимо означают водород, галоген или галоген(C1-6)алкил;
R5 и R6 независимо выбирают из группы, включающей в себя водород, C1-6алкил, C2-6алкенил, C2-6алкинил, галоген, галоген(C1-6)алкил, нитро, амино, циано, и C1-6алкокси; и
R8 выбирают из группы, включающей в себя C1-6алкил, C2-6алкенил, C2-6алкинил, ORg, амино, C1-6алкиламино, необязательно замещенный гидрокси или галогеном, ди(C1-6)алкиламино, C2-6алкениламино, ди(C1-6)алкиламино(C2-6)алкенил, ди(C1-6)алкиламино(C1-6)алкиламино, гидроксиметиленамино, метиламинометиленамино, диметиламинометилен и гетероцикло(C1-6)алкиламино, где гетероцикл представлен насыщенной или ненасыщенной шестичленной кольцевой системой, содержащей атомы углерода и один или два гетероатома, выбранных из группы, состоящей из O и N, при условии, что R8 не является OR9, если R1 означает SO2R8; где
R9 выбирают из группы, включающей в себя водород, C1-6алкил и щелочной металл; и
X выбирают из группы, включающей в себя O, S, NH или CH2;
при условии, что
1) R2 не означает NH2, если R1 означает метилтио, X означает O и два из A1, A2 и A3 означают N;
2) R2 не означает CCl3, если R1 означает CCl3, X означает S и два из A1, A2 и A3 означают N; или
3) R1 и R2 оба не означают NH2, если X означает O или S, и любые два заместителя из A1, A2 и A3 означают N.
3. Соединения по п.2, отличающиеся тем, что каждый A1, A2 и A3 означает CR2 или A1 означает N, а A2 и A3 означают CR2; или A3 означает N, а A1 и A2 означают CR2; или A2 означает N, а A1 и A3 означают CR2; или A1 и A3 означают N, а A2 означает CR2.
4. Соединения по п.2, отличающиеся тем, что R1 выбирают из группы, включающей в себя C1-6алкил, необязательно замещенный галогеном или гидроксигруппой, C(O)R8 и SO2R8, где R8 определен в п.2, при условии, что R8 не является OR9, если R1 означает SO2R8.
5. Соединения по п.4, отличающиеся тем, что R8 выбирают из группы, включающей в себя C1-6алкил, C2-6алкенил, OR9, амино, C1-6алкиламино, необязательно замещенный гидрокси или галогеном, ди(C1-6)алкиламино, C2-6алкениламино, ди(C1-6)алкиламино(C2-6)алкенил, ди(C1-6)алкиламино(C1-6)алкиламино и гетероцикло(C1-6)алкиламино, где гетероцикл представлен насыщенной или ненасыщенной шестичленной кольцевой системой, содержащей атомы углерода и один или два гетероатома, выбранных из группы, состоящей из O и N, где R9 определен в п.2.
6. Соединения по п.2, отличающиеся тем, что R2 выбирают из группы, включающей в схся водород, C1-6алкил, C2-6алкенил, C2-6алкинил, амино, гидрокси(C1-6)алкил, C1-6алкокси, аминокарбонил и C1-6алкиламинокарбонил.
7. Соединения по п.6, отличающиеся тем, что R2 выбирают из группы, включающей в себя водород, C1-6алкил, C1-6алкокси и аминокарбонил.
8. Соединения по п.2, отличающиеся тем, что R5 и R6 независимо выбирают из группы, включающей в себя водород, C1-6алкил, C2-6алкенил, C2-6алкинил, галоген, галоген(C1-6)алкил, нитро, амино и циано.
9. Соединения по п.8, отличающиеся тем, что R3 и R4 оба означают водород, а R5 и R6 независимо выбирают из группы, включающей в себя водород, C1-6алкил, галоген, галоген(C1-6)алкил и нитро.
10. Соединения по п.2, отличающиеся тем, что X означает O или S.
11. Соединения по п.10, отличающиеся тем, что X означает O.
12. Соединения по п.2, отличающиеся тем, что R2 означает водород, X означает O или S, а R1 означает аминокарбонил.
13. Соединения по п.2, отличающиеся тем, что A2 означает CR2, где R2 отличен от H, а A1 и A3 каждый означает CH.
14. Соединения по п.2, отличающиеся тем, что A1 означает N, A2 означает CR2, где R2 отличен от H, а A3 означает CH.
15. Соединения по п.2, отличающиеся тем, что A3 означает N, A2 означает CR2, где R2 отличен от H, а A1 означает CH.
16. Соединения по п.2, отличающиеся тем, что A2 означает N, A1 означает CR2, где R2 отличен от H, а A3 означает CH.
17. Соединения по п.2, отличающиеся тем, что они представлены формулой III
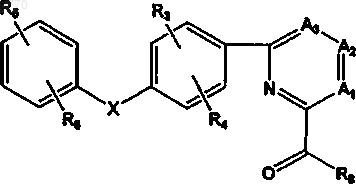
или их фармацевтически приемлемые соль, пролекарство, или сольват, где A1-A3, R2-R6, R8 и X определены в п.2.
18. Соединения по п.17, отличающиеся тем, что A1, A2 и A3 каждый означает CR2; или A1 означает N, а A2 и A3 означают CR2; или A3 означает N, а A1 и A2 означают CR2; или A2 означает N, а A1 и A3 означают CR2; или A1 и A3 означают N, а A2 означает CR2.
19. Соединения по п.17, отличающиеся тем, что R2 выбирают из группы, включающей в себя водород, C1-6алкил, C2-6алкенил, C2-6алкинил, амино, гидрокси(C1-6)алкил, C1-6алкокси, аминокарбонил и C1-6алкиламинокарбонил.
20. Соединения по п.19, отличающиеся тем, что R2 выбирают из группы, включающей в себя водород, C1-6алкил, C1-6алкокси и аминокарбонил.
21. Соединения по п.17, отличающиеся тем, что R5 и R6 независимо выбирают из группы, включающей в себя водород, C1-6алкил, C2-6алкенил, C2-6алкинил, галоген, галоген(C1-6)алкил, нитро, амино и циано.
22. Соединения по п.21, отличающиеся тем, что R3 и R4 оба означают водород, а R5 и R6 независимо выбирают из группы, включающей в себя водород, C1-6алкил, галоген, галоген(C1-6)алкил и нитро.
23. Соединения по п. 17, отличающиеся тем, что R8 выбирают из группы, включающей в себя C1-6алкил, C2-6алкенил, OR9, амино, C1-6алкиламино, необязательно замещенный OH или галогеном, ди(C1-6)алкиламино, C2-6алкениламино, ди(C1-6)алкиламиноC2-6алкенил, ди(C1-6)алкиламино(C1-6)алкиламино и гетероцикло(C1-6)алкиламино, где гетероцикл представлен насыщенной или ненасыщенной шестичленной кольцевой системой, содержащей атомы углерода и один или два гетероатома, выбранных из группы, состоящей из O и N, при условии, что R8 не означает OR9, если R1 означает SO2R8, где R9 определен в п.2.
24. Соединения по п.17, отличающиеся тем, что X означает O или S.
25. Соединения по п.24, отличающиеся тем, что X означает O.
26. Соединения по п.17, отличающиеся тем, что X означает O,
A1, A2 и A3 каждый означает CR2; или A1 означает N, а A2 и A3 означают CR2; или A3 означает N, а A1 и A2 означают CR2; или A2 означает N, а A1 и A3 означают CR2, или A1 и A3 означают N, а A2 означает CR2; где
R2 выбирают из группы, включающей в себя водород, C1-6алкил, C1-6алкокси и аминокарбонил;
R3 и R4 оба означают водород;
R5 и R6 независимо выбирают из группы, включающей в себя водород, C1-6алкил, галоген, галоген(C1-6)алкил и нитро; и R8 означает амино.
27. Соединения по п.17, отличающиеся тем, что A2 означает CR2, где R2 отличен от H, а A1 и A3 каждый означает CH.
28. Соединения по п.17, отличающиеся тем, что A1 означает N, A2 означает CR2, где R2 отличен от H, а A3 означает CH.
29. Соединения по п.17, отличающиеся тем, что A3 означает N, A2 означает CR2, где R2 отличен от H, а A1 означает CH.
30. Соединения по п.17, отличающиеся тем, что A2 означает N, A1 означает CR2, где R2 отличен от H, а A3 означает CH.
31. Соединения по п.2, отличающиеся тем, что они представлены формулой IV
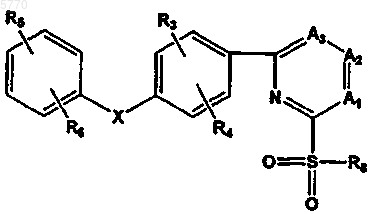
или их фармацевтически приемлемые соль, пролекарство или сольват, где A1-A3, R2-R6 и X определены в п.2, а R8 выбирают из группы, включающей в себя C1-6алкил, C2-6алкенил, C2-6алкинил, амино, C1-6алкиламино, необязательно замещенный гидрокси или галогеном, диC1-6алкиламино, C2-6алкениламино, ди(C1-6)алкиламино(C2-6)алкенил, ди(C1-6)алкиламино(C1-6)алкиламино и гетероцикло(C1-6)алкиламино, где гетероцикл представлен насыщенной или ненасыщенной шестичленной кольцевой системой, содержащей атомы углерода и один или два гетероатома, выбранных из группы, состоящей из O и N.
32. Соединения по п.31, отличающиеся тем, что A1, A2 и A3 каждый означает CR2; или A1 означает N, а A2 и A3 означают CR2; или A3 означает N, а A1 и A2 означают CR2; или A2 означает N, а A1 и A3 означают CR2; или A1 и A3 означают N, а A2 означает CR2; и R2 выбирают из группы, включающей в себя водород, C1-6алкил, C2-6алкенил, C2-6алкинил, амино, гидрокси(C1-6)алкил, C1-6алкокси и аминокарбонил.
33. Соединения по п.32, отличающиеся тем, что R2 выбирают из группы, включающей в себя водород, C1-6алкил, C1-6алкокси и аминокарбонил.
34. Соединения по п.31, отличающиеся тем, что R5 и R6 независимо выбирают из группы, включающей в себя водорюф, C1-6алкил, C2-6алкенил, C2-6алкинил, галоген, галоген(C1-6)алкил, нитро, амино и циано.
35. Соединения по п.34, отличающиеся тем, что R3 и R4 оба означают водород, а R5 и R6 независимо выбирают из группы, включающей в себя водород, C1-6алкил, галоген, галоген(C1-6)алкил и нитро.
36. Соединения по п.31, отличающиеся тем, что R8 выбирают из группы, включающей в себя C1-6алкил, C2-6алкенил, амино, C1-6алкиламино, необязательно замещенный гидрокси или галогеном, ди(C1-6)алкиламино, C2-6алкениламино, ди(C1-6)алкиламиноC2-6алкенил и гетероцикло(C1-6)алкиламино, где гетероцикл представлен насыщенной или ненасыщенной шестичленной кольцевой системой, содержащей атомы углерода и один или два гетероатома, выбранных из группы, состоящей из O и N.
37. Соединения по п.31, отличающиеся тем, что X означает O или S.
38. Соединения по п.37, отличающиеся тем, что X означает O.
39. Соединения, представляющие собой
4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоксамид,
4-[4-(4-нитрофенокси)фенил]пиримидин-2-карбоксамид,
4-[4-(4-метоксифенокси)фенил]пиримидин-2-карбоксамид,
4-[4-(4-трифторметилфенокси)фенил]пиримидин-2-карбоксамид,
4-[4-(3-хлор-2-цианофенокси)фенил]пиримидин-2-карбоксамид,
4-[4-(4-хлор-2-фторфенокси)фенил]пиримидин-2-карбоксамид,
4-[4-(2,4-дифторфенокси)фенил]пиримидин-2-карбоксамид,
4-[4-(2-хлор-4-фторфенокси)фенил]пиримидин-2-карбоксамид,
1-[4-[4-(4-фторфенокси)фенил]пиримидин-2-ил]этанон,
2-[4-(4-фторфенокси)фенил]пиримидин-4-карбоксамид,
2-[4-(4-фторфенокси)фенил]-4-метилпиримидин,
2-метил-4-[4-(4-фторфенокси)фенил]пиримидин,
4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновая кислота,
натриевая соль 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты,
метиламид 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты,
диметиламид 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты,
трет-бутиламид4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты,
2-[4-(4-хлор-2-фторфенокси)фенил]пиримидин-4-карбоксамид,
2-[4-(4-хлор-2-фторфенокси)фенил]пиримидин-4-карбоновая кислота,
диметиламид 2-(4-феноксифенил)-6-(диметиламино)пиримидин-4-карбоновой кислоты,
2-гидроксиэтиламид 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты,
гидроксиметиленамид 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты,
2-(2-гидроксипроп-2-ил)-4-[4-(4-фторфенокси)фенил]пиримидин,
амид 2-морфолин-4-илэтилового эфира,
4-[4-(2,4-дифторфенокси)фенил]пиримидин-2-карбоновой кислоты,
2-(4,5-дигидро-1H-имидазол-2-ил)-4-[4-(4-фторфенокси)фенил]пиримидин,
2-(3-пиразолил)-4-[4-(4-фторфенокси)фенил]пиримидин,
2-(5-изоксазолил)-4-[4-(4-фторфенокси)фенил]пиримидин,
2-(1-метил-3-пиразолил)-4-[4-(4-фторфенокси)фенил]пиримидин,
метиламид 2-[4-(4-хлор-2-фторфенокси)фенил]пиримидин-4-карбоновой кислоты;
3-диметиламино-1-{4-[4-(4-фторфенокси)фенил}пиримидин-2-ил]пропенон,
2-тиометил-4-[4-(4-фторфенокси)фенил]пиримидин,
2-метансульфонил-4-[4-(4-фторфенокси)фенил]пиримидин,
2-[4-(4-хлор-2-фторфенокси)фенил]-4-метилпиримидин,
4-[4-(4-фторфенокси)-3-фторфенил]пиримидин-2-карбоксамид,
2-[4-(4-фторфенокси)-3-фторфенил]пиримидин-4-карбоксамид,
2-метил-6-(4-феноксифенил)пиридин,
6-(4-феноксифенил)пиридин-2-карбоксамид,
2-метил-6-[4-(4-фторфенокси)фенил]пиридин,
6-(4-феноксифенил)пиридин-2-карбоновая кислота,
метиламид 6-(4-феноксифенил)пиридин-2-карбоновой кислоты;
6-[4-(4-фторфенокси)фенил]пиридин-2-карбоксамид,
6-[4-(2,4-дифторфенокси)фенил]пиридин-2-карбоксамид,
6-[4-(4-хлор-2-фторфенокси)фенил]пиридин-2-карбоксамид,
6-[4-(4-фторфенокси)-3-фторфенил]пиридин-2-карбоксамид,
6-[4-(4-трифторметилфенокси)фенил]пиридин-2-карбоксамид;
6-(4-феноксифенил)пиразин-2-карбоксамид,
3,5-диамино-6-(4-феноксифенил)пиразин-2-карбоксамид или
2-[4-(4-нитрофенокси)фенил]-4-метил-[1,3,5]-триазин или их фармацевтически приемлемые соль, пролекарство или сольват.
40. Соединения по п.1, отличающиеся тем, что они представляют собой
N-пиперидинилэтиламид 6-[4-(4-фторфенокси)фенил]пиридин-2-карбоновой кислоты,
6-(4-трет-бутилфенил)пиридин-2-карбоксамид,
6-(4-н-бутилфенил)пиридин-2-карбоксамид,
6-(4-изопропилфенил)пиридин-2-карбоксамид,
6-(4-тиометилфенил)пиридин-2-карбоксамид,
6-(4-этоксифенил)пиридин-2-карбоксамид или
6-(4-метоксифенил)пиридин-2-карбоксамид или их фармацевтически приемлемые соль, пролекарство или сольват.
41. Соединения по п.1, отличающиеся тем, что они представлены формулой V
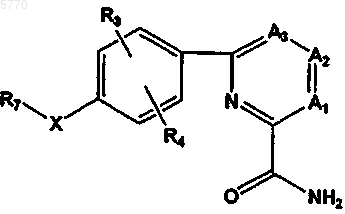
или их фармацевтически приемлемые соль, пролекарство или сольват, где A1-A3, R2-R4 и R7 определены в п.1, а X означает один из O, S, NH, CH2 или отсутствует.
42. Соединения по п.41, отличающиеся тем, что A1, A2 и A3 каждый означает CR2; или A1 означает N, а A2 и A3 означают CR2; или A3 означает N, а A1 и A2 означают CR2; или A2 означает N, а A1 и A3 означают CR2; или A1 и A3 означают N, а A2 означает CR2.
43. Соединения по п.41, отличающиеся тем, что R2 выбирают из группы, включающей в себя водород, C1-6алкил, C1-6алкокси и аминокарбонил.
44. Соединения по п.41, отличающиеся тем, что R3 и R4 оба означают водород.
45. Соединения по п.41, отличающиеся тем, что X означает O или S.
46. Соединения по п.45, отличающиеся тем, что X означает O.
47. Соединение по п.41, отличающееся тем, что оно представлено
6-[(4-трифторметокси)фенил]пиридин-2-карбоксамидом или его фармацевтически приемлемой солью, пролекарством или сольватом.
48. Соединение по п.2, отличающееся тем, что оно представлено 2-[4-(4-хлор-2-фторфенокси)фенил]пиримидин-4-карбоксамидом или его фармацевтически приемлемой солью, пролекарством или сольватом.
49. Соединение по п.48, отличающееся тем, что оно представлено 2-[4-(4-хлор-2-фторфенокси)фенил]пиримидин-4-карбоксамидом.
50. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение формулы
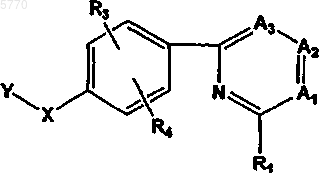
или его фармацевтически приемлемые соль, пролекарство или сольват, где
Y означает  или R7;
или R7;
при условии, что если Y означает радикал R7, то R1 означает аминокарбонил;
A1, A2 и A3 независимо выбирают из группы, включающей в себя CR2 или N, при условии, что
A1, A2 и A3 все одновременно не означают N;
R1 выбирают из группы, включающей в себя C1-6алкил, необязательно замещенный OH или галогеном, амино, C1-6алкилтио, C(O)R8, SO2R8, 2-имидазолинил, 3-пиразолил, необязательно замещенный C1-6алкилом, 5-изоксазолил и 3-(1,2,4)-триазолил;
каждый радикал R2 независимо выбирают из группы, включающей в себя водород, C1-6алкил, необязательно замещенный OH или галогеном, C2-6алкенил, C2-6алкинил, галоген, гидрокси, C3-8циклоалкил, циано, амино, C1-6алкиламино, ди(C1-6)алкиламино, C1-6алкокси, аминокарбонил и C1-6алкиламинокарбонил;
R3 и R4 независимо означают водород, галоген или галоген(C1-6)алкил;
R5 и R6 независимо выбирают из группы, включающей в себя водород, C1-6алкил, C2-6алкенил, C2-6алкинил, галоген, галоген(C1-6)алкил, нитро, амино, циано и C1-6алкокси;
R7 означает C1-6алкил, необязательно замещенный галогеном;
R8 выбирают из группы, включающей в себя C1-6алкил, C2-6алкенил, C2-6алкинил, OR9, амино, C1-6алкиламино, необязательно замещенный гидрокси или галогеном, ди(C1-6)алкиламино, C2-6алкениламино, ди(C1-6)алкиламино(C2-6)алкенил, ди(C1-6)алкиламино(C1-6)алкиламино, гидроксиметиленамино, метиламинометиленамино, диметиламинометилен и гетероцикло(C1-6)алкиламино, где гетероцикл представлен насыщенной или ненасыщенной шестичленной кольцевой системой, содержащей атомы углерода и один или два гетероатома, выбранных из группы, состоящей из O и N, при условии, что R8 не является OR9, если R1 означает SO2R8, где
R9 выбирают из группы, включающей в себя водород, C1-6алкил и щелочной металл; и
X выбирают из группы, включающей в себя O, S, NH или CH2, если Y отличен от R7; или
X выбирают из группы, включающей в себя O, S, NH, CH2 или отсутствует, при условии, что Y означает R7,
и фармацевтически приемлемые носитель или разбавитель;
при условии, что R1 и R2 оба не означают NH2, если X означает O или S, и любые два заместителя из A1, A2 и A3 означают N.
51. Композиция по п.50, отличающаяся тем, что она содержит соединение по любому из пп.1-49.
52. Композиция по п.50, отличающаяся тем, что она содержит 2-[4-(4-хлор-2-фторфенокси)фенил]пиримидин-4-карбоксамид или его фармацевтически приемлемую соль, пролекарство или сольват.
53. Композиция по п.52, отличающаяся тем, что она содержит 2-[4-(4-хлор-2-фторфенокси)фенил]пиримидин-4-карбоксамид.
54. Способ лечения нарушения, связанного с блокадой натриевых каналов, у млекопитающего, подверженного такому заболеванию, отличающийся тем, что млекопитающему, нуждающемуся в таком лечении, вводят эффективное количество соединения формулы
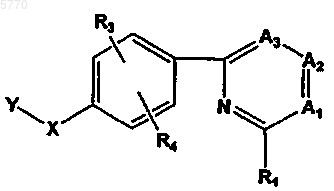
или его фармацевтически приемлемых соли, пролекарства или сольвата, где
Y означает 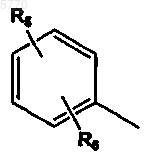 или R7;
или R7;
при условии, что если Y означает радикал R7, то R1 означает аминокарбонил;
A1, A2 и A3 независимо выбирают из группы, включающей в себя CR2 или N, при условии, что A1, A2 и A3 все одновременно не означают N;
R1 выбирают из группы, включающей в себя C1-6алкил, необязательно замещенный OH или галогеном, амино, C1-6алкилтио, C(O)R8, SO2R8, 2-имидазолинил, 3-пиразолил, необязательно замещенный C1-6алкилом, 5-изоксазолил и 3-(1,2,4)-триазолил;
каждый радикал R2 независимо выбирают из группы, включающей в себя водород, C1-6алкил, необязательно замещенный OH или галогеном, C2-6алкенил, C2-6алкинил, галоген, гидрокси, C3-8циклоалкил, циано, амино, C1-6алкиламино, ди(C1-6)алкиламино, C1-6алкокси, аминокарбонил и C1-6алкиламинокарбонил;
R3 и R4 независимо означают водород, галоген или галоген(C1-6)алкил;
R5 и R6 независимо выбирают из группы, включающей в себя водород, C1-6алкил, C2-6алкенил, C2-6алкинил, галоген, галоген(C1-6)алкил, нитро, амино, циано, C1-6алкокси;
R7 означает C1-6алкил, необязательно замещенный галогеном;
R8 выбирают из группы, включающей в себя C1-6алкил, C2-6алкенил, C2-6алкинил, OR9, амино, C1-6алкиламино, необязательно замещенный гидрокси или галогеном, ди(C1-6)алкиламино, C2-6алкениламино, ди(C1-6)алкиламино(C2-6)алкенил, ди(C1-6)алкиламино(C1-6)алкиламино, гидроксиметиленамино, метиламинометиленамино, диметиламинометилен и гетероцикло(C1-6)алкиламино, где гетероцикл представлен насыщенной или ненасыщенной шестичленной кольцевой системой, содержащей атомы углерода и один или два гетероатома, выбранных из группы, состоящей из O и N, при условии, что R8 не является OR9, если R1 означает SO2R8, где
R9 выбирают из группы, включающей в себя водород, C1-6алкил и щелочной металл; и
X выбирают из группы, включающей в себя O, S, NH или CH2, если Y отличен от R7; или
X выбирают из группы, включающей в себя O, S, NH, CH2 или отсутствует, при условии, что Y означает R7.
55. Способ по п.54, отличающийся тем, что в качестве вводимого соединения выбирают соединение по любому из пп.1-49.
56. Способ лечения, профилактики или снижения интенсивности нарушений или состояний, выбранных из группы, включающей в себя гибель нейронов при очаговой или общей ишемии, нейродегенеративные состояния, боль или шум в ушах, маниакальную депрессию, аритмии или судороги, а также обеспечения местной анестезии, отличающийся тем, что млекопитающему, нуждающемуся в таком лечении, вводят эффективное количество соединения формулы
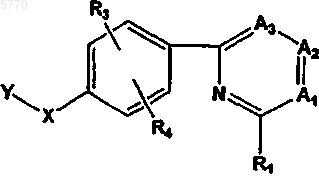
или его фармацевтически приемлемых соли, пролекарства или сольвата, где
Y означает 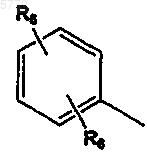 или R7;
или R7;
при условии, что если Y означает радикал R7, то R1 означает аминокарбонил;
A1, A2 и A3 независимо выбирают из группы, включающей в себя CR2 или N, при условии, что A1, A2 и A3 все одновременно не означают N;
R1 выбирают из группы, включающей в себя C1-6алкил, необязательно замещенный OH или галогеном, амино, C1-6алкилтио, C(O)R8, SO2R8, 2-имидазолинил, 3-пиразолил, необязательно замещенный C1-6алкилом, 5-изоксазолил и 3-(1,2,4)-триазолил;
каждый радикал R2 независимо выбирают из группы, включающей в себя водород, C1-6алкил, необязательно замещенный OH или галогеном, C2-6алкенил, C2-6алкинил, галоген, гидрокси, C3-8циклоалкил, циано, амино, C1-6алкиламино, ди(C1-6)алкиламино, C1-6алкокси, аминокарбонил и C1-6алкиламинокарбонил;
R3 и R4 независимо означают водород, галоген или галоген(C1-6)алкил;
R5 и R6 независимо выбирают из группы, включающей в себя водород, C1-6алкил, C2-6алкенил, C2-6алкинил, галоген, галоген(C1-6)алкил, нитро, амино, циано, C1-6алкокси;
R7 означает C1-6алкил, необязательно замещенный галогеном;
R8 выбирают из группы, включающей в себя C1-6алкил, C2-6алкенил, C2-6алкинил, OR9, амино, C1-6алкиламино, необязательно замещенный гидрокси или галогеном, ди(C1-6)алкиламино, C2-6алкениламино, ди(C1-6)алкиламино(C2-6)алкенил, ди(C1-6)алкиламино(C1-6)алкиламино, гидроксиметиленамино, метиламинометиленамино, диметиламинометилен и гетероцикло(C1-6)алкиламино, где гетероцикл представлен насыщенной или ненасыщенной шестичленэющ кольцевой системой, содержащей атомы углерода и один или два гетероатома, выбранных из группы, состоящей из O и N, при условии, что R8 не является OR9, если R1 означает SO2R8, где
R9 выбирают из группы, включающей в себя водород, C1-6алкил и щелочной металл; и
X выбирают из группы, включающей в себя O, S, NH или CH2, если Y отличен от R7; или
X выбирают из группы, включающей в себя O, S, NH, CH2 или отсутствует, при условии, что Y означает R7.
57. Способ по п.56, отличающийся тем, что выбирают соединение по любому из пп.1-49.
58. Способ по п.56, отличающийся тем, что лечат, предупреждают или снижают интенсивность боли, причем болью является невропатическая боль, боль, вызванная хирургическим вмешательством, или хроническая боль.
59. Способ снижения интенсивности или профилактики приступов судороги у животного, отличающийся тем, что животному, нуждающемуся в таком лечении, вводят эффективное количество соединения формулы
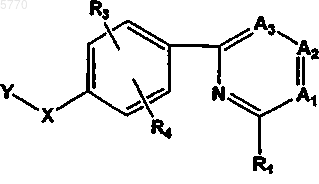
или его фармацевтически приемлемых соли, пролекарства или сольвата, где
Y означает 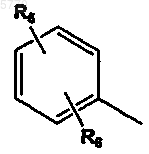 или R7;
или R7;
при условии, что если Y означает радикал R7, то R1 означает аминокарбонил;
A1, A2 и A3 независимо выбирают из группы, включающей в себя CR2 или N, при условии, что A1, A2 и A3 все одновременно не означают N;
R1 выбирают из группы, включающей в себя C1-6алкил, необязательно замещенный OH или галогеном, амино, C1-6алкилтио, C(O)R8, SO2R8, 2-имидазолинил, 3-пиразолил, необязательно замещенный C1-6алкилом, 5-изоксазолил и 3-(1,2,4)-триазолил;
каждый радикал R2 независимо выбирают из группы, включающей в себя водород, C1-6алкил, необязательно замещенный OH или галогеном, C2-6алкенил, C2-6алкинил, галоген, гидрокси, C3-8циклоалкил, циано, амино, C1-6алкиламино, ди(C1-6)алкиламино, C1-6алкокси, аминокарбонил и C1-6алкиламинокарбонил;
R3 и R4 независимо означают водород, галоген или галоген(C1-6)алкил;
R5 и R6 независимо выбирают из группы, включающей в себя водород, C1-6алкил, C2-6алкенил, C2-6алкинил, галоген, галоген(C1-6)алкил, нитро, амино, циано, C1-6алкокси;
R7 означает C1-6алкил, необязательно замещенный галогеном;
R8 выбирают из группы, включающей в себя C1-6алкил, C2-6алкенил, C2-6алкинил, OR9, амино, C1-6алкиламино, необязательно замещенный гидрокси или галогеном, ди(C1-6)алкиламино, C2-6алкениламино, ди(C1-6)алкиламино(C2-6)алкенил, ди(C1-6)алкиламино(C1-6)алкиламино, гидроксиметиленамино, метиламинометиленамино, диметиламинометилен и гетероцикло(C1-6)алкиламино, где гетероцикл представлен насыщенной или ненасыщенной шестичленной кольцевой системой, содержащей атомы углерода и один или два гетероатома, выбранных из группы, состоящей из O и N, при условии, что R8 не является OR9, если R1 означает SO2R8, где
R9 выбирают из группы, включающей в себя водород, C1-6алкил и щелочной металл; и
X выбирают из группы, включающей в себя O, S, NH или CH2, если Y отличен от R7; или
X выбирают из группы, включающей в себя O, S, NH, CH2 или отсутствует, при условии, что Y означает R7.
60. Способ по п.59, отличающийся тем, что в качестве вводимого соединения выбирают соединение по любому из пп.1-49.
Текст
005770 Область техники, к которой относится изобретение Настоящее изобретение относится к области медицинской химии. В частности, изобретение относится к новым арилзамещенным пиридинам, пиримидинам, пиразинам и триазинам, а также к открытию того, что эти соединения являются противосудорожными средствами и действуют в качестве блокаторов натриевых (Na+) каналов. Уровень техники Показано, что несколько классов лекарственных средств, применяемых в терапии, включая местные анестетики, такие как лидокаин и бупивакаин, антиаритмические препараты, такие как пропафенон и амиокларон, а также противосудорожные средства, такие как ламотригин, фенитоин и карбамазепин,имеют общий механизм действия, заключающийся в блокировании или модулировании активности Na+ каналов (W.A. Catterall, Trends Pharmacol. Sci., 8:57-65 (1987. Предполагается, что каждый из этих агентов препятствует быстрому притоку ионов Na+. Недавно было показано, что другие блокаторы Na+ каналов, такие как BW619C89 и лифаризин проявляют нейрозащитное действие на моделях животных с общей и очаговой ишемией и в настоящее время проходят клинические испытания (Graham и соавт., J. Pharmacol. Exp. Then, 269:854-859 (1994); Brown и соавт., British J. Pharmacol., 115:1425-1432 (1995. Нейрозащитная активность блокаторов Na+ каналов обусловлена их эффективностью в снижении внеклеточной концентрации глютамата при ишемии путем ингибирования высвобождения этого эксайтотоксичного аминокислотного нейротрансмиттера. Исследования показали, что в отличие от антагонистов рецептора глютамата, блокаторы Na+ каналов предотвращают гипоксическое повреждение белого вещества мозга млекопитающих (Stys и соавт., J. Neurosci., 12:430-439 (1992. Таким образом, они могут с успехом применяться при лечении некоторых видов приступов (припадков) или нейротравм с выраженным повреждением трактов белого вещества мозга. Другим примером клинического применения блокатора Na+ каналов является рилузол. Показано,что этот лекарственный препарат продлевает выживание в группе пациентов, страдающих боковым амиотрофическим склерозом (БАС) (Bensim и соавт., New Engl. J. Med., 330:585-591 (1994 и впоследствии он был одобрен администрацией по контролю качества пищевых и лекарственных препаратов (FDA) для лечения БАС. Кроме вышеуказанных способов клинического применения, карбамазепин, лидокаин и фенитоин иногда применяют для лечения невропатических болей, имеющих место при невралгии тройничного нерва, диабетической невропатии и других формах нервных поражений (Taylor and Meldrum,Trends Pharmacol. Sci., 16:309-316 (1995, а карбамазепин и ламотригин применяют для лечения маниакальной депрессии (Denicott и соавт., J. Clin. Psychiatry, 55:70-76 (1994. Кроме того, на основании ряда сходных характеристик между хронической болью и шумом в ушах (A.R. Moller, Am. J. Otol., 18:557-585(1997); Tonndorf, J. Hear. Res., 28:271-275 (1987 предложено рассматривать шум в ушах как одну из форм хронических болевых ощущений (J.J. Simpson и E.W. Davies, Tip., 20:12-18 (1999. В действительности, показано, что лигнокаин и карбамазепин эффективны при лечении шума в ушах (В. Majumdar и соавт., Clin. Otolaryngol., 8: 175-180 (1983); I. Donaldson, Laryngol. Otol., 95:947-951 (1981. Установлено, что существует по крайней мере от пяти до шести участков в чувствительных к разности потенциалов Na+ каналах, которые избирательно связывают нейротоксины (W.A. Catterall, Science,242:50-61 (1988. Кроме того, исследования выявили, что терапевтические антиаритмические, противосудорожные и местные обезболивающие средства, действие которых связано с Na+ каналами, оказывают действие путем взаимодействия с внутриклеточной стороной Na+ канала и аллостерического ингибирования взаимодействия с участком 2 рецептора нейротоксина (W.A. Catterall, Ann. Rev. Pharmacol. Toxicol., 10:15-43 (1980. В статье Yukio и соавт., Pestic. Sci., 47:103-113 (1996) описано соединение следующей формулы Описанные соединения использованы в качестве гербицидов. В патенте FR 1477021 описано соединение следующей формулы Описанное соединение включено в материалы для фотографии. В патенте FR 1536093 описано соединение следующей формулы Указанное соединение использовано в качестве промежуточного производного для красителей. В патенте США 4912218 описано соединение формулы Указанное соединение использовано для фотополимеризуемых композиций. В международной заявке на выдачу патента WO 9931088 описаны соединения формулы где X означает О или S. Эти соединения предназначены для использования в качестве ингибиторов ангиогенеза. Сущность изобретения Настоящее изобретение относится к открытию того, что арилзамещенные пиридины, пиримидины,пиразины и триазины, представленные формулой I, являются противосудорожными средствами и действуют как блокаторы натриевых (Na+) каналов. Изобретение также относится к лечению расстройств, связанных с блокадой натриевых каналов у млекопитающих, страдающих избыточной активностью указанных каналов, путем введения эффективного количества соединения формулы I, как указано в настоящей заявке. Настоящее изобретение также относится к применению соединения формулы I для лечения повреждения нервных клеток, вызванного общей и очаговой ишемией, а также для лечения или профилактики нейродегенеративных состояний, таких как боковой амиотрофический склероз (БАС), лечения шума в ушах, в качестве антиманиакальных депрессантов, местных анестетиков, в качестве противоаритмических, противосудорожных средств и для лечения или профилактики диабетической невропатии и для лечения боли, включая как острую, так и хроническую боль, а также мигрень. Ряд соединений, использованных в настоящем изобретении, до настоящего времени не опубликован. Таким образом, объектом настоящего изобретения являются новые арилзамещенные пиридины, пиримидины, пиразины и триазины формулы I. Другим аспектом настоящего изобретения является применение новых соединений формулы I в качестве блокаторов натриевых каналов. Следующим объектом настоящего изобретения является разработка способа лечения, профилактики или снижения интенсивности гибели нервных клеток, вызванной общей и очаговой ишемией; лечения, профилактики или снижения интенсивности боли, включая острую и хроническую боль, а также невропатическую боль; лечения, профилактики или снижения интенсивности судорожных и нейродегенеративных состояний; лечения, профилактики или снижения интенсивности маниакальной депрессии; применения в качестве местных анестетиков, противоаритмических средств, а также лечения шума в ушах путем введения соединения формулы I млекопитающему, нуждающемуся в таком лечении или использовании. Еще одним объектом настоящего изобретения является создание фармацевтической композиции,пригодной для лечения нарушений, связанных с блокадой каналов ионов натрия, содержащей эффективное количество соединения формулы I в смеси с по меньшей мере одним фармацевтически приемлемым носителем или растворителем. Дополнительные варианты воплощения и преимущества настоящего изобретения будут изложены в следующем разделе описания изобретения и частично будут очевидны из описания, либо могут быть выяснены на практике. Варианты воплощения и преимущества данного изобретения будут ясно представлены с помощью элементов и комбинаций, которые заявлены в прилагаемых пунктах формулы изобретения. Следует понимать, что вышеприведенное общее описание, а также подробное описание представлены только для иллюстрации и пояснения сути изобретения и не ограничивают объем притязаний изобретения, заявленный в формуле изобретения.-2 005770 Перечень фигур чертежей и иных материалов На чертеже представлены графики импульсных потенциалов, где А -кривые ток-потенциал; Б - состояние равновесной инактивации; В - кинетика восстановления в исходное состояние; Г - период времени связывания. Сведения, подтверждающие возможность осуществления изобретения Настоящее изобретение основано на открытии того, что арилзамещенные пиридины, пиримидины,пиразины и триазины формулы I являются противосудорожными средствами и действуют как блокаторы натриевых (Na+) каналов. В связи с этим открытием соединения формулы I могут быть использованы для лечения нарушений, чувствительных к блокаде натриевых каналов. Соединениями, использованными согласно данному объекту настоящего изобретения, являются арилзамещеные пиридины, пиримидины, пиразины и триазины, представленные формулой I или их фармацевтически приемлемые соль, пролекарство или сольват, где Y означает или R7; при условии, что если Y означает радикал R7, то Rt означает аминокарбонил; А 1, А 2 и A3 независимо выбирают из группы, включающей в себя CR2 или N, при условии, что A1,A2, и А 3 все одновременно не означают N;R1 выбирают из группы, включающей в себя необязательно замещенный алкил, амино, алкилтиол,C(O)R8, SO2R8, OC(O)NH2, 2-имидазолинил, 2-имидазолил, 3-пиразолил, 5-изоксазолил и 3-(1,2,4)триазолил; каждый радикал R2 независимо выбирают из группы, включающей в себя водород, необязательно замещенный алкил, такой как аминоалкил, галогеналкил и гидроксиалкил, алкенил или алкинил, галоген,гидрокси, циклоалкил, циано, амино, алкиламино, диалкиламино, алкокси, аминокарбонил, алкиламинокарбонил, ариламинокарбонил, аралкиламинокарбонил, алкилкарбониламино, арилкарбониламино и аралкилкарбониламино; или R1 и R2 объединены с атомами углерода, к которым они присоединены, с образованием гетероциклического кольца;R3, R4, R5 и R6 независимо выбирают из группы, включающей в себя водород, алкил, алкенил, алкинил, галоген, галогеналкил, гидроксиалкил, гидрокси, нитро, амино, циано, амид, карбоксиалкил, алкоксиалкил, уреидо, ациламино, тиол, ацилокси, азидо, алкокси, карбокси, карбониламидо и алкилтиол; иR7 означает необязательно замещенный алкил;R8 выбирают из группы, включающей в себя алкил, алкенил, алкинил, OR9, амино, алкиламино, диалкиламино, алкениламино, диалкиламиноалкенил, диалкиламиноалкиламино, диалкиламиноалкениламино, алкиламиноалкениламино, гидроксиаминоалкениламино, циклоалкил, гетероциклоалкил, циклоалкилалкиламино, гетероциклоалкиламино, арил, арилалкил, арилалкенил, арилалкинил и арилалкиламино,причем все они могут быть необязательно замещены, при условии, что R8 не является OR9, если R1 означает SO2R8, гдеR9 выбирают из группы, включающей в себя водород, необязательно замещенный алкил и щелочной металл; и или их фармацевтически приемлемыми солью, пролекарством или сольватом, гдеA1, A2 и А 3 независимо означают CR2 или N, при условии, что A1, A2 и А 3 все одновременно не означают N;R1 выбирают из группы, включающей в себя необязательно замещенный алкил, амино, алкилтиол,C(O)R8, SO2R8, OC(O)NH2, 2-имидазолинил, 2-имидазолил, 3-пиразолил, 5-изоксазолил и 3-(1,2,4)триазолил;-3 005770 каждый R2 независимо выбирают из группы, включающей в себя водород и необязательно замещенный алкил, такой как аминоалкил, галогеналкил и гидроксиалкил, алкенил или алкинил, галоген,гидрокси, циклоалкил, циано, амино, алкиламино, диалкиламино, алкокси, аминокарбонил, алкиламинокарбонил, ариламинокарбонил, аралкиламинокарбонил, алкилкарбониламино, арилкарбониламино и аралкилкарбониламино; или R1 и R2 объединены с атомами углерода, к которым они присоединены, с образованием гетероциклического кольца;R3, R4, R5 и R6 независимо выбирают из группы, включающей в себя водород, алкил, алкенил, алкинил, галоген, галогеналкил, гидроксиалкил, гидрокси, нитро, амино, циано, амид, карбоксиалкил, алкоксиалкил, уреидо, ациламино, тиол, ацилокси, азидо, алкокси, карбокси, карбониламидо и алкилтиол;R8 выбирают из группы, включающей в себя алкил, алкенил, алкинил, OR9, амино, алкиламино, диалкиламино, алкениламино, диалкиламиноалкенил, диалкиламиноалкиламино, диалкиламиноалкениламино, алкиламиноалкениламино, гидроксиаминоалкениламино, циклоалкил, гетероциклоалкил, циклоалкилалкиламино, гетероциклоалкиламино, арил, арилалкил, арилалкенил, арилалкинил и арилалкиламино,каждый из которых может быть необязательно замещен, при условии, что R8 не является OR9, если R1 означает SO2R8; гдеR9 выбирают из группы, включающей в себя водород, необязательно замещенный алкил и щелочной металл; иX выбирают из группы, включающей в себя O,S, NH или СН 2. Другая группа соединений, используемая в этом объекте настоящего изобретения, представляет собой арилзамещенные пиридины, пиримидины, пиразины и триазины, представленные формулой II, где А 1, А 2, А 3, R1 - R6 и R8 - R11 описаны выше при условии, что 1) R2 не означает метокси, если R5 означает трифторметил, R6 означает Н, X означает О и R1 означает SO2CH2Ph; 2) R2 не означает NH2, если R1 означает метилтио, X означает О и два из A1, A2 и A3 означают N; 3) R2 не означает метил, если R1 означает SO2R8, где R8 означает метилфенил, R3 и R4 означают метокси, X означает S и два из А 1, А 2 и А 3 означают N; 4) R2 не означает CCl3, если R1 означает CCl3, X означает S и два из A1, A2 и А 3 означают N или 5) R1 и R2 оба не означают NH2, если X означает О или S и два из А 1, А 2 и А 3 означают N. Примеры мостиковых групп, образуемых объединенными R1 и R2, включают -CH2NCH2-, -C(O)NC(O)- иR1 предпочтительно выбирают из группы, включающей в себя алкил, необязательно замещенный галогеном или гидрокси, тиометил, C(O)R8, SO2R8, 2-имидазолинил, 2-имидазолил, 3-пиразолил и 5 изоксазолил, где R8 выбирают из группы, включающей в себя алкил, алкенил, OR9, амино, алкиламино,диалкиламино, алкениламино, диалкиламиноалкенил, диалкиламиноалкиламино и гетероциклоалкиламино, каждый из которых может быть необязательно замещен, при условии, что R8 не означает OR9, еслиR2 предпочтительно выбирают из группы, включающей в себя водород, алкил, алкенил, алкинил,аминоалкил, амино, гидроксиалкил, алкокси, аминокарбонил, алкиламинокарбонил, ариламинокарбонил,аралкиламинокарбонил, алкилкарбониламино, арилкарбониламино и аралкилкарбониламино, более предпочтительно водород, алкил, алкокси, аминоалкил и аминокарбонил.R3, R4, R5 и R6 предпочтительно независимо выбирают из группы, включающей в себя водород, алкил, алкенил, алкинил, галоген, галогеналкил, гидроксиалкил, гидрокси, нитро, амино и циано. Более предпочтительно R3, R4, R5 и R6 независимо выбирают из группы, включающей в себя водород, алкил,галоген, галогеналкил и нитро. Предпочтительно R3-R6 включают водород, галоген, С 1-С 6 галогеналкил,С 1-С 6 алкил, С 2-С 6 алкенил, С 2-С 6 алкинил, С 1-С 6 гидроксиалкил, нитро, амино, уреидо, циано, С 1 С 6 ациламидо, гидрокси, тиол, С 1-С 6 ацилокси, азидо, С 1-С 6 алкокси или карбокси. Каждая из групп R3-R6 занимает место атома водорода, который присутствует в любом положении арильного кольца, к которому присоединена группа R. Наиболее предпочтительными соединениями являются соединения, в которых R3 и R4 оба означают водород, R6 означает водород и R5 означает фтор в пара-положении.R7 предпочтительно означает неразветвленную или разветвленную алкильную группу, состоящую из С 1-10 атомов углерода, более предпочтительно из C1-6 атомов углерода, необязательно замещенную по меньшей мере одним заместителем, выбранным из галогена, гидрокси, нитро, амино, циано и алкокси групп.R8 предпочтительно выбирают из группы, включающей в себя алкил, алкенил, OR9, амино, алкиламино, диалкиламино, алкениламино, диалкиламиноалкенил, диалкиламиноалкиламино и гетероциклоалкиламино, каждая из которых может быть необязательно замещенной, где R9 определен выше, при условии, что R8 не означает OR9, если R1 означает SO2R8.CR2 и один из R2 отличен от Н, то упомянутый R2 предпочтительно находится в положении А 2 Если A2 означает N, А 1 и А 3 оба означают CR2 и один из R2 отличен от Н, то упомянутый R2 предпочтительно находится в положении A1. В одном объекте изобретения предпочтительные соединения включены в объем, определенный формулой II, включая соединения, в которых X означает О или S. В этом объекте изобретения R1 предпочтительно означает аминокарбонил и R2 предпочтительно означает водород. Предпочтительные группы R3-R6 описаны выше. Поскольку соединения формулы I являются блокаторами натриевых каналов, они могут быть использованы для лечения ряда заболеваний и состояний, опосредованных притоком ионов натрия. Следовательно, изобретение относится к способу лечения, профилактики и снижению нейрональных потерь,связанных с инсультом, общей или очаговой ишемией, травмами центральной нервной системы, гипогликемией или хирургией, травмами спинного мозга; а также к способу лечения и снижению интенсивности нейродегенеративных заболеваний, включая болезнь Альцгеймера, амиотрофический латеральный склероз, болезнь Паркинсона, лечение или снижение интенсивности тревожных состояний, судорог,глаукомы, мигреней и мышечных спазмов. Соединения формулы I используют также в качестве лекарственного средства от звона в ушах, противоманиакальных депрессантов, местных обезболивающих средств, противоаритмических средств, а также для лечения, профилактики или снижения интенсивности болей, включая послеоперационные, хронические и невропатические боли. В каждом случае согласно способу по настоящему изобретению требуется введение животному, нуждающемуся в таком лечении,эффективного количества блокатора натриевых каналов по настоящему изобретению, или его фармацевтически приемлемой соли или пролекарства. Изобретение также относится к арилзамещенным пиридинам, пиримидинам, пиразинам и триазинам, представленным формулой III или их фармацевтически приемлемым соли, пролекарству, или сольвату, где A1-А 3, R2-R6, R8 и X описаны выше при определениях формул I-II. Предпочтительные соединения, описанные формулой III, включают соединения, в которых R2 означает водород, R8 означает амино, а X означает О и S. R3-R6 имеют предпочтительные значения, описанные выше для формулы II. Кроме того, предпочтительный R8 выбирают из группы, включающей в себя алкил, алкенил, амино, алкиламино, диалкиламино, алкениламино,диалкиламиноалкенил, диалкиламиноалкиламино и гетероциклоалкиламино, каждый из которых может быть необязательно замещен. Кроме того, изобретение относится к арилзамещенным пиридинам, пиримидинам, пиразинам и триазинам, представленным формулой IV или их фармацевтически приемлемым соли, пролекарству или сольвату, где А 1-A3, R2-R6 и X определены выше при определении формул I-III, a R8 выбирают из группы, включающей в себя алкил, алкенил, алкинил, амино, алкиламино, диалкиламино, алкениламино, диалкиламиноакенил, диалкиламиноалкиламино,циклоалкил, гетероциклоалкил, циклоалкилалкиламино, гетероциклоалкиламино, арил, арилалкил, арилалкенил, арилалкинил и арилалкиламино, каждый из которых может быть необязательно замещен. R8-5 005770 предпочтительно выбирают из группы, включающей в себя алкил, алкенил, амино, алкиламино, диалкиламино, алкениламино, диалкиламиноалкенил, диалкиламиноалкиламино и гетероциклоалкиламино, каждый из которых может быть необязательно замещен. Более предпочтительно, когда R8 выбирают из группы, включающей в себя необязательно замещенный алкил, циклоалкил, арил и амино. R3 - R6 имеют предпочтительные значения, как описано выше для формулы II. Предпочтительные соединения, описанные формулой IV, включают соединения, в которых R2 означает водород, R8 означает амино и X означает O и S. Настоящее изобретение относится также к соединениям формулы V или их фармацевтически приемлемым соли, пролекарству или сольвату, где А 1-А 3, R2-R4 и R7 описаны выше при определении формул I-IV и X означает О, S, NH, СН 2 или отсутствует. Предпочтительные соединения, описанные формулой V, включают соединения, в которых R2 означает водород, а X означает О и S. Предпочтительно, когда R7 означает неразветвленную или разветвленную цепь С 1-6, более предпочтительно С 1-4 алкил, необязательно замещенный по меньшей мере одним галогеном, прежде всего, фтором или хлором. R3 и R4 имеют предпочтительные значения, как описано выше для формулы II. Примеры предпочтительных соединений, которые могут быть использованы в данном способе по настоящему изобретению, включают, без ограничения перечисленным: 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоксамид,4-[4-(4-нитрофенокси)фенил]пиримидин-2-карбоксамид,4-[4-(4-метоксифенокси)фенил]пиримидин-2-карбоксамид,4-[4-(4-трифторметилфенокси)фенил]пиримидин-2-карбоксамид,4-[4-(3-хлор-2-цианофенокси)фенил]пиримидин-2-карбоксамид,4-[4-(4-хлор-2-фторфенокси)фенил]пиримидин-2-карбоксамид,4-[4-(2,4-дифторфенокси)фенил]пиримидин-2-карбоксамид,4-[4-(2-хлор-4-фторфенокси)фенил]пиримидин-2-карбоксамид,1-[4-[4-(4-фторфенокси)фенил]пиримидин-2-ил]этанон,2-[4-(4-фторфенокси)фенил]пиримидин-4-карбоксамид,2-[4-(4-фторфенокси)фенил]-4-метилпиримидин,2-метил-4-[4-(4-фторфенокси)фенил]пиримидин,4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновая кислота,натриевая соль 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты; метиламид 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты; диметиламид 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты,трет-бутиламид 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты,2-[4-(4-хлор-2-фторфенокси)фенил]пиримидин-4-карбоксамид,2-[4-(4-хлор-2-фторфенокси)фенил]пиримидин-4-карбоновая кислота,диметиламид 2-(4-феноксифенил)-6-(диметиламино)пиримидин-4-карбоновой кислоты,2-гидроксиэтиламид 4-[4-(4-фторфенокси)фенил] пиримидин-2-карбоновой кислоты,гидроксиметиленамид 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты,2-(2-гидроксипроп-2-ил)-4-[4-(4-фторфенокси)фенил]пиримидин,2-морфолин-4-ил-этиловый эфир амида 4-[4-(2,4-дифторфенокси)фенил]пиримидин-2-карбоновой кислоты,гидрохлорид 2-(4,5-дигидро-1 Н-имидазол-2-ил)-4-[4-(4-фторфенокси)фенил]пиримидина,2-(3-пиразолил)-4-[4-(4-фторфенокси)фенил]пиримидин,2-(5-изоксазолил)-4-[4-(4-фторфенокси)фенил]пиримидин,2-(1-метил-3-пиразолил)-4-[4-(4-фторфенокси)фенил]пиримидин,метиламид 2-[4-(4-хлор-2-фторфенокси)фенил]пиримидин-4-карбоновой кислоты; 3-диметиламино-1-4-[4-(4-фторфенокси)фенил]пиримидин-2-илпропенон,2-тиометил-4-[4-(4-фторфенокси)фенил]пиримидин,2-метансульфонил-4-[4-(4-фторфенокси)фенил]пиримидин,2-[4-(4-хлор-2-фторфенокси)фенил]-4-метилпиримидин,4-[4-(4-фторфенокси)-3-фторфенил]пиримидин-2-карбоксамид и 2-[4-(4-фторфенокси)-3-фторфенил]пиримидин-4-карбоксамид.-6 005770 Кроме того, используемые в настоящем изобретении соединения включают 2-метил-6-(4-феноксифенил)пиридин,6-(4-феноксифенил)пиридин-2-карбоксамид,2-метил-6-[4-(4-фторфенокси)фенил]пиридин,6-(4-феноксифенил)пиридин-2-карбоновая кислота,метиламид 6-(4-феноксифенил)пиридин-2-карбоновой кислоты; 6-[4-(4-фторфенокси)фенил]пиридин-2-карбоксамид,6-[(4-трифторметокси)фенил]пиридин-2-карбоксамид,6-[4-(2,4-дифторфенокси)фенил]пиридин-2-карбоксамид,6-[4-(4-хлор-2-фторфенокси)фенил]пиридин-2-карбоксамид,6-[4-(4-фторфенокси)-3-фторфенил]пиридин-2-карбоксамид,6-[4-(4-трифторметилфенокси)фенил]пиридин-2-карбоксамид; 6-(4-феноксифенил)пиразин-2-карбоксамид,3,5-диамино-6-(4-феноксифенил)пиразин-2-карбоксамид и 2-[4-(4-нитрофенокси)фенил]-4-метил-[1,3,5]триазин. Кроме того, используемые в этом изобретении соединения включаютN-пиперидинилэтиламид 6-[4-(4-фторфенокси)фенил]пиридин-карбоновой кислоты,6-(4-трет-бутилфенил)пиридин-2-карбоксамид,6-(4-н-бутилфенил)пиридин-2-карбоксамид,6-(4-изо-пропилфенил)пиридин-2-карбоксамид,6-(4-тиометилфенил)пиридин-2-карбоксамид,6-(4-этоксифенил)пиридин-2-карбоксамид и 6-(4-метоксифенил)пиридин-2-карбоксамид. Кроме того, используемые в этом изобретении соединения включают 2-диметиламино-4-[4-(4-фторфенокси)фенил]пиримидин,этиловый эфир 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты,4-[4-(4-фторфенокси)фенил]пиримидин-2-карбамат,2-хлорэтиламид 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты; 1-[4-[4-(4-фторфенокси)фенил]пиримидин-2-ил]-2,2-дибромэтанон,гидрохлорид метиламинометиленамида 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты,2-[3-( 1,2,4-триазолил)]-4-[4-(4-фторфенокси)фенил]-пиримидин,диметиламинометиленамид 2-[4-(4-хлор-2-фторфенокси)фенил]-пиримидин-4-карбоновой кислоты,метиловый эфир 4-[4-(2,4-дифторфенокси)фенил]пиримидин-2-карбоновой кислоты,метиловый эфир 2-[4-(4-фторфенокси)фенил]пиримидин-4-карбоновой кислоты; 2-[4-(4-фторфенокси)фенил]-4-[3-(1,2,4-триазолил)]-пиримидин,гидроксиметиленамид 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты,2-(4-феноксифенил)-6-(диметиламино)пиримидин-4-карбоксамид,диметиламин 2-(4-феноксифенил)-6-(диметиламино)пиримидин-4-карбоновой кислоты,2-метил-3-циано-6-[4-(4-фторфенокси)фенил]пиридин,6-[4-(4-фторфенокси)фенил]пиридин-2,3-дикарбоксамид,2-метил-6-[4-(4-фторфенокси)фенил]пиридин-3-карбоксамид,диметиламид 6-(4-феноксифенил)пиридин-2-карбоновой кислоты,5-циано-6-(4-феноксифенил)пиридин-2-карбоксамид,5-гидрокси-6-(4-феноксифенил)пиридин-2-карбоксамид и 5-метокси-6-(4-феноксифенил)пиридин-2-карбоксамид. Подходящими арильными группами являются С 6.14 арил, предпочтительно С 6-10 арил. Типичные арильные группы С 6-14 включают фенил, нафтил, фенантрил, антрацил, инденил, азуленил, бифенил, бифениленил и флуоренил. Подходящими циклоалкильными группами являются С 3-8 циклоалкил. Типичные циклоалкильные группы включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Подходящие галогеновые группы включают фтор, хлор, бром и иод. Подходящие алкильные группы включают неразветвленные и разветвленные С 1-10 алкильные группы, более предпочтительно С 1-6 алкильные группы. Типичные С 1-10 алкильные группы включают метил,этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, 3-пентил, гексил и октил. Рассматриваются также триметиленовые группы, замещенные в двух соседних положениях бензольного кольца соединений по настоящему изобретению. Подходящие алкенильные группы включают С 2-6 алкенильные группы, предпочтительно С 2-4 алкенилы. Типичные алкенильные группы включают этинил, пропенил, изопропенил, бутенил и втор-бутенил. Подходящие алкинильные группы включают С 2.6 алкинильные группы, предпочтительно С 2-4 алкинилы. Типичные С 2-4 алкинильные группы включают этинил, пропинил, бутинил и 2-бутинильные группы.-7 005770 Подходящие арилалкильные группы включают любую из вышеупомянутых С 1-10 алкильных групп,замещенную одной из вышупомянутых С 6-14 арильных групп. Подходящими являются бензил, фенетил и нафтилметил. Подходящие арилалкенильные группы включают любую из вышеупомянутыхС 2-4 алкенильных групп, замещенную любой вышеупомянутой С 6-14 арильной группой. Подходящие арилалкинильные группы включают любую из вышеупомянутыхС 2-4 алкинильных групп,замещенную любой вышеупомянутой С 6-14 арильной группой. Подходящими являются фенилэтинил и фенилпропинил. Подходящие циклоалкилалкильные группы включают любую из вышеупомянутых С 1-10 алкильных групп, замещенную любой вышеупомянутой циклоалкильной группой. Подходящие галогеналкильные группы включают С 1-10 алкильные группы, замещенные по меньшей мере одним атомом фтора, хлора, брома или иода, например, фторметил, дифторметил, трифторметил,пентафторэтил, 1,1-дифторэтил и трихлорметил. Подходящие гидроксиалкильные группы включают С 1-10 алкильные группы, замещенные гидроксильной группой, например, гидроксиметил, гидроксиэтил, гидроксипропил и гидроксибутил. Подходящие алкоксигруппы включают кислород, замещенный одной из С 1-10 алкильных групп,упомянутых выше. Подходящие алкилтиогруппы включают серу, замещенную одной из С 1-10 алкильных групп, упомянутых выше. Подходящими ациламиногруппами являются любые ацильные группы, например С 2-6 алканоил или С 6-10 арил(С 2-6)алканоил, присоединенные к аминному азоту, например, ацетамидо, пропионамидо, бутаноиламидо, пентаноиламидо, гексаноиламидо и бензоил. Подходящими ацилоксигруппами являются любые С 1-6 ацил(алканоил) группы, присоединенные к окси (-О-) группе, например ацетокси, пропионоилокси, бутаноилокси, пентаноилокси, гексаноилокси и т.п. Термин "гетероциклический" использован в данном описании для обозначения насыщенной или полностью или частично ненасыщенной 3-7-членной моноциклической или 7-10-членной бициклической кольцевой системы, которая состоит из атомов углерода и от одного до четырех гетероатомов, независимо выбранных из группы, включающей в себя О, N и S, где гетероатомы серы и азота могут быть необязательно окислены, а азот может быть необязательно кватернизованным, причем упомянутая система включает любую бициклическую систему, в которой определенные выше гетероциклические кольца могут быть конденсированными с бензольным кольцом, и где гетероциклическое кольцо может быть замещено по атому углерода или азота, при условии, что полученное соединение является стабильным. Примеры включают без ограничения перечисленным: пирролидин, пиперидин, пиперазин, морфолин, имидазолин, пиразолидин, бензодиазепины и т.п. Подходящие гетероциклоалкильные группы включают любые из упомянутых выше С 1-10 алкильных групп, замещенных любыми упомянутыми выше гетероциклическими группами. Подходящие гетероциклоалкиламиногруппы включают любые вышеупомянутые гетероциклоалкильные группы, присоединенные к аминному азоту, такие как N-пиперидинилэтиламиногруппа. Подходящими алкиламино и диалкиламино группами являются группы -NHR10 и -NR10R11, где R10 иR11 являются С 1-10 алкильными группами. Подходящие диалкиламиноалкильные группы включают любые вышеупомянутые С 1-10 алкильные группы, замещенные любыми вышеупомянутыми диалкиламиногруппами. Подходящими диалкиламиноалкиламино группами являются любые из вышеупомянутых диалкиламиноалкильных групп, присоединенных к аминному азоту, например, диметиламиноэтиламино. Аминокарбонильная группа означает -C(O)NH2. Подходящими алкиламинокарбонильными группами являются карбонильные группы, замещенные группами -NHR10 и -NR10R11, где R10 и R11 являются С 1-10 алкильными группами. Подходящие алкилтиольные группы включают любые из вышеупомянутых С 1-10 алкильных групп,замещенных -SH группой. Карбоксильная группа означает -СООН. Азидогруппа означает -N3. Уреидогруппа означает -NH-C(O)-NH2. Аминогруппа означает -NН 2. Амидная группа означает органический радикал, содержащий в качестве функциональной группы остаток -NHC(O)-. Необязательные заместители для R1, R2 и R7-R11 включают любую из следующих групп: галоген,галоген(С 1-6)алкил, арил, гетероцикл, циклоалкил, С 1-6 алкил, С 2-6 алкенил, С 2-6 алкинил, арил(С 1-6)алкил,арил(С 2-6)алкенил, арил(С 2-6)алкинил, циклоалкил (С 1-6)алкил, гетероцикло(С 1-6)алкил, гидрокси(С 1-6)алкил,амино(C1-6)алкил, карбокси(C1-6)алкил, алкокси(C1-6)алкил, нитро, амино, уреидо, циано, ациламино, гидрокси, тиол, ацилокси, азидо, алкокси, карбокси, аминокарбонил и С 1-6 алкилтиольные группы, упомянутые-8 005770 выше. Необязательные заместители предпочтительно включают галоген, галоген(С 1-6)алкил, гидрокси(С 1-6)алкил, амино(С 1-6)алкил, гидрокси, нитро, С 1-6 алкил, алкокси и амино. Некоторые из соединений, описанных формулами I-V, могут существовать в виде оптических изомеров, изобретение также включает рацемические смеси таких оптических изомеров, а также индивидуальные энантиомеры, которые могут быть разделены согласно методам, хорошо известным специалистам в данной области техники. Примеры фармацевтически приемлемых солей включают соли неорганических и органических кислот, таких как гидрохлориды, гидробромиды, фосфаты, сульфаты, цитраты, лактаты, тартраты, малеаты,фумараты, манделаты, ацетаты, дихлорацетаты и оксалаты. Примеры пролекарств включают эфиры или амиды формулы I-V, где радикалы R2, R3, R4, R5 и R6 означают гидроксиалкил или аминоалкил, причем эти соединения могут быть получены при взаимодействии таких соединений с ангидридами, такими как янтарный ангидрид. Изобретение также включает способ лечения нарушений, чувствительных к блокаде натриевых каналов у животных, страдающих такими заболеваниями. Предпочтительные варианты воплощения настоящего изобретения, т.е. арилзамещенные гетероарильные соединения для использования в способе по настоящему изобретению, представлены определенными выше формулами I-V. Соединения, представленные в настоящем изобретении, могут быть получены с использованием методов, хорошо известных специалистам в данной области техники. 4-арилпиримидиновые производные соединений формулы III могут быть получены, например, как показано на схеме Синтез 1. Образование пиримидинового кольца происходит, как описано в статье Fisher G.W. (J. Heterocyclic Chem., 30: 1517-1519 (1993 и в статье Domagala J.M. и соавт. (J. Heterocyclic Chem., 26: 1147-1158 (1989. Для окисления метилпиримидина используется метод, описанный в статье Sakamoto Т. и соавт. (Chem. Pharm. Пиразиновые производные соединений формулы III могут быть получены, например, как показано на схеме Синтез 2, с использованием методики, описанной в статьях Ohta А. и соавт. (J. Heterocyclic 2-арилпиримидиновые производные соединений формулы III могут быть получены, как показано на схеме Синтез 3. Пиримидиновое кольцо получают, как описано в статье Burdeska K. и соавт. (Helv. Chim. 2-арилпиримидин-4-карбоксамиды могут быть также синтезированы при конденсации 2 хлорпиримидин-4-карбоксамида и бороновой кислоты или бороната, как показано на схеме Синтез 4. Синтез 4 2-хлорпиримидин-4-карбоксамид синтезируют из гидрохлорида 4-метил-2-пиримидинола, используя методику, описанную в статье Daves и соавт. (J. Heterocycl. Chem., 1:130-133 (1964. Хлорид затем конденсируют с бороновой кислотой или боронатом, используя методику, описанную выше. Амиды пиридина формулы III могут быть синтезированы, как показано на схеме Синтез 5. Синтез 5 6-бромпиколиновую кислоту (выпускаемую, например, фирмой Aldrich) превращают в соответствующий амид и конденсируют с арилбороновыми кислотами в присутствии катализатора Pd(PPh3)4. Например, см. статью Daines R.A. и соавт. (Bioogr. Med. Chem. Lett., 7:2673-2676 (1997. Бороновые кислоты выпускаются фирмами, или также могут быть синтезированы из соответствующих бромидов или иодидов с использованием реагента Гриньяра или литийорганических соединений по методике, описанной в статьях Bettman и соавт. (J. Am. Chem. Soc, 56:1865-1866 (1934, Baldwin J. E. и соавт. (TetrahedronMed. Chem., 40:4208-4221 (1997. Кроме бороновой кислоты могут быть использованы арилборонаты,синтезированные из арилбромидов, иодидов и трифлатов с использованием методики, описанной в статье Murata М. и соавт. (J. Org. Chem., 65:164-168 (2000 и конденсации по методике, описанной в статьеGiroux А. и соавт. (Tetrahedron, 38:3841 (1997. Согласно другой методике, 2-бром-6-метилпиридин может быть конденсирован с 4-бромбороновой кислотой и полученный бромид подвергают конденсации Ульмана с фенолом в присутствии Cs2CO3 и порошкообразной меди (Buchwald S.L и соавт., J. Am. Chem. Soc, 119:10539-10540 (1997. Метильную- 10005770 группу пиридина затем в две стадии превращают в необходимую амидную группу с использованием методики, описанной выше. Синтез 6 Пиразины могут быть синтезированы конденсацией соответственно замещенного 6 галогенпиразина с арилбороновой кислотой с использованием методики, описанной для получения соответствующего пиридина, как показано ниже на схеме Синтез 7. Синтез 7 1,3,5-триазины по настоящему изобретению могут быть синтезированы, например, с использованием методики, описанной в статье Chen и соавт. (J. Org. Chem., 60:8428-8430 (1995, как показано ниже: Синтез 8 5-арил-1,2,4-триазины по настоящему изобретению могут быть синтезированы с использованием методики, описанной в сатье Benson S. и соавт. (J. Org. Chem., 55:3257-3269 (1990, как показано на схеме Синтез 9. Этилтиооксамат (Aldrich) может быть превращен в соответствующий гидразон с использованием методики, описанной в статье Raetz и Schroeder (J. Org. Chem., 23:1931-1933(1958. 3-арил-1,2,4-триазины по настоящему изобретению могут быть синтезированы, как показано на схеме Синтез 10. Натриевая соль гидразина может быть добавлена к бензонитрилу с использованием методики, описанной в статье Kauffmann Т. и соавт. (Angew. Chem., 75:344 (1963. Образование триазинового кольца можно проводить, как описано в статье Shkurko О.Р. и соавт. (Chem. Heterocycl. Compd. (перевод на англ.), 23:216-221 (1987. Превращение требуемого амида может быть осуществлено, как показано в статье Rykowski and Makosza (Tetrahedron Lett., 25:4795-4796 (1984 и Rykowski А. и соавт. (J. Соединения формулы V могут быть получены с использованием методов, описанных выше, и подходящих исходных соединений. Способность соединений по настоящему изобретению блокировать натриевые каналы исследуют путем электрофизиологического анализа диссоциированных нейронов гиппокампа. Связывание этих соединений с нейронными потенциалзависимыми натриевыми каналами может быть также исследовано с использованием мембран переднего мозга крысы и [3 Н]ВХТ-В ([3 Н]батрахотоксина-В). Натриевые каналы представляют собой высокомолекулярные трансмембранные белки, экспрессируемые в различных тканях. Эти потенциал-чувствительные каналы являются ответственными за быстрое возрастание проницаемости ионов Na+ в ответ на деполяризацию, связанную с потенциалом действия, во многих возбудимых клетках, включая мышечные, нервные клетки и клетки сердечной ткани. Одним из аспектов настоящего изобретения является открытие механизма действия соединений,описанных в данном тексте в качестве специфических блокаторов Na+ каналов. Полагают, что созданные на основании открытия этого механизма данные соединения могут быть использованы для лечения или профилактики гибели нейронов при очаговой или общей ишемии и для лечения или профилактики нейродегенеративных состояний, включая БАС, состояние тревоги и эпилепсии. Следует также ожидать, что они будут эффективны при лечении, предупреждении или уменьшении интенсивности невропатической боли, боли, вызванной хирургическим вмешательством, хронической боли и шума в ушах. Следует также ожидать, что соединения могут быть использованы в качестве антиаритмических, противоманиакальных и обезболивающих средств. Настоящее изобретение относится к соединениям формул I-V, являющимся блокаторами потенциалчувствительных натриевых каналов. Согласно настоящему изобретению, соединения, обладающие свойством блокировать предпочтительно натриевые каналы, характеризуются величиной IС 50, равной приблизительно 100 мкМ или менее, которую определяют методом электрофизиологического анализа,описанным в данном тексте. Соединения по настоящему изобретению предпочтительно характеризуются величиной IC50, равной 10 мкМ или менее. Наиболее предпочтительно соединения по настоящему изо- 12005770 бретению характеризуются величиной IC50, равной приблизительно 1,0 мкМ или менее. Способность замещенных гетероарильных соединений по настоящему изобретению блокировать Na+ каналы может быть исследована с использованием следующих методов: электрофизиологический анализ и анализ связывания с рецептором. Электрофизиологический анализ I: Препарат клеток: Клеточная линия НЕK-293 (NaIIA-B2), стабильно экспрессирующая изоформуrBIIA Na+ каналов, разработана в данной лаборатории. Клетки культивируют по стандартной методике,описанной ранее в статье Verdoorn Т.А. и соавт., Neuron, 4:919-928 (1990). Для электрофизиологического анализа клетки высевают на предварительно покрытые поли-D-лизином чашки Петри Cellware диаметром 35 мм (фирмы BIOCOAT, Becton Dickinson) до плотности 104 клеток на чашку в день пересева из конфлюэнтных культур. По наблюдениям авторов, клетки пригодны для проведения экспериментов в течение 2-3 дней после пересева. Измерение потенциал-зависимых токов Na+ методом patch-clamp (фиксации мембран): Регистрацию потенциала на целых клетках осуществляют по общепринятой методике (статья Hamill и соавт., PfluegersCity, CA). Регистрирующая ячейка находится в постоянном контакте с потоком внешнего раствора (150 мМ NaCl, 5,4 мМ KCl, 1,8 мМ CaCl2, 1 мМ MgCl2, 10 мМ HEPES, 10 мМ глюкозы, рН 7,4 (NaOH), осмоляльность 320 ммоль/кг) при скорости приблизительно 1 мл/мин. Регистрирующие пипетки (электроды) вытягивают из толстостенных капилляров (фирмы WPI, Sarasota, FI) и края оплавляют в пламени горелки. Сопротивление пипеток, заполненных внутренним раствором, содержащим (в мМ): 130 CsF, 20 NaCl,2 MgCl2, 10 EGTA, 10 HEPES, с рН 7,4, подведенным при помощи CsOH, при осмоляльности 310 ммоль/кг, находится в диапазоне от 1 до 3 МОм. Лекарственные препараты и промывочные растворы вводят через пучок линейных проточных трубок (фирмы Drummond Microcaps, 2 мкл, длина 64 мм). Соединения растворяют в диметилсульфоксиде (ДМСО) и готовят исходный концентрированный раствор с концентрацией 30 мМ, при последующем разбавлении внешним раствором конечная концентрация составляет 0,1-100 мкМ. При самой высокой (1%) концентрации, ДМСО лишь незначительно ингибирует величину тока Na+. Величину тока регистрируют при комнатной темперературе (22-25 С), отфильтровывая частоты при 5 кГц с использованием активного 8-полюсного фильтра Бесселя (Bessel filter) (фирмыFrequency Devices, Haverhill, MA), цифровые показания снимают с интервалами 10-50 мкс и сохраняют их при помощи аналого-цифрового интерфейса Digidata 1200 с программным обеспечениемPclamp6/Clampex (фирмы Axon Instruments). Последовательное сопротивление при необходимости компенсируют примерно на 75%. Для оценки импульсного потенциала и кинетики ингибирования Na+ каналов соединениями используют графики импульсных потенциалов, показанные на чертеже. Соотношение ток-потенциал (кривая ток-потенциал), график А, используют для определения величины потенциала, при которой достигается максимальный внутренний ток Na+ внутри клетки. Эту величину используют в ходе всего эксперимента в качестве тестируемого потенциала Vt. График состояния устойчивой инактивации (или наличие), график Б, используют для определения потенциала, при котором происходит практически полная (95%) инактивация Na+ каналов, эту величину используют в течение всего эксперимента в качестве потенциала Vc для предварительного импульса при обработке клеток. График В описывает, насколько быстро каналы восстанавливаются до исходного состояния после инактивации при потенциалах гиперполяризации. Этот график позволяет установить продолжительность промежутка (интервала) гиперполяризации, который используют в измерении кинетики связывания соединений с инактивированными Na+ каналами (график Г). Восстановление каналов в исходное состояние в контрольных условиях происходит быстро (90% восстановления в течение первых 5-10 мс). Если лекарственное средство в значительной степени замедляет процесс восстановления, то становится возможным (график Г) точно измерить кинетику связывания ингибитора с инактивированными каналами, а также их сродство в равновесном состоянии стабильности (k+ и Ki). Для определения величины k+ в серии успешных экспериментов с варьируемой продолжительностью предварительного импульса строят график зависимости снижения максимальных значений токов от продолжительности предварительного импульса и измеряют временную константу (т), определяемую по методу приближения с одной экспонентой. График зависимости значений 1/т от концентрации антагониста позволяет рассчитать величины скорости макроскопического связывания антагонистов. Для определения значений Ki кривые частичного ингибирования, определенные с использованием дробных сигналов в равновесном состоянии, рассчитывают с помощью логистического уравненияI/Iконтр. = 1/(1+([aнтагонист]/Ki)p) Уравнение 1 где Iконтр. - максимальная величина тока ионов Na+ в отсутствии антагониста, [антагонист] - концентрация лекарственного средства, Ki - концентрация антагониста, при которой наблюдается ингибирование, равное половине максимальной величины, а р- коэффициент наклона. Электрофизиологический анализ 2 Метод электрофизиологического анализа 2 используют для определения активности соединений по настоящему изобретению по отношению к натриевым каналам rВllа/бета 1, которые экспрессируются вooцитax Xenopus. Получение кРНК, кодирурующей клонированные субъединицы типа llа (rВllа) и бета 1 (1) из мозга крысы: Клоны кДНК, кодирующие субъединицу бета 1 из мозга крысы, получают в лаборатории с использованием стандартных методик, мРНК также получают с использованием стандартных методик. мРНК, кодирующая rВllа, предоставлена доктором A. Golden (UC Irvine). Препараты мРНК разбавляют и хранят до использования при -80 С в виде аликвотных частей по 1 мкл. Получение ооцитов: Взрослым самкам Xenopus laevis дают наркоз (20-40 мин) с использованием 0,15% этилового эфира 3-аминобензойной кислоты (MS-222), а затем обрабатывают известным способом(см. статью Woodward R.M. и соавт., Mol. Pharmacol., 41:89-103 (1992. От двух до шести долей яичников удаляют хирургическим способом. Ооциты на стадии развитияV-VI отсекают от яичника, причем ооциты все еще окружены обволакивающей тканью. В день операции ооциты отделяют от фолликулов путем обработки коллагеназой в течение 0,5-1 ч (0,5 мг/мл, тип I, производства фирмы Sigma или тип А, производства фирмы Boehringer Mannheim). Обработанные ооциты перемешивают на мешалке типа Vortex для удаления эпителия, промывают несколько раз и хранят в среде Barth, содержащей 88 мМ NaCl, 1 мМ KCl, 0,41 мМ CaCl2, 0,33 мМ Ca(NO3)2, 0,82 мМ MgSO4, 2,4 мМNaHCO3, 5 мМ HEPES, рН 7,4 доводят с использованием 0,1 мг/мл сульфата гентамицина. Микроинъекция ооцитов: Микроинъекцию ооцитов, не содержащих фолликулы, проводят с использованием системы для инъекции Nanoject (фирмы Drummond Scientific Co., Broomall, PA). Пипетки для микроинъекции имеют конический (скошенный) профиль для сведения к минимуму закупоривания. Диаметр наконечников для инъекционных пипеток составляет 15-35 мкм. Ооциты вводят микроинъекцией в количестве приблизительно 50 нл и в смеси с кРНК для rВllа и бета 1, соответственно, в соотношении 1:10. Электрофизиологический метод: Отклик мембранного тока регистрируют в растворе Рингера для контактного провода, содержащем 115 мМ NaCl, 2 мМ KCl, 1,8 мМ CaCl2, 5 мМ HEPES, рН 7,4. Электрические измерения проводят с использованием стандартного двухэлектродного зажима для измерения потенциала (Dagan TEV-200) в период в диапазоне 1-7 суток после инъекции. Измерительная ячейка представляет собой простую проточную ячейку с подачей самотеком (объем 100-500 мл зависит от регулировки отсасывающего устройства). Ооциты помещают в измерительную ячейку, накладывают на них электроды и непрерывно пропускают поток раствора Рингера (5-15 мл/мин). Исследуемые соединения наносят путем погружения в баню. Эксперименты по измерению потенциалов для индуцирования токов натриевых каналов: Стандартный поддерживающий потенциал для всего зажима на ооците составляет -120 мВ. Стандартную зависимость ток-напряжение оценивают с помощью стадий деполяризации в течение 40 мс, начиная от -60 мВ до +50 мВ с шагом увеличения 10 мВ. Максимальные токи измеряют в виде максимального отрицательного тока после стадии деполяризации потенциала. Напряжение при максимальном отклике тока регистрируют и используют для следующего эксперимента по измерению потенциала. Цель данного эксперимента заключалась в поиске соединений, которые являются модификаторами натриевых каналов нейронов, зависимыми от состояния каналов. Соединения предпочтительно характеризуются низкой аффинностью по отношению к каналам в состоянии покоя или в закрытом состоянии, но обладают высокой аффинностью по отношению к инактивированным каналам. Следующий эксперимент по измерению потенциала был использован для измерения аффинности соединений в отношении инактивированного состояния каналов. Ооциты выдерживают при поддерживающем потенциале при -120 мВ. При таком мембранном потенциале почти все каналы находятся в закрытом состоянии. Затем проводят деполяризацию напряжения в течение 4 с, когда индуцируется максимальный ток. При завершении стадии деполяризации практически все каналы находятся в инактивированном состоянии. Затем для удаления части каналов из инактивированного состояния проводят стадию гиперполяризации в течение 10 мс. Для анализа тока натриевого канала после указанной длительной стадии деполяризации (см. анализ ниже) используют конечный исследуемый импульс деполяризации. Токи натриевых каналов измеряют при указанном исследуемом импульсе до и после введения исследуемого соединения. Данные обрабатывают с использованием программного обеспеченияpClamp и clampfit (Axon instruments). Анализ данных: Величину кажущейся константы ингибирования (Ki) для антагонистов определяют по точечным данным ингибирования с использованием следующего уравнения (преобразованная форма уравнения Ченга-Прусова) (см. статью Left P. и Dougall I.G., TiPS, 14:110-112 (1993.Ki = (FR/1-FR)[лекарственное средство] Уравнение 2 где FR означает фракционный отклик, который определяют как ток ионов натрия, индуцированный конечным исследуемым импульсом деполяризации до введения лекарственного средства, деленный на ток ионов натрия, измеренный в присутствии лекарственного средства, а [лекарственное средство] означает концентрацию использованного лекарственного средства.- 14005770 Лекарственные средства: Сначала получают раствор лекарственного средства при концентрации 210 мМ в ДМСО. Затем готовят серию исходных растворов в ДМСО в диапазоне от 0,3 мкМ до 10 мМ в зависимости от активности соединения. Рабочие растворы получают путем разбавления исходных растворов в 1000-3000 раз в растворе Рингера. При таком разбавлении сам ДМСО незначительно влияет или оказывает неизмеряемое действие на отклик мембранных токов. Исходные растворы лекарственных средств в ДМСО хранят в темноте при 4 С. Растворы лекарственных средств в растворе Рингера готовят каждый день перед использованием. Анализ связывания соединений in vitro: Способность соединений по изобретению модулировать участок 1 или участок 2 Na+ канала определяют по методике, подробно описанной в статьях Yasushi, J. Biol. Chem., 261:6149-6152 (1986) и Creveling, Mol. Pharmacol., 23:350-358 (1983), соответственно. В качестве источника белков Nа+-каналов используют мембраны переднего мозга крысы. Анализ связывания проводят в 130 мкМ холинхлориде при 37 С путем инкубирования в течение 60 мин в присутствии [Н 3]-сакситоксина и [Н 3]-батрахотоксина в качестве радиоактивно меченых лигандов для участка 1 и участка 2, соответственно. Фармакологические исследования in vivo: Соединения по настоящему изобретению могут быть исследованы для определения противосудорожного действия после внутривенного, перорального или внутрибрюшинного введения с использованием ряда противосудорожных тестирований на мышах, в том числе тестирования максимального приступа, индуцированного электрошоком (МПЭ). МПЭ индуцируют электрошоком у самцов мышей линииNSA весом 15-20 г и у самцов крыс линии Sprague-Dawley весом 200-225 г путем наложения тока (для мышей: 50 мА, 60 имп/с, продолжительность импульса 0,8 мс, продолжительность воздействия 1 с, ток постоянный; для крыс: 99 мА, 125 имп/с, продолжительность импульса 0,8 мс, продолжительность воздействия 2 с, ток постоянный) с использованием прибора Ugo Basile ЕСТ (модель 7801). Мышей удерживают зажатием легко захватываемой складки на спине, а смоченные солевым раствором корнеальные электроды слегка касаются роговицы обоих глаз. Крысы свободно перемещаются на лабораторном столе,при этом используют электроды на ушных зажимах. Включают ток и для регистрации ответа в виде тонического вытяжения экстенсорной мышцы задних лап проводят наблюдения в течение до 30 с. Тонический приступ определяют как вытяжение задней лапы более чем на 90 относительно плоскости тела. Результаты обрабатывают методом пробит-анализа. Соединения можно исследовать по антиноцицепторной активности в формалиновой модели, как описано в статье S. Hunskaar, О.В. Fasmer, K. Hole, J. Neurosci. Methods, 14:69-76(1985). Во всех экспериментах используют самцов мышей линии Swiss Webster NIH (20-30 г; San Diego, CA). В день эксперимента мышей не кормят. Мышей помещают в банки из оргстекла для привыкания к условиям эксперимента по крайней мере на 1 ч. По истечении периода привыкания мышей взвешивают и вводят исследуемое вещество внутрибрюшинно или перорально, или соответствующее количество носителя (10% Твин-80). Через 15 мин после внутрибрюшинного введения дозы или через 30 мин после перорального введения мышам вводят формалин (20 мкл 5%-ного раствора формальдегида в солевом растворе) в дорсальную поверхность правой задней лапы. Мышей переносят в банки из оргстекла и регистрируют период времени, в течение которого мыши лижут или кусают лапу, в которую была осуществлена инъекция. Периоды лизания и кусания регистрируют через каждые 5 мин в течение 1 ч после инъекции формалина. Все эксперименты проводят с зашориванием глаз в течение светового цикла. Раннюю фазу ответа на введение формалина измеряют как лизание/кусание в период 0-5 мин, позднюю фазу в период 15-50 мин. Различие между группами, обработанными лекарственным препаратом и носителем, анализируют методом однофакторного дисперсионного анализа (ANOVA). Значимой является величина Р 0,05. Если соединения оказывают блокирующее действие в острой и во второй фазе активности, связанной с лизанием и покусыванием лапы, вызванной инъекцией формалина, то эти соединения считают эффективными для снижения острой и хронической боли. Соединения могут быть исследованы по их потенциальному действию на хроническую боль (антиаллодиничная и антигипералгезивная активности) в модели Чанга (периферической нейропатии). Самцов крыс линии Sprauge-Dawley весом в интервале 200-225 г подвергают анестезии галотаном (1-3% в смеси 70% воздуха и 30% кислорода) и в период анестезии контролируют температуру их тела с использованием гомеотермного одеяла. На уровне L5 и L6 делают средний надрез на спине размером 2 см, и паравертебральные группы мышц оттягивают билатерально. Затем обнажают спинные нервы L5 и L6, их отделяют и прочно сшивают шелковой нитью 6-0. В качестве отрицательного контроля проводят фиктивную операцию, обнажая спинные нервы L5 и L6 на противоположной стороне тела. Тактильная аллодиния: Крыс переносят в подвешенную экспериментальную клетку с решетчатым проволочным полом и позволяют привыкать в данных условиях в течение 5-10 мин. На подошвенной части задней ноги помещают ряд моноволокон Семмес-Вейнштайна для определения порога отдергивания. Первым используют волокно с массой изгиба 9,1 г (величина log 0,96), причем используют его до 5 раз, чтобы определить, вызовет ли оно ответ в виде отдергивания лапы. Если у животного наблюдается ответ в виде отдергивания, то следующее, более легкое волокно применяют до пяти раз, определяя, мо- 15005770 жет ли оно вызвать ответ. Эту процедуру повторяют, используя все более легкие волокна, до тех пор,пока ответ не наблюдается, и регистрируют, при использовании какого волокна наблюдается эффект. Если не наблюдается ответного отдергивания при использовании первого волокна массой 9,1 г, то применяют волокна с большей массой до тех пор, пока волокно не вызовет ответа, и регистрируют, при использовании какого волокна наблюдается ответ. Для каждого животного в каждой временной точке проводят по три измерения, чтобы определить средний порог чувствительности. Измерения проводят до введения лекарственного средства и через 1, 2, 4, и 24 ч после его введения. Одновременно проводят тестирование на тактильнуюаллодинию и механическую гиперальгезию. Механическая гиперальгезия. Крыс помещают в подвешенную клетку с проволочным решетчатым полом и в течение 5 мин позволяют им привыкать кусловиям эксперимента. Слегка притупленной иглой касаются подошвенной части задней лапы, таким образом, чтобы игла слегка вдавливалась в кожу, не проникая через нее. Прикосновение иглы к контрольным лапам обычно вызывает быструю реакцию отдергивания, слишком короткую, чтобы зафиксировать ее секундомером, и время отдергивания произвольно считают равным 0,5 с. На лапе с оперированной стороны животных с нейропатией в ответ на прикосновение затупленной иглы наблюдается чрезмерно сильное отдергивание. Максимальное время 10 с принимают за предельную величину. Время отдергивания для обеих лап животных в каждой временной точке измеряют по три раза с пятиминутным периодом между прикосновениями для восстановления в исходное состояние. Для расчета среднего значения времени отдергивания для каждой временной точки используют три измерения. Одновременно проводят тестирование на тактильную аллодинию и механическую гиперальгезию. Нейропротективная активность соединений может быть исследована после индуцирования очаговой и общей ишемии у крыс или песчанок по методике, описанной в статьях Buchan и соавт. (Stroke,Приложение, стр. 148-152 (1993, Sheardown и соавт. (Eur. J. Pharmacol., 236:347-353 (1993 и Graham и соавт. (J. Pharmacol. Exp. Therap., 276:1-4 (1996. Нейропротективная активность соединений может быть исследована после травматического повреждения спинного мозга согласно методике, описанной в статьях Wrathall и соавт. (Exp. Neurology,137:119-126 (1996 и Iwasaki и соавт. (J. Neuro Sci., 134:21-25 (1995. Композиции, входящие в объем настоящего изобретения, включают в себя все композиции, в которых соединения по настоящему изобретению содержатся в количествах, эффективных для достижения указанной цели. В связи с тем, что индивидуальные потребности различаются, определение оптимального диапазона эффективных количеств каждого компонента зависит от специалистов в данной области техники. В типичном случае соединения или эквивалентные количества их фармакологически приемлемых солей могут быть введены млекопитающим, например, человеку, перорально в дозе от 0,0025 до 50 мг в сутки на килограмм веса тела млекопитающего, нуждающегося в лечении эпилепсии, нейродегенеративных заболеваний, анестетики, аритмии, маниакальной депрессии, боли и анестезии. При внутримышечных инъекциях доза обычно составляет примерно половину оральной дозы. В случае лечения или профилактики гибели нейронов при очаговой или общей ишемии, травме головного и спинного мозга, гипоксии, гипогликемии, при состоянии эпилепсии и при хирургических операциях соединение можно вводить внутривенно в дозе от приблизительно 0,025 до приблизительно 10 мг/кг. Однократная доза для перорального приема может составлять от приблизительно 0,01 до приблизительно 50 мг, предпочтительно приблизительно от 0,1 до приблизительно 10 мг соединения. Однократную дозу можно вводить один или несколько раз в день в виде одной или нескольких таблеток, содержащих от приблизительно 0,1 до приблизительно 10, наиболее удобно от приблизительно 0,25 до приблизительно 50 мг соединения или его сольватов. Кроме введения соединения в необработанном виде без добавок, соединения по изобретению можно вводить в виде части фармацевтического препарата, содержащего подходящие фармацевтически приемлемые носители, включающие наполнители и вспомогательные материалы, облегчающие процесс обработки соединений в препараты, которые могут быть использованы в фармацевтике. Препараты, прежде всего те, которые могут быть введены перорально, и которые предпочтительны для определенного способа введения, такого как таблетки, драже и капсулы, а также препараты, которые могут быть введены ректально, такие как суппозитории, и также подходящие растворы для введения в виде инъекций или перорального приема, предпочтительно содержат от приблизительно 0,01 до 99%, предпочтительно от приблизительно 0,25 до 75% активного вещества (активных веществ), включая наполнитель. В объем притязаний настоящего изобретения включены также нетоксичные фармацевтически приемлемые соли соединений по настоящему изобретению. Кислотно-аддитивные соли получают путем смешивания раствора конкретного гетероарильного соединения по настоящему изобретению с раствором фармацевтически приемлемой нетоксичной кислоты, такой как соляная кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, лимонная кислота, винная кислота, угольная кислота, фосфорная кислота, щавелевая кислота, дихлоруксусная кислота и тому подобные. Соли с основаниями получают путем смешивания раствора гетероарильного соединения по настоящему изобретению с- 16005770 раствором фармацевтически приемлемого нетоксичного основания, такого как гидроксид натрия, гидроксид калия, гидроксидхолина, карбонат натрия и им подобные. Фармацевтические композиции по настоящему изобретению могут быть введены любому животному, которое может ощутить благотворное действие соединений по изобретению. Прежде всего, это млекопитающие, например, человек, без ограничения перечисленным. Фармацевтические композиции по настоящему изобретению могут быть введены любым способом,при котором достигается предназначенное действие. Например, вводить их можно парентерально, подкожно, внутривенно, внутримышечно, внутрибрюшинно, чрескожно или трансбуккально. Альтернативным или одновременным способом приема является пероральный прием. Вводимая доза зависит от возраста, состояния здоровья, веса принимающего препарат, вида сопутствующего лечения, если таковое имеется, частоты приема и природы требуемого эффекта. Фармацевтические препараты по настоящему изобретению получают широко распространенным способом, например, путем обычного смешивания, гранулирования, получения драже, процессов растворения и лиофилизации. Таким образом, фармацевтические препараты для перорального приема могут быть получены путем смешивания активных компонентов с твердыми носителями, необязательно путем измельчения полученной смеси и при необходимости путем обработки смеси гранул после добавления подходящих вспомогательных веществ для изготовления таблеток или ядер драже. Подходящими веществами-наполнителями являются, прежде всего, такие наполнители, как сахариды, например лактоза или сахароза, маннит или сорбит, препараты целлюлозы и/или фосфаты кальция,например трехзамещенный фосфат кальция, а также такие связующие агенты, как крахмальная паста с использованием, например, кукурузного крахмала, пшеничного крахмала, рисового крахмала, картофельного крахмала, желатина, трагаканта, метилцеллюлозы, гидроксипропилметилцеллюлозы, натрийкарбоксиметилцеллюлозы и/или поливинилпирролидона. При необходимости могут быть добавлены дезинтегрирующие агенты, такие как вышеупомянутые крахмалы и также карбоксиметилкрахмал, поперечно-сшитый поливинилпирролидон, агар или альгиновая кислота или ее соли, например, альгинат натрия. Вспомогательными веществами являются, прежде всего, агенты, регулирующие текучесть, и замасливатели, например, диоксид кремния, тальк, стеариновая кислота или ее соли, такие как стеарат магния или стеарат кальция и/или полиэтиленгликоль. Ядра драже покрывают соответствующей оболочкой, которая при необходимости является устойчивой к желудочным сокам. Для этой цели могут быть использованы концентрированные растворы сахаридов, которые необязательно могут содержать аравийскую камедь, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, лакирующие растворы и приемлемые органические растворители или смеси растворителей. Для получения оболочек,устойчивых к желудочным сокам, используют растворы подходящих препаратов целлюлозы, таких как фталат ацетилцеллюлозы или фталат гидроксипропилметилцеллюлозы. В оболочки таблеток или драже,например, для их идентификации или обозначения сочетаний доз активных соединений, могут быть добавлены пигменты или красители. Другие фармацевтические препараты, которые могут быть введены перорально, включают штампованные капсулы из желатина, а также мягкие запаянные капсулы из желатина и пластификатора, такого как глицерин или сорбит. Штампованные капсулы могут содержать активные соединения в виде гранул,которые могут быть смешаны с наполнителями, такими как лактоза, связывающими агентами, такими как крахмалы, и/или замасливателями, такими как тальк или стеарат магния, и, необязательно, стабилизаторами. В мягких капсулах активные соединения предпочтительно растворены или суспендированы в подходящих жидкостях, таких как нелетучие масла или жидкий парафин. Кроме того, могут быть добавлены стабилизаторы. Возможные фармацевтические препараты, которые могут быть использованы ректально, включают,например, суппозитории, содержащие комбинацию одного или более активных веществ с основой суппозитория. Приемлемыми основами для суппозиториев являются, например, природные или синтетические триглицериды или насыщенные углеводороды. Кроме этого, можно использовать желатиновые ректальные капсулы, содержащие комбинацию активных соединений с основой. Возможные материалы основы включают, например, жидкие триглицериды, полиэтиленгликоли или насыщенные углеводороды. Приемлемые составы для парентерального введения включают водные растворы активных соединений в водорастворимой форме, например, водорастворимые соли и спиртовые растворы. Кроме того,могут быть использованы суспензии активных соединений в виде соответствующих масляных инъекционных суспензий. Подходящие липофильные растворители или носители включают нелетучие масла,например, кунжутное масло, или синтетические эфиры жирных кислот, например, этиловый эфир олеиновой кислоты, или триглицериды или полиэтиленгликоль 400 (соединения растворимы в ПЭГ 400). Водные инъекционные суспензии могут содержать соединения, повышающие вязкозть суспензии, и включать, например, натрийкарбоксиметилцеллюлозу, сорбит и/или декстран. По выбору, суспензия может также содержать стабилизаторы. Следующие примеры приведены для иллюстрации способа и композиций по настоящему изобретению без ограничения перечисленным. Другие подходящие модификации и изменения ряда условий и- 17005770 параметров, обычно используемых в клинической терапии и очевидных для специалистов в данной области, включены в объем притязаний настоящего изобретения. Пример 1. 4-[4-(4-Фторфенокси)фенил]пиримидин-2-карбоксамид. а) 1-[4-(4-Фторфенокси)фенил]этанон Смесь 4-фторфенола (4,45 г, 39,3 ммоль), 4-фторацетофенона (4,4 мл, 36 ммоль) и карбоната калия(13 г, 94 ммоль) в ДМФ (40 мл) кипятят с обратным холодильником в течение ночи. Смесь охлаждают до комнатной температуры, распределяют между этилацетатом (ЕtOАс) (200 мл) и водой (200 мл). Отделенный водный слой экстрагируют этилацетатом (3 х 100 мл). Объединенные слои в этилацетате промывают водным раствором гидроксида натрия (2 н., 200 мл), промывают 2 раза водой (каждый раз по 200 мл), сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, при этом получают масло темного цвета. Масло затвердевает при комнатной температуре в течение ночи. При этом получают 6,7 г (80 %) неочищенного 1-[4-(4-фторфенокси)фенил]этанона. 1 Н ЯМР (CDCl3):7,96 (d, J=9,0 Гц, 2 Н), 7,11-7,06 (m, 4 Н), 6,98 (d, J=8,7 Гц, 2 Н), 2,59 (s, 3 Н). б) 3-Диметиламино-1-[4-(4-фторфенокси)фенил]пропенон Смесь неочищенного 1-[4-(4-фторфенокси)фенил]этанона (17,9 ммоль) и диметилацеталя N,Nдиметилформамида (2,6 мл, 18,4 ммоль) в N,N-диметилформамиде (ДМФ) (20 мл) кипятят с обратным холодильником в течение 24 ч. Раствор распределяют между этилацетатом и водой. Водный слой экстрагируют дважды этилацетатом и объединенные слои в этилацетате дважды промывают водой, сушат над сульфатом натрия, фильтруют, упаривают при пониженном давлении, при этом получают 3 диметиламино-1-[4-(4-фторфенокси)фенил]пропенон в виде твердого вещества желтого цвета, т.пл. 115118 С. в) 2-Метил-4-[4-(4-фторфенокси)фенил]пиримидин Гидрохлорид ацетамида (2,00 г, 20,1 ммоль) и трет-бутоксид калия (2,37 г, 20,1 ммоль) в безводном ТГФ (20 мл) кипятят с обратным холодильником в течение 50 мин. К реакционной смеси добавляют 3 диметиламино-1-[4-(4-фторфенокси)фенил]пропенон (3,96 г, 13,9 ммоль) в безводном ТГФ (20 мл) и кипятят с обратным холодильником в течение дополнительных 4 ч. Реакционную смесь охлаждают до комнатной температуры и концентрируют в вакууме, остаток распределяют между этилацетатом и водой. Водный слой дважды экстрагируют этилацетатом. Объединенные органические слои сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, при этом получают твердое вещество. Неочищенный продукт очищают колоночной хроматографией (гексан/этилацетат, 7:3), при этом получают 1,7 г (44%) требуемого соединения в виде твердого вещества желтого цвета. 1 Н ЯМР (CDCl3):8,61(d, J=5,1 Гц, 1 Н), 8,05 (d, J=8,4 Гц, 2 Н), 7,42 (d, J=5,7 Гц, 1 Н), 7,05-7,02 (m, 6H), 2,77 (s, 3 Н). г) 4-[4-(4-Фторфенокси)фенил]пиримидин-2-карбоновая кислота 4-[4-(4-Фторфенокси)фенил]-2-метилпиримидин (1,70 г, 6,03 ммоль) и диоксид селена (1,16 г, 10,4 ммоль) в пиридине (40 мл) кипятят с обратным холодильником в течение ночи. Смесь фильтруют для удаления частиц образующегося твердого вещества. Фильтрат упаривают при пониженном давлении и остаток добавляют к 2 н. водному раствору гидроксида натрия. Полученное твердое вещество собирают фильтрованием и распределяют между водным раствором соляной кислоты (2 н.) и этилацетатом. Водный слой дважды экстрагируют этилацетатом. Объединенные органические слои сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, при этом получают 1,5 г, (80%) требуемой кислоты в виде твердого вещества. 1 Н ЯМР (ДМСО-d6):8,95 (d, J=5,4 Гц, 1 Н), 8,25 (d, J=8,7 Гц, 2 Н), 8,18 (d, J=5,4 Гц, 1 Н), 7,30 (t,J=8,7 Гц, 2 Н), 7,22-7,17 (m, 2H), 7,13 (d, J=9,3 Гц, 2 Н). д) 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоксамид Смесь 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты (1,00 г, 3,23 ммоль) и карбонил диимидазола (1,10 г, 6,78 ммоль) в ДМФ (10 мл) перемешивают при комнатной температуре в течение 2 ч. К реакционной смеси добавляют твердый ацетат аммония (2,10 г, 27,2 ммоль). После перемешивания при комнатной температуре в течение ночи реакционную смесь разбавляют этилацетатом, промывают несколько раз водой, сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении. Неочищенный продукт очищают колоночной хроматографией (градиент от 100% этилацетата до этилацетат/метанол, 95:5), при этом получают 669 мг (67%) требуемого продукта в виде твердого вещества желтого цвета, т.пл. 180-182 С. 1 Н ЯМР (ДMCO-d6):8,94 (d, J=5,1 Гц, 1 Н), 8,38 (d, J=8,7 Гц, 2 Н), 8,34 (ушир.s, 1 Н), 8,15 (d, J=5,4 Гц, 1 Н), 7,83 (ушир.s, 1 Н), 7,30 (t, J=8,4 Гц, 2 Н), 7,22-7,17 (т, 2 Н), 7,12 (d, J=8,7 Гц, 2 Н). Следующие соединения получают аналогичным образом: Метиламид 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты,Диметиламид 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты,Трет-бутиламид 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты,4-[4-(4-Трифторметилфенокси)фенил]пиримидин-2-карбоксамид,4-[4-(2,4-Дифторфенокси)фенил]пиримидин-2-карбоксамид, и 4-[4-(4-Нитрофенокси)фенил]пиримидин-2-карбоксамид.- 18005770 Аналогичным способом получают также следующие соединения: 4-[4-(4-Метоксифенокси)фенил]пиримидин-2-карбоксамид,4-[4-(3-Хлор-2-цианофенокси)фенил]пиримидин-2-карбоксамид, и 4-[4-(4-Фторфенокси)-3-фторфенил]пиримидин-2-карбоксамид. Пример 2. 2-Метансульфонил-4-[4-(4-фторфенокси)фенил]пиримидин. а) 2-Тиометил-4-[4-(4-фторфенокси)фенил]пиримидин: Смесь 3-диметиламино-1-[4-(4-фторфенокси)фенил]пропенона (551 мг, 1,93 ммоль) и тиомочевины(294 мг, 3,86 ммоль), суспендированную в 5 мл этанола, обрабатывают 1,6 мл (1,93 ммоль) исходного раствора, полученного добавлением по каплям с помощью шприца 382 мг 85% раствора KОН в 5 мл этанола. Полученный раствор нагревают с обратным холодильником в течение 4 ч. Образующийся при комнатной температуре осадок желтого цвета (348 мг) отделяют фильтрованием и промывают этанолом(2 мл). Твердое вещество (338 мг) суспендируют в 5 мл воды и затем добавляют 0,25 мл (2,6 ммоль) диметилсульфата. Через 5 мин добавляют 1,6 мл водного 2 н. раствора NaOH. После перемешивания в течение ночи смесь экстрагируют простым эфиром (3x15 мл). Органические слои объединяют, промывают водой и солевым раствором, сушат (Na2SO4) и концентрируют. После экспресс-хроматографии (силикагель, гексан/этилацетат, 3:1) получают 226 мг тиола в виде твердого вещества грязно-белого цвета. 1 Н ЯМР (CDCl3):8,51 (d, 1H, J=5,1 Гц), 8,08 (d, 2H, J=8,8 Гц), 7,31 (d, 1H, J=5,5 Гц), 7,11-7,00 (m,6H), 2,64 (s, 3 Н). б) 2-Метансульфонил-4-[4-(4-фторфенокси)фенил]пиримидин: Раствор 205 мг (0,656 ммоль) 2-тиометил-4-[4-(4-фторфенокси)фенил]пиримидина в 8 мл CH2Cl2 обрабатывают раствором 321 мг м-хлорпероксибензойной кислоты (57-86%) в CH2Cl2 (2 мл). После перемешивания в течение 2 ч при комнатной температуре реакционную смесь экстрагируют по 20 мл воды,5% водного раствора гидросульфита натрия, воды и солевого раствора. После высушивания (Na2SO4) растворитель отгоняют в вакууме и остаток очищают экспресс-хроматографией (силикагель,ЕtOАс/гексан, 3:1), при этом получают 183 мг (81 %) требуемого соединения в виде твердого вещества белого цвета, т.пл. 146-147 С. 1 Н ЯМР (CDCl3):8,90 (d, 1H, J=5,5 Гц), 8,19 (d, 2H, J=8,8 Гц), 7,87 (d, 1H, J=5,5 Гц), 7,13-7,09 (m,6H), 3,45 (s, 3 Н). Пример 3. 1-[4-[4-(4-Фторфенокси)фенил]пиримидин-2-ил]этанон. а) Этиловый эфир 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты: Смесь 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты (3,15 г, 10,2 ммоль), иодэтана(2,0 мл, 25 ммоль) и карбоната цезия (7,00 г, 21,5 ммоль) в ДМФ (100 мл) выдерживают при температуре 70-80 С в течение 16 ч. Смесь распределяют между водой и этилацетатом. Водный слой дважды экстрагируют этилацетатом. Объединенные органические слои промывают 3 раза водой, сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, при этом получают масло. После очистки колоночной хроматографией (гексан/этилацетат, 1:1) получают требуемый продукт (2,14 г, 62%) в виде масла, которое затвердевает при комнатной температуре в течение ночи, т.пл. 61-63 С. 1 Н ЯМР (CDCl3):8,88 (d, J=5,4 Гц, 1 Н), 8,16 (d, J=8,7 Гц, 2 Н), 7,77 (d, J=5,4 Гц, 1 Н), 7,12-7,05 (m,6 Н), 4,55 (q, J=7,5 Гц, 2 Н), 1,49 (t, J=7,5 Гц, 3 Н). б) 1-[4-[4-(4-Фторфенокси)фенил]пиримидин-2-ил]этанон: К раствору этилового эфира 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты (0,66 г,1,95 ммоль) в безводном ТГФ (20 мл) при -78 С в атмосфере азота добавляют одной порцией 1,4 М раствор бромида метилмагния в этиловом эфире (1,4 мл, 1,96 ммоль). Реакционную смесь перемешивают при температуре -78 С в течение 30 мин, реакцию останавливают водой и распределяют между водой и этилацетатом. Водный слой экстрагируют этилацетатом и объединенные органические слои сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, при этом получают твердое вешество. Неочищенный продукт подвергают колоночной хроматографии (гексан/этилацетат, 6:4), при этом получают 0,36 г (60%) требуемого продукта в виде твердого вещества. 1 Н ЯМР (CDCl3):8,90 (d, J=4,2 Гц, 1 Н), 8,16 (d, J=8,4 Гц, 2 Н), 7,76 (d, J=4,8 Гц, 1 Н), 7,09-7,06 (m,6H), 2,85 (s, 3 Н). Пример 4. 2-[4-(4-Хлор-2-фторфенокси)фенил]пиримидин-4-карбоксамид. а) 4-(4-Хлор-2-фторфенокси)бензонитрил: Смесь 4-фторбензонитрила (5,0 г, 41,3 ммоль), 4-хлор-2-фторфенола (4,7 мл, 44 ммоль) и карбоната калия (13,8 г, 99,8 ммоль) в ДМФ (100 мл) кипятят с обратным холодильником в течение ночи. После охлаждения до комнатной температуры смесь разбавляют этилацетатом, дважды промывают 2 н. водным раствором гидроксида натрия, промывают водой, сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, при этом получают твердое вещество светло-желтого цвета. Масса неочищенного продукта составляет 7,56 г (74%). 1 Н ЯМР (CDCl3):7,61 (d, J=8,1 Гц, 2 Н), 7,27-7,07 (m, 3 Н), 6,98 (d, J=8,7 Гц, 2 Н). б) 2-[4-(4-Хлор-2-фторфенокси)фенил]-4-метилпиримидин:- 19005770 Газообразный хлористый водород пропускают через раствор 4-(4-хлор-2-фторфенокси)бензонитрила (1,64 г, 6,64 ммоль) в этаноле (100 мл) в атмосфере азота при температуре 0 С в течение 15 мин. Колбу с раствором закрывают и перемешивают при комнатной температуре в течение 24 ч и концентрируют досуха. Остаток растворяют в этаноле (100 мл), затем добавляют карбонат аммония (6,3 г, 65 ммоль) и полученную смесь перемешивают при комнатной температуре в течение 24 ч. Смесь фильтруют и фильтрат упаривают при пониженном давлении, при этом получают твердое вещество белого цвета. Неочищенный полупродукт используют на следующей стадии без очистки. 1 Н ЯМР (ДМСО-d6):7,90 (d, J=8,4 Гц, 2 Н), 7,40-7,25 (m, 3 Н), 7,18 (d, J=8,4 Гц, 2 Н). Смесь неочищенного амидина и трет-бутоксида калия (0,72 г, 6,1 ммоль) в метаноле (100 мл) кипятят с обратным холодильником в течение 30 мин. К реакционной смеси добавляют диметилацетальацетилацетальдегида(ДАААД; 0,8 мл, 5,4 ммоль) и кипятят с обратным холодильником в течение ночи. Затем добавляют дополнительные количества трет-бутоксида калия (0,72 г, 6,1 ммоль) и ДАААД (0,8 мл,5,4 ммоль). После кипячения в течение 6 ч с обратным холодильником реакционную смесь охлаждают до комнатной температуры и распределяют между водой и этилацетатом. Водный слой экстрагируют 1 раз этилацетатом. Объединенные органические слои сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, при этом получают твердое вещество темно-коричневого цвета. После колоночной хроматографии (от гексан/этилацетат, 85:15 до гексан/этилацетат, 8:2) получают 0,90 г (выход 43% из расчета на исходный бензонитрил) требуемого продукта в виде твердого вещества. 1 Н ЯМР (CDCl3):8,60 (d, J=5,1 Гц, 1 Н), 8,42 (d, J=8,4 Гц, 2 Н), 7,24-7,02 (m, 6H), 2,56 (s, 3 Н). в) 2-[4-(4-Хлор-2-фторфенокси)фенил]пиримидин-4-карбоновая кислота Смесь 2-[4-(4-хлор-2-фторфенокси)фенил]-4-метилпиримидина (0,90 г, 2,87 ммоль) и диоксида селена (0,62 г, 5,6 ммоль) в пиридине (50 мл) кипятят с обратным холодильником в течение ночи. Смесь охлаждают до комнатной температуры и фильтруют через слой целита. Фильтрат упаривают при пониженном давлении. Остаток растворяют в этилацетате, дважды промывают 2 н. водным раствором соляной кислоты. Органический слой отделяют, сушат над сульфатом натрия, фильтруют и упаривают при пониженом давлении, при этом получают 0,808 г (82%) твердого вещества светло-желтого цвета. 1 Н ЯМР (ДМСО-d6):9,11 (d, J=5,1 Гц, 1 Н), 8,46 (d, J=8,7 Гц, 2 Н), 7,87 (d, J=4,5 Гц, 1 Н), 7,38-7,35(m, 3 Н), 7,15 (d, J=9,0 Гц, 2 Н). г) 2-[4-(4-Хлор-2-фторфенокси)фенил]пиримидин-4-карбоксамид: Раствор 2-[4-(4-хлор-2-фторфенокси)фенил]пиримидин-4-карбоновой кислоты (0,6 г, 1,74 ммоль) и карбонилдиимидазол (0,54 г, 3,3 ммоль) в ДМФ (20 мл) перемешивают при комнатной температуре в атмосфере азота в течение 30 мин. Затем добавляют твердый ацетат аммония (2,0 г, 26 ммоль) и реакционную смесь перемешивают в течение ночи. Реакционную смесь разбавляют этилацетатом, промывают 3 раза водой, сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, при этом получают твердое вещество желтого цвета. Неочищенный продукт очищают колоночной хроматографией (дихлорметан/этилацетат, 4:1), при этом получают 331 мг (55%) конечного продукта в виде твердого вещества белого цвета, т.пл. 198-200 С. 1 Н ЯМР (CDCl3):9,01 (d, J=4,8 Гц, 1 Н), 8,44 (d, J=8,4 Гц, 2 Н), 7,96 (d, J=4,2 Гц, 1 Н), 7,88 (ушир.в,1 Н), 7,26-7,23 (m, 1H), 7,16-7,10 (m, 2 Н), 7,06 (d, J=8,7 Гц, 2 Н), 5,75 (ушир.s, 1 Н). Следующее соединение получают аналогичным способом: Метиламид 2-[4-(4-хлор-2-фторфенокси)фенил]пиримидин-4-карбоновой кислоты. Пример 5. 2-Хлорпиримидин-4-карбоксамид. а) Оксим 2-гидрокси-4-пиримидинкарбоксальдегида Раствор гидрохлорида 4-метил-2-пиримидинола (14,7 г, 0,100 моль) в 100 мл 50% водного раствора НОАс при температуре 12 С обрабатывают одной порцией твердого NaNO2 (10,47 г, 0,150 моль). При повышении температуры реакционной смеси до 42 С выделяется газ коричневого цвета и образуется осадок желтого цвета. После перемешивания при комнатной температуре в течение 3 ч твердый осадок отделяют фильтрованием и промывают холодной водой (2 х 50 мл). Полученное твердое вещество перекристаллизовывают из 550 мл кипящей воды, при этом получают 11,9 г (85%) оксима в виде иголок желто-коричневого цвета, т.пл. 222-226 С (разл.). 1 Н ЯМР (ДМСО-d6):12,4 (ушир.s, 1 Н), 11,9 (ушир.s, 1 Н), 7,95 (d, J=6,3 Гц, 1 Н), 7,79 (s, 1 Н), 6,68(d, 1 Н, J=6,6 Гц). б) 2-Хлор-4-цианопиримидин К очищенному POCl3 (40 мл, 65,8 г, 0,429 моль), охлажденному на водно-ледяной бане, порциями добавляют твердый порошкообразный оксим 2-гидрокси-4-пиримидинкарбоксальдегида (10,0 г, 71,9 ммоль). Охлаждающую баню удаляют и смесь медленно нагревают с обратным холодильником. Когда реакционная смесь начинает кипеть самостоятельно, нагревание прекращают. Когда кипячение замедляется, с помощью шприца добавляют очищенный N,N-диметиланилин (5 мл, 4,78 г, 39,4 ммоль). Полученный раствор темного цвета нагревают с обратным холодильником в течение 30 мин. При комнатной температуре реакционную смесь медленно добавляют к 300 г измельченного льда. Полученную смесь темного цвета экстрагируют эфиром (4 х 100 мл). Объединенные слои в эфире промывают водой (2 х 50- 20005770 мл), насыщенным водным раствором NaHCO3 (2 х 50 мл) и водой (2 х 50 мл). После высушивания(Na2SO4) смесь фильтруют и концентрируют в вакууме. 1,5 г полученного масла красного цвета растворяют в минимальном объеме CH2Cl2 и наносят на колонку для экспресс-хроматографии диаметром 4 см со слоем силикагеля 15 см. После элюирования 100% CH2Cl2 получают 1,4 г твердого вещества желтого цвета. Маслообразный остаток красного цвета (3,6 г) хроматографируют на силикагеле, при этом получают 4,72 г (47%) нитрила в виде твердого вещества желтого цвета, т.пл. 49,5-52 С. 1 Н ЯМР (CDCl3):8,89 (d, 1H, J=4,8 Гц), 7,62 (d, 1H, J=4,8 Гц). в) 2-Хлорпиримидин-4-карбоксамид: К 15 мл концентрированной H2SO4 при 15 С добавляют мелко измельченный 2-хлор-4-цианопиримидин (4,0 г, 28,7 ммоль). Полученную смесь нагревают до комнатной температуры и перемешивают в течение 5 ч. Полученный раствор светло-желтого цвета затем медленно добавляют к 80 г измельченного льда. Смесь фильтруют, промывают холодной водой (2 х 25 мл) и насыщенным водным раствором NaHCO3 (25 мл), при этом получают 490 мг амида в виде твердого вещества желтого цвета, т.пл. 151-152 С. Маточный раствор экстрагируют ЕtOАс (3 х 50 мл). Объединенные органические слои промывают водой (25 мл) и насыщенным водным раствором NaHCO3 (2 х 25 мл). После высушивания (Na2SO4) EtOAc удаляют в вакууме, при этом получают дополнительные 2,5 г амида в виде твердого вещества желтого цвета. Общий выход требуемого соединения составляет 2,99 г (66%). 1 Н ЯМР (CDCl3):8,88 (d, 1H, J=4,8 Гц), 8,07 (d, 1 Н, J=4,8 Гц), 7,65 (ушир.s, 1 Н), 5,93 (ушир.s, 1 Н). Пример 6. 6-[(4-Трифторметокси)фенил]пиридин-2-карбоксамид. а) 6-Бромпиридин-2-карбоксамид Реакцию 6-бромпиколиновой кислоты (фирмы Aldrich) с карбонилдиимидазолом в ДМФ, за которой следует добавление избытка ацетата аммония, проводят как описано выше, при этом получают амид в виде твердого вещества белого цвета, т.пл 130-135 С. 1 Н ЯМР (CDCl3):8,17 (d, 1H, J=7,5 Гц), 7,73 (t, 1H, J=7,8 Гц), 7,64 (d, 1H, J=7,5 Гц), 5,66 (ушир.s,1 Н). б) 6-[(4-Трифторметокси)фенил]пиридин-2-карбоксамид Смесь 6-бромпиридин-2-карбоксамида (110 мг, 0,547 ммоль), 4-(трифторметокси)фенилбороновой кислоты (фирмы Aldrich; 138 мг, 0,670 ммоль), карбоната натрия (185 мг) и Pd(PPh3)4 (32 мг, 5 мол.%) в 10 мл толуола и по 2,5 мл воды и EtOH кипятят с обратным холодильником в течение ночи. После охлаждения до комнатной температуры смесь распределяют между водой и ЕtOАс. Водный слой промывают дважды ЕtOАс и объединенные органические слои промывают водой (3 х), сушат (Na2SO4), фильтруют и концентрируют досуха. После экспресс-хроматографии (гексан/ацетон, 6:4) получают 122 мг (79%) требуемого соединения в виде твердого вещества белого цвета, т.пл. 133-135 С. 1 Н ЯМР (CDCl3):8,19 (d, J=7,5 Гц, 1 Н), 8,04 (d, J=9,0 Гц, 2 Н), 7,96 (t, J=7,8 Гц, 1 Н), 7,94 (ушир.s,1H), 7,87 (d, J=7,8 Гц, 2 Н), 7,35 (d, J=8,1 Гц, 2 Н), 5,76 (ушир.s, 1H). Пример 7. 3-Диметиламино-1-4-[4-(4-фторфенокси)фенил]пиримидин-2-ил-пропенон. Раствор 1-4-[4-(4-фторфенокси)фенил]пиримидин-2-илэтанона (0,36 г, 1,17 ммоль) и диметилацеталя N,N-диметилформамида (94%, 0,25 мл, 1,77 ммоль) в ДМФ (10 мл) кипятят с обратным холодильником в течение нескольких ч. Реакционную смесь охлаждают до комнатной температуры и распределяют между этилацетатом (50 мл) и водой (50 мл). Водный слой экстрагируют этилацетатом (2 х 50 мл). Объединенные органические слои промывают водой (3 х 50 мл), сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, при этом получают маслообразное вещество. Маслообразное вещество очищают колоночной хроматографией (от 100% этилацетата до этилацетат/метанол, 8:2), при этом получают 182 мг (выход 43%) конечного продукта в виде твердого вещества коричневато-желтого цвета, т. пл. 151-153 С. 1H ЯМР(CDCl3): 8,87(d, J=5,1 Гц, 1 Н), 8,16 (d, J=9,0 Гц, 2 Н), 7,98 (d, J=12,9 Гц, 1 Н), 7,67 (d, J=5,4 Гц, 1 Н), 7,11-7,05 (m, 6 Н), 6,43 (ушир.d, 1H), 3,19 (s, 3 Н), 3,00 (s, 3 Н). Пример 8. (2-Гидроксиэтил)амид 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты. К смеси 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоновой кислоты (1,03 г, 3,1 ммоль), этаноламина (0,31 мл, 5,08 ммоль) и гидрата 1-гидроксибензотриазола (0,53 г, 3,46 ммоль) в ДМФ (20 мл) в атмосфере азота при 0 С добавляют 4-метилморфолин (0,76 мл, 6,9 ммоль) и гидрохлорид 1-[3(диметиламино)пропил]-3-этилкарбодиимида (0,68 г, 3,48 ммоль). Смесь нагревают до комнатной температуры в течение ночи. Реакционную смесь разбавляют этилацетатом, промывают 3 раза водой, сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, при этом получают требуемый продукт в виде масла. 1 Н ЯМР (CDCl3):8,82 (d, J=5,7 Гц, 1 Н), 8,50 (ушир.s, 1 Н), 8,10 (d, J=8,7 Гц, 2 Н), 7,71 (d, J=5,1 Гц,1 Н), 7,08-7,03 (m, 6 Н), 3,88 (t, J=4,2 Гц, 2 Н), 3,70 (q, J=4,8 Гц, 2 Н), 3,25(ушир.s, 1H). Пример 9. Метиламид 6-(4-феноксифенил)пиридин-2-карбоновой кислоты. 6-Бромпиколиновую кислоту (фирмы Aldrich) конденсируют с метиламином с использованием карбонилдиимидазола (КДИ) в качестве конденсирующего агента, при этом получают метиламид 6-бромпиридин-2 карбоновой кислоты. Метиламид 6-бромпиридин-2-карбоновой кислоты подвергают конденсации Сузуки с 4- 21005770 феноксифенилбороновой кислотой в присутствии тетракис(трифенилфосфин)палладия в качестве катализатора,при этом получают метиламид 6-(4-феноксифенил)пиридин-2-карбоновой кислоты в виде твердого вещества. 1 Н ЯМР (CDCl3):8,12 (d, J=7,8 Гц, 1 Н), 7,98 (d, J=8,7 Гц, 2 Н), 7,90 (t, J=7,8 Гц, 1 Н), 7,81 (d, J=7,8 Гц, 1 Н), 7,38 (t, J=8,4 Гц, 2 Н), 7,18-7,06 (m, 5H), 3,08 (d, J=5,4 Гц, 3 Н). Пример 10. 6-[4-(4-Фторфенокси)фенил]пиридин-2-карбоксамид. а) 2-Метил-6-(4-бромфенил)пиридин К смеси 4-бромфенилбороновой кислоты (3,14 г, 15,6 ммоль), 2-бром-6-метилпиридина (1,7 мл, 14,9 ммоль), твердого карбоната натрия (5,1 г, 31,9 ммоль) в толуоле (60 мл), воде (15 мл) и этаноле (15 мл) добавляют тетракис(трифенилфосфин)палладия (0) (890 мг, 0,77 ммоль). Смесь кипятят с обратным холодильником (100-110 С) в течение ночи. Реакционную смесь охлаждают до комнатной температуры,затем распределяют между этилацетатом и водой. Водный слой еще раз экстрагируют этилацетатом. Объединенные органические слои сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, при этом получают неочищенный продукт. После очистки экспресс-хроматографией (силикагель, 4% ЕtOАс/гексан) получают 2,5 г (87%) продукта в виде твердого вещества белого цвета. 1 Н ЯМР (CDCl3):7,88 (d, J=9,0 Гц, 2 Н), 7,67-7,56 (m, 3 Н), 7,48 (d, J=8,1 Гц, 1 Н), 7,11 (d, J=8,1 Гц,1 Н), 2,61 (s, 3 Н). б) 2-Метил-6-[4-(4-фторфенокси)фенил]пиридин: Смесь 2-метил-6-(4-бромфенил)пиридина (3,25 г, 13 ммоль), 4-фторфенола (2,5 г, 22 ммоль), карбоната цезия (11,2 г, 34 ммоль) и порошкообразной меди (4,5 г) в ДМФ (50 мл) кипятят с обратным холодильником в течение ночи. Реакционную смесь охлаждают до комнатной температуры, фильтруют и распределяют между этилацетатом и водой. Водный слой экстрагируют 2 раза этилацетатом. Объединенные органические слои промывают 3 раза водой, сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, при этом получают твердое вещество, которое подвергают экспрессхроматографии (силикагель, 4% ЕЮАс/гексан), при этом получают 1,8 г (50%) продукта в виде твердого вещества белого цвета. 1 Н ЯМР (CDCl3):7,94 (d, J=9,0 Гц, 2H), 7,61 (t, J=7,6 Гц, 1 Н), 7,46 (d, J=8,1 Гц, 1 Н), 7,08-7,01 (m,7H), 2,61 (s, 3 Н). в) 6-[4-(4-Фторфенокси)фенил]пиридин-2-карбоксамид Смесь 2-метил-6-[4-(4-фторфенокси)фенил]пиридина (1,8 г, 6,45 ммоль) и диоксида селена (3,6 г,32,4 ммоль) в пиридине (30 мл) кипятят с обратным холодильником в течение ночи. Охлажденную до комнатной температуры реакционную смесь фильтруют через целит. Фильтрат распределяют между этилацетатом и водным раствором соляной кислоты (2 н.). Водный слой экстрагируют еще 2 раза этилацетатом. Объединенные органические слои промывают водным раствором соляной кислоты (2 н.), сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, при этом получают 1,8 г(90%) неочищенной кислоты в виде твердого вещества желтого цвета. Неочищенную кислоту (1,2 г, 3,88 ммоль) растворяют в ДМФ (50 мл) и добавляют карбонилдиимидазол (1,3 г, 8,0 ммоль). Полученный раствор перемешивают при комнатной температуре в течение 1 ч. Затем добавляют твердый ацетат аммония (3,1 г, 39 ммоль) и смесь перемешивают в течение ночи. Реакционную смесь распределяют между водой и этилацетатом. Водный слой экстрагируют дважды этилацетатом. Объединенные органические слои промывают 3 раза водой, сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, при этом получают неочищенный продукт. После очистки экспресс-хроматографией (колонка с силикагелем, гексан/ацетон, 65:35) получают 509 мг (42%) требуемого соединения, Т.пл. 150-152 С. 1 Н ЯМР (ДMCO-d6):8,32(d, J=9,0 Гц, 2 Н), 8,31 (ушир.s, 1H), 8,12 (d, J=8,1 Гц, 1 Н), 8,03 (dd, J=8,1,7,2 Гц, 1 Н), 7,94 (d, J=7,2 Гц, 1 Н), 7,69 (ушир.s, 1 Н), 7,27 (t, J=9,0 Гц, 2 Н), 7,18-7,13 (m, 2 Н), 7,07 (d, J=9,0 Гц, 2 Н). Аналогичным способом получают следующие соединения: 6-[4-(2,4-дифторфенокси)фенил]пиридин-2-карбоксамид,6-[4-(4-хлор-2-фторфенокси)фенил]пиридин-2-карбоксамид,6-[4-(4-фторфенокси)-3-фторфенил]пиридин-2-карбоксамид, и 6-[4-(4-трифторметилфенокси)фенил]пиридин-2-карбоксамид. Пример 11. 6-(4-Феноксифенил)пиридин-2-карбоксамид. 6-(4-Феноксифенил)пиридин-2-карбоксамид получают в соответствии со способом, описанным в примере 10 для его 4-фтор-аналога, но вместо 4-бромфенилбороновой кислоты используют 4 феноксифенилбороновую кислоту (фирмы Aldrich). а) 2-Метил-6-(4-феноксифенил)пиридин: 1 Н ЯМР (CDCl3):7,95 (d, J=9,0 Гц, 2 Н), 7,60 (t, J=7,5 Гц, 1 Н), 7,46 (d, J=7,5 Гц, 1 Н), 7,34 (t, J=7,8 Гц, 2 Н), 7,13-7,02 (m, 6H), 2,61 (s, 3 Н). б) 6-(4-Феноксифенил)пиридин-2-карбоновая кислота: 1 Н ЯМР (ДМСО-d6):13,1 (ушир.в, 1 Н), 8,21 (d, J=8,4 Гц, 2 Н), 8,16 (d, J=7,8 Гц, 1 Н), 8,04 (t, J=7,2 Гц, 1 Н), 7,96 (d, J=7,2 Гц, 1 Н), 7,44 (t, J=7,6 Гц, 2 Н), 7,19 (t, J=7,4 Гц, 1 Н), 7,11 (dd, J=8,4, 7,5 Гц, 4 Н). в) 6-(4-Феноксифенил)пиридин-2-карбоксамид: Н ЯМР (ДMCO-d6):8,33 (d, J=8,7 Гц, 2 Н), 8,31 (ушир.s, 1 Н), 8,12 (d, J=7,8 Гц, 1 Н), 8,03 (t, J=7,6 Гц, 1 Н), 7,94 (d, J=7,8 Гц, 1 Н), 7,69 (ушир.s, 1 Н), 7,43 (dd, J=8,7, 7,5 Гц, 2 Н), 7,19 (t, J=7,8 Гц, 1 Н), 7,09 (d,J=8,7 Гц, 4 Н), т.пл. 178-180 С, выход составляет 45% в расчете на исходные материалы (3 стадии). Пример 12. 2-[4-(4-Фторфенокси)фенил]пиримидин-4-карбоксамид. а) 4-(4-Фторфенокси)бензонитрил Смесь 4-фторфенола (5,1 г, 45,5 ммоль), 4-фторбензонитрила (4,58 г, 37,8 ммоль) и карбоната калия(12 г, 86,8 ммоль) в ДМФ (150 мл) кипятят с обратным холодильником в течение ночи. Реакционную смесь охлаждают до комнатной температуры и распределяют между этилацетатом и водой. Водный слой экстрагируют дважды этилацетатом. Объединенные органические слои промывают 3 раза водой, сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, при этом получают 7,5 гChem., 41:4408-4420 (1998). б) 4-(4-Фторфенокси)бензамидинацетат 4-(4-Фторфенокси)бензонитрил (4,7 г, 22,4 ммоль) растворяют в этаноле. Раствор охлаждают до 0 С и через раствор прокачивают газообразный HCl в течение 20 мин. Реакционную смесь герметично закрывают и перемешивают при комнатной температуре в течение ночи. Раствор упаривают при пониженном давлении и образующийся твердый остаток растворяют в этаноле, обрабатывают твердым ацетатом аммония (6,0 г, 75,5 моль). После перемешивания в течение ночи, чистый амидин выделяют фильтрованием. Дополнительную порцию выделяют из фильтрата. Твердое вещество, которое получают после концентрирования фильтрата досуха, растирают с гексаном (4 раза) и дважды перекристаллизовывают из ЕtOН. Общая масса полученного амидина составляет 2,92 г (выход 45%). 1 Н ЯМР (ДМСО-d6):7,85 (d, J=8,0 Гц, 2 Н), 7,31 (t, J=8,7 Гц, 2 Н), 7,21-7,17 (m, 2 Н), 7,11 (d, J=8,0 Гц, 2 Н), 1,77 (s, 3 Н). в) 2-[4-(4-Фторфенокси)фенил]-4-метилпиримидин 1 М раствор трет-бутоксида калия в ТГФ (11 мл, 11 ммоль) добавляют с помощью шприца в раствор ацетата 4-(4-фторфенокси)бензамидина (2,92 г, 10,2 ммоль) в ДМФ. Полученную смесь нагревают при 100 С в течение 2 ч. С помощью шприца добавляют диметилацеталь ацетилацетальдегида (2 мл, 13,6 ммоль), реакционную смесь инкубируют при 100-110 С в течение ночи, после чего по данным ТСХ реакция завершена. Реакционную смесь охлаждают до комнатной температуры и распределяют между водой и EtOAc. Водный слой экстрагируют EtOAc и объединенные органические слои промывают водой (3 раза), сушат над MgSO4, фильтруют и упаривают при пониженном давлении, при этом получают требуемый продукт в виде масла желтого цвета. 1 Н ЯМР (CDCl3):8,60 (d, J=5,1 Гц, 1 Н), 8,40 (d, J=9,0 Гц, 2 Н), 7,05-7,00 (m, 7H), 2,57 (s, 3H). Полученное вещество используют без дополнительной очистки. г) 2-[4-(4-Фторфенокси)фенил]пиримидин-4-карбоновая кислота: Смесь 2-[4-(4-фторфенокси)фенил]-4-метилпиримидина (масло желтого цвета, полученное на предыдущей стадии), диоксида селена (3,0 г, 27 ммоль) и пиридина (30 мл) кипятят с обратным холодильником в течение ночи. Реакционную смесь охлаждают до комнатной температуры и фильтруют для удаления металлического селена. Фильтрат упаривают при пониженном давлении и остаток обрабатывают 2 н. водным раствором HCl. Полученное твердое вещество растирают с гексаном (3 х) и сушат в вакууме, при этом получают 2,72 г (86%) кислоты. 1 Н ЯМР (ДМСО-d6):13,8 (ушир.s, 1H), 9,10 (d, J=5,0 Гц, 1 Н), 8,45 (d, J=9,0 Гц, 2 Н), 7,86 (d, J=5,0 Гц, 1 Н), 7,30 (t, J=9,0 Гц, 2 Н), 7,22-7,17 (m, 2 Н), 7,11 (d, J=9,0 Гц, 2 Н). д) 2-[4-(4-Фторфенокси)фенил]пиримидин-4-карбоксамид: К раствору 2-[4-(4-фторфенокси)фенил]пиримидин-4-карбоновой кислоты (2,00 г, 6,45 ммоль) в ДМФ добавляют карбонилдиимидазол (2,00 г, 12,3 ммоль). После перемешивания в течение 1 ч при комнатной температуре добавляют твердый ацетат аммония (5,00 г, 62,9 ммоль). После перемешивания при комнатной температуре в течение ночи реакционную смесь распределяют между водой и EtOAc. Водный слой экстрагируют этилацетатом и объединенные органические слои промывают водой (3 раза), сушат(Na2SO4), фильтруют и упаривают при пониженном давлении, при этом получают неочищенный продукт в виде твердого вещества. После колоночной хроматографии (силикагель) получают 1,1 г (55%) требуемого продукта в виде твердого вещества желто-коричневого цвета (чистота по данным ВЭЖХ составляет 99,80%), т.пл. 195-197 С. 1 Н ЯМР (CDCl3):9,01 (d, J=4,8 Гц, 1 Н), 8,43 (d, J=8,7 Гц, 2 Н), 7,95 (d, J=4,8 Гц, 1 Н), 7,89 (ушир.s,1 Н), 7,08-7,04 (m, 6H), 5,72 (ушир.s, 1 Н). Следующее соединение получают аналогичным способом: 2-[4-(4-фторфенокси)-3 фторфенил]пиримидин-4-карбоксамид. Пример 13. 3,5-Диамино-6-(4-феноксифенил)пиразин-2-карбоксамид. К смеси 4-феноксифенилбороновой кислоты (0,22 г, 1,02 ммоль), 3,5-диамино-6-хлорпиразин-2 карбоксамида (0,176 г, 0,919 ммоль), карбоната натрия (0,33 г, 2,06 ммоль) в толуоле (14 мл), этанола (3,5- 23005770 мл) и воды (3,5 мл) добавляют тетракис(трифенилфосфин)палладия (60 мг). Смесь кипятят с обратным холодильником в течение ночи. Реакцию охлаждают до комнатной температуры и распределяют между водой и этилацетатом. Водный слой экстрагируют еще раз этилацетатом. Объединенные органические слои промывают водой, сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, при этом получают неочищенный продукт в виде твердого вещества. После экспрессхроматографии (силикагель; от этилацетат/дихлорметан, 6:4 до этилацетат/дихлорметан, 7:3) и последующей перекристаллизации из хлороформа получают 81 мг (27%) требуемого соединения в виде твердого вещества белого цвета. 1 Н ЯМР (CDCl3):7,58 (d, J=9,0 Гц, 2 Н), 7,37 (t, J=7,8 Гц, 2 Н), 7,38 (ушир.s, 1H), 7,15 (t, J=8,4 Гц,1 Н), 7,10-7,05 (m, 4 Н), 5,26 (ушир.в, 1 Н), 4,97 (s, 4H). Пример 14. 6-(4-феноксифенил)пиразин-2-карбоксамид. а) 2-Хлор-6-(4-феноксифенил)пиразин Смесь 4-феноксифенилбороновой кислоты (0,54 г, 2,52 ммоль), 2,6-дихлорпиразина (1,28 г, 7,73 ммоль), карбоната натрия (1,15 г, 7,18 ммоль), тетракис(трифенилфосфин)палладия (0,15 г, 0,13 ммоль) в толуоле (50 мл), этанола (12 мл) и воды (12 мл) кипятят с обратным холодильником в течение ночи. Реакционную смесь охлаждают до комнатной температуры, затем распределяют между водой и этилацетатом. Водный слой экстрагируют еще 1 раз этилацетатом. Объединенные органические слои промывают водой, сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, при этом получают неочищенный продукт в виде твердого вещества. После очистки колоночной хроматографией получают 0,49 г (69%) 2-хлор-6-(4-феноксифенил)пиразина в виде твердого вещества. 1 Н ЯМР (CDCl3):8,87 (s, 1 Н), 8,47 (s, 1 Н), 7,99 (d, J=9,0 Гц, 2 Н), 7,38 (t, J=8,1 Гц, 2 Н), 7,15 (t, J=7,2 Гц, 1 Н), 7,12-7,06 (m, 4H). б) 6-(4-Феноксифенил)пиразин-2-карбоксамид Смесь 2-хлор-6-(4-феноксифенил)пиразина (0,49 г, 1,73 ммоль), цианида калия (98%, 0,30 г, 4,51 ммоль) и тетракис(трифенилфосфин)палладия (0,10 г, 0,086 ммоль) в ДМФ кипятят с обратным холодильником в течение ночи. После описанных выше стадий и колоночной хроматографии получают 35 мг(7%) 6-(4-феноксифенил)пиразин-2-карбоксамида в виде твердого вещества. 1 Н ЯМР (CDCl3):9,30 (s, 1 Н), 9,16 (s, 1 Н), 8,01 (d, J=8,7 Гц, 2 Н), 7,75 (ушир.s, 1 Н), 7,40 (t, J=8,4 Гц,2 Н), 7,21-7,08 (m, 5 Н), 5,84 (ушир.s, 1 Н). Пример 15. 2-[4-(4-Нитрофенокси)фенил]-4-метил-[1,3,5]триазин. а) N-Диметиламинометилен-4-(4-нитрофенокси)бензамид Раствор 4-(4-нитрофенокси)бензонитрила (0,90 г, 3,75 ммоль), гидроксида калия (2,0 г, 30 ммоль) в воде (10 мл), 30% водный раствор пероксида водорода (4 мл, 39 ммоль) и этанол (50 мл) кипятят с обратным холодильником в течение нескольких часов. Реакционную смесь охлаждают до комнатной температуры, затем распределяют между водой и этилацетатом. Отделенный органический слой несколько раз промывают водой, сушат над MgSO4, фильтруют и упаривают при пониженном давлении, при этом получают промежуточный амид в виде твердого вещества. Амид и диметилацеталь N,Nдиметилформамида в ДМФ (20 мл) нагревают при 100 - 120 С в течение 2 ч. После охлаждения до комнатной темпратуры добавляют воду и фильтрованием выделяют 0,93 г (79%) амида в виде твердого вещества желтого цвета. 1 Н ЯМР (CDCl3):8,66 (s, 1 Н), 8,34 (d, J=8,7 Гц, 2 Н), 8,22 (d, J=9,0 Гц, 2 Н), 7,10 (d, J=9,0 Гц, 2 Н),7,06 (d, J=9,0 Гц, 2 Н), 3,23 (s, 3H), 3,22 (s, 3 Н). б) 2-[4-(4-нитрофенокси)фенил]-4-метил-[1,3,5]триазин: Смесь N-диметиламинометилен-4-(4-нитрофенокси)бензамида (0,93 г, 2,97 ммоль), гидрохлорида ацетамидина (0,32 г, 3,2 ммоль) и трет-бутоксида калия (95%, 0,33 г, 2,79 ммоль) в диоксане кипятят с обратным холодильником в течение ночи. Реакционную смеси охлаждают до комнатной температуры,затем распределяют между водой и этилацетатом. Водный слой экстрагируют еще раз этилацетатом. Объединенные органические слои дважды промывают водой, сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, при этом получают неочищенный продукт. После очистки с помощью колоночной хроматографии получают 24 мг (3%) требуемого соединения в виде твердого вещества светло-желтого цвета, т.пл. 148-149 С. 1 Н ЯМР (CDCl3):9,08 (s, 1 Н), 8,59 (d, J=8,1 Гц, 2 Н), 8,25 (d, J=8,1 Гц, 2 Н), 7,19 (d, J=9,3 Гц, 2 Н),7,11 (d, J=8,4 Гц, 2 Н), 2,74 (s, 3 Н). а) N-пиперидинилэтиламид 6-бромпиридин-2-карбоновой кислоты (2) К раствору 6-бромпиколиновой кислоты (5,0 г, 24,8 ммоль) (1) и 1-(2-аминоэтил)пиперидина (3,3 г,26,0 ммоль) в ДМФ добавляют N-гидроксибензотриазол (HOBt) (3,4 г, 24,8 ммоль) и 5-(3,4-диметил-1 триазенил)-1 Н-имидазол-4-карбоксамид (DIC) (3,1 г, 24,8 ммоль). Реакционную смесь перемешивают в течение 24 ч при комнатной температуре. Реакционную смесь разбавляют дихлорметаном, и затем добавляют воду. Разделяют фазы, и водную фазу дважды экстрагируют дихлорметаном. Объединенные органические фазы сушат над сульфатом натрия. Раствор фильтруют и концентрируют, при этом получают продукт в виде твердого вещества бледно-желтого цвета. Очистку соединения 2 проводят с помощью хроматографии на силикагеле. б) N-пиперидинилэтиламид 6-[4-(фторфенокси)фенил] пиридинкарбоновой кислоты (3): 4-(4 фторфенокси)фенилбороновую кислоту (557 мг, 2,4 ммоль) добавляют к раствору соединения 2 (624 мг,2,0 ммоль) в 1,2-диметоксиэтане (DME) (6 мл), затем добавляют воду (2 мл) и карбонат калия (746 мг, 5,4 ммоль). Pd(PPh3)4 (92 мг, 0,08 ммоль) добавляют к смеси, и реакционную смесь нагревают при 85 С в течение 16 ч в атмосфере аргона. Реакционную смесь охлаждают до комнатной температуры, и разделяют фазы. Водную фазу трижды экстрагируют этилацетатом, и объединенные органические фазы сушат над сульфатом натрия. Раствор фильтруют, концентрируют, и затем фильтруют через слой флорисила,при этом получают неочищенное соединение 3. Очистку соединения 3 проводят с помощью хроматографии на силикагеле. 1 Н ЯМР (400 МГц, CDCl3):1,48 (ушир.s, 2 Н), 1,61-1,67 (m, 4 Н), 2,48 (ушир.s, 2 Н), 2,59 (t, 2 Н, J=6,3 Гц), 7,05-7,07 (m, 5 Н), 7,64-7,71 (m, 1 Н), 7,81-7,91 (m, 5 Н), 8,80 (ушир.s, 1H). Пример 17. 6-(4-трет-бутилфенил)пиридин-2-карбоксамид (8 а) 6-(4-н-бутилфенил)пиридин-2-карбоксамид (8b) 6-(4-изопропилфенил)пиридин-2-карбоксамид (8 с) 6-(4-тиометилфенил)пиридин-2-карбоксамид (8d) 6-(4-этоксифенил)пиридин-2-карбоксамид (8 е) 6-(4-метоксифенил)пиридин-2-карбоксамид (8f)f R=OMe а) Соединение 6: В сосуд для твердофазной реакции, содержащий амидную полистирольную смолу Rink, содержащую 9 флуоренилметоксикарбонильную (FMOC) защитную группу (PS-rink-NH-FMOC смола) (4) (4,45 г, 4,14 ммоль) добавляют 20% пиперидин в ДМФ, и реакционную смесь встряхивают в течение 1,5 ч при комнатной температуре. Смолу промывают (дважды ДМФ, дважды дихлорметаном, ДМФ) и затем снова обрабатывают 20% пипе- 25005770 ридином в ДМФ. Реакционную смесь встряхивают в течение еще 1 ч, и повторяют серию промывок в той же последовательности. К смоле добавляют ДМФ, затем N-гидроксибензотриазол (HOBt) (3,4 г, 24,8 ммоль), 6 бромпиколиновую кислоту (1, 5,0 г, 24,8 ммоль), и раствор 5-(3,4-диметил-1-триазенил)-1 Н-имидазол-4 карбоксамида (DIC) (3,1 г, 24,8 ммоль) в ДМФ. Смесь встряхивают в течение 24 ч при комнатной температуре и затем фильтруют в вакууме. Смолу промывают (дважды ДМФ, дважды дихлорметаном, ДМФ) и сушат. Соединение 6 распределяют в отдельные сосуды. б) Соединения 7a-7f: 1,2-диметоксиэтан (DME) (2,5 мл) добавляют в отдельные реакционные сосуды, содержащие соединение 6 (0,25 ммоль), затем добавляют фенилбороновую кислоту (1,5 ммоль). К этой смеси добавляют воду (1,0 мл), карбонат калия (3,8 ммоль) и Pd(PPh3)4 (0,043 ммоль). Реакционные смеси нагревают при 85 С в течение 16 ч. После охлаждения до комнатной температуры реакционные смеси фильтруют в вакууме и смолу промывают (дважды смесью DME-вода, 1:1, водой, дважды смесью DME-вода, 1:1, дважды DME, дважды водой, дважды ТГФ, дважды дихлорметаном), при этом получают соедиения 7a-7f. в) Соединения 8a-8f: Соединения 7a-7f встряхивают в присутствии смеси трифторуксусная кислота(ТФУ)/дихлорметан, 1:1 в течение 1,5 ч. Реакционные смеси фильтруют, смолы промывают дихлорметаном, и растворитель упаривают. Очистку соединений 8a-8f проводят фильтрованием через слой флорисила с последующей хроматографией на силикагеле. 6-(4-трет-бутилфенил)пиридин-2-карбоксамид (8 а): 1 Н ЯМР (400 МГц, CDCl3):1,38 (s, 9 Н), 5,65 (ушир.s, 1 Н), 7,55 (d, 2H, J=8,9 Гц), 7,85-7,99 (m, 4 Н), 8,05- 26005770 Выходы вышеуказанных реакций являются не оптимальными. Масс-спектры для всех соединений получают с использованием ЖХ-МС. Продукты реакции исследуют с помощью ТСХ, или/и ЖХ-МС или/и 1 Н ЯМР. а) Соединение 10: Раствор 10 г (100 ммоль) 2,4-пентадиона (9) и 11,2 г (120 ммоль) анилина в 100 мл толуола и каталитическое количество моногидрата п-толуолсульфокислоты кипятят в круглодонной колбе, оснащенной азеотропным аппаратом и обратным холодильником, в течение 12 ч. Раствор упаривают досуха и продукт используют без очистки. 1 Н ЯМР (CDCl3):7,35 (t, 2H, J=5,69 Гц), 7,19 (t, 1H, J=6,4 Гц), 7,10 (d, 2H, J=7,5 Гц), 5,19 (s, 1H),2,10 (s, 3 Н), 1,99 (s, 3 Н). б) 2-метил-6-[4-(4-фторфенокси)фенил]-4-пиридинон (12) 31 мл 1,6 М н-BuLi (50 ммоль) добавляют по каплям к раствору 7,21 г (51 ммоль) 2,2,6,6 тетраметилпиперидина в 80 мл ТГФ при -78 С в инертной атмосфере. Затем реакционную смесь перемешивают в течение 30 мин. К полученному раствору по каплям добавляют раствор 3 г (17 ммоль) соединения 10 в 10 мл ТГФ при -78 С. Затем реакционную смесь перемешивают в течение 30 мин. К полученному раствору темно-красного цвета по каплям добавляют раствор 2,7 г (17 ммоль) соединения 11 в 13 мл ТГФ при -78 С. Затем смесь медленно нагревают до -50 С и перемешивают при этой температуре в течение 1 ч. Реакционную смесь выливают в охлажденный насыщенный водный раствор NH4Cl и дважды экстрагируют этилацетатом. Органическую фазу промывают насыщенным солевым раствором, сушат над сульфатом магния и фильтруют. Фильтрат упаривают досуха. 2-метил-6-[4-(4 фторфенокси)фенил]-4-пиридинон используют без очистки. 1 Н ЯМР (CDCl3):7,54 (d, 2H, J=3,8 Гц), 7,31 (m, 2H), 6,90-7,10 (m, 4H), 5,23 (s, 1H), 5,08 (s, 1H),2,03 (s, 3 Н). в) 4-хлор-2-метил-6-[4-(4-фторфенокси)фенил]пиридин (13): В колбу, помещенную в маслянную баню, содержащую 20 мл POCl3, при 120 С осторожно добавляют раствор 5 г (17 ммоль) неочищенного соединения 12 и 2,6 мл 1,8-диазабицикло[5,4,0]ундец-7-ена (DBU) (7 ммоль) в 20 мл хлористого метилена. Затем реакционную смесь кипятят с обратным холодильником в течение 1 ч. Полученную смесь концентрируют досуха и растворяют в этилацетате (ЕtOАс). К раствору осторожно добавляют насыщенный водный раствор NaHCO3 до достижения рН 5-6. Отделяют органическую фазу, а водную фазу экстрагируют тем же объемом ЕtOАс. Объединенные органические фазы промывают солевым раствором и сушат над сульфатом магния, фильтруют и концентрируют досуха. Остаток очищают с помощью экспрессхроматографии (силикагель, 5% ЕЮАс/гексан), при этом получают 1,8 г соедиения 13 и 850 мг смеси соединения 13 и непрореагировавшего соединения 11. 1 Н ЯМР (CDCl3):7,93 (d, 2 Н, J=6,7 Гц), 7,48 (d, 1H, J=1,36 Гц), 7,09 (d, 1H, J=1,5 Гц), 7,00 (m, 6H),2,59 (s, 3 Н). МС: 314,1. г) 2-Метил-4-диметиламино-6-[4-(4-фторфенокси)фенил]пиридин (14): Методика 1: Смесь 800 мг (2,5 ммоль) соединения 13 и 101 мг 60% NaH (2,5 ммоль) в 5 мл N,Nдиметилэтилендиамина нагревают в запаянной трубке при 120 С в течение 6 ч. К охлажденной реакционной смеси осторожно добавляют метанол для гашения NaH. Полученную смесь концентрируют досуха, и остаток очищают экспресс-хроматографией (силикагель, 10% MeOH/CH2Cl2 +1% NH4OH), при этом получают 100 мг соединения 14. Методика 2: В трехгорлой круглодонной колбе при -78 С сжижают диметиламин и затем переносят в закрытый сосуд, содержащий соединение 13 при -78 С. Закрытый сосуд медленно нагревают до комнатной температуры и перемешивают в течение 48 ч, при этом наблюдается 10%-ное превращение. 1 Н ЯМР (CDCl3):7,89 (d, 2H, J=6,7 Гц), 7,00 (m, 6H), 6,69 (d, 1 Н, J=2,3 Гц), 6,35 (d, 1H, J=2,3 Гц),3,03 (s, 6H), 2,51 (s, 3 Н). МС: 323,2. д) 2-метил-4-метокси-6-[4-(4-фторфенокси)фенил]пиримидин (15): Закрытую трубку, содержащую 1,8 г (4,8 ммоль) соединения 13 в 10 мл 25 мас.% NaOMe в метаноле, нагревают при 85 С в течение 4 ч. Охлажденную реакционную смесь концентрируют досуха и растворяют в этилацетате. Смесь промывают насыщенным водным раствором NH4Cl и затем солевым раствором. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют досуха, при этом получают 1,5 г чистого соединения 15. Н ЯМР (CDCl3):7,92 (d, 2H, J=6,8 Гц), 7,00 (m, 7H), 6,62 (d, 1H, J=2,1 Гц), 3,88 (s, 3 Н), 2,57 (s,3 Н). МС: 310,2. е) 4-метокси-6-[4-(4-фторфенокси)фенил]пиридин-2-карбоновая кислота (16): К раствору 1,5 г (4,8 ммоль) соединения 15 в 36 мл пиридина добавляют 2,1 г SeO2 (19 ммоль) и полученный раствор кипятят с обратным холодильником в течение 3 сут. Охлажденную реакционную смесь концентрируют досуха и разбавляют метанолом, фильтруют и концентрируют, при этом наблюдается 100%-ное превращение. 1 Н ЯМР (CDCl3):7,92 (d, 2H, J=8,8 Гц), 7,69 (s, 1 Н), 7,38 (m, 3 Н), 7,07 (m, 4 Н), 3,97 (s, 3 Н). МС: 320,9. ж) Метиловый эфир 4-метокси-6-[4-(4-фторфенокси)фенил]пиридин-2-карбоновой кислоты (17) К раствору неочищенного соединения 16 в метаноле медленно и осторожно добавляют 0,701 мл (9,6 ммоль) тионилхлорида. Затем полученный раствор кипятят с обратным холодильником в течение 12 ч. Охлажденную реакционную смесь фильтруют и концентрируют досуха. Остаток фильтруют через слой силикагеля и элюируют 10% Et3N в EtOAc. Фильтрат концентрируют досуха, при этом получают 1,6 г чистого соединения 17. 1 Н ЯМР (CDCl3):7,98 (d, 2H, J=8,7 Гц), 7,61 (d, 1 Н, J=2,2 Гц), 7,33 (d, 1 Н, J=2,2 Гц), 7,00 (m, 6 Н),4,05 (s, 3 Н), 4,00 (s,3H). MC: 354,1. з) 4-Метокси-6-[4-(4-фторфенокси)фенил]пиридин-2-карбоксамид(18): 140 г (0,39 ммоль) соединения 17 добавляют в раствор 10 мл 2 М NH3 в метаноле и полученный раствор перемешивают в течение 12 ч. Смесь концентрируют досуха и полученное твердое вещество перекристаллизовывают из метанола, при этом получают 67 мг чистого 4-метокси-6-[4-(4 фторфенокси)фенил]пиридин-2-карбоксамида (18). 1 Н ЯМР (ДMCO-d6):8,31 (d, 2 Н, J=8,9 Гц), 8,27 (ушир.s, 1 Н, N-H), 7,70 (ушир.s, 1H, N-H), 7,61 (d,1H, J=2,3 Гц), 7,47 (d, 1H, J=2,3 Гц), 7,26 (t, 2H, J=8,7 Гц), 7,13 (m, 2H), 7,03 (d, 2H, J=9,0 Гц), 3,94 (s, 3 Н). МС: 339,2. и) Диметиламиноэтиламид 4-метокси-6-[4-(4-фторфенокси)фенил]пиридин-2-карбоновой кислоты(19): Избыток N,N-диметилэтилендиамина добавляют к раствору 200 мг (0,56 ммоль) соединения 17 в 10 мл метанола, и полученный раствор перемешивают при комнатной температуре в течение 4 сут, за этот период происходит 100% превращение. Реакционную смесь концентрируют досуха. К остатку добавляютHCl в Et2O, и твердое вещество перекристаллизовывают, при этом получают чистое соединение 19. 1 Н ЯМР (CDCl3):8,97 (ушир.s, 1 Н, N-H), 8,10 (d, 2H, J=8,8 Гц), 7,61 (d, 1H, J=2,2 Гц), 7,32 (d, 1H,J=2,2 Гц), 7,05 (пл, 6 Н), 4,00 (m, 1 Н), 3,96 (s, 3 Н), 3,78 (m, 1 Н), 3,63 (m, 1 Н), 3,45 (s, 3 Н), 3,27 (ушир.s,1 Н), 2,85 (s, 3 Н). МС: 410,2. Пример 19. Активность 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоксамида в качестве противосудорожного средства. Способность 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоксамида блокировать максимальный эпилептический припадок, индуцированный электрошоком (МПЭ) определяют, как описано выше. 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоксамид вводят мышам перорально за 30 мин до эксперимента. Соединение оказывает защитное действие против МПЭ, причем величина ED50 (доза, при которой наблюдается защитное действие у 50% животных), составляет 1,6 мг/кг. Следующие соединения, приведенные в табл. 1, исследовали аналогичным методом после перорального (п.о.), атакже внутривенного (в.в.) введения. Соединения вводят в.в. за 15 мин до эксперимента. Таблица 1. Определение активности противосудорожных препаратов после перорального и внутривенного введения мышам Пример 20. Активность 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоксамида в качестве блокатора натриевых каналов. 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоксамид исследуют путем электрофизиологического анализа (метод 1) и анализа связывания, описанных выше, и получают дозо-зависимое ингибирование управляемых потенциалом токов ионов натрия, регистрируемое на клетках НЕK-293, стабильно экспрессирующих изоформу натриевых каналов rВllА. Блокирующий эффект, оказываемый указанным соединением на токи Na+, является высоко чувствительным к потенциалу покоя, что свидетельствует о связыва- 29005770 нии 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоксамида с потенциал-чувствительными Na+ каналами в состоянии инактивации и о низкой активности по отношению к Nа+-каналам в состоянии покоя(Ragsdale и соавт., Mol. Pharmacol., 40:756-765 (1991); Kuo и Bean, Mol. Pharmacol., 46:716-725 (1994. Кажущаяся константа диссоциации Ki этого соединения в качестве антагониста для инактивированнных натриевых каналов составляет 0,49 мкМ. Значения Ki (концентрация соединения, при которой наблюдается ингибирование, равное половине максимальной величины) для 4-[4-(4-фторфенокси)фенил]пиримидин-2-карбоксамида и других исследованных соединений представлены в табл. 2. Таблица 2. Исследование тестируемых соединений в качестве блокаторов Na+ каналов с помощью электрофизиологического анализа 1 in vitro.
МПК / Метки
МПК: A61P 25/08, C07D 213/81, A61K 31/505
Метки: нарушения, каналов, лечения,профилактики, профилактики, различных, пиримидины, снижения, интенсивности, арилзамещенные, животного, натриевых, варианты, пиразины, лечения, композиция, блокадой, судороги, млекопитающего, приступов, триазины, способ, пиридины, связанного, нарушений, фармацевтическая, состояний
Код ссылки
<a href="https://eas.patents.su/30-5770-arilzameshhennye-piridiny-pirimidiny-piraziny-ili-triaziny-varianty-farmacevticheskaya-kompoziciya-sposob-lecheniya-narusheniya-u-mlekopitayushhego-svyazannogo-s-blokadojj-natrievy.html" rel="bookmark" title="База патентов Евразийского Союза">Арилзамещенные пиридины, пиримидины, пиразины или триазины (варианты), фармацевтическая композиция, способ лечения нарушения у млекопитающего, связанного с блокадой натриевых каналов, способ лечения,профилактики или снижения интенсивности различных нарушений или состояний, способ снижения интенсивности или профилактики приступов судороги у животного</a>
Предыдущий патент: Мутанты интерлейкина-18, их продуцирование и применение
Следующий патент: Легкий теплоизоляционный формованный продукт с высокой механической прочностью и способ его получения
Случайный патент: Гербицидный состав