Противовирусные композиции
Формула / Реферат
1. Твердая дисперсия, обладающая антивирусной активностью, содержащая
(a) соединение формулы
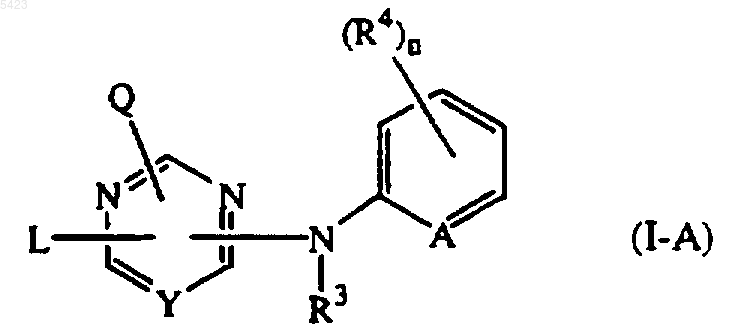
его N-оксид, фармацевтически приемлемую соль или стереохимически изомерную форму, где
Y представляет собой CR5 или N;
A представляет собой CH, CR4 или N;
n равно 0, 1, 2, 3 или 4;
Q представляет собой -NR1R2 или, когда Y представляет собой CR5, тогда Q может также быть водородом;
R1 и R2, каждый независимо, выбраны из водорода, гидрокси, C1-12алкила, C1-12алкилокси, C1-12алкилкарбонила, C1-12алкилоксикарбонила, арила, амино, моно- или ди(C1-12алкил)амино, моно- или ди(C1-12алкил)аминокарбонила, где каждая из вышеуказанных C1-12алкильных групп в отдельности может быть замещена одним или двумя заместителями, каждый из которых независимо выбран из гидрокси, C1-6алкилокси, гидроксиC1-6алкилокси, карбоксила, C1-6алкилоксикарбонила, циано, амино, имино, аминокарбонила, аминокарбониламино, моно- или ди(C1-6алкил)амино, арила и Het; или
R1 и R2, взятые вместе, могут образовывать пирролидинил, пиперидинил, морфолинил, азидо или моно- или ди(C1-12алкил) аминоC1-4алкилиден;
R3 представляет собой водород, арил, C1-6алкилкарбонил, C1-6алкил, C1-6алкилоксикарбонил, C1-6алкил, замещенный C1-6алкилоксикарбонилом; и
каждый R4 независимо представляет гидрокси, галоген, C1-6алкил, C1-6алкилокси, циано, аминокарбонил, нитро, амино, тригалогенметил, тригалогенметилокси, или, когда Y представляет собой CR5, тогда R4 также может представлять C1-6алкил, замещенный циано или аминокарбонилом;
R5 представляет собой водород или C1-4алкил;
L представляет собой -X1-R6 или -X2-Alk-R7, где R6 и R7, каждый независимо, представляют собой фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, гидрокси, C1-6алкила, C1-6алкилокси, C1-6алкилкарбонила, C1-6алкилоксикарбонила, формила, циано, нитро, амино и трифторметила; или, когда Y представляет собой CR5, тогда R6 и R7 могут также быть выбраны из фенила, замещенного одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из аминокарбонила, тригалогенметилокси и тригалогенметила; или, когда Y представляет собой N, тогда R6 и R7 могут также быть выбраны из инданила или индолила, каждый из указанных инданила или индолила может быть замещен одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, гидрокси, C1-6алкила, C1-6алкилокси, C1-6алкилкарбонила, C1-6алкилоксикарбонила, формила, циано, нитро, амино и трифторметила;
X1 и X2, каждый независимо, представляют собой -NR3-, -NH-NH-, -N=N-, -O-, -S-, -S(=O)- или -S(=O)2-;
Alk представляет собой C1-4алкандиил; или когда Y представляет собой CR5, тогда L может быть также выбран из C1-10алкила, C3-10алкенила, C3-10алкинила, C3-7циклоалкила или C1-10алкила, замещенного одним или двумя заместителями, независимо выбранными из C3-7циклоалкила, инданила, индолила и фенила, где указанный фенил, инданил и индолил могут быть замещены одним, двумя, тремя, четырьмя или, если возможно, пятью заместителями, каждый из которых независимо выбран из галогена, гидрокси, C1-6алкила, C1-6алкилокси, циано, аминокарбонила, C1-6алкилоксикарбонила, формила, нитро, амино, тригалогенметила, тригалогенметилокси и C1-6алкилкарбонила;
арил представляет собой фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, C1-6алкила, C1-6алкилокси, циано, нитро и трифторметила;
Het представляет собой алифатический или ароматический гетероциклический радикал; указанный алифатический гетероциклический радикал выбран из пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, морфолинила, тетрагидрофуранила и тетрагидротиенила, где каждый из указанных алифатических гетероциклических радикалов может быть необязательно замещен оксогруппой; и указанный ароматический гетероциклический радикал выбран из пирролила, фуранила, тиенила, пиридила, пиримидинила, пиразинила и пиридазинила, где каждый указанный ароматический гетероциклический радикал может быть необязательно замещен гидрокси; или
соединение формулы
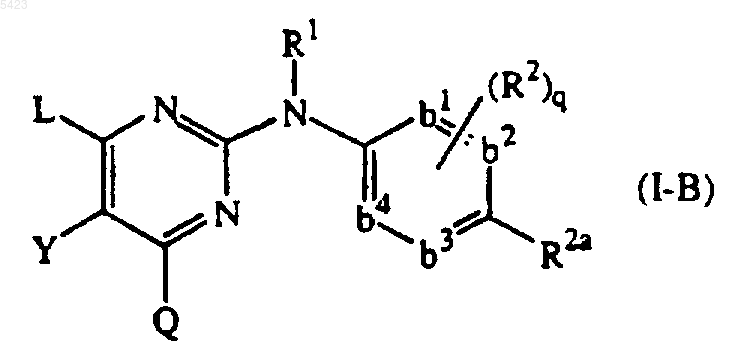
его N-оксиды, фармацевтически приемлемые соли, четвертичные амины и стереохимические изомерные формы, где
-b1=b2-C(R2a)=b3-b4= представляет собой двухвалентный радикал формулы
| -CH=CH-C(R2a)=CH-CH= | (b-1); |
| -N=CH-C(R2a)=CH-CH= | (b-2); |
| -CH=N-C(R2a)=CH-CH= | (b-3); |
| -N=CH-C(R2a)=N-CH= | (b-4); |
| -N=CH-C(R2a)=CH-N= | (b-5); |
| -CH=N-C(R2a)=N-CH= | (b-6); |
| -N=N-C(R2a)=CH-CH= | (b-7); |
q равно 0, 1, 2; или, где возможно, q равно 3 или 4;
R1 представляет собой водород, арил, формил, C1-6алкилкарбонил, C1-6алкил, C1-6алкилоксикарбонил, C1-6алкил, замещенный формилом, C1-6алкилкарбонил, C1-6алкилоксикарбонил;
R2a представляет собой циано, аминокарбонил, моно- или ди(метил)аминокарбонил, C1-6алкил, замещенный циано, аминокарбонил или моно- или ди(метил)аминокарбонил, C2-6алкенил, замещенный циано, или C2-6алкинил, замещенный циано;
каждый R2 независимо представляет собой гидрокси, галоген, C1-6алкил, необязательно замещенный циано или -C(=O)R6, C3-7циклоалкил, C2-6алкенил, необязательно замещенный одним или несколькими атомами галогена или циано, C2-6алкинил, необязательно замещенный одним или несколькими атомами галогена или циано, C1-6алкилокси, C1-6алкилоксикарбонил, карбоксил, циано, нитро, амино, моно- или ди(C1-6алкил)амино, полигалогенметил, полигалогенметилокси, полигалогенметилтио, -S(=O)pR6, -NH-S(=O)pR6, -C(=O)R6, -NHC(=O)H, -C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6 или радикал формулы

где каждый A независимо представляет собой N, CH или CR6;
B представляет собой NH, O, S или NR6;
p равно 1 или 2; и
R6 представляет собой метил, амино, моно- или диметиламино или полигалогенметил;
L представляет собой C1-10алкил, C2-10алкенил, C2-10алкинил, C3-7циклоалкил, где каждая из указанных алифатических групп может быть замещена одним или двумя заместителями, независимо выбранными из
C3-7циклоалкила,
индолила или изоиндолила, каждого необязательно замещенного одним, двумя, тремя или четырьмя заместителями, каждый из которых независимо выбран из галогена, C1-6алкила, гидрокси, C1-6алкилокси, циано, аминокарбонила, нитро, амино, полигалогенметила, полигалогенметилокси и C1-6алкилкарбонила,
фенила, пиридинила, пиримидинила, пиразинила или пиридазинила, где каждое указанное ароматического кольцо может быть необязательно замещено одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из заместителей, определенных в R2; или
L представляет собой -X-R3, где
R3 представляет собой фенил, пиридинил, пиримидинил, пиразинил или пиридазинил, где каждое из указанных ароматических колец может быть необязательно замещено одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из заместителей, определенных в R2; и
X представляет собой -NR1-, -NH-NH-, -N=N-, -O-, -C(=O)-, -CHOH-, -S-, -S(=O)- или -S(=O)2-;
Q представляет собой водород, C1-6алкил, галоген, полигалоген C1-6алкил или -NR4R5; и
R4 и R5, каждый независимо, выбран из водорода, гидрокси, C1-12алкила, C1-12алкилокси, C1-12алкилкарбонила, C1-12алкилоксикарбонила, арила, амино, моно- или ди(C1-12алкил)амино, моно- или ди(C1-12алкил)аминокарбонила, где каждая из вышеуказанных C1-12алкильных групп независимо может быть замещена одним или двумя заместителями, каждый из которых независимо выбран из гидрокси, C1-6алкилокси, гидроксиC1-6алкилокси, карбоксила, C1-6алкилоксикарбонила, циано, амино, имино, моно- или ди(C1-6алкил)амино, полигалогенметила, полигалогенметилокси, полигалогенметилтио, -S(=O)pR6, -NH-S(=O)pR6, -C(=O)R6, -NHC(=O)H, -C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6, арила и Het; или
R4 и R5,взятые вместе, могут образовывать пирролидинил, пиперидинил, морфолинил, азидо или моно- или ди(C1-12алкил)аминоC1-4алкилиден;
Y представляет собой гидрокси, галоген, C3-7циклоалкил, C2-6алкенил, необязательно замещенный одним или несколькими атомами галогена, C2-6алкинил, необязательно замещенный одним или несколькими атомами галогена, C1-6алкил, замещенный циано или -C(=O)R6, C1-6алкилокси, C1-6алкилоксикарбонил, карбоксил, циано, нитро, амино, моно- или ди(C1-6алкил)амино, полигалогенметил, полигалогенметилокси, полигалогенметилтио, -S(=O)pR6, -NH-S(=O)pR6, -C(=O)R6, -NHC(=O)H, -C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6 или арил;
арил представляет собой фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, C1-6алкила, C3-7циклоалкила, C1-6алкилокси, циано, нитро, полигалогенC1-6алкила и полигалогенC1-6алкилокси;
Het представляет собой алифатический или ароматический гетероциклический радикал; указанный алифатический гетероциклический радикал выбран из пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, морфолинила, тетрагидрофуранила и тетрагидротиенила, где каждый указанный алифатический гетероциклический радикал может быть необязательно замещен оксогруппой; и указанный ароматический гетероциклический радикал выбран из пирролила, фуранила, тиенила, пиридинила, пиримидинила, пиразинила и пиридазинила, где каждый указанный ароматический гетероциклический радикал может быть необязательно замещен гидрокси; или
соединение формулы
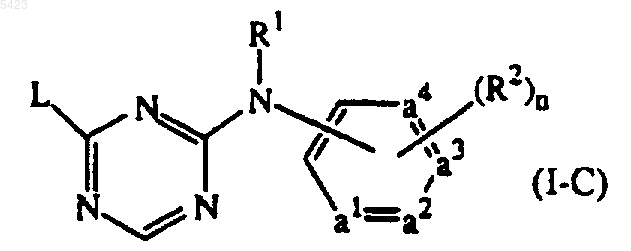
его N-оксиды, фармацевтически приемлемые соли, четвертичные амины и их стереохимически изомерные формы, где -a1=a2-a3=a4- представляет двухвалентный радикал формулы
| -CH=CH-CH=CH- | (a-1); |
| -N=CH-CH=CH- | (a-2); |
| -N=CH-N=CH- | (a-3); |
| -N=CH-CH=N- | (a-4); |
| -N=N-CH=CH- | (a-5); |
n равно 0, 1, 2, 3 или 4; и когда -a1=a2-a3=a4- равно (a-1), тогда n может также равен 5;
R1 представляет собой водород, арил, формил, C1-6алкилкарбонил, C1-6алкил, C1-6алкилоксикарбонил, C1-6алкил, замещенный формилом, C1-6алкилкарбонил, C1-6алкилоксикарбонил; и каждый R2 независимо представляет гидрокси, галоген, C1-6 алкил, необязательно замещенный циано или -C(=O)R4, C3-7циклоалкил, C2-6алкенил, необязательно замещенный одним или несколькими атомами галогена или циано, C2-6алкинил, необязательно замещенный одним или несколькими атомами галогена или циано, C1-6алкилокси, C1-6алкилоксикарбонил, карбоксил, циано, нитро, амино, моно- или ди(C1-6алкил)амино, полигалогенметил, полигалогенметилокси, полигалогенметилтио, -S(=O)pR4, -NH-S(=O)pR4, -C(=O)R4, -NHC(=O)H, -C(=O)NHNH2, -NHC(=O)R4, -C(=NH)R4 или радикал формулы

где каждый A независимо представляет N, CH или CR4;
B представляет собой NH, O, S или NR4;
p равно 1 или 2; и
R4 представляет собой метил, амино, моно- или диметиламино или полигалогенметил;
L представляет собой C1-10алкил, C2-10алкенил, C2-10алкинил, C3-7циклоалкил, где каждая из указанных алифатических групп может быть замещена одним или двумя заместителями, независимо выбранными из
C3-7циклоалкила,
индолила или изоиндолила, каждого необязательно замещенного одним, двумя, тремя или четырьмя заместителями, каждый из которых независимо выбран из галогена, C1-6алкила, гидрокси, C1-6алкилокси, циано, аминокарбонила, нитро, амино, полигалогенметила, полигалогенметилокси и C1-6алкилкарбонила,
фенила, пиридинила, пиримидинила, пиразинила или пиридазинила, где каждое указанное ароматическое кольцо может быть необязательно замещено одним, двумя, тремя, четырьмя или пятью заместителям, каждый из которых независимо выбран из заместителей, определенных в R2; или
L представляет собой -X-R3, где
R3 представляет собой фенил, пиридинил, пиримидинил, пиразинил или пиридазинил, где каждое из указанных ароматических колец может быть необязательно замещено одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из заместителей, определенных в R2; и
X представляет собой -NR1-, -NH-NH-, -N=N-, -O-, -C(=O)-, -CHOH-, -S-, -S(=O)- или -S(=O)2-;
арил представляет собой фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый независимо выбран из галогена, C1-6алкила, C3-7циклоалкила, C1-6алкилокси, циано, нитро, полигалогенC1-6алкила и полигалогенC1-6алкилокси;
при условии, что не включены соединения, в которых
L представляет собой C1-3алкил;
R1 выбран из водорода, этила и метила;
-a1=a2-a3=a4- представляет собой двухвалентный радикал формулы (a-1);
n равно 0 или 1, и
R2 выбран из фтора, хлора, метила, трифторметила, этилокси и нитро; или
L представляет собой -X-R3,
X представляет собой -NH-;
R1 представляет собой водород;
-a1=a2-a3=a4- представляет собой двухвалентный радикал формулы (a-1);
n равно 0 или 1, и
R2 выбран из хлора, метила, метилокси, циано, амино и нитро, и
R3 представляет собой фенил, необязательно замещенный одним заместителем, выбранным из хлора, метила, метилокси, циано, амино и нитро;
и соединения
N,N'-дипиридинил-(1,3,5)-триазин-2,4-диамин;
(4-хлорфенил)-(4-(1-(4-изобутилфенил)этил)-(1,3,5)триазин-2-ил)амин; и
(b) один или несколько фармацевтически приемлемых водорастворимых полимеров.
2. Твердая дисперсия по п.1, представленная в виде частиц.
3. Твердая дисперсия по п.2, где частицы имеют размер менее 1500 мкм.
4. Твердая дисперсия по п.3, где частицы имеют размер менее 125 мкм.
5. Твердая дисперсия по любому из пп.1-4, где соединение формулы (I-A), (I-B) или (I-C) находится в виде некристаллической фазы.
6. Твердая дисперсия по п.5, где твердая дисперсия находится в форме твердого раствора, содержащего (a) и (b), или в форме дисперсии, где некристаллическая или микрокристаллическая (a) или некристаллическая или микрокристаллическая (b) фаза диспергирована в большей или меньшей степени равномерно в твердом растворе, содержащем (a) или (b).
7. Твердая дисперсия по любому из предшествующих пунктов, где соединение формулы (I-A), (I-B) или (I-C) представляет собой
4-[[4-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрил,
4-[[4-амино-5-бром-6-(4-циано-2,6-диметилфенилокси)-2-пиримидинил]амино]бензонитрил (R165335),
4-[[4-амино-5-хлор-6-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрил,
4-[[5-хлор-4-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрил,
4-[[5-бром-4-(4-циано-2,6-диметилфенокси)-2-пиримидинил]амино]бензонитрил,
4-[[4-амино-5-хлор-6-[(4-циано-2,6-диметилфенил)амино]-2-пиримидинил]амино]бензонитрил,
4-[[5-бром-6-[(4-циано-2,6-диметилфенил)амино]-2-пиримидинил]амино]бензонитрил,
4-[[4-амино-5-хлор-6-(4-циано-2,6-диметилфенилокси)-2-пиримидинил]амино]бензонитрил,
4-[[2-[(цианофенил)амино]-4-пиримидинил]амино]-3,5-диметилбензонитрил или
4-[[4-[(2,4,6-трихлорфенил)амино]-2-пиримидинил]амино]бензонитрил.
8. Твердая дисперсия по любому из предшествующих пунктов, где соединение формулы (I-A) представляет собой 4-[[4-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрил.
9. Твердая дисперсия по любому из пп.1-6, содержащая соединение формулы (I-B), указанное в п.1.
10. Твердая дисперсия по п.9, где соединением формулы (I-B) является соединение, где -b1=b2-C(R2a)=b3-b4= представляет собой радикал формулы (b-1); q равно 0; R2a представляет собой циано или -C(=O)NH2; Y представляет собой циано, -C(=O)NH2 или галоген; Q представляет собой водород или -NR4R5; L представляет собой -X-R3, где R3 представляет собой замещенный фенил.
11. Твердая дисперсия по п.10, где соединением формулы (I-B) является соединение, где R2a представляет собой циано; Y представляет собой галоген; Q представляет собой NH2; L представляет собой -X-R3, где X представляет собой -NR1, O или S, и R3 представляет собой фенил, замещенный C1-6алкилом, галогеном или циано.
12. Твердая дисперсия по п.9 или 10, где соединением формулы (I-B) является соединение, в котором группа, находящаяся во втором положении пиримидинового кольца, представляет собой 4-цианоанилиногруппу, L представляет собой -X-R3, где R3 представляет собой 2,4,6-тризамещенный фенил, Y представляет собой галоген и Q представляет собой водород или NH2.
13. Твердая дисперсия по любому из пп.9, 10 и 12, где соединение формулы (I-B) выбрано из группы, включающей
4-[[4-амино-5-хлор-6-(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрил;
4-[[5-хлор-4-(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрил;
4-[[5-бром-6-(4-циано-2,6-диметилфенокси)-2-пиримидинил]амино]бензонитрил;
4-[[4-амино-5-хлор-6-[(4-циано-2,6-диметилфенил)амино]-2-пиримидинил]амино]бензонитрил;
4-[[5-бром-6-[(4-циано-2,6-диметилфенил)амино]-2-пиримидинил]амино]бензонитрил;
4-[[4-амино-5-хлор-6-(4-циано-2,6-диметилфенокси)-2-пиримидинил]амино]бензонитрил;
4-[[4-амино-5-бром-6-(4-циано-2,6-диметилфенокси)-2-пиримидинил]амино]бензонитрил;
его N-оксид, фармацевтически приемлемая соль, четвертичный амин или стереохимически изомерная форма.
14. Твердая дисперсия по п.13, где соединением формулы (I-B) является 4-[[4-амино-5-бром-6-(4-циано-2,6-диметилфенокси)-2-пиримидинил]амино]бензонитрил;
его N-оксид, фармацевтически приемлемая соль, четвертичный амин или стереохимически изомерная форма.
15. Твердая дисперсия по любому из предшествующих пунктов, где водорастворимым полимером является полимер, который имеет кажущуюся вязкость 1-5000 мПа при 2% (мас./об.) растворении в водном растворе при 20шC.
16. Твердая дисперсия по п.15, где водорастворимый полимер выбран из группы, содержащей
алкилпроизводные целлюлозы, такие как метилцеллюлоза,
гидроксиалкилцеллюлозы, такие как гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и гидроксибутилцеллюлоза,
гидроксиалкилалкилцеллюлозы, такие как гидроксиэтилметилцеллюлоза и гидроксипропилметилцеллюлоза,
карбоксиалкилцеллюлозы, такие как карбоксиметилцеллюлоза,
соли щелочных металлов карбоксиалкилцеллюлозы, такие как натрий карбоксиметилцеллюлоза,
карбоксиалкилалкилцеллюлозы, такие как карбоксиметилэтилцеллюлоза,
сложные эфиры карбоксиалкилцеллюлозы,
крахмалы,
пектины, такие как натрий карбоксиметиламилопектин,
производные хитина, такие как хитозан,
ди-, олиго- или полисахариды, такие как трегалоза, циклодекстрины и их производные, альгиновая кислота, ее соли щелочных металлов или соли аммония, каррагенаны, галактоманнаны, трагакант, агар-агар, аравийская камедь, гуаровая смола и ксантановая смола,
полиакриловые кислоты и их соли,
полиметакриловые кислоты, их соли и сложные эфиры, метакрилатные сополимеры,
поливиниловый спирт,
полиалкиленоксиды, такие как полиэтиленоксид и полипропиленоксид и сополимеры этиленоксида и пропиленоксида.
17. Твердая дисперсия по п.16, где водорастворимым полимером является гидроксипропилметилцеллюлоза.
18. Твердая дисперсия по п.17, где гидроксипропилметилцеллюлоза имеет кажущуюся вязкость около 1-100 мПа при 2% (мас./об.) растворении в водном растворе при 20шC.
19. Твердая дисперсия по п.18, где гидроксипропилметилцеллюлоза имеет кажущуюся вязкость около 3-15 мПа при 2% (мас./об.) растворении в водном растворе при 20шC.
20. Твердая дисперсия по п.19, где гидроксипропилметилцеллюлоза имеет кажущуюся вязкость около 5 мПа при 2% (мас./об.) растворении в водном растворе при 20шC.
21. Твердая дисперсия по п.16, уфх водорастворимым полимером является гидроксипропилметилцеллюлоза (HPMC) с 2910 мПа.
22. Твердая дисперсия по п.21, где массовое отношение (a):(b) находится в области от 1:1 до 1:899.
23. Твердая дисперсия по п.22, где массовое отношение (a):(b) находится в области от 1:1 до 1:5.
24. Твердая дисперсия по п.23, где массовое отношение (a):(b) находится в области от 1:1 до 1:3.
25. Твердая дисперсия по любому из предшествующих пунктов, которую получают экструзией из расплава компонентов и измельчением и, необязательно, просеиванием.
26. Твердая дисперсия по любому из предшествующих пунктов, содержащая твердый раствор, включающий две массовые части соединения формулы (I-A), (I-B) или (I-C) и три массовые части гидроксипропилметилцеллюлозы HPMC 2910 5 мПа, которую получают смешиванием указанных компонентов, экструзией смеси при температуре в области от 20 до 300шC, измельчением продукта экструзии и, необязательно, просеиванием полученной таким образом твердой дисперсии.
27. Твердая дисперсия по любому из предшествующих пунктов, которая дополнительно включает один или несколько фармацевтически приемлемых эксципиентов.
28. Фармацевтическая дозированная форма, которая включает в себя терапевтически эффективное количество твердой дисперсии по любому из предыдущих пунктов.
29. Дозированная форма по п.28, подходящая для перорального введения, представленная в виде таблетки.
30. Дозированная форма по п.29 для непосредственного высвобождения соединения формулы (I-A), (I-B) или (I-C) при пероральном приеме, где твердая дисперсия равномерно распределена в смеси разбавителя или разрыхлителя.
31. Дозированная форма по п.29 или 30, покрытая оболочкой, состоящей из полимера, образующего оболочку, пластификатора и, необязательно, пигмента.
32. Дозированная форма по п.30, где растворитель представляет собой высушенную распылением смесь моногидрата лактозы и микрокристаллической целлюлозы (75:25) и разрыхлитель представляет собой кросповидон или кроскармеллозу.
33. Дозированная форма по любому из пп.28-32, где масса указанной твердой дисперсии составляет по крайней мере 40% общей массы дозируемой формы.
34. Способ получения твердой дисперсии по любому из пп.1-27, заключающийся в смешивании компонентов, экструзии указанной смеси при температуре в области от 20-300шC, измельчении продукта экструзии и, необязательно, просеивании твердой дисперсии.
35. Способ получения твердой дисперсии по любому из пп.1-27, заключающийся в распылительной сушке раствора компонентов (a) и (b).
36. Способ получения фармацевтической дозированной формы по любому из пп.28-32, заключающийся в смешивании терапевтически эффективного количества твердой дисперсии по любому из пп.1-27 с фармацевтически приемлемым эксципиентом и прессовании указанной смеси в таблетки или наполнении капсул указанной смесью.
37. Применение твердой дисперсии по любому из пп.1-27 при получении фармацевтической дозированной формы для перорального применения у млекопитающих, страдающих вирусной инфекцией, где указанному млекопитающему может вводиться один раз в день такая единичная дозировка.
38. Фармацевтическая упаковка, подходящая для коммерческой продажи, включающая контейнер, пероральную дозированную форму соединения формулы (I-A), (I-B) или (I-C) по любому из пп.28-33 и прилагаемую к упаковке инструкцию.
Текст
005423 Настоящее изобретение относится к фармацевтическим композициям противовирусных соединений, которые могут вводиться млекопитающим, в частности, человеку, страдающим вирусной инфекцией. Эти композиции включают частицы, полученные экструзией расплава одного или нескольких противовирусных соединений и одного или нескольких соответствующих водорастворимых полимеров и затем измельчением указанной смеси, полученной экструзией расплава. Противовирусные соединения, входящие в состав фармацевтических композиций по настоящему изобретению, диспергированы в носителе с помощью экструзии расплава с получением твердой дисперсии с целью улучшения их биодоступности. Соединения структурно близки к современным противовирусным соединениям, описанным в предшествующем уровне технике. В Pharmazie (1990), 45(4), р 284 описаны тризамещенные производные 2,4,6-трихлор-1,3,5-триазина,обладающие антибактериальной активностью. В Chem. Abstr. (1990), 112,1 описан синтез фторированных производных 1,3,5-триазина в качестве возможных бактерицидных агентов. В Chem. Abstr. (1988), 108,15 описаны 2,4,6-смешанные функциональные замещенные 1,3,5 триазины в качестве противосудорожных агентов. В Chem. Abstr. (1983), 98,11 описано получение п-(2,4-диариламино-6-S-триазиниламино)бензальдегид/ацетофенонтиосемикарбазонов в качестве возможных противотуберкулезных агентов. В Chem. Abstr. (1981), 95,4 описано получение полипиромеллитимидов, содержащих меламиновые единицы диалкиламинового типа. В Chem. Abstr. (1975), 83,23 описаны оптически активные производные S-триазина. В FR-A-2099730 описаны диамино- и динитро-3-триазины, которые могут быть использованы для получения полимерных материалов и красителей. В ЕР-А-0795549 в качестве противовирусных агентов описаны бис-арилокси(амино)триазинилокси(амино)арильные производные.Ashley et al. (J. Chem. Soc. (1960), January 1, стр. 4525-4532) описали амидиноанилино-1,3,5 триазины с сильной трипаноцидной активностью. В WO 91/18887 описаны диаминопиримидины в качестве ингибиторов секреции желудочного сока. В ЕР-А-0588762 описано использование N-фенил-2-пиримидинаминовых производных в качестве С-ингибиторов протеинкиназы и противоопухолевых агентов. В WO 95/10506 описаны N-алкил-N-арилпиримидинамины и их производные в качестве антагонистов рецептора кортикотропин-рилизинг фактора. В ЕР-А-0270111 описаны производные пиримидина в качестве фунгицидов в композициях, используемых для сельскохозяйственных и садоводческих целей. В J. Med. Chem. (1969), 10, стр. 974-975 описаны 2,4-бис(ариламино)-5-метилпиримидины и Chem.Abstr. (1981), 95,11 описаны 2,4-бис(ариламино)-6-метилпиримидины в качестве противомикробных агентов. В J. Med. Chem. (1996), 39, стр. 4358-4360 рассматриваются 4-анилино-6-аминопиримидины в качестве непептидных высокоаффинных антагонистов рецептора кортикотропин-рилизинг фактора у человека. В ЕР-0834507 описаны замещенные диамино-1,3,5-триазиновые производные со свойствами ингибирования репликации ВИЧ. Частицы по настоящему изобретению состоят из твердой дисперсии, содержащей его N-оксид, фармацевтически приемлемую соль или стереохимически изомерную форму, гдеQ представляет собой -NR1R2 или, когда Y представляет собой CR5, тогда Q может быть также водородом;R1 и R2, каждый независимо, выбраны из водорода, гидрокси, C1-12 алкила, C1-12 алкилокси,C1-12 алкилкарбонила, C1-12 алкилоксикарбонила, арила, амино, моно- или ди(C1-12 алкил)амино, моно- или ди(C1-12 алкил)аминокарбонила, где каждая из вышеуказанных C1-12 алкильных групп в отдельности может быть замещенной одним или двумя заместителями, каждый из которых независимо выбран из гидрокси,C1-6 алкилокси, гидроксиС 1-6 алкилокси, карбонила, C1-6 алкилоксикарбонила, циано, амино, имино, аминокарбонила, аминокарбониламино, моно- или ди(С 1-6 алкил)амино, арила и Het; илиR3 представляет собой водород, арил, C1-6 алкилкарбонил, C1-6 алкил, C1-6 алкилоксикарбонил, C1-6 алкил, замещенный C1-6 алкилоксикарбонилом; и каждый R4 независимо представляет гидрокси, галоген, C1-6 алкил, C1-6 алкилокси, циано, амино,карбонил, нитро, амино, тригалогенметил, тригалогенметилокси, или когда Y представляет собой CR5,тогда R4 также может представлять C1-6 алкил, замещенный циано или аминокарбонилом;R5 представляет собой водород или C1-4 алкил;L представляет собой -X1-R6 или -X2-Alk-R7, где R6 и R7, каждый независимо, представляют фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, гидрокси, C1-6 алкила, C1-6 алкилокси, C1-6 алкилкарбонила,C1-6 алкилоксикарбонила, формила, циано, нитро, амино и трифторметила; или, когда Y представляет собой CR5, тогда R6 и R7 могут также быть выбраны из фенила, замещенного одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из аминокарбонила, тригалогенметилокси и тригалогенметила; или, когда Y представляет собой N, тогда R6 и R7 могут также быть выбраны из инданила или индолила, каждый из указанных инданила или индолила может быть замещен одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, гидрокси, C1-6 алкила, C1-6 алкилокси, C1-6 алкилкарбонила, C1-6 алкилоксикарбонила, формила, циано,нитро, амино и трифторметила; когда R6 необязательно замещен инданилом или индолилом, он предпочтительно присоединен к остатку молекулы посредством конденсации с кольцом фенила. Например, R6 соответствующим образом является 4-, 5-, 6- или 7-индолилом;Alk представляет собой C1-4 алкандиил; или, когда Y представляет собой CR5, тогда L может быть также выбран из C1-10 алкила, С 3-10 алкенила, С 3-10 алкинила, С 3-7 циклоалкила или C1-10 алкила, замещенного одним или двумя заместителями, независимо выбранными из С 3-7 циклоалкила, инданила, индолила и фенила, где указанный фенил, инданил и индолил могут быть замещены одним, двумя, тремя, четырьмя или возможно пятью заместителями, каждый из которых независимо выбран из галогена, гидрокси,C1-6 алкила, C1-6 алкилокси, циано, аминокарбонила, C1-6 алкилоксикарбонила, формила, нитро, амино, тригалогенметила, тригалогенметилокси и C1-6 алкилкарбонила; арил представляет собой фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, C1-6 алкила, C1-6 алкилокси, циано,нитро и трифторметила;Het представляет собой алифатический или ароматический гетероциклический радикал; указанный алифатический гетероциклический радикал выбран из пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, морфолинила, тетрагидрофуранила и тетрагидротиенила, где каждый из указанных алифатических гетероциклических радикалов может быть необязательно замещен оксогруппой; и указанный ароматический гетероциклический радикал выбран из пирролила, фуранила, тиенила, пиридила,пиримидинила, пиразинила и пиридазинила, где каждый указанный ароматический гетероциклический радикал может быть необязательно замещен гидрокси; или противовирусное соединение формулы его N-оксиды, фармацевтически приемлемые соли, четвертичные амины и стереохимические изомерные формы, где -b1=b2-C(R2a)=b3-b4= представляет собой двухвалентный радикал формулы-2 005423 каждый R2 независимо представляет гидрокси, галоген, C1-6 алкил, необязательно замещенный циано или -C(=O)R6, С 3-7 циклоалкил, С 2-6 алкенил, необязательно замещенный одним или несколькими атомами галогена или циано, С 2-6 алкинил, необязательно замещенный одним или несколькими атомами галогена или циано, C1-6 алкилокси, C1-6 алкилоксикарбонил, карбоксил, циано, нитро, амино, моно- или ди(С 1-6 алкил)амино, полигалогенметил, полигалогенметилокси, полигалогенметилтио, S(=O)pR6, -NHS(=O)pR6, -C(=O)R6, -NHC(=O)H, -C(=O)NHNH2, -NHC(=O)R6, -C(=NH)R6 или радикал формулы где каждый А независимо представляет собой N, СН или CR6; В представляет собой NH, О, S или NR6; р равно 1 или 2 иR6 представляет собой метил, амино, моно- или диметиламино или полигалогенметил;L представляет собой C1-10 алкил, С 2-10 алкенил, С 2-10 алкинил, С 3-7 циклоалкил, в соответствии с чем указанная алифатическая группа может быть замещена одним или двумя заместителями, независимо выбранными из С 3-7 циклоалкила,индолила или изоиндолила, где каждый необязательно замещен одним, двумя, тремя или четырьмя заместителями, каждый из которых независимо выбран из галогена, C1-6 алкила, гидрокси, C1-6 алкилокси,циано, аминокарбонила, нитро, амино, полигалогенметила, полигалогенметилокси и C1-6 алкилкарбонила,фенила, пиридинила, пиримидинила, пиразинила или пиридазинила, где каждое указанное ароматическое кольцо может быть необязательно замещено одним, двумя, тремя, четырьмя или пятью заместителям, каждый из которых независимо выбран из заместителей, определенных в R2; илиR3 представляет собой фенил, пиридинил, пиримидинил, пиразинил или пиридазинил, где каждое из указанных ароматических колец может быть необязательно замещено одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из заместителей, определенных в R2; и Х представляет собой -NR1-, -NH-NH-, -N=N-, -О-, -С(=O)-, -СНОН-, -S-, -S(=O)- или -S(=O)2-;R4 и R5, каждый независимо, выбраны из водорода, гидрокси, C1-12 алкила, C1-12 алкилокси,C1-12 алкилкарбонила, C1-12 алкилоксикарбонила, арила, амино, моно- или ди(C1-12 алкил)амино, моно- или ди(C1-12 алкил)аминокарбонила, где каждая из вышеуказанных C1-12 алкильных групп независимо может быть замещена одним или двумя заместителями, каждый из которых независимо выбран из гидрокси,C1-6 алкилокси, гидроксиC1-6 алкилокси, карбоксила, C1-6 алкилоксикарбонила, циано, амино, имино, моноили ди(С 1-6 алкил)амино, полигалогенметила, полигалогенметилокси, полигалогенметилтио, -S(=O)pR6,-NH-S(=O)pR6, -C(=O)R6, -NHC(=O)H, -С (=O)NHNH2, -NHC(=O)R6, -C(=NH)R6, арила и Het; илиY представляет собой гидрокси, галоген, С 3-7 циклоалкил, С 2-6 алкенил, необязательно замещенный одним или несколькими атомами галогена, С 2-6 алкинил, необязательно замещенный одним или несколькими атомами галогена, C1-6 алкил, замещенный циано или -C(=O)R6, C1-6 алкилокси, C1-6 алкилоксикарбонил, карбонил, циано, нитро, амино, моно- или ди(С 1-6 алкил)амино, полигалогенметил, полигалогенметилокси,полигалогенметилтио, -S(=O)pR6,-NH-S(=O)pR6,-C(=O)R6,-NHC(=O)H,6 6-C(=O)NHNH2, -NHC(=O)R , -C(=NH)R или арил; арил представляет собой фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, C1-6 алкила, С 3-7 циклоалкила,C1-6 алкилокси, циано, нитро, полигалогенС 1-6 алкила и полигалогенС 1-6 алкилокси;Het представляет собой алифатический или ароматический гетероциклический радикал; указанный алифатический гетероциклический радикал выбран из пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, морфолинила, тетрагидрофуранила и тетрагидротиенила, где каждый указанный алифатический гетероциклический радикал может быть необязательно замещен оксогруппой; и указанный ароматический гетероциклический радикал выбран из пирролила, фуранила, тиенила, пиридинила, пиримидинила, пиразинила и пиридазинила, где каждый указанный ароматический гетероциклический радикал может быть необязательно замещен гидрокси; Het подразумевает включение всех возможных изомерных форм гетероциклов, указанных в определении Het, например, пирролил также включает 2 Нпирролил; радикал Het может быть присоединен к остатку молекулы формулы (I-B) через любой углерод кольца или гетероатом, как подходит, таким образом, например, когда гетероцикл представляет собой пиридинил, он может быть 2-пиридинилом, 3-пиридинилом или 4-пиридинилом, или противовирусное соединение формулы его N-оксиды, фармацевтически приемлемые соли, четвертичные амины и стереохимически изомерные формы, где -a1=a2-a3=a4- представляет собой двухвалентный радикал формулыn равно 0, 1, 2, 3 или 4; и в случае, когда -a1=a2-a3=a4-равно (а-1), тогда n может также быть равен 5;R1 представляет собой водород, арил, формил, C1-6 алкилкарбонил, C1-6 алкил, C1-6 алкилоксикарбонил, C1-6 алкил, замещенный формилом, C1-6 алкилкарбонил, C1-6 алкилоксикарбонил; и каждый R2 независимо представляет гидрокси, галоген, C1-6 алкил, необязательно замещенный циано или -C(=O)R4, С 3-7 циклоалкил, С 2-6 алкенил, необязательно замещенный одним или несколькими атомами галогена или циано, C1-6 алкинил, необязательно замещенный одним или несколькими атомами галогена или циано, C1-6 алкилокси, C1-6 алкилоксикарбонил, карбонил, циано, нитро, амино, моно- или ди(С 1-6 алкил)амино, полигалогенметил, полигалогенметилокси, полигалогенметилтио, -S(=O)pR4, -NHS(=O)pR4, -C(=O)R4, -NHC(=O)H, -C(=O)NHNH2, -NHC(=O)R4, -C(=NH)R4 или радикал формулы где каждый А независимо представляет собой N, СН или CR4; В представляет собой NH, О, S или NR4; р равно 1 или 2; иR4 представляет собой метил, амино, моно- или диметиламино или полигалогенметил;L представляет собой C1-10 алкил, С 2-10 алкенил, С 2-10 алкинил, С 3-7 циклоалкил, в соответствии с чем указанная алифатическая группа может быть замещена одним или двумя заместителями, независимо выбранными из С 3-7 циклоалкила,индолила или изоиндолила, каждый необязательно замещен одним, двумя, тремя или четырьмя заместителями, каждый из которых независимо выбран из галогена, C1-6 алкила, гидрокси, C1-6 алкилокси,циано, аминокарбонила, нитро, амино, полигалогенметила, полигалогенметилокси и C1-6 алкилкарбонила,фенила, пиридинила, пиримидинила, пиразинила или пиридазинила, где каждое указанное ароматическое кольцо может быть необязательно замещено одним, двумя, тремя, четырьмя или пятью заместителям, каждый из которых независимо выбран из заместителей, определенных в R2; илиR3 представляет собой фенил, пиридинил, пиримидинил, пиразинил или пиридазинил, где каждое из указанных ароматических колец может быть необязательно замещено одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из заместителей, определенных в R2; и Х представляет собой -NR1-, -NH-NH-, -N=N-, -О-, -С(=O)-, -СНОН-, -S-, -S(=O)- или -S(=O)2-; арил представляет собой фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый независимо выбран из галогена, C1-6 алкила, С 3-7 циклоалкила, C1-6 алкилокси, циано, нитро, полигалогенС 1-6 алкила и полигалогенС 1-6 алкилокси; при условии, что не включены соединения, в которыхL представляет собой C1-3 алкил; R1 выбран из водорода, этила и метила; -a1=a2-a3=a4- представляет собой двухвалентный радикал формулы (а-1); n равно 0 или 1, и R2 выбран из фтора, хлора, метила,трифторметила, этилокси и нитро; илиa =a - представляет собой двухвалентный радикал формулы (а-1); n равно 0 или 1, и R выбран из хлора,метила, метилокси, циано, амино и нитро, и R3 представляет собой фенил, необязательно замещенный одним заместителем, выбранным из хлора, метила, метилокси, циано, амино и нитро; и соединения(b) один или несколько фармацевтически приемлемых водорастворимых полимеров. Как используется в вышеуказанных определениях и в дальнейшем, галоген обозначает фтор, хлор,бром и йод;-4 005423 полигалогенметил в качестве группы или части группы определен как моно- или полигалогензамещенный метил, в частности метил с одним или несколькими атомами фтора, например, дифторметил или трифторметил; полигалогенС 1-6 алкил в качестве группы или части группы определен как моно- или полигалогензамещенный C1-6 алкил, например, группы, определенные в галогенметиле, 1,1-дифторэтил и тому подобное; в случае, когда больше одного атома галогена присоединено к алкильной группе в пределах определения полигалогенметила или полигалогенС 1-6 алкила, они могут быть одинаковыми или различными; С 1-4 алкил, в качестве группы или части группы включает прямые и разветвленные цепи радикалов насыщенных углеводородов, содержащих от 1 до 4 атомов углерода, такие как, например, метил,этил, пропил, бутил и тому подобное; C1-6 алкил в качестве группы или части группы включает прямые и разветвленные цепи радикалов насыщенных углеводородов, как определено в C1-4 алкиле, а также их высшие гомологи, содержащие 5 или 6 атомов углерода, такие как, например, пентил или гексил; C1-10 алкил, в качестве группы или части группы, включает прямые и разветвленные цепи радикалов насыщенных углеводородов, как определено в C1-10 алкиле, а также их высшие гомологи, содержащие от 7 до 10 атомов углерода, такие как, например, гептил, октил, нонил или децил; C1-12 алкил, в качестве группы или части группы включает прямые и разветвленные цепи радикалов насыщенных углеводородов, как определено в C1-10 алкиле, а также их высшие гомологи, содержащие 11 или 12 атомов углерода, такие как, например, ундецил, додецил и тому подобное; C1-4 алкилиден, в качестве группы или части группы включает двухвалентные прямые и разветвленные цепи углеводородов, включающие от 1 до 4 атомов углерода, такие как, например, метилен, этилиден, пропилиден, бутилиден и тому подобное;C1-4 алкандиил, в качестве группы или части группы, включает радикалы, определенные в C1-4 алкилидене,а также другие двухвалентные прямые и разветвленные цепи углеводородов, включающие от 1 до 4 атомов углерода, такие как например, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил и тому подобное; С 3-7 циклоалкил, в качестве группы или части группы, включает класс циклопропила, циклобутила, циклопентила, циклогексила и циклогептила; С 3-10 алкенил, в качестве группы или части группы, относится к прямым и разветвленным цепям радикалов углеводорода, содержащим одну двойную связь и имеющим от 3 до 10 атомов углерода, таким как, например, 2-пропенил, 2-бутенил, 2-пентенил, 3-пентенил, 3 метил-2-бутенил, 3-гексенил, 3-гептенил, 2-октенил, 2-ноненил, 2-деценил и тому подобное, присоединенный таким образом атом углерода к пиримидиновому кольцу представляет собой предпочтительно алифатический атом углерода; С 3-10 алкинил, в качестве группы или части группы, относится к прямым и разветвленным цепям радикалов углеводорода, содержащим одну тройную связь и имеющим от 3 до 10 атомов углерода, таким как, например, 2-пропинил, 2-бутинил, 2-пентинил, 3-пентинил, 3-метил-2 бутинил, 3-гексинил, 3-гептинил, 2-октинил, 2-нонинил, 2-децинил и тому подобное, присоединенный таким образом атом углерода к пиримидиновому кольцу представляет собой предпочтительно алифатический атом углерода; С 2-6 алкенил относится к прямым и разветвленным цепям радикалов углеводорода,включающим от 2 до 6 атомов углерода, содержащим двойную связь, таким как винил, пропенил, бутенил, пентенил, гексенил и тому подобное; С 2-10 алкенил относится к прямым и разветвленным цепям радикалов углеводорода, включающим от 2 до 10 атомов углерода, содержащим двойную связь, таким как группы, определенные для С 2-6 алкенила и гептенила, октенила, ноненила, деценила и тому подобное; C2-6 алкинил относится к прямым и разветвленным цепям радикалов углеводорода, включающим от 2 до 6 атомов углерода, содержащим тройную связь, таким как этинил, пропинил, бутинил, пентинил, гексинил и тому подобное; С 2-10 алкинил относится к прямым и разветвленным цепям радикалов углеводорода от 2 до 10 атомов углерода, содержащим тройную связь, таким как группы, определенные для С 2-6 алкинила и гептинила, октинила, нонинила, децинила и тому подобное; C1-3 алкил в качестве группы или части группы включает в себя прямые и разветвленные цепи насыщенных радикалов углеводорода, включающие от 1 до 3 атомов углерода, такие как метил, этил и пропил; C4-10 алкил включает в себя прямые и разветвленные цепи насыщенных радикалов углеводорода как определено выше, имеющие от 4 до 10 атомов углерода. Термин C1-6 алкилокси определяет прямые и разветвленные цепи насыщенных радикалов углеводорода, такие как метокси, этокси, пропилокси, бутилокси, пентилокси, гексилокси, 1-метилэтилокси, 2 метилпропилокси, 2-метилбутилокси и тому подобное; С 3-6 циклоалкилокси представляет собой класс циклопропилокси, циклобутилокси, циклопентилокси и циклогексилокси. Как используется здесь выше, группа (=O) образует карбонильную группу, когда присоединена к атому углерода, сульфоксидную группу, когда присоединена к атому серы в количестве одного элемента,и сульфонильную группу, если присоединена к атому серы в количестве двух элементов. Когда любая группа (например, арил, R3, R4 в формуле (I-A) и тому подобное) присутствует более одного раза в любом компоненте, то каждое определение является независимым. Линии, соединяющие заместители с кольцевыми системами, показывают, что связь может быть осуществлена с любым из подходящих кольцевых атомов. Например, для соединений формулы (I-A), R4 может быть присоединено к любому доступному атому углерода фенильного или пиридильного кольца. Соли добавления, как упомянуто здесь, означают терапевтически активные формы солей, которые способны образовывать соединения формул (I-A), (I-B) или (I-C) с соответствующими кислотами, такими как, например, неорганические кислоты, такие как галогенводородная кислота, например, хлористоводородная или бромисто-водородная кислота; серная; азотная; фосфорная и подобные кислоты; или-5 005423 органические кислоты, такие как, например, уксусная, пропионовая, оксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная, малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, паминосалициловая, памовая и тому подобные кислоты. Фармацевтически приемлемые соли добавления, как указано выше, также означают соли с терапевтически активным нетоксичным основанием, в частности, формы солей добавления металла или амина,которые способны образовывать соединения по настоящему изобретению. Указанные соли могут быть получены обычным способом обработки соединений по настоящему изобретению, содержащих кислотные водородные атомы, соответствующими органическими и неорганическими основаниями, такими как, например, соли аммония, соли щелочных и щелочно-земельных металлов, например, лития, натрия,калия, магния, кальция и тому подобное, соли с органическими основаниями, например, бензатин, Nметил-D-глюкамин, соли гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и тому подобное. И, наоборот, указанные формы солей могут быть преобразованы обработкой соответствующим основанием или кислотой в форму свободной кислоты или основания. Термин "соль добавления" также включает гидраты и формы добавления растворителя, которые способны образовывать соединения формул (I-A), (I-B) или (I-C). Примерами таких форм являются, например, гидраты, алкоголяты и тому подобное. Термин стереохимически изомерные формы соединений по формулам (I-A), (I-B) или (I-C), как используется выше, определяет все возможные соединения, полученные из одних и тех же атомов, связанных одинаковой последовательностью связей, но имеющих различные невзаимозаменяемые пространственные структуры, которыми могут обладать соединения по настоящему изобретению. Если не упомянуто или не указано иначе, химическое обозначение соединения включает смесь всех возможных стереохимически изомерных форм, которыми указанное соединение может обладать. Указанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Все стереохимически изомерные формы соединений по формулам (I-A), (I-B) или (I-C) в чистом виде или в примеси друг с другом предназначены для включения в область настоящего изобретения. Некоторые из соединений по формулам (I-A), (I-B) или (I-C) могут также существовать в своих таутомерных формах. Такие формы, хотя не четко обозначены в вышеуказанных формулах, предназначены для включения в область настоящего изобретения. Здесь и далее термин "соединение формулы (I-A), (I-B) или (I-C)" означает включение любой его подгруппы, также N-оксидов, фармацевтически приемлемых солей добавления, четверичных аминов и всех стереоизомерных форм. Подходящие соединения формулы (I-A) являются соединениями, в которых Y представляет собойR1 и R2, каждый независимо, выбран из водорода, гидрокси, C1-12 алкила, C1-12 алкилокси, C1-12 алкилкарбонила, C1-12 алкилоксикарбонила, арила, амино, моно- или ди(С 1-12 алкил)амино, моно- или ди(C1-12 алкил)аминокарбонила, где каждая из вышеуказанных C1-12 алкильных групп отдельно может быть замещена одним или двумя заместителями, выбранными, каждый независимо, из гидрокси, C1-6 алкилокси,гидроксиС 1-6 алкилокси, карбоксила, C1-6 алкилоксикарбонила, циано, амино, имино, аминокарбонила,аминокарбониламино, моно- или ди(С 1-6 алкил)амино, арила и Het; или R1 и R2, взятые вместе, могут образовать пирролидинил, пиперидинил, морфолинил, азидо или моно- или ди(C1-12 алкил)амино С 1-4 алкилиден; R3 представляет собой водород, арил, C1-6 алкилкарбонил, C1-6 алкил, C1-6 алкилоксикарбонил, C1-6 алкил, замещенный C1-6 алкилоксикарбонилом; каждый R4 независимо представляет собой гидрокси, галоген, C1-6 алкил, C1-6 алкилокси, циано, аминокарбонил, нитро, амино, тригалогенметил, тригалометилокси; R5 представляет собой водород или C1-4 алкил; L представляет собой -X1-R6 или -X2-Alk-R7,где R6 и R7, каждый независимо, представляют фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, гидрокси, C1-6 алкила, C1-6 алкилокси, C1-6 алкилкарбонила, C1-6 алкилоксикарбонила, формила, циано, нитро, амино, и трифторметила, X1 и X2, каждый независимо, представляют собой -NR3-, -NH-NH-, -N=N-, -О-, -S-,-S(=O)- или -S(=O)2-, и Alk представляет собой C1-4 алкандиил; арил представляет собой фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый независимо, выбран из галогена, C1-6 алкила, C1-6 алкилокси, циано, нитро и трифторметил; Het представляет собой алифатический или ароматический гетероциклический радикал; указанный алифатический гетероциклический радикал выбран из пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, морфолинила, тетрагидрофуранила и тетрагидротиенила, где каждый из указанных алифатических гетероциклических радикалов может необязательно быть замещен группой оксо; и указанный ароматический гетероциклический радикал выбран из пирролила, фуранила, тиенила, пиридила, пиримидинила, пиразинила и пиридазинила, где каждый из указанных ароматических гетероциклических радикалов может необязательно быть замещен гидрокси. Наиболее предпочтительными соединениями формулы (I-A) являются 4-4-амино-6-[(2,6-дихлорфенил)метил]-2-пиримидинил]амино]бензонитрил (1.В 1; соед. 1);(1.В 13b; соед. 78); его N-оксиды, фармацевтически приемлемые соли добавления и стереохимические изомерные формы ( указывает номера примеров способа получения, перечисленных в экспериментальной части в соответствии с которыми синтезируются соединения формулы (I-А. Подходящими соединениями формулы (I-B) являются такие соединения, в которых соблюдено одно или несколько из следующих условий:i) -b1=b2-С(R2a)=b3-b4= является радикалом формулы (b-1);iii) R2a представляет собой циано или -С(=O)NН 2, предпочтительно R2a представляет собой циано;v) Q представляет собой водород или -NR4R5, где R4 и R5 предпочтительно являются водородом;vi) L представляет собой -X-R3, где Х предпочтительно является NR1, О или S, более предпочтительно Х представляет собой NH, и R3 представляет собой фенил, замещенный C1-6 алкилом, галогеном и циано в качестве предпочтительных заместителей. Другая группа соединений формулы (I-B), представляющая интерес, включает такие соединения формулы (I-B), в которых L представляет собой -X-R3, где R3 представляет собой 2,4,6-тризамещенный фенил, каждый заместитель независимо выбран из хлора, брома, фтора, циано или C1-4 алкила. Также интересующей группой соединений формулы (I-B) являются соединения, в которых Y представляет собой хлор или бром и Q представляет собой водород или амино. Конкретными соединениями формулы (I-B) являются такие соединения формулы (I-B), в которых группа во 2 положении пиримидинового кольца является 4-цианоанилиногруппой. Предпочтительными соединениями формулы (I-B) являются такие соединения формулы (I-B), в которых группа во 2 положении пиримидинового кольца представляет собой 4-цианоанилиногруппу, L представляет собой -X-R3, где R3 является 2,4,6-тризамещенным фенилом, Y представляет собой галоген и Q представляет собой водород или NH2. Наиболее предпочтительными соединениями формулы (I-B) являются 4-4-амино-5-хлор-6-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрил; 4-5-хлор-4-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрил; 4-5-бром-4-(4-циано-2,6-диметилфенокси)-2-пиримидинил]амино]бензонитрил; 4-4-амино-5-хлор-6-[(4-циано-2,6-диметилфенил)амино]-2-пиримидинил]амино]бензонитрил; 4-5-бром-6-[(4-циано-2,6-диметилфенил)амино]-2-пиримидинил]амино]бензонитрил; 4-4-амино-5-хлор-6-(4-циано-2,6-диметилфенилокси)-2-пиримидинил]амино]бензонитрил; и 4-4-амино-5-бром-6-(4-циано-2,6-диметилфенилокси)-2-пиримидинил]амино]бензонитрил; их N-оксиды, фармацевтически приемлемые соли добавления, четвертичные амины и стереохимические изомерные формы. Интересующей группой соединений формулы (I-C) является группа таких соединений формулы (IC), в которых соблюдено одно или несколько следующих условий:(ii) -a1=a2-a3=a4- включает двухвалентный радикал формулы (а-1);(iii) R1 представляет собой водород или алкил;(iv) R2 представляет собой циано; аминокарбонил; моно- или ди(метил)аминокарбонил; C1-6 алкил,замещенный циано, аминокарбонилом или моно- или ди(метил)аминокарбонилом; и, в частности, R2 находится в 4 положении относительно группы -NR1;v) L представляет собой -X-R3, где Х предпочтительно представляет -NR1-, -О- или -S-, более предпочтительно Х представляет -NH-, и R3 представляет собой фенил, замещенный C1-6 алкилом, галогеном и циано в качестве предпочтительных заместителей. Предпочтительными соединениями формулы (I-C) являются такие соединения формулы (I-C), где L представляет собой -X-R3, где R3 представляет собой дизамещенную фенильную группу или тризамещенную фенильную группу, каждый заместитель независимо выбран из хлора, брома, фтора, циано илиC1-4 алкила. Более предпочтительным соединением формулы (I-C) является 4-4-[(2,4,6-триметилфенил)амино]1,3,5-триазин-2-ил]амино]бензонитрил. Соединения формулы (I-A) могут быть получены в соответствии со способами, известными в данной области. В частности, соединения формулы (I-A) могут быть, как правило, получены взаимодействием промежуточного соединения формулы (II), где W1 представляет собой подходящую удаляемую группу, такую как, например, атом галогена, с аминопроизводными формулы (III) в присутствии инертного растворителя, такого как, например, 1,4-диоксан, тетрагидрофуран, 2-пропанол, N-метилпирролидинон и тому подобное, необязательно, в присутствии подходящего основания, такого как, например, гидроксид натрия, гидрид натрия, триэтиламин или N,N-диизопропилэтиламин или тому подобное. В случае, когда Q представляет собой NR1R2 и R2 содержит гидроксигруппу, реакцию удобно осуществлять с защищенной формой промежуточного соединения (III), в котором гидроксигруппа несет-9 005423 подходящую защитную группу Р, которая представляет собой, например, бензил, и последовательным удалением защитной группы в соответствии со способами, известными в данной области, такими как,например, взаимодействие с ВВr3 в дихлорметане в атмосфере азота. Соединения формулы (I-A), где Y представляет собой CR5, указанные соединения представлены формулой (I-А-а), могут также быть получены взаимодействием с промежуточными соединениями формулы (IV), где W1 представляет собой подходящую удаляемую группу, такую как, например, атом галогена, с аминопроизводным формулы (V), необязательно в растворителе, таком как, например, вода, 2 пропанол, диэтиловый эфир, 1-метил-2-пирролидинон и тому подобное, и, необязательно, в присутствии кислоты, такой как, например, 1 н. хлористо-водородная кислота в диэтиловом эфире. Удобно осуществлять взаимодействие в атмосфере инертного газа, такого как, например, аргон без кислорода или азот. Соединения формулы (I-А-а), где L представляет собой -X1-R6, где указанные соединения представлены формулой (I-A-a-1), также могут быть получены взаимодействием промежуточного соединения формулы (VI) с промежуточным соединением формулы (VII) в подходящем растворителе, таком как,например, 1,4-диоксан. В зависимости от природы Х 1 для увеличения скорости реакции может использоваться подходящее основание или кислота. Например, в случае, когда X1 представляет собой -О-, в качестве основания может выступать гидрид натрия; или когда Х 1 представляет собой -NR3-, в качестве подходящей кислоты может использоваться НСl. Соединения формулы (I-A), где Y представляет собой N, указанные соединения представлены формулой (I-А-b), могут быть легко получены с использованием твердофазного синтеза. Обычно, твердофазный синтез включает в себя взаимодействие промежуточного соединения в синтезе с полимерной подложкой. Такое промежуточное вещество на подложке может затем вступать в ряд стадий синтеза. После каждой стадии, примеси удаляются фильтрацией полимера и многоразовой промывкой различными растворителями. В каждой стадии полимер может отсоединяться для взаимодействия с различными промежуточными веществами следующей стадии, таким образом позволяя синтезироваться большому количеству соединений. После последней стадии синтеза полимер обрабатывают реагентом или вызывают отделение полимера от образца. Подходящие полимерные подложки включают в себя, например, полимер Rink Amide (CalbiochemNovabiochem Corp., Сан-Диего, Калифорния). Например, соединения формулы (I-А-b), где n равно 1 и R4 заместитель находится в метаположении А, и NR1R2 представляет собой NH2, указанные соединения представлены формулой (I-А-b1), получают в соответствии со способом, изображенным на схеме 1. Схема 1- 10005423 На схеме 1 полимер Rink Amide взаимодействует в подходящем растворителе, таком как, например,N,N-диметилформамид, в присутствии пиперидина с получением первичного амина формулы (VIII-a),который затем может взаимодействовать с промежуточным соединением формулы (IX), где W1 является подходящей удаляемой группой, такой как, например, атом галогена, в присутствии основания, такого как, например, N,N-диизопропилэтиламин, в подходящем растворителе, таком как, например, диметилсульфоксид. Примеси удаляют большим числом промывок различными растворителями, такими как,например, N,N-диметилформамид, дихлорметан, диметилсульфоксид и тому подобное. Получаемое промежуточное соединение формулы (VIII-b), связанное с полимером, затем взаимодействует с L-H (X). Для облегчения такого преобразования могут быть использованы трифлат серебра, гексаметилдисилазид натрия или карбонат цезия. Полимер, наконец, обрабатывали расщепляющим реагентом, таким как, например, трифторуксусная кислота в тетрагидрофуране, с получением, таким образом, соединений формулы(I-A-b-1). В этом и дальнейших получениях продукты реакции могут быть выделены из реакционной среды и,если необходимо, дополнительно очищены в соответствии со способами, хорошо известными в данной области, такими как, например, экстракция, кристаллизация, дистилляция, растирание в порошок и хроматография. Соединения формулы (I-A) могут, более того, быть получены преобразованием соединений формулы (I-A) друг в друга с помощью хорошо известной группы трансформирующих реакций. Соединения формулы (I-A) могут быть преобразованы в соответствующую N-оксидную форму с помощью хорошо известных способов преобразования трехвалентного азота в его W-оксидную форму. Указанная реакция N-оксидирования может обычно проводится взаимодействием исходного продукта формулы (I-A) с соответствующим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают в себя, например, перекись водорода, пероксиды щелочного или щелочно-земельного металла, например, пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать в себя пероксиды кислот, такие как, например, бензолкарбопероксокислота,или галоген, замещенный бензолкарбопероксокислотой, например, 3-хлорбензолкарбопероксокислота,пероксоалкановая кислота, например, пероксоуксусная кислота, алкилгидропероксиды, например, третбутилгидропероксид. Подходящим растворителем, например, является вода, низшие спирты, например,этанол и тому подобное, углеводороды, например, толуол, кетоны, например, 2-бутанон, галогенированные углеводороды, например, дихлорметан, и смеси этих растворителей. Например, соединения формулы (I-А-а), где Q представляет собой NR1R2, и взятые вместе R1 и R2 образуют моно- или ди(С 1-12 алкил)аминоС 1-4 алкилиден, указанные соединения представлены формулой(I-A-a-2), могут быть получены взаимодействием соединения формулы (I-А-а), где R1 и R2 представляют собой водород, указанное соединение представлено формулой (I-А-а-3) с промежуточным соединением формулы (XI) или его функциональным производным. Также соединения формулы (I-А-а), где Q представляет собой NR1R2 и R1 и R2 представляют собой водород, могут, кроме того, взаимодействовать с галогенангидридом или алкилхлорформиатом в реакционно-инертном растворителе, таком как, например дихлорметан, в присутствии подходящего основания,такого как, например, пиридин с образованием соответствующего амида, а соответственно, карбаматного производного. Некоторые соединения формулы (I-A) и некоторые промежуточные соединения по настоящему изобретению могут содержать асимметричный атом углерода. Чистая стереохимически изомерная форма указанных соединений и указанные промежуточные соединения могут быть получены с использованием хорошо известных способов в данной области. Например, диастереоизомеры могут быть разделены физическими способами, такими как селективная кристаллизация или способами хроматографии, например,противоточным распределением, жидкостной хроматографией и подобными способами. Энантиомеры могут быть получены из рацемических смесей сначала преобразованием указанных рацемических смесей подходящими разлагающими агентами, такими как, например, хиральные кислоты, в смесь диастереои- 11005423 зомерных солей или соединений; затем физическим разделением указанных смесей диастереомерных солей или соединений, например, с помощью селективной кристаллизации или способами хроматографии, например, жидкостной хроматографией и подобными методами; и наконец, преобразованием указанных разделенных диастереомерных солей или соединений в соответствующие энантиомеры. Чистые стереохимически изомерные формы могут также быть получены из чистых стереохимически изомерных форм соответствующих промежуточных соединений и исходных продуктов, при условии, что промежуточные реакции происходят стереоспецифически. Альтернативный способ разделения энантиомерных форм соединений формулы (I-A) и промежуточных соединений включает в себя жидкостную хроматографию, в частности жидкостную хроматографию со стационарной хиральной фазой. Некоторые промежуточные соединения и исходные продукты являются известными соединениями и могут быть коммерчески доступными или могут быть получены в соответствии с хорошо известными способами. Промежуточные соединения формулы (II), где Y представляет собой CR5, указанные промежуточные соединения представлены формулой (II-а), могут быть получены взаимодействием промежуточного соединения формулы (XII) с промежуточным соединением формулы (V) аналогично получению соединений формулы (I-a). Конкретная подгруппа промежуточных соединений формулы (II-а) представлена формулой где n' равно 0, 1, 2 или 3. Конкретные промежуточные соединения формулы (II'-а) представляют собой соединения, где W1 является атомом галогена, более конкретно, атомом хлора. Промежуточные соединения формулы (II), где Y представляет собой N, R4 находится в параположении NR3, и n равен 1, указанные промежуточные соединения представлены формулой (II-b-1),могут быть получены взаимодействием промежуточного соединения формулы (XIII), где W1 является подходящей удаляемой группой, такой как, например, галоген, с аминопроизводным формулы (XIV) в присутствии инертного растворителя, такого как, например, тетрагидрофуран, 1,4-диоксан или тому подобное, в присутствии подходящего основания, такого как, например, триэтиламин; и затем взаимодействием полученного таким образом промежуточного соединения формулы (XV) с промежуточным соединением формулы (XVI) в присутствии инертного растворителя, такого как, например, ацетонитрил,1,4-диоксан или тому подобное, в присутствии основания, такого как, например, карбонат калия, гидрид натрия, N,N-диизопропилэтиламин или тому подобное. Порядок вышеуказанной схемы реакции может быть изменен, т.е. сначала промежуточное соединение формулы (XIII) может взаимодействовать с промежуточным соединением формулы (XVI), и затем полученное промежуточное соединение формулы (XVII) может дополнительно взаимодействовать с аминопроизводным формулы (XIV); таким образом образуя промежуточное соединение формулы (II-b1). Конкретными промежуточными соединениями являются такие промежуточные соединения формулы (II-b-1), в которых R4 представляет собой циано, амино, карбонил, нитро или трифторметил, R3 представляет собой водород, А представляет собой СН, W1 представляет собой галоген, такой как, хлор и бром, и L такой, как определен в соединениях формулы (I), при условии, что R6 иной, чем п-цианофенил,п-нитрофенил, п-метоксифенил и п-аминокарбонилфенил, и R7 иной, чем 2-(4-гидроксифенил)этил] амино; более конкретно, R3, А и W1 такие, как определены выше, R4 представляет собой циано и L представляет собой -X1-R6 или X2-Alk-R7; где R6 и R7, каждый независимо, представляет инданил, индолил или фенил; каждый из указанных инданила, индолила или фенила могут быть замещены двумя, тремя,четырьмя или пятью заместителям, каждый независимо, выбран из галогена, C1-6 алкила, C1-6 алкилокси,гидрокси, C1-6 алкилкарбонила, C1-6 алкилоксикарбонила, формила, циано, нитро, амино и трифторметила. Промежуточные соединения формулы (IV), где Q представляет собой NR1R2, указанные промежуточные соединения представлены формулой (IV-a), могут быть получены взаимодействием пиримидинового производного формулы (XVIII), где W1 представляет собой подходящую удаляемую группу, такую как, например, атом галогена, с промежуточным соединением формулы (III) в присутствии инертного растворителя, такого как, например, 1,4-диоксан, 2-пропанол или тому подобное. Возможно получение различных изомеров положения и они могут быть отделены друг от друга с помощью подходящих способов разделения, таких как, например, хроматография. Промежуточные соединения формулы (XVIII), где L представляет собой L'-CH2, присоединенный во 2 положении пиримидинового кольца, и W1 представляет собой хлор (представлены формулой (XVIIIа, могут быть получены взаимодействием промежуточного вещества формулы (XIX) с эфиром пропандиовой кислоты формулы (XX) в растворителе, таком как, например, этанол, и в присутствии, например,натрия, и затем взаимодействием полученного таким образом промежуточного соединения формулы Промежуточные соединения формулы (XVIII), где L представляет собой L'-CH2 и находится в 4 или 6 положении пиримидинового кольца, и W1 представляет собой хлор, указанные промежуточные соединения представлены формулой (XVIII-b), могут быть получены взаимодействием промежуточного соединения формулы (XXII) с мочевиной или с ее функциональными производными, в растворителе, таком как, например, этанол, и в присутствии, например, натрия, и затем взаимодействием полученного таким образом промежуточного соединения формулы (XXIII) с подходящим реагентом, таким как, например,фосфорилхлорид.- 13005423 Промежуточные соединения формулы (XVIII), где L представляет собой L'-СН 2 и находится в любом месте на пиримидиновом кольце, представленные формулой (XVIII-c), могут быть получены взаимодействием промежуточного соединения формулы (XXIV), где W1 представляет собой подходящую удаляемую группу, такую как, например, атом галогена, с промежуточным соединением формулы(XXV), где W2 представляет собой подходящую удаляемую группу, такую как, например, галоген, в соответствии со способом реакции Гриньяра. Промежуточные соединения формулы (XVIII), где L представляет собой -Z-R6, -Z- представляет здесь -О- или -NH-, и -Z-R6 присоединен в 4 или 6 положении пиримидинового кольца, указанные промежуточные соединения представлены формулой (XVIII-d), могут быть получены взаимодействием промежуточного соединения формулы (XXVI) с промежуточным соединением формулы (XXVII), где W1 представляет собой подходящую удаляемую группу, такую как, например, атом галогена, в инертном растворителе, таком как, например, тетрагидрофуран или 1,4-диоксан, и в присутствии подходящего основания, такого как, например, гидроксид калия или диизопропилэтанамин, или гидрид натрия. Соединения формулы (I-A) и некоторые промежуточные соединения, которые могут иметь один или несколько стереогенных центров в своей структуре, присутствуют в R или S конфигурации. Обычно соединения формулы (I-B) могут быть получены взаимодействием промежуточного соединения формулы (II(b, где W1 представляет собой подходящую удаляемую группу, такую как, например,галоген, гидрокси, трифлат, тозилат, тиометил, метилсульфонил, трифторметилсульфонил и тому подобное, с аминопроизводным формулы (III(b, необязательно, без растворителя или в присутствии инертного растворителя, такого как, например, этанол, 1-метил-2-пирролидинон, N,N-диметилформамид, 1,4 диоксан, тетрагидрофуран, диметилсульфоксид, тетралин, сульфолан, ацетонитрил и тому подобное, в атмосфере инертного газа, такого как, например, аргон без кислорода или азот, и необязательно в присутствии кислоты, такой как, например, 1 н. хлористо-водородная кислота в диэтиловом эфире или тому подобное. Данную реакцию можно проводить при температуре, находящейся в области от 50 до 250 С. В этом и дальнейших получениях, продукты реакции могут быть выделены из реакционной среды и, если необходимо, дополнительно очищены в соответствии со способами, хорошо известными в данной области, такими как, например, экстракция, кристаллизация, дистилляция, растирание в порошок и хроматография. Соединения формулы (I-B), где L представляет собой радикал формулы -NR1-R3, и представленные формулой (I-B-1), могут быть получены взаимодействием промежуточного соединения формулы (IV(b,где W2 является подходящей удаляемой группой, такой как, например, галоген или трифлат, с промежуточным соединением формулы (V(b без растворителя или в подходящем растворителе, таком как, например, этанол, 1-метил-2-пирролидинон, N,N-диметилформамид, 1,4-диоксан, тетрагидрофуран, диметилсульфоксид, тетралин, сульфолан, ацетонитрил и тому подобное, в атмосфере инертного газа, такого как, например, аргон без кислорода или азота, и, необязательно, в присутствии кислоты, такой как, например, 1 н. хлористо-водородная кислота в диэтиловом эфире. Данную реакцию можно проводить при температуре, находящейся в области от 50 до 250 С. Соединения формулы (I-B), где L представляет собой радикал формулы -O-R3, и представленные формулой (I-B-2), могут быть получены взаимодействием промежуточного соединения формулы (IV(b,где W2 является подходящей удаляемой группой, такой как, например, галоген или трифлат, с промежуточным соединением формулы (VI(b в подходящем растворителе, таком как, например, этанол, 1,4 диоксан, диметилсульфоксид, тетралин, сульфолан и тому подобное, в атмосфере инертного газа, такого как, например, аргон без кислорода или азот, и необязательно в присутствии основания, такого как, например, гидрид натрия, гидрид калия и тому подобное. Данную реакцию можно проводить при температуре, находящейся в области от 50 до 250 С. Соединения формулы (I-B), кроме того, могут быть получены путем преобразования соединений формулы (I-B) друг в друга с помощью хорошо известных реакций преобразования групп. Соединения формулы (I-B) могут быть преобразованы в соответствующие N-оксидные формы с помощью способов, описанных здесь выше. Например, соединения формулы (I-B), где Q является галогеном, могут быть преобразованы в соответствующие соединения, в которых Q представляет собой -NR4H, используя NH2R4 в качестве реагента в реакции с инертным растворителем, таким как, например, 1,4-диоксан и тому подобное, необязательно в присутствии подходящего основания, такого как, например, триэтиламин или N,Nдиизопропилэтиламин или тому подобное. В случае, когда, R4 содержит гидроксигруппу, удобно осуществлять вышеуказанную реакцию с защищенной формой NH2R4, где гидроксигруппа содержит подходящую защитную группу Р, являющуюся, например, триалкилсилильной группой, и защитную группу затем удаляют в соответствии с хорошо известными способами в данной области. Некоторые соединения формулы (I-B) и некоторые промежуточные соединения по настоящему изобретению могут содержать асимметричный атом углерода. Чистые стереохимически изомерные формы указанных соединений и указанных промежуточных соединений могут быть получены с помощью хорошо известных способов в данной области. Например, диастереоизомеры могут быть разделены с помощью физических способов, таких как селективная кристаллизация, или хроматографическими способами, например противоточным распределением, жидкостной хроматографией и подобными способами. Энантиомеры могут быть получены из рацемической смеси сначала преобразованием указанных рацемических смесей подходящими разделяющими агентами, такими как, например, хиральные кислоты, в смеси диастереомерных солей или соединений; затем физическим разделением указанных смесей диастереомерных солей или соединений, например, с помощью селективной кристаллизации, или хроматографическими способами, например, жидкостной хроматографией и подобными способами; и, наконец,преобразованием указанных разделенных диастереомерных солей или соединений в соответствующие энантиомеры. Очищенные стереохимически изомерные формы могут быть также получены из чистых стереохимически изомерных форм соответствующих промежуточных соединений и исходных продуктов, при условии, что промежуточные реакции проводят стереоспецифически. Альтернативный способ разделения энантиомерных форм соединений формулы (I-B) и промежуточных соединений включает жидкостную хроматографию, в частности, жидкую хроматографию с использованием стационарной хиральной фазы. Некоторые промежуточные соединения и исходные продукты являются известными соединениями и могут быть коммерчески доступными или могут быть получены в соответствии с хорошо известными способами в данной области. Промежуточные соединения формулы (II(b, где L представляет собой -X-R3, указанные промежуточные соединения представлены формулой (II(b)-1), могут быть получены взаимодействием пиримидининового производного формулы (VII(b, где каждый W1 такой, как определен ранее, с HXR3 (VIII(b в присутствии реакционно-инертного растворителя, такого как, например, 1,4-диоксан, 2-пропанол или тому подобное, и в присутствии основания, такого как, например, триэтиламин или N,Nдиизопропилэтиламин или тому подобное. Возможно образование различных изомеров положения и они- 15005423 могут быть разделены друг от друга, с использованием подходящих способов разделения, таких как, например, хроматография. Промежуточные соединения формулы (IV(b могут быть получены взаимодействием промежуточного соединения формулы (VII(b)-а), где W2 представляет собой подходящую удаляемую группу, такую как, например, галоген, с промежуточным соединением формулы (IX(b в подходящем растворителе,таком как, например, 1-метил-2-пирролидинон, 1,4-диоксан или тому подобное, в присутствии кислоты,такой как, например, 1 н. хлористо-водородная кислота в диэтиловом эфире. Эту реакцию можно проводить при температуре, находящейся в области от 50 до 250 С. Альтернативно, промежуточные соединения формулы (IV(b могут быть получены взаимодействием промежуточного соединения формулы (Х(b с оксихлоридом фосфора, ангидридом п-трифторметилбензол сульфокислоты или их функциональными производными в атмосфере инертного газа, такого как, например, аргон без кислорода или азот. Эту реакцию можно проводить при температуре, находящейся в области от 20 до 150 С. Промежуточные соединения формулы (Х(b могут быть получены взаимодействием промежуточного соединения формулы (XI(b или его функциональных производных с промежуточным соединением формулы (IХ(b. Данное взаимодействие можно проводить без растворителя или в подходящем растворителе, таком как, например, диглим, тетралин или тому подобное, в атмосфере инертного газа, такого как, например, аргон без кислорода или азот, и, необязательно, в присутствии основания, такого как, например, гидрид натрия, гидрид калия или тому подобное. Данное взаимодействие можно проводить при температуре, находящейся в области от 100 до 250 С. Промежуточные соединения формулы (Х(b могут также быть получены взаимодействием промежуточного соединения формулы (XII(b, где W2 представляет собой подходящую удаляемую группу, иY и Q такие, как определены для соединения формулы (I-B), с промежуточным соединением формулы(XIII(b в соответствующем растворителе, таком как, например, этанол и тому подобное, и в присутствии основания, такого как, например, этоксид натрия или тому подобное, в атмосфере инертного газа,такого как, например, аргон без кислорода или азот. Взаимодействие можно проводить при температуре,находящейся в области от 20 и 125 С. Подходящий способ получения промежуточного соединения формулы (IV(b, где Y представляет собой атом брома или хлора (представленное формулой (IV(b)-l, включает введение атома брома или хлора в промежуточное соединение формулы (XIV(b, используя W-бромсукцинимид или Wхлорсукцинимид в инертном растворителе, таком как, например, хлороформ, тетрахлорид углерода или тому подобное. Данную реакцию можно проводить при температуре, находящейся в области от 20 до 125 С. Аналогично для преобразования соединений формулы (I-B), где Q представляет собой галоген, в соединения формулы (I-B), где Q представляет собой -NHR4, могут также быть преобразованы промежуточные соединения формулы (II(b, (IV(b и (VII(b. Соединения формулы (I-C), где L представляет собой радикал формулы -X-R3, указанные соединения представлены формулой (I-C-а), могут быть получены взаимодействием промежуточного соединения формулы (II(с, где W1 представляет собой подходящую удаляемую группу, например галоген, с аминопроизводным формулы (III(с в присутствии реакционно-инертного растворителя, например тетрагидрофурана, 1,4-диоксана или тому подобное, в присутствии подходящего основания, такого как,триэтиламин; и затем взаимодействием полученного таким образом промежуточного соединения формулы (IV(c с промежуточным соединением формулы (V(c в присутствии реакционно-инертного растворителя, такого как ацетонитрил, 1,4-диоксан или тому подобное, в присутствии основания, такого карбонат калия, гидрид натрия, N,N-диизопропилэтиламин или тому подобное. Порядок в вышеуказанной схеме реакции может быть изменен, т.е. сначала промежуточное соединение формулы (II(с может взаимодействовать с промежуточным соединением формулы (V(c и затем полученное промежуточное соединение может взаимодействовать с аминопроизводным формулы(III(с; с получением, таким образом, соединения формулы (I-С-а). Продукты реакции могут быть выделены из реакционной среды и, если необходимо, дополнительно очищены с помощью хорошо известных способов в данной области, такими как экстракция, кристаллизация, дистилляция, растирание в порошок и хроматография. Соединения формулы (I-C), где L представляет собой необязательно замещенный C1-10 алкил, С 2-10 алкенил, С 2-10 алкинил, С 3-7 циклоалкил, указанные соединения представлены формулой (I-С-b), могут быть получены сначала образованием реагента Гриньяра промежуточного соединения формулы (VI(с,где W2 представляет собой подходящий заместитель, такой как, галоген, например бром, в присутствии магния в инертном растворителе, таком как диэтиловый эфир, и затем взаимодействием указанного реагента Гриньяра с промежуточным соединением формулы (II(с, где W1 представляет собой подходящую удаляемую группу, такую как галоген, например хлор, в присутствии реакционно-инертного растворителя, например бензола, с получением, таким образом, промежуточного соединения формулы (VII(с. Удобно осуществлять вышеописанную реакцию в атмосфере инертного газа, например аргона. Промежуточное соединение (VII(с может быть выделено из реакционной среды или может дополнительно взаимодействовать in situ с промежуточным соединением формулы (III(с в присутствии реакционноинертного растворителя, такого как 1,4-диоксан, и в присутствии подходящего основания, такого как диизопропилэтиламин или тому подобное, с получением, таким образом, соединения формулы (I-C-b). Соединения формулы (I-C) могут быть, кроме того, получены преобразованием соединений формулы (I-C) друг в друга с помощью хорошо известных в данной области реакций трансформации групп. Соединения формулы (I-C) могут быть преобразованы в соответствующие N-оксидные формы способами, описанными здесь выше. Некоторые промежуточные соединения, как указано здесь ранее, являются коммерчески доступными или могут быть получены хорошо известными в данной области способами. Соединения формулы (I-C) и некоторые промежуточные соединения, которые могут содержать один или несколько стереогенных центров в своей структуре, присутствуют в R или S конфигурации. Соединения формулы (I-A), (I-B) или (I-C), полученные в описанных здесь ранее способах, могут быть синтезированы в виде смеси стереоизомерных форм, в частности, в виде рацемических смесей энантиомеров, которые могут быть разделены между собой с помощью хорошо известных в данной области способов. Рацемические соединения формулы (I-A), (I-B) или (I-C) могут быть преобразованы в соответствующие формы диастереомерных солей с помощью взаимодействия с подходящей хиральной кислотой. Указанные формы диастереомерных солей, кроме того, разделяют, например, с помощью селективной или фракциональной кристаллизации, и энантиомеры выделяют оттуда с помощью щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы (I-A), (I-B) или (I-C) включает жидкую хроматографию, использующую стационарную хиральную фазу. Указанные чистые стереохимические изомерные формы также получают из соответствующих чистых стереохимически изомерных форм соответствующих исходных продуктов, при условии, что реакции проводят стереоспецифически. Предпочтительно, если желательными являются специфические стероизомеры, указанное соединение нужно синтезировать стереоспецифическими способами получения. Эти способы преимущественно используют энантиомерно чистые исходные продукты. Специалистам в данной области будет понятно, что в способах описанных выше, для получения соединений формулы (I-А), (I-B) или (I-C) может быть необходимо блокировать функциональные группы промежуточных соединений защитными группами. Функциональные группы, которые желательно защитить, включают в себя гидрокси, амино и карбоновую кислоту. Подходящие защитные группы для гидрокси включают группы триалкилсилила (например, трет-бутилдиметилсилил, трет-бутилдифенилсилил или триметилсилил), бензила и тетрагидропиранила. Подходящие защитные группы для амино включают в себя трет-бутилоксикарбонил или бензилоксикарбонил. Подходящие защитные группы карбоновой кислоты включают в себя C1-6 алкил или бензиловые эфиры. Защитные и снимающие защиту функциональные группы могут вводиться до или после реакционной стадии. Использование защитных групп подробно описано в Защитные группы в органической химии,под редакцией J.W.F. McOmie, Plenum Press (1973), и Защитные группы в органическом синтезе 2 оe издание, Т.W. GreeneР G M Wutz, Wiley Interscience (1991). Соединения формулы (I-A), (I-B) и (I-C) и промежуточные соединения формулы (II'-a) неожиданно продемонстрировали противоретровирусные свойства, в частности против вируса иммунодефицита человека (ВИЧ), который является этиологическим агентом приобретенного синдрома иммунодефицита(СПИД) у людей. Вирус ВИЧ предпочтительно поражает Т-4 клетки человека и разрушает их или изменяет их нормальную функцию, в частности скоординированность иммунной системы. В результате, у инфицированного пациента наблюдается постоянное снижение числа Т-4 клеток, которые, кроме того,ведут себя анормально. Следовательно, иммунная защитная система не способна противостоять инфекциям и новообразованиям и ВИЧ инфицированные больные обычно умирают от оппортунистических инфекций, таких как пневмония или от злокачественных новообразований. Другие состояния, связанные с ВИЧ инфекцией, включают тромбоцитопению, рассеянный склероз, саркому Капоши и инфекции центральной нервной системы, характеризующиеся прогрессирующей демиелинизацией, что приводит к слабоумию и симптомам таким как прогрессирующая дисартрия, атоксия и дезориентация. ВИЧ инфекция, кроме того, связана с периферической нейропатией, прогрессирующей генерализованной лимфаденопатией (PGL) и СПИД-связанным комплексом (ARC). Соединения формулы (I-A), (I-B) и (I-C) также демонстрируют активность против штаммов ВИЧ-1,которые приобрели устойчивость к ненуклеозидным ингибиторам обратной транскриптазы, известным в данной области. Они также не обладают или обладают низкой аффинностью к человеческому -1 кислотному гликопротеину.- 18005423 Специалисты в области лечения ВИЧ-инфекции определят эффективное количество в день по приведенным здесь результатам исследования. Обычно предполагают, что эффективное количество в день может составлять от 0,01 до 50 мг/кг массы тела, более предпочтительно от 0,1 до 10 мг/кг массы тела. Может быть уместно вводить требуемую дозу двумя, тремя, четырьмя или более субдозами с соответствующими интервалами в течение дня. Указанные субдозы могут быть получены в виде единичных дозируемых форм, например, содержащих от 1 до 1000 мг, в частности от 5 до 600 мг активного ингредиента на дозируемую форму и более предпочтительно от 200 до 400 мг на единичную дозируемую форму или от 5 до 200 мг активного ингредиента на единичную дозируемую форму в зависимости от конкретного используемого соединения. Конкретная доза и частота введения зависит от конкретного используемого соединения формулы (IA), (I-B) или (I-C), конкретного состояния, которое подвергают лечению, возраста, массы и общего физического состояния конкретного пациента, а также других принимаемых пациентом лекарственных препаратов, как известно специалистам в данной области. Кроме того, несомненно, что указанное эффективное количество в день может быть снижено или увеличено в зависимости от ответа субъекта, подвергаемого лечению, и/или зависит от определения ценности предписанием лечащего врача соединений по данному изобретению. Эффективное количество в день, находящееся в области указанной здесь ранее,является, таким образом, лишь предписанием и в любом случае не предназначено для ограничения объема данного изобретения или использования изобретения. Соединение формулы (I-A), (I-B) или (I-C) могут быть использованы в настоящем изобретении в комбинации с другими соединениями формулы (I-A), (I-B) или (I-C) или с другими противоретровирусными соединением. Таким образом, настоящее изобретение также относится к фармацевтическим композициям, содержащим (а) соединение формулы (I-A), (I-B) или (I-C), (b) другое соединение формулы (IA), (I-B) или (I-C) или другое противоретровирусное соединение и (с) один или несколько водорастворимых полимеров, в качестве комбинированного препарата для противо-ВИЧ лечения. Другие указанные противоретровирусные соединения могут быть известными противоретровирусными соединениями, такими как нуклеозидные ингибиторы обратной транскриптазы, например, зидовудин (3'-азидо-3'деокситимидин, AZT), диданозин (дидеоксиинозин; ddI), зальцитабин (дидеоксицитидин, ddC) или ламивудин (3'-тиа-2'-3'-дидеоксицитидин, 3 ТС) и тому подобное; ненуклеозидные ингибиторы обратной транскриптазы, такие как сурамин, фоскарнетнатрий (тринатрийфосфоноформиат), невирапин (11 циклопропил-5,11-дигидро-4-метил-6H-дипиридо [3,2-b:2',3'-е]-[1,4]диазепин-6-он), сустива (эфавиренз),такрин-(тетрагидроаминоакридин) и тому подобное; соединения типа TIBO (тетрагидроимидазо[4,5,1jk][1,4]-бензодиазепин-2(1H)-он и тиокетон), например, (S)-S-хлор-4,5,6,7-тетрагидро-5-метил-6-(3 метил-2-бутенил)имидазо-[4,5,1-jk][1,4]бензодиазепин-2(1 Н)тион; соединения типа -АРА (анилинофенилацетамид), например, -[(2-нитрофенил)амино]-2,6-дихлорбензолацетамид и тому подобное; ТАТ-ингибиторы, например, RO-5-3335 и тому подобное; ингибиторы протеазы, например, индинавир, ритановир, саквиновир и тому подобное; NMDA ингибиторы рецепторов, например, пентамидин; ингибитор -глюкозидазы, например, кастаноспермин и тому подобное; ингибитор Rn-азы Н, например,декстран (сульфат декстрана) и тому подобное; или иммуномодуляторы, например, левамизол, тимопентин и тому подобное. Термин "твердая дисперсия" определяет систему в твердом состоянии (как противоположность в жидком или в газообразном состоянии), включающую по крайней мере два компонента, где один компонент диспергирован в большей или меньшей степени равномерно по всему объему другого компонента или компонентов. Когда указанная дисперсия компонентов представляет собой такую дисперсию, в которой система является химически и физически одинаковой или однородной по всему объему или состоит из одной фазы, как определено в термодинамике, такая твердая дисперсия будет здесь и далее называться "твердый раствор". Твердые растворы являются предпочтительными физическими системами, так как компоненты, находящиеся в них, обычно обладают быстрой биодоступностью в организме, в который они вводятся. Это преимущество можно вероятно объяснять легкостью, с которой указанные твердые растворы могут образовывать жидкие растворы при контакте с жидкой средой, такой как желудочный сок. Легкость растворения можно объяснить, по крайней мере частично, тем фактом, что требуется меньше энергии для растворения компонентов из твердого раствора, чем необходимо для растворения компонентов из кристаллической или микрокристаллической твердой фазы. Фраза "твердая дисперсия" также включает дисперсии, которые являются менее однородными по всему объему, чем твердые растворы. Такие дисперсии не являются химически и физически не однородными по всему объему или содержат более чем одну фазу. Например, фраза "твердая дисперсия" также относится к частицам, имеющим домены или небольшие области, где аморфный, микрокристаллический или кристаллический (а), или аморфный, микрокристаллический или кристаллический (b), или оба диспергированы в большей или меньшей степени равномерно в другой фазе, включающей (b), или (а), или твердый раствор, включающий (а) и (b). Указанные домены являются областями внутри частиц, характерно обозначенные определенным физическим признаком, малым размером относительно размера частицы в целом, и равномерно и случайным образом распределенные по всему объему частицы.- 19005423 Как описано выше, частицы по настоящему изобретению также включают один или несколько водорастворимых полимеров. Водорастворимый полимер в частицах по настоящему изобретению является полимером, который предпочтительно имеет кажущуюся вязкость при растворении при 20 С в водном растворе с 2% (м/об.),от 1 до 5000 мПа, более предпочтительно от 1 до 700 мПа и наиболее предпочтительный от 1 до 100 мПа. Например, водорастворимый полимер может быть выбран из группы, включающей алкильные производные целлюлозы, такие как метилцеллюлоза,гидроксиалкильные производные целлюлозы, такие как гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и гидроксибутилцеллюлоза,гидроксиалкильные производные целлюлозы, такие как гидроксиэтилметилцеллюлоза и гидроксипропилметилцеллюлоза,карбоксиалкильные производные целлюлозы, такие как карбоксиметилцеллюлоза,соли щелочных металлов карбоксиалкильных производных целлюлозы, такие как карбоксиметилцеллюлоза натрия,карбоксиалкилалкильные производные целлюлозы, такие как карбоксиметилэтилцеллюлоза,сложные эфиры карбоксиалкильных производных целлюлозы,крахмалы,пектины, такие как карбоксиметиламилопектин натрия,производные хитина, такие как хитозан,ди-, олиго- и полисахариды, такие как трегалоза,циклодекстрины и их производные, альгиновая кислота, соли щелочных металлов или соли аммония, карагены, галактоманнаны, трагакант, агар-агар, аравийская камедь, гуаровая смола и ксантановая смола,полиакриловые кислоты и их соли,полиметакриловые кислоты, их соли и сложные эфиры, метакрилатные сополимеры,поливиниловый спирт,полиалкиленоксиды, такие как полиэтиленоксид и полипропиленоксид и сополимеры этиленоксида и пропиленоксида. Предпочтительными водорастворимыми полимерами являются Eudragit Е и гидроксипропилметилцеллюлоза (НРМС). Указанный Eudragit E (Rohm GmbH, Germany) является аминоалкилсополимером метакрилата,более предпочтительно представляет собой поли(бутилметакрилат, (2-диметиламиноэтил)метакрилат,метилметакрилат) (1:2:1). Этот основной полиметакрилат растворим в желудочном соке до значения рН равному 5. Eudragit E 100, который представляет собой свободную от растворителя Eudragit E твердую субстанцию, предпочтителен. Указанный НРМС содержит достаточное количество гидроксипропила и метоксильных групп, чтобы быть водорастворимым. НРМС, обладая метоксильным уровнем замещения от приблизительно 0,8 до приблизительно 2,5 и гидроксипропильным молярным замещением от приблизительно 0,05 до приблизительно 3,0, обычно является водорастворимым. Метоксильный уровень замещения определяется средним количеством присутствующих метилэфирных групп на единицу ангидроглюкозы молекулы целлюлозы. Гидроксипропильное молярное замещение определяется средним количеством молей пропиленоксида,которые вступили в реакцию с каждой единицей ангидроглюкозы молекулы целлюлозы. Гидроксипропилметилцеллюлоза является принятым в Соединенных Штатах названием для гипромеллозы (см. Martindale, The Extra Pharmacopoeia, 29th edition, page 1435). В четырехзначной цифре "2910", первые две цифры означают приблизительное процентное содержание метоксильных групп, а третья и четвертая цифры - приблизительное процентное содержание композиции гидроксипропоксильных групп; 5 мПа равно величине, показывающей кажущуюся вязкость 2% водного раствора при 20 С. Молекулярная масса НРМС обычно оказывает влияние на оба профиля получаемого экструдата, а также его физические свойства. Желаемый профиль на выходе может, таким образом, быть спланирован,выбирая соответствующей молекулярный вес НРМС; для непосредственного получения активного ингредиента из частиц, предпочтителен низкомолекулярный полимер. НРМС с высокой молекулярной массой с большей вероятностью даст фармацевтическую дозированную форму замедленного высвобождения. Молекулярную массу водорастворимого эфира целлюлозы обычно выражают как кажущуюся вязкость при 20 С водного раствора, содержащего 2 мас.% указанного полимера. Соответствующий НРМС включает НРМС, имеющую вязкость от приблизительно 1 до приблизительно 100 мПа, в конкретной форме от приблизительно 3 до приблизительно 15 мПа, предпочтительно приблизительно 5 мПа. Наиболее предпочтительный тип НРМС, имеющий вязкость 5 мПа, является коммерчески доступным НРМС 2910 5 мПа, потому что он дает частицы, из которых может быть получена дозированная форма для перорального приема соединений формул (I-A), (I-B) или (I-C), что будет рассмотрено ниже и в экспериментальной части. Соотношение "веса к весу" (а) (т.е. противовирусное соединение): (b) (т.е. водорастворимый полимер) находится в пределах 1:1 - 1:899, предпочтительно от 1:1 до 1:100, более предпочтительно от 1:1 до 1:5. В случае (соединение по формулам (I-A), (I-B) или (I-C: (НРМС 2910 5 мПа), ука- 20005423 занное соотношение предпочтительно изменяется от приблизительно 1:1 до приблизительно 1:3 и оптимально равно приблизительно 1:1,5 (или 2:3). Большинство соответствующих соотношений "веса к весу" соединения по формулам (I-A), (I-B) или (I-C) для водорастворимого полимера(ов) может быть определено специалистами в данной области путем простого экспериментирования. Нижний предел определен практическими соображениями. Действительно, если необходимо терапевтически эффективное количество соединения по формулам (I-A), (I-B) или (I-C) (от приблизительно 1 до приблизительно 1000 мг в единичной дозированной форме, предпочтительно приблизительно от 200 до 400 мг или от 5 до 200 мг в единичной дозированной форме), нижний предел соотношения определяется максимальным количеством смеси, которая может быть преобразована в одну дозированную форму практического размера. Когда относительное количество водорастворимого полимера слишком высокое, абсолютное количество смеси, необходимое для достижения терапевтического уровня, будет также высоким, для того, чтобы быть преобразованным в одну капсулу или таблетку. Таблетки, например, имеют максимальный вес приблизительно 1 г, и экструдат может составлять максимально приблизительно 90% (мас./мас.). Следовательно, нижний предел количества соединения формулы (I-A), (I-B) или (I-C) относительно водорастворимого полимера будет приблизительно равен 1:899 (1 мг соединения формулы (I-A), (I-B) или (I-C) + 899 мг водорастворимого полимера). С другой стороны, если отношение слишком высокое, это означает, что количество соединения формулы (I-A), (I-B) или (I-C) относительно высокое по сравнению с количеством водорастворимого полимера, тогда имеется риск, что соединение формулы (I-A), (I-B) или (I-C) не будет достаточно растворяться в водорастворимом полимере, и, таким образом, необходимое биоаккумулирование не будет получено. Степень, до которой соединение растворяется в водорастворимом полимере, часто можно определить визуально: если экструдат прозрачен, то, вероятно, что соединение растворилось полностью в водорастворимом полимере. Будет принято во внимание, что верхний предел 1:1 может быть заниженным для определенных соединений формулы (I-А), (I-B) или (I-C) и конкретных водорастворимых полимеров. Так как это может быть легко установлено, хотя необходимо затратить время на экспериментирование, твердые дисперсии, в которых соотношение (а):(b) больше, чем 1:1, также предназначены для включения в область настоящего изобретения. Частицы по настоящему изобретению могут быть получены путем первоначального получения твердой дисперсии компонентов, и необязательно дальнейшим измельчением или перемалыванием этой дисперсии. Существуют различные способы получения твердых дисперсий, включающие экструзию расплава, сушку распылением и выпаривание раствора, предпочтительна экструзия расплава. Процесс экструзии расплава включает следующие этапы:a) смешивание компонентов (а) и (b),b) необязательно смешивание добавок с полученной таким образом смесью,c) нагревание полученной таким образом смеси до получения однородного расплава,d) пропускание полученного таким образом проплава через одну или несколько насадок иe) охлаждение расплава до затвердевания. Фраза "плавятся" и "плавление" должны толковаться широко. Для наших целей эти фразы означают не только преобразование от твердого состояния к жидкому состоянию, но могут также означать переход к стекловидному состоянию или каучукоподобному состоянию, и, когда это возможно, внедрение одного компонента смеси в большей или меньшей степени гомогенизированно в другой. В особых случаях один компонент будет плавиться, а другой компонент(ы) растворятся в расплаве, образуя таким образом раствор, который после охлаждения может образовать твердый раствор, обладающий полезными свойствами растворения. Одним из наиболее важных параметров экструзии расплава является температура, при которой работает экструдер расплава. Было обнаружено, что рабочая температура может легко находиться между около 20 и около 300 С, более предпочтительно около 70 и 250 С. Более низкая предельная температура зависит от растворимости соединения формул (I-A), (I-B) или (I-C) в водорастворимом полимере и от вязкости смеси. Когда соединение формулы (I-A), (I-B) или (I-C) полностью не растворено в водорастворимом полимере, экструдат не будет иметь необходимое биоаккумулирование; когда вязкость смеси слишком высокая, процесс экструзии расплава будет протекать тяжело. При температурах больше чем 300 С водорастворимый полимер может разлагаться до неприемлемой степени. Может быть отмечено,что нет необходимости опасаться разложения соединения формула (I-А), (I-B) или (I-C) при температурах до 300 С. Специалист в данной области легко определит наибольший соответствующий температурный интервал для использования. Производительность также имеет значение, потому что даже при относительно низких температурах водорастворимый полимер может начать разлагаться, когда он остается слишком долго в контакте с нагревающим элементом. Следует учесть, что специалист в данной области способен оптимизировать параметры процесса экструзии расплава в пределах вышеуказанных данных интервалов. Рабочие температуры будут также определяться видом экструдера или видом конфигурации экструдера, который используется. Большая часть энергии, необходимой для плавления, смешивания и растворения компонента в экструдере, может- 21005423 обеспечиваться нагревательными элементами. Однако, трение материала в экструдере может также обеспечить существенное количество энергии для смеси и способствовать образованию однородного расплава компонентов. Специалист в данной области легко определит наиболее подходящий экструдер, как например, одношнековый, двухшнековый экструдер или многошнековый экструдер, для получения объекта по настоящему изобретению. Распылительная сушка компонентов раствора также дает выход твердой дисперсии указанных компонентов и может быть полезной альтернативой процессу экструзии расплава, особенно в тех случаях,где водорастворимый полимер не достаточно устойчив, чтобы выдержать условия экструзии, и где остаточный растворитель может эффективно быть удален из твердой дисперсии. Все же другой возможный способ получения включает получение раствора компонентов, выливание указанного раствора на большую поверхность для образования тонкой пленки и выпаривание оттуда растворителя. Твердый продукт дисперсии перемалывали или измельчали до частиц с размером меньше чем 1500 мкм, предпочтительно меньше чем 400 мкм, более предпочтительно меньше чем 250 мкм и наиболее предпочтительно меньше чем 125 мкм. Оказалось, что размер частиц, является важным фактором, определяющим скорость, с которой конкретная дозированная форма может производиться в большом масштабе. Например, для капсул размер частиц может находиться предпочтительно от 100 до 1500 мкм; для таблеток размер частиц равен предпочтительно менее чем 250 мкм. Чем меньше размер частицы, тем выше скорость изготовления таблеток может быть без вредных последствий для их качества. Распределение частиц по размерам таково, что больше чем 70% частиц (измеренные по весу) имеют диаметр в пределах от около 50 до около 1400 мкм, в частности от около 50 до около 200 мкм, более конкретно от около 50 до около 150 мкм и еще более конкретно от около 50 до около 125 мкм. Частицы с размерами,упомянутыми здесь, могут быть получены путем их просеивания через номинальное стандартное испытательное сито, как описано в CRC Handbook, 64th ed., page F-114. Номинальное стандартное испытательное сито характеризуется величинами ширины ячейки/отверстия (мкм), DIN 4188 (мм), ASTM Е 1170 (No), Tyler (ячейка) или BS 410 (ячейка). По всему данному описанию и в формуле изобретения размеры частиц обозначены с указанием ширины ячейки/отверстия в мкм и соответствующего номера сита в стандарте ASTM E11-70. Предпочтительными являются частицы, где соединение формулы (I-A), (I-B) или (I-C) находятся в некристаллической фазе, так как они имеют присущую им более быструю скорость растворения, чем те,где часть или все соединение формулы (I-A), (I-B) или (I-C) находится в микрокристаллической или кристаллической форме. Предпочтительно твердая дисперсия находится в форме твердого раствора, включающего (а) и (b). Альтернативно, она может быть в форме дисперсии, где аморфный или микрокристаллический (а) или аморфный или микрокристаллический (b) диспергирован в большей или меньшей степени равномерно в твердом растворе, включающем (а) и (b). Предпочтительными частицами являются частицы, полученные путем экструзии расплава компонентов и измельчения и необязательно просеиванием. Более конкретно, настоящее изобретение относится к частицам, состоящим из твердого раствора, включающего две части по весу соединения формулы (IА), (I-B) или (I-C) и три части по весу гидроксипропилметилцеллюлозы НРМС 2910 5 мПа, полученным путем смешивания указанных компонентов, экструзии расплава смеси при температуре в пределах от 20 до 300 С, перемалывания экструдата и необязательно просеивания полученных таким образом частиц. Получение является выгодным для производства и получения частиц и соединения формулы (I-A), (I-B) или (I-C), которые не содержат органический растворитель. Частица, как описано выше, может далее включать один или несколько фармацевтически приемлемых инертных наполнителей, таких как, например, пластификаторы, ароматизаторы, красители, консерванты и тому подобное. Указанные инертные наполнители не должны быть чувствительны к высокой температуре, другими словами, они не должны демонстрировать какого-либо заметного распада или разложения при рабочей температуре экструдера расплава. При получении препарата (соединение формулы I-A, (I-B) или (I-С):НРМС 2910 5 мПа), количество пластификатора предпочтительно мало, порядка от 0 до 15% (мас./мас.), предпочтительно меньше чем 5% (мас./мас.). С другими водорастворимыми полимерами, хотя можно использовать различные пластификаторы, часто используют более высокие количества, потому что пластификаторы, как упомянуто здесь ниже, понижают температуру, при которой образуется расплав (а), (b) и пластификатор, и это понижение точки плавления является выгодным, где полимер ограничивает тепловую стойкость. Соответствующие пластификаторы являются фармацевтически приемлемыми и включают полиспирты с низким молекулярным весом, такие как этиленгликоль, пропиленгликоль, 1,2-бутиленгликоль, 2,3 бутиленгликоль, стиролгликоль; полиэтиленгликоли, такие как диэтиленгликоль, триэтиленгликоль, тетраэтиленгликоль; другие полиэтиленгликоли, имеющие молекулярный вес меньше чем 1,000 г/моль; полипропиленгликоли, имеющие молекулярный вес меньше чем 200 г/моль; эфиры гликоли, такие как монопропиленгликольмоноизопропиловый эфир; пропиленгликольмоноэтиловый эфир; диэтиленгликольмоноэтиловый эфир; эфирные типы пластификаторов, такие как сорбитлактат, этиллактат, бутиллактат,- 22005423 этилгликолат, аллилгликолат; и амины, такие как моноэтаноламин, диэтаноламин, триэтаноламин, моноизопропаноламин; триэтилентетрамин, 2-амино-2-метил-1,3-пропандиол и тому подобное. Из них предпочтительны низкомолекулярные полиэтиленгликоли, этиленгликоли, низкомолекулярные полипропиленгликоли и, особенно, пропиленгликоль. Когда экструдат получен, он может быть перемолот и просеян и может использоваться в качестве ингредиента для производства фармацевтических дозированных форм. Частицы по настоящему изобретению могут быть сформулированы в фармацевтическую дозированную форму, содержащую терапевтически эффективное количество частиц. Хотя, прежде всего, предусмотрены фармацевтические дозированные формы для перорального приема, такие как таблетки и капсулы, частицы по настоящему изобретению могут также использоваться для получения фармацевтической дозированной формы, например, для ректального введения. Предпочтительными дозированными формами являются формы, адаптированные для перорального приема, в виде таблетки. Они могут производиться с помощью обычных способов получения таблеток с обычными ингредиентами или эксципиентами и на обычном оборудовании для производства таблеток. Как указано выше, эффективная противовирусная доза соединения формулы (I-А), (I-B) или (I-C) находится в пределах от около 1 до около 1000 мг на единичную дозированную форму и предпочтительно равна около от 200 до 400 мг или от 5 до 200 мг на единичную дозированную форму в зависимости от конкретного используемого соединения. Учитывая, что соотношение "вес к весу" (а):(b) максимально равно около 1:1, из этого следует, что одна дозированная форма будет весить по крайней мере 10-800 мг. Для облегчения глотания такой дозированной формы млекопитающим желательно придать дозированной форме, в частности таблеткам, соответствующую форму. Таблетки, которые удобно глотать, имеют, таким образом, предпочтительно вытянутую, чем круглую форму. Особенно предпочтительны выпуклые с двух сторон сплющенные таблетки. Как рассмотрено более подробно ниже, пленочная оболочка таблетки дополнительно способствует легкости, с которой ее можно глотать. Таблетки, которые позволяют непосредственно высвобождать соединения формулы (I-A), (I-B) или(I-C) при глотании перорально и которые обладают хорошим биоаккумулированием, разработаны таким образом, при котором таблетки быстро разлагаются в желудке (непосредственно высвобождаются), и при котором частицы, которые высвобождены таким образом, находятся далеко друг от друга для того, чтобы они не коалесцировали, давали высокие локальные концентрации соединения формулы (I-A), (I-B) или (I-C) и возможность осаждаться лекарственному средству (биоаккумулирование). Желаемый эффект может быть получен путем равномерного распределения указанных частиц по всему объему смеси дезинтегрирующего агента и растворителя. Соответствующими разрыхлителями являются агенты, которые имеют большой коэффициент расширения. Их примерами являются гидрофильные, нерастворимые или плохо водорастворимые сшиваемые полимеры, такие как кросповидон (сшитый поливинилпирролидон) и кроскармелоза (сшитая карбоксиметилцеллюлоза натрия). Количество разрыхлителей в таблетках с непосредственным высвобождением по настоящему изобретению может обычно находится в пределах от около 3 до около 15%(мас./мас.), и предпочтительно равно около от 7 до 9%, в частности около 8,5% (мас./мас.). Это количество имеет тенденцию быть большим, чем обычно в таблетках, чтобы быть уверенным, в том, что частицы распространяются по большому объему содержимого желудка при глотании. Так как разрыхлители по своей природе дают замедленное высвобождение композиции при их использовании в сыпучем состоянии, то полезно разбавлять их инертной средой, называемой растворителем или наполнителем. В качестве растворителей или наполнителей можно использовать различные вещества. Примерами являются высушенная с помощью распылительной сушки или безводная лактоза, сахароза, декстроза,маннит, сорбит, крахмал, целлюлоза (например, микрокристаллическая целлюлоза Avicel), дигидратированный или безводный двухосновный фосфат кальция и другие известные в данной области вещества и их смеси. Предпочтительной является находящаяся в продаже высушенная распылением смесь моногидрата лактозы (75%) с микрокристаллической целлюлозой (25%), которая находится в продаже под маркой Microcelac. Количество растворителя или наполнителя в таблетках может обычно находится в пределах от около 20 до около 40% (мас./мас.) и предпочтительно находится в пределах от около 25 до около 32% (мас./мас.). Таблетка может включать разновидность одного или нескольких других обычных инертных наполнителей, таких как связующие вещества, буферные агенты, смазывающие агенты, агенты скольжения,загустители, подсластители, ароматизаторы и красители. Некоторые инертные наполнители могут использоваться для различных целей. Смазывающие агенты и придающие скользящие свойства агенты можно использовать в производстве некоторых дозированных форм и обычно используются при производстве таблеток. Примерами смазочных агентов и агентов скольжения являются гидрированные растительные масла, например гидрированное хлопковое масло, стеарат магния, стеариновая кислота, лаурилсульфат натрия, лаурилсульфат магния, коллоидный кремнезем, тальк, их смеси и другие известные в данной области вещества. Представляющими интерес смазывающими агентами и агентами скольжения являются стеарат магния, и смеси стеарата магния с коллоидным кремнеземом. Предпочтительными смазывающими агентами явля- 23005423 ются гидрированное растительное масло типа I, наиболее предпочтительно гидрированное, дезодорированное хлопковое масло (находящееся в продаже от Karlshamns под маркой Akofine NF (прежнее название Sterotex). Содержание смазывающих агентов и придающих скользящие свойства агентов обычно равно от 0,2 до 7,0% от общей массы таблетки. Другие инертные наполнители, такие как красящие агенты и пигменты могут также добавляться в таблетки по настоящему изобретению. Красящие агенты и пигменты включают диоксид титана и красители, пригодные для употребления в пищу. Красящий агент обычно является необязательным ингредиентом в таблетке по настоящему изобретению, но при использовании красящий агент может присутствовать в количестве до 3,5% от общей массы таблетки. Ароматизирующие агенты необязательно могут присутствовать в композиции и могут быть выбраны из синтетических ароматизирующих масел и вкусовых ароматизаторов или натуральных масел экстрактов листьев растений, цветов, фруктов и так далее и их комбинации. Они могут включать коричное масло, масло гаултерии, перечно-мятные масла, масло плодов лавра, анисовое масло, эвкалипт, тимьяновое масло. Также используются в качестве ароматизирующих агентов ваниль, масло цитрусовых, включая лимон, апельсин, грейп, лайм и грейпфрут, и фруктовые эссенции, включая яблоко, банан, грушу,персик, землянику, малину, вишню, сливу, ананас, абрикос и так далее. Количество ароматизирующего агента может зависеть от ряда факторов, включая органолептический желаемый эффект. Обычно ароматизирующий агент будет присутствовать в количестве от около 0 до около 3% (мас./мас.). Как известно в данной области, таблеточные смеси могут быть сухо-гранулированными или влажно-гранулированными перед изготовлением таблеток. Сам по себе процесс изготовления таблеток во всем остальном является стандартным и легко осуществимым, предавая таблетке из желаемой смеси или смеси ингредиентов соответствующую форму, используя обычный таблеточный пресс. Таблетки по настоящему изобретению могут быть дополнительно покрыты пленкой для улучшения вкуса, обеспечения легкости глотания и привлекательности внешнего вида. В данной области известны различные соответствующие полимерные вещества для покрывающей пленки. Предпочтительным покрывающим пленочным веществом является гидроксипропилметилцеллюлоза НРМС, особенно НРМС 2910 5 мПа. Другие соответствующие пленкообразующие полимеры также могут использоваться по изобретению, включая гидроксипропилцеллюлозу и сополимеры метакрилатакрилата. Помимо пленкообразующего полимера, пленочная оболочка может дополнительно включать пластификатор (например, пропиленгликоль) и необязательно пигмент (например, диоксид титана). Покрывающая пленочная суспензия также может содержать тальк в качестве антиадгезивного вещества. В таблетках с непосредственным высвобождением по настоящему изобретению пленочная оболочка тонка и в расчете на массу составляет меньше чем около 3% (мас./мас.) от общей массы таблетки. Предпочтительными дозированными формами являются формы, в которых масса частиц составляет по крайней мере 40% от общей массы полной дозированной формы, масса растворителя находится в пределах от 20 до 40%, и масса дезинтегрирующих веществ находится в пределах от 3 до 10%, остальное составляют один или несколько инертных наполнителей, описанных выше. Настоящее изобретение далее относится к процессу получения частиц, как описано выше, характеризующемуся смешиванием компонентов, экструзией указанной смеси при температуре в пределах от 20 до 300 С, измельчением экструдата и, необязательно, просеиванием частицы. Изобретение также относится к твердым дисперсиям, получаемым путем экструзии расплава (а) соединения формулы (I-A), (I-B) или (I-C) или одного из его стереоизомеров или смеси двух или нескольких его стереоизомеров, и (с) одного или нескольких фармацевтически приемлемых водорастворимых полимеров. К другому объекту изобретения относится способ получения фармацевтической дозированной формы, как описано выше, заключающийся в смешивании терапевтически эффективного количества частиц, как описано выше, с фармацевтически приемлемыми инертными наполнителями и прессовании указанной смеси в таблетки или наполнении указанной смесью капсул. Далее, изобретение относится к частицам, как описано выше, для использования в получении фармацевтической дозированной формы для перорального приема млекопитающим, страдающим вирусной инфекцией, где предпочтительно такая единичная дозированная форма может вводится один раз в день указанному млекопитающему. Настоящее изобретение также относится к применению частиц в соответствии с вышеописанным,для получения фармацевтической дозированной формы для перорального приема млекопитающим, страдающим вирусной инфекцией, где предпочтительно такая единичная дозированная форма может вводится один раз в день указанному млекопитающему. Изобретение также относится к способу лечения вирусной инфекции у млекопитающего, который включает введение указанному млекопитающему эффективного противовирусного количества соединения формулы (I-A), (I-B) или (I-C), предпочтительно в единичной дозированной форме для пероарального приема, которая может вводиться один раз в день.- 24005423 Изобретение также относится к фармацевтическому набору, пригодному для коммерческого использования, включающему емкость, дозированную форму для перорального приема соединения формулы (I-A), (I-B) или (I-C), как описано выше, и относящейся к указанному набору инструкции. Следующие примеры предназначены для иллюстрации настоящего изобретения. Экспериментальная часть 1. Соединения формулы (I-A). 1. А. Получение промежуточных соединений. Пример 1. А 1. а) Раствор 2,6-дихлорбензилхлорида (0,102 моль) в 1,1-диэтиловом эфире (10 мл) по каплям добавляли к магнию (0,102 моль) в 1,1-диэтиловом эфире (60 мл). Реакцию инициировали прибавлением 2 капель 1,2-дибромэтана. После того как большая часть магния исчезала, добавляли 2,4,6-трихлорпиримидин (0,051 моль) в 1,1-диэтиловом эфире (30 мл). Смесь перемешивали в течение ночи при комнатной температуре. Растворитель упаривали и осадок очищали флэш-хроматографией на колонке с силикагелем (элюент: CH2Cl2/гексан 1/2). Желаемые фракции собирали и растворитель упаривали с получением 3,3 г (21%) 2,4-дихлор-6- [(2,6-дихлорфенил)метил]пиримидина (промежуточное соединение 1; точка плавления (т.пл.): 106-107 С).b) Промежуточное соединение (1) (0,0081 моль) в 2-пропаноле (100 мл) нагревали до полного растворения. Затем раствор помещали в пробирку под высоким давлением и барботировали туда газообразный NН 3 в течение 20 мин. Потом смесь нагревали до 80 С в течение 16 ч. Растворитель упаривали с получением остатка двух соединений: 2-хлор-6-[(2,6-дихлорфенил)метил]-4-пиримидинамина (промежуточное соединение 2) и 4-хлор-6-[(2,6-дихлорфенил)метил]-2-пиримидинамина (промежуточное соединение 3). Пример 1. А 2.(1 М; 0,040 моль; 40 мл) добавляли мочевину (0,03 моль). Реакционную смесь перемешивали и нагревали с обратным холодильником в течение ночи. Растворитель упаривали, добавляли воду и смесь нейтрализовывали 0,3 н. НОАс. Осадок фильтровали и далее обрабатывали эфиром и потом Н 2 О, затем фильтровали и сушили с получением 2,2 г (39%) 6-[(2,6-дихлорфенил)метил]-5-метил-2,4(1 Н,3H)-пиримидиндиона (промежуточное соединение 4).b) Смесь промежуточного соединения (4) (0,0095 моль) и фосфорилхлорида (50 мл) перемешивали и нагревали с обратным холодильником в течение ночи. Затем упаривали избыток фосфорилхлорида. К осадку добавляли ледяную воду. Полученный белый осадок фильтровали и сушили. Осадок очищали флэш-хроматографией на колонке с силикагелем (элюент: CH2Cl2). Желаемые фракции собирали и растворитель упаривали с получением 2,06 г (67%) 2,4-дихлор-6-[(2,6-дихлорфенил)метил]-5-метилпиримидина (промежуточное соединение 5).c) 4-Хлор-6-[(2,6-дихлорфенил)метил]-5-метил-2-пиримидинамин (промежуточное соединение 6) и 2-хлор-6-[(2,6-дихлорфенил)метил]-5-метил-4-пиримидинамин (промежуточное соединение 7) получали из промежуточного соединения 5, следуя способу, описанному в примере A1b. Пример 1. A3.(20 мл) сначала добавляли по каплям раствор натрия (0,013 моль) в этаноле (10 мл), а затем диэтиловый эфир пропанодиовой кислоты (0,0109 моль). Реакционную смесь перемешивали и нагревали с обратным холодильником в течение 4 ч и затем перемешивали при комнатной температуре в течение ночи. После добавления еще одного эквивалента диэтилового эфира пропанодиовой кислоты (при перемешивании и нагревании с обратным холодильником в течение ночи) растворитель упаривали и остаток растворяли в воде и подкисляли 1 н. НСl. Твердый продукт фильтровали, промывали водой и сушили с получением 0,87 г (76,4%) 2-[(2,6-дихлорфенил)метил]-4,6-пиримидиндиола (промежуточное соединение 8).b) 6-Хлор-2-[(2,6-дихлорфенил)метил]-4-пиримидинамин (промежуточное соединение 9) получали из промежуточного соединения 8 в соответствии со способами, описанными в примере A1b, A2b и А 2 с. Пример 1. А 4. К раствору промежуточного соединения (1) (0,008 моль) в 1,4 диоксане (20 мл) добавляли 4-амино 1-бутанол (1,57 мл) в атмосфере аргона. Реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Растворитель упаривали. Остаток очищали флэш-хроматографией на колонке с силикагелем (градиент элюента: CH2Cl2/CH3OH: от 100/0 до 98/2). Чистые фракции собирали и растворитель упаривали с получением 2,05 г смеси 4-2-хлор-6-[(2,6-дихлорфенил)метил]-4-пиримидинил]амино]-1 бутанола (промежуточное соединение 10) и 4-4-хлор-6-[(2,6-дихлорфенил)метил]-2-пиримидинил] амино]-1-бутанола (промежуточное соединение 11). Пример 1. А 5. а) Гидроксид калия/этанол (10%; 0,035 моль) добавляли к раствору 2,6-дихлорфенола (0,035 моль) в тетрагидрофуране (100 мл). Смесь перемешивали и добавляли 2,4,6-трихлорпиримидин (0,044 моль). Смесь перемешивали в течение ночи при 60 С. Реакцию проводили с помощью 1 н. раствора NaOH. Водные слои экстрагировали с EtOAc несколько раз и затем органические слои объединяли и промывали 3 н.NaOH и насыщали NaCl, сушили и концентрировали. Осадок перекристаллизовывали из СН 2 Сl2/гексан. Осадок фильтровали и сушили с получением 5,98 г 2,4-дихлор-6-(2,6-дихлорфенокси)пиримидина (55%)(0,0830 моль). Реакционную смесь перемешивали и нагревали с обратным холодильником в течение 4 дней и растворитель упаривали. Осадок растворяли в CH2Cl2, промывали насыщенным растворомNаНСО 3, затем сушили (Na2SO4), фильтровали и растворитель упаривали с получением 17,1 г твердого осадка. Это твердое вещество растворяли в СН 2 Сl2:гексане (1:1; 150 мл) и полученный раствор концентрировали до 100 мл, затем фильтровали. Осадок очищали колоночной хроматографией на KP-Sil (элюент: CH2Cl2). Желаемые фракции собирали и растворитель упаривали. Менее полярную фракцию перемешивали в CH2Cl2 в течение 3 ч и фильтровали с получением 0,44 г 4-хлор-N-(2,4,6-триметилфенил)-2 пиримидинамина (промежуточное соединение 10). Вторую фракцию перекристаллизовывали из ацетонитрила, фильтровали и сушили с получением 2-хлор-N-(2,4,6-триметилфенил)-4-пиримидинамина(промежуточное соединение 14). Пример 1. А 6. Пиридин (1 мл) добавляли к смеси 4-4-амино-6-[(2,6-дихлорфенил)метил]-2-пиримидинил] амино]бензонитрил (0,00135 моль) в СН 2 Сl2 (19 мл). Раствор хлорэтаноилхлорида (0,001375 моль) в СН 2 С 12 (0,5 мл) добавляли по каплям в ванну со льдом. Смесь перемешивали при комнатной температуре в течение 2 ч. Вновь добавляли хлорэтаноилхлорид (0,00625 моль) в CH2Cl2 (0,5 мл). Смесь оставляли в холодильнике на ночь. Растворитель упаривали. Осадок обрабатывали насыщенным раствором Na2CO3 и смесь экстрагировали CH2Cl2. Выделенный органический слой сушили, фильтровали и концентрировали. Осадок очищали флэш-хроматографией на колонке с силикагелем (элюент:СН 2 Сl2/СН 3 ОН/NН 4OН 99/1/0,1). Желаемые фракции собирали и растворитель упаривали с получением 0,22 г (36,%) 2-хлор-N[6-[(2,6-дихлорфенил)метил]-2-[(4-цианофенил)амино]-4-пиримидинил]ацетамида промежуточное соединение 13). Пример 1. А 7. Смесь 4-[(4-хлор-2-пиримидинил)амино]бензонитрила (0,005 моль) и нитрилтетрафторбората(0,0025 моль) в ацетонитриле (5 мл) перемешивали при комнатной температуре в течение 4 ч. Материал гасили насыщенным бикарбонатом (50 мл) на измельченном льду. Смесь оставляли нагреваться до комнатной температуры и желтое твердое вещество фильтровали. Твердое вещество адсорбировали двуокисью кремния и очищали колоночной хроматографией (элюент: 30%, 50%, 60%, 70% СН 2 Сl2 в гексане). Растворитель желаемой фракции упаривали и остаток сушили с получением 0,89 г (64%) 3-нитро-4-[(4 хлор-2-пиримидинил)амино]бензонитрила (промежуточное соединение 15). Пример 1. А 8. Смесь 2,6-дихлор-N-(2,4,6-триметилфенил)-4-пиримидинамина (0,00376 моль) в 2,0 М растворе NН 3 в 2-пропаноле (25 мл) и 0,5 М раствора NН 3 в диоксане (25 мл) нагревали в образце под давлением при 110-115 С в течение 24 ч. Растворитель упаривали и осадок хроматографировали на Biotage (элюент: 1:1CH2Cl2: гексан). Желаемые фракции собирали, и растворитель упаривали с получением смеси 0,523 г 2 хлор-N4-(2,4,6-триметилфенил)-4,6-пиримидиндиамина (промежуточное соединение 53) и 0,101 г 6 хлор-N4-(2,4,6-триметилфенил)-2,4-пиримидиндиамина (промежуточное соединение 16). Пример 1. А 9. а) 2,4,6-трихлор-1,3,5-триазин (0,07440 моль) и тетрагидрофуран (100 мл) объединяли и охлаждали до -75 С в атмосфере Ar. Добавляли 4-аминобензонитрил (0,07440 моль) и раствор перемешивали в течение 4 ч при -75 С. Добавляли по каплям триэтиламин (0,07440 моль) и реакционную смесь оставляли медленно нагреваться до комнатной температуры и перемешивали в течение 3 дней. После добавления 1,4-диоксана (100 мл), полученный осадок собирали фильтрацией, промывали тетрагидрофураном и сушили с получением 12,74 г 4-[(4,6-дихлор-1,3,5-триазин-2-ил)амино]бензонитрила (промежуточное соединение 17).b) NaH (0,0113 моль), СН 3 СN (30 мл) и 2,6-дихлорфенол (0,0113 моль) объединяли и перемешивали в течение 15 мин в атмосфере Ar. Добавляли промежуточное соединение (17) (0,0113 моль) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь гасили ледяной водой (30 мл) и фильтровали. Осадок получали в фильтрате и фильтровали. Полученное твердое вещество промывали Н 2O и СН 3 СN, затем сушили с получением 0,62 г (14,0%) 4-4-хлор-6-(2,6 дихлорфенокси)-1,3,5-триазин-2-ил]амино]бензонитрила (промежуточное соединение 18).(0,00714 моль) в 1,4-диоксане (20 мл) в струе Ar. Добавляли раствор промежуточного соединения (17)(0,00714 моль) в 1,4-диоксане (5 мл). Реакционную смесь перемешивали и нагревали с обратным холодильником в течение 24 ч. Растворитель упаривали и добавляли CH2Cl2. Органический слой промывали насыщенным водным раствором NaHCO3 и полученный осадок фильтровали с получением 0,56 г (21,1%) 4-4-хлор-6-[(2-хлор-6-метилфенил)амино]-1,3,5-триазин-2-ил]амино]бензонитрила- 26005423 Пример 1. А 10. а) 2,4,6-Трихлор-1,3,5-триазин (0,0266 моль) добавляли к 1,4-диоксану (50 мл) в атмосфере Ar. Раствор перемешивали, пока он не стал гомогенным, затем добавляли 2,6-дихлорбензоламин (0,0266 моль) иK2 СО 3 (0,0362 моль). Реакционную смесь перемешивали при комнатной температуре в течение 3 дней. Растворитель упаривали. Воду добавляли к осадку и водную фазу экстрагировали СН 2 Сl2. Выделенный органический слой промывали соляным раствором, сушили карбонатом калия, фильтровали и фильтрат упаривали с получением 7,52 г (91,2%) N-(2,6-дихлорфенил)-4,6-дихлор-1,3,5-триазин-2-амина (промежуточное соединение 20).b) 1,4-Диоксан (50 мл), 4-цианоанилин (0,0243 моль) и N,N-диизопропилэтиламин (0,0243 моль) добавляли к промежуточному соединению (20) (0,0243 моль) в атмосфере Аr. Реакционную смесь перемешивали и нагревали с обратным холодильником в течение 1 недели. Реакцию охлаждали, растворитель упаривали и осадок растворяли в этилацетате. Органическую фазу промывали насыщенным растворомNaHCO3 и с соляным раствором, сушили карбонатом калия, фильтровали и растворитель упаривали. Осадок перемешивали в смеси CH2Cl2 и насыщенного NaHCO3 и осадок фильтровали с получением 2,26 г (23,8%) 4-4-хлор-6-[(2,6-дихлорфенил)амино]-1,3,5-триазин-2-ил]амино]бензонитрила (промежуточное соединение 21). Пример 1. A11. Смолу Rink Amide (15 г; Calbiochem-Novabiochem corp., San Diego, California; Product No. 01-640013) промывали в реакторе с CH2Cl2 (100 мл), добавляли N,N-диметилформамид (200 мл) и N,Nдиметилформамид : пиперидин (150 мл : 50 мл). Смесь перемешивали в течение 2 ч, промывали N,Nдиметилформамидом, CH2Cl2 и диметилсульфоксидом. Добавляли промежуточное соединение (17) (0,06 моль), N,N-диизопропилэтиламин (10,5 мл) и диметилсульфоксид (200 мл) и реакционную смесь перемешивали в течение трех дней, затем промывали с N,N-диметилформамидом и CH2Cl2 с получением связанного со смолой промежуточного соединения (17). 1. В. Получение соединений формулы (I-A). Пример 1. В 1. Смесь(1.А 4) (0,004 моль) и 4-аминобензонитрил (0,0084 моль) объединяли в герметичной трубке и нагревали в течение 16 ч при 160 С в атмосфере аргона. Реакционную смесь охлаждали до комнатной температуры и растворяли в CH2Cl2/CH3OH 90/10 (20 мл) и добавляли 5 г силикагеля. После выпаривания растворителя осадок очищали флэш-хроматографией на колонке с силикагелем (градиент растворителя для элюирования: СН 2 Сl2/СН 3 ОН: от 100/0 до 97/3). Желательную фракцию собирали и растворитель упаривали с получением 0,31 г (18,1%) 4-4-[(2,6-дихлорфенил)метил]-6-[(3-гидроксипропил)амино]-2-пиримидинил]амино]бензонитрила (соединение 4). ( указывает номер примера, в соответствии с которым промежуточное соединение синтезировалось). Пример 1. В 2.(0,00399 моль) и 4-аминобензонитрил (0,0012 моль) в 1-метил-2-пирролидиноне (3 мл) перемешивали в течение 16 ч при 130 С в атмосфере аргона. Затем реакционную смесь охлаждали до комнатной температуры и гасили Н 2 О (200 мл). Получали осадок путем перемешивания в течение 16 ч и отделения фильтрацией через целит. Осадок растворяли в СН 3 ОН/СН 2 Сl2 (10%, 200 мл), сушили над K2 СО 3, фильтровали и упаривали. Этот полученное вещество затем очищали флэш-хроматографией на колонке с силикагелем (градиент элюента: CH2Cl2/CH3OH от 100/0 до 95/5). Желательную фракцию собирали и растворитель упаривали с получением 0,43 г (21,7%) 4-6-[(2,6-дихлорфенил)метил]-2-3-(2-оксо-1 пирролидинил)пропил]амино]-4-пиримидинил]амино]бензонитрила (т.пл. 104-114 С). Пример 1. В 3.(0,00277 моль) в 1-метил-2-пирролидиноне (4 мл) в атмосфере N2. Реакционную смесь нагревали в течение 5 мин. Затем добавляли 4-аминобензонитрил (0,0061 моль) и реакцию нагревали при 100 С в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры и разбавляли этилацетатом (10 мл). Органический слой промывали NaOH (1N; 2100 мл), H2O (2100 мл), насыщенным солевым раствором (50 мл) соответственно, сушили, фильтровали и фильтрат упаривали. Сырой материал очищали флэш-хроматографией (элюент: 2,5-7,5% СН 3 ОН, содержащий 10% NH4OH в СН 2 Сl2). Желаемые фракции собирали и растворитель упаривали. Осадок сушили с получением 0,160 г (12,0%) 4-4-[(2,6 дихлорфенил)метил]-6-2-(1-пирролидинил)этил]амино]-2-пиримидинил]амино]бензонитрила (соединение 14; т.пл. 80-85 С). Пример 1. В 4. Суспензию(0,015 моль) вводили с помощью шприца. Реакционную смесь интенсивно перемешивали в течение двух часов. Реакционную смесь повторно охлаждали до 0 С и гасили NaOH (aq. 1 н., 25 мл). Двухфазная частично гашеная смесь давала осадок, который фильтровали и сушили, получая 2,5 г (91%) 4-4-[(2,6 дихлорфенил)метил]-6-(гидроксиамино)-2-пиримидинил]амино]бензонитрил дигидробромидпентагидрат (соединение 12; т.пл. 240-244 С). Пример 1. В 5. 1,1-Диметокси-N,N-диметилметанамин (0,152 моль) добавляли к 4-4-амино-6-[(2,6-дихлорфенил)метил]-2-пиримидинил]амино]бензонитрилу (0,0008 моль). Смесь перемешивали при комнатной температуре в течение 2 дней и затем концентрировали. Сырой продукт очищали флэш-хроматографией на колонке с силикагелем (элюент: СН 2 Сl2/СН 3 ОН 99/1). Желаемую фракцию собирали и растворитель упаривали. Полученный осадок растирали с гексаном с получением 0,15 г (42%) N'-[2-[(4-цианофенил)амино]-6-[(2,6-дихлорфенил)метил]-4-пиримидинил]-N,N-диметилметанимидамида (т.пл. 175180 С). Пример 1. В 6. Пиперидин (0,12 мл) добавляли к смеси промежуточного соединения (13) (0,00047 моль) в тетрагидрофуране (20 мл). Смесь перемешивали при комнатной температуре в течение 4 ч. Вновь добавляли пиперидин (0,14 мл). Смесь перемешивали в течение дополнительных 2 ч. Растворитель упаривали. Осадок очищали флэш-хроматографией на колонке с силикагелем (СН 2 Сl2/СН 3 ОН/NН 4OН 99/1/0,1). Желаемые фракции собирали и растворитель упаривали с получением 0,05 г (21,5%) N-[6-[(2,6-дихлорфенил)метил]-2-[(4-цианофенил)амино]-4-пиримидинил]-1-пиперидинацетамида (т.пл. 175-180 С). Пример 1. В 7. Пиридин (0,014 моль) добавляли к смеси 4-4-амино-6-[(2,6-дихлорфенил)метил]-2-пиримидинил]амино]бензонитрила (0,0013 моль) в СН 2 Сl2. Добавляли по каплям раствор октаноилхлорида (1,5 экв.) в СН 2 Сl2 (0,5 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Вновь добавляли по каплям октаноилхлорид (3,5 экв.) в СН 2 Сl2. Смесь перемешивали. Затем растворитель упаривали. Осадок обрабатывали насыщенным водным раствором NаНСО 3 и смесь экстрагировали СН 2 Сl2. Выделенный органический слой сушили, фильтровали и растворитель упаривали с получением сырого продукта. Осадок перекристаллизовывали из СНСl3 и гексана с получением 0,443 г (68,6%) N-[6-[(2,6 дихлорфенил)метил]-2-[(4-цианофенил)амино]-4-пиримидинил]октанамида (т.пл. 135-137 С). Пример 1. В 8. а) Смесь промежуточного соединения 14 (0,082 моль) и 5,4 н. НСl и 2-пропанола (0,086 моль) в воде(300 мл) перемешивали и нагревали до 40-45 С в течение 30 мин. Добавляли 4-аминобензонитрил (0,242 моль) при 40-45 С. Реакционную смесь перемешивали и нагревали с обратным холодильником в течение 4,5 ч, затем охлаждали до комнатной температуры. Смесь подщелачивали, добавляя порциями NаНСО 3.- 28005423 Эту смесь экстрагировали этилацетатом. Органический слой выделяли, промывали соляным раствором,сушили, фильтровали и растворитель упаривали. Эту фракцию перемешивали в этаноле р.а. (100 мл),фильтровали, промывали этанолом (50 мл), затем сушили с получением 23,1 г (86%) 4-4-[(2,4,6 триметилфенил)амино]-2-пиримидинил]амино]бензонитрила (соединение 17).b) Смесь 4-[(4-хлор-2-пиримидинил)амино]бензонитрила (0,021 моль) и НСl в 2-пропаноле (0,0095 моль) в воде (30 мл) перемешивали в течение одного часа при 45 С. Добавляли 4-амино-3,5-диметилбензонитрил (0,025 моль), и реакционную смесь перемешивали и нагревали с обратным холодильником в течение ночи. Смесь охлаждали до комнатной температуры, затем нейтрализовали NаНСО 3. Эту смесь экстрагировали этилацетатом. Выделенный органический слой промывали соляным раствором, сушили,фильтровали и упаривали растворитель. Осадок перекристаллизовывали из СН 3 СN, фильтровали и сушили. Осадок перемешивали в кипящем СН 2 Сl2 (20 мл), затем фильтровали и сушили. Осадок перекристаллизовывали из метилизобутилкетона, фильтровали и сушили с получением 0,3 г 4-2[(цианофенил)амино]-4-пиримидинил]амино]-3,5-диметилбензонитрила (соединение 25). Пример 1. В 9. а) 4-[(4-Хлор-2-пиримидинил)амино]бензонитрил (0,003 моль), 2,6-дибром-4-метилбензоламин(0,006 моль) и 1 М НСl в диэтиловом эфире (4,5 мл) в 1,4-диоксане (10 мл) объединяли в пробирке, и нагревали в атмосфере Аr до полного испарения диэтилового эфира. Пробирку герметизировали и нагревали при 170 С в течение 2,5 дней. Добавляли силикагель и растворитель упаривали. Осадок очищали флэш-хроматографией на колонке с силикагелем (градиент растворителя для элюирования: СН 2 Сl2:СН 3 ОН:МН 4OН 100:0:0 - 99:0,9:0,1). Желаемые фракции собирали и растворитель упаривали. Остаток перекристаллизовывали из ацетонитрила, фильтровали и сушили с получением 0,22 г (15,9%) 4([4-[(2,6-дибром-4-метилфенил)амино]-2-пиримидинил]амино]бензонитрила.CH2Cl2 и 1 н. NaOH, и смесь перемешивали в течение 1 ч и фильтровали с получением коричневого твердого вещества . Фильтрат СН 2 Сl2 отделяли и упаривали и очищали флэш-хроматографией на колонке с силикагелем (элюент: 2% СН 3 ОН/СН 2 Сl2). Желаемые фракции объединяли, упаривали и осадок перемешивали в CH2Cl2. Твердый осадок фильтровали, смешивали с коричневым твердым веществоми перекристаллизовывали из СН 3 СN. Осадок фильтровали и сушили с получением 1,57 г (29%) 4-2-[(4 цианофенил)амино]-5-метил-4-пиримидинил]амино]-3,5-диметилбензонитрила (соединение 52).c) 2-[(4-Цианофенил)амино]-4-пиримидинилтрифторметансульфонат (0,0022 моль) и 2,6-дихлор-4(трифторметил)бензоламин (0,0044 моль) объединяли в 1,4-диоксане (2,5 мл) и нагревали в герметичной пробирке в атмосфере Аr при 170 С в течение 40 ч. Реакционную смесь охлаждали до комнатной температуры. Добавляли силикагель и растворитель упаривали. Осадок очищали флэш-хроматографией на колонке с силикагелем (градиент растворителя для элюирования: CH2Cl2:СН 3 ОН:NH4OH 100:0:0 97:2,7:0,3). Желаемые фракции собирали и растворитель упаривали. Осадок перекристаллизовывали из СН 3 СN, фильтровали и сушили с получением 0,086 г (9,2%) 4-4-2,6-дихлор-4-(трифторметил) фенил]амино]-2-пиримидинил]амино]бензонитрила (соединение 23). Пример 1. В 10. К суспензии NaH (0,006 моль) в 1,4-диоксане (30 мл) добавляли 2,4,6-триметилфенол (0,006 моль). Смесь перемешивали в течение 15 мин при комнатной температуре с получением прозрачого раствора. Добавляли 4-[(4-хлор-2-пиримидинил)амино]бензотрил (0,004 моль) и реакционную смесь нагревали при кипении с обратным холодильником в атмосфере аргона в течение 15 ч. Реакционную смесь охлаждали до комнатной температуры, добавляли 0,5 мл воды, затем 4 г силикагеля и растворитель упаривали. Осадок очищали флэш-хроматографией на колонке с силикагелем (градиент растворителя для элюирования: СН 2 Сl2:СН 3 ОН 100:0:0 - 97:3). Чистые фракции собирали и растворитель упаривали с получением 1,18 г(89,4%) 4-4-(2,4,6-триметилфенокси)-2-пиримидинил]амино]бензонитрила (соединение 20). Пример 1. В 11. 4-4-[(2,4,6-Триметилфенил)амино]-2-пиримидинил]амино]бензонитрил (0,0015 моль) перемешивали в кипящем этаноле (8 мл). Добавляли 6 М НСl в 2-пропанол (0,0015 моль), и соль оставляли кристаллизоваться в течение ночи при комнатной температуре. Осадок фильтровали, промывали 2 пропанолом и сушили с получением 0,47 г (86%) 4-4-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрилхлоргидрата (1:1) (соединение 31). Пример 1. В 12. Смесь 4-4-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрила (0,00303 моль) иNaBO34H2O (0,00911 моль) в СН 3 ОН (30 мл) и Н 2 О (10 мл) перемешивали и нагревали с обратным холодильником в течение 4 дней. Реакционную смесь охлаждали. Осадок фильтровали и осадокочищали флэш-хроматографией на колонке с силикагелем (элюент: СН 2 Сl2/СН 3 ОН градиент от 100/0 до 95/5). Желаемые фракции собирали и растворитель упаривали с получением 0,586 г (56%) [4-4-[(2,4,6 триметилфенил)амино]-2-пиримидинил]амино]бензамида (соединение 40). Фильтраточищали жидкостной хроматографией высокого разрешения с обратной фазой (ЖХВР) (градиент растворителя для- 29005423 элюирования: 0,5% аммонийацетата в Н 2 О)/СН 3 СN 90/10)/CH3OH/CH3CN (0 мин) 75/25/0, (44 мин) 0/50/50, (57 мин) 0/0/100, (61,1-70 мин) 75/25/0). Три желаемые фракционные группы собирали, и их растворитель упаривали, получая 0,18 г 4-4-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино] бензамид, N3-оксид (соединение 49) и 0,030 г 4-4-[(2,4,6-триметилфенил)амино]-2-пиримидинил] амино]бензамид, N1-оксид. Пример 1. В 13. а) Смесь 4-4-хлор-6-[(2,4,6-триметилфенил)амино]-1,3,5-триазин-2-ил]амино]бензонитрила (А 9 с)(0,00137 моль) и NН 3 в 1,4-диоксане (0,5 М; 0,00548 моль) нагревали в сосуде под давлением в 100 С в течение 6 дней. Растворитель упаривали и осадок растворяли в CH2Cl2, промывали насыщенным водным раствором NаНСО 3, сушили, фильтровали и растворитель упаривали. Осадок очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 100/0, 99/1 и 98/2). Желаемые фракции собирали и растворитель упаривали. Осадок перекристаллизовывали из толуола. Осадок фильтровали и сушили с получением 0,29 г (61,4%) 4-4-амино-6-[(2,4,6-триметилфенил)амино]-1,3,5-триазин-2-ил]амино] бензонитрила.b) Как альтернатива для получения этого соединения, смесь 4-4-хлор-6-[(2,4,6 триметилфенил)амино]-1,3,5-триазин-2-ил]амино]бензонитрила (0,0230 моль) и NН 3 в 2-пропаноле(2,0 М; 60 мл) и NН 3 в 1,4-диоксане (0,5 М.; 20 мл) нагревали при 95 С в течение 21 ч. Растворитель упаривали. Осадок растворяли в этилацетате, промывали 1 н. NaOH, воде и насыщенном солевом растворе,сушили, фильтровали и фильтрат упаривали. Осадок перекристаллизовывали ацетонитрилом с получением 5,25 г (66,1%) 4-4-амино-6-[(2,4,6-триметилфенил)амино]-1,3,5-триазин-2-ил]амино]бензонитрила.(0,00150 моль) и 0,5 М NН 3 в 1,4-диоксане (0,015 моль) добавляли в колбу под давлением. Реакционную смесь нагревали до 40 С. После 5 дней реакцию охлаждали до комнатной температуры. Добавляли 2,0 МNН 3 в 2-пропаноле (0,015 моль) и реакцию доводили до 40 С. Реакцию разбавляли диэтиловым эфиром и экстрагировали холодным 1 М NaOH. Водный слой экстрагировали еще два раза и органические фазы объединяли. Нерастворимый материал фильтровали и промывали диэтиловым эфиром, который растворял большую часть материала в фильтрат. Фильтрат объединяли с органическими фазами и этот раствор сушили, фильтровали и растворитель упаривали. Осадок очищали флэш-хроматографией на колонке с силикагелем, элюируя 4:1 CH2Cl2:диэтиловый эфир до 100% диэтилового эфира. Полученный материал перекристаллизовывали в тетрагидрофуран/СН 3 СN, фильтровали и сушили с получением 0,36 г (67%) 44-амино-6-[(2,4,6-триметилфенил)азо]-1,3,5-триазин-2-ил]амино]бензонитрила. Пример 1. В 14. О-(Триметилсилил)гидроксиламин (0,0282 моль) добавляли к(1.А 10b) (0,00282 моль) в 1,4-диоксане (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 дней. Растворитель упаривали. Осадок растворяли в этилацетате, промывали 1 н. НСl, промывали насыщенным водным раствором NaHCO3 и насыщенным солевым раствором, сушили,фильтровали и растворитель упаривали. Осадок очищали колоночной хроматографией на силикагеле I) градиент растворителя для элюирования: СН 2 Сl2/СН 3 ОН от 98/2 до 96/4 и (II) градиент растворителя для элюирования: CH2Cl2/CH3OH 100/0, 99/1 и 98/2). Желаемые фракции собирали и растворитель упаривали. Осадок перекристаллизовывали из ацетонитрила. Осадок фильтровали и сушили с получением 0,32 г(29,2%) 4-6-(2,6-дихлорфениламино)-4-(гидроксиламино)]-1,3,5-триазин-2-ил]амино]бензонитрила. Пример 1. В 15. Тетрагидрофуран (10 мл) и 2,5-диметилфенол (0,00818 моль) добавляли к NaH (0,00859 моль). Смесь перемешивали в течение 30 мин при комнатной температуре. Затем добавляли раствор промежуточного соединения (17) (0,00818 моль) в тетрагидрофуране (100 мл). Реакционную смесь перемешивали в течение 16 ч. Затем растворитель упаривали и добавляли NН 3 в 1,4-диоксане (50 мл). Полученную реакционную смесь перемешивали в течение 16 ч. Растворитель упаривали и полученный остаток обрабатывали H2O/CH2Cl2, перемешивали и фильтровали. Получали осадок в фильтрате и фильтровали с получением 0,42 г фракции 1. Полученный фильтрат сушили над K2 СО 3 и концентрировали. Осадок очищали флэш-хроматографией на колонке с силикагелем (элюент: СН 3 ОН/СН 2 Сl2 2,5/97,5). Желаемые фракции собирали и растворитель упаривали с получением 2,89 г фракции 2. Фракции 1 и 2 объединяли и пере- 30
МПК / Метки
МПК: A61K 9/14
Метки: противовирусные, композиции
Код ссылки
<a href="https://eas.patents.su/30-5423-protivovirusnye-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Противовирусные композиции</a>
Предыдущий патент: Соединения для лечения ишемии
Следующий патент: Способы лечения связанного с bcl-2 нарушения с использованием bcl-2-антисмысловых олигомеров
Случайный патент: Котел-утилизатор


































