Азабициклические соединения, способ их получения и их применение в качестве лекарственных средств, в частности, в качестве антибактериальных средств
Номер патента: 4920
Опубликовано: 28.10.2004
Авторы: Роулендс Дэвид Ален, Фроментэн Клод, Асзоди Жозеф, Лампила Максим
Формула / Реферат
1. Соединение общей формулы (I) или одна из его солей с основанием или с кислотой
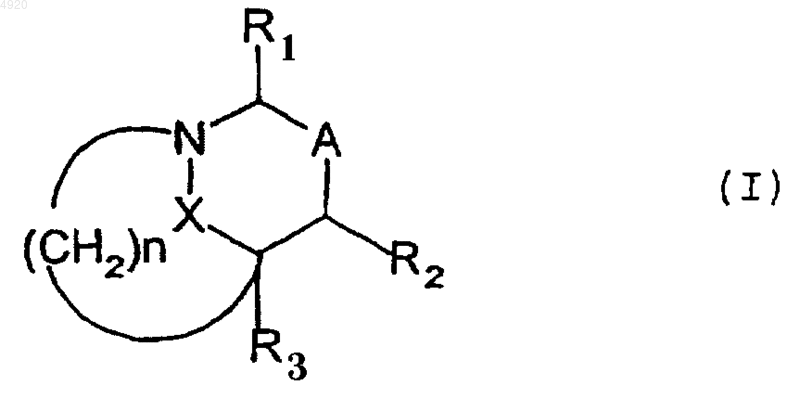
в которой
R1 означает атом водорода, радикал COOH, CN, COOR, CONR6R7, (CH2)n'R5 или радикал
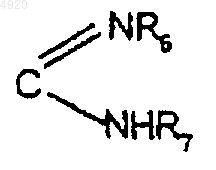
где R выбирают из группы, состоящей из алкила с 1-6 атомами углерода, возможно замещенного пиридилом или карбамоилом; -CH2-алкенила, содержащего в целом 3-9 атомов углерода; арила с 6-10 атомами углерода или аралкила с 7-11 атомами углерода, причем арильное или аралкильное ядро может быть замещено радикалом OH, NH2, NO2, алкилом с 1-6 атомами углерода, алкоксилом с 1-6 атомами углерода или одним или несколькими атомами галогена;
R6 и R7, одинаковые или разные, выбирают из группы, состоящей из атома водорода, алкила с 1-6 атомами углерода, арила с 6-10 атомами углерода и аралкила с 7-11 атомами углерода, возможно замещенных карбамоилом, уреидогруппой или диметиламиногруппой, и замещенного пиридилом алкила с 1-6 атомами углерода;
n' равно 1 или 2;
R5 выбирают из группы, состоящей из радикала COOH, CN, OH, NH2, CO-NR6R7, COOR, OR, OCOH, OCOR, OCOOR, OCONHR, OCONH2, NHR, NHCOH, NHCOR, NHSO2R, NH-COOR, NH-CO-NHR или NHCONH2, причем R, R6 и R7 имеют вышеуказанные значения;
R2 означает атом водорода или группу (CH2)n'1R5, где n'1 равно 0, 1 или 2 и R5 имеет вышеуказанное значение;
R3 означает атом водорода или алкил с 1-6 атомами углерода;
A означает связь между двумя атомами углерода, несущими радикалы R1 и R2, или группу
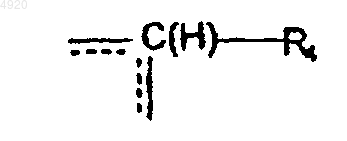
где R4 означает атом водорода или группу (CH2)n'1R5, причем n'1 и R5 имеют вышеуказанные значения, пунктирная линия означает возможную связь с одним или другим из атомов углерода, несущих заместители R1 и R2;
n равно 1 или 2;
X означает двухвалентную группу -C(O)-B-, связанную с атомом азота с помощью атома углерода; где
B означает двухвалентную группу -O-(CH2)n"-, связанную с карбонилом с помощью атома кислорода; группу -NR8-(CH2)n"- или -NR8-O-, связанную с карбонилом с помощью атома азота; n" равно 0 или 1; и R8 выбирают из группы, состоящей из атома водорода, радикала OH, R, OR, Y, OY, Y1, OY1, Y2, OY2, Y3, OCH2CH2SOmR, OSiRaRbRc и SiRaRbRc, причем Ra, Rb и Rc означают индивидуально линейный или разветвленный алкил с 1-6 атомами углерода или арил с 6-10 атомами углерода, R имеет вышеуказанное значение и m равно 0, 1 или 2;
Y выбирают из группы, состоящей из радикалов COH, COR, COOR, CONH2, CONHR, CONHOH, CONHSO2R, CH2COOH, CH2COOR, CH2CONHOH, CH2CONHCN, CH2-тетразолил, защищенный CH2-тетразолил, CH2SO3H, CH2SO2R, CH2PO(OR)2, CH2PO(OR)(OH), CH2PO(R)(OH) и CH2PO(OH)2;
Y1 выбирают из группы, состоящей из радикалов SO2R, SO2NHCOH, SO2NHCOR, SO2NHCOOR, SO2NHCONHR, SO2NHCONH2 и SO3H;
Y2 выбирают из группы, состоящей из радикалов PO(OH)2, PO(OR)2, PO(OH) (OR) и PO(OH)(R);
Y3 выбирают из группы, состоящей из тетразолила, замещенного радикалом R тетразолила, скварат-радикала, NH- или NR-тетразолила, замещенного радикалом R NH- или NR-тетразолила, NHSO2R и NRSO2R, причем R имеет вышеуказанное значение; имея в виду, что, когда n равно 1 и A означает группу
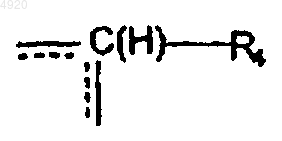
в которой R4 означает атом водорода, и либо X означает группу -C(O)-O-(CH2)n", в которой n" равно 0 или 1, либо X означает группу -CO-NR8- (CH2)n", в которой n" равно 1 и R8 означает изопропил, либо X означает группу -CO-NR8-(CH2)n", в которой n" равно 0 и R8 означает атом водорода или фенил, тогда R1, R2 и R3 все три одновременно не могут означать атом водорода.
2. Соединение по п.1, отличающееся тем, что n равно 1.
3. Соединение по п.1 или 2, отличающееся тем, что A означает группу
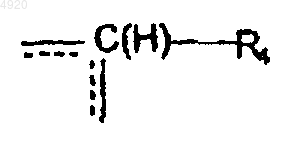
определенную в п.1.
4. Соединение по п.3, отличающееся тем, что R4 означает атом водорода.
5. Соединение по любому из пп.1-4, отличающееся тем, что X означает двухвалентную группу -CO-B-, в которой B означает группу -NR8-(CH2)n"-, определенную в п.1.
6. Соединение по любому из пп.1-5, отличающееся тем, что группа R8 означает группу Y1 или OY1, в которой Y1 выбирают из групп SO2R, SO2NHCOR, SO2NHCOOR, SO2NHCONHR и SO3H и R является таким, как определен в п.1.
7. Соединения формулы (I) по п.1, выбранные из группы, содержащей
транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3,2,1]октан-2-карбоксамид и его соли с основаниями, в частности натриевая соль;
транс-7-оксо-N-(фенилметил)-6-(сульфокси)-1,6-диазабицикло[3,2,1]октан-2-карбоксамид и его соли с основаниями, в частности натриевая соль;
транс-7-оксо-N-(4-пиридинилметил)-6-(сульфокси)-1,6-диазабицикло[3,2,1]октан-2-карбоксамид и его соли с основаниями, в частности натриевая соль;
транс-7-оксо-N-(3-пиридинилметил)-6-(сульфокси)-1,6-диазабицикло-[3,2,1]октан-2-карбоксамид и его соли с основаниями, в частности натриевая соль;
транс-7-оксо-N-(2-амино-2-оксоэтил)-6-(сульфокси)-1,6-диазабицикло[3,2,1]октан-2-карбоксамид и его соли с основаниями, в частности натриевая соль;
фенилметил-транс-7-оксо-6-(сульфокси)-1,6-диазабицикло-[3,2,1]октан-2-карбоксилат.
8. Способ получения соединения по любому из пп.1-7, отличающийся тем, что он включает
(a) стадию, в течение которой соединение формулы (II)
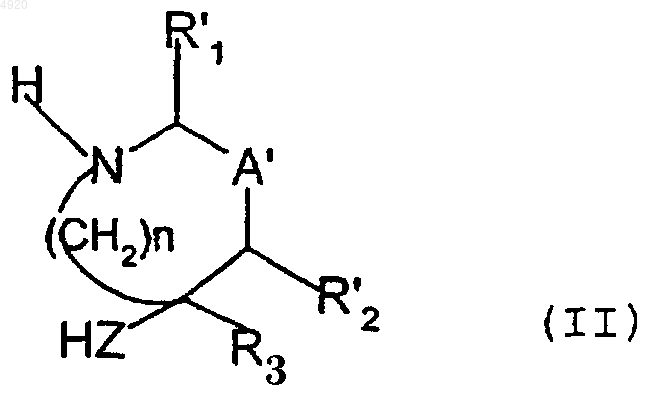
в которой
R'1 означает атом водорода или радикал CN, защищенный COOH, COOR', (CH2)n'R'5, CONR6R7 или защищенный радикал
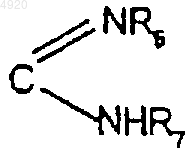
где n', R6 и R7 имеют значения по п.1 и
R' и R'5 имеют, соответственно, значения, указанные для R и R5 в п.1, в которых возможно имеющиеся реакционноспособные группы защищены;
R'2 означает атом водорода или группу (CH2)n'1R'5, где n'1 имеет значение, указанное в п.1, и R'5 имеет вышеуказанное значение;
R3 имеет указанное в п.1 значение;
A' означает связь между двумя атомами углерода, несущими радикалы R'1 и R'2, или группу
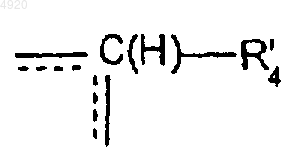
где R'4 означает атом водорода или группу (CH2)n'1R'5, причем n'1 и R'5 имеют вышеуказанные значеншя, пунктирная линия означает возможную связь с одним или другим из атомов углерода, несущих заместители R'1 и R'2;
n имеет указанное в п.1 значение;
HZ означает группу HO-(CH2)n"-, HNR'8-(CH2)n"- или HNR'8-O-, причем n" имеет вышеуказанное значение и R'8 означает атом водорода, защищенный гидроксил, R', OR', радикал Y' или OY', причем Y' выбирают из групп COH, COR', COOR', CONH2, CONHR', защищенная CONHOH, CONHSO2R', защищенная CH2COOH, CH2COOR', защищенная CH2CONHOH, CH2CONHCN, замещенный радикалом R' CH2-тетразолил, CH2SO2R', CH2PO(OR')2, защищенная CH2SO3, защищенная CH2PO(OR')OH, защищенная CH2PO(R')OH, защищенная CH2PO(OH)2; радикал Y'1 или OY'1, причем Y'1 выбирают из групп SO2R', SO2NHCOH, SO2NHCOR', SO2NHCOOR', SO2NHCONH2, SO2NHCONHR' и защищенная группа SO3H; радикал Y'2 или OY'2, причем Y'2 означает защищенную группу PO(OH)2, защищенную группу PO(OH)(OR'), защищенную группу PO(OH)R' или группу PO(OR')2; или радикал Y'3, причем Y'3 выбирают из защищенного тетразолила, замещенного радикалом R' тетразолила, защищенного NH- или NR'-тетразолила, замещенного радикалом R' NH- или NR'-тетразолила, NHSO2R' и NR'SO2R', где R' имеет вышеуказанное значение;
вводят во взаимодействие с карбонилирующим агентом, в случае необходимости, в присутствии основания, с целью получения промежуточного соединения формулы (III)
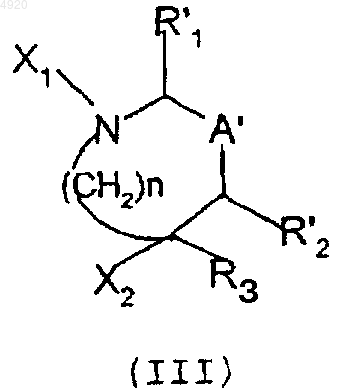
в которой R'1, R'2, R3, A' и n имеют вышеуказанные значения и либо X1 означает атом водорода и X2 означает группу -Z-CO-X3, где X3 означает остаток карбонилирующего агента, либо X2 означает группу -ZH и X1 означает группу CO-X3, где X3 имеет вышеуказанное значение;
(b) стадию, в течение которой полученное выше промежуточное соединение циклизуют в присутствии основания; и
(c) в случае необходимости перед стадией (a) и/или после стадии (b) осуществляют одну или несколько следующих реакций в соответствующем порядке: защита реакционноспособных функциональных групп; удаление защитных групп от реакционноспособных функциональных групп; этерификация; омыление; сульфатация; фосфатация; амидирование; ацилирование; сульфонилирование; алкилирование; введение двойной связи; образование карбамидной группы; введение тетразолила; восстановление карбоновых кислот; дегидратация амида до нитрила; солеобразование; ионообмен; расщепление или разделение диастереоизомеров; окисление серы до сульфоксида и/или сульфона.
9. Способ по п.8, отличающийся тем, что карбонилирующий агент выбирают из группы, состоящей из фосгена, дифосгена, трифосгена, арил-, аралкил-, алкил- и алкенилхлорформиатов, алкилдикарбонатов, карбонилдиимидазола и их смесей.
10. Способ по п.8 или 9, отличающийся тем, что реакцию карбонилирования проводят в присутствии основания.
11. Способ по п.10, отличающийся тем, что основанием является амин.
12. Способ по п.8, отличающийся тем, что в стадии (b) основание выбирают из группы, состоящей из аминов, гидридов, алкоголятов, амидов или карбонатов щелочных или щелочно-земельных металлов.
13. Лекарственное средство, представляющее собой продукт формулы (I), указанный по п.1, а также его соли с фармацевтически приемлемыми кислотами и основаниями.
14. Лекарственное средство, представляющее собой продукт, определенный по любому из пп.2-7, а также его соли с фармацевтически приемлемыми кислотами и основаниями.
15. Фармацевтическая композиция, содержащая в качестве действующего начала по меньшей мере одно лекарственное средство по любому из пп.13 или 14.
16. Соединение общей формулы (III) или одна из его солей с кислотой, в частности его гидрохлорид

в которой R'1, R'2, R3, A', n, X1 и X2 имеют такие же значения, как указанные в п.8.
Текст
1 Изобретение относится к новым гетероциклическим соединениям, к способу их получения и их применению в качестве лекарственных средств, в частности, в качестве антибактериальных средств. В журнале J. Org. Chem., 37,5, 697-699(1972) описано, в частности, получение бициклического производного брутто-формулыC10H18N2O. В журнале J. Org. Chem., 45,26, 53255326 (1980) описано, в частности, получение бициклических производных брутто-формул С 6 Н 9NO2 и C7H11NO2. В обзоре, опубликованном в Chemical Reviews, 83,5, 549-555 (1983), описано, в частности, получение бициклических производных брутто-формул C10H18N2O И C7H12N2O. В журнале Angew. Chem. Int. Ed., 39,3,625-628 (2000) описано, в частности, получение соединения брутто-формулы C12H12N2O. В этих документах нет никакой информации о конкретном использовании этих соединений в области терапии. Объектом изобретения являются соединения, отвечающие следующей формуле (I): где R выбирают из группы, состоящей из алкила с 1-6 атомами углерода, возможно замещенного пиридилом или карбамоилом; -СН 2 алкенила в целом с 3-9 атомами углерода; арила с 6-10 атомами углерода или аралкила с 7-11 атомами углерода, причем арильное или аралкильное ядро может быть замещено радикалом ОН, NH2, NO2, алкилом с 1-6 атомами углерода,алкоксилом с 1-6 атомами углерода или одним или несколькими атомами галогена;R6 и R7, одинаковые или разные, выбирают из группы, состоящей из атома водорода, алкила с 1-6 атомами углерода, арила с 6-10 атомами углерода и аралкила с 7-11 атомами углерода,возможно замещенных карбамоилом, уреидогруппой или диметиламиногруппой, и замещенного пиридилом алкила с 1-6 атомами углерода;R5 выбирают из группы, состоящей из радикала СООН, CN, ОН, NH2, CO-NR6R7, COOR,OR, OCOH, OCOR, OCOOR, OCONHR,OCONH2, NHR, NHCOH, NHCOR, NHSO2R,NH-COOR, NH-CO-NHR или NHCONH2, причем R, R6 и R7 имеют вышеуказанные значения;R2 означает атом водорода или группуR3 означает атом водорода или алкил с 1-6 атомами углерода; А означает связь между двумя атомами углерода, несущими радикалы R1 и R2, или группу где R4 означает атом водорода или группу(CH2)n'1R5, причем n'1 и R5 имеют вышеуказанные значения, пунктирная линия означает возможную связь с одним или другим из атомов углерода, несущих заместители R1 и R2;X означает двухвалентную группу -С(О)В-, связанную с атомом азота с помощью атома углерода; где В означает двухвалентную группуR8 выбирают из группы, состоящей из атома водорода, радикала ОН, R, OR, Y, OY, Y1,OY1, Y2, OY2, Y3, OCH2CH2SOmR, OSiRaRbRc иSiRaRbRc, причем Ra, Rb и Rc означают индивидуально линейный или разветвленный алкил с 1-6 атомами углерода или арил с 6-10 атомами углерода, R имеет вышеуказанное значение и m равно 0, 1 или 2;Y выбирают из группы, состоящей из радикалов СОН, COR, COOR, CONH2, CONHR,CONHOH, CONHSO2R, CH2COOH, CH2COOR,CH2CONHOH, CH2CONHCN, СН 2-тетразолил,защищенный СН 2-тетразолил,CH2SO3H,CH2SO2R,CH2PO(OR)2,CH2PO(OR)(ОН),CH2PO(R)(OH) и CH2PO(OH)2;Y1 выбирают из группы, состоящей из радикалов SO2R, SO2NHCOH, SO2NHCOR,SO2NHCOOR, SO2NHCONHR, SO2NHCONH2 иY2 выбирают из группы, состоящей из радикалов РО(ОН)2, PO(OR)2, PO(OH)(OR) и 3 водорода или фенил, тогда R1, R2 и R3 все три одновременно не могут означать атом водорода. Объектом изобретения являются также соли этих соединений, которые могут быть получены с основаниями или неорганическими или органическими кислотами, а также внутренние соли, в форме которых, в случае необходимости, могут находиться некоторые соединения. Асимметрические атомы углерода, содержащиеся в соединениях формулы (I), независимо друг от друга, могут находиться в конфигурации R, S или RS, и, следовательно, объектом изобретения являются также соединения формулы (I), находящиеся в форме чистых энантиомеров или чистых диастереоизомеров или в форме смеси энантиомеров, в частности, в виде рацематов или смесей диастереоизомеров. Из вышеуказанного следует, что заместители R1, R2, R4, каждый в отдельности, с одной стороны, и X, с другой стороны, могут находиться в цис- и/или транс-положении по отношению к циклу, с которым они связаны, и, следовательно, объектом изобретения являются соединения формулы (I), находящиеся в форме цис- или транс-изомеров или смесей. Под алкилом с 1-6 атомами углерода понимают метил, этил, пропил, изопропил, а также линейный или разветвленный бутил, пентил или гексил. Под -СН 2-алкенилом с 3-9 атомами углерода понимают, например, аллил или бутенил,пентенил или гексенил. Под арилом с 6-10 атомами углерода понимают фенил или нафтил. Под аралкилом с 7-11 атомами углерода понимают бензил, фенетил или метилнафтил. Под алкилоксигруппой с 1-6 атомами углерода понимают, в частности, метоксигруппу,этоксигруппу, пропоксигруппу, изопропоксигруппу, а также бутоксигруппу, изобутоксигруппу,втор-бутоксигруппу или третбутоксигруппу. Под атомом галогена понимают атом фтора, хлора, брома или иода. Под скварат-радикалом понимают радикал формулы(I) можно назвать наряду с другими соли, образованные с неорганическими кислотами, такими как соляная кислота, бромоводородная кислота,иодоводородная кислота, серная кислота или фосфорная кислота, или с органическими кислотами, такими как муравьиная кислота, уксусная кислота, трифторуксусная кислота, пропионовая кислота, бензойная кислота, малеиновая кислота, фумаровая кислота, янтарная кислота, винная кислота, лимонная кислота, щавелевая кислота, глиоксиловая кислота, аспараги 004920 4 новая кислота, алкансульфокислоты, такие как метансульфокислота и этансульфокислота,арилсульфокислоты, такие как бензолсульфокислота и п-толуолсульфокислота. Из солей с основаниями продуктов формулы (I) можно назвать наряду с другими соли,образованные с неорганическими основаниями,такими как, например, гидроксид натрия, гидроксид калия, гидроксид лития, гидроксид кальция, гидроксид магния или гидроксид аммония,или с органическими основаниями, такими как,например, метиламин, пропиламин, триметиламин, диэтиламин, триэтиламин, N,N-диметилэтаноламин, трис(гидроксиметил)аминометан,этаноламин, пиридин, пиколин, дициклогексиламин, морфолин, бензиламин, прокаин, лизин,аргинин, гистидин, N-метилглюкамин, или же фосфониевые соли, такие как алкилфосфониевые, арилфосфониевые, алкиларилфосфониевые, алкениларилфосфониевые соли, или четвертичные аммониевые соли, такие как тетра-нбутиламмониевая соль. Из соединений формулы (I) объектом изобретения являются особенно соединения, в которых n равно 1, а также соединения, где А означает группу описанную выше, и, в частности, среди них такие, в которых R4 означает атом водорода. Из соединений формулы (I) объектом изобретения являются, в частности, соединения, в которых X означает двухвалентную группу -СОВ-, в которой В означает группу -NR8-(СН 2)n"-,описанную выше, и из них, более конкретно,соединения, в которых R8 означает группу Y1 или OY1, в которой Y1 имеет вышеуказанное значение. Из соединений формулы (I) изобретение относится более конкретно к следующим соединениям: транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3,2,1]октан-2-карбоксамид и его соли с основаниями, в частности, натриевая соль; транс-7-оксо-N-(фенилметил)-6-(сульфокси)1,6-диазабицикло[3,2,1]октан-2-карбоксамид и его соли с основаниями, в частности, натриевая соль; транс-7-oксо-N-(4-пиридинилметил)-6(сульфокси)-1,6-диазабицикло[3,2,1]октан-2 карбоксамид и его соли с основаниями, в частности, натриевая соль; транс-7-оксо-N-(3 пиридинилметил)-6-(сульфокси)-1,6-диазабицикло[3,2,1]октан-2-карбоксамид и его соли с основаниями, в частности, натриевая соль; транс-7-окco-N-(2-амино-2-оксоэтил)-6-(сульфокси)-1,6-диазабицикло[3,2,1]октан-2-карбоксамид и его соли с основаниями, в частности,натриевая соль; фенилметил-транс-7-оксо-6(сульфокси)-1,6-диазабицикло-[3,2,1]октан-2 карбоксилат. Другим объектом изобретения является способ получения соединений формулы (I). 5 Этот способ заключается в том, что осуществляют (а) стадию, на которой соединение формулы (II)R'1 означает атом водорода или радикал где n' , R6 и R7 имеют вышеуказанные значения иR' и R'5 имеют, соответственно, значения,указанные выше для R и R5, в которых возможно имеющиеся реакционноспособные группы защищены;R'2 означает атом водорода или группуR3 имеет вышеуказанные значения; А' означает связь между двумя атомами углерода, несущими радикалы R'1 и R'2, или группу где R'4 означает атом водорода или группу(CH2)n'1R'5, причем n'1 и R'5 имеют вышеуказанные значения, пунктирная линия означает возможную связь с одним или другим из атомов углерода, несущих заместители R'1 и R'2;HZ означает группу НО-(СН 2)n"-, HNR'8(СН 2)n"- или HNR'8-O-, причем n" имеет вышеуказанное значение и R'8 означает атом водорода, защищенный гидроксил, R', OR', радикал Y' или OY',причем Y' выбирают из групп СОН, COR', COOR',CONH2, CONHR', защищенная CONHOH, CONHSO2R', защищенная СН 2 СООН, CH2COOR', защищенная CH2CONHOH, CH2CONHCN, замещенный радикалом R' СН 2-тетразолил, CH2SO2R',CH2PO(OR')2, защищенная CH2SO3, защищеннаяY'1 выбирают из групп: SO2R', SO2NHCOH,SO2NHCOR',SO2NHCOOR',SO2NHCONH2,SO2NHCONHR' и защищенная группа SО 3 Н; радикал Y'2 или OY'2, причем Y'2 означает защищенную группу РО(ОН)2,защищенную группуPO(OH)(OR'), защищенную группу PO(OH)R' или группу PO(OR')2; или радикал Y'3, причем Y'3 выбирают из защищенного тетразолила, замещенного радикалом R' тетразолила, защищенного NH- или 6 вводят во взаимодействие с карбонилирующим агентом, в случае необходимости, в присутствии основания, для получения промежуточного соединения формулы (III) в которой R'1, R'2, R3, А' и n имеют вышеуказанные значения и либо X1 означает атом водорода и Х 2 означает группу -Z-CO-Х 3, где Х 3 означает остаток карбонилирующего агента, либо Х 2 означает группу -ZH и X1 означает группу СО-Х 3,где Х 3 имеет вышеуказанное значение;(b) стадию, на которой полученное промежуточное соединение циклизуют в присутствии основания; и при этом(c) при желании, стадии (а) предшествует и/или за стадией (b) следует одна или несколько следующих реакций в соответствующем порядке: защита реакционноспособных функциональных групп; удаление защитных групп от реакционноспособных функциональных групп; этерификация; омыление; сульфатация; фосфатация; амидирование; ацилирование; сульфонилирование; алкилирование; введение двойной связи; образование карбамидной группы; введение тетразолильной группы; восстановление карбоновых кислот; дегидратация амида до нитрила; солеобразование; ионообмен; расщепление или разделение диастереоизомеров; окисление серы до сульфоксида и/или сульфона. В качестве карбонилирующего агента можно использовать реагент, такой как фосген,дифосген, трифосген, арилхлорформиат, такой как фенилхлорформиат или п-нитрофенилхлорформиат, аралкилхлорформиат, такой как бензилхлорформиат, алкил- или алкенилхлорформиат, такой как метил- или аллилхлорформиат,алкилдикарбонат, такой как трет-бутилдикарбонат, карбонилдиимидазол и их смеси. Реакцию проводят предпочтительно в присутствии основания или смеси оснований, которое (которая) нейтрализует образующуюся кислоту. Основанием, в частности, может быть амин, такой как триэтиламин, диизопропилэтиламин, пиридин, диметиламинопиридин. Однако можно также работать при использовании исходного продукта формулы (II) в качестве основания. Этот продукт тогда используют в избытке. Этот вариант приводится в экспериментальной части. В случае необходимости продукт формулы(II) используют в форме соли с кислотой, как,например, гидрохлорид или трифторацетат. В качестве основания в стадии (b) можно также использовать амины или же гидриды,алкоголяты, амиды или карбонаты щелочных или щелочно-земельных металлов. Амины мо 7 гут быть выбраны, например, из вышеприведенного перечня. В качестве гидрида можно использовать, в частности, гидрид натрия или калия. В качестве алкоголята щелочного металла предпочтительно используют трет-бутилат калия. В качестве амида щелочного металла можно использовать, в частности, бис(триметилсилил)амид лития. В качестве карбоната можно использовать, в частности, карбонат или гидрокарбонат натрия или калия. В случае необходимости промежуточное соединение формулы (III) может быть получено в форме соли с кислотой, образующейся во время реакции карбонилирования, и, в частности, в виде гидрохлорида. Его затем используют в реакции циклизации в этой форме. В случае необходимости реакцию циклизации можно осуществлять без выделения промежуточного соединения формулы (III). Указанные в стадии (с) реакции представляют собой, как правило, хорошо известные специалисту классические реакции. Реакционноспособными функциональными группами, которые, в случае необходимости,надо защищать, являются карбоксильные группы, аминогруппы, амидные группы, гидроксильные группы или гидроксиламиногруппы. Защиту кислотной функциональной группы осуществляют, в частности, в форме сложных алкиловых, аллиловых, бензиловых, бензгидрильных или п-нитробензиловых эфиров. Удаление защитных групп осуществляют путем омыления, кислотного гидролиза, гидрогенолиза или же расщепления с помощью растворимых комплексов палладия-(0). Примеры этих защит и удалений защитных групп приводятся ниже в экспериментальной части. Защиту аминов и амидов осуществляют, в частности, в форме бензилированных производных, в форме карбаматов, в частности, аллил-,бензил-, фенил- или трет-бутилкарбамата, или же в форме силилированных производных, таких как трет-бутилдиметилсилильные, триметилсилильные, трифенилсилильные или же дифенил-трет-бутилсилильные производные. Удаление защитных групп в зависимости от природы защитной группы осуществляют с помощью натрия или лития в жидком аммиаке, путем гидрогенолиза или с помощью растворимых комплексов палладия-(0), путем воздействия кислоты или путем воздействия тетрабутиламмонийфторида. Примеры приводятся ниже в экспериментальной части. Защиту гидроксиламинов осуществляют, в частности, в форме простых бензиловых или аллиловых эфиров. Расщепление простых эфиров осуществляют путем гидрогенолиза или с помощью растворимых комплексов палладия(0). Этот метод иллюстрируется в экспериментальной части. Защиту спиртов осуществляют классическим образом в форме простых эфиров, слож 004920 8 ных эфиров или карбонатов. Простыми эфирами могут быть простые алкиловые или алкоксиалкиловые эфиры, предпочтительно простые метиловые или метоксиэтоксиметиловые эфиры,простые арильные или предпочтительно аралкиловые, например, бензиловые эфиры или простые силилированные эфиры, например, вышеуказанные силилированные производные. Сложными эфирами могут быть любые, известные специалисту, расщепляемые сложные эфиры и предпочтительно ацетат, пропионат или бензоат или п-нитробензоат. Карбонаты могут представлять собой, например, метил-, третбутил, аллил-, бензил- или п-нитробензилкарбонат. Удаление защитных групп осуществляют известными специалисту способами, как, в частности, омыление, гидрогенолиз, расщепление с помощью растворимых комплексов палладия-(0), гидролиз в кислой среде или же, в случае силилированных производных, обработка тетрабутиламмонийфторидом. Примеры приводятся в экспериментальной части. Реакцию сульфатации осуществляют путем воздействия комплексов SО 3-амины, таких как SО 3-пиридин или SO3-диметилформамид,работая в пиридине, причем образовавшаяся соль, например соль пиридина, затем может быть обменена на соль другого амина, четвертичную аммониевую соль или соль щелочного металла. Примеры приводятся в экспериментальной части. Реакцию фосфатации осуществляют, например, путем воздействия хлорфосфата, такого как диметил-, дибензил- или дифенилхлорфосфат. Реакцию амидирования осуществляют, исходя из карбоновой кислоты, с помощью активатора, такого как алкилхлорформиат или EDCI,путем воздействия гидроксида аммония или соответствующего амина или их солей с кислотами. Примеры приводятся ниже в экспериментальной части. Реакции ацилирования и сульфонилирования осуществляют при использовании гидроксимочевин путем воздействия, соответственно,галоидангидрида или ангидрида соответствующей карбоновой кислоты или галоидангидрида соответствующей сульфокислоты. Несколько примеров приводится ниже в экспериментальной части. Реакцию алкилирования осуществляют путем воздействия на гидроксилированные производные алкилгалогенида или замещенного алкилгалогенида, в частности, с помощью свободного или этерифицированного карбоксильного радикала. Пояснения приводятся ниже в экспериментальной части. Возможное конечное введение двойной связи, которая тогда предпочтительно находится между атомами углерода, несущими радикалы R4 и R1, осуществляют путем воздействия галогенированного производного селена, затем 9 окисления, согласно известным специалисту способам. Пример приводится ниже в экспериментальной части. Образования карбамидной группы, которая относится к заместителю R8, достигают предпочтительно путем воздействия соответствующего изоцианата на свободную NH-группу. Пример приводится ниже в экспериментальной части. Введение тетразолильной группы осуществляют путем воздействия защищенного или замещенного галогенированного, предпочтительно фторированного, производного тетразола. Удаление защитных групп может быть осуществлено путем гидрогенолиза. Восстановление кислот в спирты может быть осуществлено путем воздействия борана или через промежуточный смешанный ангидрид путем воздействия боргидрида щелочного металла. Смешанный ангидрид получают, например, с помощью алкилхлорформиата. Иллюстрация этой реакции дана в экспериментальной части. Дегидратацию амида до образования нитрила можно осуществлять в условиях реакций карбонилирования и циклизации. Окисление сульфидов с образованием сульфоксида и/или сульфона можно осуществлять путем воздействия надкислоты, такой как м-хлорнадбензойная кислота или надфталевая кислота, или любого другого реагента, известного специалисту. Солеобразование с помощью кислот, в случае необходимости, реализуют путем добавления кислоты в растворимой форме к соединению. Солеобразование с помощью оснований может касаться либо соединений с кислотной группой, в частности, с карбоксильной группой,либо кислот с сульфоксигруппой или группой,происходящей от фосфорной кислоты, либо кислот, включающих гетероцикл с кислотным характером. В первом случае действуют путем добавления соответствующего основания, такого, как вышеописанные основания. Во втором случае пиридиниевую соль получают непосредственно во время воздействия комплекса SO3 пиридин и другие соли получают из этой пиридиниевой соли. В том или другом случае можно действовать путем ионообмена при использовании смолы. Примеры солеобразований представлены ниже в экспериментальной части. Разделение знантиомеров и диастереоизомеров может быть осуществлено известными специалисту методами, в частности, путем хроматографии. Кроме синтеза вышеописанными способами, соединения формулы (I), разумеется, могут быть получены способами, в которых используют в качестве исходных соединений соединение формулы (II), в которой R'1, А', R'2, R3 и HZ имеют значения, которые приводят прямо (без 10 превращения) к таким значениям соединений,которые желают получить. В случае необходимости, те значения, которые включают реакционноспособные функциональные группы, указанные выше, защищают, а удаление защитных групп осуществляют в конце стадии циклизации(b) или в любой другой подходящий для этого момент синтеза. Введение и удаление защитных групп тогда осуществляют, как описано выше. Такие способы представлены ниже в экспериментальной части. Продукты общей формулы (I) обладают очень хорошей антибиотической активностью в отношении грамположительных бактерий, таких как стафилококки. Особенно значительной является их эффективность в отношении грамотрицательных бактерий, в частности, в отношении колиобразных бактерий. Эти свойства позволяют использовать вышеуказанные продукты, а также их фармацевтически приемлемые соли с кислотами и основаниями, в качестве лекарственных средств при лечении заболеваний, вызванных чувствительными к медикаментам микроорганизмами, и, в частности, при лечении стафилококковых инфекций, таких как стафилококковые сепсисы,злокачественные стафилококковые инфекции лица или кожи, пиодермиты, септические или гноящиеся раны, карбункулы, флегмоны, рожистые воспаления, острые первичные или постгриппозные стафиллококковые инфекции,бронхопневмонии, легочные нагноения. Эти продукты также могут быть использованы в качестве лекарственных средств в случае лечения коли-бактериозов и сопутствующих инфекций, инфекций, вызываемых Proteus,клебсиеллой и сальмонеллой, и при лечении других заболеваний, вызванных грамотрицательными бактериями. Следовательно, объектом настоящего изобретения является также применение в качестве лекарственных средств и, в частности, в качестве антибиотических лекарственных средств продуктов формулы (I), указанной выше, а также их фармацевтически приемлемых солей с кислотами и основаниями. Более предпочтительно объектом изобретения является применение в качестве лекарственных средств продуктов формулы (I), указанной выше, в которой n равно 1, а также продуктов, в которых А означает группу указанную выше, и, в частности, соединений, в которых R4 означает атом водорода. В частности, объектом изобретения является применение, в качестве лекарственных средств, соединений формулы (I), в которой X означает двухвалентную группу -СО-В, в которой В означает группу -NR8- (CH2)n"-, указанную выше, и более конкретно, соединений, в 11 которых R8 означает группу Y1 или OY1, в которой Y1 имеет вышеуказанное значение. Из соединений формулы (I) еще более конкретно можно назвать в качестве лекарственных средств, следующие соединения: транс 7-оксо-6-(сульфокси)-1,6-диазабицикло[3,2,1] октан-2-карбоксамид и его соли с основаниями,в частности, натриевая соль; транс-7-оксо-N(фенилметил)-6-(сульфокси)-1,6-диазабицикло[3,2,1]октан-2-карбоксамид и его соли с основаниями, в частности, натриевая соль; транс-7 оксo-N-(4-пиридинилметил)-6-(сульфокси)-1,6 диазабицикло[3,2,1]октан-2-карбоксамид и его соли с основаниями, в частности, натриевая соль; транс-7-оксо-N-(3-пиридинилметил)-6(сульфокси)-1,6-диазабицикло[3,2,1]октан-2 карбоксамид и его соли с основаниями, в частности, натриевая соль; транс-7-оксо-N-(2-амино 2-оксоэтил)-6-(сульфокси)-1,6-диазабицикло[3,2,1]октан-2-карбоксамид и его соли с основаниями, в частности, натриевая соль; фенилметил-транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3,2,1]октан-2-карбоксилат. Объектом изобретения являются также фармацевтические композиции, включающие в качестве действующего начала по меньшей мере одно из соединений согласно изобретению, определенных выше. Эти композиции могут быть введены перорально, ректально, парентерально, в частности, внутримышечно, или локально путем местного нанесения на кожу и слизистые оболочки. Композиции согласно изобретению могут быть твердыми или жидкими и могут находиться в фармацевтических формах, обычно используемых в медицине человека, как, например,простые или дражированные таблетки, желатиновые капсулы, гранулы, суппозитории, препараты для инъекций, мази, кремы, гели; их можно получать обычными способами. Действующее начало или действующие начала могут быть включены в них с эксципиентами, обычно используемыми в этих фармацевтических композициях, такими как тальк, гуммиарабик, лактоза, крахмал, стеарат магния, масло какао, водные или неводные наполнители, жировые вещества животного или растительного происхождения, парафиновые производные, гликоли, различные смачиватели, диспергаторы или эмульгаторы, консерванты. Эти композиции могут находиться, в частности, в форме порошка, предназначенного для растворения в момент употребления в соответствующем растворителе, например, в стерильной апирогенной воде. Вводимая доза является изменяемой в зависимости от излечиваемого заболевания, подвергаемого лечению субъекта, пути введения и рассматриваемого продукта. Она может составлять, например, 0,250-10 г в сутки при пероральном введении человеку с использованием продукта, описанного в примере 1, или 0,25-10 г 12 в сутки при внутримышечном или внутривенном введении. Продукты формулы (I) также могут быть использованы в качестве дезинфицирующих средств для хирургических инструментов. Наконец, объектом изобретения являются новые промышленные продукты формулы (III) и, в частности, промежуточные продукты, необходимые для получения продуктов формулы (I),а также их соли с кислотами и, в частности, их гидрохлориды. Продукты формулы (II) известны или их получают известными специалисту способами. Литературные ссылки, а также способы получения приведены ниже в экспериментальной части. Следующие примеры поясняют изобретение, однако, не ограничивают его объема охраны. Примеры В нижеследующих примерах использованы следующие сокращения:EDCI: 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид ТГФ: тетрагидрофуран АИБН: 2,2'-азобисизобутиронитрил М: молекулярная молярная масса МС: масс-спектрометрия ЭУ: электронный ударFAB: бомбардировка быстрыми атомами Пример 1. Дифенилметил-цис-7-оксо-6 окса-1-азабицикло[3,2,1]октан-4-пропаноат. Смешивают 3,16 г (10,6 ммоль) гидрохлорида 3-оксо-1-(фенилметил)-4-пиперидинпропановой кислоты (М=297,7 г) (описывается в заявке на патент Японии J54098-772) со 100 мл этанола и охлаждают до температуры 10 С. В токе азота в течение 15 мин добавляют 1,84 г NaBH4,поддерживая температуру при 8-13 С. Оставляют температуру повышаться вплоть до комнатной температуры и оставляют контактировать в течение 1 ч 30 мин. Добавляют еще 380 мг NaBH4 и оставляют реакцию на всю ночь при комнатной температуре. Растворитель выпаривают при пониженном давлении, обрабатывают с помощью 50 мл воды и значение рН доводят с 10 до 2 с помощью концентрированной соляной кислоты. Снова выпаривают при пониженном давлении. Твердый остаток (примерно 10,8 г) промывают два раза с помощью 100 мл этанола,затем растворитель выпаривают при пониженном давлении. Таким образом получают 3,10 г гидрохлорида 3-гидрокси-1-(фенилметил)-4 пиперидинпропановой кислоты (М=299,7 г), что соответствует выходу 97%. 3,10 г (10,3 ммоль) полученного выше соединения разбавляют в 100 мл этанола, затем 13 добавляют к нему 900 мг предварительно гидрогенизированного 10 мас.%-ного палладия-наугле и 30 мл этанола. Всю смесь выдерживают в течение ночи в атмосфере водорода при нормальном давлении, затем катализатор удаляют путем отфильтровывания и этанол удаляют путем выпаривания при пониженном давлении. Получают 1,90 г гидрохлорида транс-3 гидрокси-4-пиперидинпропановой кислоты(М=209,6 г), или выход составляет 88%. Смешивают 1,79 г (8,54 ммоль) полученного выше соединения с 20 мл этанола и 20 мл воды. Затем добавляют концентрированный раствор гидроксида натрия вплоть до достижения значения рН примерно 8,5. После этого добавляют 1 мл аллилхлорформиата и концентрированный раствор гидроксида натрия для поддерживания значения рН от 8 до 9. Реакционную смесь экстрагируют этилацетатом, затем водную фазу подкисляют до значения рН=2 путем добавления концентрированной соляной кислоты и повторно экстрагируют этилацетатом. После высушивания и выпаривания растворителя при пониженном давлении получают 1,69 г сырого продукта, который обрабатывают смесью дихлорметана и этанола, затем отфильтровывают и растворитель снова выпаривают при пониженном давлении. Таким образом получают 1,40 г транс-3-гидрокси-1-[(2-пропенилокси)карбонил]-4-пиперидинпропановой кислоты (М=257 г), или выход составляет 60%. При температуре 0 С и в атмосфере азота,3,24 г (12,6 ммоль) вышеполученной гидроксикислоты и 6,4 г трифенилфосфина растворяют в 60 мл тетрагидрофурана. Затем добавляют 2,5 мл DEAD и спустя 15 мин реакционную смесь выпаривают при пониженном давлении, получая 12 г сырого продукта. Очищают путем хроматографии на диоксиде кремния, постепенно элюируя смесью дихлорметана и этилацетата в соотношении 9:1, 8:2, 7:3 для разделения цис- и транс-лактонов. Таким образом получают 2,72 г цис-лактона в смеси с восстановленным DEAD и фосфиноксидом. Этот продукт снова растворяют в 10 мл диметоксиэтана и добавляют 8 мл 1 н. раствора гидроксида натрия. После выдерживания в контакте в течение 1 ч реакционную смесь экстрагируют два раза этилацетатом, затем подкисляют вплоть до значения рН=2 с помощью 2 н. соляной кислоты и повторно экстагируют этилацетатом. После высушивания и выпаривания растворителя при пониженном давлении получают 1,07 г гидроксикислоты. 1,0 г сырой гидроксикислоты растворяют в смеси из 5 мл дихлорметана и 2 мл метанола,затем обрабатывают избытком дифенилдиазометана в дихлорметане вплоть до исчезновения исходного продукта. Растворитель выпаривают при пониженном давлении и продукт очищают путем хроматографии, получая 1,39 г дифенилметил-цис-3-гидрокси-1-[(2-пропенилокси)кар 004920 14 бонил]-4-пиперидинпропаноата (М=423 г), или общий выход составляет 26%. Затем, в атмосфере азота, 1,2 г (2,83 ммоль) полученного выше продукта растворяют в 23 мл дихлорметана. После этого добавляют 390 мкл уксусной кислоты, затем 860 мкл(C4H9)3SnH и 70 мг Pd[Р(С 6 Н 5)3]4. Растворитель выпаривают при пониженном давлении, получая 3,82 г сырого продукта, который промывают петролейным эфиром. Получают 1,27 г продукта, который хроматографируют на диоксиде кремния, элюируя дихлорметаном, затем смесью дихлорметана и метанола в соотношении 95:5, затем 90:10. Таким образом получают 0,87 г дифенилметил-цис-3-гидрокси-4-пиперидинпропаноата (М=339 г), или выход составляет 77%. 400 мг (1,00 ммоль) полученного выше соединения растворяют в 25 мл дихлорметана,добавляют 80 мкл дифосгена (Сl3 СОСОСl), 336 мкл триэтиламина, 144 мг DMAP. Оставляют реакцию при комнатной температуре в течение 5 ч 30 мин, затем разбавляют с помощью дихлорметана. Промывают 10%-ным водным раствором винной кислоты, затем буферным раствором фосфата натрия с рН=7, органическую фазу сушат над сульфатом натрия, после чего растворитель выпаривают при пониженном давлении. Таким образом получают 380 мг сырого продукта. Очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и этилацетата в соотношении 95:5 с 0,1% воды. Получают 184 мг указанного целевого соединения (М=365,43 г), или выход составляет 50%. 1H-ЯМР-спектр (300 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,60-1,88 (м): NCH2-CH2-CH; 2,48 (м): СН 2 СН 2-СО; 2,78 (д)-2,90 (м)-3,33-3,47 (м): CH2-NCH2; 4,50 (д): СНО-СН 2; 6,89 (с): СО 2 СН(С 6 Н 5)2; 7,33 (м): (С 6 Н 5)2. ИК-спектр (СНСl3): 1784, 1734, 1600, 1585,1496 см-1. МС (ионизация электронным распылением с образованием положительных ионов) m/z:[М]+=365. Пример 1bis. цис-7-оксо-6-окса-1-азабицикло[3,2,1]октан-4-пропановая кислота. 176 мг (0,482 ммоль) полученного выше продукта растворяют в 10 мл ацетона. Добавляют 90 мг 10 мас.%-ного палладия-на-угле. Оставляют реакцию в атмосфере водорода при нормальном давлении в течение 3 ч. Добавляют еще 25 мг катализатора и реакцию продолжают в течение 1 ч 15 мин. Катализатор отфильтровывают, затем растворитель выпаривают при пониженном давлении, получая 146 мг продукта. Снова проводят реакцию в 10 мл ацетона при использовании 35 мг 10 мас.%-ного палладияна-угле в атмосфере водорода и выдерживают дополнительно в течение 1 ч для полноты протекания реакции. Катализатор затем отфильтро 15 вывают и фильтрат выпаривают при пониженном давлении. Получают 137 мг сырого продукта, который кристаллизуют из смеси диэтилового эфира и петролейного эфира. Таким образом получают 75 мг целевого продукта (М=199 г),или выход составляет 78%. 1 Н-ЯМР-спектр (250 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,30-1,63 (м) и 1,88 (м): NCH2-CH2-CH; 2,25 (т): СН 2-СН 2-СО; 3,06 (м) и 3,38 (м): CH2N-CH2; 4,65 (д): С-СНО-СН 2; 12,08 (с): Н подвижный. ИК-спектр (вазелиновое масло): 1785, 1717 см-1. МС (FAB) m/z:[М+Н]+=200; 159. Пример 2. Дифенилметил-транс-7-оксо-6 окса-1-азабицикло[3,2,1]октан-4-ацетат. В инертной атмосфере 94 мг (0,259 ммоль) гидрохлорида дифенилметил-транс-3-гидрокси 4-пиперидинацетата (М=361,87 г) (описывается в Eur. J. Med. Chem.-Chim. Ther., 17 (6), 531-535(1982 смешивают с 7 мл дихлорметана. Охлаждают с помощью бани со льдом и инжектируют 19 мкл дифосгена. Перемешивают в течение 25 мин, затем инжектируют 72 мкл триэтиламина. Перемешивают при комнатной температуре в течение 30 мин и растворитель выпаривают при пониженном давлении. После этого обрабатывают с помощью 7 мл толуола. Добавляют 36 мкл триэтиламина, затем 31 мг DMAP. Нагревают в течение 15 мин при температуре 100 С,затем оставляют возвращаться к комнатной температуре. После этого промывают 2 раза с помощью 4 мл 10%-ного водного раствора винной кислоты, затем с помощью 4 мл водного насыщенного раствора хлорида натрия. Сушат над сульфатом магния, фильтруют и растворитель выпаривают при пониженном давлении. Получают 78 мг масла, которое хроматографируют на диоксиде кремния при использовании в качестве элюирующего средства смеси дихлорметана и этилацетата в соотношении 95:5. Таким образом получают 35,7 мг целевого соединения (М=351,405 г) в виде кристаллов белого цвета, или выход составляет 39%. Пример 2bis. транс-7-Оксо-6-окса-1 азабицикло[3,2,1]октан-4-уксусная кислота. В инертной атмосфере 38,7 мг (0,110 ммоль) полученного в примере 2 продукта смешивают с 2 мл ацетона и 38 мг катализатора 10 мас.%-ного палладия-на-угле. Помещают в атмосферу водорода при нормальном давлении. Оставляют реакцию в течение 45 мин, после чего катализатор удаляют путем отфильтровывания и растворитель выпаривают при пониженном давлении. Таким образом получают 32,6 мг сырого продукта. Перекристаллизовывают из диэтилового эфира, получая 14,2 мг кристаллов белого цвета целевого соединения(С 8 Н 10NO4 - М=185,181 г), или выход составляет 69%.(1982, 7 мл дихлорметана, 3,03 г трифенилфосфина и 22 мл тетрагидрофурана. Добавляют раствор 0,91 мл DEAD в 2,5 мл тетрагидрофурана. Оставляют реакцию в течение 3 ч 20 мин,затем добавляют 8,7 мл 1 н. раствора гидроксида натрия и перемешивают в течение 1 ч 15 мин. Реакционную смесь экстрагируют два раза этилацетатом, затем доводят до значения рН=2 с помощью 2 н. соляной кислоты. После этого экстрагируют три раза этилацетатом. Органические фазы объединяют и промывают водным насыщенным раствором хлорида натрия, затем сушат над сульфатом магния, фильтруют и растворитель выпаривают при пониженном давлении. Таким образом получают 1,37 г кристаллов белого цвета 1,1-диметилэтил-(3 а,7 а)-гексагидро-2-оксофуро[2,3-c]пиридин-6(2 Н)-карбоксилата (C12H21NO5-M=259, 304 г), или выход составляет 91%. В инертной атмосфере 1,37 г (5,28 ммоль) полученного выше соединения смешивают с 32 мл дихлорметана. Вводят избыток раствора дифенилдиазометана в дихлорметане вплоть до исчезновения исходного продукта. Затем растворитель выпаривают при пониженном давлении и таким образом получают 2,81 г сырого продукта, который очищают путем хроматографии на диоксиде кремния, используя в качестве элюирующего средства дихлорметан, затем смесь дихлорметана и этилацетата в соотношении 95:5. Получают 2,00 г дифенилметил-цис-1[(1,1-диметилэтокси)карбонил]-3-гидрокси-4 пиперидинацетата в виде кристаллов белого цвета (М=425,528 г), или выход составляет 89%. Вводят 0,6 г (1,41 ммоль) полученного выше соединения и 1,93 мл раствора хлороводорода в метаноле с концентрацией 7,3 моль/л. Перемешивают при комнатной температуре и спустя 15 мин добавляют 1 мл дихлорметана. Спустя еще 15 мин реакционную среду выпаривают при пониженном давлении. Добавляют еще дихлорметан, после чего снова выпаривают. Эту операцию повторяют несколько раз. Затем продукт кристаллизуют из диэтилового эфира. Таким образом получают 0,44 г гидрохлорида дифенилметил-цис-3-гидрокси-4-пиперидинацетата брутто-формулы(М=361,871 г), или выход составляет 86%. Эта реакция приводит также к образованию изменяемых количеств гидрохлорида лактона - (3 а,7 а)-гексагидрофуро[2,3-с]пиридин 2(3 Н)-она (М=177,6 г). В инертной атмосфере 0,28 г (0,77 ммоль) полученного выше соединения C20H23NO3HCl смешивают с 19 мл дихлорметана. При темпера 17 туре 0 С добавляют 60 мкл дифосгена и перемешивают. Спустя 25 мин вводят 0,32 мл триэтиламина. Затем добавляют 94 мг DMAP и оставляют до возвращения к комнатной температуре. Перемешивают в течение 4 ч 15 мин, после чего промывают последовательно 10%-ным водным раствором винной кислоты, затем водным насыщенным раствором хлорида натрия. После этого сушат над сульфатом магния,фильтруют и растворитель выпаривают при пониженном давлении. Таким образом получают 0,265 г целевого соединения брутто-формулыC21H21NO4 (М=351,405 г), или выход составляет 98%. 1 Н-ЯМР-спектр (250 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,82 (м): NCH2-CH2; 2,30-2,70 (м): СО-СН 2 СН; 2,93 (д)-2,99 (д) и 3,45 (м): CH2-N-CH2; 4,60(д): СН-СНО-СН 2; 6,87 (с): СО 2 СН(С 6 Н 5)2; 7,107,35 (м): (С 6 Н 5)2. ИК-спектр (СНСl3): 1786, 1734, 1600, 1587,1496 см-1. МС (SIMS) m/z: [M+Na]+=374+. Пример 3bis. цис-7-Оксо-6-окса-1-азабицикло[3,2,1]октан-4-уксусная кислота. Смешивают 55 мг (0,156 ммоль) полученного в примере 3 продукта, 3 мл этилацетата и 55 мг катализатора 10 мас.%-ного палладия-наугле. Помещают в атмосферу водорода при нормальном давлении. Оставляют реакцию в течение 1 ч 30 мин, затем катализатор отфильтровывают и растворитель выпаривают при пониженном давлении. Таким образом получают 38 мг сырого продукта, который кристаллизуют из смеси пентана и диэтилового эфира. Таким образом получают 16 мг целевого соединения в виде кристаллов белого цвета (М=185,181 г),или выход составляет 55%. 1 Н-ЯМР-спектр (250 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,63-1,86 (м) и 1,91 (м): NCH2-CH2; 2,272,49 (м) и 2,54 (дд): СО-СН 2-СН; 2,98 (д) и 3,54MC (SIMS) m/z: [M+H]+ = 186+, 167+. Пример 3ter. Метил-цис-7-оксо-6-окса-1 азабицикло[3,2,1]октан-4-ацетат. 78 мг (0,421 ммоль) полученного в примере 3bis соединения растворяют в 1 мл дихлорметана. Добавляют по каплям избыток диазометана до тех пор, пока остается желтое окрашивание, затем растворитель выпаривают при пониженном давлении. Таким образом получают 80 мг сырого продукта, который очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и этилацетата в соотношении 95:5. Таким образом получают 8,2 г целевого соединения (М=199,208 г), или выход составляет 10%.(3 а,7 а)-гексагидрофуро[2,3-c]пиридин-2(3 Н)она (М=177,6 г), полученного в примере 3, растворяют в 1 мл раствора аммиака в метаноле с концентрацией 4,17 моль/л. Перемешивают в течение 5 ч, растворитель выпаривают при пониженном давлении, затем снова добавляют 1 мл раствора аммиака в метаноле и оставляют реакцию продолжаться в течение 18 ч. Растворитель выпаривают при пониженном давлении и таким образом получают 79 мг цис-3 гидрокси-4-пиперидинацетамида бруттоформулы C7H14O2N2 (М=158 г). В инертной атмосфере 75 мг полученного выше соединения растворяют в 9 мл дихлорметана. Охлаждают на бане со льдом и вводят 30 мкл дифосгена. Выдерживают при температуре 0-5 С в течение 40 мин, после чего вводят 0,16 мл триэтиламина и, спустя 5 мин, 46 мг DMAP. Перемешивают в течение 4 ч при комнатной температуре. Промывают два раза с помощью 2 мл 10%-ного водного раствора винной кислоты,затем с помощью 2 мл водного насыщенного раствора хлорида натрия. Сушат над сульфатом магния, фильтруют, растворитель выпаривают при пониженном давлении. Таким образом получают 35 мг сырого продукта, который обрабатывают смесью этилацетата и дихлорметана в соотношении 30:70. Примеси отфильтровывают и фильтрат выпаривают при пониженном давлении. Таким образом получают 23 мг целевого соединения (М=166,18 г) в виде масла, или выход составляет около 26%. ИК-спектр (вазелиновое масло): 2241, 1777 см-1. МС (ЭУ) m/z: [М]+=166, 137, 82, 55, 42. Пример 5. 3-Бензоил-1,3-диазабицикло[2,2,1]гептан-2-он. В инертной атмосфере 1,01 г (5,43 ммоль) 1,1-диметилэтил-3-амино-1-пирролидинкарбоксилата (М=186,25 г) (описывается в международной заявке на патент WO 9801426) смешивают с 10 мл дихлорметана, раствор охлаждают до температуры 0 С, затем добавляют по каплям 0,76 мл триэтиламина. Перемешивают в течение 15 мин, поддерживая температуру 0 С, затем добавляют 0,63 мл бензоилхлорида. Оставляют до возвращения к комнатной температуре, затем разбавляют путем добавления 10 мл дихлорметана. После этого промывают с помощью 10%ного водного раствора винной кислоты, затем с помощью 10 мл воды. Сушат над сульфатом магния, фильтруют и дихлорметан удаляют путем выпаривания при пониженном давлении. Таким образом получают 1,30 г 1,1-диметилэтил-3-(бензоиламино)-1-пирролидинкарбоксилата (М=292,36 г) в виде масла желтого цвета. Соответствующий выход составляет 82%. 1,30 г (4,46 ммоль) этого соединения смешивают с 10 мл метанола. Раствор охлаждают 19 до температуры 0 С, затем постепенно вводят 6,12 мл раствора хлороводорода в метаноле с концентрацией 7,3 моль/л. После этого растворитель выпаривают при пониженном давлении. Таким образом получают 1,01 г гидрохлоридаN-(3-пирролидинил)бензамида (М=226,707 г),находящегося в виде масла каштанового цвета,или выход составляет около 100%. В инертной атмосфере 1,01 г (4,46 ммоль) полученного выше соединения смешивают с 10 мл дихлорметана. Охлаждают до температуры 0 С, затем добавляют по каплям 1,36 мл триэтиламина. Перемешивают в течение 15 мин, затем добавляют по каплям 1,44 мл дифосгена. Выдерживают при температуре 0 С в течение 30 мин, после чего оставляют до возвращения к комнатной температуре. После этого разбавляют с помощью дихлорметана, промывают 10%ным водным раствором винной кислоты, затем водой. Сушат над сульфатом магния, фильтруют и концентрируют путем выпаривания растворителя при пониженном давлении, получая 0,615 г сырого продукта. Очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и ацетона в соотношении 90:10. Таким образом выделяют 0,320 г хлорангидрида 3-(бензоиламино)-1-пирролидинкарбоновой кислоты, который кристаллизуется. Соответствующий выход составляет 28%. Затем в инертной атмосфере 0,585 г (2,31 ммоль) полученного соединения растворяют в 18 мл тетрагидрофурана. Раствор охлаждают до температуры -78 С, затем добавляют по каплям 2,55 мл 1 М раствора бис(триметилсилил)амида лития в тетрагидрофуране. Получают раствор желтого цвета, который выдерживают при температуре -78 С в течение 20 мин, затем продолжают перемешивать в течение 1 ч при повышении температуры. При температуре 0 С добавляют 350 мкл уксусной кислоты, затем 5 мл 10%-ного водного раствора винной кислоты. Разбавляют с помощью этилацетата, после чего промывают 10%-ным раствором винной кислоты, затем раствором фосфатного буфера с рН=7,затем водой. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют путем выпаривания растворителя при пониженном давлении. Таким образом получают 0,315 г сырого продукта в виде твердого вещества желтого цвета. Этот сырой продукт очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и этилацетата в соотношении 90:10. Таким образом получают 0,140 г целевого соединения C12H12N2O2 (М=216,24 г) в виде твердого вещества белого цвета, или выход составляет 28%. ИК-спектр (СНСl3): 1801, 1775, 1675; 1620,1603, 1582 см-1. МС (ионизация электронным распылением с образованием положительных ионов) m/z: 20 Пример 6. транс-6-[(Фенилметокси)карбонил]-2-оксо-1,3-диазабицикло[2,2,1]гептан-3 ацетат калия. Смешивают 1 г (3,12 ммоль М=186,25 г) 1(1,1-диметилэтил)- и 2-(фенилметил)-транс-4 амино-1,2-пирролидиндикарбоксилата (описывается в J. Org. Chem., 56, 3009-3016 (1991, 10 мл тетрагидрофурана, 560 мкл аллилбромацетата и 660 мкл триэтиламина. Оставляют реакцию при перемешивании и при комнатной температуре в течение 14 ч, затем в течение 3 ч при температуре 50 С. После этого разбавляют этилацетатом и промывают 10%-ным водным раствором винной кислоты, затем водным насыщенным раствором хлорида натрия. Органическую фазу сушат над сульфатом магния,фильтруют, после чего растворитель выпаривают при пониженном давлении. Таким образом получают 1,21 г сырого продукта, который очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и этилацетата в соотношении 80:20. Таким образом получают 0,99 мг 1-(1,1-диметилэтил)- и 2(фенилметил)-транс-4-(2-пропенилокси)карбонил]метил]амино]-1,2-пирролидиндикарбоксилата брутто-формулы C12H30N2O6 (М=418 г). К 0,99 г (2,36 ммоль) полученного выше соединения добавляют, в атмосфере азота и при температуре 0 С, 6 мл 4 М раствора хлороводорода в этилацетате. Затем оставляют реакцию при комнатной температуре в течение 15 мин. Растворитель выпаривают при пониженном давлении. Получают сырой продукт, который кристаллизуют из диэтилового эфира, получая 0,95 г дигидрохлорида фенилметил-транс-4(2-пропенилокси)карбонил]метил]амино]-2 пирролидинкарбоксилата брутто-формулыC17H23N2O42 НСl (М=394 г). 0,5 г этого продукта растворяют в 20 мл дихлорметана и добавляют 1,3 мл 2 н. раствора гидроксида натрия и 3 мл воды. Декантируют,экстрагируют дихлорметаном, сушат над сульфатом магния, затем фильтруют и растворитель выпаривают при пониженном давлении. Таким образом получают 339 мг свободного диамина. Соответствующий выход составляет 83%. 100 мг (0,314 ммоль) полученного выше диамина растворяют при температуре 0 С и в атмосфере азота в 5 мл ацетонитрила. Добавляют 21 мкл дифосгена. После контактирования в течение 15 мин, этот раствор в атмосфере азота и в течение 4 ч добавляют к нагретой до температуры 70 С смеси, содержащей 38 мг DМАР,88 мкл триэтиламина в 10 мл ацетонитрила. По окончании добавления реакционную смесь нагревают еще в течение одного часа, затем охлаждают, разбавляют этилацетатом и промывают последовательно 10%-ным водным раствором винной кислоты, затем водным насыщенным раствором хлорида натрия. После высушивания над сульфатом натрия, фильтрации и выпаривания растворителей при пониженном давлении 21 получают 58 мг сырого продукта. Этот продукт очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и этилацетата в соотношении 8:2, получая 19 мг 2 пропенил-транс-6-[(фенилметокси)карбонил]-2 оксо-1,3-диазабицикло[2,2,1]гептан-3-ацетата брутто-формулы C18H20N2O5 (М=344,57 г), или выход составляет 17%. Затем 24 мг (0,069 ммоль) полученного соединения растворяют в 250 мкл дихлорметана. В атмосфере азота вводят 3 мг Pd[P(С 6 Н 5)3]4,затем добавляют 150 мкл 0,5 М раствора 2 этилгексаноата калия в этилацетате. Спустя несколько минут выпадает осадок, который отделяют путем центрифугирования и промывают два раза с помощью 500 мкл этилацетата. Получают 24 мг целевого соединения C15H15KN2O5(М=342 г), или выход является количественным. 1 Н-ЯМР-спектр (300 МГц; диметилсульфоксид; химические сдвиги пиков в м.д. и мультиплетность): 1,83 (ддд) и 2,56: N-CH2-CHN-CH2; 2,50 и 2,79 (д): N-CH2-CHN-CH2; 3,23 (д) и 3,41 (д):J. Org. Chem., 56, 3009-3016 (1991 смешивают с 3,5 мл безводного дихлорметана для его растворения. Раствор охлаждают до температуры 0 С, затем добавляют по каплям 269 мкл триэтиламина. Перемешивают в течение 15 мин при поддерживании температуры 0 С, затем добавляют по каплям 224 мкл бензоилхлорида. После этого оставляют для повышения до 20 С в течение одного часа. Разбавляют с помощью 30 мл дихлорметана, после чего промывают 10%-ным водным раствором винной кислоты,затем насыщенным раствором гидрокарбоната натрия, потом водой. Сушат над сульфатом магния, фильтруют, концентрируют путем выпаривания дихлорметана при пониженном давлении. Таким образом получают 0,6 г масла желтого цвета, которое очищают путем хроматографии на диоксиде кремния, используя в качестве элюирующего средства смесь дихлорметана и метанола в соотношении 99:1. Таким образом выделяют 0,499 г 1-(1,1-диметилэтил)- и 2-метил-транс-4-(бензоиламино)-1,2-пирролидиндикарбоксилата брутто-формулы C18H24N2O5(М=348 г), или выход составляет 74%. Смешивают в атмосфере азота 0,400 г (1,15 ммоль) полученного выше соединения с 3 мл этилацетата для растворения соединения, затем 22 раствор охлаждают до температуры 0 С, добавляют 2,89 мл раствора хлороводорода в этилацетате с концентрацией 4 моль/л. По истечении 15 мин продолжают перемешивать при комнатной температуре в течение 1 ч. После этого растворитель удаляют путем выпаривания при пониженном давлении. Таким образом получают 0,350 г гидрохлорида метил-транс-4-(бензоиламино)-2-пирролидинкарбоксилата бруттоформулы C13H15N2O3HCl (М=284,744 г) в виде твердого вещества бежевого цвета. В атмосфере азота, 0,327 г (1,15 ммоль) полученного выше соединения смешивают с 4 мл дихлорметана. После этого суспензию охлаждают до температуры 0 С, затем добавляют 352 мкл триэтиламина. Перемешивают в течение 15 мин при температуре 0 С, затем добавляют 138 мкл дифосгена. Продолжают перемешивание в течение 5 мин при температуре 0 С,затем реакционную смесь оставляют до возвращения к комнатной температуре. Оставляют реакцию в течение 30 мин. После этого разбавляют с помощью дихлорметана и промывают 10%-ным водным раствором винной кислоты,затем водой и сушат над сульфатом магния. Фильтруют и удаляют растворитель путем выпаривания при пониженном давлении. Таким образом получают 0,360 г сырого продукта, который очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и ацетона в соотношении 95:5. Таким образом получают 93,7 мг гидрохлорида метил-транс-4(бензоиламино)-1-(хлоркарбонил)-2-пирролидинкарбоксилата (C14H14N2O4 НСl - М=310,7 4 г), или выход составляет 26%. В атмосфере азота, 93,7 мг (0,301 ммоль) полученного выше соединения смешивают с 3 мл тетрагидрофурана. Снижают температуру раствора до -78 С, затем добавляют по каплям 332 мкл 1 М раствора бис(триметилсилил)амида лития в тетрагидрофуране и реакционную среду выдерживают при температуре -78 С еще в течение 5 мин. В течение 30 мин перемешивают при комнатной температуре. Затем раствор охлаждают до температуры 0 С и добавляют 55 мкл уксусной кислоты. Добавляют 20 мл этилацетата и 3 мл фосфатного буфера с рН=7,0. Декантируют, промывают водой, сушат над сульфатом магния, фильтруют, концентрируют путем выпаривания. Таким образом получают 76 мг пены, которую очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и ацетона в соотношении 97:3. Выделяют 5 мг чистого целевого соединения брутто-формулы C14H14N2 О 4HCl (M=274,279 г),или выход составляет 6%. ИК-спектр (СНСl3): 1805, 1779, 1743, 1669,1603, 1589, 1486 см-1. МС (ЭУ) m/z: [M]+=274, 215, 169, 105, 77.J. Org. Chem., 56, 3009-3016 (1991 и получая целевое соединение с общим выходом, в расчете на 4 стадии, 5,4%. Пример 8. Фенилметил-транс-2-оксо-3(фенилсульфонил)-1,3-диазабицикло[2,2,1] гептан-6-карбоксилат. В атмосфере азота смешивают 2,97 г (9,26 ммоль) 1-(1,1-диметилэтил)- и 2-(фенилметил)транс-4-амино-1,2-пирролидиндикарбоксилата(1991 брутто-формулы C17H24N2O4 (M=320,392 г) с 25 мл дихлорметана. Охлаждают до температуры 5 С и добавляют 1,3 мл триэтиламина. Перемешивают в течение 10 мин, затем добавляют 1,63 г бензолсульфонилхлорида. Перемешивают при температуре 5 С в течение 15 мин,затем температуру реакционной смеси доводят до 20 С в течение 45 мин. Разбавляют с помощью дихлорметана, промывают 10%-ным водным раствором винной кислоты, затем фосфатным буфером с рН=7,0, после этого водным насыщенным раствором хлорида натрия. Сушат над сульфатом магния и растворитель выпаривают при пониженном давлении. Таким образом получают 4,5 г сырого продукта, который хроматографируют на диоксиде кремния, элюируя смесью дихлорметана и этилацетата в соотношении 90:10. Таким образом получают 4,06 г 1(1,1-диметилэтил)- и 2-(фенилметил)-транс-4[(фенилсульфонил)амино]-1,2-пирролидиндикарбоксилата брутто-формулы C23H28N2O6S(М=460,552 г), что соответствует выходу 95%. 3,83 г (8,31 ммоль) полученного выше сульфонамида смешивают с 10 мл безводного метанола. Раствор охлаждают до температуры 0 С и при этой температуре добавляют 8,2 мл раствора хлороводорода в метаноле с концентрацией 10 моль/л. Перемешивают при температуре 0 С в течение 5 мин, затем оставляют до повышения температуры до комнатной температуры. Спустя 30 мин метанол выпаривают при пониженном давлении, остаток обрабатывают несколько раз метанолом, затем дихлорметаном. После этого гидрохлорид кристаллизуют из диэтилового эфира. Таким образом получают 3,2 г гидрохлорида фенилметил-транс-4-[(фенилсульфонил)амино]-2-пирролидинкарбоксилата брутто-формулы C18H20N2O4SHCl (М=396,896 г),что соответствует выходу 96%. В инертной атмосфере 2,78 г (7 ммоль) полученного выше гидрохлорида смешивают с 28 мл дихлорметана. Затем охлаждают до температуры около 0-5 С, после чего добавляют 2,15 мл триэтиламина. Продолжают перемешивание в течение 15 мин при температуре 0-5 С, затем 24 добавляют 0,46 мл дифосгена. Выдерживают при этой температуре в течение 4 мин, затем добавляют 10%-ный водный раствор винной кислоты, разбавляют дихлорметаном, декантируют, промывают водным насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют при пониженном давлении. Таким образом получают 3,1 г масла желтого цвета, которое очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и этилацетата в соотношении 9:1. Получают 1,82 г фенилметил-транс-1-(хлоркарбонил)-4-[(фенилсульфонил)амино]-2-пирролидинкарбоксилата брутто-формулыC19H19ClN2O5S (М=422,89 г), что соответствует выходу 61%. В инертной атмосфере 1,81 г (4,28 ммоль) полученного выше карбамоилхлорида смешивают с 31 мл тетрагидрофурана. Полученный раствор охлаждают до температуры -70 С, затем при этой температуре в течение 10 мин добавляют 4,7 мл 1 М раствора бис(триметилсилил) амида лития в тетрагидрофуране. Перемешивают в течение 45 мин при температуре -70 С,затем температуру повышают до примерно 0 С. Реакционную среду выдерживают при этой температуре в течение 2 ч 30 мин. После этого добавляют 295 мкл уксусной кислоты. Разбавляют дихлорметаном, затем промывают 10%ным водным раствором винной кислоты, раствором фосфатного буфера с рН=7 и водным насыщенным раствором хлорида натрия. Сушат над сульфатом магния и концентрируют досуха при пониженном давлении. Сырой продукт очищают путем хроматографии на диоксиде кремния, используя в качестве элюирующего средства смесь дихлорметана и этилацетата в соотношении 95:5. Таким образом получают 244 мг целевого соединения брутто-формулыC19H18N2O5S (М=386,429 г), что соответствует выходу 14%. 1 Н-ЯМР-спектр (400 МГц; CDC13; химические сдвиги пиков в м.д. и мультиплетность): 2,15 (м): О=С-СН-СН 2; 2,85 (д) и 3,08 (д): 25 эфира. К полученному раствору добавляют суспензию 10 г СеСl3 в 50 мл безводного диэтилового эфира. Суспензию перемешивают в течение 30 мин при температуре 20 С, затем охлаждают до температуры -60 С. После этого добавляют 3 М раствор метилмагнийбромида в диэтиловом эфире. Оставляют реакцию в течение 1 ч при температуре -60 С, затем температуру повышают до 0 С в течение 30 мин. Нейтрализуют с помощью 10%-ного водного раствора хлорида аммония. Экстрагируют дихлорметаном, фильтруют, органическую фазу промывают водой,сушат над сульфатом магния и концентрируют досуха при пониженном давлении. Таким образом получают 19,33 г масла, которое очищают путем хроматографии на диоксиде кремния,элюируя смесью дихлорметана и третбутилметилового эфира в соотношении 90:10. Получают 7,21 г 1-(1,1-диметилэтил)- и 2(фенилметил)-цис-4-гидрокси-4-метил-1,2-пирролидиндикарбоксилата брутто-формулыC18H25NO5 (M=335,404 г), или выход составляет 36%, а также 2,5 г эпимерного спирта. В инертной атмосфере 3,17 г (9,45 ммоль) полученного выше соединения смешивают с 70 мл дихлорметана. Охлаждают до температуры 5 С и добавляют по каплям 2,3 мл триэтиламина, затем 1,28 мл метансульфонилхлорида. Перемешивают в течение 45 мин при температуре 5 С. Промывают 10%-ным водным раствором винной кислоты, затем раствором фосфатного буфера с рН=7, потом водой. Органическую фазу сушат над сульфатом магния и концентрируют досуха при пониженном давлении. Таким образом получают 3,9 г масла, которое очищают путем хроматографии на диоксиде кремния,элюируя смесью дихлорметана и этилацетата в соотношении 90:10. Получают 2,75 г 1-(1,1 диметилэтил)- и 2-(фенилметил)-цис-4-метил-4[(метилсульфонил)окси]-1,2-пирролидиндикарбоксилата брутто-формулы C19H27NO7S (М= 413,494 г), что соответствует выходу 70%. Приготовляют раствор 2,54 г (6,14 ммоль) полученного выше мезилата в 40 мл диметилформамида. Затем при температуре 20 С добавляют 519 мг (7,98 ммоль) NaN3, нагревают при температуре 50 С в течение 2 ч. После охлаждения выливают в 250 мл воды и экстрагируют с помощью 250 мл дихлорметана. Органическую фазу промывают водой, сушат над сульфатом магния и выпаривают досуха при пониженном давлении. Получают 2,4 г сырого продукта, который очищают путем хроматографии на диоксиде кремния при использовании в качестве элюирующего средства смеси дихлорметана и этилацетата в соотношении 95:5. Таким образом получают 1,66 г 1-(1,1-диметилэтил)- и 2(фенилметил)-транс-4-азидо-4-метил-1,2-пирролидиндикарбоксилата брутто-формулыC18H24N4O4 (М=360,42 г) (содержание около 30 мас.%), что соответствует выходу примерно 25%. 26 1,85 г (или около 1,7 ммоль) полученного выше азида растворяют в 18 мл толуола. Затем при температуре 20 С добавляют 1,38 мл(C4H9)3SnH и 84 мг АИБН. Доводят до температуры 75 С и выдерживают при этой температуре в течение 2 ч. Толуол выпаривают и остаток снова растворяют в этилацетате. Добавляют водный насыщенный раствор фторида калия и перемешивают в течение 30 мин при комнатной температуре. Фильтруют на clarcel, декантируют и органическую фазу сушат над сульфатом магния. После выпаривания растворителя при пониженном давлении получают 3 г масла, которое хроматографируют на диоксиде кремния,элюируя смесью дихлорметана и метанола в соотношении 9:1. Получают 560 мг 1-(1,1 диметилэтил)- и 2-(фенилметил)-транс-4-амино 4-метил-1,2-пирролидиндикарбоксилата бруттоформулы C18H26N2O4 (М=334,419 г). Следовательно, выход является количественным. В инертной атмосфере 578 мг (1,72 ммоль) полученного выше амина смешивают с 30 мл дихлорметана, охлаждают до температуры 5 С и добавляют по каплям 290 мкл триэтиламина,затем 240 мкл бензоилхлорида. Продолжают перемешивание при температуре 5 С в течение 30 мин. Разбавляют дихлорметаном, промывают 10%-ным водным раствором винной кислоты,водным насыщенным раствором карбоната натрия, затем водой, органическую фазу сушат над сульфатом магния и растворитель выпаривают при пониженном давлении. Таким образом получают 950 мг масла, которое очищают путем хроматографии, элюируя смесью дихлорметана и этилацетата в соотношении 90:10. Таким образом получают 732 мг 1-(1,1-диметилэтил)- и 2-(фенилметил)-транс-4-(бензоиламино)-4 метил-1,2-пирролидиндикарбоксилата бруттоформулы C25H30N2O5 (М=438,528 г), что соответствует выходу 97%. 636 мг (1,45 ммоль) полученного выше амида растворяют в 1,9 мл этилацетата, охлаждают до температуры около 0-5 С на бане со льдом, затем добавляют 3,2 мл раствора хлороводорода в этилацетате с концентрацией 4,6 моль/л. Температуру повышают до 20 С, затем,спустя 1 ч, растворитель выпаривают при пониженном давлении. После этого гидрохлорид кристаллизуют из диэтилового эфира. Таким образом выделяют 570 мг гидрохлорида фенилметил-транс-4-(бензоиламино)-4-метил-2-пирролидинкарбоксилата брутто-формулыC20H22N2O3 НСl (М=374,87 г) в виде порошка белого цвета. Следовательно, выход является количественным. В инертной атмосфере 100 мг (0,267 ммоль) полученного выше гидрохлорида растворяют в 1,5 мл дихлорметана. Охлаждают до температуры около 0-5 С, затем добавляют 90 мкл триэтиламина. Перемешивают в течение 15 мин при температуре 5 С, затем добавляют 20 мкл дифосгена. Продолжают перемешивание в 27 течение 30 мин при температуре 5 С. После этого обрабатывают с помощью 10%-ного водного раствора винной кислоты, экстрагируют дихлорметаном, органическую фазу промывают водным насыщенным раствором хлорида натрия, сушат над сульфатом магния и растворитель выпаривают при пониженном давлении. Таким образом получают 130 мг масла, которое очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и этилацетата в соотношении 9:1. Тогда получают 72 мг фенилметил-транс-4-(бензоиламино)-1(хлоркарбонил)-4-метил-2-пирролидинкарбоксилата брутто-формулы C21H21N2O4Cl (М = 400,865 г), что соответствует выходу 67%. 373 мг (0,930 ммоль) полученного выше соединения растворяют в 9 мл тетрагидрофурана. Затем раствор охлаждают до температуры-70 С и в течение 5 мин добавляют 1 мл 1 М раствора бис(триметилсилил)амида лития в тетрагидрофуране. Реакционную среду оставляют нагреваться до температуры 0 С в течение 45 мин, затем добавляют 69 мкл уксусной кислоты. После этого разбавляют дихлорметаном, промывают 10%-ным водным раствором винной кислоты, затем раствором фосфатного буфера с рН=7,0 и водным насыщенным раствором хлорида натрия. Органическую фазу сушат над сульфатом магния, концентрируют досуха при пониженном давлении, получая 330 мг сырого продукта, который очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и этилацетата в соотношении 98:2,содержащей 0,1 об.% триэтиламина. Таким образом получают 123 мг целевого соединения брутто-формулы C21H20N2O4 (М=364,404 г), что соответствует выходу 36%. 1 Н-ЯМР-спектр (300 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,76 (с): СН 3; 2,11 (дд) и 2,73 (ддд): N-CHCH2; 2,93 (д) и 3,00 (д): N-CH2; 3,96 (ддд): NCH-CH2; 5,21: СО 2 СН 2 С 6 Н 5; 7,36 (м): СН 2 С 6 Н 5; 7,43 (т) и 7,57 (т) и 7,72 (д): СОС 6 Н 5. ИК-спектр (СНСl3): 1776, 1745, 1682; 1601,1580, 1498 см-1. МС (ионизация электронным распылением с образованием положительных ионов) m/z:(М=321,377 г) растворяют в 225 мл безводного дихлорметана. К раствору добавляют 5,42 мл 2,6-лутидина. Охлаждают до температуры -70 С, затем в течение 5 мин вводят 8,25 мл ангидрида триф 004920 28 торметансульфокислоты. Перемешивают в течение 10 мин при температуре -70 С, затем при температуре -70 С вводят 4,43 г О-аллилгидроксиламина. После этого реакционную смесь доводят до комнатной температуры в течение 27 ч. Разбавляют дихлорметаном, затем промывают 10%-ным водным раствором винной кислоты, водным насыщенным раствором гидрокарбоната натрия и водой. Органическую фазу сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Таким образом получают 23 г сырого масла, которое очищают путем хроматографии на диоксиде кремния, причем элюирование осуществляют последовательно с помощью смеси дихлорметана и этилацетата в соотношении 95:5, 90:10, затем 80:20. Выделяют 7,18 г 1-(1,1-диметилэтил)и 2-(фенилметил)-транс-4-[(2-пропенилокси) амино]-1,2-пирролидиндикарбоксилата бруттоформулы C20H28N2O5 (М=376,456 г), что соответствует выходу 40%. 3,25 г (8,63 ммоль) полученного выше соединения растворяют в 3,5 мл этилацетата. Охлаждают до температуры около 0-5 С, затем добавляют 19 мл раствора хлороводорода в этилацетате с концентрацией 4,6 моль/л. Реакцию проводят при температуре около 0-5 С в течение 40 мин при постоянном перемешивании. Растворитель выпаривают при пониженном давлении, затем обрабатывают несколько раз диэтиловым эфиром, отбирая жидкость над осадком. Таким образом получают 2,54 г гидрохлорида в виде осадка белого цвета, который растворяют при перемешивании в 55 мл дихлорметана. Добавляют 7,3 мл 2 н. раствора гидроксида натрия. После декантации органическую фазу сушат над сульфатом натрия. Дихлорметан выпаривают при пониженном давлении. Таким образом получают 2,12 г фенилметил-транс-4-[(2-пропенилокси)амино]-2-пирролидинкарбоксилата брутто-формулы C15H20N2O3(М=276,337 г) в виде масла, или выход составляет 89%. В инертной атмосфере 4,14 г (15 ммоль) полученного выше соединения растворяют в 1,5 л ацетонитрила. Охлаждают до температуры около 0-5 С и добавляют 1,14 мл дифосгена. Перемешивают в течение 15 мин при поддерживании температуры 0-5 С, затем добавляют последовательно 4,6 мл триэтиламина и 1,83 гDMAP в 80 мл ацетонитрила. Температуру повышают до комнатной температуры и реакцию проводят в течение 26 ч, затем выпаривают половину растворителя при пониженном давлении. После этого обрабатывают 10%-ным водным раствором винной кислоты, затем экстрагируют дихлорметаном. Органическую фазу промывают с помощью водного насыщенного раствора хлорида натрия, сушат ее над сульфатом магния и растворитель выпаривают при пониженном давлении. Таким образом получают 43 г сырого продукта, который очищают пу 29 тем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и этилацетата в соотношении 90:10, содержащей 0,1% триэтиламина. Получают 312 мг фенилметил-транс-2-оксо 3-(2-пропенилокси)-1,3-диазабицикло[2,2,1] гептан-6-карбоксилата брутто-формулыC16H18N2O4 (M=302,33 г), что соответствует выходу 7%. В инертной атмосфере 70,2 мг (0,232 ммоль) полученного выше соединения растворяют в 2,3 мл дихлорметана. Затем вводят 26,5 мкл уксусной кислоты и 134 мг Pd[P(С 6 Н 5)3]4. Реакцию проводят в течение 40 мин при комнатной температуре, затем температуру понижают до -20 С и добавляют 2,96 мл раствора комплекса SО 3-пиридин с концентрацией 0,314 моль/л. Реакцию проводят в течение 2,5 ч, затем добавляют дихлорметан и реакционную среду выпаривают при пониженном давлении. После этого обрабатывают с помощью 40 мл дихлорметана и промывают все с помощью 5 мл воды. Органическую фазу отделяют и сушат над сульфатом натрия, затем растворитель выпаривают при пониженном давлении. Таким образом получают 280 мг сырого продукта, который очищают путем хроматографии на диоксиде кремния, элюируя последовательно смесью дихлорметана и ацетона в соотношении 80:20, содержащей 0,1% триэтиламина, затем смесью дихлорметана и ацетона в соотношении 50:50,содержащей 0,1% триэтиламина. Выделяют 34,0 мг целевого соединения брутто-формулыC34H33N2O7SP (М=644,689) в виде масла желтого цвета, или выход составляет 23%. 1 Н-ЯМР-спектр (400 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 2,00 (м) и 2,48 (м): СН 2-СН-С=О; 2,12(д) и 3,12(с): СН-СН 2-N; 3,75(м): СН 2-СН-С=О 2; 4,71(с): CH-CH2-N; 5,18 [АВ] СН 2-С 6 Н 5; 7,35(м): СН 2-С 6 Н 5 и 2,29 (м): СН 3-СН=СН; 6,62 и 7,21 СН 3-СН=СН; 7,60-7,85 Р(С 6 Н 5)3. МС (ионизация электронным распылением с образованием положительных и отрицательных ионов) m/z: [М анион]- = 341; [М катион]+ = 303. Пример 11. 1-Пропенилтрифенилфосфониевая соль метил-транс-2-оксо-3-(сульфокси)-1,3 диазабицикло[2,2,1]гептан-6-карбоксилата. Следуют методике примера 10, но исходя из 207 мг 1-(1,1-диметилэтил)- и 2-метил-цис-4 гидрокси-1,2-пирролидиндикарбоксилата. Таким образом получают 12 мг целевого продукта формулы C7H10N2O7S (М=266,231 г). МС (ионизация электронным распылением с образованием положительных и отрицательных ионов) m/z: [М анион]- = 265; [М катион]+ = 303. Пример 12 а. Дифенилметил-транс-7-оксо 6-окса-1-азабицикло[3,2,1]октан-3-карбоксилат. В инертной атмосфере смешивают 8 мл дихлорметана и 347 мг (1 ммоль) гидрохлорида дифенилметил-цис-5-гидрокси-3-пиперидинкар 004920 30 боксилата (описывается в Acta Chem. Scand.,серия В, 35 (4), 289-294). Охлаждают до температуры 0 С, затем добавляют 346 мкл триэтиламина и 72 мкл дифосгена. Реакцию проводят в течение 15 мин при поддерживании температуры 0 С, затем растворитель выпаривают при пониженном давлении. Обрабатывают с помощью 25 мл безводного толуола. Фильтруют для удаления триэтиламингидрохлорида. К фильтрату добавляют 553 мкл триэтиламина и в течение 4 ч кипятят с обратным холодильником. Затем разбавляют с помощью этилацетата и промывают 10%-ным водным раствором винной кислоты, потом водным насыщенным раствором хлорида натрия и органическую фазу сушат над сульфатом магния. Затем выпаривают при пониженном давлении и выделяют 339 мг сырого продукта, который очищают путем хроматографии на диоксиде кремния, элюируя смесью толуола и этилацетата в соотношении 70:30. Таким образом получают 146 мг целевого соединения (М=337,378 г), что соответствует выходу 43%. 1 Н-ЯМР-спектр (250 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 2,15 (ддд) и 2,73 (д квадруплет): N-CH2CHO-CH2; 2,92 (т): О 2 С-СН-; 3,00 (д) и 3,45 (д):N-CH2-CHO; 3,48 (дд) и 4,07 (дд): N-CH2-CHCO2; 4,79 (д): N-CH2-CHO; 6,90 (с): СО 2-СН(С 6 Н 5)2; 7,33 (м): (С 6 Н 5)2. ИК-спектр (СНСl3): 1792, 1734; 1600, 1585,1497 см-1. МС (ЭУ) m/z: [М]+=337, 292, 183, 167. Пример 12b. транс-7-Оксо-6-окса-1 азабицикло[3,2,1]октан-3-карбоновая кислота. Смешивают 320 мг полученного в примере 12 а соединения, 17 мл ацетона и 70 мг катализатора 20%-ного палладия-на-угле в массе. Перемешивают в атмосфере водорода при нормальном давлении. Спустя 2 ч 30 мин добавляют 70 мг катализатора и проводят реакцию в течение еще 1 ч 30 мин, затем реакционную среду фильтруют. Растворитель выпаривают при пониженном давлении и таким образом получают 350 мг сырого продукта, который кристаллизуют из пентана. Отфильтровывают и таким образом выделяют 158 мг целевого продукта бруттоформулы C7H9NO4 (М=171,154 г) в виде твердого вещества серого цвета. Соответствующий выход составляет 89%. 1 Н-ЯМР-спектр (300 МГц; диметилсульфоксид; химические сдвиги пиков в м.д. и мультиплетность): 2,10 (ддд) и 2,43 (дм): N-CH2-CHO-CH2; 2,83 (т): О 2 С-СН-; 3,13 (д) и 3,27 (дм): N-CH2CHO; 3,40 (дд) и 3,72 (д): N-CH2-CH-СО 2 Н; 4,81 31 Пример 12 с. (4-Нитрофенил)метил-транс 7-оксо-6-окса-1-азабицикло[3,2,1]октан-3-карбоксилат. В инертной атмосфере смешивают 30 мг(0,175 ммоль) полученной в примере 12b кислоты и 0,5 мл дихлорметана. После этого добавляют 26,8 мг 4-нитробензилового спирта, 2,2 мгDMAP и 37 мг EDCl. Реакцию проводят при перемешивании в течение 2 ч при комнатной температуре. Органическую фазу затем разбавляют дихлорметаном, промывают 10%-ным водным раствором винной кислоты и раствором фосфатного буфера с рН=7. После высушивания органической фазы над сульфатом натрия и выпаривания растворителя при пониженном давлении получают 57 мг сырого продукта, который очищают путем хроматографии на диоксиде кремния, элюируя смесью толуола и этилацетата в соотношении 85:15. Продукт затем кристаллизуют из смеси диэтилового эфира и пентана, получая 34 мг целевого соединения в виде кристаллов белого цвета (М=306,277 г). Соответствующий выход составляет 63,5%. 1 Н-ЯМР-спектр (300 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 2,14 (ддд) и 2,84 (дм): N-CH2-CHO-CH2; 2,90 (т): О 2 С-СН-; 3,10 и 3,49 (дм): N-CH2-CHO; 3,43 (дд) и 4,14 (уш.д): N-CH2-CH-СО 2; 5,27[АВ]: СО 2-СН 2-С 6 Н 5; 7,56 и 8,24 [АА'ВВ']: CC6H5-NO2. ИК-спектр (СНСl3): 1799, 1789, 1741; 1609,1526, 1495 см-1. МС (ЭУ) m/z: [M]+ = 306, 170, 136, 126,106, 82. Пример 13. 6-(Фенилметил)-1,6-диазабицикло[3,2,1]октан-7-он. Стадия А. К раствору 20,71 г 3-аминопиридина в 200 мл дихлорметана при температуре около 0-5 С добавляют 30,7 мл триэтиламина. Затем добавляют по каплям в течение 15 мин 25,5 мл бензоилхлорида и оставляют для повышения до комнатной температуры. После перемешивания в течение 1 ч промывают водой, затем насыщенным раствором гидрокарбоната натрия, после чего органическую фазу сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Получают 42,29 г кристаллического целевого продукта (М=198,226 г). Стадия В. К раствору 10 г полученного на стадии А продукта в 200 мл метанола добавляют 4,3 мл концентрированной соляной кислоты и 500 мг 5 мас.%-ного родия-на-оксиде алюминия. Выдерживают в атмосфере водорода при давлении 60110 бар в течение 15 ч. Реакционную смесь фильтруют, промывают метанолом, затем фильтрат концентрируют при пониженном давлении. Гидрохлорид целевого продукта получают в смеси с 10% гидрохлорида исходного продукта. 32 Продукт обрабатывают с помощью 250 мл дихлорметана и добавляют 1,1 экв. 1 н. раствора гидроксида натрия. После перемешивания в течение 15 мин дихлорметан декантируют, органическую фазу промывают водой, сушат и выпаривают при пониженном давлении. Остаток хроматографируют на диоксиде кремния, элюируя смесью дихлорметана, метанола и триэтиламина в соотношении 92:8:3. Получают 7,4 г кристаллического целевого продукта, или выход составляет 72%. Стадия С.N-(Фенилметил)-3-пиперидинамин. 20 г полученного на стадии В продукта растворяют в 600 мл 1,2-диметоксиэтана. К раствору в течение 30 мин добавляют 14,86 г литийалюминийгидрида. Нагревают при перемешивании и в атмосфере инертного газа при температуре 75-80 С в течение 16 ч, затем охлаждают до температуры 0 С и в течение 45 мин, не превышая температуру 12 С, добавляют 11 мл воды. Перемешивают в течение 10 мин, фильтруют и осадок промывают дихлорметаном. Фильтрат концентрируют при пониженном давлении. Получают 17,8 г целевого продукта в виде масла, которое перегоняют при пониженном давлении (температура кипения 114-121 С при 0,8 мбар). Получают 16 г целевого продукта, или выход составляет 86%. Стадия D. 6-(Фенилметил)-1,6-диазабицикло[3,2,1] октан-7-он. 1,06 г полученного на стадии С продукта растворяют в 28 см 3 толуола, затем охлаждают до температуры 0 С и в атмосфере инертного газа добавляют 337 мкл дифосгена. Оставляют температуру повышаться и раствор выдерживают в течение 2 ч при температуре 20 С. Концентрируют при пониженном давлении, затем остаток хроматографируют на диоксиде кремния,элюируя последовательно с помощью смеси дихлорметана и ацетона в соотношении 95:5,затем 80:20, и, наконец, с помощью смеси дихлорметана, метанола и триэтиламина в соотношении 92:8:3, и получают 362 мг целевого продукта C13H16N2O (М=216,85 г), или выход составляет 30%.[3,2,1]октан-7-он. Стадия А. 3-(Бензиламино)-1-пиперидинкарбоновая кислота. В атмосфере азота 5 г продукта, полученного на стадии В примера 13, растворяют в 1,25 л безводного толуола, затем добавляют 3,4 мл триэтиламина и при температуре 0-5 С в течение 3 мин вводят 1,47 мл дифосгена. После выдерживания в течение 20 мин при температуре 0-5 С смесь оставляют для повышения температуры до 20 С, перемешивают в течение 75 мин, 33 затем растворитель выпаривают при пониженном давлении. Остаток хроматографируют на диоксиде кремния, элюируя смесью дихлорметана и ацетона в соотношении 8:2. Получают 3,44 г целевого продукта (выход составляет 52,6%). Стадия В. 6-Бензоил-1,6-диазабицикло[3,2,1]октан-7 он. В атмосфере азота вводят 48 мг гидрида натрия в виде 50%-ной дисперсии в масле и 20 мл тетрагидрофурана. Охлаждают до температуры около 0-5 С, затем за один раз добавляют 266 мг полученного на стадии А продукта. Смесь оставляют для повышения температуры до комнатной, затем добавляют 60 мкл уксусной кислоты и 10 мл фосфатного буфера с рН=7. После этого добавляют немного этилацетата,затем декантируют и повторно экстрагируют этилацетатом. Органическую фазу сушат над сульфатом магния, после чего растворители выпаривают при пониженном давлении. Сырой продукт хроматографируют на диоксиде кремния, элюируя дихлорметаном, содержащим 2% ацетона. Таким образом получают 143 мг целевого продукта C13H12N2O2 (М=228,25 г). Соответствующий выход составляет 62%. 1 Н-ЯМР-спектр (250 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,20-2,15 (м) и 2,42 (м): NCH-CH2-CH2-; 2,80 (д)-2,93 (д); 3,11 (м); 3,28-3,58 (м): CH2-N; 4,54 (м): CH-N; 7,43 (м); 7,55 (м); 7,69 (м): С 6 Н 5. ИК-спектр (СНСl3): 1758, 1672; 1605, 1586,1492 см-1. МС (ЭУ) m/z: [M]+=230, 125, 105, 77. Пример 15. 7-Оксо-1,6-диазабицикло[3,2,1] октан-6-уксусная кислота. Стадия А. 5-[(1,1-Диметилэтил)диметилсилил]-1,6 диазабицикло[3,2,1]октан-7-он. Помещают в атмосферу азота 843 мг лития и конденсируют при температуре -70 С 320 мл аммиака. При температуре -70 С в течение 10 мин добавляют 7,56 г (34,8 ммоль) полученного в примере 13 продукта в 160 мл тетрагидрофурана. Перемешивают в течение 5 мин, затем аммиак отгоняют в токе азота при медленном нагревании до температуры 20 С. При температуре 20 С к полученной суспензии медленно добавляют 7,9 г (1,1-диметилэтил)диметилсилилхлорида в 10 см 3 тетрагидрофурана, затем перемешивают в течение 10 мин. После этого добавляют 160 см 3 этилацетата, потом 60 см 3 10%-ного водного раствора винной кислоты. Декантируют, повторно экстрагируют этилацетатом, органическую фазу промывают водой,сушат ее над сульфатом натрия и растворитель выпаривают при пониженном давлении. Полученное масло хроматографируют на диоксиде кремния с 10% воды, элюируя дихлорметаном,затем смесью дихлорметана и ацетона в соот 004920 34 ношении 8:2 и получают 3,04 г целевого продукта (выход составляет 36,2%). 1 Н-ЯМР-спектр (250 МГц; CDCl3, химические сдвиги пиков в м.д. и мультиплетность): 0,21 (с) и 0,40 (с): SiCH3; 0,97 (с): SitBu; 1,5-1,8 (м) и 2,07(м): N-CH-CH2-CH2; 2,85 (д) и 3,32 (м); -CH-CH2-N: 2,93 (д) и 3,32 (м): -CH2CH2-N; 3,65 (м): CH-N. ИК-спектр (СНСl3) : 1710, 842 см-1. МС (ЭУ) m/z: [M]+=240, 225, 183, 100, 83,57. Стадия В. Фенилметил-7-оксо-1,6-диазабицикло[3,2,1]октан-6-ацетат. В атмосфере азота 1,44 г (5,99 ммоль) полученного на стадии А продукта растворяют в 14,4 мл тетрагидрофурана, затем добавляют 941 мкл фенилметилбромацетата и потом по каплям 6 мл 1 М раствора тетра-н-бутил-аммонийфторида в тетрагидрофуране. Перемешивают в течение 10 мин при температуре 20 С, затем разбавляют с помощью 15 мл этилацетата и добавляют 5 мл водного раствора фосфатного буфера с рН=7. Декантируют, повторно экстрагируют этилацетатом, органическую фазу промывают водой, сушат ее над сульфатом натрия и растворитель выпаривают при пониженном давлении. Маслянистый остаток хроматографируют на диоксиде кремния с 10% воды, элюируя смесью дихлорметана и ацетона в соотношении 8:2. Получают 14 0 мг целевого продукта. Соответствующий выход составляет 9%. ИК-спектр (СНСl3): 1746, 1720 см-1. МС (ЭУ) m/z: [M]+=274, 183, 155, 139, 91,83. Стадия С. 7-Оксо-1,6-диазабицикло[3,2,1]октан-6 уксусная кислота. 137 мг полученного на стадии В продукта растворяют в 1,5 мл этилацетата, затем к раствору добавляют 14 мг 10%-ного палладия-наугле и помещают в атмосферу водорода. Спустя 15 мин снова добавляют 15 мг палладия-на-угле и выдерживают при перемешивании в течение 15 мин. Катализатор отфильтровывают, промывают этилацетатом, потом ацетоном и метанолом и растворитель выпаривают при пониженном давлении. Получают в целом 68 мг сырого продукта, который кристаллизуют из простого эфира. Получают 58 мг целевого продукта брутто-формулы C15H18N2O3 (М=274,321 г). Соответствующий выход составляет 63%. 1H-ЯМР-спектр (400 МГц; СDСl3; химические сдвиги пиков в м.д. и мультиплетность): 1,48 (м), 1,63 (м), 1,73 (м) и 1,86 (м): N-CHCH2-CH2; 2,85-3,00 (м), 3,14 (дм) и 3,64 (м): CH2N-CH2 и CH-N; 3,78 и 4,14 [АВ]: CON-CH2-CO. МС (ЭУ) m/z: [М]+=184, 139, 125, 111, 97,83. Пример 16. 7-Оксо-N-фенил-1,6-диазабицикло[3,2,1]октан-6-карбоксамид. 35 В атмосфере инертного газа смешивают 1 мл тетрагидрофурана и 99 мг (0,41 ммоль) полученного на стадии А примера 15 соединения. Последовательно добавляют 50 мкл фенилизоцианата, затем 450 мкл 1 М раствора тетрабутиламмонийфторида в тетрагидрофуране. Реакцию проводят в течение 10 мин, затем разбавляют этилацетатом, промывают водой. Органическую фазу декантируют и сушат над сульфатом магния. Растворитель выпаривают при пониженном давлении. Таким образом получают 140 мг сырого продукта, который очищают путем хроматографии на диоксиде кремния, используя в качестве элюирующего средства смесь дихлорметана и этилацетата в соотношении 90:10. Получают 21 мг целевого соединения бруттоформулы C13H15N3O (М=245,283 г), что соответствует выходу 20%. 1 Н-ЯМР-спектр (250 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,78 (м), 2,02 (м) и 2,17 (м): N-CH-CH2CH2; 2,88 (д), 3,13 (д) и 3,42 (м): CH2-N-CH2; 4,49 (м): CH-N; 7,11 (т), 7,34 (т) и 7,54 (д): С 6 Н 5; 10,05: NH. ИК-спектр (СНСl3): 3302, 3266; 1734; 1700; 1602, 1553, 1501 см-1. МС (ЭУ) m/z: [М]+=245, 153, 126, 119, 98,92. Пример 17 а. 6-[1-(Фенилметил)-1 Н-тетразол-5-ил]-1,6 диазабицикло[3,2,1]октан-7-он. Помещают в атмосферу инертного газа 480 мг (2 ммоль) соединения, полученного на стадии А примера 15. Затем добавляют раствор 712 мг 5-фтор-1-(фенилметил)-1 Н-тетразола в 1,5 мл тетрагидрофурана, потом 2 мл 1 М раствора тетрабутиламмонийфторида в тетрагидрофуране. Реакцию проводят в течение 1 мин. Затем разбавляют этилацетатом, промывают водой, декантируют, органическую фазу сушат над сульфатом магния и растворитель выпаривают при пониженном давлении. Получают 1,06 г маслянистого продукта, который хроматографируют на диоксиде кремния при использовании смеси дихлорметана и этилацетата в соотношении 90:10. Таким образом получают 143 мг целевого соединения брутто-формулы(М=284,324 г) в виде аморфного продукта белого цвета. Соответствующий выход составляет 25%. 1 Н-ЯМР-спектр (250 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,80 (м), 2,04 (м) и 2,67 (м): N-CH-CH2CH2; 2,83 (д), 2,85 (дм), 3,10 (дд) и 3,44 (дд):CH2-N-CH2; 3,99 (м): CH-N; 5,63 и 5,88 [АВ]: С 6 Н 5-СН 2; 7,18 (м) и 7,32 (м): С 6 Н 5. Пример 17b. 6-(1 Н-Тетразол-5-ил)-1,6 диазабицикло[3,2,1]октан-7-он. Смешивают 120 мг продукта, полученного в примере 17 а, и 2,4 мл смеси метанола и этилацетата в соотношении 90:10, затем добавляют 2,4 мл тетрагидрофурана вплоть до достижения 36 полного растворения. После этого добавляют 24 мг катализатора 10%-ного палладия-на-угле,затем перемешивают в атмосфере водорода. После протекания реакции в течение 3 ч катализатор отфильтровывают, промывают смесью тетрагидрофурана и метанола, затем растворитель выпаривают при пониженном давлении. После этого продукт кристаллизуют из диэтилового эфира. Таким образом получают 72 мг целевого соединения брутто-формулы C7H10N6O(М=194,198 г) в виде кристаллического продукта белого цвета. Соответствующий выход составляет 88%. 1 Н-ЯМР-спектр (300 МГц; диметилсульфоксид; химические сдвиги пиков в м.д. и мультиплетность): 1,63 (м), 1,89 (м) и 2,07 (м): N-CH-CH2CH2; 3,14-3,20 (м) и 3,43 (м): CH2-N-CH2; 4,51[3,2,1]октан-7-он. В 1,4 мл тетрагидрофурана растворяют 140 мг (0,582 ммоль) соединения, полученного на стадии А примера 15. К полученному раствору последовательно добавляют 55 мкл уксусного ангидрида, затем 0,58 мл 1 М раствора тетрабутиламмонийфторида в тетрагидрофуране. После этого разбавляют этилацетатом, промывают водой, декантируют, органическую фазу сушат над сульфатом магния, затем растворитель выпаривают при пониженном давлении. Таким образом получают 116 мг сырого масла, которое хроматографируют на диоксиде кремния при использовании смеси дихлорметана и ацетона в соотношении 80:20. Таким образом получают 18 мг целевого соединения брутто-формулыC8H12N2O2 (М=168,196 г), что соответствует выходу 18%. 1 Н-ЯМР-спектр (300 МГц; диметилсульфоксид; химические сдвиги пиков в м.д. и мультиплетность): 1,65-2,20 (м): N-CH-CH2-CH2; 2,54 (с):Med. Chem., 29, 224-229 (1986 в 440 мл этанола. Затем добавляют 38,7 9 г О-бензилгидроксиламингидрохлорида. После этого в суспензию по каплям вводят 54 мл пиридина. Реакцию проводят при перемешивании в течение 4 ч при температуре около 25 С, затем растворитель выпаривают при пониженном давлении. Обра 37 батывают смесью дихлорметана и этилацетата,затем фильтруют и промывают дихлорметаном,потом смесью дихлорметана и этилацетата. Фильтрат после этого концентрируют досуха при пониженном давлении. Таким образом получают 69,8 г масла светло-желтого цвета, которое очищают путем хроматографии на диоксиде кремния. Используемым элюирующим средством является смесь циклогексана и этилацетата в соотношении 80:20. Получают 57,21 г 1,1 диметилэтил-3-[(фенилметокси)имино]-1-пиперидинкарбоксилата брутто-формулы C17H24N3O3(М=304,39 г) в виде масла очень бледножелтого цвета. Соответствующий выход составляет 85%. В атмосфере азота 24,82 г (0,0815 ммоль) полученного выше оксима растворяют в 163 мл охлажденного до температуры -10 С этанола. После этого добавляют 25 мл комплекса боранпиридин, затем по каплям в течение 1 ч 15 мин,204 мл 2 н. соляной кислоты. Раствор перемешивают в течение 1 ч 15 мин при температуре-5 С, затем обрабатывают с помощью 100 мл насыщенного раствора гидрокарбоната натрия,потом с помощью 35 г карбоната натрия, которые добавляют маленькими порциями. Значение рН тогда составляет 7-8. Реакционную среду экстрагируют этилацетатом. Органические фазы объединяют, сушат над сульфатом натрия, растворитель выпаривают при пониженном давлении. Таким образом получают 39,0 г бесцветной маслянистой жидкости, которую обрабатывают с помощью 400 мл этилацетата. Раствор промывают с помощью 0,05 н. соляной кислоты, затем органические фазы объединяют и растворитель выпаривают при пониженном давлении. Выделяют 35,5 г маслянистой бесцветной жидкости,которую очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и этилацетата в соотношении 95:5, затем смесью дихлорметана и этилацетата в соотношении 80:20. Таким образом получают 17,89 г 1,1 диметилэтил-3-[(фенилметокси)амино]-1-пиперидинкарбоксилата брутто-формулы C17H26N2O3(М=306,41 г) в виде бесцветного масла. Соответствующий выход составляет 72%. 6,72 г (21,9 ммоль) полученного выше пиперидина растворяют в 22 мл этилацетата, охлажденного до температуры -10 С. В течение 30 мин добавляют по каплям 28 мл раствора безводного хлороводорода в этилацетате с концентрацией 4,0 моль/л. После выдерживания в течение 1 ч при температуре 0 С добавляют 40 мл диэтилового эфира, осадок дигидрохлорида отфильтровывают и промывают его диэтиловым эфиром. Таким образом получают 3,87 г твердого вещества белого цвета. Путем кристаллизации фильтрата получают еще 1,80 г целевого продукта. Полученный продукт обрабатывают с помощью 60 мл 1 н. раствора гидроксида натрия и 120 мл этилацетата. После декантации водную фазу насыщают хлоридом натрия, затем экстра 004920 38 гируют два раза этилацетатом. Органические фазы объединяют и сушат над сульфатом магния, затем концентрируют досуха при пониженном давлении. Таким образом получают 3,67 гN-(фенилметокси)-3-пиперидинамина бруттоформулы C12H18N2O (M=206,29 г), что соответствует выходу 81%. 518 мг (2,5 ммоль) полученного выше соединения растворяют в 5 мл безводного дихлорметана, затем добавляют 0,5 мл триэтиламина. Полученную суспензию беловатого цвета охлаждают до температуры -65 С, затем в течение 15 мин добавляют 12,5 мл раствора дифосгена в дихлорметане с концентрацией 0,10 моль/л. После протекания реакции в течение 45 мин бесцветный раствор разбавляют с помощью 15 мл дихлорметана и обрабатывают с помощью 15 мл воды. Среду декантируют, затем водную фазу экстрагируют с помощью 20 мл дихлорметана. Объединенные органические фазы сушат над сульфатом магния, затем концентрируют досуха при пониженном давлении. Таким образом получают масло бледно-желтого цвета, которое очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и этилацетата в соотношении 90:10, затем смесью дихлорметана и этилацетата в соотношении 80:20. Таким образом получают 196 мг целевого соединения брутто-формулы(М=232,28 г) в виде бесцветного масла. Соответствующий выход составляет 34%. 1 Н-ЯМР-спектр (300 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,59 (м) и 1,93-2,18 (м): N-CH-CH2-CH2; 2,73 (д), 2,94 (д), 3,17 (д) и 3,40 (дд): CH2-N-CH2; 3,29 (т): N-CH; 4,89 (д): N-O-СН 2-(С 6 Н 5); 7,38: С 6 Н 5. ИК-спектр (СНСl3): 1747; 1498 см-1. МС (ЭУ) m/z: [M]+=232,91. Пример 19b. 6-(Ацетилокси)-1,6-диазабицикло[3,2,1]октан-7-он. Растворяют 95 мг (0,41 ммоль) соединения,полученного в примере 19 а, в 5 мл метанола,добавляют 8 мг 10 мас.%-ного палладия-наугле, затем суспензию выдерживают в атмосфере водорода при нормальном давлении в течение 1 ч при температуре 25 С, после чего катализатор отфильтровывают. После выпаривания растворителя при пониженном давлении получают 70 мг кристаллов белого цвета. Кристаллы обрабатывают с помощью 2 мл безводного дихлорметана. Раствор охлаждают до температуры-10 С в атмосфере азота. Затем добавляют 70 мкл пиридина, потом 40 мкл уксусного ангидрида и перемешивают в течение 20 мин. Концентрируют при пониженном давлении и получают 75 мг кристаллов белого цвета, которые очищают на диоксиде кремния, элюируя смесью дихлорметана и этилацетата в соотношении 80:20. Получают 49 мг целевого соединения(М=184,20 г) в виде твердого вещества белого цвета. Соответствующий выход составляет 65%. Н-ЯМР-спектр (300 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность) : 1,60-2,2: N-CH-CH2-CH2; 2,24 (с): СН 3; 2,95(уш.дд): N-CH2-CH2; 3,94 (уш.т): O=C-N-CH. ИК-спектр (СНСl3): 1798; 1764 см-1. МС (ЭУ) m/z: [M]+=184, 142, 125, 43. Пример 19 с. 6-(Бензоилокси)-1,6-диазабицикло[3,2,1]октан-7-он. Следуют методике, подобной таковой,описанной в примере 19b, исходя из 205 мг соединения, полученного в примере 19 а, и 200 мг бензойного ангидрида. Таким образом получают 64 мг целевого соединения брутто-формулыC13H14N2O3 (M=246,27 г), или выход составляет 30%. 1 Н-ЯМР-спектр (250 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,64-1,95 (м) и 2,10-2,35 (м): СН-СН 2-CH2; 3,02 (д) и 3,65 (дм): N-CH2-CH; 3,13 (д) и 3,55(уш.дд): N-CH2-CH2; 4,09 (уш.т): O=C-N-CH; 7,4 9 (м): 7,65 (т); 8,12 (м): С 6 Н 5. ИК-спектр (СНСl3): 1774, 1756; 1602, 1585,1495 см-1. МС (ЭУ) m/z: [M]+=246, 105, 77. Пример 19d. 6-(1-Оксопропокси)-1,6 диазабицикло[3,2,1]октан-7-он. Следуют методике, подобной таковой,описанной в примере 19 с, исходя из 163 мг соединения, полученного в примере 19 а, и 70 мкл пропионилхлорида. Таким образом получают 17 мг целевого соединения брутто-формулыC9H14N2O3 (М=198,23 г), или выход составляет 12%. 1 Н-ЯМР-спектр (300 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,25 (т): О=С-СН 2-СН 3; 1,65 (м), 1,78 (м) и 2,10 (м): N-CH-СН 2-СН 2; 2,52 (м) О=С-СН 2-СН 3; 2,94 (д) и 3,55 (уш.д): N-CH2-CH; 3,07 (д) и 3,48(дд): N-CH2-CH2; 3,93 (м): N-CH2-CH. ИК-спектр (СНСl3): 1792; 1763 см-1. МС (ЭУ) m/z: [M]+=198, 170, 142, 125, 97,57. Пример 19 е. 6-(4-Метилфенил)сульфонил]окси]-1,6-диазабицикло[3,2,1]октан-7-он. Следуют методике, подобной, описанной в примере 19d, исходя из 139 мг соединения, полученного в примере 19 а, и 126 мг тозилхлорида. Таким образом получают 77 мг целевого соединения брутто-формулы(М=296,35 г), или выход составляет 44%. 1 Н-ЯМР-спектр (250 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,55 и 2,99 (м): N-CH-CH2-CH2; 2,45 (с): СН 3; 2,89 (д), 3,00 (д), 3,29 (д) и 3,39 (дд): CH2N-CH2; 4,04 (м): N-CH; 7,35 и 7,91 [АА'ВВ'] 40 Следуют методике, подобной описанной в примере 19 е, исходя из 211 мг соединения, полученного в примере 19 а, и 80 мкл мезилхлорида. Таким образом получают 50 мг целевого соединения брутто-формулы(M=220,25 г), или выход составляет 25%. 1 Н-ЯМР-спектр (250 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,56 и 2,38 (м): N-CH-CH2-CH2; 3,00 (д),3,12 (д) и 3,49 (м): N-(CH2)2; 3,26 (с): СН 3; 4,12(м): N-CH. ИК-спектр (СНСl3): 1775; 1381, 1187 см-1. МС (ЭУ) m/z: [M]+=220, 141, 125, 97, 79. Пример 19g. 6-(4-Нитрофенил)сульфонил]окси]-1,6-диазабицикло[3,2,1]октан-7-он. Следуют методике, подобной описанной в примере 19f, исходя из 270 мг соединения, полученного в примере 19 а, и 283 мг 4 нитробензолсульфонилхлорида. Таким образом получают 205,5 мг целевого соединения бруттоформулы C12H13N3O6S (М=327,32 г), или выход составляет 54%. 1 Н-ЯМР-спектр (250 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,64 (д), 1,84 (м), 1,99 (м), 2,31 (дм): NCHCH2-CH2; 2,94 (д), 3,30 (д), 3,04 (д), 3,40 (уш.дд):M=199,251 г) растворяют в 50 мл дихлорметана. Затем к раствору добавляют 4,67 г тозилгидразина и оставляют реагировать в течение 2 ч при перемешивании, затем растворитель выпаривают при пониженном давлении. Таким образом получают с количественным выходом 9,56 г 1,1 диметилэтил-3-[2-[(4-метилфенил)сульфонил] гидразоно]-1-пиперидинкарбоксилата бруттоформулы C17H25N3O4S (M=367,47 г). В атмосфере инертного газа смешивают 4,5 г (12,2 ммоль) полученного выше соединения, 90 мл смеси метанола и тетрагидрофурана в соотношении 50:50 и несколько крупинок бромкрезолового зеленого. Затем добавляют 1,62 гNaBH3CN, потом охлаждают до температуры около 0-5 С и вводят с целью сохранения значения рН среды в пределах от 3,8 до 5,4 раствор газообразного хлороводорода в метаноле с концентрацией 0,7 моль/л. Реакцию проводят при перемешивании в течение 2,5 ч. Выпаривают при пониженном давлении 2/3 растворителей,затем добавляют 200 мл дихлорметана и промывают насыщенным водным раствором гидрокарбоната натрия. Органическую фазу сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Таким образом(М=369,486 г). Соответствующий выход составляет 99%. В атмосфере инертного газа и при температуре 0 С смешивают 4,48 г полученного выше соединения и 9 мл этилацетата. Добавляют 30 мл раствора газообразного хлороводорода в этилацетате с концентрацией 4 моль/л, перемешивают в течение 15 мин, затем фильтруют и гидрохлорид промывают этилацетатом. Высушивают при пониженном давлении и получают 3,48 г дигидрохлорида 2-(3-пиперидинил)гидразида 4-метилбензолсульфокислоты бруттоформулы C12H19N3O2S2HCl (М=342,289 г). Соответствующий выход составляет 84%. Затем 3,48 г полученного выше соединения растворяют в 5 мл деминерализованной воды. При интенсивном перемешивании добавляют 10,2 мл 2 н. водного раствора гидроксида натрия. После контактирования в течение 1-2 мин выпадает осадок. Затем перемешивают в течение 10 мин, после чего осадок отфильтровывают и промывают его водой, петом этилацетатом. Полученное твердое вещество высушивают при пониженном давлении. Таким образом получают 2,21 г 2-(3-пиперидинил)гидразида 4-метилбензолсульфокислоты брутто-формулыC12H19N3O2S (М=269,328 г). Соответствующий выход составляет 81%. В атмосфере инертного газа смешивают 500 мг (1,85 ммоль) полученного выше амина и 20 мл тетрагидрофурана. К полученной суспензии при температуре от 0 до 5 С добавляют 112 мкл дифосгена, затем 517 мкл триэтиламина и 23 мг DMAP. Реакцию проводят при перемешивании и повышении температуры до 20 С. Затем разбавляют этилацетатом, после чего промывают 10%-ным водным раствором винной кислоты, потом деминерализованной водой. Органическую фазу сушат над сульфатом магния, затем растворитель выпаривают при пониженном давлении. Получают 769 мг сырого продукта, который растворяют в 7 мл дихлорметана и 517 мкл триэтиламина. Реакцию проводят в течение ночи при перемешивании. Разбавляют дихлорметаном, промывают водой, сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Полученную пену (395 мг) очищают путем хроматографии на диоксиде кремния с помощью смеси дихлорметана и этилацетата в соотношении 80:20. Получают 44 мг целевого соединения брутто-формулыC13H17N3O2S (М=295,362 г). Соответствующий выход составляет 8%. 1 Н-ЯМР-спектр (250 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,55-1,80 (м) и 2,18 (м): N-CH-CH2-CH2; 2,42 (с): СН 3; 2,88 (д) и 2,93 (м); N-CH2-CH; 3,18-3,32 (м): N-CH2-CH2; 4,08 (м): N-СН-СН 2; 6,98 (уш.с): NH.[M+Na] +=318; [M+H]+=296. Пример 21. 6-[(4-Метилфенил)сульфонил]1,6-диазабицикло[3,2,1]октан-7-он. В 3 мл безводного дихлорметана растворяют 305 мг (1,52 ммоль) 1,1-диметилэтил-3 амино-1-пиперидинкарбоксилата (описывается вJ. Med. Chem., 35, 4334-4343 (1992 бруттоформулы C10H20N2O2 (М=200,282 г). Затем добавляют 212 мкл триэтиламина, после чего охлаждают до температуры 5 С и добавляют 278 мг тозилхлорида. Перемешивают до достижения температуры 20 С и оставляют реакцию в течение 2 ч. Затем разбавляют дихлорметаном и промывают сначала 10%-ным водным раствором винной кислоты, затем раствором фосфатного буфера с рН=7. Органическую фазу отделяют и сушат над сульфатом магния, затем растворитель выпаривают при пониженном давлении. Таким образом получают масло, которое очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и этилацетата в соотношении 9:1. Получают 440 мг 1,1-диметилэтил-3-(4-метилфенил)сульфонил] амино]-1-пиперидинкарбоксилата(описывается в J. Med. Chem., 35, 4334-4343 (1992 бруттоформулы C17H26N2O4S (М=354,472 г). Соответствующий выход составляет 82%. Смесь из 425 мг полученного выше соединения и 2,1 мл смеси трифторуксусной кислоты и дихлорметана в соотношении 50:50 охлаждают до температуры 0-5 С. Перемешивают в течение 30 мин при температуре 5 С. Затем растворитель выпаривают при пониженном давлении, получая 403 мг трифторацетата 4-метил-N(3-пиперидинил)бензолсульфонамида бруттоформулы C14H19F3N2O4S (М=368,377 г). 228 мг полученного выше соединения суспендируют в 2 мл метанола. Обрабатывают с помощью избытка активированной гидроксидом натрия смолы DOWEX 21 К, 20-50 меш. Отфильтровывают, промывают смолу метанолом,затем фильтрат выпаривают при пониженном давлении. Таким образом получают 123 мг 4 метил-N-(3-пиперидинил)бензолсульфонамида брутто-формулы C12H18N2O2S (М=254,353 г). В атмосфере инертного газа 118 мг полученного выше амина растворяют в 1,2 мл дихлорметана. После этого последовательно вводят 98 мкл триэтиламина, затем 28 мкл дифосгена. Оставляют реакцию при перемешивании в течение 30 мин при температуре 0-5 С. Разбавляют дихлорметаном, органическую фазу промывают 10%-ным водным раствором винной кислоты, затем водой. После высушивания над сульфатом натрия, фильтрации и выпаривания растворителя при пониженном давлении сырой продукт очищают путем хроматографии на диоксиде кремния, используя в качестве элюи 43 рующего средства смесь дихлорметана и ацетона в соотношении 95:5. Таким образом получают 112 мг хлорангидрида 3-(4-метилфенил) сульфонил]амино]-1-пиперидинкарбоновой кислоты брутто-формулы(М=316,308 г). Соответствующий выход составляет 76%. В инертной атмосфере 10 мг гидрида натрия (в виде 55-65%-ной суспензии в масле) смешивают с 2 мл безводного тетрагидрофурана. Затем добавляют 71 мг полученного выше продукта. Перемешивают при комнатной температуре в течение 15 мин, затем добавляют 12 мкл уксусной кислоты и 2 мл раствора фосфатного буфера с рН=7. Перемешивают еще в течение 5 мин, затем добавляют 5 мл этилацетата,декантируют, затем повторно экстрагируют этилацетатом. После этого органическую фазу отделяют и сушат над сульфатом магния,фильтруют и растворитель выпаривают при пониженном давлении. Таким образом получают 65 мг сырого продукта, который очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и ацетона в соотношении 95:5. Таким образом получают 40 мг целевого соединения брутто-формулы(М=280,348 г). Соответствующий выход составляет 64%. 1 Н-ЯМР-спектр (250 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность) (в присутствии двух изомеров в соотношении 90/10): 1,46 (м), 1,76 (м) и 2,08 (дм): NCH-CH2CH2; 2,44 (с) и 2,45 (с): СН 3; 2,82 (д) и 2,98 (м) и 3,28-3,50 (м): -N-(CH2)2; 4,55 (м) и 4,65(м): CON-CH; 7,33 и 7,78, 7,35 и 8,02 [АА'ВВ'] CH3C6H4-SO2. ИК-спектр (СНСl3): 1758, 1598, 1995, 1367,1169 см-1. МС (ЭУ) m/z: [M]-=280, 216, 155, 125, 97,91. Пример 22. 6-Окса-1-азабицикло[3,2,1]окт 3-ен-7-он. В атмосфере инертного газа смешивают 5 мл дихлорметана и 68 мг гидрохлорида 1,2,3,6 тетрагидропиридин-3-ола (М=135,5 г) (описывается в Chem. Pharm. Bull., 30. (10), 3617-3623(1982. Добавляют 33 мкл дифосгена и перемешивают в течение 5 мин при температуре 0 С. Затем добавляют 140 мкл триэтиламина и 61 мгDМАР. Оставляют реакцию при комнатной температуре в течение 2 ч, затем разбавляют дихлорметаном и промывают 10%-ным водным раствором винной кислоты, потом водой. Органическую фазу декантируют и сушат над сульфатом магния. Растворитель выпаривают при пониженном давлении. Таким образом получают 5 мг сырого продукта, который очищают путем хроматографии на диоксиде кремния,элюируя дихлорметаном, затем смесью дихлорметана и этилацетата в соотношении 95:5. Таким образом получают 3 мг целевого соедине 004920 44 ния брутто-формулы С 6H7NO2 (М=125 г). Соответствующий выход составляет 5%. Пример 23. Фенилметил-транс-3-бекзоил 2-оксо-4-окса-1,3-диазабицикло[3,2,1]октан-7 карбоксилат. В атмосфере инертного газа 5,50 г (13,7 ммоль) 1-(1,1-диметилэтил)- и 2-(фенилметил)цис-4-[(метилсульфонил)окси]-1,2-пирролидиндикарбоксилата (описывается в J. Org. Chem.,56,3009-3016C18H25NO7S (M=399,466 г) смешивают со 110 мл диметилформамида, затем добавляют 2,58 г Nгидроксифталимида, потом 1,52 г гидрокарбоната калия. Нагревают при перемешивании до температуры 100 С и реакционную смесь выдерживают при этой температуре в течение 4 ч. Охлаждают до температуры 20 С, добавляют 220 мл воды и льда, затем экстрагируют диизопропиловым эфиром. Сушат над сульфатом магния, затем выпаривают досуха при пониженном давлении. Остаток хроматографируют на диоксиде кремния, элюируя смесью дихлорметана и этилацетата в соотношении 90:10. Таким образом получают 3,06 г 1-(1,1-диметилэтил)- и 2-(фенилметил)-транс-4-[(1,3-дигидро 1,3-диоксо-2 Н-изоиндол-2-ил)окси]-1,2-пирролидиндикарбоксилата брутто-формулыC25H26N2O7 (М=466,494 г). Соответствующий выход составляет 47%. 3,24 г (6,94 ммоль) полученного выше фталимида растворяют в 33 мл дихлорметана. Добавляют 372 мкл гидразингидрата. Перемешивают еще в течение 2 ч 30 мин при температуре 20 С. Выпавший осадок отфильтровывают,промывают дихлорметаном, затем растворитель выпаривают при пониженном давлении. Получают 2,91 г сырого продукта, который очищают путем хроматографии на диоксиде кремния,элюируя смесью дихлорметана и этилацетата в соотношении 90:10, затем 80:20 и 50:50. Таким образом выделяют в целом 942 мг 1-(1,1 диметилэтил)и 2-(фенилметил)-транс-4(аминоокси)-1,2-пирролидиндикарбоксилата брутто-формулы C17H24N2O5 (М=336,39 г). Соответствующий выход составляет 40%. В атмосфере инертного газа 853 мг (2,53 ммоль) полученного выше соединения смешивают с 8,5 мл безводного дихлорметана. Охлаждают до температуры около 0-5 С, затем добавляют 706 мкл триэтиламина и 588 мкл бензоилхлорида. Перемешивают в течение 10 мин при температуре 0-5 С, затем оставляют снова нагреваться до температуры 20 С и оставляют реакцию в течение 30 мин. Органическую фазу промывают 10%-ным водным раствором винной кислоты, затем водой. Органическую фазу декантируют и сушат над сульфатом натрия, растворитель выпаривают при пониженном давлении. Таким образом получают 1,38 г продукта,который смешивают с 25 мл дихлорметана. Охлаждают до температуры 10-15 С и добавляют 123 мкл гидразингидрата. Реакцию проводят 45 при перемешивании и при температуре 20 С в течение двух с половиной часов. Растворитель выпаривают при пониженном давлении. Таким образом получают 1,13 г сырого продукта, который очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и этилацетата в соотношении 80:20. Получают 948 мг 1-(1,1-диметилэтил)- и 2-(фенилметил)транс-4-[(бензоиламино)окси]-1,2-пирролидиндикарбоксилата брутто-формулы C24H28N2O6(М=440,50 г). Общий выход, следовательно,составляет 85%. При перемешивании 948 мг полученного выше соединения растворяют в 2 мл этилацетата. Охлаждают до температуры 0-5 С, затем добавляют за один раз 4,7 мл примерно 4,6 М раствора газообразного хлороводорода в этилацетате. Спустя 1 ч растворитель выпаривают при пониженном давлении и продукт обрабатывают 3 раза диэтиловым эфиром. Растворитель выпаривают при пониженном давлении. Таким образом получают 842 мг гидрохлорида фенилметил-транс-4-[(бензоиламино)окси]-2-пирролидинкарбоксилата в виде хрупкой белой пены формулы C19H20N2O4HCl (М=376,84 г). Выход является количественным. В атмосфере инертного газа 47 мг (0,125 ммоль) полученного выше гидрохлорида растворяют в 0,5 мл дихлорметана. Добавляют 25,2 мкл пиридина, затем охлаждают до температуры 0-5 С и добавляют 9,5 мкл дифосгена. Оставляют температуру повышаться до 20 С, разбавляют дихлорметаном, затем реакционную среду промывают 10%-ным водным раствором винной кислоты, потом водой. Органическую фазу декантируют и сушат ее над сульфатом натрия. Затем растворитель выпаривают при пониженном давлении. Таким образом получают 43,8 мг сырого продукта, который очищают путем хроматографии на диоксиде кремния,элюируя смесью дихлорметана и этилацетата в соотношении 90:10. Получают 34,9 мг фенилметил-транс-4-[(бензоиламино)окси]-1-(хлоркарбонил)-2-пирролидинкарбоксилата бруттоформулы C20H19ClN2O5 (М=402,83 г). Соответствующий выход составляет 69%. 13 мг (0,032 ммоль) полученного выше соединения растворяют в 4 мл толуола. Добавляют 9 мкл триэтиламина и 7,8 мг DMAP. Нагревают при температуре 100 С в течение ночи. Растворитель выпаривают при пониженном давлении, затем остаток очищают путем хроматографии, элюируя дихлорметаном. Таким образом получают 4,3 мг целевого соединения брутто-формулы C20H18N2O5 (М=336,37 г). Соответствующий выход составляет 40%. 1 Н-ЯМР-спектр (300 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,97 (ддд) и 2,85 (ддд): N-O-CH-CH2-CH; 3,80 (дд) и 4,14 (дд): N-O-CH-CH2-N; 4,75 (дд):[2,2,2]октан-2-он. В атмосфере азота 2,4 г (10 ммоль) гидрохлорида N-(4-пиперидинил)бензамида (описывается в J. Med. Chem. EN., 17, 736-739 (1974 брутто-формулы C12H16N2O растворяют в 30 мл дихлорметана. Охлаждают до температуры 0 С,при перемешивании добавляют 2,8 мл триэтиламина и 0,66 мл дифосгена. Спустя несколько минут разбавляют дихлорметаном, затем промывают 10%-ным водным раствором винной кислоты, потом водой. Органическую фазу декантируют, сушат ее над сульфатом магния и растворитель выпаривают при пониженном давлении. Остаток очищают на диоксиде кремния,элюируя смесью дихлорметана и этилацетата в соотношении 90:10. Получают 1,62 г хлорангидрида 4-(бензоиламино)-1-пиперидинкарбоновой кислоты брутто-формулы C13H15ClN2O5(М=266,5 г). Соответствующий выход составляет 61%. В атмосфере азота 1,21 г (48 ммоль) полученного выше соединения растворяют в 37 мл тетрагидрофурана. Раствор охлаждают до температуры -78 С, затем добавляют по каплям 5 мл 1 М раствора бис(триметилсилил)амида лития в тетрагидрофуране. Выдерживают при температуре -78 С в течение 15 мин, затем оставляют для повышения температуры до комнатной и продолжают реакцию еще в течение часа. Раствор охлаждают до температуры 0 С,добавляют 720 мкл уксусной кислоты. Выпадает осадок. Разбавляют этилацетатом, затем промывают 10%-ным водным раствором винной кислоты и раствором фосфатного буфера с рН=7,0. Органическую фазу декантируют и сушат ее над сульфатом магния. Фильтруют, затем растворитель выпаривают при пониженном давлении. Сырой продукт очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и этилацетата в соотношении 90:10. Таким образом получают 0,214 г целевого соединения формулы C18H14N2O2 (М=230 г), кристаллизованного из диэтилового эфира. Соответствующий выход составляет 20%. 1 Н-ЯМР-спектр (250 МГц; диметилсульфоксид; химические сдвиги пиков в м.д. и мультиплетность): 1,71-2,02 (м): (CH2)2-CHN; 3,14 (т): N(CH2)2; 4,84 (м): (CH2)2-CHN; 7,39-7,65 (м): С 6 Н 5. ИК-спектр (СНСl3): 1735, 1682; 1618, 1602,1582; 1488 см-1. МС (ионизация электронным распылением с образованием положительных ионов) m/z: 47 Пример 25. Дифенилметил-транс-7-оксо-6 окса-1-азабицикло[3,2,1]октан-2-карбоксилат. В инертной атмосфере смешивают 15 мл дихлорметана и 197 мг (0,633 ммоль) дифенилметил-транс-5-гидрокси-2-пиперидинкарбоксилата (описывается в Rec. Trav. Chim., 78, 648658 (1959 брутто-формулы C19H21NO3. Охлаждают до температуры 0 С, затем последовательно добавляют 42 мкл дифосгена, 177 мкл триэтиламина, потом 77 мг DMAP. Оставляют реакцию в течение 4 ч при комнатной температуре. Затем реакционную смесь промывают 10%ным водным раствором винной кислоты, потом водным насыщенным раствором хлорида натрия. Органические фазы объединяют и сушат их над сульфатом магния, растворитель выпаривают при пониженном давлении и таким образом получают 195 мг сырого продукта, который очищают путем хроматографии на диоксиде кремния, элюируя дихлорметаном, содержащим 0,1% воды. Получают масло, которое кристаллизуют из смеси пентана и диэтилового эфира. Таким образом выделяют 108 мг целевого соединения в виде кристаллов белого цвета, соответствующего брутто-формуле(М=337,338 г). Соответствующий выход составляет 51%. 1 Н-ЯМР-спектр (400 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,86 (м) и 2,03 (м): N-CH-CH2-CH2-CO; 2,27 (м): N-CH-CH2-СН 2-СО; 3,07 (д) и 3,29 (м):(м): СН(С 6 Н 5)2. ИК-спектр (СНСl3): 1788, 1736; 1496 см-1. МС (SIMS) m/z: [M+Na]+=360; [M+Li]+= 344; [M]+=337, 167. Пример 26 а. (4-Нитрофенил)метил-транс 7-оксо-6-окса-1-азабицикло[3,2,1]октан-2-карбоксилат. В инертной атмосфере 66 мл дихлорметана смешивают с 1 г (3,56 ммоль) (4-нитрофенил) метил-транс-5-гидрокси-2-пиперидинкарбоксилата брутто-формулы C13H16N2O5 (M=280,282 г). Охлаждают до температуры 0 С и добавляют 0,24 мл дифосгена. Реакцию проводят при перемешивании в течение 10 мин при температуре 0 С, затем оставляют нагреваться до комнатной температуры. Растворитель выпаривают при пониженном давлении. Остаток растворяют в 66 мл толуола и добавляют 0,99 мл триэтиламина. Колбу погружают в масляную баню с температурой 110 С и выдерживают там в течение 15 мин. Затем доводят температуру до комнатной. Промывают 10%-ным водным раствором винной кислоты, затем насыщенным водным раствором хлорида натрия. Органическую фазу сушат над сульфатом магния, затем растворитель выпаривают при пониженном давлении. Таким образом получают 0,885 г сырого продукта, который очищают путем хроматографии на диоксиде кремния, элюируя смесью толуола 48 и этилацетата в соотношении 85:15. Таким образом получают 0,184 г целевого соединения брутто-формулы C14H14N2O6 (М=306,276 г) в виде масла желтого цвета. Соответствующий выход составляет 17%. 1 Н-ЯМР-спектр (400 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,92 (м) и 2,07 (м): N-CH-CH2-CH2-CO; 2,22 (м) и 2,30 (м): N-CH-CH2-CH2-CO; 3,17 (д) и 3,35 (дм): N-CH2-CHO; 4,28 (дд): N-СН-СН 2; 4,79 (м): N-CH2-CHO; 5,33 [АВ]: CO2-CH2C6H4NO2; 7,56 и 8,25 [АА'ВВ']: СН 2-С 6 Н 4NО 2. ИК-спектр (СНСl3): 1791, 1745; 1609, 1526,1495 см-1. МС (ЭУ) m/z: [М]+=306, 262, 136, 126, 82,55. Пример 26b. транс-7-Оксо-6-окса-1 азабицикло[3,2,1]октан-2-карбоновая кислота. Смешивают 14 0 мг (0,457 ммоль) сложного эфира, полученного в примере 26 а, 7 мл ацетона и 28 мг катализатора 20 мас.%-ного палладия-на-угле. Затем реакцию проводят при перемешивании в течение 25 мин в атмосфере водорода при нормальном давлении. Катализатор отфильтровывают и растворитель затем выпаривают при пониженном давлении. Таким образом получают 137 мг целевого соединения брутто-формулы C7H9NO4 (М=171,152 г) в виде масла в смеси с одним молем п-толуидина. Соответствующий выход составляет 97%. 1 Н-ЯМР-спектр (400 МГц; диметилсульфоксид; химические сдвиги пиков в м.д. и мультиплетность): 1,84 (м) и 1,95-2,05 (м): N-CH-CH2-CH2CO; 3,13 (д) и 3,24 (дд): N-CH2-CHO; 4,02 (дд):N-CH-CH2; 4,81 (дм): N-CH2-CHO. Пример 26 с. Метил-транс-7-оксо-6-окса-1 азабицикло[3,2,1]октан-2-карбоксилат. 17,25 мг (0,1 ммоль) полученной в примере 26b кислоты растворяют в 3 мл дихлорметана. Обрабатывают избытком диазометана в виде раствора в дихлорметане, затем растворитель выпаривают при пониженном давлении. Таким образом получают 30 мг сырого продукта, который очищают путем хроматографии на диоксиде кремния, элюируя смесью толуола и этилацетата в соотношении 90:10. Получают 6,7 мг целевого соединения (М=485,187 г). Соответствующий выход составляет 36%. Пример 27. (4-Нитрофенил)метил-цис-7 оксо-6-окса-1-азабицикло[3,2,1]октан-2-карбоксилат. В атмосфере азота в 40 мл дихлорметана вводят 0,802 г (2,034 ммоль) трифторацетата (4 нитрофенил)метил-цис-5-гидрокси-2-пиперидинкарбоксилата (описывается в Rec. Trav.C13H16N2O5CF3CO2H (М=394,303 г) и охлаждают до температуры 0 С. Добавляют 0,135 мл дифосгена. Перемешивают в течение 15 мин при температуре 0 С, температуру повышают до комнатной и продолжают перемешивание в те 49 чение 35 мин. Растворитель выпаривают при пониженном давлении. Этот продукт растворяют в 40 мл толуола и 1,1 мл триэтиламина. Реакционную смесь в течение 35 мин выдерживают при температуре 100 С, затем оставляют охлаждаться до комнатной температуры. Промывают водой, затем раствором фосфатного буфера с рН=7. Органическую фазу сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Таким образом получают 0,56 г сырого продукта, который очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и ацетона в соотношении 95:5. Таким образом получают 110 мг целевого соединения брутто-формулы С 14 Н 14N2O2 (M=306,275 г) в виде масла. Соответствующий выход составляет 17%. 1 Н-ЯМР-спектр (300 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,80-1,94 и 2,10-2,45: N-CH-CH2-CH2-CO; 3,07 (д), 3,04 (дм) и 3,86 (дд): CH-N-CH2; 4,80Trav. Chim., 78, 648-658 (1959 растворяют в 80 мл безводного дихлорметана. Охлаждают до температуры 5 С и добавляют 9,5 мл триэтиламина, затем по каплям 6,46 мл трифторуксусного ангидрида. Реакцию ведут при перемешивании при температуре 5 С в течение одного часа,затем разбавляют дихлорметаном, промывают последовательно 10%-ным раствором винной кислоты, водным раствором фосфатного буфера с рН=7 и водным раствором хлорида натрия. Органическую фазу декантируют и сушат ее над сульфатом магния. Затем растворитель выпаривают при пониженном давлении. Таким образом получают 10 г масла красного цвета, которое растворяют в 100 мл метанола. Охлаждают до температуры около 10 С и медленно, при температуре максимально 20 С, добавляют 6,8 г (78 ммоль) гидрокарбоната натрия в виде раствора в 100 мл воды. Реакцию ведут при перемешивании и при температуре 20 С в течение 30 мин,экстрагируют дихлорметаном. Органическую фазу декантируют, промывают ее водным насыщенным раствором хлорида натрия и сушат ее над сульфатом магния. Растворитель выпари 004920 50 вают при пониженном давлении и таким образом получают 7,6 г масла оранжевого цвета,которое очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и этилацетата в соотношении 95:5. Таким образом получают 6 г целевого соединения бруттоформулы C15H16F3NO4 (M=331,294 г). Соответствующий выход составляет 68%. Стадия В. Фенилметил-транс-5-[(2-пропенилокси) амино]-1-(трифторацетил)-2-пиперидинкарбоксилат. В 29 мл ацетонитрила вводят 1,74 г (5,26 ммоль) полученного выше спирта. Охлаждают до температуры -40 С и при этой температуре добавляют 0,61 мл 2,6-лутидина (C5H3N(CH3)2),затем 0,91 мл ангидрида трифторметансульфокислоты. Реакцию ведут при перемешивании в течение 30 мин при температуре -40 С. Затем добавляют все время при температуре -40 С в течение одной минуты 0,7 мл (10,52 ммоль) Оаллилгидроксиламина. Доводят температуру до 0 С, затем добавляют 0,61 мл 2,6-лутидина и выдерживают реакционную смесь в течение ночи (15 ч) при температуре около 5 С, затем еще 2 ч при температуре 20 С. После этого разбавляют дихлорметаном, промывают водным раствором гидрокарбоната натрия, затем 10%ным водным раствором винной кислоты и водным насыщенным раствором хлорида натрия. Органическую фазу декантируют, сушат ее над сульфатом магния и растворитель выпаривают при пониженном давлении. Таким образом получают 2,1 г масла желтого цвета, которое очищают путем хроматографии на диоксиде кремния, элюируя смесью толуола и этилацетата в соотношении 90:10. Получают 1,23 г целевого соединения брутто-формулы(М=386,374 г). Соответствующий выход составляет 61%. Стадия С. Фенилметил-транс-5-[(2-пропенилокси) амино]-2-пиперидинкарбоксилат. В инертной атмосфере 1,41 г (3,65 ммоль) полученного выше соединения растворяют в 25 мл безводного метанола. Охлаждают до температуры 0-5 С, затем осуществляют 3 добавления, с промежутками в 45 мин, 145 мг NaBH4. Реакционную среду затем подкисляют до рН=2 1 н. водным раствором соляной кислоты, предварительно охлажденной до 5 С. Экстрагируют этилацетатом. Водную фазу охлаждают до температуры 5 С, добавляют 100 мл этилацетата и обрабатывают насыщенным раствором карбоната натрия вплоть до достижения рН, равного 8,5-9. Затем амин экстрагируют этилацетатом. Органическую фазу промывают водным насыщенным раствором хлорида натрия, потом сушат над сульфатом магния и концентрируют путем выпаривания растворителя при пониженном давлении. Таким образом получают 0,628 г целевого продукта брутто-формулы C16H22N2O3(М=290,364 г). Соответствующий выход составляет 59%. Стадия D. Фенилметил-транс-7-оксо-6-(2-пропенилокси)-1,6-диазабицикло[3,2,1]октан-2-карбоксилат. В инертной атмосфере 103 мг (0,35 ммоль) полученного выше амина растворяют в 35 мл безводного дихлорметана. Раствор охлаждают до температуры около 0-5 С и при этой температуре добавляют по каплям 0,1 мл триэтиламина, затем 21 мкл дифосгена. Реакцию ведут при перемешивании в течение 15 мин при температуре 0-5 С, затем оставляют для повышения до 20 С и добавляют 42 мг DMAP. Продолжают перемешивание при температуре 20 С в течение примерно 5 ч. Разбавляют дихлорметаном, промывают 10%-ным водным раствором винной кислоты, затем водой. Органическую фазу сушат над сульфатом магния и концентрируют путем выпаривания растворителя при пониженном давлении. Таким образом получают 70 мг сырого продукта, который очищают путем хроматографии на 5 г диоксида кремния, элюируя смесью дихлорметана и метанола в соотношении 98:2. Получают 48 мг целевого продукта формулы C17H20N2O4 (М=316,36 г). Соответствующий выход составляет 43%. ИК-спектр (СНСl3): 1750; 1642; 1600, 1496 см-1. МС (ионизация электронным распылением с образованием положительных ионов) m/z:[M+Na+CH3CN]+=380; [M+Na]+=339; [М+Н]+= 317. Стадия Е. 1-Пропенилтрифенилфосфониевая соль фенилметил-транс-7-оксо-6-(сульфокси)-1,6 диазабицикло[3,2,1]октан-2-карбоксилата. В инертной атмосфере 202 мг (0,638 ммоль) полученного на стадии D соединения растворяют в 5,5 мл безводного дихлорметана. К полученному раствору при температуре 20 С добавляют 73 мкл уксусной килоты, затем 369 мг Pd[P(С 6 Н 5)3]4. После перемешивания в течение 30 мин при комнатной температуре образовавшуюся N-гидроксимочевину обрабатывают с помощью 5,5 мл пиридина и 358 мг комплексаSО 3-пиридин. Реакцию ведут при перемешивании в течение 18 ч при температуре 20 С, затем реакционную среду концентрируют путем выпаривания растворителя при пониженном давлении. Остаток обрабатывают с помощью 50 мл дихлорметана и промывают водой. Органическую фазу сушат над сульфатом магния и дихлорметан выпаривают при пониженном давлении. Таким образом получают 650 мг сырого продукта, который очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и ацетона в соотношении 60:40, содержащей 0,1 об.% триэтиламина. Таким образом получают 280 мг фосфониевой соли целевого соединения брутто-формулы C35H35N2O7PS(М=646,705 г). Соответствующий выход составляет 68%. 1 Н-ЯМР-спектр (300 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 2,05 (м), 2,22 (дм) и 2,33 (м): N-CH-CH2CH2; 2,95 (д) и 3,30 (д); O=C-N-CH2; 4,10 (м) и 4,32 (м): OC-N-CH и O=C-N-CH2-СН; 5,12 (с): СОО-СН 2-С 6 Н 5; 7,36: С 6 Н 5 и 2,30 (м): СН 3 СН=СН; 6,65 и 7,20 СН 3-СН=СН; 7,65-7,85 Р(С 6 Н 5)3. ИК-спектр (СНСl3): 1746; 1638, 1605, 1587,1495 см-1. МС (ионизация электронным распылением с образованием положительных и отрицательных ионов) m/z: [М анион]-=355; [М катион]+=303. Пример 28b. Фенилметил-транс-7-оксо-6(сульфокси)-1,6-диазабицикло[3,2,1]октан-2 карбоксилат натрия. 236 мг (0,364 ммоль) фосфониевой соли,полученной на стадии Е примера 28 а, растворяют в 0,8 мл тетрагидрофурана и 4 каплях воды. Полученный раствор пропускают через колонку со смолой DOWEX 50WX8 в Nа+-форме, элюируя водой. После лиофилизации получают 127 мг целевой натриевой соли брутто-формулыC14H15N2O7SNa (M=378,339 г). Соответствующий выход составляет 92%. 1 Н-ЯМР-спектр (300 МГц; диметилсульфоксид; химические сдвиги пиков в м.д. и мультиплетность): 1,65-2,02: N-CH-CH2-CH2; 2,91 (д) и 3,04[3,2,1]октан-2-карбоксилат. 48 мг (0,152 ммоль) производного, полученного на стадии D примера 28 а, растворяют в 1,2 мл дихлорметана. При температуре 20 С к полученному раствору добавляют 26 мкл уксусного ангидрида, затем 88 мг Pd[P(С 6 Н 5)3]4 и реакцию ведут в течение 2 ч при температуре 20 С и при перемешивании. Разбавляют путем добавления толуола и растворители выпаривают при пониженном давлении. К полученному сырому продукту добавляют 1,5 мл дихлорметана, 25 мкл пиридина и 24 мкл бензолсульфонилхлорида. Реакцию ведут при температуре 20 С и при перемешивании в течение 1 ч, затем добавляют 12,5 мкл пиридина и 10 мкл бензолсульфонилхлорида. Перемешивают в течение 15 мин при температуре 20 С и разбавляют дихлорметаном. Затем последовательно промывают 10%-ным водным раствором винной кислоты, раствором фосфатного буфера с рН=7 и водным насыщен 53 ным раствором хлорида натрия. Органическую фазу сушат над сульфатом магния и растворитель выпаривают при пониженном давлении. Получают 180 мг масла желтого цвета, которое очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и третбутилметилового эфира в соотношении 95:5. Таким образом получают 20 мг целевого соединения брутто-формулы C20H20N2O6S (М=416,456 г). Соответствующий выход составляет 31%. 1 Н-ЯМР-спектр (300 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,83 (м) и 2,00-2,25 (м): N-CH-CH2-CH2; 3,02 (д) и 3,16 (дм): O=C-N-CH2; 4,04 (м) и 4,11[3,2,1]октан-2-карбоксилат. Исходя из 100 мг (0,316 ммоль) соединения, полученного на стадии D примера 28 а, следуют методике, подобной только что описанной, за исключением того, что вместо бензолсульфонилхлорида используют 2-тиенилсульфонилхлорид. Таким образом получают 8 мг целевого соединения брутто-формулыC18H18N2O6S2 (M=422,481 г). Соответствующий выход составляет 30%. 1 Н-ЯМР-спектр (300 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,84 (м) и 2,10-2,25: N-CH-CH2-CH2; 3,02[M+Na+CH3CN]+=867; [2M+Na]+=445; 339, 298,91. Пример 28 е. Фенилметил-транс-6-(2 гидрокси-2-оксоэтокси)-7-оксо-1,6-диазабицикло[3,2,1]октан-2-карбоксилат. Стадия А. Фенилметил-транс-7-оксо-6-[2-оксо-2-(2 пропенилокси)этокси]-1,6-диазабицикло[3,2,1] октан-2-карбоксилат. В инертной атмосфере 48 мг (0,15 ммоль) соединения, полученного на стадии D примера 28 а, растворяют в 1,5 мл безводного дихлорметана. При температуре 20 С добавляют 18 мкл уксусной кислоты, затем 88 мг Pd[Р(С 6 Н 5)3]4 и перемешивают в течение 1 ч при температуре 54 20 С. Хроматографируют на диоксиде кремния,элюируя смесью дихлорметана и метил-третбутилового эфира в соотношении 7:3. Растворитель выпаривают при пониженном давлении и получают 70 мг гидроксимочевины, которую обрабатывают с помощью 2 мл дихлорметана,затем добавляют 85 мкл триэтиламина и 64 мкл аллилбромацетата. Перемешивают в течение трех с половиной часов при температуре 20 С. Промывают последовательно 10%-ным водным раствором винной кислоты, водным раствором фосфатного буфера с рН=7 и водой. Органическую фазу сушат и растворитель выпаривают при пониженном давлении. Таким образом получают 60 мг сырого продукта, который хроматографируют на диоксиде кремния, элюируя смесью дихлорметана и метил-трет-бутилового эфира в соотношении 90:10, содержащей 0,1% триэтиламина. Получают 22 мг продукта брутто-формулы C19H22N2O6 (M=374,396 г). Соответствующий выход составляет 39%. Стадия В. Фенилметил-транс-6-(2-гидрокси-2-оксоэтокси)-7-оксо-1,6-диазабицикло[3,2,1]октан-2 карбоксилат. В инертной атмосфере 22 мг (0,0587 ммоль) полученного выше соединения растворяют в 1 мл безводного дихлорметана. При температуре 20 С добавляют 10 мкл уксусной кислоты и 34 мг Pd[P(С 6 Н 5)3]4 и реакцию ведут при перемешивании в течение 30 мин при температуре 20 С. Реакционную среду концентрируют и обрабатывают толуолом для удаления уксусной кислоты. Таким образом получают 49 мг сырого продукта, к которому добавляют 2 мл фосфатного буфера с рН=7, затем промывают 2 раза с помощью 1 мл дихлорметана. Растворитель выпаривают и получают 46 мг сырого продукта, который очищают путем хроматографии на диоксиде кремния, элюируя сначала смесью дихлорметана и метил-трет-бутилового эфира в соотношении 90:10, затем смесью дихлорметана и этанола в соотношении 60:40. Таким образом получают 4,5 мг целевого соединения бруттоформулы C37H37N2O6P (М=636,691 г). Соответствующий выход составляет 12%. Пример 29 а. (4-Нитрофенил)метил-транс 6-бензоил-7-оксо-l,6-диазабицикло[3,2,1]октан 2-карбоксилат. Стадия А. 1-(1,1-Диметилэтил)- и 2-[(4-нитрофенил) метил]-цис-5-(метилсульфонил)окси-1,2-пиперидиндикарбоксилат. В инертной атмосфере в 112 мл дихлорметана растворяют 11,25 г (29,5 ммоль) 1-(1,1 диметилэтил)- и 2-[(4-нитрофенил)метил]-цис 5-гидрокси-1,2-пиперидиндикарбоксилата (описывается в Rec. Trav. Chim. , 78, 648-658 (1959 брутто-формулы C18H24N2O7 (М=380,398 г). Охлаждают до температуры 0-5 С, затем последовательно вводят 5 мл триэтиламина, потом 2,44 мл метансульфонилхлорида. Температуру дово 55 дят до 20 С при перемешивании и реакцию ведут таким образом в течение 1 ч. Затем разбавляют дихлорметаном, промывают два раза водой, сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Таким образом получают 16 г сырого масла,которое очищают путем хроматографии на диоксиде кремния, элюируя дихлорметаном, содержащим 2% этилацетата. Получают 9,14 г целевого продукта брутто-формулыC19H26N2O9S (М=458,491 г). Соответствующий выход составляет 67%. Стадия В. 1-(1,1-Диметилэтил)- и 2-[(4-нитрофенил) метил]-транс-5-азидо-1,2-пиперидиндикарбоксилат. В инертной атмосфере 11,1 г (24,2 ммоль) полученного выше мезилата растворяют в 111 мл диметилформамида. Затем добавляют 1,73 г азида натрия NaN3. Нагревают при перемешивании до температуры 80 С и выдерживают при этой температуре в течение 18 ч. Температуру доводят до 20 С, затем диметилформамид выпаривают при пониженном давлении вплоть до получения незначительного объема, затем разбавляют этилацетатом и промывают 2 н. раствором гидроксида натрия, потом водой. Сушат над сульфатом магния, затем растворители выпаривают при пониженном давлении. Полученное сырое масло очищают путем хроматографии на диоксиде кремния, элюируя дихлорметаном,содержащим 2% этилацетата. Таким образом получают 7,34 г целевого соединения бруттоформулы C18H23N5O6 (М=405,413 г) в виде масла желтого цвета, которое кристаллизуется. Соответствующий выход составляет 75%. Стадия С. 1-(1,1-Диметилэтил)- и 2-[(4-нитрофенил) метил]-транс-5-амино-1,2-пиперидиндикарбоксилат. 7,34 г (18,1 ммоль) полученного выше азида вводят в 150 мл тетрагидрофурана и 30 мл воды. Добавляют 7,2 г трифенилфосфина, затем реакцию ведут при перемешивании при температуре 20 С в течение ночи. После этого растворитель выпаривают при пониженном давлении и осуществляют две обработки с отгонкой при использовании этилацетата. Таким образом получают сухой экстракт, который очищают путем хроматографии на диоксиде кремния,элюируя дихлорметаном, содержащим 5% метанола. Получают 5,62 г целевого соединения брутто-формулы C18H25N3O6 (М=379,416 г). Соответствующий выход составляет 82%. Стадия D. 1-(1,1-Диметилэтил)- и 2-[(4-нитрофенил) метил]-транс-5-(бензоиламино)-1,2-пиперидиндикарбоксилат. 700 мг (1,84 ммоль) полученного выше амина растворяют в 8 мл дихлорметана. Охлаждают до температуры 0 С, затем вводят 257 мкл триэтиламина, потом 214 мкл бензоилхлорида. 56 Температуру доводят до 20 С. После протекания реакции в течение 40 мин разбавляют дихлорметаном, промывают насыщенным раствором гидрокарбоната натрия, затем водой. Сушат над сульфатом натрия, растворитель выпаривают при пониженном давлении. Таким образом получают 867 мг целевого соединения бруттоформулы C25H29N3O7 (М=483,525 г). Соответствующий выход составляет 97%. Стадия Е. Гидрохлорид (4-нитрофенил)метил-транс 5-(бензоиламино)-2-пиперидинкарбоксилата. Смешивают 861 мг (8 ммоль) полученного выше амида, 9 мл метанола и 2,3 мл раствора газообразного хлороводорода в метаноле с концентрацией 8 моль/л. Температуру доводят до 20 С и реакцию ведут в течение 3 ч. Затем добавляют 1,15 мл раствора хлороводорода в метаноле. Перемешивают в течение 20 мин при температуре 20 С, затем растворитель выпаривают при пониженном давлении. После этого осуществляют две отгонки при использовании дихлорметана, затем две отгонки при использовании диэтилового эфира. Продукт кристаллизуют из диэтилового эфира. Таким образом получают 715 мг целевого соединения бруттоформулы C20H22ClN3O5 (М=419,967 г). Соответствующий выход составляет 96%. Стадия F.(4-Нитрофенил)метил-транс-5-(бензоиламино)-1-(хлоркарбонил)-2-пиперидинкарбоксилат. Смешивают 1,08 г (2,58 ммоль) полученного, как указано выше, гидрохлорида и 11 мл дихлорметана. Полученную суспензию охлаждают до температуры около 0-5 С и добавляют 791 мкл триэтиламина, затем к полученному раствору добавляют 161 мкл дифосгена. Перемешивают в течение 5 мин при температуре 05 С, затем температуру доводят до 20 С и перемешивают еще в течение 30 мин. После этого разбавляют дихлорметаном, промывают 10%ным водным раствором винной кислоты, затем водой. Сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Сырой продукт очищают путем хроматографии на диоксиде кремния, элюируя дихлорметаном,содержащим 5% ацетона. Получают 969 мг целевого соединения брутто-формулыC21H20ClN3O6 (М=445,862 г). Соответствующий выход составляет 84%. Стадия G:(4-Нитрофенил)метил-транс-6-бензоил-7 оксо-1,6-диазабицикло[3,2,1]октан-2-карбоксилат. В атмосфере инертного газа смешивают 928 мг (2,08 ммоль) полученного выше соединения и 27 мл тетрагидрофурана. Полученный раствор охлаждают до температуры -78 С при перемешивании, затем вводят 2,1 мл 1 М раствора бис(триметилсилил)амида лития в тетрагидрофуране. Перемешивают при температуре-78 С в течение 10 мин, затем добавляют 130 мкл уксусной кислоты и перемешивают при доведении температуры до 15 С. Разбавляют этилацетатом, затем промывают последовательно 10%-ным водным раствором винной кислоты, раствором фосфатного буфера с рН=7 и водой. Сушат над сульфатом магния и растворитель выпаривают при пониженном давлении. Таким образом получают 1,6 г сухого экстракта,который очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и ацетона в соотношении 98:2. Продукт затем кристаллизуют из диэтилового эфира, получая 204 мг целевого соединения брутто-формулыC21H19N3O6 (М=409,441 г). Соответствующий выход составляет 24%. 1 Н-ЯМР-спектр (250 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,98 (м), 2,22 (м) и 2,40 (м): N-CH-CH2CH2; 3,08 (д) и 3,42 (д): O=C-N-CH2; 4,23 (дд):(м): С 6 Н 5 и C6H4NO2. ИК-спектр (СНСl3): 1763, 1744, 1676; 1609,1603, 1583, 1526, 1492 см-1. МС (ЭУ) m/z: [M]+=409, 304, 273, 201, 105,77. Пример 29b. транс-6-Бензоил-7-оксо-1,6 диазабицикло[3,2,1]октан-2-карбоновая кислота. Смешивают 89 мг полученного в примере 29 а сложного эфира, 4 мл ацетона и 6 мг катализатора 10%-ного палладия-на-угле. Реакцию ведут при перемешивании при температуре 20 С и в атмосфере водорода в течение 2 ч 45 мин, затем катализатор отфильтровывают и фильтрат выпаривают при пониженном давлении. Таким образом получают 88 мг смолы, которую кристаллизуют из 0,5 мл диэтилового эфира. Таким образом получают 54 мг целевого соединения брутто-формулы(М=274,278 г). Соответствующий выход составляет 91%. 1 Н-ЯМР-спектр (250 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,96 (м) 2,10 (м) и 2,37 (м): N-CH-CH2-CH2; 3,13 (д) и 3,41 (дм): O=C-N-CH2; 4,10 (уш.д):O=C-N-CH; 4,52 (м): O=C-N-CH2-CH; 7,44 (м): 7,56 (т) и 7,69 (дд) С 6 Н 5. МС (ЭУ) m/z: [M]+=274, 229, 169, 105, 77. Пример 29 с. Метил-транс-6-бензоил-7 оксо-1,6-диазабицикло[3,2,1]октан-2-карбоксилат. При перемешивании к 28 мг (0,102 ммоль) полученной в примере 29b кислоты добавляют 2 мл раствора диазометана в дихлорметане с концентрацией 12,7 г/л. Растворитель выпаривают при пониженном давлении и остаток очищают путем хроматографии на диоксиде кремния,элюируя смесью дихлорметана и этилацетата в соотношении 98:2. Получают 18,4 мг целевого соединения брутто-формулы(М=288,305 г). Соответствующий выход составляет 63%. 1 Н-ЯМР-спектр (300 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,90-2,42: N-CH-CH2-CH2; 3,12 (д) и 3,44(д): O=C-N-CH2; 3,83 (с): СН 3; 4,17 (уш.д): O=CN-CH; 4,54 (м): O=C-N-CH2-CH; 7,44 (т), 7,56 (т) и 7,69 (д): С 6 Н 5. МС (ЭУ) m/z: [M]+=288, 229, 183, 155, 105,77. Пример 29d. транс-6-Бензоил-7-оксo-N(фенилметил)-1,6-диазабицикло[3,2,1]октан-2 карбоксамид. Смешивают 30 мг (0,109 ммоль) полученной в примере 29b транс-6-бензоил-7-оксо-l,6 диазабицикло[3,2,1]октан-2-карбоновой кислоты, 0,5 мл дихлорметана, 23 мг EDCI и 13 мкл бензиламина. Реакцию ведут в течение 30 мин при перемешивании. Затем разбавляют дихлорметаном, промывают 10%-ным водным раствором винной кислоты, декантируют и сушат органическую фазу над сульфатом натрия. Растворитель выпаривают при пониженном давлении,получая сырой продукт, который очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и ацетона в соотношении 98:2. Таким образом получают 19,5 мг целевого соединения брутто-формулыC21H21N3O3 (М=363,419 г). Соответствующий выход составляет 49%. 1 Н-ЯМР-спектр (300 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,97 (м), 2,34 (м) и 2,59 (м): N-CH-CH2CH2; 2,90 (д), 3,33 (м), 3,99 (уш.д) и 4,50 (м):O=C-N-CH, O=C-N-CH2-CH, O=C-N-СН 2, CONH-CH2-C6H5; 6,94 (уш.т): NH; 7,24-7,58 (м) и 7,68 (м): С 6 Н 5-СО и С 6 Н 5-СН 2. ИК-спектр (СНСl3): 3411, 1763, 1680; 1603,1583, 1519, 1498 см-1. Пример 29 е. 6-Бензоил-N-[метил(фенилметил)]-7-оксо-1,6-диазабицикло[3,2,1]октан-2 карбоксамид. Следуют методике, аналогичной таковой примера 29d, исходя из 50 мг (0,182 ммоль) полученной в примере 29b кислоты и 45 мкл Nметилбензиламина. Таким образом получают 12 мг целевого соединения брутто-формулыC22H23N3O3 (М=377,45 г). Соответствующий выход составляет 17%. МС (ЭУ) m/z: [M]+=377, 272, 105. Пример 29f. 6-Бензоил-2-(гидроксиметил)1,6-диазабицикло[3,2,1]октан-7-он. В инертной атмосфере в 3 мл тетрагидрофурана растворяют 100 мг (364 ммоль) полученной в примере 29b транс-6-бензоил-7-оксо 1,6-диазабицикло[3,2,1]октан-2-карбоновой кислоты. Охлаждают до температуры -10 С и добавляют 40 мкл метилморфолина, затем 38 мкл этилхлорформиата. Реакцию ведут в течение 15 мин при температуре -10 С, затем температуру доводят до 0 С и добавляют 27 мг NaBH4, потом 59 по каплям 1,5 мл метанола. Перемешивают при температуре 0 С в течение 2 ч, затем температуру доводят до комнатной температуры. Добавляют 3 мл воды, перемешивают в течение 15 мин, затем добавляют несколько капель раствора хлорида аммония. Экстрагируют этилацетатом, сушат над сульфатом магния, фильтруют и растворитель выпаривают при пониженном давлении. Таким образом получают 85 мг сырого продукта, который очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и метанола в соотношении 98:2. Таким образом получают 25 мг целевого соединения брутто-формулы C14H16N2O3 (М=260,3 г). Соответствующий выход составляет 26%. 1 Н-ЯМР-спектр (300 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,61 (м, 1 Н), 2,00 (м, 2 Н), 2,30 (м, 1 Н): СНСН 2-СН 2-СН; 2,19: 3,23 (д) и 3,26 (д): N-CH2; 3,60 (м): N-CH-CH2-OH; 3,70 (м) и 3,77 (дд): СНСН 2-О; 4,56 (м): N-CH-CH2-N. МС (SIMS) m/z: [M+Na]+=283; [M+H]+= 261; [M]+=260, 229, 105. Пример 30. (4-Нитрофенил)метил-транс-6 ацетил-7-оксо-1,6-диазабицикло[3,2,1]октан-2 карбоксилат. 1 г (2,63 ммоль) полученного на стадии С примера 29 продукта растворяют в 12 мл дихлорметана. Добавляют 250 мкл уксусного ангидрида, реакцию ведут в течение 10 мин при перемешивании, затем разбавляют дихлорметаном и промывают водным насыщенным раствором гидрокарбоната натрия. Органическую фазу сушат над сульфатом натрия, выпаривают досуха при пониженном давлении, получая 1,2 г 1(1,1-диметилэтил)- и 2-[(4-нитрофенил)метил]транс-5-(ацетиламино)-1,2-пиперидиндикарбоксилата брутто-формулы C20H27N3O7 (М=421,453 г). Этот продукт используют без очистки на стадиях, подобных стадиям E-G примера 29, и таким образом получают 14 мг целевого соединения брутто-формулы C16H17N3O6 (M=347,330 г). Соответствующий выход составляет 17%. 1 Н-ЯМР-спектр (300 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,87 (м), 2,00-2,30 (м): N-CH-CH2-CH2; 2,54[АА'ВВ']: С 6 Н 4-NO2. МС (ЭУ) m/z: [M]+=347, 304, 211, 169, 125,43. Пример 31a. (4-Нитрофенил)метил- и 2 пропенил-транс-7-оксо-1,6-диазабицикло[3,2,1] октан-2,6-дикарбоксилат. В атмосфере азота, в 8 мл дихлорметана растворяют 1,24 г (3,278 ммоль) продукта, полученного на стадии С примера 29 а. Раствор охлаждают до температуры 0 С, затем добавляют по каплям 0,45 мл триэтиламина, потом 0,35 мл аллилхлорформиата. Выдерживают при температуре 0 С в течение 15 мин, затем реакцию 60 ведут при перемешивании в течение 1 ч при комнатной температуре. После этого разбавляют с помощью 20 мл дихлорметана, промывают водным раствором гидрокарбоната натрия и два раза водой. Сушат над сульфатом магния и растворитель выпаривают при пониженном давлении. Таким образом получают 1,5 г 1-(1,1 диметилэтил)и 2-[(4-нитрофенил)метил]транс-5-(2-пропенилокси)карбонил]амино]1,2-пиперидиндикарбоксилата брутто-формулыC22H28N3O8 (M=462,486 г). Соответствующий выход составляет 99%. Этот продукт используют на стадиях, подобных стадиям E-G примера 29 а, и таким образом получают 30,6 мг целевого соединения брутто-формулы C18H19N3O7 (М=389,368 г) в виде твердого вещества белого цвета. Соответствующий выход составляет 40%. 1 Н-ЯМР-спектр (300 МГц; CDCl3; химические сдвиги пиков в м.д. и мультиплетность): 1,91 (м), 2,00-2,29 (м): N-CH-CH2-CH2; 2,98[2M+Na]+=801; [M+Na+CH3CN]+=453; [M+Na]+= 412. Пример 31b. Фенилметил-транс-6-бензоил 7-оксо-1,6-диазабицикло[3,2,1]октан-2-карбоксилат. В инертной атмосфере смешивают 200 мг фенилметил-транс-5-(бензоиламино)-1-(хлоркарбонил)-2-пиперидинкарбоксилата бруттоформулы C21H21ClN2O4 (М=400,87 г), полученного согласно методикам, подобным таковым стадий A-F примера 29 а, и 6 мл безводного тетрагидрофурана и охлаждают до температуры-78 С. Добавляют по каплям 0,55 мл 1 М раствора бис(триметилсилил)амида лития в тетрагидрофуране. Реакцию ведут при перемешивании при температуре -78 С в течение 10 мин, затем добавляют 25 мкл уксусной кислоты. Температуру доводят до комнатной, затем выливают в 10 мл 10%-ного водного раствора винной кислоты. Экстрагируют этилацетатом, промывают водным раствором фосфатного буфера с рН=7,потом водой и сушат над сульфатом магния. Доводят досуха путем выпаривания растворителя при пониженном давлении. Таким образом получают 158 мг сырого продукта, который очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана и ацетона в соотношении 98:2. Таким образом получают 70 мг целевого соединения бруттоформулы C21H20N2O4 (М=364,40 г). Соответствующий выход составляет 39%.
МПК / Метки
МПК: A61P 31/04, A61K 31/529, C07D 498/08, C07D 487/08
Метки: лекарственных, применение, соединения, антибактериальных, частности, качестве, получения, азабициклические, средств, способ
Код ссылки
<a href="https://eas.patents.su/30-4920-azabiciklicheskie-soedineniya-sposob-ih-polucheniya-i-ih-primenenie-v-kachestve-lekarstvennyh-sredstv-v-chastnosti-v-kachestve-antibakterialnyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Азабициклические соединения, способ их получения и их применение в качестве лекарственных средств, в частности, в качестве антибактериальных средств</a>
Предыдущий патент: Многовитковый соленоид
Следующий патент: Аттенуированный микроорганизм salmonella и способы его применения
Случайный патент: Способы лечения кожных язв


































