Соединения пиразинона, фармацевтическая композиция (варианты) и лекарственная форма, способ ингибирования сериновой протеазы, способ снижения тромбообразующей способности поверхности, способ лечения нарушенного протеолиза и тромбоза, связанного с различными заболеваниями, способ снижения свертывания крови у млекопитающего
Номер патента: 4884
Опубликовано: 26.08.2004
Авторы: Маркоутэн Томас П., Лу Тианбао, Томкзук Брюс Э.
Формула / Реферат
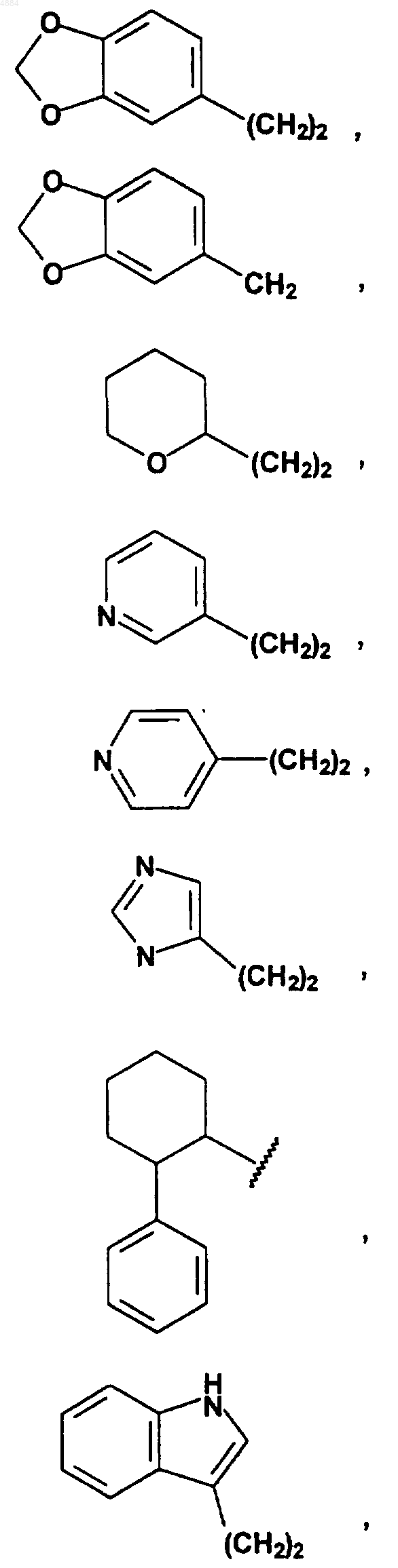
1. Соединение формулы I
или его сольват, гидрат или фармацевтически приемлемая соль, где
W означает R1;
R1 означает R2,
R2(CH2)tC(R12)2, где t равно 0-3 и оба R12 одинаковые или различные,
(R2)(OR12)CH(CH2)p, где p равно 1-4,
R2C(R12)2(CH2)t, где t равно 1-3 и оба R12 одинаковые или различные, причем (R12)2 может быть объединен с атомом углерода, к которому он присоединен, с образованием от 3- до 7-членного циклоалкильного кольца;
R2CH2C(R12)2(CH2)q, где q равно 0-2 и оба R12 одинаковые или различные, причем (R12)2 может быть объединен с атомом углерода, к которому он присоединен, с образованием от 3- до 7-членного циклоалкильного кольца;
R2CF2C(R12)2(CH2)q, где q равно 0-2 и оба R12 одинаковые или различные, причем (R12)2 может быть объединен с атомом углерода, к которому он присоединен, с образованием от 3- до 7-членного циклоалкильного кольца;
(R2)2CH(CH2)r, где r равно 1-3 и оба R2 одинаковые или различные, причем (R2)2 может быть объединен с атомом углерода, к которому он присоединен, с образованием 5-7-членного моно- или бициклогетероциклического кольца, которое является насыщенным или ненасыщенным и которое содержит от одного до трех гетероатомов, выбранных из группы, включающей N, O и S;
(R2)2CF(CH2)r, где r равно 1-3 и оба R2 одинаковые или различные или R2CF2C(R12)2,
R2 означает фенил или нафтил, каждый из которых необязательно замещен одной или более из следующих групп: C1-4алкил, C1-4алкокси, галоген, CF3,
5-7-членное насыщенное или ненасыщенное моно- или 9-10-членное бициклическое кольцо, которое необязательно содержит один или два гетероатома, выбранные из N или O,
C1-7алкил, необязательно замещенный одной или более из следующих групп: арил, C1-3алкиларил или гетероцикл;
R3 означает водород, C1-4алкил, галоген или циано;
R4 означает водород или галоген;
R12 означает водород, фенил или C1-4алкил;
R5 означает водород;
R6 означает водород или алкил;
R7, R8, R9, R10 независимо означают водород или алкил;
X означает кислород или -CH=N-;
Ra, Rb и Rc независимо означают водород или -CO2Rw, причем Rw означает

где Rd и Re независимо означают водород и Rf означает C1-6алкил, n означает число от 0 до 4 и m означает число от 0 до 4.
2. Соединение по п.1, отличающееся тем, что R3 означает водород или C1-4алкил; m равно 0 и n равно 0.
3. Соединение по п.2, отличающееся тем, что R3 означает C1-4алкил.
4. Соединение по п.2, отличающееся тем, что R4 означает водород.
5. Соединение по п.1, отличающееся тем, что R1 означает R2,
R2(CH2)tC(R12)2, где t равно 0-3 и оба R12 одинаковые или различные,
R2C(R12)2(CH2)t, где t равно 1-3 и оба R12 одинаковые или различные, причем (R12)2 может быть объединен с атомом углерода, к которому он присоединен, с образованием от 3- до 7-членного циклоалкильного кольца;
R2CH2C(R12)2(CH2)q, где q равно 0-2 и оба R12 одинаковые или различные, причем (R12)2 может быть объединен с атомом углерода, к которому он присоединен, с образованием от 3- до 7-членного циклоалкильного кольца;
(R2)CH(CH2)r, где r равно 1-3 и оба R2 одинаковые или различные, причем (R2)2 может быть объединен с атомом углерода, к которому он присоединен, с образованием от 5 до 7-членного моно- или бициклогетероциклического кольца, насыщенного или ненасыщенного и которое содержит от одного до трех гетероатомов, выбранных из группы, включающей N, O или S;
R2CF2C(R12)2(CH2)q, где q равно 0-2 и оба R12 одинаковые или различные, причем (R12)2 может быть объединен с атомом углерода, к которому он присоединен, с образованием от 3- до 7-членного циклоалкильного кольца;
R2 означает фенил или нафтил, каждый из которых необязательно замещен одной или более из следующих групп: C1-4алкил, C1-4алкокси, галоген, CF3,
5-7-членное моно- или 9-10-членное бициклогетероциклическое кольцо, насыщенное или ненасыщенное, которое содержит один или 2 гетероатома, выбранные из N или O,
C1-7алкил, необязательно замещен одной или более из следующих групп: C1-3алкиларил или гетероцикл; и R12 означает водород или C1-4 алкил.
6. Соединение по п.5, отличающееся тем, что
R3 означает H, CH3 или CH2CH3;
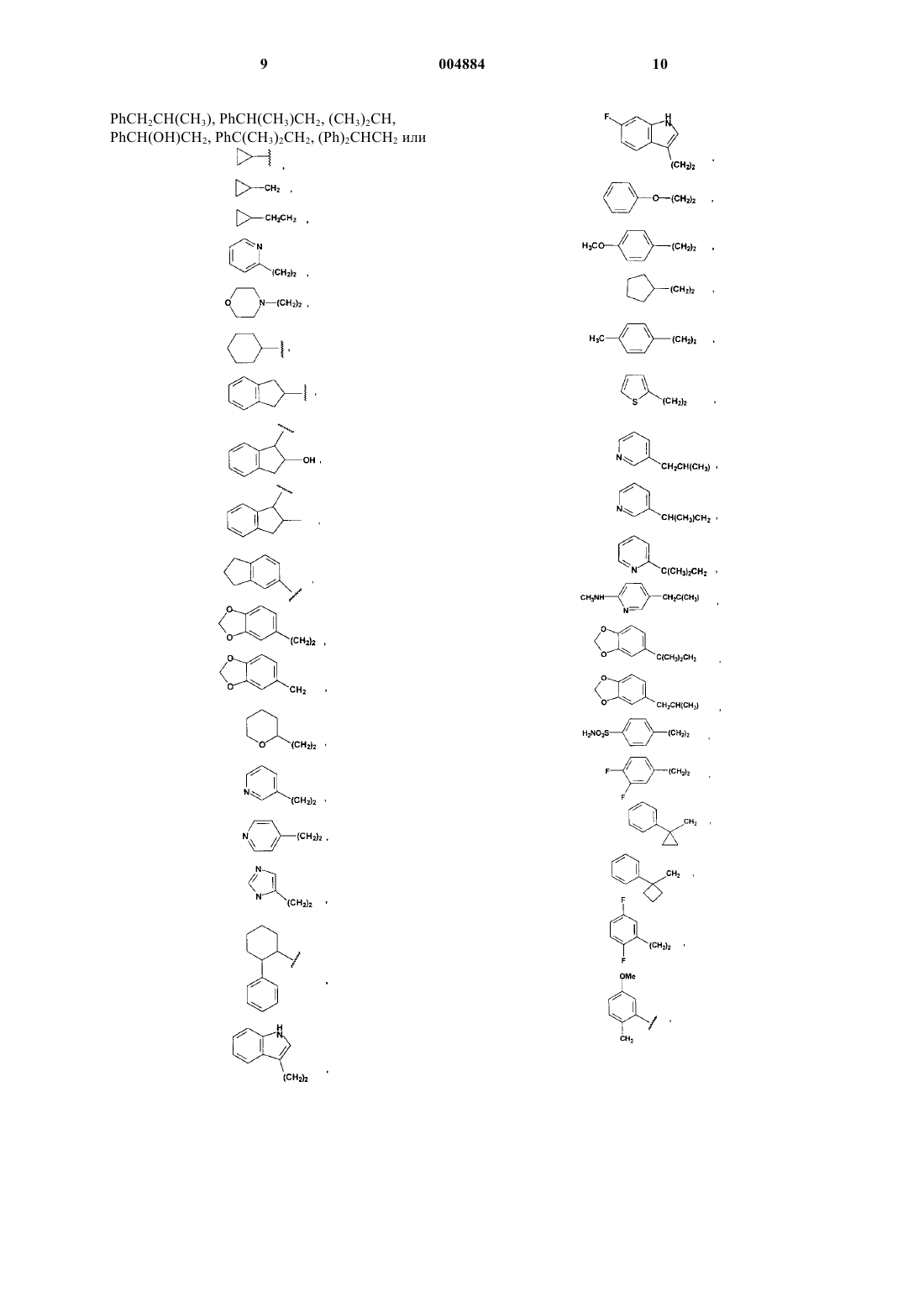
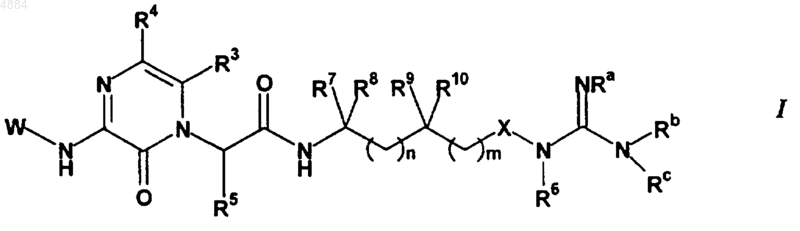
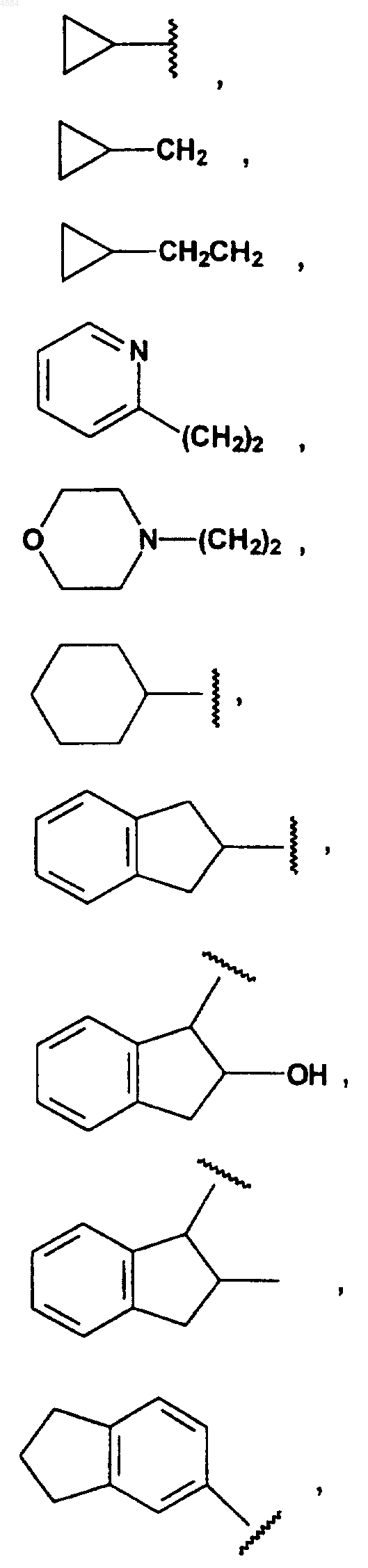
R4 означает H или хлор и W означает PhCH2CH2, (CH3)3C, CF3CH2, PhCH2O(CH2)2, PhCH(CH3), CH3(CH2)5, PhCH2, CH3(CH2)4, CH3CH2CH(CH3)CH2, (Ph)2CHCH2, PhCH2CH(CH3), PhCH(CH3)CH2, (CH3)2CH, PhC(CH3)2CH2, (Ph)2CHCH2, или W означает
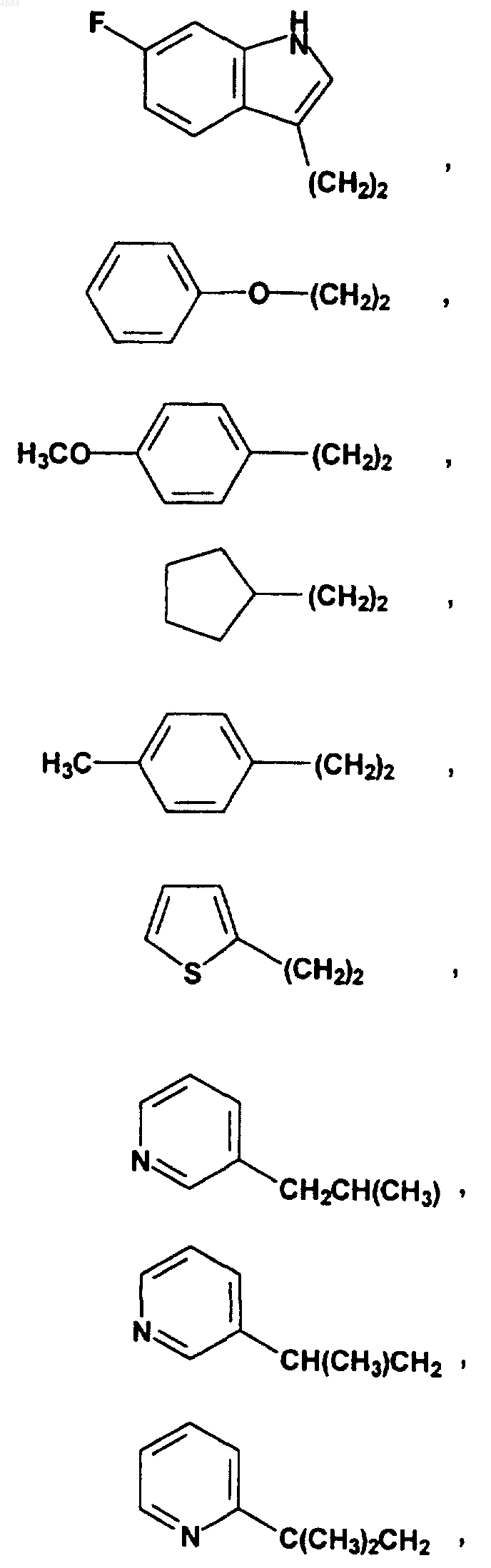
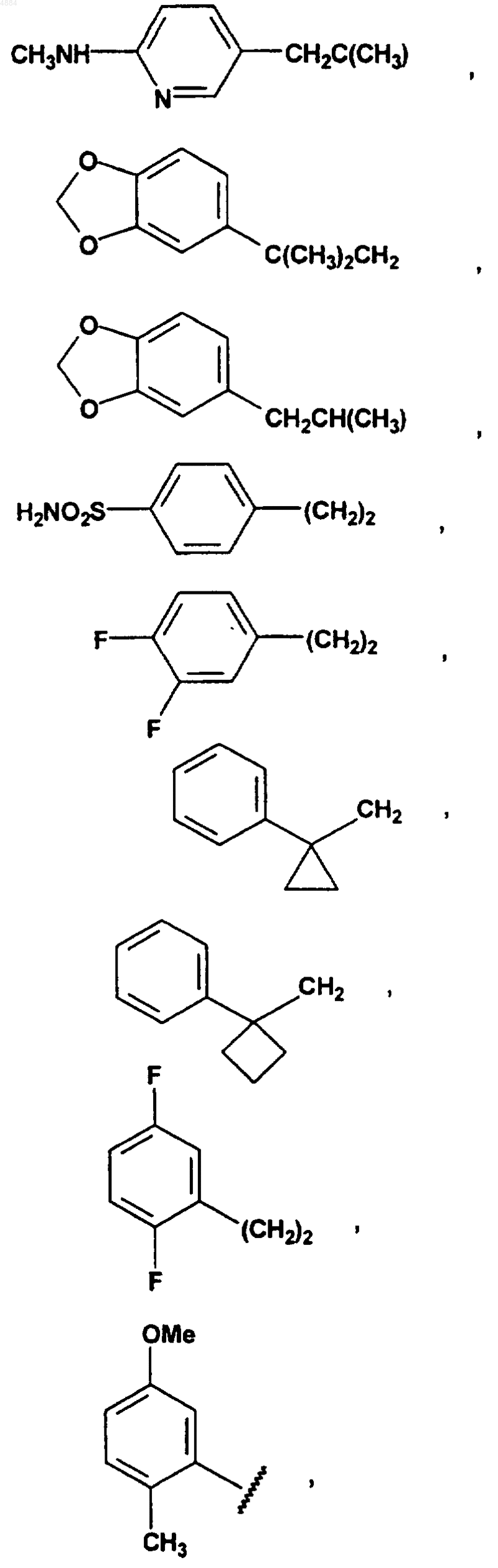
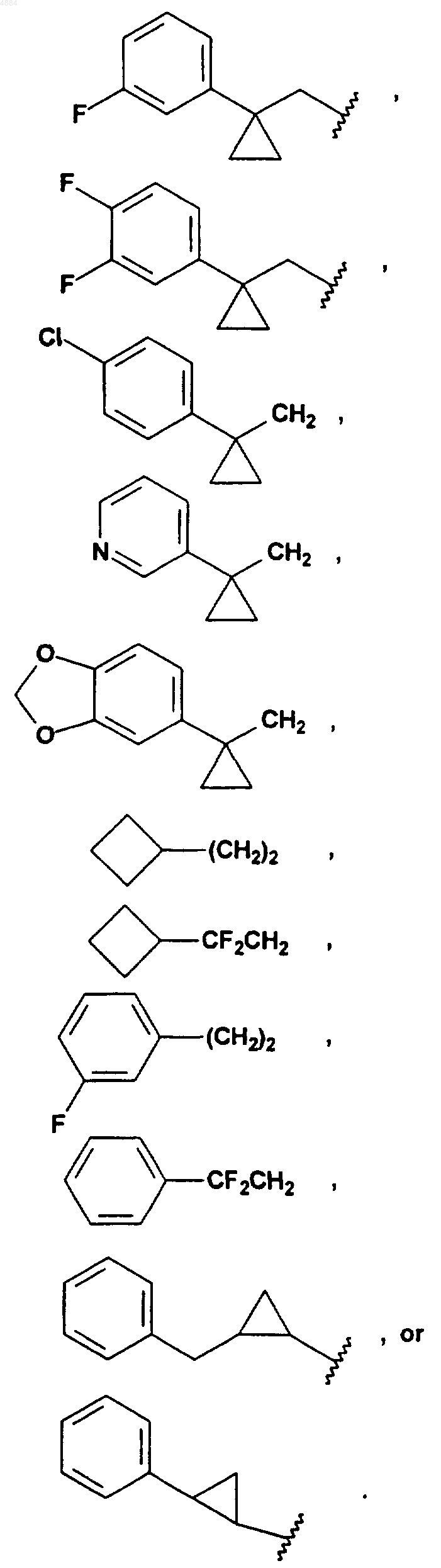
7. Соединение по любому из пп.1-6, отличающееся тем, что X означает -CH=N-.
8. Соединение по любому из пп.1-6, отличающееся тем, что X означает кислород.
9. Соединение по любому из пп.1-6, отличающееся тем, что R6 означает водород или C1-6алкил.
10. Соединение по любому из пп.1-6, отличающееся тем, что R7, R8, R9 и R10 независимо означают водород или C1-6алкил.
11. Соединение по п.10, отличающееся тем, что R7, R8, R9 и R10 независимо означают одну из следующих групп: водород, метил, этил, пропил или н-бутил.
12. Соединение по любому из пп.1-6, отличающееся тем, что Ra, Rb и Rc независимо означают водород.
13. Соединение по п.12, отличающееся тем, что Ra, Rb и Rc независимо означают
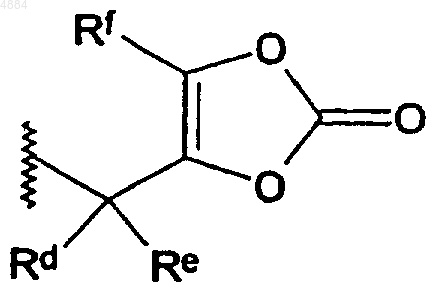
где Rd-Rf определены в п.1.
14. Соединение по п.13, отличающееся тем, что Rd и Re означрют водород, а Rf означает метил.
15. Соединение по п.1, отличающееся тем, что оно имеет структуру формулы II

или его сольват, гидрат или фармацевтически приемлемая соль, где R3, R4, W, X, n и m определены в п.1.
16. Соединение по п.15, отличающееся тем, что W означает PhCH2CH2, (CH3)3C, CF3CH2, PhCH2O(CH2)2, PhCH(CH3), CH3(CH2)5, PhCH2, CH3(CH2)4, CH3CH2CH(CH3)CH2, (Ph)2CHCH2, PhCH2CH(CH3), PhCH(CH3)CH2, (CH3)2CH, PhC(CH3)2CH2, (Ph)2CHCH2 или W означает


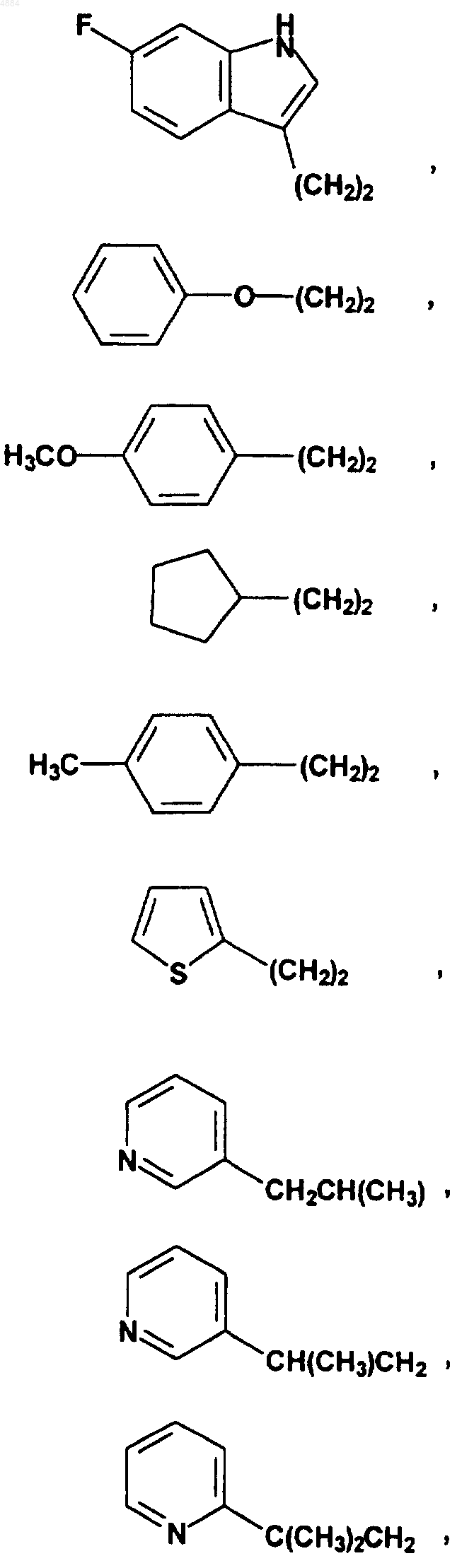
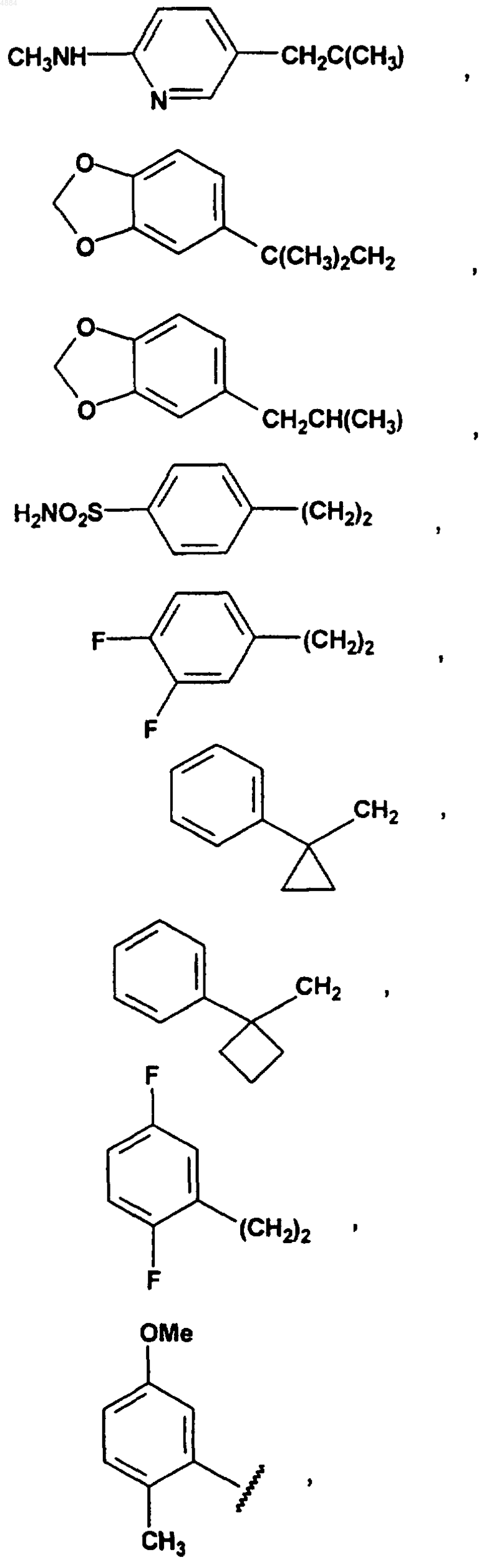
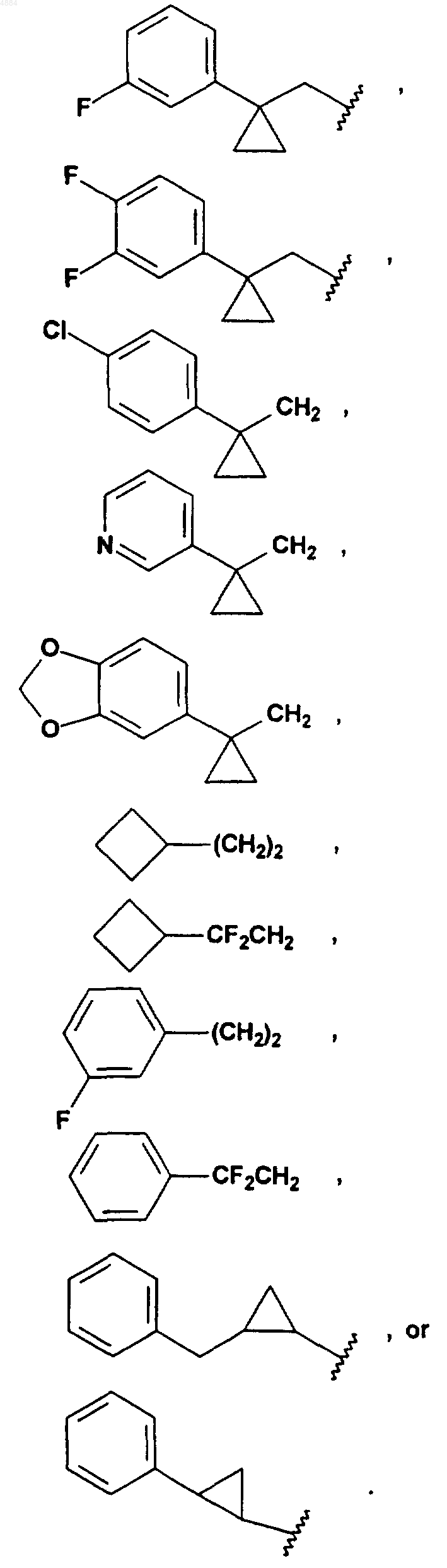
17. Соединение по п.1, отличающееся тем, что оно представляет собой одно из следующих соединений:
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(фенетиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2,2-дифенилэтиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(4-метилфенетиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(4-метоксифенетиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(1-фенилциклобутил)метиламинопиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-[2-(1-нафталин)этил]аминопиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-фенил-1-бутиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-[3,4-метилендиоксифенил]этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-[2-пиридил]этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-[2-метилфенил]этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-[3-метилфенил]этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-[2-трифторметилфенил]этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-[3-трифторметилфенил]этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-[4-трифторметилфенил]этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-[3,5-диметилфенил]этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-инданиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-[3,4-дифторфенил]этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-[5-инданил]этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-фторфенетиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(3,4-диметоксифенетиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(4-фторфенетиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(4-этилфенетиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-фенилпропиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(3,4-диметилфенетиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-нафталинэтиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2,2-дифенилпропиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-(3-индолил)этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-[1-(4-метилнафталин)]этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-[2,4-дифторфенил]этиламино)пиразинон,
1-{N-[2-(амидино-N'-метиламиноокси)этил]амино}карбонилметил-6-метил-3-(2-[4-метилфенил]этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-5-хлор-6-метил-3-(фенетиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-5-хлор-6-метил-3-(2,2-дифенилэтиламино)пиразинон,
1-{N-[2-(амидиногидразино)этил]амино}карбонилметил-6-метил-3-(фенетиламино)пиразинон,
1-{N-[2-(амидиногидразино)этил]амино}карбонилметил-6-метил-3-(1-метил-2-фенилэтиламино)пиразинон,
1-{N-[2-(амидиногидразино)этил]амино}карбонилметил-6-этил-3-(фенетиламино)пиразинон,
1-{N-[2-(амидиногидразино)этил]амино}карбонилметил-6-метил-3-(4-метилфенилэтиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(1-метил-2-(4-метиламино-3-пиридил)этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(1-метил-2-(3-пиридил)этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-циклопропил-2-(3,4-диметоксифенил)этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-циклобутилэтиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-циклобутил-2,2-дифторэтиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-(3-фторфенил) этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2,2-дифтор-2-фенилэтиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-фенилциклопропиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-(4-хлорфенил)-2-циклопропилэтиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-циклопропил-2-(3-пиридил)этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-бензилциклопропиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-циклопропил-2-(3-фторфенил)этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2-циклопропил-2-(3,4-дифторфенил)этиламино)пиразинон,
1-{N-[2-(амидиноаминоокси)этил]амино}карбонилметил-6-метил-3-(2,2-дифтор-2-фенилэтиламино)пиразинон и их фармацевтически приемлемые соли.
18. Соединение по любому из пп.1-6, отличающееся тем, что оно включает в себя по меньшей мере один атом, представленный радиоактивным атомом.
19. Соединение по п.18, отличающееся тем, что радиоактивным атомом является радиоактивный иод, выбранный из группы, содержащей I-125, I-131 и I-123.
20. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение по п.1 и фармацевтически приемлемый носитель.
21. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение по п.15 и фармацевтически приемлемый носитель.
22. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение по п.17 и фармацевтически приемлемый носитель.
23. Способ ингибирования сериновой протеазы, отличающийся тем, что проводят контактирование сериновой протеазы с соединением по п.1.
24. Способ по п.23, отличающийся тем, что упомянутой протеазой является тромбин.
25. Способ снижения тромбообразующей способности поверхности, отличающийся тем, что упомянутую поверхность покрывают или в нее вводят соединение по п.1, или проводят адсорбцию упомянутой поверхностью или ковалентное связывание с ней соединения по п.1.
26. Способ по п.25, отличающийся тем, что в качестве упомянутой поверхности используют стент.
27. Способ лечения нарушеннюую протеолиза у млекопитающего, обусловленного сериновой протеазой, отличающийся тем, что млекопитающему вводят соединение по п.1.
28. Способ лечения тромбоза, связанного с ишемией, вирусными инфекциями, инсультом, онкологическими заболеваниями, рестенозом, инфактом миокарда, рассеянной внутримышечной коагулопатией, наблюдаемой в процессе септического шока, неустойчивой стенокардией, рассеяной внутримышечной коагулопатией, вызванной травмой, шунтированием коронарной артерии, вправлением бедра, тромболитической терапией, сепсисом, гемодиализом, респираторным дистресс-синдромом у взрослых, ревматоидным артритом, неспецифическим язвенным колитом, индурацией, метастазом, гиперкоагуляцией в процессе химиотерапии, болезнью Альцгеймера, синдромом Дауна, образованием фибрина в глазной ткани, заживлением ран или воспалительным процессом у млекопитающего, отличающийся тем, что млекопитающему вводят соединение по п.1.
29. Способ снижения свертывания крови у млекопитающего, отличающийся тем, что млекопитающему вводят соединение по п.1.
30. Фармацевтическая лекарственная форма, отличающаяся тем, что она содержит фармацевтически приемлемый носитель и от приблизительно 0,1 до приблизительно 500 мг соединения по п.1.
31. Лекарственная форма по п.30, отличающаяся тем, что она приспособлена для парентерального или орального введения.
Текст
1 Область техники, к которой относится изобретение Настоящее изобретение относится к новым соединениям, которые проявляют активность ингибиторов протеолитических ферментов, и, в частности, к новому классу ингибиторов тромбина. Уровень техники Протеазами называются ферменты, которые расщепляют белки по одной специфической пептидной связи. Протеазы принято подразделять на четыре основных класса: сериновые,тиоловые или цистеиновые, кислые или аспарагиновые и металлопротеазы (статья Cuypers и соавт. в журнале J.Biol.Chem. 257:7086 (1982. Протеазы играют важную роль в реализации ряда биологических функций, таких как пищеварение, образование и растворение сгустков крови, воспроизведение и иммунный ответ на чужеродные клетки и организмы. Аберрантный(нарушенный) протеолиз связан с рядом болезненных состояний у человека и других млекопитающих. Протеазы из нейтрофильных лейкоцитов человека - эластаза и катепсин G принимают участие в болезненных состояниях, характеризующихся разрушением ткани. К таким болезням относятся эмфизема, ревматоидный артрит, язва роговицы и гломерулярный нефрит(книга Barret "Enzyme Inhibitors as Drugs" под редакцией Sandler, University Park Press, Baltimore, (1980. Другие протеазы, такие как плазмин, эстераза С-1, конвертаза С-3, урокиназа,активатор плазминогена, акрозин и калликреины играют ключевую роль в проявлении нормальных функций в организме млекопитающих. Во многих случаях при терапевтическом лечении млекопитающих представляется целесообразным блокирование функционирования одного или более протеолитических ферментов. Сериновые протеазы включают такие ферменты, как эластаза (лейкоцитов человека), катепсин G, плазмин, эстераза С-1, конвертаза С 3, урокиназа, активатор плазминогена, акрозин,химотрипсин, трипсин, тромбин, фактор Ха и калликреины. Эластаза лейкоцитов человека высвобождается из полиморфноядерных лейкоцитов в очагах воспаления и, таким образом, вносит вклад в возникновение ряда болезненных состояний. Катепсин G является другой сериновой протеазой нейтрофильных лейкоцитов человека. Можно ожидать, что соединения, обладающие ингибиторной активностью по отношению к указанным ферментам, будут оказывать противовоспалительное действие, которое можно использовать при лечении подагры, ревматоидного артрита и других воспалительных заболеваний, а также для лечения эмфиземы. Химотрипсин и трипсин являются пищеварительными ферментами. Ингибиторы этих ферментов используют при лечении панкреатита. Ингибиторы урокиназы и активатора плазминогена ис 004884 2 пользуют при лечении болезней, сопровождающихся избыточным ростом клеток, таких как доброкачественная гипертрофия простаты, карцинома простаты и псориаз. Сериновая протеаза тромбин играет центральную роль в процессах гемостаза и тромбоза, а также является многофункциональным белком, оказывающим ряд воздействий на тромбоциты, эндотелиальные клетки, клетки гладкой мускулатуры, лейкоциты, сердце и нейроны. Активация каскада реакций свертывания крови по внутреннему пути (контактная активация) или по внешнему пути (активация путем экспозиции плазмы на неэндотелиальной поверхности, путем повреждения клеток сосудов или путем выделения тканевого фактора) приводит к серии биохимических реакций, которые регулируются тромбином. Тромбин расщепляет фибриноген, что в конечном итоге приводит к образованию гемостатической пробки (сгустка),существенно активирует тромбоциты с помощью уникального протеолитического расщепления рецептора тромбина на поверхности клеток (статья Coughlin в журнале Seminars in Hematology 31(4):270-277 (1994, а также приводит к инициированию образования самого фермента по механизму обратной связи. Таким образом, ингибиторы действия тромбина могут быть потенциальными терапевтическими средствами для лечения сердечно-сосудистых и несердечно-сосудистых заболеваний. Фактор Ха является другой сериновой протеазой, включенной в путь свертывания крови. Фактор Ха связывается с фактором Va и кальцием на фосфолипидной мембране, при этом образуется комплекс протромбиназы, который превращает протромбин в тромбин (статья Claeson в журнале Blood Coagulation and(Suppl 1):S47-S58 (1994. Предполагают, что ингибиторы фактора Ха обладают преимуществом по сравнению с агентами, которые напрямую ингибируют тромбин, так как прямые ингибиторы тромбина стимулируют образование значительного количества новой порции тромбина (статья Lefkovits и Topol в журнале Circulation 90(3): 1522-1536 (1994); статья Harker в журнале Blood Coagulation and Fibrinolysis 5(Suppl 1):S47-S58 (1994. Ранее были описаны способы визуальной диагностики in vivo для выявления внутрисосудистых тромбов. Для этих визуальных способов используют соединения, определяемо меченные радиоактивными или парамагнитными атомами. Например, в качестве агента для получения изображения при обнаружении тромбов могут быть использованы тромбоциты, меченные гаммаизлучателем, In-111 (Thakur M.L. и соавт.,Thrombs Res. 9:345 (1976); Powers и соавт., Neurology 32:938 (1982. В качестве агента для получения изображения был предложен тромбо 3 литический фермент - стрептокиназа, меченнаяTc-99m (Wong, патент США N 4418052, 1983). В качестве агентов для получения изображения были также предложены гамма-излучатели 1125 и 1-131 (Pang, патент США N 5011686,1991). В качестве агентов для получения изображения описаны также моноклональные антитела, специфичные к фибрину (по контрасту с фибриногеном) и меченные Tc-99m (Berger и соавт., патент США N 5024829, 1991; Dean и соавт., патент США N 4980148, 1990). Опубликовано также применение парамагнитного контрастного агента, гадолиний диэтилентриаминопентауксусной кислоты, для получения парамагнитного изображения сосудов пациентов с острым инфарктом миокарда, леченных тромболизом (статья De Roos А. и соавт., Int. J. Card.Imaging 7:133, 1991). В качестве агентов для получения изображения тромбов предложены также радиоактивно-меченые и парамагнитномеченые альфа-кетоамидные производные(Abelman и соавт., патент США N 5656600). В настоящее время существует необходимость в получении непептидных соединений,являющихся высокоэффективными и селективными ингибиторами протеаз и обладающих более высокой биодоступностью и меньшим количеством побочных эффектов по сравнению с известными доступными ингибиторами протеаз. В связи с этим, особенно ценными терапевтическими агентами являются принадлежащие к новому классу эффективные ингибиторы протеаз,обладающие значительной ингибирующей способностью и низкой токсичностью по отношению к млекопитающим, для лечения различных состояний, включая лечение ряда патологических состояний млекопитающих, связанных с протеолитическими ферментами. Сущность изобретения Настоящее изобретение относится к новым аминогунидин(гидразиноамидин)- и алкоксигуанидин(алкоксиаминоамидин)-пиразинонам формулы I (см. ниже). Представлены также способы получения соединений формулы I. Новые соединения по настоящему изобретению являются эффективными ингибиторами протеаз,особенно трипсин-подобных сериновых протеаз, таких как химотрипсин, трипсин, тромбин,плазмин и фактор Ха. Некоторые соединения проявляют антитромботическую активность благодаря прямому селективному ингибированию тромбина или являются промежуточными соединениями, которые используют для образования соединений с антитромбической активностью. Представлены также способы ингибирования или лечения нарушений протеолиза у млекопитающих и способы лечения тромбоза,ишемии, инсульта, рестеноза или воспалительных процессов у млекопитающих путем введения эффективного количества соединения формулы I. 4 Изобретение включает композицию, ингибирующую потерю тромбоцитов, агрегацию тромбоцитов крови, образование фибрина, ингибирующую образование тромбов и образование эмбола у млекопитающих, которая содержит соединение согласно изобретению на фармацевтически приемлемом носителе. Такие композиции могут во выбору включать антикоагулянты, антитромбоцитарные агенты и тромболитические агенты. Чтобы получить требуемый ингибирующий эффект, композиции можно добавлять в кровь, в продукты крови или органы млекопитающих. В изобретении описаны также способы ингибирования или лечения нарушенного протеолиза у млекопитающих и способы лечения инфаркта миокарда; неустойчивой стенокардии; кровоизлияний; рестеноза; глубокого венозного тромбоза; обширной внутрисосудистой коагулопатии, вызванной травмой, сепсисом или метастазами; применение при гемодиализе; при хирургическом шунтировании; лечение респираторного дистресс-синдрома взрослых; эндотоксинового бактериально-токсического шока; ревматоидного артрита; неспецифического язвенного колита; индурации; метастазов; гиперкоагуляции при хемотерапии; болезни Альцгеймера; синдрома Дауна; образования фибрина в глазной ткани и при ранозаживлении. Другой областью применения упомянутых ингибиторов тромбина является их использование в качестве антикоагулянтов, включенных в материалы или физически связанных с материалами, которые используются для производства медицинского оборудования для сбора и хранения крови, таких как катетеры, устройство для диализа крови,шприцы и пробирки для сбора крови, соединительные линии для циркуляции крови и стенты. В изобретение включен также способ снижения тромбогенности поверхностей в организме млекопитающих путем ковалентного или нековалентного связывания соединения согласно изобретению с поверхностью, предназначенной для введения в организм. Другим объектом настоящего изобретения являются композиции, которые используют для получения изображения тромбов in vivo у млекопитающих и включающие соединение по изобретению, которое детектируют за пределами тела. Предпочтительные композиции включают соединение по настоящему изобретению и детектируемую метку, такую как радиоактивный или парамагнитный атом. Другим объектом настоящего изобретения являются диагностические композиции, пригодные для получения изображения тромбов in vivo у млекопитающих, включающие фармацевтически приемлемый носитель и диагностически эффективное количество соединения или композиции по настоящему изобретению. 5 Другим объектом изобретения являются способы, используемые для получения изображения in vivo тромбов у млекопитающих. Сведения, подтверждающие возможность изобретения Соединения по настоящему изобретению включают соединения формулы I: или их сольваты, гидраты или фармацевтически приемлемые соли, где:R1 означает R2,R2(CH2)tC(R12)2, где t равно 0-3 и оба R12 могут быть одинаковыми или различными,(R2)(OR12)CH(CH2)p, где р равно 1-4,(R2)2(OR12)C(CH2)p, где р равно 1-4,R2C(R12)2(CH2)t, где t равно 0-3 и оба R12 могут быть одинаковыми или различными, причем (R12)2 также может образовывать кольцо с атомом углерода, например, С 3-7 циклоалкил;R могут быть одинаковыми или различными,причем (R12)2 также может образовывать кольцо с атомом углерода, например, С 3-7 циклоалкил;R могут быть одинаковыми или различными,причем (R12)2 может образовывать кольцо с атомом углерода, например, С 3-7 циклоалкил;(R2)2CH(CH2)r, где r равно 0-4 и оба R2 могут быть одинаковыми или различными, причем(R2)2 также может образовывать кольцо с СH,например, С 3-7 циклоалкил, С 7-12 бициклоалкил,С 10-16 трициклоалкил или 5-7-членный моно- или бициклогетероциклическое кольцо, которое может быть насыщенным или ненасыщенным и которое содержит от одного до трех гетероатомов, выбранных из группы, включающей N, О иR2O(СН 2)p, где р равно 2-4,(R2)2CF(CH2)r, где r равно 0-4 и оба R2 могут быть одинаковыми или различными, причем(R12)2 также может образовывать кольцо с атомом углерода, например, С 3-7 циклоалкил, С 7-12 бициклоалкил, С 10-16 трициклоалкил или 5-7 членный моно- или бициклогетероциклическое кольцо, которое может быть насыщенным или ненасыщенным и которое содержит от одного до трех гетероатомов, выбранных из группы,включающей N, О и S,где s равно 0 или 1, или R2 СF2C(R12)2;R2 означает фенил, нафтил или бифенил, каждый из которых может быть незамещенным или замещенным одной или более из следующих групп: 6 С 1-4 алкил, С 1-4 алкокси, галоген, гидрокси, CF3,OCF3, COOH, CONH2 или SO2NH2,5-7-членное моно- или 9-10-членное бициклогетероциклическое кольцо или негетероциклическое кольцо, которое может быть насыщенным или ненасыщенным, причем гетероциклическое кольцо содержит от 1 до 4 гетероатомов, которые выбирают из группы, включающей N, О и S, и причем гетероциклическое или негетероциклическое кольцо является незамещенным или замещенным галогеном или гидрокси,С 1-7 алкил, незамещенный или замещенный одной или более из следующих групп: гидрокси,COOH, амино, арил, С 3-7 циклоалкил, СF3,N(CH3)2, С 1-3 алкиларил, гетероарил или гетероциклоалкил,СF3,С 3-7 циклоалкил, незамещенный или замещенный арилом,С 7-12 бициклоалкил илиC10-16 трициклоалкил; R3 означает водород, алкил, циклоалкил, алкенил, алкинил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероарил, трифторметил, галоген, гидроксиалкил, циано, нитро, карбоксамидо, -СО 2Rx, -CH2ORx или -ORx, где Rx в каждом случае независимо означает водород, алкил или циклоалкил, причем упомянутые алкильные или циклоалкильные группы могут необязательно содержать одну или более ненасыщенных связей;R4 означает водород или галоген;R12 означает водород,фенил, нафтил или бифенил, которые могут быть незамещенными или замещенными одной или более из следующих групп: С 1-4 алкил, С 1-4 алкокси, галоген, гидрокси, СF3, OCF3,СООН, CONH2,5-7-членное моно- или 9-10-членное бициклогетероциклическое кольцо, которое может быть насыщенным или ненасыщенным, и которое содержит от 1 до 4 гетероатомов, выбранных из группы, включающей N, О и S; С 1-4 алкил, незамещенный или замещенный одной или более из следующих групп: гидрокси,СООН, амино, арил, гетероарил или гетероциклоалкил,СF3,С 3-7 циклоалкил,С 7-12 бициклоалкил или С 10-16 трициклоалкил;N присоединен к NR6) где R11 означает водород, алкил, циклоалкил или арил, причем упомянутые алкил, циклоалкил или арил могут быть необязательно замещены амино, моноалкиламино, диалкиламино, алкокси, гидрокси, карбокси, алкоксикарбонил, арилоксикарбонил, аралкоксикарбонил,арил, гетероарил, ациламино, циано или трифторметильной группой;Rw означает алкил, циклоалкил, фенил,бензил, где Rd и Re независимо означают водород, С 1-6 алкил,С 2-6 алкенил или фенил, Rf означает водород, С 1-6 алкил, С 2-6 алкенил или фенил, Rg означает водород, С 1-6 алкил, С 2-6 алкенил или фенил и Rh означает аралкил или С 1-6 алкил;m равно от 0 до 6. Один класс соединений и их фармацевтически приемлемых солей представлен соединениями, в которых R3 означает водород, С 1-4 алкил, C3-7 циклоалкил или СF3, предпочтительно С 1-4 алкил и каждый из m и n равен от 0 до 4. Подкласс данного класса соединений и их фармацевтически приемлемых солей представлен соединениями, в которых R4 означает водород или галоген. Группа данного подкласса соединений и их фармацевтически приемлемых солей представлена соединениями, в которых W означает Н или R1. Подгруппа данной группы соединений и их фармацевтически приемлемых солей представлена соединениями, в которых R1 означаетR2,R2(CH2)tC(R12)2, где t равно 0-3 и оба R12 могут быть одинаковыми или различными,R2C(R12)2(CH2)t, где t равно 0-3 и оба R12 могут быть одинаковыми или различными, при 004884 8 чем (R12)2 также может образовывать кольцо с атомом углерода, например, C3-7 циклоалкил,R2CH2C(R12)2(CH2)q, где q равно 0-2 и оба 12R могут быть одинаковыми или различными,где (R12)2 также может образовывать кольцо с атомом углерода, например, С 3-7 циклоалкил,(R2)2CH(CH2)r, где r равно 0-4 и оба R2 могут быть одинаковыми или различными, причем(R2)2 также может образовывать кольцо с СH,например, С 3-7 циклоалкил, С 7-12 бициклоалкил,С 10-16 трициклоалкил или 5-7-членный моно- или бициклогетероциклическое кольцо, которое может быть насыщенным или ненасыщенным и которое содержит от одного до трех гетероатомов, выбранных из группы, включающей N, О иR могут быть одинаковыми или различными,причем (R12)2 также может образовывать кольцо с атомом углерода, например, С 3-7 циклоалкил илиR2 означает фенил или нафтил, каждый из которых является замещенным или незамещенным одной или более из следующих групп: С 1-4 алкил, С 1-4 алкокси, галоген, гидрокси, CF3, OCF3 илиSO2NH2,5-7-членное моно- или 9-10-членное бициклогетероциклическое кольцо или негетероциклическое кольцо, которое может быть насыщенным или ненасыщенным, причем гетероциклическое кольцо содержит от 1 до 4 гетероатомов, которые выбирают из группы, включающей N, О и S, и причем гетероциклическое или негетероциклическое кольцо является незамещенным или замещенным галогеном или гидроксилом,С 1-7 алкил, незамещенный или замещенный одной или более из следующих групп: гидрокси,СООН, С 3-7 циклоалкил, СF3, N(СН 3)2, С 1-3 алкиларил, гетероарил или гетероциклоалкил,СF3 или С 3-7 циклоалкил, незамещенный или замещенный арилом; и R12 означает водород или С 1-4 алкил, незамещенный или замещенный одной или более из следующих групп: гидрокси,СООН, амино, арил, гетероарил или гетероциклоалкил. Семейство данной подгруппы соединений или их фармацевтически приемлемых солей представлено соединениями, в которых: 12 динены с образованием алкиленовой связующей группы, -(CH2)u- и -(СН 2)v-, соответственно, где каждый u и v равен 2-5, наиболее предпочтительно 2 или 3. Предпочтительными значениями Ra, Rb иR в формуле I являются водород, гидрокси, С 1-6 алкил, С 1-6 алкокси, циано или -CO2Rw, где Rw в каждом случае предпочтительно означает С 1-4 алкил, С 4-7 циклоалкил или бензилоксикарбонил. Подходящие значения Ra, Rb и Rc включают водород, метил, этил, пропил, н-бутил, гидрокси,метокси, этокси, циано, -CO2CH3, -СО 2 СН 2 СН 3 и-CO2CH2CH2CH3. В наиболее предпочтительных вариантах воплощения настоящего изобретения каждый Ra, Rb и Rc означает водород. Предпочтительным также значением Ra, Rbc и R является также группа -CO2Rw, где Rw является одним из следующих остатковR являются -СО 2Rw, где Rw является одним из этих остатков, то полученные соединения являются пролекарствам и, которые обладают требуемыми характеристикам и по составу и биодоступности. Предпочтительным значением Rd,Re и Rg является водород, Rf означает метил и предпочтительное значение Rh включает бензил или трет-бутил. Предпочтительные значения n в формуле I равны от 0 до 6, более предпочтительно от 0 до 4 и наиболее предпочтительно 0, 1 или 2. Предпочтительное значение m равно от 0 до 4, наиболее предпочтительно 0, 1 или 2. Особенно предпочтительные соединения представлены формулами II, III и IV:R5 предпочтительно означает водород. Предпочтительными соединениями, где Х означает NR11, являются соединения, в которых,R11 означает водород или С 1-6 алкил, необязательно замещенный одной, двумя или тремя,предпочтительно одной из следующих групп: амино, моноалкиламино, диалкиламино, алкокси, гидрокси, алкоксикарбонил, арилоксикарбонил, аралкоксикарбонил, карбоалкокси, фенил,циано, трифторметил, ацетиламино, пиридил,тиофенил, фурил, пирролил или имидазолил. Подходящие значения R11 включают водород, метил, этил, пропил, н-бутил, бензил, фенетил, 2-гидроксиэтил, 3-гидроксипропил, 4 гидроксибутил, карбоксиметил и карбоксиэтил. Наиболее предпочтительными соединениями являются соединения, в которых Х означает кислород. Предпочтительными являются соединения формулы I, где R6 означает водород или С 1-6 алкил. Предпочтительными являются соединения формулы I, где R7, R8, R9 и R10 независимо означают водород, С 1-6 алкил, С 6-10 ар(С 1-6)алкил, С 6-10 арил, С 2-10 гидроксиалкил или С 2-7 карбоксиалкил. Используемые значения R7, R8, R9 и R10 включают водород, метил, этил, пропил, н-бутил, бензил, фенетил, 2-гидроксиэтил, 3-гидроксипропил, 4-гидроксибутил, 2-карбоксиметил, 3-карбоксиэтил и 4-карбоксипропил. Предпочтительными являются также соединения, в которых R7 и R8 или R9 и R10 объе или их сольватами, гидратами или фармацевтически приемлемыми солями, где W определено выше и имеет предпочтительные значения, как определено для формулы I выше; Х означает -О-, -NH- или -CH=N- (амидиногидразоновая группа, где NH присоединен кNН-группе исходной формулы). Х предпочтительно находится в третьем или четвертом по 13 ложении кольца, наиболее предпочтительно в четвертом положении.R4 означает водород или галоген;m' равно 0, 1, 2 или 3, предпочтительно 0 или 1. Отдельные соединения по настоящему изобретению включают следующие: 1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(фенетиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]аминокарбонилметил-6-метил-3-(2,2-дифенилэтиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(4-метилфенетиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(4-метоксифенетиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(1-фенилциклобутил) метиламинопиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-[2-(1-нафталин)этил] аминопиразинон,1-N-[2-(aмидинoaминooкcи)этил]aминo кapбoнилмeтил-6-мeтил-3-(2-фенил-1-бутиламино)пиразинон,1-N-[2-(aмидинoaминooкcи)этил]aминo кapбoнилмeтил-6-мeтил-3-(2-[3,4-метилендиоксифенил]этиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-[2-пиридил]этиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-[2-метилфенил] этиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-[3-метилфенил] этиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-[2-трифторметилфенил]этиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-[3-трифторметилфенил]этиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-[4-трифторметилфенил]этиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-[3,5-диметилфенил]этиламино)пиразинон, 004884 14 1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-инданиламино) пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-[3,4-дифторфенил]этиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-[5-инданил]этиламино)пиразинон,1-N-[2-(aмидинoaминooкcи)этил]aминo кapбoнилмeтил-6-мeтил-3-(2-фторфенетиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(3,4-диметоксифенетиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(4-фторфенетиламино)пиразинон,1-N-[2-(aмидиноаминоокси)этил]амино карбонилметил-6-метил-3-(4-этилфенетиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-фенилпропиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(3,4-диметилфенетиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-нафталинэтиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2,2-дифенилпропиламино)пиразинон,1-N-[2-(aмидинoaминooкcи)этил]aминo кapбoнилмeтил-6-мeтил-3-(2-(3-индолил)этиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-[1-(4-метилнафталин)]этиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-[2,4-дифторфенил] этиламино)пиразинон,1-N-[2-(амидино-N'-метиламиноокси) этил]аминокарбонилметил-6-метил-3-(2-[4 метилфенил]этиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-5-хлор-6-метил-3-(фенетиламино)пиразинон,1-N-[2-(aмидинoaминooкcи)этил]aминo кapбoнилмeтил-5-xлop-6-мeтил-3-(2,2-дифенилэтиламино)пиразинон,1-N-[2-(амидиногидразино)этил]амино карбонилметил-6-метил-3-(фенетиламино)пиразинон,1-N-[2-(aмидинoгидpaзинo)этил]aминo кapбoнилмeтил-6-мeтил-3-(1-метил-2-фенилэтиламино)пиразинон,1-N-[2-(амидиногидразино)этил]амино карбонилметил-6-этил-3-(фенетиламино)пиразинон, 15 1-N-[2-(амидиногидразино)этил]амино карбонилметил-6-метил-3-(4-метилфенилэтиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(1-метил-2-(4-метиламино-3-пиридил)этиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(1-метил-2-(3-пиридил)этиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-циклопропил-2(3,4-диметоксифенил)этиламино)пиразинон,1-N-[2-(aмидинoaминooкcи)этил]aминo кapбoнилмeтил-6-мeтил-3-(2-циклобутилэтиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-циклобутил-2,2 дифторэтиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-(3-фторфенил) этиламино)пиразинон,1-N-[2-(aмидинoaминooкcи)этил]aминo кapбoнилмeтил-6-мeтил-3-(2,2-дифтор-2-фенилэтиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-фенилциклопропиламино)пиразинон,1-N-[2-(aмидинoaминooкcи)этил]aминo кapбoнилмeтил-6-мeтил-3-(2-(4-хлорфенил)-2 циклопропилэтиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-циклопропил-2-(3 пиридил)этиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-бензилциклопропиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-циклопропил-2-(3 фторфенил)этиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2-циклопропил-2(3,4-дифторфенил)этиламино)пиразинон,1-N-[2-(амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(2,2-дифтор-2-фенилэтиламино)пиразинон,а также их фармацевтически приемлемые соли, например гидрохлорид, ацетат и трифторацетат. Следует также понимать, что настоящее изобретение включает стереоизомеры наряду с оптическими изомерами, например, смеси энантиомеров наряду с индивидуальными энантиомерами и диастереомерами, которые образуются вследствие структурной ассиметричности указанных серий выбранных соединений. Соединения по настоящему изобретению также могут образовывать полиморфные кристаллические формы, причем все такие полиморфные кристаллические формы включены в область настоящего изобретения. Соединения формулы I могут быть также в форме сольватов, прежде всего в форме гидра 004884 16 тов. Гидратация может происходить в процессе получения соединений или композиций, содержащих соединения, или гидратация может происходить во времени благодаря гигроскопической природе соединений. Некоторые соединения формулы I, включенные в область изобретения, являются производными, названными пролекарствами. Термин"пролекарство" означает производное известного лекарственного средства прямого действия,причем указанное производное обладает улучшенными характеристиками по доставке и повышенной терапевтической эффективностью по сравнению с лекарственным средством, и превращается в активное лекарственное средство путем ферментативного или химического процесса. Подходящими пролекарствами являются соединения, в которых Ra, Rb и/или Rc означают-СО 2Rw, где Rw определен выше. См. патент США No 5466811 и статью Saulnier и соавт.,Bioorg. Med. Chem. Lett. 4:1985-1990 (1994). Если в любой составляющей части или в формуле I содержится более одного любого изменяемого элемента (заместителя), его определение в каждом случае не зависит от его определения в любом другом случае. Кроме того,комбинация заместителей и/или изменяемых элементов допустима только, если такая комбинация позволяет получить устойчивые соединения. Согласно другому объекту, настоящее изобретение включает композиции, которые могут быть использованы для получения изображения тромбов in vivo у млекопитающих, причем композиции включают соединение по настоящему изобретению, которое можно детектировать за пределами тела. Предпочтительными являются композиции, включающие соединение по настоящему изобретению и детектируемую метку,такую как радиоактивный или парамагнитный атом. Другим аспектом настоящего изобретения являются диагностические композиции для получения изображения in vivo тромба у млекопитающих, включающие фармацевтически приемлемый носитель и диагностически эффективное количество соединения или композиции по настоящему изобретению. Согласно другому аспекту настоящее изобретение включает способы, которые могут быть использованы для получения изображенияin vivo тромбов у млекопитающих. Согласно предпочтительному аспекту подходящими являются соединения, в которых заместитель R1 замещен детектируемым атомом(меткой), таким как атом радиоактивного иода,таким как I-125, I-131 или I-123. В этом случае предпочтительным R1 является фенил, содержащий в пара-положении I-123, I-125 или I-131,или бензил, содержащий в мета-положении I123, I-125 или I-131. 17 Детектируемой меткой может быть также радиоактивный или парамагнитный хелатный остаток, в котором подходящий лиганд (L) присоединен к заместителю R1 напрямую или через двухвалентную связывающую группу А". В альтернативном варианте группы W в формуле I заменены на группу -А"-L. Термин "подходящий лиганд" означает органический остаток,образующий хелатный комплекс с ионом радиоактивного или парамагнитного металла. В указанных соединениях двухвалентная связывающая группа А" включает группы, способные образовывать ковалентную связь со свободной аминогруппой, а также образовывать хелатные комплексы. Например, А" может означать -C(=S)-, -C(=O)-, -С(=NН)-(СН 2)6 С(=NН)-, -С(=O)-(СН 2)6-С(=O)-, и т.п. В соединениях, представленных формулойI, хелатный лиганд L включает также группы,способные образовывать ковалентное и нековалентное связывание с радиоактивным или парамагнитным атомом. Указанные хелатные остатки включают известные остатки, используемые для комплексообразования радиоактивных или парамагнитных атомов. Указанные хелатные остатки содержат от 3 до 12, предпочтительно от 3 до 8 остатков метиленфосфониевой кислоты, метиленкарбогидроксамовой кислоты, карбоксиэтилиденовых групп или прежде всего карбоксиметиленовых групп, присоединенных к атому азота. Если к атому азота присоединены только одна или две кислотные группы, то этот атом азота соединен с другим атомом азота, который имеет такие группы, соединенные через этиленовые группы, по выбору замещенные,или через отдельные этиленовые звенья (до четырех звеньев), разделенные атомом азота или кислорода, или серы. Предпочтительным способом комплексообразования является использование диэтилентриамино-N,N,N',N",N"-пентауксусной кислоты (ДТПУ). ДТПУ хорошо известна в данной области техники в качестве хелатного агента для радиоактивных атомов индия 111 (In-111), технеция-99m (Тс-99m) и парамагнитного атома гадолиния (Gd). См. статью Khaw и соавт., Science 209: 295(1980); патент США No 4652440 (1987), Paik C.H. и соавт.; патент СШАNo 4957939 (1990), Gries H. и соавт. Предпочтительным хелатным лигандом L является 1-(паминобензил)диэтилентриаминопентауксусная кислота. В качестве хелатных агентов включены также соединения, содержащие сульфгидрильные или аминные остатки, и любые комбинации, по крайней мере, четырех указанных остатков. Эти сульфгидрильные или аминные остатки разделены друг от друга по крайней мере двумя атомами, которыми могут быть атомы углерода, 004884 18 азота, кислорода или серы. Особенно предпочтительным хелатным агентом L является металлотионеин, хорошо известный в области техники в качестве хелатного агента для Тс-99m. Термин "алкил", использованный в данном описании самостоятельно или в составе другой группы, означает линейные или разветвленные углеводородные цепи, содержащие до 12 атомов углерода, такие как метил, этил, пропил, изопропил, бутил, трет-бутил, изобутил, пентил,гексил, изогексил, гептил, 4,4-диметилпентил,оксил, 2,2,4-триметилпентил, нонил, децил, ундецил, додецил. Термин "алкенил", использованный в данном описании, означает линейную или разветвленную углеводородную цепь, содержащую 220 атомов углерода, если длина цепи особо не ограничена, включая, но не ограничивая область изобретения перечисленным,этенил,1 пропенил, 2-пропенил, 2-метил-1-пропенил, 1 бутенил, 2-бутенил и т.п. Предпочтительная длина алкенильной цепи составляет от 2 до 10 атомов углерода, более предпочтительно от 2 до 8 атомов углерода и наиболее предпочтительно от 2 до 4 атомов углерода. Термин "алкинил", использованный в данном описании, означает линейную или разветвленную цепь, содержащую 2-20 атомов углерода, если длина цепи особо не ограничена, в которой содержится, по крайней мере, одна тройная связь между двумя атомами углерода в цепи, включая, но не ограничивая область изобретения перечисленным, ацетилен, 1-пропилен, 2 пропилен и т.п. Предпочтительная длина алкинильной цепи составляет от 2 до 10 атомов углерода, более предпочтительно от 2 до 8 атомов углерода и наиболее предпочтительно от 2 до 4 атомов углерода. Во всех случаях, если в цепи в качестве заместителя присутствует алкенильный или алкинильный остаток, ненасыщенная связь, то есть винилиденовая или ацетиленовая связь предпочтительно не связана напрямую с остатком, содержащим азот, кислород или серу. Термин "алкокси", использованный в данном описании, означает линейную или разветвленную цепь, содержащую от 1 до 20 атомов углерода, если длина цепи особо не ограничена,и связанную с атомом кислорода, включая, но не ограничивая область изобретения перечисленным, метокси, этокси, н-пропокси, изопропокси и т.п. Предпочтительно длина алкокси цепи составляет от 1 до 10 атомов углерода,более предпочтительно от 1 до 8 атомов углерода. Термин "арил", использованный в данном описании самостоятельно или в составе другой группы, означает моноциклические или бициклические ароматические группы, содержащие от 6 до 12 атомов углерода в циклическом остатке,предпочтительно от 6 до 10 атомов углерода,такие как фенил, нафтил или тетрагидронафтил. 19 Термин "гетероарил", использованный в данном описании, означает группы, содержащие от 5 до 14 атомов в цикле и 6, 10 или 14 общих п-электронов в циклической структуре; и содержащие атомы углерода и 1, 2 или 3 атомов кислорода, азота или серы в качестве гетероатомов (если примерами гетероарильных групп являются тиенил, бензо[b]тиенил, нафто[2,3b]тиенил, тиантренил, фурил, пиранил, изобензофуранил, бензоксазолил, хроменил, ксантенил, феноксатиинил, 2 Н-пирролил, пирролил,имидазолил, пиразолил, пиридил, пиразинил,пиримидинил, пиридазинил, индолизинил, изоиндолил, 3H-индолил, индолил, индазолил, пиринил, 4H-хинолизинил, изохинолил, хинолил,фталазинил, нафтиридинил, хиназолинил, циннолинил, птеридил, 4 Н-карбазолил, карбазолил, -карболинил, фенантридинил, акридинил,перимидинил, фенантролинил, феназинил, изотиазолил, фенотиазинил, изоксазолил, фуразанил и феноксазинил группы). Термин "аралкил" или "арилалкил", использованный в данном описании самостоятельно или в составе другой группы, означает С 1-6 алкил группы, описанные выше и имеющие арильный заместитель, такой как бензил, фенилэтил или 2-нафтилметил. Термин "циклоалкил", использованный в данном описании самостоятельно или в составе другой группы, означает циклоалкильные группы, содержащие от 3 до 9 атомов углерода. Типичными примерами являются циклопропил,циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и циклононил. Термин "С 7-12 бициклический алкил" включает бицикло[2.2.1]гептил(норборнил), бицикло[2.2.2]октил, 1,1,3-триметилбицикло[2.2.1] гептил(борнил) и т.п. Термин "алкокси" относится к определенным выше алкильным группам, присоединенным к атому кислорода. Термин "галоген" или "галогенид", использованный в данном описании самостоятельно или в составе другой группы, относится к хлору,брому, фтору или иоду, причем предпочтительно к хлору. Термин "моноалкиламин", использованный в данном описании самостоятельно или в составе другой группы, относится к аминогруппе, замещенной одной алкильной группой, содержащей от 1 до 6 атомов углерода. Термин "диалкиламин", использованный в данном описании самостоятельно или в составе другой группы, относится к аминогруппе, замещенной двумя алкильными группами, каждая их которых содержит от 1 до 6 атомов углерода. Термин "гидроксиалкил", использованный в данном описании, относится к любой из вышеописанных алкильных групп, замещенных одной или более гидроксильными группами. 20 Термин "карбоксиалкил", использованный в данном описании, относится к описанным выше алкильным группам, замещенным одним или более карбоксильными остатками. Термин "гетероцикл" или "гетероциклическое кольцо", использованный в данном описании, если особо не оговорено, представляет стабильную 5-7-членную моно- или бициклическую систему или стабильную 7-10-членную бициклическую гетероциклическую кольцевую систему, любой цикл в которой может быть насыщенным или ненасыщенным и в состав которого включены атомы углерода и от одного до трех гетероатомов, выбранных из группы,включающей атомы N, О и S, причем гетероатомы азота и серы могут быть по выбору окислены, а гетероатом азота может быть по выбору в четвертичном состоянии, а также система включает любую бициклическую группу, в которой любые из определенных выше гетероциклических колец образуют конденсированные с бензолом системы. Прежде всего подходящими являются кольца, содержащие один атом кислорода или серы, от одного до трех атомов азота или один атом кислорода или серы в сочетании с одним или двумя атомами азота. Гетероциклическое кольцо может быть присоединено к любому гетероатому или атому углерода, что приводит к образованию стабильной структуры. Примеры таких гетероциклических групп включают пиперидинил,пиперазинил,2 оксопиперазинил,2-оксопиперидинил,2 оксопирролодинил, 2-оксоазепинил, азепинил,пирролил, 4-пиперидонил, пирролидинил, пиразолил, пиразолидинил, имидазолил, имидазолинил, имидазолидинил, пиридил, парзинил, пиримидинил, пиридазинил, оксазолил, оксазолидинил, изоксазолил, изоксазолидинил, морфолинил, тиазолил, тиазолидинил, изотиазолил,хинуклидинил, изотиазолидинил, индолил, хинолинил, изохинолинил,бензимидазолил, тиадиазолил, бензопиранил, бензотиазолил, бензоксазолил, фурил, тетрагидрофурил, тетрагидропиранил, тиенил, бензотиенил, тиаморфолинил, тиаморфолинилсульфоксид, тиаморфолинилсульфон и оксадиазолил. Термин морфолино идентичен термину морфолинил. Термин "гетероатом", использованный в данном описании, означает атом кислорода("О"), атом серы ("S") или атом азота ("N"). Следует понимать, что если гетероатомом является атом азота, он может образовать остатокNRaRb, где Ra и Rb независимо друг от друга означают водород или С 1 - C8 алкил или объединены вместе с атомом азота, к которому они присоединены, с образованием насыщенного или ненасыщенного 5-, 6- или 7-членного кольца. На схемах 1 и 2 представлены стадии синтеза соединений формулы I. Значения W, R3, R7, R8, R9, R10, Ra, Rb, Rc, n и m на схемах 1 и 2 определены выше; R4 означает Cl или Br; P означает защитную группу аминогруппы, такую как бензилоксикарбонил(Cbz), и P' означает защитную группу для карбоксильной группы, такую как бензил. Согласно схеме 1 защищенный аминоспирт 1 присоединяют к N-гидроксифталимиду 2 по методике азосочетания Мицунобу (Mitsunobu О., Synthesis 1 (1981, и получают соединение 3. Предпочтительные условия реакции включают использование триалкилфосфина или триарилфосфина, например, трифенилфосфина в подходящем растворителе, таком как тетрагидрофуран или хлористый метилен, и диалкилазодикарбоксилата, например, диэтилазодикарбоксилата. Удаление фталимидной защитной группы проводят в стандартных условиях, хорошо известных в данной области техники (GreenSynthesis, 2-oe изд., John Wiley and Sons Inc.,New York (1991, таких как метиламин или гидразин в соответствующем растворителе, например, этаноле или изопропаноле. Гуанидилирование полученного алкоксиамина с образованием соединения 4 проводят с использованием замещенных реагентов для гуанидинилирования, таких как N,N'-бис(трет-бутоксикарбонил)S-метилизотиомочевина (Bergeron R.J. and(Bernatowicz M.S. с соавт., Tetrahedron Letter,34:3389 (1993. Удаление защитной группы с аминогруппы с образованием промежуточного соединения 5 осуществляют с использованием 22 стандартной методики, хорошо известной в данной области техники (Green T.W., Wuts(1991, например, в присутствии палладия на угле, в подходящем растворителе, например,метаноле или этаноле. В некоторых случаях предпочтительно добавляют кислоту, например,соляную кислоту. Согласно схеме 2 глицин, защищенный эфирной группой, например, Р' означает бензил или этил, вступает в реакцию конденсации с альдегидом, таким как ацетальдегид, и цианидом, таким как цианотриметилсилан (TMSCN),в подходящем растворителе, таком как хлористый метилен, с образованием аминонитрила 6. Аминонитрил реагирует с оксалилхлоридом или оксалилбромидом в подходящем растворителе,таком как 1,2-дихлорбензол, с образованием пиразинона 7. Затем 3-хлор или 3-бром группы в пиразиноне 7 замещают на соответствующий амин, такой как фенетиламин, 2,2-дифенилэтиламин или 4-метоксифенетиламин, в подходящем растворителе, таком как этилацетат, с образованием соединения 8. Из сложного эфира 8 получают кислоту 9 с использованием стандартной методики, хорошо известной в данной области техники (Green T.W., Wuts P.G.M., Protectiveand Sons Inc., New York (1991, например, гидролиза с использованием оснований, например,LiOH или NaOH, в подходящем растворителе,таком как смесь тетрагидрофуран/метанол/вода. Затем оставшийся хлор или бром необязательно удаляют гидрированием с использованием катализатора, такого как палладий на угле или никель Ренея, в соответствующем растворителе,таком, как вода, при этом получают соединение 9. В случае если Р' означает бензил, удаление бензилового эфира и удаление оставшегося хлора или брома можно осуществить одновременно с использованием палладия на угле в подходящем растворителе, таком как смесь тетрагидрофуран/этанол, с образованием соединения 9. Затем полученная кислота вступает в реакцию конденсации с амином 5 путем обычной конденсации амина с кислотой, например, в присутствии бензиоктилфталата (ВОР) или пиридилбензиоктилфталата (РуВОР), в подходящем растворителе, таком как N,N-диметилформамид,и основания, такого как диизопропилэтиламин(DIEA), затем необязательно удаляют Ra, Rb, Rc,в случае если Ra и Rb означает третбутилоксикарбонил (Воc) и Rc означает водород. Группы Воc удаляют обработкой кислотой, такой как трифторуксусная кислота или соляная кислота, в соответствующем растворителе, таком как хлористый метилен или диоксан, при этом получают требуемое соединение 10. Соединения, в которых Х означает-CH=NR11 или NR11, могут быть получены с 23 использованием стадий, представленных на схеме 3. Схема 3 Кислота 9 (полученная по схеме 2) взаимодействует с аминоспиртом 11 по стандартной методике конденсации амина с кислотой, например, в присутствии ВОР или РуВОР в растворителе, таком как N,N-диметилформамид, и основания, такого как DIEA, с образованием соединения 12. Соответствующий альдегид 13 получают с использованием стандартных методик окисления спиртов (см. например, CareyF.A. and Sundberg R.J. Advanced Organic Chemistry, Part B: Reactions and Synthesis, 3-ье изд.,Plenum Press, New York (1990, таких как окисление по Сверну (Mancuso A.J. с соавт., Journalof Organic Chemistry, 3329 (1976, окисление хлорхроматом пиридиния (Corey E.J. и SuggsJ.W. Tetrahedron Letters, 2647 (1975, окисление дихроматом пиридиния (Corey E.G. and SchmidtG, Tetrahedron Letters, 399 (1979 или окисление комплексом триоксида серы и пиридинадиметилсульфоксида (Tetrahedron Letters,28:1603 (1987. Затем из альдегида 13 получают амидиногидразон 14 с использованием стандартных методик, например, обработкой аминогуанидином или замещенным аминогуанидином, такими как аминогуанидин или 2-гидразиноимидазолин,необязательно в присутствии кислоты, такой как азотная кислота, соляная кислота или бромистоводородная кислота, в подходящем растворителе, например, этаноле или метаноле, которые также могут содержать другие растворители,такие как дихлорметан или тетрагидрофуран. Получение аминогуанидина 15 из амидиногидразона 14 осуществляют в условиях восстановления, хорошо известных в данной области техники, например, боргидридом лития в подходящем растворителе, таком как тетрагидрофуран или метанол, при различных температурах вплоть до температуры кипения. По другой методике используют каталитическое гидрирование в присутствии катализатора палладий на угле. 24 В соединениях 14 и 15 Ra, Rb, Rc могут быть необязательно удалены с использованием условий, хорошо известных в данной области техники. В случае если Ra и Rb означают третбутилоксикарбонил (Воc) и Rc означает водород, группы Воc удаляют обработкой кислотой,такой как трифторуксусная кислота или соляная кислота, в соответствующем растворителе, таком как хлористый метилен или диоксан, при этом получают соединения 16 и 17, соответственно. Фармацевтически приемлемые соли соединений формулы I (в форме водно- или маслорастворимых или диспергируемых продуктов) включают обычные нетоксичные соли или соли четвертичного аммония, которые образуются,например, при обработке неорганическими или органическими кислотами или основаниями. Примеры таких кислотно-аддитивных солей включают ацетат, адипат, альгинат, аспартат,бензоат, бензолсульфонат, бисульфат, бутират,цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат,этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат,гидрохлорид, гидробромид, гидроиодид, 2 гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, никотинат,нитрат, оксалат, памоат, пектинат, персульфат,3-фенилпропионат, пикрат, пивалат, пропионат,сукцинат, сульфат, тартрат, тиоцианат, тозилат и ундеканоат. Основно-присоединенные соли включают соли аммония, соли щелочных металлов, такие как соли натрия и калия, соли щелочно-земельных металлов, такие как соли кальция и магния, соли органических оснований, такие как соли дициклогексиламина, Nметил-D-глюкамина и соли аминокислот, таких как аргинин, лизин и т.д. Основные азотсодержащие группы могут быть превращены в группы с четвертичным атомом азота путем обработки агентами, например, низшими алкилгалогенидами, такими как метил, этил, пропил и бутилхлориды, бромиды и иодиды; диалкилсульфатами, такими как диметил, диэтил, дибутил и диамилсульфаты; высшими алкилгалогенидами, такими как децил, лаурил, миристил и стеарилхлориды, бромиды и иодиды; аралкилгалогенидами, такими как бензил и фенетилбромиды и т.п. Предпочтительные кислоты для получения кислотно-аддитивных солей включают хлористоводородную кислоту и уксусную кислоту. Соединения по настоящему изобретению составляют новый класс эффективных ингибиторов металло, кислых, тиоловых и сериновых протеаз. Примерами сериновых протеаз, которые ингибируются соединениями по изобретению, являются эластаза (нейтрофилов из лейкоцитарной фракции) протеолитический фермент,включенный в патогенез эмфиземы; химотрипсин и трипсин - пищеварительные ферменты; 25 эластаза из поджелудочной железы и катепсинG - химотрипсин-подобная протеаза, также ассоциированная с лейкоцитами; тромбин и фактор Ха - протеолитические ферменты, включенные в путь свертывания крови. Соединения по настоящему изобретению используют также для ингибирования термолизина -металлопротеазы,и пепсина - кислой протеазы. Соединения по настоящему изобретению используют предпочтительно для ингибирования трипсин-подобных протеаз. Эффективность и другие биохимические параметры ингибирования ферментов для соединений по настоящему изобретению (для их целевого применения) можно легко определить с использованием стандартных биохимических методов, хорошо известных в данной области техники. Например, целевым применением соединений, ингибирующих химотрипсин и трипсин, является лечение панкреатита. Диапазон действующих доз для специфического целевого применения, естественно, зависит от природы и степени заболевания пациента или животного,подлежащего лечению, причем природа и степень заболевания определяется практикующим диагностом. Предполагается, что используемый диапазон доз для получения эффективного терапевтического действия составляет от 0,01 до 10 мг на кг в день. Соединения по настоящему изобретению,различающиеся по их способности ингибировать тромбин, могут быть использованы для ряда терапевтических целей. В качестве ингибиторов тромбина соединения по настоящему изобретению ингибируют образование тромбина. Следовательно, эти соединения могут быть использованы для лечения или профилактики состояний, характеризующихся аномальным венозным или артериальным тромбозом, включая образование или действие тромбина. Эти состояния включают, но не ограничивают область изобретения перечисленным, тромбоз глубоких вен, рассеянную (дессиминированную) внутрисосудистую коагулопатию, которая происходит при септическом шоке, вирусных инфекциях и онкологических заболеваниях; инфаркт миокарда; инсульт; шунтирование коронарной артерии; образование фибрина в глазном яблоке; вправление бедренного сустава и образование тромба,которое происходит либо в результате тромболитической терапии, либо в результате пластической чрескожной операции на коронарных сосудах (РСТА). Другой областью применения является использование упомянутых ингибиторов трипсина в качестве антикоагулянтов, либо введенных в материалы, либо физически связанных с материалами, которые используются для производства устройств для сбора крови,кровообращения и хранения крови, таких как катетеры, аппараты для диализа крови, шприцы и пробирки для отбора крови, системы кровообращения. Соединения по настоящему изобрете 004884 26 нию могут быть также использованы в качестве антикоагулянтов для аппаратов искусственного кровообращения. Показано, что металлические стенты снижают рестеноз, но являются тромбогенными. Стратегией для снижения тромбогенности стентов является нанесение, включение, адсорбция или ковалентное связывание тромбинингибирующего агента на поверхность или к поверхности стента. Для этой цели могут быть использованы соединения по настоящему изобретению. Соединения по изобретению могут быть связаны или включены в растворимые и/или биоразрушаемые полимеры и затем нанесены в качестве покрытия на материалы для изготовления стентов. Такие полимеры включают поливинилпирролидон, полигидроксипропилметакриламидфенол, полигидроксиэтиласпарамидфенол или полиэтиленоксидполилизин, замещенные остатками пальмитоила, полимолочную кислоту, полигликолевую кислоту, сополимеры полимолочной и полигликолевой кислоты, полиэпсилонкапролактон,полигидроксимасляную кислоту, полиортоэфиры, полиацетали, полидигидропираны, полицианоакрилаты и поперечно сшитые или амфипатичные блоксополимеры гидрогелей. См. заявка на выдачу европейского патента 761251,заявка на выдачу европейского патента 604022,канадский патент 2164684 и опубликованные заявки РСТ WO 96/11668, WO 96/32143 и WO 96/38136. В виду действия тромбина на типы клеток хозяина, такие как клетки гладкой мускулатуры,эндотелиальные клетки и нейтрофилы, соединения по настоящему изобретению могут быть дополнительно использованы для лечения или профилактики респираторного дистресссиндрома у взрослых, воспалительных реакций,заживления ран, повреждения после повторной перфузии, атеросклероза и рестеноза, возникающего после повреждения, такого как пластическая операция на сосудах с использованием надувного баллона, атеректомия и установка артериального стента. Соединения по настоящему изобретению могут быть использованы для лечения неоплазии и метастаза, а также нейродегенеративных заболеваний, таких как болезнь Альцгеймера и болезнь Паркинсона. При использовании в качестве ингибиторов тромбина соединения по настоящему изобретению можно вводить в эффективном количестве в диапазоне от приблизительно 0,1 до приблизительно 500 мг/кг, предпочтительно от 0,1 до 10 мг/кг тела, по схеме приема в виде суточных однократных доз или суточных доз, разделенных на 2-4 порции. При использовании в качестве ингибиторов тромбина соединения по настоящему изобретению можно использовать в комбинации с тромболитическими агентами, такими как тка 27 невой активатор плазминогена, стрептокиназа и урокиназа. Кроме того, соединения по настоящему изобретению можно использовать в комбинации с другими средствами, антитромботическими или антикоагулянтами, такими как (без ограничения области изобретения перечисленным) антагонисты фибриногена и антагонисты рецептора тромбоксана. Ингибиторы тромбина могут быть также связаны с растворимыми полимерами, используемыми в качестве целевых носителей лекарственных средств. Такие полимеры могут включать поливинилпирролидон, сополимер пирана,полигидроксипропилметакриламид-фенол, полигидроксиэтил-аспартамид-фенол или полиэтиленоксид-полилизин, замещенный остатками пальмитоила. Кроме того, ингибиторы тромбина могут быть связаны с классом биоразрушаемых полимеров, используемых для обеспечения управляемого высвобождения лекарственного средства, например, с полимолочной кислотой,полигликолевой кислотой, сополимерами полимолочной и полигликолевой кислоты, полиэпсилон-капролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями,полидигидропиранами, полицианоакрилатами и поперечно сшитыми или амфипатичными блоксополимерами гидрогелей. Эластаза лейкоцитов человека выделяется полиморфонуклеарными лейкоцитами в очагах воспаления, и таким образом ее выделение является причиной ряда патологических состояний. Предполагается, что соединения по настоящему изобретению будут обладать противовоспалительным действием, которое можно использовать при лечении подагры, ревматоидного артрита и других воспалительных процессов, а также при лечении эмфиземы. Ингибирующие свойства соединений по настоящему изобретению по отношению к эластазе лейкоцитов определяют способом, описанным ниже. Катепсин G также вовлечен в патологические состояния при артрите, подагре и эмфиземе, и,кроме того, при гломерулонефрите и инвазиях легких, вызванных инфекциями в легких. Для целевого применения соединений формулы I в качестве ингибиторов ферментов свойства этих соединений можно легко определить с использованием стандартных биохимических методов,хорошо известных в области техники. Ингибирующие свойства соединений,включенных в область настоящего изобретения,по отношению к катепсину G определяют по следующему методу. Препарат частично очищенного катепсина G человека получают по методике, описанной в статье Baugh и соавт.,Biochemistry 15:836 (1979). Основным источником для получения эластазы лейкоцитов и катепсина G (с химотрипсин-подобной активностью) являются гранулоциты. Лейкоциты подвергают лизису и выделяют гранулоциты. Гранулоциты экстрагируют 0,20 М раствором аце 004884 28 тата натрия, рН 4,0 и экстракты диализуют против 0,05 М Трио-буферного раствора, содержащего 0,05 М NaCl, рН 8,0 при 4 С в течение ночи. В процессе диализа белковая фракция выпадает в осадок и ее выделяют центрифугированием. Эта фракция содержит основное количество химотрипсин-подобной активности гранулоцитов. Для каждого фермента получают специфические субстраты, а именно N-Suc-Ala-Ala-ProVal-n-нитроанилид и Suc-Ala-Ala-Pro-Рhе-пнитроанилид. Последний не гидролизуется эластазой лейкоцитов. Препараты ферментов анализируют в 2,00 мл 0,10 М буферного раствораHepes, рН 7,5, содержащего 0,50 М NaCl, 10% диметилсульфоксида и в качестве субстрата 0,0020 М Suc-Ala-Ala-Pro-Phe-п-нитроанилида. Гидролиз субстрата,содержащего пнитроанилид, контролируют по поглощению при 405 нм и температуре 25 С. Используемый диапазон доз, в случае применения соединений по настоящему изобретению в качестве ингибиторов эластазы нейтрофилов и в качестве ингибиторов катепсинаG, зависит от природы и степени патологического заболевания, которые определяются практикующим диагностом, причем диапазон доз при использовании указанных соединений для лечения вышеупомянутых патологических состояний составляет от 0,01 до 10 мг/кг массы тела в день. Соединения по настоящему изобретению,которые ингибируют урокиназу или активатор плазминогена, могут быть эффективно использованы для лечения патологических состояний,сопровождающихся избыточным ростом клеток. Такие соединения по настоящему изобретению могут быть также использованы при лечении доброкачественной гипертрофии предстательной железы и карциномы предстательной железы, при лечении псориаза и в качестве абортивных средств. Для целевого применения этих соединений эффективность действия и другие биохимические параметры характеристик ингибирующей активности для соединений по настоящему изобретению можно легко определить с использованием стандартных биохимических методов, хорошо известных в области техники. Диапазон действующих доз в случае указанного применения зависит от природы и степени патологического состояния пациента или животного, подлежащего лечению, причем природа и степень заболевания определяется практикующим диагностом. Предполагается, что для достижения эффективного терапевтического эффекта диапазон основной дозы составляет от приблизительно 0,01 до 10 мг/кг в день. Дополнительная область применения соединений по настоящему изобретению включает анализ коммерческих ферментативных реагентов для определения концентрации активных центров. Например, химотрипсин выпускается в качестве стандартного реагента для количест 29 венного клинического определения активности химотрипсина в соке поджелудочной железы и фекалиях. Такие методы анализа используют для диагноза нарушений в желудочнокишечном тракте и поджелудочной железе. Панкреатическая эластаза также выпускается в качестве реагента для количественного определения 1-антитрипсина в плазме. Концентрация 1-антитрипсина в плазме возрастает в процессе некоторых воспалительных реакций, а недостаточность 1-антитрипсина связана с увеличением частоты заболеваний легких. Соединения по настоящему изобретению могут быть использованы для повышения точности и воспроизводимости таких анализов с помощью титраметрической стандартизации выпускаемых коммерческих препаратов эластазы. См. патент США No 4499082. Активность протеаз в различных белковых экстрактах в процессе очистки определенных белков является широко распространенной проблемой, так как присутствие протеаз усложняет процесс и искажает результаты выделения белка. Некоторые протеазы, содержащиеся в таких экстрактах, можно ингибировать в процессе выделения с помощью соединений по настоящему изобретению, которые прочно связывают различные протеолитические ферменты. Фармацевтические композиции по изобретению могут быть введены любому животному,на котором можно испытать положительное действие соединений по изобретению. Предпочтительным среди таких животных является человек, хотя область изобретения этим не ограничивается. Фармацевтические композиции по настоящему изобретению могут быть введены любым способом для достижения необходимой цели. Например, способ введения может быть парентеральным, подкожным, внутривенным,внутримышечным, внутрибрюшинным, чрескожным, трансбуккальным или в глазное яблоко. В альтернативном случае или одновременно соединения могут быть введены оральным способом. Вводимая доза зависит от возраста, состояния здоровья и веса пациента, типа одновременного лечения, если такое проводится,частоты лечения и природы ожидаемого эффекта. Новые фармацевтические препараты кроме фармакологически активных соединений могут содержать подходящие фармацевтически приемлемые носители, включающие наполнители и вспомогательные агенты, которые облегчают обработку активных соединений для получения препаратов для фармацевтического применения. Способы получения фармацевтических препаратов по настоящему изобретению сами по себе хорошо известны, например, способы обычного смешивания, гранулирования, получения драже, растворения или лиофилизации. 30 Таким образом, фармацевтические препараты для орального введения могут быть получены путем смешивания активных соединений с твердыми наполнителями, по выбору путем размалывания полученной смеси и обработки смеси гранул, в случае необходимости или по желанию, после добавления вспомогательных агентов для получения таблеток или ядер драже. Подходящими наполнителями прежде всего являются наполнители типа сахаридов, например, лактоза или сахароза, маннит или сорбит, препараты целлюлозы и/или фосфаты кальция, например, фосфат кальция или гидрофосфат кальция, а также связующие вещества, такие как крахмальная паста, например, с использованием маисового крахмала, пшеничного крахмала, рисового крахмала, картофельного крахмала; желатин, трагакант, метилцеллюлоза,гидроксипропилметилцеллюлоза, натрий карбоксиметилцеллюлоза и/или поливинилпирролидон. По желанию могут быть добавлены дезинтегрирующие агенты, такие как выше перечисленные крахмалы, а также карбоксиметилированный крахмал, поперечно сшитый поливинилпирролидон, агар или альгиновая кислота или ее соль, такая как альгинат натрия. Вспомогательными агентами прежде всего являются вещества, регулирующие текучесть, и замасливатели, например, кремнезем, тальк, стеариновая кислота и ее соли, такие как стеарат магния или стеарат кальция, и/или полиэтиленгликоль. Ядра драже получают с подходящим покрытием, которое по желанию может быть устойчивым к желудочным сокам. Для этих целей можно использовать концентрированные растворы сахаридов, которые по выбору могут содержать аравийскую камедь, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана,растворы глазурей и подходящие органические растворители или смеси растворителей. Для получения покрытий, устойчивых к желудочным сокам, используют подходящие препараты целлюлозы, такие как фталат ацетилцеллюлозы или фталат гидроксиметилцеллюлозы. К таблеткам или покрытиям драже могут быть добавлены красители или пигменты, например, для идентификации или характеристики комбинаций доз активных соединений. Другие фармацевтические препараты, используемые для орального введения, включают штампованные капсулы из желатина, а также мягкие герметичные капсулы из желатина и пластификатора, такого как глицерин или сорбит. Штампованные капсулы могут содержать активные соединения в форме гранул, которые могут быть смешаны с наполнителями, такими как лактоза, связующими веществами, такими как крахмалы, и/или умасливателями, такими как тальк, или стеарат магния, и по выбору стабилизаторами. Для мягких капсул активные соединения предпочтительно растворяют или суспендируют в подходящих жидкостях, таких как 31 растительные (нелетучие) масла или вазелиновое масло. Кроме того, могут быть добавлены стабилизаторы. Подходящие композиции для парентерального введения включают водные растворы активных соединений в водно-растворимой форме, например, водно-растворимые соли, щелочные растворы и циклодекстриновые комплексы включения. Особенно предпочтительными щелочными солями являются соли аммония, полученные, например, в смеси с Трис, гидроксидом холина,бис-Трис-пропаном,Nметилглюкамином или аргинином. Для стабилизации и увеличения растворимости соединений по настоящему изобретению в воде могут быть использованы один или более модифицированных или немодифицированных циклодекстринов. Использованные для этой цели циклодекстрины описаны в патентах США N 4727064, N 4764604 и N 5024998. Кроме того, активные соединения могут быть введены в виде соответствующих масляных суспензий для инъекций. Подходящими липофильными растворителями или наполнителями являются растительные масла, например,кунжутное масло, или синтетические эфиры жирных кислот, например, этилолеат или триглицериды или полиэтиленгликоль-400 (соединения растворимы в ПЭГ-400). Водные суспензии для инъекций могут содержать вещества для повышения вязкости суспензии, например, натрий карбоксиметилцеллюлозу, сорбит и/или декстран. По выбору суспензия может содержать стабилизаторы. В соединения формулы I можно ввести метку в виде радиоактивного иода с использованием реакции обмена. Обмен холодного иода на горячий иод является известным способом в данной области техники. По альтернативному способу, меченное радиоактивным иодом соединение можно получить из соответствующего бромзамещенного соединения через промежуточное трибутилстаннил-производное. См. патент США No 5122361, включенный в текст данного описания. Настоящее соединение включает также композиции, которые используют для получения изображения тромбов in vivo у млекопитающих, причем композиции включают соединение формулы I в составе комплекса с радиоактивным атомом. Подходящими радиоактивными атомами для соединений формулы I являются Со-57, Cu67, Ga-67, Ga-68, Ru-97, Tc-99m, In-111, In113m, Hg-197, Au-198 и Pb-203. Некоторые радиоактивные атомы обладают превосходными свойствами, подходящими для использования в радиохимических способах получения изображений. Идеальным радиоактивным атомом для получения изображения прежде всего является технеций-99m (Тс-99m) благодаря свойствам его ядра. Этот атом является гамма-излучателем 32 и характеризуется единой энергией фотона,равной 140 кэВ, и периодом полураспада приблизительно 6 ч. Тс-99m легко получить с использованием генератора Мо-99/Тс-99. Рений 186 и-188 также характеризуется гамма-излучением,что позволяет использовать этот атом для получения изображения. Предпочтительные композиции содержат радиоактивный атом, Тс-99m. Композиции по настоящему изобретению обычно получают путем заполнения соединения формулы I радиоактивными изотопами, подходящими для детектирования за пределами тела. Предпочтительными радиоактивными атомами являются гамма-излучатели индий-111m итехнеций-99m, благодаря возможности их детектирования в камере для измерения гаммаизлучения, а также благодаря подходящим величинам периода полураспада in vivo. В соединения формулы I можно ввести метку с использованием любого из методов,широко известных в данной области техники. Например, ввести метку в эти соединения можно с помощью хелатного агента, такого как диэтилентриаминпентауксусная кислота (DTPA) или металлотионеин, которые могут быть ковалентно связаны с соединением формулы I. В основном, композиции по настоящему изобретению, содержащие технеций-99m, получают путем образования водной смеси технеция-99m, восстанавливающего агента и воднорастворимого лиганда с последующим контактированием смеси с соединением по настоящему изобретению формулы I. Например, соединения для получения изображения по настоящему изобретению получают путем взаимодействия технеция-99m (в окисленном состоянии) с соединением по настоящему изобретению, содержащим хелатную группу, в присутствии восстанавливающего агента, при этом образуется стабильный комплекс между соединением и технецием-99m в восстановленном состоянии(до валентности IV или V). Согласно одному варианту воплощения изобретения композицию по настоящему изобретению получают путем введения метки- технеция-99m, в соединение формулы I, содержащее хелатную группу DTPA. Эту операцию проводят путем смешивания предварительно определенного количества (от 5 мкг до 0,5 мг) соединения по настоящему изобретению с водным раствором, содержащим цитратный буфер и восстанавливающий агент на основе двухвалентного олова, затем добавляют свежеполученный пертехнетат натрия, содержащий предварительно определенный уровень радиоактивности (например, 15 мКи). После инкубирования при комнатной температуре реакционную смесь заливают в экранированный шприц через стерильный фильтр (0,2-0,22 мкм), затем при необходимости смесь распределяют в 0,9% раствор хлористого натрия для инъекций. 33 Согласно другому варианту воплощения изобретения композицию по настоящему изобретению получают путем введения метки технеция-99m, в соединение формулы I, содержащее хелатные группы - металлотионеин. Эту операцию проводят путем смешивания водного раствора пертехнетата-99m натрия с водным раствором глюкогептоната олова, при этом образуется растворимый комплекс технеция-99m(в восстановленном состоянии) с двумя молекулами глюкогептоната, затем этот раствор смешивают с раствором соединения формулы I,содержащим ковалентно связанный металлотионеин. После инкубирования смеси в течение определенного периода времени и в условиях,обеспечивающих перенос технеция-99m из глюкогептонатного комплекса в металлотионеинсодержащее соединение формулы I, образуется меченная технецием композиция по настоящему изобретению. Источник технеция-99m должен быть предпочтительно водно-растворимым. Предпочтительными источниками являются пертехнетаты (ТсО 4-) щелочных и щелочно-земельных металлов. Наиболее предпочтительным способом получения технеция-99m является свежий раствор пертехнетата натрия из стерильного генератора технеция-99m (например, из обычного генератора Мо-99/Тс-99m). Однако можно использовать любой другой источник физиологически приемлемого технеция-99m. Восстанавливающими агентами, используемыми в способе, являются физиологически приемлемые агенты для восстановления технеция-99m из его окисленной формы до валентности IV или V или для восстановления окисленной формы рения. В качестве восстанавливающих агентов могут быть использованы хлорид олова, фторид олова, глюкогептонат олова, тартрат олова и дитионит натрия. Предпочтительными агентами являются восстанавливающие агенты на основе двухвалентного олова, прежде всего хлорид олова или глюкогептонат олова. Количество восстанавливающего агента должно быть достаточным для восстановления технеция-99m, который в указанной восстановленной форме связывается с хелатной группой соединения формулы I. Например, хлорид олова(SnCl2) может быть использован в качестве восстанавливающего агента в диапазоне концентраций от 1 до 1000 мкг/мл. Особенно предпочтительный диапазон концентраций составляет приблизительно от 30 до 500 пиког/мл. При взаимодействии лимонной кислоты с технецием-99m с высокой скоростью образуются стабильные комплексы технеций-99m-цитрат. При контакте с соединением формулы I происходит быстрый и практически количественный перенос технеция-99m из цитратного комплекса в хелатную группу соединения формулы I в мягких условиях. Количество лимонной кислоты (в форме цитрата натрия) может находиться 34 в диапазоне от приблизительно 0,5 мг/мл до максимально растворимого в среде количества. Предпочтительный диапазон концентраций лимонной кислоты составляет от 15 до 30 мкг/мл. Количество соединения формулы I, содержащего хелатную группу, может варьировать в диапазоне от 0,001 до приблизительно 3 мг/мл,предпочтительно от приблизительно 0,017 до приблизительно 0,15 мг/мл. В конечном итоге,технеций-99m в форме пертехнетата может быть использован в количестве, которое предпочтительно составляет приблизительно от 1 до 50 мКи. Количество радиоактивности в единицах мКи на мг соединения по настоящему изобретению составляет предпочтительно от 30 до 150. Реакцию между соединением формулы I и лигандным комплексом-переносчиком ионов металла предпочтительно проводят в водном растворе при рН среды, в котором соединение формулы I является устойчивым. Термин "устойчивое" означает что соединение остается в растворенном состоянии и сохраняет свою ингибирующую активность по отношению к тромбину. В основном, рН реакционной среды составляет от приблизительно 5 до 9, предпочтительно рН составляет выше 6-8. Комплекс технеций-99m-цитрата и соединения формулы I предпочтительно инкубируют при температуре от приблизительно 20 С до приблизительно 60 С, наиболее предпочтительно от приблизительно 20 С до приблизительно 37 С, в течение достаточного периода времени для переноса иона металла из цитратного комплекса в хелатную группу соединения формулы I. В основном,для завершения реакции переноса в указанных условиях достаточно менее 1 ч. В альтернативном способе композиции по настоящему изобретению включают соединение по настоящему изобретению, меченное In-111. Настоящее изобретение также включает композиции соединений по настоящему изобретению, которые используют для получения изображения тромбов in vivo у млекопитающих,причем композиции содержат соединение формулы I в форме комплекса с парамагнитным атомом. Предпочтительными парамагнитными атомами являются двухвалентные или трехвалентные ионы элементов с атомными номерами 21-29, 42, 44 и 58-70. Подходящие ионы включают хром (III), марганец (II), железо (III), железо (II), кобальт (II), никель (II), медь (II), празеодим (III), неодим (III), самарий (III) и иттербий(III). Предпочтительными элементами, благодаря характерным для них сильным магнитным моментом, являются гадолиний (III), тербий(III), диспрозий (III), гольмий (III) и эрбий (III). Особенно предпочтительным парамагнитным атомом является гадолиний (III). Композиции по настоящему изобретению могут быть получены путем смешивания соеди 35 нения формулы I с парамагнитным атомом. Например, оксид металла или соль металла (например, нитрат, хлорид или сульфат) подходящего парамагнитного атома растворяют или суспендируют в среде, содержащей воду и спирт, такой как метиловый, этиловый или изопропиловый спирт. Эту смесь добавляют к раствору эквимолярного количества соединения формулы I в аналогичной водной среде и перемешивают. Затем реакционную смесь слабо нагревают до завершения реакции. При образовании нерастворимых композиций их выделяют фильтрованием, в то время как растворимые композиции выделяют упариванием растворителя. Если кислотные группы еще остаются в составе хелатного остатка в композиции по настоящему изобретению, то для упрощения процессов выделения и очистки гомогенной композиции в исходную композицию можно добавить неорганические или органические основания и даже аминокислоты для превращения кислого комплекса в нейтральный. В качестве нейтрализующих агентов можно использовать органические основания или основные аминокислоты, а также неорганические основания, такие как гидроксиды, карбонаты или бикарбонаты натрия, калия или лития. Настоящее изобретение включает также диагностические композиции, которые используют для получения изображения in vivo тромбов у млекопитающих, причем композиции включают фармацевтически приемлемый носитель и диагностически эффективное количество композиций на основе соединений формулы I."Диагностически эффективное количество" композиции, которое необходимо использовать в виде дозы, зависит от способа введения,рода млекопитающего, подлежащего лечению, и физических характеристик определенного изучаемого млекопитающего. Эти факторы и их взаимосвязь для определения указанной дозы хорошо известны для практикующих специалистов в данной области медицинской диагностики. Диагностически эффективное количество и способ введения могут быть также подобраны для достижения оптимальной эффективности,однако, эти факторы зависят от таких характеристик, как вес, диета, одновременное (сопутствующее) лечение и другие параметры, известные для специалистов в области медицины. В любом случае, доза для получения изображения должна быть достаточной для детектирования присутствия агента для получения изображения в месте локализации исследуемого тромба. Обычно, для получения рентгенологического изображения требуется доза, обеспечиваемая фармацевтической композицией по настоящему изобретению и равная приблизительно от 5 до 20 мКи, предпочтительно приблизительно 10 мКи. Для получения магнитно-резонансного изображения требуется доза соединения формулы I в составе комплекса с парамагнитным ато 004884 36 мом, равная приблизительно от 0,001 до 5 ммоль/кг, предпочтительно от приблизительно 0,005 до 0,5 ммоль/кг соединения формулы I в составе комплекса с парамагнитным атомом. В любом случае специалистам в данной области медицины известно, что действующая доза зависит от локализации тромба."Фармацевтически приемлемые носители" для применения in vivo хорошо известны в области фармацевтики и описаны, например, в книге Remington's Pharmaceutical Sciences (Фармацевтические науки Ремингтона), Mack Publishing Co. (ред. A.R.Gennaro, 1985). Для получения стерильных растворов или суспензий для инъекций фармацевтические композиции по настоящему изобретению могут быть получены путем смешивания с фармацевтически приемлемым носителем. Прежде всего, композиции для инъекций могут быть получены в стандартной форме в виде жидких растворов или суспензий, твердых форм, подходящих для растворения или суспендирования в жидкости перед инъекцией, или в форме эмульсий. Подходящими наполнителями являются, например, вода,соль, декстроза, маннит, лактоза, лецитин, альбумин, глутамат натрия, гидрохлорид цистеина и т.п. Кроме того, при необходимости фармацевтические композиции для инъекций могут содержать незначительные количества нетоксичных вспомогательных веществ, таких как увлажнители, буферные соли для создания требуемой величины рН и т.п. При необходимости могут быть использованы препараты для увеличения всасывания (например, липосомы). Настоящее изобретение включает также диагностические композиции для накопления или введения. Такие композиции могут, кроме того, содержать консерванты, стабилизаторы и красители. Например, в качестве консервантов могут быть добавлены бензоат натрия, сорбиновая кислота и эфиры п-гидроксибензойной кислоты. Идентификационный номер (Id.) 1449. Кроме того, могут быть использованы антиоксиданты и суспендирующие агенты. Способы получения изображения in vivo по настоящему изобретению также обладают рядом преимуществ по сравнению с известными ранее методами получения изображения, предназначенными для детектирования или контроля присутствия, размера, уменьшения или увеличения тромба. Прежде всего, в настоящем изобретении разработаны соединения, композиции и диагностические композиции, которые чрезвычайно прочно связываются с тромбином,ассоциированным с тромбом, и тем самым снижают "фон", который возникает благодаря циркуляции радиоактивности или парамагнитного излучения, связанных со свободным агентом для получения изображения. Более того, следует ожидать, что изображение in vivo путем внутрикоронарной инъекции соединений, композиций и диагностических композиций по настоящему 37 изобретению будет получено практически мгновенно, так как эти агенты для получения изображения немедленно насыщают тромбин, ассоциированный с тромбом. В связи с этим, настоящее изобретение включает также способы получения изображения in vivo тромба у млекопитающих, включающие следующие стадии: (1) введение млекопитающему диагностически приемлемого количества соединения, композиции или диагностической композиции по настоящему изобретению и (2) детектирование тромба в кровеносном сосуде. Термин "получение изображения in vivo",использованный в данном описании, означает способы детектирования тромбов у млекопитающих, способы локализации, определения размера, и числа тромбов у млекопитающих, а также способы наблюдения за процессами рассасывания или роста тромба. Согласно этому способу использования соединений, композиций или диагностических композиций in vivo, "введение" осуществляют парентерально либо системным способом, либо местно-целевым способом. Системное введение осуществляют путем инъекции соединений,композиций и диагностических композиций по настоящему изобретению в обычную и доступную вену или артерию. Способ включает (но не ограничивает область изобретения) введение в локтевую вену. Местно-целевое введение осуществляют путем инъекции соединений, композиций или диагностических композиций по настоящему изобретению в кровоток, соседний с веной или артерией, в которых предполагается наличие тромба, отдаленного от места инъекции. Этот способ включает, но не ограничивает область изобретения, прямое введение в коронарную артериальную сосудистую сеть для получения изображения коронарного тромба, в сонную артерию для получения изображения тромбов в церебральной сосудистой сети или в вену стопы для получения изображения тромбоза глубокой вены ноги. Способ доставки композиции по настоящему изобретению к месту локализации тромба можно рассматривать в пределах термина "введение". Например, соединение формулы I, содержащее присоединенные хелатные группы,может быть введено млекопитающему через некоторое время после введения радиоактивного атома, при этом в месте локализации тромба образуется in vivo комплекс соединения формулы I с радиоактивным атомом. По альтернативному способу млекопитающему вводят композицию, содержащую соединение формулы I в составе комплекса с радиоактивным атомом."Диагностически эффективное количество" соединений, композиций или диагностических композиций, использованных согласно способам по настоящему изобретению, как было упомянуто выше, зависит от способа введения, 004884 38 вида млекопитающего, подлежащего лечению, и физических характеристик определенного изучаемого млекопитающего. Эти факторы и их взаимосвязь для определения указанной дозы хорошо известны для практикующих специалистов в данной области медицинской диагностики. В любом случае, доза для получения изображения in vivo должна быть достаточной для детектирования присутствия агента для получения изображения в месте локализации исследуемого тромба. Обычно, для получения рентгенологического изображения требуется доза,обеспечиваемая диагностической композицией по настоящему изобретению и равная приблизительно от 5 до 20 мКи, предпочтительно приблизительно 10 мКи. Для получения магнитнорезонансного изображения требуется доза соединения формулы I, обеспечиваемая диагностической композицией по настоящему изобретению, и равная приблизительно от 0,001 до 5 ммоль/кг, предпочтительно от приблизительно 0,005 до 0,5 ммоль/кг соединения формулы I в составе комплекса с парамагнитным атомом. В любом случае, компетентным специалистам в данной области медицины известно, что действующая доза зависит от локализации тромба. Детектирование тромба путем получения его изображения становится возможным в присутствии радиоактивных или парамагнитных атомов, локализованных в месте образования тромба. Изображение радиоактивных атомов, связанных с композициями и диагностическими композициями по настоящему изобретению получают предпочтительно с использованием устройств для определения радиоактивности, которые созданы для определения гамма-излучения,таких как камеры для детектирования гаммаизлучения или т.п. Обычно в камерах для получения рентгенологического изображения используют конверсионную среду (в которой поглощается гамма-излучение высокой энергии,при этом происходит вытеснение электрона,испускающего фотон после возвращения в орбитальное состояние), фотоэлектрические детекторы, расположенные в камере для пространственного детектирования (для определения положения испускаемых фотонов) и электронную схему для анализа фотонов, обнаруженных в камере, и для получения изображения. Парамагнитные атомы, связанные с композициями или диагностическими композициями по настоящему изобретению, детектируют в системах для получения магнитно-резонансного изображения (MRI). В таких системах используют сильное магнитное поле, чтобы синхронизировать векторы ядерных спинов атомов в теле пациента. В присутствии парамагнитных атомов, локализованных в месте образования тромба, поле искажается, и таким образом получают изображение тела пациента в процессе возвра 39 щения ядер в состояния их равновесной синхронизации. Следующие примеры приведены для иллюстрации, без ограничения области изобретения, способа и композиций по настоящему изобретению. Для специалистов в данной области техники представляются очевидными другие подходящие модификации и изменения ряда условий и параметров, которые находятся в пределах объема изобретения. Пример 1. Трифторацетат 1-N-[2-(амидиноаминоокси)этил]аминокарбонилметил-6 метил-3-(фенетиламино)пиразинона.N-(2 гидроксиэтил)карбамата (5,9 г, 30 ммоль), Nгидроксифталимида (4,9 г, 30 ммоль) и трифенилфосфина (7,9 г, 30 ммоль) в тетрагидрофуране (100 мл) добавляют диэтиловый эфир азодикарбоновой кислоты (5,2 г, 30 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Добавляют этилацетат (200 мл), промывают насыщеннымNаНСО 3 (2 х 100 мл) и солевым раствором (100 мл), сушат над Na2SO4 и фильтруют. После упаривания фильтрата остаток очищают экспрессколоночной хроматографией (градиент: от хлористого метилена до 4% этилацетата в хлористом метилене), при этом получают требуемое соединение в виде твердого вещества белого цвета (9,3 г, 91%). 1H ЯМР (300 МГц, СDCl3)7,84(m, 2 Н), 7,78 (m, 2 Н), 7,37 (m, 5 Н), 5,97 (br s,1H), 5,14 (s, 2H), 4,27 (t, J=4,9 Гц, 2 Н), 3,51 (q,J=5,2 Гц, 2 Н). К раствору N-[2-(бензилоксикарбониламино)этокси]фталимида (1,36 г, 4,0 ммоль),полученному, как указано на предыдущей стадии, в этаноле (20 мл) и тетрагидрофуране (20 мл) добавляют 40% метиламин (2,0 мл, 25 ммоль) и перемешивают при комнатной температуре в течение 1 ч. После упаривания растворителя остаток пропускают через силикагель(градиент: от смеси этилацетат/гексан, 3:1 до этилацетата), при этом получают требуемое соединение в виде твердого вещества белого цвета К раствору 2-(бензилоксикарбониламино) этоксиамина (780 мг, 3,7 ммоль), полученному,как указано на предыдущей стадии, в N,Nдиметилформамиде (20 мл) добавляют [N,N'ди(трет-бутоксикарбонил)]амидинопиразол(1,25 г, 4,0 ммоль). Смесь перемешивают при комнатной температуре в течение ночи, и растворитель упаривают в высоком вакууме. Остаток очищают экспресс-колоночной хроматографией (0-5% этилацетата в хлористом метилене),при этом получают требуемое соединение в виде бесцветного масла (1,55 г, 93%). 1H ЯМР (300 МГц, CDCl3)9,08(s, 1 Н), 7,67(s, 1 Н), 7,33 (m,5 Н), 6,21 (br s, 1H), 5,21 (br s, 1H), 5,11 (s, 2H),4,12 (t, J=4,8 Гц, 2H), 3,54 (q, J=4,9 Гц, 2H), 1,49(730 мг, 1,5 ммоль), полученного, как указано на предыдущей стадии, 10% палладия на угле (70 мг) в этаноле (20 мл) и тетрагидрофуране (20 мл) гидрируют в атмосфере водорода (из баллона) в течение 30 мин. Катализатор удаляют фильтрованием через слой целита и фильтрат концентрируют в вакууме. Остаток очищают на колонке Waters Sep-Pak (10 г, хлористый метилен/метанол, насыщенный аммиаком, 95:5), при этом получают требуемое соединение в виде бесцветного масла (290 мг, 61%). 1H ЯМР (300 МГц, СDСl3)9,08(br s, 1H), 4,08 (t, J=5,2 Гц,2H), 2,99(q, J=5,1 Гц, 2H), 1,50 (s, 9H), 1,48 (s,9H). е. Гидрохлорид бензил-N-(1-цианоэтил) глицина. Триметилсилилцианид(ТМSCN) (4,0 мл, 30 ммоль) осторожно добавляют к перемешиваемому раствору свободного основания бензилглицина (5,0 г, 30 ммоль) и ацетальдегида (1,7 мл, 30 ммоль) в хлористом метилене (15 мл) в атмосфере аргона. Через 15 мин летучие компоненты удаляют в вакууме, а остаток растворяют в этилацетате (200 мл), промывают солевым раствором (100 мл), сушат(Na2SO4) и упаривают до маслообразного остатка. Масло повторно растворяют в эфире (30 мл) и этаноле (30 мл), и по каплям добавляют 1 М раствор HCl в эфире (33 мл), при этом получают 41 требуемое соединение в виде кристаллического осадка грязно-белого цвета. Т. пл. 137-138 С; 1(3,82 г, 15 ммоль), полученного, как указано на предыдущей стадии, в 1,2-дихлорбензоле (30 мл) при перемешивании нагревают при 100 С в течение ночи. Растворитель упаривают в вакууме и остаток очищают экспресс-колоночной хроматографией (20-30% этилацетата в гексане),при этом получают твердое вещество. Добавляют 10% этилацетат в гексане (100 мл) и твердое вещество собирают, при этом получают требуемое соединение в виде кристаллического твердого вещества оранжевого цвета (2,7 г, 55%). 1H ЯМР (300 МГц, CDCl3)7,38 (m, 5H), 5,24 (s,2 Н), 4,89 (s, 2H), 2,34 (s, 3 Н). Фенетиламин (1,5 мл, 12 ммоль) добавляют при перемешивании к раствору 1 бензилоксикарбонилметил-3,5-дихлор-6-метилпиразинона (1,31 г, 4,0 ммоль), полученного, как указано на предыдущей стадии, в этилацетате(10 мл), и полученную смесь нагревают с обратным холодильником в атмосфере азота. Через 2 ч реакционную смесь охлаждают, разбавляют хлористым метиленом (100 мл), промывают 5% раствором лимонной кислоты (2 х 50 мл), солевым раствором (50 мл), сушат (Na2SO4) и фильтруют. После упаривания фильтрата в вакууме, твердое вещество собирают и промывают 20% этилацетатом в гексане, при этом получают требуемое соединение в виде кристаллического твердого вещества (1,5 г, 91%). 1H ЯМР Смесь 3-(2-фенетиламино)-5-хлор-6-метил 1-(бензилоксикарбонилметил)пиразинона (412 мг, 1,0 ммоль), полученного, как указано на предыдущей стадии, и палладия на угле (10%,100 мг) в тетрагидрофуране (10 мл) и этаноле(баллон) в течение двух дней. Реакционную смесь фильтруют через слой целита, фильтр промывают этанолом, и фильтрат упаривают в вакууме, при этом получают смесь 3-(2 фенетиламино)-6-метил-1-карбоксиметилпиразинона и 3-(2-фенетиламино)-5-хлор-6-метил 1-карбоксиметилпиразинона в виде твердого вещества светло-красного цвета (210 мг), полученную смесь используют на следующей стадии без дополнительной очистки. К раствору смеси 3-(2-фенетиламино)-6 метил-1-карбоксиметилпиразинона и 3-(2 фенетиламино)-5-хлор-6-метил-1-карбоксиметилпиразинона (200 мг), полученного, как указано на предыдущей стадии, [N,N'-ди(третбутоксикарбонил)]2-аминоэтоксигуанидина(225 мг, 0,7 ммоль), полученного, как указано на стадии d в примере 1, диизопропилэтиламина(10 мл) добавляют реактив Кастро (ВОР) (442 мг, 1,0 ммоль). Смесь перемешивают при комнатной температуре в течение ночи, растворитель удаляют в высоком вакууме и остаток растворяют в хлористом метилене (100 мл), промывают 10% раствором лимонной кислоты(2 х 50 мл), солевым раствором (50 мл), и сушат над Na2SO4. После упаривания растворителя в вакууме остаток очищают экспресс-колоночной хроматографией (градиент: от смеси этилацетат/гексан, 2:1 до этилацетат/гексан, 3:1), при этом получают 1-N-[2-(N',N"-бис(трет-бутоксикарбонил)амидиноаминоокси)этил]аминокарбонилметил-5-хлор-6-метил-3-(фенетиламино) пиразинон в виде бесцветной пены (100 мг,23%). 1H ЯМР (300 МГц, СDCl3/СD3 ОD)8,42(m, 2H), 2,15 (s, 3H), 1,52 (s, 9H), 1,49 (s, 9H). Выделяют также 1-N-[2-(N',N"-бис(трет-бутоксикарбонил)амидиноаминоокси)этил]амино карбонилметил-6-метил-3-(фенетиламино)пиразинон в виде бесцветной пены (130 мг, 32%). 1H ЯМР (300 МГц, CDCl3/CD3OD)8,47 (t, J=4,9 Гц, 1 Н), 7,44-7,87 (m, 3H), 7,25 (m, 5H), 4,80 (s,2H), 4,11 (m, 2H), 3,65 (t, J=7,0 Гц, 2H), 3,59 (m,2H), 2,93 (t, J=7,1 Гц, 2H), 2,28 (s, 3H), 1,52 (s,9H), 1,48 (s, 9H). Смесь 1-N-[2-(N',N"-бис(трет-бутоксикарбонил)амидиноаминоокси)этил]аминокарбонилметил-6-метил-3-(фенетиламино)пиразинона (120 мг, 0,2 ммоль), полученного, как указано на предыдущей стадии, и трифторуксусной кислоты (2 мл) в хлористом метилене (4 мл) перемешивают при комнатной температуре в течение 1 ч. После упаривания растворителя в вакууме остаток очищают на колонке WatersSep-Pak (5 г, 10% метанол в хлористом метилене), при этом получают требуемое соединение в виде твердого вещества белого цвета (90 мг,89%). 1H ЯМР (300 МГц, DMSO-d6)10,95 (s,1H), 8,44 (t, J=5,6 Гц, 1 Н), 7,73 (br s, 4H), 7,207,30 (m, 6H), 6,67 (s, 1H), 4,61 (s, 2H), 3,81 (t,J=5,4 Гц, 2 Н), 3,50 (q, J=6,7 Гц, 2 Н), 3,39 (q,J=5,4 Гц, 2H), 2,86 (t, J=6,9 Гц, 2H), 2,07 (s, 3H). МС (MALDI-TOF (время пролетный МС с ионизацией лазерной десорбцией), матрица -циано 4-гидроксикоричная кислота). Рассчитано для Требуемое соединение получают из 1-N[2-(N',N"-бис(трет-бутоксикарбонил)амидиноаминоокси) этил]аминокарбонилметил-5-хлор 6-метил-3-(фенетиламино)пиразинона,полученного, как указано на стадии i в примере 1, по методике, как указано на стадии j в примере 1. 1 Требуемое соединение получают из 1 бензилоксикарбонилметил-3,5-дихлор-6-метилпиразинона, полученного, как указано на стадииf в примере 1, и 2,2-дифенилэтиламина, по методике, как указано на стадиях g-j в примере 1. 1 Требуемое соединение получают из 1 бензилоксикарбонилметил-3,5-дихлор-6-метилпиразинона, полученного, как указано на стадииf в примере 1, и 2,2-дифенилэтиламина, по методике, как указано на стадиях g-j в примере 1. 1 Требуемое соединение получают из 1 бензилоксикарбонилметил-3,5-дихлор-6 метилпиразинона, полученного, как указано на стадии f в примере 1, и 4-метилфенетиламина,по методике, как указано на стадиях g-j в примере 1. 1H ЯМР (300 МГц, DMSO-d6)10,92 (s,1H), 8,44 (t, J=5,6 Гц, 1 Н), 7,71 (br s, 4H), 7,11 (s,4H), 6,67 (s, 1H), 4,61 (s, 2H), 3,81 (t, J=5,4 Гц,2 Н), 3,50 (m, 2 Н), 3,38 (m, 2H), 2,81 (t, J=6,9 Гц,2H), 2,27 (s, 3H), 2,07 (s, 3H). MC (MALDI-TOF, 45 матрица -циано-4-гидроксикоричная кислота). Рассчитано для С 19H27N7O3: 402,2 (М+Н), 424,2 Требуемое соединение получают из 1 бензилоксикарбонилметил-3,5-дихлор-6-метилпиразинона, полученного, как указано на стадииf в примере 1, и 4-метоксифенетиламина, по методике, как указано на стадиях g-j в примере 1. 1H ЯМР (300 МГц, DMSO-d6)10,88 (s, 1H),8,42 (t, J=5,5 Гц, 1 Н), 7,68(brs, 4H), 7,15(d, J=8,6 Гц, 2H), 6,85 (d, J=8,7 Гц, 2H), 6,67 (s, 1H), 4,61(12 мл, 12 ммоль). После перемешивания в течение 2 ч при температуре окружающей среды избыток ЛАГ медленно гасят водой (10 мл) и разбавляют дополнительным количеством тетрагидрофурана (20 мл). Затем проводят реакцию с 0,25 н. водным раствором NaOH (5 мл) при температуре окружающей среды в течение 20 ч и фильтруют, фильтрат концентрируют в вакууме, а остаток очищают экспресс-колоночной хроматографией (10% метанол в дихлорметане,насыщенном аммиаком), при этом получают требуемое соединение в виде масла желтого цвета (0,52 г, 53%). 1H ЯМР (300 МГц, CDCl3)7,32 (m, 2H), 7,19 (m, 1H), 7,10 (m, 2H), 2,93 (s,2H), 2,38-2,26 (m, 2H), 2,18-2,01 (m, 3H). 1,921,82 (m, 1H), 1,14 (bs, 2H).b. 3-(1-Фенилциклобутил)метиламино-5 хлор-6-метил-1-(бензилоксикарбонилметил)пиразинон. Раствор продукта, полученного на предыдущей стадии (0,52 г, 3,21 ммоль), и 1 бензилоксикарбонилметил-3,5-дихлор-6-метилпиразинона (0,36 г. 1,08 ммоль), полученного,как указано на стадии f в примере 1, в этилаце 004884 46 тате (15 мл) кипятят с обратным холодильником в течение 3 ч и растворитель удаляют в вакууме. Остаток растворяют в дихлорметане, промывают 10% водным раствором лимонной кислотыNa2SO4 и фильтруют. Упаренный фильтрат затем очищают экспресс-колоночной хроматографией (20% этилацетата в гексане), при этом получают требуемое соединение в виде масла желтого цвета (0,35 г, 71%). 1 Н ЯМР (300 МГц,СDCl3)7,32 (m, 7H), 7,17 (m, 3H), 5,86 (t, J=5,5 Гц, 1 Н), 5,17 (s, 2H), 4,73 (s, 2H), 3,72 (d, J=5,7 Гц, 2 Н), 2,35 (m, 2H), 2,22 (m, 2H), 2,17 (s, 3H),1,89 (m, 1H). с. 3-(1-Фенилциклобутил)метиламино-6 метил-1-карбоксиметилпиразинон. Продукт, полученный на предыдущей стадии (0,33 г, 0,74 ммоль), 10% палладий(0) на угле (0,13 г) и твердый гидроксид калия (0,2 г,3,6 ммоль) растворяют в смеси метанол/вода/тетрагидрофуран, 1:1:1 (60 мл), дегазируют пропусканием газообразного азота, а затем азот откачивают в вакууме, полученный раствор перемешивают в атмосфере водорода(баллон) при температуре окружающей среды. Через 24 ч реакционную смесь фильтруют через слой целита, фильтрат упаривают, а остаток частично очищают экспресс-колоночной хроматографией (20% метанол в дихлорметане), при этом получают требуемое соединение (0,16 г,65%) в виде твердого вещества, которое затем используют без дальнейшей очистки.d. 1-N-[2-(N',N"-Биcтpeт-бyтoкcикapбoнилaмидинoaминoокси)этил]аминокарбонилметил-6-метил-3-(1-фенилциклобутил)метиламинопиразинон. Продукт, полученный на предыдущей стадии (0,16 г, 0,48 ммоль), реактив Кастро (0,24 г,0,54 ммоль) и [N,N'-ди(трет-бутоксикарбонил)]2-аминоэтоксигуанидин (0,16 г, 0,52 ммоль),полученный, как указано на стадии d в примере 1, растворяют в N,N-диметилформамиде (10 мл) и проводят реакцию с триэтиламином (0,25 мл,1,80 ммоль) при температуре окружающей среды. Через 24 ч растворитель удаляют в вакууме,остаток растворяют в дихлорметане, и раствор промывают 10% водным раствором лимонной кислоты, насыщенным NaHCO3 и солевым раствором, сушат над Nа 2SO4 и фильтруют. Упаренный фильтрат затем очищают экспрессколоночной хроматографией (33% этилацетат в дихлорметане), при этом получают требуемое соединение в виде прозрачного твердого вещества (0,11 г, 37%). 1H ЯМР (300 МГц, СDCl3)9,15 (s, 1 Н), 8,36 (t, J=5 Гц, 1 Н), 7,57 (s, 1H), 7,32 47 для С 31 Н 45N7 О 7:428,2 (M-2 Вос+Н); найдено: 428,9. е. Трифторацетат 1-N-[2-(амидиноаминоокси)этил]аминокарбонилметил-6-метил-3-(1 фенилциклобутил)метиламинопиразинона. Продукт, полученный на предыдущей стадии (0,10 г, 0,17 ммоль), растворяют в дихлорметане (5 мл) и проводят реакцию с трифторуксусной кислотой (2 мл) при температуре окружающей среды. Через 6 ч летучие компоненты удаляют в вакууме и остаток очищают на колонке силикагеля Waters silica Sep-Pak (градиент, используемый для элюции, 10-20% метанола в дихлорметане), при этом получают требуемое соединение в виде гигроскопичного твердого вещества светло-желтого цвета (0,10 г,100%). 1H ЯМР (300 МГц, СDCl3/СD3OD)7,33 а. 2-(1-Нафталинэтил)фталимид. Проводят реакцию путем взаимодействия раствора 1-нафталинэтанола (2,51 г, 14,6 ммоль), трифенилфосфина (4,57 г, 17,4 ммоль) и фталимида (2,37 г, 16,1 ммоль) в тетрагидрофуране (120 мл) с диэтилазодикарбоксилатом (2,80 мл, 17,8 ммоль) при температуре окружающей среды в течение 2 ч. Упаренный продукт промывают диэтиловым эфиром и сушат в вакуумном эксикаторе в течение ночи, при этом получают требуемое соединение (4,34 г, 99%) в виде твердого вещества цвета слоновой кости. 1H ЯМР (300 МГц, CDCl3)8,31 (d, J=8,5 Гц, 1 Н),7,86 (m, 3H), 7,74 (m, 3H), 7,60 (add, J=8,4 Гц,6,9 Гц, 1,5 Гц, 1 Н), 7,50 (ddd, J=8,0 Гц, 6,9 Гц,1,2 Гц, 1 Н), 7,41 (m, 2 Н), 4,04 (m, 2 Н), 3,44 (m,2H).b. 2-(1-Нафталин )этиламин. Продукт, полученный на предыдущей стадии (4,30 г, 14,3 ммоль), растворяют в метаноле(30 мл) и проводят реакцию с 40% водным метиламином (20 мл) при 70 С в течение 20 ч. Реакционную смесь концентрируют в вакууме,остаток растворяют в дихлорметане, и полученный раствор экстрагируют 10% водным раствором HCl и водой. Водный слой подщелачивают при помощи твердого КОН и полученный раствор экстрагируют дихлорметаном. Полученный органический слой промывают солевым раствором, сушат над Nа 2SO4, фильтруют и фильтрат 48 упаривают, при этом получают требуемое соединение в виде масла коричневого цвета (0,83 г, 34%). 1H ЯМР (300 МГц, CDCl3)8,06 (m,1 Н), 7,87 (m, 1H), 7,74 (d, J=8,0 Гц, 1H), 7,50 (m,2H), 7,37 (m, 2H), 3,23 (t, J=6,6 Гц, 2H), 3,11 (t,J=6,6 Гц, 2H). с. 3-[2-(1-Нафталин)этил]амино-5-хлор-6 метил-1-(бензилоксикарбонилметил)пиразинон. Раствор продукта, полученного на предыдущей стадии (0,82 г, 4,76 ммоль), триэтиламина (2,0 мл, 14 ммоль) и 1-бензилоксикарбонилметил-3,5-дихлор-6-метилпиразинона(1,05 г, 3,21 ммоль), полученного, как указано на стадии f в примере 1, в этилацетате (80 мл) кипятят с обратным холодильником в течение 20 ч. После упаривания остаток растворяют в дихлорметане и раствор промывают 10% водным раствором лимонной кислоты, насыщенным NaHCO3 и солевым раствором, сушат надNa2SO4 и фильтруют. Затем фильтрат упаривают в вакууме, при этом получают требуемое соединение в виде твердого вещества желтокоричневого цвета (1,49 г, 68%). 1H ЯМР (300 МГц, CDCl3)8,33 (d, J=8,6 Гц, 1 Н), 7,86 (dd,J=8 Гц, 1 Гц, 1 Н), 7,75 (d, J=7,8 Гц, 1 Н), 7,58d. 3-[2-(1-Нафталин)этил]амино-6-метил-1 карбоксиметилпиразинон. Смесь продукта, полученного на предыдущей стадии (1,48 г, 3,20 ммоль), 10% палладия(0) на угле (500 мг), твердого КОН (2,05 г,36,5 ммоль) в смеси тетрагидрофуран/метанол/ вода, 2:1:1 дегазируют пропусканием газообразного азота, затем азот откачивают в вакууме, а полученный раствор интенсивно перемешивают в атмосфере водорода (из баллон) при температуре окружающей среды. Через 16 ч реакционную смесь фильтруют через слой целита,фильтр промывают смесью метанол/вода и фильтрат упаривают. Остаток обрабатывают 10% водным раствором HCl, охлаждают и фильтруют, осадок промывают водой и эфиром,сушат в вакууме в течение ночи, при этом получают требуемое соединение (0,84 г, 78%) в виде твердого вещества золотистого цвета, по данным ЯМР и ТСХ полученный продукт является неразделимой смесью 5-хлор- и 5-гидропроизводных. 1H ЯМР (400 МГц, CDCl3)8,54 49 Продукт, полученный на предыдущей стадии (0,84 г, 2,49 ммоль), реактив Кастро (1,15 г,2,60 ммоль) и [N,N'-ди(трет-бутоксикарбонил)]2-аминоэтоксигуанидин (0,91 г, 2,55 ммоль),полученный, как указано на стадии d в примере 1, растворяют в N,N-диметилформамиде (50 мл) и обрабатывают триэтиламином (1,0 мл, 7,2 ммоль) при температуре окружающей среды. После перемешивания в течение ночи реакционную смесь упаривают в вакууме и остаток очищают экспресс-колоночной хроматографией(этилацетат), при этом получают требуемое соединение (0,79 г, 50%) в виде твердого вещества. 1H ЯМР (400 МГц, CDCl3)9,17 (s, 1H), 8,41f. Гидрохлорид 1-N-[2-(амидиноаминоокси)этил]аминокарбонилметил-6-метил-3-[2-(1 нафталин)этил]аминопиразинона. Продукт, полученный на предыдущей стадии (0,79 г, 1,25 ммоль), растворяют в дихлорметане (10 мл) и проводят реакцию с трифторуксусной кислотой (5 мл) при температуре окружающей среды в течение ночи. Реакционную смесь концентрируют в вакууме, остаток очищают экспресс-колоночной хроматографией(15% метанол в дихлорметане, насыщенный аммиаком) и упаренные фракции, элюированные с колонки, обрабатывают 4 н. НСl в этаноле, концентрируют в высоком вакууме и при этом получают требуемое соединение (0,43 г,73%) в виде твердого вещества бледно-желтого цвета. 1H ЯМР (400 МГц, DMSO-d6)11,1 (s,1H), 8,71 (t, J=5,3 Гц, 1 Н), 8,26 (d, J=8,2 Гц, 1H),7,94 (d, J=8,1 Гц, 1H), 7,83 (d, J=8,2 Гц, 1 Н), 7,78 Требуемое соединение получают в виде твердого вещества бледно-желтого цвета из 1 фенилциклопропанкарбонитрила, аналогичным методом, как указано в примере 7, но при этом в процессе каталитического гидрирования происходит раскрытие циклопропанового кольца. 1H ЯМР (300 МГц, CDCl3/CD3OD)7,24-7,07 (m,5H), 6,47 (s, 1H), 3,81 (t, J=4,7 Гц, 2 Н), 3,62 (dd,J=13,5 Гц, 6,3 Гц, 1H), 3,42 (dd, J=13,6 Гц, 9,0 Гц, 1H), 3,35 (t, J=4,6 Гц, 2H), 2,73 (m, 1H), 2,02 Требуемое соединение получают в виде масла бледно-желтого цвета из гидрохлорида 3,4-метилендиоксифенетиламина, аналогичным методом, как указано в примере 1. 1 Н ЯМР (300 МГц, CDCl3/CD3OD)6,70 (m, 3H), 6,63 (s, 1 Н),5,91 (s, 2 Н), 4,67 (s, 2H), 3,95 (t, J=4,8 Гц, 2 Н),3,61 (t, J=7,3 Гц, 2 Н), 3,49 (t, J=4,7 Гц, 2H), 2,86 Требуемое соединение получают в виде масла оранжевого цвета из 2-(2 аминоэтил)пиридина аналогичным методом, как указано в примере 1. 1 Н ЯМР (300 МГц,CDCl3/CD3OD)8,46 (d, J=4,2 Гц, 1 Н), 7,74 (t,J=7 Гц, 1 Н), 7,34 (d, J=7,7 Гц, 1 Н), 7,25 (dd, J=7,1 Гц, 4,9 Гц, 1 Н), 6,71 (s, 1 Н), 3,99 (t, J=4,5 Гц,2 Н), 3,72 (t, J=6,7 Гц, 2 Н), 3,54 (m, 2H), 3,11 (t,J=6,7 Гц, 2 Н), 2,18 (s, 3H). МС (MALDI-TOF,матрица гентизиновая кислота). Рассчитано для С 17H24N8O3: 389,2 (М+Н), 411,2 (M+Na); найдено: 389,8, 411,6. Пример 12. Трифторацетат 1-N-[2-(амидиноаминоокси)этил]амино-карбонилметил-6 метил-3-(2-[2-метилфенил]этиламино)пиразинона. Требуемое соединение получают в виде твердого вещества бледно-оранжевого цвета из 2-метилбензилцианида аналогичным методом,как указано в примере 7. 1H ЯМР (300 МГц,DMSO-d6)11,13 (s, 1H), 8,48 (t, J=5,5 Гц, 1H),7,83 (bs, 4 Н), 7,12 (m, 4H), 6,68 (d, J=1,0 Гц, 1H),4,63 (s, 2H), 3,82 (t, J=5,4 Гц, 2H), 3,47 (m, 2H),3,39 (q, J=5 Гц, 2H), 2,85 (m, 2H), 2,31 (s, 3H),2,08 (s, 3H). MC (LCMS, ESI pos.). Рассчитано для C19H27N7O3: 402,2 (М+Н); найдено: 402,2. Требуемое соединение получают в виде твердого вещества бледно-желтого цвета из 3 метилбензилцианида аналогичным методом, как указано в примере 7. 1H ЯМР (400 МГц, DMSOd6)11,16 (s, 1H), 8,74 (t, J=5,5 Гц, 1H), 7,80 (bs,4H), 7,19 (t, J=7,5 Гц, 1H), 7,16 (s, 1H), 7,12 (d,J=7,5 Гц, 1H), 7,03 (d, J=7,4 Гц, 1H), 6,70 (s, 1H),4,67 (s, 2H), 3,82 (t, J=5,2 Гц, 2H), 3,69 (m, 2H),3,39 (q, J=5,3 Гц, 2H), 2,89 (t, J=7,6 Гц, 2H), 2,28 Требуемое соединение получают в виде твердого вещества бледно-желтого цвета из 2(трифторметил)фенетилового спирта аналогичным методом, как указано в примере 8. 1H ЯМР Требуемое соединение получают в виде твердого вещества белого цвета из 3(трифторметил)фенетилового спирта аналогичным методом, как указано в примере 8. 1 Н ЯМР Требуемое соединение получают в виде твердого вещества желто-коричневого цвета из 4-(трифторметил)фенилацетонитрила аналогичным методом, как указано в примере 7. 1H ЯМР Требуемое соединение получают в виде твердого вещества бледно-желтого цвета из 3,5 диметилфенилацетонитрила аналогичным методом, как указано в примере 7. 1 Н ЯМР (400 МГц, DMSO-d6)10,88 (s, 1H), 8,44 (t, J=5,7 Гц,1H), 7,68 (bs, 4 Н), 6,84 (s, 3H), 6,68 (s, 1H), 4,61 Требуемое соединение получают в виде твердого вещества белого цвета из гидрохлорида 2-аминоиндана аналогичным методом, как указано в примере 1. 1H ЯМР(400 МГц, DMSOd6)10,95 (s, 1H), 8,54 (m, 1H), 7,69 (bs, 4 Н),7,17 (m, 4 Н), 6,71 (s, 1H), 4,64 (s, 2H), 3,81 (t,J=5,3 Гц, 2 Н), 3,27 (dd, J=16 Гц, 7,6 Гц, 2H), 3,05 Требуемое соединение получают в виде твердого вещества белого цвета из 3,4 дифторфенилацетонитрила аналогичным мето 53 дом, как указано в примере 7. 1H ЯМР (400 МГц, DMSO-d6)11,05(s, 1H), 8,63 (t, J=5,5 Гц,1H), 7,74 (bs, 4H), 7,46 (t, J=10 Гц, 1H), 7,36 (dt,J=10,9 Гц, 8,5 Гц, 1H), 7,15 (m, 1H), 6,70 (s, 1H),4,66 (s, 2H), 3,82 (t, J=5,4 Гц, 2H), 3,66 (m, 2H),3,38 (m, 2H), 2,91 (t, J=7,4 Гц, 2H), 2,13 (s, 3H). Требуемое соединение получают в виде твердого вещества бледно-желтого цвета из 5 инданилацетонитрила (см. патент США No 3452085, F. Lauria и W. Logemann) аналогичным методом, как указано в примере 7. 1H ЯМР (400 МГц, DMSO-d6)11,13 (s, 1 Н), 8,71 (t, J=5,5 Гц,1 Н), 7,78 (bs, 4H), 7,19 (s, 1 Н), 7,14 (d, J=7,7 Гц,1H), 7,07 (m, 1 Н), 6,70 (s, 1 Н), 4,67 (s, 2H), 3,82 Требуемое соединение получают из 1 бензилоксикарбонилметил-3,5-дихлор-6-метилпиразинона, полученного, как указано на стадииf в примере 1 и 2-фторфенетиламина, по методике, как указано на стадиях g-j в примере 1. 1H ЯМР (300 МГц, DMSO-d6)10,91 (s, 1H), 8,43 Требуемое соединение получают из 1 бензилоксикарбонилметил-3,5-дихлор-6 метилпиразинона, полученного, как указано на стадии f в примере 1 и 3,4-диметоксифене 004884 54 тиламина, по методике, как указано на стадиях Требуемое соединение получают из 1 бензилоксикарбонилметил-3,5-дихлор-6-метилпиразинона, полученного, как указано на стадииf в примере 1 и 4-фторфенетиламина, по методике, как указано на стадиях g-j в примере 1. 1H ЯМР (300 МГц, DMSO-d6)10,97 (s, 1H), 8,45 Требуемое соединение получают из 1 бензилоксикарбонилметил-3,5-дихлор-6-метилпиразинона, полученного, как указано на стадииf в примере 1, и 4-этилфенетиламина, по методике, как указано на стадиях b-е в примере 7. 1 Н ЯМР (300 МГц, DMSO-d6)10,97 (s, 1H), 8,44 Требуемое соединение получают из 1 бензилоксикарбонилметил-3,5-дихлор-6-метилпиразинона, полученного, как указано на стадииf в примере 1, и 2-фенилпропиламина, по мето 55 дике, как указано на стадиях b-е в примере 7. 1H ЯМР (300 МГц, DMSO-d6)10,98 (s, 1H), 8,43 Требуемое соединение получают из 3,4 диметилбензилцианида по методике, как указано на стадиях а-е в примере 7. 1H ЯМР (300 МГц, DMSO-d6)11,10 (s, 1 Н), 8,47 (t, J=5,5 Гц,1 Н), 7,81 (br s, 4H), 7,55 (m, 1H), 7,03 (t, J=7,9 Гц, 2H), 6,94 (d, J=7,8 Гц, 1H), 6,68 (s, 1H), 4,62 Требуемое соединение получают из 2 нафталинэтанола, по методике, как указано на стадиях a-f в примере 8. 1 Н ЯМР (400 МГц,DMSO-d6)10,90 (s, 1H), 8,43 (t, J=5,5 Гц, 1 Н),7,87 (m, 3H), 7,85 (s, 1H), 7,69 (br s, 4H), 7,47 (m,3H), 6,69 (s, 1H), 4,61 (s, 2 Н), 3,80 (t, J=5,4 Гц,2 Н), 3,61 (m, 4H), 3,04 (t, J=7,2 Гц, 2 Н), 2,07 (s,3H). MC (LCMS, ESI). Рассчитано для С 22H27N7O3:438,2 (М+Н); найдено: 438,2. Пример 28. Трифторацетат 1-N-[2(aмидинoaминooкcи)этил]aминo-карбонилметил-6-метил-3-(2,2-дифенилпропиламино)пиразинона. Требуемое соединение получают из 1 бензилоксикарбонилметил-3,5-дихлор-6-метилпиразинона, полученного, как указано на стадииf в примере 1, и гидрохлорида 2,2-дифенилпропиламина, по методике, как указано на ста 004884 Требуемое соединение получают из 1 бензилоксикарбонилметил-3,5-дихлор-6-метилпиразинона, полученного, как указано на стадииf в примере 1, и триптамина, по методике, как указано на стадиях g-j в примере 1. 1H ЯМР (400 МГц, DMSO-d6)10,98 (s, 1H), 8,44 (t, J=5,6 Гц,1H), 7,74 (br s, 4H), 7,00-7,60 (m, 6H), 6,69 (s,1H), 4,62 (s, 2H), 3,81 (t, J=5,3 Гц, 2H), 3,39 (m,4H), 2,97 (t, J=7,4 Гц, 2H), 2,08 (s, 3H). МС Требуемое соединение получают в виде твердого вещества белого цвета из 1-(4 метилнафталин)ацетонитрила по аналогичной методике, как указано в примере 7. 1H ЯМР (400 МГц, DMSO-d6)10,94 (s, 1H), 8,45 (t, J=5,6 Гц,1 Н), 8,33 (d, J=7,2 Гц, 1H), 8,04 (d, J=7,1 Гц, 1H),7,72 (br s, 4H), 7,58 (m, 2H), 7,28 (s, 2H), 6,73 (s,1H), 4,63 (s, 2H), 3,82 (t, J=5,4 Гц, 2H), 3,57 (m,2H), 3,40 (t, J=6,4 Гц, 2H), 3,29 (t, J=7,3 Гц, 2H),2,62 (s, 3H), 2,09 (s, 3H). MC (MALDI-TOF, матрица -циано-4-гидроксикоричная кислота). Рассчитано для С 23 Н 29N7O3: 452,2 (М+Н), 474,2 Требуемое соединение получают в виде твердого вещества белого цвета из 2,4 дифторфенилэтанола по аналогичной методике,как указано в примере 8. 1H ЯМР(400 МГц,DMSO-d6)11,03 (s, 1H), 8,46 (t, J=5,6 Гц, 1 Н),7,77 (br s, 4H), 7,34 (q, J=7,8 Гц, 1H), 7,18 (t,J=9,5 Гц, 1H), 7,03 (t, J=8,0 Гц, 1H), 6,67 (s, 1H),4,62 (s, 2H), 3,81 (t, J=5,4 Гц, 2 Н), 3,51 (m, 2 Н), 57 3,39 (t, J=5,5 Гц, 2 Н), 2,89 (t, J=7,1 Гц, 2H), 2,08(10 мл) добавляют 2 мл 4 н. HCl в этаноле, растворяют в смеси метанол/дихлорметан, и снова фильтруют. Затем фильтрат концентрируют в вакууме, при этом получают требуемое соединение в виде твердого вещества желтого цвета Требуемое соединение получают из 1 бензилоксикарбонилметил-3,5-дихлор-6-метилпиразинона, полученного, как указано на стадииf в примере 1, и 2,2-дифтор-2-фенилэтиламина,по методике, как указано на стадиях g-j в примере 1. 1 Н ЯМР (400 МГц, DMSO-d6)10,89 (s,1H), 8,46 (t, J=5,5 Гц, 1 Н), 7,69 (br s, 4H), 7,53(1,5 мл, 21 ммоль) и триэтиламина (3,0 мл, 22 ммоль) в дихлорметане (10 мл) охлаждают до 0 С и медленно обрабатывают комплексом триоксид серы-пиридин (4,0 г, 25 ммоль). После перемешивания в течение 2 ч реакционную смесь промывают 10% водной лимонной кислотой, водой и солевым раствором, сушат надNа 2SO4 и фильтруют. Затем упаренный фильтрат хроматографируют на силикагеле с использованием в качестве элюента смеси этилацетат/гексан 2:1, при этом получают требуемое соединение в виде масла светло-желтого цвета(0,16 г, 16%), которое содержит примеси, но его используют без дальнейшей очистки.b. Нитрат 2-(амидиногидразонил)этил-(Nтрет-бутоксикарбонил)амина. Продукт, полученный на предыдущей стадии (0,16 г, 1,00 ммоль) растворяют в этаноле(10 мл) и обрабатывают нитратом аминогуанидина (0,16 г, 1,17 ммоль) при температуре окружающей среды в течение 3 сут. Реакционную смесь концентрируют в вакууме и неочищенный продукт хроматографируют на силикагеле с использованием в качестве элюента смеси дихлорметан/метанол 3:1, при этом получают требуемое соединение в виде твердого вещества белого цвета (0,16 г, 56%). 1 Н-ЯМР (400 МГц,DMSO-d6):1,25 (bs, 1 Н), 7,53 (bs, 4H), 7,44 (t,1 Н, J=4,0 Гц), 7,25 (t, 1H, J=4,7 Гц), 3,81 (t, 2H,J=4,6 Гц), 1,40 (s, 9H). с. Бис(трифторацетат) 2-(амидиногидразонил)этиламина. Продукт, полученный на предыдущей стадии (0,155 г, 0,557 ммоль), обрабатывают смесью дихлорметана (10 мл) и трифторуксусной кислоты (3 мл), перемешивают при температуре окружающей среды в течение 5 сут. Затем реакционную смесь концентрируют в вакууме, при этом получают требуемое соединение в виде геля желтого цвета (0,223 г, 100%), которое используют без дальнейшей очистки.
МПК / Метки
МПК: G01N 33/68, A61P 7/02, A61K 38/05, C07K 5/078
Метки: лечения, способ, свертывания, поверхности, снижения, фармацевтическая, связанного, сериновой, лекарственная, варианты, различными, композиция, пиразинона, протеолиза, форма, способности, заболеваниями, тромбообразующей, крови, протеазы, нарушенного, млекопитающего, ингибирования, соединения, тромбоза
Код ссылки
<a href="https://eas.patents.su/30-4884-soedineniya-pirazinona-farmacevticheskaya-kompoziciya-varianty-i-lekarstvennaya-forma-sposob-ingibirovaniya-serinovojj-proteazy-sposob-snizheniya-tromboobrazuyushhejj-sposobnosti-p.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения пиразинона, фармацевтическая композиция (варианты) и лекарственная форма, способ ингибирования сериновой протеазы, способ снижения тромбообразующей способности поверхности, способ лечения нарушенного протеолиза и тромбоза, связанного с различными заболеваниями, способ снижения свертывания крови у млекопитающего</a>
Предыдущий патент: Производные алкинилсодержащих гидроксамовых кислот и их применение в качестве ингибиторов tace
Следующий патент: Никотинамидные бензоконденсированные гетероциклические производные, полезные в качестве селективных ингибиторов pde4-изозимов
Случайный патент: Изготовление дорожных знаков