Варианты нейротрофического фактора глиальных клеток (gdnf) человека
Номер патента: 25129
Опубликовано: 30.11.2016
Авторы: Смит Розамунд Карол, О`брайан Линда Маурин, Мерчант Калпана Махеш, Гханем Махмуд, Лу Джиронг, Леунг Донмиенн Доен Мун
Формула / Реферат
1. Вариант GDNF (нейротрофического фактора глиальных клеток) человека, содержащий последовательность аминокислот SEQ ID NO: 23
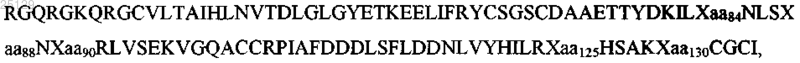
где
i) Xaa84 представляет собой K или А;
ii) Xaa88 представляет собой R или K;
iii) Xaa90 представляет собой R или K;
iv) Xaa125 представляет собой K или E;
v) Xaa130 представляет собой R или E.
2. Вариант GDNF человека по п.1, отличающийся тем, что указанный вариант выбран из группы, состоящей из

3. Вариант GDNF человека по п.2, отличающийся тем, что указанный вариант представляет собой
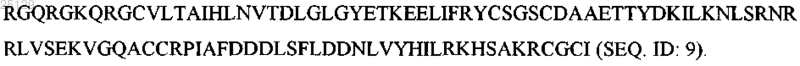
4. Вариант GDNF человека по п.2, отличающийся тем, что указанный вариант представляет собой

5. Вариант GDNF человека по п.2, отличающийся тем, что указанный вариант представляет собой
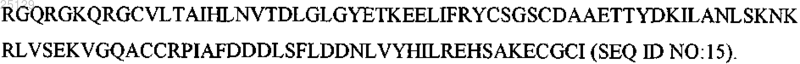
6. Промежуточное соединение, используемое в получении δ31-N-укороченного варианта GDNF, содержащее последовательность аминокислот, выбранную из группы, состоящей из
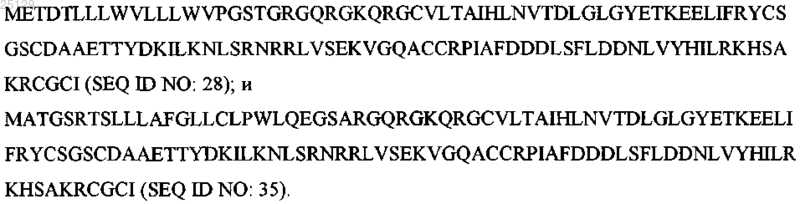
7. Промежуточное соединение по п.6, отличающееся тем, что последовательность аминокислот представляет собой
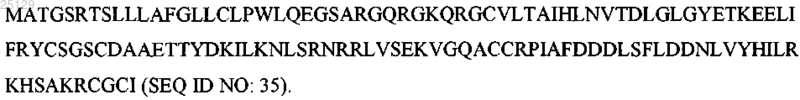
8. Фармацевтическая композиция, содержащая вариант GDNF человека по любому из пп.1-5 и один или более фармацевтически приемлемых разбавителей, носителей или вспомогательных веществ.
9. Способ лечения болезни Паркинсона, включающий введение эффективного количества композиции по п.8 нуждающемуся в этом пациенту - человеку.
10. Вариант GDNF человека по любому из пп.1-5 для применения в качестве лекарственного средства.
11. Вариант GDNF человека по любому из пп.1-5 для применения для лечения болезни Паркинсона.
12. Способ лечения болезни Паркинсона у млекопитающего, включающий этап введения млекопитающему варианта GDNF человека по любому из пп.1-5.
13. Вариант GDNF человека по любому из пп.1-5 для применения в качестве терапевтического средства.
14. Способ лечения болезни Паркинсона, включающий введение нуждающемуся в этом млекопитающему эффективного количества варианта GDNF человека согласно любому из пп.1-5.
Текст
ВАРИАНТЫ НЕЙРОТРОФИЧЕСКОГО ФАКТОРА ГЛИАЛЬНЫХ КЛЕТОК (GDNF) ЧЕЛОВЕКА Настоящее изобретение относится к новым вариантам нейротрофического фактора глиальных клеток (GDNF) человека и способам их применения. Леунг Донмиенн Доен Мун, Лу Джиронг, Мерчант Калпана Махеш,Гханем Махмуд, ОБрайан Линда Маурин, Смит Розамунд Карол (US) Лыу Т.Н. (RU)(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Настоящее изобретение относится к области медицины, в частности к области терапевтических белков. В частности, настоящее изобретение относится к новым вариантам нейротрофического фактора глиальных клеток (GDNF) человека. Новые варианты GDNF могут быть полезны для лечения болезни Паркинсона.GDNF представляет собой хорошо известный нейротрофический фактор, который, как сообщалось,обеспечивает алиментарную поддержку дофаминергических нейронов in vitro и in vivo. Кроме того, сообщалось, что GDNF обеспечивает функциональные улучшения и обладает нейропротективным действием в моделях болезни Паркинсона у грызунов и приматов. Белок GDNF дикого типа из E. coli вводили в центральную нервную систему пациентов, страдающих болезнью Паркинсона, что приводило к противоречивым результатам. В двух небольших открытых исследованиях обнаружили, что GDNF дикого типа вызывает длительное улучшение двигательной функции. Тем не менее, в фазе IIa рандомизированного плацебо-контролируемого исследования с участием 34 пациентов выявили, что при доставке GDNF в скорлупу чечевицеобразного ядра в течение 6 месяцев не наблюдалось улучшений. Повышение сигнала биомаркера было выраженным только в близлежащей ткани, окружающей место введения. В одном недавнем источнике сообщалось, что GDNF может представлять собой перспективную молекулу для спасения умирающих нервов; тем не менее, доставка данной молекулы в соответствующую область мозга остается очень сложной. Nature, т. 466:19 августа 2010. Укороченные белки GDNF описаны в WO 97/11964 (PCT/US 96/14915); тем не менее, сохраняется потребность в новых вариантах GDNF, обладающих желательными фармакологическими свойствами,стабильностью и биораспределением. Существует потребность в вариантной форме GDNF, которая будет стабильна внутри средства доставки и будет способствовать желательному биораспределению в головном мозге, при этом демонстрируя желаемую эффективность и приемлемые иммуногенные свойства. Варианты GDNF, обладающие одним или более из перечисленных желательных свойств, могут представлять собой новые фармацевтически пригодные лекарственные средства, в частности, для применения для лечения болезни Паркинсона. Согласно настоящему изобретению предложен новый укороченный вариант GDNF зрелого доменаGDNF человека, в котором нет первых 31 аминокислот на N-конце ("31-N-укороченный GDNF"), в который введены некоторые замены аминокислот для получения стабильных, достаточно эффективных вариантов GDNF, обладающих желательными свойствами биораспределения и фармацевтически приемлемым профилем иммуногенности. Согласно настоящему изобретению предложены некоторые вариантыGDNF человека, которые дают одно или более преимуществ по сравнению со зрелым GDNF дикого типа человека, включая варианты, которые обладают улучшенной фармацевтической стабильностью, а также улучшенным биораспределением, сниженной способностью к связыванию с гепарином, сниженным дезаминированием, сниженной тенденцией к образованию сукцинимида и сниженным иммуногенным потенциалом по сравнению с GDNF дикого типа человека. Некоторые новые варианты GDNF могут представлять собой полезный новый вариант лечения пациентов с болезнью Паркинсона. Согласно настоящему изобретению предложен вариант GDNF человека, содержащий SEQ ID NO: 23v) Хаа 130 представляет собой R или E. Согласно настоящему изобретению дополнительно предложен вариант GDNF человека, отличающийся тем, что указанный вариант выбран из группы, состоящей из В некотором аспекте согласно настоящему изобретению предложен вариант GDNP человека, со-1 025129 Согласно настоящему изобретению дополнительно предложен интермедиат, полезный для получения 31-N-укороченного варианта зрелого GDNF человека. Указанный интермедиат включает последовательность аминокислот, представленную в SEQ ID NO: 23 к N-концу которой присоединен секреторный сигнальный пептид. В настоящем изобретении можно применять множество последовательностей секреторных сигнальных пептидов. Примеры последовательностей секреторных сигнальных пептидов включают секреторный сигнальный лидерный пептид каппа мыши, имеющий последовательность METDTLLLWVLLLWVPGSTG (SEQ ID NO: 25), и секреторный сигнальный пептид гормона роста человека, имеющий последовательность MATGSRTSLLLAFGLLCLPWLQEGSA (SEQ ID NO: 32). Интермедиаты, содержащие указанные секреторные сигнальные пептиды, позволяют получить заявленные варианты GDNF человека с более высоким выходом, чем конструкции укороченного GDNF,содержащие другие лидерные последовательности. Описанные интермедиаты, включающие секреторный сигнальный пептид, таким образом, могут иметь следующие последовательности аминокислот: Согласно настоящему изобретению предложена фармацевтическая композиция, содержащая вариант GDNF человека согласно настоящему изобретению и один или более фармацевтически приемлемых разбавителей, носителей или вспомогательных веществ. Согласно настоящему изобретению предложен вариант GDNF человека для применения в качестве лекарственного средства. Согласно настоящему изобретению дополнительно предложен вариант GDNF человека для применения для лечения болезни Паркинсона. Согласно настоящему изобретению предложен вариант GDNF для применения в качестве терапевтического средства. Вариант, в котором Xaa84 представляет собой A, Xaa88 представляет собой K и Xaa90 представляет собой K, является предпочтительным. Вариант, в котором Xaa84 представляет собой K, Xaa88 представляет собой R и Xaa90 представляет собой R, является предпочтительным. Вариант, в котором Xaa125 представляет собой K и Xaa130 представляет собой R, является предпочтительным. Вариант, в котором Xaa84 представляет собой A, Xaa88 представляет собой K и Xaa90 представляет собой K, Xaa125 представляет собой E и Xaa130 представляет собой E, является предпочтительным. Подробное описание изобретения Сообщалось, что GDNF дикого типа связывается с гепарином и внеклеточным матриксом, вероятно, посредством положительных зарядов, расположенных в N-концевых аминокислотных остатках 1-31,тем самым ограничивая распределение GDNF при доставке в головной мозг (Lin и др., J. Neurochem 63,758-768, 1994; Rickard и др., Glycobiology 13, 419-426, 2003; Piltonen и др., Experimental Neurology 219,499-506, 2009). Также сообщалось, что GDNF обеспечивает функциональные улучшения и обладает нейропротективным действием в моделях болезни Паркинсона у грызунов и приматов (Тотас и др., 1995;Gash и др., 1996). Белок GDNF дикого типа из E. coli вводили в центральную нервную систему пациентов, страдающих от болезни Паркинсона, что приводило к противоречивым результатам. В двух небольших открытых исследованиях обнаружили, что GDNF дикого типа вызывает длительное улучшение двигательной функции (Gill и др., 2003, Slevin и др., 2005). Кроме того, наблюдалось явное повышенное разрастание дофаминергических нейронов у одного пациента, который умер от независимой причины - инфаркта миокарда (Love и др., 2005). Тем не менее, в фазе IIa рандомизированного плацебоконтролируемого исследования с участием 34 пациентов, осуществленного Amgen, доставка GDNF(Лиатермина) в скорлупу чечевицеобразного ядра в течение 6 месяцев не приводила к улучшению (Lang и др., 2006). Предложенные варианты GDNF проявляют улучшенные свойства по сравнению с ранее исследованным белком GDNF дикого типа из E. coli. Последовательность полноразмерной конструкции GDNF дикого типа (211 AK), включающая сигнальный пептид (первые 19 аминокислот, SEQ ID NO: 4), продомен (курсивный шрифт, SEQ ID NO: 5) и зрелый пептид (подчеркнут, SEQ ID NO: 3), указана в SEQ ID NO: 1 Последовательность полноразмерной ДНК GDNF дикого типа указана в SEQ ID NO: 2 Положения аминокислот вариантов согласно настоящему изобретению определяют по полипептиду зрелого GDNF дикого типа человека, состоящему из 134 аминокислот (SEQ ID NO: 3). Мутации обозначены путем указания исходной аминокислоты, затем порядкового номера данной аминокислоты, а затем заменяющей аминокислоты. Численное обозначение каждого варианта приведено на основании зрелой последовательности дикого типа ("зрелый GDNF ДТ") до укорачивания. Например, замену Lys (K) в положении 84 (т.е. K84) на Ala (A) обозначают K84 А. Аналогично, несколько замен Lys (K) в положении 84 на Ala (A), Arg (R) в положении 88 на Lys (K), Arg (R) в положении 90 на Lys (K) и Asp (D) в положении 95 на Glu (E) обозначают K84A/R88K/R90K/D95E. В данной заявке аббревиатура "KAKKE" относится к K84A-R88K-R90K-D95E. В данной заявке "полноразмерный GDNF" относится к последовательности целого белка, включающей сигнальный пептид, продомен и зрелый домен. В данной заявке "зрелый GDNF" или "полноразмерный зрелый GDNF" относится к целому зрелому домену GDNF (от которого отщеплены сигнальный пептид и продомен). В данной заявке "31-N-укороченный GDNF" относится к зрелому домену GDNF, в котором нет первых 31 аминокислот на N-конце. В данной заявке термины "31-N-укороченный GDNF" и "вариантGDNF человека" (или "GDNFv") используют взаимозаменяемо. При трансфекции полноразмерными конструкциями GDNF клеток HEK293 получают преимущественно полноразмерный зрелый GDNF в течение 5 дней. При трансфекции полноразмерными конструкциями GDNF клеток CHO в течение более длительного периода времени и при получении стабильной линии клеток укороченные формы GDNF представляют собой преобладающие формы (Lin и др., Science 260, 1130-1132, 1993). Дельта 31 ("31"), укороченная вариантная форма зрелого GDNF человека, в которой удалены с 1 по 31 аминокислотные остатки на N-конце, имеет последовательность SEQ ID NO: 8, и ее можно очистить из смеси. Вариант GDNF, 31-укороченный с N-конца, можно получить в системе экспрессии млекопитающего или в бактериальной системе экспрессии путем удаления как пептидной последовательности продомена, так и первых 31 аминокислотных остатков зрелого пептида GDNF на уровне ДНК, и применяя ряд последовательностей секреторных сигнальных пептидов, таких как нативный секреторный сигнальный пептид GDNF (SEQ ID NO: 4 MKLWDVVAVCLVLLHTASA); секреторный сигнальный лидерный пептид каппа мыши (SEQ ID NO: 25 METDTLLLWVLLLWVPGSTG); и секреторный сигнальный пептид гормона роста человека (SEQ ID NO: 32 MATGSRTSLLLAFGLLCLPWLQEGSA). Данные конструкции позволяют получить однотипные гомогенные 31-N-укороченные варианты GDNF. Для среднего специалиста в данной области очевидно, что предложенные варианты GDNF не исключают возможность гликозилирования. Предложенные варианты GDNF могут быть гликозилированы в соответствующих случаях в зависимости от используемой системы экспрессии. Например, вариантыGDNF, экспрессированные в системе млекопитающего, гликозилированы по положению N49, тогда как варианты, экспрессированные в бактериальной системе, не гликозилированы. Если для экспрессии используется конструкция с полноразмерной нативной последовательностью(SEQ ID NO: 2), получают смесь видов GDNF с различными укорочениями N-конца, а также зрелую форму (не укороченную) с участком продомена или без него. Следующие примеры, выполненные, по существу, как описано ниже, можно использовать для оценки некоторых свойств вариантов GDNF человека согласно настоящему изобретению. Пример 1. Экспрессия, очистка и анализ иммуногенности белка.rhGDNF, растили на питательной среде Луриа-Бертани, содержащей канамицин в конечной концентрации 30 мкг/мл, в течение ночи при 37C. После сбора клеток путем центрифугирования выделяли плазмидный вектор с использованием набора QIAquick Spin Miniprep (Qiagen), следуя протоколу производителя. Выделенную плазмидную ДНК затем использовали для реакции удлинения праймеров для генов 31-GDNF и 31-N38Q-GDNF, кодирующих белок 31-GDNF (31 остаток удален с N-конца зрелогоGDNF человека) и белок 31-N38Q-GDNF (31 остаток удален с N-конца зрелого GDNF человека и остаток аспарагина в положении 38 заменен на глутамин) соответственно. Это можно осуществить, применяя олигонуклеотидные праймеры 31-for, 31-rev, 31-N38Q-for и 31-N38Q-rev (SEQ ID NOs: 6, 7, 39 и 40 соответственно), содержащие сайты рестрикции эндонуклеазами NdeI и XhoI, разработанные таким образом, чтобы они отжигались на 5'- и 3'-концы гена. Сайты рестрикции NdeI и XhoI, введенные в 5'концы смыслового и антисмыслового праймеров, обеспечивают возможность клонирования 31-GDNF и 31-N38Q-GDNF в соответствующие сайты вектора pET-30 а(+). Реакцию удлинения праймера осуществляли в течение 3 мин при 94C, затем следовало 16 трехэтапных циклов: 1 мин при 94C, 0,5 мин при 55C и 1 мин при 72C и конечный этап 10 мин при 72C, в общем объеме 100 мкл, с применением 80 нг матричной ДНК, прямой и обратный праймеры и смесь для ПЦР PCR Supermix (Invitrogen, номер в каталоге 10572-014). Полученные ампликоны проверяли путем электрофореза в агарозном геле и очищали с использованием набора для очистки продуктов ПЦР QIAquick (Qiagen), следуя протоколу производителя. Как амплифицированный ген 31-GDNF или 31-N38Q-GDNF, так и вектор pET-30 а(+) расщепляли в течение 2 ч при 37C рестриктазами NdeI и XhoI, а затем очищали ДНК путм электрофореза в агарозном геле с использованием набора QIAquick Gel Extraction. 31-GDNF или 31-N38Q-GDNF, затем лигировали в плазмиду pET-30 а(+), применяя Т 4 ДНК-лигазу и следуя протоколу производителя. 2-5 мкл реакционных смесей лигирования использовали для непосредственной трансформации 50-100 мкл химически компетентных клеток штамма BL21-CodonPlus (DE3)-RIPL E. coli, следуя протоколу производителя (Agilent, номер в каталоге 230280). Колонии трансформантов, полученные путем посева на чашки с агаром Луриа-Бертани, содержащим канамицин в конечной концентрации 30 мкг/мл, подвергали скринингу на присутствие правильной конструкции путем секвенирования выделеной плазмиды в обоих направлениях, применяя стандартные олигонуклеотидные праймеры, содержащие последовательности промотора и терминатора Т 7. Мутации. Сайт-направленный мутагенез осуществляли с использованием набора QuikChange MultiSite-Directed Mutagenesis (Stratagene, Ла-Хойя, Калифорния), с получением 31-N38Q-D95E-GDNF и 31-N38Q-K84A-R88K-R90K-D95E-GDNF. В данном способе используют 31-N38Q-GDNF, встроенный в pET-30 а(+), в качестве матрицы и олигонуклеотиды 31-N38Q-D95E-for и 31-N38Q-D95E-rev (табл. 1,SEQ ID NOs: 41 и 42) в качестве прямого и обратного праймеров соответственно. Затем успешно мутированный ген 31-N38Q-D95E, встроенный в pET-30 а(+), используют в качестве матрицы, а олигонуклеотиды 31-N38Q-K84A-R88K-R90K-D95E-for и 31-K84A-R88K-R90K-D95E-D95E-rev (табл. 1, SEQ IDNOs: 43 и 44) используют в качестве прямого и обратного праймеров соответственно с получением 31N38Q-K84A-R88K-R90K-D95E-GDNF. Затем проверяют правильность последовательности ДНК и трансформируют полученной плазмидой химически компетентные клетки штамма BL21-CodonPlus(DE3)-RIPL E. coli. Экспрессия белка. Клетки из замороженных исходных растворов клеток BL21-CodonPlus (DE3)RIPL E. coli, несущих плазмиду pET-30a(+)/GDNFv, применяли для инокулирования 50 мл питательной среды 2xTY, содержащей канамицин в конечной концентрации 30 мкг/мл, при 37C. Через 9 ч 5 мл заквасочной культуры использовали для инокулирования 62 л такой же жидкой культуральной среды при 37C. Когда культура достигала оптической плотности при 600 нм между 0,8 и 1,4, обычно через 16 ч,добавляли IPTG до конечной концентрации 1 мМ и температуру культуры снижали до 27-30C в течение 5 ч. Клетки собирали путем центрифугирования при 10000 g в течение 20 мин при 4C и хранили при-80C. Растворение - повторная укладка. Осадок клеток суспендировали в 2-3 объемах раствора, содержащего 0,2 мг/мл лизоцима, 5 мМ MgCl2 и 50 мМ Трис-Cl при pH 8, и оставляли для инкубации при перемешивании в течение 30 мин на льду. Полученную в результате этого взвесь разрушали ультразвуком на льду в течение 10 мин (импульсы по 5 с, интервал 2 с, амплитуда 30-40%). После этого получали GDNFv в виде телец включений, которые выделяли из клеточного лизата путем центрифугирования при 20000 g в течение 20 мин и растворяли в 4 М гуанидине, 90 мМ цистеине, 20 мМ Трис-Cl, pH 8,5. Полученный белок пересворачивали с получением его активной формы путем 10X разведения в 0,2 М гуанидине, 2 М мочевине, 20 мМ Трис-Cl, pH 8,75. Смесь для пересворачивания выдерживали при 4C в течение 2 дней. Очистка. GDNFv после повторного сворачивания очищали до гомогенного состояния путем 3 этапной колоночной хроматографии. 1. Катионообменная хроматография (КОХ) на колонке SP. 2. Хроматография гидрофобных взаимодействий (ХГВ) па фенильной колонке Phenyl. 3. Эксклюзионная хроматография (ЭХ) на колонке Superdex-75. Ренатурированный белок сначала наносили на колонку с SP-сефарозой быстрого пропускания (SPSepharose Fast Flow), уравновешенную 20 мМ ацетатом натрия, pH 5. GDNFv элюировали восходящим линейным градиентом соли от 0,3 до 1 М NaCl в 20 мМ ацетате натрия, pH 5. В объединенный основной поток КОХ добавляли NaCl до конечной концентрации 2,5 М, а затем наносили на колонку для хроматографии гидрофобных взаимодействий Phenyl Sepharose HP в 20 мМ цитрате натрия, pH 5. Колонку для ХГВ элюировали нисходящим линейным градиентом соли от 2,5 до 0 М NaCl в 20 мМ цитрате натрия,pH 5. GDNFv крепко связывался с колонкой для ХГВ. Объединенный основной поток с колонки ХГВ затем концентрировали и, наконец, наносили на колонку Superdex-75, белок элюировали ФБР, pH 7,4. Конечный пул концентрировали, фильтровали через мембрану с диаметром пор 0,22 мкм и хранили приb) Экспрессия GDNFv в клетках млекопитающих и очистка. Гены, кодирующие варианты GDNF, можно получить, применяя стандартные методики молекулярной биологии, или путем синтеза гена в клетках млекопитающего в векторе экспрессии под контролем промотора цитомегаловируса (CMV). Рекомбинантные плазмиды использовали для временной трансфекции клеток эмбриональной почки человека 293EBNA (HEK293) и собирали среды через 5 дней. В другом способе получали стабильные линии клеток яичника китайского хомячка (CHO) для экспрессии вариантов GDNF. Гены, кодирующие варианты белка, субклонировали в каркасы экспрессионных плазмид, содержащих ген глутаминсинтетазы (GS) (плазмиды на основе pEE12.4, Lonza Biologics, Слау, Великобритания) в одной рамке считывания с нативной сигнальной последовательностью GDNF с продоменом, согласно инструкции производителя. Полноразмерными конструкциями GDNF (SEQ ID NO: 2) в векторах на основе pEE12.4 трансфицировали клетки CHO и получали укороченные формы GDNF, при этом преобладающей формой была 31, и ее можно было очистить от смеси. Удаление продомена и первых 31 N-концевых аминокислот, эффективное получение чистого 31-N-укороченного варианта GDNF в системе экспрессии млекопитающего, без необходимости очистки из смеси полноразмерных и укороченных продуктов, известной ранее. Нативный секреторный сигнальный пептид GDNF также можно заменить на некоторое количество секреторных сигнальных пептидов, включая секреторный сигнальный лидерный пептид каппа мыши или секреторный сигнальный пептид гормона роста человека. Все описанные секреторные сигнальные пептиды также обеспечивают эффективное получение чистого 31-Nукороченного варианта GDNF, но уровни экспрессии при этом отличаются. Варианты GDNF, включающие желательные мутации, субклонировали в подходящие векторы экспрессии (такие как pEMK-NF2,Lonza) в одной рамке считывания с сигнальной последовательностью каппа мыши. Очистка. GDNFv очищали до гомогенного состояния с помощью 4-этапной хроматографии на гранулах. 1. Катионообменная хроматография (КОХ) на колонке SP. 2. Хроматография гидрофобных взаимодействий (ХГВ) на колонке Phenyl. 3. Катионообменная хроматография (КОХ) на колонке смешанного режима CaptoMMC. 4. Эксклюзионная хроматография (ЭХ) на колонке Superdex-75. Вкратце, собранные культуральные среды, содержащие варианты белка GDNF, сначала наносили на колонку SP Sepharose Fast Flow, уравновешенную 20 мМ ацетатом натрия, pH 5. GDNFv элюировали линейным градиентом соли от 0 до 1 М NaCl в 20 мМ ацетате натрия, pH 5. В объединенный основной поток КОХ добавляли NaCl до конечной концентрации 2,5 М, а затем наносили на колонку Phenyl Sepharose HP для хроматографии гидрофобных взаимодействий в 20 мМ ацетате натрия, pH 5. Колонку для ХГВ элюировали обратным линейным градиентом соли от 2,5 до 0 М NaCl в 20 мМ ацетате натрия, pH 5.GDNFv слабо связывался с колонкой для ХГВ. Объединенный элюат и ранние элюированные фракции затем наносили на смолу смешанного режима колонки Capto MMC при pH 5. Колонку промывали 50 мМ Трис-Cl, pH 8, а затем элюировали GDNFv линейным градиентом соли от 0 до 1 М NaCl в 50 мМ ТрисCl, pH 8. Основной поток с Capto ММС, наконец, наносили на колонку Superdex-75 и элюировали белок с помощью ФБР, pH 7,4. Конечный поток фильтровали через мембрану с диаметром пор 0,22 мкм и хранили при 2-8C. Таблица 1 Олигонуклеотидные праймеры, использованные для ПЦР и сайт-направленного мутагенеза Сайты рестрикции для эндонуклеаз NdeI и XhoI выделены курсивом. Подчеркивание букв указывает на некомплементарность. Анализ иммуногенного потенциала Epivax. Получали выбранные варианты GDNF человека с сниженной вероятностью связывания с HLA-DR(SEQ ID NOs: 12 и 15) и сравнивали их с GDNF дикого типа в анализе на связывание GFR и гепарина. Пример 2. Стабильность GDNF дикого типа и варианта 31 GDNF. Стабильность полноразмерного зрелого GDNF дикого типа и 31-N-укороченных вариантов GDNF можно оценить, применяя множество аналитических способов, таких как обращенно-фазовая ВЭЖХ (ОФ ВЭЖХ), эксклюзионная ВЭЖХ, катионообменная ВЭЖХ и масс-спектрометрия, для определения какихлибо сайтов деградации в данных молекулах. Затем вводят мутации, чтобы убрать сайты химической деградации для повышения стабильности варианта GDNF человека. Аналитическая обращенно-фазовая хроматография (ОФ ВЭЖХ). Осуществляли на колонке Zorbax C8 SB-300, 3,5 мкм, 4,650 мм, нагретой до 60C (Agilent Technologies, номер в каталоге 865973-909). Подвижная фаза представляла собой 0,1% ТФК в H2O. GDNFv элюировали в виде одиночного пика на 214 нм, время удерживания составляло 19-20 мин, линейным градиентом ацетонитрила от 5 до 50% за 30 мин при скорости потока 1 мл/мин в течение 35 мин. Аналитическая эксклюзионная хроматография (ЭХ-ВЭЖХ). Осуществляли на колонке TSK-G-2000-SW-XL, 5 мкм, 7,8300 мм (TOSOH BIOSEP, номер в каталоге 08540). Подвижная фаза: ФБР + 350 мМ NaCl, pH 7,4, при скорости потока 0,5 мл/мин в течение 35 мин. GDNFv элюировали в виде одиночного пика на 214 нм, время удерживания составляло 16-17 мин. Аналитическая катионообменная хроматография (КОХ-ВЭЖХ). Осуществляли на колонке Dionex, Propac WCX-10, 4250 мм (Dionex, номер в каталоге 054993). Подвижная фаза представляла собой 20 мМ фосфат натрия, 10% ацетонитрил, pH 7. GDNFv элюировали в виде сложного пика, время удерживания составляло 25-30 мин, линейным градиентом соли от 0,15 до 0,6 М NaCl за 45 мин при скорости потока 1 мл/мин в течение 52 мин. Анализ химической стабильности (ЖХ/МС) GDNF дикого типа (полноразмерного бактериальногоGDNF дикого типа (полноразмерный бактериальный GDNF) и GDNFv CHO дикого типа (N-31 укороченный GDNF) подвергали воздействию температуры 37C в течение 4 недель, чтобы определить аминокислоты, которые могут отвечать за химическую нестабильность. Образцы: 1 - полноразмерный GDNF ДТ E. coli при 4C в течение 4 недель, 1,0 мг/мл,2 - полноразмерный GDNF ДТ E. coli при 37C в течение 4 недель, 1,0 мг/мл,3 - 31-GDNFv ДТ CHO при 4C в течение 4 недель, 1,0 мг/мл,4 - 31-GDNFv ДТ CHO при 37C в течение 4 недель, 1,0 мг/мл. Молекулярный анализ интактных и расщепленных образцов. Аликвоту 10 мкл каждого образца(раствор смешивали с 20 мкл воды или аликвотой 10 мкл каждого раствора) смешивали с 40 мкл буфера 100 мМ Трис-HCl, pH 8, 1,0 мкл 50 мг/мл дитиотреитола (ДТТ) при температуре окружающей среды в течение 30 мин. Каждый образец подвергали анализу ЖХ/МС. Расщепление Lys-C. Аликвоту объемом 20 мкл раствора каждого образца лиофилизировали досуха на вакуумной центрифуге, а затем полученный материал перерастворяли в 0,5 мкл 50 мг/мл ДТТ и 4,5 мкл 6 М гуанидин-HCl, 0,5 М буфера Трис-HCl, pH 8. Смесь инкубировали при 37C в течение 30 мин, а затем каждый раствор разбавляли 93 мкл воды и обрабатывали 2 мкл 0,2 мг/мл Lys-C (Wako) при 37C в течение 2 ч. Для CHO GDNFv 30 мкл триптического гидролизата обрабатывали 0,5 мкл PNGазой F при 37C в течение 1 ч (чтобы оценить углеводный профиль). Гидролизат подкисляли 2 мкл 10% ТФК в H2O перед проведением анализа ЖХ/МС. Анализ ЖХ/МС. Растворы образцов анализировали с помощью масс-спектрометрии Waters SYNAPT в сочетании с СВЭЖХ Acquity UPLC или масс-спектрометрии Waters LCT premier в сочетании с ВЭЖХ Waters 2795. Нисходящий анализ. Продукты расщепления GDNF дикого типа получали путем ЖХ/МС анализа частично укороченного GDNF. Идентифицировали множество продуктов расщепления, количественные данные для этих продуктов расщепления представлены в табл. 2. Несколько продуктов расщепления(расщепления между N15/R16, N22/P23, N25/S26 и N38/R39) характеризуются близкими механизмами разрушения, например дезаминированием через образование сукцинимида. Для 31-GDNFv CHO дикого типа первые 31 аминокислотных остатков отщепляются от N-конца. Хотя в GDNFv из CHO есть два потенциальных сайта N-гликозилирования на цепь, только один сайт N-гликозилируется. Большинство наблюдаемых гликанов представляли собой ди- или триантенные олигосахариды с различным галактозилированием. Интересно, что не было обнаружено значительно сиалированных гликанов (табл. 3). Восходящий анализ (пептидное картирование). Хроматограммы в УФ-свете реакции расщепленияLys-C образцов укороченного GDNF, исследуемых на стабильность, выявили присутствие всех ожидаемых пептидов за исключением пептида GDNF 126-129. В материале CHO N-концевые пептиды (до R32) обнаружены не были. Пептид 38-60, включающий N49, был гликозилирован и более чем 95% Asn49 были заняты. Пептид 85-96, включающий N85, не был гликозилирован. Полученные результаты согласуются с результатами анализа ЖХ/МС для образцов укороченного GDNF. В целом, основным компонентом материалов как дикого типа, так и CHO был гомодимер. Минорный компонент, который элюировался рано, представлял собой мономер. Согласно массспектроскопическому анализу в мономере Cys41 GDNF образовал дисульфидную связь со свободным остатком Cys. Относительный процент пиков мономера был очень низок и составлял 1% для CHO и 0,5% для дикого типа при исследовании в ультрафиолете. Содержание мономера не изменялось в материалах после термического воздействия. Такие виды деградации, как окисление, дезаминирование и изомеризация, также выявили с помощью пептидного картирования. Результаты представлены в табл. 4. Полноразмерный GDNF дикого типа из E. coli содержит два остатка Met, M(-1) и M6, и окисление этих сайтов относительно низко. GDNF не содержит остатков Trp. В полноразмерном мономере GDNF содержится восемь остатков Asp. Основные сайты дезаминирования представляют собой N25 и N38. Поскольку дезаминирование происходит значительно быстрее в буфере с высоким pH, относительный процент таких сайтов должен быть низким при обработке буфером с pH 5 или 6. Обнаружили один изомерный пептид, 85-96, но не ясно, образовался ли он в результате изомеризации Asp до Iso-Asp или в результате рацемизации аминокислотного остатка. Известно, что воздействие высокого pH, как правило, приводит к рацемизации, а воздействие низкого pH приводит к изомеризации Asp. Для полноразмерного GDNF дикого типа у нескольких пептидов оказались различные массы как в контрольном (4C), так и в подвергнутом воздействию температуры (37C) образцах. Их появление, наиболее вероятно, объясняется ошибками включения в процессе биосинтеза вE. coli. Таблица 2 Относительный процент расщепления GDNF Полученные результаты свидетельствуют о том, что 31-N-укороченный вариант GDNF, полученный в клетках CHO, обладает повышенной химической стабильностью благодаря делеции первых 31 аминокислотного остатка, которые включают важные участки окисления и дезаминирования по сравнению с полученным в E. coli полноразмерным зрелым GDNF дикого типа человека, при воздействии температуры 37C в течение 4 недель. Кроме того, в табл. 5 показано, что после введения мутации наблюдались существенные улучшения биофизических и биохимических свойств двух мутированных 31-Nукороченных вариантов GDNF (N38Q и D95E соответственно) по сравнению как с полноразмерным Таблица 5 Улучшенные биофизические и биохимические свойства вариантов GDNF по сравнению с GDNF дикого типа после 4 недель инкубации при 37C по сравнению с инкубацией при 4C Пример 3. Активность связывания in vitro. В следующих анализах показано, что некоторые варианты GDNF человека характеризуются сниженным связыванием в гепарином, и при этом сохраняется связывание с рецептором GFR1, что обеспечивает целый ряд различных свойств связывания гепарина и рецептора. Кинетика связывания GDNFv с рецепторами GFR на устройстве Biacore. Варианты GDNF (GDNFv: N-31-укороченные) можно экспрессировать в клетках E. coli (бактериальных) или клетках млекопитающих (клетки CHO или клетки EBNA HEK293) и очистить, как описано в примере 1. Первичные последовательности указанных вариантов остаются одинаковыми независимо от используемой системы экспрессии. Для измерения кинетики связывания GDNFv с рецепторами семейства GDNF человека и крысы(GFR1 и GFR2) использовали устройство Biacore 2000. Измерения осуществляли при 25C. Образцы растворяли в буфере HBS-EP (150 мМ хлорид натрия, 3 мМ ЭДТА, 0,005% (вес./об.) поверхностноактивного вещества P-20, pH 7,4). Белок A, Staphylococcus aureus, иммобилизовали на проточных кюветах с 1 по 4 сенсорного чипа СМ 4 (GE Healthcare, номер в каталоге BR-1005-39) в количестве 200 еди-9 025129 ниц ответа (RU), используя химию связывания амина для захвата GFR Fc химеры (рекомбинантная человеческая GFR-1/GDNF R-1 Fc химера; рекомбинантная человеческая GFR-2/GDNF R-2 Fc химера; рекомбинантная крысиная GFR-1/GDNF R-1 Fc химера; рекомбинантная мышиная GFR-2/GDNF R2 Fc химера). Связывание оценивали, используя множество циклов. Каждый цикл состоял из следующих этапов: 1) впрыскивание приблизительно 10 мкл GFR при концентрации 1,0 мкг/мл и скорости потока 10 мкл/мин с целью захвата 120-150 RU; 2) впрыскивание 250 мкл GDNFv при скорости потока 50 мкл/мин в диапазоне конечных концентраций между 10 и 0,04 нМ, за чем следовала диссоциация в течение 20 мин; и 3) регенерация с применением приблизительно 30 мкл 10 мМ гидрохлорида глицина, pH 1,5. Скорости ассоциации и диссоциации для каждого цикла оценивали, используя модель "связывания 1:1 (Лэнгмюр)" в версии 4.1 программного обеспечения BIAevaluation. Результаты представлены ниже в табл. 6-8. Таблица 6 Связывание вариантов GDNF человека с GFR1 с применением твердофазного иммуноферментного анализа (ELISA).GDNF дикого типа и его варианты исследовали методом твердофазного иммуноферментного анализа (ELISA), в котором измеряли связывание белков GDNF с рецептором (GFR1), адсорбированным на планшете. Условия "без GDNF" и/или "посторонний белок" использовали в качестве отрицательных контролей. Каждую лунку 96-луночного планшета (планшеты для ELISA Greiner 655081 Immunobind) покрывали 70 мкл GFR1 человека (рекомбинантной человеческой GFR1-Fc химерой, свободной от носителя) в концентрации 1 мкг/мл в карбонатном буфере, pH 9,6. В случае покрытия посторонним рецептором он представлял собой посторонний химерный Fc, и использовали такую же концентрацию, что и при покрытии GFR1. Планшеты запечатывали и инкубировали при 4C в течение ночи. Из лунок аспирировали жидкость и промывали дважды буфером для промывки (20 мМ Трис(гидроксиметил)аминометан, pH 7,4, 0,15 М NaCl, 0,1% Tween-20), применяя устройство для автоматической промывки планшетов. Планшеты блокировали 200 мкл блокирующего буфера на лунку (3% быстрорастворимое сухое молоко от Carnation в описанном выше буфере для промывки) в течение по меньшей мере 1 ч при комнатной температуре. Планшеты промывали дважды буфером для промывки. Готовили серийные разведения белков GDNF в блокирующем буфере в подходящем диапазоне концентраций, обычно начиная с 5 мкг/мл и заканчивая серийным разведением 1:10. Использовали контроль без GDNF, который состоял только из блокирующего буфера. 50 мкл каждого раствора GDNF добавляли в лунки, покрытые GFR1, в трех повторах. Планшеты инкубировали в течение 1,5 ч при комнатной температуре. Затем трижды промывали лунки буфером для промывки. Аликвоту объемом 50 мкл биотинилированного антитела к GDNF человека (RD Systems, биотинилированное поликлональное антитело козы к GDNF человека, номер в каталоге BAF212), разбавленного до концентрации 1 мкг/мл в блокирующем буфере, добавляли в каждую лунку и инкубировали в течение 45 мин при комнатной температуре. Затем трижды промывали лунки буфером для промывки. Аликвоту объемом 50 мкл стрептавидина, конъюгированного с пероксидазой хрена (Jackson ImmunoResearch, номер в каталоге 016-030-084), разбавленного 1:1000 в блокирующем буфере, добавляли в каждую лунку и инкубировали в течение 20-30 мин при комнатной температуре. В качестве альтернативы можно использовать разведение 1:2000 и инкубировать в течение 30-90 мин. Затем трижды промывали лунки буфером для промывки. В каждую лунку добавляли 50 мкл хромогенного субстрата (т.е. субстрата ортофенилендиамина (ОФД и проявляли при комнатной температуре в течение 2-3 мин. Реакцию вводили путем инфузии добавлением 100 мкл 1H HCl в каждую лунку. Поглощение в лунках считывали при 490 нм на спектрофотометре для прочтения планшетов SpectraMax250 производства Molecular Devices. Определяли среднее поглощение, рассчитанное по трем лункам, для каждого условия, и полученные в результате этого значения обрабатывали для расчета EC50 с помощью программного обеспечения Graph Pad Prism,чтобы получить 95% доверительный интервал. Данные интервалы указаны ниже в табл. 9. Связывание вариантов GDNF человека с гепарином с применением ELISA.GDNF дикого типа и его варианты исследовали методом ELISA, в котором измеряли связывание белков GDNF с гепарином, адсорбированным на планшете. Условия "без GDNF" использовали в качестве отрицательного контроля. Каждую лунку 96-луночного планшета для связывания гепарина (BD BioSciences Heparin BindingPlates, номер в каталоге 354676) покрывали 70 мкл гепарина (смесью гепаринов разных молекулярных весов от Sigma, натриевой солью гепарина, приобретенной в Porcine Intestinal Mucosa, номер в каталоге Н-3149) в концентрации 5 мкг/мл в ФБР. Планшеты запечатывали и инкубировали при комнатной температуре в течение ночи с защитой от света. Из лунок отсасывали жидкость и промывали три раза буфером для промывки, применяя устройство для автоматической промывки планшетов. Планшеты блокировали 200 мкл блокирующего буфера на лунку в течение 90-120 мин при 37C (для данной инкубации планшеты запечатывали). Планшеты промывали дважды буфером для промывки. Готовили серийные разведения GDNF в блокирующем буфере в подходящем диапазоне концентраций, обычно начиная с 5 мкг/мл и заканчивая серийным разведением 1:10. Использовали контроль "безGDNF", состоящий только из блокирующего буфера. Аликвоту объемом 50 мкл каждого раствора GDNF добавляли в покрытые гепарином лунки в трех повторах. Планшеты инкубировали в течение 1,5-2 ч при комнатной температуре. Затем трижды промывали лунки буфером для промывки. Аликвоту объемом 50 мкл биотинилированного антитела против GDNF человека, разбавленного до концентрации 1 мкг/мл в блокирующем буфере, добавляли в каждую лунку и инкубировали в течение от 45 мин до 1 ч при комнатной температуре. Затем трижды промывали лунки буфером для промывки. Аликвоту объемом 50 мкл стрептавидина, конъюгированного с пероксидазой хрена, разбавленного 1:1000 в блокирующем буфере, добавляли в каждую лунку и инкубировали в течение 20-30 мин при комнатной температуре. В качестве альтернативы можно использовать разведение 1:2000 и инкубировать в течение 30-90 мин. Затем трижды промывали лунки буфером для промывки. Аликвоту объемом 50 мкл хромогенного субстрата (т.е. субстрата ОФД) добавляли в каждую лунку и позволяли окраске развиться при комнатной температуре в течение 2-3 мин. Реакцию вводили путем инфузии добавлением 100 мкл 1N HCl в каждую лунку. Поглощение в лунках считывали при 490 нм на спектрофотометре для прочтения планшетов. Определяли среднее поглощение, рассчитанное по трем лункам, для каждого условия,и полученные в результате этого значения обрабатывали для расчета EC50 с помощью программного обеспечения Graph Pad Prism, чтобы получить 95% доверительный интервал. Данные интервалы указаны ниже в табл. 9. провели 2 отдельных эксперимента, не комплекс Полученные результаты показывают, что делеция 31 N-концевой аминокислоты (вариант, названный "CHO 31 GDNF") в GDNF дикого типа (названном "ДТ E. Coli GDNF") может значительно уменьшать связывание с гепарином (приблизительно в 10 раз), при этом сохраняется связывание с рецепторомGFR1, и данные результаты дополнительно свидетельствуют о том, что с помощью дополнительных вариантов GDNF человека можно достичь множества различных свойств связывания гепарина и рецептора. Пример 4. Активности in vitro. Анализ разрастания нейритов NS-1. Влияние GDNF на дифференцировку нервных клеток оценивали, применяя клетки крысы Neuroscreen-1 (субклон PC12). Указанные клетки поддерживали в минимальной среде F-12K, дополненной 12,5% термоинактивированной лошадиной сыворотки, 2,5% термоинактивированной фетальной бычьей сыворотки (FBS), 1X GlutaMAX (Invitrogen, номер в каталоге 35050061) и 1X антибиотикомантимикотиком Anti-anti (Invitrogen, номер в каталоге 15240), при 37C, влажности 95%, на покрытых коллагеном флаконах. Для измерения разрастания нейритов клетки Neuroscreen-1 высевали на 96 луночные планшеты, покрытые коллагеном I типа, в количестве 2200 клеток на лунку в ростовой среде,используя только внутренние 60 лунок. Через 24 ч, отведенные на прикрепление клеток, среду удаляли и добавляли новую ростовую среду, содержащую GFR1-Fc в концентрации 1 мкг/мл плюс GDNF, разбавленный в серии 8-кратных разведений, либо в три, либо в шесть лунок планшета на концентрацию. Среду с добавлением 1 мкг/мл GFR1-Fc включили в качестве отрицательного контроля, а среду с добавлением 25 нг/мл фактора роста нервов включили в качестве положительного контроля ответа клеток в данном анализе. Планшеты инкубировали в течение 96 ч при 37C, влажности 95%, а затем фиксировали путем добавления 45 мкл фиксажа в каждую лунку и инкубации при комнатной температуре в течение 1 ч. Планшеты промывали дважды 1X буфером для промывки из набора Neurite Outgrowth Hit Kit (Cellomics, номер в каталоге K07-0001-1), а затем промывали дважды 1X буфером из указанного набора. Клетки подвергали иммунному окрашиванию реагентами из набора для выявления разрастания нейритов, следуя инструкциям производителя. Планшеты загружали в устройство Arrayscan и анализировали,применяя программное обеспечение Arrayscan и алгоритм Neuronal Profiling от Cellomics. Данные, сгенерированные указанным алгоритмом, обрабатывали для расчета EC50 с помощью программного обеспечения Graph Pad Prism. Несколько вариантов исследовали на влияние на дифференцировку нервов, наблюдаемые EC50 для каждого варианта приведены в табл. 10 А. Нет данных вследствие либо низкой эффективности, либо невозможности достичь максимального плато. Все исследованные в данном анализе образцы GDNF проявили разные степени активности в тесте на разрастание нейритов. Кривые зависимости от дозы для варианта 31-N38Q-K84A-R88K-R90K-D95EK125E-R130E не достигали плато при максимальной дозе в двух проведенных экспериментах, поэтому рассчитать EC50 невозможно. Диапазоны 95% доверительных интервалов EC50 для других четырех вариантов GDNF перекрываются, что указывает на близкие уровни активности в данном анализе. Фосфорилирование рецептора c-Ret. Анализ фосфорилирования рецептора c-Ret можно применять для демонстрации индукции фосфорилирования рецептора c-Ret в положении Y1016. Активность GDNF по отношению к фосфорилированию рецептора c-Ret оценивали в клетках линии нейробластомы человека SH-SY5Y (АТСС), которые были стабильно трансфицированы для сверхэкспрессии c-Ret человека. Указанные клетки поддерживали в модифицированной по способу Дульбекко среде Игла (DMEM), дополненной 10% FBS, 3 мкг/мл бластицидина. Для фосфорилирования c-Ret клетки высевали в количестве 510 на лунку в 24-луночные покрытые коллагеном планшеты в ростовой среде без бластицидина и позволяли им прикрепиться в течение ночи. Среду заменили на DMEM с низким содержанием глюкозы + 0,25% БСА (бычий сывороточный альбумин) на 24 ч. Среду для голодания клеток удаляли и клетки обрабатывали GDNF в безглюкозной DMEM с добавлением 0,25% БСА и 1 мкг/мл GFR1-Fc в течение 30 мин при 37C. Каждый вариантGDNF тестировали в различных концентрациях. После обработки среду удаляли и клетки соскребали с поверхности планшета в ледяном лизирующем буфере, содержащем экстракционный реагент M-Per + коктейль ингибиторов протеаз, ингибитор фосфатаз 1, коктейль ингибиторов фосфатаз 2 и коктейль ингибиторов фосфатаз 3 (Sigma). Суспензии клеток встряхивали на вортексе до полного лизиса, центрифугировали при 14000 g, чтобы осадить обломки клеток, и измеряли концентрацию белка в супернатанте, применяя реагенты для анализа с помощью бицинхониновой кислоты (БХК). Для каждого лизатаGDNF 10 мкг белка разделяли посредством электрофореза в 4-12% бис-трис гелях NuPAGE Novex(Invitrogen, номер в каталоге NP0322) и переносили на поливинилиденфторидную (ПВДФ) мембрану.Ret, фосфорилированный по 1016 тирозину (тирозин-1016-фосфо-Ret), выявляли с помощью поликлональных антител кролика и антитела козы против антител кролика, меченного пероксидазой хрена(HRP); и c-Ret выявляли с помощью моноклонального антитела мыши и антитела козы против антител мыши, меченного HRP. Блоты проявляли с помощью реагентов Supersignal West Pico (ThermoScientific, номер в каталоге 34081) и экспонировали с рентгеновской пленкой. Пять вариантов GDNF (ДТ E. coli GDNF, CHO 31 GDNF, CHO 31-N38Q-D95E GDNF, CHO 31N38Q-K84A-R88K-R90K-D95E GDNF и CHO 31-N38Q-K84A-R88K-R90K-D95E-K125E-R130E GDNF) исследовали в безглюкозной среде DMEM, содержащей 0,25% БСА + 1 мкг/мл GFR1-Fc, на фосфорилирующую активность по отношению к c-Ret в семи концентрациях, составляющих 0,8, 2,0, 4,0, 10, 20,50 и 100 нг/мл. В качестве отрицательных контролей также тестировали образцы: только среда, среда + 1 мкг/мл GFR1-Fc и среда + 100 нг/мл CHO 31 GDNF. Каждый из пяти вариантов GDNF вызывал фосфорилирование c-Ret с EC50, равной 8-15 нг/мл. Полученные результаты демонстрируют, что все пять вариантов GDNF индуцируют дозозависимое фосфорилирование Y1016 c-Ret. В табл. 10 В показано, что искусственные 31-N-укороченные варианты GDNF, которые демонстрировали существенные улучшения биофизических и биохимических свойств (табл. 5, 6, 9 и 10 А), сохранили оптимизированные биологические свойства, например сравнимое связывание рецептора GFR1,сниженное связывание с гепарином и сравнимое разрастание нейритов, после 4 недель инкубации при 37C. Таблица 10 В Сравнение биологической активности ДТ- E. coli GDNF и 31-N-укороченных вариантов GDNF после 4 недель инкубации при 37C по сравнению с образцами, инкубированными при 4C Пример 5. Активность вариантов GDNF в анализах метаболизма дофамина (ДА). Самцов крыс линии Sprague-Dawley обезболивали, применяя изофлуран (3% в O2). Голову брили и стерилизовали раствором йода, а затем фиксировали животное в стереотаксической рамке с терморегулируемой подложкой. Глаза защищали с помощью офтальмологического геля и поддерживали анестезию с помощью изофлурана (1-2% в O2). На голове животного делали срединный разрез, кожу черепа и находящуюся под ней ткань отгибали и осушали череп, чтобы было видно брегму. Для инфузии GDNF отмеряли координаты хвостатого ядра от брегмы и поверхности твердой мозговой оболочки. Инфузионный катетер 28 калибра медленно погружали в данном положении и спустя 1 мин начинали инфузию с применением насоса. Разовую дозу 2 мкл тестируемого GDNF вводили инфузией в левое полушарие в течение 4 мин при скорости потока 0,5 мкл/мин и оставляли катетер на месте в течение дополнительных 3 мин после прекращения инфузии. Сразу после удаления катетера место разреза зашивали, вводили послеоперационный анальгетик и позволяли животному восстановиться в клетке с контролируемой температурой перед переносом в домашнюю клетку. После операции животных проверяли в соответствии с местным руководством по этике. Через подходящий промежуток времени после инфузии умерщвляли животное, удаляли головной мозг,хвостатые ядра аккуратно иссекали, взвешивали и замораживали до момента проведения анализа ВЭЖХ на дофамин и метаболиты. Замороженной ткани позволяли быстро оттаять и гомогенизовали ее в 0,5 мл буфера для гомогенизации (0,1 М перхлорная кислота (ПХК), 0,1 мМ этилендиаминтетрауксусная кислота (ЭДТА), 2,5 мг/л аскорбиновой кислоты) перед центрифугированием при 20000 g в течение 15 мин. Супернатант удаляли и фильтровали через фильтрующее устройство без шприца. Анализ на дофамин (ДА), дигидроксифенилуксусную кислоту (ДОФУК) и гомованилиновую кислоту (ГВК) осуществляли методом ВЭЖХ с детектированием электрохимическим детектором. Впрыскивали аликвоту объемом 20 мкл каждого образца и осуществляли количественный анализ с использованием внешней калибровочной кривой (LC-4C, BAS,США). Подвижная фаза состояла из 100 мМ NaH2PO4, 100 мМ Н 3 РО 4, 2 мМ растворимой в масле кислоты (РМК), 1 мМ ЭДТА, 13% метанола (MeOH), pH 2,8, использовали колонку C18 Hypersil BDS (кремний, деактивированный основанием) (Thermo Scientific, номер в каталоге 28105) размером 1503,0 мм с диаметром частиц 3 мкм при 40C. Результаты регистрировали, применяя программное обеспечение для хроматографии Empower. Осуществляли 4-параметрическую логарифмическую аппроксимацию всех данных, а затем представляли их в виде нг/г сырой массы ткани. Меру метаболизма дофамина выражали в виде (ДОФУК+ГВК)/ДА и осуществляли сравнение левого полушария (обработанного) с правым полушарием (интактным). Значения представлены в виде среднегостандартная ошибка среднего,n=5 на группуp 0,01 илиp0,001 по сравнению с интактной стороной Представленные результаты демонстрируют, что каждый из вариантов GDNF, перечисленных в табл. 11, значительно повышал метаболизм дофамина в обработанном полушарии по сравнению с интактным полушарием. Пример 6. Анализы in vivo. Модель дегенеративного нарушения, вызванного 6-гидроксидофамином (6-ГДА). Самцов крыс линии Sprague-Dawley обезболивали, применяя изофлуран (3% в O2). Голову брили и стерилизовали раствором йода, а затем фиксировали животное в стереотаксической рамке с терморегулируемой подложкой. Глаза защищали с помощью офтальмологического геля и поддерживали анестезию с помощью изофлурана (1-2% в O2). На голове животного делали срединный разрез, кожу черепа и находящуюся под ней ткань отгибали и осушали череп, чтобы было видно брегму. Отмеряли координаты хвостатого ядра от брегмы и поверхности твердой мозговой оболочки для инфузии 10 мкг 6-гидроксидофамина (6-ГДА). Инфузионный катетер 28 калибра медленно погружали в данное положение, и спустя 1 мин начинали инфузию. Разовую дозу 2 мкл 6-ГДА вводили путем инфузии в левое полушарие в течение 4 мин при скорости потока 0,5 мкл/мин и оставляли катетер на месте в течение дополнительных 3 мин после прекращения инфузии. Через 30 мин после инфузии 6-ГДА вводили путем инфузии тестируемый GDNF, используя тот же протокол. Координаты для инфузии GDNF были следующими: передне-заднее положение +1,0, боковоесреднее -2,5, дорсально-вентральное -4,5 мм от брегмы и поверхности твердой мозговой оболочки, как и ранее. Сразу после удаления катетера место разреза зашивали, вводили послеоперационный анальгетик и позволяли животному восстановиться в клетке с контролируемой температурой перед переносом в домашнюю клетку. После операции животных исследовали в соответствии с местным этическим руководством. Через подходящий промежуток времени после инфузии умерщвляли животное, удаляли головной мозг и хвостатые ядра, черное вещество аккуратно иссекали, взвешивали и замораживали до момента проведения анализа ВЭЖХ на дофамин и метаболиты. Замороженной ткани позволяли быстро оттаять и гомогенизовали ее в 0,5 мл буфера для гомогенизирования (0,1 М ПХК, 0,1 мМ ЭДТА, 2,5 мг/л аскорбиновой кислоты) перед центрифугированием при 20000 g в течение 15 мин. Супернатант удаляли и фильтровали через фильтрующее устройство без шприца. Анализ дофамина (ДА), ДОФУК и ГВК осуществляли с применением ВЭЖХ с обнаружением электрохимическим детектором. Впрыскивали аликвоту объемом 20 мкл каждого образца и осуществляли количественный анализ с использованием внешней калибровочной кривой. Подвижная фаза состояла из 100 мМ NaH2PO4, 100 мМ Н 3 РО 4, 2 мМ РМК, 1 мМ ЭДТА, 13% MeOH, pH 2,8, использовали колонкуC18 BDS Hypersil размером 1503,0 мм с диаметром частиц 3 мкм при 40C. Результаты регистрировали,применяя программное обеспечение для хроматографии Empower. Осуществляли 4-параметрическую логарифмическую аппроксимацию всех данных, а затем представляли их в виде нг/г сырой массы ткани. Осуществляли сравнение левого полушария (обработанного) с правым полушарием (интактным). Значения представлены в виде среднегостандартная ошибка среднего,n=8 на группу p0,001 по сравнению с интактной стороной Таблица 13 Черное веществоp0,05,p 0,01 илиp0,001 по сравнению с интактной сторонойp0,05,p0,01 по сравнению со средой (для обработанной стороны) Введение 6-ГДА в хвостатое ядро приводило к существенному снижению уровней дофамина в обработанной стороне по сравнению с интактной стороной (табл. 12). В черном веществе также наблюдался существенный недостаток (табл. 13), который предотвратили введением GDNF. Результаты для всех протестированных в данном анализе вариантов GDNF значительно отличались от результатов для среды при сравнении обработанных сторон. Кратковременное биораспределение в головном мозге крысы. Самцов крыс линии Sprague-Dawley обезболивали, применяя изофлуран (3% в O2). Голову брили и стерилизовали раствором йода, а затем фиксировали животное в стереотаксической рамке с терморегулируемой подложкой. Глаза защищали с помощью офтальмологического геля и поддерживали анестезию с помощью изофлурана (1-2% в O2). На голове животного делали срединный разрез, кожу черепа и находящуюся под ней ткань отгибали и осушали череп, чтобы было видно брегму. Для инфузии GDNF отмеряли координаты хвостатого ядра от брегмы и поверхности твердой мозговой оболочки (передне-заднее положение +0,5, боковоесреднее -3,0, дорсально-вентральное -5,5 мм). Инфузионный катетер 30 калибра медленно погружали в данное положение и спустя 1 мин начинали инфузию (применяя насос). Разовую дозу 2 мкл тестируемого GDNF вводили путем инфузии в левое полушарие в течение 4 мин при скорости потока 0,5 мкл/мин и оставляли катетер на месте в течение дополнительных 3 мин после прекращения инфузии. Сразу после удаления катетера место разреза зашивали, вводили послеоперационный анальгетик, а затем позволяли животному восстановиться в клетке с контролируемой температурой. Через подходящий промежуток времени после инфузии умерщвляли животное и головной мозг удаляли и замораживали до момента изготовления криосрезов для иммуногистохимии. Иммуногистохимическое исследование (ИГХ) GDNF в головном мозге крысы. Биораспределение введенного GDNF исследовали в иммуногистохимическом анализе, в котором измеряли связывание антитела с введенным путем инфузии антигеном (GDNF и вариантами GDNF) в головном мозге крыс. Изотипическое контрольное антитело использовали в качестве отрицательного контроля. Получение криосрезов из замороженного головного мозга крыс начинали с отсекания мозжечка внутри криостата при -20C с использованием шаблона головного мозга крысы для получения плоской поверхности. Состав Optimal Cutting Temperature (ОСТ, от Sakura или других аналогичных поставщиков) помещали на охлажденный криостатный фиксатор для образца. По мере замерзания ОСТ плоскую каудальную поверхность головного мозга крысы помещали на фиксатор для образца, применяя охлажденный до -20 С пинцет, таким образом, что ОСТ закреплял головной мозг на месте, при этом самая передняя часть головного мозга была повернута в направлении от фиксатора образца. Фиксатор для образца помещали в держатель объекта и закрепляли. После того как лезвие микротома было вставлено в держатель ножа, использовали функцию подрезки на криостате, чтобы отбросить обонятельные луковицы, а также часть головного мозга, расположенную спереди от следа инфузии. Делали срезы толщиной 8 мкм с интервалами по 300 мкм и помещали на положительно заряженные предметные стекла. На каждое предметное стекло помещали по два или три сделанных подряд среза для каждого головного мозга крысы. Стекла затем помещали в 4% параформальдегид при комнатной температуре на 20 мин и промывали в буфере для промывки - буферном растворе трис, содержащем Tween-20 (TBST). Применяя раствор для окрашивания при комнатной температуре, стекла инкубировали в течение 10 мин с двойным реагентом для блокировки эндогенных ферментов, промывали буфером для промывки TBST, инкубировали в течение 15 мин с каждым из блокирующих реагентов авидином и биотином, промывали буфером для промывки TBST, блокировали с помощью блокировки белка в течение 60 мин и сдували со стекла, применяя воздушный нож. Биотинилированное антитело против GDNF человека или биотинилированные IgG козы разбавляли в разбавителе для антител с агентами, уменьшающими фоновое окрашивание, до концентрации 2 мкг/мл и инкубировали с ними стекла в течение 60 мин, затем трижды промывали буфером для промывки TBST. Стекла инкубировали с меченым стрептавидином-биотином 2 (LSAB2) (Dako, номер в каталоге K0609) в течение 10 мин и промывали буфером для промывки TBST. Стекла инкубировали сDAB+ 2 капли DAB в разбавителе DAB в течение 5 мин, затем промывали буфером для промывки TBST,а затем споласкивали дистиллированной водой. После удаления стекол из автоматизированной системы окрашивания (автостейнера), осуществляли контрастное окрашивание гематоксилином и заклеивали покровными стеклами, применяя Cytoseal XYL (Stephens Scientific, номер в каталоге 8312-4). Стеклам позволяли высохнуть, а затем анализировали их, применяя Aperio XT для измерения биораспределения. Измерение биораспределения GDNF в головном мозге крысы. Изображения со стекол получали с 20 увеличением с помощью сканирующей системы AperioScanScope XT (запускали программное обеспечение Controller версии 10.00.00.1805). Метаданные со стекол хранили в доступном через сеть программном обеспечении Spectrum (версии 10.0.1346.1806) от Aperio. Каждый срез головного мозга обводили вручную, применяя программное обеспечение для визуализации изображений ImageScope (версии 10.0.36.1805) от Aperio. Для первого исследования обводили срез целого головного мозга с наименьшим количеством видимых артефактов изготовления срезов. Для второго исследования обводили срез целого головного мозга, расположенный ближе всего к маркировке стекла. Каждый обведенный участок анализировали, применяя алгоритм "Positive Pixel Count" (версии 9) от Aperio [все параметры оставили установленными по умолчанию за исключением увеличения изображения = .01 и порога интенсивности Слабый (верхний предел) = 235]. Площадь распределения GDNF в мм 2 для каждой крысы вычисляли путем сложения положительных и резко положительных площадей, вычисленных с помощью алгоритма положительных пикселей. Статистическую значимость определяли с помощью парного критерия Стьюдента. Таблица 14 Биораспределение GDNFv в головном мозге крысы Для 31, p0,003 по сравнению со средой, IgG и E.coli-ДТ-GDNF, Статистически значимый по сравнению с E. coli ДТ-GDNF, p0,05 Результаты ELISA по связыванию гепарина (табл. 9) показали, что модификации, введенные вGDNF дикого типа, могут уменьшать связывание с гепарином по сравнению с E. coli-ДТ GDNF. Эти результаты вместе с результатами эксперимента по биораспределению, показанными выше в табл. 14, подтверждают, что варианты, которые уменьшают связывание с гепарином, могут приводить к повышению биораспределения в головном мозге крысы. Варианты N38Q-D95E и N38Q-K84A-R88K-R90K-D95E, перечисленые в таблице выше, обладают повышенным биораспределением по сравнению с E. coli-ДТGDNF. Новые варианты GDNF согласно настоящему изобретению предпочтительно входят в состав фармацевтических композиций, которые можно вводить различными путями. В наиболее предпочтительном случае такие варианты GDNF предназначены для парентерального или интракраниального введения. Такие фармацевтические композиции и способы их получения хорошо известны в данной области. См.,например, Remington: The Science and Practice of Pharmacy (A. Gennaro, и др., ред., 19oe изд., Mack Publishing Co., 1995). Терапевтически эффективное количество представляет собой такое количество нового вариантаGDNF согласно настоящему изобретению, которое необходимо, чтобы принести пациенту терапевтическую пользу. Очевидно, что количество варианта GDNF, которое фактически вводят, должен определять врач в свете соответствующих обстоятельств, включая состояние, от которого лечат, выбранный путь введения, фактически вводимый активный агент, возраст, вес и ответ конкретного пациента, а также тяжесть симптомов пациента.SEQ ID NO: 4: AK - нативный секреторный сигнальный пептид GDNF человека.SEQ ID NO: 18: ДНК - нативный секреторный сигнальный пептид GDNF человека.SEQ ID NO: 25: AK - секреторный сигнальный лидерный пептид каппа мыши (MKL).SEQ ID NO: 26: ДНК - секреторный сигнальный лидерный пептид каппа мыши (MKL).SEQ ID NO: 31: AK - лидерный пептид каппа мыши-консенсусная последовательность вариантов.SEQ ID NO: 32: AK - секреторный сигнальный пептид гормона роста человека (hGH).SEQ ID NO: 33: ДНК - секреторный сигнальный пептид гормона роста человека (hGH). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Вариант GDNF (нейротрофического фактора глиальных клеток) человека, содержащий последовательность аминокислот SEQ ID NO: 23v) Xaa130 представляет собой R или E. 2. Вариант GDNF человека по п.1, отличающийся тем, что указанный вариант выбран из группы,состоящей из 3. Вариант GDNF человека по п.2, отличающийся тем, что указанный вариант представляет собой 4. Вариант GDNF человека по п.2, отличающийся тем, что указанный вариант представляет собой 5. Вариант GDNF человека по п.2, отличающийся тем, что указанный вариант представляет собой
МПК / Метки
МПК: C07K 14/475, A61K 38/18
Метки: глиальных, человека, gdnf, нейротрофического, фактора, варианты, клеток
Код ссылки
<a href="https://eas.patents.su/30-25129-varianty-nejjrotroficheskogo-faktora-glialnyh-kletok-gdnf-cheloveka.html" rel="bookmark" title="База патентов Евразийского Союза">Варианты нейротрофического фактора глиальных клеток (gdnf) человека</a>
Предыдущий патент: Лекарственная форма для целевого высвобождения активных веществ
Следующий патент: Композиции с высокой долей хондроитинсульфата и глюкозамина
Случайный патент: Способ получения защищенных производных l-аланина












