Антитела, связывающие cd27 человека, и их применение
Номер патента: 24701
Опубликовано: 31.10.2016
Авторы: Марш Генри К., Келер Тибор, Томас Лоренс Дж., Витале Лаура А., Хе Личжэнь
Формула / Реферат
1. Выделенное моноклональное антитело, которое связывается с CD27 человека и индуцирует или усиливает иммунный ответ, опосредованный Т-клетками, где указанное антитело включает:
(i) CDR1 вариабельной области тяжелой цепи, включающий SEQ ID NO:38; CDR2 вариабельной области тяжелой цепи, включающий SEQ ID NO:39; CDR3 вариабельной области тяжелой цепи, включающий SEQ ID NO:40; CDR1 вариабельной области легкой цепи, включающий SEQ ID NO:44; CDR2 вариабельной области легкой цепи, включающий SEQ ID NO:45, и CDR3 вариабельной области легкой цепи, включающий SEQ ID NO:46; или
(ii) вариабельную область тяжелой цепи и вариабельную область легкой цепи, включающие аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотным последовательностям SEQ ID NO:37 и 43 соответственно; или
(iii) вариабельную область тяжелой цепи и вариабельную область легкой цепи, включающие аминокислотную последовательность, по меньшей мере на 95% идентичную аминокислотным последовательностям SEQ ID NO:37 и 43 соответственно; или
(iv) вариабельную область тяжелой цепи и вариабельную область легкой цепи, кодируемые нуклеотидными последовательностями, по меньшей мере на 90% идентичными нуклеотидным последовательностям SEQ ID NO:35 и 41 соответственно.
2. Выделенное моноклональное антитело по п.1, где указанное антитело содержит CDR1 вариабельной области тяжелой цепи, включающий SEQ ID NO:38; CDR2 вариабельной области тяжелой цепи, включающий SEQ ID NO:39; CDR3 вариабельной области тяжелой цепи, включающий SEQ ID NO:40; CDR1 вариабельной области легкой цепи, включающий SEQ ID NO:44; CDR2 вариабельной области легкой цепи, включающий SEQ ID NO:45, и CDR3 вариабельной области легкой цепи, включающий SEQ ID NO:46.
3. Выделенное моноклональное антитело по п.1 или 2, где антитело содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, включающие аминокислотные последовательности SEQ ID NO:37 и 43 соответственно.
4. Выделенное моноклональное антитело по п.1 или п.2, где антитело содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, кодируемые нуклеотидными последовательностями SEQ ID NO:35 и 41 соответственно.
5. Выделенное моноклональное антитело по любому из предшествующих пунктов, проявляющее по меньшей мере одно из следующих свойств:
a) блокирование связывания sCD70 с CD27 по меньшей мере на 70% при концентрации антител 10 мкг/мл;
b) связывание с CD27 человека с равновесной константой диссоциации Kd, равной 109 M или менее, или, альтернативно, с равновесной константой ассоциации Ka, равной 10+9 М-1 или более;
c) индукцию специфической комплемент-опосредованной цитотоксичности (CDC) по отношению к клеткам, экспрессирующим CD27, по меньшей мере на 10% при концентрации антител 3 мкг/мл и приблизительно 6% комплемента сыворотки кролика;
d) индукцию срецифического лизиса клеток, экспрессирующих CD27, вызванного антителозависимой клеточно-опосредованной цитотоксичностью (ADCC), по меньшей мере на 10% при концентрации антител 3 мкг/мл и соотношении эффекторных клеток и клеток-мишеней 75:1;
e) повышение медианы выживаемости по меньшей мере на 20% у мышей с тяжелой комбинированной иммунной недостаточностью (ТКИН) после инокуляции опухолевых клеток in vivo (5´105 клеток Раджи или 1´106 клеток Дауди) при введении 0,3 мг (внутрибрюшинно) по меньшей мере дважды в неделю на протяжении 3 недель по сравнению с мышами, которым не вводили антитела;
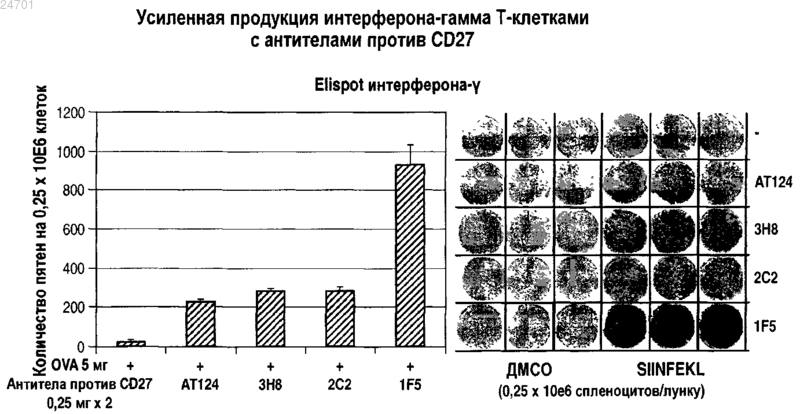
f) индукцию или усиление антигенспецифического иммунного ответа in vivo в комбинации с вакциной или эндогенным антигеном;
g) индукцию или усиление антигенспецифического иммунного ответа ТН1 in vivo в комбинации с вакциной или эндогенным антигеном;
h) индукцию или усиление антигенспецифической пролиферации или активации Т-клеток in vivo в комбинации с вакциной или эндогенным антигеном;
i) индукцию или усиление активности Т-клеток в комбинации с одновременной, раздельной или последовательной активацией TCR;
j) уменьшение количества CD3+ Т-клеток (не являющихся NK-клетками) у макак менее чем на 50% при введении в количестве 3 мг/кг (в/в) на протяжении периода 29 суток непосредственно после введения; или
k) уменьшение количества В-клеток памяти у макак менее чем на 50% при введении в количестве 3 мг/кг (в/в) на протяжении периода 29 суток непосредственно после введения.
6. Антитело по любому из предшествующих пунктов, где антитело выбрано из:
(i) антител IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgD и IgE; и/или
(ii) антитела человека, гуманизированного или химерного антитела.
7. Биспецифическая молекула, включающая антитело по любому из предшествующих пунктов, связанное со второй молекулой, специфичность связывания которой отличается от специфичности антитела.
8. Биспецифическая молекула по п.7, где вторая молекула связывается с Fc-рецептором, NK-рецептором или Т-клеточным рецептором, выбранным из группы, состоящей из CD3, CD40 и CD25.
9. Экспрессирующий вектор, содержащий нуклеотидную последовательность, кодирующую вариабельную область легкой цепи и/или тяжелой цепи антитела по любому из пп.1-6.
10. Клетка, трансформированная экспрессирующим вектором по п.9.
11. Композиция для индуцирования или усиления иммунного ответа против антигена у субъекта, включающая эффективное количество антитела по любому из пп.1-6 или биспецифической молекулы по п.7 или 8.
12. Композиция по п.11, дополнительно включающая:
(i) адъювант и/или иммуностимулятор; или
(ii) по меньшей мере одно второе антитело, которое индуцирует или усиливает иммунный ответ, и/или антиген.
13. Композиция по п.12, где иммуностимулятор выбран из группы, состоящей из лиганда CD40, лиганда FLT 3, цитокинов, колониестимулирующих факторов, LPS (эндотоксина), оцРНК, дцРНК, бациллы Кальметта-Герена (BCG), левамизола гидрохлорида, иммуноглобулинов для внутривенного введения и агониста Toll-подобного рецептора (TLR).
14. Композиция по п.13, где агонист Toll-подобного рецептора (TLR) представляет собой агонист TLR3, агонист TLR4, агонист TLR5, агонист TLR7, агонист TLR8 или агонист TLR9.
15. Композиция по п.12, где антиген включает компонент патогенного организма, аллерген, аутоантиген или опухолевый антиген.
16. Композиция по п.15, где опухолевый антиген представляет собой βhCG, gp100 или Pmel17, HER2/neu, WT1, мезотелин, CEA, gp100, MART1, TRP-2, melan-A, NY-ESO-1, NY-BR-1, NY-CO-58, MN (gp250), набор идиотипических детерминант, MAGE-1, MAGE-3, MAGE-А3, тирозиназа, теломераза, антигены SSX2, антигены MUC-1 или опухолевые антигены эмбрионального происхождения.
17. Композиция по п.12, где второе антитело связывает CTLA-4, PD-1, 41BB или ОХ-40.
18. Способ индукции или услления иммунного ответа на антиген у субъекта, включающий введение субъекту антитела по любому из пп.1-6 или композиции по п.11 или 12 в количестве, достаточном для индукции или усиления иммунного ответа на антиген.
19. Способ ингибирования роста клеток, экспрессирующих CD27, включающий приведение в контакт клеток с антителом по любому из пп.1-6, или композицией по п.11 или 12 в количестве, эффективном для ингибирования роста клеток, экспрессирующих CD27.
20. Способ ингибирования связывания CD70 с CD27 на клетках, включающий введение антитела по любому из пп.1-6.
21. Способ лечения рака, включающий введение субъекту антитела по любому из пп.1-6.
22. Способ детектирования CD27 в биологическом образце, включающий
приведение в контакт биологического образца с антителом по любому из пп.1-6, где антитело мечено обнаруживаемым веществом, и
обнаружение антитела, связанного с CD27, что свидетельствует о наличии CD27 в биологическом образце.
Текст
Изобретение относится к выделенному моноклональному антителу, которое связывается с CD27 человека и индуцирует или усиливает иммунный ответ, опосредованный Т-клетками. Изобретение также относится к биспецифической молекуле, включающей указанное антитело, связанное со второй молекулой, специфичность связывания которой отличается от специфичности антитела. Кроме того, изобретение также раскрывает композицию на основе указанных антитела или биспецифической молекулы и способы индукции или усиления иммунного ответа, ингибирования роста клеток, экспрессирующих CD27, лечения рака и детектирования наличия или отсутствия CD27 в биологическом образце с использованием указанных антител. Уровень техники Во взаимодействии между Т-клетками и антигенпрезентирующими клетками участвуют разнообразные вспомогательные молекулы, облегчающие развитие иммунного ответа. Одной из таких молекул является CD27, связывающий CD70 и принадлежащий к надсемейству рецепторов факторов некроза опухолей (TNF-R, ФНО-Р) (Ranheim EA, et al., Blood. 1995 June 15;85(12):3556-65). CD27 обычно существует в виде гликозилированного трансмембранного белка типа I, часто в форме гомодимеров с дисульфидным мостиком, связывающим два мономера. Дисульфидный мостик располагается в пределах внеклеточного домена вблизи от мембраны (Camerini et al., J Immunol. 147:3165-69 (1991). CD27 также может экспрессироваться в растворимой форме (см., например, van Oers MH, et al., Blood. 1993 Dec 1; 82(11):3430-6 и Loenen WA, et al., Eur. J. Immunol. 22:447, 1992). Перекрестное связывание антигенаCD27 на поверхности Т-клеток обеспечивает костимулирующий сигнал, который совместно с перекрестным связыванием рецептора Т-клеток может вызывать пролиферацию Т-клеток и активацию клеточного иммунитета.CD27 экспрессируется на поверхности зрелых тимоцитов, большинства CD4 + и CD8+ Т-клеток периферической крови, NK-клеток и В-клеток (Kobata T, et al., Proc. Natl. Acad. Sci. US A. 1995 Nov 21; 92(24):11249-53). Высокий уровень экспрессии CD27 также наблюдается при В-клеткочных неходжкинских лимфомах и В-клеточных хронических лимфолейкозах (Ranheim EA, et al., Blood. 1995 Jun 15; 85(12):3556-65). Кроме того, повышенный уровень растворимого белка CD27 обнаружен в сыворотке или в областях, пораженных заболеванием, при паразитарной инфекции, цитомегаловирусной (ЦМВ) инфекции, саркоидозе, рассеянном склерозе и В-клеточном лимфолейкозе (Loenen WA, et al., Eur. J. Immunol. 22:447, 1992). Показано, что агонистические моноклональные антитела против CD27 стимулируют Т-клеточный ответ и являются перспективными противораковыми терапевтическими средствами (см., например, Sakanishi T, et al., Biochem Biophys. Res. Commun. 2010 Feb 18 и WO 2008/051424). В то же время, хотя,согласно современным данным, CD27 является пригодной для иммунотерапии мишенью, неизвестно,какие конкретные свойства моноклональных антител против CD27 являются особенно выгодными для терапевтических целей. В силу этого в данной области техники существует потребность в дополнительной информации о специфических функциональных свойствах, обеспечивающих терапевтическую эффективность антител против CD27, а также в усовершенствованных терапевтических антителах противCD27, более эффективных для лечения и/или предотвращения заболеваний. Сущность изобретения Настоящее изобретение представляет, в числе прочего, выделенные антитела против CD27, обладающие некоторыми функциональными свойствами, которые могут быть связаны с выгодным и желательным терапевтическим действием. Настоящее изобретение относится к выделенному моноклональному антителу, которое связывается с CD27 человека и индуцирует или усиливает иммунный ответ, опосредованный Т-клетками, где указанное антитело включает:(i) CDR1 вариабельной области тяжелой цепи, включающий SEQ ID NO:38; CDR2 вариабельной области тяжелой цепи, включающий SEQ ID NO:39; CDR3 вариабельной области тяжелой цепи, включающий SEQ ID NO:40; CDR1 вариабельной области легкой цепи, включающий SEQ ID NO:44; CDR2 вариабельной области легкой цепи, включающий SEQ ID NO:45, и CDR3 вариабельной области легкой цепи, включающий SEQ ID NO:46; или(ii) вариабельную область тяжелой цепи и вариабельную область легкой цепи, включающие аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотным последовательностям SEQ ID NO:37 и 43, соответственно; или(iii) вариабельную область тяжелой цепи и вариабельную область легкой цепи, включающие аминокислотную последовательность, по меньшей мере на 95% идентичную аминокислотным последовательностям SEQ ID NO:37 и 43, соответственно; или(iv) вариабельную область тяжелой цепи и вариабельную область легкой цепи, кодируемые нуклеотидными последовательностями, по меньшей мере на 90% идентичными нуклеотидным последовательностям SEQ ID NO:35 и 41, соответственно. В одном из вариантов осуществлени выделенное моноклональное антитело содержит CDR1 вариабельной области тяжелой цепи, включающий SEQ ID NO:38; CDR2 вариабельной области тяжелой цепи,включающий SEQ ID NO:39; CDR3 вариабельной области тяжелой цепи, включающий SEQ ID NO:40;CDR1 вариабельной области легкой цепи, включающий SEQ ID NO:44; CDR2 вариабельной области легкой цепи, включающий SEQ ID NO:45, и CDR3 вариабельной области легкой цепи, включающий SEQ IDNO:46. В еще одном варианте осуществления выделенное моноклональное антитело содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, включающие аминокислотные последовательности SEQ ID NO:37 и 43, соответственно. В другом варианте осуществления выделенное моноклональное антитело содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, кодируемые нуклеотидными последователь-1 024701 ностями SEQ ID NO:35 и 41, соответственно. В следующем варианте осуществления выделенное моноклональное антитело проявляет по меньшей мере одно из следующих свойств:a) блокирование связывания sCD70 с CD27 по меньшей мере на 70% при концентрации антител 10 мкг/мл;b) связывание с CD27 человека с равновесной константой диссоциации Kd, равной 10-9 М или менее, или, альтернативно, с равновесной константой ассоциации Ка, равной 10+9 M-1 или более;c) индукцию специфической комплемент-опосредованной цитотоксичности (CDC) по отношению к клеткам, экспрессирующим CD27, по меньшей мере на 10% при концентрации антител 3 мкг/мл и приблизительно 6% комплемента сыворотки кролика;d) индукцию срецифического лизиса клеток, экспрессирующих CD27, вызванного антителозависимой клеточно-опосредованной цитотоксичностью (ADCC), по меньшей мере на 10% при концентрации антител 3 мкг/мл и соотношении эффекторных клеток и клеток-мишеней 75:1;e) повышение медианы выживаемости по меньшей мере на 20% у мышей с тяжелой комбинированной иммунной недостаточностью (ТКИН) после инокуляции опухолевых клеток in vivo (5105 клеток Раджи или 1106 клеток Дауди) при введении 0,3 мг (внутрибрюшинно) по меньшей мере дважды в неделю на протяжении 3 недель по сравнению с мышами, которым не вводили антитела;f) индукцию или усиление антигенспецифического иммунного ответа in vivo в комбинации с вакциной или эндогенным антигеном; д) индукцию или усиление антигенспецифического иммунного ответа ТН 1 in vivo в комбинации с вакциной или эндогенным антигеном;h) индукцию или усиление антигенспецифической пролиферации или активации Т-клеток in vivo в комбинации с вакциной или эндогенным антигеном;i) индукцию или усиление активности Т-клеток в комбинации с одновременной, раздельной или последовательной активацией TCR;j) уменьшение количества CD3+ Т-клеток (не являющихся NK-клетками) у макак менее чем на 50% при введении в количестве 3 мг/кг (в/в) на протяжении периода 29 суток непосредственно после введения; илиk) уменьшение количества В-клеток памяти у макак менее чем на 50% при введении в количестве 3 мг/кг (в/в) на протяжении периода 29 суток непосредственно после введения. В другом варианте осуществления антитело выбирается из(ii) антитела человека, гуманизированного или химерного антител. Настоящее изобретение таже относится к биспецифической молекуле, включающей антитело по любому из предшествующих пунктов, связанное со второй молекулой, специфичность связывания которой отличается от специфичности антитела. В одном из вариантов осуществления указанная вторая молекула связывается с Fc-рецептором, NKрецептором или Т-клеточным рецептором, выбранным из группы, состоящей из CD3, CD40 и CD25. Кроме того, настоящее изобретение относится к экспрессирующему вектору, содержащему нуклеотидную последовательность, кодирующую вариабельную область легкой цепи и/или тяжелой цепи антитела по изобретению. Настоящее изобретение также относится к клетке, трансформированной экспрессирующим вектором. Дополнительно настоящее изобретение также относится к композиции для индуцирования или усиления иммунного ответа против антигена у субъекта, включающей эффективное количество антитела или биспецифической молекулы по изобретению. В одном из вариантов осуществления композиция также включает:(ii) по меньшей мере одно второе антитело, которое индуцирует или усиливает иммунный ответ,и/или антиген. В частности, композиция включает иммуностимулятор, выбранный из группы, состоящей из лиганда CD40, лиганда FLT 3, цитокинов, колониестимулирующих факторов, LPS (эндотоксина), оцРНК,дцРНК, бациллы Кальметта-Герена (BCG), левамизола гидрохлорида, иммуноглобулинов для внутривенного введения и агониста Toll-подобного рецептора (TLR). В еще одном варианте осуществления агонист Toll-подобного рецептора (TLR) представляет собой агонист TLR3, агонист TLR4, агонист TLR5, агонист TLR7, агонист TLR8 или агонист TLR9. В следующем варианте осуществления изобретения антиген включает компонент патогенного организма, аллерген, аутоантиген или опухолевый антиген. Изобретение также относится к композиции, в которой опухолевый антиген представляет собойhCG, gp100 или Pmel17, HER2/neu, WT1, мезотелин, CEA, gp100, MART1, TRP-2, melan-A, NY-ESO-1,NY-BR-1, NY-CO-58, MN (gp250), набор идиотипических детерминант, MAGE-1, MAGE-3, MAGE-А 3,-2 024701 тирозиназа, теломераза, антигены SSX2, антигены MUC-1 или опухолевые антигены эмбрионального происхождения. В одном из вариантов осуществления композиция включает второе антитело, которое связываетCTLA-4, PD-1, 41BB или ОХ-40. Изобретение также относится к способу индукции или усиления иммунного ответа на антиген у субъекта, включающему введение субъекту антитела по изобретению или композиции по изобретению, в количестве, достаточном для индукции или усиления иммунного ответа на антиген. Кроме того, изобретение также относится к способу ингибирования роста клеток, экспрессирующихCD27, включающему приведение в контакт клеток с антителом или композицией по изобретению в количестве, эффективном для ингибирования роста клеток, экспрессирующих CD27. Изобретение также относится к способу ингибирования связывания CD70 с CD27 на клетках, включающему введение антитела по изобретению. В частности, изобретение относится также к способу лечения рака, включающему введение субъекту антитела по изобретению. Также в объем изобретения входит способ детектирования наличия или отсутствия CD27 в биологическом образце, включающий:a) приведение в контакт биологического образца с антителом по изобретению, где антитело мечено обнаруживаемым веществом, иb) обнаружение антитела, связанного с CD27, для детектирования посредством этого наличия или отсутствия CD27 в биологическом образце. Другие свойства и преимущества настоящего изобретения будут очевидны из следующего подробного описания и формулы изобретения. Краткое описание чертежей На фиг. 1 изображены сродство и кинетические параметры моноклональных антител 1G5, 1 Н 8,3 Н 12, 3 Н 8, 2G9, 1F5, 3 А 10, 2C2, ms 1A4, ms 9F4 и ms M-T271, определенные с помощью программного обеспечения BiacoreBiaEvaluation (Biacore AB) при использовании рекомбинантного CD27 человека,иммобилизованного на чипе. Фиг. 2 представляет собой график, показывающий связывание антител человека против CD27 (2C2,3 Н 8, 1F5, 1G5, 1 Н 8, 2G9, 3 А 10 и 3 Н 12) с рекомбинантным очищенным CD27 человека при использовании ELISA. Фиг. 3 представляет собой график, показывающий связывание в ходе ELISA 1F5 с очищенным рекомбинантным CD27 человека или обезьяны (макака). Фиг. 4 представляет собой график, изображающий действие антител человека против CD27 (2C2,3 Н 8, 1F5, 1G5, 1 Н 8, 2G9, 3 А 10 и 3 Н 12) и MsIgG (1 А 4, 9F4 и M-Т 271) на связывание растворимого CD70(sCD70) с белком CD27 (показано как % блокирования) при использовании ELISA. Фиг. 5 представляет собой результат проточного цитометрического анализа связывания 1F5 с клетками лимфобластоидной линии человека и блокирования связывания с SCD70. Фиг. 6A-D представляют собой графики, показывающие связывание антител человека против CD27(2C2, 3 Н 8 и 1F5) с CD27 на поверхности клеток Jurkat (фиг. 4 А), клеток Раджи (фиг. 4 В), клеток Ramos(фиг. 4C) и клеток Дауди (фиг. 4D) согласно оценке с помощью проточной цитометрии. Фиг. 7 представляет собой график, показывающий связывание антител человека против CD27 (2C2,3 Н 8, 1F5, 1G5, 1 Н 8, 2G9, 3 А 10 и 3 Н 12) с CD27 на поверхности клеток Дауди согласно оценке с помощью проточной цитометрии. Фиг. 8 представляет собой гистограмму, показывающую результаты эксперимента на основе ELISA по перекрестному блокированию антител против CD27, демонстрирующую, что антитела 1F5, 1 Н 8 и 3 Н 12 способны перекрестно блокировать друг друга и, таким образом, связываются с одним и тем же зпитопом. Фиг. 9 представляет собой гистограмму, показывающую результаты эксперимента на основе ELISA по перекрестному блокированию антител против CD27, демонстрирующую, что антитела 2 С 2, 3 Н 8, 1G5 и 2G9 способны перекрестно блокировать друг друга и, таким образом, связываются с одним и тем же эпитопом. Фиг. 10 представляет собой гистограмму, показывающую результаты эксперимента на основе ELISA по перекрестному блокированию антител против CD27, демонстрирующую, что связывание антитела 3 А 10 с CD27 не полностью перекрестно блокируется любым из других протестированных антител против CD27, таким образом, указывая на то, что 3 А 10 связывается с уникальным эпитопом, однако связывание 3 А 10 частично перекрестно блокируется антителами 1F5, 1 Н 8 и 3 Н 12, что указывает на возможную схожесть эпитопа для 3 А 10 с эпитопом, связываемым антителами 1F5, 1 Н 8 и 3 Н 12. Фиг. 11 представляет собой график, иллюстрирующий результаты анализа комплемент-зависимой клеточной цитотоксичности (CDCC) с использованием моноклональных антител 1F5, 2C2, 3 Н 8, 1G5,1 Н 8, 2G9, 3 А 10 и 3 Н 12. Фиг. 12 представляет собой график, иллюстрирующий результаты дальнейшего анализа комплемент-зависимой клеточной цитотоксичности (CDCC) с использованием моноклональных антител 1F5.-3 024701 Фиг. 13 представляет собой график, иллюстрирующий результаты анализа антителозависимой клеточно-опосредованной цитотоксичности (ADCC) с использованием моноклональных антител 2C2, 1F5,3 Н 8, 1G5, 1 Н 8, 2G9, 3 А 10, 3 Н 12, ритуксан и HuIgG. Фиг. 14 представляет собой график, иллюстрирующий результаты дальнейшего анализа антителозависимой клеточно-опосредованной цитотоксичности (ADCC) с использованием моноклональных антител 1F5. Фиг. 15 представляет собой выравнивание последовательностей VH антител человека против CD27(1F5, 1G5, 1 Н 8, 2 С 2, 2G9, 3 А 10, 3 Н 12 и 3 Н 8). Фиг. 16 представляет собой выравнивание последовательностей VL антител человека против CD27(1F5, 1G5, 1 Н 8, 2C2, 2G9, 3 А 10, 3 Н 12 и 3 Н 8). На фиг. 17 и 18 показаны результаты исследования с использованием моноклональных антител 1F5in vivo на нечеловекообразных приматах. В частности, на фиг. 17 показаны 1F5 на циркулирующих лимфоцитах после введения однократной дозы. На фиг. 18 показано, что 1F5 не приводят к значительному уменьшению количества циркулирующих лимфоцитов. На фиг. 19 изображены результаты анализа окрашивания пентамером на клетках периферической крови и спленоцитах мыши. На фиг. 20 изображены результаты анализа ELISPOT анализа и усиленное продуцирование IFN с помощью антител против CD27. На фиг. 21 показано усиливающее действие моноклональных антител против CD27 на Т-клеточный ответ на вакцинный антиген у модели трансгенной мыши с помощью окрашивания пентамером и ELISPOT интерферона. Фиг. 22 А-C представляют собой протокол и результаты эксперимента, показывающего, что антитела против CD27 усиливают Т-клеточный ответ на вакцину X-DEC205-OVA), мишенью которой являются АПК. На фиг. 22 А показан протокол эксперимента. На фиг. 22 В показаны результаты эксперимента по измерению антиген-специфических Т-клеток путем окрашивания тетрамерами. На фиг. 22C показаны результаты измерения антиген-специфических Т-клеток путем анализа ELISPOT интерферона-гамма. Фиг. 23A-D представляют собой результаты эксперимента, показывающего, что антитела противCD27 в комбинации с агонистом TLR3 PolyIC (в количестве 25 мкг, 50 мкг или 100 мкг) усиливают Тклеточный ответ на вакцину (-DEC205-OVA), мишенью которой являются АПК. Фиг. 23 А представляет собой график, показывающий % интерферон-гамма-положительных клеток среди CD8+ Т-клеток у мышей дикого типа, обработанных poly IC и моноклональными антителами 1F5 против CD27, huCD27-трансгенных мышей, обработанных poly IC и контрольными IgG1-антителами человека или huCD27-трансгенных мышей, обработанных poly IC и моноклональными антителами 1F5 против CD27. На фиг. 24 и 25 показаны результаты исследования введения моноклональных антител против CD27 до введения вакцины в присутствии или в отсутствие агониста TLR и значение расписания введения антитела относительно вакцины. На фиг. 26 и 27 показаны результаты от введения моноклональных антител против CD27 в комбинации с TCR-активацией Т-клеток мышей, трансгенных по CD27 человека, согласно как пролиферации,так и продукции цитокина. Фиг. 28A-D представляют собой протокол и результаты эксперимента, показывающего, что антитела против CD27 повышают эффективность вакцины (X-DEC205-OVA в МО 4 (B16-OVA) на модели вызванной меланомы. На фиг. 24 А показан протокол эксперимента. Фиг. 24 В представляет собой график размера опухоли (в мм 2) от количества дней после инокуляции опухоли в организмы мышей, не подвергавшихся лечению. Фиг. 24 С представляет собой график размера опухоли (в мм 2) от количества дней после инокуляции опухоли в организмы мышей, подвергавшихся лечению только вакциной. Фиг. 24D представляет собой график размера опухоли (в мм 2) от количества дней после инокуляции опухоли в организмы мышей, подвергавшихся лечению вакциной в комбинации с антителом против CD27. Фиг. 29 А и В представляют собой графики, показывающие длительное выживание мышей, трансгенных по CD27 человека (модели опухоли) после стимуляции сингенной лимфомой и введения различных доз моноклональных антител 1F5 против CD27. На фиг. 30-32 показаны результаты эксперимента по проверке эффекта от лечения антителами против CD27 на модели ксенотрансплантата Раджи в организмах ТКИН-мышей. На фиг. 30 А показан график размера опухоли (в мм 3) от количества дней после инокуляции опухоли в организмы мышей, не подвергавшихся лечению, подвергавшихся лечению контрольными IgG1 антителами человека или антителами 1F5 и 3 Н 8 против CD27. Стрелками указаны дни лечения антителами путем внутрибрюшинных инъекций. На фиг. 30 В показано выживание на графике Каплана-Мейера. На фиг. 31 А показан график размера опухоли (в мм 3) от количества дней после инокуляции опухоли в организмы мышей, не подвергавшихся лечению, подвергавшихся лечению контрольными IgG1-4 024701 антителами человека или антителами 1F5 против CD27. Стрелками указаны дни лечения антителами путем внутрибрюшинных инъекций. На фиг. 31 В показано выживание на графике Каплана-Мейера. На фиг. 32 показаны результаты дальнейшего эксперимента по проверке эффекта от лечения антителами против CD27 на модели ксенотрансплантата Раджи в организмах ТКИН-мышей на графике Каплана-Мейера. На фиг. 33 показаны результаты эксперимента по проверке эффекта от лечения антителами противCD27 на модели ксенотрансплантата Дауди в организмах ТКИН-мышей. На фиг. 33 А показан график размера опухоли (в мм 3) от количества дней после инокуляции опухоли в организмы мышей, подвергавшихся лечению контрольными IgG1-антителами человека или антителами 1F5 против CD27 (0,1 мг или 0,3 мг). Стрелками указаны дни лечения антителами путем внутрибрюшинных инъекций. На фиг. 33 В показано выживание на графике Каплана-Мейера. На фиг. 34 показаны результаты анализа ELISPOT и невозможность усиленного антигенспецифического продуцирования интерферона-гамма с помощью антитела против CD27 при неспособности Fc-фрагмента IgG связывать Fc-рецепторы. Подробное описание изобретения Настоящее изобретение представляет антитела против CD27, обладающие определенными функциональными свойствами, соотносящимися со значительными терапевтическими преимуществами,включая стимуляцию иммунитета (например, иммунного ответа, опосредованного Т-клетками, при вакцинной терапии, активацию NK-клеток при лечении рака), подавление роста клеток (например, при лечении рака) и подавление иммунных реакций, опосредованных Т-клетками (например, при лечении аутоиммунных заболеваний). Указанные функциональные свойства включают, например: (1) ингибирование (например, полное или частичное блокирование) связывания растворимого CD70 с клетками, экспрессирующими CD27, по меньшей мере, приблизительно на 70%, более того, например, по меньшей мере, на 80% или, по меньшей мере, на 90% (2) связывание с CD27 человека с KD, равной 110-9 M или менее, (3) индукцию, по меньшей мере, приблизительно 40% комплемент-опосредованной цитотоксичности (CDC) клеток, экспрессирующих CD27, в концентрации 10 мкг/мл, (4) индукцию, по меньшей мере, приблизительно 40% специфического лизиса клеток, экспрессирующих CD27, за счет ADCC в концентрации 10 мкг/мл, (более того, например, по меньшей мере, приблизительно 50%, по меньшей мере,приблизительно 60% или, по меньшей мере, приблизительно 70% специфического лизиса), (5) индукцию усиления иммунного ответа, особенно TH1-ответа и/или (6) индукцию усиления активности Т-клеток,особенно количества и/или активности специфических CD8+ Т-клеток. В других вариантах воплощения антитела включают определенные последовательности вариабельных областей и/или CDR тяжелых и легких цепей. Для облегченного понимания настоящего изобретения сначала приводятся определения некоторых терминов. Дополнительные определения приведены на протяжении подробного описания. Термин "CD27" (также называемый "CD27 молекулой", "CD27L рецептором", "S1521", "антигеном активации Т-клеток CD27", "TNFRSF7", "MGC20393", "членом 7 надсемейства рецепторов факторов некроза опухолей", "антигеном активации Т-клеток S152", "Тр 55", "членом 7 надсемейства рецепторов факторов некроза опухолей", "антигеном CD27" и "антигеном активации Т-клеток CD27") относится к рецептору, являющемуся членом надсемейства TNF-рецепторов, который связывается с лигандом CD70.CD27 необходим для формирования и долгосрочного поддержания Т-клеточного иммунитета и играет ключевую роль в регуляции активации В-клеток и синтезе иммуноглобулинов. Термин "CD27" включает любые варианты или изоформы CD27, экспрессируемые клетками в природных условиях (например,CD27 человека, депонированный в GENBANK под номером доступа ААН 12160.1). Соответственно,антитела по изобретению могут перекрестно реагировать с CD27 видов животных, не являющихся человеком. В качестве альтернативы антитела могут быть специфичны к CD27 человека и не проявлять перекрестной активности по отношению к другим видам. CD27 или его любые варианты и изоформы могут быть выделены из клеток или тканей, экспрессирующих их в естественных условиях, или рекомбинантно продуцированы с использованием методик, известных в данной области техники и/или описанных здесь. Предпочтительно мишенью антител является hCD27, для которого характерна нормальная картина гликозилирования. По сообщению GenBank (номер доступа ААН 12160.1), аминокислотная последовательность CD27 человека представляет собой (SEQ ID NO:1): 1 marphpwwlc vlgtlvglsa tpapkscper hywaqgklcc qmcepgtflv kdcdqhrkaa 61 qcdpcipgvs fspdhhtrph cescrhcnsg llvrnctita naecacrngw qcrdkectec 121 dplpnpslta rssqalsphp qpthlpyvse mleartaghm qtladfrqlp artlsthwpp 181 qrslcssdfi rilvifsgmf lvftlagalf lhqrrkyrsn kgespvepae pcryscpree 241 egstipiqed yrkpepacsp Термин "CD70" (также называемый "молекулой CD70", "CD27L", "CD27LG", "TNFSF7", "членом 7 надсемейства (лигандов) факторов некроза опухолей", "лигандом CD27", "антигеном CD70", "поверхностным антигеном CD70", "членом 7 надсемейства лигандов факторов некроза опухолей", "антигеном Ki-5 024701 24" и "CD27-L") относится к лиганду CD27 (см., например, Bowman MR et al., J. Immunol. 1994 Feb 15; 152(4):1756-61). CD70 является трансмембранным белком II типа, который принадлежит к семейству лигандов факторов некроза опухолей (TNF, ФНО). Он представляет собой поверхностный антиген активированных Т- и В-лимфоцитах, индуцирующий пролиферацию костимулированных Т-клеток, усиливает образование цитолитических Т-клеток и вносит вклад в активацию Т-клеток. Кроме того, предполагают, что CD70 играет роль в регуляции активации В-клеток, цитотоксической функции NK-клеток и синтезе иммуноглобулинов (Hintzen RQ et al., J. Immunol. 1994 Feb 15; 152 (4):1762-73). По сообщению GenBank (номер доступа NP001243), аминокислотная последовательность CD70 человека представляет собой (SEQ ID NO:2): 1 mpeegsgcsv rrrpygcvlr aalvplvagl viclvvciqr faqaqqqlpl eslgwdvael 61 qlnhtgpqqd prlywqggpa lgrsflhgpe ldkgqlrihr dgiymvhiqv tlaicsstta 121 srhhpttlav gicspasrsi sllrlsfhqg ctiasqrltp largdtlctn ltgtllpsrn 181 tdetffgvqw vrp Термин "антитело", упоминаемый здесь, включает целые антитела и их антиген-связывающий фрагмент (т.е. "антиген-связывающую часть") одиночную цепь. В одном из предпочтительных вариантов воплощения "антитело" относится к гликопротеину, состоящему, по меньшей мере, из двух тяжелых (Н) цепей и двух легких (L) цепей, соединенных дисульфидными связями, или его антиген-связывающий фрагмент. Каждая тяжелая цепь включает вариабельную область тяжелой цепи (сокращенно обозначаемую здесь как VH) и константную область тяжелой цепи. Константная область тяжелой цепи включает три домена - CH1, CH2 и СН 3. Каждая легкая цепь включает вариабельную область легкой цепи (сокращенно обозначаемую здесь как VL) и константную область легкой цепи. Константная область легкой цепи включает один домен - CL. Области VH и VL также можно разделить на области гипервариабельности,называемые областями, определяющими комплементарность (CDR), перемежающиеся с более консервативными областями, называемыми каркасными областями (FR). Каждая VH и VL включает три CDR и четыре FR, выстроенных от N-конца к С-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3,CDR3, FR4. Вариабельные области тяжелых и легких цепей содержат связывающий домен, взаимодействующий с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (C1q) классической системы комплемента. Термин "антиген-связывающий фрагмент" антитела (или просто "фрагмент антитела"), как используется здесь, относится к одному или более фрагментам антитела, сохраняющим способность специфически связываться с антигеном (например, CD27 человека). Длина таких "фрагментов" находится в диапазоне, например, приблизительно от 8 до приблизительно 1500 аминокислот, соответственно, приблизительно от 8 до приблизительно 745 аминокислот, соответственно, приблизительно от 8 до приблизительно 300, например, приблизительно от 8 до приблизительно 200 аминокислот или приблизительно от 10 до приблизительно 50 или 100 аминокислот. Показано, что функцию связывания антитела с антигеном могут выполнять фрагменты полноразмерного антитела. Примеры связывающих фрагментов, охватываемых термином "антиген-связывающий фрагмент" антитела, включают (i) Fab-фрагмент - моновалентный фрагмент, состоящий из VL-, VH-, CL- и CH1-доменов; (ii) F (ab')2-фрагмент бивалентный фрагмент,включающий два Fab-фрагмента, соединенных дисульфидным мостиком в шарнирной области; (iii) Fdфрагмент, состоящий из VH- и CH1-доменов; (iv) Fv-фрагмент, состоящий из VL- и VH-доменов одиночного плеча антитела, (v) dAb-фрагмент (Ward et al., (1989) Nature 341:544-546), состоящий из VH-домена; и (vi) выделенную гипервариабельную область (CDR) или(vii) комбинацию двух или более выделенных CDR, необязательно объединенных с помощью синтетического линкера. Кроме того, хотя два домена Fv-фрагмента VL и VH кодируются отдельными генами, их можно объединить, используя рекомбинантные методики, с помощью синтетического линкера,позволяющего им продуцироваться в виде единой белковой цепи, в которой области VL и VH соединяются, образуя моновалентные молекулы (известные как одноцепочечные Fv (scFv); см., например, Bird et al.(1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Подразумевается, что такие одноцепочечные антитела также охватываются термином "антиген-связывающий фрагмент" антитела. Эти фрагменты антител получают с помощью общепринятых методик, известных специалистам в данной области техники; скрининг фрагментов на пригодность выполняют таким же образом, как и для интактных антител. Антиген-связывающие фрагменты можно получить с помощью методик рекомбинантных ДНК или путем ферментативного или химического гидролиза интактных иммуноглобулинов."Биспецифическое" или "бифункциональное антитело" представляет собой искусственное гибридное антитело, содержащее две различные пары тяжелых/легких цепей и два различных сайта связывания. Биспецифические антитела можно получить с помощью различных способов, включая слияние гибридом или соединение Fab'-фрагментов. См., например, SongsivilaiLachmann, Clin. Exp. Immunol. 79:315-321(1990); Kostelny et al., J. Immunol. 148, 1547-1553 (1992). Термин "моноклональное антитело", как используется здесь, относится к антителу, обладающему единственной специфичностью связывания и сродством к определенному эпитопу. Соответственно, тер-6 024701 мин "моноклональное антитело человека" относится к антителу, обладающему единственной специфичностью связывания и содержащему вариабельные и необязательные константные области, происходящие от последовательностей иммуноглобулина человека эмбрионального типа. В одном из вариантов воплощения моноклональные антитела человека продуцируются гибридомой, которая включает В-клетку, полученную из трансгенного животного, не являющегося человеком, например, трансгенной мыши, геном которого содержит трансген тяжелой цепи и трансген легкой цепи человека, объединенную с иммортализированной клеткой. Термин "рекомбинантное антитело человека", как используется здесь, включает все антитела человека, полученные, экспрессированные, созданные или выделенные рекомбинантными средствами, например, (а) антитела, выделенные из животного (например, мыши), являющегося трансгенным или трансхромосомальным по генам иммуноглобулина человека, или гибридомы, полученной из него, (b) антитела, выделенные из клетки-хозяина, трансформированной с целью экспрессии антитела, например,из трансфектомы, (с) антитела, выделенные из рекомбинантной комбинаторной библиотеки антител человека и (d) антитела, полученные, экспрессированные, созданные или выделенные любым другим способом, включающим сплайсинг последовательностей генов иммуноглобулинов человека с другими последовательностями ДНК. Такие рекомбинантные антитела человека включают вариабельные и константные области, использующие определенные последовательности иммуноглобулинов человека эмбрионального типа, кодируемые эмбриональными генами, однако включают последующие реаранжировки и мутации, которые происходят, например, во время созревания антитела. Как известно в данной области техники (см., например, Lonberg (2005) Nature Biotech. 23(9):1117-1125), вариабельная область содержит антиген-связывающий домен, кодируемый различными генами, которые реаранжируются, образуя антитело, специфичное по отношению к чужеродному антигену. Кроме реаранжировки, вариабельная область также может быть модифицирована путем множественных замен одиночных аминокислот (называемых соматическими мутациями или гипермутациями) для увеличения сродства антитела к чужеродному антигену. Константные области изменяются в ходе дальнейшего ответа на антиген (т.е. переключении изотипа). В силу этого подвергшиеся реаранжировке и соматической мутации молекулы нуклеиновых кислот, кодирующие полипептиды легких цепей и тяжелых цепей иммуноглобулинов в ответ на антиген, могут не обладать идентичностью последовательности с исходными молекулами нуклеиновых кислот, но вместо этого быть в значительной степени идентичными или аналогичными (т.е. обладать, по меньшей мере, 80% идентичностью). Термин "антитело человека" включает антитела, содержащие вариабельные и константные области(при их наличии) с последовательностями иммуноглобулинов человека эмбрионального типа. Антитела человека по изобретению могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулинов человека эмбрионального типа (например, мутации, внесенные в ходе случайного или сайт-специфического мутагенеза in vitro или путем соматической мутации in vivo) (см. Lonberg, N. et(1995) Ann. N.Y. Acad. Sci 764:536-546). В то же время термин "антитело человека" не включает антитела, в которых последовательности CDR, происходящие от последовательности эмбрионального типа другого вида млекопитающих, например, мыши, перенесены на каркасные последовательности человека(т.е. гуманизированные антитела). Как используется здесь, определение термина "гетерологичное антитело" приведено по отношению к трансгенному организму, не являющемуся человеком и продуцирующему такое антитело. Этот термин относится к антителу, обладающему аминокислотной последовательностью или кодирующей нуклеотидной последовательностью, соответствующей последовательности, присутствующей в организме, не представляющем собой трансгенное животное, не являющееся человеком, и в общем случае принадлежащей виду, отличающемуся от указанного трансгенного животного, не являющегося человеком. Подразумевается, что термин "выделенное антитело", как используется здесь, относится к антителу,практически не содержащему других антител, обладающих отличающейся антигенной специфичностью(например, выделенное антитело, специфически связывающееся с CD27 человека, практически не содержит антител, специфически связывающихся с антигенами, не являющимися CD27 человека). Выделенное антитело, специфически связывающееся с эпитопом, может, вместе с тем, обладать перекрестной реактивностью по отношению к другим белкам CD27 различных видов. В то же время указанное антитело предпочтительно всегда связывается с CD27 человека. Кроме того, выделенное антитело обычно практически не содержит других клеточных материалов и/или химических соединений. В одном из вариантов воплощения изобретения комбинацию "выделенных" антител, обладающих различной специфичностью к CD27, объединяли в составе четко определенной композиции. Термин "эпитоп" или "антигенная детерминанта" относится к сайту на поверхности антигена, с которым специфически связывается иммуноглобулин или антитело. Эпитоп может быть образован как непрерывной последовательностью аминокислот, так и аминокислотами, не образующими непрерывной последовательности, но расположенными вблизи друг от друга за счет формирования третичной структуры белка. Эпитопы, образованные непрерывной последовательностью аминокислот, как правило, ус-7 024701 тойчивы к воздействию денатурирующих растворителей, в то время как эпитопы, образованные за счет третичной структуры, как правило, повреждаются при обработке денатурирующими растворителями. Эпитоп обычно включает, по меньшей мере, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислот, образующих уникальную пространственную конформацию. Способы определения того, какие эпитопы связываются данным антителом (т.е. картирования эпитопов) хорошо известны в данной области техники и включают, например, иммуноблоттинг и иммунопреципитацию, где перекрывающиеся или непрерывные пептиды в составе CD27 тестируют на реакционноспособность с данным антителом против CD27. Способы определения пространственной конформации эпитопов включают методики, известные в данной области техники и описанные здесь, например, рентгеновскую кристаллографию и 2-мерный ядерный магнитный резонанс (см., например, Epitope Mapping Protocols in Methods in Molecular Biology, Vol. 66,G. E. Morris, Ed. (1996. Кроме того, в объем настоящего изобретения входят антитела, связывающиеся с эпитопом на поверхности CD27, полностью или частично включающим эпитоп, распознаваемый определенным антителом, описанным здесь (например, с одной и той же или перекрывающейся областью, или промежуточной областью, или вокруг области). Кроме того, в объем настоящего изобретения входят антитела, которые связывают один и тот же эпитоп и/или антитела, которые конкурируют за связывание с CD27 человека с антителами, описанными здесь. Антитела, распознающие один и тот же эпитоп или конкурирующие за связывание, можно идентифицировать с помощью обычных методик. Такие методики включают, например, иммуноанализ, который показывает способность одного антитела блокировать связывание другого антитела с антигеноммишенью, т.е. конкурентный анализ связывания. Конкурентное связывание определяют в ходе анализа, в котором тестируемый иммуноглобулин ингибирует специфическое связывание эталонного антитела с общим антигеном, например, CD27. Известны различные типы конкурентных анализов связывания, например, твердофазный прямой или непрямой радиоиммуноанализ (RIA), твердофазный прямой или непрямой иммуноферментный анализ (EIA), конкурентный сэндвич-анализ (см. Stahli et al., Methods in Enzymology 9:242 (1983; твердофазный прямой EIA с биотин-авидином (см. Kirkland et al., J. Immunol. 137:3614 (1986; твердофазный анализ с использованием метки, твердофазный сэндвич-анализ с использованием метки (см. Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Press (1988; твердофазный RIA с использованием I-125 в качестве метки (см. Morel et al., Mol. Immunol. 25(1):7(1988; прямой твердофазный EIA с использованием биотин-авидина (Cheung et al., Virology 176:546 (1990; и RIA с использованием метки (Moldenhauer et al., Scand. J. Immunol. 32:77 (1990. Как правило, такой анализ предполагает использование очищенного антигена, связанного с твердой поверхностью или клеток, несущих антиген, немеченого тестируемого иммуноглобулина и меченого эталонного иммуноглобулина. Конкурентное ингибирование измеряют путем определения количества метки, связанной с твердой поверхностью или клетками, в присутствии тестируемого иммуноглобулина. Обычно тестируемый иммуноглобулин присутствует в избытке. Обычно, если конкурирующее антитело присутствует в избытке, оно ингибирует специфическое связывание эталонного антитела с общим антигеном по меньшей мере на 50-55%, 55-60%, 60-65%, 65-70%, 70-75% или более. Другие методики включают, например, способы картирования эпитопов, например, рентгеновскую кристаллографию комплексов антиген:антитело, которая обеспечивает атомное разрешение эпитопа. Другие способы отслеживают связывание антитела с фрагментами антигена или мутированными вариантами антигена, причем потеря способности к связыванию вследствие модификации аминокислотного остатка в пределах последовательности антигена часто считается признаком компонента эпитопа. Кроме того, для картирования эпитопа также можно использовать вычислительные комбинаторные методики. Эти методики основываются на способности исследуемого антитела аффинно выделять специфические короткие пептиды из комбинаторной пептидной библиотеки фагового дисплея. Указанные пептиды затем рассматривают в качестве ориентиров для определения эпитопа, соответствующего антителу, используемому для скрининга пептидной библиотеки. Разработаны вычислительные алгоритмы для картирования эпитопа, способные картировать конформационные прерывистые эпитопы. Как используется здесь, термины "специфическое связывание", "селективное связывание", "селективно связывается" и "специфически связывается" относятся к связыванию антигена с эпитопом заранее определенного антигена. Как правило, антитело связывается с равновесной константой диссоциации(KD) приблизительно менее 10-7 М, например, приблизительно менее 10-8 М, 10-9 М или 10-10 М, или менее, согласно определению с помощью технологии поверхностного плазмонного резонанса (SPR) с использованием инструмента BIACORE 2000 и рекомбинантного CD27 человека в качестве анализируемого соединения и антитела в качестве лиганда, и связывается с заранее определенным антигеном со сродством, по меньшей мере, в два раза превышающим его сродство связывания с неспецифическим антигеном (например, БСА, казеином), отличающимся от заранее определенного антигена или близкородственного антигена. Фразы "антитело, распознающее антиген" и "антитело, специфичное к антигену" используют здесь на равных основаниях с термином "антитело, специфически связывающееся с антигеном". Предполагается, что термин "KD", как используется здесь, относится к равновесной константе диссоциации конкретного взаимодействия антиген-антитело. Как правило, антитела человека по изобрете-8 024701 нию связываются с CD27 с равновесной константой диссоциации (KD) приблизительно 10-8 М или менее, например, менее 10-9 M или 10-10 M, или менее, согласно определению с помощью технологии поверхностного плазмонного резонанса (SPR) с использованием инструмента BIACORE 2000 и рекомбинантного CD27 человека в качестве анализируемого соединения и антитела в качестве лиганда. Предполагается, что термин "kd", как используется здесь, относится к константе скорости диссоциации антитела из комплекса антиген/антитело. Предполагается, что термин "ka", как используется здесь, относится к константе скорости ассоциации антитела с антигеном. Термин "ЕС 50", как используется здесь, относится к концентрации антитела или его антигенсвязывающего фрагмента, индуцирующего ответ в ходе анализа in vitro или in vivo, равный 50% от максимального ответа, т.е. находящийся посередине между максимальным ответом и фоновым уровнем. Как используется здесь, "изотип" относится к классу антитела (например, IgM или IgG1), кодируемого генами константной области тяжелой цепи. В одном из вариантов воплощения моноклональное антитело человека по изобретению относится к изотипу IgG1. В еще одном из вариантов воплощения моноклональное антитело человека по изобретению относится к изотипу IgG2. Термин "связывается с иммобилизованным CD27" относится к способности антитела человека по изобретению связываться с CD27, например, экспрессируемым на поверхности клетки или прикрепленным к твердому носителю. Термин "перекрестно реагирует", как используется здесь, относится к способности антитела по изобретению связываться с CD27 различных видов животных. Например, антитело по настоящему изобретению, связывающее CD27 человека, также может связывать другие виды CD27. Как используется здесь,перекрестную реакционную способность измеряют путем обнаружения специфической способности реагировать с очищенным антигеном в ходе анализа связывания (например, SPR, ELISA), или связывания с,или иного типа функционального взаимодействия с клетками, физиологически экспрессирующимиCD27. Способы определения перекрестной реакционноспособности включают стандартные анализы связывания, описанные здесь, например, анализ с использованием поверхностного плазмонного резонанса(SPR) Biacore с помощью SPR-инструмента Biacore 2000 (Biacore AB, Уппсала, Швеция), или проточно-цитометрических методик. Как используется здесь, "переключение изотипов" относится к феномену, согласно которому класс или изотип антитела меняется с одного класса Ig на один из других классов Ig. Как используется здесь, "непереключенный изотип" относится к изотипическому классу тяжелых цепей, продуцируемому при отсутствии переключения изотипа; СН-ген, кодирующий непереключенный изотип, обычно представляет собой первый СН-ген, расположенный непосредственно ниже функционально реаранжированного VDJ-гена. Переключение изотипов классифицируют как классическое или неклассическое переключение изотипов. Классическое переключение изотипов происходит за счет рекомбинационных событий, в которых участвует, по меньшей мере один сайт переключающей последовательности трансгена. Неклассическое переключение изотипов может происходить, например, за счет гомологичной рекомбинации междучеловека ичеловека (-асоциированной делеции). В числе прочего, переключение изотипов может осуществляться за счет альтернативных механизмов неклассического переключения, например, межтрансгенной или межхромосомной рекомбинации. Как используется здесь, термин "переключающая последовательность" относится к последовательностям ДНК, отвечающим за рекомбинацию на этапе переключения. "Донорная переключающая" последовательность, обычно -переключающая область, располагается в направлении 5'- (т.е. выше) области конструкта, удаляемой во время рекомбинации на этапе переключения. "Акцепторная переключающая" область располагается между удаляемой областью конструкта и замещающей константной областью (например, ,и т.д.). Поскольку конкретный постоянный сайт рекомбинации отсутствует, окончательную последовательность генов обычно невозможно предсказать на основе конструкта. Как используется здесь, "картина гликозилирования" определяется как картина углеводных групп,ковалентно присоединенных к белку, более конкретно - к белку иммуноглобулина. Картину гликозилирования гетерологичного антитела можно описать как в значительной степени аналогичную картине гликозилирования, наблюдаемой в естественных условиях у антител, продуцированных трансгенным животным, не являющимся человеком, если специалист в данной области техники может распознать, что картина гликозилирования гетерологичного антитела более сходна с указанной картиной гликозилирования у трансгенного животного, не являющегося человеком, чем с картиной гликозилирования у вида, от которого происходят СН-гены трансгена. Термин "природный", как используется здесь по отношению к объекту, относится к тому факту, что объект можно найти в природе. Например, полипептидная или полинуклеотидная последовательность,присутствующая в организме (включая вирусы), который можно выделить из естественного источника и не являющаяся целенаправленно модифицированной человеком в лаборатории, является природной. Термин "реаранжированный", как используется здесь, относится к конфигурации локуса тяжелой цепи или легкой цепи иммуноглобулина, где сегмент V непосредственно примыкает к сегменту D-J или J-9 024701 в конформации, кодирующей фактически полный VH- или VL-домен, соответственно. Реаранжированный генный локус иммуноглобулина можно идентифицировать путем сравнения с ДНК эмбрионального типа; реаранжированный локус содержит, по меньшей мере, один рекомбинированный гептамерный/нонамерный гомологичный элемент. Термин "нереаранжированный" или "конфигурация зародышевого типа", как используется здесь по отношению к сегменту V, относящемуся к конфигурации, в которой сегмент V не подвергался рекомбинации, обеспечивающей его непосредственное примыкание к сегменту D или J. Предполагается, что термин "молекула нуклеиновой кислоты", как используется здесь, включает молекулы ДНК и молекулы РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двуцепочечной, но предпочтительно представляет собой двуцепочечную ДНК. Предполагается, что термин "выделенная молекула нуклеиновой кислоты", как используется здесь по отношению к нуклеиновым кислотам, кодирующим антитела или фрагменты антител (например, VH,VL, CDR3), связывающиеся с CD27, относится к молекуле нуклеиновой кислоты, в которой нуклеотидные последовательности, кодирующие антитело или фрагмент антитела, не содержат других нуклеотидных последовательностей, кодирующих антитела или фрагменты антител, связывающие антигены, не являющиеся CD27, причем эти другие последовательности в естественных условиях могут фланкировать указанную нуклеиновую кислоту в геномной ДНК человека. Например, SEQ ID NO:35 и 41, 47 и 53, 101 и 107, 83 и 89, 83 и 95, 23 и 29, 71 и 77 соответствуют нуклеотидным последовательностям, включающим вариабельные области тяжелой цепи (VH) и легкой цепи (VL) моноклональных антител 1F5, 1 Н 8, 3 Н 12,3 А 10, 2 С 2, 2G9, 3 Н 8 и 1G5 против CD27. Настоящее изобретение также включает "консервативные модификации последовательностей",представленных в SEQ ID NO:5-112, т.е. модификации нуклеотидных и аминокислотных последовательностей, не препятствующие связыванию антитела, кодируемого нуклеотидной последовательностью или содержащего аминокислотную последовательность, с антигеном. Такие консервативные модификации последовательностей включают консервативные нуклеотидные и аминокислотные замены, а также добавления и делеции нуклеотидов и аминокислот. Например, модификации можно внедрить в SEQ IDNO:5-112 с помощью стандартных методик, известных в данной области техники, например, сайтспецифического мутагенеза и ПЦР-опосредованного мутагенеза. Консервативные аминокислотные замены включают замены, при которых аминокислотный остаток заменяют аминокислотным остатком, содержащим аналогичную боковую цепь. В данной области техники существуют определения семейств аминокислотных остатков, содержащих аналогичные боковые цепи. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями(например, аспарагиновую кислоту, глутаминовую кислоту), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин),бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Так, предсказанный аминокислотный остаток, не являющийся незаменимой аминокислотой, в составе антитела человека против CD27 предпочтительно замещают другим аминокислотным остатком из того же семейства боковых цепей. Способы идентификации нуклеотидных и аминокислотных консервативных замен, не устраняющих связывания с антигеном, широко известны в данной области техники (см., например, Brummell et al., Biochem. 32:1180-1187 (1993); Kobayashi et al. Protein Eng. 12(10):879-884 (1999); и Burks et al. Proc. Natl.Acad. Sci. USA 94:412-417 (1997. В качестве альтернативы, в еще одном варианте воплощения можно внедрить случайные мутации на протяжении всей кодирующей последовательности антитела против CD27 или ее фрагмента, например, путем насыщающего мутагенеза, и выполнить скрининг связывающей активности среди полученных модифицированных антител против CD27. По отношению к нуклеиновым кислотам термин "значительная гомология" означает, что две нуклеиновые кислоты или обозначающие их последовательности при оптимальном выравнивании и сравнении являются идентичными при учете соответствующих нуклеотидных инсерций и делеций, по меньшей мере приблизительно на 80% от общего количества нуклеотидов, обычно, по меньшей мере, приблизительно на 90-95%, а более предпочтительно - по меньшей мере, приблизительно на 98-99,5% от общего количества нуклеотидов. В качестве альтернативы, значительная гомология существует, если сегменты гибридизуются с комплементарной цепью при условиях для селективной гибридизации. Процент идентичности между двумя последовательностями представляет собой функцию количества идентичных положений, общих для обеих последовательностей (т.е. % гомологии= идентичных положений/общееположений 100), с учетом количества пробелов и длины каждого пробела, которые необходимо внести для оптимального выравнивания двух указанных последовательностей. Сравнение последовательностей и определение процента идентичности между двумя последовательностями можно выполнить с использованием математического алгоритма, как описано в неограничивающих примерах ниже. Процент идентичности двух нуклеотидных последовательностей можно определить с помощью- 10024701 программы GAP в пакете программного обеспечения GCG (доступном на http://www.gcg.com), используя матрицу NWSgapdna.CMP, вес пробела 40, 50, 60, 70 или 80 и вес длины 1, 2, 3, 4, 5 или 6. Процент идентичности двух нуклеотидных или аминокислотных последовательностей также можно определить с помощью алгоритма Е. Meyers and W. Miller (CABIOS, 4:11-17 (1989, включенного в программу ALIGN(версия 2,0), при использовании таблицы весов остатков РАМ 120, штрафа за длину пробела 12 и штрафа за пробел 4. Кроме того, процент идентичности двух аминокислотных последовательностей можно определить с помощью алгоритма Needleman and Wunsch (J. Mol. Biol. (48):444-453 (1970, включенного в программу GAP в пакете программного обеспечения GCG (доступном на http://www.gcg.com), используя матрицу Blossum 62 или матрицу РАМ 250, вес пробела 16, 14, 12, 10, 8, 6 или 4 и вес длины 1, 2, 3, 4, 5 или 6. Последовательности нуклеиновых кислот и белков по настоящему изобретению можно в дальнейшем использовать в качестве "запрашиваемой последовательности" для выполнения поиска в общедоступных базах данных, например, с целью определения родственных последовательностей. Такой поиск можно выполнить с помощью программ NBLAST и XBLAST (версии 2,0), описанных в Altschul, et al.(1990) J. Mol. Biol. 215:403-10. BLAST-поиск нуклеотидных последовательностей можно осуществить с помощью программы NBLAST при следующих значениях: параметр = 100, длина слова = 12, получая нуклеотидные последовательности, гомологичные молекулам нуклеиновой кислоты по настоящему изобретению. BLAST-поиск белков можно осуществить с помощью программы XBLAST при следующих значениях: параметр = 50, длина слова = 3, получая аминокислотные последовательности, гомологичные белковым молекулам по изобретению. Для получения выровненных последовательностей, содержащих пробелы, для целей сравнения, можно использовать Gapped BLAST, как описано в Altschul et al., (1997)Nucleic Acids Res. 25 (17):3389-3402. При использовании программ BLAST и Gapped BLAST можно использовать параметры по умолчанию соответствующих программ (например, XBLAST и NBLAST). См.http://www.ncbi.nlm.nih.gov. Нуклеиновые кислоты могут присутствовать в целых клетках, в клеточном лизате или в частично очищенном или практически чистом виде. Нуклеиновая кислота является "выделенной" или "практически очищенной", если она очищена от других компонентов клетки или других загрязняющих веществ,например, других внутриклеточных нуклеиновых кислот или белков, с помощью стандартных методик, в том числе обработки щелочью/SDS, расслоения при центрифугировании в градиенте CsCl, колоночной хроматографии, электрофореза в агарозном геле и других методик, хорошо известных в данной области. См. F. Ausubel, et al., ed. Current Protocols in Molecular Biology, Greene Publishing and Wiley Interscience,New York (1987). Композиции нуклеиновых кислот по настоящему изобретению, часто присутствующие в виде нативной последовательности (за исключением модифицированных сайтов рестрикции и т.п.), либо полученные из кДНК, геномной ДНК или их смесей, можно мутировать в соответствии со стандартными методиками, получая последовательности генов. Для кодирующих последовательностей при желании эти мутации могут влиять на аминокислотную последовательность. В частности, рассматриваются последовательности ДНК, в значительной степени гомологичные или происходящие от нативных последовательностей V, D, J, константных, переключающих и других подобных последовательностей, описанные в данном документе (где "происходящие" означает, что последовательность идентична другой последовательности или представляет собой ее модифицированный вариант). Нуклеиновая кислота является "функционально связанной", если она вступает в функциональное взаимодействие с другой нуклеотидной последовательностью. Например, промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию указанной последовательности. В отношении последовательностей регуляции транскрипции термин "функционально связанный" означает, что связанные последовательности ДНК являются непрерывными и, при необходимости объединения кодирующих областей двух белков, являются непрерывными и находятся в одной рамке считывания. Для переключающих последовательностей термин "функционально связанный" указывает, что последовательности способны эффективно переключать рекомбинацию. Предполагается, что термин "вектор", как используется здесь, относится к молекуле нуклеиновой кислоты, способной переносить другую нуклеиновую кислоту, с которой он связан. Одним из типов вектора является "плазмида", которая относится к кольцевой двуцепочечной петле ДНК, в которую можно лигировать дополнительные сегменты ДНК. Еще одним типом вектора является вирусный вектор, где дополнительные сегменты ДНК можно лигировать в вирусный геном. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую они внедрены (например, бактериальные векторы,содержащие бактериальный сайт инициации репликации, и эписомальные векторы млекопитающих). Другие векторы (например, неэписомальные векторы млекопитающих) могут быть интегрированы в геном клетки-хозяина после внедрения в клетку-хозяина и, тем самым, реплицируются вместе с геномом хозяина. Более того, некоторые векторы способны управлять экспрессией генов, с которыми они функционально связаны. Такие векторы здесь называют "рекомбинантными экспрессирующими векторами" (или просто "экспрессирующими векторами"). В общем случае экспрессирующие векторы, использующиеся в методиках рекомбинантных ДНК, часто находятся в форме плазмид. В настоящем па- 11024701 тентном описании "плазмида" и "вектор" могут использоваться на равных основаниях, поскольку плазмида является наиболее часто используемой формой вектора. В то же время предполагается, что изобретение включает другие формы экспрессирующих векторов, например, вирусные векторы (например, дефектные по репликации ретровирусы, аденовирусы и аденоассоциированные вирусы), которые выполняют эквивалентные функции. Предполагается, что термин "рекомбинантная клетка-хозяин" (или просто "клетка-хозяин"), как используется здесь, относится к клетке, в которую внедрен рекомбинантный экспрессирующий вектор. Следует понимать, что такие термины должны относиться не только к определенной клетке субъекта, но и к потомству такой клетки. Поскольку в последующих поколениях ввиду мутаций или влияния окружающей среды могут возникнуть некоторые модификации, такое потомство фактически может не являться идентичным исходной клетке, но все же оставаться в рамках термина "клетка-хозяин", как используют здесь. Как используется здесь, термин "антиген" относится к любому природному или синтетическому иммуногенному веществу, например белку, пептиду или гаптену. Антигены, пригодные для использования в настоящем изобретении (например, в составе вакцины в сочетании с антителами против CD27 по изобретению) включают, например, антигены инфекционных заболеваний и опухолевые антигены, против которых желательны защитные или терапевтические иммунные реакции, например, антигены, экспрессируемые опухолевой клеткой или патогенным организмом, или антигены инфекционных заболеваний. Например, подходящие антигены включают опухоле-ассоциированные антигены для профилактики или лечения рака. Примеры опухоле-ассоциированных антигенов включают последовательности, полностью или частично содержащие последовательности phCG, gp100 или Pmel17, HER2/neu, WT1, мезотелин, CEA, gp100, MARTI, TRP-2, melan-A, NY-ESO-1, NY-BR-1, NY-CO-58, MN (gp250), набора идиотипических детерминант, MAGE-1, MAGE-3, MAGE-А 3, тирозиназы, теломеразы, антигенов SSX2 и MUC1 и опухолевых антигенов эмбрионального происхождения, но не ограничиваются ими. Опухолеассоциированные антигены также включают антигены группы крови, например, антигены Lea, Leb, LeX, LeY,H-2, B-1, В-2. В качестве альтернативы, в конструкты антиген-антитело по изобретению можно включать более одного антигена. Например, антиген MAGE можно комбинировать с другими антигенами, например, меланином А, тирозиназой и gp100, наряду с такими адъювантами, как GM-CSF и IL-12, и связывать с антителом против АПК. Другие подходящие антигены включают вирусные антигены для профилактики и лечения вирусных заболеваний. Примеры вирусных антигенов включают антигены HIV-1 gag, HIV-1 env, HIV-1 nef, HBV(поверхностные или коровью антигены), HPV, FAS, HSV-1, HSV-2, p17, ORF2 и ORF3, но не ограничиваются ими. Примеры бактериальных антигенов включают Toxoplasma gondii или Treponema pallidum, но не ограничиваются ими. Конъюгаты антитело-бактериальный антиген по изобретению можно использовать при лечении и профилактике различных бактериальных заболеваний, например, сибирской язвы,ботулизма, столбняка, хламидиозов, холеры, дифтерии, болезни Лайма, сифилиса и туберкулеза. Другие подходящие антигены возбудителей инфекционных заболеваний, например, вирусов, бактерий, паразитов и грибков, описаны ниже. Последовательности вышеописанных антигенов хорошо известны в данной области. Например,пример последовательности кДНК MAGE-3 представлен в US 6235525 (Ludwig Institute for Cancer Research); примеры нуклеотидной и белковой последовательностей NY-ESO-1 представлены в US 5804381 и US 6069233 (Ludwig Institute for Cancer Research); примеры нуклеотидной и белковой последовательностей Melan-A представлены в US 5620886 и US 5854203 (Ludwig Institute for Cancer Research); примеры нуклеотидной и белковой последовательностей NY-BR-1 представлены в US 6774226 и US 6911529(Ludwig Institute for Cancer Research), а примеры нуклеотидной и белковой последовательностей NY-CO58 представлены в WO 02090986 (Ludwig Institute for Cancer Research); пример аминокислотной последовательности белка HER-2/neu доступен в GENBANK под номером доступа ААА 58637; а нуклеотидная последовательность (мРНК) ракового эмбрионального антигена-1 человека (СЕА-1) доступна в GENBANK под номером доступа NM020219. Антиген HPV, который можно использовать в композициях и способах по изобретению, может включать, например, антиген HPV-16, антиген HPV-18, антиген HPV-31, антиген HPV-33 и/или антигенHPV-35, и предпочтительно является антигеном HPV-16 и/или антигеном HPV-18. Геном HPV-16 описан в Virology, 145:181-185 (1985), а последовательности ДНК, кодирующие HPV-18, описаны в патенте США 5840306, описание которого полностью включено в настоящий документ посредством ссылки. Антигены HPV-16 (например, области белков HPV-16 Е 1 и/или Е 2, вызывающие серологическую реакцию),описаны в патенте США 6531127, а антигены HPV-18 (например, области белков HPV-18 L1 и/или L2,вызывающие серологическую реакцию), описаны в патенте США 5840306, описания которых включены в настоящий документ посредством ссылки. Аналогично, полный геном HBV доступен в GENBANK под номером доступа NC003977, описание которого включено в настоящий документ. Геном HCV описан в европейской патентной заявке 318216, описание которой включено в настоящий документ. ВPCT/US90/01348, включенном в настоящий документ посредством ссылки, описана информация о кло- 12024701 нах генома HCV, аминокислотных последовательностях вирусных белков HCV и способах изготовления и использования таких композиций в составе HCV-вакцин, включающих белки HCV и пептиды, происходящие от них. Антигенные пептиды, белки (т.е. пептиды и белки, содержащие Т-клеточные эпитопы) можно идентифицировать различными способами, хорошо известными в данной области техники. Например, Тклеточные эпитопы можно предсказать на основе анализа последовательности белка с помощью вебалгоритма для прогнозирования (BIMASSYFPEITHI), создавая потенциальные пептиды, связывающие МНС класса I и II, которые соответствуют внутренней базе данных из 10000 хорошо изученных MHCсвязывающих пептидов, определенных ранее с использованием CTL. Пептиды с высокими показателями можно классифицировать и выбрать в качестве "интересующих" на основании высокого сродства к данной молекуле МНС. Еще один способ идентификации антигенных пептидов, содержащих Т-клеточные эпитопы, заключается в разделении белка на неперекрывающиеся пептиды нужной длины или перекрывающиеся пептиды нужной длины, которые можно получить рекомбинантно, синтетически, или, в некоторых ограниченных случаях, путем химического расщепления белка, и протестировать на иммуногенные свойства, например, способность вызывать Т-клеточный ответ (т.е. пролиферацию или секрецию лимфокинов). Для определения точных Т-клеточных эпитопов белка, например, с помощью методик точного картирования, пептид, обладающий стимуляторной активностью по отношению к Т-клеткам и, следовательно, содержащий, по меньшей мере, один Т-клеточный эпитоп, согласно методикам Т-клеточной биологии, можно модифицировать путем добавления или удаления аминокислотных остатков на N-или Сконце указанного пептида и протестировать на изменение реакционной способности модифицированного пептида по отношению к Т-клеткам. Если установлено, что два или более пептидов, содержащих общую перекрывающуюся область в нативной последовательности белка, обладают стимуляторной активностью по отношению к Т-клеткам человека, согласно методикам Т-клеточной биологии, можно получить дополнительные пептиды, полностью или частично включающие такие пептиды, и протестировать указанные дополнительные пептиды с помощью аналогичной процедуры. Следуя этой методике, осуществляют выбор и получение пептидов рекомбинантным или синтетическим путем. Пептиды выбраны на основании различных факторов, в том числе силы Т-клеточного ответа на пептид (например, индекса стимуляции). Затем можно исследовать физические и химические свойства указанных выбранных пептидов (например, растворимость, стабильность) для определения пригодности этих пептидов для использования в терапевтических композициях, или необходимости модификации этих пептидов. Термин "антигенпрезентирующая клетка" или "АПК" обозначает клетку, на поверхности которой находится чужеродный антиген в комплексе с МНС Т-клетки распознают этот комплекс, используя Тклеточный рецептор (TCR). Примеры АПК включают дендритные клетки (ДК), мононуклеары периферической крови (МПК), моноциты (например, ТНР-1), В-лимфобластоидные клетки (например, C1R.A2,1518 B-LCL) и дендритные клетки моноцитарного происхождения (ДК), но не ограничиваются ими. Некоторые АПК поглощают антигены путем фагоцитоза или рецептор-опосредованного эндоцитоза. Примеры АПК-рецепторов включают лектины С-типа, например, рецептор дендритных и эпителиальных клеток человека 205 (CD27) и рецептор маннозы макрофагов человека, но не ограничиваются ими. Термин "презентация антигена" относится к процессу, посредством которого АПК захватывают антигены и делают возможным их распознавание Т-клетками, например, в качестве компонента конъюгата"Молекулы МНС" включают два вида молекул, МНС класса I и МНС класса II. Молекулы МНС класса I, презентируют антиген специфическим CD8+ Т-клеткам, а молекулы МНС класса II презентируют антиген специфическим CD4+ Т-клеткам. Внеклеточные антигены обрабатываются АПК в первую очередь путем связывания с МНС класса II. В противоположность этому, внутриклеточные антигены обрабатываются АПК в первую очередь путем связывания с МНС класса I. Как используется здесь, термин "иммуностимулятор" включает соединения, способные стимулировать АПК, например, ДК и макрофаги, но не ограничивается ими. Например, подходящие для использования в настоящем изобретении иммуностимуляторы могут стимулировать АПК, ускоряя процесс созревания АПК, усиливая пролиферацию АПК и/или стимулируя рекрутинг или высвобождение костимулирующих молекул (например, CD80, CD86, ICAM-1, молекул МНС и CCR7) и провоспалительных цитокинов (например, IL-1, IL-6, IL-12, IL-15 и интерферон-). Подходящие иммуностимуляторы также способны усиливать пролиферацию Т-клеток. Такие иммуностимуляторы включают лиганд CD40; лигандPD1, антитело против 41 ВВ или антитело против ОХ-40; LPS (эндотоксин); оцРНК; дцРНК; бациллу Кальмета-Герена (BCG); левамизола гидрохлорид, а также иммуноглобулины для внутривенного введения, но не ограничиваются ими. В одном из вариантов воплощения иммуностимулятор может представлять собой агонист Toll-подобного рецептора (TLR). Например, иммуностимулятор может представлять- 13024701 собой агонист TLR3, например, двуцепочечный полинуклеотид инозин:цитозин (Poly I:C, например, доступный как AmpligenTM от Hemispherx Bipharma, штат Пенсильвания, США или Poly IC:LC от Oncovir) или Poly A:U; агонист TLR4, например, монофосфориллипид (MPL) или RC-529 (например, доступный от GSK, Великобритания); агонист TLR5, например, флагеллин; агонист TLR7 или TLR8, например,имидазохинолин, агонист TLR7 или TLR8, например, имиквимод (например, AldaraTM) или резиквимод и родственные имидазохинолину агенты (например, доступные от 3M Corporation), или агонист TLR 9,например, дезоксинуклеотид с неметилированными CpG-мотивами (так называемые "CpG", например,доступные от Coley Pharmaceutical). Предпочтительным иммуностимулятором является агонист TLR3,предпочтительно Poly I:C. Такие иммуностимуляторы можно вводить одновременно, раздельно или последовательно с антителами и конструктами по настоящему изобретению, а также можно физически связывать с указанными антителами и конструктами. Как используется здесь, термин "связанный" относится к объединению двух или более молекул. Указанная связь может быть ковалентной или нековалентной. Указанная связь также может быть генетической (т.е. компоненты могут быть объединены рекомбинантным путем). Такую связь можно получить,используя широкий спектр методик, принятых в данной области техники, например, химическое конъюгирование и продуцирование рекомбинантного белка. Как используется здесь, термин "перекрестная презентация" антигена относится к презентации экзогенных белковых антигенов Т-клеткам через молекулы МНС класса I и класса II на АПК. Как используется здесь, термин "ответ, опосредованный Т-клетками" относится к любому ответу,опосредованному Т-клетками, в том числе эффекторными Т-клетками (например, CD8+-клетками) и Тхелперами (например, CD4+-клетками). Ответы, опосредованные Т-клетками, включают, например, Тклеточную цитотоксичность и пролиферацию Т-клеток. Как используется здесь, термин "ответ цитотоксических Т-лимфоцитов (CTL)" относится к иммунному ответу, индуцированному цитотоксическими Т-клетками. CTL-ответы опосредуются главным образом CD8+ Т-клетками. Как используется здесь, термины "ингибирует" или "блокирует" (например, по отношению к ингибированию/блокированию связывания CD70 с CD27 на поверхности клеток) используются на равных основаниях и охватывают как частичное, так и полное ингибирование/блокирование. Ингибирование/ блокирование CD70 предпочтительно снижает или изменяет нормальный уровень или тип активности,имеющий место при связывании с CD70 при отсутствии ингибирования или блокирования. Предполагается, что ингибирование и блокирование также включают любое измеримое снижение сродства связывания CD70 при контакте с антителом против CD27 по сравнению с CD70, не находящимся в контакте с антителом против CD27, например, ингибирование связывания CD70, по меньшей мере, приблизительно на 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 96, 97, 98, 99 или 100%. В предпочтительном варианте воплощения антитело против CD27 ингибирует связывание CD70, по меньшей мере,приблизительно на 70%. В еще одном варианте воплощения антитело против CD27 ингибирует связывание CD70 по меньшей мере приблизительно на 80%. Как используется здесь, предполагается, что термин "подавляет рост" (например, по отношению к клеткам) включает любое измеримое снижения роста клеток, например, подавление роста клеток, по меньшей мере, приблизительно на 10, 20, 30, 40, 50, 60, 70, 80, 90, 99 или 100%. Термины "индукция иммунного ответа" и "повышение иммунного ответа" используются на равных основаниях и относятся к стимуляции иммунного ответа (т.е. пассивного или адаптивного) на конкретный антиген. Термин "индуцировать", используемый по отношению к индукции CDC или ADCC, относится к стимуляции конкретных механизмов прямого уничтожения клеток. Например, в одном из вариантов воплощении, антитело в концентрации 10 мкг/мл индуцирует, по меньшей мере, приблизительно 20, 25, 30, 35, 40, 45, 50, 55 или 60% лизис клеток, экспрессирующих CD27, за счет CDC. В предпочтительном варианте воплощения антитело в концентрации 10 мкг/мл индуцирует, по меньшей мере, приблизительно 40% лизис клеток, зкспрессирующих CD27, за счет CDC. В еще одном варианте воплощения антитело в концентрации 10 мкг/мл индуцирует, по меньшей мере, приблизительно 20, 25, 30, 35, 40,45, 50, 55, 60, 65, 70, 75, 80 или 85% лизис клеток, экспрессирующих CD27, за счет ADCC (т.е. специфический лизис). В предпочтительном варианте воплощения антитело в концентрации 10 мкг/мл индуцирует, по меньшей мере, приблизительно 40% лизис клеток, экспрессирующих CD27, за счет ADCC. Термины "лечить" и "лечение", как используются здесь, относятся к терапевтическим или профилактическим мерам, описанным здесь. Способы "лечения" включают введение в организм субъекта, нуждающегося в таком лечении, антитела человека по настоящему изобретению, например, в организм субъекта, нуждающегося в усиленном иммунном ответе против определенного антигена, или субъекта, у которого в конечном счете может развиться такое расстройство, в целях предотвращения, лечения, задержки, снижения тяжести или улучшения одного или нескольких симптомов расстройства или рецидивирующего расстройства, или для повышения продолжительности жизни субъекта по сравнению с ожидаемой продолжительностью жизни при отсутствии такого лечения. Термин "эффективная доза" или "эффективная дозировка" определяется как количество, достаточное для достижения или, по меньшей мере, частичного достижения желательного эффекта. Термин "те- 14024701 рапевтически эффективная доза" определяется как количество, достаточное для лечения или, по меньшей мере, частичного замедления развития заболевания и его осложнений у пациента, уже страдающего этим заболеванием. Количество, эффективное для этой цели, зависит от тяжести расстройства, подвергаемого лечению, и общего состояния иммунной системы пациента. Термин "пациент" включает в себя человека и других субъектов-млекопитающих, которые получают профилактическое или терапевтическое лечение. Как используется здесь, термин "субъект" включает человека или любое животное, не являющееся человеком. Например, способы и композиции по настоящему изобретению можно использовать для лечения субъекта, страдающего иммунным расстройством. Термин "животное, не являющееся человеком" включает всех позвоночных, например, млекопитающих и позвоночных, не являющихся млекопитающими, например, приматов, не являющихся человеком, овец, собак, коров, кур, амфибий, рептилий и т.д. Различные аспекты изобретения более подробно описаны в следующих подразделах.I. Получение антител к CD27. Настоящее изобретение включает антитела, например, полностью человеческие антитела, связывающиеся с CD27, например, CD27 человека. Типичные моноклональные антитела, связывающиеся сCD27, включают 1F5, 1 Н 8, 3 Н 12, 3 А 10, 2 С 2, 2G9, 3 Н 8 и 1G5. Моноклональные антитела по изобретению можно получить с помощью множества известных методик, например, стандартной методики гибридизации соматических клеток, описанной в работе Kohler and Milstein, Nature 256: 495 (1975). Хотя предпочтительными являются процедуры гибридизации соматических клеток, в принципе, также можно использовать другие методики получения моноклональных антител, например, вирусную или онкогенную трансформацию В-лимфоцитов, технологию фагового дисплея с использованием библиотеки генов антител человека. Соответственно, в одном из вариантов воплощения для получения антитела, связывающего CD27 человека, используют технологию гибридом. Согласно этому способу мышь или другое подходящее животное-носитель можно иммунизировать подходящим антигеном с целью выделения лимфоцитов, продуцирующих или способных продуцировать антитела, специфически связывающиеся с антигеном, использованным для иммунизации. В качестве альтернативы лимфоциты можно иммунизировать in vitro. Затем лимфоциты можно слить с миеломными клетками с помощью подходящего агента, вызывающего слияние клеток, например, полиэтиленгликоля, получая клетку гибридомы (Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986. Культуральную среду, в которой растут клетки гибридомы, анализируют на продукцию моноклональных антител против заданного антигена. После того, как установлено, что клетки гибридомы продуцируют антитела, обладающие желательной специфичностью, сродством и/или активностью, клоны можно субклонировать, используя способ серийных разведений, и вырастить с помощью стандартных способов (Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986. Подходящие для этих целей культуральные среды включают, например, среду D-MEM или RPMI-1640. Кроме того, клетки гибридомы можно вырастить invivo в организме животного в виде асцитной опухоли. Моноклональные антитела, секретируемые субклонами, можно отделить от культуральной среды, асцитной жидкости или сыворотки с помощью стандартных процедур очистки иммуноглобулинов, например, гель-фильтрации на белок А-сефарозе, хроматографии на гидроксиапатите, гель-электрофореза, диализа или аффинной хроматографии. В еще одном варианте воплощения антитела или фрагменты антител, связывающие CD27 человека,можно выделить из фаговых библиотек антител, полученных с использованием методик, описанных,например, в статье McCafferty et al., Nature, 348:552-554 (1990). Clackson et al., Nature, 352:624-628 (1991),Marks et al., J. Mol. Biol., 222:581-597 (1991) и Hoet et al (2005) Nature Biotechnology 23, 344-348; патентах США 5223409; 5403484; и 5571698, принадлежащих Ladner et al.; патентах США 5427908 и 5580717,принадлежащих Dower et al.; патентах США 5969108 и 6172197, принадлежащих McCafferty et al.; и патентах США 5885793; 6521404; 6544731; 6555313; 6582915 и 6593081, принадлежащих Griffiths et al Кроме того, можно использовать получение высокоаффинных (в диапазоне нМ) антител человека путем перетасовки цепей (Marks et al., Bio/Technology, 10:779-783 (1992, а также комбинаторную инфекцию и рекомбинацию in vivo в качестве стратегий конструирования очень крупных фаговых библиотек (Waterhouse et al., Nuc. Acids. Res., 21:2265-2266 (1993. В конкретном варианте осуществления антитело, связывающее CD27 человека, получают с помощью методики фагового дисплея, описанной Hoet et al., supra. Эта методика включает получение библиотеки Fab человека, содержащей уникальную комбинацию последовательностей иммуноглобулинов, выделенных из материала, полученного от доноров-людей и характеризующихся сгенерированным синтетическим разнообразием CDR тяжелых цепей. Затем осуществляют скрининг библиотеки в поисках Fab,связывающихся с CD27 человека. Предпочтительная система животного для создания гибридом, продуцирующих антитела по изобретению, представляет собой систему мыши. Получение гибридом мыши хорошо известно в данной области техники, включая протоколы иммунизации и методики выделения и слияния иммунизированных спленоцитов. В одном из вариантов воплощения антитела против CD27 получают с использованием трансгенных- 15024701 или трансхромосомальных мышей, несущих фрагменты иммунной системы человека, а не мыши. В одном из вариантов воплощения изобретения используют трансгенных мышей, называемых здесь "HuMAbмышами", несущих мини-локусы генов иммуноглобулинов человека, кодирующих не подвергавшиеся реаранжировке последовательности тяжелых (- и -) и легких -цепей иммуноглобулинов наряду с адресными мутациями, инактивирующими эндогенные локусы - и -цепей (Lonberg, N. et al. (1994) Nature 368(6474): 856-859). Соответственно, указанные мыши демонстрируют пониженную экспрессию IgM или к мыши и, в ответ на иммунизацию, внедренные трансгены тяжелых и легких цепей подвергаются переключению классов и соматической мутации, что позволяет генерировать высокоаффинные моноклональные IgG-антитела человека (Lonberg, N. et al. (1994), supra; обзор Lonberg, N. (1994) Handbook ofWO 92/22645, опубликованную 23 декабря 1992 г.; WO 92/03918, опубликованную 19 марта 1992 г. Иммунизация Для получения полностью человеческих антител к CD27 трансгенных или трансхромосомальных мышей, несущих гены иммуноглобулинов человека (например, мышей НСо 12, НСо 7 или KM), можно иммунизировать очищенным или обогащенным препаратом антигена CD27 и/или клеток, экспрессирующих CD27, как описано, например, в Lonberg et al. (1994) Nature 368(6474): 856-859; Fishwild et al.(1996) Nature Biotechnology 14: 845-851 и WO 98/24884. Как описано здесь, HuMAb-мышей иммунизировали рекомбинантными белками CD27 или клетками линий, экспрессирующих CD27, в качестве иммуногенов. В качестве альтернативы, мышей можно иммунизировать ДНК, кодирующей CD27 человека. Предпочтительно, для первого вливания использовали мышей возрастом 6-16 недель. Например, для внутрибрюшинной иммунизации HuMAb-мышей можно использовать очищенный или обогащенный препарат (5-50 мкг) рекомбинантного антигена CD27. В случае, если иммунизация с использованием очищенного или обогащенного препарата антигена CD27 не приводит к продукции антител, для стимуляции иммунного ответа мышей также можно иммунизировать клетками, экспрессирующими CD27, например, линией клеток. Типичные линии клеток включают CD27-сверхэкспрессирующие стабильные линии клеток СНО и Раджи. Опыт, накопленный при использовании различных антигенов, показал, что наилучший ответ у трансгенных HuMAb-мышей развивался при первоначальной внутрибрюшинной (в/б) или подкожной(п/к) иммунизации антигеном в полном адъюванте Фрейнда с последующей в/б/п/к иммунизацией раз в две недели (в общей сложности до 10 раз) антигеном в неполном адъюванте Фрейнда. Иммунный ответ можно отслеживать в течение курса иммунизации, используя образцы плазмы, полученные путем ретроорбитального отбора крови. Скрининг плазмы можно осуществлять с помощью ELISA (как описано ниже), и мышей с достаточными титрами иммуноглобулина человека против CD27 можно использовать для слияния. Мышей можно дополнительно стимулировать внутривенными инъекциями антигена за 3 суток до умерщвления и удаления селезенки. Получение гибридом, продуцирующих моноклональные антитела к CD27 Для создания гибридом, продуцирующих моноклональные антитела к CD27, можно выделить клетки селезенки и лимфатических узлов иммунизированных мышей и слить их с клетками соответствующих иммортализованных линий, например, клетками миеломной линии мыши. Полученные гибридомы можно подвергнуть скринингу на продукцию антиген-специфических антител. Например, суспензии одиночных лимфоцитов селезенки иммунизированных мышей можно слить с клетками несекретирующей миеломной линии мыши SP2/0-Ag8,653 (АТСС, CRL 1580) с 50% ПЭГ (мас./об). Клетки можно высеять в количестве приблизительно 1105 на плоскодонные титрационные микропланшеты с последующим инкубированием в течение двух недель в селективной среде, содержащей, помимо обычных реагентов, 10% эмбриональной сыворотки для клонирования, 5-10% фактора для клонирования гибридом Origen (IGEN) и IX HAT (Sigma). Спустя приблизительно две недели клетки можно культивировать в среде, в которойHAT заменили на НТ. Затем можно выполнить скрининг отдельных лунок с помощью ELISA на моноклональные IgM- и IgG-антитела человека против CD27 или на связывание с поверхностью клеток, экспрессирующих CD27, например, клеток линии СНО, экспрессирующих CD27, с помощью твердофазного- 16024701 флуоресцентного иммуноанализа. После возникновения экстенсивного роста гибридом среду можно наблюдать, как правило, спустя 10-14 суток. Гибридомы, секретирующие антитела, можно пересеять, подвергнуть повторному скринингу и, при подтверждении положительного результата анализа IgG, по меньшей мере, дважды субклонировать моноклональные антитела против CD27 с помощью серийных разведений. Затем можно культивировать стабильные субклоны in vitro, получая антитела в среде тканевой культуры для оценки их характеристик. Получение трансфектом, продуцирующих моноклональные антитела к CD27 Антитела по изобретению также можно продуцировать в трансфектоме клетки-хозяина, используя,например, сочетание технологии рекомбинантных ДНК и методик трансфекции генов, хорошо известных в данной области (Morrison, S. (1985) Science 229:1202). Например, в одном из вариантов воплощения, ген(ы), интересующие исследователя, например, гены антитела человека, можно лигировать в экспрессирующий вектор, например, в эукариотическую экспрессирующую плазмиду, например, плазмиду, используемую в системе экспрессии генов GS, описанную в WO 87/04462, WO 89/01036 и ЕР 338841 или других зкспрессирующих системах, хорошо известных в данной области техники. Очищенную плазмиду с клонированными генами антитела можно внедрить в эукариотические клетки-хозяева, например, СНО-клетки или NSO-клетки или, в качестве альтернативы, другие зукариотические клетки типа клеток растительного происхождения, клеток грибов и дрожжей. Способ, используемый для внедрения этих генов, может представлять собой способ, описанный в данной области, например, электропорацию, липофектин, липофектамин или др. После внедрения указанных генов антител в клетки-хозяева можно идентифицировать и выделить клетки, экспрессирующие антитела. Эти клетки представляют собой трансфектомы, в которых затем можно усилить уровень экспрессии и использовать для широкомасштабного продуцирования антител. Затем можно выделить рекомбинантные антитела и очистить их от надостадочной культуральной жидкости и/или клеток. В качестве альтернативы указанные клонированные гены антител можно экспрессировать в других экспрессирующих системах, например, Е. coli или полных организмах или экспрессировать синтетически. Использование неполных последовательностей антител для экспрессии интактных антител Антитела взаимодействуют с антигенами-мишенями преимущественно через аминокислотные остатки, расположенные в шести гипервариабельных областях (CDR) тяжелых и легких цепей. По этой причине аминокислотные последовательности в пределах CDR в большей степени различаются между отдельными антителами, чем последовательности за пределами CDR. Поскольку последовательностиCDR отвечают за большинство взаимодействий антитело-антиген, можно экспрессировать рекомбинантные антитела, имитирующие свойства специфических природных антител, путем конструирования экспрессирующих векторов, включающих последовательности CDR специфических природных антител,пересаженные на каркасные последовательности другого антитела с другими свойствами (см., например,Riechmann, L. et al., 1998, Nature 332:323-327; Jones, P. et al., 1986, Nature 321:522-525; и Queen, C. et al.,1989, Proc. Natl. Acad. See. U.S.A. 86:10029-10033). Такие каркасные последовательности можно получить из общедоступных баз данных ДНК, которые включают последовательности генов антител эмбрионального типа. Эти последовательности эмбрионального типа отличаются от последовательностей генов зрелых антител, потому что они не содержат полностью собранных вариабельных генов, которые формируются путем объединения V(D)J во время созревания В-клетки. Последовательности генов эмбрионального типа также равномерно отличаются от последовательностей высокоаффинных антител вторичного иммунного репертуара организма на всем протяжении вариабельной области. Например, соматические мутации сравнительно редко встречаются в N-концевой части каркасной области. Например, соматические мутации сравнительно редко встречаются в N-концевой части каркасной области 1 и Сконцевой части каркасной области 4. Кроме того, многие соматические мутации не приводят к существенным изменениям связывающих свойств антитела. По этой причине нет необходимости получать полную последовательность ДНК конкретного антитела для воссоздания интактного рекомбинантного антитела, обладающего связывающими свойствами, аналогичными свойствам исходного антитела (см.PCT/US 99/05535, поданную 12 марта 1999 г.). Частичная последовательность тяжелой и легкой цепи,перекрывающая области CDR, обычно является достаточной для этой цели. Указанную частичную последовательность используют для определения генов вариабельных и соединительных сегментов эмбрионального типа, присутствующих в составе вариабельных генов рекомбинированного антитела. Затем для восполнения недостающих фрагментов вариабельных областей используют последовательности эмбрионального типа. Лидерные последовательности тяжелых и легких цепей расщепляются во время созревания белка и не вносят вклада в свойства окончательного антитела. Для добавления недостающих последовательностей можно сочетать клонированные кДНК-последовательности с синтетическими олигонуклеотидами путем лигирования или ПЦР-амплификации. В качестве альтернативы, полную вариабельную область можно синтезировать в виде набора коротких перекрывающихся олигонуклеотидов и объединить с помощью ПЦР-амплификации, создавая полный синтетический клон вариабельной области. Этот способ обладает определенными преимуществами, например, возможностью удаления или внедрения определенных сайтов рестрикции или оптимизации определенных кодонов.- 17024701 Для формирования набора перекрывающихся синтетических олигонуклеотидов для создания синтетических V-последовательностей с аминокислотной кодирующей емкостью, аналогичной природным последовательностям, используют нуклеотидные последовательности транскриптов тяжелых и легких цепей гибридомы. Последовательности синтетических последовательностей тяжелой и каппа-цепей могут отличаться от природных последовательностей по трем признакам: последовательности повторяющихся нуклеиновых оснований прерываются для облегчения синтеза олигонуклеотидов и ПЦРамплификации; внедрены оптимальные сайты инициации трансляции в соответствии с правилами Козака(Kozak, 1991, J. Biol. Chem. 266:19867-19870), и сконструированы сайты HindIII выше сайтов инициации трансляции. Для вариабельных областей как тяжелых, так и легких цепей последовательности оптимизированной кодирующей и соответствующей некодирующей цепей разделены на 30-50 нуклеотидов в области середины соответствующего некодирующего олигонуклеотида. Таким образом, для каждой цепи указанные олигонуклеотиды можно собрать в наборы перекрывающихся двуцепочечных последовательностей,охватывающих сегменты из 150-400 нуклеотидов. Затем указанные пулы используют в качестве матриц для получения продуктов ПЦР-амплификации длиной 150-400 нуклеотидов. Как правило, один набор олигонуклеотидов вариабельной области делят на два пула, которые раздельно амплифицируют, получая два перекрывающихся продукта ПЦР. Указанные перекрывающиеся продукты затем объединяют с помощью ПЦР-амплификации, формируя полную вариабельную область. Кроме того, при ПЦРамплификации может быть желательно включить перекрывающийся фрагмент константной области тяжелой или легкой цепи (включая сайт BbsI легкой каппа-цепи или сайт AgeI, тяжелой гамма-цепи) для создания фрагментов, которые можно легко клонировать в конструктах экспрессирующих векторов. Реконструированные вариабельные области тяжелых и легких цепей затем объединяют с клонированным промотором, лидерной последовательностью, последовательностью инициации трансляции, лидерной последовательностью, константной областью, 3'-нетранслируемой последовательностью, последовательностью полиаденилирования и последовательностью терминации транскрипции, формируя конструкт экспрессирующего вектора. Экспрессирующие конструкты тяжелых и легких цепей можно объединить в единый вектор, совместно трансфицировать, последовательно трансфицировать или раздельно трансфицировать в клетки-хозяева, которые затем сливают, образуя клетки-хозяева, экспрессирующие обе цепи. Плазмиды для конструирования экспрессирующих векторов сконструированы так, что ПЦРамплифицированные V-последовательности кДНК тяжелых и легких каппа-цепей можно использовать для реконструирования полных минигенов тяжелой и легкой цепи. Указанные плазмиды можно использовать для экспрессии полностью человеческих IgG1- или IgG4-антител. Полностью человеческие и химерные антитела по настоящему изобретению также включают антитела IgG2, IgG3, IgE, IgA, IgM иIgD. Аналогичные плазмиды можно сконструировать для экспрессии других изотипов тяжелых цепей или для экспрессии антител, содержащих легкие лямбда-цепи. Так, в еще одном аспекте изобретения, структурные особенности антител против CD27 по изобретению использовали для создания близких по структуре антител против CD27, сохраняющих, по меньшей мере, одно функциональное свойство антител по изобретению, например,(1) ингибирующих (например, полностью или частично блокирующих) связывание CD70 с клетками, экспрессирующими CD27, по меньшей мере, приблизительно на 70% (например, по меньшей мере,приблизительно на 70% или, по меньшей мере, на 70% при концентрации антител 10 мкг/мл);(2) связывающихся с CD27 человека с равновесной константой диссоциации Kd, равной 10-9 М или менее, или, в качестве альтернативы, с равновесной константой ассоциации Ka, равной 10+9 M-1 или более;(5) предотвращающих или подавляющих рост опухолевых клеток, экспрессирующих CD27, на модели ксенотрансплантата (например, уменьшающих размер опухоли у мышей с тяжелой комбинированной иммунной недостаточностью (ТКИН), по меньшей мере, приблизительно на 50% через 20 суток после инокуляции опухолевых клеток in vivo при внутрибрюшинном введении 0,5 мг, по меньшей мере, на 6 сутки);(6) вызывающих или усиливающих антиген-специфические иммунные реакции в сочетании с вакциной или другим антигеном;(7) вызывающих или усиливающих иммунный ответ, в частности, иммунный ответ ТН 1, но, не ограничиваясь им;(8) индуцирующих или усиливающих Т-клеточную активность, в частности, количество или функциональную активность специфических CD8+ Т-клеток, или пролиферацию или активацию Т-клеток, но не ограничиваясь ими; и / или(9) ослабляющих или ингибирующих пролиферацию или активацию Т-клеток. В одном из вариантов воплощения одну или несколько CDR-областей антител по изобретению можно рекомбинантно объединить с известными каркасными областями и CDR, создавая дополнительные рекомбинантные антитела против CD27 по изобретению. Вариабельные каркасные области тяжелой и легкой цепи могут происходить от одних и тех же или различных последовательностей антител. Последовательности антител могут представлять собой последовательности природных антител или консенсусные последовательности нескольких антител. См. Kettleborough et al., Protein Engineering 4:773(1991); Kolbinger et al., Protein Engineering 6:971 (1993) и Carter et al., WO 92/22653. Соответственно, в еще одном варианте воплощения настоящее изобретение представляет способ получения антител против CD27, включающий: получение антитела, в том числе (1) каркасных областей тяжелых цепей и CDR тяжелых цепей, причем, по меньшей мере, один из CDR тяжелых цепей включает аминокислотную последовательность, выбранную из аминокислотных последовательностей CDR, представленных в SEQ ID NO:8, 9, 10, 26, 27, 28, 38, 39, 40, 50, 51, 52, 62, 63, 64, 74, 75, 76, 86, 87, 88, 104,105, 106; и (2) каркасных областей легких цепей и CDR легких цепей, причем, по меньшей мере, один изCDR легких цепей включает аминокислотную последовательность, выбранную из аминокислотных последовательностей CDR, представленных в SEQ ID NO:14, 15, 16, 20, 21, 22, 32, 33, 34, 44, 45, 46, 56, 57,58, 68, 69, 70, 80, 81, 82, 92, 93, 94, 98, 99, 100, 110, 111, 112; причем указанное антитело сохраняет способность связываться с CD27. Способность антитела связывать CD27 можно определить с помощью стандартных анализов связывания, например, изложенных в примерах (например, ELISA или твердофазного флуоресцентного иммуноанализа). В данной области техники известно, что CDR3-домены тяжелых и легких цепей антител играют особенно важную роль в специфичности/сродстве связывания антитела с антигеном (см. Hall et al., J.(2000); Rader et al., Proc. Natl. Acad. Sci. USA, 95:8910-8915 (1998); Barbas et al., J. Am. Chem. Soc.,116:2161-2162 (1994); Ditzel et al., J. Immunol., 157:739-749 (1996. Соответственно, рекомбинантные антитела по изобретению, изготовленные, как указано выше, предпочтительно содержат CDR3 тяжелых и/или легких цепей антител 1F5, 1 Н 8, 3 Н 12, 3 А 10, 2 С 2, 2G9, 3 Н 8 и 1G5. Кроме того, указанные антитела могут содержать CDR2 антител 1F5, 1 Н 8, 3 Н 12, 3 А 10, 2 С 2, 2G9, 3 Н 8 и 1G5. Кроме того, указанные антитела могут содержать CDR1 антител 1F5, 1 Н 8, 3 Н 12, 3 А 10, 2 С 2, 2G9, 3 Н 8 и 1G5. Кроме того, антитела могут содержать любые комбинации указанных CDR. Соответственно, в еще одном варианте воплощения, изобретение также представляет антитела против CD27, содержащие: (1) каркасные области тяжелых цепей, CDR1-область тяжелой цепи, CDR2 область тяжелой цепи и CDR3-область тяжелой цепи, причем CDR3-область тяжелой цепи выбирают изCDR3 1F5, 1H8, 3 Н 12, 3 А 10, 2 С 2, 2G9, 3 Н 8 и 1G5, и (2) каркасные области легких цепей, CDR1-область легкой цепи, CDR2-область легкой цепи и CDR3-область легкой цепи, причем CDR3-область легкой цепи выбирают из CDR3 1F5, 1 Н 8, 3 Н 12, 3 А 10, 2 С 2, 2G9, 3 Н 8 и 1G5, причем антитело связывает CD27. Антитело может дополнительно включать CDR2 тяжелых цепей и/или CDR2 легких цепей антител 1F5,1 Н 8, 3 Н 12, 3 А 10, 2 С 2, 2G9, 3 Н 8 и 1G5. Антитело может дополнительно содержать CDR1 тяжелых цепей и/или CDR1 легких цепей антител 1F5, 1 Н 8, 3 Н 12, 3 А 10, 2 С 2, 2G9, 3 Н 8 и 1G5. Получение антител с модифицированными последовательностями В еще одном варианте воплощения последовательности вариабельных областей антител противCD27 или их фрагменты по изобретению модифицируют, создавая близкие по структуре антитела противCD27, которые сохраняют связывающую способность (т.е. с тем же эпитопом, что и немодифицированные антитела) и, таким образом, являются функционально эквивалентными. Способы идентификации остатков, которые можно изменить без потери способности связывать антиген, хорошо известны в данной области техники (см., например, Marks et al. (Biotechnology (1992) 10(7):779-83 (диверсификация моноклональных антител путем перетасовки вариабельных областей легкой цепи, а затем вариабельных областей тяжелой цепи при фиксированных изменениях последовательности CDR3), Jespers et al.(1994)Biotechnology 12(9):899-903 (выбор антител человека из репертуара фагового дисплея к единичному эпитопу антигена), Sharon et al. (1986) PNAS USA 83(8):2628-31 (сайт-направленный мутагенез инвариантного аминокислотного остатка в положении соединения вариабельного и дополнительного сегментов антитела); Casson et al. (1995) J. Immunol. 155(12):5647-54 (эволюция утраты и изменения специфичности в результате случайного мутагенеза вариабельной области тяжелой цепи антитела). Соответственно, в одном из аспектов настоящего изобретения области CDR1, 2 и/или 3 вышеописанных сконструированных антител могут содержать точную(ые) аминокислотную(ые) последовательность(и) антител 1F5, 1 Н 8, 3 Н 12, 3 А 10, 2 С 2, 2G9, 3 Н 8 и 1G5, описанных здесь. Вместе с тем, в других аспектах настоящего изобретения антитела содержат производные от точных последовательностей CDR 1F5, 1 Н 8, 3 Н 12, 3 А 10, 2 С 2, 2G9, 3 Н 8 и 1G5, сохраняя способность эффективно связывать CD27. Такие- 19024701 модификации последовательности могут включать добавление, делецию или замену одной или более аминокислот, например, консервативные модификации последовательности, как описано выше. Модификации последовательностей также могут основываться на консенсусных последовательностях, описанных выше для конкретных последовательностей CDR1, CDR2 и CDR3 антител 1F5, 1 Н 8, 3 Н 12, 3 А 10,2 С 2, 2G9, 3 Н 8 и 1G5. Соответственно, в еще одном варианте воплощения сконструированное антитело может содержать один или более CDR, являющихся, например, на 90, 95, 98 или 99,5% идентичными одному или болееCDR антител 1F5, 1 Н 8, 3 Н 12, 3 А 10, 2 С 2, 2G9, 3 Н 8 и 1G5. Подразумевается, что промежуточные диапазоны вышеуказанных значений, например, CDR, на 90-95%, 95-98%, 90-95% или 98-100% идентичные одной или более из вышеупомянутых последовательностей, также входят в объем настоящего изобретения. В еще одном варианте воплощения можно изменить один или несколько остатков в составе CDR,модифицируя характеристики связывания с целью получения более благоприятной скорости ассоциации,более благоприятной скорости диссоциации или обеих этих характеристик, так что достигается оптимальная константа связывания. При использовании этой стратегии можно получить антитело со сверхвысоким сродством связывания, равным, например, 1010 M-1 или более. Для модификации CDRобласти(ей) можно использовать методики созревания аффинности, хорошо известные в данной области техники и описанные здесь, с последующим скринингом полученных связывающих молекул на желательные изменения характеристик связывания. Соответственно, после модификации CDR можно отслеживать и оценивать изменения сродства связывания, а также иммуногенности, получая антитело, оптимизированное по наилучшему сочетанию связывающей способности и низкой иммуногенности. В дополнение к или вместо модификаций в пределах CDR, также можно внести модификации в пределах одной или более каркасных областей FR1, FR2, FR3 и FR4 вариабельных областей тяжелой и/или легкой цепи антитела, при условии, что эти модификации не устраняют сродства связывания антитела. Например, один или более аминокислотный остаток неэмбрионального типа в каркасных вариабельных областях тяжелой цепи и/или легкой цепи антитела по изобретению замещают аминокислотным остатком эмбрионального типа, т.е. соответствующим аминокислотным остатком последовательности вариабельной области тяжелой или легкой цепи человека эмбрионального типа, которая в значительной степени идентична последовательности указанного антитела. Например, цепь антитела и цепь антитела эмбрионального типа, для которых характерна значительная идентичность последовательностей, можно выровнять друг с другом и заменить аминокислотные остатки, не совпадающие в каркасной последовательности антитела и в каркасной последовательности эмбрионального типа, соответствующими остатками из последовательности эмбрионального типа. Если аминокислота различается в вариабельной каркасной области антитела и эквивалентной вариабельной каркасной области последовательности эмбрионального типа человека, аминокислоту каркаса антитела обычно следует заменить эквивалентной аминокислотой последовательности эмбрионального типа человека, если имеются основания ожидать, что указанная аминокислота относится к одной из следующих категорий:(1) аминокислотному остатку, непосредственно связывающему антиген нековалентным образом,(2) аминокислотному остатку, примыкающему к CDR-области,(3) аминокислотному остатку, иным образом взаимодействующему с CDR-областью (например,расположенный в пределах 3-6 от CDR-области, согласно данным компьютерного моделирования),или(4) аминокислотному остатку, участвующему в контакте VL-VH. Остатки, "непосредственно связывающие антиген нековалентным образом", включают аминокислоты в положениях каркасных областей,для которых характерна высокая вероятность непосредственного взаимодействия с аминокислотами антигена посредством известных химических сил, например, водородных связей, сил ван-дер-Ваальса, гидрофобных взаимодействий и т.п. Соответственно, в одном из вариантов воплощения аминокислотный остаток в каркасной области антитела по изобретению заменяют соответствующим аминокислотным остатком эмбрионального типа, который непосредственно связывает антиген нековалентным образом. Остатки, "примыкающие к CDR-области", включают аминокислотные остатки в положениях, непосредственно примыкающих к одному или нескольким CDR первичной последовательности антитела,например, в положениях, непосредственно примыкающих к CDR по Кабату или по Chothia (см., например, Chothia and Lesk J. Mol. Biol. 196:901 (1987. Соответственно, в одном из вариантов воплощения аминокислотный остаток в каркасной области антитела по изобретению заменяют соответствующим аминокислотным остатком эмбрионального типа, который примыкает к CDR-области. Остатки, "иным образом взаимодействующие с CDR-областью", включают остатки, пространственное расположение которых, согласно анализу вторичной структуры, позволяет им влиять на CDRобласть. Такие аминокислоты, как правило, содержат атом боковой цепи, расположенный в пределах 3 ангстремот какого-либо атома в составе CDR, и должны содержать атом, который может взаимодействовать с атомами CDR посредством известных химических сил, например, перечисленных выше. Соответственно, в одном из вариантов воплощения аминокислотный остаток в каркасной области антитела по изобретению заменяют соответствующим аминокислотным остатком эмбрионального типа, который- 20024701 иным образом взаимодействует с CDR-областью. Известно, что аминокислоты в нескольких положениях каркаса важны для определения конформации CDR (например, способны взаимодействовать с CDR) многих антител (Chothia and Lesk, supra, Chothia et al., supra, и Tramontano et al., J. Mol. Biol. 215:175 (1990), включенные в настоящий документ посредством ссылок). Эти авторы идентифицировали консервативные остатки каркаса, важные для конформации CDR, с помощью анализа структуры нескольких известных антител. Проанализированные антитела относились к ограниченному количеству структурных или "канонических" классов, основанных на конформации CDR. Консервативные остатки каркаса, общие для членов канонического класса, называют "каноническими" остатками. Канонические остатки включают остатки 2, 25, 29, 30, 33, 48, 64, 71,90, 94 и 95 легкой цепи и остатки 24, 26, 29, 34, 54, 55, 71 и 94 тяжелой цепи. Дополнительные остатки(например, остатки, определяющие структуру CDR) можно идентифицировать согласно методологииMartin and Thorton (1996) J. Mol. Biol. 263:800. Примечательно, что аминокислоты в положениях 2, 48, 64 и 71 легкой цепи и 26-30, 71 и 94 тяжелой цепи (нумерация по Кабату), как известно, способны взаимодействовать с CDR во многих антителах. Аминокислоты в положениях 35 в легкой цепи и 93 и 103 в тяжелой цепи также, вероятно, взаимодействуют с CDR. Дополнительные остатки, которые могут влиять на конформацию CDR, можно идентифицировать согласно методологии Foote and Winter (1992) J. Mol.Biol. 224:487. Такие остатки называются "верньерными" остатками и представляют собой остатки каркасной области, расположенные непосредственно под (т.е. образующие "платформу" под) CDR. Остатки, "участвующие в контакте VL-VH" или "упаковочные остатки" включают остатки, расположенные на поверхности контакта между VL и VH, согласно определению, например, Novotny and Haber,Proc. Natl. Acad. Sci. USA, 82:4592-66 (1985) или Chothia et al, supra. Иногда возникает некоторая неоднозначность в принадлежности конкретной аминокислоты к одной или более вышеупомянутых категорий. В таких случаях продуцируются альтернативные варианты антител, одно из которых содержит данную конкретную замену, а другое - нет. Желательную активность альтернативных вариантов антител, полученных таким образом, можно протестировать с помощью любого из анализов, описанных здесь, и выбрать предпочтительные антитела. Дополнительными кандидатами на замену в каркасной области являются аминокислоты, которые являются необычными или "редкими" для антитела в этом положении. Указанные аминокислоты можно заменить аминокислотами из эквивалентного положения последовательности человека эмбрионального типа или из эквивалентных положений более типичных антител. Например, замена может быть желательна, если аминокислота каркасной области антитела редко встречается в этом положении, а соответствующая аминокислота в последовательности эмбрионального типа является распространенной в этом положении в последовательностях иммуноглобулинов; или если аминокислота каркасной области антитела редко встречается в этом положении, а соответствующая аминокислота в последовательности эмбрионального типа также встречается редко по сравнению с другими последовательностями. Предполагается, что за счет замены необычной аминокислоты аминокислотой из последовательности эмбрионального типа, являющейся типичной для антител, антитело можно сделать менее иммуногенным. Термин "редкий", как используется здесь, означает аминокислоту, встречающуюся в данном положении менее чем приблизительно в 20%, предпочтительно менее чем приблизительно в 10%, более предпочтительно - менее чем приблизительно в 5%, еще более предпочтительно - менее чем приблизительно в 3%, еще более предпочтительно - менее чем приблизительно в 2%, и еще более предпочтительно - менее чем приблизительно в 1% последовательностей в репрезентативной выборке последовательностей, а термин "распространенный", как используется здесь, означает аминокислоту, встречающуюся более чем приблизительно в 25%, но обычно более чем в приблизительно в 50% последовательностей репрезентативной выборки. Например, все последовательности вариабельных областей легких и тяжелых цепей, соответственно, сгруппированы в "подгруппы" последовательностей, обладающих повышенной гомологией по отношению друг к другу и содержащих одни и те же аминокислоты в определенных критических положениях (Kabat et al., supra). При определении того, является ли аминокислота в последовательности антитела "редкой" или "распространенной" среди последовательностей, часто бывает предпочтительно рассматривать только последовательности в той же подгруппе, к которой принадлежит последовательность антитела. В общем случае каркасные области антител, как правило, в значительной степени идентичны и, чаще всего, идентичны каркасным областям последовательностей человека эмбрионального типа, от которых они происходят. Разумеется, многие из аминокислот каркасной области вносят незначительный вклад или не вносят непосредственного вклада в специфичность или сродство антитела. Таким образом,могут быть допустимы многие отдельные консервативные замены остатков каркасов, не приводящие к заметному изменению специфичности или сродства получаемого иммуноглобулина. Так, в одном из вариантов воплощения вариабельная каркасная область антитела обладает по меньшей мере 85% идентичностью последовательности с последовательностью вариабельной каркасной области человека эмбрионального типа или консенсусной последовательностью, рассчитанной на основе таких последовательностей. В еще одном из вариантов воплощения вариабельная каркасная область антитела обладает по меньшей мере 90, 95, 96, 97, 98 или 99% идентичностью последовательности с последовательностью ва- 21024701 риабельной каркасной области человека эмбрионального типа или консенсусной последовательностью,рассчитанной на основе таких последовательностей. В дополнение к простому связыванию CD27, антитело можно выбрать на основе сохранения ими других функциональных свойств антител по изобретению, например:(1) ингибирования (например, полного или частичного блокирования) связывания CD70 с клетками,экспрессирующими CD27, по меньшей мере, приблизительно на 70%;(2) связывания с CD27 человека с равновесной константой диссоциации Kd, равной 10-9 M или менее, или, в качестве альтернативы, с равновесной константой ассоциации Ka, равной 10+9 M-1 или более;(4) индукции, по меньшей мере, приблизительно 40% ADCC-опосредованного специфического лизиса клеток, экспрессирующих CD27, в концентрации 10 мкг/мл. Исследование характеристик моноклональных антител к CD27 Связывание моноклональных антител по изобретению с CD27 можно охарактеризовать с помощью различных известных методик. Как правило, характеристики антител вначале оценивают с помощью ELISA. Кратко, титрационные микропланшеты можно покрыть очищенным CD27 в PBS, а затем заблокировать неспецифическими белками, например, бычьим сывороточным альбумином (БСА), разбавленным PBS. В каждую лунку вносили разведения плазмы CD27-иммунизированных мышей и инкубировали в течение 1-2 ч и 37 С. Планшеты промывали PBS/Tween 20 и затем инкубировали с Fc-специфическим поликлональным реагентом козы против IgG человека, конъюгированным со щелочной фосфатазой, в течение 1 ч при 37 С. После промывки планшеты обрабатывали субстратом ABTS и анализировали при OD 405 нм. Предпочтительно мышей, у которых развивались высокие титры, использовали для слияния.ELISA, как описано выше, можно использовать для скрининга антител и, таким образом, гибридом,продуцирующих антитела, обладающие положительной способностью реагировать с иммуногеномCD27. Гибридомы, связывающиеся с CD27, желательно с высоким сродством, можно клонировать и исследовать далее. Один клон из каждой гибридомы, сохраняющий реакционную способность родительских клеток (согласно ELISA), можно выбрать для создания банка клеток, а также для очистки антител. Для очистки антител против CD27, выбранную гибридому можно вырастить в роллер-флаконах,двухлитровых роллерных колбах или других системах для культивирования. Надосадочную жидкость можно отфильтровать и концентрировать, а затем подвергнуть аффинной хроматографии с сорбентом белок А-сефароза (Pharmacia, Пискатауэй, штат Нью-Джерси, США) для очистки белка. После замены буфера на PBS можно определить концентрацию при OD280, используя коэффициент экстинкции 1,43,или предпочтительно с помощью нефелометрического анализа. IgG можно проверять с помощью гельэлектрофореза и с помощью антиген-специфического способа. Для определения того, связываются ли выбранные моноклональные антитела против CD27 с уникальными эпитопами, каждое антитело можно биотинилировать с использованием доступных для приобретения реагентов (Pierce, Рокфорд, штат Иллинойс, США). Связывание биотинилированных моноклональных антител можно обнаружить с помощью зонда, меченого стрептавидином. Для определения изотипа очищенных антител можно выполнить ELISA изотипов с помощью принятых в данной области техники методик. Например, лунки титрационных микропланшетов можно покрыть с 10 мкг/мл антител против Ig в течение ночи при 4 С. После блокирования 5% БСА планшеты подвергали реакции с 10 мкг/мл моноклональных антител или очищенных изотипических контролей при комнатной температуре в течение двух часов. Затем лунки можно подвергнуть реакции с зондом, специфически конъюгированным с IgG1 или другим изотипом. Планшеты обрабатывали и анализировали, как описано выше. Для тестирования связывания моноклональных антител с живыми клетками, экспрессирующимиCD27, можно использовать проточную цитометрию. Кратко, линии клеток и/или мононуклеары периферической крови человека, экспрессирующие мембраносвязанный CD27 (выращенные в стандартных условиях), смешивают с различными концентрациями моноклональных антител в PBS, содержащем 0,1% БСА при 4 С в течение 1 ч. После промывки клетки подвергают реакции с антителами против IgG, мечеными флуоресцеином, в тех же условиях, что и при окрашивании первичных антител. Образцы можно анализировать с помощью инструмента FACScan при использовании светорассеяния и бокового светорассеяния, гейтируя одиночные клетки, и определять связывание меченых антител. Можно использовать(в дополнение к или вместо) проточно-цитометрического анализа альтернативный анализ с использованием флуоресцентной микроскопии. Клетки можно окрасить в строгом соответствии с вышеприведенным описанием и оценить с помощью флуоресцентной микроскопии. Этот способ позволяет визуализировать отдельные клетки, но может обладать пониженной чувствительностью в зависимости от плотности антигена.IgG против CD27 можно дополнительно протестировать на способность реагировать с антигеномCD27 с помощью вестерн-блоттинга. Кратко, можно получить экстракты клеток, экспрессирующихCD27, и подвергнуть их электрофорезу в полиакриламидном геле с додецилсульфатом натрия. После электрофореза разделенные антигены переносят на нитроцеллюлозные мембраны, блокируют 20% сыво- 22024701 роткой мыши и анализируют, используя тестируемые моноклональные антитела. Связывание IgG можно обнаружить с помощью антител против IgG, меченых щелочной фосфатазой и проявить с помощью таблеток субстрата BCIP/NBT (Sigma Chem. Co., Сент-Луис, штат Миссури, США). Способы анализа аффинности связывания, перекрестной реакционной способности и кинетики связывания различных антител против CD27 включают стандартные анализы, известные в данной области техники, например, анализ поверхностного плазменного резонанса (SPR) Biacore с использованиемSPR-анализатора Biacore 2000 (Biacore AB, Уппсала, Швеция), как описано здесь в примере 2.II. Иммунотоксины. В еще одном варианте воплощения антитела по настоящему изобретению связывают с терапевтической группой, например, цитотоксином, лекарственным агентом или радиоактивным изотопом. При конъюгировании с цитотоксином эти конъюгаты антител называются "иммунотоксинами". Цитотоксин или цитотоксический агент включает любой агент, который наносит ущерб клеткам (например, уничтожает их). Примеры включают таксол, цитохалазин В, грамицидин D, этидий-бромид, эметин, митомицин,этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромицин и их аналоги или гомологи. Терапевтические агенты включают антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5 фторурацил, декарбазин), алкилирующие агенты (например, мехлорэтамин, тиотепа, хлорамбуцил, мелфалан, кармустин (BSNU) и ломустин (CCNU), циклофосфамид, бусульфан, дибромманнит, стрептозотоцин, митомицин С и цис-дихлордиаминплатину (II) (DDP), цисплатин), антрациклины (например, даунорубицин (ранее дауномицин) и доксорубицин), антибиотики (например, дактиномицин (ранее актиномицин), блеомицин, митрамицин и антрамицин (АМС и антимитотические агенты (например, винкристин и винбластин), но не ограничиваются ими. Антитело по настоящему изобретению можно конъюгировать с радиоактивным изотопом, например, радиоактивным иодом, получая цитотоксические радиофармацевтические средства для лечения расстройства, ассоциированного с дендритными клетками, например, аутоиммунного или воспалительного заболевания или реакции "трансплантат против хозяина". Конъюгаты антител по изобретению можно использовать для модификации данной биологической ответной реакции, а лекарственную группу в составе препарата не следует рассматривать как ограничивающую настоящее изобретение классическими химическими терапевтическими агентами. Например,лекарственная группа в составе препарата может представлять собой белок или полипептид, обладающий желательной биологической активностью. Такие белки могут включать, например, токсин, обладающий ферментативной активностью, или его активный фрагмент, например, абрин, рицин А, экзотоксин Pseudomonas или дифтерийный токсин; белок, например, фактор некроза опухолей или интерферон; или модификаторы биологического ответа, например, лимфокины, интерлейкин-1 ("IL-1"), интерлейкин-2 ("IL-2"), интерлейкин-6 ("IL-6"), гранулоцитарно-макрофагальный колонестимулирующий фактор("GM-CSF"), гранулоцитарный колониестимулирующий фактор ("G-CSF") или другие факторы роста. Хорошо известны методики конъюгирования такой терапевтической группы с антителом, см., например, Arnon et al., "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy", в Monoclonal Antibodies And Cancer Therapy, Reisfeld et al. (eds.), pp. 243-56 (Alan R. Liss, Inc. 1985); Hellstrom etIII. Композиции. В еще одном варианте воплощения настоящее изобретение представляет композицию, например,композицию, содержащую одно моноклональное антитело по настоящему изобретению или их комбинацию, включенное в состав препарата вместе с носителем (например, фармацевтически приемлемым носителем). Кроме того, представлены композиции, содержащие биспецифические молекулы, содержащие антитело по настоящему изобретению. В одном из вариантов воплощения композиции включают комбинацию нескольких (например, двух или более) выделенных антител по изобретению. Предпочтительно каждое из антител композиции связывает отдельный, заранее выбранный эпитоп CD27. Кроме того, фармацевтическую композицию по изобретению можно вводить в рамках комбинированной терапии, т.е. в комбинации с другими агентами. Например, комбинированная терапия может включать композицию по настоящему изобретению, по меньшей мере, с одним или несколькими дополнительными терапевтическими агентами, например, противовоспалительными агентами, DMARD (модифицирующими заболевание противоревматическими препаратами), иммунодепрессантами и химиотерапевтическими средствами. Фармацевтическую композицию по изобретения также можно вводить в сочетании с лучевой терапией. Совместное введение с другими антителами также входит в объем изо- 23024701 бретения. Как используются здесь, термины "носитель" и "фармацевтически приемлемый носитель" включают всевозможные растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и задерживающие всасывание агенты и т.п., являющиеся физиологически совместимыми. Предпочтительно носитель подходит для внутривенного, внутримышечного, подкожного, парентерального, спинального или эпидермального введения (например, путем инъекции или вливания). В зависимости от пути введения активное соединение, т.е. антитело, биспецифическую и полиспецифическую молекулу, можно покрыть материалом для защиты соединения от действия кислот и других природных условий, которые могут инактивировать соединение. Примеры адъювантов, которые можно использовать с антителами и конструктами по настоящему изобретению, включают: неполный адъювант и полный адъювант Фрейнда (Difco Laboratories, Детройт,штат Мичиган, США); адъювант Merck Adjuvant 65 (Merck and Company, Inc., Роуэй, штат Нью-Джерси,США); AS-2 (SmithKline Beecham, Филадельфия, штат Пенсильвания, США); соли алюминия, например,гель гидроксида алюминия (квасцы) или фосфат алюминия; соли кальция, железа и цинка; нерастворимую суспензию ацилированного тирозина; ацилированные сахара; полисахариды, модифицированные катионами или анионами; полифосфазены; биоразлагаемые микросферы; цитокины, например, GM-CSF,интерлейкин-2, -7, -12 и другие подобные факторы; 3D-MPL; CpG-олигонуклеотид; и монофосфориллипид А, например 3-де-О-ацилированный монофосфориллипид А.MPL-адъюванты доступны от Corixa Corporation (Сиэтл, штат Вашингтон, США; см., например, патенты США 4436727; 4877611; 4866034 и 4912094). CpG-содержащие олигонуклеотиды (в которых динуклеотид CpG неметилирован) хорошо известны и описаны, например, в WO 96/02555, WO 99/33488 и патентах США 6008200 и 5856462. Иммуностимулирующие последовательности ДНК также описаны,например, Sato et al., Science 273:352, 1996. Другие альтернативные адъюванты включают, например, сапонины, например, Quil А или его производные, включая QS21 и QS7 (Aquila Biopharmaceuticals Inc., Фремингейм, штат Массачусетс, США); эсцин; дигитонин; или сапонины Gypsophila или Chenopodium quinoa; монтанид ISA 720 (Seppic, Франция); SAF (Chiron, штат Калифорния, США); иммуностимулирующие комплексы (CSL), MF-59 (Chiron); серию адъювантов SBAS (например, SBAS-2 или SBAS-4, доступные от SmithKline Beecham, Риксансар,Бельгия); детокс (EnhanzynTM) (Corixa, Гамильтон, штат Монтана, США); RC-529 (Corixa, Гамильтон,штат Монтана, США) и другие аминоалкилглюкозаминид-4-фосфаты (AGP); адъюванты на основе эфиров полиоксиэтилена, например, описанные в WO 99/52549 А 1; синтетические имидазохинолины, например, имиквимод [S-26308, R-837], (Harrison, et al., Vaccine 19: 1820-1826, 2001; и резиквимод [S-28463, R848] (Vasilakos, et al., Cellular immunology 204: 64-74, 2000; шиффовы основания карбонилов и аминов,конститутивно экспрессирующиеся на поверхности антигенпрезентирующих клеток и Т-клеток, например, тукарезол (Rhodes, J. et al., Nature 377: 71-75, 1995); цитокины, хемокины и костимуляторные молекулы, являющиеся пептидами или белками, включая, например, провоспалительные цитокины, например, интерферон, GM-CSF, IL-1 альфа, IL-1 бета, TGF-альфа и TGF-бета, индукторы Th1, например, интерферон-гамма, IL-2, IL-12, IL-15, IL-18 и IL-21, индукторы Th2, например, IL-4, IL-5, IL-6, IL-10 и IL13 и гены других хемокинов и костимуляторов, например, МСР-1, MIP-1 альфа, MIP-1 бета, RANTES,ТСА-3, CD80, CD86 и CD40L; иммуностимуляторы, мишенями которых являются лиганды, например,CTLA-4 и L-селектин, белки и пептиды, стимулирующие апоптоз, например, Fas; адъюванты на основе синтетических липидов, например, ваксфектин, (Reyes et al., Vaccine 19: 3778-3786, 2001) сквален, альфатокоферол, полисорбат 80, диолеилфосфатидилхолин и холестерин; эндотоксин, [LPS], (Beutler, В., Current Opinion in Microbiology 3: 23-30, 2000); лиганды, переключающие Toll-рецепторы на продукциюTh1-индуцирующих цитокинов, например, синтетические микобактериальные липопротеины, микобактериальный белок р 19, пептидогликан, тейхоевые кислоты и липид А; СТ (холерный токсин, субъединицы А и В) и LT (термолабильный энтеротоксин Е. coli, субъединицы А и В), семейство белков теплового шока (HSP) и LLO (листериолизин О; WO 01/72329). Эти и различные другие агонисты Toll-подобного рецептора (TLR) описаны, например, в Kanzler et al, Nature Medicine, May 2007, Vol 13, No 5. Предпочтительным иммуностимулятором для использования в комбинации с антителом противCD27 по изобретению является агонист TLR3, например, Poly IC."Фармацевтически приемлемая соль" относится к соли, сохраняющей желательную биологическую активность исходного соединения и не обладающей нежелательным токсикологическим действием (см.,например, Berge, S.M., et al. (1977) J. Pharm. Sci. 66:1-19). Примеры таких солей включают соли добавления кислот и соли добавления оснований. Соли добавления кислот включают соли, происходящие от нетоксичных неорганических кислот, например, соляной, азотной, фосфорной, серной, бромистоводородной, йодоводородной, фосфористой и т.п., а также от нетоксичных органических кислот, например,алифатических моно - и дикарбоновых кислот, фенилзамещенных карбоновых кислот, гидроксикарбоновых кислот, ароматических кислот, алифатических и ароматических сульфоновых кислот и т.п. Соли добавления оснований включают соли, происходящие от щелочноземельных металлов, например, натрия, калия, магния, кальция и т.д., а также от нетоксичных органических аминов, например N,N'дибензилэтилендиамина, N-метилглюкамина, хлорпрокаина, холина, диэтаноламина, этилендиамина,- 24024701 прокаина и т.п. Композиции по настоящему изобретению можно вводить с помощью разнообразных способов, известных в данной области техники. Специалист должен принимать во внимание, что путь и/или режим введения варьируется в зависимости от желательных результатов. Активные соединения можно изготовить в комбинации с носителями, защищающими соединение от быстрого высвобождения, например,препараты контролируемого высвобождения, включая импланты, трансдермальные пластыри и микрокапсулированные системы доставки. Можно использовать биоразлагаемые, биосовместимые полимеры,например, этиленвинилацетат, полиангидриды, полигликолевую кислоту, коллаген, полиортоэфиры и полимолочную кислоту. Многие способы изготовления таких составов запатентованы или известны специалистам в данной области техники. См., например, Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978. Для введения соединения по изобретению посредством определенного пути введения может быть необходимо покрыть соединение или совместно вводить соединение с материалом для предотвращения его инактивации. Например, соединение можно ввести в организм субъекта в подходящем носителе, например, липосомах или разбавителе. Приемлемые разбавители включают физиологический раствор и водные буферные растворы. Липосомы включают CGF-эмульсии типа "вода в масле в воде", а также традиционные липосомы (Strejan et al. (1984) J. Neuroimmunol. 7:27). Носители включают стерильные водные растворы или дисперсии и стерильные порошки для немедленного приема или стерильные растворы или дисперсии для инъекций. Использование таких сред и агентов в комбинации с фармацевтически активными веществами хорошо известно в данной области техники. Кроме того, поскольку любая обычная среда или агент несовместима с активным соединением,рассматривается их использование в фармацевтической композиции по изобретению. В композиции можно также включать дополнительные активные соединения. Терапевтические композиции обычно должны быть стерильными и стабильными в условиях производства и хранения. Композицию можно составить в виде раствора, микроэмульсии, липосомы или другой упорядоченной структуры, подходящей для высокой концентрации лекарственного агента. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.) и их подходящие смеси. Надлежащую текучесть можно поддерживать, например, путем использования покрытий,например, лецитина, путем поддержания требуемого размера частиц в случае дисперсии и путем использования ПАВ. Во многих случаях предпочтительно включать в композицию изотонические агенты, например, сахара, многоатомные спирты, например, маннит, сорбит или хлорид натрия. Длительное поглощение композиций, вводимых путем инъекции, можно осуществить путем включения в композицию агента, замедляющего поглощение, например, солей моностеарата и желатина. Стерильные растворы для инъекций можно изготовить путем включения активного соединения в необходимом количестве в соответствующий растворитель с одним из ингредиентов, перечисленных выше, или их комбинацией, при необходимости, с последующей стерилизацией микрофильтрацией. Как правило, дисперсии изготавливают путем включения активного соединения в стерильную средуноситель, содержащую основную дисперсионную среду и другие необходимые ингредиенты из числа вышеперечисленных. В случае стерильного порошка для приготовления стерильных растворов для инъекций предпочтительными способами изготовления являются вакуумная сушка и сублимационная сушка(лиофилизация), которые позволяют получить порошок активного ингредиента в сочетании с любым дополнительным желательным ингредиентом из его раствора, ранее стерилизованного фильтрацией. Схемы приема корректируют для обеспечения оптимального желательного ответа (например, терапевтического ответа). Например, можно ввести однократный болюс, можно ввести несколько разделенных доз за период времени, или дозу можно пропорционально уменьшать или увеличивать в зависимости от потребностей, определяемых терапевтической ситуацией. Например, антитела по изобретению можно вводить один или два раза в неделю подкожно или внутримышечно, или один или два раза в месяц подкожно или внутримышечно. Особенно выгодно составление парентеральных композиций в виде дозированной лекарственной формы для удобства введения и единообразия дозировки. Дозированная лекарственная форма, как используется здесь, относится к физически дискретным единицам, пригодным в качестве единичной дозировки для введения субъектам, подвергаемым лечению; каждая единица лекарственной формы содержит заранее определенное количество активного соединения, рассчитанное на получение желательного терапевтического эффекта, в комбинации с необходимым фармацевтическим носителем. Требования к дозированным лекарственным формам по изобретению определяются и напрямую зависят от (а) уникальных характеристик активного соединения и конкретного планируемого терапевтического эффекта и (b) ограничений, существующих в области составления рецептуры такого активного соединения для лечения чувствительности у людей. Примеры фармацевтически приемлемых антиоксидантов включают:(EDTA), сорбит, винную кислоту, фосфорную кислоту и т.п. Для терапевтических композиций составы по настоящему изобретению включают составы, пригодные для перорального, назального, местного (включая буккальное и подъязычное), ректального, вагинального и/или парентерального введения. Составы может быть удобно представлять в дозированной лекарственной форме и можно готовить любым способом, известным в области фармации. Количество активного ингредиента, которое можно смешать с материалом носителя для получения дозированного лекарственного средства, будет меняться в зависимости от субъекта, подвергающегося лечению, и конкретного способа введения. Количество активного ингредиента, которое можно объединить с материалом носителя для получения одной дозированной формы, в общем случае представляет собой количество композиции, производящее терапевтический эффект. Как правило, это количество находится в диапазоне от 0,001% до приблизительно девяноста процентов активного ингредиента из ста, предпочтительно приблизительно от 0,005% до приблизительно 70%, наиболее предпочтительно приблизительно от 0,01 до 30%. Составы по настоящему изобретению, подходящие для вагинального введения, также включают составы в форме вагинальных суппозиториев, тампонов, кремов, гелей, паст, пен или аэрозолей, содержащие подходящие носители, известные в данной области техники. Дозированные формы для местного или трансдермального введения композиций по настоящему изобретению включают порошки, аэрозоли, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и ингаляторы. Активное соединение можно смешать в стерильных условиях с фармацевтически приемлемым носителем и с любыми необходимыми консервантами, буферами или пропеллентами. Фразы "парентеральное введение" и "вводили парентерально", как используются здесь, означают способы введения, не являющиеся энтеральным и местным введением, обычно выполняемые путем инъекции и включающие, но без ограничения, внутривенные, внутримышечные, внутриартериальные, интратекальные, внутрисуставные, внутриглазничные, внутрисердечные, внутрикожные, внутрибрюшинные, транстрахеальные, подкожные, подкутикулярные, внутрисуставные, субкапсулярные, субарахноидальные, интраспинальные, эпидуральные и внутригрудинные инъекции и вливания. Примеры подходящих водных и неводных перевозчиков, которые можно использовать в фармацевтической композиции по изобретению, включают воду, этанол, полиолы (например, глицерин, пропиленгликоль, полиэтиленгликоль и т.п.) и их подходящие смеси, растительные масла, например, оливковое масло, и органические эфиры для инъекций, например, этилолеат. Надлежащую текучесть можно поддерживать, например, путем использования покровных материалов, например, лецитина, путем поддержания требуемого размера частиц в случае дисперсии и путем использования ПАВ. Указанные композиции также могут содержать адъюванты, например, консерванты, смачивающие агенты, эмульгаторы и диспергаторы. Предотвращение присутствия микроорганизмов можно обеспечить как за счет процедур стерилизации, описанных выше, так и включения различных антибактериальных и противогрибковых агентов, например, парабена, хлорбутанола, фенола, сорбиновой кислоты и т.п. Также может быть целесообразно включение в композицию изотонических агентов, например, сахаров, хлорида натрия и т.п. Кроме того, длительное поглощение фармацевтической формы, вводимой путем инъекции,можно обеспечить за счет включения агентов, замедляющих поглощение, например, моностеарата алюминия и желатина. Если соединения по настоящему изобретению вводят людям и животным в качестве фармацевтических препаратов, они могут быть предоставлены в чистом виде или в виде фармацевтической композиции, содержащей, например, от 0,001 до 90% (более предпочтительно, от 0,005 до 70%, например, от 0,01 до 30%) активного ингредиента в сочетании с фармацевтически приемлемым носителем. Независимо от выбранного пути введения, соединения по настоящему изобретению, которые можно использовать в подходящей гидратированной форме, и/или фармацевтические композиции по настоящему изобретению, составляют в виде фармацевтически приемлемых дозируемых форм с использованием обычных способов, известных специалистам. Фактическую дозировку активного ингредиента в фармацевтической композиции в соответствии с настоящим изобретением можно изменять с тем, чтобы получить количество активного ингредиента,являющееся эффективным с точки зрения достижения желательного терапевтического ответа у конкретного пациента при данной композиции и режиме введения, и не являющееся токсичным для пациента. Выбранная дозировка зависит от различных фармакокинетических факторов, включая активность конкретных используемых композиций по настоящему изобретению или их эфиров, солей или амидов, способа употребления, времени употребления, скорости выведения конкретного используемого соединения,продолжительности лечения, других лекарств, соединений и/или материалов, используемых в комбинации с конкретными используемыми композициями, возраста, половой принадлежности, общего состояния здоровья и предыдущей истории болезни пациента, подвергаемого лечению, и т.п. факторов, общеизвестных в области медицины. Врач или ветеринар-специалист может легко определить и назначить- 26024701 необходимое эффективное количество фармацевтической композиции. Например, врач или ветеринар может начать с дозировок соединения по изобретению, использованных в фармацевтической композиции, на несколько уровней меньших, чем требуется для достижения желательного терапевтического эффекта, и постепенно увеличивать дозировку до достижения желательного эффекта. В общем случае подходящая суточная доза композиции по изобретению равна количеству соединения, которое представляет собой наименьшую дозу, позволяющую получить терапевтический эффект. Обычно такая эффективная доза зависит от факторов, описанных выше. Предпочтительным является внутривенное, внутримышечное, внутрибрюшинное или подкожное введение, предпочтительно, введение вблизи от местоположения мишени. При желании, эффективную суточную дозу терапевтической композиции можно вводить в виде двух, трех, четырех, пяти, шести или более меньших доз, вводимых раздельно через соответствующие интервалы в течение суток, при необходимости, в виде дозированных лекарственных форм. Хотя возможно введение соединения по настоящему изобретению в чистом виде, желательно вводить соединение в виде фармацевтического состава (композиции). Терапевтические композиции можно вводить с помощью медицинских устройств, известных в данной области техники. Например, в предпочтительном варианте воплощения, терапевтическую композицию можно вводить с помощью устройства для безыгольных подкожных инъекций, например, устройства, описанного в патентах США 5399163, 5383851, 5312335, 5064413, 4941880, 4790824 или 4596556. Примеры известных имплантов и модулей, которые можно использовать в настоящем изобретении,включают: патент США 4487603, в котором описан имплантируемый насос для микровливаний, позволяющий подавать лекарство с контролируемой скоростью; патент США 4486194, в котором описано терапевтическое устройство для введения медикаментов через кожу; патент США 4447233, в котором описан насос для вливания лекарств с точно заданной скоростью; патент США 4447224, в котором описан имплантируемый аппарат для вливания с переменной скоростью потока, позволяющий осуществлять непрерывную доставку лекарства; патент США 4439196, в котором описана система осмотической доставки лекарств, содержащая многокамерные отсеки; и патент США 4475196, в котором описана система осмотической доставки лекарств. Специалистам известны многие другие импланты, системы доставки и модули такого рода. В некоторых вариантах воплощения антитела по изобретению можно включать в состав препарата,обеспечивая надлежащее распределение in vivo. Например, гематоэнцефалический барьер (ГЭБ) задерживает многие высокогидрофильные соединения. Чтобы обеспечить прохождение ГЭБ терапевтическими соединениями по изобретению (при необходимости), их можно включать в состав препарата, например, на основе липосом. Способы изготовления липосом см., например, в патентах США 4522811; 5374548 и 5399331. Липосомы могут содержать одну или несколько групп, которые избирательно транспортируются в специфические клетки или органы, тем самым улучшая адресную доставку лекарств (см.,например, V.V. Ranade (1989) J. Clin. Pharmacol. 29:685). Типичные молекулы, обеспечивающие адресную доставку лекарства, включают фолат или биотин (см., например, патент США 5416016, принадлежащий Low et al.); маннозиды (Umezawa et al., (1988) Biochem. Biophys. Res. Commun. 153:1038); антитела (P.G. Bloeman et al. (1995) FEBS Lett. 357:140; M. Owais et al. (1995) Antimicrob. Agents Chemother. 39:180); рецептор белка А сурфактанта (Briscoe et al. (1995) Am. J. Physiol. 1233:134), различные типы которого могут входить в состав препаратов по изобретению, а также компоненты молекул по изобретению; р 120 (Schreier et al. (1994) J. Biol. Chera. 269:9090); см. также K. Keinanen; M.L. Laukkanen (1994)FEBS Lett. 346:123; J.J. Killion; I.J. Fidler (1994) Immunomethods 4:273. В одном из вариантов воплощения изобретения терапевтические соединения по изобретению составлены в виде липосом; в более предпочтительном варианте воплощения липосомы включают группу для адресной доставки. В наиболее предпочтительном варианте воплощения терапевтические соединения в составе липосом доставляют болюсной инъекцией в область, расположенную вблизи от опухоли или инфекции. Композиция должна быть в достаточной степени жидкой, чтобы ее можно было легко ввести с помощью шприца. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего действия микроорганизмов, например, бактерий и грибов. Способность соединения подавлять рак можно оценить в системе животной модели, позволяющей прогнозировать эффективность по отношению к опухолям человека. Кроме того, это свойство композиции можно оценивать путем проверки способности соединения осуществлять такое ингибирование invitro с помощью анализов, известных специалистам в данной области техники. Терапевтически эффективное количество терапевтического соединения может уменьшить размер опухоли или иным образом облегчить симптомы рака у субъекта. Специалист в данной области техники может определить такое количество на основе таких факторов, как размер субъекта, тяжесть симптомов у субъекта и конкретная выбранная композиция или путь введения. Композиция должна быть стерильной и в достаточной степени жидкой для возможности ее доставки с помощью шприца. Кроме воды, носитель может представлять собой изотонический забуференный физиологический раствор, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.) и их подходящие смеси. Надлежащую текучесть можно поддерживать, например, путем использования покровных материалов, например, лецитина, путем поддержания требуемого размера- 27024701 частиц в случае дисперсии и путем использования ПАВ. Во многих случаях предпочтительно включать в композицию изотонические агенты, например, сахара, многоатомные спирты, например, маннит или сорбит, и хлорид натрия. Длительное поглощение композиций, вводимых путем инъекции, можно осуществить путем включения в композицию агента, замедляющего поглощение, например, моностеарата алюминия и желатина. Если активное соединение надлежащим образом защищено, как описано выше, это соединение можно вводить перорально, например, с инертным разбавителем или усваиваемым съедобным носителем.IV. Варианты применения и способы согласно изобретению. В одном из вариантов воплощения антитела биспецифические молекулы и композиции по настоящему изобретению можно использовать для лечения и/или предотвращения (например, иммунизации против) разнообразных заболеваний и состояний. Одним из основных заболеваний, которые можно лечить, является рак. В частности, антитело против CD27, индуцирующее или усиливающее иммунный ответ, может использоваться при лечении рака. Типы рака включают лейкоз, острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз, миелобластный, промиелоцитарный, миеломоноцитарный, моноцитарный лейкоз, эритролейкоз, хроническый лейкоз, хронический миелоцитарный (гранулоцитарный) лейкоз, хронический лимфоцитарный лейкоз,лимфому из клеток мантии, первичную лимфому центральной нервной системы, лимфому Беркитта и Вклеточную лимфому пограничной зоны, истинную полицитемию, болезнь Ходжкина, неходжкинскую лимфому, множественную миелому, макроглобулинемию Вальденстрема, болезнь тяжелых цепей, солидные опухоли, саркомы и карциномы, фибросаркому, миксосаркому, липосаркому, хондросаркому,остеогенную саркому, остеосаркому, хордому, ангиосаркому, эндотелиосаркому, лимфангиосаркому,лимфангиоэндотелиосаркому, синовиому, мезотелиому, саркому Юинга, лейомиосаркому, рабдомиосаркому, саркому толстой кишки, карциному ободочной и прямой кишки, рак поджелудочной железы, рак молочной железы, рак яичников, рак предстательной железы, плоскоклеточную карциному, базальноклеточную карциному, аденокарциному, карциному потовой железы, карциному сальной железы, папиллярную карциному, папиллярные аденокарциномы, цистаденокарциному, медуллярный рак, бронхогенную карциному, почечноклеточную карциному, гепатому, карциному желчного протока, хориокарциному,семиному, эмбриональную карциному, нефробластому, рак шейки матки, рак матки, опухоли яичка, рак легких, мелкоклеточный рак легких, немелкоклеточный рак легких, карциному мочевого пузыря, эпителиальную карциному, глиому, астроцитому, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, нейрому слухового нерва, олигодендроглиому, менингиому, меланому, нейробластому, ретинобластому, носоглоточную карциному, рак пищевода, базальноклеточную карциному,рак желчных путей, рак мочевого пузыря, рак костей, рак головного мозга и центральной нервной системы (ЦНС), рак шейки матки, хориокарциному, рак ободочной и прямой кишки, рак соединительной ткани, рак пищеварительной системы, рак эндометрия, рак пищевода, рак глаза, рак головы и шеи, рак ЖКТ,внутриэпителиальное новообразование, рак почек, рак гортани, рак печени, рак легких (мелкоклеточный,крупноклеточный), меланому, нейробластому; рак ротовой полости (например, губ, языка, ротовой полости и глотки), рак яичников, рак поджелудочной железы, ретинобластому, рабдомиосаркому, рак прямой кишки; рак дыхательной системы, саркому, рак кожи, рак желудка, рак яичек, рак щитовидной железы, рак матки и рак мочевыделительной системы, но не ограничиваются ими. Предпочтительные виды рака включают опухоли, экспрессирующие CD27, выбранные из группы, состоящей из хронического лимфоцитарного лейкоза, лимфомы из клеток мантии, первичной лимфомы центральной нервной системы, лимфомы Беркитта и В-клеточной лимфомы пограничной зоны. Другие заболевания, являющиеся показаниями к применению антитела против CD27, индуцирующего или усиливающего иммунный ответ, включают бактериальные, грибковые, вирусные и паразитарные инфекционные заболевания. Другие заболевания, являющиеся показаниями к применению антитела против CD27, ингибирующего или блокирующего иммунный ответ, включают отторжение трансплантата, аллергию и аутоиммунные заболевания. Типичные аутоиммунные заболевания включают рассеянный склероз, ревматоидный артрит, диабет типа 1, псориаз, болезнь Крона и другие воспалительные заболевания кишечника, например, язвенный колит, системную красную волчанку (СКВ), аутоиммунный энцефаломиелит, миастению гравис (МГ),тиреоидит Хашимото, синдром Гудпасчера, пузырчатку, болезнь Грейвса, аутоиммунную гемолитическую анемию, аутоиммунную тромбоцитопеническую пурпуру, склеродермию с антителами против коллагена, смешанное заболевание соединительной ткани, полимиозит, пернициозную анемию, идиопатическую болезнь Аддисона, бесплодие, связанное с аутоиммунными факторами, гломерулонефрит, серповидный гломерулонефрит, пролиферативный гломерулонефрит, буллезный пемфигоид, синдром Шегрена, псориатическийартрит, инсулинорезистентность, аутоиммунный сахарный диабет, аутоиммунный гепатит, аутоиммунную гемофилию, аутоиммунный лимфопролиферативный синдром (ALPS), аутоиммунный гепатит, аутоиммунную гемофилию, аутоиммунный лимфопролиферативный синдром, аутоиммунный увеоретинит, синдром Гийена-Барре, артериосклероз и болезнь Альцгеймера, но не ограничиваются ими. Типичные аллергические расстройства включают аллергический конъюнктивит, весенний- 28024701 конъюнктивит, весенний кератоконъюнктивит и гигантский папиллярный конъюнктивит; назальные аллергические расстройства, включая аллергический ринит и синусит; аллергические расстройства уха,включая зуд евстахиевой трубы; аллергические расстройства верхних и нижних дыхательных путей,включая врожденную и приобретенную бронхиальную астму; аллергические заболевания кожи, включая дерматит, экзему и крапивницу; и аллергические заболевания желудочно-кишечного тракта, но не ограничиваются ими. В еще одном аспекте антитело по изобретению вводят в комбинации с вакциной для усиления иммунного ответа против антигена вакцины, например, опухолевого антигена (с целью усиления иммунного ответа против опухоли за счет этого) или антигена возбудителя инфекционного заболевания (с целью усиления иммунного ответа против возбудителя инфекционного заболевания за счет этого). Соответственно, в этом варианте воплощения антиген вакцины может включать, например, антиген или композицию антигенов, способную вызвать иммунный ответ против опухоли или против возбудителя инфекционного заболевания, например, вируса, бактерии, паразита или грибка. Антиген или антигены могут представлять собой, например, пептиды/белки, полисахариды и/или липиды. Антиген или антигены могут иметь опухолевое происхождение, например, различные опухолевые антигены, описанные выше. Альтернативно, антиген или антигены могут происходить от патогенных организмов, например, вирусов,бактерий, паразитов или грибков, например, различные антигены патогенных организмов, описанные выше. Дополнительные примеры подходящих антигенов патогенных организмов включают, но не ограничиваются ими, следующие: вирусные антигены или антигенные детерминанты могут происходить,например, от: цитомегаловируса (особенно человека, например, gB или его производных); вируса Эпштейна-Барр (например, gp350); флавивирусов (например, вируса желтой лихорадки, вируса денге, вируса клещевого энцефалита, вируса японского энцефалита); вируса гепатита, например, вируса гепатита В(например, поверхностный антиген вируса гепатита В, например, антигены PreS1, PreS2 и S, описанные в ЕР-А-414374; ЕР-А-0304578 и ЕР-А-198474), вируса гепатита А, вируса гепатита С и вируса гепатита Е; ВИЧ-1 (например, tat, nef, gpl20 или gpl60); вирусов герпеса человека, например, gD или его производных, или предраннего белка, например, ICP27 HSV1 или HSV2; вирусов папилломы человека (например,HPV6, 11, 16, 18); вируса гриппа (интактного или инактивированного вируса, сплит-вируса гриппа, выращенного в яйцах или клетках MDCK, или клетках Vero, или полных виросом гриппа (как описано вGluck, Vaccine, 1992, 10, 915-920) или их очищенных или рекомбинантных белков, например, белков NP,NA, НА или M); вируса кори; вируса эпидемического паротита; вируса парагриппа; вируса бешенства; респираторно-синцитиального вируса (например, белки F и G); ротавируса (в том числе живого ослабленного вируса); вируса натуральной оспы; вируса ветряной оспы (например, gpI, II и IE63); и HPV, ответственных за рак шейки матки (например, ранние белки Е 6 и Е 7, гибридизованные с переносчиком белка D, образующие гибридные белки D-E6 или Е 7 HPV 16, или их комбинации; или комбинации E6 или Е 7 с L2 (см., например, WO 96/26277). Бактериальные антигены или антигенные детерминанты могут происходить, например, от: Bacillus(например, клостридиальные токсины А или В); Corynebacterium spp., включая С. diphtheriae (например,дифтерийный токсин); Ehrlichia spp., включая Е. equi и возбудителя гранулоцитарного эрлихиоза человека; Rickettsia spp, включая R.rickettsii; Enterococcus spp., включая E. faecalis, E. faecium; Escherichia spp,включая энтеротоксические штаммы Е. coli (например, факторы колонизации, термолабильный токсин или его производные, или термостабильный токсин), энтерогеморрагические штаммы Е. coli, энтеропатогенные штаммы Е. coli (например, токсин, подобный шига-токсину); Haemophilus spp., включая Н. influenzae типа В (например, PRP), нетипируемые штаммы Н. influenzae, например, ОМР 26, высокомолекулярные адгезины, Р 5, Р 6, белок D и липопротеин D, и фимбрин и белки-производные фимбрина (см.,например, US 5843464); Helicobacter spp, включая Н. pylori (например, уреазу, каталазу, вакуолизированный токсин); Pseudomonas spp, включая P. aeruginosa; Legionella spp, включая L. pneumophila; Leptospiraspp., включая L. interrogans; Listeria spp., включая L. monocytogenes; Moraxella spp, включая M. catarrhalis,также известную как Branhamella catarrhalis (например, высоко- и низкомолекулярные адгезины и инвазины); Morexella catarrhalis (включая везикулы ее наружной мембраны и OMP106 (см., например, WO 97/41731; Mycobacterium spp., включая М. tuberculosis (например, ESAT6, антиген 85 А, -В или -С), М.bovis, M. leprae, M. avium, M. paratuberculosis, М. smegmatis; Neisseria spp, включая N. gonorrhea и N. meningitidis (например, полисахариды капсулы и их конъюгаты, трансферрин-связывающие белки, лактоферрин-связывающие белки, PilC, адгезины); Neisseria mengitidis В (включая везикулы ее наружной мембраны и NspA (см., например, WO 96/29412); Salmonella spp, включая S. typhi, S. paratyphi, S. choleraesuis,- 29
МПК / Метки
МПК: A01K 67/027, A61K 39/395, A61P 35/00, C07K 14/705, C07K 16/28, A61P 37/02
Метки: связывающие, антитела, человека, применение
Код ссылки
<a href="https://eas.patents.su/30-24701-antitela-svyazyvayushhie-cd27-cheloveka-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Антитела, связывающие cd27 человека, и их применение</a>
Предыдущий патент: Высокоотражающая стеклянная панель
Следующий патент: Новые иммуномодуляторные и противовоспалительные соединения
Случайный патент: Подводное устройство выемки грунта


































