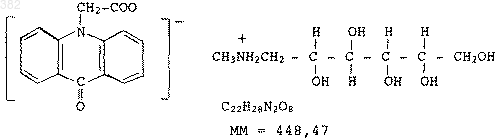Аналоги инсулина человека с пролонгированной терапевтической активностью, стабильные в кислой среде
Номер патента: 23559
Опубликовано: 30.06.2016
Авторы: Соколовска Ивона, Курзынога Дариуш, Пстжох Яцек, Степниевски Яцек, Бернат Юстина, Кесик-Бродацка Малгорзата, Плуциенничак Андрзей, Войтович-Кравец Анна, Славински Войциевич, Антосик Ярослав, Богиел Моника, Плуциенничак Гражина, Зиелински Марцин, Микиевич-Сыгула Диана, Стадник Дорота, Глабски Тадеуш, Адамчевска-Цецуда Виолетта, Миколайчук Йерзы, Павлуковиец Томаш, Борович Пётр
Формула / Реферат
1. Производное инсулина человека или его фармацевтически приемлемая соль, обладающие пролонгированной терапевтической активностью и стабильностью в кислой среде, включающие два полипептида, образующие цепь А и цепь В, где аминокислотная последовательность цепи А была выбрана из SEQ ID NO: 1-6, тогда как аминокислотная последовательность цепи В была выбрана из SEQ ID NO: 7-10.
2. Производное инсулина человека или его фармацевтически приемлемая соль по п.1, имеющее структуру в соответствии с формулой 1
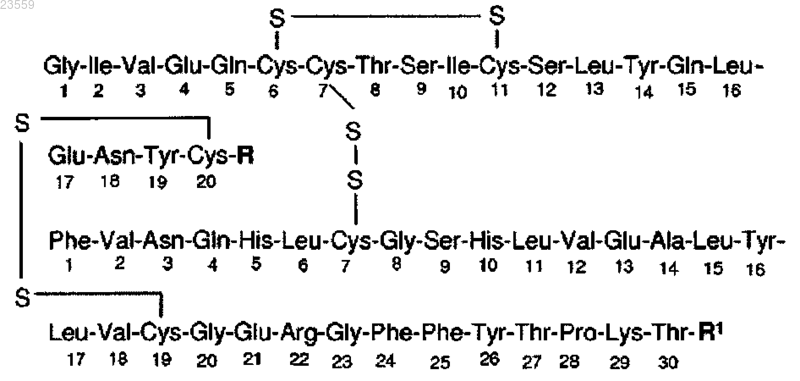
где R обозначает группу NH2 или группу формулы Asn-R2, где R2 обозначает глицин, или аланин, или серин, или треонин, или группу NH2;
R1 обозначает B31Lys-B32Arg, где B3Asn может быть необязательно замещен другой аминокислотой, предпочтительно Glu, или B31Arg-B32Arg, или HB31Arg.
3. Производное инсулина или его физиологически приемлемая соль по п.2, характеризующееся тем, что в формуле 1
R обозначает группу формулы Asn-R2, где R2 обозначает Gly, и R1 обозначает B31Lys-B32Arg, или
R обозначает группу формулы Asn-R2, где R2 обозначает Ala, и R1 обозначает B31Lys-B32Arg, или
R обозначает группу формулы Asn-R2, где R2 обозначает Ser, и R1 обозначает B31Lys-B32Arg, или
R обозначает группу формулы Asn-R2, где R2 обозначает Thr, и R1 обозначает B31Lys-B32Arg, или
R обозначает группу формулы Asn-R2, где R2 обозначает группу NH2, и R1 обозначает B31Lys-B32Arg, или
R обозначает группу NH2 и R1 обозначает B31Lys-B32Arg, или
R обозначает группу формулы Asn-R2, где R2 обозначает Gly, и R1 обозначает B31Arg-B32Arg, или
R обозначает группу формулы Asn-R2, где R2 обозначает Ala, и R1 обозначает B31Arg-B32Arg, или
R обозначает группу формулы Asn-R2, где R2 обозначает Thr, и R1 обозначает B31Arg-B32Arg, или
R обозначает группу формулы Asn-R2, где R2 обозначает Ser, и R1 обозначает B31Arg-B32Arg, или
R обозначает группу формулы Asn-R2, где R2 обозначает группу NH2, и R1 обозначает B31Arg-B32Arg, или
R обозначает группу NH2 и R1 обозначает B31Arg-B32Arg, или
R обозначает группу формулы Asn-R2, где R2 обозначает Gly, и R1 обозначает B31Arg, или
R обозначает группу формулы Asn-R2, где R2 обозначает Ala, и R1 обозначает B31Arg, или
R обозначает группу формулы Asn-R2, где R2 обозначает Thr, и R1 обозначает B31Arg, или
R обозначает группу формулы Asn-R2, где R2 обозначает Ser, и R1 обозначает B31Arg, или
R обозначает группу формулы Asn-R2, где R2 обозначает группу NH2, и R1 обозначает B31Arg, или
R обозначает группу NH2 и R1 обозначает B31Arg, или
R обозначает группу формулы Asn-R2, где R2 обозначает Gly, R1 обозначает B31Lys-B32Arg и B3Asn был замещен на B3Glu.
4. Фармацевтическая композиция, обладающая активностью снижения концентрации глюкозы в крови, содержащая эффективно действующее количество производного инсулина или его фармацевтически приемлемой соли по какому-либо из пп.1-3.
5. Фармацевтическая композиция по п.4, дополнительно содержащая 10-50 мкг/мл цинка.
6. Применение производного инсулина или его фармацевтически приемлемой соли по какому-либо из пп.1-3 для производства лекарственного препарата для лечения или профилактики сахарного диабета.
7. Способ лечения пациентов, страдающих сахарным диабетом, характеризующийся тем, что пациенту, нуждающемуся в таком лечении, вводят эффективно действующее количество фармацевтической композиции по пп.4 и 5.
Текст
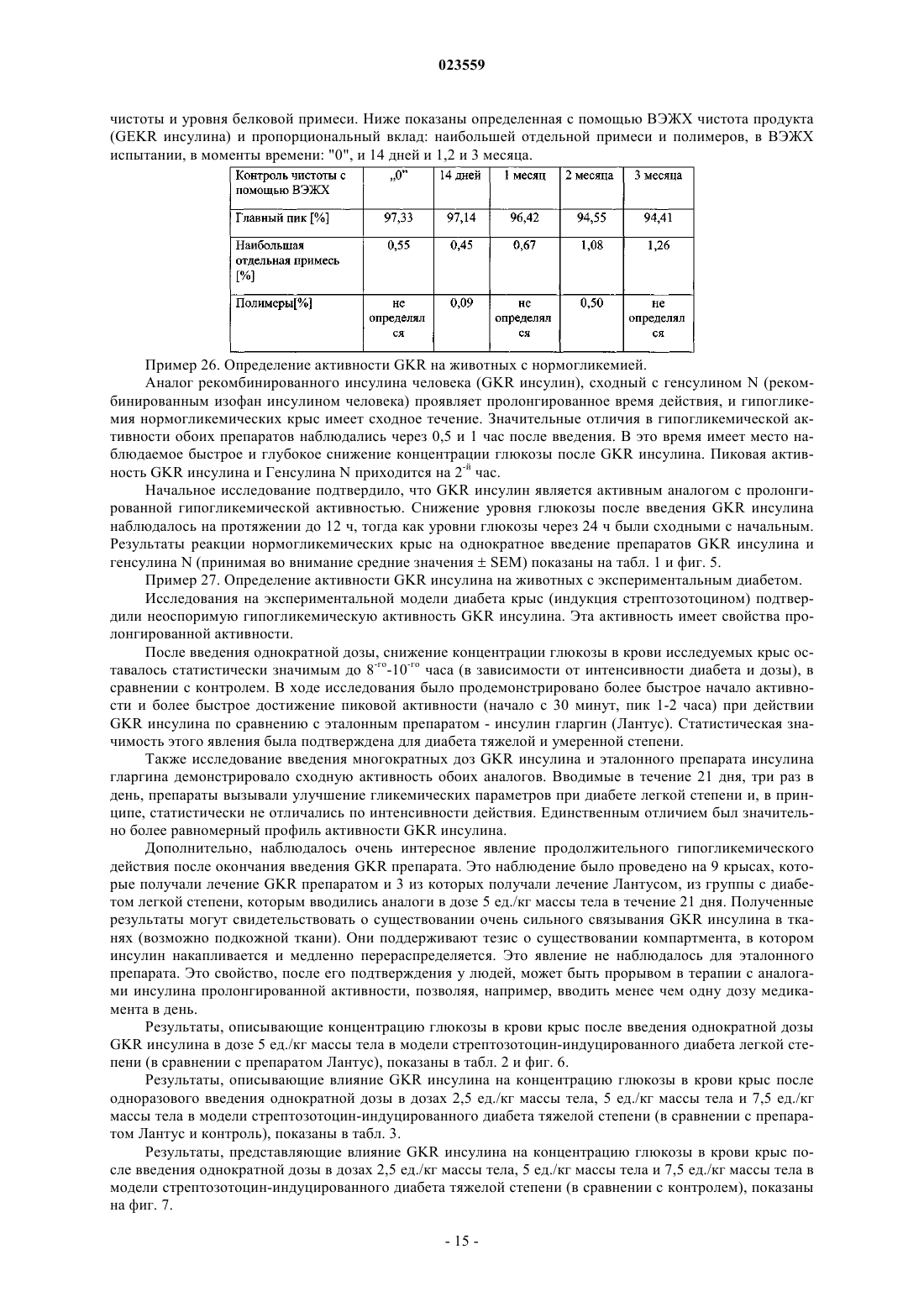
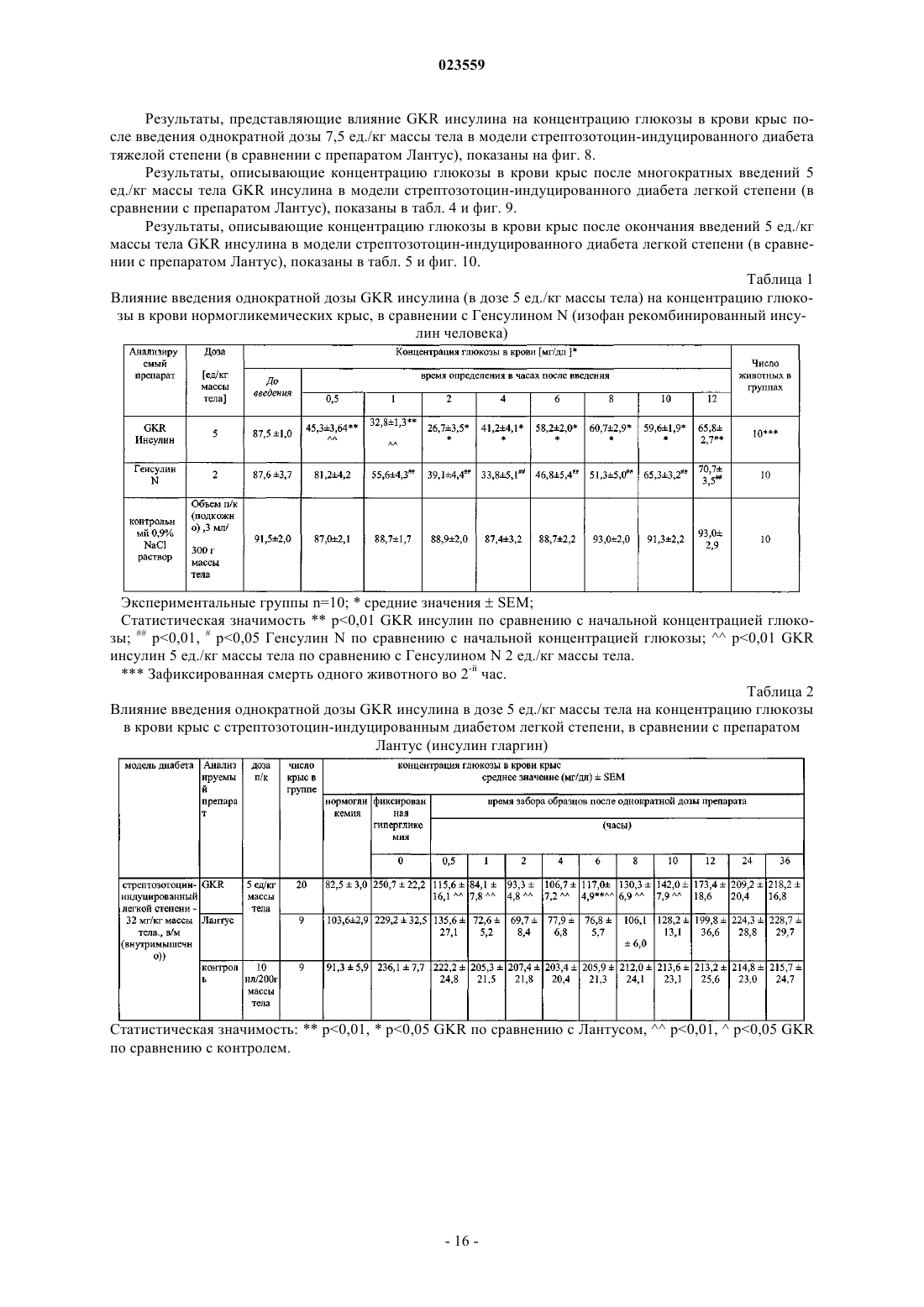
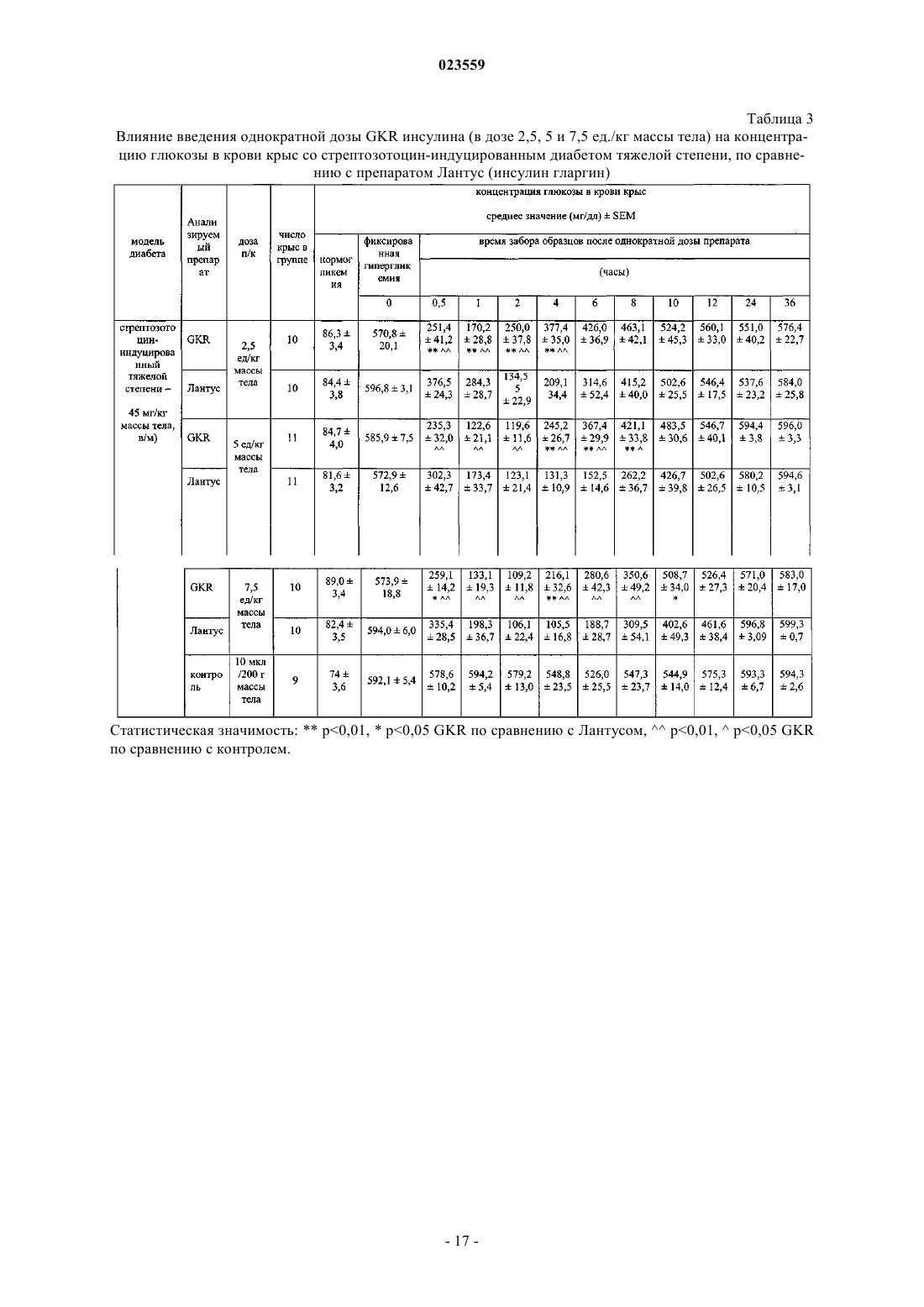
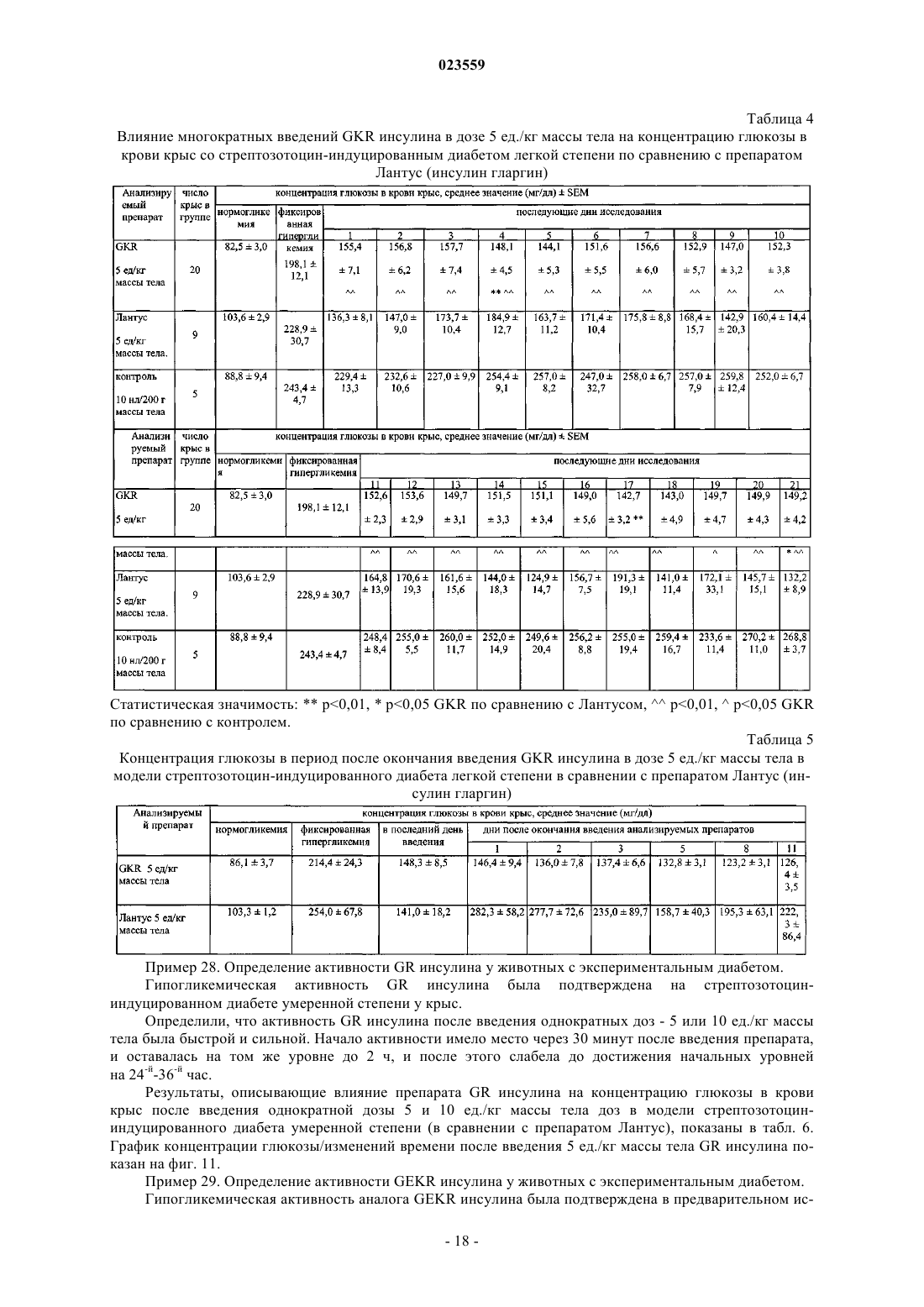
АНАЛОГИ ИНСУЛИНА ЧЕЛОВЕКА С ПРОЛОНГИРОВАННОЙ ТЕРАПЕВТИЧЕСКОЙ АКТИВНОСТЬЮ, СТАБИЛЬНЫЕ В КИСЛОЙ СРЕДЕ Изобретение относится к производным инсулина человека, обладающим пролонгированной терапевтической активностью и стабильностью в кислой среде, а также к их фармацевтически приемлемым солям. Заявленные производные инсулина человека могут быть использованы для производства лекарственного препарата для лечения или профилактики сахарного диабета, а также могут быть использованы при лечении пациентов, страдающих сахарным диабетом. Объектами изобретения являются новые биосинтетические аналоги рекомбинированного инсулина человека пролонгированной терапевтической активности, которые могут найти применение в профилактике и лечении сахарного диабета. Инсулин и его различные производные используются в больших количествах при лечении сахарного диабета и часто производятся в крупном промышленном масштабе. Несмотря на то что существуют многие различные известные модифицированные производные инсулина и многие фармацевтические препараты с различными профилями активности, все еще существует необходимость в лекарственном препарате, который сможет обеспечить поддержание постоянного уровня глюкозы в организме человека в течение длительного периода времени. Для достижения эффекта замедленной и/или пролонгированной активности некоторые препараты нормального инсулина человека содержат специфические добавки, например, различные количества протамина, белка, который образует нерастворимый комплекс с инсулином, который образует отложения в подкожных тканях, и из которых постепенно высвобождается инсулин. Известны различные производные инсулина человека, используемые при лечении диабета, которые содержат дополнительные аминокислоты, или имеют модифицированную последовательность некоторых аминокислот. Изменения первичной структуры инсулина воздействует на его вторичную и третичную структуру, которая влияет на химические и биологические свойства белка, и что, в свою очередь,приводит к фармакокинетическим и фармакодинамическим эффектам. Эти изменения носят различный характер, могут привести к ускоренной или замедленной и пролонгированной активности модифицированного инсулина. Активная форма инсулина представляет собой мономер, который легко проникает в кровь после подкожной инъекции. Известно, что экзогенный инсулин человека в растворах имеет гексамерную форму, которая после употребления диссоциирует на димеры и впоследствии на мономеры до проникновения в кровоток. Одно из производных инсулина, характеризующееся ускоренной активностью, представляет собой лиспро-инсулин (Humalog), в котором была инвертирована последовательность пролин (28)-лизин (29) в цепи В. Это делает затруднительным, со стерической точки зрения, образование димеров инсулина в растворе. Второе такое производное представляет собой инсулин, в котором пролин в положении 28 цепи В был замещен аспарагиновой кислотой. Этот введенный отрицательный заряд снижает возможность самоассоциации мономеров инсулина. Оба этих производных инсулина абсорбируются быстрее благодаря их структуре. Аналоги рекомбинированного инсулина человека пролонгированной активности сконструированы с помощью удлинения цепи В с помощью щелочных аминокислот или ацилирования -аминогруппы в лизине в цепи В с помощью алифатической кислоты с около дюжиной атомов углерода. Введение этих дополнительных щелочных аминокислот изменяет некоторые химические или физические свойства инсулина. Наиболее важное изменение представляет собой сдвиг изоэлектрической точки по отношению к немодифицированному естественному инсулину от 5,4 до диапазона от около 5,5 до около 8,5, что является результатом введения чрезмерных положительных зарядов в молекулу. Вследствие этого, растворимость этих аналогов в нейтральном водном окружении снижается, и, соответственно,необходимость применения слегка кислотного окружения для получения фармацевтических препаратов,содержащих такой модифицированный инсулин. Тем не менее, кроме очевидных преимуществ, полученных в результате введения дополнительных щелочных аминокислот, также наблюдается неблагоприятное снижение стабильности новых аналогов,которые происходят, в первую очередь, в результате дезаминирования аспарагина в положении А 21,происходящем в кислотном окружении. Данная проблема решается замещением A21Asn другой аминокислотой, такой как аспарагиновая кислота, глицин, аланин, треонин и другие. Один из таких аналогов представляет собой рекомбинантное производное инсулина человека, в котором в цепи А аспарагин(21) был замещен глицином(21) и в Сконце цепи В было прикреплено два аргининовых остатка. Это - так называемое производное инсулина гларгин, производимый под названием Лантус (патент США 5656722). В ходе нашего исследования было установлено, что производное инсулина человека, где к С-концу цепи В были прикреплены остатки лизина (B31Lys) и аргинина (B32Arg), проявляет биологическую активность, которая сходна с производным гларгин, которое уже присутствует на рынке. Предыдущее исследование, проведенное на животных, показывает, что этот препарат, называемый лизаргинсулин, характеризуется пролонгированной активностью и плоским профилем высвобождения, имитируя секрецию естественного инсулина, и с клинической точки зрения - снижением ночных гипогликемии. Благодаря исключительному сходству с инсулином человека, а также с проинсулином, могут ожидаться хорошие результаты исследования, способствующие постепенной разработке потенциального лекарства и его конечной коммерциализации. Важно, что LysArg последовательность на С-конце цепи В инсулина человека обнаружена в проинсулине человека, и это предполагает трансформацию лизаргинсулина в инсулин человека благодаря присутствию карбоксипептидазы С. Это означает, что первым метаболитом лизаргинсулина в организме человека может быть инсулин человека с хорошо известными и приемлемыми характеристиками, даже в случае экзогенного гормона. Было проведено широкое доклиническое иссле-1 023559 дование на крысах, которое подтвердило пролонгированную активность нового инсулинового аналога. Тем не менее, оказывается, что это производное, помимо его благоприятной биологической активности, характеризуется недостаточной стабильностью в кислотных инъекционных растворах. Основной причиной недостаточной стабильности, которая проявляет себя в первую очередь как дезамидирование,является присутствие остатка аспарагина на С-конце цепи А, где в кислотном водном окружении может происходить дезамидирование, автокатализируемое протоном из карбоксильной группы. Следовательно, целью данного изобретения является обеспечение новых аналогов инсулина, которые характеризовались бы адекватной стабильностью в кислотных инъекционных растворах (рН 3,5-5), и в то же время могут обладать необходимой биологической активностью. Особенно желательным является, чтобы они проявляли характеристики биологической активности естественного инсулина. Также является особенно важным, чтобы начало активности новых производных было практически немедленным,сразу после введения пациенту, со способностью пролонгированного высвобождения части дозы. Это дало бы возможность обеспечить как ускоренную, так и пролонгированную активность фармацевтического препарата, содержащего инсулиновые аналоги. Вышеизложенная задача была непредвиденно достигнута в данном изобретении. Основной аспект данного изобретения представляет собой производное инсулина или его фармацевтически приемлемую соль, содержащую два полипептида, составляющие цепь А и цепь В, где аминокислотная последовательность цепи А была выбрана из SEQ ID NO: 1-5, тогда как аминокислотная последовательность цепи В была выбрана из SEQ ID NO: 6-8. Предпочтительное производное инсулина или его фармацевтически приемлемая соль согласно данному изобретению характеризуется тем, что является аналогом рекомбинированного инсулина человека с изоэлектрической точкой 5-8,5 и имеет формулу 1 где R обозначает NH2 группу или группу согласно формуле Asn-R2, где R2 обозначает нейтральнуюR1 обозначает B31Lys-B32Arg, или B31Arg-B32Arg, или B31Arg, где B3Asn может быть альтернативно замещен другой аминокислотой, преимущественно Glu. Преимущественно, производное инсулина или его физиологически приемлемая соль согласно данному изобретению характеризуется тем, чтоR в формуле 1 обозначает группу формулы Asn-R2, где R2 обозначает Gly, и R1 обозначает B31LysB32Arg, илиR в формуле 1 обозначает группу формулы Asn-R2, где R2 обозначает Ala, и R1 обозначает В 31LysB32Arg, илиR в формуле 1 обозначает группу формулы Asn-R2, где R2 обозначает Ser, и R1 обозначает B31LysB32Arg, илиR в формуле 1 обозначает группу формулы Asn-R2, где R2 обозначает Thr, и R1 обозначает B31LysB32Arg, илиR в формуле 1 обозначает группу формулы Asn-R2, где R2 обозначает группу NH2, и R1 обозначаетR в формуле 1 обозначает группу формулы Asn-R2, где R2 обозначает Gly, a R1 обозначает B31ArgB32Arg, илиR в формуле 1 обозначает группу формулы Asn-R2, где R2 обозначает Ala, a R1 обозначает B31ArgB32Arg, илиR в формуле 1 обозначает группу формулы Asn-R2, где R2 обозначает Thr, a R1 обозначает B31ArgB32Arg, илиR в формуле 1 обозначает группу формулы Asn-R2, где R2 обозначает Ser, a R1 обозначает B31ArgB32Arg, илиR в формуле 1 обозначает группу формулы Asn-R2, где R2 обозначает группу NH2, и R1 обозначаетR в формуле 1 обозначает группу формулы Asn-R2, где R2 обозначает Gly, a R1 обозначает B31Arg,илиR в формуле 1 обозначает группу формулы Asn-R2, где R2 обозначает Ala, a R1 обозначает В 31Arg,илиR в формуле 1 обозначает группу формулы Asn-R2, где R2 обозначает Thr, a R1 обозначает B31Arg,илиR в формуле 1 обозначает группу формулы Asn-R2, где R2 обозначает Ser, a R1 обозначает B31Arg,илиR в формуле 1 обозначает группу формулы Asn-R2, где R2 обозначает группу NH2, и R1 обозначаетR в формуле 1 обозначает группу формулы Asn-R2, где R2 обозначает Gly, R1 обозначает B31LysB32Arg и B3Asn был замещен B3Glu. Как описано ранее, в случае гларгина проблема низкой стабильности решили путем замещения аспарагина в положении А 21 глицином. Исследование, которое направлено на получение инсулинового аналога, который проявляет пролонгированную активность и стабильность в кислотных инъекционных растворах, как описано в данном изобретении, шло в другом направлении. Для того чтобы блокировать карбоксильную группу, ответственную за низкую стабильность, были получены новые производные лизаргинсулина с карбоксильной группой в остатке аспарагина, модифицированном различными путями,используя способы генетической инженерии и ферментативной трансформации. В результате проведенного исследования неожиданно выяснилось, что химические и биологические свойства, сходные с таковыми у производного гларгина и лизаргина, проявляются производными инсулина человека формулы 1,где цепь А была удлиненна на С-конце остатком нейтральной аминокислоты (А 22), или, где карбоксильная группа аспарагина или цистеина на С-конце цепи А была трансформирована в карбоксиамидную группу, и к С-концу цепи В были прикреплены остатки лизина и аргинина (B31Lys-B32Arg) или два остатка аргинина (B31Arg-B32Arg), или один остаток аргинина (B31Arg). Новые аналоги, полученные таким образом, характеризуются надлежащей стабильностью в кислотных инъекционных растворах (рН 3,5-5) и в то же время проявляют необходимую биологическую активность. Введенная модификация неожиданно привела к получению стабильных фармацевтических композиций производных инсулина, которые в то же время сохраняют биологическую активность и вызывают сдвиг изоэлектрической точки до рН 5-8, тем самым, уменьшая растворимость нового производного инсулина в физиологическом рН в месте инъекции. Это вызывает осаждение микроотложения производного инсулина в подкожной ткани и, затем, медленное высвобождение вещества в кровь, что вызывает поддержание терапевтического уровня в течение пролонгированного времени. Свойства этих соединений и их композиций были подтверждены исследованием стабильности и исследованием их активности у животных с экспериментальным диабетом. В ходе них был неожиданно обнаружен существенно пролонгированный эффект гипогликемической активности, который также длился в течение длительного времени после прекращения введения медикамента, в отличие от того, что наблюдалось для эталонного коммерчески доступного производного инсулина с пролонгированной активностью. Это позволяет предположить, что свойства производных, которые являются объектами данного изобретения, будут давать возможность значительно уменьшить частое введение медикамента, что будет повышать эффективность, безопасность и комфорт терапии пациента. Также важно, что начало активности новых производных согласно данному изобретению является практически немедленным, что означает, что эти соединения неожиданно проявляют характеристики биологической активности известных инсулиновых аналогов с как ускоренной, так и пролонгированной активностью. Примеры производных инсулина формулы 1 являются такими как следующие, но не ограничиваются теми, что представлены ниже. Чтобы упростить названия аналогов рекомбинированного инсулина человека, которые являются объектом данного изобретения, они были обозначены символами, которые состоят из названия "инсулин" и 2-4 заглавных букв алфавита, которые обозначают аминокислотные остатки, которые были добавлены или которые замещают те, которые присутствуют в материнской частице инсулина человека. В большинстве случаев эти буквы находятся в соответствии с однобуквенным кодом аминокислотных остатков, признанным в литературе. Только для двух остатков, которые не встречаются в природе, использовались дополнительные буквы, а именно "Z" и "X". В обоих случаях буква обозначает остаток, помещенный на С-конце цепи А, где вместо терминальной СООН группы находится CONH2 группа; буква"Z" обозначает соответствующий амид аспарагина (т.е. A21Asn-NH2), и буква "X" - амид цистеина (т.е.de(A21Asn)A20Cys-NH2). Инсулиновые аналоги формулы 1 были получены с помощью серии генетических манипуляций с использованием стандартных способов генной инженерии. Для этой цели были сконструированы модификации гена, кодирующего рекомбинированный проинсулин человека, с помощью генетических методик, таких как, например, сайт-специфический мутагенез. Реакция сайт-специфического мутагенеза проводилась с использованием набора Stratagene (номер по каталогу 200518-5), в качестве матрицы была использована плазмидная ДНК pIGALZUINS - p5/ZUINS или pIGTETZUINS - р 6/ZUINS. Также в качестве матрицы может быть использована любая другая ДНК,содержащая соответствующую последовательность, кодирующую рекомбинированный проинсулин или препроинсулин человека. Согласно данному изобретению, в свете общепризнанной терминологии, под рекомбинированным проинсулином человека понимается полипептидная цепь, где цепи А и В инсулина человека соединены дипептидом Lys-Arg или Arg-Arg, а под рекомбинированным препроинсулином - комбинация проинсулина и дополнительного лидерного полипептида, например, убиквитина, или SOD (супероксиддисмутаза) или их фрагментов. Реакционную смесь использовали для трансформации компетентных клеток соответствующего штамма Escherichia coli, как например, DH5, DH5 или НВ 101, хотя возможно использовать клетки других штаммов Е.coli или клетки других микроорганизмов, или другие известные клеточные линии, которые могут быть использованы для экспрессии рекомбинированных белков. Плазмиду, содержащую данную модификацию гена, кодирующего рекомбинированный проинсулин человека, выделяли и секвенировали для того, чтобы проверить правильность нуклеотидной последовательности. Согласно варианту данного изобретения плазмида с модифицированным геном, кодирующим рекомбинированный проинсулин человека, использовалась для трансформации компетентных клеток DH5 E.coli, и бактерии культивировались в средах LB (Лурия-Бертани) с добавлением антибиотика для отбора (0,01 мг/мл) в объеме 500 мл при температуре 37 С, 200 об/мин в течение 18 ч. Бактериальный материал готовили для банка штаммов, образцы в пропорции 1:1 бактериальной культуры и 40% глицерин хранили при -70 С. Варианты рекомбинированного препроинсулина, полученные путем экспрессии в штаммах Е.coli,выделяли в форме телец включения, после того, как клетки были дезинтегрированы, и далее подвергали стандартным процессам очистки слитых белков. Раствор гибридного белка с инсулиновым аналогом,полученным после ренатурации, подвергли контролируемой обработке трипсином, аналогичным образом, как во многих способах, известных ранее и описанных, например, Kemmlera et al. в J. Biol. Chem.,Vol. 246, с. 6786-6791 (1971) или патентах США 6686177 и 6100376. Полученные инсулиновые аналоги подвергались процессу очистки с использованием известных способов, главным образом, хроматографии при низком давлении, ультрафильтрации и/или ВЭЖХ (высокоэффективная жидкостная хроматография). Продукт осаждали из достаточно очищенного раствора инсулинового аналога. Для того чтобы получить производные, содержащие на С-конце цепи А остаток A21Asn-NH2 илиA20Cys-NH2, использовали -амидирующие ферменты (-АЕ), катализирующие превращение прогормонов, встречающихся в природе в живых организмах, которые являются субстратами реакции, превращаемыми в активные формы -амида. Фермент РАМ (пептидилглицин -амидирующая монооксигеназа) представляет собой протеазу с двойной активностью, обозначенной как активность РИМ (пептидилглицин альфа-гидроксилирующая монооксигеназа) и PAL (пептидиламидогликолят лиазная активность) (схема 1), которая позволяет получить С терминальный амид. Было обнаружено, что половина пептидных гормонов, таких как окситоцин или вазопрессин, для достижении их оптимальной активности нуждаются в С-терминальной амидной группе. В этой реакции амидная группа происходит от С-терминального остатка глицина, который здесь является предшественником прямой реакции (Satani M., Takahashi K., Sakamoto H., Harada S., Kaida Y.,Noguchi M.; Expression and characterization of human bifunctional peptidylglycine alpha-amidating monooxygenase. Protein Expr Purif. 2003 Apr; 28(2):293-302.; Miller D.A., Sayad K, Kulathila R., Beaudry G.A.,Merkler D.J., Bertelsen A.H.; Characterization of a bifunctional peptidylglycine alpha-amidating enzyme expressed in Chinese hamster ovary cells. Arch Biochem Biophys. 1992 Nov 1; 298(2):380-8). Схема 1 Краткое описание -амидирования пептида активной РАМ протеазой (согласно Satani M., Takahashi К., Sakamoto H., Harada S., Kaida Y., Noguchi M.; Expression and characterization of human bifunctional peptidylglycine alpha-amidating monooxygenase. Protein ExprPurif. 2003 Apr; 28(2):293-302.). РАМ протеаза представляет собой белок, который обнаруживается среди прочего у эукариотических организмов, с различной длиной аминокислотной цепи. В данном проекте была использована протеаза, которая происходит из организма человека (Homo sapiens), в которой обнаружены 6 генов, кодирующих белки, проявляющие активность -амидирующей протеазы. Основное физико-химическое свойство аналогов рекомбинированного инсулина человека формулы 1, которое отличает их от инсулина человека, представляет собой их значение изоэлектрической точки,которая имеет значения от около 5 до около 8. Это означает хорошую растворимость соединений в растворах с кислотным - слегка кислотным рН. Это свойство обеспечивало получение композиции - растворов новых производных инсулина в кислотном рН. Аспектом данного изобретения также является фармацевтическая композиция, характеризующаяся тем, что она содержит эффективно действующее количество производного инсулина согласно данному изобретению или его фармацевтически приемлемой соли, которые определены выше. Предпочтительно,фармацевтическая композиция согласно данному изобретению также содержит от 10 до 50 мкг/мл цинка. Следующий аспект данного изобретения также представляет собой применение производного инсулина согласно данному изобретению или его фармацевтически приемлемой соли, которые определены выше, для производства лекарства для лечения или профилактики диабета. Согласно вышесказанному, фармацевтическая композиция по данному изобретению содержит эффективно действующее количество биосинтетического аналога инсулина человека формулы 1 или его фармакологически приемлемой соли и вспомогательные вещества. Соль биосинтетического аналога инсулина человека согласно данному изобретению может быть,например, солью щелочного металла или аммонийной солью. Предназначенную для введения композицию согласно данному изобретению получают в форме раствора, и она содержит эффективно действующее количество биосинтетического аналога инсулина человека формулы 1 или его фармакологически приемлемой соли и вспомогательные вещества, такие как изотонические агенты, консерванты, стабилизаторы, факультативно буферные вещества. Количество активного вещества, используемого в композиции согласно данному изобретению, составляет около 1-1600, предпочтительно 10-1200, особенно предпочтительно 10-500 ед./мл. В случае каждого аналога инсулина человека, который является объектом данного изобретения, под 1 единицей (1 ед.) подразумевается 1 вспомогательная единица, содержащая такое же число молей аналога, как 1 международная единица инсулина, соответствующая 6 нмоль (т.е. 610-9 моль). Для фармацевтической композиции согласно данному изобретению значение рН раствора составля-5 023559 ет от около 3,5 до около 5, предпочтительно 4,0-4,5. В общем, вспомогательные вещества в композициях согласно данному изобретению представляют собой те же вещества, что используются в препаратах, содержащих известный рекомбинированный инсулин человека. Изотоническое вещество согласно данному изобретению может быть любым веществом, которое позволяет получить раствор изоосмотический по отношению к плазме крови человека. К типичным изотоническим агентам, используемым в фармацевтике, принадлежат такие вещества, как хлорид натрия,маннитол, глицин, предпочтительно глицерин. Предпочтительным является использование глицерина. Пригодными консервантами для использования в композиции согласно данному изобретению являются соединения, выбранные из группы, к которой принадлежат m-крезол, фенол или их смеси. Новые производные, сходные с рекомбинированным нормальным инсулином человека, стабилизируются добавлением ионов цинка, введенными в раствор в форме, среди прочего, хлорида цинка или оксида цинка. Количество цинка может находиться в диапазоне от около 5 до около 150 мкг/мл. Был разработан следующий пример содержимого композиции, содержащей производные рекомбинированного инсулина человека согласно данному изобретению: 10-500 ед./мл биосинтетического аналога инсулина человека формулы 1 или его фармакологически приемлемой соли, 16 мг/мл глицерина, 2,7-3 мг/мл m-крезола, 10-50 мкг/мл цинка и вода для инъекции до 1 мл. Для лучшего объяснения сущности данного изобретения данное описание было расширено детальным обсуждением примеров реализации данного изобретения, которое включает также прилагаемые перечни последовательностей и фигуры, из которых показано следующее. Фиг. 1 представляет структуру плазмиды p5/ZUINSGly(22A), содержащей ген, кодирующий GKR белок рекомбинированного инсулина. Фиг. 2 представляет нуклеотидную и аминокислотную последовательность плазмидыp5/ZUINSGly(22A). Фиг. 3 представляет структуру плазмиды p6/ZUINSSer(22A), содержащей ген, кодирующий инсулиновый SKR белок. Фиг. 4 представляет нуклеотидную и аминокислотную последовательность плазмидыp6/ZUINSSer(22A). Фиг. 5 представляет влияние введения однократной дозы GKR инсулина (в дозе 5 ед./кг массы тела на концентрацию глюкозы в крови нормагликемических крыс, по сравнению с препаратом Генсулин N(Gensulin N. Средние значенияSEM (стандартная ошибка среднего). Статистическая значимостьр 0,01: инсулин GKR по сравнению с начальной концентрацией глюкозы;р 0,01,р 0,05: генсулин N по сравнению с начальной концентрацией глюкозы;р 0,01: инсулин GKR по сравнению с генсулином N. Фиг. 6 представляет влияние введения однократной дозы GKR инсулина (в дозе 5 ед./кг массы тела) на концентрацию глюкозы в крови крыс со стрептозотоцин-индуцированным диабетом легкой степени (в сравнении с препаратом Лантус). О - фиксированная гипергликемия; контроль - физиологический солевой раствор 10 мкл/200 г массы тела. Статистическая значимость:р 0,01,р 0,05 GKR по сравнению с Лантусом. Фиг. 7 представляет влияние введения однократной дозы GKR инсулина (в дозах 2,5, 5 и 7,5 ед./кг массы тела) на концентрацию глюкозы в крови крыс со стрептозотоцин-индуцированным диабетом тяжелой степени. 0 - фиксированная гипергликемия; контроль - физиологический солевой раствор 10 мкл/200 г массы тела. Статистическая значимость:р 0,01,р 0,05 GKR 2,5 ед. по сравнению с контролем;р 0,01,р 0,05 GKR 5 ед. по сравнению с контролем;р 0,01,р 0,05 GKR 7,5 ед. по сравнению с контролем. Фиг. 8 представляет влияние введения однократной дозы GKR инсулина (в дозе 7,5 ед./кг массы тела) на концентрацию глюкозы в крови крыс со стрептозотоцин-индуцированным диабетом тяжелой степени (в сравнении с препаратом Лантус). 0 - фиксированная гипергликемия; контроль - физиологический солевой раствор 10 мкл/200 г массы тела. Статистическая значимость:р 0,01, р 0,05 GKR по сравнению с Лантусом. Фиг. 9 представляет концентрацию глюкозы в крови крыс после множественных введений GKR инсулина в дозах 5 ед./кг массы тела в модели стрептозотоцин-индуцированного диабета легкой степени (в сравнении с препаратом Лантус); 0 - фиксированная гипергликемия; контроль - физиологический солевой раствор 10 мкл/200 г массы тела. Фиг. 10 представляет концентрацию глюкозы в крови крыс в период после прекращения введенияGKR инсулина в дозе 5 ед./кг массы тела в модели стрептозотоцин-индуцированного диабета легкой степени (в сравнении с препаратом Лантус). Фиг. 11 представляет влияние введения однократной дозы GR инсулина (в дозах 10 ед./кг массы тела) на концентрацию глюкозы в крови крыс со стрептозотоцин-индуцированным диабетом умеренной степени в сравнении с препаратом Лантус. 0 - фиксированная гипергликемия; контроль физиологическая соль 10 мкл/200 г массы тела. 0 - фиксированная гипергликемия; контроль - физиологический солевой раствор 10 мкл/200 г массы тела. Статистическая значимость:р 0,01,р 0,05 GR по сравнению с Лантусом. Фиг. 12 представляет влияние введения однократной дозы GEKR инсулина (в дозе 10 ед./кг массы тела) на концентрацию глюкозы в крови крыс со стрептозотоцин-индуцированным диабетом умеренной степени в сравнении с препаратом Левемир. 0 - фиксированная гипергликемия. Пример 1. Конструирование p5/ZUINSGly(22A) плазмиды и получение штамма, трансформированного этой плазмидой. Для конструирования гена, кодирующего рекомбинированный INSGly(22A) проинсулин, была использована p5/ZUINS плазмида, в которой фрагмент ДНК, кодирующий предшественник рекомбинированного инсулина, добавляют к модифицированному гену синтетического убиквитина. В гене убиквитина аргининовые кодоны были замещены аланиновыми кодонами, и к С-концу гена убиквитина был добавлен дополнительный аргининовый кодон. Пептид, который составляет часть убиквитина, является переносчиком для предшественника инсулина и является условием высокой эффективности синтеза слитого белка в Е.coli. Участок, кодирующий модифицированный слитый белок убиквитин-инсулин человека, помещается под контроль pms (WO 05066344 А 2) промотора. Плазмида несет ген устойчивости к ампициллину. Для конструирования вектора p5/ZUINS была использована плазмида pIGAL1, чья последовательность, сохраняемая в Банке Генов (Gene Bank), имеет номер AY424310. Ген рекомбинированного INSGly(22A) проинсулина отличается от модельного гена проинсулина человека таким образом, что он имеет прикрепленный дополнительный GGT кодон на С-конце цепи А. В результате аминокислотная последовательность цепи А удлиняется в положении 22 на аминокислотный остаток Gly - глицин. Для того чтобы модифицировать ген, кодирующий последовательность рекомбинированного проинсулина человека, путем добавления GGT (Gly) кодона на ее С-конце, были разработаны следующие праймеры для реакции точечного мутагенеза: Реакцию точечного мутагенеза проводили с использованием набора Stratagene (номер по каталогу 200518-5). В качестве матрицы была использована плазмидная ДНК p5/ZUINS. Компетентные клеткиDH5 Escherichia coli были трансформированы реакционной смесью. Плазмиду p5/ZUINSGly(22A) выделили и секвенировали для того, чтобы подтвердить наличие GGT нуклеотидов, кодирующих глицин, и правильность плазмидной последовательности. Плазмида с модифицированным геном, кодирующим рекомбинированный p5/ZUINSGly(22A) проинсулин, была использована в трансформации компетентных клеток DH5 E.coli, которые далее культивировали в течение 18 ч в среде LB с добавлением ампициллина (0,01 мг/мл) в объеме 500 мл при 37 С, 200 об/мин. Бактериальный материал был приготовлен для банка штаммов, образцы, содержащие 1:1 бактериальные культуры и 40% глицерин хранили при -70 С. Полученный штамм Escherichia coli представляет собой начальный биологический материал в способе получения GKR инсулина посредством биосинтеза, согласно примеру 10. Генетическое конструирование плазмиды p5/ZUINSGly(22A). Плазмида p5/ZUINSGly(22A) составляет 4775 пар оснований в длину и построена из следующих регуляторных последовательностей и генов: от 374 до 1234 п.о. (пар оснований, или bp) имеет место ген устойчивости к ампициллину AMP R; от 4158 до 4323 п.о. имеет место участок, кодирующий pms промотор; от 4327 до 4554 п.о. имеет место последовательность, кодирующая модифицированный синтетический ген убиквитина ZUBI; от 4558 до 4722 п.о. имеет место последовательность, кодирующая ген рекомбинированногоINSGly(22A) проинсулина; от 4729 до 4775 п.о. имеет место участок, кодирующий терминатор транскрипции Ter. Структура плазмиды p5/ZUINSGly(22A), содержащей ген, кодирующий белок рекомбинированного инсулина человека (GKR инсулин), показана схематически на фиг. 1, и ее нуклеотидная и аминокислотная последовательность на фиг. 2. Пример 2. Конструирование плазмиды p5/ZUINSGly(22A)Arg(31B) и получение штамма, трансформированного ею. При конструировании гена рекомбинированного INSGly(22A)Arg(31B) проинсулина была использована плазмида p5/ZUINSGly(22A). Рекомбинированный INSGly(22A)Arg(31B) ген характеризуется замещением AAG (Lys) кодона CGT (Arg) кодоном в положении 31 цепи В. Для того чтобы модифицировать ген, кодирующий последовательность рекомбинированного INS-7 023559Gly(22A) проинсулина, были разработаны следующие праймеры для реакции точечного мутагенеза: Набор Stratagene (номер по каталогу 200518-5) был использован для проведения реакции точечного мутагенеза. Выделение, подтверждение правильности плазмидной нуклеотидной последовательности и получение DH5 бактерий Е.coli с p5/ZUINSGly(22A)Arg(31B) плазмидой были проведены, как в примере 1. Полученный штамм Escherichia coli представляет собой начальный биологический материал в процессе производства GR инсулина посредством биосинтеза согласно примеру 11. Пример 3. Конструирование плазмиды p5/ZUINSSer(22A)Arg(31B) и получение штамма, трансформированного ею. Для конструирования гена рекомбинированного INSSer(22A)Arg(31B) проинсулина была использована плазмида p5/ZUINSGly(22A)Arg(31B). Различие между геном, кодирующим рекомбинированныйINSSer(22A)Arg(31B) проинсулин, и геном, кодирующим рекомбинированный проинсулин INSGly(22A)Arg(31B), состоит в замещении GGT (Gly) кодона ТСТ (Ser) кодоном в положении 22 цепи А. Для того чтобы модифицировать ген, кодирующий последовательность рекомбинированного INSGly(22A)Arg(31B) проинсулина, с помощью замещения GGT (Gly) кодоном ТСТ (Ser) в положении 22 цепи А, были разработаны следующие праймеры для реакции точечного мутагенеза: Набор Stratagene (номер по каталогу 200518-5) был использован для проведения реакции точечного мутагенеза. Выделение, подтверждение правильности плазмидной нуклеотидной последовательности и получение DH5 бактерий Е.coli с плазмидой p5/ZUINSSer(22A)Arg(31B) были проведены, как в примере 1. Полученный штамм Escherichia coli представляет собой начальный биологический материал в процессе производства SR инсулина посредством биосинтеза согласно примеру 12. Пример 4. Конструирование плазмиды p5/ZUINSAla(22A) и получение штамма, трансформированного ею. Для конструирования гена рекомбинированного INSAla(22A) проинсулина была использована плазмида p5/ZUINS. Различие между геном рекомбинированного INSAla(22A) проинсулина и модельным геном проинсулина человека состоит в добавлении GCT кодона к С-концу цепи А первого. В результате аминокислотная последовательность цепи А удлиняется в положении 22 на аминокислотный остаток Ala - аланин. Для того чтобы модифицировать ген, кодирующий последовательность рекомбинированного инсулина человека, добавлением GCT (Ala) кодона на ее С-конце, были разработаны следующие праймеры для точечного мутагенеза: Набор Stratagene (номер по каталогу 200518-5) был использован для проведения реакции точечного мутагенеза. Выделение, подтверждение правильности плазмидной нуклеотидной последовательности и получение DH5 бактерий Е.coli с плазмидой p5/ZUINSAla(22A) были проведены, как в примере 1. Полученный штамм Escherichia coli представляет собой начальный биологический материал в процессе производства AKR инсулина посредством биосинтеза согласно примеру 13. Пример 5. Конструирование плазмиды p5/ZUINSGly(22A)Glu(3B) и получение штамма, трансформированного ею. Для конструирования гена рекомбинированного p5/ZUINSGly(22A)Glu(3B) проинсулина была использована p5/ZUINSGly(22A) плазмида. Различие между геном, кодирующим рекомбинированныйINSGly(22A)Glu(3B) проинсулин, и геном, кодирующим рекомбинированный INSGly(22A) проинсулин,заключается в замещении кодона ААС (Asn) кодоном GAA (Glu) в положении 3 цепи В. Для того чтобы модифицировать ген, кодирующий последовательность рекомбинированного ENSGly(22A) проинсулина, посредством замещения ААС (Asn) кодоном GAA (Glu) в положении 3 цепи В,были разработаны следующие праймеры для реакции точечного мутагенеза: Набор Stratagene (номер по каталогу 200518-5) был использован для проведения реакции точечного мутагенеза. Выделение, подтверждение правильности плазмидной нуклеотидной последовательности и получение DH5 бактерий Е.coli с плазмидой p5/ZUINSGly(22A)Glu(31B) были проведены, как в примере 1. Полученный штамм Escherichia coli представляет собой начальный биологический материал в процессе производства GEKR инсулина посредством биосинтеза согласно примеру 14. В примерах 1-5 в качестве хозяинов плазмиды были использованы DH5 бактерии Е.coli, но в описанной выше модельной реализации данного изобретения могут быть использованы также другие штаммы Е.coli, например, DH5 или НВ 101. Пример 6. Конструирование плазмиды p6/ZUINSSer(22A) и получение штамма, трансформированного ею. Для конструирования гена, кодирующего рекомбинированный INSSer(22A) проинсулин, была использована плазмида р 6/ZUINS, в которой фрагмент ДНК, кодирующий предшественник рекомбинированного инсулина, был добавлен к модифицированному гену, кодирующему синтетический убиквитин. В убиквитин-кодирующем гене кодоны аргинина были замещены кодонами аланина и к С-концу гена убиквитина был добавлен дополнительный аргининовый кодон. Пептид, составляющий часть убиквитина,является переносчиком для предшественника инсулина, который обуславливает высокую эффективность экспрессии слитого белка у Е.coli. Участок, кодирующий модифицированный слитый белок убиквитининсулин человека помещают под контроль pms промотора (WO 05066344 А 2). Плазмида несет ген устойчивости к тетрациклину. Для конструирования вектора р 6/ZUINS была использована плазмидаp5/ZUINS. Различие между геном, кодирующим рекомбинированный INSSer(22A) проинсулин, и модельным геном проинсулина человека состоит в том, что к первому был добавлен дополнительный кодон ТСТ на С-конце цепи А. В результате аминокислотная последовательность цепи А удлиняется в положении 22 на аминокислотный остаток Ser - серин. Для того чтобы модифицировать ген, кодирующий последовательность рекомбинированного проинсулина, посредством добавления кодона ТСТ (Ser) на ее С-конце, были разработаны следующие праймеры для реакции точечного мутагенеза: Набор Stratagene (номер по каталогу 200518-5) был использован для проведения реакции точечного мутагенеза, в качестве матрицы использовали р 6/ZUINS плазмидную ДНК. Компетентные клетки DH5Escherichia coli были трансформированы реакционной смесью. Плазмида p6/ZUESfSSer(22A) была выделена и секвенирована для того, чтобы подтвердить присутствие ТСТ нуклеотидов, кодирующих серии, иp6/ZUINSSer(22A) проинсулин, была использована для трансформации DH5 бактерий Е.coli. Впоследствии бактерии культивировали в течение 18 ч в средах LB с добавлением тетрациклина (0,01 мг/мл) в 500 мл объема при 37 С, 200 об/мин. Бактериальный материал был приготовлен для банка штаммов, образцы, содержащие 1:1 бактериальные культуры и 40% глицерин, хранили при -70 С. Полученный штамм Escherichia coli представляет собой начальный биологический материал в процессе производства SKR инсулина посредством биосинтеза согласно примеру 15. Генетическое конструирование плазмиды p6/ZUINSSer(22A). Плазмида p6/ZUINSSer(22A) составляет 4911 пар оснований в длину и составлена из следующих регуляторных последовательностей и генов: от 146 до 1336 п.о. имеет место ген устойчивости к тетрациклину ТЕТ R; от 4304 до 4469 п.о. имеет место участок, кодирующий pms промотор; от 4473 до 4703 п.о. имеет место участок, кодирующий ген, кодирующий модифицированный синтетический убиквитин; существуют следующие модификации: замещение аминокислоты аргинин в положениях 42, 54, 72, 74 в гене убиквитина аланином и добавление аргинина в положении 77, что позволяет удалить убиквитин; от 4704 до 4868 п.о. имеет место последовательность, кодирующая ген, кодирующий рекомбинированный INSSer(22A) проинсулин; от 4875 до 4911 п.о. имеет место участок, кодирующий терминатор транскрипции Ter. Структура плазмиды p6/ZUINSSer(22A), содержащей ген, кодирующий белок рекомбинированного инсулина человека (SKR белок), показана схематически на фиг. 3, а ее нуклеотидная и аминокислотная последовательность на фиг. 4. Пример 7. Конструирование плазмиды p6/ZUINSGly(22A) и получение штамма, трансформированного ею. Для конструирования гена, кодирующего рекомбинированный INSGly(22A) проинсулин, была использована плазмида р 6/ZUINS, в которой фрагмент ДНК, кодирующий предшественник рекомбинированного инсулина, добавлен к модифицированному гену, кодирующему синтетический убиквитин. Различие между геном, кодирующим рекомбинированный INSGly(22A) проинсулин, и модельным геном проинсулина человека, состоит в том, что к первому был добавлен дополнительный кодон GGT на С-конце цепи А. В результате аминокислотная последовательность цепи А удлиняется в положении 22 на аминокислотный остаток Gly - глицин. Для того чтобы модифицировать ген, кодирующий последовательность рекомбинированного проинсулина человека, посредством добавления кодона GGT (Gly) на ее С-конце, были разработаны следующие праймеры для реакции точечного мутагенеза: Набор Stratagene (номер по каталогу 200518-5) был использован для проведения реакции точечного мутагенеза. Выделение, подтверждение правильности плазмидной нуклеотидной последовательности и получение DH5 бактерий Е.coli с плазмидой p6/ZUINSGly(22A) были проведены, как в примере 6. Полученный штамм Escherichia coli представляет собой начальный биологический материал в процессе производства GKR инсулина посредством биосинтеза согласно примеру 16. Пример 8. Конструирование плазмиды p6/ZUINSGly(22A)Glu(3B) и получение штамма, трансформированного ею. Для конструирования гена рекомбинированного INSGly(22A)Glu(3B) проинсулина была использована плазмида p6/ZUINSGly(22A). Различие между геном рекомбинированного INSGly(22A)Glu(3B) проинсулина и геном рекомбинированного INSGly(22A) проинсулина состоит в замещении ААС (Asn) кодона GAA (Glu) кодоном в положении 3 цепи В. Для того чтобы модифицировать ген, кодирующий последовательность рекомбинированного INSGly(22A) проинсулина, посредством замещения ААС (Asn) кодона GAA (Glu) кодоном в положении 3 в цепи В, были разработаны следующие праймеры для точечного мутагенеза: Набор Stratagene (номер по каталогу 200518-5) был использован для проведения реакции точечного мутагенеза. Выделение, подтверждение правильности плазмидной нуклеотидной последовательности и получение DH5 бактерий Е.coli с плазмидой p6/ZUINSGly(22A)Glu(31B) были проведены, как в примере 6. Полученный штамм Escherichia coli представляет собой начальный биологический материал в процессе производства GEKR инсулина посредством биосинтеза согласно примеру 17. Пример 9. Конструирование плазмиды p6/ZUINSGly(22A)Arg(31B) и получение штамма, трансформированного ею. Для конструирования гена рекомбинированного INSGly(22A)Arg(31B) проинсулина была использована плазмида p6/ZUINSGly(22A). Ген, кодирующий рекомбинированный INSGly(22A)Arg(31B) проинсулин, характеризуется тем, что в нем замещен AAG (Lys) кодон CGT (Arg) кодоном в положении 31 цепи В. Для того чтобы модифицировать ген, кодирующий последовательность рекомбинированного INSGly(22A) проинсулина, были разработаны следующие праймеры для точечного мутагенеза: Набор Stratagene (номер по каталогу 200518-5) был использован для проведения реакции точечного мутагенеза. Выделение, подтверждение правильности плазмидной нуклеотидной последовательности и получение DH5 бактерий Е.coli с плазмидой p6/ZUINSGly(22A)Arg(31B) были проведены, как в примере 6. Полученный штамм Escherichia coli представляет собой начальный биологический материал в процессе производства GR инсулина посредством биосинтеза согласно примеру 18. Пример 10. Производство GKR инсулина.GKR инсулин был произведен в процессе биосинтеза, осуществляемом классическим путем (инокулят, посевная культура, продуктивная культура) с использованием штамма Escherichia coli с фрагментом ДНК, кодирующим предшественник GKR инсулина, полученного согласно примеру 1. Продуктивная культивация была проведена в 150 дм 3 ферментационном чане в течение 20 ч при 37 С, контролируя рН,температуру, оптическую плотность, концентрацию глюкозы и аэрацию. В условиях ферментации GKR аналог образовывался внутриклеточно в тельцах включения. После окончания ферментации ферментационный бульон концентрировали и далее обрабатывали лизозимом, и бактериальные клетки подвергали разрушению. Полученную суспензию разводили водой и после инкубации с тритоном центрифугировали. Созданное сырое отложение телец включения вначале очищали, в итоге получая гомогенат телец включения. Полученный гомогенат растворяли (10-15 мг/см 3) в растворе карбоната натрия с добавлением ЭДТА (этилендиаминтетрауксусная кислота), подвергали ренатурации и, для защиты свободных аминогрупп лизина, подвергали обратимому процессу цитраконилирования в реакции с цитраконовым ангидридом. Растворенный белок подвергали расщеплению трипсином для того, чтобы выщепить лидерный белок и расщепить инсулиновые цепи. В результате действия трипсина был получен GKR инсулин. Раствор после расщепления трипсином подвергли очищению жидкостной хроматографией при низком давлении на геле ДЭАЭ (диэтиламиноэтил или DEAE) - сефароза FF (Sepharose FF(Fast Flow, и после этого диафильтрации и концентрированию - вторая жидкостная хроматография при низком давлении на геле Qсефарозы FF. Основная фракция подвергалась очистке жидкостной хроматографией при высоком давлении на 10 мкм геле Kromasil-RPC8 100A. Основную фракцию концентрировали с использованием диализа до концентрации 30-40 мг/см 3 и очищенный GKR инсулин был отделен путем кристаллизации с использованием цитрата натрия, ацетата цинка, лимонной кислоты. Из одной партии телец включения получили около 5,4 г кристаллизованного GKR инсулина с чистотой ВЭЖХ 97%. Структура продукта была подтверждена следующими данными: молекулярная масса, определенная масс-спектрометрией, равна 6149 и соответствует теоретическому значению (6149,1); пептидная карта: соответствует; последовательность и аминокислотный состав: соответствующий теоретическому. Изоэлектрическая точка, определенная с помощью капиллярного электрофореза, составляет 7,19. Пример 11. Производство GR инсулина. Осуществляя процесс аналогично примеру 10, используя штамм Escherichia coli с фрагментом ДНК,кодирующим предшественник GR инсулина, полученный согласно примеру 2, получили из аналогичной партии телец включения 5,2 г GR инсулина с чистотой ВЭЖХ, равной 97,5%. Структура продукта была подтверждена следующими данными: молекулярная масса, определенная масс-спектрометрией, равна 6021 и соответствует теоретическому значению (6020,9); пептидная карта: соответствует,последовательность и аминокислотный состав: соответствуют теоретическому. Изоэлектрическая точка: 6,39. Пример 12. Производство SR инсулина. Осуществляя процесс аналогично примеру 10, используя штамм Escherichia coli с фрагментом ДНК,кодирующим предшественник SR инсулина, полученный согласно примеру 3, получили из аналогичной партии телец включения 5,5 г SR инсулина с чистотой ВЭЖХ, равной 97%. Структура продукта была подтверждена следующими данными: молекулярная масса, определенная масс-спектрометрией, равна 6051 и соответствует теоретическому значению (6050,9); пептидная карта: соответствует. Изоэлектрическая точка: 6,55. Пример 13. Производство AKR инсулина. Осуществляя процесс аналогично примеру 10, используя штамм Escherichia coli с фрагментом ДНК,кодирующим предшественник AKR инсулина, полученный согласно примеру 4, получили из аналогичной партии телец включения 4,7 г AKR инсулина с чистотой ВЭЖХ, равной 96,5%. Структура продукта была подтверждена следующими данными: молекулярная масса, определенная масс-спектрометрией, равна 6163 и соответствует теоретическому значению (6163,1); пептидная карта: соответствует. Изоэлектрическая точка: 7,07. Пример 14. Производство GEKR инсулина. Осуществляя процесс аналогично примеру 10, используя штамм Escherichia coli с фрагментом ДНК,кодирующим предшественник GEKR инсулина, полученный согласно примеру 5, получили из аналогичной партии телец включения 5,0 г GEKR инсулина с чистотой ВЭЖХ, равной 97,5%. Структура продукта была подтверждена следующими данными: молекулярная масса, определенная масс-спектрометрией, равна 6164 и соответствует теоретическому значению (6164,1); пептидная карта: соответствует. Изоэлектрическая точка: 6,29. Пример 15. Производство SKR инсулина. Осуществляя процесс аналогично примеру 10, используя штамм Escherichia coli с фрагментом ДНК,кодирующим предшественник SKR инсулина, полученный согласно примеру 6, получили из аналогичной партии телец включения 5,3 г SKR инсулина с чистотой ВЭЖХ, равной 98%. Структура продукта была подтверждена следующими результатами: молекулярная масса, определенная масс-спектрометрией, равна 6179 и соответствует теоретическому значению (6179,1); пептидная карта: соответствует. Изоэлектрическая точка: 7,05. Пример 16. Производство GKR инсулина. Осуществляя процесс аналогично примеру 10, используя штамм Escherichia coli с фрагментом ДНК,кодирующим предшественник GKR инсулина, полученный согласно примеру 7, получили из аналогичной партии телец включения 6,3 г GKR инсулина с чистотой ВЭЖХ, равной 95,5%. Остальные свойства продукта (GKR инсулина) такие, как в примере 10. Пример 17. Производство GEKR инсулин. Осуществляя процесс аналогично примеру 10, используя штамм Escherichia coli с фрагментом ДНК,кодирующим предшественник GEKR инсулина, полученный согласно примеру 8, получили из аналогичной партии телец включения 6,0 г GEKR инсулина с чистотой ВЭЖХ, равной 97%. Остальные свойства продукта (GEKR инсулина) такие, как в примере 14. Пример 18. Производство GR инсулина. Осуществляя процесс аналогично примеру 10, используя штамм Escherichia coli с фрагментом ДНК,кодирующим предшественник GR инсулина, полученный согласно примеру 9, получили из аналогичной партии телец включения 5,5 г GR инсулина с чистотой ВЭЖХ, равной 96,5%. Остальные свойства продукта (GR инсулина) такие, как в примере 11. Пример 19. Производство ZKR инсулина. К 1000 мл раствора GKR инсулина, произведенного согласно примеру 10 или 16 (концентрация 0,1 мг/мл), в 100 мМ MES/KOH буфера рН 5,0-5,5 добавляли 1 мкМ CuSO4, 100 мкг/мл каталазы, 5 мМ аскорбиновой кислоты и 2 мкМ РАМ фермента (полученного согласно Satani M., Takahashi K., Sakamotoalpha-amidating monooxygenase. Protein Expr Purif. 2003 Apr; 28(2):293-302), и после этого смесь оставляли на 2 ч при 37 С. Реакцию останавливали добавлением 1 мМ Na2-ЭДТА. После фильтрации полученный раствор подвергался очищению с помощью способов ионообменной хроматографии и ВЭЖХ. Главную фракцию, содержащую ZKR инсулин, концентрировали и подвергали кристаллизации, используя цитрат натрия, цитрат цинка, лимонную кислоту. Из одной партии реакционной смеси получали около 10 мг кристаллического ZKR инсулина с чистотой ВЭЖХ, равной 97%. Структура продукта была подтверждена следующими результатами: молекулярная масса, определенная масс-спектрометрией, равна 6091 и соответствует теоретическому значению (6091,1); пептидная карта: соответствует. Изоэлектрическая точка: 7,54. Пример 20. Производство ZR инсулина. К 100 мл раствора GR инсулина, произведенного согласно примеру 11 или 18 (2 мг/мл), в 100 мМMES/KOH буфера, рН 4,5, добавляли 1 мкМ CuSO4, 100 мкг/мл каталазы, 5 мМ аскорбиновой кислоты и 2 мкМ РАМ фермента, и после этого раствор слегка перемешивали в течение 1 ч при 37 С. Реакцию останавливали добавлением 1 мМ Na2-ЭДТА. Раствор после реакции с РАМ подвергали очищению с помощью способов ионообменной хроматографии и ВЭЖХ. Главную фракцию, содержащую инсулин, концентрировали и подвергали кристаллизации, используя цитрат натрия, цитрат цинка, лимонную кислоту. Из одной партии реакционной смеси получали 22 мг кристаллического ZR инсулина с чистотой ВЭЖХ, равной 98%. Структура продукта была подтверждена следующими результатами: молекулярная масса, определенная масс-спектрометрией, равна 5963 и соответствует теоретическому значению (5962,9); пептидная карта: соответствует. Изоэлектрическая точка: 6,97. Пример 21. Производство фармацевтического препарата GKR инсулина (100 ед./мл). Приготовили 100 мл фармацевтического препарата GKR инсулина (100 ед./мл) следующего состава Процедура приготовления была следующей. Готовили два следующих раствора. Раствор 1. Оксид цинка в количестве, необходимом для реакции с конечной концентрацией ионов Zn 30 мкг/мл, растворяли в 40 мл 10 мМ соляной кислоты. После этого, к полученному раствору добавляли инсулин GKR в количестве, соответствующем 10000 ед. инсулина GKR, при легком перемешивании до получения прозрачного раствора и затем рН доводили до значения 4,5. Раствор 2. Отдельно, 270 мг m-крезола и 1600 мл безводного глицерина разводили в 40 мл воды для инъекции. Смешивание растворов 1 и 2. Раствор 1 добавляли при перемешивании к раствору 2, дополненному водой для инъекции до объема 100 мл и в случае необходимости доведя рН до значения 4,5 с помощью 10 мМ соляной кислоты или 0,2 М раствора гидроксида натрия. Полученную смесь в стерильных условиях фильтровали через 0,22 мкм фильтр и отбирали аликвоты в стеклянные 3 мл флаконы. Определили, что препарат, содержащийGKR инсулин (100 ед./мл), проявляет стабильность при комнатной температуре в исследуемый период равный 56 дням, в ускоренном испытании на стабильность (пример 24). Пример 22. Производство фармацевтического препарата GR инсулина (100 ед./мл). Приготовили 100 мл фармацевтического препарата GR инсулина (100 ед./мл) следующего состава Процедура была идентичной таковой в примере 21, за исключением того, что вместо GKR инсулина был использован GR инсулин (в количестве 361 мг, 10000 ед.) и что конечное значение рН было 4,0. Пример 23. Производство фармацевтического препарата GEKR инсулина (100 ед./мл). Приготовили 100 мл фармацевтического препарата GEKR инсулина (100 ед./мл) следующего состава (значения на 1,0 мл): Процедура была идентичной таковой в примере 21, за исключением того, что вместо GKR инсулина был использован GEKR инсулин (в количестве 10000 ед.) и что конечное значение рН было 4,0. Пример 24. Ускоренное испытание стабильности фармацевтического препарата GKR инсулина (100 ед./мл). Фармацевтический препарат GKR инсулина (100 ед./мл), приготовленный согласно примеру 21,подвергался ускоренному испытанию стабильности (252 С). В ходе этого испытания проводили анализ чистоты и уровня белковой примеси. Ниже показаны определенная с помощью ВЭЖХ чистота продукта Пример 25. Ускоренное испытание стабильности фармацевтического препарата GEKR инсулина(100 ед./мл). Фармацевтический препарат GEKR инсулина (100 ед./мл), приготовленный согласно примеру 23,подвергался ускоренному испытанию стабильности (252 С). В ходе этого испытания проводили анализ чистоты и уровня белковой примеси. Ниже показаны определенная с помощью ВЭЖХ чистота продукта(GEKR инсулина) и пропорциональный вклад: наибольшей отдельной примеси и полимеров, в ВЭЖХ испытании, в моменты времени: "0", и 14 дней и 1,2 и 3 месяца. Пример 26. Определение активности GKR на животных с нормогликемией. Аналог рекомбинированного инсулина человека (GKR инсулин), сходный с генсулином N (рекомбинированным изофан инсулином человека) проявляет пролонгированное время действия, и гипогликемия нормогликемических крыс имеет сходное течение. Значительные отличия в гипогликемической активности обоих препаратов наблюдались через 0,5 и 1 час после введения. В это время имеет место наблюдаемое быстрое и глубокое снижение концентрации глюкозы после GKR инсулина. Пиковая активность GKR инсулина и Генсулина N приходится на 2-й час. Начальное исследование подтвердило, что GKR инсулин является активным аналогом с пролонгированной гипогликемической активностью. Снижение уровня глюкозы после введения GKR инсулина наблюдалось на протяжении до 12 ч, тогда как уровни глюкозы через 24 ч были сходными с начальным. Результаты реакции нормогликемических крыс на однократное введение препаратов GKR инсулина и генсулина N (принимая во внимание средние значенияSEM) показаны на табл. 1 и фиг. 5. Пример 27. Определение активности GKR инсулина на животных с экспериментальным диабетом. Исследования на экспериментальной модели диабета крыс (индукция стрептозотоцином) подтвердили неоспоримую гипогликемическую активность GKR инсулина. Эта активность имеет свойства пролонгированной активности. После введения однократной дозы, снижение концентрации глюкозы в крови исследуемых крыс оставалось статистически значимым до 8-го-10-го часа (в зависимости от интенсивности диабета и дозы), в сравнении с контролем. В ходе исследования было продемонстрировано более быстрое начало активности и более быстрое достижение пиковой активности (начало с 30 минут, пик 1-2 часа) при действииGKR инсулина по сравнению с эталонным препаратом - инсулин гларгин (Лантус). Статистическая значимость этого явления была подтверждена для диабета тяжелой и умеренной степени. Также исследование введения многократных доз GKR инсулина и эталонного препарата инсулина гларгина демонстрировало сходную активность обоих аналогов. Вводимые в течение 21 дня, три раз в день, препараты вызывали улучшение гликемических параметров при диабете легкой степени и, в принципе, статистически не отличались по интенсивности действия. Единственным отличием был значительно более равномерный профиль активности GKR инсулина. Дополнительно, наблюдалось очень интересное явление продолжительного гипогликемического действия после окончания введения GKR препарата. Это наблюдение было проведено на 9 крысах, которые получали лечение GKR препаратом и 3 из которых получали лечение Лантусом, из группы с диабетом легкой степени, которым вводились аналоги в дозе 5 ед./кг массы тела в течение 21 дня. Полученные результаты могут свидетельствовать о существовании очень сильного связывания GKR инсулина в тканях (возможно подкожной ткани). Они поддерживают тезис о существовании компартмента, в котором инсулин накапливается и медленно перераспределяется. Это явление не наблюдалось для эталонного препарата. Это свойство, после его подтверждения у людей, может быть прорывом в терапии с аналогами инсулина пролонгированной активности, позволяя, например, вводить менее чем одну дозу медикамента в день. Результаты, описывающие концентрацию глюкозы в крови крыс после введения однократной дозыGKR инсулина в дозе 5 ед./кг массы тела в модели стрептозотоцин-индуцированного диабета легкой степени (в сравнении с препаратом Лантус), показаны в табл. 2 и фиг. 6. Результаты, описывающие влияние GKR инсулина на концентрацию глюкозы в крови крыс после одноразового введения однократной дозы в дозах 2,5 ед./кг массы тела, 5 ед./кг массы тела и 7,5 ед./кг массы тела в модели стрептозотоцин-индуцированного диабета тяжелой степени (в сравнении с препаратом Лантус и контроль), показаны в табл. 3. Результаты, представляющие влияние GKR инсулина на концентрацию глюкозы в крови крыс после введения однократной дозы в дозах 2,5 ед./кг массы тела, 5 ед./кг массы тела и 7,5 ед./кг массы тела в модели стрептозотоцин-индуцированного диабета тяжелой степени (в сравнении с контролем), показаны на фиг. 7. Результаты, представляющие влияние GKR инсулина на концентрацию глюкозы в крови крыс после введения однократной дозы 7,5 ед./кг массы тела в модели стрептозотоцин-индуцированного диабета тяжелой степени (в сравнении с препаратом Лантус), показаны на фиг. 8. Результаты, описывающие концентрацию глюкозы в крови крыс после многократных введений 5 ед./кг массы тела GKR инсулина в модели стрептозотоцин-индуцированного диабета легкой степени (в сравнении с препаратом Лантус), показаны в табл. 4 и фиг. 9. Результаты, описывающие концентрацию глюкозы в крови крыс после окончания введений 5 ед./кг массы тела GKR инсулина в модели стрептозотоцин-индуцированного диабета легкой степени (в сравнении с препаратом Лантус), показаны в табл. 5 и фиг. 10. Таблица 1 Влияние введения однократной дозы GKR инсулина (в дозе 5 ед./кг массы тела) на концентрацию глюкозы в крови нормогликемических крыс, в сравнении с Генсулином N (изофан рекомбинированный инсулин человека) Экспериментальные группы n=10;средние значенияSEM; Статистическая значимостьр 0,01 GKR инсулин по сравнению с начальной концентрацией глюкозы;р 0,01,р 0,05 Генсулин N по сравнению с начальной концентрацией глюкозы;р 0,01 GKR инсулин 5 ед./кг массы тела по сравнению с Генсулином N 2 ед./кг массы тела.Зафиксированная смерть одного животного во 2-й час. Таблица 2 Влияние введения однократной дозы GKR инсулина в дозе 5 ед./кг массы тела на концентрацию глюкозы в крови крыс с стрептозотоцин-индуцированным диабетом легкой степени, в сравнении с препаратом Лантус (инсулин гларгин) Таблица 3 Влияние введения однократной дозы GKR инсулина (в дозе 2,5, 5 и 7,5 ед./кг массы тела) на концентрацию глюкозы в крови крыс со стрептозотоцин-индуцированным диабетом тяжелой степени, по сравнению с препаратом Лантус (инсулин гларгин) Таблица 4 Влияние многократных введений GKR инсулина в дозе 5 ед./кг массы тела на концентрацию глюкозы в крови крыс со стрептозотоцин-индуцированным диабетом легкой степени по сравнению с препаратом Лантус (инсулин гларгин) Статистическая значимость:р 0,01,р 0,05 GKR по сравнению с Лантусом,р 0,01,р 0,05 GKR по сравнению с контролем. Таблица 5 Концентрация глюкозы в период после окончания введения GKR инсулина в дозе 5 ед./кг массы тела в модели стрептозотоцин-индуцированного диабета легкой степени в сравнении с препаратом Лантус (инсулин гларгин) Пример 28. Определение активности GR инсулина у животных с экспериментальным диабетом. Гипогликемическая активность GR инсулина была подтверждена на стрептозотоцининдуцированном диабете умеренной степени у крыс. Определили, что активность GR инсулина после введения однократных доз - 5 или 10 ед./кг массы тела была быстрой и сильной. Начало активности имело место через 30 минут после введения препарата,и оставалась на том же уровне до 2 ч, и после этого слабела до достижения начальных уровней на 24-й-36-й час. Результаты, описывающие влияние препарата GR инсулина на концентрацию глюкозы в крови крыс после введения однократной дозы 5 и 10 ед./кг массы тела доз в модели стрептозотоцининдуцированного диабета умеренной степени (в сравнении с препаратом Лантус), показаны в табл. 6. График концентрации глюкозы/изменений времени после введения 5 ед./кг массы тела GR инсулина показан на фиг. 11. Пример 29. Определение активности GEKR инсулина у животных с экспериментальным диабетом. Гипогликемическая активность аналога GEKR инсулина была подтверждена в предварительном ис- 18023559 следовании стрептозотоцин-индуцированного диабета крыс с умеренным течением. После однократного введения GEKR инсулина в дозе 10 ед./кг массы тела наблюдалась очень быстрая (уже через 0,5 ч), сильная активность, снижающая концентрацию глюкозы в крови животных. Эта активность достигала пика уже через час после введения препарата и медленно снижалась, все еще вызывая значительное снижение уровня глюкозы в сравнении с начальными значениями до 12 ч после введения. Это исследование было проведено в сравнении с препаратом Левемир, аналогом инсулина пролонгированной активности (инсулин детемир). Результаты, описывающие влияние GEKR инсулина на концентрацию глюкозы в крови крыс после введения однократной дозы 10 ед./кг массы тела в модели стрептозотоцин-индуцированного диабета умеренной тяжести, в сравнении с препаратом Левемир, показаны в табл. 7, и график изменения концентрации глюкозы как функция времени после введения 10 ед./кг массы тела GEKR инсулина на фиг. 12. Таблица 6 Влияние введения однократной дозы GR инсулина (дозы 5 ед./кг массы тела и 10 ед./кг массы тела) на концентрацию глюкозы в крови крыс со стрептозотоцин-индуцированным диабетом умеренной степени в сравнении с препаратом Лантус (инсулин гларгин) Статистическая значимость:р 0,01,р 0,05 GR по сравнению с Лантусом. Таблица 7 Влияние введения однократной дозы GEKR инсулина (в дозе 10 ед./кг массы тела) на концентрацию глюкозы в крови крыс с диабетом умеренной степени в сравнении с препаратом Левемир (инсулин детемир)
МПК / Метки
МПК: C07K 14/62, A61K 38/28
Метки: стабильные, среде, терапевтической, пролонгированной, аналоги, инсулина, активностью, человека, кислой
Код ссылки
<a href="https://eas.patents.su/30-23559-analogi-insulina-cheloveka-s-prolongirovannojj-terapevticheskojj-aktivnostyu-stabilnye-v-kislojj-srede.html" rel="bookmark" title="База патентов Евразийского Союза">Аналоги инсулина человека с пролонгированной терапевтической активностью, стабильные в кислой среде</a>
Предыдущий патент: Термостабильный полипептид с активностью β-целлобиогидролазы и его применение для производства сахаров из лигноцеллюлозного материала
Следующий патент: Сепаратор для трубчатых проточных устройств
Случайный патент: Способ мультипраймерной амплификации для штрихового кодирования целевых нуклеиновых кислот