Таргетирование раковых клеток с использованием наночастиц
Формула / Реферат
1. Мишень-специфическая наночастица для лечения заболевания или расстройства и доставки терапевтического средства, включающая полимерную матрицу, содержащую сополимер PLA (поли- молочная кислота) и ПЭГ (полиэтиленгликоль) или PLGA (сополимер молочной кислоты и гликолевой кислоты) и ПЭГ, где часть полимерной матрицы ковалентно связана с низкомолекулярным PSMA лигандом через свободный конец ПЭГ;
и терапевтическое средство;
где низкомолекулярный PSMA лиганд представляет собой

его энантиомеры, стереоизомеры, ротамеры, таутомеры, диастереомеры или рацематы;
и где NH2-группа служит в качестве точки ковалентного присоединения к ПЭГ.
2. Наночастица по п.1, где полимерная матрица включает содержащий липидную концевую группу ПЭГ и PLGA.
3. Наночастица по п.2, где липид представляет собой липид формулы V
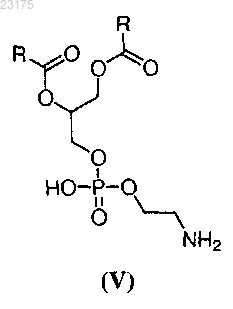
и его соли, где каждый R независимо представляет собой C1-30 алкил.
4. Наночастица по п.2, где липид представляет собой 1,2 дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE) и его соли.
5. Наночастица по п.1, где заболеванием или расстройством является рак предстательной железы.
6. Наночастица по п.1, где терапевтическое средство связано с поверхностью наночастицы, инкапсулировано внутри нее, окружено ею или диспергировано в ней.
7. Наночастица по п.1, где наночастица имеет гидрофобное ядро и терапевтическое средство инкапсулировано внутри него.
8. Наночастица по п.1, где терапевтическое средство выбрано из группы, включающей митоксантрон и доцетаксел.
9. Наночастица по п.1, где терапевтическое средство выбрано из группы, включающей химиотерапевтические средства, такие как доксорубицин (адриамицин), гемцитабин (гемзар), даунорубицин, прокарбазин, митомицин, цитарабин, этопозид, метотрексат, 5-фторурацил (5-FU), винбластин, винкристин, блеомицин, паклитаксел (таксол), доцетаксел (таксотер), альдеслейкин, аспарагиназу, бусульфан, карбоплатин, кладрибин, камптотецин, СРТ-11, 10-гидрокси-7-этилкамптотецин (SN38), дакарбазин, S-I капецитабин, фторафур, 5'-дезоксифторуридин, UFT, енилурацил, дезоксицитидин, 5-азацитозин, 5-азадезоксицитозин, аллопуринол, 2-хлораденозин, триметрексат, аминоптерин, метилен-10-деазааминоптерин (MDAM), оксаплатин, пикоплатин, тетраплатин, сатраплатин, платинум-DACH, ормаплатин, CI-973, JM-216 и его аналоги, эпирубицин, этопозид фосфат, 9-аминокамптотецин, 10,11-метилендиоксикамптотецин, каренитецин, 9-нитрокамптотецин, TAS 103, виндезин, L-фенилаланиниприт, ифосфамидмефосфамид, перфосфамид, трофосфамид кармустин, семустин, эпотилоны А-Е, томудекс, 6-меркаптопурин, 6-тиогуанин, амсакрин, этопозид фосфат, каренитецин, ацикловир, валацикловир, ганцикловир, амантадин, римантадин, ламивудин, зидовудин, бевацизумаб, трастузумаб, ритуксимаб и 5-фторурацил и их сочетания.
10. Наночастица по п.1, где терапевтическое средство представляет собой siPHK.
11. Наночастица по п.10, где молекула siPHK является комплементарной связанным с опухолью мишеням.
12. Наночастица по п.1, где наночастица содержит количество низкомолекулярного PSMA лиганда, эффективное для лечения рака, где PSMA экспрессируется на поверхности раковых клеток или в опухолевой неоваскулатуре, у субъекта, нуждающегося в этом.
13. Наночастица по п.12, где рак выбирают из группы, состоящей из следующих: рак предстательной железы, немелкоклеточный рак легкого, колоректальная карцинома и глиобластома.
14. Наночастица по п.1, где наночастица имеет диаметр от 80 до 200 нм.
15. Наночастица по п.1, где полимерная матрица дополнительно содержит PLA (полимолочная кислота).
16. Наночастица по п.1, где полимерная матрица дополнительно содержит PLGA (сополимер молочной кислоты и гликолевой кислоты).
17. Наночастица по п.1, содержащая лигандсвязанный сополимер и нефункционализированный сополимер PLA (полимолочная кислота) или PLGA (сополимер молочной кислоты и гликолевой кислоты) и ПЭГ (полиэтиленгликоль).
18. Способ получения наночастицы по п.1, имеющей отношение лигандсвязанного полимера к нефункционализированному полимеру, эффективное для лечения рака предстательной железы, включающий
обеспечение терапевтического средства;
обеспечение первого полимера, включающего сополимер PLA (полимолочная кислота) и ПЭГ (полиэтиленгликоль) или PLGA (сополимер молочной кислоты и гликолевой кислоты) и ПЭГ (полиэтиленгликоль);
обеспечение низкомолекулярного PSMA лиганда;
взаимодействие первого полимера с низкомолекулярным PSMA лигандом с получением лигандсвязанного полимера, где низкомолекулярный PSMA лиганд представляет собой
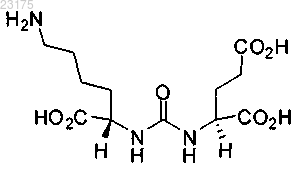
его энантиомеры, стереоизомеры, ротамеры, таутомеры, диастереомеры или рацематы,
первый полимер является ковалентно связанным с NH2-группой низкомолекулярного PSMA лиганда; и
смешивание лигандсвязанного полимера со вторым нефункционализированным полимером, включающим сополимер PLA (полимолочная кислота) и ПЭГ (полиэтиленгликоль) или PLGA (сополимер молочной кислоты и гликолевой кислоты) и ПЭГ (полиэтиленгликоль), и терапевтическим средством,
с получением наночастицы.
19. Способ по п.18, где первый полимер представляет собой сополимер PLGA и ПЭГ, где ПЭГ содержит карбоксильную группу на свободном конце.
20. Способ по п.18, где первый полимер сначала взаимодействует с липидом с образованием полимер/липидного конъюгата, который затем смешивают с низкомолекулярным PSMA лигандом.
21. Способ по п.20, где липид представляет собой 1,2 дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE) и его соли.
22. Мишень-специфическая наночастица, включающая полимерную матрицу, включающую комплекс фосфолипидсвязанного PEG (полиэтиленгликоль) и PLA (полимолочная кислота) или фосфолипидсвязанного PEG (полиэтиленгликоль) и PLGA (сополимер молочной кислоты и гликолевой кислоты), где часть полимерной матрицы ковалентно связана с низкомолекулярным PSMA лигандом через свободный конец ПЭГ; и терапевтическое средство;
где указанный низкомолекулярный PSMA лиганд представляет собой

его энантиомеры, стереоизомеры, ротамеры, таутомеры, диастереомеры или рацематы;
и где NH2-группа служит в качестве точки ковалентного присоединения к ПЭГ.
23. Наночастица по п.22, где терапевтическое средство представляет собой митоксантрон или доцетаксел.
24. Фармацевтическая композиция, включающая множество мишень-специфических наночастиц, включающих siRNA терапевтическое средство; где указанные наночастицы содержат полимерную матрицу, содержащую сополимер PLA (полимолочная кислота) и ПЭГ (полиэтиленгликоль), где часть полимерной матрицы ковалентно связана с низкомолекулярным PSMA лигандом через свободный конец ПЭГ, где указанный низкомолекулярный PSMA лиганд представляет собой
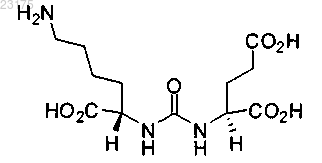
его энантиомеры, стереоизомеры, ротамеры, таутомеры, диастереомеры или рацематы или;
и где NH2-группа служит в качестве точки ковалентного присоединения к ПЭГ.
25. Фармацевтическая композиция по п.24, где siPHK обусловливает "молчание" VEGF.
26. Фармацевтическая композиция по п.24, где композиция подходит для системного введения путем внутривенной инфузии или инъекции.
27. Фармацевтическая композиция, включающая наночастицы в соответствии с любым из пп.1-17 и фармацевтически приемлемый носитель.
28. Фармацевтическая композиция по п.24 для лечения рака предстательной железы у субъекта, нуждающегося в этом.
29. Фармацевтическая композиция по п.24 для лечения солидных опухолей, экспрессирующих PSMA в опухолевой неоваскулатуре, у субъекта, нуждающегося в этом.
30. Применение фармацевтической композиции по п.27 для получения лекарственного средства для лечения рака.
31. Применение по п.30, где рак представляет собой рак предстательной железы.
32. Применение по п.30, где фармацевтическую композицию вводят внутривенно.
33. Способ лечения рака предстательной железы у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества фармацевтической композиции по любому из пп.24-29.
34. Способ по п.33, где фармацевтическую композицию вводят непосредственно в предстательную железу субъекта.
35. Способ по п.33, где фармацевтическую композицию вводят непосредственно в раковые клетки предстательной железы.
36. Способ по п.33, где фармацевтическую композицию вводят непосредственно в раковые клетки предстательной железы путем инъекции в ткань, включающую раковые клетки предстательной железы.
37. Способ по п.33, где фармацевтическую композицию вводят субъекту путем имплантации на участке или около раковых клеток предстательной железы в процессе хирургического удаления опухоли.
38. Способ по п.33, где фармацевтическую композицию вводят системно путем внутривенной инфузии или инъекции.
39. Способ по п.33, где фармацевтическую композицию вводят внутривенно.
Текст
ТАРГЕТИРОВАНИЕ РАКОВЫХ КЛЕТОК С ИСПОЛЬЗОВАНИЕМ НАНОЧАСТИЦ Изобретение в основном относится к полимерам и макромолекулам, в частности к полимерам,используемым в частицах, таких как наночастицы. Один аспект изобретения направлен на способ разработки наночастиц с желаемыми свойствами. В одной группе вариантов воплощения изобретения способ включает получение библиотек наночастиц, имеющих высококонтролируемые свойства, которые могут быть образованы путем смешивания вместе двух или более макромолекул в различных соотношениях. Одна или несколько из таких макромолекул могут представлять собой полимерный конъюгат составляющего фрагмента с биосовместимым полимером. В некоторых случаях наночастица может содержать лекарственное средство. Другие аспекты настоящего изобретения направлены на способы с использованием библиотек наночастиц. Родственные заявки Настоящая заявка заявляет приоритет относительно временной заявки США 60/976197, AttorneyDocket 3BBZ-014-1, поданной 28 сентября 2007 г., озаглавленной "Таргетирование раковых клеток с использованием наночастиц"; и международной заявки PCT/US2007/007927, Attorney DocketBBZ005PC, поданной 30 марта 2007 г., озаглавленной "Системы для направленной доставки терапевтических средств", которые все включены в настоящую заявку посредством ссылки во всей их полноте. Кроме того, содержание любых патентов, патентных заявок и ссылки, указанные в тексте настоящего описания,включены в настоящую заявку посредством ссылки во всей их полноте. Область изобретения Настоящее изобретение в общем смысле относится к фармацевтическим композициям, включающим мишень-специфические наночастицы, полезные для лечения рака. Предпосылки изобретения Доставка пациенту лекарственного средства с контролируемым высвобождением активного ингредиента в течение десятилетий является областью активных исследований, и стимулом для этого явились многие последние разработки в области полимеров. Кроме того, полимерные системы контролируемого высвобождения могут быть разработаны специально для обеспечения уровня лекарственного средства в оптимальных пределах в течение более длительного периода времени по сравнению с другими способами доставки лекарственных средств, повышая таким образом эффективность лекарственного средства и сводя к минимуму проблемы податливости пациента лечению. Биоразлагаемые частицы были разработаны в качестве носителей для длительного непрерывного высвобождения, которые используют при введении малых молекул лекарственных средств, белковых и пептидных лекарственных средств и нуклеиновых кислот. Лекарственные средства типично являются инкапсулированными в полимерной матрице, которая является биоразлагаемой и биосовместимой. По мере разложения полимера и/или диффундирования лекарственного средства из полимера, лекарственное средство высвобождается в организм. Полимерные системы направленной доставки с контролируемым высвобождением (например, прицельно направленные на конкретную ткань или тип клеток или прицельно направленные на конкретную пораженную заболеванием ткань, но не на нормальную ткань) являются желательными, поскольку это снижает количество лекарственного средства, присутствующего в тканях организма, которые не являются мишенями. Это является особенно важным при лечении состояния, такого как рак, где желательно,чтобы цитотоксическую дозу лекарственного средства можно было доставить к раковым клеткам, не убивая при этом окружающую нераковую ткань. Эффективная направленная доставка лекарственного средства должна снижать нежелательные, а иногда и угрожающие жизни побочные эффекты, типичные для противораковой терапии. Кроме того, направленная доставка может обеспечить возможность достижения лекарственными средствами определенных тканей, которые иначе были бы недостижимыми без наночастиц направленной доставки. Соответственно существует необходимость в разработке систем доставки, которые могут доставлять терапевтические уровни лекарственного средства для лечения заболеваний, таких как рак, при этом также снижая побочные эффекты у пациента. Краткое описание изобретения Остается необходимость в композициях, полезных для лечения или профилактики или уменьшения интенсивности одного или нескольких симптомов рака, в частности рака, который экспрессирует простата-специфический мембранный антиген (PSMA), включая, но не ограничиваясь этим, рак предстательной железы, немелкоклеточный рак легкого, колоректальную карциному и глиобластому и солидные опухоли, экспрессирующие PSMA в опухолевой неоваскулатуре. В одном аспекте изобретение обеспечивает фармацевтическую композицию, включающую множество мишень-специфических наночастиц, которые включают терапевтическое средство; где указанные наночастицы содержат таргетирующие составляющие, присоединенные к ним, где таргетирующая составляющая представляет собой низкомолекулярныйPSMA лиганд. В одном варианте воплощения фармацевтической композиции по настоящему изобретению наночастица содержит количество таргетирующей составляющей, эффективное для лечения рака предстательной железы у субъекта, нуждающегося в этом. В другом варианте воплощения наночастица содержит количество таргетирующей составляющей, эффективное для лечения солидных опухолей, экспрессирующих PSMA в опухолевой неоваскулатуре у субъекта, нуждающегося в этом. В следующем варианте воплощения низкомолекулярный PSMA лиганд имеет Ki в пределах от 0,5 до 10 нМ. В одном варианте воплощения фармацевтической композиции по настоящему изобретению наночастица содержит количество терапевтического средства, эффективное для лечения рака предстательной железы у субъекта, нуждающегося в этом. В другом варианте воплощения наночастица содержит количество терапевтического средства, эффективное для лечения солидных опухолей, экспрессирующихPSMA в опухолевой неоваскулатуре у субъекта, нуждающегося в этом. В другом варианте воплощения мишень-специфических наночастиц по настоящему изобретению низкомолекулярный PSMA лиганд имеет молекулярную массу меньше чем 1000 г/моль. В конкретных вариантах воплощения низкомолекулярный PSMA лиганд выбран из группы, включающей соединения I,-1 023175II, III и IV. В других вариантах воплощения низкомолекулярный PSMA лиганд представляет собой и его энантиомеры, стереоизомеры, ротамеры, таутомеры, диастереомеры или рацематы. В других вариантах воплощения мишень-специфических наночастиц по настоящему изобретению наночастица включает полимерную матрицу. В одном варианте воплощения полимерная матрица включает два или более полимеров. В другом варианте воплощения полимерная матрица включает полиэтилены, поликарбонаты, полиангидриды, полиоксикислоты, полипропилфумераты, поликапролактоны, полиамиды, полиацетали, простые полиэфиры, сложные полиэфиры, поли(ортоэфиры), полицианоакрилаты, поливиниловые спирты,полиуретаны, полифосфазены, полиакрилаты, полиметакрилаты, полицианоакрилаты, соединения полимочевины, полистиролы или полиамины или их сочетания. Еще в одном варианте воплощения полимерная матрица включает один или несколько сложных полиэфиров, полиангидридов, простых полиэфиров,полиуретанов, полиметакрилатов, полиакрилатов или полицианоакрилатов. В другом варианте воплощения по меньшей мере один полимер представляет собой полиалкиленгликоль. Еще в одном варианте воплощения полиалкиленгликоль представляет собой полиэтиленгликоль. В следующем варианте воплощения по меньшей мере один полимер представляет собой сложный полиэфир. В другом варианте воплощения сложный полиэфир выбран из группы, включающей PLGA, PLA,PGA и поликапролактоны. Еще в одном варианте воплощения сложный полиэфир представляет собойPLGA или PLA. В следующем варианте воплощения полимерная матрица включает сополимер, состоящий из двух или более полимеров. В другом варианте воплощения сополимер представляет собой сополимер полиалкиленгликоля и сложного полиэфира. Еще в одном варианте воплощения сополимер представляет собой сополимерPLGA или PLA и ПЭГ. В следующем варианте воплощения полимерная матрица включает PLGA илиPLA и сополимер PLGA или PLA и ПЭГ. В другом варианте воплощения полимерная матрица включает содержащий липидную концевую группу полиалкиленгликоль и сложный полиэфир. В другом варианте воплощения фармацевтической композиции по настоящему изобретению полимерная матрица включает содержащий липидную концевую группу ПЭГ и PLGA. В одном варианте воплощения липид имеет формулу V. В конкретном варианте воплощения липид представляет собой 1,2 дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE) и его соли, например натриевую соль. В другом варианте воплощения фармацевтической композиции по настоящему изобретению часть полимерной матрицы ковалентно связана с низкомолекулярным PSMA лигандом. В другом варианте воплощения полимерная матрица ковалентно связана с низкомолекулярным PSMA лигандом через свободный конец ПЭГ. Еще в одном варианте воплощения полимерная матрица ковалентно связана с низкомолекулярным PSMA лигандом через карбоксильную группу на свободном конце ПЭГ. В следующем варианте воплощения полимерная матрица ковалентно связана с низкомолекулярным PSMA лигандом через малеимидную функциональную группу на свободном конце ПЭГ. В другом варианте воплощения фармацевтической композиции по настоящему изобретению наночастица имеет отношение лигандсвязанного полимера к нефункционализированному полимеру, эффективное для лечения рака предстательной железы. В другом варианте воплощения полимеры полимерной матрицы имеют молекулярную массу, эффективную для лечения рака предстательной железы. Еще в одном варианте воплощения наночастица имеет поверхностный заряд, эффективный для лечения рака предстательной железы. В другом варианте воплощения фармацевтической композиции по настоящему изобретению указанная система является подходящей для мишень-специфического лечения заболевания или расстройства и доставки терапевтического средства. В другом варианте воплощения наночастица дополнительно включает терапевтическое средство. В одном варианте воплощения терапевтическое средство является связанным с поверхностью наночастицы, является инкапсулированным внутри нее, окружено ею или диспергировано в ней. Еще в одном варианте воплощения терапевтическое средство является инкапсулированным в гидрофобном ядре наночастицы. В конкретных вариантах воплощения терапевтическое средство выбрано из группы, включающей митоксантрон и доцетаксел. В другом аспекте изобретение обеспечивает способ лечения рака предстательной железы у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества фармацевтической композиции по настоящему изобретению. В одном варианте воплощения фармацевтическую композицию вводят непосредственно в предстательную железу субъекта. Еще в одном варианте воплощения фармацевтическую композицию вводят непосредственно в раковые клетки предстательной железы. В другом варианте воплощения фармацевтическую композицию вводят непосредственно в раковые клетки предстательной железы путем инъекции в ткань, включающую раковые клетки предстательной железы. В следующем варианте воплощения фармацевтическую композицию вводят субъекту путем имплантации наночастиц на участке или около раковых клеток предстательной железы в процессе хирургического удаления опухоли. В другом варианте воплощения фармацевтическую композицию вводят системно или путем внутривенного введения. В другом аспекте изобретение обеспечивает способ получения наночастицы, где наночастица имеет отношение лигандсвязанного полимера к нефункционализированному полимеру, эффективное для лечения рака предстательной железы, включающий обеспечение терапевтического средства; обеспечение полимера; обеспечение низкомолекулярного PSMA лиганда; смешивание полимера с терапевтическим средством с получением частиц; и связывание этих частиц с низкомолекулярным PSMA лигандом. В одном варианте воплощения способа полимер включает сополимер, состоящий из двух или более полимеров. В другом варианте воплощения сополимер представляет собой сополимер PLGA и ПЭГ или PLA и ПЭГ. В другом аспекте изобретение обеспечивает способ получения наночастицы, где наночастица имеет отношение лигандсвязанного полимера к нефункционализированному полимеру, эффективное для лечения рака предстательной железы, включающий обеспечение терапевтического средства; обеспечение первого полимера; обеспечение низкомолекулярного PSMA лиганда; взаимодействие первого полимера с низкомолекулярным PSMA лигандом с получением лигандсвязанного полимера; и смешивание лигандсвязанного полимера со вторым нефункционализированным полимером и терапевтическим средством; таким образом получают наночастицу. В одном варианте воплощения этого способа первый полимер включает сополимер, состоящий из двух или более полимеров. В другом варианте воплощения второй нефункционализированный полимер включает сополимер, состоящий из двух или более полимеров. В одном варианте воплощения способов, описанных выше, сополимер представляет собой сополимер PLGA и ПЭГ или PLA и ПЭГ. В другом варианте воплощения первый полимер представляет собой сополимер PLGA и ПЭГ, где ПЭГ содержит карбоксильную группу на свободном конце. В другом варианте воплощения первый полимер сначала взаимодействует с липидом с образованием полимер/липидного конъюгата, который затем смешивают с низкомолекулярным PSMA лигандом. Еще в одном варианте воплощения липид представляет собой 1,2 дистеароил-sn-глицеро-3-фосфоэтаноламин(DSPE) и его соли, например натриевую соль. В другом варианте воплощения фармацевтической композиции по настоящему изобретению наночастица содержит количество таргетирующей составляющей, эффективное для лечения рака у субъекта,нуждающегося в этом, где PSMA экспрессируется на поверхности раковых клеток или в опухолевой неоваскулатуре. В одном варианте воплощения PSMA-связанное показание выбрано из группы, включающей рак предстательной железы, немелкоклеточный рак легкого, колоректальную карциному и глиобластому. В другом аспекте изобретение обеспечивает наночастицу, включающую сополимер PLGA и ПЭГ; и терапевтическое средство, включающее митоксантрон или доцетаксел; где указанная наночастица содержит таргетирующие составляющие, присоединенные к ней, где таргетирующая составляющая представляет собой низкомолекулярный PSMA лиганд. В другом аспекте изобретение обеспечивает наночастицу, включающую полимерную матрицу,включающую комплекс, состоящий из фосфолипидсвязанного ПЭГ и PLGA; и терапевтическое средство; где указанная наночастица содержит таргетирующие составляющие, присоединенные к ней, где таргетирующая составляющая представляет собой низкомолекулярный PSMA лиганд. В одном варианте воплощения этой наночастицы терапевтическое средство представляет собой митоксантрон или доцетаксел. В конкретных вариантах воплощения наночастиц, описанных выше, низкомолекулярный PSMA лиганд представляет собой и его энантиомеры, стереоизомеры, ротамеры, таутомеры, диастереомеры или рацематы. В другом аспекте изобретение обеспечивает частицу направленной доставки, включающую таргетирующую составляющую и терапевтическое средство; где частица включает полимерную матрицу, где полимерная матрица включает сложный полиэфир, и где таргетирующая составляющая представляет собой низкомолекулярный PSMA лиганд. В одном варианте воплощения этой частицы направленной доставки частица представляет собой наночастицу. В другом варианте воплощения сложный полиэфир выбран из группы, включающей PLGA, PLA, PGA, поликапролактон и полиангидриды. В одном варианте воплощения полимерной матрицы этой частицы направленной доставки по меньшей мере один полимер представляет собой полиалкиленгликоль. В некоторых вариантах воплощения частицы направленной доставки низкомолекулярный PSMA лиганд выбран из группы, включающей фолиевую кислоту,тиольные и индолтиольные производные, гидроксаматные производные и ингибиторы на основе мочевины. В другом аспекте изобретение обеспечивает композицию, включающую частицу, имеющую сред-3 023175 ний характеристический размер меньше чем около 1 мкм, где указанная частица включает макромолекулу, включающую первую часть, включающую биосовместимый полимер, и вторую часть, включающую составляющую часть, выбранную из группы, состоящей из таргетирующей составляющей и терапевтической составляющей, где таргетирующая составляющая представляет собой низкомолекулярный PSMA лиганд, и где таргетирующая составляющая имеет, по существу, ненулевую концентрацию внутри частицы, т.е. присутствует от небольшого до не поддающегося определению количества соединения внутри частицы. В одном варианте воплощения этой частицы биосовместимый полимер включает сополимер полилактида и полигликолида. В другом варианте воплощения этой частицы полимер включает полиэтиленгликоль. В одном варианте воплощения изобретение включает наночастицу, включающую низкомолекулярный PSMA лиганд, биоразлагаемый полимер, полимер и терапевтическое средство. В одном варианте воплощения изобретение включает наночастицу, включающую низкомолекулярный PSMA лиганд, биоразлагаемый полимер, полимер и терапевтическое средство, где наночастица может селективно аккумулироваться в предстательной железе или в ткани сосудистого эндотелия, окружающей рак. В одном варианте воплощения изобретение включает наночастицу, включающую низкомолекулярный PSMA лиганд, биоразлагаемый полимер, полимер и терапевтическое средство, где наночастица может селективно аккумулироваться в предстательной железе или в ткани сосудистого эндотелия, окружающей рак, и где наночастица может поглощаться в результате эндоцитоза PSMA экспрессирующей клеткой. В другом варианте воплощения изобретение включает наночастицу, включающую низкомолекулярный PSMA лиганд, биоразлагаемый полимер, полиэтиленгликоль и химиотерапевтическое средство. В другом варианте воплощения изобретение включает наночастицу, включающую низкомолекулярный PSMA лиганд,биоразлагаемый полимер, полиэтиленгликоль и доцетаксел. В другом варианте воплощения изобретение включает наночастицу, включающую низкомолекулярный PSMA лиганд, PLGA, полиэтиленгликоль и доцетаксел. В одном аспекте изобретение обеспечивает мишень-специфическую наночастицу, включающую терапевтическое средство; где наночастица содержит таргетирующие составляющие, присоединенные к ней, где таргетирующая составляющая представляет собой низкомолекулярный PSMA лиганд, и где терапевтическое средство представляет собой siPHK. В другом аспекте молекула siPHK является комплементарной опухолевым мишеням, например опухоли предстательной железы. Краткое описание чертежей Фиг. 1 А, 1 В и фиг. 2 представляют репрезентативные схемы синтеза мишень-специфических наночастиц по настоящему изобретению. Фиг. 3 представляет репрезентативную схему синтеза наночастицы по настоящему изобретению. Фиг. 4 представляет поглощение клеткой наночастиц по настоящему изобретению. Подробное описание изобретения Настоящее изобретение в общем смысле относится к частицам и, в частности к наночастицам, где наночастицы включают систему контролируемого высвобождения для направленной доставки терапевтического средства. Один аспект настоящего изобретения направлен на способ разработки полимерных наночастиц с желаемыми свойствами, где наночастицы содержат таргетирующую составляющую, которая представляет собой низкомолекулярный PSMA лиганд. В одной группе вариантов воплощения способ включает получение библиотек наночастиц, содержащих низкомолекулярные PSMA лиганды, где библиотеки имеют высококонтролируемые свойства, и где библиотеки могут быть образованы путем смешивания вместе двух или более полимеров (например, лиганд-функционализированных полимеров и нефункционализированных полимеров) в различных соотношениях. Один или несколько из полимеров может представлять собой биосовместимый полимер (например, гомополимер, сополимер или блоксополимер), где биосовместимый полимер может быть конъюгирован с низкомолекулярным PSMA лигандом. В некоторых случаях наночастица может содержать терапевтическое средство, например лекарственное средство. В одном варианте воплощения наночастица системы контролируемого высвобождения имеет количество таргетирующей составляющей (т.е. низкомолекулярного PSMA лиганда), эффективное для лечения рака предстательной железы у субъекта, нуждающегося в этом. В некоторых вариантах воплощения низкомолекулярный PSMA лиганд является конъюгированным с полимером, и наночастица включает определенное отношение лиганд-конъюгированного полимера к нефункционализированному полимеру. Наночастица может иметь оптимизированное отношение этих двух полимеров, так чтобы эффективное количество лиганда связывалось с наночастицей для лечения рака. Например, повышенная плотность лиганда (например, на PLGA-PEG сополимере) будет усиливать связывание с мишенью (связывание с клеткой/поглощение мишенью), что делает наночастицу "мишень-специфической". Альтернативно, определенная концентрация нефункционализированного полимера (например, нефункционализированногоPLGA-PEG сополимера) в наночастице может контролировать воспаление и/или иммуногенность (т.е. способность вызывать иммунный ответ) и позволяет наночастице иметь период полужизни в системе кровообращения, который является адекватным для лечения рака (например, рака предстательной железы). Кроме того, нефункционализированный полимер может снижать скорость выведения из системы кровообращения через ретикулоэндотелиальную систему (RES). В конкретном варианте воплощения полимер представляет собой ПЭГ. Кроме того, нефункционализированный полимер уравновешивает высокую, в противном случае, концентрацию лигандов, которая в отсутствие такого балансирующего действия может ускорять скорость выведения из организма субъекта, приводя к снижению доставки к клеткам-мишеням. Поскольку они содержат таргетирующие составляющие, "мишень-специфические" наночастицы способны эффективно связываться или иным образом ассоциироваться с биологической структурой, например мембранным компонентом или клеточно-поверхностным рецептором. Направленная доставка терапевтического средства (например, к конкретной ткани или типу клеток, к специфической пораженной заболеванием ткани, но не к нормальной ткани и т.д.) является желательной для лечения тканеспецифических заболеваний, таких как рак (например, рак предстательной железы). Например, в отличие от системной доставки цитотоксического противоракового средства направленная доставка может предотвратить уничтожение здоровых клеток этим средством. Кроме того, направленная доставка делает возможным введение более низкой дозы такого средства, за счет чего можно уменьшить нежелательные побочные эффекты, обычно связанные с традиционной химиотерапией. Как обсуждалось выше, специфичность в отношении определенной мишени наночастиц по настоящему изобретению можно сделать максимальной путем оптимизации плотности лиганда на наночастице. Мишень-специфические наночастицы, включающие полимеры. В некоторых вариантах воплощения наночастицы по настоящему изобретению включают матрицу из полимеров. Как правило, "наночастица" относится к любой частице, имеющей диаметр меньше чем 1000 нм. В некоторых вариантах воплощения терапевтическое средство и/или таргетирующая составляющая (т.е. низкомолекулярный PSMA лиганд) могут быть связаны с полимерной матрицей. В некоторых вариантах воплощения таргетирующая составляющая может быть ковалентно связана с поверхностью полимерной матрицы. В некоторых вариантах воплощения ковалентное связывание опосредовано линкером. В некоторых вариантах воплощения терапевтическое средство может быть связано с поверхностью полимерной матрицы, инкапсулировано в полимерной матрице, окружено ею и/или диспергировано в ней. Большое количество разнообразных полимеров и способов образования частиц из этих полимеров являются известными в области, относящейся к доставке лекарственных средств. В некоторых вариантах воплощения настоящего изобретения матрица частицы включает один или несколько полимеров. Любой полимер можно использовать в соответствии с настоящим изобретением. Полимеры могут быть природного или неприродного происхождения (синтетическими) полимерами. Полимеры могут представлять собой гомополимеры или сополимеры, включающие два или более мономеров. Что касается последовательности, сополимеры могут быть статистическими, блок-сополимерами или могут включать комбинацию статистических и блок последовательностей. Типично, полимеры в соответствии с настоящим изобретением представляют собой органические полимеры."Полимер", как этот термин используется в настоящей заявке, имеет свое обычное значение, используемое в данной области техники, т.е. означает молекулярную структуру, включающую одно или несколько повторяющихся звеньев (мономеры), соединенных ковалентными связями. Повторяющиеся звенья могут все быть одинаковыми или, в некоторых случаях, в полимере может присутствовать более чем один тип повторяющихся звеньев. В некоторых случаях полимер имеет биологическое происхождение, т.е. биополимер. Неограничивающие примеры полимеров включают пептиды или белки (т.е. полимеры, состоящие из различных аминокислот) или нуклеиновые кислоты, такие как ДНК или РНК, как обсуждается ниже. В некоторых случаях в полимере также могут присутствовать дополнительные группы, например биологические группы, такие как группы, описанные ниже. Если в полимере присутствует более чем один тип повторяющегося звена, в этом случае полимер указан как "сополимер". Должно быть понятно, что в любом варианте воплощения с использованием полимера, в некоторых случаях, используемый полимер может быть сополимером. Повторяющиеся звенья, образующие сополимер, могут быть расположены в любом порядке. Например, повторяющиеся звенья могут быть расположены неупорядоченно, в чередующемся порядке или в виде "блок" сополимера,т.е. включающего один или несколько участков, каждый из которых включает первое повторяющееся звено (например, первый блок), и один или несколько участков, каждый из которых включает второе повторяющееся звено (например, второй блок), и т.д. Блок-сополимеры могут содержать два (диблоксополимер), три (триблок-сополимер) или большее количество отдельных блоков. Должно быть понятно, что, хотя термины "первый," "второй" и т.д. можно использовать в настоящей заявке для описания различных элементов, включая полимерные компоненты, эти термины не следует понимать как ограничивающие (например, описывающие конкретный порядок или количество элементов), но они скорее являются чисто иллюстративными, т.е. метками, которые используются для отличия одного элемента от другого, как это обычно используется в области патентного законодательства. Таким образом, например, хотя один вариант воплощения настоящего изобретения может быть описан как включающий присутствие "первого" элемента и присутствие "второго" элемента, другие варианты воплощения настоящего изобретения могут включать присутствие "первого" элемента, но без присутст-5 023175 вия "второго" элемента, присутствие "второго" элемента, но без присутствия "первого" элемента, присутствие двух (или более) "первых" элементов и/или присутствие двух (или более) "вторых" элементов и т.д., и/или дополнительные элементы, такие как "первый" элемент, "второй" элемент и "третий" элемент,без отступления от объема настоящего изобретения. Различные варианты воплощения настоящего изобретения направлены на сополимеры, которые в конкретных вариантах воплощения описывают два или более полимеров (таких как описанные в настоящей заявке), которые связаны друг с другом, обычно при помощи ковалентного связывания двух или более полимеров вместе. Таким образом, сополимер может включать первый полимер и второй полимер,которые были конъюгированы вместе с образованием блок-сополимера, где первый полимер представляет собой первый блок блок-сополимера, а второй полимер представляет собой второй блок блоксополимера. Конечно, специалистам в данной области должно быть понятно, что блок-сополимер в некоторых случаях может содержать несколько блоков полимера, и что "блок-сополимер", как этот термин используется в настоящей заявке, не ограничивается только блок-сополимерами, содержащими только один первый блок и один второй блок. Например, блок-сополимер может включать первый блок, включающий первый полимер, второй блок, включающий второй полимер, и третий блок, включающий третий полимер или первый полимер, и т.д. В некоторых случаях блок-сополимеры могут содержать любое количество первых блоков первого полимера и вторых блоков второго полимера (и в некоторых случаях третьих блоков, четвертых блоков и т.д.). Кроме того, следует указать, что блок-сополимеры, в некоторых случаях, также могут быть образованы из других блок-сополимеров. Например, первый блок-сополимер может быть конъюгирован с другим полимером (который может представлять собой гомополимер, биополимер, другой блок-сополимер и т.д.) с образованием нового блок-сополимера, содержащего несколько типов блоков и/или с другими структурами (например, с неполимерными структурами). В некоторых вариантах воплощения полимер (например, сополимер, например, блок-сополимер) является амфифильным, т.е. содержащим гидрофильную часть и гидрофобную часть, или относительно гидрофильную часть и относительно гидрофобную часть. Гидрофильный полимер представляет собой такой полимер, который, как правило, притягивает воду, а гидрофобный полимер представляет собой такой полимер, который, как правило, отталкивает воду. Гидрофильный или гидрофобный полимер может быть идентифицирован, например, путем получения образца полимера и измерения угла его контакта с водой (типично, полимер имеет угол контакта меньше чем 60, тогда как гидрофобный полимер имеет угол контакта больше чем около 60). В некоторых случаях можно измерить гидрофильность двух или более полимеров относительно друг друга, т.е. первый полимер может быть более гидрофильным,чем второй полимер. Например, первый полимер может иметь меньший угол контакта по сравнению со вторым полимером. В одной группе вариантов воплощения полимер (например, сополимер, например, блок-сополимер) по настоящему изобретению включает биосовместимый полимер, т.е. полимер, который обычно не индуцирует неблагоприятный ответ при его включении или введении в организм живого субъекта, например, без существенного воспаления и/или резкого отторжения полимера иммунной системой, например,через Т-клеточный ответ. Конечно, должно быть понятно, что "биосовместимость" является относительным термином, и иммунный ответ в некоторой степени можно ожидать даже для полимеров, которые являются высокосовместимыми с живой тканью. Однако, как это используется в настоящей заявке, "биосовместимость" относится к резкому отторжению материала по меньшей мере частью иммунной системы, т.е. небиосовместимый материал, имплантированный в организм субъекта, вызывает иммунный ответ у субъекта, который является достаточно сильным, в такой степени, что отторжение материала иммунной системой невозможно адекватно контролировать, и часто в такой степени, что материал необходимо удалить из организма субъекта. В одном простом испытании биосовместимости полимер подвергают контакту с клетками in vitro; биосовместимые полимеры представляют собой полимеры, которые типично не приводят к существенной клеточной гибели при умеренных концентрациях, например при концентрациях 50 мкг/106 клеток. Например, биосовместимый полимер может вызывать менее чем около 20% клеточную гибель при его контактировании с клетками, такими как фибробласты или эпителиальные клетки, даже если он подвергался фагоцитозу или каким-либо иным образом был поглощен такими клетками. Неограничивающие примеры биосовместимых полимеров, которые могут быть полезными в различных вариантах воплощения настоящего изобретения, включают полидиоксанон (PDO), полигидроксиалканоат, полигидроксибутират, полиглицеринсебасат, полигликолид, полилактид, PLGA, поликапролактон, или сополимеры, или производные, включающие эти и/или другие полимеры. В некоторых вариантах воплощения биосовместимый полимер является биоразлагаемым, т.е. полимер способен разлагаться, химически и/или биологически, в физиологическом окружении, например в организме. Например, полимер может быть таким, который спонтанно гидролизуется при воздействии на него воды (например, в организме субъекта), полимер может разлагаться под воздействием тепла например, при температуре около 37 С). Разложение полимера может происходить с различной скоростью в зависимости от используемого полимера или сополимера. Например, период полужизни полимера(время, в течение которого 50% полимера разлагается на мономеры и/или другие неполимерные части-6 023175 цы) может быть порядка нескольких дней, недель, месяцев или лет в зависимости от полимера. Полимеры могут биологически разлагаться, например, в результате ферментативной активности или клеточного механизма, в некоторых случаях, например, через воздействие лизозима (например, имеющего относительно низкое значение рН). В некоторых случаях полимеры могут разлагаться на мономеры и/или другие неполимерные частицы, которые клетки могут либо повторно использовать, либо ликвидировать без существенного токсического эффекта на эти клетки (например, полилактид может гидролизоваться с образованием молочной кислоты, полигликолид может гидролизоваться с образованием гликолевой кислоты и т.д.). В некоторых вариантах воплощения полимеры могут представлять собой сложные полиэфиры,включая сополимеры, включающие звенья молочной кислоты и гликолевой кислоты, такие как сополимер молочной кислоты и гликолевой кислоты и сополимер лактида и гликолида, в общем виде указанные в настоящей заявке как "PLGA"; и гомополимеры, включающие звенья гликолевой кислоты, указанные в настоящей заявке как "PGA", и звенья молочной кислоты, такие как поли-b-молочная кислота, поли-Dмолочная кислота, поли-D,L-молочная кислота, поли-L-лактид, поли-D-лактид и поли-D,L-лактид, в общем виде указанные в настоящей заявке как "PLA". В некоторых вариантах воплощения примеры сложных полиэфиров включают, например, полиоксикислоты; ПЭГилированные полимеры и сополимеры лактида и гликолида (например, ПЭГилированные PLA, ПЭГилированные PGA, ПЭГилированные PLGA и их производные). В некоторых вариантах воплощения сложные полиэфиры включают, например, полиангидриды, полиортоэфир, ПЭГилированный полиортоэфир, поликапролактон, ПЭГилированный поликапролактон, полилизин, ПЭГилированный полилизин, полиэтиленимин, ПЭГилированный полиэтиленимин, сополимер поли-L-лактида и поли-b-лизина, поли(сериновый эфир), поли(4-гидрокси-bпролиновый эфир), поли[а-(4-аминобутил)-L-гликолевая кислота] и их производные. В некоторых вариантах воплощения полимер может представлять собой PLGA. PLGA представляет собой биосовместимый и биоразлагаемый сополимер молочной кислоты и гликолевой кислоты, и различные формы PLGA характеризуются соотношением молочной кислоты:гликолевой кислоты. Молочная кислота может представлять собой L-молочную кислоту, D-молочную кислоту или D,L-молочную кислоту. Скорость разложения PLGA можно регулировать, меняя соотношение молочной кислоты и гликолевой кислоты. В некоторых вариантах воплощения PLGA для использования в соответствии с настоящим изобретением характеризуется отношением молочной кислоты к гликолевой кислоте приблизительно 85:15, приблизительно 75:25, приблизительно 60:40, приблизительно 50:50, приблизительно 40:60, приблизительно 25:75 или приблизительно 15:85. В конкретных вариантах воплощения путем оптимизации отношения мономеров молочной кислоты к мономерам гликолевой кислоты в полимере наночастицы (например, PLGA блок-сополимере илиPLGA-PEG блок-сополимере), могут быть оптимизированы параметры наночастицы, такие как поглощение воды, высвобождение терапевтического средства (например, "контролируемое высвобождение") и кинетика разложения полимера. В некоторых вариантах воплощения полимеры могут представлять собой один или несколько акриловых полимеров. В некоторых вариантах воплощения акриловые полимеры включают, например, сополимеры акриловой кислоты и метакриловой кислоты, метилметакрилатные сополимеры, этоксиэтилметакрилаты, цианоэтилметакрилат, аминоалкилметакрилатный сополимер, поли(акриловая кислота), поли(метакриловая кислота), сополимеры метакриловой кислоты и алкиламида, полиметилметакрилат, поли(метакриловая кислота), полиакриламид, аминоалкилметакрилатный сополимер, глицидилметакрилатные сополимеры, полицианоакрилаты и сочетания, включающие один или несколько из перечисленных выше полимеров. Акриловый полимер может включать полностью полимеризованные сополимеры сложных эфиров акриловой и метакриловой кислоты с низким содержанием групп четвертичного аммония. В некоторых вариантах воплощения полимеры могут представлять собой катионные полимеры. Как правило, катионные полимеры способны к конденсации и/или защите отрицательно заряженных цепей нуклеиновых кислот (например, ДНК, РНК или их производных). Аминсодержащие полимеры, такие как полилизин (Zauner et al., 1998, Adv. Drug Del. Rev., 30:97; и Kabanov et al., 1995, Bioconjugate Chem., 6:7),полиэтиленимин (PEI; Boussif et al., 1995, Proc. Natl. Acad. Sci, USA, 1995, 92:7297) и полиамидоаминовые дендримеры (Kukowska-Latallo et al., 1996, Proc. Natl. Acad. Sci, USA, 93:4897; Tang et al., 1996, Bioconjugate Chem., 7:703; и Haensler et al., 1993, Bioconjugate Chem., 4:372) являются положительно заряженными при физиологическом рН, образуют ионные пары с нуклеиновыми кислотами и опосредуют трансфекцию в различных клеточных линиях. В некоторых вариантах воплощения полимеры могут представлять собой разлагаемые сложные полиэфиры, содержащие катионные боковые цепи (Putnam et al., 1999, Macromolecules, 32:3658; Barrera etal., 1993, J. Am. Chem. Soc, 115:11010; Urn et al., 1999, J. Am. Chem. Soc, 121:5633 и Zhou et al., 1990, Macromolecules, 23:3399). Примеры таких сложных полиэфиров включают сополимер поли-L-лактида и поли-L-лизина (Barrera et al., 1993, J. Am. Chem. Soc, 115:11010), поли(сериновый эфир) (Zhou et al., 1990,Macromelecules, 23:3399), поли(4-гидрокси-L-пролиновый эфир) (Putnam et al., 1999, Macromolecules,32:3658 и Lim et al., 1999, J. Am. Chem. Soc, 121:5633). Было продемонстрировано, что поли(4-гидрокси-7 023175L-пролиновый эфир) конденсируется с плазмидной ДНК через электростатические взаимодействия и опосредует перенос гена (Putnam et al, 1999, Macromelecules, 32:3658 и Lim el al., 1999, J. Am. Chem. Soc,121:5633). Эти новые полимеры менее токсичны по сравнению с полилизином и PEI, и они разлагаются на нетоксичные метаболиты. Полимер (например, сополимер, блок-сополимер), содержащий полиэтиленгликолевые повторяющиеся звенья, также указан как "ПЭГилированный" полимер. Такие полимеры могут контролировать воспаление и/или иммуногенность (т.е. способность вызывать иммунный ответ) и/или снижать скорость выведения из системы кровообращения через ретикулоэндотелиальную систему (RES) благодаря присутствию групп полиэтиленгликоля. ПЭГилирование также можно использовать, в некоторых случаях, для снижения взаимодействия зарядов между полимером и биологической частицей, например, путем создания гидрофильного слоя на поверхности полимера, который может защищать полимер от взаимодействия с биологической частицей. В некоторых случаях добавление полиэтиленгликолевых повторяющихся звеньев может увеличивать период полужизни полимера (например, сополимера, блок-сополимера) в плазме, например, путем уменьшения поглощения полимера системой фагоцитоза, снижая при этом эффективность трансфекции/поглощения клетками. Специалистам в данной области должны быть известны способы и технологические приемы ПЭГилирования полимера, например с использованием EDC (гидрохлорид 1-этил-3-(3 диметиламинопропил)карбодиимида) и NHS (N-гидроксисукцинимид) для взаимодействия полимера с группой ПЭГ, содержащей на конце амин, используя методы полимеризации с раскрытием цикла(ROMP) или подобные. Кроме того, некоторые варианты воплощения настоящего изобретения направлены на сополимеры,содержащие сложные полиэфиры и простые полиэфиры, например полимеры, содержащие повторяющиеся звенья, соединенные сложноэфирными связями (например, R-C(O)-O-R' связи) и простыми эфирными связями (например, R-O-R' связи). В некоторых вариантах воплощения настоящего изобретения биоразлагаемый полимер, такой как гидролизуемый полимер, содержащий карбоновокислотные группы,может быть конъюгирован с полиэтиленгликолевыми повторяющимися звеньями с образованием сополимера сложного полиэфира и простого полиэфира. В конкретном варианте воплощения молекулярная масса полимеров наночастиц по настоящему изобретению является оптимизированной для эффективного лечения рака, например рака предстательной железы. Например, молекулярная масса полимера влияет на скорость разложения наночастиц (в частности, когда молекулярная масса биоразлагаемого полимера отрегулирована), растворимость, поглощение воды и кинетику высвобождения лекарственного средства (например, "контролируемое высвобождение"). В качестве еще одного примера молекулярная масса полимера может быть отрегулирована таким образом, чтобы происходило биоразложение наночастицы в организме субъекта, принимающего лечение, в течение разумного периода времени (в пределах от нескольких часов до 1-2 недель, 3-4 недель, 5-6 недель, 7-8 недель и т.д.). В конкретных вариантах воплощения наночастицы, включающей сополимер ПЭГ и PLGA, ПЭГ имеет молекулярную массу 1000-20000, например 5000-20000, например 10000-20000, a PLGA имеет молекулярную массу 5000-100000, например 20000-70000, например 2000050000. В некоторых вариантах воплощения полимеры наночастиц могут быть конъюгированы с липидом. Полимер может представлять собой, например, ПЭГ, содержащий липид на конце цепи. Как описано ниже, липидную часть полимера можно использовать для самосборки с другим полимером, облегчая образование наночастицы. Например, гидрофильный полимер может быть конъюгирован с липидом, который будет осуществлять самосборку с гидрофобным полимером. В некоторых вариантах воплощения липиды представляют собой масла. Как правило, любое масло,известное из уровня техники, может быть конъюгировано с полимерами, используемыми в настоящем изобретении. В некоторых вариантах воплощения масло может включать одну или несколько групп жирной кислоты или солей жирных кислот. В некоторых вариантах воплощения группа жирной кислоты может включать перевариваемые, длинноцепочечные (например, C8-C50), замещенные или незамещенные углеводороды. В некоторых вариантах воплощения группа жирной кислоты может представлять собой С 10-С 20 жирную кислоту или ее соль. В некоторых вариантах воплощения группа жирной кислоты может представлять собой С 15-С 20 жирную кислоту или ее соль. В некоторых вариантах воплощения жирная кислота может быть ненасыщенной. В некоторых вариантах воплощения группа жирной кислоты может быть мононенасыщенной. В некоторых вариантах воплощения группа жирной кислоты может быть полиненасыщенной. В некоторых вариантах воплощения двойная связь группы ненасыщенной жирной кислоты может быть в цис-конформации. В некоторых вариантах воплощения двойная связь ненасыщенной жирной кислоты может быть в транс-конформации. В некоторых вариантах воплощения группа жирной кислоты может представлять собой одну или несколько групп, выбранных из масляной, капроновой, каприловой, каприновой, лауриновой, миристиновой, пальмитиновой, стеариновой, арахидоновой, бегеновой или лигноцериновой кислоты. В некоторых вариантах воплощения группа жирной кислоты может представлять собой одну или несколько групп, выбранных из пальмитолеиновой, олеиновой, вакценовой, линолевой, альфа-линоленовой, гамма-8 023175 линолевой, арахидоновой, гадолеиновой, арахидоновой, ейкозапентаеновой, докозагексаеновой или эруковой кислоты. В конкретном варианте воплощения липид представляет собой липид формулы V и его соли, где каждый R независимо представляет собой C1-30 алкил. В одном варианте воплощения формулы V липид представляет собой 1,2 дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE) и его соли,например натриевую соль. В одном варианте воплощения низкомолекулярные таргетирующие составляющие являются связанными, например, ковалентно связанными, с липидным компонентом наночастицы. Таким образом,изобретение также обеспечивает мишень-специфическую наночастицу, включающую терапевтическое средство, полимерную матрицу, липид и низкомолекулярный таргетирующий PSMAлиганд, где таргетирующий лиганд является связанным, например, ковалентно связанным, с липидным компонентом наночастицы. В одном варианте воплощения липидный компонент, который является связанным с низкомолекулярной таргетирующей составляющей, имеет формулу V. В другом варианте воплощения изобретение обеспечивает мишень-специфическую наночастицу, включающую терапевтическое средство, полимерную матрицу, DSPE и низкомолекулярный таргетирующий PSMA лиганд, где лиганд является связанным, например ковалентно связанным, с DSPE. Например, наночастица по настоящему изобретению включает полимерную матрицу, включающую PLGA-DSPE-ПЭГ-Лиганд. Эти наночастицы можно использовать для лечения заболеваний и расстройств, обсуждаемых в настоящей заявке. Свойства этих и других полимеров и способы их получения хорошо известны из уровня техникиChem. Res., 33:94; Langer, 1999, J. Control. Release, 62:7; и Uhrich et al., 1999, Chem. Rev., 99:3181). В более широком смысле, различные способы синтеза подходящих полимеров описаны в Concise Encyclopedia of Polymer Science and Polymeric Amines and Ammonium Salts, Ed. by Goethals, Pergamon Press, 1980;Chemistry by Allcock et al., Prentice-Hall, 1981; Deming et al., 1997, Nature, 390:386; и в патентах США 6506577, 6632922, 6686446 и 6818732. Еще в одной группе вариантов воплощения, частица (включающая, например, сополимер, например, блок-сополимер) по настоящему изобретению включает терапевтическую составляющую, т.е. составляющую, которая имеет терапевтический или профилактический эффект при введении субъекту. Примеры терапевтических составляющих для использования с наночастицами по настоящему изобретению включают противоопухолевые или цитостатические средства, или другие средства с противораковыми свойствами, или их сочетание. В некоторых случаях частица представляет собой наночастицу, т.е. частица имеет характеристический размер меньше чем около 1 мкм, где характеристический размер частицы представляет собой диаметр абсолютной сферы, имеющей такой же объем, как и частица. Например, частица может иметь характеристический размер частицы меньше чем около 300 нм, меньше чем около 200 нм, меньше чем около 150 нм, меньше чем около 100 нм, меньше чем около 50 нм, меньше чем около 30 нм, меньше чем около 10 нм, меньше чем около 3 нм или меньше чем около 1 нм в некоторых случаях. В конкретных вариантах воплощения наночастица по настоящему изобретению имеет диаметр 80-200 нм. В одной группе вариантов воплощения частицы могут иметь внутреннюю часть и поверхность, ,где поверхность имеет композицию, отличную от внутренней части, т.е. может быть по меньшей мере одно соединение, присутствующее во внутренней части, но не присутствующее на поверхности (или наоборот), и/или по меньшей мере одно соединение присутствует во внутренней части и на поверхности в разных концентрациях. Например, в одном варианте воплощения соединение, такое как таргетирующая составляющая (т.е. низкомолекулярный PSMA лиганд) полимерного конъюгата по настоящему изобретению, может присутствовать как во внутренней части, так и на поверхности частицы, но при более высокой концентрации на поверхности, чем во внутренней части частицы, хотя в некоторых случаях концентрация во внутренней части частицы может, по существу, отличаться от нулевой, т.е. во внутренней части частицы присутствует количество соединения, которое поддается определению. В некоторых случаях внутренняя часть частицы является более гидрофобной, чем поверхность частицы. Например, внутренняя часть частицы может быть относительно гидрофобной по отношению к поверхности частицы, и лекарственное средство или другая полезная нагрузка может быть гидрофобной и легко связывается с относительно гидрофобным центром частицы. Лекарственное средство или другая полезная нагрузка могут, таким образом, содержаться во внутренней части частицы, которая, таким об-9 023175 разом, может защищать их от внешней среды, окружающей частицу (или наоборот). Например, лекарственное средство или другая полезная нагрузка, содержащиеся внутри частицы, вводимой субъекту, будут защищены от организма субъекта, а организм также будет защищен от лекарственного средства. Таргетирующая составляющая, присутствующая на поверхности частицы, может обеспечить возможность локализации частицы на конкретном целевом участке, например в опухоли, на участке заболевания, в ткани, органе, типе клеток и т.д. Таким образом, наночастица является "мишень-специфической". Лекарственное средство или другая полезная нагрузка может затем, в некоторых случаях, высвобождаться из частицы и иметь возможность локально взаимодействовать с конкретным целевым участком. Еще один аспект настоящего изобретения направлен на полимерные частицы, содержащие более чем один полимер или макромолекулу, присутствующие в них, и библиотеки, включающие такие полимеры или макромолекулы. Например, в одной группе вариантов воплощения частицы могут содержать более одного различаемых полимеров (например, сополимеры, например, блок-сополимеры), и отношение таких двух (или более) полимеров может независимо контролироваться, что позволяет контролировать свойства частицы. Например, первый полимер может представлять собой полимерный конъюгат,включающий таргетирующую составляющую и биосовместимую часть, а второй полимер может включать биосовместимую часть, но не содержит таргетирующую составляющую, или второй полимер может содержать биосовместимую часть, отличимую от первого полимера. Контроль количеств этих полимеров внутри полимерной частицы можно, таким образом, использовать для контроля различных физических,биологических или химических свойств частицы, например размера частицы (например, путем изменения молекулярной массы одного или обоих полимеров), поверхностного заряда (например, путем регулирования соотношений полимеров, если полимеры имеют разные заряды или концевые группы), поверхностной гидрофильности (например, если полимеры имеют разную молекулярную массу и/или гидрофильность), плотности поверхности таргетирующей составляющей (например, путем регулирования соотношений двух или более полимеров) и т.д. В качестве конкретного примера частица может включать первый полимер, включающий полиэтиленгликоль и таргетирующую составляющую, конъюгированную с полиэтиленгликолем, и второй полимер, включающий полиэтиленгликоль, но не таргетирующую составляющую, или включающий и полиэтиленгликоль и таргетирующую составляющую, где полиэтиленгликоль второго полимера имеет длину(или количество повторяющихся звеньев), отличную от полиэтиленгликоля первого полимера. В качестве другого примера частица может включать первый полимер, включающий первую биосовместимую часть и таргетирующую составляющую, и второй полимер, включающий вторую биосовместимую часть,отличную от первой биосовместимой части (например, имеющую другую композицию, по существу,другое количество повторяющихся звеньев и т.д.), и таргетирующую составляющую. В качестве еще одного примера первый полимер может включать биосовместимую часть и первую таргетирующую составляющую, а второй полимер может включать биосовместимую часть и вторую таргетирующую составляющую, отличную от первой таргетирующей составляющей. В других вариантах воплощения наночастицы по настоящему изобретению представляют собой липосомы, комбинации липосомных полимеров, дендримеры и альбуминовые частицы, которые функционализированы низкомолекулярным PSMA лигандом. Эти наночастицы можно использовать для доставки терапевтического средства субъекту, такого как противораковое средство, например митоксантрон или доцетаксел. Как он используется в настоящей заявке, термин "липосома" относится в основном к сферическому пузырьку или капсиду, в основном состоящему из амфипатических молекул (например, содержащих как гидрофобную (неполярную) часть, так и гидрофильную (полярную) часть). Обычно липосому можно получить в виде одного (однослойная) закрытого бислоя или многосекционного (многослойная) закрытого бислоя. Липосома может быть образована из природных липидов, синтетических липидов или их сочетания. В предпочтительном варианте воплощения липосома включает один или несколько фосфолипидов. Липиды, известные из уровня техники для образования липосом, включают, но не ограничиваются этим, лецитин (соевый или яичный; фосфатидилхолин), дипальмитоилфосфатидилхолин, димиристоилфосфатидилхолин, дистеароилфосфатидилхолин, дицетилфосфат, фосфатидилглицерин, гидрированный фосфатидилхолин, фосфатидиновую кислоту, холестерин, фосфатидилинозит, гликолипид, фосфатидилэтаноламин, фосфатидилсерин, малеимидил-дериватизированный фосфолипид (например, N-[4(пмалеимидофенил)бутирил]фосфатидилэтаноламин), диолеилфосфатидилхолин, дипальмитоилфосфатидилглицерин, димиристоилфосфатидиновую кислоту и их сочетание. Липосомы используются для доставки терапевтических средств к клеткам. Наночастицы по настоящему изобретению также могут представлять собой "липосомы", которые включают липиды, где головная группа модифицирована ПЭГ. Это в результате дает более долгий период полужизни в системе кровообращения у субъекта. Дендритные полимеры (известные также как "дендримеры") представляют собой однородные полимеры, которые в литературе называют по-разному, как гиперразветвленные дендримеры, арборолы,фрактальные полимеры и дендримеры типа "звездного взрыва", имеющие центральное ядро, внутреннюю дендритную (гиперразветвленную) структуру и внешнюю поверхность с концевыми группами. Эти полимеры отличаются от классических линейных полимеров как формой, так и функцией. Химия дендримеров создает макромолекулы с жестким контролем размера, топологии формы, гибкости и поверхностных групп (например, низкомолекулярного PSMA лиганда). В том, что известно как дивергентный синтез, начало этим макромолекулам дает взаимодействие исходного центра в высокопроизводительных повторяющихся последовательностях реакций для построения симметричных ответвлений, отходящих в виде лучей от ядра, с четко определенными поверхностными группами. Альтернативно, в том, что известно как конвергентный синтез, дендритные клинья строятся от периферии внутрь в направлении фокальной точки, а затем несколько дендритных клиньев соединяются в фокальных точках с полифункциональным ядром. В результате реакций дендритного синтеза образуются концентрические слои, известные как генерации, при этом каждая генерация удваивает молекулярную массу и количество реактивных групп на концах ответвлений, таким образом, конечный генерируемый дендример представляет собой высокочистую однородную монодисперсную макромолекулу, которая легко солюбилизируется в самых различных условиях. По причинам, которые обсуждаются ниже, молекулярная масса дендримеров находится в пределах от 300 до 700000 Да, и количество поверхностных групп (например, реактивных сайтов для связывания) существенно различается."Альбуминовые частицы" (также указаны как "альбуминовые микросферы") были описаны как носители фармакологических или диагностических средств (см., например, патенты США 5439686; 5498421; 5560933; 5665382; 6096331; 6506405; 6537579; 6749868 и 6753006; которые все включены в настоящую заявку посредством ссылки). Микросферы из альбумина получают либо путем тепловой денатурации, либо путем химической сшивки. Используя метод тепловой денатурации, микросферы получают из эмульгированной смеси (например, альбумин, средство, которое нужно включить в микросферы, и подходящее масло) при температуре в пределах от 100 до 150 С. Микросферы затем промывают подходящим растворителем и хранят. Leucuta et al. (International Journal of Pharmaceutics 41:213-217 (1988 описывают способ получения микросфер методом тепловой денатурации. Таргетирующие составляющие, представляющие собой малые молекулы. Еще в одной группе вариантов воплощения полимерный конъюгат по настоящему изобретению включает таргетирующую составляющую, т.е. составляющую, способную связываться или каким-либо иным образом вступать в ассоциацию с биологической структурой, например мембранным компонентом,клеточно-поверхностным рецептором, простата-специфическим мембранным антигеном или подобными. В случае настоящего изобретения таргетирующая составляющая представляет собой низкомолекулярныйPSMA лиганд. Термин "связываться" или "связывание", как он используется в настоящей заявке, относится к взаимодействию между соответствующей парой молекул или их частями, которые демонстрируют взаимное сродство или способность к связыванию, типично благодаря специфическому или неспецифическому связыванию или взаимодействию, включая, но не ограничиваясь этим, биохимическое, физиологическое и/или химическое взаимодействия. "Биологическое связывание" определяет тип взаимодействия, которое происходит между парами молекул, включая белки, нуклеиновые кислоты, гликопротеины, углеводы, гормоны или подобные. Термин "связывающийся партнер" относится к молекуле, которую можно подвергать связыванию с конкретной молекулой. "Специфическое связывание" относится к молекулам, таким как полинуклеотиды, которые способны связываться со связывающимся партнером(или ограниченным количеством связывающихся партнеров) или распознавать его в гораздо большей степени, чем с другими подобными биологическими структурами. В одной группе вариантов воплощения таргетирующая составляющая обладает сродством (как измерено через константу дисссоциации) меньше чем около 1 мкМ, по меньшей мере около 10 мкМ или по меньшей мере около 100 мкМ. В предпочтительных вариантах воплощения таргетирующая составляющая по настоящему изобретению представляет собой малую молекулу. В некоторых вариантах воплощения термин "малая молекула" относится к органическим соединениям либо природного происхождения, либо искусственно созданным (например, через химический синтез), которые имеют относительно низкую молекулярную массу и которые не являются белками, полипептидами или нуклеиновыми кислотами. Малые молекулы типично содержат несколько углерод-углеродных связей. В некоторых вариантах воплощения малые молекулы имеют размер меньше чем около 2000 г/моль. В некоторых вариантах воплощения малые молекулы являются меньше чем около 1500 г/моль или меньше чем около 1000 г/моль. В некоторых вариантах воплощения малые молекулы меньше чем около 800 г/моль или меньше чем около 500 г/моль. В особенно предпочтительных вариантах воплощения низкомолекулярная таргетирующая составляющая нацелена на раковые опухоли предстательной железы, и, в частности, низкомолекулярная таргетирующая составляющая представляет собой ингибитор PSMA пептидазы. Эти составляющие также указаны в настоящей заявке как "низкомолекулярные PSMA лиганды". При сравнении с экспрессией в нормальных тканях экспрессия простата-специфического мембранного антигена (PSMA) по меньшей мере в 10 раз больше в злокачественной предстательной железе по сравнению с нормальной тканью, и уровень экспрессии PSMA еще больше повышается по мере прогрессирования заболевания в метастатические фазы (Silver et al., 1997, Clin. Cancer Res., 3:81). В варианте воплощения низкомолекулярный PSMA лиганд представляет собой и его энантиомеры, стереоизомеры, ротамеры, таутомеры, диастереомеры или рацематы. Для этого лиганда NH2 группа служит в качестве точки ковалентного связывания с наночастицей (например, -N(H)PEG). Соответственно настоящее изобретение обеспечивает низкомолекулярный PSMA лиганд, представленный выше, где аминовые заместители этих соединений ковалентно связаны с полиэтиленгликолем,например соединения где n имеет значение от 20 до 1720. Соединения по настоящему изобретению также включают где R1 и R3 представляют собой алкильные группы, R2 представляет собой сложноэфирную или амидную связь, Х=0-1 мольных долей, Y=0-0,5 мольных долей, X+Y=20-1720 и Z=25-455. Соответственно изобретение обеспечивает мишень-специфическую наночастицу, включающую терапевтическое средство и конъюгат полимер/низкомолекулярный PSMA лиганд, описанный выше. В некоторых вариантах воплощения низкомолекулярный PSMA лиганд выбран из лигандов, описанных в Zhou et al., Nat. Rev. Drug Discov. 4:1015-26 (2005); Humblett et al., Mol. Imaging 4:448-62 (2005);Jayaprakash et al., Chem. Med. Chem. 1:299-302 (2006); Yoo et al., Controlled Release 96:273-83 (2004); Aggarwal et al., Cancer Res. 66:9171-9177 (2006); и Foss et al., Clin. Cancer Res. 11(11):4022-4028 (2005), которые все включены в настоящую заявку посредством ссылки во всей их полноте. В некоторых вариантах воплощения низкомолекулярные таргетирующие составляющие, которые можно использовать для таргетирования клеток, ассоциированных с раковыми опухолями предстательной железы, включают ингибиторы PSMA пептидазы, такие как 2-РМРА, GPI5232, VA-033, фенилалкилфосфонамидаты (Jackson et al., 2001, Curr. Med. Chem., 8:949; Bennett et al., 1998, J. Am. Chem. Soc,120:12139; Jackson et al., 2001, J. Med. Chem., 44:4170; Tsulcarnoto et al., 2002, Bioorg. Med. Chem. Lett.,12:2189; Tang et al., 2003, Biochem. Biophys. Res. Commun., 307:8; Oliver et al., 2003, Bioorg. Med. Chem.,11:4455; и Maung et al., 2004, Bioorg. Med. Chem., 12:4969), и/или их аналоги и производные. В некоторых вариантах воплощения низкомолекулярные таргетирующие составляющие, которые можно использовать для таргетирования клеток, ассоциированных с раковыми опухолями предстательной железы,включают тиольные и индолтиольные производные, такие как производные 2-МРРА и 3-(2 меркаптоэтил)-1 Н-индол-2-карбоновой кислоты (Majer et al., 2003, J. Med. Chem., 46:1989; и патентная публикация США 2005/0080128). В некоторых вариантах воплощения низкомолекулярные таргетирующие составляющие, которые можно использовать для таргетирования клеток, ассоциированных с раковыми опухолями предстательной железы, включают гидроксаматные производные (Stoermer et al., 2003,Bioorg. Med. Chem. Lett., 13:2097). В некоторых вариантах воплощения низкомолекулярные таргетирующие составляющие, которые можно использовать для таргетирования клеток, ассоциированных с раковыми опухолями предстательной железы, включают ингибиторы на основе PBDA и мочевины, такие как ZJ 43, ZJ 11, ZJ 17, ZJ 38 (Nan et al., 2000, J. Med. Chem., 43:772; и Kozikowski et al., 2004, J. Med.Chem., 47:1729), и/или и их аналоги и производные. В некоторых вариантах воплощения низкомолекулярные таргетирующие составляющие, которые можно использовать для таргетирования клеток, ассоциированных с раковыми опухолями предстательной железы, включают средства, направленно действующие на андрогеновые рецепторы (ARTA), такие как средства, описанные в патентах США 7026500; 7022870; 6998500; 6995284; 6838484; 6569896; 6492554; и в патентных публикациях США 2006/0287547; 2006/0276540; 2006/0258628; 2006/0241180; 2006/0183931; 2006/0035966; 2006/0009529; 2006/0004042; 2005/0033074; 2004/0260108; 2004/0260092; 2004/0167103; 2004/0147550; 2004/0147489; 2004/0087810; 2004/0067979; 2004/0052727; 2004/0029913; 2004/0014975; 2003/0232792; 2003/0232013; 2003/0225040; 2003/0162761; 2004/0087810; 2003/0022868; 2002/0173495; 2002/0099096; 2002/0099036. В некоторых вариантах воплощения низкомолекулярные таргетирующие составляющие, которые можно использовать для таргетирования клеток, ассоциированных с раковыми опухолями предстатель- 12023175 ной железы, включают полиамины, такие как путресцин, спермин и спермидин (патентные публикации США 2005/0233948 и 2003/0035804). В некоторых вариантах воплощения низкомолекулярный PSMA лиганд представляет собой ингибитор фермента глутаматкарбоксилазы II (GCPII), также известной как NAAG пептидаза или NAALAD аза. Соответственно можно осуществить анализ оценки ингибиторной активности в отношении GCPII илиNAALAD азы как основы для разработки/идентификации низкомолекулярных малых молекул, которые связываются с PSMA. Таким образом, настоящее изобретение относится к наночастицам с низкомолекулярными PSMA лигандами, которые можно использовать для лечения рака, ассоциированого с GCPII активностью. Способы скрининга для определения имеющих низкую молекулярную массу молекул, способных специфически связываться с клеточно-поверхностными белками PSMA или GCPII, хорошо известны из уровня техники. В неограничивающем примере имеющие низкую молекулярную массу молекулыкандидаты могут быть мечеными либо радиоактивно (см. Foss et al., Clin Cancer Res, 2005, 11, 40224028), либо флуоресцентно (Humblet et al., Molecular Imaging, 2005, 4, 448-462). Стандартная лабораторная клеточная линия, например клетки HeLa, которые в нормальном состоянии не экспрессируют PMSA(контрольные клетки), может быть трансфицирована трансгеном, кодирующим PMSA белок, так чтобыPMSA экспрессировался на клеточной поверхности этих трансфицированных клеток. Способность имеющих низкую молекулярную массу меченых молекул связываться с клетками, эктопически экспрессирующими PMSA, но не с контрольными клетками, можно определить in vitro с использованием стандартных известных из уровня техники средств, таких как анализ с использованием сцинтилляционного счетчика или клеточного сортера с возбуждением флуоресценции (FACS). Имеющие низкую молекулярную массу молекулы, которые связываются с клетками, экспрессирующими PMSA, но не с контрольными клетками, следует рассматривать как специфические в отношении PMSA. Связывание и поглощение наночастиц можно определить при помощи анализов с использованием LNCap клеток, которые экспрессируют PSMA (см., например, пример 4 в настоящей заявке). Молекулы, раскрытые в патентах, патентных заявках и непатентных ссылочных документах, указанных в настоящей заявке, могут быть дополнительно замещены функциональной группой, которая может взаимодействовать с полимером по настоящему изобретению (например, ПЭГ), для получения полимера, конъюгированного с таргетирующей составляющей. Функциональные группы включают любой фрагмент, который можно использовать для создания ковалентной связи с полимером (например,ПЭГ), такой как амино, гидрокси и тио. В конкретном варианте воплощения малые молекулы могут быть замещены группой NH2, SH или ОН, которые либо непосредственно связываются с малой молекулой,либо связываются с малой молекулой через дополнительную группу, например, алкил или фенил. В неограничивающем примере малые молекулы, раскрытые в патентах, патентных заявках и непатентных ссылочных документах, указанных в настоящей заявке, могут быть связаны с анилином, алкил-NH2 (например, (CH2)1-6NH2) или алкил-SH (например, (СН 2)1-6NH2), где группы NH2 и SH могут взаимодействовать с полимером (например, ПЭГ), с образованием ковалентной связи с этим полимером, т.е. с образованием полимерного конъюгата. Полимерный конъюгат по настоящему изобретению можно получить с использованием любого подходящего способа конъюгирования. Например, два соединения, такие как таргетирующая составляющая и биосовместимый полимер, биосовместимый полимер и полиэтиленгликоль и т.д., могут быть конъюгированы вместе с использованием таких методов, как химия EDC-NHS (гидрохлорид 1-этил-3-(3 диметиламинопропил)карбодиимида и N-гидроксисукцинимид) или реакция с участием малеимида или карбоновой кислоты, которые могут быть конъюгированы с одним концом тиола, амина или аналогичным образом функционализированного простого полиэфира. Конъюгирование таких полимеров, например конъюгирование сложного полиэфира и простого полиэфира с образованием сополимера сложного эфира и простого эфира, можно осуществить в органическом растворителе, таком как, но не ограничиваясь этим, дихлорметан, ацетонитрил, хлороформ, диметилформамид, тетрагидрофуран, ацетон или подобные. Конкретные условия реакции может определить специалист в данной области с использованием обычных рутинных экспериментов. В другой группе вариантов воплощения реакцию конъюгации можно осуществить путем взаимодействия полимера, который включает карбоновокислотную функциональную группу (например, сополимера сложного эфира и простого эфира) с полимером или другой частицей (такой как таргетирующая составляющая), включающей амин. Например, можно осуществить взаимодействие таргетирующей составляющей, такой как низкомолекулярный PSMA лиганд, с амином с образованием аминсодержащей составляющей, которая затем может быть конъюгирована с карбоновой кислотой полимера. Такую реакцию можно осуществить как одностадийную реакцию, т.е. конъюгирование осуществляют без использования промежуточных соединений, таких как N-гидроксисукцинимид или малеимид. Реакцию конъюгации между аминсодержащей составляющей и полимером с карбоновокислотной концевой группой (таким как сополимер сложного эфира и простого эфира) можно осуществить, в одной группе вариантов воплощения, путем добавления аминсодержащей составляющей, солюбилизированной в органическом растворителе, таком как (но не ограничиваясь этим) дихлорметан, ацетонитрил, хлороформ, тетрагидро- 13023175 фуран, ацетон, формамид, диметилформамид, пиридины, диоксан или диметилсульфоксид, к раствору,содержащему полимер, имеющий карбоновокислотную концевую группу. Полимер, имеющий карбоновокислотную концевую группу, может содержаться в органическом растворителе, таком как, но не ограничиваясь этим, дихлорметан, ацетонитрил, хлороформ, диметилформамид, тетрагидрофуран или ацетон. Взаимодействие между аминсодержащей составляющей и полимером, имеющим карбоновокислотную концевую группу, в некоторых случаях может происходить самопроизвольно. Участвующие в реакции вещества, которые остались неконъюгированными, можно удалить путем промывки после таких реакций, и можно осуществить осаждение полимера в растворителях, таких как, например, этиловый эфир,гексан, метанол или этанол. В качестве конкретного примера низкомолекулярный PSMA лиганд может быть получен в качестве таргетирующей составляющей в частице следующим образом. Модифицированный карбоновой кислотой сополимер полилактида и полигликолида (PLGA-COOH) может быть конъюгирован с аминмодифицированным гетеробифункциональным полиэтиленгликолем (NH2-ПЭГ-СООН) с образованием сополимера PLGA-ПЭГ-СООН. С использованием аминмодифицированного низкомолекулярного PSMA лиганда (NH2-Lig) может быть получен триблок-полимер PLGA-ПЭГ-Lig путем конъюгации карбоновокислотного конца ПЭГ с аминовой функциональной группой лиганда. Мультиблок-полимер затем можно использовать, например, как обсуждается ниже, например, для терапевтического применения. Другой аспект настоящего изобретения направлен на частицы, которые включают полимерные конъюгаты, например, описанные выше. Такие частицы могут иметь, по существу, сферическую (т.е. частицы в основном являются сферическими) или несферическую конфигурацию. Например, частицы при их набухании или сжатии могут принимать несферическую конфигурацию. В некоторых случаях частицы могут включать полимерные смеси. Например, может быть получена полимерная смесь, которая включает первый полимер, включающий таргетирующую составляющую (т.е. низкомолекулярныйPSMA лиганд) и биосовместимый полимер, и второй полимер, включающий биосовместимый полимер,но не включающий таргетирующую составляющую. Путем контролирования соотношения первого и второго полимеров в конечном полимере концентрацию и местоположение таргетирующей составляющей в конечном полимере можно легко контролировать до любой подходящей степени. Как используется в настоящем описании термин "алкил" включает насыщенные алифатические группы, включая линейные алкильные группы (например, метил, этил, пропил, бутил, пентил, гексил,гептил, октил, нонил, децил и т.д.), алкильные группы с разветвленной цепью (изопропил, трет-бутил,изобутил и т.д.), циклоалкильные (алициклические) группы (циклопропил, циклопентил, циклогексил,циклогептил, циклооктил), алкилзамещенные циклоалкильные группы и циклоалкилзамещенные алкильные группы. Кроме того, выражение "Сх-Су-алкил", где х имеет значение 1-5 и у имеет значение 210, указывает конкретную алкильную группу (с линейной или разветвленной цепью) с количеством атомов углерода в конкретных пределах. Например, выражение С 1-С 4-алкил включает, но не ограничивается этим, метил, этил, пропил, бутил, изопропил, трет-бутил и изобутил. Термин "алкил" также включает алкильные группы, которые могут дополнительно включать атомы кислорода, азота, серы или фосфора, замещающие один или несколько атомов углерода углеводородного скелета. В одном варианте воплощения алкил с линейной или разветвленной цепью содержит 10 или меньше атомов углерода в своей основной цепи (например, C1-С 10 для линейной, С 3-С 10 для разветвленной цепи), и более предпочтительно 6 или меньше атомов углерода. Подобным образом, предпочтительные циклоалкилы содержат 4-7 атомов углерода в их кольцевой структуре и более предпочтительно они содержат 5 или 6 атомов углерода в кольцевой структуре. Более того, алкил (например, метил, этил, пропил, бутил, пентил, гексил и т.д.) включает как "незамещенный алкил", так и "замещенный алкил", из которых последний относится к алкильным группам,содержащим заместители, замещающие водород по одному или нескольким атомам углерода углеводородной основной цепи, что позволяет молекуле осуществлять ее предполагаемую функцию. Термин "замещенный" предназначен для описания групп, содержащих заместители, замещающие водород по одному или нескольким атомам, например С, О или N, в молекуле. Такие заместители могут включать, например, алкенил, алкинил, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонато,фосфинато, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино),ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино,сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонат, сульфамоил,сульфонамидо, нитро, трифторметил, циано, азидо, гетероциклическую группу, алкиларил, морфолино,фенол, бензил, фенил, пиперазин, циклопентан, циклогексан, пиридин, 5 Н-тетразол, триазол, пиперидин или ароматическую или гетероароматическую группу. Следующие примеры заместителей по настоящему изобретению, которые не следует рассматривать как ограничивающие, включают группы, выбранные из линейного или разветвленного алкила (предпочтительно С 1-С 5), циклоалкила (предпочтительно С 3-С 8), алкокси (предпочтительно C1-С 6), тиоалкила циклической группы, карбоциклической группы, арила (например, фенила), арилокси (например, фенокси), аралкила (например, бензила), арилоксиалкила (например, фенилоксиалкила), арилацетамидоила,алкиларила, гетероаралкила, алкилкарбонила и арилкарбонила или другой такой ацильной группы, гетероарилкарбонильной или гетероарильной группы, (CR'R")0-3NR'R" (например, -NH2), (CR'R")0-3CN (например, -CN), -NO2, галогена (например, -F, -Cl, -Br или -I), (CR'R")0-3 С(галоген)3 (например, -CF3),(CR'R")0-3CH (галоген)2, (CR'R")0-3 СН 2(галоген), (CR'R")0-3CONR'R", (CR'R")0-3(CNH)NR'R", (CR'R")0I 3S(O)1-2NR R", (CR'R")0-3CHO, (CR'R")0-3C(CR'R" )0-3H, (CR'R")0-3S(O)0-3R' (например, -SO3H, -OSO3H),(CR'R" )0-3 О(CR'R")0-3H (например, -СН 2 ОСН 3 и -OCH3), (CR'R")0-3S(CR'R")0-3H (например, -SH и -SCH3),(CR'R")0-3OH (например, -OH), (CR'R")0-3COR' , (CR'R")0-3 (замещенный или незамещенный фенил),(CR'R")0-3(С 3-C8 циклоалкил), (CR'R")0-3CO2R' (например, -СО 2 Н) или (CR'R")0-3OR' группы, или боковой цепи любой природной аминокислоты; где R' и R" каждый независимо представляет собой водород, С 1 С 5 алкильную, С 2-С 5 алкенильную, С 2-С 5 алкинильную или арильную группу. Такие заместители могут включать, например, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси,арилоксикарбонилокси, карбоксилат, алкилкарбонил, алкоксикарбонил, аминокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонато, фосфинато, циано, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, оксим, тиол, алкилтио, арилтио, тиокарбоксилат, сульфаты,сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, циано, азидо, гетероциклил или ароматическую или гетероароматическую группу. В некоторых вариантах воплощения карбонильная группа(С=O) может быть дополнительно дериватизирована группой оксима, например, альдегидная группа может быть дериватизирована в виде его оксимного (-C=N-OH) аналога. Специалистам в данной области должно быть понятно, что группы, замещенные на углеводородной цепи, сами могут быть замещены,если это является подходящим. Циклоалкилы могут быть дополнительно замещены, например, заместителями, описанными выше. Группа "аралкил" представляет собой алкил, замещенный арилом (например,фенилметил (т.е. бензил. Термин "арил" включает группы, включающие 5- и 6-членные содержащие одно кольцо ароматические группы, которые могут включать от нуля до четырех гетероатомов, например фенил, пиррол, фуран,тиофен, тиазол, изотиазол, имидазол, триазол, тетразол, пиразол, оксазол, изоксазол, пиридин, пиразин,пиридазин и пиримидин и подобные. Кроме того, термин "арил" включает полициклические арильные группы, например трициклические, бициклические, например нафталин, бензоксазол, бензодиоксазол,бензотиазол, бензоимидазол, бензотиофен, метилендиоксифенил, хинолин, изохинолин, антрил, фенантрил, нафтиридин, индол, бензофуран, пурин, бензофуран, деазапурин или индолизин. Теарильные группы, которые содержат гетероатомы в кольцевой структуре, также могут быть указаны как "арильные гетероциклы", "гетероциклы", "гетероарилы" или "гетероароматические группы". Ароматическое кольцо может быть замещено в одном или нескольких положениях кольца такими заместителями, как заместители, описанные выше, например алкил, галоген, гидроксил, алкокси, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, алкиламиноакарбонил, аралкиламинокарбонил, алкениламинокарбонил, алкилкарбонил, арилкарбонил, аралкилкарбонил,алкенилкарбонил, алкоксикарбонил, аминокарбонил, алкилтиокарбонил, фосфат, фосфонато, фосфинато,циано, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфат, алкилсульфинил, сульфонат, сульфамоил, сульфонамидо, нитро, трифторметил, циано, азидо, гетероциклил, алкиларил или ароматическая или гетероароматическая группа. Арильные группы также могут быть конденсированы или связаны мостиковой связью с алициклическими или гетероциклическими кольцами, которые не являются ароматическими, с образованием, таким образом, полицикла (например, тетралин). Кроме того, фраза "любое их сочетание" предполагает, что любое количество перечисленных функциональных групп и молекул можно объединить для создания более крупной молекулярной архитектуры. Например, термины "алкил" и "арил" можно объединить с образованием - CH2Ph или -PhCH3 (тоуил) группы. Подобным образом, фраза "любое сочетание C1-6-алкила или фенила, которые независимо замещены один или несколько раз группой ОН, SH, NH2 или СО 2 Н" представляет структуру -(СН 2)3-аналина или -Ph- (CH2)3-NH2 заместитель. Должно быть понятно, что при объединении функциональных групп и молекул для создания более крупной молекулярной архитектуры атомы водорода могут быть удалены или добавлены, как это необходимо для соответствия валентности каждого атома. Получение мишень-специфических наночастиц. Другой аспект настоящего изобретения направлен на системы и способы получения таких мишеньспецифических наночастиц. В некоторых вариантах воплощения осуществляют контактирование раствора, содержащего полимер, с жидкостью, такой как несмешиваемая жидкость, с образованием наночастиц,содержащих полимерный конъюгат. Как было указано, один аспект настоящего изобретения направлен на способ разработки наночастиц с желаемыми свойствами, такими как желаемые химические, биологические или физические свойства. В одной группе вариантов воплощения способ включает получение библиотеки наночастиц, имею- 15023175 щих высококонтролируемые свойства, которую можно получить путем смешивания вместе двух или более полимеров в различных соотношениях. Путем смешивания вместе двух или более разных полимеров(например, сополимеров, например, блок-сополимеров) в различных соотношениях и получения частиц из этих полимеров (например, сополимеров, например, блок-сополимеров), можно получить частицы,обладающие высоко контролируемыми свойствами. Например, один полимер (например, сополимер,например, блок-сополимер) может включать низкомолекулярный PSMA лиганд, тогда как другой полимер (например, сополимер, например, блок-сополимер) может быть выбран с учетом его биосовместимости и/или его способности контролировать иммуногенность получаемой в результате частицы. В одной группе вариантов воплощения частицы получают путем обеспечения раствора, включающего один или несколько полимеров, и контактирования раствора с осадителем полимера с получением частицы. Раствор может быть смешиваемым или не смешиваемым с осадителем полимера. Например,смешиваемая с водой жидкость, такая как ацетонитрил, может содержать полимеры, и частицы образуются при контакте ацетонитрила с водой, осадителем полимера, например, при выливании ацетонитрила в воду с контролируемой скоростью. Полимер, содержащийся в растворе, при контакте с осадителем полимера может затем осаждаться с образованием частиц, таких как наночастицы. Две жидкости указываются как "несмешиваемые" или как жидкости, которые не могут смешиваться друг с другом, когда одна из них не является растворимой в другой до уровня по меньшей мере 10 мас.% при температуре и давлении окружающей среды. Типично, органический раствор (например, дихлорметан, ацетонитрил, хлороформ, тетрагидрофуран, ацетон, формамид, диметилформамид, пиридины, диоксан, диметилсульфоксид и т.д.) и водная жидкость (например, вода или вода, содержащая растворенные соли или другие молекулы, клеточную или биологическую среду, этанол и т.д.) являются несмешиваемыми по отношению друг к другу. Например, первый раствор можно выливать во второй раствор (с подходящей скоростью). В некоторых случаях частицы, такие как наночастицы, могут быть образованы при контактировании первого раствора с несмешиваемой второй жидкостью, например осаждение полимера при контакте приводит к образованию этим полимером наночастиц по мере того, как первый раствор выливают во вторую жидкость, и в некоторых случаях, например, когда скорость введения тщательно контролируют и поддерживают на относительно низком уровне, могут образовываться наночастицы. Контроль такого образования частиц легко может оптимизировать специалист, обладающий средней квалификацией, исключительно путем рутинного экспериментирования. Путем создания библиотеки таких частиц можно идентифицировать частицы, обладающие любыми желательными свойствами. Например, свойства, такие как поверхностная функциональность, поверхностный заряд, размер, зетапотенциал, гидрофобность, способность контролировать иммуногенность и подобные, могут быть высоко контролируемыми. Например, библиотеку частиц можно синтезировать и скринировать для идентификации частиц, имеющих конкретное отношение полимеров, которое позволяет частицам иметь определенную плотность групп (например, низкомолекулярных PSMA лигандов),присутствующих на поверхности частицы. Это дает возможность получать частицы, обладающие одним или несколькими специфическими свойствами, например имеющие специфический размер и специфическую поверхностную плотность групп, без излишних усилий. Соответственно некоторые варианты воплощения настоящего изобретения направлены на методы скрининга с использованием таких библиотек,а также на любые частицы, идентифицированные с использованием таких библиотек. Кроме того, идентификацию можно осуществить любым подходящим способом. Например, идентификация может быть прямой или косвенной или может проходить количественно или качественно. В некоторых вариантах воплощения уже образовавшиеся наночастицы функционализируют таргетирующей составляющей с использованием процедур, аналогичных тем, которые описаны для получения лиганд-функционализированных полимерных конъюгатов. В качестве конкретного неограничивающего примера этот вариант воплощения схематически проиллюстрирован на фиг. 1 А. На этой схеме первый сополимер (PLGA-PEG, сополимер полилактида и полигликолида-полиэтиленгликоля) смешивают с терапевтическим средством с образованием частиц. Частицы затем связывают с низкомолекулярнымPSMA лигандом с образованием наночастиц, которые можно использовать для лечения рака. Частицы можно связывать с разными количествами низкомолекулярных PSMA лигандов, чтобы контролировать плотность PSMA лиганда на поверхности наночастицы, изменяя, таким образом, терапевтические характеристики наночастиц. Кроме того, например, путем контролирования параметров, таких как молекулярная масса PLGA, молекулярная масса ПЭГ и поверхностный заряд наночастицы, можно получить очень точно контролируемые частицы с использованием этого способа получения. В качестве конкретного неограничивающего примера этот вариант воплощения схематически проиллюстрирован на фиг. 1 В. На этой схеме первый сополимер (PLGA-PEG) конъюгируют с низкомолекулярным PSMA лигандом (PSMALig) с образованием PLGA-ПЭГ-PSMALig полимера. Этот лигандсвязанный полимер смешивают со вторым нефункционализированным полимером (в этом примере,PLGA-ПЭГ) при разных соотношениях с образованием ряда частиц, имеющих разные свойства, например разную плотность PSMA лиганда на их поверхности, как показано в этом примере. Например, путем контролирования параметров, таких как молекулярная масса PLGA, молекулярная масса ПЭГ, плотностьPSMA лиганда на поверхности и поверхностный заряд наночастицы, можно получить очень точно кон- 16023175 тролируемые частицы с использованием этого способа получения. Как показано на фиг. 1 В, полученная наночастица также может включать терапевтическое средство. В другом варианте воплощения изобретение обеспечивает способ получения наночастицы, где наночастица имеет отношение лигандсвязанного полимера к нефункционализированному полимеру, эффективное для лечения рака предстательной железы, где гидрофильный лигандсвязанный полимер конъюгирован с липидом, который будет осуществлять самосборку с гидрофобным полимером, таким образом, чтобы гидрофобный и гидрофильный полимеры, которые образуют наночастицу, не были ковалентно связаны. "Самосборка" относится к процессу самопроизвольной сборки структуры высшего порядка, который основан на естественном притяжении компонентов структуры высшего порядка (например, молекул) друг к другу. Это обычно происходит через неупорядоченные движения молекул и образование связей на основании размера, формы, композиции или химических свойств. Например, такой способ включает обеспечение первого полимера, который подвергают взаимодействию с липидом, с образованием полимер/липидного конъюгата. Полимер/липидный конъюгат затем подвергают взаимодействию с низкомолекулярным PSMA лигандом с получением конъюгата лигандсвязанный полимер/липид; и смешивание конъюгата лигандсвязанный полимер/липид со вторым нефункционализированным полимером и терапевтическим средством с получением, таким образом, наночастицы. В некоторых вариантах воплощения первый полимер представляет собой ПЭГ, чтобы получить ПЭГ, содержащий липид на конце цепи. В одном варианте воплощения липид представляет собой липид формулы V, например 2 дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE) и его соли, например натриевую соль. ПЭГ, содержащий липид на конце цепи, затем может быть, например, смешан с PLGA с образованием наночастицы. Также могут быть получены библиотеки таких частиц. Например, путем изменения соотношения двух (или более) полимеров в частице эти библиотеки могут быть полезны для скрининговых испытаний,в высокопроизводительных анализах или т.п. Входящие в библиотеку частицы могут отличаться по своим свойствам, таким как описанные выше свойства, и в некоторых случаях более чем одно свойство частиц может отличаться в пределах библиотеки. Соответственно один вариант воплощения настоящего изобретения направлен на библиотеку наночастиц, имеющих разные соотношения полимеров с отличающимися свойствами. Библиотека может включать любое подходящее соотношение (соотношения) полимеров. В некоторых случаях может присутствовать популяция частиц. Например, популяция частиц может включать по меньшей мере 20 частиц, по меньшей мере 50 частиц, по меньшей мере 100 частиц, по меньшей мере 300 частиц, по меньшей мере 1000 частиц, по меньшей мере 3000 частиц или по меньшей мере 10000 частиц. Различные варианты воплощения настоящего изобретения направлены на такие популяции частиц. Например, в некоторых вариантах воплощения частицы могут быть, каждая, по существу одинаковой формы и/или размера ("монодисперсные"). Например, частицы могут иметь такое распределение характеристических размеров, чтобы не более чем около 5% или около 10% частиц имели характеристический размер, больше чем примерно на 10% превышающий средний характеристический размер частиц, и в некоторых случаях, чтобы не более чем около 8%, около 5%, около 3%, около 1%, около 0,3%, около 0,1%, около 0,03% или около 0,01% имели характеристический размер, больше чем примерно на 10% превышающий средний характеристический размер частиц. В некоторых случаях не более чем около 5% частиц имеют характеристический размер, больше чем на около 5%, около 3%, около 1%, около 0,3%, около 0,1%, около 0,03% или около 0,01% превышающий средний характеристический размер частиц. В более широком смысле полимеры, выбранные для использования в создании библиотеки частиц,могут представлять собой любые из широкого разнообразия полимеров, например которые описаны в настоящей заявке. Как правило, смешивают два, три, четыре или более полимеров, в широких пределах пропорций (например, каждый в пределах от 0 до 100%), с образованием частиц, таких как наночастицы,имеющих разные пропорции каждого из полимеров. Два или более полимеров могут различаться некоторым образом, например содержать разные полимерные группы, содержать одинаковые полимерные группы, но с разной молекулярной массой, содержать некоторые полимерные группы, которые являются одинаковыми, но содержать другие группы, которые отличаются в этих полимерах (например, один может содержать полимерную группу, которую другой не содержит), содержать одинаковые полимерные группы, но в разных порядках, и т.д. Библиотека частиц может содержать любое количество членов, например библиотека может содержать 2, 3, 5, 10, 30, 100, 300, 1000, 3000, 10000, 30000, 100000 и т.д. членов, которые могут быть идентифицированы определенным образом. В некоторых случаях библиотека может существовать одновременно; например библиотека может содержаться в одном или нескольких микротитровальных планшетах, флаконах и т.д., или в некоторых вариантах воплощения библиотека может включать члены, созданные в разное время. Библиотеку частиц затем можно скринировать определенным образом для идентификации тех частиц, которые обладают одним или несколькими желаемыми свойствами, например поверхностной функциональностью, поверхностным зарядом, размером, зетапотенциалом, гидрофобностью, способностью контролировать иммуногенность и подобными. Одна или несколько макромолекул в частицах могут включать один или несколько полимеров, выбранных таким образом, чтобы они были биосовмести- 17023175 мыми или биоразлагаемыми, один или несколько полимеров, выбранных для снижения иммуногенности,и/или один или несколько низкомолекулярных PSMA лигандов. Макромолекулы, входящие в библиотеку, могут включать некоторые или все из этих полимеров в любом подходящем сочетании (включая, но не ограничиваясь этим, сочетания, в которых первый полимер включает низкомолекулярный PSMA лиганд, а второй полимер не содержит ни одну из таких групп). В качестве конкретного примера, в одном варианте воплощения частицы могут включать первую макромолекулу, включающую биосовместимый полимер и низкомолекулярный PSMA лиганд, и вторую макромолекулу, включающую биосовместимый полимер, который может быть или может не быть, таким же, как в первой макромолекуле. В качестве другого примера, первая макромолекула может представлять собой блок-сополимер, включающий биосовместимый гидрофобный полимер, биосовместимый гидрофильный полимер и низкомолекулярный PSMA лиганд; а вторая макромолекула отличается от первой макромолекулы некоторым образом. Например, вторая макромолекула может включать такой же (или другой) биосовместимый гидрофобный полимер и такой же (или другой) биосовместимый гидрофильный полимер, но другой низкомолекулярный PSMA лиганд (или вообще никакого лиганда), отличный от первой макромолекулы. Наночастица по настоящему изобретению также может состоять, в качестве еще одного примера, из первой макромолекулы, включающей биосовместимый гидрофобный полимер, биосовместимый гидрофильный полимер и низкомолекулярный PSMA лиганд, и второй макромолекулы, которая отличается от первой макромолекулы. Например, вторая макромолекула может не содержать ни один из полимеров первой макромолекулы, вторая макромолекула может содержать один или несколько полимеров первой макромолекулы и один или несколько полимеров, не присутствующих в первой макромолекуле, вторая макромолекула может не включать один или несколько полимеров первой макромолекулы, вторая макромолекула может содержать все полимеры первой макромолекулы, но в другом порядке и/или при том,что один или несколько полимеров имеют другую молекулярную массу и т.д. В качестве еще одного примера, первая макромолекула может включать биосовместимый гидрофобный полимер, биосовместимый гидрофильный полимер и низкомолекулярный PSMA лиганд, а вторая макромолекула может включать биосовместимый гидрофобный полимер и биосовместимый гидрофильный полимер и отличаться от первой макромолекулы некоторым образом. В качестве еще одного примера, первая макромолекула может включать биосовместимый гидрофобный полимер и биосовместимый гидрофильный полимер, а вторая макромолекула может включать биосовместимый гидрофобный полимер и низкомолекулярный PSMA лиганд, при этом вторая макромолекула отличается от первой макромолекулы некоторым образом. Наночастицы, описанные выше, также могут содержать терапевтические средства. Примеры терапевтических средств включают, но не ограничиваются этим, химиотерапевтическое средство, радиоактивное средство, средство на основе нуклеиновой кислоты, средство на основе липидов, средство на основе углеводов, природную малую молекулу или синтетическую малую молекулу. Полимеры или макромолекулы затем могут быть сформированы в частицу с использованием способов, таких как обсуждаемые подробно ниже. Геометрия, образуемая частицей из полимера или макромолекулы, может зависеть от таких факторов, как полимеры, которые образуют частицу. На фиг. 2 проиллюстрировано, что библиотеки можно получить с использованием полимеров, таких как полимеры, описанные выше. Например, на фиг. 2 полимерные частицы, включающие первую макромолекулу, включающую биосовместимый гидрофобный полимер, биосовместимый гидрофильный полимер и низкомолекулярный PSMA лиганд, и вторую макромолекулу, которая включает биосовместимый гидрофобный полимер и биосовместимый гидрофильный полимер, можно использовать для создания библиотеки частиц, имеющих разные соотношения первой и второй макромолекул. Такая библиотека может быть полезной для получения частиц с любым числом желательных свойств, например, таких свойств, как поверхностная функциональность, поверхностный заряд, размер,зетапотенциал, гидрофобность, способность контролировать иммуногенность или подобные. На фиг. 2 разные соотношения первой и второй макромолекул (включая соотношения, где одна из макромолекул отсутствует) объединяют с получением частиц, которые образуют основу библиотеки. Например, как показано на фиг. 2, с увеличением количества первой макромолекулы относительно второй макромолекулы количество составляющей (например, низкомолекулярного PSMA лиганда), присутствующей на поверхности частицы, может увеличиваться. Таким образом, любую подходящую концентрацию составляющей, присутствующей на поверхности, можно получить просто путем контролирования соотношения первой и второй макромолекул в частицах. Соответственно такая библиотека частиц может быть полезной для выбора или идентификации частиц, обладающих определенной функциональностью. В качестве конкретных примеров, в некоторых вариантах воплощения настоящего изобретения библиотека включает частицы, включающие полимерные конъюгаты биосовместимого полимера и низкомолекулярного PSMA лиганда, как обсуждается в настоящей заявке. Обращаясь к фиг. 3, одна такая частица показана в качестве неограничивающего примера. На этой фигуре полимерный конъюгат по настоящему изобретению используют для получения частицы 10. Полимер, образующий частицу 10, вклю- 18023175 чает низкомолекулярный PSMA лиганд 15, присутствующий на поверхности частицы, и биосовместимую часть 17. В некоторых случаях, как показано на этой фигуре, таргетирующая составляющая 15 может быть конъюгирована с биосовместимой частью 17. Однако, показано, что не вся биосовместимая часть 17 является конъюгированной с таргетирующей составляющей 15. Например, в некоторых случаях частицы, такие как частица 10, могут быть образованы с использованием первого полимера, включающего биосовместимую часть 17 и низкомолекулярный PSMA лиганд 15, и второго полимера, включающего биосовместимую часть 17, но не таргетирующую составляющую 15. Путем контролирования соотношения первого и второго полимеров могут быть образованы частицы, имеющие разные свойства, и в некоторых случаях могут быть образованы библиотеки таких частиц. Кроме того, присутствует содержащееся в центре частицы 10 лекарственное средство 12. В некоторых случаях лекарственное средство 12 может содержаться внутри частицы благодаря гидрофобным эффектам. Например, внутренняя часть частицы может быть относительно гидрофобной по сравнению с поверхностью частицы, и лекарственное средство может быть гидрофобным лекарственным средством, которое соединяется с относительно гидрофобным центром частицы. В одном варианте воплощения терапевтическое средство является связанным с поверхностью наночастицы, инкапсулировано внутри нее, окружено ею или диспергировано в ней. В другом варианте воплощения терапевтическое средство является инкапсулированным в гидрофобном ядре наночастицы. В качестве конкретного примера частица 10 может содержать полимеры, включающие относительно гидрофобный биосовместимый полимер и относительно гидрофильную таргетирующую составляющую 15, так чтобы в процессе образования частицы более высокая концентрация гидрофильной таргетирующей составляющей была доступна на поверхности, а более высокая концентрация гидрофобного биосовместимого полимера присутствовала во внутренней части частицы. В некоторых вариантах воплощения биосовместимый полимер является гидрофобным полимером. Неограничивающие примеры биосовместимых полимеров включают полилактид, полигликолид и/или сополимер полилактида и полигликолида. В одном варианте воплощения изобретение включает наночастицу, включающую 1) полимерную матрицу; 2) амфифильное соединение или слой, который окружает или является диспергированным в полимерной матрице, образуя непрерывную или прерывистую оболочку для частицы; 3) полимер и 4) ковалентно присоединенный низкомолекулярный PSMA лиганд. Амфифильный слой может снижать проникновение воды в наночастицу, усиливая таким образом эффективность инкапсулирования лекарственного средства и замедляя высвобождение лекарственного средства. Кроме того, эти защищенные амфифильным слоем наночастицы могут обеспечить терапевтические преимущества путем высвобождения инкапсулированного лекарственного средства и полимера в подходящее время. Как используется в настоящем описании, термин "амфифильный" относится к свойству, когда молекула содержит как полярную часть, так и неполярную часть. Часто амфифильное соединение содержит полярную головную часть, присоединенную к длинному гидрофобному хвосту. В некоторых вариантах воплощения полярная часть является растворимой в воде, тогда как неполярная часть не растворима в воде. Кроме того, полярная часть может иметь либо формальный положительный заряд, либо формальный отрицательный заряд. Альтернативно, полярная часть может иметь как положительный, так и отрицательный формальный заряд, и может представлять собой цвиттерион или внутреннюю соль. Для целей настоящего изобретения амфифильное соединение может представлять собой, но не ограничивается этим, одно или несколько из следующих: липиды природного происхождения, поверхностно-активные вещества или синтезированные соединения как с гидрофильными, так и с гидрофобными группами. Конкретные примеры амфифильных соединений включают, но не ограничиваются этим, фосфолипиды, такие как 1,2 дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), дипальмитоилфосфатидилхолин(DPPC), дистеароилфосфатидилхолин (DSPC), диарахидоилфосфатидилхолин (DAPC), дибегеноилфосфатидилхолин (DBPC), дитрикозаноилфосфатидилхолин (DTPC) и дилигноцероилфатидилхолин (DLPC),включенные при отношении в пределах 0,01-60 (масса липида/масса полимера), наиболее предпочтительно 0,1-30 (масса липида/масса полимера). Фосфолипиды, которые можно использовать, включают,но не ограничиваются этим, фосфатидиновые кислоты, фосфатидилхолины как с насыщенными, так и ненасыщенными липидами, фосфатидилэтаноламины, фосфатидилглицерины, фосфатидилсерины, фосфатидилинозиты, лизофосфатидильные производные, кардиолипин и -ацилалкилфосфолипиды. Примеры фосфолипидов включают, но не ограничиваются этим, фосфатидилхолины, такие как диолеоилфосфатидилхолин, димиристоилфосфатидилхолин, дипентадеканоилфосфатидилхолин дилауроилфосфатидилхолин, дипальмитоилфосфатидилхолин (DPPC), дистеароилфосфатидилхолин (DSPC), диарахидоилфосфатидилхолин (DAPC), дибегеноилфосфатидилхолин (DBPC), дитрикозаноилфосфатидилхолин (DTPC), дилигноцероилфатидилхолин (DLPC); и фосфатидилэтаноламины, такие как диолеоилфосфатидилэтаноламин или 1-гексадецил-2-пальмитоилглицерофосфоэтаноламин. Синтетические фосфолипиды с асимметрическими ацильными цепями (например, с одной ацильной цепью из 6 атомов углерода и другой ацильной цепью из 12 атомов углерода) также можно использовать. В конкретном варианте воплощения амфифильный компонент, который можно использовать с образованием амфифильного слоя, представляет собой лецитин и, в частности фосфатидилхолин. Лецитин представляет собой амфифильный липид и, как таковой, образует фосфолипидный бислой, содержащий гидрофильные (полярные) головные группы, обращенные к их окружению, которое часто является водным, и гидрофобные хвостовые части, обращенные друг к другу. Лецитин обладает тем преимуществом,что он является природным липидом, который является доступным, например из сои, и он уже одобренFDA для использования в других устройствах доставки. Кроме того, смесь липидов, таких как лецитин,является более привлекательной, чем один чистый липид. В некоторых вариантах воплощения настоящего изобретения амфифильный слой наночастицы, например слой лецитина, представляет собой монослой, и это означает, что слой не является фосфолипидным бислоем, но существует в виде единственного непрерывного или прерывистого слоя вокруг или внутри наночастицы. Амфифильный слой является "ассоциированным с" наночастицей по настоящему изобретению, это означает, что он расположен в некоторой близости к полимерной матрице, например окружая внешнюю часть полимерной оболочки, или диспергирован внутри полимеров, которые составляют наночастицу. Таким образом, в одном варианте воплощения изобретение обеспечивает мишень-специфическую наночастицу, включающую 1) PLGA; 2) ПЭГ; 3) амфифильное соединение или слой (например, лецитин), который окружает или является диспергированным в PLGA/PEG матрице с образованием непрерывной или прерывистой оболочки для частицы; и 4) присоединенный путем ковалентного связывания низкомолекулярный PSMA лиганд. В одном варианте воплощения PLGA и ПЭГ являются сополимерами,и низкомолекулярный PSMA лиганд является ковалентно связанным с ПЭГ. В другом варианте воплощения ПЭГ является связанным с DSPE, который осуществляет самосборку с PLGA, и низкомолекулярный PSMA лиганд является ковалентно связанным с ПЭГ. В другом варианте воплощения отношение амфифильного соединения к полимеру находится в пределах от 14:1 до 34:1 в расчете на массу. В другом варианте воплощения изобретение включает наночастицу, включающую 1) полимерную матрицу, включающую биоразлагаемый полимер; 2) амфифильное соединение или слой, который окружает или является диспергированным в полимерной матрице с образованием непрерывной или прерывистой оболочки для частицы; 3) полимер и 4) присоединенный путем ковалентного связывания низкомолекулярный PSMA лиганд, где диаметр наночастицы находится в пределах 40-80 нм, и где отношение амфифильного соединения к полимеру находится в пределах от 14:1 до 34:1 в расчете на массу. В другом варианте воплощения изобретение включает наночастицу, включающую 1) полимерную матрицу, включающую биоразлагаемый полимер; 2) лецитин; 3) полимер и 4) присоединенный путем ковалентного связывания низкомолекулярный PSMA лиганд. В другом варианте воплощения изобретение включает наночастицу, включающую 1) полимерную матрицу, включающую биоразлагаемый полимер; 2) лецитин; 3) полимер и 4) присоединенный путем ковалентного связывания низкомолекулярный PSMA лиганд, где диаметр наночастицы находится в пределах 40-80 нм, и где отношение лецитина к полимеру находится в пределах от 14:1 до 34:1 в расчете на массу. В другом варианте воплощения изобретение включает наночастицу, включающую 1) полимерную матрицу, включающую биоразлагаемый полимер; 2) смесь двух или более амфифильных соединений, выбранных из фосфатидилхолина, фосфатидилинозита, фосфатидилэтаноламина и фосфатидиновой кислоты; 3) полимер и 4) присоединенный путем ковалентного связывания низкомолекулярный PSMA лиганд. В следующем варианте воплощения изобретение включает наночастицу, включающую 1) полимерную матрицу, включающую биоразлагаемый полимер; 2) смесь трех или более амфифильных соединений, выбранных из фосфатидилхолина, фосфатидилинозита, фосфатидилэтаноламина и фосфатидиновой кислоты; 3) полимер и 4) присоединенный путем ковалентного связывания низкомолекулярный PSMA лиганд. Еще в одном варианте воплощения изобретение включает наночастицу, включающую 1) полимерную матрицу, включающую биоразлагаемый полимер; 2) амфифильное соединение или слой, который окружает или является диспергированным в полимерной матрице с образованием непрерывной или прерывистой оболочки для частицы; 3) полиэтиленгликоль и 4) присоединенный путем ковалентного связывания низкомолекулярный PSMA лиганд. В другом варианте воплощения изобретение включает наночастицу, включающую 1) полимерную матрицу,включающую биоразлагаемый полимер; 2) лецитин; 3) полиэтиленгликоль и 4) присоединенный путем ковалентного связывания низкомолекулярный PSMA лиганд. В другом варианте воплощения изобретение включает наночастицу, включающую 1) полимерную матрицу, включающую биоразлагаемый полимер; 2) смесь двух или более амфифильных соединений, выбранных из фосфатидилхолина, фосфатидилинозита, фосфатидилэтаноламина и фосфатидиновой кислоты; 3) полиэтиленгликоль и 4) присоединенный путем ковалентного связывания низкомолекулярный PSMA лиганд. В одном варианте воплощения изобретение включает наночастицу, включающую 1) полимерную матрицу, включающую биоразлагаемый полимер; 2) лецитин; 3) полиэтиленгликоль и 4) присоединенный путем ковалентного связывания низкомолекулярный PSMA лиганд, где диаметр наночастицы находится в пределах 40-80 нм, и где отношение лецитин к полимеру находится в пределах от 14:1 до 34:1 в расчете на массу. В некоторых вариантах воплощения биоразлагаемый полимер представляет собой PLGA. В других вариантах воплощения полимер представляет собой ПЭГ. Терапевтические средства. В соответствии с настоящим изобретением любые средства ("полезная нагрузка"), включая, например терапевтические средства (например, противораковые средства), диагностические средства (например, контрастные средства; радионуклиды и флуоресцентные, люминесцентные и магнитные частицы),профилактические средства (например, вакцины) и/или питательные вещества (например, витамины,минералы и т.д.), могут доставляться наночастицами по настоящему изобретению. Примеры средств,доставку которых можно обеспечить в соответствии с настоящим изобретением, включают, но не ограничиваются этим, малые молекулы (например, цитотоксические средства), нуклеиновые кислоты (например, средства на основе siPHK, PHKi и микроРНК), белки (например, антитела), пептиды, липиды,углеводы, гормоны, металлы, радиоактивные элементы и соединения, лекарственные средства, вакцины,иммунологические средства и т.д. и/или их сочетания. В некоторых вариантах воплощения средство,доставку которого нужно осуществить, представляет собой средство, полезное для лечения рака (например, рака предстательной железы). Например, таргетирующая составляющая может направлять частицу или заставлять ее локализоваться на конкретных участках в организме субъекта, и полезная нагрузка может быть доставлена к этим участкам. В конкретном варианте воплощения лекарственное средство или другая полезная нагрузка может высвобождаться путем контролируемого высвобождения из частицы и имеет возможность локально взаимодействовать с конкретным участком-мишенью (например, опухолью). Термин "контролируемое высвобождение" (и варианты этого термина), как используется в настоящем описании (например, в контексте "системы контролируемого высвобождения"), в общем смысле включает высвобождение вещества(например, лекарственного средства) на избранном участке или же с контролируемой скоростью, интервалом и/или количеством. Контролируемое высвобождение охватывает, но не обязательно ограничивается этим, по существу, непрерывную доставку, доставку по определенному образцу (например, прерывистую доставку в течение определенного периода времени, которая прерывается регулярными или нерегулярными временными интервалами) и доставку болюса выбранного вещества (например, в виде предварительно определенного дискретного количества вещества в течение относительно короткого периода времени (например, несколько секунд или минут. Например, таргетирующая составляющая может заставлять частицы локализоваться к опухоли,участку заболевания, ткани, органу, типу клеток и т.д. в организме субъекта в зависимости от используемой таргетирующей составляющей. Например, низкомолекулярный PSMA лиганд может локализоваться на раковых клетках предстательной железы. Субъект может представлять собой человека или животное. Примеры субъектов включают, но не ограничиваются этим, млекопитающее, такое как собака, кошка,лошадь, осел, кролик, корова, свинья, овца, коза, крыса, мышь, морская свинка, хомяк, обезьяна, человек или т.п. В одной группе вариантов воплощения полезная нагрузка представляет собой лекарственное средство или сочетание более чем одного лекарственного средства. Такие частицы могут быть полезными,например, в вариантах воплощения, где таргетирующую составляющую можно использовать для направления частицы, содержащей лекарственное средство, на конкретное местоположение в организме субъекта, например для обеспечения возможности локализованной доставки лекарственного средства. Примеры терапевтических средств включают химиотерапевтические средства, такие как доксорубицин(таксотер), альдеслейкин, аспарагиназа, бусульфан, карбоплатин, кладрибин, камптотецин, СРТ-11, 10 гидрокси-7-этилкамптотецин (SN38), дакарбазин, S-I капецитабин, фторафур, 5'-дезоксифторуридин,UFT, енилурацил, дезоксицитидин, 5-азацитозин, 5-азадезоксицитозин, аллопуринол, 2-хлораденозин,триметрексат, аминоптерин, метилен-10-деазааминоптерин (MDAM), оксаплатин, пикоплатин, тетраплатин, сатраплатин, платинум-DACH, ормаплатин, CI-973, JM-216 и его аналоги, эпирубицин, этопозид фосфат, 9-аминокамптотецин, 10,11-метилендиоксикамптотецин, каренитецин, 9-нитрокамптотецин,TAS 103, виндезин, L-фенилаланин иприт, ифосфамидмефосфамид, перфосфамид, трофосфамид кармустин, семустин, эпотилоны А-Е, томудекс, 6-меркаптопурин, 6-тиогуанин, амсакрин, этопозид фосфат,каренитецин, ацикловир, валацикловир, ганцикловир, амантадин, римантадин, ламивудин, зидовудин,бевацизумаб, трастузумаб, ритуксимаб, 5-фторурацил и их сочетания. Неограничивающие примеры потенциально подходящих лекарственных средств включают противораковые средства, включающие, например, доцетаксел, митоксантрон и митоксантрон гидрохлорид. В другом варианте воплощения полезная нагрузка может представлять собой противораковое лекарственное средство, такое как 20-эпи-1, 25 дигидрокси витамин D3, 4-ипомеанол, 5-этинилурацил, 9 дигидротаксол, абиратерон, ацивицин, акларубицин, акодазол гидрохлорид, акронин, ацилфиилвен, адеципенол, адозелесин, альдеслейкин, антагонисты all-tk, алтретамин, амбамустин, амбомицин, аметантрон ацетат, амидокс, амифостин, аминоглутетимид, аминолевулиновую кислоту, амрубицин, амсакрин, анагрелид, анастрозол, андрографолид, ингибиторы ангиогенеза, антагонист D, антагонист G, антареликс,антрамицин, антидорсализирующий морфогенетический белок-1, антиэстроген, антинеопластон, антисмысловые олигонуклеотиды, афидиколин глицинат, модуляторы гена апоптоза, регуляторы апоптоза,- 21023175BRC/ABL, брефлат, бреквинар натрий, бропиримин, будотитан, бусульфан, бутионин сульфоксимин,кактиномицин, кальципотриол, калфостин С, калустерон, производные камптотецина, канарипокс IL-2,капецитабин, карацераид, карбетимер, карбоплатин, карбоксамидаминотриазол, карбоксиамидотриазол,карест М 3, кармустин, еарн 700, ингибитор, выделенный их хряща, карубицин гидрохлорид, карцелезин,ингибиторы казеинкиназы, кастаноспермин, цекропин В, цедефингол, цетрореликс, хлорамбуцил, хлорины, хлорхиноксалин сульфонамид, цикапрост, циролемицин, цисплатин, цис-порфирин, кладрибин, аналоги кломифена, клотримазол, коллисмицин А, коллисмицин В, комбретастатин А 4, аналог комбретастатина, конагенин, крамбесцидин 816, криснатол, криснатол мезилат, криптофицин 8, производные криптофицина А, курацин А, циклопентантрахиноны, циклофосфамид, циклоплатам, ципемицин, цитарабин,цитарабин окфосфат, цитолитический фактор, цитостатин, дакарбазин, дакликсимаб, дактиномицин, даунорубицин гидрохлорид, децитабин, дегидродидемнин В, деслорелин, дексифосфамид, дексормаплатин, дексразоксан, дексверапамил, дезагуанин, дезагуанин мезилат, диазиквон, дидемнин В, дидокс, диэтигиорспермин, дигидро-5-азацитидин, диоксамицин, дифенил спиромустин, доцетаксел, доконазол,доласетрон, доксифлуридин, доксорубицин, доксорубицин гидрохлорид, дролоксифен, дролоксифен цитрат, дромостанолон пропионат, дронабинол, дуазомицин, дуоканницин SA, эбселен, экомустин, эдатрексат, эделфосин, эдреколомаб, эфломитин, эфломитин гидрохлорид, элемене, элсарнитруцин, эмитефур, энлоплатин, энпромат, эпипропидин, эпирубицин, эпирубицин гидрохлорид, эпристерид, эрбулозол,векторную систему эритроцитной генной терапии, эзорубицин гидрохлорид, эстрамустин, аналог эстрамустина, натрий эстрамустинфосфат, агонисты эстрогена, антагонисты эстрогена, этанидазол, этопозид,этопозид фосфат, этоприн, эксеместан, фадрозол, фадрозол гидрохлорид, фазарабин, фентретинид, филграстим, финастерид, флавопиридол, флезеластин, флоксиридин, флуастерон, флударабин, флударабин фосфат, фтордаунорубицин гидрохлорид, фторурацил, флуроцитабин, форфенимекс, форместан, фосквидон, фостриецин, фостриецин натрий, фотемустин, гадолиний тексафирин, нитрат галлия, галоцитабин, ганиреликс, ингибиторы желатиназы, гемцитабин, гемцитабин гидрохлорид, ингибиторы глутатиона, гепсульфам, герегулин, гексаметилен бисацетамид, гидроксимочевину, гиперицин, ибандроновую кислоту, идарубицин, идарубицин гидрохлорид, идоксифен, идрамантон, ифосфамид, игнофосин, иломастат, имидазоакридоны, имиквимод, иммуностимулирующие пептиды, ингибитор рецептора инсулиноподобного ростового фактора-1, агонисты интерферона, интерферон альфа-2 А, интерферон альфа-2 В,интерферон альфа-N1, интерферон альфа-N3, интерферон бета-1 А, интерферон гамма-IB, интерфероны,интерлейкины, иобенгуан, иододоксорубицин, ипроплатм, иринотекан, иринотекан гидрохлорид, иропласт, ирсогладин, изобенгазол, изогомогаликондрин В, итасетрон, иасплакинолид, кахалалил F, ламелларин-N триацетат, лантреотид, лантреотид ацетат, лейнамицин, ленограстим, лентинан сульфат, лепролстатин, летрозол, лейкоз-ингибирующий фактор, лейкоцитарный альфа интерферон, леупролид ацетат, леупролид/эстроген/прогестерон, леупрорелин, левамизол, лиарозол, лиарозол гидрохлорид, линейный полиаминовый аналог, липофильный дисахаридный пептид, липофильные платиновые соединения,лиссоклинамид, лобаплатин, ломбрицин, лометрексол, лометрексол натрий, ломустин, лонидамин, лосоксантрон, лосоксантрон гидрохлорид, ловастатин, локсорибин, луртотекан, лютециум тексафирин лизофиллин, литические пептиды, мейтансин, манностатин А, маримастат, масопрокол, маспин, ингибиторы матрилизина, ингибиторы металлопротеиназы матрикса, майтансин, мехлоретамин гидрохлорид, мегестрол ацетат, меленгестрол ацетат, мелфалан, меногарил, мербарон, меркаптопурин, метерелин, метиониназу, метотрексат, метотрексат натрий, метоклопрамид, метоприн, метуридепа, ингибиторы микроводорослевой протеинкиназы С, ингибитор MIF, мифепристон, милтефосин, миримостим, ошибочно спаренную двухцепочечную РНК, митиндомид, митокарцин, митокромин, митогиллин, митогуазон, митолактол, митомальцин, митомицин, аналоги митомицина, митонафид, митоспер, митотан, митотоксиновый фактор роста фибробластов-сапорин, митоксантрон, митоксантрон гидрохлорид, мофаротен, молграмостин, моноклональное антитело, человеческий хорионический гонадотропин, монофосфориллипидa/SK миобактериальной клеточной оболочки, мопидамол, ингибитор гена множественной лекарственной резистентности, терапевтическое средство на основе супрессора 1 различных опухолей, противораковое средство на основе иприта, микапероксид В, экстракт микобактериальной клеточной оболочки, микофеноловую кислоту, мириапорон, н-ацетилдиналин, нафарелин, нагрестип, налоксон/пентазоцин, напавин,нафтерпин, нартограстим, недаплатин, неморубицин, неридроновую кислоту, нейтральную эндопептидазу, нилутамид, нисамицин, модуляторы оксида азота, нитроксидный антиоксидант, нитруллин, нокодазол, ногаламицин, н-замещенные бензамиды, 06-бензилгуанин, октреотид, окицерон, олигонуклеотиды,онапристон, ондансетрон, орацин, пероральный индуктор цитокинов, ормаплатин, осатерон, оксалиплатин, оксауномицин, оксисуран, паклитаксел, аналоги паклитаксела, производные паклитаксела, палауамин, пальмитоилризоксин, памидроновую кислоту, панакситриол, паномифен, парабактин, пазеллиптин,- 22023175 пегаспаргазу, пелдесин, пелиомицин, пентамустин, пентосан полисульфат натрия, пентостатин, пентрозол, пепломицин сульфат, перфлуброн, перфосфамид, периллиловый спирт, феназиномицин, фенилацетат, ингибиторы фосфатазы, пицибанил, пилокарпин гидрохлорид, пипоброман, пипосульфан, пирарубицин, пиритрексим, пироксантрон гидрохлорид, плацетин А, плацетин В, ингибитор активатора плазминогена, комплекс платины, соединения платины, платина-триаминовый комплекс, пликамицин, пломестан, порфимер натрий, порфиромицин, преднимустин, прокарбазин гидрохлорид, пропил бис-акридон,простагландин J2, антиандроген карциномы простаты, ингибиторы протеасомы, иммуномодулятор на основе белка А, ингибитор протеинкиназы С, ингибиторы протеинтирозинфосфатазы, ингибиторы пуриннуклеозидфосфорилазы, пуромицин, пуромицин гидрохлорид, пурпурины, пиразорурин, пиразолоакридин, пиридоксилированный гемоглобин-полиоксиэтиленовый конъюгат, антагонисты RAF, ралтитрексед, рамосетрон, ингибиторы фарнезилпротеинтрансферазы RAS, ингибиторы RAS, ингибитор RASGAP, деметилированный рателлиптин, рений RE 18 6 этидронат, ризоксин, рибоприн, рибозимы, RH ретинарнид, PHKi, роглетимид, рогитукин, ромуртид, роквинимекс, рубигинон В 1, рубоксил, сафингол,сафингол гидрохлорид, сайнтопин, саркну, саркофитол А, сарграмостим, SDI1 миметики, семустин, ингибитор старения 1, смысловые олигонуклеотиды, ингибиторы сигнальной трансдукции, модуляторы сигнальной трансдукции, семтразен, белок, связывающийся с одноцепочечным антигеном, сизофиран,собузоксан, натрий борокаптат, натрий фенилацетат, солверол, белок, связывающийся с соматомедином,сонермин, спарфосат натрий, спарфосовую кислоту, спарсомицин, спикамицин D, спирогерманий гидрохлорид, спиромустин, спироплатин, спленопентин, спонгистатин 1, скваламин, ингибитор стволовых клеток, ингибиторы деления стволовых клеток, стипиамид, стрептонигрин, стрептозоцин, ингибиторы стромелизина, сульфиносин, сулофенур, суперактивный вазоактивный кишечный пептидный антагонист,сурадиста, сурамин, свайнсонин, синтетические гликозаминогликаны, тализомицин, таллимустин, тамоксифен метиодид, тауромустин, тазаротен, текогалан натрий, тегафур, теллурапирилиум, ингибиторы теломеразы, телоксантрон гидрохлорид, темопорфин, темозоломид, тенипозид, тероксирон, тестолактон,тетрахлордекаоксид, тетразомин, талибластин, талидомид, тиамиприн, тиокоралин, тиогуанин, тиотепа,тромбопоэтин, миметик тромбопоэтина, тималфасин, агонист рецептора тимопоэтина, тимотрианан, тиреотропный гормон, тиазофурин, оловоэтилэтиопурпурин, тирапазамин, титаноцен дихлорид, топотекан гидрохлорид, топсентин, торемифен, торемифен цитрат, тотипотентный фактор стволовых клеток, ингибиторы трансляции, трестолон ацетат, третионин, триацетилуридин, трицирибин, трицирибин фосфат,триметрексат, триметрексат глюкуронат, трипторелин, трописетрон, тубулозол гидрохлорид, туростерид,ингибиторы тирозинкиназы, тирфостины, ингибиторы UBC, убенимекс, урацилиприт, уридепа, фактор ингибирования роста урогенитального синуса, антагонисты рецептора урокиназы, вапреотид, вариолин В, веларесол, верамин, вердинс, вертепорфин, винбластин сульфат, винкристин сульфат, виндезин, виндезин сульфат, винепидин сульфат, винглицинат сульфат, винлеуросин сульфат, винорелбин, винорелбин тартрат, винрозидин сульфат, винксалтин, винзолидин сульфат, витаксин, вопозол, занотерон, зениплатин, зиласкорб, зиностатин, зиностатиновый стиламер или зорубицин гидрохлорид. Получив конъюгаты в соответствии с настоящим изобретением, их можно объединить с фармацевтически приемлемыми носителями для получения фармацевтической композиции в соответствии с еще одним аспектом настоящего изобретения. Как должно быть понятно специалистам в данной области,носители могут быть выбраны с учетом пути введения, как описано ниже, местоположения объекта, на который направлено действие, лекарственного средства, подлежащего доставке, времени, в течение которого нужно осуществить доставку лекарственного средства, и т.д. В одном варианте воплощения наночастицы по настоящему изобретению содержат нуклеиновые кислоты, такие как siPHK. Предпочтительно молекула siPHK имеет длину около 10-50 или более нуклеотидов. Более предпочтительно молекула siPHK имеет длину около 15-45 нуклеотидов. Еще более предпочтительно молекулаsiPHK имеет длину около 19-40 нуклеотидов. И еще более предпочтительно молекула siPHK имеет длину около 21-23 нуклеотидов.siPHK по настоящему изобретению предпочтительно опосредует PHKi против мРНК мишени. Молекула siPHK может быть рассчитана таким образом, чтобы каждый остаток был комплементарным остатку в молекуле-мишени. Альтернативно, можно осуществить одно или несколько замещений в молекуле для повышения стабильности и/или усиления процессинговой активности указанной молекулы. Замещения могут быть осуществлены внутри цепи или могут быть осуществлены по остаткам на концах цепи. Реакция расщепления мРНК мишени, направляемая молекулами siPHK, является последовательность-специфической. Как правило, siPHK, имеющие нуклеотидную последовательность, идентичную части гена-мишени, являются предпочтительными для ингибирования. Однако для осуществления настоящего изобретения не требуется 100% идентичность последовательностей между siPHK и геноммишенью. Возможны вариации последовательностей, включая те, которые могут быть ожидаемыми в результате генетической мутации, штаммового полиморфизма или эволюционной дивергенции. Например, было обнаружено, что последовательности siPHK с вставками, делециями и точечными мутациями относительно последовательности-мишени также являются эффективными для ингибирования. Альтер- 23023175 нативно, последовательности siPHK с замещениями нуклеотидными аналогами или вставками могут быть эффективными для ингибирования. Более того, не все положения siPHK в равной мере способствуют распознаванию мишени. Ошибочные спаривания в центре siPHK являются наиболее критическими и, по существу, устраняют деградацию являющейся мишенью РНК. В отличие от этого, 3'-нуклеотиды в siPHK не способствуют каким-либо существенным образом специфичности распознавания мишени. Как правило, остатки по 3'-концу последовательности siPHK, которая является комплементарной РНК-мишени (например, направляющая последовательность), не являются критическими для деградации являющейся мишенью РНК. Идентичность последовательностей легко можно определить путем сравнения последовательностей и при помощи алгоритмов выравнивания, известных из уровня техники. Для определения процента идентичности двух нуклеиновокислотных последовательностей (или двух аминокислотных последовательностей) последовательности выравнивают для оптимального сравнения (например, можно внести пробелы в первую последовательность или вторую последовательность для оптимального выравнивания). Затем осуществляют сравнение нуклеотидов (или аминокислотных остатков) в соответствующих положениях нуклеотидов (или аминокислот). Когда положение в первой последовательности занято тем же остатком,как в соответствующем положении во второй последовательности, тогда молекулы являются идентичными в этом положении. Процент идентичности между двумя последовательностями является функцией количества идентичных положений для этих последовательностей (т.е. % гомологии=количество идентичных положений/общее количество положений 100) с необязательным "штрафом" за количество введенных пробелов и/или длину введенных пробелов. Сравнение последовательностей и определение процента идентичности между двумя последовательностями можно осуществить с использованием математического алгоритма. В одном варианте воплощения выравнивание осуществляют по определенной части выравниваемой последовательности,имеющей достаточную идентичность, но не по тем частям, которые имеют низкую степень идентичности(т.е. локальное выравнивание). Предпочтительным неограничивающим примером алгоритма локального выравнивания, используемого для сравнения последовательностей, является алгоритм Karlin и AltschulProc. NatL Acad. Sci. USA 90:5873. Такой алгоритм включен в BLAST программы (версия 2.0) Altschul, etal. (1990) J Mol Biol. 215:403-10. В другом варианте воплощения выравнивание оптимизируют путем введения соответствующих пробелов, и процент идентичности определяют по длине выровненных последовательностей (т.е. выравнивание с пробелами). Для получения выравниваний с пробелами для сравнительных целей можно использовать Gapped BLAST, как описано в Altschul et al., (1997) Nucleic Acids Res. 25(17):3389. В другом варианте воплощения выравнивание оптимизируют путем введения соответствующих пробелов, и процент идентичности определяют по всей длине последовательностей, которые подлежат выравниванию(т.е. глобальное выравнивание). Предпочтительным неограничивающим примером математического алгоритма, используемого для глобального сравнения последовательностей, является алгоритм Myers иMiller, CABIOS (1989). Такой алгоритм включен в ALIGN программу (версия 2.0), которая является частью пакета программ GCG для выравнивания последовательностей. При использовании ALIGN программы для сравнения аминокислотных последовательностей можно использовать таблицу РАМ 120 массы остатков, "штраф" за длину пробелов=12 и "штраф" за пробелы=4. Предпочтительной является идентичность последовательностей больше чем 90%, например идентичность последовательностей 91, 92, 93, 94, 95, 96, 97, 98, 99% или даже 100%, между siPHK и частью мPHK-мишени. Альтернативно, siPHK может быть функционально определена как нуклеотидная последовательность (или олигонуклеотидная последовательность), которая способна гибридизоваться с частью транскрипта мРНК-мишени (например, в условиях гибридизации 400 мМ NaCl, 40 мМ PIPES pH 6,4, 1 мМ EDTA, 50 или 70 С в течение 12-16 ч с последующей промывкой). Дополнительные условия гибридизации включают гибридизацию при 70 С в 1SSC или 50 С в 1SSC, 50% формамида с последующей промывкой при 70 С в 0,3SSC или гибридизацию при 70 С в 4SSC или 50 С в 4SSC, 50% формамида с последующей промывкой при 67 С в lSSC. Температура гибридизации для гибридов, которые, как ожидают, должны быть меньше чем 50 пар оснований в длину, должна быть на 5-10 С меньше, чем температура плавления (Тпл) гибрида, где Тпл определяют в соответствии со следующими уравнениями. Для гибридов меньше чем 18 пар оснований в длину Тпл (С)=2 (количество А+Т оснований)+4(количество G+C оснований). Для гибридов, имеющих длину в пределах от 18 до 49 пар оснований, Тпл (С)=81,5+16,6(log10[Na+])+0,41 (%G+C)-(600/N), где N представляет количество оснований в гибриде, и [Na+] представляет концентрацию ионов натрия в гибридизационном буфере ([Na+] дляlSSC=0,165M). Дополнительные примеры жесткости условий для гибридизации полинуклеотидов представлены в Sambrook J., E.F. Fritsch and T. Maniatis, 1989, Molecular Cloning: A Laboratory Manual, ColdBiology, 1995, F.M. Ausubel et al., eds., John WileySons, Inc., sections 2,10 and 6,3-6,4, включенных в настоящую заявку посредством ссылки. Длина идентичных нуклеотидных последовательностей может быть, по меньшей мере, около или примерно около 10, 12, 15, 17, 20, 22, 25, 27, 30, 32, 35, 37, 40, 42, 45,47 или 50 оснований. В одном варианте воплощения молекулы siPHK по настоящему изобретению являются модифицированными для улучшения стабильности в сыворотке или в питательной среде для клеточных культур. Для повышения стабильности 3'-остатки могут быть стабилизированы против разложения, например они могут быть выбраны так, чтобы они состояли из пуриновых нуклеотидов, в частности аденозиновых или гуанозиновых нуклеотидов. Альтернативно, замещение пиримидиновых нуклеотидов модифицированными аналогами, например, замещение уридина 2'-дезокситимидином является допустимым и не влияет на эффективность РНК интерференции. Например, отсутствие 2'-гидроксила может существенно повышать резистентность к нуклеазе молекул siPHK в среде с культурой ткани. В другом варианте воплощения настоящего изобретения молекула siPHK может содержать по меньшей мере один модифицированный нуклеотидный аналог. Нуклеотидные аналоги могут быть расположены в положениях, где мишень-специфическая активность, например PHKi опосредуемая активность, по существу, не подвергается влиянию, например, в области 5'-конца и/или 3'-конца молекулы РНК. В частности, эти концы могут быть стабилизированы путем включения модифицированных нуклеотидных аналогов. Нуклеотидные аналоги включают модифицированные по группе сахара и/или основной цепи рибонуклеотиды (т.е. включают модификации фосфат-сахарной основной цепи). Например, фосфодисложноэфирные связи природной РНК могут быть модифицированы таким образом, чтобы они включали по меньшей мере один из гетероатомов азота или серы. В предпочтительных имеющих модификацию в основной цепи рибонуклеотидах группа сложного фосфоэфира, соединяющая смежные рибонуклеотиды,замещена модифицированной группой, например фосфотиоатной группой. В предпочтительных сахармодифицированных рибонуклеотидах 2'ОН-группа замещена группой, выбранной из Н, OR, R, галогена,SH, SR, NH2, NHR, NR2 или NO2, где R представляет собой С 1-С 6 алкил, алкенил или алкинил, и галоген представляет собой F, Cl, Br или I. Нуклеотидные аналоги также включают нуклеооснование - модифицированные рибонуклеотиды,т.е. рибонуклеотиды, содержащие по меньшей мере одно не встречающееся в природе нуклеооснование вместо природного нуклеооснования. Основания могут быть модифицированы для блокирования активности аденозиндезаминазы. Примеры модифицированных нуклеооснований включают, но не ограничиваются этим, уридин и/или цитидин, модифицированный в 5-положении, например 5-(2 амино)пропилуридин, 5-бромуридин; аденозин и/или гуанозины, модифицированные в 8 положении,например 8-бромгуанозин; деазануклеотиды, например 7-деаза-аденозин; О- и N-алкилированные нуклеотиды, например N6-метиладенозин, являются подходящими. Следует отметить, что указанные выше модификации можно сочетать. РНК можно получить ферментативным путем или путем частичного/общего органического синтеза,любой модифицированный рибонуклеотид можно ввести посредством in vitro ферментативного или органического синтеза. В одном варианте воплощения siPHK получают химическим путем. Способы синтеза молекул РНК известны из уровня техники, в частности способы химического синтеза, описанные вVerina and Eckstein (1998), Annul Rev. Biochem. 67:99. В другом варианте воплощения siPHK получают ферментативным путем. Например, siPHK можно получить путем ферментативного процессинга длинной двухцепочечной РНК, имеющей достаточную комплементарность с желаемой мРНК, которая является мишенью. Процессинг длинноцепочечной РНК можно осуществить in vitro, например, с использованием подходящих клеточных лизатов, и siPHK могут быть затем очищены методом гель-электрофореза или гель-фильтрации. siPHK затем может быть денатурирована в соответствии со способами, известными из уровня техники. В иллюстративном варианте воплощения siPHK может быть очищена из смеси путем экстракции с использованием растворителя или смолы, осаждения, электрофореза, хроматографии или с использованием сочетания этих методов. Альтернативно, siPHK можно использовать без какойлибо или с использованием минимальной очистки для избежания потерь в результате процессинга образца. Альтернативно, siPHK также могут быть получены путем ферментативной транскрипции из синтетических ДНК матриц или из ДНК плазмид, выделенных из рекомбинантных бактерий. Типично используют фаговые РНК полимеразы, такие как Т 7, Т 3 или SP6 РНК полимераза (Milligan and Uhlenbeck (1989)Methods EnzynioL 180:51-62). РНК можно высушить для хранения или растворить в водном растворе. Раствор может содержать буферы или соли для ингибирования гибридизации и/или промотирования стабилизации двойных цепей. Коммерчески доступные инструменты для моделирования и наборы, например, которые доступны от Ambion, Inc. (Austin, TX) и the Whitehead Institute of Biomedical Research at MIT (Cambridge, MA),обеспечивают возможность конструирования и продукции siPHK. В качестве примера желаемую последовательность мРНК можно ввести в программу последовательностей, которая будет создавать смысловые и антисмысловые целевые цепочки последовательностей. Эти последовательности затем можно ввести в программу, которая определяет смысловые и антисмысловые олигонуклеотидные матрицы siPHK. Эти программы также можно использовать для добавления, например вставок "шпилек" или Т 1 промоторных праймерных последовательностей. Наборы также можно затем использовать для создания кассет экспрессии siPHK. В различных вариантах воплощения siPHK синтезируют in vivo, in situ и in vitro. Эндогенная РНК полимераза клетки может опосредовать транскрипцию in vivo или in situ, или клонированную РНК полимеразу можно использовать для транскрипции in vivo или in vitro. Для транскрипции из трансгена in vivo или экспрессирующей конструкции регуляторную область (например, промотор, энхансер, сайленсер,сплайсинг донор и акцептор, полиаденилирование) можно использовать для транскрипции siPHK. Ингибирование можно направлять путем специфической транскрипции в органе, ткани или типе клеток; путем стимуляции окружающих условий (например, инфекции, стресса, температуры, химических индукторов); и/или использования инженерии для осуществления транскрипции на стадии или в период развития. Трансгенный организм, который экспрессирует siPHK из рекомбинантной конструкции, можно получить путем введения такой конструкции в зиготу, эмбриональную стволовую клетку или другую обладающую множественной активностью клетку, выделенную из соответствующего организма. В одном варианте воплощения являющаяся мишенью мРНК по настоящему изобретению определяет аминокислотную последовательность по меньшей мере одного белка, такого как клеточный белок (например, ядерного, цитоплазматического, трансмембранного или связанного с мембраной белка). В другом варианте воплощения являющаяся мишенью мРНК по настоящему изобретению определяет аминокислотную последовательность внеклеточного белка (например, белка внеклеточного матрикса или секретируемого белка). Как используется в настоящем описании, фраза "определяет аминокислотную последовательность" белка означает, что мРНК последовательность транслируется в аминокислотную последовательность в соответствии с правилами генетического кода. Следующие классы белков перечислены в иллюстративных целях: белки развития (например, молекулы адгезии, ингибиторы циклинкиназы, члены семейства Wnt, члены семейства Pax, члены семейства Winged helix, члены семейства Нох,цитокины/лимфокины и их рецепторы, факторы роста/дифференциации и их рецепторы, нейротрансмиттеры и их рецепторы); онкоген-кодируемые белки (например, ABLI, BCL1, BCL2, BCL6, CBFA2, CBL,CSFIR, ERBA, ERBB, EBRB2, ERBB2, ERBB3, ETSI, ETV6, FGR, FOS, FYN, HCR, HRAS, JUN, KRAS,LCK, LYN, MDM2, MLL, MYB, MYC, MYCLI, MYCN, NRAS, PIM 1, PML, RET, SRC, TALI, TCL3 иYES); опухоль-супрессорные белки (например, АРС, BRCA1, BRCA2, MADH4, MCC, NF1, NF2, RB 1,ТР 53 и WTI); и ферменты (например, АСС синтазы и оксидазы, АСР десатуразы и гидроксилазы, ADP глюкоза-пирофорилазы, ацетилазы и деацетилазы, АТФазы, дегидрогеназы спиртов, амилазы, амилоглюкозидазы, каталазы, целлюлазы, халкон-синтазы, хитиназы, циклооксигеназы, декарбоксилазы, декстриназы, ДНК и РНК полимеразы, галактозидазы, глюканазы, глюкоза-оксидазы, гранулосвязанные крахмал-синтазы, GTP азы, геликазы, геимцеллюлазы, интегразы, инулиназы, инвертазы, изомеразы, киназы,лактазы, липазы, липоксигеназы, лизозимы, нопалинсинтазы, октопинсинтазы, пектинэстеразы, пероксидазы, фосфатазы, фосфолипазы, фосфорилазы, фитазы, синтазы регулятора роста растений, полигалактуроназы, протеиназы и пептидазы, пулланазы, рекомбиназы, обратные транскриптазы, RUBISCOs, топоизомеразы и ксиланазы), белки, вовлеченные в рост опухоли (включая васкуляризацию) или в метастатическую активность или потенциал, включая клеточно-поверхностные рецепторы и лиганды, а также секретируемые белки, белки регуляции клеточного цикла, регуляции генов и регуляции апоптоза, белки регуляции иммунного ответа, воспаления, комплемента или коагуляции. Как используется в настоящем описании, термин "онкоген" относится к гену, который стимулирует клеточный рост, и, когда его уровень экспрессии в клетке снижается, скорость клеточного роста снижается, или клетка принимает состояние покоя. В контексте настоящего изобретения онкогены включают внутриклеточные белки, а также внеклеточные ростовые факторы, которые могут стимулировать клеточную пролиферацию через аутокринную или паракринную функцию. Примеры человеческих онкогенов, против которых могут быть направлены siPHK и морфолиноконструкции, включают, среди прочих,c-myc, c-myb, mdm2, PKA-I (протеинкиназа А типа I), Abl-1, Bcl2, Ras, c-Raf киназу, CDC25 фосфатазы,циклины, циклинзависимые киназы (cdks), теломеразу, PDGF/sis, erb-B, fos, jun, mos и src. В контексте настоящего изобретения онкогены также включают гибридный ген, образованный в результате хромосомной транслокации, например Bcr/Abl гибридный онкоген. Следующие белки включают циклинзависимые киназы, c-myb, c-myc, пролиферирующий клеточноядерный антиген (PCNA), трансформирующий ростовой фактор-бета (TGF-бета) и транскрипционные факторы: ядерный фактор каппа В (NF-.каппа.В), E2F, HER-2/neu, PKA, TGF-альфа, EGFR, TGF-бета,IGFIR, P12, MDM2, BRCA, Bc1-2, VEGF, MDR, ферритин, рецептор трансферрина, гены IRE, C-fos,HSP27, C-raf и металлотионеина.siPHK, используемая в настоящем изобретении, может быть направлена против синтеза одного или нескольких белков. Дополнительно или альтернативно, может быть более одной siPHK, направленной против белка, например дублет siPHK или siPHK, которая соответствует перекрывающимся или неперекрывающимся являющимися мишенями последовательностям против одного и того же белка-мишени. Соответственно в одном варианте воплощения две, три, четыре или любое количество siPHK против одной и той же мРНК, которая является мишенью, могут быть включены в наночастицы по настоящему изобретению. Кроме того, можно использовать несколько siPHK, направленных против нескольких белков. Альтернативно, siPHK может быть направлена против структурных или регуляторных молекул РНК,которые не кодируют белки. В предпочтительном аспекте настоящего изобретения являющаяся мишенью молекула мРНК по настоящему изобретению определяет аминокислотную последовательность белка, ассоциированного с патологическим состоянием. Например, белок может представлять собой патоген-ассоциированный белок(например, вирусный белок, вовлеченный в иммуносупрессию или иммуноизбегание хозяина, репликацию патогена, трансмиссию патогена или поддержание инфекции) или белок хозяина, который способствует проникновению патогена в организм хозяина, метаболизму лекарственного средства патогеном или хозяином, репликации или интеграции генома патогена, установлению или распространению инфекции в организме хозяина или сборке следующего поколения патогена. Альтернативно, белок может представлять собой ассоциированный с опухолью белок или ассоциированный с аутоиммунным заболеванием белок. В одном варианте воплощения являющаяся мишенью молекула мРНК по настоящему изобретению определяет аминокислотную последовательность эндогенного белка (т.е. белка, присутствующего в геноме клетки или организма). В другом варианте воплощения являющаяся мишенью молекула мРНК по настоящему изобретению определяет аминокислотную последовательность гетерологичного белка, экспрессируемого в рекомбинантной клетке или генетически измененном организме. В другом варианте воплощения являющаяся мишенью молекула мРНК по настоящему изобретению определяет аминокислотную последовательность белка, кодируемого трансгеном (т.е. генной конструкцией, введенной на эктопическом участке в геном клетки). В следующем варианте воплощения являющаяся мишенью молекула мРНК по настоящему изобретению определяет аминокислотную последовательность белка, кодируемого патогенным геномом, который способен инфицировать клетку или организм, из которого происходит эта клетка. Путем ингибирования экспрессии таких белков можно получить ценную информацию, касающуюся функции указанных белков и терапевтических преимуществ, которые могут быть получены в результате указанного ингибирования. В одном варианте воплощения наночастица по настоящему изобретению включает одну или несколько молекул siPHK, опосредующих "молчание" PDGF бета гена, Erb-B гена, Src гена, CRK гена,GRB2 гена, RAS гена, MEKK гена, INK гена, RAF гена, Erk1/2 гена, PCNA(p21) гена, MYB гена, JIJN гена, FOS гена, BCL-2 гена, Циклин D гена, VEGF гена, EGFR гена, Циклин А гена, Циклин Е гена,WNT-I гена, гена бета-катенина, с-МЕТ гена, PKC гена, Skp2 гена, гена кинезинового веретенного белка,Bcr-Abl гена, Stat3 гена, cSrc гена, PKC гена, Вах гена, Вс 1-2 гена, EGFR гена, VEGF гена, myc гена,NFKB гена, STAT3 гена, гена сурвинина, Her2/Neu гена, гена топоизомеразы I, PLK1 гена, гена протеинкиназы 3, CD31 гена, IGF-1 гена, гена топоизомеразы II альфа, мутаций в р 73 гене, мутаций в р 21 (WAF 1/CIP 1) гене, мутаций в р 27(KIPl) гене, мутаций в PPM1D гене, мутаций в RAS гене, мутаций в гене кавеолина I, мутаций в MIB I гене, мутаций в MTAI гене, мутаций в М 68 гене, мутаций в опухольсупрессорных генах, мутаций в р 53 опухоль-супрессорном гене, мутаций в DN-р 63 - члене семейства р 53, мутаций в pRb опухоль-супрессорном гене, мутаций в APCl опухоль-супрессорном гене, мутаций вBRCAl опухоль-супрессорном гене, мутаций в PTEN опухоль-супрессорном гене, mLL слитого гена,BCRIABL слитого гена, TEL/AML1 слитого гена, EWS/FLI1 слитого гена, TLS/FUS1 слитого гена,PAX3/FKHR слитого гена, AML1/ET0 слитого гена, гена альфа v-интегрина, гена Fit-i рецептора, гена тубулина, гена вируса папилломы человека, гена, необходимого для репликации вируса папилломы человека, гена иммунодефицита человека, гена, необходимого для репликации вируса иммунодефицита человека, гена вируса гепатита А, гена, необходимого для репликации вируса гепатита А, гена вируса гепатита В, гена, необходимого для репликации вируса гепатита В, гена вируса гепатита С, гена, необходимого для репликации вируса гепатита С, гена вируса гепатита D, гена, необходимого для репликации вируса гепатита D, гена вируса гепатита Е, гена, необходимого для репликации вируса гепатита Е, гена вируса гепатита F, гена, необходимого для репликации вируса гепатита F, гена вируса гепатита G, гена,необходимого для репликации вируса гепатита G, гена вируса гепатита Н, гена, необходимого для репликации вируса гепатита Н, гена респираторно-синцитиального вируса, гена, необходимого для репликации респираторно-синцитиального вируса, гена вируса простого герпеса, гена, необходимого для репликации вируса простого герпеса, гена цитомегаловирусного герпеса, гена, необходимого для репликации цитомегаловируса герпеса, гена вируса герпеса Эпштейна-Барра, гена, необходимого для репликации вируса герпеса Эпштейна-Барра, гена вируса герпеса, ассоциированного с саркомой Калоши, гена, необходимого для репликации вируса герпеса, ассоциированного с саркомой Капоши, гена вируса JC, человеческого гена, необходимого для репликации вируса JC, гена миксовируса, гена, необходимого для репликации миксовируса, гена риновируса, гена, необходимого для репликации риновируса, гена коронавируса, гена, необходимого для репликации коронавируса, гена вируса Западного Нила, гена, необходимого для репликации вируса Западного Нила, гена вируса американского энцефалита, гена, необходимого для репликации вируса американского энцефалита, гена вируса клещевого энцефалита, гена, необходимого для репликации вируса клещевого энцефалита, гена вируса австралийского энцефалита, гена, необ- 27023175 ходимого для репликации вируса австралийского энцефалита, гена вируса денге, гена, необходимого для репликации вируса денге, гена вакуолизирующего обезьяньего вируса ОВ-40, гена, необходимого для репликации вакуолизирующего обезьяньего вируса ОВ-40, гена человеческого Т-клеточного лимфотропного вируса, гена, необходимого для репликации человеческого Т-клеточного лимфотропного вируса,гена вируса лейкоза Moloney-Murine, гена, необходимого для репликации вируса лейкоза MoloneyMurine, гена вируса энцефаломиокардита, гена, необходимого для репликации вируса энцефаломиокардита, гена вируса кори, гена, необходимого для репликации вируса кори, гена вируса опоясывающего лишая Vericella, гена, необходимого для репликации вируса опоясывающего лишая Vericella, гена аденовируса, гена, необходимого для репликации аденовируса, гена вируса желтой лихорадки, гена, необходимого для репликации вируса желтой лихорадки, гена вируса полиомиелита, гена, необходимого для репликации вируса полиомиелита, гена вируса оспы, гена, необходимого для репликации вируса оспы,гена plasmodium, гена, необходимого для репликации гена plasmodium, гена Mycobacterium ulcerans, гена,необходимого для репликации Mycobacterium ulcerans, гена Mycobacterium tuberculosis, гена, необходимого для репликации Mycobacterium tuberculosis, гена Mycobacterium leprae, -185-а, гена, необходимого для репликации Mycobacterium leprae, гена Staphylococcus aureus, гена, необходимого для репликацииStaphylococcus aureus, гена Streptococcus pneumoniae, гена, необходимого для репликации Streptococcuspneumoniae, гена Streptococcus pyogenes, гена, необходимого для репликации Streptococcus pyogenes, генаChlamydia pneumoniae, гена, необходимого для репликации Chlamydia pneumoniae, гена Mycoplasmapneumoniae, гена, необходимого для репликации Mycoplasma pneumoniae, гена интегрина, гена селектина, гена системы комплемента, гена хемокина, гена рецептора хемокина, GCSF гена, Gro1 гена, Gro2 гена, Gro3 гена, PF4 гена, MIG гена, гена основного белка про-тромбоцитов, MIP-11 гена, MIP-1J гена,RANTES гена, МСР-1 гена, МСР-2 гена, МСР-3 гена, CMBKR1 гена, CMBKR2 гена, CMBKR3 гена,CMBKR5v, AIF-1 гена, 1-309 гена, гена для компонента ионного канала, гена для рецептора нейротрансмиттера, гена для лиганда нейротрансмиттера, гена семейства амилоидов, гена пресенилина, HD гена,DRPLA гена, SCA1 гена, SCA2 гена, MJD1 гена, CACNL1A4 гена, SCA7 гена, SCA8 гена, аллельного гена, обнаруженного в LOH клетках, или одного аллельного гена из полиморфного гена. Примеры соответствующих молекул siPHK, обусловливающих "молчание" генов, и способы получения молекул siPHK можно найти в коммерческих источниках, таких как Dharmacon, или в следующих патентных заявках:US 2005017667, WO 2006066158, WO 2006078278, US 7056704, US 7078196, US 5898031, US 6107094, ЕР 1144623, EU 1144623. Хотя были перечислены некоторые специфические мишени генного сайлесинга,этот перечень является чисто иллюстративным, и другие молекулы siPHK также можно использовать с наночастицами по настоящему изобретению. В одном варианте воплощения наночастицы по настоящему изобретению включают молекулу siPHK, обладающую PHKi активностью против РНК, где молекула siPHK включает последовательность,комплементарную любой РНК, имеющей кодирующую или некодирующую последовательность, такую как последовательности, указанные в соответствии с GenBank Accession Nos., описанные в табл. VPCT/US03/05028 (Международная РСТ публикацияWO 03/4654), или другие, известные из уровня техники. В одном варианте воплощения наночастицы по настоящему изобретению включают молекулу siPHK, которая обусловливает "молчание" гена фактора роста эндотелия сосудов. В другом варианте воплощения наночастицы по настоящему изобретению включают молекулу siPHK, которая обусловливает"молчание" гена рецептора фактора роста эндотелия сосудов. В другом варианте воплощения наночастицы по настоящему изобретению включают молекулу siPHK, где последовательность молекулы siPHK является комплементарной связанным с опухолью мишеням, включая, но не ограничиваясь этим, гипоксия-индуцируемый фактор-1 (HIF-1), который обнаружен в человеческих метастатических раковых клетках предстательной железы РС 3-М (Mol Carcinog. 2008 Jan 31 [Epub ahead of print]); находящийся ниже HIF-1 ген-мишень (Mol Carcinog. 2008 Jan 31 [Epub ahead ofprint]), митогенактивируемые протеинкиназы (MAPK), ростовый фактор гепатоцитов (HGF), интерлейкин 12 р 70 (IL12), рецептор фактора некроза глюкокортикоид-индуцируемой опухоли (GITR), молекула межклеточной адгезии 1 (ICAM-I), нейротрофин-3 (NT-3), интерлейкин 17 (IL17), белок, связывающийся с интерлейкином 18 (IL18Bpa) и эпителиальный нейтрофил-активирующий пептид (ENA78) (см., например, "Cytokine profiling of prostatic fluid from cancerous prostate glands identifies cytokines associated withThe Prostate Early view Published Online: 24 Mar 2008); рецептор андрогена (AR), кератин, эпителиальный мембранный антиген, рецептор EGF и Е кадхерин (см., например, "Characterization of PacMetUTl, a recently isolated human prostate cancer cell line"); рецептор Y, активируемый пролиферацией пероксисом (РРARy; см., например, The Prostate volume 68, issue 6, 1 May 2008, pages 588-598); рецептор для развитых конечных продуктов гликирования (RAGE) и развитые конечные продукты гликирования (AGE), (см.,например, "V domain of RAGE interacts with AGEs on prostate carcinoma cells" The Prostate Early view Published Online: 26 Feb 2008); рецепторную тирозинкиназу erb-B2 (Her2/neu), рецептор фактора роста гепатоцитов (Met), рецептор трансформирующего ростового фактора-бета 1 (TGFR1), ядерный фактор кап- 28023175 па В (NFKB), Jagged-1, Sonic hedgehog (Shh), металлопротеиназы матрикса (ММР, в частности, ММР-7),рецептор эндотелина типа А (ЕТА), эндотелин-1 (ЕТ-1), субсемейство 3 ядерных рецепторов, группа С,член 1 (NR3C1), ко-активатор 1 ядерного рецептора (NCOA1), NCOA2, NCOA3, Е 1 А связывающий белок р 300 (ЕР 300), CREB связывающий белок (CREBBP), циклин G-ассоциированную киназу (GAK), гелсолин(GSN), семейство 1 альдо-кеторедуктаз, член C1 (AKR1C1), AKR1C2, AKR1C3, нейротенсин(NTS),енолазу 2(ENO2), хромогранин В (CHGB, секретогранин 1), секретагогин (SCGN или EF-сторонний кальций-связывающий белок), допа-декарбоксилазу (DDC или ароматическую L-аминокислотную декарбоксилазу), ко-активатор-1 стероидного рецептора (SRC-1), SRC-2 (a.k.a. TIF2), SRC-3 (а.k.a. AIB-1) (см.,например, "Longitudinal analysis of androgen deprivation of prostate cancer cells identifies pathways to androgen independence" The Prostate Early view Published Online: 26 Feb 2008); эстрогеновые рецепторы (ERa,ER или GPR30) (см., например, The Prostate volume 68, issue 5, рages 508-516); молекула адгезии клеток меланомы (МСАМ) (см., например, The Prostate volume 68, issue 4, рages 418-426; ангиогенные факторы(такие как сосудистый эндотелиальный ростовый фактор (VEGF) и эритропоэтин), транспортеры глюкозы (такие как GLUT1), белок 3, взаимодействующий с BCL2/аденовирусом Е 1 В, 19 кДа (BNIP3) (см.,например, The Prostate volume 68, issue 3, pages 336-343); типы 1 и 2 5-редуктазы (см., например, The(PSA), простата-специфический мембранный антиген (PSMA), антиген стволовых клеток предстательной железы (PSCA), -метилацил кофермент А рацемазу (AMACR), PCA3DD3, глутатион-S-трансферазу, pi 1(GSTP1), р 16, фактор ADP-рибозилирования (ARF), О-6-метилгуанин-ДНК метилтрансферазу (MGMT),человеческую теломераза-обратную транскриптазу (hTERT), ранний антиген рака предстательной железы (ЕРСА), человеческий калликреин 2 (HK2) и гепсин (см., например, The Journal of Urology, volume 178, issue 6, pages 2252-2259); бромодоменсодержащий 2 (BRD2), эукариотический фактор 4 гамма инициации трансляции, 1 (eIF4Gl), рибосомальный белок L13a (RPL13a) и рибосомальный белок L22(RPL22) (см., например, N Engl J Med 353 (2005), p. 1224); HER2/neu, Derlin-1, ERBB2, AKT, циклооксигеназу-2 (COX-2), PSMD3, CRKRS, PERLD1 и C17ORF37, PPP4C, PARN, ATP6V0C, C16orfl4, GBL,HAGH, ITFG3, MGC13114, MRPS34, NDUFB10, HMRAL1, NTHL1, NUBP2, POLR3K, RNPS1, STUBl,TBL3 и USP7. Все ссылки, описанные в настоящей заявке, включены в настоящую заявку посредством ссылки во всей их полноте. Таким образом, в одном варианте воплощения изобретение включает наночастицу, включающую низкомолекулярный PSMA лиганд, биоразлагаемый полимер, полимер и молекулу siPHK. В одном варианте воплощения изобретение включает наночастицу, включающую низкомолекулярный PSMA лиганд,биоразлагаемый полимер, компонент и молекулу siPHK, которая обусловливает "молчание" гена фактора роста эндотелия сосудов. В одном варианте воплощения изобретение включает наночастицу, включающую низкомолекулярный PSMA лиганд, биоразлагаемый полимер, компонент и молекулу siPHK, которая обусловливает "молчание" гена рецептора фактора роста эндотелия сосудов. В другом варианте воплощения изобретение включает наночастицу, включающую низкомолекулярный PSMA лиганд, PLGA,полиэтиленгликоль и молекулу siPHK. В одном варианте воплощения изобретение включает наночастицу, включающую низкомолекулярный PSMA лиганд, биоразлагаемый полимер, компонент и молекулуsiPHK, где наночастица может селективно аккумулироваться в предстательной железе или в ткани сосудистого эндотелия, окружающего рак. В одном варианте воплощения изобретение включает наночастицу, включающую низкомолекулярный PSMA лиганд, биоразлагаемый полимер, компонент и молекулуsiPHK, где наночастица может селективно аккумулироваться в предстательной железе или в ткани сосудистого эндотелия, окружающего рак, и где наночастица может поглощаться в результате эндоцитозаPSMA экспрессирующей клеткой. В другом варианте воплощения siPHK, которую включают в наночастицу по настоящему изобретению, представляет собой такую, которая лечит рак предстательной железы, например, такие, которые раскрыты в заявке США 11/021159 (siPHK последовательность является комплементарной SEQ IDNO:8: gaaggccagu uguauggac) и заявке США 11/349473 (раскрывает siPHK, которые связываются с областью от нуклеотида 3023 до 3727 SEQ ID NO:1). Оба указанных ссылочных документа включены в настоящую заявку посредством ссылки во всей их полноте. В другом варианте воплощения терапевтические средства наночастиц по настоящему изобретению включают РНК, которые можно использовать для лечения рака, такие как антисмысловые мРНК и микроРНК. Примеры микроРНК, которые можно использовать в качестве терапевтических средств для лечения рака, включают такие, которые раскрыты в Nature 435 (7043): 828-833; Nature 435 (7043): 839-843; иNature 435 (7043): 834-838, которые все включены в настоящую заявку посредством ссылки во всей их полноте. Способы лечения. В некоторых вариантах воплощения частицы направленной доставки в соответствии с настоящим изобретением можно использовать для лечения, облегчения, улучшения, ослабления, задержки развития,ингибирования прогрессии, уменьшения тяжести и/или сокращения случаев проявления одного или нескольких симптомов или признаков заболевания, расстройства и/или состояния. В некоторых вариантах
МПК / Метки
Метки: наночастиц, раковых, таргетирование, использованием, клеток
Код ссылки
<a href="https://eas.patents.su/30-23175-targetirovanie-rakovyh-kletok-s-ispolzovaniem-nanochastic.html" rel="bookmark" title="База патентов Евразийского Союза">Таргетирование раковых клеток с использованием наночастиц</a>
Предыдущий патент: Криогенная система для удаления кислотных газов из потока газообразных углеводородов с удалением сероводорода
Следующий патент: Арилсульфонилпиразолинкарбоксамидиновые производные в качестве антагонистов 5-нт6
Случайный патент: Устройство для точного измерения характеристик пласта


































