Рекомбинантный белок эксендина-4 и его аналога, способ их приготовления и применение
Формула / Реферат
1. Рекомбинантный белок, способный снижать уровень глюкозы в крови и полученный посредством слияния пептидного гормона с транспортным белком с помощью линкера, где пептидный гормон представляет собой эксендин-4 или его аналог и способен снижать уровень глюкозы в крови, а указанный транспортный белок представляет собой Fc-фрагмент иммуноглобулина IgG2; при этом указанный пептидный гормон включает последовательность, соответствующую формуле I
где

2. Рекомбинантный белок по п.1, отличающийся тем, что пептидный гормон представляет собой эксендин-4, имеющий аминокислотную последовательность SEQ ID NO: 1.
3. Рекомбинантный белок по п.1, отличающийся тем, что указанный линкер представляет собой пептид, имеющий следующую последовательность: (Gly)m-Xaa-(Gly)n, в которой m представляет целое число от 3 до 8, n представляет целое число от 3 до 8, Хаа представляет собой любую аминокислоту, выбранную из группы, состоящей из Gly, Ser, Ala и Thr.
4. Рекомбинантный белок по п.3, отличающийся тем, что m представляет целое число от 4 до 6, n представляет целое число от 4 до 6.
5. Рекомбинантный белок по п.4, отличающийся тем, что линкер имеет аминокислотную последовательность SEQ ID NO: 3.
6. Рекомбинантный белок по п.1, отличающийся тем, что Fc-фрагмент IgG2 происходит от человека.
7. Рекомбинантный белок по п.1, отличающийся тем, что имеет аминокислотную последовательность SEQ ID NO: 4.
8. Полинуклеотидная последовательность, кодирующая рекомбинантный белок по любому из пп.1-7.
9. Клетка-хозяин, полученная путем трансфекции клетки-реципиента вектором, который содержит полинуклеотидную последовательность по п.8, при этом указанная клетка-реципиент представляет собой клетку СНО.
10. Фармацевтическая композиция, содержащая эффективное количество рекомбинантного белка по любому из пп.1-7 и фармакологически приемлемый наполнитель.
11. Фармацевтическая композиция по п.10, отличающаяся тем, что ее вводят местно, в виде аэрозоля или инъекции.
12. Фармацевтическая композиция по п.11, отличающаяся тем, что ее вводят внутрибрюшинно, подкожно, внутримышечно и внутривенно.
13. Применение рекомбинантного белка по любому из пп.1-7 для производства лекарственного средства для лечения диабета и ожирения.
Текст
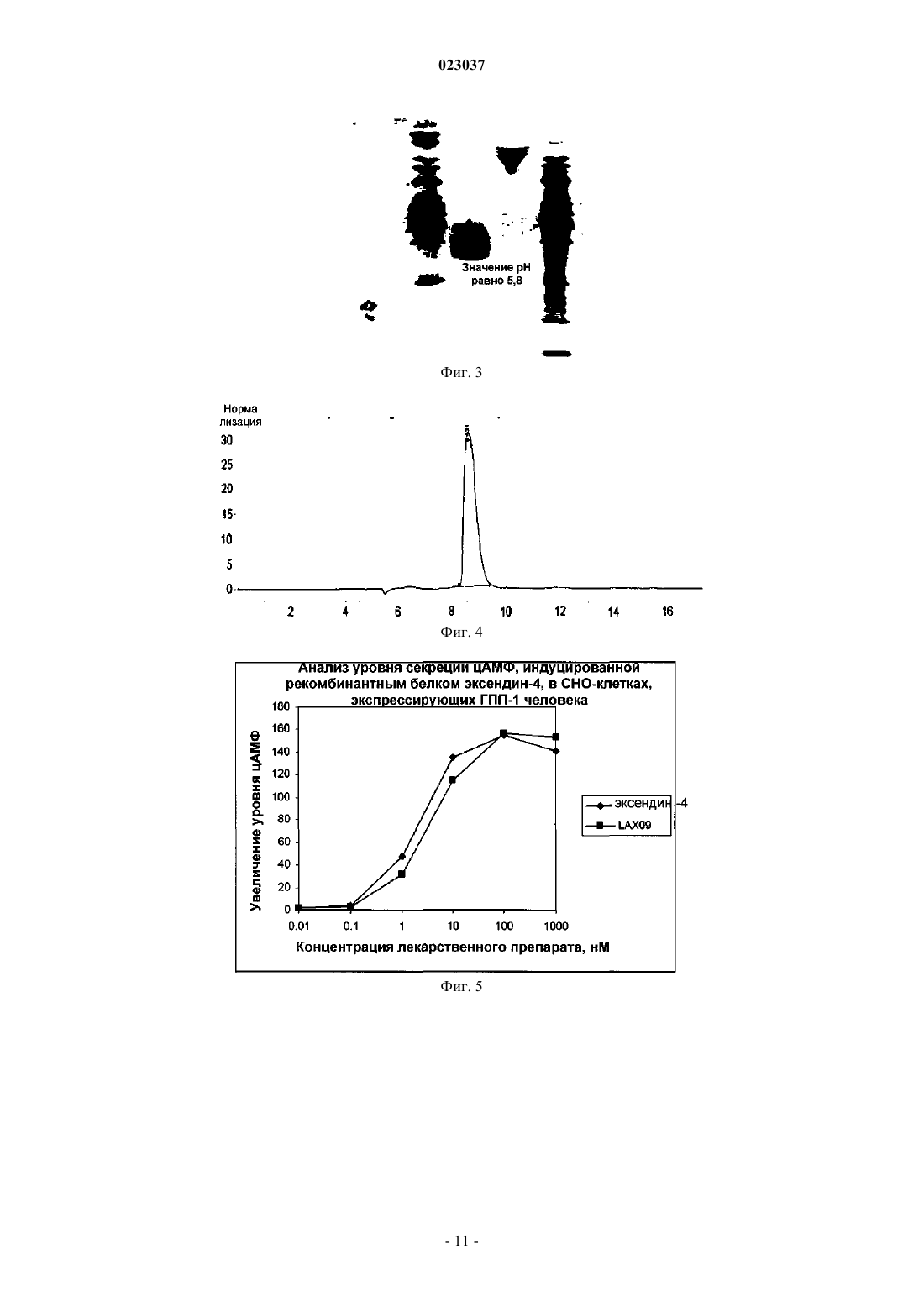
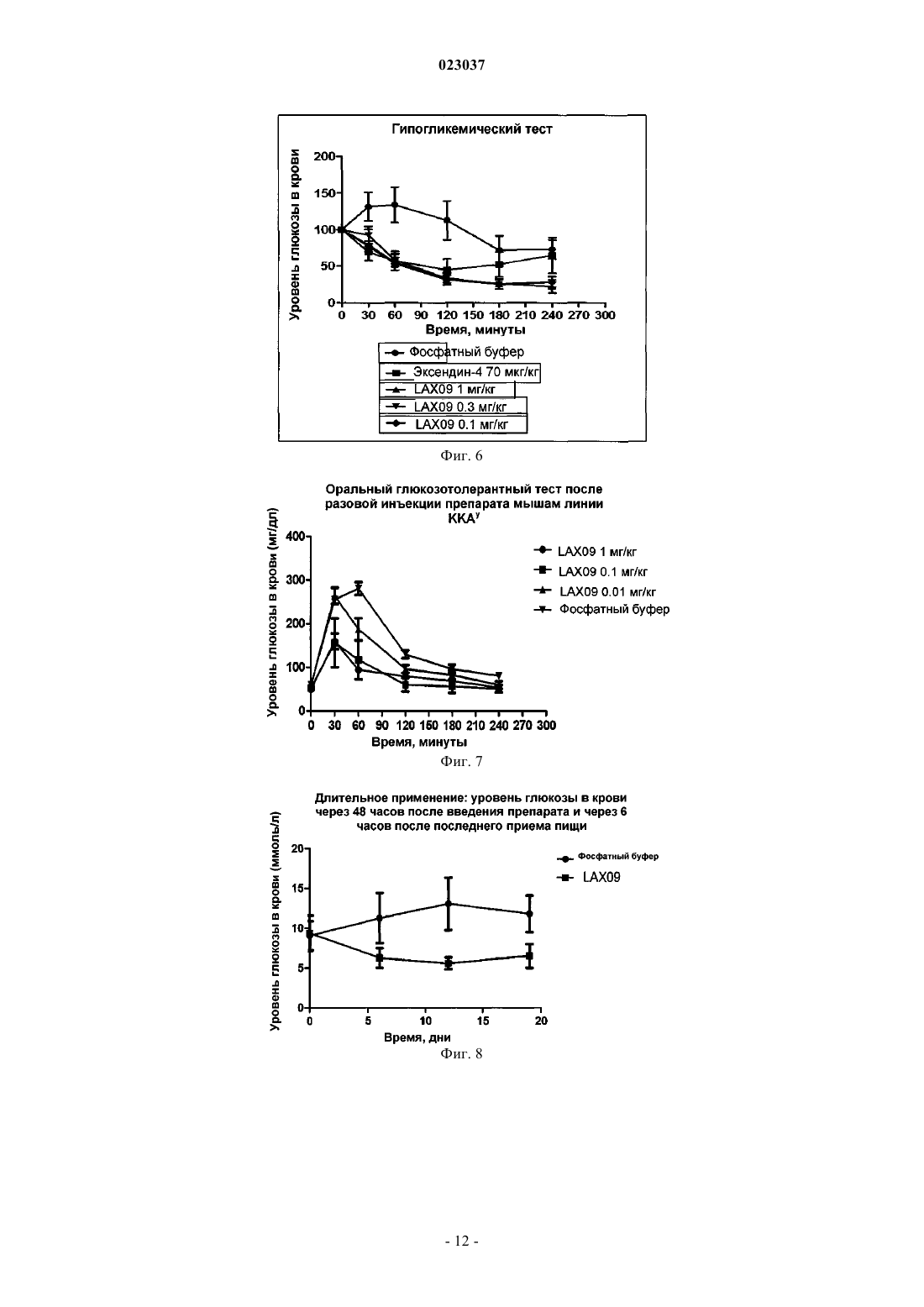
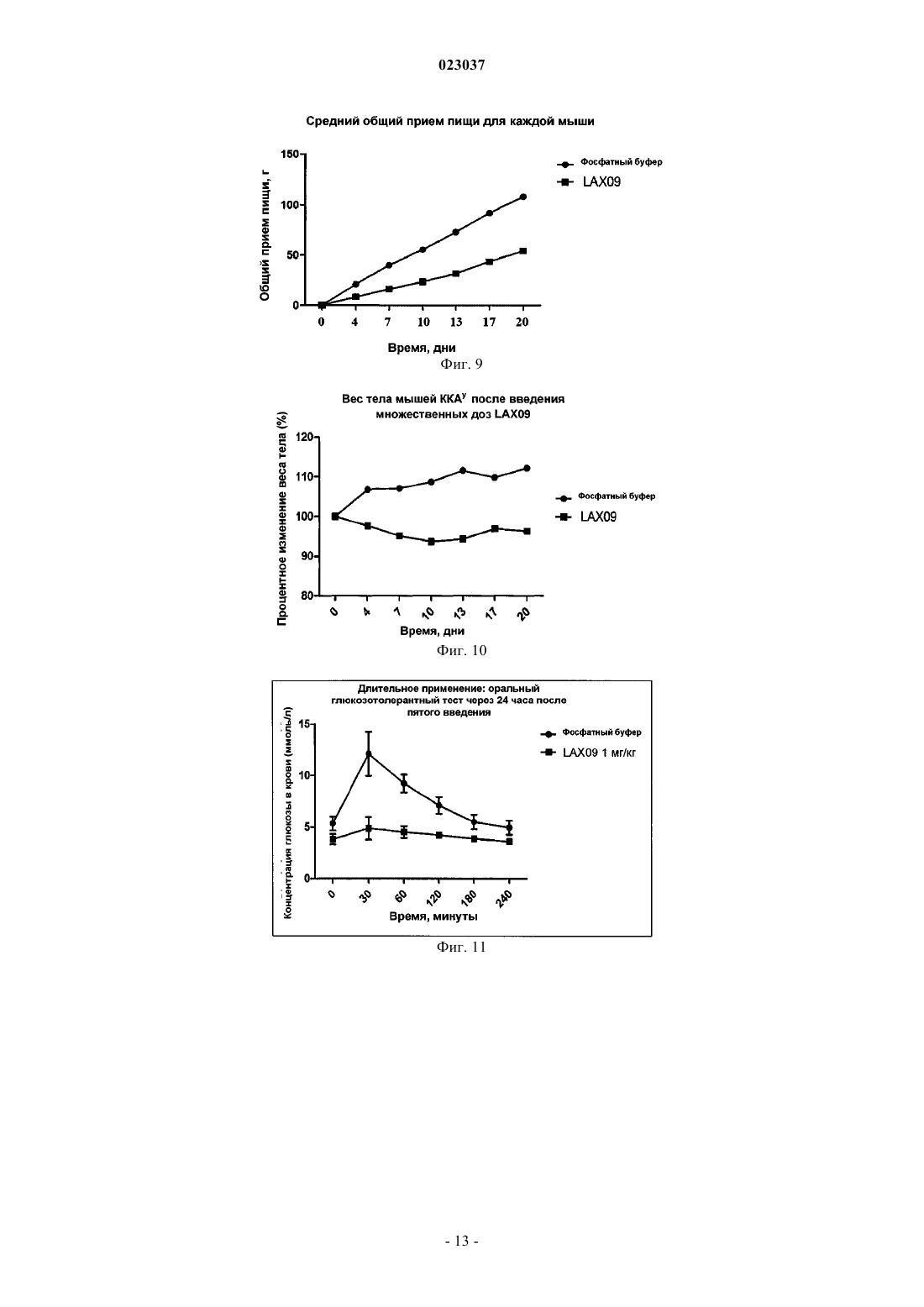
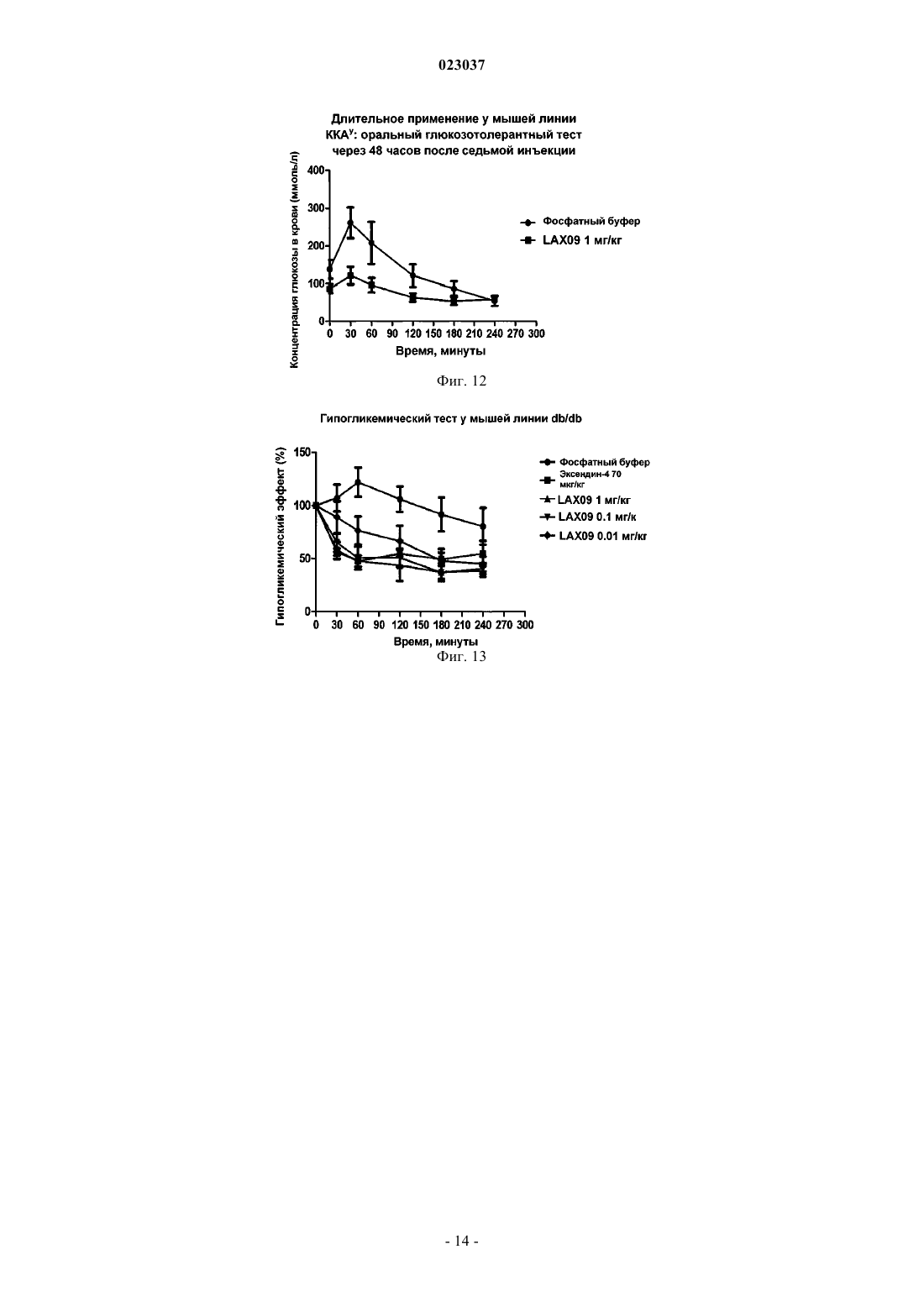
РЕКОМБИНАНТНЫЙ БЕЛОК ЭКСЕНДИНА-4 И ЕГО АНАЛОГА, СПОСОБ ИХ ПРИГОТОВЛЕНИЯ И ПРИМЕНЕНИЕ Согласно настоящему изобретению предложен рекомбинантный белок эксендина-4 и его аналога,способ их приготовления и применения. Указанный рекомбинантный белок получают путем слияния эксендина-4 или его аналога с Fc-фрагментом IgG2 человека через линкерный пептид. Предложенный рекомбинантный белок имеет более высокую стабильность, более длительное время полужизни в сыворотке и может быть использован для лечения диабета и ожирения.(71)(73) Заявитель и патентовладелец: БЕЙДЖИНГ ДУНФАН БАЙОТЕК КО., ЛТД. (CN) Область техники Настоящее изобретение относится к рекомбинантному белку, способу его получения и его применению. В частности, настоящее изобретение относится к длительно действующему рекомбинантному белку эксендина-4 и его аналога, кодирующей рекомбинантный белок нуклеотидной последовательности, векторам, клеткам-хозяевам и фармацевтическим композициям, способу их получения и применения. Предшествующий уровень техники Эксендин-4 представляет собой пептидный гормон, который состоит из 39 аминокислот и способен стимулировать секрецию инсулина. В 2005 году фармацевтическими компаниями Eli Lilly и Amylin была совместно создана инъекционная лекарственная форма Баета (Byetta), содержащая эксенатид, синтетический аналог эксендина-4, препарат был одобрен для лечения сахарного диабета, однако из-за своей небольшой молекулярной массы эксендин-4 быстро выводится почками и, следовательно, не способен продолжительно стимулировать рецепторы глюкагоноподобного пептида-1 (ГПП-1, GLP-1R), в результате приемлемый уровень эффективности может быть достигнут только при введении двух инъекций в день, что вызывает значительные неудобства при клиническом лечении. Соответственно, разработка длительно действующей фармацевтической формы эксендина-4 будет способствовать увеличению его эффективности при лечении сахарного диабета 1 и 2 типа. Исследователи, работающие в области фармацевтики, предпринимают попытки продлить устойчивость эффективность в отношении длительности действия лекарственных средств, действующих in vivo в качестве гипогликемических средств, путем модификации их молекулярной структуры. Для того чтобы увеличить период полувыведения ГПП-1 или эксендина-4 in vivo, исследователи разработали соответствующие рекомбинантные белки, такие как химерный белок ГПП-1 и альбумина,описанный в патенте WO 2002/46227 или WO 2005/000892, либо химерный белок ГПП-1-IgG4 (Kim et al.,Diabetes. 2003; 52(3): 751-759), однако вследствие того, что их связывающая активность in vitro относительно низкая, по эффективности они уступают эксендину-4. Идеальным изобретением является изобретение, в котором было бы достигнуто значительное увеличение периода полувыведения препарата из организма in vivo, сохранялась бы гипогликемическая эффективность эксендина-4, а также улучшилась чувствительность организма к инсулину. Таким образом, существует потребность в разработке длительно действующих факторов эксендина-4 и его аналога с устойчивой эффективностью in vivo. Сущность изобретения Целями настоящего изобретения являются обеспечение рекомбинантного белка эксендина-4 и его аналога, обладающего пролонгированным действием и стабильной эффективностью in vivo, соответствующие нуклеотидные последовательности, векторы, клетки-хозяева и фармацевтические композиции,способ их получения и применения. Согласно настоящему изобретению рекомбинантный белок эксендина-4 и его аналога получают путем слияния эксендина-4 и его аналога с Fc-фрагментом иммуноглобулина IgG2 через линкер. Указанный рекомбинантный белок используют для лечения диабета и ожирения, а также любых других заболеваний, течение которых можно облегчать при снижении уровня глюкозы в плазме крови, ингибировании моторики желудочно-кишечного тракта и замедлении опорожнения желудка. Из-за короткого периода полувыведения эксендин-4 и его аналог приходится вводить ежедневно для поддержания приемлемого уровня эффективности, что накладывает определенные ограничения на их применение в клинической практике. Для улучшения терапевтической эффективности этого препарата заявителем были проведены дополнительные исследования и разработан рекомбинантный белок эксендина-4 и его аналога, описанный согласно настоящему изобретению. Этот рекомбинантный белок имеет более высокую стабильность и более длительный период полувыведения in vivo, что таким образом способствует воспроизводству и восстановлению островковых -клеток поджелудочной железы в соответствии с уровнем глюкозы invivo, он также увеличивает количество островковых -клеток поджелудочной железы и тем самым способствует секреции инсулина и повышает чувствительность организма к инсулину, и, следовательно,обладает более высокой антидиабетической активностью и минимальным риском гипогликемии, кроме того, указанный белок снижает массу тела и оказывает гиполипедимическое и гипотензивное действие,защищая таким образом сердечно-сосудистую систему. Помимо этого, действуя на центральную нервную систему, он улучшает как функционирование в состоянии покоя, так и функцию памяти, т.е. обладает нейропротекторными свойствами. Согласно настоящему изобретению предложен рекомбинантный белок, который получают путем слияния пептидного гормона и транспортного белка с помощью линкера, при этом указанный пептидный гормон представляет собой эксендин-4 или аналог эксендина-4, указанный пептидный гормон способен снижать уровень глюкозы в крови, указанный транспортирующий белок представляет собой Fc-фрагмент иммуноглобулина IgG2 и указанный рекомбинантный белок способен снижать уровень глюкозы в крови. Предложенный согласно настоящему изобретению рекомбинантный белок эксендина-4 и его аналога получают путем слияния эксендина-4 и его аналога с Fc-фрагментом иммуноглобулина IgG2 через линкер. В соответствии с настоящим изобретением указанный эксендин-4 имеет последовательность аминокислот, соответствующую SEQ ID NO: 1, указанный аналог эксендина-4 имеет любую последовательность, выбранную из группы, состоящей из последовательности, которая является производной от аминокислотной последовательности SEQ ID NO: 1, аминокислотной последовательности SEQ ID NO: 2,последовательности, которая является производной от аминокислотной последовательности SEQ ID NO: 2, аминокислотной последовательности ГПП-1, который является антигенным для ДПП-4 (DPP-IV), и последовательности, которая является производной от аминокислотной последовательности для ГПП-1,который является антигенным к ДПП-4. Эксендин-4 или его аналог, входящий в состав указанного рекомбинантного белка, может быть выбран из группы, состоящей из эксендина-4 [SEQ ID NO: 1], ГПП-1 (7-36) NH2 [SEQ ID NO: 2] ГПП-1,который является антигенным для ДПП-4, а также их производных и фрагментов. Следует отметить, что согласно настоящему изобретению под понятием "эксендин-4 и его аналог" следует понимать любые производные эксендина-4, ГПП-1 (7-36) NH2, ГПП-1, который является антигенным для ДПП-4, или их фрагменты, биологический эффект (т.е. гипогликемический эффект) которых сопоставим с эффектом исходных белков. Производные включают, но не ограничиваются ими, регулярную замену аминокислоты, непосредственную замену и химическую модификацию аминокислоты и т.п. Указанный эксендин-4 и его аналог может быть представлен последовательностью эксендина-4,представленной SEQ ID NO: 1, ее производным и фрагментом. В пределах настоящего изобретения указанные производные эксендина-4, как правило, предпочтительно представлены пептидом, который имеет не более 6 отличий от последовательности SEQ ID NO: 1, более предпочтительно пептидом, имеющим не более 5 отличий от последовательности SEQ ID NO: 1, и наиболее предпочтительно пептидом, который имеет 4, 3, 2 отличий или 1 отличие от последовательности SEQ ID NO: 1, т.е. предпочтительно не более 6, более предпочтительно не более 5, еще более предпочтительно не более 4, еще более предпочтительно не более 3, даже еще более предпочтительно не более 2, наиболее предпочтительно 1 или менее отличий в положениях аминокислотной последовательности между указанной последовательностью, которая является производной от аминокислотной последовательности SEQ ID NO: 1 и аминокислотной последовательностью SEQ ID NO: 1. В рамках настоящего изобретения указанная последовательность, которая является производной от аминокислотной последовательности, представленной SEQ ID NO: 1, предпочтительно представляет собой фрагмент аминокислотной последовательности SEQ ID NO: 1, более предпочтительно аминокислотную последовательность полипептида, кодируемого участком с 1 по 20 аминокислоту с N-конца аминокислотной последовательности SEQ ID NO: 1. Фрагмент эксендина-4 представляет собой полипептид, кодируемый участком с 1 по 20 аминокислоту с N-конца аминокислотной последовательности SEQ ID NO: 1. Указанный эксендин-4 и его аналог предпочтительно представляют собой эксендин-4, который имеет аминокислотную последовательность, соответствующую SEQ ID NO: 1. Указанный эксендин-4 и его аналог может быть представлен последовательностью ГПП-1 (7-36)NH2, приведенной в SEQ ID NO: 2, ее фрагментом или производным. Указанный ГПП-1, который является антигенным для ДПП-4, представляет собой ГПП-1A8G. Т.е. указанный пептидный гормон включает последовательность согласно формуле I При этом указанный линкер представляет собой пептид, который имеет последовательность(Gly)m-Xaa-(Gly)n, в которой m представляет собой целое число от 3 до 8, n представляет собой целое число от 3 до 8, Хаа представляет собой любую аминокислоту, выбранную из группы, состоящей из Gly,Ser, Thr и Ala. Последовательность, представленная формулой I, представляет собой последовательностьSEQ ID NO: 23. Причм m предпочтительно представляет собой целое число от 4 до 6, n предпочтительно представляет собой целое число от 4 до 6. При этом указанный линкер предпочтительно имеет аминокислотную последовательность SEQ IDNO: 3. Притом, что указанный рекомбинантный белок наиболее предпочтительно имеет аминокислотную последовательность, соответствующую SEQ ID NO: 4.Fc-фрагмент IgG2, являющийся частью рекомбинантного белка, представляет собой фрагмент антитела человека. Указанный IgG содержит Fc фрагмент IgG, или фрагмент, или производное Fc. Согласно настоящему изобретению предложена также полинуклеотидная последовательность, кодирующая описанный выше рекомбинантный белок. Согласно настоящему изобретению также предложен вектор, содержащий указанную полинуклеотидную последовательность. Согласно данному изобретению также предложена клетка-хозяин, трансфецированная описанным выше вектором, при этом указанная клетка-хозяин может быть представлена клеткой СНО или клеткойNSO. В соответствии с типом клетки-хозяина, предложенной согласно настоящему изобретению, указанную клетку-хозяин получают путем трансфекции клетки-реципиента описанным выше вектором. В отношении типа клетки-хозяина, предложенной согласно настоящему изобретению, указанная клетка-реципиент может представлять собой СНО клетку. В отношении типа клетки-хозяина, предложенной согласно настоящему изобретению, указанная клетка-реципиент может представлять собой клетку NS0. Настоящее изобретение также предлагает способ получения рекомбинантного белка эксендина-4 и его аналога, который включает стадии осуществления транскрипции и трансляции указанного полинуклеотида, а также очистку с использованием способа, основанного на связывании с протеином-А. Настоящее изобретение также предлагает методику получения рекомбинантного белка, как описано выше, при этом указанная методика состоит из следующих этапов:(1) осуществление транскрипции и трансляции упомянутой выше полинуклеотидной последовательности,(2) осуществление очистки продукта трансляции упомянутой выше полинуклеотидной последовательности с использованием способа, основанного на связывании с протеином-А. После экспрессии рекомбинантного белка в соответствии с настоящим изобретением в клеткехозяине можно использовать ряд способов очистки белков хорошо известных в данной области, при этом выбор способа очистки зависит от методики получения и типа белка. Например, для эффективной очистки рекомбинантного белка, включающего Fc-фрагмент, может быть использован аффинный сорбент на основе протеина А или G, элюирование рекомбинантного белка с аффинного сорбента может быть проведено с использованием буфера с низким или высоким рН. Способы, предназначенные для характеристики рекомбинантного белка эксендина-4 в соответствии с данным изобретением, включают ДСН-ПААГ электрофорез, Вестерн-блоттинг, изоэлектрическое фокусирование, гельпроникающую хроматографию, время-пролтную ионизацию лазерной десорбцией с использованием матрицы (MALDI-TOF), жидкостную хроматографию с масс-спектрометрией (LC-MS). Настоящее изобретение также предлагает фармацевтическую композицию, которая содержит рекомбинантный белок эксендина-4 и его аналога, а также фармакологически приемлемый наполнитель. В рамках настоящего изобретения описанная фармацевтическая композиция состоит из рекомбинантного белка, описанного выше, и фармакологически приемлемого наполнителя. Термин "фармакологически приемлемый", используемый в настоящем описании, относится к молекуле и е части, которая не вызывает нежелательных, аллергических или других неблагоприятных явлений при надлежащем введении животному и человеку. Термин "наполнитель", используемый в настоящем описании, должен быть совместим с рекомбинантным белком согласно данному изобретению, т.е.,как правило, он существенно не снижает эффективность композиции препарата при смешивании с рекомбинантным белком. Рекомбинантный белок согласно настоящему изобретению может быть приготовлен с одним или несколькими наполнителями. Рекомбинантный белок согласно настоящему изобретению может быть приготовлен в виде раствора или лиофилизированного порошка для инъекции, который может быть восстановлен соответствующим разбавителем. Активный рекомбинантный белок согласно настоящему изобретению может быть смешан с медицинским буфером для доведения рН так, чтобы обеспечить приемлемую стабильность и рН, пригодный для вводимого парентерально препарата; к композиции может быть добавлен один или несколько медицинских антибиотиков, для доведения ионной силы или давления раствора могут быть добавлены один или несколько солевых растворов, для последующей корректировки изотоничности раствора могут быть добавлены один или несколько наполнителей, например глицерин, и т.п. Наполнители в указанной композиции могут быть представлены такими разбавителями, как сахариды, например лактоза, глюкоза и сахароза, крахмал, например кукурузный и картофельный крахмал,целлюлоза и ее производные, такие как натрий-карбоксиметилцеллюлоза, этилцеллюлоза и метилцеллюлоза; порошок трагаканта; солод; желатин; тальк; твердые смазки, такие как стеариновая кислота и стеарат магния; сульфат кальция; растительные масла, такие как арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло; полиолы, такие как пропиленгликоль, глицерин, сорбитол, маннол и полиэтиленгликоль; альгиновая кислота, эмульгаторы, такие как Tween, увлажняющий агент, такой как лаурилсульфат натрия, краситель, ароматизатор, стабилизаторы; антиоксидант; консервант; не содержащая пирогенов вода; изотонический солевой раствор; фосфатный буфер; и т.д. Лекарственная солевая форма рекомбинантного белка согласно настоящему изобретению также входит в объм настоящего изобретения. Кислоты, обычно используемые для приготовления соли присоединения кислоты, представляют собой неорганические кислоты, такие как соляная кислота, бромоводородная кислота, йодоводородная кислота, серная кислота, фосфорная кислота, либо органические кислоты, такие как пара-толуолсерная кислота, щавелевая кислота, лимонная кислота, янтарная кислота,уксусная кислота и т.д. Соли присоединения щелочей включают соли, полученные из неорганических оснований, таких как аммоний, гидроксиды щелочных или щелочно-земельных металлов. Щелочи, используемые для приготовления раствора соли в рамках настоящего изобретения, также включают гидроксид натрия, гидроксид калия, гидроксид аммония, карбонат калия и так далее. Данное изобретение также предлагает способ введения указанной фармацевтической композиции,которую можно вводить местно, в виде аэрозоля или инъекции; указанную инъекцию можно вводить внутрибрюшинно, подкожно, внутримышечно и внутривенно. В рамках настоящего изобретения указанную фармацевтическую композицию можно вводить местно, в виде аэрозоля или инъекции. Указанную инъекцию можно вводить внутрибрюшинно, подкожно,внутримышечно и внутривенно. Эффективность гипогликемической дозы предложенного рекомбинантного белка зависит от многих факторов, которые включают, но не ограничиваются, пол пациента, массу тела и возраст, способ введения и биодоступность. Согласно настоящему изобретению также предлагается применение рекомбинантного белка согласно настоящему изобретению при получении лекарственных препаратов, для лечения диабета и ожирения,Рекомбинантный белок согласно настоящему изобретению обладает биологической активностью. Биологическая активность определяется, как способность этого рекомбинантного белка связываться с ГПП-1 рецепторами, активировать их и вызывать ответную реакцию in vivo. Ответные реакции включают, но не ограничиваются ими, такие реакции как секреция инсулина, ингибирование секреции глюкагона поджелудочной железой, подавление аппетита, снижение массы тела, возникновение чувства сытости,подавление апоптоза -клеток поджелудочной железы, индукция пролиферации и регенерации -клеток поджелудочной железы. В описании примера 4 (1) приведены экспериментальные данные, иллюстрирующие способность рекомбинантного белка взаимодействовать с ГПП-1 рецепторами человека in vitro и активировать их, а также индуцировать выработку инсулина островковыми клетками. В описании примера 4 (2) приведены данные о гипогликемической активности рекомбинантного белка in vivo у Ob/ob тучных мышей с диабетом и инсулинорезистентных мышей. В рамках настоящего изобретения рекомбинантный белок эксендина-4 и его аналога демонстрирует значительную антидиабетическую эффективность: за счет активации воспроизводства и восстановления островковых -клеток этот препарат увеличивает количество островковых -клеток, стимулирует секрецию инсулина, повышает чувствительность организма к инсулину, таким образом эффективно контролирует уровень глюкозы в крови пациентов с сахарным диабетом 2-го и даже 1-го типа, обеспечивая при этом долгосрочный лечебный эффект. В рамках настоящего изобретения биологическая активность рекомбинантного белка опосредована его воздействием на рецепторы ГПП-1, что можно применять для лечения диабета и ожирения. Краткое описание чертежей На фиг. 1 показаны результаты электрофоретического анализа продуктов, образованных после ферментного расщепления вектора pHT112-SP-IgGH/Exendin-4/IgG2-Fc. На фиг. 2 приведены данные по иммунологической идентификации рекомбинантного белка эксендина-4. На фиг. 3 приведены данные по изоэлектрическому фокусированию рекомбинантного белка эксендина-4. На фиг. 4 приведены данные по гель-хроматографии рекомбинантного белка эксендина-4. На фиг. 5 показаны результаты изменения концентрации цАМФ в СНО-hGLP1R клетках, обработанных рекомбинантным белком эксендина-4. На фиг. 6 показано гипогликемическое действие, индуцированное разовой инъекцией рекомбинантного белка эксендина-4, на мышиной модели диабетического ожирения KKAy. На фиг. 7 показаны результаты исследования толерантности к оральной глюкозе после введения рекомбинантного белка эксендина-4 мышам линии KKAy с моделью диабетического ожирения. На фиг. 8 показано влияние длительного введения рекомбинантного белка эксендина-4 на уровень глюкозы в крови мышей линии KKAy с моделью диабетического ожирения. На фиг. 9 показано влияние длительного введения рекомбинантного белка эксендина-4 на прием пищи у мышей. На фиг. 10 показано влияние длительного введения рекомбинантного белка эксендина-4 на массу тела мышей. На фиг. 11 показаны результаты влияния длительного применения рекомбинантного белка эксендина-4 на уровень глюкозы в крови в течение 24 ч после введения. На фиг. 12 показаны результаты влияния длительного применения рекомбинантного белка эксендина-4 на уровень глюкозы в крови в течение 48 ч после введения. На фиг. 13 показано влияние рекомбинантного белка эксендина-4 на уровень глюкозы в крови мышей линии db/db с моделью диабетической ожирения. Подробное описание примеров вариантов реализации изобретения Варианты реализации настоящего изобретения описаны в следующих примерах. Тем не менее, следует отметить, что вариант реализации изобретения не ограничивается определенными деталями этих примеров, так как для специалиста в данной области может быть хорошо известен или очевиден другой вариант реализации на основании непосредственно изложенного содержания и прилагаемых пунктов формулы изобретения. Таким образом, любая технология, разработанная в соответствии с содержанием настоящего изобретения, в ходит в объм охраны, определяемый формулой данного изобретения. Содержание литературных источников, цитируемых здесь, включено в полном объеме. Экспериментальные способы, описанные в следующих примерах, являются общепринятыми технологиями, если не указано иное, все описанные реагенты и биологические вещества коммерчески доступны, если не указано иное. Пример 1. Синтез генов и конструирование вектора для экспрессии рекомбинантного белка эксендина-4. Последовательность ДНК, кодирующую рекомбинантный белок эксендина-4, синтезировали с применением лигазной цепной реакции. Белковая последовательность содержит следующие аминокислоты: При этом в аминокислотной последовательности SEQ ID NO: 4 пептидный гормон эксендин-4 кодируется участком с 1 по 39 аминокислотный остаток последовательности SEQ ID NO: 1. Линкер кодируется участком с 40 по 48 аминокислотный остаток и имеет последовательность, представленную SEQID NO: 3 (где Хаа представляет собой Ala). Транспортный белок, т.е. Fc фрагмент IgG2, кодируется участком с 49 по 271 аминокислотный остаток. Сначала конструируют вектор указанного рекомбинантного белка, кодирующий эксендин-4 и рекомбинантный белок IgG2-Fc человека. IgG2-Fc домен содержит СН 2 и СН 3 части константной области тяжелой цепи IgG2. Лидерную пептидную последовательность SP-IgGH из IgG объединяют с эксендином-4 для обеспечения секреции синтезируемого рекомбинантного белка в культуральную среду. кДНК,которая кодирует рекомбинантный белок SP-IgGH/Exendin-4/IgG2 (аминокислотной последовательность линкера расположена между эксендином-4 и IgG2), синтезируют с помощью ПЦР и автоматического синтезатора ДНК и затем встраивают в вектор рНТ 112 (приобретен в Yihu Biopharmaceutical Co., Ltd.) между рестрикционными сайтами Hind III и Not I с образованием готового вектора pHT112-SPIgGH/Exendin-4/IgG2-Fc. Рекомбинантный белок Exendin-4/IgG2-Fc, который может быть секретирован из клетки во внеклеточное пространство, включает константные области тяжелой цепи IgG2 (CH2 и СН 3). Пептидную последовательность SP-IgGH, обеспечивающую секрецию, присоединяют к последовательности эксендина-4 для индукции секреции синтезируемого белка в культуральную клеточную среду. На фиг. 1 показаны результаты электрофоретического анализа в агарозном геле продуктов расщепления вектора pHT112-SP-IgGH/Exendin-4/IgG2-Fc эндонуклеазами Hind III и Not I. Эндонуклеазы Hind III и Not I вырезают участок ДНК размером 880 пар оснований, в том числе последовательность SPIgGH/Exendin-4/IgG2-Fc. Пример 2. Конструирование и очистка инженерной клеточной линии для экспрессии рекомбинантного белка эксендина-4. 1. Конструирование инженерной клеточной линии для экспрессии рекомбинантного белка эксендин-4. Культуру овариальных клеток китайского хомяка (СНО) культивируют в полноценной культуральной среде DMEM (приобретена у Invitrogen) с добавлением 10% (объемные проценты) эмбриональной телячьей сыворотки (FCS), затем за один день до трансфекции в каждую лунку 6-луночного планшета для микротитрования вносят по 3105 клеток. Трансфекцию проводят с использованием липофектамина 2000 (LIPOFECTAMINE 2000) в соответствии с инструкциями производителя. Через 48 ч после трансфекции клетки компримировано культивируют в присутствии селективного субстрата (метионинсульфоксимина (MSX) 25 мкМ) на протяжении примерно одной недели, в течение этого периода происходит отмирание нетрансфицированных клеток, в то время как уцелевшие клетки пересевают в 96-луночные планшеты (50 клеток/лунку) для дальнейшего компримирования культуры. После клонирования клеток проводят ELISA анализ для определения количества экспрессированного белка в надосадочной культуральной жидкости. Клетки из лунок, в которых был обнаружен высокий уровень экспрессии (количество экспрессированного белка превышает 200 мг/л), подвергают скринингу и переносят в 24-луночные планшеты для наращивания биомассы культуры. Затем повторяют ELISA для определения уровня экспрессии белка в надосадочной жидкости. После проведения анализа клеточные линии с высоким уровнем экспрессии белка (количество экспрессированного белка превышает 200 мг/л) проверяют и наращивают в соответствии со стандартными методиками (Cell Experimental Manual, Science Press, 2003). Таким образом, посредством постепенного пересева суспензии культуры с высоким уровнем экспрессии белка формируется банк клеток, пригодных для субклонирования с целью получения рабочего банка клеток(состоящий из инженерной линии клеток СНО). 2. Очистка рекомбинантного белка эксендина-4. Инженерную линию СНО клеток, полученную в соответствии с описанным выше способом, размораживают и высевают в 25 см 2 Т-колбу, в каждую колбу вносят по 5 мл клеточной суспензии и культивируют при непрерывном встряхивании в течение 4-5 дней. Затем клетки переносят в треугольную колбу и культивируют еще в течение 7-10 дней в соответствии со стандартными методиками (MolecularCloning, Science Press, 2002). Культуральную среду, содержащую рекомбинантный белок, отделяют и затем последовательно очищают посредством аффинной хроматографии с использованием протеина-А(MabSuRe, GE Healthcare), анионообменного хроматографического сорбента (Q Sepharose FF, GEHealthcare), катионообменного хроматографического сорбента (SP Sepharose FF, GE Healthcare). В результате очищенный рекомбинантный белок получают элюированием из колонки G-25 для гельфильтрации буфером для приготовления лекарственной формы. Пример 3. Анализ структуры рекомбинантного белка эксендина-4. 1. Вестерн-блот анализ. После электрофореза рекомбинантного белка в невосстанавливающих условиях гель переносят наPVDF мембрану, активированную метанолом, при помощи передаточного устройства (трансблоттер производства GE Healthcare) (ток: 25 мА, время: 2 ч). Неспецифические центры PVDF мембраны блокируют в 5 % обезжиренном молоке в течение 2 ч, затем мембрану инкубируют в течение 1 ч с предварительно разбавленными антителами против IgG2, мечеными щелочной фосфатазой, и промывают несколько раз свежим TBST буфером в течение 5 мин. После отмывки добавляют люминесцентный субстрат CDP-Star и прижимают пленку для экспозиции и визуализации. Результат показан на фиг. 2, рекомбинантный белок демонстрирует положительный результат на наличие IgG2 антитела. 2. Изоэлектрическое фокусирование в геле. Очищенный рекомбинантный белок анализируют при помощи изоэлектрического фокусирования в заранее подготовленном геле, имеющем рН 3-10, с использованием системы быстрого электрофореза(Phast System, GE). После окончания фокусирования гель окрашивают красителем Кумасси синим. Результат анализа показан на фиг. 3. Изоэлектрическая точка основной полосы рекомбинантного белка лежит в области 5.8, что близко к ожидаемому значению 6.2. 3. Очистка при помощи гель-хроматографии. Очищенный рекомбинантный белок анализируют при помощи гель-хроматографии (хроматографическая колонка TSK3000sw) в соответствии с методикой, описанной в ссылке (Molecular Cloning, SciencePress, 2002), загрузочное количество белка составляет 10 мкг. Результат анализа приведен на фиг. 4, на полученной хроматограмме наблюдается один симметричный пик рекомбинантного белка, время удерживания составляет 8,5 мин. Пример 4. Биологическая активность рекомбинантного белка эксендина-4. 1. Активность рекомбинантного белка эксендина-4 in vitro. А. Анализ секреции цАМФ, индуцированной рекомбинантным белком эксендина-4, в СНО клетках,экспрессирующих рецептор ГПП-1 человека. Биологическую активность рекомбинантного белка на клеточном уровне анализировали на CHOhGLP1R клетках, экспрессирующих рецептор ГПП-1 человека (как описано в ссылке WO 2007/017892) для определения молярной концентрации активных продуктов, образующихся в клетке после активации рецептора (вторичный мессинджер цАМФ), и эффективности предложенного согласно настоящему изобретению LAX09 in vitro (т.е. рекомбинантный белок эксендин-4, полученный в соответствии с описанным выше способом и показанный SEQ ID NO: 4, то же ниже). В 96-луночный черный прозрачный планшет вносят DMEM субстрат, содержащий 10 об.% ЭТС, затем добавляют эксендин-4 и LAX09 в концентрациях от 0,01 до 1000 нм, после инкубации в течение 30 мин клетка разрушается и концентрация внутриклеточного цАМФ определяется при помощи коммерческого набора для количественного определения (Cisbio), результат анализа представлен в табл. 1. Таблица 1 Анализ соотношения концентраций цАМФ в клетках, экспрессирующих рецепторы ГПП-1 человека Величины ЕС 50 для эксендина-4 и LAX90 сопоставимы и составляют примерно 4,5 и 2,5 нМ соответственно. Таким образом, уровень активации рецептора ГПП-1 при действии LAX09 согласно настоящему изобретению сопоставим с эффектом эксендина-4. Результаты представлены на фиг. 5. В. Комбинированный анализ действия LAX09 на инженерную клеточную линию СНО, экспрессирующую рецепторы ГПП-1 человека. Для определения биологической активности очищенного образца изобретения LAX09 был проведен анализ комбинированной активности LAX09 с использованием инженерной клеточной линии СНО(CHO-hGLP1R, то же ниже), устойчиво экспрессирующей рецепторы ГПП-1 человека. Комбинированный анализ клеточной линии CHO-hGLP1R: штамм инженерной клеточной линии СНО (CHO-hGLP1R, то же ниже), устойчиво экспрессирующей рецепторы ГПП-1 человека, приготавливают в виде суспензии отдельных клеток, плотность клеток доводят до 10 млн кл./мл используя фосфатный буфер. Образец LAX09 разбавляют с образованием серии разведений в наборе флаконов, 20 мкл суспензии клеток смешивают с 20 мкл образцов с различными концентрациями, соответственно, инкубируют при 4 С в течение 30 мин. После отмывки фосфатным буфером добавляют -цепь иммуноглобулина человека, меченную флуоресцеин изотиоцианатом (ФИТЦ) и инкубируют при 4 С в течение 30 мин. После отмывки фосфатным буфером добавляют 1% параформальдегид в ФБ, тщательно перемешивают. Образцы загружают в проточный цитофлуориметр и регистрируют среднюю интенсивность флуоресценции образца для каждой концентрации в выбранной зоне. Результаты приведены в табл. 2. Таблица 2 Анализ комбинированной активности LAX09 в СНО клетках, экспрессирующих рецепторы ГПП-1 человека 2. Активность рекомбинантного белка эксендина-4 in vivo. А. Мыши линии KKAy с моделью диабетического ожирения. Гипогликемический эффект после однократной инъекции: мышей линии KKAy с моделью диабетического ожирения (приобретены Beijing, Beijing HFK Bioscience Co., Ltd, то же ниже) случайным образом распределяют на 4 группы, включая одну контрольную группу для получения фосфатного буфера и три экспериментальные группы для получения различных концентраций рекомбинантного белка эксен-7 023037 дин-4 (LAX 09). Животных не кормят в течение 2 ч перед инъекцией, затем вводят препарат в хвостовую вену из расчета 200 мкл/животное. Уровень глюкозы в крови мышей определяют на 0, 30, 60, 120, 180 и 240 мин, результаты анализа приведены на фиг. 6. Наибольший гипогликемический эффект наблюдается при дозе LAX09 равной 1 мг/кг, при этом уровень глюкозы в крови мышей поддерживается на уровне не более 10 ммоль/л. Оральный глюкозотолерантный тест: мышей линии KKAy с моделью диабетического ожирения случайным образом распределяют на 4 группы, включая одну контрольную группу для получения фосфатного буфера и три экспериментальные группы для получения различных концентраций рекомбинантного белка эксендин-4 (LAX 09). Животных не кормят в течение 6 ч перед инъекцией, затем вводят препарат подкожно из расчета 200 мкл/животное, через 6 ч интрагастрально вводят глюкозу через желудочный зонд в количестве, рассчитанном на основании массы тела (1 мг/г). Уровень глюкозы в крови мышей определяют на 0, 30, 60, 120, 180 и 240 мин, результаты анализа приведены на фиг. 7. У мышей в группах, получивших препарат в дозе 1 мг/кг и 0,1 мг/кг, наблюдали сопоставимую удовлетворительная способность поддерживать нормальный уровень глюкозы в крови. Анализ эффекта длительного применения препарата: мышей линии KKAy с моделью диабетического ожирения случайным образом распределяют на 2 группы, включая одну контрольную группу для получения фосфатного буфера и одну экспериментальную группу для получения 1 мг/кг рекомбинантного белка эксендин-4 (LAX 09). Препарат вводят два раза в неделю, анализ уровня глюкозы проводят каждую среду и перед определением мышей не кормят в течение 6 ч. Изменения потребления пищи и веса животного регистрируются. Результаты анализа приведены на фиг. 8. Уровень глюкозы натощак у мышей из экспериментальной группы значительно отличается от уровня в группе, получавшей фосфатный буфер. Результаты, приведенные на фиг. 9 и 10, демонстрируют снижение потребления пищи и значительное уменьшение веса соответственно. Результаты орального теста на глюкозотолерантность через 24 ч после введения препарата приведены на фиг. 11. Результаты орального теста на глюкозотолерантность через 48 ч после введения препарата приведены на фиг. 12. Все результаты свидетельствуют о значительной эффективности рекомбинантного белка эксендин-4. Б. Модель мышей с ожирением и СД типа 2 (db/db). Гипогликемический эффект после однократной инъекции: 5-6-недельные мышей с ожирением и СД типа 2 (db/db) случайным образом распределяют на 4 группы, включая одну контрольную группу для получения фосфатного буфера и три экспериментальные группы для получения различных концентраций рекомбинантного белка эксендин-4 (LAX09). Животных не кормят в течение 2 ч перед инъекцией, затем вводят препарат в хвостовую вену из расчета 200 мкл/животное. Уровень глюкозы в крови мышей определяют на 0, 30, 60, 120, 180 и 240 мин, результаты анализа приведены на фиг. 13. Наибольший гипогликемический эффект наблюдается при дозе LAX09 равной 0,1 и 1 мг/кг. Пример 5. Рекомбинантный белок, кодируемый приведенными в табл. 3 последовательностями, готовят для определения эффективности in vivo и in vitro в соответствии с методикой отбора проб, использованной в примере 1-4. Таблица 3 Рекомбинантный белок и его относительная биоактивность Относительная биологическая активность определяется как относительное соотношение между быстрым снижением глюкозы в крови (по сравнению с контрольной группой, получающей фосфатный буфер), индуцированном рекомбинантным белком, которое было определено в ходе эксперимента с длительным введением препарата (мыши линии KKAy с моделью диабетического ожирения) у мышей линииKKAy с диабетическим ожирением, и соответствующим значением для очищенного рекомбинантного белка, полученным в примере 2. В частности, длительное введение рекомбинантного белка осуществляется по следующему протоколу: мышей линии KKAy с моделью диабетического ожирения случайным образом распределяют на 2 группы, включая одну контрольную группу (получают инъекции фосфатного буфера) и одну экспериментальную группу (получают 1 мг/кг рекомбинантного белка эксендин-4, в соответствии с табл. 3). Препарат вводят два раза в неделю, перед определением уровня глюкозы натощак мышей не кормили в течение 6 ч. Снижение уровня глюкозы в крови в одной экспериментальной группе рассчитывается путем вычитания уровня глюкозы в крови натощак в экспериментальной группе от уровня в контрольной группе. При этом SEQ ID NO: 6 отличается от SEQ ID NO: 1 по двум аминокислотным остаткам и имеет последовательность, соответствующую формуле I; SEQ ID NO: 8 отличается от SEQ ID NO: 1 по 3 аминокислотным остаткам и имеет последовательность, соответствующую формуле I; SEQ ID NO: 10 отличается от SEQ ID NO: 1 по 4 аминокислотным остаткам и имеет последовательность, соответствующую формуле I; SEQ ID NO: 12 отличается от SEQ ID NO: 1 по 6 аминокислотным остаткам и имеет последовательность, соответствующую формуле I; SEQ ID NO: 14 представляет собой аминокислотную последовательность ГПП-1A8G; SEQ ID NO: 16 отличается от SEQ ID NO: 2 по 3 аминокислотным остаткам;SEQ ID NO: 18 отличается от SEQ ID NO: 2 по 3 аминокислотным остаткам, SEQ ID NO: 20 отличается от SEQ ID NO: 2 по 2 аминокислотным остаткам. Описанные выше результаты свидетельствуют о том, что рекомбинантный белок, предложенный согласно настоящему изобретению, эффективно снижает уровень глюкозы в крови, когда пептидный гормон представлен аминокислотной последовательностью, показанной на SEQ ID NO: 1 и транспортный белок представляет собой IgG2-Fc, он может существенно продлить как период полувыведения препарата in vivo, так и поддержать эффективность гипогликемического действия эксендина-4, а также повысить чувствительность организма к инсулину. Однако, если транспортный белок представляет собойIgG4-Fc, относительная биологическая активность рекомбинантного белка ниже. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Рекомбинантный белок, способный снижать уровень глюкозы в крови и полученный посредством слияния пептидного гормона с транспортным белком с помощью линкера, где пептидный гормон представляет собой эксендин-4 или его аналог и способен снижать уровень глюкозы в крови, а указанный транспортный белок представляет собой Fc-фрагмент иммуноглобулина IgG2; при этом указанный пептидный гормон включает последовательность, соответствующую формуле I 2. Рекомбинантный белок по п.1, отличающийся тем, что пептидный гормон представляет собой эксендин-4, имеющий аминокислотную последовательность SEQ ID NO: 1. 3. Рекомбинантный белок по п.1, отличающийся тем, что указанный линкер представляет собой пептид, имеющий следующую последовательность: (Gly)m-Xaa-(Gly)n, в которой m представляет целое число от 3 до 8, n представляет целое число от 3 до 8, Хаа представляет собой любую аминокислоту, выбранную из группы, состоящей из Gly, Ser, Ala и Thr. 4. Рекомбинантный белок по п.3, отличающийся тем, что m представляет целое число от 4 до 6, n представляет целое число от 4 до 6. 5. Рекомбинантный белок по п.4, отличающийся тем, что линкер имеет аминокислотную последовательность SEQ ID NO: 3. 6. Рекомбинантный белок по п.1, отличающийся тем, что Fc-фрагмент IgG2 происходит от человека. 7. Рекомбинантный белок по п.1, отличающийся тем, что имеет аминокислотную последовательность SEQ ID NO: 4. 8. Полинуклеотидная последовательность, кодирующая рекомбинантный белок по любому из пп.17. 9. Клетка-хозяин, полученная путем трансфекции клетки-реципиента вектором, который содержит полинуклеотидную последовательность по п.8, при этом указанная клетка-реципиент представляет собой клетку СНО. 10. Фармацевтическая композиция, содержащая эффективное количество рекомбинантного белка по любому из пп.1-7 и фармакологически приемлемый наполнитель. 11. Фармацевтическая композиция по п.10, отличающаяся тем, что е вводят местно, в виде аэрозоля или инъекции. 12. Фармацевтическая композиция по п.11, отличающаяся тем, что е вводят внутрибрюшинно,подкожно, внутримышечно и внутривенно. 13. Применение рекомбинантного белка по любому из пп.1-7 для производства лекарственного средства для лечения диабета и ожирения.
МПК / Метки
МПК: A61P 3/10, C07K 19/00, C12N 15/62, C12N 5/10, A61P 3/04, C12N 15/85, A61K 38/26
Метки: аналога, рекомбинантный, применение, способ, белок, эксендина-4, приготовления
Код ссылки
<a href="https://eas.patents.su/30-23037-rekombinantnyjj-belok-eksendina-4-i-ego-analoga-sposob-ih-prigotovleniya-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Рекомбинантный белок эксендина-4 и его аналога, способ их приготовления и применение</a>
Предыдущий патент: Пакер для установки гравийного фильтра по альтернативному пути и способ заканчивания ствола скважины с необсаженным забоем
Следующий патент: Соединения – ингибиторы фермента
Случайный патент: Циклопентеноны, способы их получения и применение