Триазолопиридины
Номер патента: 22353
Опубликовано: 30.12.2015
Авторы: Коппитц Маркус, Шульце Фолькер, Холтон Саймон, Широк Хартмут, Зимайстер Герхард, Венгнер Антье Маргарет, Бёмер Ульф, Коземунд Дирк, Бадер Беньямин, Линау Филип, Прехтль Штефан, Брим Ханс
Формула / Реферат
1. Соединение общей формулы (I)
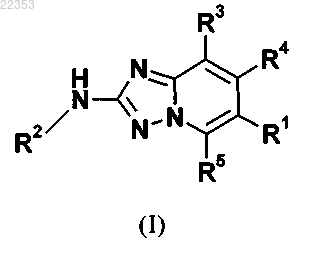
в которой R1 представляет собой фенильную группу,
которая замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из R6-(C1-C6-алкокси)-, R6-O-, -C(=O)R6, -C(=O)O-R6, -N(H)C(=O)R6, -N(H)C(=O)NR6R7, -NR6R7, -C(=O)N(H)R6, -C(=O)NR6R7, R6-S-, R6-S(=O)2-, -N(H)S(=O)2R6, -S(=O)2N(H)R6, и
которая необязательно замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из гало-, гидроксил-, нитро-, C1-С6-алкил-, C1-С6-алкокси-, гидрокси-С1-С6-алкил, -N(H)C(=O)R8, -N(H)C(=O)NR8R7, -C(=O)N(H)R8, -N(H)S(=O)2R8;
R2 представляет собой фенильную группу или пиридинильную группу, которая необязательно замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из гало-, циано-, нитро-, C1-С6-алкил-, гало-С1-С6-алкил-, C1-С6-алкокси-, гало-С1-С6-алкокси-, -O-(CH2)n-C(=O)NR8R7, -C(=O)N(H)R8, -C(=O)NR8R7, R8-S-, R8-S(=O)-, R8-S(=O)2-, -N(H)S(=O)R8, -N(R7)S(=O)R8, -S(=O)N(H)R8, -S(=O)NR8R7, -S(=O)2N(H)R8, -S(=O)2NR8R7;
R3 представляет собой атом водорода;
R4 представляет собой атом водорода;
R5 представляет собой атом водорода;
R6 представляет собой группу, выбранную из С3-С6-циклоалкила, 3-10-членного гетероциклила, фенила, гетероарила, -(СН2)q-(С3-С6-циклоалкила), -(CH2)q-(3-10-членного гетероциклила), -(СН2)q-фенила или -(СН2)q-гетероарила, где каждая гетероарильная группа, выбрана из пиридила, бензофуранила, бензизоксазолила, индазолила, хиназолинила, тиенила, хинолинила, бензотиенила, пиразолила и фуранила; где каждый 3-10-членный гетероциклил выбран из оксиранила, оксетанила, азиридинила, азетидинила, тетрагидрофуранила, пирролидинила, имидазолидинила, пиразолидинила, пирролинила, тетрагидропиранила, пиперидинила, морфолинила, дитианила, тиоморфолинила, пиперазинила, тритианила, хинуклидинила;
указанная R6 группа необязательно замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из гало-, гидроксил-, циано-, нитро-, C1-С6-алкил-, гало-С1-С6-алкил-, C1-С6-алкокси-, гало-С1-С6-алкокси-, гидрокси-С1-С6-алкил, С1-С6-алкокси-С1-С6-алкил-, гало-С1-С6-алкокси-С1-С6-алкил-, R8-(C1-С6-алкил)-, R8-(СН2)n(СНОН)(СН2)m-, R8-(C1-C6-алкокси)-, R8-(CH2)n(CHOH)(CH2)p-O-, R8-(C1-C6-алкокси-C1-C6-алкил)-, R8-(C1-C6-алкокси-C1-C6-алкил)-O-, фенила, R8-O-, -C(=O)R8, -C(=O)O-R8, -OC(=O)-R8, -N(H)C(=O)R8, -N(R7)C(=O)R8, -N(H)C(=O)NR8R7, -N(R7)C(=O)NR8R7, -NR8R7, -C(=O)N(H)R8, -C(=O)NR8R7, R8-S-, R8-S(=O)-, R8-S(=O)2-, -N(H)S(=O)R8, -N(R7)S(=O)R8, -S(=O)N(H)R8, -S(=O)NR8R7, -N(H)S(=O)2R8, -N(R7)S(=O)2R8, -S(=O)2N(H)R8, -S(=O)2NR8R7, -S(=O)(=NR8)R7, -S(=O)(=NR7)R8, -N=S(=O)(R8)R7;
R7 представляет собой атом водорода, C1-С6-алкил- или С3-С6-циклоалкилгруппу или
NR6R7 вместе представляют собой 3-10-членную гетероциклильную группу, выбранную из азиридинила, азетидинила, пирролидинила, имидазолидинила, пиразолидинила, пирролинила, пиперидинила, морфолинила, тиоморфолинила, пиперазинила, которая необязательно замещена, один или несколько раз, одинаково или различно, галогеном, гидрокси, циано-, нитро-, C1-С6-алкил-, гало-С1-С6-алкил-, C1-С6-алкокси-, гало-С1-С6-алкокси-, гидрокси-С1-С6-алкилом, С1-С6-алкокси-С1-С6-алкил-, гало-С1-С6-алкокси-С1-С6-алкил-, С2-С6-алкенил-, С2-С6-алкинил- или С3-С6-циклоалкил-;
R8 представляет собой атом водорода, C1-С6-алкил- или С3-С6-циклоалкилгруппу;
n, m, р представляют собой, независимо друг от друга, целое число 0, 1, 2, 3, 4 или 5;
q представляет собой целое число 0, 1, 2 или 3;
или его стереоизомер, таутомер, N-оксид, гидрат, сольват или соль или их смесь.
2. Соединение в соответствии с п.1, где
R1 представляет собой фенильную группу,
которая замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из R6-(C1-C6-алкокси)-, R6-O-, -C(=O)R6, -C(=O)O-R6, -N(H)C(=O)R6, -N(H)C(=O)NR6R7, -NR6R7, -C(=O)N(H)R6, -C(=O)NR6R7, R6-S-, R6-S(=O)2-, -N(H)S(=O)2R6, -S(=O)2N(H)R6, и
которая необязательно замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из гало-, гидроксил-, нитро-, C1-С6-алкил-, C1-С6-алкокси-, гидрокси-С1-С6-алкил, -N(H)C(=O)R8, -N(H)C(=O)NR8R7, -C(=O)N(H)R8, -N(H)S(=O)2R8;
R2 представляет собой фенильную группу или пиридинильную группу, которая необязательно замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из гало-, циано-, нитро-, C1-С6-алкил-, гало-С1-С6-алкил-, C1-С6-алкокси-, гало-С1-С6-алкокси-, -O-(CH2)n-C(=O)NR8R7, -C(=O)N(H)R8, -C(=O)NR8R7, R8-S-, R8-S(=O)-, R8-S(=O)2-, -N(H)S(=O)R8, -N(R7)S(=O)R8, -S(=O)N(H)R8, -S(=O)NR8R7, -S(=O)2N(H)R8, -S(=O)2NR8R7;
R3 представляет собой атом водорода;
R4 представляет собой атом водорода;
R5 представляет собой атом водорода;
R6 представляет собой группу, выбранную из С3-С6-циклоалкила, 3-10-членного гетероциклила, фенила, гетероарила, -(СН2)q-(С3-С6-циклоалкила), -(CH2)q-(3-10-членного гетероциклила), -(СН2)q-фенила или -(СН2)q-гетероарила, где каждая гетероарильная группа выбрана из пиридила, бензофуранила, бензизоксазолила, индазолила, хиназолинила, тиенила, хинолинила, бензотиенила, пиразолила и фуранила; где каждый 3-10-членный гетероциклил выбран из оксиранила, оксетанила, азиридинила, азетидинила, тетрагидрофуранила, пирролидинила, имидазолидинила, пиразолидинила, пирролинила, тетрагидропиранила, пиперидинила, морфолинила, дитианила, тиоморфолинила, пиперазинила, тритианила, хинуклидинила;
указанная R6 группа необязательно замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из гало-, гидроксил-, циано-, нитро-, C1-С6-алкил-, гало-С1-С6-алкил-, C1-С6-алкокси-, гало-С1-С6-алкокси-, гидрокси-С1-С6-алкил, C1-С6-алкокси-С1-С6-алкил-, гало-С1-С6-алкокси-С1-С6-алкил-, R8-(C1-C6-алкил)-, R8-(CH2)n(CHOH)(CH2)m-, R8-(C1-C6-алкокси)-, R8-(CH2)n(CHOH)(CH2)p-O-, R8-(C1-C6-алкокси-C1-C6-алкил)-, R8-(C1-C6-алкокси-C1-C6-алкил)-O-, фенила, R8-O-, -C(=O)R8, -C(=O)O-R8, -OC(=O)-R8, -N(H)C(=O)R8, -N(R7)C(=O)R8, -N(H)C(=O)NR8R7, -N(R7)C(=O)NR8R7, -NR8R7, -C(=O)N(H)R8, -C(=O)NR8R7, R8-S-, R8-S(=O)-, R8-S(=O)2-, -N(H)S(=O)R8, -N(R7)S(=O)R8, -S(=O)N(H)R8, -S(=O)NR8R7, -N(H)S(=O)2R8, -N(R7)S(=O)2R8, -S(=O)2N(H)R8, -S(=O)2NR8R7, -S(=O)(=NR8)R7, -S(=O)(=NR7)R8, -N=S(=O)(R8)R7;
R7 представляет собой атом водорода, C1-С6-алкил- или С3-С6-циклоалкилгруппу или
NR6R7 вместе представляют собой 3-10-членную гетероциклильную группу, выбранную из азиридинила, азетидинила, пирролидинила, имидазолидинила, пиразолидинила, пирролинила, пиперидинила, морфолинила, тиоморфолинила, пиперазинила, которая необязательно замещена, один или несколько раз, одинаково или различно, галогеном, гидрокси, циано-, нитро-, C1-С6-алкил-, гало-С1-С6-алкил-, C1-С6-алкокси-, гало-С1-С6-алкокси-, гидрокси-С1-С6-алкил, C1-С6-алкокси-С1-С6-алкил-, гало-С1-С6-алкокси-С1-С6-алкил-, С2-С6-алкенил-, С2-С6-алкинил- или С3-С6-циклоалкил-;
R8 представляет собой атом водорода, C1-С6-алкил- или С3-С6-циклоалкилгруппу;
n, m, p представляют собой, независимо друг от друга, целое число 0, 1, 2 или 3;
q представляет собой целое число 0, 1, 2 или 3;
или его стереоизомер, таутомер, N-оксид, гидрат, сольват или соль или их смесь.
3. Соединение в соответствии с п.1 или 2, где
R1 представляет собой фенильную группу,
которая замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из R6-(C1-C6-алкокси)-, R6-O-, -C(=O)R6, -C(=O)O-R6, -N(H)C(=O)R6, -N(H)C(=O)NR6R7, -NR6R7, -C(=O)N(H)R6, -C(=O)NR6R7, R6-S-, R6-S(=O)2-, -N(H)S(=O)2R6, -S(=O)2N(H)R6, и
которая необязательно замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из гало-, гидроксил-, нитро-, C1-С6-алкил-, C1-С6-алкокси-, гидрокси-С1-С6-алкил, -N(H)C(=O)R8, -N(H)C(=O)NR8R7, -C(=O)N(H)R8, -N(H)S(=O)2R8;
R2 представляет собой фенильную группу или пиридинильную группу, которая необязательно замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из гало-, циано-, нитро-, C1-С6-алкил-, гало-С1-С6-алкил-, C1-С6-алкокси-, гало-С1-С6-алкокси-, -O-(CH2)n-C(=O)NR8R7, -C(=O)N(H)R8, -C(=O)NR8R7, R8-S-, R8-S(=O)-, R8-S(=O)2-, -N(H)S(=O)R8, -N(R7)S(=O)R8, -S(=O)N(H)R8, -S(=O)NR8R7, -S(=O)2N(H)R8, -S(=O)2NR8R7;
R3, R4 представляют собой атом водорода;
R5 представляет собой атом водорода;
R6 представляет собой группу, выбранную из С3-С6-циклоалкила, 3-10-членного гетероциклила, фенила, гетероарила, -(СН2)q-(С3-С6-циклоалкила), -(CH2)q-(3-10-членного гетероциклила), -(СН2)q-фенила или -(СН2)q-гетероарила, где каждая гетероарильная группа выбрана из пиридила, бензофуранила, бензизоксазолила, индазолила, хиназолинила, тиенила, хинолинила, бензотиенила, пиразолила и фуранила;
указанная R6 группа необязательно замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из гало-, гидроксил-, циано-, нитро-, C1-С6-алкил-, гало-С1-С6-алкил-, C1-С6-алкокси-, гало-С1-С6-алкокси-, гидрокси-C1-С6-алкил, С1-С6-алкокси-С1-С6-алкил-, гало-С1-С6-алкокси-С1-С6-алкил-, R8-(С1-С6-алкил)-, R8-(CH2)n(CHOH)(CH2)m-, R8-(С1-С6-алкокси)-, R8-(CH2)n(CHOH)(CH2)p-O-, R8-(С1-С6-алкокси-С1-С6-алкил)-, R8-(С1-С6-алкокси-С1-С6-алкил)-О-, фенила, R8-O-, -C(=O)R8, -C(=O)O-R8, -OC(=O)-R8, -N(H)C(=O)R8, -N(R7)C(=O)R8, -N(H)C(=O)NR8R7, -N(R7)C(=O)NR8R7, -NR8R7, -C(=O)N(H)R8, -C(=O)NR8R7, R8-S-, R8-S(=O)-, R8-S(=O)2-, -N(H)S(=O)R8, -N(R7)S(=O)R8, -S(=O)N(H)R8, -S(=O)NR8R7, -N(H)S(=O)2R8, -N(R7)S(=O)2R8, -S(=O)2N(H)R8, -S(=O)2NR8R7, -S(=O)(=NR8)R7, -S(=O)(=NR7)R8, -N=S(=O)(R8)R7;
R7 представляет собой атом водорода, С1-С6-алкил- или С3-С6-циклоалкилгруппу или
NR6R7 вместе представляют собой 3-10-членную гетероциклильную группу, выбранную из азиридинила, азетидинила, пирролидинила, имидазолидинила, пиразолидинила, пирролинила, пиперидинила, морфолинила, тиоморфолинила, пиперазинила, которая необязательно замещена, один или несколько раз, одинаково или различно, галогеном, гидрокси, циано-, нитро-, C1-С6-алкил-, гало-С1-С6-алкил-, C1-С6-алкокси-, гало-С1-С6-алкокси-, гидрокси-С1-С6-алкилом, C1-С6-алкокси-С1-С6-алкил-, гало-С1-С6-алкокси-С1-С6-алкил-, С2-С6-алкенил-, С2-С6-алкинил- или С3-С6-циклоалкил-;
R8 представляет собой атом водорода, С1-С6-алкил- или С3-С6-циклоалкилгруппу;
n представляет собой целое число 0 или 1;
m представляет собой целое число 0, 1 или 2;
р представляет собой целое число 1 или 2;
q представляет собой целое число 0, 1 или 2;
или его стереоизомер, таутомер, N-оксид, гидрат, сольват или соль или их смесь.
4. Соединение в соответствии с любым из пп.1, 2 или 3, где
R1 представляет собой фенильную группу,
-которая замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из R6-(С1-С6-алкокси)-, R6-O-, -C(=O)R6, -C(=O)O-R6, -N(H)C(=O)R6, -N(H)C(=O)NR6R7, -NR6R7, -C(=O)N(H)R6, -C(=O)NR6R7, R6-S-, R6-S(=O)2-, -N(H)S(=O)2R6, -S(=O)2N(H)R6, и
которая необязательно замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из гало-, гидроксил-, нитро-, C1-С6-алкил-, C1-С6-алкокси-, гидрокси-C1-C6-алкил, -N(H)C(=O)R8, -N(H)C(=O)NR8R7, -C(=O)N(H)R8, -N(H)S(=O)2R8;
R2 представляет собой фенильную группу или пиридинильную группу, которая необязательно замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из гало-, циано-, нитро-, C1-С6-алкил-, гало-С1-С6-алкил-, C1-С6-алкокси-, гало-С1-С6-алкокси-, -O-(CH2)n-C(=O)NR8R7, -C(=O)N(H)R8, -C(=O)NR8R7, R8-S-, R8-S(=O)-, R8-S(=O)2-, -N(H)S(=O)R8, -N(R7)S(=O)R8, -S(=O)N(H)R8, -S(=O)NR8R7, -S(=O)2N(H)R8, -S(=O)2NR8R7;
R3, R4 представляют собой атом водорода;
R5 представляет собой атом водорода;
R6 представляет собой группу, выбранную из С3-С6-циклоалкила, 3-10-членного гетероциклила, фенила, гетероарила, -(CH2)q-(C3-C6-циклоалкила), -(CH2)q-(3-10-членного гетероциклила), -(СН2)q-фенила или -(СН2)q-гетероарила, где каждая гетероарильная группа выбрана из пиридила, бензофуранила, бензизоксазолила, индазолила, хиназолинила, тиенила, хинолинила, бензотиенила, пиразолила и фуранила;
указанная R6 группа необязательно замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из гало-, гидроксил-, циано-, нитро-, C1-С6-алкил-, гало-С1-С6-алкил-, C1-С6-алкокси-, гало-С1-С6-алкокси-, гидрокси-С1-С6-алкил, C1-С6-алкокси-С1-С6-алкил-, гало-С1-С6-алкокси-С1-С6-алкил-, -N(H)C(=O)R8, -N(R7)C(=O)R8, -N(H)C(=O)NR8R7, -N(R7)C(=O)NR8R7, -NR8R7, -C(=O)N(H)R8, -C(=O)NR8R7, R8-S-, R8-S(=O)-, R8-S(=O)2-;
R7 представляет собой атом водорода, C1-С6-алкил- или С3-С6-циклоалкилгруппу или
NR6R7 вместе представляют собой 3-10-членную гетероциклильную группу, выбранную из азиридинила, азетидинила, пирролидинила, имидазолидинила, пиразолидинила, пирролинила, пиперидинила, морфолинила, тиоморфолинила, пиперазинила, которая необязательно замещена, один или несколько раз, одинаково или различно, галогеном, гидрокси, циано-, нитро-, C1-С6-алкил-, гало-С1-С6-алкил-, C1-С6-алкокси-, гало-С1-С6-алкокси-, гидрокси-С1-С6-алкилом, C1-С6-алкокси-С1-С6-алкил-, гало-С1-С6-алкокси-С1-С6-алкил-, С2-С6-алкенил-, С2-С6-алкинил- или С3-С6-циклоалкил-;
R8 представляет собой атом водорода, C1-С6-алкил- или С3-С6-циклоалкилгруппу;
n представляет собой целое число 0 или 1;
q представляет собой целое число 0, 1 или 2;
или его стереоизомер, таутомер, N-оксид, гидрат, сольват или соль или их смесь.
5. Соединение в соответствии с любым из пп.1-3 или 4, которое выбирают из группы, включающей
N-циклопропил-4-[2-(2-метоксифениламино)[1,2,4]триазоло[1,5-а]пиридин-6-ил]бензамид;
3-{2-[(2-цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}-N-фенилбензамид;
N-(4-{2-[(2-цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-2-[4-(трифторметил)фенил]ацетамид;
N-(4-{2-[(2-цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-2-метокси-2-фенилацетамид;
N-(4-{2-[(2-цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-2-[3-(трифторметил)фенил]ацетамид;
N-(4-{2-[(2-цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-2-(2-фторфенил)ацетамид;
N-(4-{2-[(2-цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-2-(3-фторфенил)ацетамид;
N-(4-{2-[(2-цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-2-(4-фторфенил)ацетамид;
1-(4-{2-[(2-цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-3-фенилмочевину;
N-(4-{2-[(2-цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-2-(пиридин-3-ил)ацетамид;
N-(4-{2-[(2-цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-2-(3-метоксифенил)ацетамид;
N-(4-{2-[(2-цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-2-(3,4-дифторфенил)ацетамид;
N-(4-{2-[(2-цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-2-фенилацетамид;
N-(4-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-2-фенилацетамид;
2-циклопропил-N-(4-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)ацетамид;
N-(4-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)циклопропанкарбоксамид;
2-фенил-N-[4-(2-{[2-(трифторметил)фенил]амино}[1,2,4]триазоло[1,5-а]пиридин-6-ил)фенил]ацетамид;
N-[4-(2-{[2-(трифторметил)фенил]амино}[1,2,4]триазоло[1,5-а]пиридин-6-ил)фенил]циклопропанкарбоксамид;
2-циклопропил-N-[4-(2-{[2-(трифторметил)фенил]амино}[1,2,4]триазоло[1,5-а]пиридин-6-ил)фенил]ацетамид;
2-(4-метилпиперазин-1-ил)-N-[4-(2-{[2-(трифторметил)фенил]амино}[1,2,4]триазоло[1,5-а]пиридин-6-ил)фенил]ацетамид;
2-(морфолин-4-ил)-N-[4-(2-{[2-(трифторметил)фенил]амино}[1,2,4]триазоло[1,5-а]пиридин-6-ил)фенил]ацетамид;
2-(пиперидин-1-ил)-N-[4-(2-{[2-(трифторметил)фенил]амино}[1,2,4]триазоло[1,5-а]пиридин-6-ил)фенил]ацетамид;
2-амино-2-фенил-N-[4-(2-{[2-(трифторметил)фенил]амино}[1,2,4]триазоло[1,5-а]пиридин-6-ил)фенил]ацетамид;
2-(пиридин-3-ил)-N-[4-(2-{[2-(трифторметил)фенил]амино}[1,2,4]триазоло[1,5-а]пиридин-6-ил)фенил]ацетамид;
2-метокси-2-фенил-N-[4-(2-{[2-(трифторметил)фенил]амино}[1,2,4]триазоло[1,5-а]пиридин-6-ил)фенил]ацетамид;
N-(4-{2-[(2-циано-5-метилфенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-2-фенилацетамид;
N-(4-{2-[(2-циано-3-фторфенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-2-фенилацетамид;
N-(3-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-2-фенилацетамид;
N-(3-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)циклопропанкарбоксамид;
1-циклопропил-N-(3-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)метансульфонамид;
N-(3-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)циклопропансульфонамид;
1-(3-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-3-фенилмочевину;
N-(3-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)бензолсульфонамид;
N-(3-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)бензамид;
N-(3-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-4-метилпиперазин-1-карбоксамид;
1-циклопропил-3-(3-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)мочевину;
N-(3-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)морфолине-4-карбоксамид;
4-(диметиламино)-N-(3-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)пиперидин-1-карбоксамид;
1-(3-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-3-пиридин-3-илмочевину;
1-(3-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-3-[2-(морфолин-4-ил)этил]мочевину;
1-(3-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}фенил)-3-пиридин-4-илмочевину;
2-[(6-{3-[(4-метилпиперазин-1-ил)карбонил]фенил}[1,2,4]триазоло[1,5-а]пиридин-2-ил)амино]бензонитрил;
3-{2-[(2-цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}-N-циклопентилбензамид;
3-{2-[(2-цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}-N-(1-метилпиперидин-4-ил)бензамид;
N-бензил-3-{2-[(2-цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}бензамид;
3-{2-[(2-цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}-N-циклопропилбензамид;
N-циклопропил-3-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}бензамид и
N-бензил-3-{2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-ил}бензамид.
6. Способ получения соединения общей формулы (I) в соответствии с любым из пп.1-5, в котором промежуточное соединение общей формулы (5)
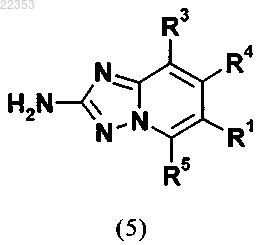
в которой R1, R3, R4 и R5 имеют значение, как определено для соединения общей формулы (I) в любом из пп.1-5,
вводят в реакцию с фенилгалогенидом общей формулы (5а)

в которой R2 имеет значение, как определено для соединения общей формулы (I) в любом из пп.1-5, и Y представляет собой атом галогена или трифторметилсульфонилокси или нонафторбутилсульфонилоксигруппу, обеспечивая соединение общей формулы (I)
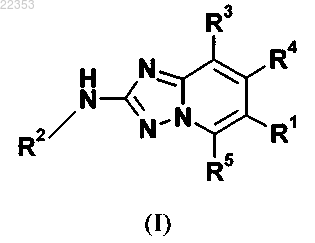
в которой R1, R2, R3, R4 и R5 имеют значение, как определено в любом из пп.1-5.
7. Способ получения соединения общей формулы (I) в соответствии с любым из пп.1-5, в котором промежуточное соединение общей формулы (7)
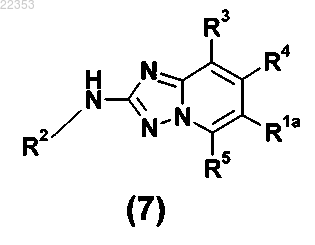
в которой R2, R3, R4 и R5 имеют значение, как определено для соединения общей формулы (I) в любом из пп.1-5, и R1a представляет собой фенильную группу, с которой связан -NH2 заместитель,
вводят в реакцию с соединением общей формулы
в которой R1b представляет собой -C(=O)R6, -C(=O)NR6R7, -S(=O)R6, -S(=O)2R6 и X представляет собой подходящую функциональную группу, посредством которой R1b R1b-X соединения (7а) может быть связан, с помощью реакции амидного сочетания, на -NH2 заместитель, связанный с фенильной группой R1a соединения (7), таким образом заменяя указанный X на указанный R1a, таким образом обеспечивая соединение общей формулы (I)
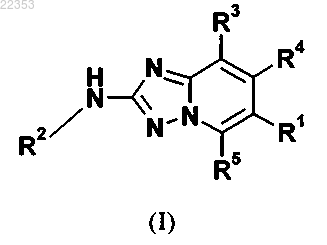
в которой R1, R2, R3, R4 и R5 имеют значение, как определено в любом из пп.1-5.
8. Фармацевтическая композиция, которая содержит соединение общей формулы (I) или его стереоизомер, таутомер, N-оксид, гидрат, сольват или его фармацевтически приемлемую соль или их смесь в соответствии с любым из пп.1-5 и фармацевтически приемлемый разбавитель или носитель.
9. Фармацевтическая комбинация, которая содержит
одно или несколько соединений общей формулы (I) или его стереоизомер, таутомер, N-оксид, гидрат, сольват или его фармацевтически приемлемую соль или их смесь в соответствии с любым из пп.1-5; и
один или несколько агентов, выбранных из следующих соединений: таксан, такой как доцетаксел, паклитаксел или таксол; эпотилон, такой как иксабепилон, патупилон или сагопилон; митоксантрон; преднизолон; дексаметазон; эстрамустин; винбластин; винкристин; доксорубицин; адриамицин; идарубицин; даунорубицин; блеомицин; этопозид; циклофосфамид; ифосфамид; прокарбазин; мельфалан; 5-фторурацил; капецитабин; флударабин; цитарабин; ара-с; 2-хлор-2'-дезоксиаденозин; тиогуанин; антиандроген, такой как флутамид, ципротерон ацетат или бикалутамид; бортезомиб; производное платины, такое как цисплатин или карбоплатин; хлорамбуцил; метотрексат и ритуксимаб.
10. Применение соединения общей формулы (I) или его стереоизомера, таутомера, N-оксида, гидрата, сольвата или его фармацевтически приемлемой соли или их смеси в соответствии с любым из пп.1-5 для приготовления лекарственного средства для профилактики или лечения заболевания, где указанное заболевание представляет собой заболевание неконтролируемого роста, пролиферации и/или выживания клеток, неподходящего клеточного иммунного ответа или неподходящего клеточного воспалительного ответа, в особенности, где неконтролируемый рост, пролиферация и/или выживание клеток, неподходящий клеточный иммунный ответ или неподходящий клеточный воспалительный ответ опосредуются Mps-1, более предпочтительно, где заболевание неконтролируемого роста, пролиферации и/или выживания клеток, неподходящего клеточного иммунного ответа или неподходящего клеточного воспалительного ответа представляет собой гематологическую опухоль, солидную опухоль и/или их метастазы, например лейкозы и миелодиспластический синдром, злокачественные лимфомы, опухоли головы и шеи, включая опухоли головного мозга и метастазы головного мозга, опухоли грудной клетки, включая немелкоклеточные и мелкоклеточные опухоли легких, опухоли желудочно-кишечного тракта, эндокринные опухоли, опухоли молочной железы и другие гинекологические опухоли, урологические опухоли, включая опухоли почек, мочевого пузыря и предстательной железы, опухоли кожи и саркомы и/или их метастазы.
11. Соединение общей формулы (7)
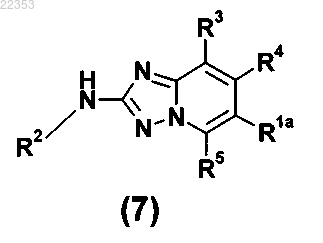
в которой R2, R3, R4 и R5 имеют значение, как определено для соединения общей формулы (I) в любом из пп.1-5, и R1a представляет собой фенильную группу, с которой связан -NH2 заместитель.
12. Применение соединения общей формулы (5)
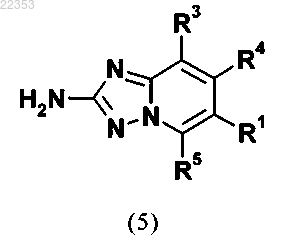
в которой R1, R3, R4 и R5 имеют значение, как определено для соединения общей формулы (I) в любом из пп.1-5,
или его стереоизомера, таутомера, N-оксида, гидрата, сольвата или соли или их смеси для приготовления соединения общей формулы (I) в соответствии с любым из пп.1-5.
13. Применение соединения общей формулы (7) в соответствии с п.11 для приготовления соединения общей формулы (I) в соответствии с любым из пп.1-5.
Текст
Настоящее изобретение относится к триазолопиридиновым соединениям общей формулы (I) в которой R1, R2, R3, R4 и R5 имеют значения, представленные в описании и в пунктах формулы, к способам получения указанных соединений, к фармацевтическим композициям и комбинациям, содержащим указанные соединения, к применению указанных соединений для приготовления фармацевтической композиции для лечения или профилактики заболевания, а также к промежуточным соединениям, пригодным для приготовления указанных соединений.(71)(73) Заявитель и патентовладелец: БАЙЕР ИНТЕЛЛЕКТЧУАЛ ПРОПЕРТИ ГМБХ (DE) Настоящее изобретение относится к триазолопиридиновым соединениям общей формулы (I), как описано и определено в указанной заявке, к способам получения указанных соединений, к фармацевтическим композициям и комбинациям, содержащим указанные соединения, к применению указанных соединений для приготовления фармацевтической композиции для лечения или профилактики заболевания, а также к промежуточным соединениям, пригодным для приготовления указанных соединений. Предпосылки создания изобретения Настоящее изобретение относится к химическим соединениям, которые ингибируют Mps-1 (однополюстное веретено 1) киназу (также известную как тирозинтреонинкиназа, ТТК). Mps-1 представляет собой Ser/Thr киназу с двойной специфичностью, которая играет решающую роль в активации митотической контрольной точки (также известной как контрольная точка веретена, контрольная точка сборки веретена), таким образом обеспечивая правильное расхождение хромосом в процессе осуществления митоза [Abrieu A. и др. Cell, 2001, 106, 83-93]. Каждая делящаяся клетка должна обеспечить равное разделение реплицированных хромосом в две дочерние клетки. При вхождении в митоз хромосомы присоединяются на их кинетохорах к микротрубочкам аппарата веретена. Контрольная точка митоза представляет собой контролирующий механизм, который активный до тех пор, пока присутствуют неприсоединенные кинетохоры, и предотвращает митотические клетки от вхождения в анафазу и, таким образом,завершение деления клеток с неприсоединенными хромосомами [Suijkerbuijk S.J. и Kops G.J. Biochemicaet Biophysica Acta, 2008, 1786, 24-31; Musacchio А. и Salmon E.D., Nat Rev Mol Cell Biol., 2007, 8, 379-93]. Как только все кинетохоры присоединяются правильным амфителическим, то есть биполярным, образом к митотическому веретену, контрольная точка удовлетворяется и клетка входит в анафазу и проходит через митоз. Контрольная точка митоза состоит из комплексной сети незаменимых белков, включая представителей семейств MAD (дефект задержки митоза, MAD 1-3) и Bub (почкование, неингибированное бензимидазолом, Bub 1-3), двигательный белок CENP-E, Mps-1 киназа, а также другие компоненты,многие из них сверхэкспрессируются в пролиферирующих клетках (например, раковых клетках) и тканях[Yuan В. и др. Clinical Cancer Research, 2006, 12, 405-10]. Существенная роль активности Mps-1 киназы в передаче сигналов контрольной точки митоза была показана с помощью мшРНК-молчания, химической генетики, а также химических ингибиторов Mps-1 киназы [Jelluma N. и др. PLos ONE, 2008, 3, е 2415;Schmidt M. et al. EMBO Reports, 2005, 6, 866-72]. Существует достаточное доказательство, связывающее уменьшенную, но неполную митотическую функцию контрольной точки с анэуплоидией и онкогенезом [Weaver B.A. и Cleveland D.W. Cancer Research, 2007, 67, 10103-5; King R.W. Biochimica et Biophysica Acta, 2008, 1786, 4-14]. В отличие от этого,установлено, что полное ингибирование контрольной точки митоза приводит к серьезным нарушениям расхождения хромосом и индукции апоптоза в опухолевых клетках [Kops G.J. и др. Nature Reviews Cancer, 2005, 5, 773-85; Schmidt M. и Medema R.H. Cell Cycle, 2006, 5, 159-63; Schmidt M. и Bastians H. DrugResistance Updates, 2007, 10, 162-81]. Следовательно, нейтрализация контрольной точки митоза с помощью фармакологического ингибирования Mps-1 киназы или других компонентов контрольной точки митоза представляет собой новый подход для лечения пролиферативных нарушений, включая солидные опухоли, такие как карциномы, саркомы, лейкозы и лимфолейкозы или другие нарушения, связанные с неконтролируемой пролиферацией клеток.WO 2008/025821 A1 (Cellzome (UK) Ltd) относится к производным триазола в качестве ингибиторов киназы, в особенности ингибиторов ITK или PI3K, для лечения или профилактики иммунологических, воспалительных или аллергических нарушений. Указанные производные триазола иллюстрируются как обладающие амидным, мочевинным или алифатическим аминовым заместителем в положении 2.WO 2009/047514 A1 (Cancer Research Technology Limited) относится к [1,2,4]триазоло[1,5-а]пиридиновым и [1,2,4]триазоло[1,5-с]пиримидиновым соединениям, которые ингибируют функцию AXL рецепторной тирозин киназы, и к лечению заболеваний и состояний, которые опосредуются AXL рецепторной тирозинкиназой, которые облегчаются путем ингибирования функции AXL рецепторной тирозинкиназы и т.д., включая пролиферативные состояния, такие как злокачественное новообразование и др. Указанные соединения иллюстрируются как обладающие заместителем в 5-м положении указанных соединений и заместителем во 2-м положении. Однако в уровне техники, указанном выше, не описаны триазолопиридиновые соединения общей формулы (I) настоящего изобретения или их стереоизомер, таутомер, N-оксид, гидрат, сольват или соль или их смесь, как описано и определено в настоящей заявке, и которые далее в настоящей заявке обозначаются как "соединения согласно настоящему изобретению", или их фармакологическая активность. Сейчас было обнаружено, и это оставляет основу настоящего изобретения, что указанные соединения согласно настоящему изобретению имеют неожиданные и благоприятные свойства. В особенности, неожиданно было обнаружено, что указанные соединения согласно настоящему изобретению эффективно ингибируют Mps-1 киназу и, следовательно, могут применяться для лечения или профилактики заболеваний неконтролируемого роста, пролиферации и/или выживания клеток, неподходящих клеточных иммунных ответов или неподходящих клеточных воспалительных ответов или заболеваний, которые сопровождаются неконтролируемым ростом, пролиферацией и/или выживанием клеток, неподходящими клеточными иммунными ответами или неподходящими клеточными воспалительными ответами, в особенности, где неконтролируемый рост, пролиферация и/или выживание клеток,неподходящие клеточные иммунные ответы или неподходящие клеточные воспалительные ответы опосредуются Mps-1 киназой, такое как, например, гематологические опухоли, солидные опухоли и/или их метастазы, например лейкозы и миелодиспластический синдром, злокачественные лимфомы, опухоли головы и шеи, включая опухоли головного мозга и метастазы головного мозга, опухоли грудной клетки,включая немелкоклеточные и мелкоклеточные опухоли легких, опухоли желудочно-кишечного тракта,эндокринные опухоли, опухоли молочной железы и другие гинекологические опухоли, урологические опухоли, включая опухоли почек, мочевого пузыря и предстательной железы, опухоли кожи и саркомы и/или их метастазы. Описание изобретения В соответствии с первым аспектом настоящее изобретение охватывает соединения общей формулы где R1 представляет собой фенильную группу,которая замещена, один или несколько раз, одинаково или различно, заместителем, выбранным изR6-(C1-С 6-алкокси)-, R6-О-, -C(=O)R6, -C(=O)O-R6, -N(H)C(=O)R6, -N(H)C(=O)NR6R7, -NR6R7,-C(=O)N(H)R6, -C(=O)NR6R7, R6-S-, R6-S(=O)2-, -N(H)S(=O)2R6, -S(=O)2N(H)R6, и которая необязательно замещена, один или несколько раз, одинаково или различно, заместителем,выбранным из гало-, гидроксил-, нитро-, C1-С 6-алкил-, C1-С 6-алкокси-, гидрокси-С 1-С 6-алкил,-N(H)C(=O)R8, -N(H)C(=O)NR8R7, -C(=O)N(H)R8, -N(H)S(=O)2R8;R2 представляет собой фенильную группу или пиридинильную группу,которая необязательно замещена, один или несколько раз, одинаково или различно, заместителем,выбранным из гало-, циано-, нитро-, C1-С 6-алкил-, гало-С 1-С 6-алкил-, C1-С 6-алкокси-, гало-С 1-С 6-алкокси,-O-(CH2)n-C(=O)NR8R7, -C(=O)N(H)R8, -C(=O)NR8R7, R8-S-, R8-S(=O)-, R8-S(=O)2-, -N(H)S(=O)R8,-N(R7)S(=O)R8, -S(=O)N(H)R8, -S(=O)NR8R7, -S(=O)2N(H)R8, -S(=O)2NR8R7;R3 представляет собой атом водорода;R4 представляет собой атом водорода;R5 представляет собой атом водорода;R6 представляет собой группу, выбранную из С 3-С 6-циклоалкила, 3-10-членного гетероциклила, фенила, гетероарила, -(СН 2)q-(С 3-С 6-циклоалкила), -(CH2)q-(3-10-членного гетероциклила), -(СН 2)q-фенила или -(СН 2)q-гетероарила, где каждая гетероарильная группа, выбрана из пиридила, бензофуранила, бензизоксазолила, индазолила, хиназолинила, тиенила, хинолинила, бензотиенила, пиразолила и фуранила; где каждый 3-10-членный гетероциклил, выбран из оксиранила, оксетанила, азиридинила, азетидинила,тетрагидрофуранила, пирролидинила, имидазолидинила, пиразолидинила, пирролинила, тетрагидропиранила, пиперидинила, морфолинила, дитианила, тиоморфолинила, пиперазинила, тритианила, хинуклидинила; указанная R6 группа необязательно замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из гало-, гидроксил-, циано-, нитро-, C1-С 6-алкил-, гало-С 1-С 6-алкил-, C1-С 6 алкокси-, гало-С 1-С 6-алкокси-, гидрокси-С 1-С 6-алкил, C1-С 6-алкокси-С 1-С 6-алкил-, гало-С 1-С 6-алкоксиС 1-С 6-алкил-, R8-(C1-С 6-алкил)-, R8-(CH2)n(CHOH)(CH2)m-, R8-(С 1-С 6-алкокси)-, R8-(CH2)n(CHOH)(CH2)pR7 представляет собой атом водорода, C1-С 6-алкил- или С 3-С 6-циклоалкилгруппу; илиNR6R7 вместе представляют собой 3-10-членную гетероциклильную группу, выбранную из азиридинила, азетидинила, пирролидинила, имидазолидинила, пиразолидинила, пирролинила, пиперидинила,морфолинила, тиоморфолинила, пиперазинила; которая необязательно замещена, один или несколько раз, одинаково или различно, галогеном, гидрокси, циано-, нитро-, C1-С 6-алкил-, гало-С 1-С 6-алкил-, C1-С 6-алкокси-, гало-С 1-С 6-алкокси-, гидрокси-С 1 С 6-алкилом, C1-С 6-алкокси-С 1-С 6-алкил-, гало-С 1-С 6-алкокси-С 1-С 6-алкил-, С 2-С 6-алкенил-, С 2-С 6-алкинил- или С 3-С 6-циклоалкил-;R8 представляет собой атом водорода, C1-С 6-алкил- или С 3-С 6-циклоалкилгруппу;n, m, р представляют собой, независимо друг от друга, целое число 0, 1, 2, 3, 4 или 5;q представляет собой целое число 0, 1, 2 или 3; или их стереоизомер, таутомер, N-оксид, гидрат, сольват или соль или их смесь. Термины, как указано в тексте настоящей заявки, предпочтительно имеют следующие значения. Термин "атом галогена" или "гало-" обозначает атом фтора, хлора, брома или йода. Термин "C1-С 6-алкил" предпочтительно обозначает линейную или разветвленную, насыщенную,одновалентную углеводородную группу, имеющую 1, 2, 3, 4, 5 или 6 атомов углерода, например метильную, этильную, пропильную, бутильную, пентильную, гексильную, изопропильную, изобутильную,втор-бутильную, трет-бутильную, изопентильную, 2-метилбутильную, 1-метилбутильную, 1-этилпропильную, 1,2-диметилпропильную, неопентильную, 1,1-диметилпропильную, 4-метилпентильную, 3-метилпентильную, 2-метилпентильную, 1-метилпентильную, 2-этилбутильную, 1-этилбутильную, 3,3-диметилбутильную, 2,2-диметилбутильную, 1,1-диметилбутильную, 2,3-диметилбутильную, 1,3-диметилбутильную или 1,2-диметилбутильную группу или ее изомер. В особенности, указанная группа имеет 1,2, 3 или 4 атома углерода ("С 1-С 4-алкил"), например метильная, этильная, пропильная, бутильная, изопропильная, изобутильная, втор-бутильная, трет-бутильная группа, более предпочтительно 1, 2 или 3 атома углерода ("C1-С 3-алкил"), например метильная, этильная, н-пропил- или изопропильная группа. Термин "гало-С 1-С 6-алкил" предпочтительно обозначает линейную или разветвленную, насыщенную, одновалентную углеводородную группу, в которой термин "C1-С 6-алкил" имеет значения, указанные выше, и в которой один или несколько атомов водорода заменены атомом галогена, одинаково или различно, то есть один атом галогена является независимым от другого. В особенности, указанный атом галогена представляет собой F. Указанная гало-С 1-С 6-алкильная группа представляет собой, например,-CF3, -CHF2, -CH2F, -CF2CF3 или -CH2CF3. Термин "C1-С 6-алкокси" предпочтительно обозначает линейную или разветвленную, насыщенную,одновалентную, углеводородную группу формулы -О-алкил, в которой термин "алкил" имеет значения,указанные выше, например метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, третбутокси, втор-бутокси, пентокси, изопентокси или н-гексоксигруппу или ее изомер. Термин "гало-С 1-С 6-алкокси" предпочтительно обозначает линейную или разветвленную, насыщенную, одновалентную C1-С 6-алкоксигруппу, как определено выше, в которой один или несколько атомов водорода заменены, одинаково или различно, атомом галогена. В особенности, указанный атом галогена представляет собой F. Указанная гало-С 1-С 6-алкоксигруппа представляет собой, например, -OCF3,-OCHF2, -OCH2F, -OCF2CF3 или -OCH2CF3. Термин "С 1-С 6-алкокси-С 1-С 6-алкил" предпочтительно обозначает линейную или разветвленную,насыщенную, одновалентную алкильную группу, как определено выше, в которой один или несколько атомов водорода заменены, одинаково или различно, C1-С 6-алкоксигруппой, как определено выше, например метоксиалкил, этоксиалкил, пропилоксиалкил, изопропоксиалкил, бутоксиалкил, изобутоксиалкил, трет-бутоксиалкил, втор-бутоксиалкил, пентилоксиалкил, изопентилоксиалкил, гексилоксиалкильную группу, в которой термин "C1-С 6-алкил" имеет значения, указанные выше, или ее изомер. Термин "гало-С 1-С 6-алкокси-С 1-С 6-алкил" предпочтительно обозначает линейную или разветвленную, насыщенную, одновалентную С 1-С 6-алкокси-С 1-С 6-алкильную группу, как определено выше, в которой один или несколько атомов водорода заменены, одинаково или различно, атомом галогена. В особенности, указанный атом галогена представляет собой F. Указанная гало-C1-С 6-алкокси-С 1-С 6 алкильная группа представляет собой, например, -CH2CH2OCF3, -CH2CH2OCHF2, -CH2CH2OCH2F,-CH2CH2OCF2CF3 или -CH2CH2OCH2CF3. Термин "С 2-С 6-алкенил" предпочтительно обозначает линейную или разветвленную, одновалентную углеводородную группу, которая содержит одну или несколько двойных связей и которая имеет 2, 3,4, 5 или 6 атомов углерода, в особенности 2 или 3 атома углерода ("С 2-С 3-алкенил"), и подразумевается,что в случае, когда указанная алкенильная группа содержит больше одной двойной связи, то указанные двойные связи могут быть отделены от или конъюгированы друг другом. Указанная алкенильная группа представляет собой, например, винил, аллил, (Е)-2-метилвинил, (Z)-2-метилвинил, гомоаллил, (Е)-бут-2 енил, (Z)-бут-2-енил, (Е)-бут-1-енил, (Z)-бут-1-енил, пент-4-енил, (Е)-пент-3-енил, (Z)-пент-3-енил, (Е)пент-2-енил, (Z)-пент-2-енил, (Е)-пент-1-енил, (Z)-пент-1-енил, гекс-5-енил, (Е)-гекс-4-енил, (Z)-гекс-4 енил, (Е)-гекс-3-енил, (Z)-гекс-3-енил, (Е)-гекс-2-енил, (Z)-гекс-2-енил, (Е)-гекс-1-енил, (Z)-гекс-1-енил,изопропенил, 2-метилпроп-2-енил, 1-метилпроп-2-енил, 2-метилпроп-1-енил, (Е)-1-метилпроп-1-енил,(Z)-1-метилпроп-1-енил, З-метилбут-3-енил, 2-метилбут-3-енил, 1-метилбут-3-енил, 3-метилбут-2-енил,(Е)-2-метилбут-2-енил, (Z)-2-метилбут-2-енил, (Е)-1-метилбут-2-енил, (Z)-1-метилбут-2-енил, (Е)-3 метилбут-1-енил, (Z)- 3-метилбут-1-енил, (Е)-2-метилбут-1-енил, (Z)-2-метилбут-1-енил, (Е)-1-метилбут 1-енил, (Z)-1-метилбут-1-енил, 1,1-диметилпроп-2-енил, 1-этилпроп-1-енил, 1-пропилвинил, 1-изопропилвинил, 4-метилпент-4-енил, 3-метилпент-4-енил, 2-метилпент-4-енил, 1-метилпент-4-енил, 4-метилпент-3-енил, (Е)-3-метилпент-3-енил, (Z)-3-метилпент-3-енил, (Е)-2-метилпент-3-енил, (Z)-2-метилпент 3-енил, (Е)-1-метилпент-3-енил, (Z)-1-метилпент-3-енил, (Е)-4-метилпент-2-енил, (Z)-4-метилпент-2 енил, (Е)-3-метилпент-2-енил, (Z)-3-метилпент-2-енил, (Е)-2-метилпент-2-енил, (Z)-2-метилпент-2-енил,(Е)-1-метилпент-2-енил, (Z)-1-метилпент-2-енил, (Е)-4-метилпент-1-енил, (Z)-4-метилпент-1-енил, (Е)-3 метилпент-1-енил, (Z)-3-метилпент-1-енил, (Е)-2-метилпент-1-енил, (Z)-2-метилпент-1-енил, (Е)-1 метилпент-1-енил, (Z)-1-метилпент-1-енил, 3-этилэтил-3-енил, 2-этилэтил-3-енил, 1-этилэтил-3-енил, (Е)-3 022353 3-этилбут-2-енил, (Z)-3-этилбут-2-енил, (Е)-2-этилбут-2-енил,(Z)-2-этилбут-2-енил, (Е)-1-этилбут-2-енил,(Z)-1-этилбут-2-енил, (Е)-3-этилбут-1-енил, (Z)-3-этилбут-1-енил, 2-этилбут-1-енил, (Е)-1-этилбут-1 енил, (Z)-1-этилбут-1-енил, 2-пропилпроп-2-енил, 1-пропилпроп-2-енил, 2-изопропилпроп-2-енил, 1 изопропилпроп-2-енил, (Е)-2-пропилпроп-1-енил, (Z)-2-пропилпроп-1-енил, (E)-1-пропилпроп-1-енил,(Z)-1-пропилпроп-1-енил, (Е)-2-изопропилпроп-1-енил, (Z)-2-изопропилпроп-1-енил, (Е)-1-изопропилпроп-1-енил, (Z)-1-изопропилпроп-1-енил, (Е)-3,3-диметилпроп-1-енил, (Z)-3,3-диметилпроп-1-енил, 1(1,1-диметилэтил)этенил, бута-1,3-диенил, пента-1,4-диенил, гекса-1,5-диенил или метилгексадиенил группу. В особенности, указанная группа представляет собой винил или аллил. Термин "С 2-С 6-алкинил" предпочтительно обозначает линейную или разветвленную, одновалентную углеводородную группу, которая содержит одну или несколько тройных связей и которая содержит 2, 3, 4, 5 или 6 атомов углерода, в особенности 2 или 3 атома углерода ("С 2-С 3-алкинил"). Указанная С 2 С 6-алкинильная группа представляет собой, например, этинил, проп-1-инил, проп-2-инил, бут-1-инил,бут-2-инил, бут-3-инил, пент-1-инил, пент-2-инил, пент-3-инил, пент-4-инил, гекс-1-инил, гекс-2-инил,гекс-3-инил, гекс-4-инил, гекс-5-инил, 1-метилпроп-2-инил, 2-метилбут-3-инил, 1-метилбут-3-инил, 1 метилбут-2-инил, 3-метилбут-1-инил, 1-этилпроп-2-инил, 3-метилпент-4-инил, 2-метилпент-4-инил, 1 метилпент-4-инил, 2-метилпент-3-инил, 1-метилпент-3-инил, 4-метилпент-2-инил, 1-метилпент-2-инил,4-метилпент-1-инил, 3-метилпент-1-инил, 2-этилэтил-3-инил, 1-этилэтил-3-инил, 1-этилэтил-2-инил, 1 пропилпроп-2-инил, 1-изопропилпроп-2-инил, 2,2-диметилбут-3-инил, 1,1-диметилбут-3-инил, 1,1-диметилбут-2-инил или 3,3-диметилбут-1-инил группу. В особенности, указанная алкинильная группа представляет собой этинил, проп-1-инил или проп-2-инил. Термин "С 3-С 6-циклоалкил" предпочтительно обозначает насыщенное, одновалентное, моно- или бициклическое углеродное кольцо, которое содержит 3, 4, 5 или 6 атомов углерода ("С 3-С 6-циклоалкил"). Указанная С 3-С 6-циклоалкильная группа представляет собой, например, моноциклическое углеродное кольцо, например циклопропильное, циклобутильное, циклопентильное или циклогексильное, или бициклическое углеродное кольцо, например пергидропенталениленовое или декалиновое кольцо. Указанное циклоалкильное кольцо необязательно может содержать одну или несколько двойных связей, например циклоалкенил, такой как циклопропенильная, циклобутенильная, циклопентенильная или циклогексенильная группа, где связь между указанным кольцо и остальной частью молекулы может быть с любым атомом углерода указанного кольца, будь то насыщенная или ненасыщенная. Термин "гетероциклическое кольцо", как используется в термине "4-, 5-, 6-, 7-, 8-, 9- или 10-членное гетероциклическое кольцо", или "4-6-членное гетероциклическое кольцо", или "5-6-членное гетероциклическое кольцо", например, как используется в определении соединений общей формулы (I), как определено в настоящей заявке, обозначает насыщенное или частично ненасыщенное, моно-, би- или полициклическое кольцо, содержащее атом азота, указанный атом азота является точкой присоединения указанного гетероциклического кольца с остальной частью молекулы. Указанное кольцо, содержащее атом азота, необязательно дополнительно содержит 1 или 2 группы, содержащие гетероатом, выбранные из О,С(=O), S, S(=O), S(=O)2, NR1, в которой R1 имеет значения, как определено выше. В особенности, не ограничиваясь только этим, указанное кольцо, содержащее атом азота, может представлять собой 4 членное кольцо, такое как азетидинильное кольцо, например, или 5-членное кольцо, такое как пирролидинильное кольцо, например, или 6-членное кольцо, такое как пиперидинильное, пиперазинильное, морфолинильное или тиоморфолинильное кольцо, например, или 7-членное кольцо, такое как диазепанильное кольцо, например, или 8-, 9- или 10-членное кольцо, такое как циклогептиламинильное, циклооктиламинильное или циклонониламинильное кольцо соответственно, например, следует повторить, что любое из вышеуказанных колец, содержащих атом азота, может дополнительно содержать 1 или 2 группы,содержащие гетероатомы, выбранные из О, С(=О), S, S(=O), S(=O)2, NR1, в которой R1 имеет значения,как определено выше. Как указано выше, указанное кольцо, содержащее атом азота, может быть бициклическим, такое как, не ограничиваясь только этим, 5,5-членное кольцо, например гексагидроциклопента[с]пиррол-2(1 Н)-ил) кольцо, или 5,6-членное бициклическое кольцо, например гексагидропирроло[1,2-а]пиразин-2(1 Н)-ильное кольцо, например. Как указано выше, указанное кольцо, содержащее атом азота, может быть частично ненасыщенным, то есть оно может содержать одну или несколько двойных связей, такое как, не ограничиваясь только этим, 2,5-дигидро-1 Н-пирролильное, 4 Н-[1,3,4]тиадиазинильное, 4,5-дигидрооксазолильное или 4 Н-[1,4]тиазинильное кольцо, например, или оно может быть бензосопряженным, такое как, не ограничиваясь только этим, например, дигидроизохинолинильное кольцо. Термин "3-10-членный гетероциклоалкил" предпочтительно обозначает насыщенное или частично ненасыщенное, моновалентное, моно- или бициклическое углеродное кольцо, которое содержит 2, 3, 4, 5,6, 7, 8 или 9 атомов углерода и одну или несколько групп, содержащих гетероатомы, выбранные из С(=О), О, S, S(=O), S(=O)2, NH, NR', где R' представляет собой C1-С 6-алкил, С 3-С 6-циклоалкил, С 3-С 6 гетероциклоалкил, C(=O)R7, C(=O)NR7R8, -S(=O)2R7, -S(=O)2NR7R8 группу, как определено выше, подразумевается, что если указанный R' представляет собой С 3-С 6 гетероциклоалкильную группу, то указанная С 3-С 6-гетероциклоалкильная группа присутствует только один раз. В особенности, указанное кольцо может содержать 2, 3, 4 или 5 атомов углерода и одну или несколько вышеуказанных групп, содержащих гетероатомы ("3-6-членный гетероциклоалкил"), более предпочтительно указанное кольцо может содержать 4 или 5 атомов углерода, и одну или несколько вышеуказанных групп, содержащих гетероатомы("5-6-членный гетероциклоалкил"). Указанное гетероциклоалкильное кольцо представляет собой, например, моноциклическое гетероциклоалкильное кольцо, такое как оксиранильная, оксетанильная, азиридинильная, азетидинильная, тетрагидрофуранильная, пирролидинильная, имидазолидинильная, пиразолидинильная, пирролинильная, тетрагидропиранильная, пиперидинильная, морфолинильная, дитианильная,тиоморфолинильная, пиперазинильная, тритианильная или хинуклидинильная группа. Необязательно,указанное гетероциклоалкильное кольцо может содержать одну или несколько двойных связей, например 4 Н-пиранильная, 2 Н-пиранильная, 3 Н-диазиринильная, 2,5-дигидро-1 Н-пирролильная, [1,3]диоксолильная, 4 Н-[1,3,4]тиадиазинильная, 2,5-дигидрофуранильная, 2,3-дигидрофуранильная, 2,5-дигидротиофенильная, 2,3-дигидротиофенильная, 4,5-дигидрооксазолильная или 4 Н-[1,4]тиазинильная группа, или оно может быть бензосопряженным. Термин "арил" предпочтительно обозначает моновалентное, ароматическое или частично ароматическое, моно-, или би-, или трициклическое углеродное кольцо, содержащее 6, 7, 8, 9, 10, 11, 12, 13 или 14 атомов углерода ("С 6-С 14-арилгруппу"), в особенности кольцо, содержащее 6 атомов углерода ("С 6 арилгруппу"), например фенильную группу, или бифенильную группу, или кольцо, содержащее 9 атомов углерода ("С 9-арилгруппу"), например инданильную или инденильную группу, или кольцо, содержащее 10 атомов углерода ("С 10-арилгруппу"), например тетралинильную, дигидронафтильную или нафтильную группу, или кольцо, содержащее 13 атомов углерода ("С 13-арилгруппу"), например флуоренильную группу, или кольцо, содержащее 14 атомов углерода ("С 14-арилгруппу"), например антранилгруппу. Термин "гетероарил" предпочтительно обозначает моновалентную, ароматическую, моно- или бициклическую ароматическую кольцевую систему, имеющую 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 кольцевых атомов ("5-14-членную гетероарильную" группу), в особенности 5, или 6, или 9, или 10 атомов, и которая содержит по меньшей мере один гетероатом, которые могут быть одинаковыми или разными, указанный гетероатом может представлять собой кислород, азот или серу и может быть моноциклическим, бициклическим или трициклическим и дополнительно, в каждом случае, может быть бензосопряженным. В особенности, гетероарил выбирают из тиенила, фуранила, пирролила, оксазолила, тиазолила, имидазолила, пиразолила, изоксазолила, изотиазолила, оксадиазолила, триазолила, тиадиазолила, тиа-4 Н-пиразолила и др., и их бензопроизводных, таких как, например, бензофуранила, бензотиенила, бензоксазолила,бензизоксазолила, бензимидазолила, бензотриазолила, индазолила, индолила, изоиндолила и др.; или пиридила, пиридазинила, пиримидинила, пиразинила, триазинила и др. и их бензопроизводных, таких как, например, хинолинила, хиназолинила, изохинолинила и др.; или азоцинила, индолизинила, пуринила и др., и их бензопроизводных; или циннолинила, фталазинила, хиназолинила, хиноксалинила, нафтпиридинила, птеридинила, карбазолила, акридинила, феназинила, фенотиазинила, феноксазинила, ксантенила или оксепинила и др. Более предпочтительно гетероарил выбирают из пиридила, бензофуранила,бензизоксазолила, индазолила, хиназолинила, тиенила, хинолинила, бензотиенила, пиразолила или фуранила. Термин "алкилен" предпочтительно обозначает необязательно замещенную углеводородную цепь(или "предел"), содержащую 1, 2, 3, 4, 5 или 6 атомов углерода, то есть необязательно замещенную -СН 2("метилен" или "одночленный предел" или, например, -С(Ме)2-), -СН 2-СН 2- ("этилен", "диметилен" или"двучленный предел"), -СН 2-СН 2-СН 2- ("пропилен", "триметилен" или "трехчленный предел"), -СН 2-СН 2 СН 2-СН 2- ("бутилен", "тетраметилен" или "четырехчленный предел"), -СН 2-СН 2-СН 2-СН 2-СН 2- ("пентилен", "пентаметилен" или "пятичленный эфир") или -СН 2-СН 2-СН 2-СН 2-СН 2-СН 2- ("гексилен", "гексаметилен" или шестичленный эфир") группу. В особенности, указанный алкиленовый предел имеет 1, 2, 3, 4 или 5 атомов углерода, более предпочтительно 1 или 2 атома углерода. Термин "C1-С 6", как используется в настоящей заявке, например, в контексте определения "C1-С 6 алкил", "C1-С 6-галоалкил", "C1-С 6-алкокси" или "C1-С 6-галоалкокси" обозначает алкильную группу, имеющую определенное количество атомов углерода от 1 до 6, то есть 1, 2, 3, 4, 5 или 6 атомов углерода. Также подразумевается, что указанный термин "C1-С 6" интерпретируется как любой поддиапазон, который он включает, например, C1-С 6, С 2-С 5, C3-C4, C1-С 2, С 1-С 3, С 1-С 4, C1-C5, C1-C6; в особенности С 1-С 2,С 1-С 3, С 1-С 4, C1-C5, C1-C6; более предпочтительно С 1-С 4; в случае "C1-С 6-галоалкил" или "C1-С 6-галоалкокси" еще более предпочтительно С 1-С 2. Аналогичным образом, как используется в настоящей заявке, термин "С 2-С 6", как используется в настоящей заявке, например, в контексте определений "С 2-С 6-алкенил" и "С 2-С 6-алкинил", обозначает алкенильную группу или алкинильную группу, имеющую определенное количество атомов углерода от 2 до 6, то есть 2, 3, 4, 5 или 6 атомов углерода. Также подразумевается, что указанный термин "С 2-С 6" интерпретируется как любой поддиапазон, который он включает, например С 2-С 6, C3-C5, C3-C4, С 2-С 3, С 2 С 4, C2-C5; в особенности С 2-С 3. Кроме того, как используется в настоящей заявке, термин "С 3-С 6", как используется в настоящей заявке, например, в контексте определения "С 3-С 6-циклоалкил" обозначает циклоалкильную группу, имеющую определенное количество атомов углерода от 3 до 6, то есть 3, 4, 5 или 6 атомов углерода. Также подразумевается, что указанный термин "С 3-С 6" интерпретируется как любой поддиапазон, который он включает, например С 3-С 6, С 4-С 5, C3-C5, C3-C4, С 4-С 6, С 5-С 6; в особенности С 3-С 6. Как используется в настоящей заявке, термин "один или несколько раз", например, в определении заместителей соединений общих формул настоящего изобретения обозначает "один, два, три, четыре или пять раз, в особенности один, два, три или четыре раза, более предпочтительно один, два или три раза,еще более предпочтительно один или два раза". Если используется множественное число для соединений, солей, полиморфов, гидратов, сольватов и др. в настоящей заявке, то это обозначает также единичное соединение, соль, полиморф, изомер, гидрат, сольват или др. Соединения согласно настоящему изобретению могут содержать один или несколько ассиметричных центров в зависимости от расположения и природы различных желательных заместителей. Ассиметричные атомы углерода могут находиться в (R) или (S) конфигурации, что приводит к получению рацемических смесей в случае единичного ассиметричного центра и диастереомерных смесей в случае множественных ассиметричных центров. В определенных случаях асимметрия также может присутствовать вследствие ограниченного вращения вокруг данной связи, например центральной связи, граничащей с двумя замещенными ароматическими кольцами определенных соединений. Заместители на кольце также могут находиться либо в цис- или транс-форме. Подразумевается, что все такие конфигурации (включая энантиомеры и диастереомеры) охватываются объемом настоящего изобретения. Предпочтительными соединениями являются соединения, которые проявляют более желательную биологическую активность. Разделенные, чистые или частично очищенные изомеры и стереоизомеры или рацемические или диастереомерные смеси соединений согласно настоящему изобретению также охватываются объемом настоящего изобретения. Очистка и разделение таких материалов может осуществлять с помощью стандартных техник, известных в данной области. Оптические изомеры могут быть получены путем разделения рацемических смесей в соответствии с общепринятыми процессами, например путем образования диастереоизомерных солей, используя оптически активную кислоту или основание или образование ковалентных диастереомеров. Примерами подходящих кислот являются винная, диацетилвинная, дитолуолвинная и камфорсульфоновая кислота. Смеси диастереоизомеров могут быть разделены на их индивидуальные диастереомеры на основании их физических и/или химических отличий с помощью методов, известных в данной области, например путем хроматографии или фракционированной кристаллизации. После этого оптически активные основания или кислоты высвобождают из разделенных диастереомерных солей. Другой процесс для разделения оптических изомеров включает применение хиральной хроматографии (например, хиральных ВЭЖХ колонок), с или без общепринятой дериватизации, оптимально выбранных для максимального разделения энантиомеров. Подходящие хиральные ВЭЖХ колонки производятся Diacel, например, в частностиChiracel OD и Chiracel OJ, все выбираются в рабочем порядке. Также пригодно ферментативное разделение с или без дериватизации. Оптически активные соединения согласно настоящему изобретению могут также быть получены с помощью хирального синтеза, используя оптически активные исходные вещества. Для ограничения различных типов изомеров друг от друга производятся ссылки на раздел Е правилIUPAC (Pure Appl Chem. 45, 11-30, 1976). Настоящее изобретение включает все возможные стереоизомеры соединений настоящего изобретения, а также единичные стереоизомеры или любые смеси указанных стереоизомеров в любом соотношении. Выделение отдельного стереоизомера, например отдельного энантиомера или отдельного диастереомера, соединения в соответствии с настоящим изобретением может осуществляться с помощью любого подходящего метода из уровня техники, такого как, например, хроматография, в особенности хиральная хроматография. Кроме того, соединения в соответствии с настоящим изобретением могут существовать в виде таутомеров. Например, любое соединение в соответствии с настоящим изобретением, которое содержит пиразольный компонент в качестве гетероарильной группы, может существовать, например, в виде 1 Н таутомера или 2 Н таутомера, или даже смеси в любом количестве двух таутомеров, или триазольный компонент может существовать, например, в виде 1 Н таутомера, 2 Н таутомера или 4 Н таутомера, или даже смеси в любом количестве указанных 1 Н, 2 Н и 4 Н таутомеров, то есть 1 Н-таутомер 2 Н-таутомер 4 Н-таутомер Настоящее изобретение включает все возможные таутомеры соединений настоящего изобретения в виде отдельных таутомеров или в виде любой смеси указанных таутомеров в любом соотношении. Кроме того, соединения в соответствии с настоящим изобретением могут существовать в виде Nоксидов, которые определяются как соединения в соответствии с настоящим изобретением, в которых по меньшей мере один атом азота окислен. Настоящее изобретение включает все такие возможные N-6 022353 оксиды. Настоящее изобретение также относится к пригодным формам соединений, как раскрыто в настоящей заявке, таким как метаболиты, гидраты, сольваты, пролекарства, соли, в особенности фармацевтически приемлемые соли и ко-преципитаты. Соединения в соответствии с настоящим изобретением могут существовать в виде гидрата или в виде сольвата, где соединения настоящего изобретения содержат полярные растворители, в особенности,например воду, метанол или этанол в качестве структурного элемента кристаллической решетки соединений. Количество полярных растворителей, в особенности воды, может быть представлено в стехиометрическом или нестехиометрическом соотношении. В случае стехиометрических сольватов возможны,например, гидрат, геми-, (семи-), моно-, полутора-, ди, три-, тетра-, пента- и др. сольваты или гидраты соответственно. Настоящее изобретение включает все возможные гидраты или сольваты. Кроме того, соединения в соответствии с настоящим изобретением могут существовать в свободной форме, например в виде свободного основания, или в виде свободной кислоты, или в виде цвиттер-иона,или могут существовать в форме соли. Указанная соль может представлять собой любую соль, либо органическую или неорганическую соль присоединения, в особенности любую фармацевтически приемлемую органическую или неорганическую соль присоединения, которая общепринято используется в фармацевтике. Термин "фармацевтически приемлемая соль" относится к относительно нетоксичной, неорганической или органической соли присоединения соединения в соответствии с настоящим изобретением [см.,например, Berge S.M. и др. "Pharmaceutical Salts," J. Pharm. Sci. 1977, 66, 1-19]. Подходящая фармацевтически приемлемая соль соединений настоящего изобретения может представлять собой, например, соль присоединения кислоты соединения в соответствии с настоящим изобретением, несущую атом азота, например, в цепи или в кольце, которая является достаточно основной, такая как соль присоединения кислоты с неорганической кислотой, такой как, например, соляная, бромисто-водородная, йодисто-водородная, серная, бисерная, фосфорная или азотная кислота, или с органической кислотой, такой как, например, муравьиная, уксусная, ацетоуксусная, пировиноградная, трифторуксусная, пропионовая, масляная, капроновая, энантовая, ундекановая, лауриновая, бензойная, салициловая, 2-(4-гидроксибензоил)бензойная, камфарная, коричная, циклопентанпропионовая, диглюконовая, 3 гидрокси-2-нафтойная, никотиновая, памоевая, пектиновая, надсерная, 3-фенилпропионовая, пикриновая, триметилуксусная, 2-гидроксиэтансульфонат, итаконовая, сульфаминовая, трифторметансульфоновая, додецилсерная, этансульфоновая, бензолсульфоновая, паратолуолсульфоновая, метансульфоновая,2-нафталинсульфоновая, нафталиндисульфоновая, камфорсульфоновая кислота, лимонная, винная, стеариновая, молочная, щавелевая, малоновая, янтарная, яблочная, адипиновая, альгиновая, малеиновая, фумаровая, D-глюконовая, миндальная, аскорбиновая, глюкоэнантовая, глицерофосфорная, аспарагиновая,сульфосалициловая, гемисерная или тиоциановая кислота. Кроме того, другая подходящая фармацевтически приемлемая соль соединения в соответствии с настоящим изобретением, которая является достаточно кислотной, представляет собой соль щелочного металла, например соль натрия или калия, соль щелочно-земельного металла, например соль кальция или магния, аммониевая соль или соль с органическим основанием, которое обеспечивает физиологически приемлемый катион, например соль с N-метилглюкамином, диметилглюкамином, этилглюкамином, лизином, дициклогексиламином, 1,6-гексадиамином, этаноламином, глюкозамином, саркозином, серинолом, трис-гидроксиметиламинометаном, аминопропандиолом, основанием Совака, 1-амино-2,3,4-бутантриолом. Дополнительно, группы, содержащие азотистые основания, могут быть кватернизированы с такими агентами, как низшие алкилгалогениды, такие как метил, этил, пропил и бутилхлориды, бромиды и йодиды; диалкилсульфаты, такие как диметил, диэтил и дибутилсульфат; и диамилсульфаты, длинноцепочечные галогениды, такие как децил, лаурил, миристил и стеарил хлориды, бромиды и йодиды,аралкилгалогениды, такие как бензил и фенетилбромиды и др. Для специалистов в данной области техники также будет понятным, что соли присоединения кислот заявленных соединений могут быть получены путем взаимодействия соединений с подходящей неорганической или органической кислотой посредством различных известных методов. Альтернативно,соли щелочных и щелочно-земельных металлов кислотных соединений согласно изобретению приготавливают путем взаимодействия соединений согласно изобретению с подходящим основанием посредством различных известных методов. Настоящее изобретение включает все возможные соли соединений настоящего изобретения в виде единичных солей или в виде любой смеси указанных солей в любом соотношении. Как используется в настоящей заявке, термин "сложный эфир, который способен гидролизу in vivo" обозначает сложный эфир, который способен гидролизу in vivo, соединения в соответствии с настоящим изобретением, содержащего карбокси- или гидроксигруппу, например фармацевтически приемлемый сложный эфир, который гидролизуется в организме человека или животного с получением исходной кислоты или спирта. Подходящие фармацевтически приемлемые сложные эфиры для карбокси включают,например, алкиловые, циклоалкиловые и необязательно замещенные фенилалкиловые, в особенности бензиловые сложные эфиры, C1-С 6-алкоксиметиловые сложные эфиры, например метоксиметиловые, C1-7 022353 С 6-алканоилоксиметиловые сложные эфиры, например пивалоилоксиметиловые, фталидиловые сложные эфиры, С 3-C8-циклоалкоксикарбонилокси-С 1-С 6-алкиловые сложные эфиры, например 1-циклогексилкарбонилоксиэтил; 1,3-диоксолен-2-онилметиловые сложные эфиры, например 5-метил-1,3-диоксолен-2 онилметил; и C1-С 6-алкоксикарбонилоксиэтиловые сложные эфиры, например, 1-метоксикарбонилоксиэтил, и могут образовываться на любой карбоксигруппе, в соединениях согласно настоящему изобретению. Сложный эфир, который способен гидролизу in vivo, соединения в соответствии с настоящим изобретением, содержащего гидроксигруппу, включает неорганические сложные эфиры, такие как фосфатные сложные эфиры и [альфа]ацилоксиалкиловые эфиры и родственные соединения, которые в результате распада сложного эфира при гидролизе в условиях in vivo обеспечивают образование исходной гидроксигруппы. Примеры [альфа]ацилоксиалкиловых эфиров включают ацетоксиметокси и 2,2-диметилпропионилоксиметокси. Выбор групп, образующих сложный эфир, который способен гидролизу in vivo,для гидрокси включает алканоил, бензоил, фенилацетил и замещенный бензоил и фенилацетил, алкоксикарбонил (для получения алкилкарбонатных эфиров), диалкилкарбамоил и N-(диалкиламиноэтил)-Nалкилкарбамоил (для получения карбаматов), диалкиламиноацетил и карбоксиацетил. Настоящее изобретение охватывает все такие сложные эфиры. Кроме того, настоящее изобретение включает все возможные кристаллические формы или полиморфы соединений настоящего изобретения, либо в виде отдельных полиморфов, или в виде смеси более одного полиморфа в любом соотношении. В соответствии со вторым аспектом настоящее изобретение охватывает соединения общей формулы (I), выше, в которойR1 представляет собой фенильную группу,которая замещена, один или несколько раз, одинаково или различно, заместителем, выбранным изR6-(С 1-С 6-алкокси)-, R6-O-, -C(=O)R6, -C(=O)O-R6, -N(H)C(=O)R6, -N(H)C(=O)NR6R7, -NR6R7,-C(=O)N(H)R6, -C(=O)NR6R7, R6-S-, R6-S(=O)2-, -N(H)S(=O)2R6, -S(=O)2N(H)R6, и которая необязательно замещена, один или несколько раз, одинаково или различно, заместителем,выбранным из гало-, гидроксил-, нитро-, C1-С 6-алкил-, C1-С 6-алкокси-, гидрокси-С 1-С 6-алкил,-N(H)C(=O)R8, -N(H)C(=O)NR8R7, -C(=O)N(H)R8, -N(H)S(=O)2R8;R2 представляет собой фенильную группу или пиридинильную группу,которая необязательно замещена, один или несколько раз, одинаково или различно, заместителем,выбранным из гало-, циано-, нитро-, C1-С 6-алкил-, гало-С 1-С 6-алкил-, C1-С 6-алкокси-, гало-С 1-С 6-алкокси,-O-(CH2)n-C(=O)NR8R7, -C(=O)N(H)R8, -C(=O)NR8R7, R8-S-, R8-S(=O)-, R8-S(-O)2-, -N(H)S(-O)R8, -N(R7)SR3 представляет собой атом водорода;R4 представляет собой атом водорода;R5 представляет собой атом водорода;R6 представляет собой группу, выбранную из С 3-С 6-циклоалкила, 3-10-членного гетероциклила, фенила, гетероарила, -(СН 2)q-(С 3-С 6-циклоалкила), -(CH2)q-(3-10-членного гетероциклила), -(СН 2)q-фенила или -(СН 2)q-гетероарила, где каждая гетероарильная группа выбрана из пиридила, бензофуранила, бензизоксазолила, индазолила, хиназолинила, тиенила, хинолинила, бензотиенила, пиразолила и фуранила; где каждый 3-10-членный гетероциклил выбран из оксиранила, оксетанила, азиридинила, азетидинила, тетрагидрофуранила, пирролидинила, имидазолидинила, пиразолидинила, пирролинила, тетрагидропиранила, пиперидинила, морфолинила, дитианила, тиоморфолинила, пиперазинила, тритианила, хинуклидинила; указанная R6 группа необязательно замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из гало-, гидроксил-, циано-, нитро-, C1-С 6-алкил-, гало-C1-С 6-алкил-, C1-С 6 алкокси-, гало-С 1-С 6-алкокси-, гидрокси-C1-С 6-алкил, С 1-С 6-алкокси-С 1-С 6-алкил-, гало-С 1-С 6-алкоксиС 1-С 6-алкил-, R8-(C1-С 6-алкил)-, R8-(CH2)n(CHOH)(CH2)m-, R8-(C1-C6-алкокси)-, R8-(CH2)n(CHOH)(CH2)pR7 представляет собой атом водорода, C1-С 6-алкил- или С 3-С 6-циклоалкилгруппу; илиNR6R7 вместе представляют собой 3-10-членную гетероциклильную группу, выбранную из азиридинила, азетидинила, пирролидинила, имидазолидинила, пиразолидинила, пирролинила, пиперидинила,морфолинила, тиоморфолинила, пиперазинила; которая необязательно замещена, один или несколько раз, одинаково или различно, галогеном, гидрокси, циано-, нитро-, C1-С 6-алкил-, гало-C1-С 6-алкил-, C1-С 6-алкокси-, гало-С 1-С 6-алкокси-, гидрокси-C1 С 6-алкил, C1-С 6-алкокси-С 1-С 6-алкил-, гало-С 1-С 6-алкокси-С 1-С 6-алкил-, С 2-С 6-алкенил-, С 2-С 6-алкинилили С 3-С 6-циклоалкил-;R8 представляет собой атом водорода, C1-С 6-алкил- или С 3-С 6-циклоалкилгруппу;n, m, p представляют собой, независимо друг от друга, целое число 0, 1, 2 или 3;q представляет собой целое число 0, 1, 2 или 3; или их стереоизомер, таутомер, N-оксид, гидрат, сольват или соль или их смесь. В соответствии с третьим аспектом настоящее изобретение охватывает соединения общей формулыR1 представляет собой фенильную группу,которая замещена, один или несколько раз, одинаково или различно, заместителем, выбранным изR6-O-, -C(=O)R6, -C(=O)O-R6, -N(H)C(=O)R6, -N(H)C(=O)NR6R7, -NR6R7, -C(=O)N(H)R6, -C(=O)NR6R7, R6S-, R6-S(=O)2-, -N(H)S(=O)2R6, -S(=O)2N(H)R6; и которая необязательно замещена, один или несколько раз, одинаково или различно, заместителем,выбранным из гало-, гидроксил-, нитро-, C1-С 6-алкил-, C1-С 6-алкокси-, гидрокси-С 1-С 6-алкил,-N(H)C(=O)R8, -N(H)C(=O)NR8R7, -C(=O)N(H)R8, -N(H)S(=O)2R8;R2 представляет собой фенильную группу или гетероарильную группу,которая необязательно замещена, один или несколько раз, одинаково или различно, заместителем,выбранным из гало-, циано-, нитро-, C1-С 6-алкил-, гало-С 1-С 6-алкил-, C1-С 6-алкокси-, гало-С 1-С 6-алкокси,-O-(CH2)n-C(=O)NR8R7, -C(=O)N(H)R8, -C(=O)NR8R7, R8-S-, R8-S(=O)-, R8-S(=O)2-, -N(H)S(=O)R8,-N(R7)S(=O)R8, -S(=O)N(H)R8, -S(=O)NR8R7, -S(=O)2N(H)R8, -S(=O)2NR8R7;R3, R4 представляют собой атом водорода;R5 представляет собой атом водорода;R6 представляет собой группу, выбранную из С 3-С 6-циклоалкила, 3-10-членного гетероциклила, фенила, гетероарила, -(СН 2)q-(С 3-С 6-циклоалкила), -(CH2)q-(3-10-членного гетероциклила), -(СН 2)q-фенила или -(СН 2)q-гетероарила, где каждая гетероарильная группа выбрана из пиридила, бензофуранила, бензизоксазолила, индазолила, хиназолинила, тиенила, хинолинила, бензотиенила, пиразолила и фуранила; указанная R6 группа необязательно замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из гало-, гидроксил-, циано-, нитро-, C1-С 6-алкил-, гало-С 1-С 6-алкил-, C1-С 6 алкокси-, гало-С 1-С 6-алкокси-, гидрокси-С 1-С 6-алкил, С 1-С 6-алкокси-С 1-С 6-алкил-, гало-С 1-С 6-алкоксиС 1-С 6-алкил-, R8-(C1-С 6-алкил)-, R8-(CH2)n(CHOH)(CH2)m-, R8-(C1-C6-алкокси)-, R8-(CH2)n(CHOH)(CH2)pR7 представляет собой атом водорода, C1-С 6-алкил- или С 3-С 6-циклоалкилгруппу; илиNR6R7 вместе представляют собой 3-10-членную гетероциклильную группу, выбранную из азиридинила, азетидинила, пирролидинила, имидазолидинила, пиразолидинила, пирролинила, пиперидинила,морфолинила, тиоморфолинила, пиперазинила; которая необязательно замещена, один или несколько раз, одинаково или различно, галогеном, гидрокси, циано-, нитро-, C1-С 6-алкил-, гало-С 1-С 6-алкил-, C1-С 6-алкокси-, гало-С 1-С 6-алкокси-, гидрокси-С 1 С 6-алкилом, С 1-С 6-алкокси-С 1-С 6-алкил-, гало-С 1-С 6-алкокси-С 1-С 6-алкил-, С 2-С 6-алкенил-, С 2-С 6-алкинил- или С 3-С 6-циклоалкил-;R8 представляет собой атом водорода, C1-С 6-алкил- или С 3-С 6-циклоалкилгруппу;n представляет собой целое число 0 или 1;m представляет собой целое число 0, 1 или 2; р представляет собой целое число 1 или 2;q представляет собой целое число 0, 1 или 2; или их стереоизомер, таутомер, N-оксид, гидрат, сольват или соль или их смесь. В соответствии с четвертым аспектом настоящее изобретение охватывает соединения общей формулы (I), выше, в которойR1 представляет собой фенильную группу,которая замещена, один или несколько раз, одинаково или различно, заместителем, выбранным изR6-(С 1-С 6-алкокси)-, R6-O-, -C(=O)R6, -C(=O)O-R6, -N(H)C(=O)R6, -N(H)C(=O)NR6R7, -NR6R7,-C(=O)N(H)R6, -C(=O)NR6R7, R6-S-, R6-S(=O)2-, -N(H)S(=O)2R6, -S(=O)2N(H)R6, и которая необязательно замещена, один или несколько раз, одинаково или различно, заместителем,выбранным из гало-, гидроксил-, нитро-, C1-С 6-алкил-, C1-С 6-алкокси-, гидрокси-С 1-С 6-алкил,-N(H)C(=O)R8, -N(H)C(=O)NR8R7, -C(=O)N(H)R8, -N(H)S(=O)2R8;R2 представляет собой фенильную группу или пиридинильную группу,которая необязательно замещена, один или несколько раз, одинаково или различно, заместителем,выбранным из гало-, циано-, нитро-, C1-С 6-алкил-, гало-С 1-С 6-алкил-, C1-С 6-алкокси-, гало-С 1-С 6-алкокси,-O-(CH2)n-C(=O)NR8R7, -C(=O)N(H)R8, -C(=O)NR8R7, R8-S-, R8-S(=O)-, R8-S(=O)2-, -N(H)S(=O)R8,-N(R7)S(=O)R8, -S(=O)N(H)R8, -S(=O)NR8R7, -S(=O)2N(H)R8, -S(=O)2NR8R7;R3, R4 представляют собой атом водорода;R5 представляет собой атом водорода;R6 представляет собой группу, выбранную из С 3-С 6-циклоалкила, 3-10-членного гетероциклила,арила, гетероарила, -(СН 2)q-(С 3-С 6-циклоалкила), -(CH2)q-(3-10-членного гетероциклила), -(СН 2)q-фенила или -(CH2)q-гетероарила, где каждая гетероарильная группа выбрана из пиридила, бензофуранила, бензизоксазолила, индазолила, хиназолинила, тиенила, хинолинила, бензотиенила, пиразолила и фуранила; указанная R6 группа необязательно замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из гало-, гидроксил-, циано-, нитро-, C1-С 6-алкил-, гало-С 1-С 6-алкил-, C1-С 6 алкокси-, гало-С 1-С 6-алкокси-, гидрокси-С 1-С 6-алкил, C1-С 6-алкокси-С 1-С 6-алкил-, гало-С 1-С 6-алкоксиС 1-С 6-алкил-, -N(H)C(=O)R8, -N(R7)C(=O)R8, -N(H)C(=O)NR8R7, -N(R7)C(=O)NR8R7, -NR8R7,-C(=O)N(H)R8, -C(=O)NR8R7, R8-S-, R8-S(=O)-, R8-S(=O)2-;R7 представляет собой атом водорода, C1-С 6-алкил- или С 3-С 6-циклоалкилгруппу; илиNR6R7 вместе представляют собой 3-10-членную гетероциклильную группу, выбранную из азиридинила, азетидинила, пирролидинила, имидазолидинила, пиразолидинила, пирролинила, пиперидинила,морфолинила, тиоморфолинила, пиперазинила; которая необязательно замещена, один или несколько раз, одинаково или различно, галогеном, гидрокси, циано-, нитро-, C1-С 6-алкил-, гало-С 1-С 6-алкил-, C1-С 6-алкокси-, гало-С 1-С 6-алкокси-, гидрокси-С 1 С 6-алкил, C1-С 6-алкокси-С 1-С 6-алкил-, гало-С 1-С 6-алкокси-С 1-С 6-алкил-, С 2-С 6-алкенил-, С 2-С 6-алкинилили С 3-С 6-циклоалкил-;R8 представляет собой атом водорода, C1-С 6-алкил- или С 3-С 6-циклоалкилгруппу;n представляет собой целое число 0 или 1;q представляет собой целое число 0, 1 или 2; или их стереоизомер, таутомер, N-оксид, гидрат, сольват или соль или их смесь. В варианте осуществления вышеуказанных аспектов изобретение относится к соединениям формулы (I), гдеR1 представляет собой фенильную группу,которая замещена, один или несколько раз, одинаково или различно, заместителем, выбранным изR6-(С 1-С 6-алкокси)-, R6-O-, -C(=O)R6, -C(=O)O-R6, -N(H)C(=O)R6, -N(H)C(=O)NR6R7, -NR6R7,-C(=O)N(H)R6, -C(=O)NR6R7, R6-S-, R6-S(=O)2-, -N(H)S(=O)2R6, -S(=O)2N(H)R6; и которая необязательно замещена, один или несколько раз, одинаково или различно, заместителем,выбранным из гало-, гидроксил-, нитро-, C1-С 6-алкил-, C1-С 6-алкокси-, гидрокси-С 1-С 6-алкила,-N(H)C(=O)R8, -N(H)C(=O)NR8R7, -C(=O)N(H)R8, -N(H)S(=O)2R8. В варианте осуществления вышеуказанных аспектов изобретение относится к соединениям формулы (I), гдеR2 представляет собой фенильную группу или пиридинильную группу, которая необязательно замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из гало-, циано-,нитро-, C1-С 6-алкил-, гало-С 1-С 6-алкил-, C1-С 6-алкокси-, гало-C1-С 6-алкокси-, -O-(CH2)n-C(=O)NR8R7,-C(=O)N(H)R8, -C(=O)NR8R7, R8-S-, R8-S(=O)-, R8-S(=O)2-, -N(H)S(=O)R8, -N(R7)S(=O)R8, -S(=O)N(H)R8,-S(=O)NR8R7, -S(=O)2N(H)R8, -S(=O)2NR8R7. В варианте осуществления вышеуказанных аспектов изобретение относится к соединениям формулы (I), где R3 представляет собой атом водорода. В варианте осуществления вышеуказанных аспектов изобретение относится к соединениям формулы (I), где R4 представляет собой атом водорода. В варианте осуществления вышеуказанных аспектов изобретение относится к соединениям формулы (I), где R5 представляет собой атом водорода. В варианте осуществления вышеуказанных аспектов изобретение относится к соединениям формулы (I), где R6 представляет собой группу, выбранную из С 3-С 6-циклоалкила, 3-10-членного гетероциклила, фенила, гетероарила, -(СН 2)q-(С 3-С 6-циклоалкила), -(CH2)q-(3-10-членного гетероциклила), -(СН 2)qфенила или -(CH2)q-гетероарила, где каждая гетероарильная группа выбрана из пиридила, бензофуранила, бензизоксазолила, индазолила, хиназолинила, тиенила, хинолинила, бензотиенила, пиразолила и фуранила; где каждый 3-10-членный гетероциклил выбран из оксиранила, оксетанила, азиридинила, азетидинила, тетрагидрофуранила, пирролидинила, имидазолидинила, пиразолидинила, пирролинила, тетрагидропиранила, пиперидинила, морфолинила, дитианила, тиоморфолинила, пиперазинила, тритианила,хинуклидинила; указанная R6 группа необязательно замещена, один или несколько раз, одинаково или различно, заместителем, выбранным из гало-, гидроксил-, циано-, нитро-, C1-С 6-алкил-, гало-С 1-С 6-алкил,C1-С 6-алкокси-, гало-С 1-С 6-алкокси-, гидрокси-С 1-С 6-алкил, С 1-С 6-алкокси-С 1-С 6-алкил-, гало-С 1-С 6 алкокси-С 1-С 6-алкил-,R8-(C1-C6-алкил)-,R8-(CH2)n(CHOH)(CH2)m-,R8-(C1-C6-алкокси)-,R88 8(CH2)n(CHOH)(CH2)p-O-, R -(С 1-С 6-алкокси-С 1-С 6-алкил)-, R -(С 1-С 6-алкокси-С 1-С 6-алкил)-О-, фенил-, R8O-, -C(=O)R8, -C(=O)O-R8, -OC(=O)-R8, -N(H)C(=O)R8, -N(R7)C(=O)R8, -N(H)C(=O)NR8R7,-N(R7)C(=O)NR8R7, -NR8R7, -C(=O)N(H)R8, -C(=O)NR8R7, R8-S-, R8-S(=O)-, R8-S(-O)2-, -N(H)S(=O)R8,-N(R7)S(=O)R8, -S(=O)N(H)R8, -S(=O)NR8R7, -N(H)S(=O)2R8, -N(R7)S(=O)2R8, -S(=O)2N(H)R8,-S(=O)2NR8R7, -S(=O)(=NR8)R7, -S(=O)(=NR7)R8, -N=S(=O)(R8)R7. В варианте осуществления вышеуказанных аспектов изобретение относится к соединениям формулы (I), где R7 представляет собой атом водорода, C1-С 6-алкил- или С 3-С 6-циклоалкилгруппу. В варианте осуществления вышеуказанных аспектов изобретение относится к соединениям формулы (I), где NR6R7 вместе представляют собой 3-10-членную гетероциклильную группу, выбранную из азиридинила, азетидинила, пирролидинила, имидазолидинила, пиразолидинила, пирролинила, пиперидинила, морфолинила, тиоморфолинила, пиперазинила, которая необязательно замещена, один или несколько раз, одинаково или различно, галогеном, гидрокси, циано-, нитро-, C1-С 6-алкил-, гало-С 1-С 6 алкил-, C1-С 6-алкокси-, гало-С 1-С 6-алкокси-, гидрокси-C1-С 6-алкилом, С 1-С 6-алкокси-С 1-С 6-алкил-, галоС 1-С 6-алкокси-С 1-С 6-алкил-, С 2-С 6-алкенил-, С 2-С 6-алкинил- или С 3-С 6-циклоалкил-. В варианте осуществления вышеуказанных аспектов изобретение относится к соединениям формулы (I), где R8 представляет собой атом водорода, C1-С 6-алкил- или С 3-С 6-циклоалкилгруппу. В варианте осуществления вышеуказанных аспектов изобретение относится к соединениям формулы (I), где n, m, или р представляют собой, независимо друг от друга, целое число 0, 1, 2, 3, 4 или 5. В варианте осуществления вышеуказанных аспектов изобретение относится к соединениям формулы (I), где q представляет собой целое число 0, 1, 2 или 3. В варианте осуществления вышеуказанных аспектов изобретение относится к соединениям формулы (I), где n, m, р представляют собой, независимо друг от друга, целое число 0, 1, 2 или 3. В варианте осуществления вышеуказанных аспектов изобретение относится к соединениям формулы (I), где q представляет собой целое число 0, 1, 2 или 3. В варианте осуществления вышеуказанных аспектов изобретение относится к соединениям формулы (I), где n представляет собой целое число 0 или 1. В варианте осуществления вышеуказанных аспектов изобретение относится к соединениям формулы (I), где m представляет собой целое число 0, 1 или 2. В варианте осуществления вышеуказанных аспектов изобретение относится к соединениям формулы (I), где р представляет собой целое число 1 или 2. В варианте осуществления вышеуказанных аспектов, изобретение относится к соединениям формулы (I), где q представляет собой целое число 0, 1 или 2. Подразумевается, что настоящее изобретение относится к любой подкомбинации в пределах любого варианта осуществления настоящего изобретения соединений общей формулы (I), выше. Еще более предпочтительно настоящее изобретение охватывает соединения общей формулы (I), которые описаны в разделе примеров настоящего текста ниже. В соответствии с другим аспектом настоящее изобретение охватывает способы получения соединений согласно настоящему изобретению, указанные способы включают стадии, как описано в экспериментальном разделе в настоящей заявке. В соответствии с дальнейшим аспектом настоящее изобретение охватывает промежуточные соединения, которые пригодны для получения соединений настоящего изобретения общей формулы (I), в особенности в способе, описанном в настоящей заявке. В особенности, настоящее изобретение охватывает: а) соединения общей формулы (5) в которой R1, R3, R4 и R5 имеют значение, как определено для соединения общей формулы (I) настоящего изобретения, как определено в пунктах формулы изобретения,или их стереоизомер, таутомер, N-оксид, гидрат, сольват или соль или их смесь; иb) соединения общей формулы (7) в которой R2, R3, R4 и R5 имеют значение, как определено для соединения общей формулы (I) настоящего изобретения, как определено в пунктах формулы изобретения, и R1a представляет собой фенильную группу, с которой связан -NH2 заместитель. В соответствии с еще другим аспектом настоящее изобретение охватывает применение промежуточных соединений: а) общей формулы (5)- 11022353 в которой R1, R3, R4, и R5 имеют значение, как определено для соединения общей формулы (I) настоящего изобретения, как определено в пунктах формулы изобретения,или в которой R2, R3, R4 и R5 имеют значение, как определено для соединения общей формулы (I) согласно настоящему изобретению, как определено в пунктах формулы изобретения, и R1a представляет собой фенильную группу, с которой связан -NH2 заместитель,для приготовления соединений общей формулы (I) настоящего изобретения, как определено в пунктах формулы изобретения. Экспериментальный раздел В следующей таблице перечислены сокращения, используемые в этом абзаце и в разделе примеров. Образованные пики ЯМР указаны, как они появляются в спектре, возможные эффекты высшего порядка не рассматривались. Схемы и процедуры, описанные ниже, иллюстрируют общие пути синтеза для соединений общей формулы (I) согласно изобретению и не предназначены для ограничения. Для специалиста в данной области техники очевидно, что порядок превращений, как поясняется на схемах, можно модифицировать различными путями. Таким образом, порядок превращений, иллюстрируемый на схемах, не предназначен для ограничения. Дополнительно, можно осуществлять взаимное превращение любых заместителей,R1, R2, R3, R4, R5, R6, R7 или R8 перед и/или после проиллюстрированных превращений. Эти модификации могут быть такими, как введение защитных групп, отщепление защитных групп, восстановление или окисление функциональных групп, галогенирование, металлирование, замещение или другие реакции,известные специалисту в данной области техники. Эти превращения включают превращения, которые вводят функциональную группу, предоставляющую возможность дальнейшего взаимного превращения заместителей. Подходящие защитные группы и их введение и отщепление хорошо известно специалисту в данной области техники [см., например, T.W. Greene и P.G.M. Wuts в Protective Groups in Organic Synthesis, 3-е изд., Wiley 1999]. Специфические примеры описаны в последующих абзацах. Первая схема реакций представлена ниже. Синтез соединений общей формулы (I) настоящего изобретения Схема 1 где R1, R2, R3, R4 и R5 имеют значения, указанные в определениях и в пунктах формулы изобретения, Y представляет собой атом галогена, как определено выше, и Z представляет собой подходящую функциональную группу, посредством которой R1 R1-Z соединения может быть связан, с помощью реакции сочетания, на Y-несущем атоме углерода соединения (4), таким образом заменяя указанный Y на указанный R1 компонент. Многие арилгалогениды формулы R2-Y могут быть получены коммерчески. Реагенты общей структуры R1a-Z и R1-Z могут представлять собой, например, арилбороновые кислоты или арилбороновые эфиры. Многие такие реагенты общих структур R1a-Z и R1-Z также являются коммерчески доступными. Реагентами общих структур R1a-Z и R1-Z могут быть приготовлены из фенилгалогенидов [см., например, K.L. Billingslay, Т.Е. Barde, S.L. Buchwald, Angew. Chem. 2007, 119, 5455 или T.R1a может быть превращен в R1 за одну или несколько стадий. Типично, R1a может представлять собой защищенный арил-амин, в особенности -фенил-NH-Вос, или фенилкарбоновую кислоту, [-фенилС(О)ОН] или сложный эфир -фенил-карбоновой кислоты [-фенил-С(О)О-алкил]. Например, если R1a представляет собой фенильную группу, с которой -NH2 заместитель связан, то может быть возможным взаимодействие с соединением общей формулы R1b-X (7 а), в которой R1b представляет собой -C(=O)R6,-C(=O)NR6R7, -S(=O)R6 или -S(=O)2R6 (R6 и R7 имеют значения, как указано для соединений общей формулы (I) настоящего изобретения, как определено в пунктах формулы изобретения), и X представляет собой подходящую функциональную группу (например,-ОН, -О-C1-С 6-алкильную группу, или атом галогена), посредством которой R1b R1b-X соединения (7 а) может быть связан с помощью реакции сочетания,такой как реакция амидного сочетания, например, на -NH2 заместитель, связанный с фенильной группойR1a соединения (7), таким образом заменяя указанный X на указанный R1a, таким образом обеспечивая соединение общей формулы (I) настоящего изобретения, в которой R1, R2, R3, R4 и R5 имеют значения,как определено в пунктах формулы изобретения. Соединения общей формулы (I) могут быть синтезированы в соответствии с процедурами, представленными на схеме 1. Для специалиста в данной области техники будет понятно, что существует много прецедентных методов для синтеза подходящих 3,4,6-замещенных 5-галопиридин-2-иламинов общей формулы (1); некоторые 3,4,6-замещенные 5-галопиридин-2-иламины могут быть получены коммерчески. Подходяще замещенный промежуточный 5-галопиридин-2-иламин общей формулы (1) превращают в соответствующее промежуточное соединение общей формулы (2) путем реакции с подходящим оксикарбонилизотиоцианатом, таким как, например, этоксикарбонилизотиоцианат, при температурах в интервале от комнатной температуры до точки кипения растворителя, предпочтительно при комнатной температуре [см., например, М. Nettekoven, В. Pllmann, S. Schmitt, Synthesis 2003, 1643-1652]. Промежуточные соединения общей формулы (2) могут быть превращены в 6-промежуточные гало[1,2,4]триазоло[1,5-а]пиридин-2-иламиновые соединения общей формулы (3) путем взаимодействия с подходящим реагентом, например гидрохлоридом гидроксиламина, в присутствии подходящего основания, такого как, например, DIPEA в подходящей системе растворителей, такой как, например, метанол,этанол, 1-пропанол, 2-пропанол или смесях этих растворителей при повышенных температурах, например, 60 С [см., например, М. Nettekoven, В. Pllmann, S. Schmitt, Synthesis 2003, 1643-1652]. Промежуточные соединения общей формулы (3) можно подвергать реакции с подходящими фенилгалогенидами, предпочтительно фенилбромидами, в присутствии подходящего основания, такого как,например, NaOtBu или карбонат цезия, и подходящей системы катализатор/лиганд, такой как, например,Pd2(dba)3/rac-BINAP в подходящем растворителе, таком как ТГФ, толуол, DME или NMP, или смесях этих растворителей при температурах в интервале от комнатной температуры до 200 С, получая соединения общей формулы (4). Для специалиста в данной области техники будет понятным, что надлежащий выбор условий реакции, таких как температура, выбор растворителя и системы катализаторов, является решающим для предпочтительной дериватизации на аминогруппе промежуточных соединений общей формулы (3). Промежуточные соединения общей формулы (4) могут быть превращены в соединения общей формулы (I) путем взаимодействия с подходящим реагентом, таким как, например, производное бороновой кислоты в присутствии подходящей системы катализаторов, таких как, например, Pd(OAc)2 иP(oTol)3 или PdCl2(PPh3)2 и PPh3, и подходящего основания, такого как, например, водный карбонат калия, в подходящем растворителе, таком как, например, ТГФ, DME, этанол или 1-пропанол или смесях этих растворителей при температурах в интервале от комнатной температуры до 200 С, предпочтительно точке кипения используемого растворителя. В альтернативном пути для синтеза соединений общей формулы (I) промежуточные соединения общей формулы (3) можно подвергать реакции с подходящим реагентом, таким как, например, производное бороновой кислоты, в присутствии подходящей системы катализаторов, таких как, например,Pd(OAc)2 и P(oTol)3 или PdCl2(PPh3)2 и PPh3, и подходящего основания, такого как, например, водный карбонат калия, в подходящем растворителе, таком как, например, ТГФ, DME, этанол или 1-пропанол или смесях этих растворителей при температурах в интервале от комнатной температуры до 200 С,предпочтительно точке кипения используемого растворителя для обеспечения промежуточных соединений общей формулы (5). Промежуточные соединения общей формулы (5) могут быть превращены в соединения общей формулы (I) путем взаимодействия с подходящими фенилгалогенидами формулы (5 а), как определено в настоящей заявке, предпочтительно фенилбромидами или фенилтрифторметилсульфонатами или фенилнонафторбутилсульфонатами, например, необязательно в присутствии подходящего основания, такого как,например, NaOtBu или карбонат цезия, и подходящей системы катализатор/лиганд, такой как, например,Pd2(dba)3/rac-BINAP в подходящем растворителе, таком как, например, ТГФ, толуол, DME или NMP, или смесях этих растворителей при температурах в интервале от комнатной температуры до 200 С. Также, как представлено на схеме 1, существует дополнительный альтернативный путь для синтеза соединений общей формулы (I). Промежуточные соединения общей формулы (3) могут быть превраще- 14022353 ны в промежуточные соединения общей формулы (6) с помощью реакции сочетания, как описано выше для синтеза промежуточного соединения общей формулы (5), таким образом заменяя указанный Y на указанный R1a компонент. Промежуточные соединения общей формулы (6) впоследствии могут быть превращены в промежуточные соединения общей формулы (7) с помощью реакции сочетания, как описано выше для синтеза промежуточных соединений общей формулы (4). Промежуточные соединения общей формулы (7) впоследствии могут быть превращены в соединения общей формулы (I) с помощью одного или нескольких дальнейших превращений. Они могут включать модификации, такие как отщепление защитных групп, восстановление или окисление функциональных групп, галогенирование, металлирование, замещение или другие реакции, известные для специалиста в данной области техники, например образование амидной связи, образование мочевины или образование сульфонамида. В варианте осуществления настоящее изобретение относится к способу приготовления соединений общей формулы (I) настоящего изобретения, как определено в пунктах формулы изобретения, в котором промежуточное соединение общей формулы (5) в которой R1, R3, R4 и R5 имеют значения, как определено для соединений общей формулы (I) настоящего изобретения, как определено в пунктах формулы изобретения,вводят в реакцию с фенилгалогенидом общей формулы (5 а) в которой R2 имеет значения, как определено для соединений общей формулы (I) настоящего изобретения, как определено в пунктах формулы изобретения, и Y представляет собой атом галогена, таким образом обеспечивая соединение общей формулы (I) в которой R1, R2, R3, R4 и R5 имеют значения, как определено в пунктах формулы изобретения. В другом варианте осуществления настоящее изобретение относится к способу получения соединений общей формулы (I) настоящего изобретения, как определено в пунктах формулы изобретения, в котором промежуточное соединение общей формулы (7) в которой R2, R3, R4 и R5 имеют значения, как определено для соединений общей формулы (I) настоящего изобретения, как определено в пунктах формулы изобретения, и R1a представляет собой фенильную группу, с которой связан -NH2 заместитель, вводят в реакцию с соединением общей формулы в которой R1b представляет собой -C(=O)R6, -C(=O)NR6R7, -S(=O)R6 или -S(=O)2R6 (R6 и R7 имеют значения, как указано для соединений согласно настоящему изобретению, как определено в пунктах формулы изобретения), и X представляет собой подходящую функциональную группу (например, -ОН,-О-C1-С 6-алкильную группу или атом галогена), посредством которой R1b R1b-X соединения (7 а) может быть связан с помощью реакции амидного сочетания, на -NH2 заместителе, связанным с фенильной группой R1a соединения (7), таким образом заменяя указанный X на указанный R1a, таким образом обеспечивая соединение общей формулы (I) в которой R1, R2, R3, R4 и R5 имеют значения, как определено для соединений общей формулы (I) настоящего изобретения, как определено в пунктах формулы изобретения. Каждая из схем 2-7 ниже иллюстрирует специфические превращения для синтеза некоторых выбранных соединений в соответствии с общей формулой (I). Схема 2. Синтез соединений общей формулы (11) Схема 2. Синтез соединений общей формулы (11), где R2, R3, R4, R5 и R6 имеют значения, указанные в определениях и в пунктах формулы изобретения. Y представляет собой галоген, как определено в определениях. Rxy представляет собой галоген, гидрокси или C1-С 6-алкил; а) реакция сочетания, используя условия, как описано выше для синтеза промежуточных соединений общей формулы (5); b) реакция сочетания, используя условия, как описано выше для синтеза промежуточных соединений общей формулы(4); с) удаление Вос-защитной группы, используя условия, известные специалисту в данной области техники (см., например, T.W. Greene и P.G.M. Wuts в Protective Groups in Organic Synthesis, 3-е издание,Wiley 1999); d) условия для образования амидной связи, например, используя связующие реагенты, такие как HATU или TBTU и основание, такое как карбонат калия или DIPEA в инертном растворителе, таком как ТГФ, ДМФА, ДХМ или NMP. Схема 3. Синтез соединений общей формулы (12) Схема 3. Синтез соединений общей формулы (12), где R2, R3, R4, R5 и R6 имеют значения, указанные в определениях и в пунктах формулы изобретения. Rxy представляет собой галоген, гидрокси или C1-С 6 алкил; а) условия для образования сульфонамида, например, используя сульфонил хлорид и основание,такое как DIPEA в инертном растворителе, таком как, например, ТГФ, ДМФА, ДХМ или NMP при температурах в интервале от комнатной температуры до 70 С. Схема 4. Синтез соединений общей формулы (13) Схема 4. Синтез соединений общей формулы (13), где R2, R3, R4, R5, R6 и R7 имеют значения, указанные в определениях и в пунктах формулы изобретения. Rxy представляет собой галоген, гидрокси илиC1-С 6-алкил; а) условия для образования мочевины, например, используя изоцианат в инертном растворителе, таком как, например, ТГФ, ДМФА, ДХМ или NMP при температурах в интервале от комнатной температуры до 70 С. Альтернативно, можно использовать двустадийную процедуру, которая включает реакцию 4-нитрофенилхлороформиата в инертном растворителе, таком как, например, ТГФ или ДХМ и основании, таком как пиридин, при температурах в интервале от 0 С до комнатной температуры, с последующей реакцией с амином в инертном растворителе, таком как ТГФ или ДХМ при температурах в интервале от 0 до 40 С. Схема 5. Синтез соединений общей формулы (15) Схема 5. Синтез соединений общей формулы (15), где R2, R3, R4 и R5 имеют значения, указанные в определениях и в пунктах формулы изобретения. Rxy представляет собой галоген, гидрокси или C1-С 6-алкил. Rxz представляет собой уходящую группу, например галоген. RHet представляет собой 3-10-членный гетероциклил, как определено выше; а) условия для образования амидной связи, например, используя связующие реагенты, такие как, например, HATU или TBTU и основание, такое как, например, карбонат калия или DIPEA в инертном растворителе, таком как, например, ТГФ, ДМФА, ДХМ или NMP. Альтернативно, можно использовать хлорангидрид кислоты и основание, такое как, например, пиридин, в инертном растворителе, таком как, например, ТГФ или ДХМ; b) реакция с гетероциклическим амином, таким как, например, пиперидин, в полярном растворителе, таком как, например, ДМФА или NMP, используя основание, такое как, например,карбонат калия, и необязательно используя каталитическое количество йодида калия. Схема 6. Синтез соединений общей формулы (11) Схема 6. Синтез соединений общей формулы (11), где R2, R3, R4, R5 и R6 имеют значения, указанные в определениях и в пунктах формулы изобретения. Rxy представляет собой галоген, гидрокси или C1-С 6 алкил; а) удаление Вос-защитной группы, используя условия, известные специалисту в данной области техники (см., например, T.W. Greene и P.G.M. Wuts в Protective Groups in Organic Synthesis, 3-е издание,Wiley 1999); b) условия для образования амидной связи, например, используя связующие реагенты, такие как, например, HATU или TBTU и основание, такое как, например, карбонат калия или DIPEA в инертном растворителе, таком как, например, ТГФ, ДМФА, ДХМ или NMP; с) реакция сочетания, используя условия, как описано выше для синтеза промежуточных соединений общей формулы (4). Схема 7. Синтез соединений общей формулы (22)- 17022353 Схема 7. Синтез соединений общей формулы (21), где R2, R3, R4, R5, R6 и R7 имеют значения, указанные в определениях и в пунктах формулы изобретения. Rxy представляет собой галоген, гидрокси илиC1-С 6-алкил. R алкил представляет собой C1-С 6-алкил; а) реакция сочетания, используя условия, как описано выше для синтеза промежуточных соединений общей формулы (5); b) образование сложного эфира,используя условия, известные специалисту в данной области техники (см., например, T.W. Greene иP.G.M. Wuts в Protective Groups in Organic Synthesis, 3-е издание, Wiley 1999), например, используя тионил хлорид в подходящем спирте при температурах в интервале от комнатной температуры до 100 С; с) реакция сочетания, используя условия, как описано выше для синтеза промежуточных соединений общей формулы (4); d) гидролиз для сложного эфира, используя условия, известные специалисту в данной области техники (см., например, T.W. Greene и P.G.M. Wuts в Protective Groups in Organic Synthesis, 3-е издание, Wiley 1999), например, гидроксид натрия в смеси ТГФ, метанол вода при к.т.; е) условия для образования амидной связи, например, используя связующие реагенты, такие как, например, HATU илиTBTU и основание, такое как, например, карбонат калия или DIPEA в инертном растворителе, таком как,например, ТГФ, ДМФА, ДХМ или NMP. Соединения и промежуточные соединения, полученные в соответствии с методами согласно изобретению, могут нуждаться в очистке. Очистка органических соединений хорошо известна специалисту в данной области техники и существует несколько путей очистки одного и того же соединения. В некоторых случаях может отсутствовать необходимость очистки. В некоторых случаях соединения могут быть очищены путем кристаллизации. В некоторых случаях примеси могут быть удалены, используя подходящий растворитель. В некоторых случаях соединения могут быть очищены путем хроматографии,в особенности флэш-хроматографии, используя, например, предварительно упакованные силикагелевые картриджи, например, от Separtis, такие как Isolute Flash силикагель (хроматография на силикагеле) илиIsolute Flash NH2 силикагель (аминофазная хроматография на силикагеле) в комбинации с подходящей хроматографической системой, такой как Flashmaster II (Separtis) или Isolera система (Biotage), и элюенты, такие как, например, градиенты гексан/этилацетат или ДХМ/метанол. В некоторых случаях соединения могут быть очищены путем препаративной ВЭЖХ, используя, например, автоматический очистительWaters, оборудованный детектором на диодной матрице и/или он-лайн масс-спектрометром электрораспылительной ионизации в комбинации с подходящей предварительно упакованной колонкой с обращенной фазой и элюантами, такими как, например, градиенты воды и ацетонитрила, которые могут содержать вспомогательные вещества, такие как трифторуксусная кислота, муравьиная кислота или водный аммиак. Аналитическую СЭЖХ-МС осуществляли следующим образом. Метод А. Система: СЭЖХ Acquity (Waters) с PDA детектором и Waters ZQ масс-спектрометр; колонка: Acquity ВЕН С 18 1,7 мкм 2,150 мм; температура: 60 С; растворитель А: вода + 0,1% муравьиная кислота; растворитель В: ацетонитрил; градиент: 99% А 1% А (1,6 мин)1% А (0,4 мин); поток: 0,8 мл/мин; вводимый объем: 1,0 мкл (0,1 мг-1 мл/мл концентрации образца); обнаружение: PDA диапазон сканирования 210-400 нМ - Fixed и ESI (+), диапазон сканирования 170-800 m/z. Названия соединений создавали с помощью ACD/Name Batch версия 1200 или ACD/Name Batch версия 12.01. Названия соединений в табличном формате создавали с помощью ACD/Name Batch версия 12.00. Синтез промежуточных соединений Промежуточный пример Пром 1.1 Этил[(5-бромпиридин-2-ил)карбамотиоил]карбамат Этоксикарбонилизотиоцианат (16,7 г) добавляли к перемешиваемому раствору 2-амино-5-бромпиридина (20 г) в диоксане (200 мл). Смесь перемешивали в течение 2 ч при к.т. Осаждалось белое твердое вещество. Добавляли гексан (20 мл) и белое твердое вещество собирали путем фильтрации. Выход: 30,4 г указанного в заглавии соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 1,22 (t, 3H), 4,19 (q, 2H), 8,08 (dd, 1H), 8,49 (d, 1H),8,57 (br. d, 1H), 11,37-12,35 (m, 2H). Промежуточный пример Пром 1.2 6-Бром[1,2,4]триазоло[1,5-а]пиридин-2-амин Гидроксиламмонийхлорид (39,8 г) суспендировали в метаноле (200 мл) и этаноле (190 мл) и добавляли основание Хунига (59 мл) при к.т. Смесь нагревали до 60 С, добавляли порциями Пром 1.1 (30 г), и смесь перемешивали при 60 С в течение 2 ч. Растворитель удаляли в вакууме и добавляли воду (150 мл). Твердое вещество собирали путем фильтрации и промывали водой и высушивали в вакууме. 1H). Промежуточный пример Пром 2.1 4-(2-Амино-[1,2,4]триазоло[1,5-а]пиридин-6-ил)-N-циклопропилбензамидPd(dppf)Cl2 и 6 мл раствора карбоната калия (1 М в воде, 3 экв.) при комнатной температуре в микроволновом реакторе. Раствор нагревали до 150 С в течение 120 мин под воздействием микроволнового облучения. После охлаждения раствор фильтровали и очищали путем препаративной ВЭЖХ с обращенной фазой, получая 49,9 мг (8,5%) указанного в заглавии соединения. СЭЖХ-МС: RT = 0,69 мин; m/z (ES+) 294,3 [МН+]; необходимый MB = 293,3. Промежуточный пример Пром 3.1 К перемешиваемому раствору 213 мг (1 ммоль) Пром 1.2 в ТГФ (2,5 мл) добавляли 364 мг (2 ммоль,2 экв.) 2-бромбензонитрила, 183 мг (0,2 ммоль, 0,2 экв.) Pd2(dba)3, 374 мг (0,6 ммоль, 0,6 экв.) rac-BINAP и 240 мг (2,5 ммоль, 2,5 экв.) NaOtBu при комнатной температуре в микроволновом реакторе. Раствор нагревали до 150 С в течение 50 мин под воздействием микроволнового облучения. После охлаждения раствор фильтровали и упаривали. При последующей очистке путем препаративной ВЭЖХ с обращенной фазой получали 186 мг (59%) указанного в заглавии соединения. 1 Н-ЯМР (300 МГц, d6-ДМСО):= 9,56 (1 Н, s), 9,16 (1 Н, s), 7,91 (1 Н, d), 7,72 (1 Н, d), 7,70 (1 Н, d),7,62 (1 Н, dd) 7,54 (1 Н, d), 7,15 (1 Н, dd) част. на млн СЭЖХ-МС: RT = 1,15 мин; m/z (ES+) 315,2 [МН+]; необходимый MB = 314,2. Промежуточный пример Пром 4.1 трет-Бутил[4-(2-амино[1,2,4]триазоло[1,5-а]пиридин-6-ил)фенил]карбамат К перемешиваемому раствору Пром 1.2 (5,82 г) в 1-пропаноле (400 мл) добавляли 2 М раствор карбоната калия (41 мл), 4-[(трет-бутоксикарбонил)амино]фенилбороновую кислоту (8,6 г), трифенилфосфин (150 мг) и PdCl2(PPh3)2 (1,9 г). Смесь нагревали в колбе с обратным холодильником в течение 4 ч, растворитель удаляли в вакууме, добавляли воду (150 мл) и смесь экстрагировали этилацетатом (500 мл). Органическую фазу высушивали (сульфат натрия), фильтровали через целит и растворитель удаляли в вакууме. Остаток растирали в порошок с ДХМ, получая указанное в заглавии соединение в виде белого твердого вещества. Выход: 7,2 г. 1 Н-ЯМР (400 МГц, ДМСО-d6):[част. на млн]= 1,37-1,55 (m, 9H), 5,99 (s, 2H), 7,36 (dd, 1 Н), 7,487,55 (т, 2 Н), 7,55-7,62 (т, 2 Н), 7,69 (dd, 1H), 8,78 (dd, 1H), 9,44 (s, 1H). Промежуточный пример Пром 4.2 трет-Бутил(4-2-[(2-цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-илфенил)карбамат К перемешиваемому раствору Пром 4.1 (8,0 г) в толуоле (95 мл) добавляли 2-бромбензонитрил (6,33 г), Pd2dba3 (1,13 г) и rac-BINAP (1,56 г). Колбу два раза дегазировали и заполняли аргоном. Смесь перемешивали при к.т. в течение 5 мин. Добавляли карбонат цезия (24,3 г), колбу два раза дегазировали и заполняли аргоном и смесь нагревали в колбе с обратным холодильником в течение 3 ч. Добавляли воду и реакционную смесь экстрагировали этилацетатом и метанолом (10:1). Органическую фазу промывали водой, высушивали (сульфат натрия) и растворитель удаляли в вакууме. При осуществлении хроматографии на силикагеле получали белое твердое вещество, которое перекристаллизовали из этанола. Выход: 5,8 г указанного в заглавии соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):[част. на млн]= 1,46 (s, 9H), 7,11 (t, 1H), 7,53 (d, 2 Н), 7,57-7,68 (m,4H), 7,70 (d, 1H), 7,87 (dd, 1H), 8,00 (d, 1H), 9,03 (s, 1H), 9,47 (br. s., 2H). Промежуточный пример Пром 4.3 2-[6-(4-Аминофенил)[1,2,4]триазоло[1,5-а]пиридин-2-ил]аминобензонитрил К перемешиваемой суспензии Пром 4.2 (2,0 г) в ДХМ (100 мл) и уксусной кислоте (46 мл) добавляли 1,3-диметоксибензол (6,0 мл) и трифторид бора диэтилэфират (2,4 мл). Смесь перемешивали при к.т. в течение 2 ч. Смесь вливали в полунасыщенный раствор карбоната калия (400 мл) и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, высушивали (сульфат натрия) и растворитель удаляли в вакууме. При осуществлении хроматографии на силикагеле получали 943 мг указанного в заглавии соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):[част. на млн]= 5,29 (s, 2H), 6,62 (d, 2H), 7,09-7,16 (m, 1H), 7,42 (d,2H), 7,56 (d, 1H), 7,59-7,67 (m, 1H), 7,71 (dd, 1H), 7,80 (dd, 1 Н), 8,00 (d, 1H), 8,88 (d, 1H), 9,39 (s, 1H). Промежуточный пример Пром 5.1 трет-Бутил(4-2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-илфенил)карбамат К перемешиваемому раствору Пром 4.1 (1,0 г) в толуоле (10 мл) добавляли 2-броманизол (830 мг),Pd2dba3 (141 мг) и rac-BINAP (195 мг). Колбу два раза дегазировали и заполняли аргоном. Смесь перемешивали при к.т. в течение 5 мин. Добавляли карбонат цезия (5,06 г), колбу два раза дегазировали и заполняли аргоном и смесь нагревали в колбе с обратным холодильником в течение 15 ч. Добавляли воду и реакционную смесь последовательно экстрагировали этилацетатом и смесью дихлорметана и метанола(10:1). Объединенные органические фазы промывали насыщенным раствором хлорида натрия, высушивали (сульфат натрия) и растворитель удаляли в вакууме. При осуществлении хроматографии на силикагеле получали 238 мг указанного в заглавии соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 1,46 (s, 9H), 3,84 (s, 3H), 6,86-6,95 (m, 2 Н), 6,97-7,02(m, 1 Н), 7,49-7,61 (m, 3 Н), 7,62-7,69 (m, 2 Н), 7,86 (dd, 1H), 7,93 (s, 1H), 8,22 (dd, 1H), 9,04 (dd, 1H), 9,47 (s,1H). Промежуточный пример Пром 5.2 6-(4-Аминофенил)-N-(2-метоксифенил)[1,2,4]триазоло[1,5-а]пиридин-2-амин К перемешиваемой суспензии Пром 5.1 (210 мг) в ДХМ (6,2 мл) добавляли 1,3-диметоксибензол(0,62 мл) и TFA (1,9 мл). Смесь перемешивали при к.т. в течение 3 ч. Смесь вливали в полунасыщенный раствор карбоната калия (30 мл) и экстрагировали смесью ДХМ и метанола (10:1). Органическую фазу промывали насыщенным раствором хлорида натрия, высушивали (сульфат натрия) и растворитель удаляли в вакууме. При осуществлении хроматографии на силикагеле получали 120 мг указанного в заглавии соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 3,84 (s, 3 Н), 5,28 (s, 2H), 6,62 (d, 2 Н), 6,84-6,96 (m,2 Н), 6,97-7,03 (m, 1H), 7,41 (d, 2H), 7,53 (dd, 1H), 7,78 (dd, 1 Н), 7,87 (s, 1H), 8,22 (dd, 1H), 8,88 (d, 1H). Промежуточный пример Пром 6.1 трет-Бутил[4-(2-[2-(трифторметил)фенил]амино[1,2,4]триазоло[1,5-а]пиридин-6-ил)фенил]карбамат К перемешиваемому раствору Пром 4.1 (2,0 г) в толуоле (28 мл) добавляли 1-бром-2-(трифторметил)бензол (5,53 г), Pd2dba3 (562 мг) и rac-BINAP (765 мг). Колбу два раза дегазировали и заполняли аргоном. Смесь перемешивали при к.т. в течение 5 мин. Добавляли карбонат цезия (10 г), колбу два раза дегазировали и заполняли аргоном и смесь нагревали в колбе с обратным холодильником в течение 15 ч. Дополнительно добавляли Pd2dba3 (562 мг) и rac-BINAP (765 мг), колбу два раза дегазировали и заполняли аргоном и смесь нагревали в колбе с обратным холодильником в течение 4 ч. Добавляли воду и реакционную смесь экстрагировали смесью дихлорметана и метанола (10:1). Объединенные органические фазы промывали насыщенным раствором хлорида натрия, высушивали (сульфат натрия) и растворитель удаляли в вакууме. При осуществлении хроматографии на силикагеле получали 2,48 г указанного в заглавии соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):[част. на млн]= 1,45 (s, 9H), 7,25 (t, 1H), 7,47-7,60 (m, 3H), 7,60-7,71(m, 4H), 7,85 (dd, 1H), 8,03 (d, 1H), 8,34 (s, 1H), 9,00 (s, 1 Н), 9,46 (s, 1H). Промежуточный пример Пром 6.2 6-(4-Аминофенил)-N-[2-(трифторметил)фенил][1,2,4]триазоло[1,5-а]пиридин-2-амин К перемешиваемой суспензии Пром 6.1 (2,47 г) в ДХМ (50 мл) добавляли TFA (16 мл). Смесь перемешивали при к.т. в течение 1 ч. Добавляли полунасыщенный раствор карбоната калия до тех пор, пока рН раствора не становилась щелочным. Смесь экстрагировали с помощью ДХМ. Органическую фазу промывали насыщенным раствором хлорида натрия, высушивали (сульфат натрия) и растворитель удаляли в вакууме. При осуществлении хроматографии на силикагеле получали 1,71 г указанного в заглавии соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 5,28 (s, 2H), 6,62 (d, 2H), 7,22 (t, 1 Н), 7,40 (d,2H), 7,51 (dd, 1H), 7,58-7,69 (m, 2H), 7,77 (dd, 1H), 8,05 (d, 1H), 8,24 (s, 1H), 8,83 (d, 1H). Промежуточный пример Пром 6.3 2-Хлор-N-[4-(2-[2-(трифторметил)фенил]амино[1,2,4]триазоло[1,5-а]пиридин-6-ил)фенил]ацетамид К перемешиваемой суспензии Пром 6.2 (400 мг) в ДХМ (50 мл) добавляли пиридин (214 мг) иDMAP (13 мг). Смесь охлаждали до 0 С и добавляли хлорацетилхлорид (0,095 мл). Смесь перемешивали при 0 С в течение 2 ч. Добавляли воду и белое твердое вещество собирали путем фильтрации, промывали этанолом и высушивали в вакууме, получая 342 мг указанного в заглавии соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 4,26 (s, 2H), 7,25 (t, 1H), 7,58 (d, 1 Н), 7,60-7,78 (m,6H), 7,88 (dd, 1H), 8,02 (d, 1H), 8,39 (s, 1H), 9,04 (s, 1H), 10,42 (s, 1H). Промежуточный пример Пром 6.4 рац-трет-Бутил(2-оксо-1-фенил-2-[4-(2-[2-(трифторметил)фенил]амино[1,2,4]триазоло[1,5-а]пиридин-6-ил)фенил]аминоэтил)карбамат К перемешиваемой суспензии Пром 6.2 (120 мг) в ДМФА (6 мл) добавляли карбонат калия (314 мг),N-Boc-DL-Фенилглицин (326 мг) и TBTU (312 мг). Смесь перемешивали при к.т. в течение 24 ч. Добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, высушивали (сульфат натрия) и растворитель удаляли в вакууме. При осуществлении хроматографии на силикагеле получали 120 мг указанного в заглавии соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 1,36 (s, 9H), 5,34 (d, 1H), 7,20-7,37 (m, 5 Н), 7,47 (d,2H), 7,51-7,73 (m, 7H), 7,85 (dd, 1H), 8,01 (d, 1H), 8,37 (s, 1 Н), 9,01 (s, 1H), 10,35 (s, 1H). Промежуточный пример Пром 7.1 трет-Бутил[4-(2-амино[1,2,4]триазоло[1,5-а]пиридин-6-ил)фенил]карбамат К перемешиваемому раствору Пром 4.1 (500 мг) в толуоле (7,5 мл) добавляли 2-бром-4-метилбензонитрил (1,2 г), Pd2dba3 (140 мг) и rac-BINAP (191 мг). Колбу два раза дегазировали и заполняли аргоном. Смесь перемешивали при к.т. в течение 5 мин. Добавляли карбонат цезия (2,5 г), колбу два раза дегазировали и заполняли аргоном и смесь нагревали в колбе с обратным холодильником в течение 4 ч. Дополнительно добавляли Pd2dba3 (140 мг) и rac-BINAP (191 мг), колбу два раза дегазировали и заполняли аргоном и смесь нагревали в колбе с обратным холодильником в течение 2 ч. Добавляли воду и реакционную смесь экстрагировали смесью дихлорметана и метанола (10:1). Объединенные органические фазы промывали насыщенным раствором хлорида натрия, высушивали (сульфат натрия) и растворитель удаляли в вакууме. При осуществлении хроматографии на силикагеле получали 205 мг указанного в заглавии соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):[част. на млн]= 1,46 (s, 9H), 2,35 (s, 3H), 6,96 (dd, 1H), 7,54 (d, 2H),7,57-7,63 (m, 2H), 7,66 (d, 2H), 7,79 (s, 1H), 7,87 (dd, 1H), 9,04 (dd, 1H), 9,34 (s, 1H), 9,47 (s, 1H). Промежуточный пример Пром 7.2 2-[6-(4-Аминофенил)[1,2,4]триазоло[1,5-а]пиридин-2-ил]амино-4-метилбензонитрил К перемешиваемой суспензии Пром 7.1 (200 мг) в ДХМ (4,5 мл) добавляли TFA (1,4 мл). Смесь перемешивали при к.т. в течение 1 ч. Смесь концентрировали в вакууме. Добавляли полунасыщенный раствор карбоната калия. Смесь экстрагировали с помощью ДХМ и метанола (10:1). Органическую фазу промывали насыщенным раствором хлорида натрия, высушивали (сульфат натрия) и растворитель удаляли в вакууме, получая 103 мг указанного в заглавии соединения в виде неочищенного продукта, который использовали без очистки. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 2,34 (s, 3H), 5,29 (s, 2H), 6,62 (d, 2 Н), 6,95 (d, 1 Н),7,37-7,45 (m, 2 Н), 7,52-7,61 (m, 2 Н), 7,76-7,83 (m, 2 Н), 8,85-8,90 (m, 1 Н), 9,27 (br. s., 1H). Промежуточный пример Пром 8.1 6-(4-Аминофенил)[1,2,4]триазоло[1,5-а]пиридин-2-амин К перемешиваемой суспензии Пром 4.1 (7,05 г) в ДХМ (210 мл) добавляли TFA (66 мл). Смесь перемешивали при к.т. в течение 1 ч. Смесь концентрировали в вакууме. Добавляли насыщенный раствор карбоната калия до достижения рН 10 и смесь экстрагировали три раза с помощью ДХМ и метанола(10:1). Органическую фазу высушивали (сульфат натрия) и растворитель удаляли в вакууме, получая 4,6 г указанного в заглавии соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 5,26 (s, 2 Н), 5,95 (s, 2H), 6,64 (d, 2 Н), 7,29-7,45 (m,3 Н), 7,64 (dd, 1 Н), 8,60-8,70 (m, 1 Н). Промежуточный пример Пром 8.2 К перемешиваемой суспензии Пром 8.1 (1,09 г) в ДМФА (45 мл) добавляли карбонат калия (3,3 г),фенилуксусную кислоту (791 мг) и TBTU (3,1 г). Смесь перемешивали при к.т. в течение 24 ч. Добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, высушивали (сульфат натрия) и растворитель удаляли в вакууме. При осуществлении хроматографии на силикагеле получали 870 мг указанного в заглавии соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):[част. на млн]= 3,67 (s, 2H), 6,04 (s, 2H), 7,22-7,28 (m, 1H), 7,30-7,37(m, 4 Н), 7,40 (dd, 1 Н), 7,63-7,72 (m, 4 Н), 7,74 (dd, 1H), 8,84 (dd, 1H), 10,31 (s, 1H). Промежуточный пример Пром 9.1 трет-Бутил[3-(2-амино[1,2,4]триазоло[1,5-а]пиридин-6-ил)фенил]карбамат К перемешиваемому раствору Пром 1.2 (5,0 г) в 1-пропаноле (350 мл) добавляли 2 М раствор карбоната калия (34,5 мл), 3-[(трет-бутоксикарбонил)амино]фенилбороновую кислоту (10,9 г), трифенилфосфин (126 мг) и PdCl2(PPh3)2 (1,61 г). Смесь нагревали в колбе с обратным холодильником в течение 1 ч, растворитель удаляли в вакууме, добавляли воду и смесь экстрагировали этилацетатом и метанолом(9:1). Органическую фазу высушивали (сульфат натрия), фильтровали через целит и растворитель удаляли в вакууме. Остаток растирали в порошок с ДХМ, получая указанное в заглавии соединение в виде белого твердого вещества. Выход: 6,65 г. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 1,49 (s, 9H), 6,08 (s, 2H), 7,26-7,39 (m, 2H), 7,44 (dd,2H), 7,65 (dd, 1H), 7,78 (s, 1H), 8,74 (d, 1H), 9,45 (s, 1H). Промежуточный пример Пром 9.2 трет-Бутил(3-2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-илфенил)карбамат К перемешиваемому раствору Пром 9.1 (1,4 г) в толуоле (20 мл) добавляли 2-броманизол (3,22 г),Pd2dba3 (394 мг) и rac-BINAP (536 мг). Колбу два раза дегазировали и заполняли аргоном. Смесь перемешивали при к.т. в течение 5 мин. Добавляли карбонат цезия (6,99 г), колбу два раза дегазировали и заполняли аргоном и смесь нагревали в колбе с обратным холодильником в течение 15 ч. Дополнительно добавляли Pd2dba3 (197 мг) и rac-BINAP (268 мг), колбу два раза дегазировали и заполняли аргоном и смесь нагревали в колбе с обратным холодильником в течение 2 ч. Добавляли воду и реакционную смесь экстрагировали смесью дихлорметана и метанола (10:1). Органическую фазу промывали насыщенным раствором хлорида натрия, высушивали (сульфат натрия) и растворитель удаляли в вакууме. При осуществлении хроматографии на силикагеле получали 1,25 г указанного в заглавии соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 1,50 (s, 9H), 3,88 (s, 3H), 6,90-7,01 (m, 2 Н), 7,01-7,07(m, 1 Н), 7,37 (d, 2 Н), 7,41-7,49 (m, 1 Н), 7,66 (dd, 1H), 7,81 (dd, 1 Н), 7,85 (s, 1 Н), 8,01 (s, 1 Н), 8,22-8,30 (m,1H), 9,00 (dd, 1H), 9,48 (s, 1 Н). Промежуточный пример Пром 9.3 6-(3-Аминофенил)-N-(2-метоксифенил)[1,2,4]триазоло[1,5-а]пиридин-2-амин К перемешиваемой суспензии Пром 9.2 (1,20 г) в ДХМ (7,5 мл) добавляли 1,3-диметоксибензол(0,77 г) и TFA (3,2 мл). Смесь перемешивали при к.т. в течение 1 ч. 1 М раствор гидроксида натрия добавляли при 0 С до достижения рН 9 и смесь экстрагировали смесью ДХМ и метанола (9:1). Органическую фазу промывали насыщенным раствором хлорида натрия, высушивали (сульфат натрия) и растворитель удаляли в вакууме. При осуществлении хроматографии на аминофазном силикагеле получали 710 мг указанного в заглавии соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 3,88 (s, 3H), 5,21 Промежуточный пример Пром 9.4 4-Нитрофенил(3-2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-илфенил)карбамат К перемешиваемому раствору 4-нитрофенилхлороформиата (564 мг) в ТГФ (20 мл) добавляли пиридин (0,37 мл) и DMAP (11 мг). Смесь охлаждали до 0 С и добавляли Пром 9.3 (300 мг). Смесь перемешивали при 0 С в течение 2 ч. Добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным раствором хлорида натрия, высушивали (сульфат натрия) и растворитель удаляли в вакууме. Остаток растирали в порошок с ДХМ. Твердое вещество собирали путем фильтрации. Выход: 380 мг указанного в заглавии соединения в виде неочищенного продукта, который использовали без дополнительной очистки. СЭЖХ-МС: RT = 1,43 мин; m/z (ES+) 497 [МН+]; необходимый MB = 496. Промежуточный пример Пром 10.1 3-(2-Амино[1,2,4]триазоло[1,5-а]пиридин-6-ил)бензойная кислота К перемешиваемому раствору Пром 1.2 (7,0 г) в 1-пропаноле (480 мл) добавляли 2 М раствор карбоната калия (48 мл), 3-карбоксифенилбороновую кислоту (10,7 г), трифенилфосфин (177 мг) иPdCl2(PPh3)2 (2,26 г). Смесь нагревали в колбе с обратным холодильником в течение 15 ч. Добавляли воду (1000 мл) и смесь промывали этилацетатом (1000 мл). 4 н. Раствор соляной кислоты добавляли к водной фазе до достижения рН 5. Осаждалось белое твердое вещество, собирали путем фильтрации, промывали водой и этанолом и высушивали в вакууме. Выход: 7,3 г указанного в заглавии соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 6,11 (br. s., 2H), 7,45 (d, 1H), 7,56-7,68 (m, 1 Н), 7,79(dd, 1 Н), 7,90-8,04 (m, 2 Н), 8,21 (s, 1H), 8,88-9,07 (m, 1 Н), 13,13 (br.s., 1H). Промежуточный пример Пром 10.2 Этил 3-(2-амино[1,2,4]триазоло[1,5-а]пиридин-6-ил)бензоат К перемешиваемой суспензии Пром 10.1 (2,00 г) в этаноле (40 мл) добавляли тионилхлорид (0,86 мл) при 0 С. Смесь нагревали в колбе с обратным холодильником в течение 96 ч. Дополнительно добавляли тионилхлорид (1,72 мл) и смесь нагревали в колбе с обратным холодильником в течение 48 ч. Смеси позволяли охладиться до к.т. Осаждалось белое твердое вещество, собирали путем фильтрации. Твердое вещество промывали этанолом и высушивали в вакууме. Добавляли полунасыщенный раствор карбоната калия и смесь экстрагировали с помощью ДХМ и метанола (10:1). Органическую фазу промывали насыщенным раствором хлорида натрия, высушивали (сульфат натрия) и растворитель удаляли в вакууме, получая 1,52 г указанного в заглавии соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 1,35 (t, 3H), 4,35 (q, 2 Н), 6,11 (s, 2 Н), 7,45 (dd, 1H),7,63 (t, 1H), 7,79 (dd, 1H), 7,90-8,08 (m, 2H), 8,21 (t, 1H), 8,97 (d, 1H). Промежуточный пример Пром 10.3 Этил 3-2-[(2-цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-илбензоат К перемешиваемому раствору Пром 10.2 (1,5 г) в толуоле (25 мл) добавляли 2-бромбензонитрил(3,87 г), Pd2dba3 (487 мг) и rac-BINAP (662 мг). Колбу два раза дегазировали и заполняли аргоном. Смесь перемешивали при к.т. в течение 5 мин. Добавляли карбонат цезия (8,6 г), колбу два раза дегазировали и заполняли аргоном и смесь нагревали в колбе с обратным холодильником в течение 3 ч. Добавляли воду и реакционную смесь экстрагировали этилацетатом и метанолом (10:1). Органическую фазу промывали водой, высушивали (сульфат натрия) и растворитель удаляли в вакууме. Остаток перекристаллизовывали из этанола, получая 1,85 г указанного в заглавии соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):[част. на млн]= 1,36 (t, 3H), 4,36 (q, 2H), 7,18 (td, 1H), 7,62-7,72 (m,3 Н), 7,76 (dd, 1 Н), 7,95-8,01 (m, 2 Н), 8,02 (d, 1H), 8,05-8,09 (m, 1 Н), 8,27 (t, 1H), 9,23 (dd, 1H), 9,55 (s, 1H). Промежуточный пример Пром 10.4 3-2-[(2-Цианофенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-илбензойная кислота К перемешиваемому раствору Пром 10.3 (1,8 г) в ТГФ (30 мл) и метаноле (60 мл) добавляли 2,5 М раствор гидроксида натрия (47 мл). Смесь перемешивали при к.т. в течение 4 ч. Добавляли 1 н. раствор соляной кислоты до достижения рН 3. Осаждалось белое твердое вещество, собирали путем фильтрации,промывали водой и этанолом и высушивали в вакууме. Выход: 1,12 г указанного в заглавии соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6, выбранные сигналы):[част. на млн]= 7,15 (t, 1H), 7,55-7,68 (m, 3 Н),7,73 (dd, 1H), 7,94 (d, 2H), 7,99 (t, 2H), 8,23 (s, 1H), 9,17 (s, 1H), 9,54 (s, 1H). Промежуточный пример Пром 11.1 трет-Бутил 3-(2-амино[1,2,4]триазоло[1,5-а]пиридин-6-ил)бензоат К перемешиваемому раствору Пром 1.2 (1,2 г) в 1-пропаноле (83 мл) добавляли 2 М раствор карбоната калия (8,3 мл), [3-(трет-бутоксикарбонил)фенил]бороновую кислоту (2,45 г), трифенилфосфин (30 мг) и PdCl2(PPh3)2 (387 г). Смесь нагревали в колбе с обратным холодильником в течение 15 ч. Добавляли воду (50 мл) и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, высушивали (сульфат натрия) и растворитель удаляли в вакууме. При осуществлении хроматографии на силикагеле получали 1,04 г указанного в заглавии соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 1,57 (s, 9H), 6,10 (s, 2H), 7,45 (dd, 1 Н), 7,56-7,64 (m,1 Н), 7,78 (dd, 1 Н), 7,90 (dt, 1 Н), 7,94-8,01 (m, 1 Н), 8,15 (t, 1H), 8,95 (dd, 1H). Промежуточный пример Пром 11.2 трет-Бутил 3-2-[(2-метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-илбензоат Промежуточный пример Пром 11.3 3-2-[(2-Метоксифенил)амино][1,2,4]триазоло[1,5-а]пиридин-6-илбензойная кислота К перемешиваемому раствору Пром 11.1 (1,0 г) в толуоле (15 мл) добавляли 2-броманизол (1,2 г),Pd2dba3 (148 мг) и rac-BINAP (201 мг). Колбу два раза дегазировали и заполняли аргоном. Смесь перемешивали при к.т. в течение 5 мин. Добавляли трет-бутилатнатрия (619 мг), колбу два раза дегазировали и заполняли аргоном и смесь нагревали в колбе с обратным холодильником в течение 1 ч. Добавляли воду и смесь экстрагировали этилацетатом и метанолом (10:1). Органическую фазу промывали насыщенным раствором хлорида натрия, высушивали (сульфат натрия) и растворитель удаляли в вакууме. При осуществлении хроматографии на силикагеле получали 71 мг Пром 11.2. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 1,59 (s, 9H), 3,89 (s, 3H), 6,93-7,00 (m, 2 Н), 7,02-7,07(m, 1 Н), 7,58-7,70 (m, 2 Н), 7,90-7,98 (m, 2 Н), 8,01-8,07 (m, 2 Н), 8,21 (t, 1H), 8,23-8,30 (m, 1H), 9,22 (d, 1H). 4 н. Раствор соляной кислоты добавляли к водной фазе отработки до достижения рН 3 и смесь экст- 25022353 рагировали с помощью ДХМ и метанола (10:1). Органическую фазу высушивали (сульфат натрия) и растворитель удаляли в вакууме, получая 155 мг Пром 11.3. 1 Н-ЯМР (400 МГц, ДМСО-d6):[част. на млн]= 3,81-3,92 (m, 3H), 6,94-7,00 (m, 2 Н), 7,02-7,07 (m,1 Н), 7,63 (t, 1 Н), 7,69-7,73 (m, 1 Н), 7,97 (dt, 1H), 7,99-8,07 (m, 3 Н), 8,20-8,24 (m, 1H), 8,27 (t, 1H), 9,25 (d,1H). Примеры Пример 1.1 Раствор 0,17 ммоль Пром 2.1 в 1,33 мл NMP объединяли с 0,44 ммоль 4-бром-3-метоксибензонитрилом (48,6 мг, 2,6 экв.), 0,04 ммоль Pd2(dba)3 (36,6 мг, 0,23 экв.), 0,12 ммоль гас-BINAP (74,7 мг,0,7 экв.) и 0,25 ммоль NaOtBu (24,03 мг, 1,5 экв.) в запечатанном сосуде и нагревали при 170 С под воздействием микроволнового облучения в течение 2 ч. После охлаждения раствор фильтровали и подвергали препаративной ВЭЖХ, получая 4,7 мг указанного в заглавии соединения. СЭЖХ-МС:RT = 1,15 мин;P(oTol)3 (0,4 мл, 0,05 М в NMP, 0,2 экв.) и 0,3 ммоль карбоната калия (0,3 мл, 1M в воде, 3 экв.) объединяли в запечатанном сосуде и нагревали при 140 С под воздействием микроволнового облучения в течение 40 мин. После охлаждения раствор фильтровали и подвергали препаративной ВЭЖХ, получая 7,5 мг К перемешиваемому раствору Пром 4.3 (60 мг) в ДМФА (3 мл) добавляли карбонат калия (178 мг),[4-(трифторметил)фенил]уксусную кислоту (57 мг) и TBTU (295 мг). Смесь перемешивали при к.т. в течение 2 ч. Смесь концентрировали в вакууме, добавляли воду и смесь экстрагировали этилацетатом и метанолом (100:1). Органическую фазу промывали водой и насыщенным раствором хлорида натрия, высушивали (сульфат натрия) и растворитель удаляли в вакууме. При перекристаллизации остатка из этанола получали 27 мг указанного в заглавии соединения. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 3,77 (s, 2H), 7,14 (td, 1H), 7,54 (d, 2H), 7,58-7,76 (m,9H), 7,89 (dd, 1H), 7,99 (d, 1H), 9,06 (br. s, 1H), 9,47 (s, 1 Н), 10,33 (br. s, 1H). Пример 3.2 Используя в качестве исходного вещества Пром 4.3, пример 3.2 приготавливали аналогично процедуре для приготовления примера 3.1. Используя в качестве исходного вещества Пром 4.3, пример 3.3 приготавливали аналогично процедуре для приготовления примера 3.1. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 3,71-3,84 (m, 2H), 7,14 (td, 1H), 7,50-7,77 (m, 11 Н),7,89 (dd, 1H), 7,98 (d, 1H), 9,07 (br. s, 1H), 9,48 (s, 1H), 10,33 (br. s, 1H). Пример 3.4 Используя в качестве исходного вещества Пром 4.3, пример 3.4 приготавливали аналогично процедуре для приготовления примера 3.1. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 3,73 (s, 2H), 7,15 (d, 3H), 7,24-7,32 (m, 1 Н), 7,34-7,43 Используя в качестве исходного вещества Пром 4.3, пример 3.5 приготавливали аналогично процедуре для приготовления примера 3.1. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 3,68 (s, 2 Н), 7,00-7,20 (m, 4H), 7,28-7,40 (m, 1 Н),7,58-7,77 (m, 7 Н), 7,89 (dd, 1H), 7,99 (d, 1H), 9,06 (d, 1H), 9,48 (s, 1H), 10,30 (s, 1H). Пример 3.6 Используя в качестве исходного вещества Пром 4.3, пример 3.6 приготавливали аналогично процедуре для приготовления примера 3.1. 1 Н-ЯМР (400 МГц, ДМСО-d6):[част. на млн]= 3,64 (s, 2 Н), 7,09-7,17 (m, 3 Н), 7,31-7,38 (m, 2 Н),7,59-7,64 (m, 2 Н), 7,64-7,75 (m, 5 Н), 7,89 (dd, 1H), 7,99 (d, 1 Н), 9,06 (dd, 1H), 9,48 (s, 1H), 10,28 (s, 1H). К перемешиваемому раствору Пром 4.3 (80 мг) в ТГФ (10 мл) добавляли фенил изоцианат (55 мкл). Смесь нагревали до 50 С в течение 15 ч. Добавляли полунасыщенный раствор бикарбоната натрия и этилацетат. Твердое вещество осаждалось и собирали путем фильтрации. Твердое вещество растворяли в ДМФА. Полученный раствор фильтровали и концентрировали в вакууме. Остаток растирали в порошок с ДХМ. Твердое вещество собирали путем фильтрации. Выход: 85 мг указанного в заглавии соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):[част. на млн]= 6,94 (t, 1H), 7,14 (t, 1H), 7,26 (t, 2 Н), 7,44 (d, 2H),7,55 (d, 2H), 7,60-7,76 (m, 5H), 7,90 (br. d, 1H), 8,00 (d, 1H), 8,73 (s, 1H), 8,83 (s, 1H), 9,06 (s, 1H), 9,48 (s,1H). Пример 3.8 Используя в качестве исходного вещества Пром 4.3, пример 3.8 приготавливали аналогично процедуре для приготовления примера 3.1. 1 Н-ЯМР (400 МГц, ДМСО-d6):[част. на млн]= 3,71 (s, 2H), 7,14 (td, 1H), 7,34 (dd, 1H), 7,62 (d, 2H),7,64-7,76 (m, 6H), 7,89 (dd, 1H), 7,99 (d, 1H), 8,44 (dd, 1H), 8,51 (d, 1H), 9,07 (d, 1H), 9,48 (s, 1H), 10,35 (s,1H). Пример 3.9 Используя в качестве исходного вещества Пром 4.3, пример 3.9 приготавливали аналогично процедуре для приготовления примера 3.1. 1 Н-ЯМР (300 МГц, ДМСО-d6):[част. на млн]= 3,60 (s, 2H), 3,71 (s, 3H), 6,76-6,82 (m, 1 Н), 6,85-6,92 Используя в качестве исходного вещества Пром 4.3, пример 3.10 приготавливали аналогично процедуре для приготовления примера 3.1. 1 Н-ЯМР (400 МГц, ДМСО-d6):[част. на млн]= 3,67 (s, 2 Н), 7,11-7,18 (m, 2 Н), 7,32-7,41 (m, 2 Н),7,59-7,64 (m, 2 Н), 7,64-7,75 (m, 5 Н), 7,89 (dd, 1H), 7,99 (d, 1 Н), 9,03 (br. s, 1H), 9,48 (s, 1H), 10,28 (br. s,1H). Используя в качестве исходного вещества Пром 4.3, пример 3.11 приготавливали аналогично процедуре для приготовления примера 3.1. 1 Н-ЯМР: (300 МГц, ДМСО-d6):[част. на млн]= 3,64 (s, 2H), 7,14 (td, 1H), 7,18-7,36 (m, 5 Н), 7,587,75 (m, 7 Н), 7,89 (dd, 1 Н), 7,99 (d, 1 Н), 9,06 (d, 1H), 9,49 (s, 1 Н), 10,28 (s, 1H). Пример 4.1 Используя в качестве исходного вещества Пром 5.2, пример 4.1 приготавливали аналогично процедуре для приготовления примера 3.1. 1 Н-ЯМР (400 МГц, ДМСО-d6):[част. на млн]= 3,64 (s, 2H), 3,85 (s, 3H), 6,87-6,97 (m, 2 Н), 6,97-7,03 Используя в качестве исходного вещества Пром 5.2, пример 4.2 приготавливали аналогично процедуре для приготовления примера 3.1. 1 Н-ЯМР (400 МГц, ДМСО-d6):[част. на млн]= 0,14-0,20 (m, 2H), 0,43-0,50 (m, 2 Н), 0,97-1,11 (m,1 Н), 2,20 (d, 2 Н), 3,85 (s, 3 Н), 6,88-6,97 (m, 2 Н), 6,98-7,04 (m, 1H), 7,60 (d, 1 Н), 7,65-7,74 (m, 4 Н), 7,89 (dd,1H), 7,99 (br. s, 1H), 8,21 (dd, 1 Н), 9,08 (s, 1H), 9,92 (br. s, 1H). Пример 4.3 Используя в качестве исходного вещества Пром 5.2, пример 4.3 приготавливали аналогично процедуре для приготовления примера 3.1. 1 Н-ЯМР (400 МГц, ДМСО-d6):[част. на млн]= 0,69-0,86 (m, 4H), 1,69-1,83 (m, 1 Н), 3,85 (s, 3 Н),6,92 (m, 2 Н), 6,98-7,03 (m, 1H), 7,59 (d, 1H), 7,64-7,74 (m, 4 Н), 7,88 (dd, 1H), 7,94 (s, 1H), 8,22 (dd, 1H),9,06 (s, 1H), 10,29 (s, 1H). Пример 5.1 2-Фенил-N-[4-(2-[2-(трифторметил)фенил]амино[1,2,4]триазоло[1,5-а]пиридин-6-ил)фенил]ацетамид Используя в качестве исходного вещества Пром 6.2, пример 5.1 приготавливали аналогично проце- 29
МПК / Метки
МПК: A61K 31/437, C07D 471/04, A61P 35/00
Метки: триазолопиридины
Код ссылки
<a href="https://eas.patents.su/30-22353-triazolopiridiny.html" rel="bookmark" title="База патентов Евразийского Союза">Триазолопиридины</a>
Предыдущий патент: Запирающее устройство для противопожарных дверей или окон
Следующий патент: Терапевтическое применение конъюгатов интерферон-пэг
Случайный патент: Способ разрешения коллизий, возникающих при идентификации кодов, обуславливаемых множеством идентификационных меток на поверхностных акустических волнах






























