Гербицидно активные циклические дионы и их производные, способы их получения, композиции, содержащие эти соединения
Номер патента: 22104
Опубликовано: 30.11.2015
Авторы: Скатт Джеймс Николас, Матью Кристофер Джон, Робинсон Луиса, Финни Джон, Делейни Джон Стивен
Формула / Реферат
1. Соединение формулы I
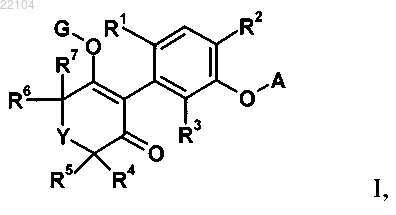
в которой
А обозначает пиридил, пиразинил, пиримидинил, пиридазинил, бензотиазолил, бензоксазолил, циннолинил, хинолинил, хиназолинил, хиноксалинил или бензотриазинил, в каждом случае содержащий в качестве заместителей галоген, метил, этил, трифторметил, метоксигруппу, дифторметоксигруппу, трифторметоксигруппу, нитрогруппу или цианогруппу;
R1 обозначает метил, этил, н-пропил, циклопропил, этинил, фтор, хлор, бром, метоксигруппу или галогенметоксигруппу;
R2 и R3 обозначают водород и
R4, R5, R6 и R7 независимо друг от друга обозначают водород, C1-С6-алкил или C1-алкил, замещенный C1-алкоксигруппой; или
R5 и R6 вместе с атомами, к которым они присоединены, образуют 5-8-членный карбоциклил или гетероциклил, где гетероциклил содержит один гетероатом кислорода;
Y обозначает О или CR8R9; и
R8 и R9 независимо друг от друга обозначают водород, С1-С6-алкил, C1-С3-алкил, замещенный С1-С4-алкоксигруппой, или гетероциклил или гетероциклил, замещенный C1-алкилом или C1-алкоксигруппой; или
R8 и R9 вместе с атомами, к которым они присоединены, образуют 5-8-членный спирокарбоциклил или спирогетероциклил, который содержит один или два гетероатома, выбранных из группы, включающей азот, кислород и серу; и
G обозначает водород или сельскохозяйственно приемлемый металл, сульфоний, аммоний или маскирующую группу;
и в которой, если G обозначает маскирующую группу, то G обозначает C(Xa)-Ra или C(Xb)-Xc-Rb;
где Ха, Xb и Xc обозначают кислород; и где
Ra обозначает С1-С18-алкил, С2-С18-алкенил, С2-С18-алкинил, С1-галогеналкил, С3-С7-циклоалкил(С1-С5)алкил, С1-С5-алкокси(С1-С5)алкил, С3-С5-алкенилокси(С1-С5)алкил, С1-С5-алкилтио(С1-С5)алкил, С1-С5-алкилкарбонил(С1-С5)алкил, С1-С5-алкоксикарбонил(С1-С5)алкил, С1-С5-алкиламинокарбонил(С1-С5)алкил, С2-С8-диалкиламинокарбонил(С1-С5)алкил, С1-С5-алкилкарбониламино(С1-С5)алкил, фенил(С1-С5)алкил (где фенил необязательно содержит в качестве заместителей C1-С3-алкил, С1-С3-галогеналкил, С1-С3-алкоксигруппу, С1-С3-галогеналкоксигруппу, С1-С3-алкилтиогруппу, С1-С3-алкилсульфинил, С1-С3-алкилсульфонил, галоген, цианогруппу или нитрогруппу), гетероарил(С1-С5)алкил (где гетероарил необязательно содержит в качестве заместителей C1-С3-алкил, C1-С3-галогеналкил, С1-С3-алкоксигруппу, С1-С3-галогеналкоксигруппу, C1-С3-алкилтиогруппу, C1-С3-алкилсульфинил, С1-С3-алкилсульфонил, галоген, цианогруппу или нитрогруппу), С3-С8-циклоалкил; фенил или фенил, содержащий в качестве заместителей С1-С3-алкил, C1-С3-галогеналкил, C1-С3-алкоксигруппу, С1-С3-галогеналкоксигруппу, галоген, цианогруппу или нитрогруппу; или гетероарил или гетероарил, содержащий в качестве заместителей С1-С3-алкил, C1-С3-галогеналкил, C1-С3-алкоксигруппу, С1-С3-галогеналкоксигруппу, галоген, цианогруппу или нитрогруппу; и Rb обозначает С1-С18-алкил, С3-С18-алкенил, С3-С18-алкинил, С2-галогеналкил, С3-С7-циклоалкил(С1-С5)алкил, С1-С5-алкокси(С1-С5)алкил, С3-С5-алкенилокси(С1-С5)алкил, С3-С5-алкинилокси(С1-С5)алкил, С1-С5-алкилтио(С1-С5)алкил, С1-С5-алкилкарбонил(С1-С5)алкил, С1-С5-алкоксикарбонил(С1-С5)алкил, С1-С5-алкиламинокарбонил(С1-С5)алкил, C2-C8-диалкиламинокарбонил(С1-С5)алкил, С1-С5-алкилкарбониламино(С1-С5)алкил, фенил(С1-С5)алкил (где фенил необязательно содержит в качестве заместителей C1-С3-алкил, С1-С3-галогеналкил, C1-С3-алкоксигруппу, С1-С3-галогеналкоксигруппу, С1-С3-алкилтиогруппу, С1-С3-алкилсульфинил, С1-С3-алкилсульфонил, галоген, цианогруппу или нитрогруппу), гетероарил-С1-С5-алкил (где гетероарил необязательно содержит в качестве заместителей С1-С3-алкил, С1-С3-галогеналкил, C1-С3-алкоксигруппу, С1-С3-галогеналкоксигруппу, С1-С3-алкилтиогруппу, C1-С3-алкилсульфинил, С1-С3-алкилсульфонил, галоген, цианогруппу или нитрогруппу), С3-С8-циклоалкил; фенил или фенил, содержащий в качестве заместителей C1-С3-алкил, C1-С3-галогеналкил, C1-С3-алкоксигруппу, C1-С3-галогеналкоксигруппу, галоген, цианогруппу или нитрогруппу; или гетероарил или гетероарил, содержащий в качестве заместителей C1-С3-алкил, С1-С3-галогеналкил, C1-С3-алкоксигруппу, С1-С3-галогеналкоксигруппу, галоген, цианогруппу или нитрогруппу; и где
"гетероарил" означает ароматическую кольцевую систему, содержащую по меньшей мере один гетероатом и включающую одно кольцо или два конденсированных кольца, где одно гетероарильное кольцо содержит от одного до трех гетероатомов, а бициклические гетероарильные системы содержат от одного до четырех гетероатомов, которые выбраны из группы, включающей азот, кислород и серу; и
"гетероциклил", кроме где определено иначе, означает неароматическую моноциклическую кольцевую систему, содержащую до 7 атомов, включая один или два гетероатома, выбранных из группы, включающей О, S и N.
2. Соединение по п.1, в котором А обозначает пиридил, пиразинил, пиримидинил, бензотиазолил, бензоксазолил, хинолинил или хиноксалинил, в каждом случае содержащий в качестве заместителей галоген, метил, этил, трифторметил, метоксигруппу, дифторметоксигруппу, трифторметоксигруппу, нитрогруппу или цианогруппу.
3. Соединение по п.1, в котором R1 обозначает метил, этил, н-пропил, циклопропил, фтор, хлор, бром или C1-галогеналкоксигруппу.
4. Соединение по п.1, в котором
R4, R5, R6 и R7 независимо друг от друга обозначают водород или С1-С6-алкил или
R5 и R6 вместе с атомами, к которым они присоединены, образуют 6- или 7-членный карбоциклил.
5. Соединение по п.1, в котором Y обозначает О.
6. Соединение по п.1, в котором R8 и R9 независимо друг от друга обозначают водород или метил; или R8 и R9 вместе с атомами, к которым они присоединены, образуют спиротетрагидропиранил или спиротетрагидрофуранил.
7. Соединение по п.1, в котором
"гетероциклил" означает неароматическую моноциклическую кольцевую систему, содержащую до 7 атомов, включая 1 гетероатом, выбранный из группы, включающей О, S и N.
8. Соединение по п.1, в котором G обозначает водород, сельскохозяйственно приемлемый щелочной металл или сельскохозяйственно приемлемый щелочно-земельный металл.
9. Соединение по п.1, в котором G обозначает водород.
10. Соединение по п.1, в котором
А обозначает пиридил, пиразинил, пиримидинил, бензотиазолил, бензоксазолил, циннолинил, хинолинил, хиназолинил, хиноксалинил или бензотриазинил, в каждом случае содержащий в качестве заместителей галоген, метил, трифторметил, нитрогруппу или цианогруппу;
R1 обозначает этил;
R2 и R3 обозначают водород и
R4-R7 обозначают водород или метил или
R5 и R6 вместе с атомами, к которым они присоединены, образуют 6- или 7-членный карбоциклил; и
Y обозначает О или CR8R9;
где R8 и R9 независимо друг от друга обозначают водород или метил, или R8 и R9 вместе с атомами, к которым они присоединены, образуют спиротетрагидропиранил или спиротетрагидрофуранил; и G обозначает водород.
11. Соединение по п.1, в котором
R1 обозначает метил, этил или циклопропил;
R2 и R3 обозначают водород; и
R4, R5, R6 и R7 независимо друг от друга обозначают водород или метил или
R5 и R6 вместе с атомами, к которым они присоединены, образуют 6- или 7-членный карбоциклил; и
Y обозначает О или CR8R9;
где R8 и R9 независимо друг от друга обозначают водород или метил или R8 и R9 вместе с атомами, к которым они присоединены, образуют спиротетрагидропиранил или спиротетрагидрофуранил; и
G обозначает водород; и
А обозначает пиридил, пиразинил, пиримидинил, бензотиазолил, бензоксазолил, хинолинил или хиноксалинил, в каждом случае содержащий в качестве заместителей метоксигруппу, фтор, хлор, бром, йод, метил, трифторметил, нитрогруппу или цианогруппу.
12. Соединение следующего типа:
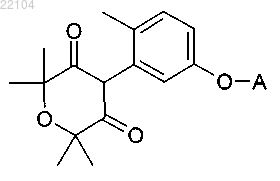
где А обозначает 3-хлорпиридин-2-ил, 4-хлорпиридин-2-ил, 5-хлорпиридин-2-ил, 6-хлорпиридин-2-ил, 2-хлорпиридин-3-ил, 4-хлорпиридин-3-ил, 5-хлорпиридин-3-ил, 6-хлорпиридин-3-ил, 2-хлорпиридин-4-ил, 3-хлорпиридин-4-ил, 3,4-дихлорпиридин-2-ил, 3,5-дихлорпиридин-2-ил, 3,6-дихлорпиридин-2-ил, 2,5-дихлорпиридин-3-ил, 2,6-дихлорпиридин-3-ил, 2,3-дихлорпиридин-4-ил, 2,5-дихлорпиридин-4-ил, 3,5,6-трихлорпиридин-2-ил, 3-фторпиридин-2-ил, 4-фторпиридин-2-ил, 5-фторпиридин-2-ил, 6-фторпиридин-2-ил, 2-фторпиридин-3-ил, 4-фторпиридин-3-ил, 5-фторпиридин-3-ил, 6-фторпиридин-3-ил, 2-фторпиридин-4-ил, 3-фторпиридин-4-ил, 3,4-дифторпиридин-2-ил, 3,5-дифторпиридин-2-ил, 3,6-дифторпиридин-2-ил, 2,5-дифторпиридин-3-ил, 2,6-дифторпиридин-3-ил, 2,3-дифторпиридин-4-ил, 2,5-дифторпиридин-4-ил, 3,5,6-трифторпиридин-2-ил, 3-трифторметилпиридин-2-ил, 4-трифторметилпиридин-2-ил, 5-трифторметилпиридин-2-ил, 6-трифторметилпиридин-2-ил, 2-трифторметилпиридин-3-ил, 4-трифторметилпиридин-3-ил, 5-трифторметилпиридин-3-ил, 6-трифторметилпиридин-3-ил, 2-трифторметилпиридин-4-ил, 3-трифторметилпиридин-4-ил, 4-хлор-3-фторпиридин-2-ил, 5-хлор-3-фторпиридин-2-ил, 6-хлор-3-фторпиридин-2-ил, 3-хлор-4-фторпиридин-2-ил, 3-хлор-5-фторпиридин-2-ил, 3-хлор-6-фторпиридин-2-ил, 3-хлор-5-трифторметилпиридин-2-ил, 3-фтор-5-трифторметилпиридин-2-ил, 6-фтор-3,4,5-трихлорпиридин-2-ил, 4-метил-3,5,6-трифторпиридин-2-ил, пиримидин-2-ил, 5-фторпиримидин-2-ил, 5-хлорпиримидин-2-ил, 5-бромпиримидин-2-ил, 6-хлорпиридазин-3-ил, 6-бромпиридазин-3-ил, хинолин-2-ил, 6-фторхинолин-2-ил, 7-фторхинолин-2-ил, 6-хлорхинолин-2-ил, 7-хлорхинолин-2-ил, 6-бромхинолин-2-ил, 7-бромхинолин-2-ил, 6-трифторметилхинолин-2-ил, 7-трифторметилхинолин-2-ил, хиноксалин-2-ил, 6-фторхиноксазин-2-ил, 7-фторхиноксалин-2-ил, 6-хлорхиноксалин-2-ил, 7-хлорхиноксалин-2-ил, 6-бромхиноксалин-2-ил, 7-бромхиноксалин-2-ил, 6-трифторметилхиноксалин-2-ил, 7-трифторметилхиноксалин-2-ил, хиназолин-2-ил, 6-фторхиназолин-2-ил, 7-фторхиназолин-2-ил, 6-хлорхиназолин-2-ил, 7-хлорхиназолин-2-ил, 6-бромхиназолин-2-ил, 7-бромхиназолин-2-ил, бензоксазол-2-ил, 5-фторбензоксазол-2-ил, 6-фторбензоксазол-2-ил, 5-хлорбензоксазол-2-ил, 6-хлорбензоксазол-2-ил, 5-бромбензоксазол-2-ил, 6-бромбензоксазол-2-ил, 5-трифторметилбензоксазол-2-ил, 6-трифторметилбензоксазол-2-ил, бензотиазол-2-ил, 5-фторбензотиазол-2-ил, 6-фторбензотиазол-2-ил, 5-хлорбензотиазол-2-ил, 6-хлорбензотиазол-2-ил, 5-бромбензотиазол-2-ил, 6-бромбензотиазол-2-ил, 5-трифторметилбензотиазол-2-ил, 6-трифторметилбензотиазол-2-ил, бензо[1,2,4]триазин-3-ил, 6-фторбензо[1,2,4]триазин-3-ил, 7-фторбензо[1,2,4]триазин-3-ил, 6-хлорбензо[1,2,4]триазин-3-ил, 7-хлорбензо[1,2,4]триазин-3-ил, 6-бромбензо[1,2,4]триазин-3-ил или 7-бромбензо[1,2,4]триазин-3-ил.
13. Соединение следующего типа:
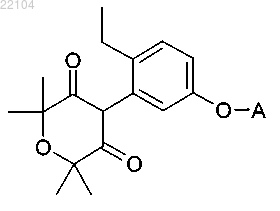
где А обозначает 3-хлорпиридин-2-ил, 4-хлорпиридин-2-ил, 5-хлорпиридин-2-ил, 6-хлорпиридин-2-ил, 2-хлорпиридин-3-ил, 4-хлорпиридин-3-ил, 5-хлорпиридин-3-ил, 6-хлорпиридин-3-ил, 2-хлорпиридин-4-ил, 3-хлорпиридин-4-ил, 3,4-дихлорпиридин-2-ил, 3,5-дихлорпиридин-2-ил, 3,6-дихлорпиридин-2-ил, 2,5-дихлорпиридин-3-ил, 2,6-дихлорпиридин-3-ил, 2,3-дихлорпиридин-4-ил, 2,5-дихлорпиридин-4-ил, 3,5,6-трихлорпиридин-2-ил, 3-фторпиридин-2-ил, 4-фторпиридин-2-ил, 5-фторпиридин-2-ил, 6-фторпиридин-2-ил, 2-фторпиридин-3-ил, 4-фторпиридин-3-ил, 5-фторпиридин-3-ил, 6-фторпиридин-3-ил, 2-фторпиридин-4-ил, 3-фторпиридин-4-ил, 3,4-дифторпиридин-2-ил, 3,5-дифторпиридин-2-ил, 3,6-дифторпиридин-2-ил, 2,5-дифторпиридин-3-ил, 2,6-дифторпиридин-3-ил, 2,3-дифторпиридин-4-ил, 2,5-дифторпиридин-4-ил, 3,5,6-трифторпиридин-2-ил, 3-трифторметилпиридин-2-ил, 4-трифторметилпиридин-2-ил, 5-трифторметилпиридин-2-ил, 6-трифторметилпиридин-2-ил, 2-трифторметилпиридин-3-ил, 4-трифторметилпиридин-3-ил, 5-трифторметилпиридин-3-ил, 6-трифторметилпиридин-3-ил, 2-трифторметилпиридин-4-ил, 3-трифторметилпиридин-4-ил, 4-хлор-3-фторпиридин-2-ил, 5-хлор-3-фторпиридин-2-ил, 6-хлор-3-фторпиридин-2-ил, 3-хлор-4-фторпиридин-2-ил, 3-хлор-5-фторпиридин-2-ил, 3-хлор-6-фторпиридин-2-ил, 3-хлор-5-трифторметилпиридин-2-ил, 3-фтор-5-трифторметилпиридин-2-ил, 6-фтор-3,4,5-трихлорпиридин-2-ил, 4-метил-3,5,6-трифторпиридин-2-ил, пиримидин-2-ил, 5-фторпиримидин-2-ил, 5-хлорпиримидин-2-ил, 5-бромпиримидин-2-ил, 6-хлорпиридазин-3-ил, 6-бромпиридазин-3-ил, хинолин-2-ил, 6-фторхинолин-2-ил, 7-фторхинолин-2-ил, 6-хлорхинолин-2-ил, 7-хлорхинолин-2-ил, 6-бромхинолин-2-ил, 7-бромхинолин-2-ил, 6-трифторметилхинолин-2-ил, 7-трифторметилхинолин-2-ил, хиноксалин-2-ил, 6-фторхиноксазин-2-ил, 7-фторхиноксалин-2-ил, 6-хлорхиноксалин-2-ил, 7-хлорхиноксалин-2-ил, 6-бромхиноксалин-2-ил, 7-бромхиноксалин-2-ил, 6-трифторметилхиноксалин-2-ил, 7-трифторметилхиноксалин-2-ил, хиназолин-2-ил, 6-фторхиназолин-2-ил, 7-фторхиназолин-2-ил, 6-хлорхиназолин-2-ил, 7-хлорхиназолин-2-ил, 6-бромхиназолин-2-ил, 7-бромхиназолин-2-ил, бензоксазол-2-ил, 5-фторбензоксазол-2-ил, 6-фторбензоксазол-2-ил, 5-хлорбензоксазол-2-ил, 6-хлорбензоксазол-2-ил, 5-бромбензоксазол-2-ил, 6-бромбензоксазол-2-ил, 5-трифторметилбензоксазол-2-ил, 6-трифторметилбензоксазол-2-ил, бензотиазол-2-ил, 5-фторбензотиазол-2-ил, 6-фторбензотиазол-2-ил, 5-хлорбензотиазол-2-ил, 6-хлорбензотиазол-2-ил, 5-бромбензотиазол-2-ил, 6-бромбензотиазол-2-ил, 5-трифторметилбензотиазол-2-ил, 6-трифторметилбензотиазол-2-ил, бензо[1,2,4]триазин-3-ил, 6-фторбензо[1,2,4]триазин-3-ил, 7-фторбензо[1,2,4]триазин-3-ил, 6-хлорбензо[1,2,4]триазин-3-ил, 7-хлорбензо[1,2,4]триазин-3-ил, 6-бромбензо[1,2,4]триазин-3-ил или 7-бромбензо[1,2,4]триазин-3-ил.
14. Соединение, которое представляет собой одно из следующих соединений:
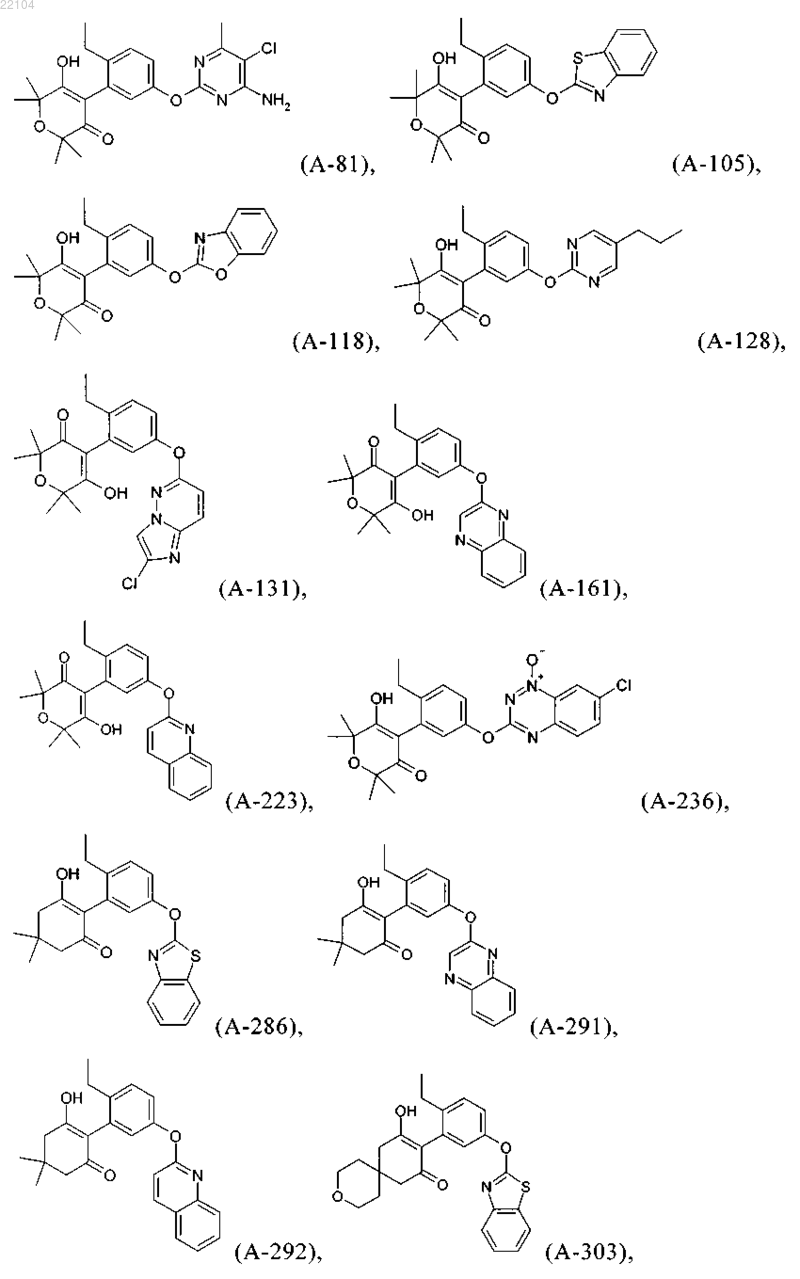
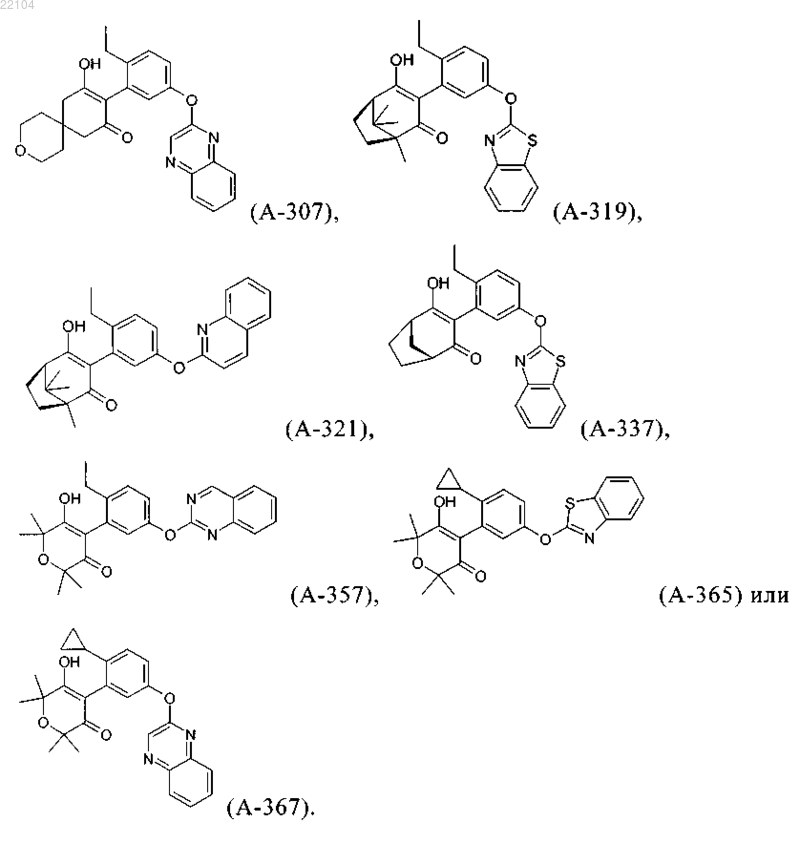
15. Способ получения соединения формулы I по п.1, в которой G обозначает водород, который включает реакцию соединения формулы (K)
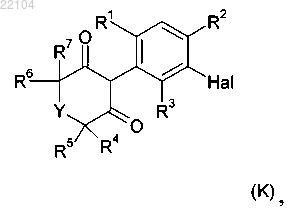
в которой Y и R1-R7 являются такими, как определено в п.1, и Hal обозначает бром или йод, с соединением А-ОН, в котором А является таким, как определено в п.1, в присутствии катализатора, лиганда или добавки и основания, в растворителе.
16. Способ получения соединения формулы I по п.1, в которой G обозначает водород, который включает реакцию соединения формулы (М)
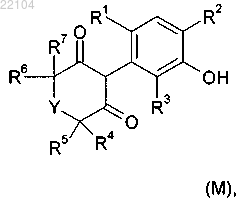
в которой Y и R1-R7 являются такими, как определено в п.1, с соединением А-Hal, в котором А является таким, как определено в п.1, и Hal обозначает фтор, хлор, бром или йод, в присутствии или при отсутствии катализатора и лиганда и в присутствии основания и в растворителе.
17. Гербицидная композиция, которая содержит соединение формулы I по любому из пп.1-11 в гербицидно эффективном количестве и вспомогательные вещества.
18. Способ борьбы с травянистыми растениями и сорняками в культурах полезных растений, который включает нанесение соединения формулы I по любому из пп.1-11 в гербицидно эффективном количестве или композиции, содержащей такое соединение, на растения или на место их произрастания.
19. Способ по п.18, который включает нанесение композиции, содержащей соединение формулы I в гербицидно эффективном количестве, на растения или на место их произрастания и в котором культурами полезных растений являются злаки, рис, кукуруза, рапс, сахарная свекла, сахарный тростник, соя, хлопчатник, подсолнечник или арахис.
Текст
ГЕРБИЦИДНО АКТИВНЫЕ ЦИКЛИЧЕСКИЕ ДИОНЫ И ИХ ПРОИЗВОДНЫЕ,СПОСОБЫ ИХ ПОЛУЧЕНИЯ, КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЭТИ СОЕДИНЕНИЯ Робинсон Луиса, Делейни Джон Стивен (GB) В изобретении предложено соединение формулы I в которой А обозначает пиридил, пиразинил, пиримидинил, пиридазинил, бензотиазолил,бензоксазолил, циннолинил, хинолинил, хиназолинил, хиноксалинил или бензотриазинил, в каждом случае содержащий в качестве заместителей галоген, метил, этил, трифторметил,метоксигруппу, дифторметоксигруппу, трифторметоксигруппу, нитрогруппу или цианогруппу; R1 обозначает метил, этил, н-пропил, циклопропил, этинил, фтор, хлор, бром, метоксигруппу или галогенметоксигруппу; R2 и R3 обозначают водород и Y обозначает О или CR8R9; и R4, R5, R6,R7, R8 и R9 являются такими, как определено в настоящем изобретении; и G обозначает водород или сельскохозяйственно приемлемый металл, сульфоний, аммоний или маскирующую группу; где маскирующая группа является такой, как определено в настоящем изобретении. Описываются способы его получения, гербицидная композиция и способ борьбы с сорняками в культурах полезных растений. Настоящее изобретение относится к новым гербицидно активным циклическим дионам и их производным, к способам их получения, к композициям, содержащим эти соединения, и к их применению для борьбы с сорняками, предпочтительно в культурах полезных растений, или для подавления роста нежелательных растений. Циклические дионы, обладающие гербицидной активностью, описаны, например, в WO08/071405 иWO08/145336. Согласно изобретению обнаружены новые циклические дионы и их производные, обладающие гербицидной активностью и способностью подавлять рост. Поэтому настоящее изобретение относится к соединениям формулы I в которой А обозначает пиридил, пиразинил, пиримидинил, пиридазинил, бензотиазолил, бензоксазолил, циннолинил, хинолинил, хиназолинил, хиноксалинил или бензотриазинил, в каждом случае содержащий в качестве заместителей галоген, метил, этил, трифторметил, метоксигруппу, дифторметоксигруппу, трифторметоксигруппу, нитрогруппу или цианогруппу;R4, R5, R6 и R7 независимо друг от друга обозначают водород, C1-С 6-алкил или С 1-алкил, замещенный C1-алкоксигруппой; илиR5 и R6 вместе с атомами, к которым они присоединены, образуют 5-8-членный карбоциклил или гетероциклил, где гетероциклил содержит один гетероатом кислорода; иR8 и R9 независимо друг от друга обозначают водород, C1-С 6-алкил, C1-С 3-алкил, замещенный С 1 С 4-алкоксигруппой, или гетероциклил или гетероциклил, замещенный C1-алкилом или C1 алкоксигруппой; илиR8 и R9 вместе с атомами, к которым они присоединены, образуют 5-8-членный спирокарбоциклил или спирогетероциклил, который содержит один или два гетероатома, выбранных из группы, включающей азот, кислород и серу; иG обозначает водород или сельскохозяйственно приемлемый металл, сульфоний, аммоний или маскирующую группу; и в которой, если G обозначает маскирующую группу, то маскирующая группа является такой, как определено в настоящем изобретении. В определениях заместителей соединений формулы I каждый алкильный фрагмент, по отдельности или в виде части большей группы (такой как алкоксигруппа, алкилтиогруппа, алкоксикарбонил, алкилкарбонил, алкиламинокарбонил, диалкиламинокарбонил), обладает линейной или разветвленной цепью и означает, например, метил, этил, н-пропил, н-бутил, н-пентил, н-гексил, изопропил, н-бутил, втор-бутил,изобутил, трет-бутил или неопентил. Алкильные группы предпочтительно представляют собой C1-С 6 алкильные группы, но более предпочтительно С 1-С 4-алкильные или С 1-С 3-алкильные группы и более предпочтительно С 1-С 2-алкильные группы. Алкенильные и алкинильные фрагменты могут находиться в виде линейных или разветвленных цепей и алкенильные фрагменты, если это является подходящим, могут находиться в (Е)- или (Z)конфигурации. Примерами являются винил, аллил и пропаргил. Алкенильные и алкинильные фрагменты могут содержать одну или большее количество двойных и/или тройных связей в любой комбинации. Следует понимать, что в эти термины включены алленил и алкинилалкенил. Галоген означает фтор, хлор, бром или йод. Галогеналкильные группы представляют собой алкильные группы, которые замещены одним или большим количеством одинаковых или разных атомов галогенов и представляют собой, например, CF3,CF2Cl, CF2H, CCl2H, FCH2, ClCH2, BrCH2, CH3CHF, (CH3)2CF, CF3CH2 или CHF2CH2. В контексте настоящего описания термин "арил" относится к кольцевым системам, которые могут быть моно- или бициклическими. Примеры таких колец включают фенил и нафтил. Предпочтительной арильной группой является фенил. Термин "гетероарил" предпочтительно означает ароматическую кольцевую систему, содержащую по меньшей мере один гетероатом и включающую одно кольцо или два конденсированных кольца. Предпочтительно, если одно кольцо содержит до трех гетероатомов, а бициклические системы - до четырех гетероатомов, которые предпочтительно выбраны из группы, включающей азот, кислород и серу. Примеры таких групп включают фурил, тиенил, пирролил, пиразолил, имидазолил, 1,2,3-триазолил,1,2,4-триазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил,-1 022104 1,2,5-оксадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, 1,2,5-тиадиазолил, пиридил,пиримидинил, пиридазинил, пиразинил, 1,2,3-триазинил, 1,2,4-триазинил, 1,3,5-триазинил, бензофурил,бензизофурил, бензотиенил, бензизотиенил, индолил, изоиндолил, индазолил, бензотиазолил, бензизотиазолил, бензоксазолил, бензизоксазолил, бензимидазолил, 2,1,3-бензоксадиазол, хинолинил, изохинолинил, циннолинил, фталазинил, хиназолинил, хиноксалинил, нафтиридинил, бензотриазинил, пуринил,птеридинил и индолизинил. Термин "гетероциклил" предпочтительно означает неароматические, предпочтительно моноциклические или бициклические кольцевые системы, содержащие до 7 атомов, включая один или большее количество (предпочтительно 1 или 2) гетероатомов, выбранных из группы, включающей О, S и N. Примеры таких колец включают тетрагидропиран, 1,3-диоксолан, оксетан, тетрагидрофуран, морфолин, тиоморфолин и пиперазин. Циклоалкил предпочтительно включает циклопропил, циклобутил, циклопентил и циклогексил. Циклоалкилалкил предпочтительно представляет собой циклопропилметил. Циклоалкенил предпочтительно включает циклопентенил и циклогексенил. Карбоциклические кольца включают арильные, циклоалкильные или карбоциклические группы и циклоалкенильные группы. Если они содержатся, то необязательные заместители арила, гетероарила и карбоциклов предпочтительно независимо выбраны из группы, включающей галоген, нитрогруппу, цианогруппу, родановую группу, изотиоцианатную группу, С 1-С 6-алкил, C1-С 6-галогеналкил, С 1-С 6-алкокси(С 1-С 6) алкил, С 2-С 6 алкенил, С 2-С 6-галогеналкенил, С 2-С 6-алкинил, С 3-С 7-циклоалкил (сам необязательно замещенный С 1-С 6 алкилом или галогеном), С 5-С 7-циклоалкенил (сам необязательно замещенный C1-С 6-алкилом или галогеном),гидроксигруппу,C1-С 10-алкоксигруппу,С 1-С 10-алкокси(С 1-С 10)алкоксигруппу,три(С 1 С 4)алкилсилил(С 1-С 6)алкоксигруппу, С 1-С 6-алкоксикарбонил(С 1-С 10)алкоксигруппу, С 1-С 10-галогеналкоксигруппу, арил(С 1 -С 4)алкоксигруппу (где арильная группа необязательно замещена галогеном или С 1 С 6-алкилом), С 3-С 7-циклоалкилоксигруппу (где циклоалкильная группа необязательно замещена C1-С 6 алкилом или галогеном), С 3-С 10-алкенилоксигруппу, С 3-С 10-алкинилоксигруппу, меркаптогруппу, С 1-С 10 алкилтиогруппу,С 1-С 10-галогеналкилтиогруппу,арил(С 1-С 4)алкилтиогруппу,С 3-С 7-циклоалкилтиогруппу (где циклоалкильная группа необязательно замещена С 1-С 6-алкилом или галогеном), три(С 1 С 4)-алкилсилил(С 1-С 6)алкилтиогруппу,арилтиогруппу,C1-С 6-алкилсульфонил,C1-С 6-галогеналкилсульфонил, C1-С 6-алкилсульфинил, С 1-С 6-галогеналкилсульфинил, арилсульфонил, три(С 1 С 4)алкилсилил,арилди(С 1-С 4)алкилсилил,С 1-С 4-алкилдиарилсилил,триарилсилил,C1-С 10 алкилкарбонил, НО 2 С, C1-С 10-алкоксикарбонил, аминокарбонил, С 1-С 6-алкиламинокарбонил, ди(С 1-С 6 алкил)аминокарбонил, N-(С 1-С 3-алкил)-N-(С 1-С 3-алкокси)аминокарбонил, C1-С 6-алкилкарбонилоксигруппу,арилкарбонилоксигруппу, ди(С 1-С 6)алкиламинокарбонилоксигруппу, арил (сам необязательно замещенный C1-С 6-алкилом или галогеном), гетероарил (сам необязательно замещенный С 1-С 6-алкилом или галогеном), гетероциклил (сам необязательно замещенный С 1-С 6-алкилом или галогеном), арилоксигруппу (где арильная группа необязательно замещена C1-С 6-алкилом или галогеном), гетероарилоксигруппу (где гетероарильная группа необязательно замещена С 1-С 6-алкилом или галогеном), гетероциклилоксигруппу (где гетероциклильная группа необязательно замещена C1-С 6-алкилом или галогеном), аминогруппу, C1-С 6-алкиламиногруппу, ди(С 1-С 6)алкиламиногруппу, C1-С 6-алкилкарбониламиногруппу, N(C1-С 6)алкилкарбонил-N-(С 1-С 6)алкиламиногруппу, арилкарбонил (где арильная группа сама необязательно замещена галогеном или С 1-С 6-алкилом) или два соседних положения арильной или гетероарильной системы могут быть циклизованы и образуют 5-, 6- или 7-членное карбоциклическое или гетероциклическое кольцо, само необязательно замещенное галогеном или С 1-С 6-алкилом. Другие заместители арила или гетероарила включают арилкарбониламиногруппу (где арильная группа замещена C1-С 6 алкилом или галогеном), (С 1-С 6)алкоксикарбониламиногруппу, (С 1-С 6)алкоксикарбонил-N-(С 1 С 6)алкиламиногруппу, арилоксикарбониламиногруппу (где арильная группа замещена C1-С 6-алкилом или галогеном), арилоксикарбонил-N-(С 1-С 6)алкиламиногруппу, (где арильная группа замещена С 1-С 6 алкилом или галогеном), арилсульфониламиногруппу (где арильная группа замещена С 1-С 6-алкилом или галогеном), арилсульфонил-N-(С 1-С 6)алкиламиногруппу (где арильная группа замещена С 1-С 6-алкилом или галогеном), арил-N-(С 1-С 6)алкиламиногруппу (где арильная группа замещена C1-С 6-алкилом или галогеном), ариламиногруппу (где арильная группа замещена С 1-С 6-алкилом или галогеном), гетероариламиногруппу (где гетероарильная группа замещена С 1-С 6-алкилом или галогеном), гетероциклиламиногруппу (где гетероциклильная группа замещена С 1-С 6-алкилом или галогеном), аминокарбониламиногруппу, С 1 -С 6-алкиламинокарбониламиногруппу, ди(С 1-С 6)алкиламинокарбониламиногруппу, ариламинокарбониламиногруппу (где арильная группа замещена C1-С 6-алкилом или галогеном), арил-N-(С 1 С 6)алкиламинокарбониламиногруппу (где арильная группа замещена С 1-С 6-алкилом или галогеном), С 1 С 6-алкиламинокарбонил-N-(С 1-С 6)алкиламиногруппу, ди(С 1-С 6)алкиламинокарбонил-N-(С 1-С 6)алкиламиногруппу, ариламинокарбонил-N-(С 1-С 6)алкиламиногруппу (где арильная группа замещена С 1-С 6 алкилом или галогеном) и арил-N-(С 1-С 6)алкиламинокарбонил-N-(С 1-С 6)алкиламиногруппу (где арильная группа замещена С 1-С 6-алкилом или галогеном). Настоящее изобретение также относится к сельскохозяйственно приемлемым солям, которые со-2 022104 единения формулы I могут образовать с основаниями переходных металлов, щелочных металлов и щелочно-земельных металлов, аминами, четвертичными аммониевыми основаниями или четвертичными сульфониевыми основаниями. Из являющихся солеобразователями гидроксидов переходных металлов, щелочных металлов и щелочно-земельных металлов следует особо отметить гидроксиды меди, железа, лития, натрия, калия, магния и кальция и предпочтительно гидроксиды, бикарбонаты и карбонаты натрия и калия. Примеры аминов, пригодных для образования солей аммония, включают аммиак, а также первичные, вторичные и третичные С 1-С 18-алкиламины, С 1-С 4-гидроксиалкиламины и С 2-С 4 алкоксиалкиламины, например, метиламин, этиламин, н-пропиламин, изопропиламин, четыре изомера бутиламина, н-амиламин, изоамиламин, гексиламин, гептиламин, октиламин, нониламин, дециламин,пентадециламин, гексадециламин, гептадециламин, октадециламин, метилэтиламин, метилизопропиламин, метилгексиламин, метилнониламин, метилпентадециламин, метилоктадециламин, этилбутиламин,этилгептиламин, этилоктиламин, гексилгептиламин, гексилоктиламин, диметиламин, диэтиламин, ди-нпропиламин, диизопропиламин, ди-н-бутиламин, ди-н-амиламин, диизоамиламин, дигексиламин, дигептиламин, диоктиламин, этаноламин, н-пропаноламин, изопропаноламин, N,N-диэтаноламин, Nэтилпропаноламин, н-бутилэтаноламин, аллиламин, н-бут-2-ениламин, н-пент-2-ениламин, 2,3 диметилбут-2-ениламин, дибут-2-ениламин, н-гекс-2-ениламин, пропилендиамин, триметиламин, триэтиламин, три-н-пропиламин, триизопропиламин, три-н-бутиламин, триизобутиламин, три-вторбутиламин, три-н-амиламин, метоксиэтиламин и этоксиэтиламин; гетероциклические амины, например,пиридин, хинолин, изохинолин, морфолин, пиперидин, пирролидин, индолин, хинуклидин и азепин; первичные ариламины, например, анилины, метоксианилины, этоксианилины, о-, м- и п-толуидины, фенилендиамины, бензидины, нафтиламины и о-, м- и п-хлоранилины; но предпочтительно триэтиламин, изопропиламин и диизопропиламин. Предпочтительные четвертичные аммониевые основания, применимые для образования солей, соответствуют, например, формуле [N(RaRb Rc Rd)]OH, в которой Ra, Rb, Rc и Rd все независимо от других обозначают водород, С 1-С 4-алкил. Другие подходящие тетраалкиламмониевые основания с другими анионами можно получить, например, с помощью анионообменных реакций. Предпочтительные третичные сульфониевые основания, применимые для образования солей, соответствуют, например, формуле [SReRfRg]OH, в которой Re, Rf и Rg все независимо от других обозначают С 1-С 4-алкил. Особенно предпочтительным является триметилсульфонийгидроксид. Подходящие сульфониевые основания можно получить по реакции с простыми тиоэфирами, в частности с диалкилсульфидами, с алкилгалогенидами с последующим превращением в подходящее основание, например гидроксид с помощью анионообменных реакций. Следует понимать, что в соединениях формулы I, в которой G обозначает металл, катион аммония или сульфония, как это указано выше, соответствующий отрицательный заряд в значительной степени делокализован по фрагменту О-С=С-С=О. Соединения формулы I, предлагаемые в настоящем изобретении, также включают гидраты, которые могут образоваться при получении солей. Маскирующие группы G выбраны так, чтобы их можно было удалить с помощью биохимического,химического или физического процесса или их комбинации с получением соединений формулы I, в которой G обозначает Н, до, во время или после нанесения на обрабатываемый участок или растения. Примеры этих процессов включают ферментативное расщепление, химический гидролиз и фотолиз. Соединения, содержащие такие маскирующие группы G, могут обеспечивать определенные преимущества,такие как улучшенное проникновение в кутикулу обрабатываемых растений, улучшенная переносимость культурами, улучшенная совместимость или стабильность в готовых смесях, содержащих другие гербициды, антидоты гербицидов, регуляторы роста растений, фунгициды или инсектициды, или уменьшенное выщелачивание в почвах. Когда G обозначает маскирующую группу, то G обозначает C(Xa)-Ra или С(Xb)-Xc-Rb; где Ха, Xb иRa обозначает С 1-С 18-алкил, С 2-С 18-алкенил, С 2-С 18-алкинил, C1-галогеналкил, С 3-С 7-циклоалкил(С 1 С 5)алкил, С 1-С 5-алкокси(С 1-С 5)алкил, С 3-С 5-алкенилокси(С 1-С 5)алкил, С 1-С 5-алкилтио(С 1-С 5)алкил, С 1 С 5-алкилкарбонил(С 1-С 5)алкил, С 1-С 5-алкоксикарбонил(С 1-С 5)алкил, С 1-С 5-алкиламинокарбонил(С 1 С 5)алкил, С 2-С 8-диалкиламинокарбонил(С 1-С 5)алкил, С 1-С 5-алкилкарбониламино(С 1-С 5)алкил, фенил(С 1 С 5)алкил (где фенил необязательно содержит в качестве заместителей C1-С 3-алкил, C1-С 3-галогеналкил,C1-С 3-алкоксигруппу, C1-С 3-галогеналкоксигруппу, С 1-С 3-алкилтиогруппу, C1-С 3-алкилсульфинил, С 1-С 3 алкилсульфонил, галоген, цианогруппу или нитрогруппу), гетероарил(С 1-С 5)алкил (где гетероарил необязательно содержит в качестве заместителей C1-С 3-алкил, С 1-С 3-галогеналкил, C1-С 3-алкоксигруппу,C1-С 3-галогеналкоксигруппу, С 1-С 3-алкилтиогруппу, С 1-С 3-алкилсульфинил, С 1-С 3-алкилсульфонил, галоген, цианогруппу или нитрогруппу), С 3-С 8-циклоалкил; фенил или фенил, содержащий в качестве заместителей С 1-С 3-алкил, C1-С 3-галогеналкил, С 1-С 3-алкоксигруппу, C1-С 3-галогеналкоксигруппу, галоген, цианогруппу или нитрогруппу; или гетероарил или гетероарил, содержащий в качестве заместителей С 1-С 3-алкил, C1-С 3-галогеналкил, C1-С 3-алкоксигруппу, С 1-С 3-галогеналкоксигруппу, галоген, циано-3 022104 группу или нитрогруппу; и Rb обозначает С 1-С 18-алкил, С 3-С 18-алкенил, С 3-С 18-алкинил, С 2-галогеналкил,С 3-С 7-циклоалкил(С 1-С 5)алкил, С 1-С 5-алкокси(С 1-С 5)алкил, С 3-С 5-алкенилокси(С 1-С 5)алкил, С 3-С 5 алкинилокси(С 1-С 5)алкил, С 1-С 5-алкилтио(С 1-С 3)алкил, С 1-С 5-алкилкарбонил(С 1-С 5)алкил, С 1-С 5 алкоксикарбонил(С 1-С 5)алкил,С 1-С 5-алкиламинокарбонил(С 1-С 5)алкил,С 2-С 8-диалкиламинокарбонил(С 1-С 5)алкил, С 1-С 5-алкилкарбониламино(С 1-С 5)алкил, фенил(С 1-С 5)алкил (где фенил необязательно содержит в качестве заместителей C1-С 3-алкил, C1-С 3-галогеналкил, С 1-С 3-алкоксигруппу, C1-С 3 галогеналкоксигруппу, С 1-С 3-алкилтиогруппу, C1-С 3-алкилсульфинил, С 1-С 3-алкилсульфонил, галоген,цианогруппу или нитрогруппу), гетероарил-C1-C5-алкил (где гетероарил необязательно содержит в качестве заместителей С 1-С 3-алкил, С 1-С 3-галогеналкил, С 1-С 3-алкоксигруппу, С 1-С 3-галогеналкоксигруппу,C1-С 3-алкилтиогруппу, С 1-С 3-алкилсульфинил, С 1-С 3-алкилсульфонил, галоген, цианогруппу или нитрогруппу), С 3-С 8-циклоалкил; фенил или фенил, содержащий в качестве заместителей C1-С 3-алкил, С 1-С 3 галогеналкил, С 1-С 3-алкоксигруппу, С 1-С 3-галогеналкоксигруппу, галоген, цианогруппу или нитрогруппу; или гетероарил или гетероарил, содержащий в качестве заместителей С 1-С 3-алкил, C1-С 3 галогеналкил, C1-С 3-алкоксигруппу, С 1-С 3-галогеналкоксигруппу, галоген, цианогруппу или нитрогруппу. Предпочтительно, если маскирующая группа G представляет собой группу -C(Xd)-Ra или -С(Xb)-XcbR и значения Ха, Ra, Xb, Xc и Rb являются такими, как определено выше. Предпочтительно, если G обозначает водород, щелочной металл или щелочно-земельный металл,где водород является особенно предпочтительным. В зависимости от природы заместителей соединения формулы I могут существовать в различных изомерных формах. Например, если G обозначает водород и R4 и R5 отличаются от R6 и R7, то соединения формулы I могут существовать в различных таутомерных формах: В объем настоящего изобретения входят все такие изомеры и таутомеры и их смеси во всех соотношениях. Кроме того, если заместители содержат двойные связи, то могут существовать цис- и трансизомеры. Эти изомеры также входят в объем заявленных соединений формулы I. Предпочтительно, если в соединениях формулы I R8 и R9 независимо друг от друга обозначают водород или метил, или R8 и R9 вместе с атомами, к которым они присоединены, образуют спиротетрагидропиранил или спиротетрагидрофуранил. Предпочтительно, если G обозначает водород, группу -C(Xa)-Ra или -С(Xb)-Xc-Rb, где значения Ха,aR , X , Xc и Rb являются такими, как определено выше, и особенно предпочтительно водород. В особенно предпочтительной группе соединений формулы I группа А обозначает пиридил, пиразинил, пиримидинил, пиридазинил, бензотиазолил, бензоксазолил, циннолинил, хинолинил, хиназолинил, хиноксалинил или бензотриазинил, в каждом случае содержащий в качестве заместителей галоген,метил, трифторметил, нитрогруппу или цианогруппу, R1 обозначает этил, R2 и R3 обозначают водород,R4-R7 обозначают водород или метил, или R5 и R6 вместе с атомами, к которым они присоединены, образуют 6- или 7-членный карбоциклил, Y обозначает О или CR8R9, где R8 и R9 независимо друг от друга обозначают водород или метил, или R8 и R9 вместе с атомами, к которым они присоединены, образуют спиротетрагидропиранил или спиротетрагидрофуранил и G обозначает водород. В другой особенно предпочтительной группе соединений формулы (I) R1 обозначает метил, этил или циклопропил, R2 и R3 обозначают водород, R4, R5, R6 и R7 независимо друг от друга обозначают водород или метил, или R4 и R5 или R6 и R7 вместе с атомами, к которым они присоединены, образуют спиротетрагидропиранил или спиротетрагидрофуранил, или R5 и R6 вместе с атомами, к которым они присоединены, образуют 6- или 7-членный карбоциклил, Y обозначает О или CR8R9, где R8 и R9 независимо друг от друга обозначают водород или метил, или R8 и R9 вместе с атомами, к которым они присоединены, образуют спиротетрагидропиранил или спиротетрагидрофуранил, G обозначает водород и А обозначает пиридил, пиразинил, пиримидинил, пиридазинил, бензотиазолил, бензоксазолил, хинолинил или хиноксалинил, в каждом случае незамещенный или содержащий в качестве заместителей метоксигруппу,фтор, хлор, бром, йод, метил, трифторметил, нитрогруппу или цианогруппу. Соединение формулы I, в которой Q обозначает Q1 и G обозначает C1-C8-алкил, С 2-С 8-галогеналкил,фенил-С 1-С 8-алкил (где фенил может необязательно содержать в качестве заместителей C1-С 3-алкил, С 1 С 3-галогеналкил, С 1-С 3-алкоксигруппу, С 1-С 3-галогеналкоксигруппу, C1-С 3-алкилтиогруппу, С 1-С 3 алкилсульфинил, C1-С 3-алкилсульфонил, галоген, цианогруппу или нитрогруппу), гетероарил-С 1-С 8 алкил (где гетероарил может необязательно содержать в качестве заместителей C1-С 3-алкил, C1-С 3 галогеналкил, С 1-С 3-алкоксигруппу, С 1-С 3-галогеналкоксигруппу, С 1-С 3-алкилтиогруппу, С 1-С 3 алкилсульфинил, C1-С 3-алкилсульфонил, галоген, цианогруппу или нитрогруппу), С 3-С 8-алкенил, С 3-С 8 галогеналкенил, С 3-С 8-алкинил, C(Xa)-Ra, C(Xb)-Xc-Rb, C(Xd)-N(Rc)-Rd, -SO2-Re, -P(Xe)(Rf)-Rg или CH2-XfRh, где Ха, Xb, Xc, Xd, Xe, Xf, Ra, Rb, Rc, Rd, Re, Rf, RG и RH являются такими, как определено выше, можно получить путем обработки соединения формулы (А), которое является соединением формулы I, в которой G обозначает Н, реагентом G-Z, где G-Z представляет собой алкилирующий реагент, такой как алкилгалогенид (определение алкилгалогенидов включает простые С 1-С 8-алкилгалогениды, такие как метилйодид и этилйодид, замещенные алкилгалогениды, такие как хлорметилалкиловые простые эфиры,Cl-CH2-Xf-Rh, где Xf обозначает кислород, и хлорметилалкилсульфиды, Cl-СН 2-Xf-Rh, где Xf обозначает серу), C1-C8-алкилсульфонат или ди(С 1-С 8)алкилсульфат, или С 3-С 8-алкенилгалогенидом, или С 3-С 8 алкинилгалогенидом, или ацилирующим реагентом, таким как карбоновая кислота, HO-C(Xa)Ra, где Ха обозначает кислород, хлорангидрид кислоты, Cl-C(Xa)Ra, где Ха обозначает кислород, или ангидрид кислоты, [RaC(Xa)]2O, где Ха обозначает кислород, или изоцианат, RcN=C=O, или карбамоилхлорид, ClC(Xd)-N(Rc)-Rd (где Xd обозначает кислород и при условии, что ни Rc, ни Rd не обозначает водород), или тиокарбамоилхлорид Cl-C(Xd)-N(Rc)-Rd(где Xd обозначает серу и при условии, что ни Rc, ни Rd не обозначает водород), или хлорформиат, Cl-C(Xb)-Xc-Rb, (где Xb и Xc обозначают кислород), или хлортиоформиат Cl-C(Xb)-Xc-Rb (где Xb обозначает кислород и Xc обозначает серу), или хлортиоформиат ClC(Xb)-Xc-Rb (где Xb и Xe обозначают серу), или изотиоцианат, RcN=C=S, или путем последовательной обработки дисульфидом углерода и алкилирующим реагентом или фосфорилирующим реагентом, таким как фосфорилхлорид, Cl-P(Xe)(Rf)-Rg, или сульфонилирующим реагентом, таким как сульфонилхлорид,Cl-SO2-Re, предпочтительно в присутствии по меньшей мере одного эквивалента основания. Если заместители R4 и R5 отличаются от заместителей R6 и R7, то эти реакции в дополнение к соединению формулы I могут дать второе соединение формулы IA. Настоящее изобретение включает соединение формулы I и соединение формулы IA вместе со смесями этих соединений в любом соотношении. О-Алкилирование циклических 1,3-дионов известно; подходящие методики описаны, например, в публикации Т. Wheeler, US4436666. Альтернативные методики описаны в публикациях М. Pizzorno andConstantino et al., Synth. Commun., (1992), 22 (19), 2859-2864; Y. Tian et al., Synth. Commun., (1997), 27 (9),1577-1582; S. Chandra Roy et al., Chem. Letters, (2006), 35 (1), 16-17; P. K. Zubaidha et al., Tetrahedron Lett,(2004), 45, 7187-7188. О-Ацилирование циклических 1,3-дионов можно провести по методикам, аналогичным описанным,например, в публикациях R. Haines, US4175135 и Т. Wheeler, US4422870, US4659372 и US4436666. Обычно дионы формулы (А) можно обработать ацилирующим реагентом в присутствии по меньшей мере одного эквивалента подходящего основания и необязательно в присутствии подходящего растворителя. Основание может быть неорганическим, таким как карбонат или гидроксид щелочного металла или гидрид металла, или органическим основанием, таким как третичный амин или алкоксид металла. Примеры подходящих неорганических оснований включают карбонат натрия, гидроксид натрия или калия,гидрид натрия и подходящие органические основания включают триалкиламины, такие как триметиламин и триэтиламин, пиридины или другие амины-основания, такие как 1,4-диазабицикло[2.2.2]-октан и 1,8-диазабицикло[5.4.0]ундец-7-ен. Предпочтительные основания включают триэтиламин и пиридин. Подходящие для этой реакции растворители выбирают так, чтобы они были совместимы с реагентами и они включают простые эфиры, такие как тетрагидрофуран и 1,2-диметоксиэтан, и галогенированные растворители, такие как дихлорметан и хлороформ. Некоторые основания, такие как пиридин и триэтиламин, можно с успехом использовать в качестве и основания, и растворителя. В случаях, когда ацилирующим реагентом является карбоновая кислота, ацилирование предпочтительно проводить в присутствии известного реагента сочетания, такого как 2-хлор-1-метилпиридиниййодид, N,N'дициклогексилкарбодиимид, 1-(3-диметиламинопропил)-3-этилкарбодиимид и N,N'-карбодиимидазол, и необязательно в присутствии основания, такого как триэтиламин или пиридин, в подходящем растворителе, таком как тетрагидрофуран, дихлорметан или ацетонитрил. Подходящие методики описаны, например, в публикациях W. Zhang and G. Pugh, Tetrahedron Lett., (1999), 40 (43), 7595-7598; T. Isobe and T.Mathison, J. Am. Chem. Soc, (2005), 127(24), 8872-8888. Фосфорилирование циклических 1,3-дионов можно провести с использованием фосфорилгалогенида или тиофосфорилгалогенида и основания по методикам, аналогичным описанным в публикации L.Hodakowski, US4409153. Сульфонилирование соединений формулы (А) можно провести с использованием алкил- или арилсульфонилгалогенида, предпочтительно в присутствии по меньшей мере одного эквивалента основания,например, по методике, описанной в публикации С. Kowalski and К. Fields, J. Org. Chem., (1981), 46, 197-5 022104 201. Соединения формулы (А), в которой Y обозначает S(O)n и n равно 1 или 2, можно получить из соединений формулы (А), в которой Y обозначает S, путем окисления по методике, аналогичной описанной в публикации Е. Fehnel and A. Paul, J. Am. Chem. Soc, (1955), 77, 4241-4244. Соединение формулы (А), в которой Y обозначает О, S, С=О или CR12R13, можно получить путем циклизации соединения формулы (В), предпочтительно в присутствии кислоты или основания, и необязательно в присутствии подходящего растворителя, по методикам, аналогичным описанным в публикации Т. Wheeler, US4209532. Соединения формулы (В) были специально получены в качестве промежуточных продуктов для синтеза соединений формулы I. Соединения формулы (В), в которой R обозначает водород или С 1-С 4-алкил (предпочтительно метил, этил и трет-бутил), можно циклизовать в кислой среде, предпочтительно в присутствии сильной кислоты, такой как серная кислота, полифосфорная кислота или реагент Итона, необязательно в присутствии подходящего растворителя, такого как уксусная кислота, толуол или дихлорметан. Соединение формулы (В), в которой R обозначает алкил (предпочтительно метил или этил), можно циклизовать в кислой или щелочной среде, предпочтительно в щелочной среде в присутствии по меньшей мере одного эквивалента сильного основания, такого как трет-бутоксид калия, диизопропиламид лития, бис(триметилсилил)амид натрия или гидрид натрия, и в растворителе, таком как тетрагидрофуран,толуол, диметилсульфоксид или N,N-диметилформамид. Соединение формулы (В), в которой R обозначает Н, можно этерифицировать с образованием соединения формулы (В), в которой R обозначает алкил, при известных условиях (например, путем обработки спиртом, R-OH, в присутствии кислотного катализатора). Соединение формулы (В), в которой R обозначает Н, можно получить путем гидролиза соединения формулы (С), в которой R обозначает Н или алкил и R' обозначает алкил (предпочтительно метил или этил), с последующим подкислением реакционной смеси для проведения декарбоксилирования по методикам, аналогичным описанным, например, в публикации Т. Wheeler, US4209532. Альтернативно, соединение формулы (В), в которой R обозначает алкил (предпочтительно метил), можно получить из соединения формулы (С), в которой R обозначает алкил (предпочтительно метил), путем декарбоксилирования по методике Крапчо при известных условиях использованием известных реагентов (см., например,G. Quallich, P. Morrissey, Synthesis, (1993), (1), 51-53). Соединение формулы (С), в которой R обозначает алкил, можно получить путем обработки соединения формулы (D) подходящим хлорангидридом карбоновой кислоты формулы (Е), в которой R обозначает алкил, в щелочной среде. Подходящие основания включают трет-бутоксид калия, натрия бис(триметилсилил)амид и диизопропиламид лития и реакцию предпочтительно проводят в подходящем растворителе (таком как тетрагидрофуран или толуол) при температуре от -80 до 30 С: Альтернативно, соединение формулы (С), в которой R обозначает Н, можно получить путем обработки соединения формулы (D) подходящим основанием (таким как трет-бутоксид калия,бис(триметилсилил)амид натрия и диизопропиламид лития) в подходящем растворителе (таком как тетрагидрофуран или толуол) при подходящей температуре (от -80 до 30 С) и введения полученного аниона в реакцию с подходящим ангидридом формулы (F): Соединения формулы (Е) и формулы (F) являются известными или их можно получить по аналогичным методикам из имеющихся в продаже исходных веществ (см., например, С. Rouvier, TetrahedronBull., (1991), 39 (11), 2878-2882; R. Kirsten et al., EP338306 A2; W. Marshall, US3649679) или их можно получить по аналогичным методикам из известных соединений. В другом подходе соединение формулы (А) можно получить по реакции соединения формулы (G) трикарбоксилатом арилсвинца в присутствии подходящего лиганда и в подходящем растворителе. Аналогичные реакции описаны в литературе (например, см. М. Muehlebach et al., WO08/071405; J. Pinhey, В.Rowe, Aust. J. Chem., (1979), 32, 1561-6; J. Morgan, J. Pinhey, J. Chem. Soc. Perkin Trans. 1, (1990), 3, 71520). Предпочтительно, если трикарбоксилатом арилсвинца является триацетат арилсвинца формулы (Н). Предпочтительно, если лигандом является азотсодержащий гетероцикл, такой как N,Nдиметиламинопиридин, 1,10-фенантролинпиридин, бипиридин, или имидазол, и предпочтительно использовать 1-10 экв. лиганда в пересчете на соединение формулы (J). Наиболее предпочтительно, если лигандом является N,N-диметиламинопиридин. Растворителем предпочтительно является хлороформ,дихлорметан или толуол, наиболее предпочтительно хлороформ, или смесь хлороформа и толуола. Предпочтительно, если реакцию проводят при температуре от -10 до 100 С, наиболее предпочтительно при 40-90 С. Соединения формулы (G), в которой Y обозначает О, являются известными соединениями или их можно получить по методикам, аналогичным описанным в литературе (см., например, М. Muehlebach etStudzinskii, Chemistry of Heterocyclic Compounds (1966), (6), 848-854). Соединения формулы (G), в которой Y обозначает S, являются известными соединениями или их можно получить по методикам, аналогичным описанным в литературе (см., например, Е. Fehnel and A. Paul, J. Am. Chem Soc, (1955), 77, 42414244; E. Er and P. Margaretha, Helvetica Chimica Acta (1992), 75(7), 2265-69; H. Gayer et al, DE 3318648 Al). Соединения формулы (G), в которой Y обозначает С=О, являются известными соединениями или их можно получить по методикам, аналогичным описанным в литературе (см., например, R. Gotz and N.Chem., (2007), 72(13), 4803-4815); F. Effenberger et al., Chem. Ber., (1986), 119, 3394-3404 и цитированную в них литературу). Соединения формулы (G), в которой Y обозначает CR12R13, являются известными соединениями или их можно получить по методикам, аналогичным описанным в литературе (см.,например, М. Muehlebach et al., WO 08/110307; М. Muehlebach et al., WO 08/110308; S. Spessard and B. Соединение формулы (Н) можно получить из соединения формулы (I) путем обработки тетраацетатом свинца в подходящем растворителе (например, хлороформе) при температуре от 25 до 100 С (предпочтительно при 25-50 С), и необязательно в присутствии катализатора, такого как диацетат ртути, по методикам, описанным в литературе (например, см. К. Shimi, G. Boyer, J-P. Finet and J-P. Galy, Letters in Арилбороновую кислоту формулы (I) можно получить из арилгалогенида формулы (J), в которойHal обозначает бром или йод, по известным методикам (см., например, W. Thompson and J. Gaudino, J.Org. Chem, (1984), 49, 5237-5243 и R. Hawkins et al, J. Am. Chem. Soc, (1960), 82, 3053-3059). Таким образом, арилгалогенид формулы (J) можно обработать алкиллитием или алкилмагнийгалогенидом при низкой температуре и полученный арилмагниевый или ариллитиевый реагент ввести в реакцию с триалкилборатом, В(OR")3, предпочтительно триметилборатом, и получить арилдиалкилборонат, который можно гидролизовать в кислой среде и получить искомую бороновую кислоту формулы (I). Альтернативно такое же общее превращение соединения (J) в соединение (I) можно провести по катализируемой палладием реакции борилирования при известных условиях с использованием известных реагентов (см., например, Т. Ishiyama, M. Murata, N. Miyaura, J. Org. Chem. (1995), 60, 7508-7501; и К. L. Billingsley, Т. Е.Barder, S. L. Buchwald, Angew. Chem. Int. Ed. (2007), 46, 5359-5363), с последующим гидролизом промежуточного боронатного эфира. Арилгалогениды формулы (J) являются известными соединениями или их можно получить по известным методикам из известных соединений (см., например, R. Clark, J. Agric. Food Chem., (1996), 44Sweeten, J. Chem. Soc, (1934), 52-56). В другом подходе соединение формулы (А) можно получить по реакции перекрестного сочетания арилгалогенида формулы (K), в которой Hal обозначает бром или йод, с фенолом, А-ОН, в присутствии подходящего катализатора, необязательно подходящего лиганда или добавки, подходящего основания и подходящего растворителя при условиях, аналогичных описанных, например, в публикациях S. Hu et al.,J. Org. Chem., (2008), 73, 7814-7817; P. Chan et al., Tetrahedron Lett., (2008), 49, 2018-2022); R. Hosseinzadeh et al., Synthetic Commun., (2008) 38, 3023-3031; S. Buchwald et al., J. Am. Chem. Soc, (2006), 128,10694-10695 ; H. Rao et al., Chem. Eur. J., (2006), 12, 3636-3646; M. Taillefer et al., Adv. Synth. Catal. (2006),348, 499-505; M. Beller et al., Tetrahedron Lett., (2005), 46 (18), 3237-3240; M. Taillefer et al., Org. Lett. Подходящие катализаторы включают содержащие палладий и медь катализаторы, такие как ацетат палладия(II), бис(дибензилиденацетон)палладий(II), порошкообразная медь, ацетат меди(II), хлорид меди(I), бромид меди(I), бромид меди(II), йодид меди(I), оксид меди(I), сульфат меди(II), трифторметансульфонат меди(I) и трифторметансульфонат меди(II). Катализаторы необязательно используют вместе с соответствующими лигандами или добавками, такими как N-метилглицин N,N-диметилглицин, 1 бутилимидазол, этилацетат, этиленгликоль диацетат, 8-гидроксихинолин, L-пролин, 1-нафтойная кислота, трифенилфосфин, 1,1'-бис(дифенилфосфино)ферроцен, салицилальдоксим, 2-(N,N-диметиламино)-2'ди-трет-бутилфосфинобифенил, неокупроин, фениловый моноэфир пирролидин-2-фосфоновой кислоты,2,2,6,6-тетраметилгептан-3,5-дион, тетрабутиламмонийбромид, 2,2-бипиридин или 1,10-фенантролин. Подходящими основаниями являются карбонат цезия, фторид цезия, фторид калия, фосфат калия и гидроксид натрия. Подходящими растворителями являются ацетонитрил, N,N-диметилформамид, 1,4 диоксан или толуол, или смеси растворителей, такие как толуол/тетрагидрофуран и 1,4-диоксан/вода. В качестве катализаторов предпочтительно использовать йодид меди(I) и трифторметансульфонат меди(II). Соединение формулы (K) можно получить по методикам, описанным в публикации М. Muehlebachet al., WO 08/071405. Например, соединение формулы (K) можно получить из соединения формулы (G) по реакции с соединением формулы (L) при условиях, аналогичных использованным для получения соединения формулы (А) из соединения формулы (G). В другом подходе соединение формулы (А) можно получить по реакции соединения формулы (М) с арилгалогенидом формулы А-Hal, в которой Hal обозначает фтор, хлор, бром или йод. Если А-Hal представляет собой арилбромид или арилйодид, то реакцию можно провести с использованием содержащих медь или палладий катализаторов при условиях, описанных выше для получения соединения формулы(А) из соединения формулы (K). Альтернативно, если А-Hal представляет собой подходящий электронодефицитный арилгалогенид(например, арилфторид или арилхлорид, дополнительно содержащий один или большее количество электроноакцепторных заместителей, таких как трифторметил, нитрогруппа или цианогруппа) или подходящий гетероарилгалогенид (например, галогенпиридин, галогенпиримидин или другой электронодефицитный гетероарилгалогенид), то реакцию можно провести в присутствии подходящего основания,такого как карбонат калия или карбонат цезия, без использования катализатора и лиганда. Соединение формулы (М) можно получить из соединения формулы (K). В одном подходе соединение формулы (K) депротонируют основанием (таким как реагент Гриньяра или алкиллитиевый реагент) и затем обрабатывают алкиллитиевым реагентом для проведения реакции обмена металл-галоген. Затем полученное металлоорганическое соединение можно превратить в соединение формулы (М) путем обработки триалкилборатом, таким как триметилборат, с последующим окислением (например, пероксидом водорода, N-метилморфолин-N-оксидом или оксоном), как описано, например, в публикациях G. Prakashand D. Levy, Tetrahedron Lett., (1995), 36 (29), 5117-5118. В альтернативном подходе соединение формулы(М) можно получить из соединения формулы (K) путем обработки водным раствором гидроксида щелочного металла в присутствии подходящего катализатора и подходящего лиганда по известным методикам. Например, соединение формулы (М) можно получить путем обработки соединения формулы (К) гидроксидом калия в присутствии палладиевого катализатора(например,бис(дибензилиденацетон)палладия(II и в присутствии подходящего фосфинового лиганда, такого как 2-(ди-третбутилфосфино)-2',4',6'-триизопропилбифенил и 2-(ди-трет-бутилфосфино)-3,4,5,6-тетраметил-2',4',6'триизопропилбифенил, при условиях, описанных, например, в публикации S. Buchwald et al., J. Am.Chem. Soc, (2006), 128, 10694-10695. Альтернативно, соединение формулы (М) можно получить путем обработки соединения формулы (К) водным раствором гидроксида натрия в присутствии подходящего содержащего медь катализатора (например, йодида меди(I и подходящего лиганда (такого как Lпролин) при условиях описанных, например, в публикации С. Kormos and N. Leadbeater, Tetrahedron В третьем подходе для получения соединения формулы (М) соединение формулы (K) можно обработать бензиловым спиртом в присутствии подходящего содержащего медь катализатора с последующим дебензилированием при известных условиях (например, путем каталитического гидрогенолиза). Соединения формулы (М) являются новыми и были специально получены в качестве промежуточных продуктов для синтеза соединений формулы соединений формулы I. В альтернативном подходе соединение формулы (А) можно получить по реакции соединения формулы (N), в которой Ar обозначает арильный фрагмент (предпочтительно фенил) с арилбороновой кислотой формулы (I) в присутствии подходящего палладиевого катализатора, подходящего основания,необязательно в присутствии подходящего лиганда или добавки и в подходящем растворителе. Подходящие палладиевые катализаторы включают, например, дигалогениды палладия(II), ацетат палладия(II) и сульфат палладия(II), и предпочтительным является ацетат палладия(II). Подходящие лиганды включают трифенилфосфин,трициклопентилфосфин,трициклогексилфосфин,2 дициклогексилфосфино-2',6'-диметоксибифенил,2-дициклогексилфосфино-2',4',6'-триизопропилбифенил, 1,1'-бис(дифенилфосфино)ферроцен и 1,2-бис(дифенилфосфино)этан. Реакцию также можно провести в присутствии других добавок, таких как тетраалкиламмониевые соли, например, тетрабутиламмонийбромид. Подходящие основания включают гидроксиды щелочных металлов, предпочтительным является гидроксид лития. Подходящим растворителем является водный раствор 1,2-диметоксиэтана. Соединение формулы (N), в которой Ar обозначает фенил, можно получить из соединения формулы(G) реагентом, содержащим гипервалентным йод, таким как (диацетокси)йодбензол или иодозилбензол,и основанием, таким как водный раствор карбоната натрия, гидроксида лития или гидроксида натрия, в растворителе, таком как вода или водный раствор спирта, такой как водный раствор этанола, по методикам, описанным в публикациях K. Schank and С. Lick, Synthesis (1983), 392; R. Moriarty et al., J. Am. В другом подходе соединение формулы I можно получить по реакции соединения формулы (О) (в которой G предпочтительно обозначает С 1-С 4-алкил и Hal обозначает галоген, предпочтительно бром или йод) с арилбороновой кислотой формулы (I) в присутствии подходящего палладиевого катализатора(например, 0,001-50% ацетата палладия(II) в пересчете на соединение (О и основания (например, от 1 до 10 экв. фосфата калия в пересчете на соединение (О и предпочтительно в присутствии подходящего лиганда (например, 0,001-50% (2-дициклогексилфосфино)-2',6'-диметоксибифенила в пересчете на соединение (U, и в подходящем растворителе (например, толуоле), предпочтительно при температуре от 25 до 200 С. Аналогичные реакции сочетания известны из литературы (см., например, Y. Song, В. Kim Соединение формулы (О) можно получить галогенированием соединения формулы (G) с последующим алкилированием полученного галогенида формулы (Q) С 1-С 4-алкилгалогенидом или три-С 1-С 4 алкилортоформиатом при известных условиях, например, по методикам, описанным в публикациях R.Chem. (2002), 10, 685-690). Альтернативно, соединение формулы (О) можно получить по реакции соединения формулы (G) с С 1-С 4-алкилгалогенидом или три-С 1-С 4-алкилортоформиатом и галогенированием полученного енона формулы (R) при известных условиях (см., например, Y. Song, В. Kim and J.-N. Heo,Tetrahedron Letters (2005), 46(36), 5987-5990). В другом подходе соединение формулы (А) можно получить по реакции соединения формулы (G) с соединением формулы (J) в присутствии подходящего палладиевого катализатора (например, 0,001-50% ацетата палладия(II) в пересчете на соединение (G и основания (например, от 1 до 10 экв. фосфата калия в пересчете на соединение (G и предпочтительно в присутствии подходящего лиганда (например,0,001-50% (2-дициклогексилфосфино)-2',4',6'-триизопропилбифенила в пересчете на соединение (G, и в подходящем растворителе (например, диоксане), предпочтительно при температуре от 25 до 200 С и необязательно при нагревании микроволновым излучением. Аналогичные реакции сочетания известны из литературы (см., например, S. Buchwald et al., J. Am.(А) можно получить по реакции соединения формулы (J) с соединением формулы (М) в присутствии подходящего содержащего медь катализатора (например, 0,001-50% йодида меди(I) в пересчете на соединение (J и основания (например, от 1 до 10 экв. карбоната цезия в пересчете на соединение (J и предпочтительно в присутствии подходящего лиганда (например, 0,001-50% L-пролина в пересчете на соединение (J, и в подходящем растворителе (например, диметилсульфоксиде), предпочтительно при температуре от 25 до 200 С. Аналогичные реакции сочетания известны из литературы (см., например, Y.Jiang et al., Synlett, (2005), 18, 2731-2734 и X. Xie et al., Organic Letters (2005), 7(21), 4693-4695). Соединения формулы I, предлагаемые в настоящем изобретении, можно использовать в качестве средств защиты растений в неизмененном виде, т.е. в том виде, в котором они получены при синтезе, но обычно их различным образом включают в композиции для защиты растений с использованием вспомогательных веществ, таких как носители, растворители и поверхностно-активные вещества. Композиции могут находиться в различных формах, например, в виде порошков для опудривания, гелей, смачивающихся порошков, обладающих покрытием или пропитанных гранул, предназначенных для ручного или механического внесения на обрабатываемых участках, диспергирующихся в воде гранул, растворимых в воде гранул, эмульгирующихся гранул, диспергирующихся в воде таблеток, шипучих прессованных таблеток, растворимых в воде лент, эмульгирующихся концентратов, микроэмульгирующихся концентратов, эмульсий масло-в-воде (ЭМ) или вода-в-масле (ЭВ), других многофазных систем, таких как продукты масло-в-воде-в-масле и вода-в-масле-в-воде, текучих масел, водных дисперсий, масляных дисперсий,суспоэмульсий, суспензий капсул, растворимых жидкостей, растворимых в воде концентратов (с водой или смешивающимся с водой органическим растворителем в качестве носителя), пропитанных полимерных пленок или в других формах, описанных, например, в руководстве Manual on Development and Use ofFAO Specifications for Plant Protection Products, 5th Edition, 1999. Активные ингредиенты можно включать в микроволокна или микростержни полимеров или полимеризующихся мономеров, обладающих диаметром, равным от примерно 0,1 до примерно 50 мкм, и отношением длины к толщине, равным от примерно 10 до примерно 1000. Такие композиции можно использовать непосредственно или можно разбавить перед использованием. Затем их можно внести с помощью подходящего оборудования для наземного опрыскивания или опрыскивания с самолета или других наземных систем внесения, таких как оросительные системы с движением по кругу или средств капельного орошения. Разбавление можно провести, например, водой, жидкими удобрениями, питательными микровеществами, биологическими организмами, маслом или растворителями. Композиции можно получить, например, путем смешивания активного ингредиента со вспомогательными веществами для приготовления композиций и получить композиции в виде тонкоизмельченных твердых веществ, гранул, растворов, дисперсий или эмульсий. Активные ингредиенты также могут содержаться в очень мелких микрокапсулах, состоящих из ядра и полимерной оболочки. Микрокапсулы обычно обладают диаметром, равным от 0,1 до 500 мкм. Они содержат активные ингредиенты в количестве, составляющем примерно от 25 до 95 мас.% в пересчете на массу капсулы. Активные ингредиенты могут содержаться в виде жидкого технического вещества, в виде подходящего раствора, в виде мелких частиц в твердой или жидкой дисперсии или в виде сплошного твердого вещества. Капсулирующие мембраны включают, например, натуральные и синтетические камеди, целлюлозу, сополимеры стирола с бутадиеном или другой подходящий образующий мембрану материал, полиакрилонитрил, полиакрилат,сложный полиэфир, полиамиды, полимочевины, полиуретан, аминопласты или химически модифицированный крахмал или другие полимеры, известные в этом контексте специалисту в данной области техники. Альтернативно, можно получить так называемые "микрокапсулы", в которых активный ингредиент содержится в виде тонкоизмельченных твердых частиц в твердой матрице основного вещества, но в этом случае микрокапсула не капсулирована с помощью ограничивающей диффузию мембраны, как это описано в предыдущих разделах. Активные ингредиенты можно адсорбировать на пористом носителе. Это может обеспечить высвобождение активных ингредиентов в окружающую среду в регулируемых количествах (например, замедленное высвобождение). Другими формами композиций регулируемого высвобождения являются гранулы или порошки, в которых активный ингредиент диспергирован или растворен в твердой матрице, состоящей из полимера,воска или подходящего твердого вещества, обладающего низкой молекулярной массой. Подходящими полимерами являются поливинилацетаты, полистиролы, полиолефины, поливиниловые спирты, поливинилпирролидоны, алкилированные поливинилпирролидоны, сополимеры поливинилпирролидонов с малеиновым ангидридом и его эфирами и однозамещенными эфирами, химически модифицированные сложные эфиры целлюлозы, такие как карбоксиметилцеллюлоза, метилцеллюлоза, гидроксиэтилцеллюлоза, примерами подходящих восков являются полиэтиленовый воск, окисленный полиэтиленовый воск,сложноэфирные воска, такие как горные воска, воска природного происхождения, такие как карнаубский воск, канделильский воск, пчелиный воск и т.п. Другими матричными материалами, подходящими для приготовления композиций медленного высвобождения, являются крахмал, стеарин, лигнин. Вспомогательные вещества, которые пригодны для получения композиций, предлагаемых в настоящем изобретении, сами по себе известны. В качестве жидких носителей можно использовать: воду, ароматические растворители, такие как толуол, м-ксилол, о-ксилол, п-ксилол и их смеси, кумол, смеси ароматических углеводородов с диапазонами температуры кипения от 140 до 320 С, известные под различными торговыми названиями, такими как Solvesso, Shellsol A, Caromax, Hydrosol, парафиновые и изопарафиновые носители, такие как парафиновые масла, минеральные масла, деароматизированные углеводородные растворители с диапазонами температуры кипения от 50 до 320 С, известные, например, под торговым названием Exxsol,недеароматизированные углеводородные растворители с диапазонами температуры кипения от 100 до 320 С, известные под торговым названием Varsol, изопарафиновые растворители с диапазонами температуры кипения от 100 до 320 С, известные под различными торговыми названиями, такими как Iso- 12022104par или Shellsol Т, углеводороды, такие как циклогексан, тетрагидронафталин (тетралин), декагидронафталин, альфа-пинен, d-лимонен, гексадекан, изооктан, сложноэфирные растворители, такие как этилацетат, н/изобутилацетат, амилацетат, изоборнилацетат, 2-этилгексилацетат, С 6-С 18-алкиловые эфиры уксусной кислоты, известные под торговым названием Exxate, этиловый эфир молочной кислоты, пропиловый эфир молочной кислоты, бутиловый эфир молочной кислоты, бензилбензоат, бензиллактат, дибензоат дипропиленгликоля, диалкиловые эфиры янтарной, малеиновой и фумаровой кислоты и полярные растворители, такие как N-метилпирролидон, N-этилпирролидон, С 3-С 18-алкилпирролидоны, гаммабутиролактон, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N-диметиллактамид, диметиламиды С 4-С 18-жирных кислот, диметиламид бензойной кислоты, ацетонитрил, ацетон,метилэтилкетон, метилизобутилкетон, изоамилкетон, 2-гептанон, циклогексанон, изофорон, метилизобутенилкетон (мезитилоксид), ацетофенон, этиленкарбонат, пропиленкарбонат, бутиленкарбонат, спирты растворители и разбавители, такие как метанол, этанол, пропанол, н/изобутанол, н/изопентанол, 2 этилгексанол, н-октанол, тетрагидрофурфуриловый спирт, 2-метил-2,4-пентандиол, 4-гидрокси-4-метил 2-пентатнон, циклогексанол, бензиловый спирт, этиленгликоль, бутиловый эфир этиленгликоля, метиловый эфир этиленгликоля, диэтиленгликоль, бутиловый эфир диэтиленгликоля, этиловый эфир диэтиленгликоля, метиловый эфир диэтиленгликоля, пропиленгликоль, дипропиленгликоль, метиловый эфир дипропиленгликоля и другие аналогичные растворители - простые эфиры гликоля на основе сырья из этиленгликоля, пропиленгликоля и бутиленгликоля, триэтиленгликоль, полиэтиленгликоль (ПЭГ 400),полипропиленгликоли, обладающие молекулярными массами, равными 400-4000, глицерин, глицеринацетат, глицериндиацетат, глицеринтриацетат, 1,4-диоксан, абиетат диэтиленгликоля, хлорбензол, хлортолуол, эфиры жирных кислот, такие как метилоктаноат, изопропилмиристат, метиллаурат, метилолеат,смесь метиловых эфиров C8-С 10-жирной кислоты, метиловые и этиловые эфиры кислот рапсового масла,метиловые и этиловые эфиры кислот соевого масла, растительные масла, жирные кислоты, такие как олеиновая кислота, линолевая кислота, линоленовая кислота, эфиры фосфорной и фосфоновой кислоты,такие как триэтилфосфат, С 3-С 18-трис-алкилфосфаты, алкиларилфосфаты, бис-октилоктилфосфонаты. Обычно в качестве носителя для разбавления концентратов используют воду. Подходящими твердыми носителями являются, например, тальк, диоксид титана, пирофиллитовая глина, диоксид кремния (пирогенный или осажденный и необязательно обработанный с введением функциональных групп, например, силанизированный), аттапульгитовая глина, кизельгур, известняк,карбонат кальция, бентонит, монтмориллонит кальция, шелуха семян хлопка, пшеничная мука, соевая мука, пемза, древесная мука, размолотая скорлупа грецких орехов, лигнин и аналогичные вещества, такие как описанные, например, в ЕРА CFR 180.1001. (с)(d). В качестве твердых носителей также можно использовать порошкообразные или гранулированные удобрения. Большое количество поверхностно-активных веществ с успехом можно использовать и в твердых, и в жидких композициях, в особенности в таких, которые перед применением можно разбавить носителем. Поверхностно-активные вещества могут быть анионогенными, катионогенными, амфотерными, неионогенными или полимерными и их можно использовать в качестве эмульгирующих, смачивающих, диспергирующих или суспендирующих агентов или для других целей. Типичные поверхностно-активные вещества включают, например, соли алкилсульфатов, такие как диэтаноламмонийлаурилсульфат; лаурилсульфат натрия, соли алкиларилсульфонатов, такие как додецилбензолсульфонат кальция или натрия; продукты присоединения алкилфенолов к алкиленоксидам, такие как нонилфенолэтоксилаты; продукты присоединения спиртов к алкиленоксидам, такие как этоксилат тридецилового спирта; мыла, такие как стеарат натрия; соли алкилнафталинсульфонатов, такие как дибутилнафталинсульфонат натрия; диалкиловые эфиры сульфосукцинатных солей, такие как ди(2-этилгексил)сульфосукцинат натрия; сложные эфиры сорбита, такие как сорбитолеат; четвертичные амины, такие как лаурилтриметиламмонийхлорид,сложные эфиры полиэтиленгликоля и жирных кислот, такие как полиэтиленгликольстеарат; блоксополимеры этиленоксида с пропиленоксидом; и соли моно- и диалкилфосфатных сложных эфиров; а также другие вещества, описанные, например, в публикации "McCutcheon's Detergents and EmulsifiersAnnual", MC Publishing Corp., Ridgewood, New Jersey, 1981. Другие вспомогательные вещества, которые обычно можно использовать в пестицидных композициях, включают ингибиторы кристаллизации, вещества, модифицирующие вязкость, суспендирующие агенты, красители, антиоксиданты, вспенивающие агенты, поглощающие свет агенты, вспомогательные вещества, способствующие смешиванию, противовспенивающие вещества, комплексообразователи, нейтрализующие или меняющие рН вещества и буферы, ингибиторы коррозии, отдушки, смачивающие агенты, вещества, улучшающие абсорбцию, питательные микроэлементы, пластификаторы, вещества,придающие скользкость, смазывающие вещества, диспергирующие вещества, загустители, антифризные агенты, микробициды, агенты, обеспечивающие совместимость, и солюбилизаторы, а также жидкие и твердые удобрения. Композиции также могут содержать дополнительные активные вещества, например, другие гербициды, антидоты гербицидов, регуляторы роста растений, фунгициды или инсектициды. Композиции, предлагаемые в настоящем изобретении, могут дополнительно включать добавки(обычно называющиеся вспомогательными веществами), включающие минеральное масло, масла растительного или животного происхождения, алкиловые эфиры таких масел или смеси таких масел и производных масел. Количество добавки масла, использующееся в композициях, предлагаемых в настоящем изобретении, обычно составляет от 0,01 до 10% в пересчете на смесь для опрыскивания. Например, добавку масла можно добавить в бак для опрыскивания в необходимой концентрации после приготовления смеси для опрыскивания. Предпочтительные добавляемые масла включают минеральные масла или масла растительного происхождения, например, рапсовое масло, оливковое масло или подсолнечное масло,эмульгированное растительное масло, такое как AMIGO (Loveland Products Inc.), алкиловые эфиры масел растительного происхождения, например, метилпроизводные, или масло животного происхождения,такое как рыбий жир или говяжий жир. Предпочтительная добавка, например, содержит в качестве активных компонентов в основном 80 мас.% алкиловых эфиров рыбьего жира и 15 мас.% метилированного рапсового масла и также 5 мас.% обычных эмульгаторов и веществ, изменяющих рН. Особенно предпочтительные добавки масла включают алкиловые эфиры С 8-С 22-жирных кислот, предпочтительно метилпроизводные С 12-С 18-жирных кислот, например, особенно предпочтительными являются метиловые эфиры лауриновой кислоты, пальмитиновой кислоты и олеиновой кислоты. Эти сложные эфиры известны,как метиллаурат (CAS-111-82-0), метилпальмитат (CAS-112-39-0) и метилолеат (CAS-112-62-9). Предпочтительным метилпроизводным жирной кислоты является AGNIQUE ME 18 RD-F (Cognis). Эти и другие добавки масла также описаны в публикации Compendium of Herbicide Adjuvants, 5th Edition,Southern Illinois University, 2000. Внесение и воздействие добавок масла можно дополнительно улучшить путем их комбинирования с поверхностно-активными веществами, такими как неионогенные, анионогенные, катионогенные или амфотерные поверхностно-активные вещества. Примеры подходящих анионогенных, неионогенных катионогенных или амфотерных поверхностно-активных веществ приведены на стр. 7 и 8 в WO 97/34485. Предпочтительными поверхностно-активными веществами являются анионогенные поверхностноактивные вещества типа додецилбензолсульфоната, в особенности их кальциевые соли, а также неионогенные поверхностно-активные вещества типа этоксилатов жирных спиртов. Особое предпочтение отдается этоксилированным С 12-С 22-жирным спиртам, обладающим степенью этоксилирования, составляющей от 5 до 40. Примерами имеющихся в продаже поверхностно-активных веществ являются вещества типа Genapol (Clariant). Также предпочтительными являются силиконовые поверхностно-активные вещества, в особенности модифицированные полиалкилоксидом гептаметилтрисилоксаны, которые имеются в продаже, например, под названием SILWET L-77, а также перфорированные поверхностно-активные вещества. Концентрация поверхностно-активных веществ в пересчете на всю добавку обычно составляет от 1 до 50 мас.%. Примерами добавок масел, которые состоят из смеси масел или минеральных масел или их производных с поверхностно-активными веществами являются TURBOCHARGE, ADIGOR(Helena Chemical Company). Указанные поверхностно-активные вещества также можно использовать в композициях по отдельности, т. е. без добавки масла. Кроме того, добавление органического растворителя к смеси добавка масла/поверхностно-активное вещество также может привести к дополнительному усилению воздействия. Подходящими растворителями являются, например, растворители SOLVESSO и AROMATIC (Exxon Corporation). Концентрация таких растворителей может составлять от 10 до 80 мас.% в пересчете на полную массу. Такие добавки масла, которые содержатся в смеси с растворителями, описаны, например, в US 4834908. Описанные в нем имеющиеся в продаже добавки масла, известны под названием MERGE (BASF). Другими добавкамии масла, которые предпочтительны для настоящего изобретения, являются SCORE и ADIGOR (обе выпускаются фирмой Syngenta Crop Protection AG). В дополнение к добавкам масла, перечисленным выше, для усиления воздействия композиций,предлагаемых в настоящем изобретении, в смесь для опрыскивания также можно добавлять алкилпирролидоны (например, AGRIMAX, выпускающийся фирмой ISP). Для этой цели также можно использовать композиции синтетических латексов, такие как, например, полиакриламиды, поливинилы и поли-1 п-ментен (например, BOND, COURIER или EMERALD). Такие вспомогетельные масла, описанные в предыдущих абзацах, можно использовать в качестве жидкого носителя, в котором активное соединение растворяют, эмульгируют или диспергируют в соответствии с тем, что является подходящим для агрегатного состояния активного соединения. Пестицидные композиции обычно содержат от 0,1 до 99 мас.%, предпочтительно от 0,1 до 95 мас.%, соединения формулы I и от 1 до 99,9 мас.% вспомогательного вещества композиции, которое предпочтительно содержит от 0 до 25 мас.% поверхностно-активного вещества. В то время как имеющиеся в продаже продукты предпочтительно готовят в виде концентратов, конечный потребитель обычно использует разбавленные композиции. Нормы расхода соединений формулы I могут меняться в широких пределах и зависят от характера почвы, методики внесения (до- или послевсходовое; протравливание семян; внесение в борозды для се- 14022104 мян; внесение без обработки почвы и т.п.), возделываемого растения, сорняка или травянистого растения, с которыми необходимо бороться, преобладающих климатических условий и других факторов, зависящих от методики внесения, времени внесения и обрабатываемой культуры. Соединения формулы I,предлагаемые в настоящем изобретении, обычно вносят при норме расхода, составляющей от 1 до 2000 г/га, предпочтительно 1-1000 г/га, наиболее предпочтительно 1-500 г/га. Предпочтительные композиции преимущественно обладают следующими типичными составами:(% = мас.%): Эмульгирующиеся концентраты: активный ингредиент: от 1 до 95%, предпочтительно от 60 до 90% поверхностно-активные вещества: от 1 до 30%, предпочтительно от 5 до 20% растворители в качестве жидкого носителя: от 1 до 80%, предпочтительно от 1 до 35% Дусты: активный ингредиент: от 0,1 до 10%, предпочтительно от 0,1 до 5% твердые носители: от 99,9 до 90%, предпочтительно от 99,9 до 99% Концентраты суспензий: активный ингредиент: от 5 до 75%, предпочтительно от 10 до 50% вода: от 94 до 24%, предпочтительно от 88 до 30% поверхностно-активные вещества: от 1 до 40%, предпочтительно от 2 до 30% Смачивающиеся порошки: активный ингредиент: от 0,5 до 90%, предпочтительно от 1 до 80% поверхностно-активные вещества: от 0,5 до 20%, предпочтительно от 1 до 15% твердые носители: от 5 до 95%, предпочтительно от 15 до 90% Гранулы: активный ингредиент: от 0,1 до 30%, предпочтительно от 0,1 до 15% твердые носители: от 99,5 до 70%, предпочтительно от 97 до 85% Диспергирующиеся в воде гранулы: активный ингредиент: от 1 до 90%, предпочтительно от 10 до 80% поверхностно-активные вещества: от 0,5 до 80%, предпочтительно от 5 до 30% твердые носители: от 90 до 10%, предпочтительно от 70 до 30% Приведенные ниже примеры дополнительно иллюстрируют, но не ограничивают настоящее изобретение. Эмульсии любой необходимой концентрации можно получить из таких концентратов путем разбавления водой. Молекулярная масса. Растворы пригодны для внесения в неразбавленном виде или после разбавления водой. Активный ингредиент тщательно смешивают со вспомогательными веществами и смесь тщательно размалывают на подходящей мельнице и получают смачивающиеся порошки, которые можно разбавить водой и получить суспензии любой необходимой концентрации. Активный ингредиент растворяют в метиленхлориде и наносят на носитель путем разбрызгивания и затем растворитель выпаривают в вакууме. В смесителе тонкоразмолотый активный ингредиент равномерно наносят на носитель, смоченный полиэтиленгликолем. Таким образом получают не образующие пыли гранулы с покрытием. Активный ингредиент смешивают со вспомогательными веществами и смесь увлажняют водой. Полученную смесь экструдируют и затем сушат в потоке воздуха. Активный ингредиент смешивают со вспомогательными веществами и смесь увлажняют водой. Полученную смесь экструдируют и затем сушат в потоке воздуха. Готовые к применению дусты получают смешиванием активного ингредиента с носителями и размолом смеси на подходящей мельнице. Тонкоразмолотый активный ингредиент тщательно смешивают со вспомогательными веществами с получением концентрата суспензии, из которого путем разбавления водой можно получить суспензии любой необходимой концентрации. Культуры полезных растений, для которых можно применять композиции, предлагаемые в настоящем изобретении, предпочтительно включают злаки, в частности, пшеницу и ячмень, рис, кукурузу,рапс, сахарную свеклу, сахарный тростник, хлопчатник, подсолнечник, арахис и плантационные культуры. Термин "культуры" следует понимать и как включающий культуры, которым придана стойкость к гербицидам или классам гербицидов (например, к ингибиторам АЛС (ацетолактатсинтаза), ГС (глутаминсинтетаза), ЕПШФС (5-енолпирувилшикимат-3-фосфатсинтаза), ПФО (полифенолоксидаза) и ГФПД(4-гидроксифенилпируватдиоксигеназа с помощью обычных методик селекции или генной инженерии. Примером культуры, которой с помощью обычных методик селекции придана стойкость, например, к имидазолинонам, таким как имазамокс, является сурепица Clearfield (канола). Примеры культур, которым с помощью методик генной инженерии придана стойкость к гербицидам, включают сорта кукурузы,стойкие, например, к глифосату или глуфосинату, которые имеются в продаже под торговыми названиями RoundupReady и LibertyLink. Сорняками, с которым проводят борьбу, могут быть однодольные и двудольные сорняки, такие как, например, Stellaria, Nasturtium, Agrostis, Digitaria, Avena, Setaria, Sinapis,Lolium, Solanum, Echinochloa, Scirpus, Monochoria, Sagittaria, Bromus, Alopecurus, Sorghum, Rottboellia,Cyperus, Abutilon, Sida, Xanthium, Amaranthus, Chenopodium, Ipomoea, Chrysanthemum, Galium, Viola иVeronica. Борьба с однодольными сорняками, в частности, с Agrostis, Avena, Setaria, Lolium, Echinochloa,Bromus, Alopecurus и Sorghum является весьма интенсивной. Под культурами также следует понимать такие, у которых методами генной инженерии была выработана стойкость к насекомым-вредителями, например, Bt-кукурузу (стойкую по отношению к кукурузному мотыльку), Bt-хлопчатник (устойчивый к хлопковому долгоносику), а также различные сорта Btкартофеля (устойчивого к колорадскому жуку). Примерами Bt-кукурузы являются гибриды кукурузы Bt176 сорта NK (Syngenta Seeds). Токсин Bt представляет собой белок, вырабатываемый в естественных условиях почвенными бактериями Bacillus thuringiensis. Примеры токсинов и трансгенных растений,способных синтезировать подобные токсины, описаны в ЕР-А-451878, ЕР-А-374753, WO 93/07278, WO 95/34656, WO 03/052073 и ЕР-А-427529. Примерами трансгенных растений, которые содержат один или большее количество генов, которые кодируют стойкость к инсектицидам и вырабатывают один или большее количество токсинов, являются KnockOut (кукуруза), Yield Gard (кукуруза), NuCOTIN33B(хлопчатник), Bollgard (хлопчатник), NewLeaf (картофель), NatureGard и Protexcta. Культурные растения и их семенной материал может быть стойким по отношению к гербицидам и одновременно также к поеданию насекомыми (совмещенные трансгенные характеристики). Семена могут, например,обладать способностью вырабатывать обладающий инсектицидной активностью белок Cry3 и одновременно являться стойкими по отношению к глифосату. Термин "культуры" следует понимать, как включающий и культуры, полученные по обычным методикам селекции или генной инженерии, которые обладают дополнительными характеристиками (например, улучшенными вкусом, стабильностью при хранении, содержанием питательных веществ). Под посевными площадями следует понимать участки, на которых уже растут культурные растения, а также участки, предназначенные для выращивания этих культурных растений. Соединения формулы I, предлагаемые в настоящем изобретении, также можно использовать в комбинации с другими гербицидами. Предпочтительно, если в этих смесях соединение формулы I является одним из соединений, приведенных ниже в таблицах 1-57. Приведенные ниже смеси, содержащие соединение формулы I, являются особенно важными: соединение формулы I + ацетохлор, соединение формулы I + ацифлюорфен, соединение формулы I(регистрационныйCAS 353292-31-6), соединение формулы I + 4-[(4,5-дигидро-3-метокси-4-метил-5 оксо)-1 Н-1,2,4-триазол-1-илкарбонилсульфамоил]-5-метилтиофен-3-карбоновая кислота (BAY636), соединение формулы I + BAY747 (регистрационныйCAS 335104-84-2), соединение формулы I + топрамезон (регистрационныйCAS 210631-68-8), соединение формулы I + 4-гидрокси-3-2-[(2 метоксиэтокси)метил]-6-(трифторметил)-3-пиридинил]карбонил]бицикло[3.2.1]окт-3-ен-2-он (регистрационныйCAS 352010-68-5) и соединение формулы I + 4-гидрокси-3-2-(3-метоксипропил)-6(дифторметил)-3-пиридинил]карбонил]бицикло[3.2.1]окт-3-ен-2-он. Компоненты для смешивания с соединением формулы I также могут представлять собой сложные эфиры или соли, указанные, например, в публикации The Pesticide Manual, 12th Edition (BCPC) 2000. При использовании для злаков предпочтительными являются следующие смеси: соединение формулы I + аклонифен, соединение формулы I + амидосульфурон, соединение формулы I + аминопиралид,соединение формулы I + бефлубутамид, соединение формулы I + бенфлуралин, соединение формулы I + бифенокс, соединение формулы I + бромоксинил, соединение формулы I + бутафенацил, соединение формулы I + карбетамид, соединение формулы I + карфентразон, соединение формулы I + карфентразонэтил, соединение формулы I + хлортолурон, соединение формулы I + хлорпрофам, соединение формулы лы I + пирасульфотол, соединение формулы I + пиридат, соединение формулы I + пироксасульфон (KIH485), соединение формулы I + пироксулам соединение формулы I + сульфосульфурон, соединение формулы I + темботрион, соединение формулы I + тербутрин, соединение формулы I + тифенсульфурон,соединение формулы I + тиенкарбазон, соединение формулы I + тифенсульфурон-метил, соединение формулы I + топрамезон, соединение формулы I + тралкоксидим, соединение формулы I + три-аллат,соединение формулы I + триасульфурон, соединение формулы I + трибенурон, соединение формулы I + трибенуронметил, соединение формулы I + трифлуралин, соединение формулы I + тринексапак-этил и соединение формулы I + тритосульфурон, где смеси, содержащие соединение формулы (I) + амидосульфурон, соединение формулы (I) + аминопиралид, соединение формулы (I) + бефлубутамид, соединение формулы (I) + бромоксинил, соединение формулы (I) + карфентразон, соединение формулы (I) + карфентразон-этил, соединение формулы (I) + хлортолурон, соединение формулы (I) + хлорсульфурон, соединение формулы (I) + клодинафоп, соединение формулы (I) + клодинафоп-пропаргил, соединение формулы (I) + клопиралид, 2,4-D, соединение формулы (I) + дикамба, соединение формулы (I) + дифензокват,соединение формулы (I) + дифензокват метилсульфат, соединение формулы (I) + дифлуфеникан, соединение формулы (I) + феноксапроп-Р, соединение формулы (I) + феноксапроп-Р-этил, соединение формулы (I) + флорасулам, соединение формулы (I) + флукарбазон, соединение формулы (I) + флукарбазоннатрий, соединение формулы (I) + флуфенацет, соединение формулы (I) + флупирсульфурон, соединение формулы (I) + флупирсульфурон-метилнатрий, соединение формулы (I) + флуроксипир, соединение формулы (I) + флуртамон, соединение формулы (I) + йодосульфурон, соединение формулы (I) + йодосульфурон-метилнатрий, соединение формулы (I) + МСРА, соединение формулы (I) + мезосульфурон,соединение формулы (I) + мезосульфуронметил, соединение формулы (I) + метсульфурон, соединение формулы (I) + метсульфуронметил, соединение формулы (I) + пендиметалин, соединение формулы (I) + пиколинафен, соединение формулы (I) + пиноксаден, соединение формулы (I) + просульфокарб, соединение формулы (I) + пирасульфотол, соединение формулы (I) + пироксасульфон (KIH-485), соединение формулы (I) + пироксулам, соединение формулы (I) + сульфосульфурон, соединение формулы (I) + тифенсульфурон, соединение формулы (I) + тифенсульфурон-метил, соединение формулы (I) + тралкоксидим, соединение формулы (I) + триасульфурон, соединение формулы (I) + трибенурон, соединение формулы (I) + трибенурон-метил, соединение формулы (I) + трифлуралин, соединение формулы (I) + тринексапак-этил и соединение формулы (I) + тритосульфурон, являются особенно предпочтительными. При использовании для риса предпочтительными являются следующие смеси: соединение формулы+ пиразосульфурон, соединение формулы (I) + пиразосульфурон-этил, соединение формулы (I) + пиразоксифен, соединение формулы (I) + пирибензоксим, соединение формулы (I) + пирифталид, соединение формулы (I) + пириминобак, соединение формулы (I) + пириминобакметил, соединение формулы (I) + пиримисульфан, соединение формулы (I) + хинклорак, соединение формулы (I) + тефурилтрион, соединение формулы (I) + триасульфурон и соединение формулы (I) + тринексапакэтил, где смеси, содержащие соединение формулы (I) + азимсульфурон, соединение формулы (I) + бенсульфурон, соединение формулы (I) + бенсульфурон-метил, соединение формулы (I) + бензобициклон, соединение формулы (I)+ пирибензоксим, соединение формулы (I) + пирифталид, соединение формулы (I) + пириминобак, соединение формулы (I) + пириминобак-метил, соединение формулы (I) + пиримисульфан, соединение формулы (I) + хинклорак, соединение формулы (I) + тефурилтрион, соединение формулы (I) + триасульфурон и соединение формулы (I) + тринексапак-этил, являются особенно предпочтительными. Соединения формулы I, предлагаемые в настоящем изобретении, также можно использовать в комбинации с антидотами. Предпочтительно, если в этих смесях соединение формулы I является одним из соединений, приведенных ниже в табл. 1-57. Приведенные ниже смеси, содержащие антидоты, являются особенно важными: соединение формулы I + клохинтоцет-мексил, соединение формулы I + клохинтоцетовая кислота и ее соли, соединение формулы I + фенхлоразолэтил, соединение формулы I + фенхлоразоловая кислота и ее соли, соединение формулы I + мефенпирдиэтил, соединение формулы I + мефенпира дикислота, соединение формулы I + изоксадифен-этил, соединение формулы I + изоксадифеновая кислота, соединение формулы I + фурилазол, соединение формулы I + R-изомер фурилазола, соединение формулы (I) + N-(2-метоксибензоил)-4-[(метиламинокарбонил)амино]бензолсульфонамид, соединение формулы I + беноксакор, соединение формулы I + дихлормид, соединение формулы I + AD-67, соединение формулы I + оксабетринил, соединение формулы I + циометринил, соединение формулы I + Zизомер циометринила, соединение формулы I + фенклорим, соединение формулы I + ципросульфамид,соединение формулы I + нафтойный ангидрид, соединение формулы I + флуразол, соединение формулы I+ CL 304,415, соединение формулы I + дициклонон, соединение формулы I + флуксофеним, соединение формулы I + DKA-24, соединение формулы I + R-29148 и соединение формулы I + PPG-1292. Антидотный эффект также можно обнаружить для смесей соединения формулы I + димрон, соединения формулыI + МСРА, соединения формулы I + мекопроп и соединения формулы I + мекопроп-Р. Указанные выше антидоты и гербициды описаны, например, в публикации Pesticide Manual, TwelfthWO 09211761 и N-(2-метоксибензоил)-4-[(метиламинокарбонил)амино]бензолсульфонамид описан в ЕР 365484. Беноксакор, клохинтоцет-мексил, ципросульфамид, мефенпир-диэтил и N-(2-метоксибензоил)-4[(метиламинокарбонил)амино]бензолсульфонамид являются особенно предпочтительными, а клохинтоцет-мексил является особенно ценным. Норма расхода антидота по сравнению с гербицидом в значительной степени зависит от методики внесения. В случае обработки в поле обычно вносят от 0,001 до 5,0 кг антидота/га, предпочтительно от 0,001 до 0,5 кг антидота/га, и обычно от 0,001 до 2 кг гербицида/га, но предпочтительно вносят от 0,005 до 1 кг/га. Гербицидные композиции, предлагаемые в настоящем изобретении, пригодны для всех методик внесения, обычно применяющихся в сельском хозяйстве, таких как, например, довсходовое внесение,послевсходовое внесение и протравливание семян. В зависимости от назначения антидоты можно использовать для предварительной обработки семенного материала культурного растения (протравливание семян или черенков) или вносить в почву до или после высевания, с последующим внесением не являющегося антидотом соединения формулы (I), необязательно в комбинации со вспомогательным гербицидом. Однако их также можно вносить по отдельности или вместе с гербицидом до или после появления всходов растений. Поэтому обработку растений или семенного материала антидотом, в принципе, можно проводить независимо от времени внесения гербицида. Обработка растения путем одновременного внесения гербицида и антидота (например, в виде баковой смеси) обычно является предпочтительной. Норма расхода антидота по сравнению с гербицидом в значительной степени зависит от методики внесения. В случае обработки в поле обычно вносят от 0,001 до 5,0 кг антидота/га, предпочтительно от 0,001 до 0,5 кг антидота/га. В случае протравливание семян обычно вносят от 0,001 до 10 г антидота/кг семян, предпочтительно от 0,05 до 2 г антидота/кг семян. Если антидот используют в жидком виде при замачивании семян незадолго до высевания, то предпочтительно использовать растворы антидота, которые содержат активный ингредиент в концентрации, равной от 1 до 10000 част./млн, предпочтительно от 100 до 1000 част./млн. Другой гербицид предпочтительно вносить вместе с одним или большим количеством антидотов,указанных выше. Представленные ниже примеры дополнительно иллюстрируют, но не ограничивают настоящее изобретение. Примеры получения Специалисты в данной области техники должны понимать, что некоторые соединения, описанные ниже, являются -кетоенолами и сами по себе могут находится в форме одного таутомера или в виде смеси кетоенольного и дикетонного таутомеров, как описано, например, в публикации J. March, Advanced Organic Chemistry, third edition, John Wiley and Sons. Соединения, приведенные ниже и в таблице Т 1, изображены в виде произвольного одного енольного таутомера, но следует понимать, что это описание включает и дикетонную форму, и любые возможные енолы, которые могут образоваться вследствие таутомерии. В случае, если в протонном спектре ЯМР (ядерный магнитный резонанс) наблюдается более чем один таутомер, приведенные характеристики относятся к смеси таутомеров. Кроме того, некоторые из соединений, приведенных ниже, изображены в виде одного энантиомера для простоты, но, если не указано, что они являются единственными энантиомерами, то эти структуры следует понимать, как описывающие смесь энантиомеров. Кроме того, некоторые из соединений могут находится в форме диастереоизомеров и следует понимать, что они могут находиться в виде смеси диастереоизомеров или в виде одного любого возможного диастереоизомера. В подробно описанной экспериментальной части дикетонная таутомерная форма выбрана для названий соединений, даже если преобладающей таутомерной формой является енольная форма. Пример 1. Получение 2-[5-(4-хлор-2-фторфенокси)-2-этилфенил]циклогексан-1,3-диона(22,36 г, 176 ммоль). После перемешивания реакционной смеси при комнатной температуре в течение 5 мин добавляют толуол (50 мл) и раствор нагревают при 80 С в течение 4 ч. После охлаждения до комнатной температуры смесь выдерживают в течение ночи, затем обрабатывают 2 М водным раствором хлористоводородной кислоты. Осадок отфильтровывают, затем двухфазный раствор разделяют и водную фазу повторно экстрагируют дихлорметаном (2). Органические фракции объединяют, затем выпаривают при пониженном давлении и получают неочищенный продукт, который очищают с помощью колоночной флэш-хроматографии (элюент: от 10% этилацетата/гексан до 70% этилацетата/гексан) и получают 2-(5-бром-2-этилфенил)циклогексан-1,3-дион в виде белого твердого вещества. Стадия 2: Получение 2-(2-этил-5-йодфенил)циклогексан-1,3-диона К смеси 2-(5-бром-2-этилфенил)циклогексан-1,3-диона (0,917 г, 3,11 ммоль), йодида натрия (0,934 г, 6,23 ммоль) и гексаметилдисилазана (0,454 г, 3,11 ммоль) добавляют йодид меди(I) (0,030 г, 0,15 ммоль) и транс-N,N-диметил-1,2-циклогександиамин (0,044 г, 0,31 ммоль). Добавляют дегазированный диоксан (5 мл) и смесь продувают азотом, затем нагревают микроволновым излучением при 180 С в течение 1 ч. После охлаждения до комнатной температуры реакционную смесь обрабатывают 2 М водным раствором хлористо-водородной кислоты и экстрагируют дихлорметаном. Фазы разделяют и затем водную фазу экстрагируют дихлорметаном. Органические фракции объединяют, затем выпаривают при пониженном давлении и получают неочищенный продукт, который очищают с помощью колоночной флэш-хроматографии (элюент: от 10% этилацетата/гексан до 70% этилацетата/гексан) и получают 2-(2 этил-5-йодфенил)циклогексан-1,3-дион в виде белого вспененного вещества.(0,535 г, 3,65 ммоль) и карбоната цезия (0,477 г, 1,46 ммоль) добавляют порошкообразные 3 молекулярные сита (0,300 г) и трифторметансульфонат меди(II) (0,012 г, 0,037 ммоль). После дегазирования азотом добавляют безводный толуол (4 мл) и суспензию нагревают микроволновым излучением при 160 С в течение 1 ч. Реакционную смесь подкисляют 2 М водным раствором хлористо-водородной кислоты и экстрагируют дихлорметаном (2). Органическую фазу отделяют, затем выпаривают при пониженном давлении и получают неочищенный продукт, который очищают с помощью препаративной ВЭЖХ с обращенной фазой и получают 2-[5-(4-хлор-2-фторфенокси)-2-этилфенил]циклогексан-1,3-дион. Пример 2. Получение 2-[5-(4-хлор-3-фторфенокси)-2-этилфенил]-5,5-диметилциклогексан-1,3 диона(0,012 г, 0,04 ммоль) и порошкообразных 3 молекулярных сит (0,300 г) добавляют безводный толуол (4 мл). После продувания азотом реакционную смесь нагревают микроволновым излучением при 170 С в течение 1 ч, затем ей дают охладиться до комнатной температуры. Реакцию останавливают 2 М водным раствором хлористо-водородной кислоты, неочищенный продукт экстрагируют дихлорметаном (2) и фазы разделяют. Органические растворители удаляют в вакууме и неочищенный продукт очищают с помощью препаративной ВЭЖХ с обращенной фазой и получают 2-[5-(4-хлор-3-фторфенокси)-2 этилфенил]-5,5-диметилциклогексан-1,3-дион в виде белого твердого вещества. Пример 3. Получение мезо-(1R,5S)-3-[5-(4-хлорфенокси)-2-этилфенил]бицикло[3.2.1]октан-2,4 диона К раствору 5-бром-2-этилфенилтетраацетата свинца (16,34 г, 28,80 ммоль) в хлороформе (160 мл) добавляют бицикло[3.2.1]октан-2,4-дион (3,61 г, 26,10 ммоль) и 4-диметиламинопиридин (16,63 г, 131 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 5 мин. Затем добавляют толуол (40 мл) и смесь перемешивают при 80 С в течение 1 ч (предварительно нагретая масляная баня). Реакционной смеси дают охладиться до комнатной температуры, реакцию останавливают 1 М раствором хлористо-водородной кислоты и органическую фазу отделяют. Затем водную фазу промывают дихлорметаном (2) и фазы повторно разделяют. Все органические вещества объединяют, затем выпаривают при пониженном давлении и получают неочищенное масло, которое очищают с помощью колоночной флэш-хроматографии на силикагеле (элюент: от 30 до 50% этилацетата/изогексан, затем 10% метанола/дихлорметан). Затем полученное смолообразное вещество перекристаллизовывают из смеси дихлорметан/гексан и получают 3-(5-бром-2-этилфенил)бицикло[3.2.1]октан-2,4-дион в виде кремового твердого вещества. Стадия 2: Получение мезо-(1R,5S)-3-[5-(4-хлорфенокси)-2-этилфенил]бицикло[3.2.1]октан-2,4 диона ди(II) (0,011 г, 0,03 ммоль) и порошкообразные 3 молекулярные сита (0,300 г). Затем добавляют дегазированный безводный толуол (2 мл), затем смесь продувают азотом, затем нагревают микроволновым излучением при 170 С в течение 1 ч. После охлаждения до комнатной температуры смесь подкисляют 2 М водным раствором хлористо-водородной кислоты и экстрагируют дихлорметаном (2). Органическую фазу отделяют, затем концентрируют в вакууме. Затем неочищенный продукт очищают с помощью препаративной ВЭЖХ с обращенной фазой и дополнительно с помощью колоночной флэшхроматографии (элюент от 10% этилацетата/гексан до 70% этилацетата/гексан) и получают мезо-(1R,5S)3-[5-(4-хлорфенокси)-2-этилфенил]бицикло[3.2.1]октан-2,4-дион в виде белого твердого вещества. Пример 4. Получение рац-(1S,5R)-3-[5-(2,4-дихлорфенокси)-2-этилфенил]-1,8,8-триметилбицикло[3.2.1]октан-2,4-диона Раствор 1,8,8-триметилбицикло[3.2.1]октан-2,4-диона (0,22 г, 1,22 ммоль) (получение описано в публикации Н. Favre et al., Can. J. Chem. (1956), 34 1329-39) в сухом хлороформе (10 мл) перемешивают при комнатной температуре, затем тщательно продувают азотом. Затем к этой смеси добавляют 4 диметиламинопиридин (0,744 г, 6,15 ммоль) и безводный толуол (3 мл), затем нагревают при 80 С. Порциями в течение 10 мин добавляют 5-бром-2-этилфенилтетраацетат свинца (0,673 г, 1,18 ммоль) и затем смесь нагревают при этой же температуре в течение еще 4 ч, затем выдерживают в течение ночи. Добавляют 2 М раствор хлористо-водородной кислоты (10 мл) и полученную двухфазную смесь фильтруют для удаления неорганических солей (дополнительно промывают дихлорметаном, 10 мл). Органическую фазу отделяют и водную фазу повторно экстрагируют дихлорметаном (10 мл 2). Все органические фракции объединяют, сушат над сульфатом магния, фильтруют и фильтрат концентрируют при пониженном давлении и получают оранжевое смолообразное вещество. Этот неочищенный продукт очищают с помощью колоночной флэш-хроматографии на силикагеле (элюент: от 100 до 40% смесь гексан/этилацетат) и получают рац-3-(5-бром-2-этилфенил)-1,8,8-триметилбицикло[3.2.1]октан-2,4-дион в виде бесцветного смолообразного вещества. Стадия 2: Получение рац-(1S,5R)-3-[5-(2,4-дихлорфенокси)-2-этилфенил]-1,8,8-триметилбицикло[3.2.1]октан-2,4-диона К смеси рац-3-(5-бром-2-этилфенил)-1,8,8-триметилбицикло[3.2.1]октан-2,4-диона (0,175 г, 0,48 ммоля), карбоната цезия (0,314 г, 0,96 ммоль) и 2,4-дихлорфенола (0,393 г, 2,41 ммоль) добавляют трифторметансульфонат меди(II) (0,009 г, 0,024 ммоль) и порошкообразные 3 молекулярные сита (0,200 г). Затем добавляют дегазированный безводный толуол (2 мл), затем смесь продувают азотом и нагревают микроволновым излучением при 170 С в течение 1 ч. После охлаждения до комнатной температуры реакцию останавливают 2 М водным раствором хлористо-водородной кислоты и смесь экстрагируют дихлорметаном (2). Органическую фазу отделяют и концентрируют при пониженном давлении. Затем неочищенный продукт очищают с помощью препаративной ВЭЖХ с обращенной фазой и получают рац(1S,5R)-3-[5-(2,4-дихлорфенокси)-2-этилфенил]-1,8,8-триметилбицикло[3.2.1]октан-2,4-дион. Пример 5. Получение 4-[2-этил-5-(3-фторфенокси)фенил]-2,2,6,6-тетраметилпиран-3,5-диона. ют микроволновым излучением при 160 С в течение 60 мин. Смесь охлаждают до комнатной температуры, выливают в 2 М раствор хлористо-водородной кислоты, разбавляют дихлорметаном и фильтруют через картридж для разделения фаз. Органическую фазу собирают. Растворитель выпаривают при пониженном давлении и остаток очищают с помощью колоночной хроматографии на силикагеле и получают 4-[2-этил-5-(3-фторфенокси)фенил]-2,2,6,6-тетраметилпиран-3,5-дион. Пример 6. Получение 4-[5-(4-хлорфенокси)-2-этилфенил]-2,2,6,6-тетраметилпиран-3,5-диона. Смесь 4-(5-бром-2-этилфенил)-2,2,6,6-тетраметилпиран-3,5-диона (200 мг, 0,57 ммоль), 4 хлорфенола (110 мг, 0,86 ммоль), йодида меди (I) (109 мг, 0,57 ммоль), 1,10-фенантролина (103 мг, 0,57 ммоль) и фосфата калия (483 мг, 2,28 ммоль) в диметилсульфоксиде (3,5 мл) нагревают микроволновым излучением при 200 С в течение 30 мин. Смесь охлаждают до комнатной температуры, выливают в 2 М раствор хлористо-водородной кислоты и экстрагируют дихлорметаном. Органический экстракт промывают водой, сушат над безводным сульфатом магния, фильтруют и фильтрат выпаривают при пониженном давлении. Растворитель выпаривают при пониженном давлении и остаток очищают с помощью колоночной хроматографии на силикагеле и получают 4-[5-(4-хлорфенокси)-2-этилфенил]-2,2,6,6 тетраметилпиран-3,5-дион. Пример 7. Получение 4-[5-(3-хлор-4-нитрофенокси)-2-этилфенил]-2,2,6,6-тетраметилпиран-3,5 диона. Раствор изопропилмагнийхлорида в сухом тетрагидрофуране (10,6 мл 2 М раствора, 21,2 ммоль) при 0 С по каплям добавляют к раствору 4-(5-бром-2-этилфенил)-2,2,6,6-тетраметилпиран-3,5-диона (5,0 г, 14,2 ммоль) в тетрагидрофуране (60 мл) и после завершения добавления смесь перемешивают в течение 10 мин, затем ей дают нагреться и перемешивают при комнатной температуре в течение 70 мин. Затем смесь охлаждают до -78 С и в течение 20 мин по каплям добавляют раствор н-бутиллития в гексанах(53 мл 1,6 М раствора, 85,0 ммоль). Смесь перемешивают при -78 С в течение 10 мин, и затем раствору дают нагреться и его перемешивают при комнатной температуре в течение 1 ч и 50 мин. Полученную смесь при -78 С через канюлю добавляют к раствору триметилбората (31,6 мл, 283 ммоль) в сухом тетрагидрофуране (30 мл) и смесь перемешивают в течение 20 мин, затем ей дают нагреться до комнатной температуры. Для облегчения перемешивания добавляют дополнительное количество сухого тетрагидрофурана (20 мл) и смесь перемешивают при комнатной температуре в течение еще 1 ч и 30 мин. Смесь охлаждают до 0 С и осторожно добавляют 30% раствор пероксида водорода (16 мл, 142 ммоль). Смесь перемешивают при 0 С в течение 10 мин, затем ей дают нагреться до комнатной температуры и перемешивают при в течение 18 ч. Смесь подвергают распределению между дихлорметаном и разбавленным водным раствором хлористо-водородной кислоты. Водную фазу экстрагируют дихлорметаном и органические экстракты объединяют, промывают рассолом, сушат над безводным сульфатом магния, фильтруют и фильтрат концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле и получают 4-(2-этил-5-гидроксифенил)-2,2,6,6-тетраметилпиран-3,5-дион. Стадия 2: Получение 4-[5-(3-хлор-4-нитрофенокси)-2-этилфенил]-2,2,6,6-тетраметилпиран-3,5 диона. 4-фтор-1-нитробензола (72 мг, 0,41 ммоль) и карбоната калия (110 мг, 0,69 ммоль) в N,Nдиметилформамиде (2 мл) нагревают микроволновым излучением при 140 С в течение 40 мин. Смесь охлаждают до комнатной температуры, выливают в 2 М водный раствор хлористо-водородной кислоты и экстрагируют этилацетатом. Органический экстракт промывают рассолом, сушат над безводным сульфатом магния, фильтруют и фильтрат выпаривают при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле и получают 4-[5-(3-хлор-4-нитрофенокси)-2-этилфенил]2,2,6,6-тетраметилпиран-3,5-дион. Пример 8. Получение 4-[2-этил-5-(6-трифторметилпиридин-2-илокси)фенил]-2,2,6,6-тетраметилпиран-3,5-диона.(108 мг, 0,57 ммоль) и L-пролина (33 мг, 0,28 ммоль) в водном растворе гидроксида натрия (8,8 мл 1 н. раствора) нагревают микроволновым излучением при 200 С в течение 2 ч. Смесь охлаждают до комнатной температуры, выливают в 2 М водный раствор хлористо-водородной кислоты и экстрагируют этилацетатом. Органический экстракт промывают рассолом, сушат над безводным сульфатом магния, фильтруют и фильтрат выпаривают при пониженном давлении. Растворитель выпаривают при пониженном давлении и остаток очищают с помощью колоночной хроматографии на силикагеле и получают 4-(2 этил-5-гидроксифенил)-2,2,6,6-тетраметилпиран-3,5-дион. Стадия 2: Получение 4-[2-этил-5-(6-трифторметилпиридин-2-илокси)фенил]-2,2,6,6-тетраметилпиран-3,5-диона. Смесь 4-(2-этил-5-гидроксифенил)-2,2,6,6-тетраметилпиран-3,5-диона (100 мг, 0,34 ммоль), 2-фтор 6-трифторметилпиридина (68 мг, 0,41 ммоль), и карбоната калия (110 мг, 0,69 ммоль) в N,Nдиметилформамиде (3 мл) нагревают микроволновым излучением при 140 С в течение 40 мин. Смесь охлаждают до комнатной температуры, выливают в 2 М водный раствор хлористо-водородной кислоты,разбавляют дихлорметаном и фильтруют через картридж для разделения фаз. Органическую фазу собирают. Растворитель выпаривают при пониженном давлении и остаток очищают с помощью колоночной хроматографии на силикагеле и получают 4-[2-этил-5-(6-трифторметилпиридин-2-илокси)фенил]-2,2,6,6 тетраметилпиран-3,5-дион. Пример 9. Получение 4-[2-этил-5-(2-фтор-4-нитрофенокси)фенил]-2,2,6,6-тетраметилпиран-3,5 диона. Смесь 4-(2-этил-5-гидроксифенил)-2,2,6,6-тетраметилпиран-3,5-диона (135 мг, 0,47 ммоль), 3,4 дифтор-1-нитробензола (90 мг, 0,56 ммоль) и карбоната калия (130 мг, 0,94 ммоль) в N,Nдиметилформамиде (3 мл) нагревают при 80 С в течение 3 ч. Смесь охлаждают до комнатной температуры, выливают в 2 М водный раствор хлористо-водородной кислоты и экстрагируют этилацетатом. Органический экстракт сушат над безводным сульфатом магния, фильтруют и фильтрат выпаривают при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле и получают 4-[2-этил-5-(2-фтор-4-нитрофенокси)фенил]-2,2,6,6-тетраметилпиран-3,5-дион. Пример 10. Получение 9-[5-(4-бром-2-фторфенокси)-2-этилфенил]-3-оксаспиро[5.5]ундекан-8,10- 27022104(58,3 г, 0,55 моль) в смеси этанола (175 мл) и воды (700 мл) и смесь перемешивают при комнатной температуре до завершения растворения и затем смесь охлаждают до 5 С. В течение 15 мин порциями добавляют йодбензолдиацетат (88,45 г, 0,275 моль) и после завершения добавления смесь перемешивают при 5 С в течение 15 мин, затем охлаждающую баню удаляют и смесь перемешивают и ей в течение 4 ч дают нагреться до комнатной температуры. Осадившийся йодонийилид собирают фильтрованием. Порцию йодонийилида (2,0 г, 5,21 ммоль) добавляют к смеси 2-этил-5-бромфенилбороновой кислоты (1,43 г, 6,25 ммоль), ацетата палладия (II) (59 мг, 0,26 ммоль) и моногидрата гидроксида лития (0,656 г, 15,6 ммоль) в 1,2-диметоксиэтане (40 мл) и воде (10 мл) и смесь нагревают при 50 С в течение 6 ч и затем выдерживают при комнатной температуре в течение ночи. Смесь фильтруют через диатомовую землю, промывая осадок на фильтре водой (50 мл) и этилацетатом (50 мл). Органическую фазу отбрасывают. Водную фазу подкисляют до рН 2 путем добавления концентрированной хлористо-водородной кислоты и затем экстрагируют этилацетатом. Органический экстракт сушат над безводным сульфатом магния, фильтруют и фильтрат выпаривают при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле и получают 9-(5-бром-2-этилфенил)-3-оксаспиро[5.5]ундекан 8,10-дион. Стадия 2: Получение 9-[5-(4-бром-2-фторфенокси)-2-этилфенил]-3-оксаспиро[5.5]ундекан-8,10 диона.(II) (18 мг, 0,05 ммоль) и этил ацетата (50 мкл) в толуоле (10 мл) кипятят с обратным холодильником в течение 19 ч. Смесь охлаждают до комнатной температуры добавляют N,N-диметилформамид (2 мл) и 2 М водный раствор хлористо-водородной кислоты (10 мл) и смесь энергично перемешивают в течение 45 мин. Смесь экстрагируют этилацетатом и органический экстракт сушат над безводным сульфатом магния, фильтруют и фильтрат выпаривают при пониженном давлении. Остаток очищают с помощью препаративной ВЭЖХ с обращенной фазой и получают 9-[5-(4-бром-2-фторфенокси)-2-этилфенил]-3 оксаспиро[5.5]ундекан-8,10-дион. Пример 11. Получение 4-[2-циклопропил-5-(2,4-дихлорфенокси)фенил]-2,2,6,6-тетраметилпиран 3,5-диона. К смеси толуола (2250 мл) и дистиллированной воды (250 мл) при 0 С в течение 10 мин порциями добавляют тонкоизмельченный трикалийфосфат (699,23 г, 3,29 моль). Затем этой смеси дают нагреться до комнатной температуры, затем добавляют 2,5-дибромбензальдегид (235,0 г, 890 ммоль) и циклопропилбороновую кислоту (68,92 г, 801 ммоль). Смесь перемешивают под слоем азота при комнатной температуре в течение 50 мин, затем в течение 10 мин добавляют тетракис(трифенилфосфин)палладий(102,89 г, 89 ммоль), промывая оставшееся твердое вещество толуолом (50 мл). Затем реакционную смесь перемешивают при 80 С в течение 22 ч, затем охлаждают до комнатной температуры и добавляют дистиллированную воду (500 мл). Смесь фильтруют через слой диоксида кремния (промывая дополнительным количеством этилацетата) и водную фазу экстрагируют этилацетатом (2300 мл). Объединенные органические экстракты промывают рассолом (500 мл), сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на силикагеле(элюент: изогексан/этилацетат), затем перегоняют при пониженном давлении и получают 5-бром-2 циклопропилбензальдегид в виде желтого масла. Стадия 2: Получение 4-[1-(5-бром-2-циклопропилфенил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3-она К охлажденной льдом суспензии метоксида натрия (40,1 г, 740 ммоль) в безводном 1,2 диметоксиэтане добавляют 2,2,5,5-тетраметилдигидрофуран-3-он (94,9 г, 670 ммоль) и промывают дополнительным количеством диметоксиэтана (120 мл). Реакционную смесь перемешивают при 0 С в течение 30 мин, затем добавляют 5-бром-2-циклопропилбензальдегид (137,2 г, 610 ммолей) в виде раствора в диметоксиэтане (280 мл). После перемешивания при этой же температуре в течение еще 3 ч реакцию останавливают водой (800 мл) и смеси дают нагреться до комнатной температуры. Добавляют диэтиловый эфир (800 мл) и две фазы разделяют. Водную фазу повторно экстрагируют диэтиловым эфиром (2) и все органические вещества промывают рассолом (800 мл), затем сушат над сульфатом магния. После концентрирования в вакууме остаток очищают с помощью флэш-хроматографии на силикагеле (элюент: изогексан/этилацетат) и получают 4-[1-(5-бром-2-циклопропилфенил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3-он. Стадия 3: Получение 2-(5-бром-2-циклопропилфенил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-она(189 г, 541 ммоль) в метаноле (2650 мл) при 53 С добавляют 2 М водный раствор гидроксида лития (27,1 мл, 54,2 ммоль), затем 50% водный раствор пероксида водорода (46,1 мл, 812 ммоль). После перемешивания при этой же температуре в течение 30 мин раствор охлаждают до 45 С и реакцию останавливают насыщенным водным раствором тиосульфата натрия. Добавляют дистиллированную воду (1000 мл) и органические растворители удаляют в вакууме. Затем водную фазу экстрагируют этилацетатом (ззз 2) и объединенные органические экстракты промывают насыщенным водным раствором гидрокарбоната натрия (2), рассолом (500 мл), затем сушат над безводным сульфатом магния. Летучие растворители удаляют в вакууме и получают 2-(5-бром-2-циклопропилфенил)-4,4,6,6-тетраметил-1,5 диоксаспиро[2.4]гептан-7-он. Стадия 4: Получение 4-(5-бром-2-циклопропилфенил)-2,2,6,6-тетраметилпиран-3,5-диона К суспензии хлорида железа(III) (53,0 г, 327 ммоль) в безводном дихлорметане (1000 мл) при 5 С добавляют второй раствор 2-(5-бром-2-циклопропилфенил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-она (119,1 г, 326 ммоль) в безводном дихлорметане (400 мл) с такой скоростью, чтобы внутренняя температура оставалась ниже 10 С. После перемешивания в течение 15 мин реакцию останавливают дистиллированной водой (900 мл) и смеси дают нагреться до комнатной температуры. Две
МПК / Метки
МПК: C07D 309/32, A01N 43/16, C07D 409/10, C07D 405/10, C07D 417/10, C07D 407/04, C07D 493/10, C07D 413/10, C07D 311/96, C07D 309/10, C07C 17/093
Метки: способы, циклические, эти, соединения, содержащие, дионы, получения, активные, композиции, производные, гербицидно
Код ссылки
<a href="https://eas.patents.su/30-22104-gerbicidno-aktivnye-ciklicheskie-diony-i-ih-proizvodnye-sposoby-ih-polucheniya-kompozicii-soderzhashhie-eti-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Гербицидно активные циклические дионы и их производные, способы их получения, композиции, содержащие эти соединения</a>
Предыдущий патент: Способ получения кабеля
Следующий патент: Флюс и флюсующая ванна для горячего погружного цинкования, способ горячего погружного цинкования изделий из железа или стали
Случайный патент: Способ получения гранул метионина












