Опсинсвязывающие лиганды, композиции и способы использования
Номер патента: 21747
Опубликовано: 31.08.2015
Авторы: Брюэр Марк Л., Коте Джеми Б., Лароса Грегори Дж., Гарви Дэвид С., Гринвуд Джереми Роберт, Каш Тан, Берман Джадд
Формула / Реферат
1. Соединение структурной формулы I
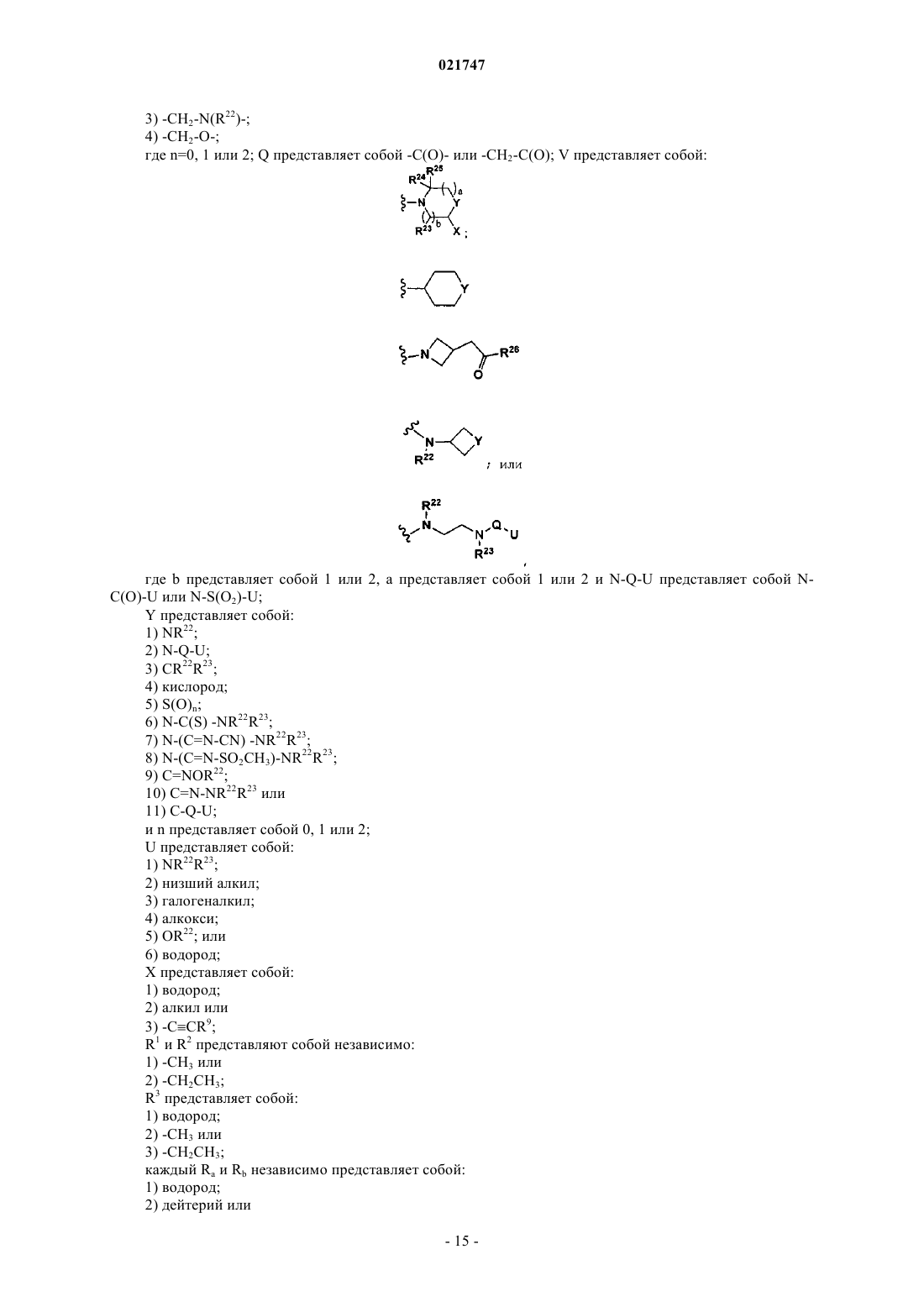
где А представляет собой
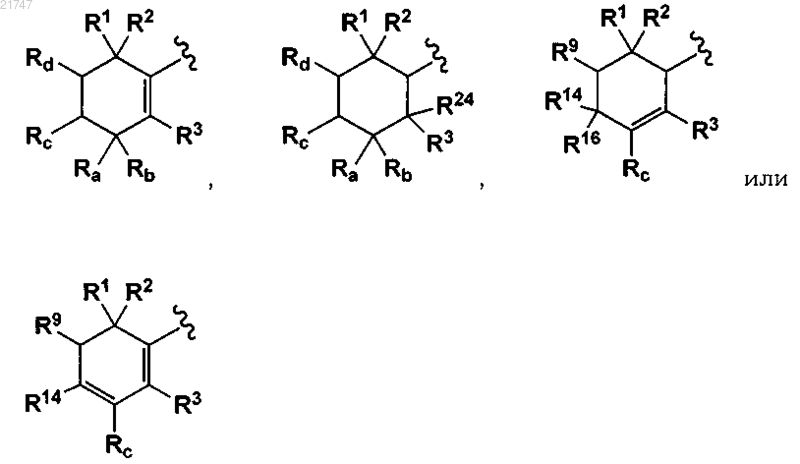
В представляет собой -(CH2)n-, -CH=CH-, -CH2-N(R22)- или -СН2-О-, где n = 0, 1 или 2;
Q представляет собой -C(О)- или -СН2-С(О)-;
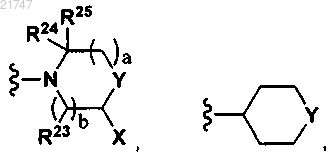
V представляет собой
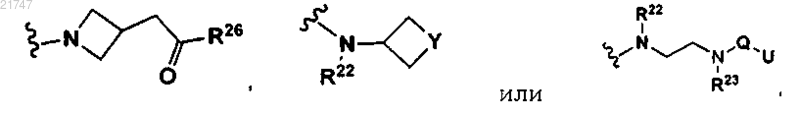
где b представляет собой 1 или 2, а представляет собой 1 или 2 и N-Q-U означает N-C(O)-U или N-S(O2)-U;
Y представляет собой NR22, N-Q-U, CR22R23, кислород, S(O)n, N-C(S)-NR22R23, N-(C=N-CN)-NR22R23, N-(C=N-SO2CH3)-NR22R23, C=NOR22, C=N-NR22R23 или C-Q-U, n представляет собой 0, 1 или 2;
U представляет собой NR22R23, алкил, галогеналкил, алкокси, OR22 или водород;
X представляет собой водород, алкил или -CºCR9;
R1 и R2 независимо представляют собой -СН3 или -СН2СН3;
R3 представляет собой водород, -СН3 или -СН2СН3;
каждый Ra и Rb представляет собой независимо водород, дейтерий или -СН3-;
каждый Rc и Rd независимо представляет собой водород, алкокси, алкил или алкенил;
каждый R9, R14 и R16 независимо представляет собой водород или -СН3;
каждый R22 и R23 независимо представляет собой водород или алкил;
каждый R24 и R25 независимо представляет собой водород или -СН3;
R26 представляет собой NR22R23 или алкокси;
и где R1 и R2, взятые вместе, или Ra и Rb, взятые вместе с углеродом, к которому они присоединены, представляют собой циклопропил;
R24 и R25, взятые вместе с углеродом, к которому они присоединены, представляют собой циклопропил;
R24 и R25, взятые вместе, представляют собой оксо;
включая его фармацевтически приемлемые соли,
где любой алкил представляет собой ациклическую алкильную группу с разветвленной или неразветвленной цепью, включающей от 1 до 10 атомов углерода;
группа алкокси содержит от 1 до 10 атомов углерода и
алкенил представляет собой разветвленную или неразветвленную цепь С2-С10 углеводорода, которая включает одну или две углерод-углеродные двойные связи.
2. Соединение по п.1, где А представляет собой
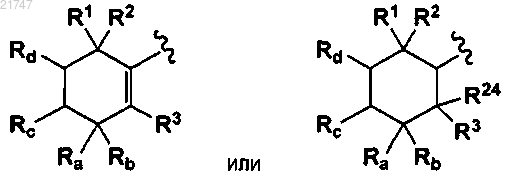
3. Соединение по п.2, где каждый из R1, R2 и R3 представляет собой метил, или где каждый из R24 представляет собой водород, или где каждый Ra и Rb независимо представляет собой водород или метил, или где каждый Ra и Rb представляет собой метил, или где каждый Rc и Rd независимо представляет собой водород или алкил, или где каждый Rc и Rd представляет собой алкил, или где каждый Rc и Rd представляет собой водород.
4. Соединение по п.1, где V представляет собой

или где В представляет собой СН=СН, или где Q представляет собой -С(O)-, или где X представляет собой Н, или алкил, или -CºCR9, или где X представляет собой Н или метил, или где Y представляет собой О или N-C(О)-NR22R23.
5. Соединение, выбранное из группы, состоящей из
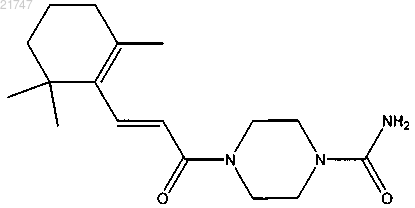
(Е)-4-(3-(2,6,6-триметилциклогекс-1-енил)акрилоил)пиперазин-1-карбоксамида,
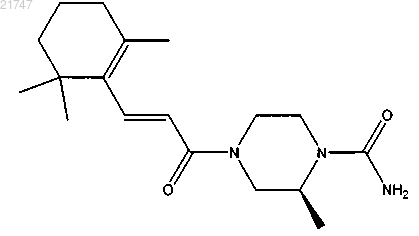
(S,Е)-2-метил-4-(3-(2,6,6-триметилциклогекс-1-енил)акрилоил)пиперазин-1-карбоксамида,

(Е)-4-(3-(3,3-дидейтеро-2,6,6-триметилциклогекс-1-ен-1-ил)акрилоил)пиперазин-1-карбоксамида,

(±)-4-((Е)-3-((1,6-анти)-2,2,6-триметилциклогексил)акрилоил)пиперазин-1-карбоксамида,
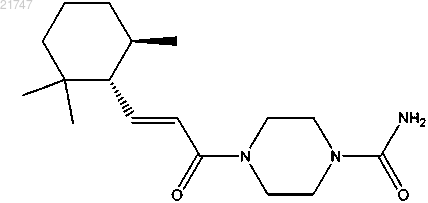
(-)-4-((Е)-3-((1R,6R)-2,2,6-триметилциклогексил)акрилоил)пиперазин-1-карбоксамида,

(+)-4-((Е)-3-((1S,6S)-2,2,6-триметилциклогексил)акрилоил)пиперазин-1-карбоксамида или

4-(3-((1R,6S)-2,2,6-триметилциклогексил)пропаноил)пиперазин-1-карбоксамида,
включая его фармацевтически приемлемые соли.
6. Соединение, выбранное из группы, состоящей из
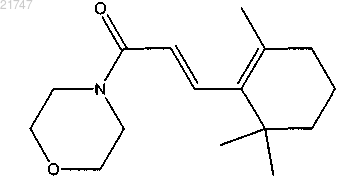
(Е)-1-морфолино-3-(2,6,6-триметилциклогекс-1-енил)проп-2-ен-1-она,
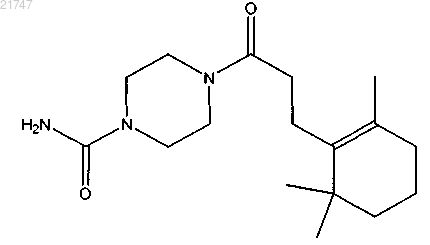
4-(3-(2,6,6-триметилциклогекс-1-енил)пропаноил)пиперазин-1-карбоксамида,
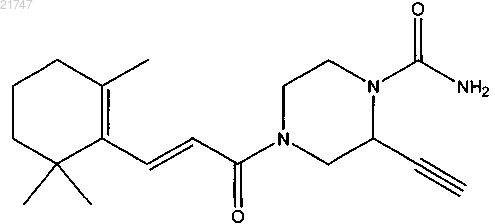
(Е)-2-этинил-4-(3-(2,6,6-триметилциклогекс-1-ен-1-ил)акрилоил)пиперазин-1-карбоксамида,
включая его фармацевтически приемлемые соли.
7. Соединение, выбранное из группы, состоящей из
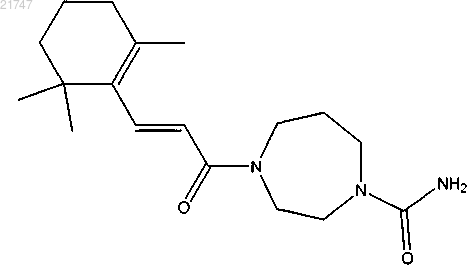
(Е)-4-(3-(2,6,6-триметилциклогекс-1-енил)акрилоил)-1,4-диазепан-1-карбоксамида,
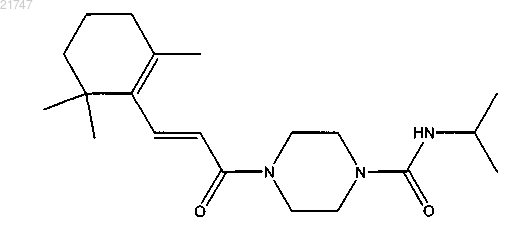
(Е)-N-изопропил-4-(3-(2,6,6-триметилциклогекс-1-енил)акрилоил)пиперазин-1-карбоксамида,
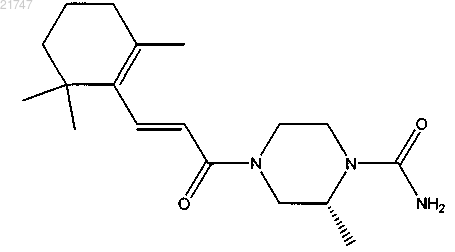
(R,E)-2-метил-4-(3-(2,6,6-триметилциклогекс-1-енил)акрилоил)пиперазин-1-карбоксамида,
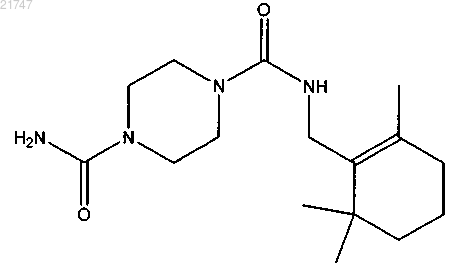
N1-((2,6,6-триметилциклогекс-1-ен-1-ил)метил)пиперазин-1,4-дикарбоксамида,
включая его фармацевтически приемлемые соли.
8. Способ ингибирования образования или накопления продукта цикла превращений родопсина, включающий осуществление контактирования олеинового белка с соединением по п.1.
9. Способ по п.8, где опсиновый белок присутствует в клетке.
10. Способ по п.8, где указанный продукт цикла превращений родопсина представляет собой липофусцин или N-ретинилиден-N-ретинилэтаноламин (А2Е).
11. Фармацевтическая композиция, предназначенная для лечения или для предупреждения офтальмологического состояния у субъекта, подверженного риску возникновения указанного состояния, содержащая эффективное количество соединения по пп.1, 5, 6 или 7.
12. Фармацевтическая композиция по п.11, где указанное офтальмологическое состояние выбирают из группы, состоящей из влажной или сухой возрастной макулярной дегенерации (ARMD), пигментного ретинита (RP), ретинальной или макулярной дистрофии, болезни Старгардта, дистрофии Сорсби, аутосомно-доминантных друз, дистрофии Беста, мутаций периферина, связанных с макулярной дистрофией, доминантной формы болезни Старгардта, макулярной дистрофии Северной Каролины, светотоксичности, естественной потери зрения, связанной со старением, и естественной потери ночного зрения, связанной со старением.
Текст
Раскрыты соединения и композиции указанных соединений наряду со способами использования соединений для лечения офтальмологических состояний, связанных с неправильной локализацией опсиновых белков и неправильной укладкой мутантных опсиновых белков и продуцированием токсичных продуктов цикла превращений родопсина, которые накапливаются в глазу. Раскрыты также соединения и композиции, которые пригодны для использования в указанных способах или отдельно, или в комбинации с другими терапевтическими агентами. Область техники, к которой относится изобретение Изобретение относится к соединениям и их композициям для применения для лечения и/или предупреждения офтальмологических заболеваний. Уровень техники Уменьшенная острота зрения или полная потеря зрения могут быть результатом ряда глазных заболеваний или нарушений, вызванных дисфункцией тканей или структур переднего сегмента глаза и/или заднего сегмента глаза. В тех заболеваниях, которые возникают как следствие дисфункции в переднем сегменте, часто принимают участие аберрации в цикле превращений родопсина. Цикл превращений родопсина (также часто называемый ретиноидным циклом) включает ряд происходящих под действием света и/или катализируемых ферментами реакций, в которых светочувствительный хромофор (называемый родопсином) образуется за счет ковалентного связывания опсинового белка и ретиноидного средства 11-цис-ретиналя, и затем, после экспонирования светом, 11-цис-ретиналь превращается в 11-трансретиналь, который может затем быть регенерированным в 11-цис-ретиналь, чтобы снова взаимодействовать с опсином. Ряд зрительных офтальмологических проблем может возникать из-за нарушения указанного цикла. В настоящее время стало понятно, что, по меньшей мере, некоторые из указанных проблем вызваны неправильной укладкой белка, такой как у опсинового белка. Основным фоторецептором света и темноты в глазах млекопитающих являются палочкоподобные клетки сетчатки, которые содержат складчатую мембрану, содержащую белковые молекулы, которые могут быть восприимчивы к свету, причем основной молекулой является опсин. Подобно другим белкам,присутствующим в клетках млекопитающих, опсин синтезируется в эндоплазмическом ретикулуме (т.е. на рибосомах) цитоплазмы, и затем поступает в клеточные мембраны палочкоподобных клеток. В некоторых случаях, таких как те, что связаны с генетическими дефектами и мутациями опсинового белка,опсин может демонстрировать неправильную укладку с образованием конформаций, которые или не могут соответствующим образом встраиваться в мембрану палочкоподобных клеток, или могут встраиваться, но затем не могут соответствующим образом реагировать с 11-цис-ретиналем с образованием природного родопсина. В любом случае результатом является нарушение (от умеренного до сильного) зрительного восприятия животного с таким офтальмологическим нарушением. Среди заболеваний и состояний, связанных с неправильной укладкой опсина, находится пигментный ретинит (RP), прогрессирующее окулярно-нейродегенеративное заболевание (или группа заболеваний), которое поражает по существующим оценкам от 1 до 2 миллионов человек во всем мире. При RP фоторецепторные клетки в сетчатке повреждаются или разрушаются, что приводит к утрате периферического зрения (т.е. туннельного зрения) и к последующей частичной или почти полной слепоте. У жителей Америки наиболее часто дефекты возникают как результат замещения пролинового остатка гистидиновым остатком у аминокислоты номер 23 в полипептидной цепочке опсина (получившего название "Р 23H"), вызываемого мутацией в гене опсина. Результатом является продуцирование дестабилизированной формы белка, который оказывается неправильно свернутым и скорее агрегируется в цитоплазме, нежели транспортируется на клеточную поверхность. Подобно многим другим заболеваниям,обусловленным конформационными заболеваниями (PCD), клинически обычный Р 23H опсиновый мутант, связанный с аутосомально-доминантным RP, характеризуется неправильной укладкой и тем, что остается внутри клетки. Считают, что агрегация белков с неправильной укладкой приводит к повреждению фоторецепторов и к гибели клеток. Недавние исследования обнаружили малые молекулы, которые стабилизируют неправильно упакованные мутантные белки, связанные с заболеванием. Некоторые из них, называемые "химическими шаперонами", стабилизируют белки неспецифически. Примеры таких молекул включают глицерин и триметиламиноксид. Их использование не очень желательно для лечения офтальмологических заболеваний,так как такая обработка обычно требует высоких доз, которые могут вызвать токсические побочные эффекты. Другие средства, именуемые "фармакологическими шаперонами" (которые включают природные лиганды и аналоги субстратов), действуют как стабилизаторы белков, путем связывания со специфическими сайтами, и были идентифицированы для многих белков с неправильной укладкой, например, Gбелок-связанных рецепторов. Опсин представляет собой пример G-белок-связанного рецептора, и его канонические фармакологические шапероны включают класс соединений, называемых ретиноидами. Так, было показано, что некоторые ретиноидные соединения стабилизируют мутантные опсиновые белки (см., например, публикацию патента США 2004-0242704, а также Noorwez et al., J. Biol. Chem.,279(16): 16278-16284 (2004. Цикл превращений родопсина включает ряд катализируемых ферментами реакций, обычно инициируемых световым импульсом, в результате чего зрительный хромофор родопсина, состоящий из опсинового белка, ковалентно связанного с 11-цис-ретиналем, превращается в 11-транс-изомер, который затем выделяется из активированного родопсина, образуя опсин и 11-транс-ретинальный продукт. Указанная часть цикла превращений родопсина происходит во внешней части палочкоподобных клеток сетчатки глаза. Дальнейшие части цикла происходят в пигментированном эпителии сетчатки (RPE). Компоненты указанного цикла включают различные ферменты, такие как дегидрогеназы и изомеразы, также как транспортные белки для передачи материалов между RPE и палочкоподобными клетками. В результате цикла превращений родопсина образуются различные продукты, называемые продуктами цикла превращений родопсина. Одним из них является 11-транс-ретиналь, продуцируемый в палочкоподобных клетках, как прямой результат контактирования световых импульсов с 11-цисретинальными фрагментами родопсина. 11-транс-Ретиналь, после выделения из активированного родопсина, может быть регенирирован обратно в 11-цис-ретиналь или может реагировать с дополнительной молекулой 11-транс-ретиналя и молекулой фосфатидилэтаноламина с образованием N-ретинилиден-Nретинилэтаноламина (именуемого "А 2 Е"), флуорофора, эмиттирующего в оранжевой области спектра,который может затем накапливаться в палочкоподобных клетках и в пигментированном эпителии сетчатки (RPE). Так как А 2 Е накапливается (как нормальное следствие цикла превращений родопсина), он может также превращаться в липофусцин, токсичное вещество, которое могло принимать участие в некоторых анормальностях, включая офтальмологические нарушения, такие как влажная и сухая возрастная макулярная дегенерация (ARMD). Было также доказано, что А 2 Е может быть токсичным для RPE и связан с сухой ARMD. Так как накопление токсичных продуктов цикла превращений родопсина представляет собой нормальную часть физиологического процесса, по-видимому, у всех млекопитающих, особенно у всех людей, такой процесс накопления происходит до некоторой степени на протяжении жизни. Однако во время хирургических процедур на глазах, особенно на сетчатой оболочке глаза, когда требуется сильное освещение в течение длительного промежутка времени, например, в конце операции по удалению катаракты и во время имплантирования новых линз, такие (в других случаях природные) процессы могут вызывать токсичность из-за накопления природных продуктов цикла превращений родопсина. Кроме того, чрезмерная активация родопсина в результате стимуляции ярким светом может вызывать апоптоз фоторецепторных клеток за счет механизма, зависящего от фактора транскрипции АР-1. Поэтому существует необходимость в средствах, которые можно было бы вводить до, во время или после (или в любой их комбинации) хирургического процесса и которые обладали бы свойством ингибирования активации родопсина также как и уменьшения продуцирования продуктов цикла превращений родопсина, которые, в противном случае, могли бы накапливаться и приводить к токсичности для глаз, особенно для сетчатой оболочки глаз. Настоящее изобретение отвечает указанным потребностям, предлагая малые молекулы, которые нековалентно связываются с опсином или мутированными формами опсина, для лечения и/или облегчения таких состояний, если не для полного их предотвращения. Важно отметить, что такие средства не являются природными ретиноидами и поэтому тщательно не контролируются в отношении включения в палочкоподобные клетки, где синтезируются мутированные формы опсина и/или в другом случае накапливаются продукты цикла превращений родопсина. Поэтому, чрезвычайно важно добавлять такие средства при необходимости для облегчения правильной укладки и миграции мутированных опсинов в клеточные мембраны или для предотвращения активации родопсина, которая может привести к избыточному накоплению продуктов цикла превращений родопсина, таких как 11-транс-ретиналь, что, в свою очередь, может привести к образованию токсичных продуктов метаболизма. Такие соединения могут конкурировать с 11-цис-ретиналем в отношении уменьшения количества 11-транс-ретиналя, закрывая доступ в ретинальсвязывающий карман опсина для предотвращения избыточного накопления 11-транс-ретиналя. Таким образом, соединения, предложенные в настоящем изобретении, обладают тем преимуществом, что они непосредственно не ингибируют ферментативные процессы, в результате которых в глазу продуцируется 11-цис-ретиналь (таким образом не внося вклад в дегенерацию ретиналя). Вместо этого ограничивается образование 11-транс-ретиналя, и, тем самым, уменьшается образование А 2 Е. Наконец, в результате ограничения способности 11-цис-ретиналя комбинироваться с опсином с образованием родопсина, также уменьшается активация родопсина, вызываемая стимуляцией ярким светом, особенно во время офтальмологических операций, и тем самым, в результате предотвращается гибель фоточувствительных клеток. Неправильная локализация фоторецепторных клеток зрительных пигментных белков (опсинов) может происходить при различных глазных заболеваниях и также при естественном старении. В обоих случаях накопление неправильно локализованного опсина приводит к снижению жизнеспособности фоторецепторных клеток. Со временем такое накопление неправильно локализованного опсина приводит к гибели палочкообразных и колбочкообразных клеток, дегенерации сетчатки и к потере зрения. Настоящее изобретение решает указанную проблему, предлагая способ корректировки неправильно локализованного опсина внутри фоторецепторных клеток путем осуществления контактирования неправильно локализованного опсинового белка с опсинсвязывающим средством, которое связывается обратимо и/или нековалентно с указанным неправильно локализованным опсиновым белком, и промотирует соответствующий внутриклеточный процессинг и транспорт указанного опсинового белка. Такая корректировка неправильной локализации уменьшает стресс фоторецепторных клеток, предотвращая снижение жизнеспособности и гибель фоторецепторных клеток при различных заболеваниях потери зрения, и при нормальном возрастном ослаблении зрения при слабой освещенности и периферическом палочкоопосредованном зрении, центральном колбочко-опосредованном зрении и при потере ночного зрения. Компьютерная молекулярная стыковка привела к успешному обнаружению новых лигандов для бо-2 021747 лее чем 30 мишеней (Shoichet et al., Curr. Opin. в Chem. Biol. 6: 439-46 (2002. Указанная стратегия применялась, главным образом, к ферментам, таким как альдозоредуктаза (Iwata et al., J. Med. Chem. 44: 1718-28 (2001, Bcl-2, матриптаза (Enyedy et al., J. Med. Chem. 44: 1349-55 (2001, аденовирусная протеаза (Pang et al., FEBS Letters 502: 93-97 (2001, AmpC f1-лактамаза, карбоангидраза (Gruneberg et al., J.Chem. 44: 4615-27 (2001. Усовершенствования в установочных алгоритмах и в мультипроцессорных ресурсах усовершенствовали способы компьютерной молекулярной стыковки, так что теперь они применимы к более сложным проблемам. Например, указанный подход был недавно применен к определению малых молекул, которые направлены на поверхности раздела белок-белок, которые относительно широки и достаточно плоски по сравнению с легкодостигаемыми активными сайтами ферментов. Совсем недавно были разработаны новые компьютерные технологии определения термодинамических свойств и фазового поведения воды в ограниченных участках белковых карманов (Young et. al.,PNAS 104: 808-13 (2007. Разработанный алгоритм был использован для характеризации сольватации белковых карманов. Методы симуляции молекулярной динамики и анализа растворителей охарактеризовали сольватацию гидрофобных включений и коррелирующих водородных связей как вызывающие атипические энтропические и энтальпические "штрафы" гидратации, которые стабилизируют комплекс белок-лиганд по сравнению с независимо сольватированными лигандом и белком. Указанные критерии,обычно называемые водной картой, были использованы для объяснения связывания лиганда с факторомXa (Abel et. al., JACS 130: 2817-31 (2008. Сущность изобретения В одном аспекте в настоящем изобретении предложены соединения структурной формулы IR1 и R2 независимо представляют собой -СН 3 или -СН 2 СН 3;R3 представляет собой водород, -СН 3 или -СН 2 СН 3; каждый Ra и Rb представляет собой независимо водород, дейтерий или -СН 3-; каждый Rc и Rd независимо представляет собой водород, алкокси, алкил или алкенил; каждый R9, R14 и R16 независимо представляет собой водород или -СН 3; каждый R22 и R23 независимо представляет собой водород или алкил; каждый R24 и R25 независимо представляет собой водород или -СН 3;R24 и R25, взятые вместе, представляют собой оксо; включая их фармацевтически приемлемые соли, где любой алкил представляет собой ациклическую алкильную группу с разветвленной или неразветвленной цепью, включающей от 1 до 10 атомов углерода; группа алкокси содержит от 1 до 10 атомов углерода; и алкенил представляет собой разветвленную или неразветвленную цепь С 2-С 4 углеводорода, которая включает одну или две углерод-углеродные двойные связи. В предпочтительном варианте осуществления настоящего изобретения предложены соединения,где А представляет собой Предпочтительно каждый из R1, R2 и R3 в указанных структурах представляет собой метил, или где каждый из R24 представляет собой водород, или где каждый Ra и Rb независимо представляет собой водород или метил, или где каждый Ra и Rb представляет собой метил, или где каждый Rc и Rd независимо представляет собой водород или алкил, или где каждый Rc и Rd представляет собой алкил, или где каждый Rc и Rd представляет собой водород. В предпочтительном варианте осуществления настоящего изобретения предложены соединения,где V представляет собой: или где В представляет собой СН=СН, или где Q представляет собой -С(О)-, или где X представляет собой Н, или алкил, или -CCR9, или где X представляет собой Н или метил, или где Y представляет собой О или N-C (О)-NR22R23. Ещ одним объектом настоящего изобретения является соединение, выбранное из группы, состоящей из 4-(3-1R,6S)-2,2,6-триметилциклогексил)пропаноил)пиперазин-1-карбоксамида,включая его фармацевтически приемлемые соли. Ещ одним другим объектом изобретения является соединение, выбранное из группы, состоящей из(E)-2-этинил-4-(3-(2,6,6-триметилциклогекс-1-ен-1-ил)акрилоил)пиперазин-1-карбоксамида,включая его фармацевтически приемлемые соли. Ещ одним другим объектом изобретения является соединение, выбранное из группы, состоящей изN1-2,6,6-триметилциклогекс-1-ен-1-ил)метил)пиперазин-1,4-дикарбоксамида,включая его фармацевтически приемлемые соли. Другим объектом настоящего изобретения является способ ингибирования образования или накопления продукта цикла превращений родопсина, включающий осуществление контактирования опсинового белка с вышеописанным соединением формулы I. Предпочтительно опсиновый белок присутствует в клетке. Кроме того, предпочтительно указанный продукт цикла превращений родопсина представляет собой липофусцин или N-ретинилиден-N-ретинилэтаноламин (А 2 Е). Ещ одним другим объектом изобретения является фармацевтическая композиция, предназначенная для лечения или для предупреждения офтальмологического состояния у субъекта, подверженного риску возникновения указанного состояния, содержащая эффективное количество соединения, имеющего любую из описанных выше структурных формул. В предпочтительном варианте офтальмологическое состояние выбирают из группы, состоящей из влажной или сухой возрастной макулярной дегенерации (ARMD), пигментного ретинита (RP), ретинальной или макулярной дистрофии, болезни Старгардта, дистрофии Сорсби, аутосомно-доминантных друз,дистрофии Беста, мутаций периферина, связанных с макулярной дистрофией, доминантной формы болезни Старгардта, макулярной дистрофии Северной Каролины, светотоксичности, естественной потери зрения, связанной со старением, и естественной потери ночного зрения, связанной со старением. Краткое описание чертежей На фиг. 1 показана предполагаемая гидратация кармана связывания ретиналя родопсина, созданная на основании гомологической модели человеческого родопсина на основании кристаллической структуры бычьего родопсина. Для сравнения поверхностный объем 11-цис-ретиналя обозначен общим контуром, а структура 11-цис-ретиналя обозначена жирными черными линиями. Специфические сайты гидратации представлены кружками, в которых молекулы воды, как предполагают, находятся внутри кармана в отсутствии лиганда. Кружки, помеченные "D", обозначают сайты гидратации, которые находятся в очень гидрофобном окружении, и поэтому, после замещения лигандом, как предполагают, понижают энергию комплекса лиганда и белка по сравнению с гидратированным апопротеином. Кружки, помеченные "R", обозначают сайты гидратации, в которых молекулы воды образуют стабильные водородные связи с функциональными группами белка, и таким образом обозначают координаты внутри кармана связывания, куда подходящие, образующие водородные связи функциональности лиганда, должны быть включены для замены водородсвязывающих взаимодействий, которые разрушены между молекулами воды и белком после связывания лиганда. На фиг. 2 демонстрируется увеличение регенерации пигмента, поглощающего на длине волны 500 нм, после обработки ретиналем из Р 23 Н опсина, который был обработан 20 мкМ соединения 6 во время продуцирования мутантного белка, по сравнению с образованием пигмента в присутствии одного только носителя, здесь диметилсульфоксида (ДМСО). На фиг. 3 демонстрируется увеличение регенерации пигмента, поглощающего на длине волны 500 нм, после обработки ретиналем из Р 23 Н опсина, который был обработан 20 мкМ соединения 13 во время продуцирования мутантного белка, по сравнению с образованием пигмента в присутствии только одного носителя (ДМСО). На фиг. 4 демонстрируется увеличение регенерации пигмента, поглощающего на длине волны 500 нм, после обработки ретиналем из Р 23 Н опсина, который был обработан 20 мкМ соединения 33 во время продуцирования мутантного белка, по сравнению с образованием пигмента в присутствии только одного носителя (ДМСО). На фиг. 5 демонстрируется увеличение регенерации пигмента, поглощающего на длине волны 500 нм, после обработки ретиналем из Р 23 Н опсина, который был обработан 20 мкМ соединения 37 во время продуцирования мутантного белка по сравнению с образованием пигмента в присутствии одного только носителя (ДМСО). На фиг. 6 демонстрируется увеличение регенерации пигмента, поглощающего на длине волны 500 нм, который обрабатывают ретиналем из Р 23 Н опсина, который был обработан 20 мкМ соединения 50 во время продуцирования мутантного белка, по сравнению с образованием пигмента в присутствии только одного носителя (ДМСО). На фиг. 7 демонстрируется увеличение регенерации пигмента, поглощающего на длине волны 500 нм, после обработки ретиналем из Р 23 Н опсина, который был обработан 20 мкМ соединения 51 во время продуцирования мутантного белка, по сравнению с образованием пигмента в присутствии только одного носителя (ДМСО). На фиг. 8 демонстрируется увеличение регенерации пигмента, поглощающего на длине волны 500 нм, после обработки ретиналем из Р 23 Н опсина, который был обработан 20 мкМ соединения 52 во время продуцирования мутантного белка, по сравнению с образованием пигмента в присутствии только одного носителя (ДМСО). На фиг. 9 демонстрируется увеличение регенерации пигмента, поглощающего на длине волны 500 нм, после обработки ретиналем из Р 23 Н опсина, который был обработан 20 мкМ соединения 53 во время продуцирования мутантного белка, по сравнению с образованием пигмента в присутствии только одного носителя (ДМСО). На фиг. 10 демонстрируется увеличение регенерации пигмента, поглощающего на длине волны 500 нм, после обработки ретиналем из Р 23 Н опсина, который был обработан 20 мкМ соединения 55 во время продуцирования мутантного белка, по сравнению с образованием пигмента в присутствии только одного носителя (ДМСО). На фиг. 11 демонстрируется увеличение регенерации пигмента, поглощающего на длине волны 500 нм, после обработки ретиналем из Р 23 Н опсина, который был обработан 20 мкМ соединения 57 во время продуцирования мутантного белка, по сравнению с образованием пигмента в присутствии только одного носителя (ДМСО). На фиг. 12 демонстрируется увеличение регенерации пигмента, поглощающего на длине волны 500 нм, после обработки ретиналем из Р 23 Н опсина, который был обработан 20 мкМ соединения 63 во время продуцирования мутантного белка, по сравнению с образованием пигмента в присутствии только одного носителя (ДМСО). На фиг. 13 демонстрируется увеличение регенерации пигмента, поглощающего на длине волны 500 нм, после обработки ретиналем из Р 23 Н опсина, который был обработан 20 мкМ соединения 71 во время продуцирования мутантного белка, по сравнению с образованием пигмента в присутствии только одного носителя (ДМСО). На фиг. 14 демонстрируется увеличение регенерации пигмента, поглощающего на длине волны 500 нм, после обработки ретиналем из Р 23 Н опсина, который был обработан 20 мкМ соединения 73 во время продуцирования мутантного белка, по сравнению с образованием пигмента в присутствии только одного носителя (ДМСО). На фиг. 15 демонстрируется увеличение регенерации пигмента, поглощающего на длине волны 500 нм, после обработки ретиналем из Р 23 Н опсина, который был обработан 20 мкМ соединения 80 во время продуцирования мутантного белка, по сравнению с образованием пигмента в присутствии только одного носителя (ДМСО). На фиг. 16 демонстрируется увеличение регенерации пигмента, поглощающего на длине волны 500 нм, после обработки ретиналем из Р 23 Н опсина, который был обработан 20 мкМ соединения 105 во время продуцирования мутантного белка, по сравнению с образованием пигмента в присутствии только одного носителя (ДМСО). На фиг. 17 демонстрируется увеличение регенерации пигмента, поглощающего на длине волны 500 нм, после обработки ретиналем из Р 23 Н опсина, который был обработан 20 мкМ соединения 106 во время продуцирования мутантного белка, по сравнению с образованием пигмента в присутствии только одного носителя (ДМСО). Определения Как использовано на протяжении всего описания изобретения, следующие термины, если не указано иначе, имеют следующие значения. Под термином "неправильная локализация" белка зрительного пигмента фоторецепторной клетки(например, опсина, особенно человеческого опсина) подразумевают, что синтезированный белок не локализован в нормальном или соответствующем месте клетки. Термин "фармакологические шапероны" относится к химическим соединениям малого молекулярного веса, которые взаимодействуют с белком (обычно с неправильно упакованным или неупакованным белком) таким образом, что изменяют упаковку или конформацию указанного белка. Такое взаимодействие может привести к вредным последствиям для судьбы клеток белка, в том числе, но этим не ограничиваясь, приводя к повышенной стабильности и повышенным уровням содержания функционального белка, к повышенной стабильности и повышенным уровням содержания нефункционального белка или к пониженной стабильности и пониженным уровням содержания функционального или нефункционального белка. Термин "продуктивный шаперон" относится к фармакологическому шаперону, взаимодействие которого с белком приводит к повышенному уровню содержания функционального белка. Термин "контрпродуктивный, разрушительный или деструктивный шаперон" относится к фармакологическому шаперону, который взаимодействует с белком (обычно с неправильно упакованным или с неупакованным белком), и указанное взаимодействие приводит к пониженной стабильности и/или пониженным уровням содержания функционального или нефункционального белка. Под термином "ингибитор протеасомальной активности" подразумевают соединение, которое снижает протеасомальную активность, такую как разрушение убиквитинированного белка. Под термином "ингибитор аутофагии" подразумевают соединение, которое уменьшает деградацию клеточного компонента клеткой, в которой расположен указанный компонент. Под термином "лизосомальный ингибитор" подразумевают соединение, которое уменьшает внутриклеточный гидролиз макромолекул лизосомой. В одном варианте лизосомальный ингибитор снижает протеолитическую активность лизосом. Под термином "ингибитор транспорта белка ER-Golgi" подразумевают соединение, которое уменьшает транспорт белка из ER (эндоплазматического ретикулума) в комплекс Гольджи или из комплекса Гольджи в ER. Под термином "ингибитор HSP90 шаперона" подразумевают соединение, которое уменьшает активность шаперона белка термического шока 90 (HSP90). В одном варианте указанный ингибитор изменяет связывание белка с HSP90 ATP/ADP карманом. Под термином "активатор реакции термического шока" подразумевают соединение, которое повышает активность шаперона или экспрессию компонента пути термического шока. Компоненты пути термического шока включают, но ими не ограничиваются, HSP100, HSP90, HSP70, HASP60, HSP40 и члены семейства малых HSP. Под термином "ингибитор гликозидазы" подразумевают соединение, которое уменьшает активность фермента, который расщепляет гликозидную связь. Под термином "ингибитор гистондеацетилазы" подразумевают соединение, которое уменьшает активность фермента, который деацетилирует гистон. Под терминами "уменьшает" или "увеличивает" подразумевают негативное и позитивное изменение соответственно. В конкретных вариантах указанное изменение составляет по меньшей мере около 10, 25,50, 75 или 100% от исходного уровня белка, продуцируемого в отсутствии опсинсвязывающего лиганда. В том смысле, как здесь использован, термин "конформация дикого типа" относится к трехмерной конформации или форме белка, который не содержит мутаций в своей аминокислотной последователь-7 021747 ности. В случае опсина это означает, что белок не содержит мутаций, которые вызывают ошибочную регистрацию остатков, таких как мутации, обозначаемые Р 23 Н (что означает, что пролин заменен на гистидин у остатка 23, начиная с N-конца). Опсин в "конформации дикого типа" обладает биологическими функциями опсина, включая, но этим не ограничиваясь, связывание ретиноидов, функции цикла превращений родопсина и встраивание в фоторецепторные мембраны. Под термином "средство" подразумевают малое соединение (называемое также просто "соединением"), полипептид, полинуклеотид или его фрагмент. Указанные термины "соединение" и "средство" используют взаимозаменяемо, если конкретно не указано иначе для конкретного средства или соединения. Под термином "корректирование конформации" белка подразумевают то, что индуцируют принятие белком конформации, обладающей по меньшей мере одной биологической активностью, связанной с белком дикого типа. Под выражением "неправильно упакованный опсиновый белок" подразумевают белок, третичная структура которого отличается от конформации белка дикого типа, так что у неправильно упакованного белка отсутствует одна или более из биологических активностей, присущих белку дикого типа. Под термином "селективно связывает" подразумевают соединение, которое распознает и связывается с полипептидом настоящего изобретения, таким как опсин, но практически не распознает и не связывается с другими молекулами, особенно неопсиновыми полипептидами, в образце, например в биологическом образце. Под термином "эффективное количество" или "терапевтически эффективное количество" подразумевают уровень средства, которого достаточно, чтобы оказать физиологическое воздействие на клетку,ткань, орган или пациента. В том смысле, как этот термин здесь использован, он представляет собой такое количество, которого достаточно, чтобы осуществить способы настоящего изобретения для достижения необходимого результата. Под термином "фармакологический шаперон" подразумевают молекулу, которая после осуществления контактирования с мутантным белком способна облегчить/стабилизировать правильную укладку белка таким образом, чтобы он действовал и функционировал гораздо более похоже на белок дикого типа, нежели это было бы в случае отсутствии указанной молекулы. Под термином "контроль" подразумевают сравнительные условия. Например, если клетку, контактировавшую со средством настоящего изобретения, сравнивают с соответствующей клеткой, которая не контактировала с указанным средством, тогда последняя называется "контролем" или "контрольной клеткой". Под термином "лечение" подразумевают снижение, подавление, ослабление, уменьшение, остановку или стабилизацию развития или прогресса заболевания, предпочтительно глазного заболевания, такого как RP, AMD и/или светотоксичность. Под термином "предотвратить" подразумевают уменьшение риска того, что у субъекта разовьется состояние, заболевание или нарушение, предпочтительно глазное заболевание, такое как RP, AMD и/или светотоксичность. Под термином "конкурирует за связывание" подразумевают, что соединение настоящего изобретения и эндогенный лиганд способны связываться с мишенью одновременно. Анализы, в которых измеряют конкурентное связывание, известны специалистам и включают измерение дозозависимого ингибирования связывания соединения настоящего изобретения и эндогенного лиганда, измеряя, например, величину t1/2."Фармацевтически приемлемая соль" представляет собой соль, образованную кислотной или щелочной группой одного из соединений настоящего изобретения. Примеры солей включают, но ими не ограничиваются, сульфат, цитрат, ацетат, оксалат, хлорид, бромид, иодид, нитрат, бисульфат, фосфат,кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентисинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат (т.е. 1,1'метилен-бис-(2-гидрокси-3-нафтоат. Термин "фармацевтически приемлемая соль" также относится к соли, полученной из соединения настоящего изобретения, содержащего кислотную функциональную группу, такую как функциональная группа карбоновой кислоты, и фармацевтически приемлемого неорганического или органического основания. Подходящие основания включают, но ими не ограничиваются, гидроксиды щелочных металлов,таких как натрий, калий и литий; гидроксиды щелочно-земельных металлов, таких как кальций и магний; гидроксиды других металлов, таких как алюминий и цинк; аммиак и органическое амины, такие как незамещенные или гидроксизамещенные моно-, ди- или триалкиламины; дициклогексиламин; трибутиламин; пиридин; N-метил-N-этиламин; диэтиламин; триэтиламин; моно-, бис- или трис-2-гидрокси-низшие алкиламины), такие как моно-, бис- или трис-(2-гидроксиэтил) амин, 2-гидрокси-трет-бутиламин или трис-(гидроксиметил)метиламин, N,N-ди-низший алкил-N-(гидрокси низший алкил)амины, такие как здесь соединений, например, солям соединений примера 1, содержащим основную функциональную группу, такую как аминофункциональная группа, и фармацевтически приемлемых неорганических или органических кислот. Подходящие кислоты включают, но ими не ограничиваются, гидросульфат, лимонную кислоту, уксусную кислоту, щавелевую кислоту, хлористо-водородную кислоту, бромистый водород, йодистый водород, азотную кислоту, фосфорную кислоту, изоникотиновую кислоту, молочную кислоту, салициловую кислоту, винную кислоту, аскорбиновую кислоту, янтарную кислоту, малеиновую кислоту, бензолсульфоновую кислоту, фумаровую кислоту, глюконовую кислоту, глюкуроновую кислоту, сахариновую кислоту, муравьиную кислоту, бензойную кислоту, глютамовую кислоту, метансульфоновую кислоту, этансульфоновую кислоту, бензолсульфоновую кислоту и п-толуолсульфоновую кислоту. Термин "фармацевтически приемлемый эксципиент", в том смысле, как здесь использован, означает один или более из совместимых твердых или жидких наполнителей, разбавителей или инкапсулирующих веществ, которые пригодны для введения человеку. Термин "эксципиент" включает инертные вещества,которые добавляют к фармакологическим композициям для дальнейшего облегчения введения соединений. Примеры эксципиентов включают, но ими не ограничиваются, карбонат кальция, фосфат кальция,различные сахара и типы крахмала, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли. Термин "носитель" обозначает органический или неорганический ингредиент, природный или синтетический, с которым совместим активный ингредиент, используемый для облегчения введения. Термин "парентеральный" включает подкожное, интратекальное, внутривенное, внутримышечное,внутрибрюшинное введение или вливание. Термин "продукт цикла превращений родопсина" относится к химической единице, полученной как природный продукт одной или более из реакций цикла превращений родопсина (реактивного цикла, в котором белок опсина связывает 11-цис-ретиналь с образованием родопсина, который акцептирует световой импульс, превращая 11-цис-ретиналь в 11-транс-ретиналь, который затем выделяется из молекулы,регенерируя опсиновый белок с последующим связыванием нового 11-цис-ретиналя для регенерации родопсина). Такие продукты цикла превращений родопсина включают, но ими не ограничиваются, 11 транс-ретиналь, липофусцин и А 2 Е. Термин "светотоксичность" относится к любому состоянию, влияющему на зрение, которое связано с, относится к или вызвано продуцированием и/или накоплением продуктов цикла превращений родопсина. Продукты цикла превращений родопсина включают, но ими не ограничиваются, 11-транс-ретиналь, липофусцин или А 2 Е. В одном конкретном варианте светотоксичность связана с экспонированием глаза большому количеству света или очень высокой интенсивности света, что происходит, например, во время хирургической операции на сетчатке. Термин "опсин" относится к опсиновому белку, предпочтительно опсиновому белку млекопитающего, наиболее предпочтительно к опсиновому белку человека. В одном варианте опсиновый белок находится в конформации дикого типа (т.е. физиологически активной). Одним из способов анализа физиологической активности является анализ способности опсина связываться с 11-цис-ретиналем и образовывать активный родопсин. Мутантный опсин, такой как Р 23 Н мутант, который обычно неправильно упакован, обладает пониженной способностью связываться с 11-цис-ретиналем, и поэтому родопсина образуется мало или вовсе не образуется. Если конформация мутантного опсина оказывалась правильной(например, при связывании с фармакологическим шапероном), такой опсин правильно встроен в мембрану палочки сетчатки, так что его конформация такая же или практически такая же, как конформация немутантного опсина. Это позволяет мутантному опсину связываться с 11-цис-ретиналем и образовывать активный родопсин. Поэтому способы настоящего изобретения работают на уменьшение образования продуктов цикла превращений родопсина. Термин "алкил" относится к неразрушенной нециклической цепи атомов углерода, которые могут быть замещены другими химическими группами. Цепь может быть также разветвленной или неразветвленной, замещенной или незамещенной. Термин "низший алкил" относится к ациклической алкильной группе с разветвленной или неразветвленной цепью, включающей от одного до десяти атомов углерода, предпочтительно от одного до восьми атомов углерода, более предпочтительно от одного до шести атомов углерода. Примеры низших алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, третбутил, пентил, неопентил, изоамил, гексил и октил. Все раскрытые здесь алкильные, алкенильные или алкинильные группы могут быть замещены одной или более из следующих групп: низший алкил, гидрокси, сложный эфир, амидил, оксо, карбоксил,карбоксамидо, галоген, циано, нитрат, нитрит, тионитрат, тионитрит, сульфгидрил и амино (как определено в настоящем описании в любом другом месте). Термин "галогеналкил" относится к низшей алкильной группе, алкенильной группе, алкинильной группе, мостиковой циклоалкильной группе, циклоалкильной группе или к гетероциклическому кольцу,как здесь определено, к которым присоединен один или более из галогенов, как здесь определено. Примеры галогеналкильных групп включают трифторметил, хлорметил, 2-бромбутил и 1-бром-2-9 021747 хлорпентил. Термин "алкенил" относится к разветвленной или неразветвленной цепи, состоящей из С 2-С 10 углеводородов (предпочтительно С 2-С 8 углеводородов, более предпочтительно С 2-С 6 углеводородов), которая может включать одну или более из углерод-углеродных двойных связей. Примеры алкенильных групп включают пропиленил, бутен-1-ил, изобутенил, пентен-1-ил, 2,2-метилбутен-1-ил, 3-метилбутен-1 ил, гексен-1-ил, гептен-1-ил и октен-1-ил. Термин "мостиковый циклоалкил" относится к двум или более циклоалкильным группам, гетероциклическим группам или к их комбинациям, конденсированным через соседние или несоседние атомы. Мостиковые циклоалкильные группы могут быть незамещенными или могут быть замещены одним,двум или тремя заместителями, независимо выбранными из алкила, алкокси, амино, алкиламино, диалкиламино, гидрокси, галогена, карбоксила, алкилкарбоновой кислоты, арила, амидила, сложного эфира,алкилкарбонового эфира, карбоксамидо, алкилкарбоксамидо, оксо и нитро. Примеры мостиковых циклоалкильных групп включают адамантил, декагидронафтил, хинуклидил, 2,6-диоксабицикло(3.3.0)октан, 7 оксабицикло(2.2.1)гептил и 8-азабицикло(3.2.1)окт-2-енил. Термин "циклоалкил" относится к насыщенному или ненасыщенному циклическому углеводороду,включающему от около 3 до около 10 атомов углерода. Циклоалкильные группы могут быть незамещенными или могут быть замещены одним, двумя или тремя заместителям, которые независимо выбирают из алкила, алкокси, амино, алкиламино, диалкиламино, ариламино, диариламино, алкилариламино, арила, амидила, сложного эфира, гидрокси, галогена, карбоксила, алкилкарбоновой кислоты, алкилкарбонового эфира, карбоксамидо, алкилкарбоксамидо, оксо, алкилсульфинила и нитро. Примеры циклоалкильных групп включают циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил и циклогепта-1,3-диенил. Термин "гетероциклическое кольцо или группа" относится к насыщенной или ненасыщенной циклической или полициклической углеводородной группе, содержащей от около 2 до около 12 атомов углерода, где от 1 до около 4 атомов углерода заменены одним или более из атомов азота, кислорода и/или серы. Сера может находиться в тио, сульфинил или сульфонил окисленном состоянии. Указанное гетероциклическое кольцо или группа могут быть конденсированы с ароматической углеводородной группой. Гетероциклические группы могут быть незамещенными или могут быть замещены одним, двумя или тремя заместителями, которые независимо выбирают из алкила, алкокси, амино, алкилтио, арилокси,арилтио, арилалкила, гидрокси, оксо, тиала, галогена, карбоксила, карбонового эфира, алкилкарбоновой кислоты, алкилкарбонового эфира, арила, арилкарбоновой кислоты, арилкарбонового эфира, амидила,сложного эфира, алкилкарбонила, арилкарбонила, алкилсульфинила, карбоксамидо, алкилкарбоксамидо,арилкарбоксамидо, сульфоновой кислоты, сульфонового эфира, сульфонамид нитрата и нитро. Примеры гетероциклических групп включают пирролил, фурил, тиенил, 3-пирролинил, 4,5,6-тригидро-2 Нпиранил, пиридинил, 1,4-дигидропиридинил, пиразолил, триазолил, пиримидинил, пиридазинил, оксазолил, тиазолил, тиено[2,3-d]пиримидин, 4,5,6,7-тетрагидробензо[b]тиофен, имидазолил, индолил, тиофенил, фуранил, тетрагирофуранил, тетразолил, пирролинил, пирролидинил, оксазолиндинил, 1,3 диоксоланил, имидазолинил, имидазолиндинил, пиразолинил, пиразолидинил, изоксазолил, изотиазолил,1,2,3-оксадиазолил, 1,2,3-триазолил, 1,3,4-тиадиазолил, 2 Н-пиранил, 4 Н-пиранил, пиперидинил, 1,4 диоксанил, морфолинил, 1,4-дитианил, тиоморфолинил, пиразинил, пиперазинил, 1,3,5-триазинил, 1,3,5 тритианил, бензо(b)тиофенил, бензимидазолил, бензотиазолинил, хинолинил и 2,6-диоксабицикло(3.3.0)октан. Термин "арил" относится к моноциклической, бициклической, карбоциклической или гетероциклической кольцевой системе, содержащей одно или два ароматических кольца. Примеры арильных групп включают фенил, пиридил, нафтил, хиноил, тетрагидронафтил, фуранил, инданил, инденил, индоил. Арильные группы (включая бициклические арильные группы) могут быть незамещенными или могут быть замещены одним, двумя или тремя заместителями, которые независимо выбирают из алкила, алкокси, алкилтио, амино, алкиламино, диалкиламино, ариламино, диариламино, алкилариламино, галогена,циано, алкилсульфинила, гидрокси, карбоксила, карбонового эфира, алкилкарбоновой кислоты, алкилкарбонового эфира, арила, арилкарбоновой кислоты, арилкарбонового эфира, алкилкарбонила, арилкарбонила, амидила, сложного эфира, карбоксамидо, алкилкарбоксамидо, карбомила, сульфоновой кислоты,сульфонового эфира, сульфонамидо и нитро. Примеры замещенных арильных групп включают тетрафторфенил, пентафторфенил, сульфонамид, алкилсульфонил и арилсульфонил. Термин "арилгетероциклическое кольцо" относится к би- или трициклическому кольцу, включающему арильное кольцо, как здесь определено, присоединенное через два соседних атома углерода арильного кольца к гетероциклическому кольцу, как здесь определено. Примеры арилгетероциклических колец включают дигидроиндол и 1,2,3,4-тетрагидрохинолин. Термин "алкокси" относится к R50O-, где R50 представляет собой алкильную группу, как здесь определено (предпочтительно низшую алкильную группу или галогеналкильную группу, как здесь определено). Примеры алкоксигрупп включают метокси, этокси, трет-бутокси, циклопентилокси и трифторметокси. Термин "арилокси" относится к R55O-, где R55 представляет собой арильную группу, как здесь опре- 10021747 делено. Примеры арилоксигрупп включают нафтилокси, хинолилокси, изохинолизинилокси. Термин "алкилтио" относится к R50S-, где R50 представляет собой алкильную группу, как здесь определено. Термин "гидрокси" относится к -ОН. Термин "оксо" относится к =O. Термин "органический катион" относится к положительно заряженному органическому иону. Примеры органических катионов включают алкилзамещенные катионы аммония. Термин "неорганический катион" относится к положительно заряженному иону металла. Примеры неорганических катионов включают катионы металлов группы I, таких как, например, натрий, калий,магний и кальций. Термин "нитрат" относится к группе -O-NO2, т.е. к окисленному азоту. Термин "нитро" относится к группе -NO2, и термин "нитрозированный" относится к соединениям,которые им замещены. Термины "нитрил" и "циано" относятся к группе -CN. Термин "галоген" относится к иоду (I), брому (Br), хлору (Cl) и/или фтору (F). Термин "амино" относится к группе -NH2, алкиламиногруппе, диалкиламиногруппе, ариламиногруппе, диариламиногруппе, алкилариламиногруппе или гетероциклическому кольцу, как здесь определено. Термин "алкиламино" относится к группе R50NH-, где R50 представляет собой алкильную группу,как здесь определено. Примеры алкиламиногрупп включают метиламино, этиламино, бутиламино и циклогексиламино."Ариламино" относится к группе R55NH-, где R55 представляет собой арильную группу, как здесь определено. Термин "диалкиламино" относится к группе R52R53N-, где каждый R52 и R53 независимо представляет собой алкильную группу, как здесь определено. Примеры диалкиламиногрупп включают диметиламино, диэтиламино и метилпропаргиламино. Термин "диариламино" относится к группе R55R60N, где каждый R55 и R60 независимо представляет собой арильную группу, как здесь определено. Термины "алкилариламино" или "арилалкиламино" относятся к группе R52R55N-, где R52 представляет собой алкильную группу, как здесь определено, и R55 представляет собой арильную группу, как здесь определено. Термин "тиал" относится к =S. Термин "сульфоновая кислота" относится к группе -S(O)2OR76, где R76 представляет собой водород,органический катион или неорганический катион, как здесь определено. Термин "сульфоновый сложный эфир" относится к -S(O)2OR58, где R58 представляет собой алкильную группу, арильную группу или арильное гетероциклическое кольцо, как здесь определено. Термин "сульфонамидо" относится к группе -S(О)2-N (R51) (R57), где каждый R51 и R57 независимо представляет собой атом водорода, алкильную группу, арильную группу или арилгетероциклическое кольцо, как здесь определено, или R51 и R57, взятые вместе, представляют собой гетероциклическое кольцо, циклоалкильную группу или мостиковую циклоалкильную группу, как здесь определено. Термин "алкилсульфинил" относится к группе R50-S(O)-, где R50 представляет собой алкильную группу, как здесь определено. Термин "амидил" относится к группе R51C(О)N(R57)-, где каждый R51 и R57 независимо представляет собой атом водорода, алкильную группу, арильную группу или арилгетероциклическое кольцо, как здесь определено. Термин "сложный эфир" относится к группе R51C(O)R82-, где R51 представляет собой атом водорода,алкильную группу или арильную группу или арилгетероциклическое кольцо, как здесь определено, и R82 представляет собой кислород или серу. Термин "карбоксил" относится к группе -C(O)OR76, где R76 представляет собой водород, органический катион или неорганический катион, как здесь определено. Термин "алкилкарбонил" относится к группе R52-C(O)-, где R52 представляет собой алкильную группу, как здесь определено. Термин "арилкарбонил" относится к группе R55-C(O)-, где R55 представляет собой арильную группу,как здесь определено. Термин "эфир карбоновой кислоты" относится к группе -C(O)OR58, где R58 представляет собой алкильную группу, арильную группу или арильное гетероциклическое кольцо, как здесь определено. Термин "алкилкарбоновая кислота" и "алкилкарбоксил" относятся к алкильной группе, как здесь определено, присоединенной к карбоксильной группе, как здесь определено. Термин "эфир алкилкарбоновой кислоты" относится к алкильной группе, как здесь определено,присоединенной к группе карбонового эфира, как здесь определено. Термин "арилкарбоновая кислота" относится к арильной группе, как здесь определено, присоединенной к карбоксильной группе, как здесь определено. Термины "эфир арилкарбоновой кислоты" и "арилкарбоксил" относятся к арильной группе, как здесь определено, присоединенной к группе эфира карбоновой кислоты, как здесь определено. Термин "карбоксамидо" относится к группе -C(O)N(R51) (R57), где каждый R51 и R57 независимо представляет собой атом водорода, алкильную группу, арильную группу или арилгетероциклическое кольцо, как здесь определено, или R51 и R57, взятые вместе, представляют собой гетероциклическое кольцо, циклоалкильную группу или мостиковую циклоалкильную группу, как здесь определено. Термин "алкилкарбоксамидо" относится к алкильной группе, как здесь определено, присоединенной к карбоксамидогруппе, как здесь определено. Термин "арилкарбоксамидо" относится к арильной группе, как здесь определено, присоединенной к карбоксамидогруппе, как здесь определено. Термин "независимо выбранные" группы относится к группам, присутствующим в одной и той же структуре, и которые не должны все представлять собой одно и то же замещение. Например, если два заместителя представлены как NORA, и указано, что каждый RA независимо выбирают из Н, метила, этила и т.д., это означает, что, если один RA представляет собой метил, другой RA может быть метилом, но может быть Н или этилом (или любым другим указанным замещением). Некоторые из соединений для использования в способах настоящего изобретения могут иметь один или более из хиральных центров и поэтому могут существовать в энантиомерных и диастереоизомерных формах. Объем настоящего изобретения включает использование всех изомеров per se, так же как и смесейцис- и транс-изомеров, а также смесей диастерероизомеров и рацемических смесей энантиомеров(оптических изомеров). Кроме того, имеется возможность, используя хорошо известные способы разделения различных форм и некоторые варианты настоящего изобретения, далее очистить или обогатить образцы конкретным энантиомером или диастереоизомером. Термин "фармакологическая композиция" относится к смеси одного или более из раскрытых здесь соединений или их фармацевтически приемлемых солей с другими химическими компонентами, такими как фармацевтически приемлемые носители и/или эксципиенты. Цель фармакологических композиций состоит в облегчении введения соединений в организм. Выражение "фармацевтически приемлемый носитель" в том смысле, как здесь использован, означает фармацевтически приемлемое вещество, композицию или носитель, такой как жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующее вещество, участвующее в переносе или в транспортировке рассматриваемого средства из одного органа или части тела в другой орган или часть тела. Каждый носитель должен быть "приемлемым" в том смысле, что он должен быть совместим с другими ингредиентами лекарственной формы и не должен быть вредным для пациента. Некоторые примеры материалов, которые можно использовать в качестве фармацевтически приемлемых носителей, включают сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошок трагаканта; солод; желатин; тальк; эксципиенты, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, масло хлопковых семян, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли,такие как пропиленгликоль; полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этилаурат; агар; буферные средства, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; не содержащую пирогена воду; изотонический солевой раствор; раствор Рингера, этиловый спирт; фосфато-буферные растворы и другие нетоксичные совместимые вещества, используемые в фармацевтических лекарственных формах. Физиологически приемлемый носитель не должен вызывать заметного раздражения организма и не должен нарушать биологическую активность и свойства вводимого соединения. Термины "оптический изомер", "геометрический изомер" (например, цис- и/или транс-изомер),"стереоизомер" и "диастереоизомер" имеют общепринятые значения (см., например, Hawley's CondensedChemical Dictionary, 1 1th Ed.). Иллюстрации конкретных защищенных форм и других производных соединений настоящего изобретения не следует рассматривать как ограничивающие. Применение других подходящих защитных групп, форм солей, пролекарств и т.д. относится к компетенции специалиста. Термин "пролекарство" обозначает такую форму лекарства, которая должна претерпеть химическое превращение в результате метаболических процессов прежде, чем становится активным или полностью активным фармакологическим средством. Пролекарство не является активным или оно является менее активным в его поглощенной или абсорбированной или каким-либо другим образом введенной форме. Например, пролекарство может быть разрушено бактериями в пищеварительной системе на продукты, по меньшей мере один из которых становится активным как лекарственное средство. Альтернативно, пролекарство можно вводить системно, например, путем внутривенной инъекции с последующим метаболическим превращением в одну или более из активных молекул. Описание предпочтительного варианта осуществления настоящего изобретения В соответствии с настоящим изобретением было обнаружено, что некоторые малые молекулы - лиганды способны обратимо связываться нековалентно с опсиновым белком и ингибировать связывание 11-цис-ретиналя с опсиновым карманом связывания ретиналя. Такое нарушение связывания ретиналя уменьшает образование продуктов цикла превращений родопсина, таких как 11-транс-ретиналь, и тем самым ингибирует продуцирование соединений, таких как липофусцин и А 2 Е, что приводит к уменьшению риска и проявления токсичности, которая может возникнуть в результате накопления указанных веществ. Такие соединения, функционируя как фармакологические шапероны, также способны облегчить правильную укладку и миграцию мутантных опсинов, связанных с RP. Кроме того, за счет ингибирования связывания 11-цис-ретиналя и образования родопсина, избыточная стимуляция и результирующая активация родопсина, вызванная экспонированием сетчатки яркому свету, особенно во время хирургических операций на сетчатке, уменьшают гибель фоточувствительных клеток. Сообщалось, что некоторые синтетические ретиноиды (соединения, структурно родственные ретинолу (спиртовой витамин А связываются с опсином. В некоторых вариантах настоящего изобретения было обнаружено, что неретиноидные малые молекулы (соединения с молекулярным весом менее чем около 1000, менее чем 800, менее чем 600, менее чем 500, менее чем 400 или менее чем около 300 Да) связываются с опсином. Настоящее изобретение можно использовать для уменьшения образования продуктов цикла превращений родопсина и уменьшения токсичности, связанной с накоплением таких продуктов in vivo,уменьшая вероятность апоптотических актов, связанных с избыточной активацией родопсина, а также предотвращая гибель палочкоподобных клеток, связанную с аберрантным процессингом и миграцией мутантных опсиновых белков, связанных с RP. Неправильная локализация фоторецепторных клеток белков зрительного пигмента (опсинов) может происходить при различных глазных болезнях, и также может быть обусловлена старением. В таких случаях накопление неправильно локализованного опсина приводит к снижению жизнеспособности фоторецепторных клеток. Со временем такое накопление неправильно локализованного опсина приводит к гибели палочкоподобных и колбочкоподобных клеток, дегенерации сетчатки и к потере зрения. В одном аспекте в настоящем изобретении предложен способ коррекции неправильно локализованного опсина внутри фоторецепторной клетки, включающий осуществление контактирования неправильно локализованного опсинового белка с опсинсвязывающим средством, которое связывается обратимо и/или нековалентно с указанным неправильно локализованным опсиновым белком, тем самым промотируя корректный внутриклеточный процессинг и миграцию указанного опсинового белка. Такое опсинсвязывающее средство называют "продуктивным шапероном". Такого рода коррекция неправильной локализации уменьшает стресс для фоторецепторных клеток,предотвращая снижение жизнеспособности и гибель фоторецепторных клеток при различных заболеваниях, связанных с потерей зрения, и при естественном связанном с возрастом ослаблении зрения при тусклом свете и периферического зрения, опосредованного палочками, центрального зрения, опосредованного колбочками, и при потере ночного зрения. В другом аспекте настоящего изобретения опсинсвязывающее средство промотирует деградацию неправильно локализованного опсинового белка. Такой тип опсинсвязывающего средства называют"контрпродуктивным", "разрушительным" или "деструктивным шапероном". Усиление деградации неправильно локализованного опсина таким средством уменьшает количество неправильно локализованного белка, тем самым ослабляя стресс фоторецепторных клеток, предотвращая снижение жизнеспособности и гибель фоторецепторных клеток при различных заболеваниях,связанных с потерей зрения, а также при естественном связанном с возрастом ослаблении зрения при тусклом свете, и периферического зрения, опосредованного палочками, центрального зрения, опосредованного колбочками, и при потере ночного зрения. В вышеизложенных вариантах офтальмологическое состояние представляет собой одну или более из влажных или сухих форм макулярной дегенерации, пигментный ретинит, ретинальную или макулярную дистрофию, болезнь Старгардта, дистрофию Сорсби, аутосомально-доминантные друзы, дистрофию Беста, мутации периферина, связанные с макулярной дистрофией, доминантную форму болезни Старгардта, макулярную дистрофию Северной Каролины, светотоксичность, пигментный ретинит, естественную потерю зрения, связанную со старением, и естественную потерю ночного зрения, связанную со старением. Опсин, GPCR (сопряженный с G-белком рецептор), ответственный за зрение, легко регенерирует с 11-цис-ретиналем с образованием зрительного пигмента родопсина. Указанный пигмент вырабатывается за счет образования протонированного основания Шиффа между альдегидной группой 11-цис-ретиналя и-аминогруппой L-лизина опсина (Matsumoto and Yoshizawa, Nature 1975 Dec 11;258(5535):523-6). Таким образом, в настоящем изобретении предложены композиции и способы использования малых молекул соединений, которые связываются с опсинами дикого типа и мутантными опсинами и конкурируют или другим образом предотвращают комбинирование 11-цис-ретиналя с опсином с образованием родопсина и тем самым ингибируют образование 11-цис-ретиналя и других продуктов цикла пре- 13021747 вращений родопсина. Связывание с указанным сайтом можно предсказать по эффективности, с которой лиганд способен вытеснять и/или замещать воду в различных сайтах гидратации в 11-цис-карманах связывания ретиналя,как определено с помощью методики "водной карты". Сайты гидратации, обозначаемые как "R" (фиг. 1 демонстрирует сайты гидратации как кружки или сферы), которые заняты водой, которая, как предполагают, имеет водородсвязывающие взаимодействия с белком. Таким образом, лиганды, которые вытесняют указанную воду, будут, в идеале, иметь соответствующим образом ориентированную функциональность, когда лиганд связывается с заменой указанных водородных связей, которые разрушены в процессе занятия указанным соединением кармана связывания. В соответствии с настоящим изобретением эффективность связывания лиганда возрастает за счет соединений, которые эффективно вытесняют существенно нестабильно воду из кармана связывания опсина. Занятие кармана фармакологическим шапероном создает взаимодействие между лигандом и белком, которое вызывает правильную укладку и/или стабилизацию природной трехмерной конформации белка, что приводит к тому, что указанный белок соответствующим образом процессируется и мигрирует в правильное положение в клеточной мембране. Альтернативно, сайты гидратации, помеченные как "D" (фиг. 1), локализуют воду, которая находится в гидрофобном окружении, и поэтому она оптимальна для связывания соединения для замещения всей указанной воды неполярными заместителями, которые дополняют гидрофобное окружение белка. Таким образом, замещение воды в гидрофобном окружении при замене водородных связей воды в сайтах гидратации, которые, как предполагают, имеют водородсвязывающие взаимодействия с белком, функциональностью на лиганде, который может действовать как водный миметик, когда указанная вода вытесняется, приводит к оптимальной активности и эффективности. Альтернативно, вытеснение воды в сайтах гидратации, помеченных как "D" на фиг. 1, и оставление воды в сайтах гидратации, помеченных как "R" (представлено на фиг. 1), нетронутой, таким образом, что их окружение с лигандной связью не оказывает вредного воздействия на внутреннюю стабильность указанной воды в кармане в отсутствии занятия лигандом, приводит к активным и эффективным соединениям. Сайты гидратации имеют предсказанную локализацию воды в отсутствии лиганда на основании карты гидратации. Связывание лиганда настоящего изобретения может происходить по одному из четырех возможных механизмов: (i) вытеснение воды, занимающей сайт гитдратации, (ii) замена водородной связи между белком и водой в сайте гидратации на функциональность лиганда, (iii) связывание лиганда и оставление воды в сайте гидратации интактной, и (iv) образование расширенной сетки водородных связей с водой в сайте гидратации, но при этом не вытесняя ее. В одном варианте в настоящем изобретении предложены опсинсвязывающие лиганды формулы (I) и их фармацевтически приемлемые соли: 3) -СН 3 каждый Rc и Rd независимо представляет собой: 1) водород; 2) алкокси; 3) низший алкил или 4) алкенил; каждый R9, R14 и R16 независимо представляет собой: 1) водород; или 2) -СН 3; каждый R22 и R23 независимо представляет собой: 1) водород или 2) низший алкил; каждый R24 и R25 независимо представляет собой: 1) водород или 2) -СН 3;R24 и R25, взятые вместе, могут образовать оксо; В самых широких вариантах R1, R2 и R3 независимо представляют собой низший алкил. В предпочтительных вариантах полученное соединение имеет структурную формулу I, где V представляет собой: и где каждый а и b независимо представляет собой 1 или 2, более предпочтительно, где по меньшей мере один из а или b представляет собой 1, наиболее предпочтительно, где оба а и b представляют собой 1, X представляет собой водород, R23, R24 и R25 представляют собой водород, Y представляет собой СC(O)NR22R23 или N-C(O)NR22R23, и оба R22 и R23 представляют собой водород. В предпочтительных примерах настоящего изобретения указанное соединение имеет структурную формулу I, где А представляет собой: В предпочтительных вариантах изобретения один или более из R1 и R2 представляет собой метил,более предпочтительно оба представляют собой метил, и R3 представляет собой водород или метильную группу. В других предпочтительных вариантах Ra и Rb независимо представляют собой водород, дейтерий или метил, предпочтительно водород или метил, Rc и Rd предпочтительно представляют собой водород или низший алкил, наиболее предпочтительно водород или метил. В другом предпочтительном примере соединение имеет структурную формулу I, где А представляет собой В предпочтительных вариантах изобретения каждый R1, R2 и R3 представляет собой метил и R24 представляет собой метил или водород, предпочтительно водород. В других конкретных вариантах Ra и Rb независимо представляют собой водород, дейтерий или метил, предпочтительно водород или метил, Rc и Rd представляют собой водород, низший алкил, алкокси или алкоксиметил, более предпочтительно водород, алкокси или низший алкил, наиболее предпочтительно водород. В другом предпочтительном примере соединение имеет формулу I, где В представляет собой-СН=СН-, -СН 2-СН 2- или -CH2-N(R22)-, предпочтительно -СН=СН или -СН 2-СН 2- и наиболее предпочтительно -СН=СН-. В другом предпочтительном примере соединение имеет формулу I, где Q представляет собой -С(O)или -СН 2-, наиболее предпочтительно -С(О)-. В другом предпочтительном примере соединение имеет формулу I, где X представляет собой водород, низший алкил или -C=CR9, более предпочтительно водород или -C=CR9, где R9 представляет собой водород или метил. В другом предпочтительном примере соединение имеет формулу I, где Y представляет собой кислород или N-C (О)-R22R23, более предпочтительно N-C(О) -NR22R23, наиболее предпочтительно N-C(O)NR22R23, где R22 и R23 представляют собой водород. В другом предпочтительном примере соединение имеет формулу I, где каждый R24 и R25 представляет собой водород. В конкретных вариантах опсинсвязывающее соединение формулы I представляет собой (номер каждого соединения соответствует номеру примера, в котором это соединение получено): включая все их фармацевтически приемлемые соли или их гидраты или сольваты. Названия всех соединений приведены в соответствии с ChemBioDraw 11.0.1. Особенно предпочтительные примеры соединений настоящего изобретения и способы применения указанных соединений включают соединения табл. 1 и также выбраны из одной или более из групп, состоящих из соединений 6, 13, 14, 22, 33, 34, 37, 44, 45, 50, 51 а, 51b, 52, 53, 55, 57, 60b, 63, 69, 71, 72, 73,80, 84, 105, 106, 107, 108, 109 и 110, включая все их фармацевтически приемлемые соли, сольваты и гидраты. В другом варианте настоящего изобретения предложены метаболиты опсинсвязывающих лигандов опсинсвязывающих соединений. Указанные метаболиты включают, но ими не ограничиваются, продукты деградации, продукты гидролиза, аддукты глюкуронида и т.п., опсинсвязывающих соединений и их фармацевтически приемлемых солей, соединений опсина. В другом варианте настоящего изобретения предложены способы получения новых соединений настоящего изобретения и промежуточных соединений, которые можно использовать в таких способах. Реакции осуществляют в растворителях, соответствующих реагентам и используемым материалам, пригодным для осуществления превращений. Специалистам в области органического синтеза следует понимать, что присутствующая в молекуле функциональность должна быть совместимой с предполагаемым химическим превращением. Это требует в каждом случае суждения специалиста относительно порядка стадий синтеза, требуемых защитных групп и условий удаления защитных групп. Заместители у исходных материалов могут быть совместимы с некоторыми из условий реакций, необходимых в некоторых раскрытых способах, но альтернативные способы и заместители, совместимые с условиями реакций, будут легко понятны специалистам в данной области. Использование защитных групп для серы, азота и кислорода хорошо известно для защиты групп тиола, аминогрупп и спиртовых групп от нежелательных реакций во время стадий синтеза, и многие такие защитные группы известны и раскрыты, например, в(1999). Соединения настоящего изобретения, которые содержат один или более из асимметрических атомов углерода, могут существовать в виде оптически чистых энантиомеров, чистых диастереоизомеров,смесей энантиомеров, смесей диастереоизомеров, рацемических смесей энантиомеров, диастереоизомерных рацематов или смесей диастереоизомерных рацематов. Следует понимать, что настоящее изобретение антиципирует и включает в свой объем все такие изомеры и их смеси. Описываемые здесь химические реакции обычно раскрываются в терминах их наиболее широкого применения к получению соединений настоящего изобретения. Иногда бывают случаи, когда реакции не могут быть применимы, как раскрыто, к каждому из соединений, включенных в раскрытый объем изобретения. Соединения, к которым это относится, хорошо известны специалистам в данной области. Во всех таких случаях любые такие реакции можно с успехом осуществить, используя обычные модификации, известные специалистам в данной области, например, осуществляя соответствующую защиту взаимодействующих групп, заменяя на альтернативные обычные реагенты, осуществляя рутинные модификации условий реакции или осуществляя другие раскрытые здесь реакции или другие обычные реакции,которые будут применимы для получения соответствующих соединений настоящего изобретения. Во всех способах получения все исходные материалы известны или их можно легко получить из известных исходных материалов. Способы настоящего изобретения В настоящем изобретении предложен способ применения соединений формулы I для уменьшения образования токсичных продуктов цикла превращений родопсина, включающий осуществление контактирования опсинового белка с малыми молекулами - лигандами, которые обратимо связываются с указанным опсиновым белком, для ингибирования связывания 11-цис-ретиналя в указанном кармане связывания, тем самым уменьшая образование токсичных продуктов цикла превращений родопсина, связанного с влажной или сухой ARMD, и уменьшая апоптоз фоточувствительных клеток, связанный с избыточной активацией родопсина в результате стимуляции ярким светом. В настоящем изобретении также предложен способ применения соединений формулы I для лечения, предотвращения или уменьшения риска светотоксичности для млекопитающего, включающий введение млекопитающему, которое подвержено риску развития офтальмологического состояния, которое связано с образованием или накоплением продуктов цикла превращений родопсина или апоптотической гибелью фоточувствительных клеток. В настоящем изобретении также предложен способ применения соединений формулы I для лечения, предотвращения или уменьшения риска светотоксичности для млекопитающего, включающий введение млекопитающему, которое подвержено риску развития офтальмологического состояния, которое связано с образованием или накоплением продуктов цикла превращений родопсина или апоптотической гибелью фоточувствительных клеток, эффективного количества указанных малых клеток лиганда, который обратимо связывается (например, у или вблизи кармана связывания ретиналя) с опсиновым белком,присутствующим в глазу указанного млекопитающего, например, для ингибирования связывания 11-цисретиналя в указанном кармане связывания, тем самым уменьшая светотоксичность и апоптоз фоточувст- 20021747 вительных клеток. В настоящем изобретении также предложен способ применения соединений формулы I для лечения, предотвращения или уменьшения риска возникновения RP у млекопитающего, включающий введение млекопитающему, подверженному риску RP, связанному с неправильной укладкой и миграцией мутантных опсинов, эффективного количества указанных малых клеток лиганда, который обратимо связывается (например, у или вблизи кармана связывания ретиналя) с опсиновым белком, присутствующим в глазу указанного млекопитающего, например, для ингибирования связывания 11-цис-ретиналя в указанном кармане связывания, тем самым уменьшая потерю зрения, вызываемую RP. В конкретных примерах таких способов, малые молекулы лиганда селективны в отношении связывания с опсином, и/или малые молекулы лиганда связываются с указанным опсином в кармане связывания ретиналя указанного опсинового белка, и/или малые молекулы лиганда связываются с указанным опсиновым белком таким образом, что ингибируют ковалентное связывание 11-цис-ретиналя с указанным опсиновым белком, когда указанный 11-цис-ретиналь контактирует с указанным опсиновым белком, когда указанные малые молекулы лиганда присутствуют и/или когда млекопитающим является человек. В одном варианте светотоксичность связана с офтальмологической процедурой, например офтальмологической операцией. Указанное средство можно вводить до, во время или после указанной операции(или в любое одно или более из указанных времен). В конкретных вариантах настоящего изобретения природный опсиновый белок присутствует в клетке, такой как палочкоподобная клетка, предпочтительно млекопитающего, и более предпочтительно в человеческой клетке. В конкретных вариантах малые молекулы лигандов настоящего изобретения связываются с 11-цис-ретиналем в кармане связывания опсина и замедляют цикл превращений родопсина,тем самым уменьшая образование 11-транс-ретиналя или токсичных продуктов цикла превращений родопсина, образующихся из него, таких как липофусцин или N-ретинилиден-N-ретинилэтаноламин (А 2 Е). Альтернативно, апоптоз фоточувствительных клеток в результате избыточной активации родопсина уменьшается или предотвращается за счет ингибирования образования родопсина. Кроме того, уменьшается неправильная укладка и миграция мутантных опсиновых белков, связанных с RP. В способах настоящего изобретения введение предпочтительно осуществляют, используя местное введение (такое как глазная примочка) или системное введение (включая пероральное, интраокулярные инъекции или окологлазные инъекции). Предпочтительным примером офтальмологических состояний, подлежащих лечению, является светотоксичность, такая, которая возникает при глазных операциях, например операциях на сетчатке или при удалении катаракты. Включена также офтальмологическая композиция, включающая эффективное количество соединений формулы I в фармацевтически приемлемом носителе, где указанное средство обратимо нековалентно связывается (например, у или вблизи кармана связывания ретиналя) с указанным опсиновым белком,ингибируя связывание 11-цис-ретиналя в указанном кармане, предпочтительно, где малые молекулы лиганда селективны в отношении опсинового белка. Далее в настоящем изобретении предложен способ скрининга для идентификации малых молекул лиганда, который уменьшает светотоксичность для глаза млекопитающего, включающий:(а) осуществление контактирования природного опсинового белка с тестируемым соединением в присутствии 11-цис-ретиналя и в условиях, которые промотируют связывание тестируемого соединения и 11-цис-ретиналя с природным опсиновым белком; и(b) определение обратимого уменьшения скорости образования родопсина относительно скорости,когда указанное тестируемое соединение отсутствует, тем самым идентифицируя указанное тестируемое соединение как малую молекулу лиганда, который уменьшает светотоксичность для глаза млекопитающего. В предпочтительном варианте указанное тестируемое соединение структурно родственно раскрытому здесь соединению. В типичном конкурентном анализе настоящего изобретения ищут соединение, которое будет "завязывать" карман связывания ретиналя опсинового белка. Таким образом, указанный анализ позволяет определить малые молекулы опсинсвязывающего соединения (соединения, которое не будет сильно регулироваться сетчаткой в зависимости от количества входящих палочкоподобных клеток), которое конкурирует с или предотвращает образование родопсина или изородопсина из 11-цис-ретиналя или 9-цисретиналя. Со временем это замедляет скорость образования родопсина относительно скорости в случае,когда присутствует только 11-цис-ретиналь. В одном варианте указанный анализ осуществляют в присутствии 11-цис-ретиналя, и скорость образования родопсина измеряют как способ определения конкуренции за карман связывания ретиналя, например, определяя скорость увеличения пика на длине волны 500 нм, характеристического для родопсина. Для указанного анализа не требуются антитела для родопсина. Подходящее соединение продемонстрирует скорость образования родопсина, которая по меньшей мере примерно в 2-5 раз ниже, чем скорость, которая наблюдается в присутствии 11-цис-ретиналя, если указанное тестируемое соединение отсутствует. Соединения формулы I можно вводить вместе с другими средствами, включая минеральные добав- 21021747 ки, противовоспалительные средства, такие как стероиды, например кортикостероиды, и/или антиоксиданты. Среди кортикостероидов, которые можно использовать для такого введения, находятся такие,которые выбирают из группы, состоящей из кортизона, гидрокортизона, преднизона, преднизолона, метилпреднизолона, триамцинолона, бетаметазона, бекламетазона и дексаметазона. Подходящие антиоксиданты включают витамин А, витамин С и витамин Е. Способы настоящего изобретения также рассматривают уменьшение светотоксичности за счет использования по меньшей мере одного дополнительного средства (в дополнении к соединению формулыI, которое выбирают из группы, состоящей из протеосомального ингибитора, ингибитора аутофагии, лизосомального ингибитора, ингибитора транспорта белка из ER в комплекс Гольджи, ингибитора Hsp90 шаперона, активатора реакции на тепловой шок, ингибитора гликозидазы и ингибитора гистондеацетилазы, где связывающиеся с опсином малые молекулы и дополнительное соединение вводят одновременно или одно за другим с интервалом в четырнадцать дней в количествах, достаточных для лечения субъекта. В конкретном примере способов настоящего изобретения соединения формулы I и дополнительное соединение вводят одно за другими с интервалом в десять дней, одно за другим с интервалом в пять дней, одно за другим с интервалом в двадцать четыре часа и предпочтительно вводят одновременно. В одном примере связывающиеся с опсином малые молекулы и дополнительное соединение вводят непосредственно в глаз. Такое введение может быть интраокулярным или интравитреальным. В других примерах связывающиеся с опсином малые молекулы и дополнительное соединение, каждые, включают в композицию, которая обеспечивает их длительное высвобождение, такое, как в случаях, когда указанная композиция представляет собой часть микросферы, наносферы, наноэмульсии или импланта. Как здесь раскрыто, соединения формулы I, которые можно использовать в способах настоящего изобретения, пригодны для использования отдельно или в комбинации с одним или более дополнительными соединениями для лечения или предотвращения состояний, связанных с избыточной активацией родопсина, таких как светотоксичность, например, возникших в результате глазных операций. В одном варианте соединения формулы I настоящего изобретения вводят без дополнительного активного соединения. В другом варианте соединения формулы I настоящего изобретения используют в комбинации и с другим активным соединением (например, как здесь раскрыто). В еще другом примерном варианте соединения формулы I вводят в комбинации с протеасомальным ингибитором MG132, ингибитором аутофагии 3-метиладенином, лизосомальным ингибитором аммонийхлоридом, ингибитором транспорта ERкомплекс Голджи брефелдином А, ингибитором Hsp90 шаперона гелдамицином, активатором реакции термического шока целастролом, ингибитором гликозидазы и ингибитором гистондеацетилазы скриптаидом, для уменьшения образования продуктов цикла превращений родопсина и клеточного апоптоза как результата избыточной активации родопсина. Как здесь раскрыто, соединения формулы I, которые можно использовать в способах настоящего изобретения, доступны для использования отдельно или в комбинации с одним или более дополнительными соединениями для лечения или предотвращения аберрантного процессинга и миграции мутантных опсиновых белков, связанных с гибелью палочкоподобных клеток в результате RP. В одном варианте соединения формулы I настоящего изобретения вводят без дополнительных активных соединений. В другом варианте соединения формулы I настоящего изобретения используют в комбинации и с другим активным соединением (например, как здесь раскрыто). В еще другом примерном варианте соединения формулы I вводят в комбинации с протеасомальным ингибитором MG132, ингибитором аутофагии 3 метиладенином, лизосомальным ингибитором аммонийхлоридом, ингибитором транспорта ER-комплекс Гольджи брефелдином А, ингибитором Hsp90 шаперона гелдамицином, активатором реакции термического шока целастролом, ингибитором гликозидазы и ингибитором гистондеацетилазы скриптаидом, для уменьшения или предотвращения гибели палочкоподобных клеток и в результате слепотой, связанной сRP. Как здесь раскрыто, соединения формулы I, которые можно использовать в способах настоящего изобретения, доступны для использования отдельно или в комбинации с одним или более дополнительными соединениями для лечения или предупреждения состояний, связанных с продуцированием и накоплением токсичных продуктов цикла превращений родопсина, образующихся из 11-транс-ретиналя, таких как липофуцин и А 2 Е, например, слепоты, связанной с влажной или сухой ARMD. В одном варианте соединения формулы I настоящего изобретения вводят без дополнительного активного соединения. В другом варианте соединения формулы I настоящего изобретения можно использовать в комбинации и с другим активным соединением (например, как здесь раскрыто). В еще другом примерном варианте соединения формулы I вводят в комбинации с протеасомальным ингибитором MG132, ингибитором аутофагии 3-метиладенином, лизосомальным ингибитором аммонийхлоридом, ингибитором транспорта ERкомплекс Гольджи брефелдином А, ингибитором Hsp90 шаперона гелдамицином, активатором реакции термического шока целастролом, ингибитором гликозидазы и ингибитором гистондеацетилазы скриптаидом, для уменьшения образование токсичных метаболитов продуктов цикла превращений родопсина и гибели фоточувствительных клеток в результате сухой ARMD. В конкретных вариантах способов настоящего изобретения неправильно упакованный опсиновый белок включает мутацию в своей аминокислотной последовательности, например одну из мутаций Т 17 М, P347S или Р 23 Н, предпочтительно Р 23 Н. Предпочтительно в любом из способов настоящего изобретения опсинсвязывающее средство связывается с опсином в кармане связывания ретиналя. В одном аспекте в настоящем изобретении предложен способ ингибирования образования или накопления продуктов цикла превращений родопсина, включающий осуществление контактирования опсинового белка с соединением, которое уменьшает гидратацию указанного опсинового белка, предпочтительно, где указанное соединение конкурирует с одной или более молекулами воды за связывание с опсином. В конкретных вариантах таких способов указанное соединение связывается химически с опсиновым белком, например, за счет водородного связывания. В конкретных примерах способов настоящего изобретения соединение, которое можно использовать в способе настоящего изобретения, может связываться с опсином по любому сайту гидратации, находящемуся внутри кармана связывания ретиналя молекулы опсина столь долго, что указанное связывание исключает полностью, или частично, связывание одной или более молекул воды в указанном кармане связывания. Предпочтительно, чтобы соединение, используемое в таком способе, связывалось таким образом, чтобы занять левую сторону кармана связывания, как представлено на фиг. 1, и заменить воду в сайтах гидратации 5-20 (нумерация кружков на фиг. 1), более предпочтительно, чтобы связывалось таким образом, чтобы заменить воду в сайтах гидратации 5-20, и воду в сайтах гидратации 3 или 4, как представлено на фиг. 1, вытеснить и заменить функциональностью лиганда, который имитирует водородсвязывающие взаимодействия, которые указанная вода, как предполагают, имеет с остатками у белка. Конкретный пример указанных способов рассматривает связывание соединения за счет химического взаимодействия с Cys187 или Glu113 опсинового белка. В отдельных вариантах настоящего изобретения указанное взаимодействие существует с Cys187, или указанное взаимодействие существует с Glu113,или существует с обоими сайтами. Предпочтительным типом указанного взаимодействия является водородное связывание. В других конкретных примерах указанное взаимодействие происходит с карбонильной группой опсинового белка. В конкретных вариантах указанный карбонил находится у Cys187 или Glu113 указанного опсинового белка. Отдельные варианты включают случаи, когда указанный карбонил находится уCys187 опсинового белка или когда указанный карбонил находится у Glu113 опсинового белка. В одном варианте указанный карбонил находится в гамма-карбоксильной группе Glu113 опсинового белка. Предпочтительным вариантом является тот, где взаимодействие осуществляется через группу амина, карбоксамидо или мочевины соединения. Хотя использование любого из раскрытых здесь соединений в качестве средства уменьшения гидратации в кармане связывания опсина следует рассматривать как предпочтительный вариант такого способа, уменьшение образования продуктов цикла превращений родопсина за счет уменьшения образования родопсина является основным способом настоящего изобретения для уменьшения образования таких продуктов цикла превращений родопсина, особенно продуцирования липофусцина и/или А 2 Е, и для лечения офтальмологических заболеваний путем уменьшения указанной гидратации является основной целью настоящего изобретения, и нет необходимости ограничивать его объем только использованием раскрытых здесь химических соединений, но можно включить использование других известных или тех,что еще будут известны, химических соединений поскольку они функционируют в способах настоящего изобретения и уменьшают гидратацию (т.е. связывание воды) в кармане связывания ретиналя опсина. Следует заметить, что раскрытые здесь соединения для использования в способах настоящего изобретения могут не действовать в плане уменьшения гидратации в кармане связывания ретиналя опсина,но все еще могут функционировать в одном или более из способов настоящего изобретения. Например,соединения формулы I могут связываться с аллостерическим сайтом белка, тем самым, исключая ретиналь из сайта связывания ретиналя без необходимости уменьшения гидратации, но все еще уменьшая образование продуктов цикла превращений родопсина, таких как липофусцин и/или А 2 Е, за счет исключения ретиналя из кармана связывания, таким образом нековалентно уменьшая активность цикла превращений родопсина. В вариантах любой из композиций и способов настоящего изобретения, опсинсвязывающее средство (например, неретиноидное связывающее средство) является селективным для связывания с опсином. Такую селективность не следует понимать как требование исключительности того, что указанное средство может связываться с другими белками также как с опсином, но его связывание с опсином будет, по меньшей мере, селективным, в результате чего константа связывания (или константа диссоциации) для связывания с опсином будет меньше, чем среднее значение для связывания с другими белками, которые также связывают ретиноиды, такие как аналоги ретиналя. Предпочтительно, чтобы опсинсвязывающие средства были бы неретиноидными опсинсвязывающими средствами, которые нековалентно связываются с опсином. Предпочтительно, если опсинсвязывающее средство связывается у или вблизи кармана связывания ретиналя опсина, где обычно связывается природный лиганд, 11-цис-ретиналь. Без желания связываться с какой-либо теорией, в одном варианте карман связывания вмещает ретиналь или средство настоящего изобретения, но не оба. Соответственно, если средство настоящего изобретения связано у или вблизи кармана связывания рети- 23021747 наля, другие ретиноиды, такие как 11-цис-ретиналь, уже не могут связываться с опсином. Связывание средства настоящего изобретения внутри кармана связывания ретиналя неправильно упакованной молекулы опсина приводит к образованию природной или дикого типа конформации молекулы опсина или к стабилизации правильно упакованного опсинового белка, тем самым облегчая встраивание теперь правильной конформации опсина в мембраны палочкоподобных клеток. И снова без желания связываться какой-либо теорией, указанное встраивание может помочь сохранить конформацию опсина дикого типа,и опсинсвязывающее средство может свободно диффундировать из кармана связывания, после чего указанный карман доступен для связывания с ретиналем с образованием светочувствительного родопсина. Предложены другие способы настоящего изобретения для восстановления фоторецепторной функции глаза млекопитающего, содержащего неправильно упакованный опсиновый белок, что вызывает снижение фоторецепторной функции, включающие осуществление контактирования указанного неправильно упакованного опсинового белка с опсинсвязывающим средством (например, неретиноидным),которое обратимо связывается (например, которое связывается нековалентно) у или вблизи кармана связывания ретиналя. В других вариантах связывание опсинсвязывающего средства с неправильно упакованным опсиновым белком конкурирует с 11-цис-ретиналем за связывание в указанном кармане связывания. Желательно, чтобы при связывании опсинсвязывающего средства восстанавливалась природная конформация указанного неправильно упакованного опсинового белка. В предпочтительных вариантах глазом млекопитающего является человеческий глаз. В дополнительных вариантах указанное осуществление контактирования происходит путем введения указанного опсинсвязывающего средства (например, неретиноида) млекопитающему с офтальмологическим состоянием, таким как состояние, характеризующееся пониженной фоторецепторной функцией. В различных вариантах указанное состояние представляет собой влажную или сухую форму макулярной дегенерации,диабетический RP, ретинальную или макулярную дистрофию, болезнь Старгардта, дистрофию Сорсби,аутосомально-доминантные друзы, дистрофию Беста, мутации периферина, связанные с макулярной дистрофией, доминантную форму болезни Старгардта, макулярную дистрофию Северной Каролины,светотоксичность (например, связанную с операцией на сетчатке), или пигментный ретинит. Способ введения может быть местным введением или системным введением, причем последнее включает пероральное введение, интраокулярные инъекции или окологлазные инъекции. Местное введение может включать, например, глазные капли, содержащие эффективное количество средства настоящего изобретения в подходящем фармацевтическом носителе. В другом варианте в настоящем изобретении также предложен способ стабилизации мутантного опсинового белка, включающий осуществление контактирования указанного мутантного опсинового белка с неретиноидным опсинсвязывающим средством, которое обратимо связывается нековалентно(например, у кармана или в кармане связывания ретиналя) с указанным мутантным опсиновым белком,предотвращая связывание ретиноида в указанном кармане связывания, тем самым стабилизируя указанный мутантный опсиновый белок. В настоящем изобретении также предложен способ уменьшения потери фоторецепторной функции глаза млекопитающего, включающий введение эффективного количества опсинсвязывающего средства,такого как неретиноид, млекопитающему с мутантным опсиновым белком, который обладает пониженным сродством в отношении 11-цис-ретиналя, за счет чего опсинсвязывающее средство обратимо связывается (например, нековалентно) с карманом связывания ретиналя указанного мутантного опсина, тем самым уменьшая потерю фоторецепторной функции глаза указанного млекопитающего. В одном варианте осуществление контактирования происходит путем введения указанного опсинсвязывающего средства млекопитающему с указанной пониженной фоторецепторной функцией, где указанное введение может быть местным введением или системным введением, причем последнее включает пероральное введение,интраокулярные инъекции или окологлазные инъекции, и первое включает использование глазных капель, содержащих средство настоящего изобретения. Такая потеря фоторецепторной функции может быть частичной потерей или полной потерей, и в случае частичной потери она может быть любой степени между потерей 1% и потерей 99%. Кроме того, такая потеря может быть связана с присутствием мутации, которая вызывает неправильную укладку опсина, такой как Р 23 Н мутация. В другом варианте опсинсвязывающее средство вводят для облегчения офтальмологического состояния, связанного с неправильной локализацией опсинового белка. В одном варианте в настоящем изобретении предложен способ лечения субъекта с сухой формой возрастной макулярной дегенерации, где по меньшей мере часть опсина, присутствующего в фоторецепторной клетке глаза (например, палочноподобной клетке или колбочкоподобной клетке), неправильно локализована. Такой неправильно локализованный белок не может быть встроен в мембрану фоторецепторной клетки, где его функция необходима для зрения. Введение опсинсвязывающего средства субъекту с неправильно локализованным опсиновым белком исправляет, по меньшей мере частично, локализацию опсина. Соответственно, настоящее изобретение можно использовать для предотвращения или лечения офтальмологических состояний, связанных с неправильной локализацией опсина, или для облегчения симптомов указанных состояний. В настоящем изобретении предложен способ лечения и/или предотвращения офтальмологических состояний или их симптомов, включая, но ими не ограничиваясь, влажную или сухую форму макулярной дегенерации, пигментный ретинит, ретинальную или макулярную дистрофию, болезнь Старгардта, дистрофию Сорсби, аутосомально-доминантные друзы, дистрофию Беста, мутации периферина, связанные с макулярной дистрофией, доминантную форму болезни Старгардта, макулярную дистрофию Северной Каролины, светотоксичность (например, связанную с операцией на сетчатке), или пигментный ретинит у субъекта, такого как пациент-человек, включающий введение субъекту, пораженному или рискующему развитием одного из вышеуказанных состояний или других офтальмологических состояний, связанных с экспрессией неправильно упакованного или неправильно локализованного опсинового белка, используя терапевтически эффективное количество опсинсвязывающего средства, например средства, которое демонстрирует позитивную активность при тестировании в любом одном или более из анализов скринирования настоящего изобретения. Такой способ может также включать введение указанному субъекту по меньшей мере одного дополнительного средства, выбранного из группы, состоящей из протеосомального ингибитора, ингибитора аутофагии, лизосомального ингибитора, ингибитора транспорта белка из ER в комплекс Гольджи, ингибитора Hsp90 шаперона, активатора реакции на тепловой шок, ингибитора гликозидазы и ингибитора гистондеацетилазы, где опсинсвязывающее соединение и дополнительное соединение вводят одновременно или в течение четырнадцати дней одно за другим в количествах, достаточных для лечения субъекта. И снова, у пациента может существовать мутация, которая влияет на укладку белка, где указанная мутация (мутации) вызывает неправильную укладку, например, в опсиновом белке, и может быть любой из перечисленных здесь мутаций, таких как Р 23 Н мутация. В других вариантах у пациента существует офтальмологическое состояние, которое связано с неправильной локализацией опсинового белка. Неправильно локализованный опсин не может встраиваться в фоторецепторные клетки мембраны (например,палочкоподобную или колбочкоподобную клетку). Обычно такое отсутствие соответствующей локализации влияет только на часть опсина, присутствующего в клетке глаза пациента. В конкретных примерах способов настоящего изобретения опсинсвязывающее соединение и дополнительное соединение вводят одно за другим с интервалом десять дней, более предпочтительно одно за другим с интервалом пять дней, еще более предпочтительно одно за другим с интервалом двадцать четыре часа и наиболее предпочтительно вводят одновременно. В одном примере опсинсвязывающее соединение и дополнительное соединение вводят непосредственно в глаз. Такое введение может быть интраокулярным. В других примерах опсинсвязывающее соединение и дополнительное соединение, каждое, включают в композицию, которая обеспечивает их длительное высвобождение, например, такую,как те, где указанная композиция представляет собой часть микросферы, наносферы или наноэмульсии. В одном примере указанную композицию вводят, используя систему доставки лекарства, которая обеспечивает длительное его высвобождение. Такие способы также включают введение добавки - витамина А вместе со средством настоящего изобретения. Как здесь раскрыто, опсинсвязывающие средства, которые можно использовать в способах настоящего изобретения, доступны для использования отдельно или в комбинации с одним или более дополнительными соединениями для лечения или предупреждения состояний, связанных с влажной или сухой формой макулярной дегенерации, пигментным ретинитом, ретинальной или макулярной дистрофией,болезнью Старгардта, дистрофией Сорсби, аутосомально-доминантными друзами, дистрофией Беста,мутациями периферина, связанными с макулярной дистрофией, доминантной формой болезни Старгардта, макулярной дистрофией Северной Каролины, светотоксичностью (например, связанной с операцией на сетчатке), пигментным ретинитом или другими офтальмологическими состояниями, связанными с экспрессией неправильно упакованного или неправильно локализованного опсинового белка. В одном варианте опсинсвязывающее соединение настоящего изобретения (например, неретиноид или ретиноид,который не может ковалентно связываться с опсином) вводят субъекту, у которого развивается такое состояние или существует риск развития такого состояния. Необязательно, опсинсвязывающее средство вводят вместе с другим терапевтическим средством. В другом варианте неретиноидное опсинсвязывающее соединение настоящего изобретения используют в комбинации с синтетическим ретиноидом (например, как раскрыто в патентной публикации США 2004-0242704), и необязательно с другим активным соединением (например, как здесь обсуждалось). В еще одном примерном варианте опсинсвязывающее соединение вводят в комбинации с протеасомальным ингибитором MG132, ингибитором аутофагии 3-метиладенином, лизосомальным ингибитором, таким как аммонийхлорид, ингибитором транспорта ER-комплекс Гольджи брефелдином А, ингибитором Hsp90 шаперона, гелдамицином, активатором реакции термического шока целастролом, ингибитором гликозидазы и/или ингибитором гистондеацетилазы скриптаидом, или любым другом средством, которое может стабилизировать мутантный Р 23 Н опсиновый белок в биологически функциональной конформации, которая обеспечивает его ассоциацию с 11-цис-ретиналем с образованием родопсина. В конкретных вариантах опсинсвязывающее соединение является неполимерным (например, малой молекулой, такой, как те, что раскрыты здесь для использования в способах настоящего изобретения) соединением с молекулярным весом менее чем около 1000, менее чем 800, менее чем 600, менее чем 500,менее чем 400 или менее чем около 300 Да. В некоторых вариантах соединение настоящего изобретения увеличивает количество (например, вне или в клетке) стабильно упакованного и/или закомплексованного мутантного белка на по меньшей мере 10, 15, 20, 25, 50, 75 или 100% по сравнению с необработанной контрольной клеткой или белком. Протеасомальные ингибиторы 26S протеасома представляет собой мультикаталитическую протеазу, которая расщепляет убиквитинированные белки на короткие пептиды. MG-132 представляет собой один протеасомальный ингибитор, который можно использовать. MG-132 наиболее подходит для лечения светотоксичности и других глазных болезней, связанных с накоплением продуктов циклапревращений родопсина (например, 11 транс-ретиналя, А 2 Е, липофусцина), агрегаций белка или с неправильной укладкой белка. Другие протеасомальные ингибиторы, которые можно использовать в комбинации с настоящим изобретением в способах настоящего изобретения, включают лактоцистин (LC), класто-лактоцистин-бета-лактон, PSI (Nкарбобензоил-Ile-Glu-(OtBu)-Ala-Leu-CHO), MG-132 (N-карбобензоил-Leu-Leu-Leu-СНО), MG-115 (Nкарбобензоил-Leu-Leu-Nva-CHO), MG-101 (N-ацетил-Leu-Leu-norLeu-CHO), ALLM (N-Ацетил-Leu-LeuMet-СНО),N-карбобензоил-Gly-Pro-Phe-leu-CHO,N-карбобензоил-Gly-Pro-A1a-Phe-СНО,Nкарбобензоил-Leu-Leu-Phe-CHO, и их соли или аналоги. Другие протеасомальные ингибиторы и их использование раскрыто в патенте США 6492333. Ингибитор аутофагии Аутофагия представляет собой эволюционно консервативный механизм деградации клеточных компонент в цитоплазме и является механизмом выживания клеток в голодающих клетках. Во время аутофагии частицы цитоплазмы инкапсулируются клеточными мембранами, образуя аутофагические вакуоли, которые впоследствии сливаются с лизосомами, для деградации их содержимого. Ингибиторы аутофагии можно использовать в комбинации с опсинсвязывающими или опсинстабилизирующими соединениями настоящего изобретения. Ингибиторы аутофагии, которые можно использовать в комбинации с настоящим изобретением в способах настоящего изобретения, включают, но ими не ограничиваются, 3-метиладенин, 3-метиладенозин, аденозин, окадаиковую кислоту, N6-меркаптопуринрибозид (N6MPR), аминотиолированный аналог аденозина, 5-амино-4-имидазолкарбоксамидрибозид (AICAR), бафиломицин А 1, и их соли или аналоги. Лизосомальные ингибиторы Лизосомы представляют собой основной сайт деградации клеточного белка. Деградация белков,попадающих в клетку за счет рецептор-опосредованного эндоцитоза или пиноцитоза, и плазменных мембранных белков происходит в лизосомах. Лизосомальные ингибиторы, такие как аммонийхлорид, леупептин, транс-эпоксисакцинил-Lлейциламид-(4-гуанидино)бутан, метиловый сложный эфир L-метионина, аммонийхлорид, метиламин,хлорохин и их соли или аналоги можно использовать в комбинации с опсинсвязывающими или опсинстабилизирующими соединениями настоящего изобретения. Ингибиторы HSP90 шаперона Белок теплового шока 90 (Hsp90) ответственен за шаперонирование белков, участвующих в сигнальной системе, пролиферации и выживании клеток, и важен для конформационной стабильности и функционирования ряда белков. HSP-90 ингибиторы можно использовать в комбинации с опсинсвязывающими или опсинстабилизирующими соединениями в способах настоящего изобретения. HSP90 ингибиторы включают бензохинон, ансамициновые антибиотики, такие как гелданамицин и 17 аллиламино-17-деметоксигелданамицин (17-AAG), которые специфически связываются с Hsp90, изменяют его функции и промотируют протеолитическое расщепление субстратных белков. Другие ингибиторы HSP-90 включают, но ими не ограничиваются, радицикол, новобиоцин и любые ингибиторы Hsp90,которые связываются с Hsp90 ATP/ADP карманом. Активатор реакции термического шока Целастрол, хинонметидтритерпен, активирует реакцию термического шока человека. В комбинации с опсинсвязывающими или опсинстабилизирующими соединениями в способах настоящего изобретения целастрол и другие активаторы реакции термического шока можно использовать для лечения PCD. Активаторы реакции термического шока включают, но ими не ограничиваются, целастрол, метиловый сложный эфир целастрола, дигидроцеластролдиацетат, бутиловый сложный эфир целастрола, дигидроцеластрол и их соли или аналоги. Ингибиторы гистондеацетилазы Регулирование генной экспрессии опосредовано несколькими механизмами, включая посттрансляционные модификации гистонов за счет динамического ацетилирования и деацетилирования. Ферменты, ответственные за обратимые процессы ацетилирования/деацетилирования представляют собой гистонацетилтрансферазы (HAT) и гистондеацетилазы (HDAC) соответственно. Ингибиторы гистондеацетилазы включают скриптаид, АРНА соединение 8, апицидин, бутират натрия, (-)-депудецин, сиртинол, трихостатин А, и их соли или аналоги. Такие ингибиторы можно использовать в комбинации с соединениями настоящего изобретения в раскрытых здесь способах. Ингибиторы гликозидазы Ингибиторы гликозидазы представляют собой один класс соединений, которые можно использовать в способах настоящего изобретения, если вводить в комбинации с опсинсвязывающими или опсинстабилизирующими соединениями настоящего изобретения. Кастаноспермин, полигидроксиалкалоид,выделенный из растительных источников, ингибирует ферментативный гидролиз гликозидов. Кастаноспермин и его производные особенно пригодны для лечения светотоксичности или нарушений, связанных с конформацией белка глаза, таких как RP. Также можно использовать в способах настоящего изобретения другие ингибиторы гликозидаз, включая австралийский гидрохлорид, 6-ацетамидо-6-деоксикастаноспермин, который представляет собой эффективный ингибитор гексозаминидаз, деоксифуконоджиримицин гидрохлорид (DFJ7), деоксиноджиримицин (DNJ), которые ингибируют глюкозидазы I и II,деоксигалактоноджиримицин гидрохлорид (DGJ), который ингибирует -D-галактозидазу, деоксиманноноджиримицин гидрохлорид (DM1), 2R,5R-бис(гидроксиметил)-3R,4R-дигидроксипирролидин(DMDP), известный также как 2,5-дидеокси-2,5-имино-D-маннит, 1,4-дидеокси-1,4-имино-В-маннитгидрохлорид, (3R,4R,5R,6R)-3,4,5,6-тетрагидроксиазепан гидрохлорид, который ингибирует b-N-ацетилглюкозаминидазу, 1,5-дидеокси-1,5-иминоксилитол, который ингибирует -глюкозидазу, и кифуненсин,ингибитор маннозидазы 1. В комбинации с опсинсвязывающим или опсинстабилизирующим соединением можно использовать также N-бутилдеоксиноджиримицин (EDNJ), N-нонил DNJ (NDND, N-гексилDNJ (15TDNJ), N-метилдеоксиноджиримицин (MDNJ) и другие ингибиторы гликозидазы, известные специалистам в данной области. Ингибиторы гликозидазы коммерчески доступны, например, из Industrial Research Limited (Wellington, New Zealand) и способы их использования раскрыты, например, в патентах США 4894388, 5043273, 5103008, 5844102 и 6831176; и в патентной публикации США 20020006909. Фармацевтические композиции В настоящем изобретении предложены фармацевтические препараты, включающие соединения вместе с фармацевтически приемлемыми носителями, где указанные соединения предложены для ингибирования продуктов цикла превращений родопсина, таких как 11-транс-ретиналь или другие продукты,образующиеся из 11-цис-ретиналя. Такие препараты имеют как терапевтическое, так и профилактическое применение. В одном варианте фармацевтические композиции включают опсинсвязывающее или опсинстабилизирующее соединение (например, соединение, идентифицируемое с помощью способов примера 1) или его фармацевтически приемлемые соли; необязательно в комбинации по меньшей мере с одним дополнительным соединением, которое представляет собой ингибитор протеасомальной активности, ингибитор аутофагии, лизосомальный ингибитор, ингибитор транспорта белка из ER в комплекс Гольджи, ингибитор Hsp90 шаперона, активатор реакции на тепловой шок, ингибитор гликозидазы или ингибитор гистондеацетилазы. Опсинсвязывающее или опсинстабилизирующее соединение предпочтительно не является природным или синтетическим ретиноидом. Опсинсвязывающее или опсинстабилизирующее соединение и дополнительное соединение включают в рецептуру вместе или отдельно. Соединения настоящего изобретения можно вводить как часть фармацевтической композиции. Композиции, предназначенные для не перорального введения, должны быть стерильными и должны содержать терапевтически эффективное количество опсинсвязывающего или опсинстабилизирующего соединения в единице веса или объема, подходящей для введения субъекту. Композиции и комбинации настоящего изобретения могут составлять часть фармацевтического препарата, где каждое из соединений присутствует в индивидуальных дозовых количествах. Выражение "фармацевтически приемлемый" относится к таким соединениям настоящего изобретения, композициям, содержащим такие соединения, и/или к дозовым формам, которые с точки зрения медиков пригодны для использования в контакте с тканями человека и животных и не отличаются избыточной токсичностью, не раздражают, не вызывают аллергических реакций или не создают других проблем или осложнений и характеризуются разумным соотношением выгода/риск. Фармацевтические композиции настоящего изобретения не для перорального введения, которые следует использовать для профилактического или терапевтического введения, должны быть стерильными. Стерильность легко достигается за счет фильтрования через стерилизующие мембранные фильтры(например, мембраны 0,2 мкм), под действием гамма-излучения, или с помощью любых других подходящих средств, известных специалистам в данной области. Терапевтические композиции опсинсвязывающих или опсинстабилизирующих соединений обычно помещают в контейнер со стерильным отверстием для доступа, например, в контейнер для внутривенного раствора или в ампулу с пробкой,которую можно проткнуть гиподермической иглой шприца. Такие композиции обычно хранят в единичных или многодозовых контейнерах, например, в запаянных ампулах или пробирках, в виде водных растворов или в лиофилизированной лекарственной форме для восстановления. Указанные соединения можно комбинировать, необязательно, с фармацевтически приемлемым эксципиентом. Компоненты фармацевтических композиций также могут совместно смешиваться с молекулами настоящего изобретения и друг с другом таким образом, чтобы не происходило взаимодействия, которое могло бы существенно нарушить необходимую фармацевтическую эффективность. Соединения настоящего изобретения могут содержаться в фармацевтически приемлемых эксципиентах. Эксципиент предпочтительно содержит небольшие количества добавок, таких как вещества, которые повышают изотоничность и химическую стабильность. Такие материалы являются нетоксичными для реципиента в используемых дозах и концентрациях и включают буферные соединения, такие как такие как фосфат, цитрат, сукцинат, ацетат, лактат, тартрат и другие органические кислоты или их соли; трис-гидроксиметиламинометан (TRIS), бикарбонат, карбонат и другие органические основания и их соли; антиоксиданты, такие как аскорбиновая кислота; низкомолекулярные (например, содержащие менее чем около десяти остатков) полипептиды, например, полиаргинин, полилизин, полиглутамат и полиаспартат; белки, такие как сывороточный альбумин, желатин, или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон (PVP), полипропиленгликоли (PPG), и полиэтиленгликоли(PEG); аминокислоты, такие как глицин, глутамовая кислота, аспарагиновая кислота, гистидин, лизин или аргинин; моносахариды, дисахариды, и другие углеводы, включая целлюлозу или ее производные,глюкозу, маннозу, сахарозу, декстрины или сульфатированные производные углеводов, такие как гепарин, хондроитинсульфат или декстрансульфат; ионы поливалентных металлов, такие как ионы двухвалентных металлов, включая ионы кальция, ионы магния и ионы марганца; хелатирующие средства, такие как этилендиаминтетрауксусная кислота (EDTA); сахарные спирты, такие как маннит или сорбит; противоионы, такие как натрий или аммоний; и/или неионные поверхностно-активные средства, такие как полисорбаты или полоксамеры. Можно включать другие добавки, такие как стабилизаторы, противомикробные средства, инертные газы, жидкие и питательные репленишеры (т.е. декстрозу Рингера), репленишеры электролитов, которые могут присутствовать в обычных количествах. Такие композиции, как раскрыто выше, можно вводить в эффективных количествах. Эффективное количество будет зависеть от типа или способа введения, конкретного состояния, подлежащего лечению,и желательного результата. Оно также может зависеть от стадии состояния, возраста и физического состояния субъекта, природы одновременной терапии, если она применяется, и тому подобных факторов,хорошо известных практикующим врачам. Для терапевтических применений это такое количество, которого достаточно для достижения необходимого медицинского результата. По отношению к субъекту, у которого развивается или который подвержен риску развития светотоксичности, такой, которая связана с глазными операциями, эффективным количеством является такое количество, которого достаточно для уменьшения скорости или степени образования и накопления продуктов цикла превращений родопсина, таких как 11-транс-ретиналь или липофусцин, или А 2 Е, а также для предотвращения апоптоза фоточувствительных клеток в результате избыточной активации родопсина. Итак, дозы соединений настоящего изобретения должны составлять от около 0,01 мг/кг в день до около 1000 мг/кг в день. Предполагают, что подходящими будут дозы в интервале от около 50 до около 2000 мг/кг. Более низкие дозы будут зависеть от некоторых способов введения, таких как внутривенное введение. В тех случаях, когда реакция субъекта оказывается достаточной при применении начальной дозы, более высокие дозы (или эффективно более высокие дозы, вводимые другим более локализованным способом) можно использовать до тех пор, пока пациент их переносит. Возможно использование многократных доз в день для достижения соответствующего системного уровня содержания композиции настоящего изобретения. Возможны различные способы введения. Способы настоящего изобретения, вообще говоря, можно практиковать, используя любой способ введения, который приемлем с медицинской точки зрения, что означает любой способ, который обеспечивает эффективные уровни содержания активного соединения,которые не вызывают клинически неприемлемых вредных эффектов. В одном предпочтительном варианте композицию настоящего изобретения вводят интраокулярно. Другие способы введения включают пероральное, ректальное, местное, интраокулярное, буккальное, интравагинальное, интрацистернальное,интрацеребровентрикулярное, интратрахеальное, назальное, трансдермальное, внутрь имплантов или на импланты, или парентеральное введение. Композиции, включающие композиции настоящего изобретения, можно добавлять к физиологическим жидкостям, таким как гумор стекловидного тела. Для введения в ЦНС доступны различные методики для промотирования проникновения терапевтического средства через гематоэнцефалический барьер, включая разрушение его хирургическим путем или с помощью инъекции лекарственных средств, которые временно создают адгезионный контакт между эндотелиальными клетками сосудистой системы ЦНС и соединениями, которые облегчают перемещение через такие клетки. Пероральное введение может оказаться предпочтительным для профилактического применения благодаря удобству для пациента, также как и для режима дозирования. Фармацевтические композиции настоящего изобретения могут необязательно содержать далее при желании один или более из дополнительных белков, включая плазменные белки, протеазы и другие биологические материалы, если только они не вызывают вредных эффектов после введения субъекту. Подходящие белки или биологические материалы можно получить из плазмы человека или млекопитающего, используя любые известные и доступные специалистам в данной области способы очистки; из надосадочных жидкостей, экстрактов или лизатов рекомбинатных тканевых культур, вирусов, дрожжей, бактерий или тому подобных, которые содержат ген, который экспрессирует человеческий плазмопротеин или плазмопротеин млекопитающего, который был встроен в соответствии со стандартными техноло- 28021747 гиями рекомбинантной ДНК; или из жидкостей (например, из крови, молока, лимфы, урины или т.п.),или из трансгенных животных, у которых есть ген, который экспрессирует человеческий плазмопротеин,который был встроен в соответствии со стандартными трансгенными методиками. Фармацевтические композиции настоящего изобретения могут включать одно или более из рНбуферирующих соединений для сохранения величины рН лекарственной формы на заранее определенном уровне, который отражает физиологические значения рН, такие, как значения в интервале от около 5,0 до около 8,0 (например, 6,0, 6,5, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,8). рН-Буферирующие соединения, используемые в водных жидких лекарственных формах, могут быть аминокислотами или смесями аминокислот, такими как гистидин или смесь аминокислот, таких как гистидин и глицин. Альтернативно, рН-буферирующие соединения представляют собой предпочтительно средства, которые поддерживают рН лекарственной формы на заранее определенном уровне, таком, как в интервале от около 5,0 до около 8,0, и которые не образуют хелатных комплексов с ионами кальция. Иллюстративные примеры таких рН-буферирующих соединений включают, но ими не ограничиваются, имидазольный и ацетатный ионы. рН-Буферирующие соединения могут присутствовать в любом количестве, подходящем для поддержания величины рН лекарственной формы на заранее определенном уровне. Фармацевтические композиции настоящего изобретения могут также содержать один или более из модулирующих осмотические характеристики средств, т.е. соединений, которые модулируют осмотические характеристики (например, тоничность, осмоляльность и/или осмотическое давление) лекарственной формы до уровней, которые приемлемы для кровотока и клеток крови конкретных реципиентов. Модулирующее осмотические характеристики средство может быть средством, которое не образует хелатных комплексов с ионами кальция. Модулирующее осмотические характеристики средство может быть любым соединением, известным или доступным специалистам в указанной области, которое модулирует осмотические характеристики лекарственной формы. Специалисты в данной области могут эмпирически определить пригодность конкретного модулирующего осмотические характеристики средства для использования в лекарственной форме настоящего изобретения. Иллюстративные примеры подходящих типов модулирующих осмотические характеристики средств включают, но ими не ограничиваются: соли, такие как хлорид натрия и ацетат натрия; сахара, такие как сахароза, декстроза и маннит; аминокислоты, такие как глицин; и смеси одного или более из указанных средств и/или типов средств. Модулирующее осмотические характеристики средство (средства) может присутствовать в любой концентрации,достаточной для модулирования осмотических характеристик лекарственной формы. Композиции, включающие опсинсвязывающее или опсинстабилизирующее соединение настоящего изобретения, могут содержать ионы поливалентных металлов, такие как ионы кальция, ионы магния и/или ионы марганца. Можно использовать любой ион поливалентного металла, который способствует стабилизации указанной композиции и который не оказывает вредного воздействия на конкретных реципиентов. Специалисты на основании указанных двух критериев могут определить подходящие ионы металлов эмпирически, а подходящие источники таких ионов металлов известны и включают неорганические и органические соли. Фармацевтические композиции настоящего изобретения могут также быть неводными жидкими лекарственными формами. Можно использовать любые подходящие неводные жидкости, при условии, что они обеспечивают стабильность содержащегося в них активного средства (средств). Предпочтительно,чтобы неводная жидкость была гидрофильной жидкостью. Иллюстративные примеры подходящих неводных жидкостей включают: глицерин; диметилсульфоксид (ДМСО); полидиметилсилоксан (PMS); этиленгликоли, такие как этиленгликоль, диэтиленгликоль, триэтиленгликоль, полиэтиленгликоль("PEG") PEG 200, PEG 300 и PEG 400; и пропиленгликоли, такие как дипропиленгликоль, трипропиленгликоль, полипропиленгликоль ("PPG") PPG 425, PPG 725, PPG 1000, PEG 2000, PEG 3000 и PEG 4000. Фармацевтические композиции настоящего изобретения могут также представлять собой смеси водных/неводных жидких лекарственных форм. Любые подходящие неводные жидкие лекарственные формы, такие, как раскрытые выше, можно использовать наряду с любыми водными жидкими лекарственными формами, такими, как раскрыты выше, при условии, что смешанные водные/неводные жидкие лекарственные формы обеспечивают стабильность содержащегося в них активного соединения. Предпочтительно, чтобы неводные жидкости в таких композиция были гидрофильными жидкостями. Иллюстративные примеры подходящих неводных жидкостей включают: глицерин; ДМСО; EMS; этиленгликоли, такие как PEG 200, PEG 300 и PEG 400; и пропиленгликоли, такие как PPG 425, PPG 725, PEG 1000,PEG 2000, PEG 3000 и PEG 4000. Подходящие стабильные лекарственные формы могут обеспечить хранение активных средств в замороженном или в незамороженном жидком состоянии. Стабильные жидкие лекарственные формы можно хранить при температуре по меньшей мере -70 С, но можно также хранить при более высоких температурах, по меньшей мере 0 С, или между около 0 С и около 42 С, в зависимости от свойств композиции. Специалистам в данной области хорошо известно, что белки и полипептиды чувствительны к изменениям величины рН, температуры и ко множеству других факторов, которые могут влиять на терапевтическую эффективность. В некоторых вариантах желательным способом введения может быть введение в легкие аэрозоля. Методики для получения аэрозольных систем доставки, содержащих полипептиды, хорошо известны
МПК / Метки
МПК: A01N 35/00, A61K 31/11
Метки: способы, опсинсвязывающие, использования, композиции, лиганды
Код ссылки
<a href="https://eas.patents.su/30-21747-opsinsvyazyvayushhie-ligandy-kompozicii-i-sposoby-ispolzovaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Опсинсвязывающие лиганды, композиции и способы использования</a>
Предыдущий патент: Водоочистительное устройство
Следующий патент: Разъединительная установка и связанный с ней способ отделения
Случайный патент: Прокладочная шайба и композитная пленка для закрытия емкости