Модифицированные полипептиды фактора vii и их применение
Формула / Реферат
1. Модифицированный полипептид фактора VII (FVII), включающий модификации в полипептиде FVII, где
модификации осуществляют в положениях, соответствующих положениям 286 и 298 в полипептиде FVII с последовательностью аминокислот, приведенной в SEQ ID NO: 3, или в соответствующих положениях в полипептиде FVII,
модификация в положении 286 представляет собой замену аминокислоты на аргинин (Arg, R);
модификация в положении 298 представляет собой замену аминокислоты на глютамин (Gln, Q) и
модифицированный полипептид FVII обладает повышенной коагулянтной активностью по сравнению с полипептидом FVII, немодифицированным в положениях 286 и 298.
2. Модифицированный полипептид FVII по п.1, где модификация в положении 286 представляет собой замену Gln (Q) на Arg (R).
3. Модифицированный полипептид FVII по п.1, где модификация в положении 298 представляет собой замену Met (M) на глютамин (Gln, Q).
4. Модифицированный полипептид FVII по п.1, содержащий модификации Q286R и M298Q.
5. Модифицированный полипептид FVII по любому из пп.1-4, где немодифицированный полипептид FVII содержит последовательность аминокислот, приведенную в любой из SEQ ID NO: 1-3, 18-74, 98, 158 или 343-353, или представляет собой ее аллельный или видовой вариант, или вариант, обладающий по меньшей мере 60% идентичностью с последовательностью FVII из любой последовательности SEQ ID NO: 1-3, 18-74, 98, 158 или 343-353, или представляет собой активный фрагмент полипептида FVII, который включает последовательность аминокислот, приведенную в любой из последовательностей SEQ ID NO: 1-3, 18-74, 98, 158 или 343-353.
6. Модифицированный полипептид FVII по любому из пп.1-5, содержащий одну или несколько дополнительных модификаций в другом положении в полипептиде FVII.
7. Модифицированный полипептид FVII по п.6, где дополнительная модификация представляет собой замену аминокислоты в положении, соответствующем положению, выбранному из 51, 52, 54, 60, 66, 68, 109, 119, 122, 124, 130, 132, 158, 161, 175, 196, 197, 199, 202, 216, 222, 237, 239, 257, 286, 287, 290, 292, 294, 296, 305, 314, 318, 321, 337, 341, 366, 373, 374, 394, 395 и 396.
8. Модифицированный полипептид FVII по п.6, в котором дополнительная модификация аминокислоты выбрана из

9. Модифицированный полипептид FVII по любому из пп.6-8, включающий модификации, выбранные из


10. Модифицированный полипептид FVII по любому из пп.6-11, включающий модификации, выбранные из



11. Модифицированный двухцепочечный активированный полипептид фактора VII (FVIIa), включающий аминокислотные замены, соответствующие положениям 128, 129, 286 и 289 в SEQ ID NO: 3, где
аминокислота в положении 128 заменена на аспарагин (N), аминокислота в положении 129 заменена на аланин (А), аминокислота в положении 286 заменена на аргинин (R) и аминокислота в положении 298 заменена на глутамин (Q),
модифицированный полипептид FVIIa включает аминокислотную последовательность, по крайней мере на 85 или 90% идентичную последовательности полипептида, приведенной в SEQ ID NO: 3; и
модифицированный полипептид FVIIa обладает прокоагулянтной активностью.
12. Модифицированный полипептид фактора VII (FVII), состоящий из аминокислотной последовательности, приведенной в SEQ ID NO: 280.
13. Модифицированный двухцепочечный активированный полипептид фактора VII (FVIIa), состоящий из аминокислотной последовательности, приведенной в SEQ ID NO: 280, расщепленной между аргинином в положении 152 и изолейцином в положении 153.
14. Модифицированный полипептид FVIIa по п.11, где полипептид включает аминокислотную последовательность, по крайней мере на 95% идентичную последовательности полипептида, приведенной в SEQ ID NO: 3.
15. Активированный модифицированный полипептид фактора VII (FVIIa) по п.11, в котором аминокислотная последовательность легкой цепи модифицированного FVIIa по крайней мере на 95% идентична аминокислотной последовательности на участке 1-152 последовательности, приведенной в SEQ ID NO:280, и включает аминокислотные замены в положениях 128 и 129.
16. Активированный модифицированный полипептид фактора VII (FVIIa) по п.11, в котором аминокислотная последовательность тяжелой цепи модифицированного FVIIa по крайней мере на 95% идентична аминокислотной последовательности на участке 153-406 последовательности, приведенной в SEQ ID NO:280, и включает аминокислотные замены в положениях 286 и 298.
17. Модифицированный полипептид фактора VII (FVII), в котором полипептид FVII включает только 1, 2, 3, 4, 5, 6 или 7 замен аминокислот в полипептиде FVII дикого типа, имеющем аминокислотную последовательность, приведенную в SEQ ID NO: 3 или в его аллельном или видовом варианте, или в полипептиде с последовательностью, приведенной в SEQ ID NO: 3, содержащем гетерологичный Gla домен вместо Gla домена последовательности SEQ ID NO: 3;
одна замена аминокислоты находится в положении, соответствующем положению 286 в полипептиде FVII с аминокислотной последовательностью, приведенной в SEQ ID NO: 3, или в соответствующем положении в полипептиде FVII, и
замена в положении 286 представляет собой замену на аргинин (Arg, R), что приводит к модифицированному полипептиду FVII, обладающему повышенной коагулянтной активностью по сравнению с полипептидом FVII, немодифицированным в положении 286.
18. Модифицированный полипептид FVII по любому из пп.1-17, где немодифицированный полипептид FVII содержит последовательность аминокислот, приведенную в любой из SEQ ID NO: 1-3 или 18-74, или представляет собой его аллельный или видовой вариант, или представляет собой активный фрагмент полипептида FVII, включающий последовательность аминокислот, приведенную в любой из последовательностей SEQ ID NO: 1-3 или 18-74.
19. Модифицированный полипептид FVII по п.18, где модифицированный полипептид FVII представляет собой активный фрагмент, включающий замену аминокислоты в положении, соответствующем положению 286 в полипептиде FVII.
20. Модифицированный полипептид FVII по любому из пп.17-19, в котором замена аминокислоты, в дополнение к замене 286R, находится в положении, соответствующем положению, выбранному из 51, 52, 54, 60, 66, 68, 109, 119, 122, 124, 130, 132, 158, 161, 175, 196, 197, 199, 202, 216, 222, 237, 239, 257, 286, 287, 290, 292, 294, 296, 298, 305, 314, 318, 321, 337, 341, 366, 373, 374, 394, 395 и 396.
21. Модифицированный полипептид FVII по любому из пп.17-20, включающий замену аминокислот, выбранную из
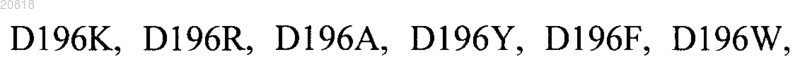

22. Модифицированный полипептид FVII по п.21, включающий замены аминокислот, выбранные из

23. Модифицированный полипептид FVII по любому из пп.1-10, включающий замены аминокислот, выбранные из
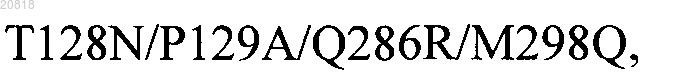


24. Модифицированный полипептид FVII по любому из пп.1-23, включающий аминокислотную последовательность, приведенную в любой из SEQ ID NOS: 118, 131-141-155, 157, 274-282, 285-288, 290, 292-297, 299, 301-306, 308, 310-314, 316-318, 321-326, 328, 334-342, 355-358, 360 или 364-371.
25. Модифицированный полипептид FVII, включающий модификацию в полипептиде FVII, где модификация введена в положение, соответствующее положению, выбранному из 54, 66, 121, 122, 129 и 132 в полипептиде FVII с последовательностью аминокислот, приведенной в SEQ ID NO: 3, или в соответствующих остатках в полипептиде FVII.
26. Модифицированный полипептид FVII по п.25, в котором модификация выбрана из P54S, Q66N, L121S, A122N, Р129А и E132S.
27. Модифицированный полипептид FVII, включающий модификацию в полипептиде FVII, где модификация соответствует модификации, выбранной из T239S, T239Q, T239V, T239L, Т239Н, T239I, Р321К, Р321Е, P321Y, P321S, Q366D, Q366N, Q366V, Q366I, Q366L, Q366M, H373D, Н373Е, H373S, H373F, Н373А, K161S, K161V, H216S, H216K, H216R, S222A, S222K, S222V, S222D, S222N, S222E и H247S в полипептиде FVII с последовательностью аминокислот, приведенной в SEQ ID NO: 3, или в соответствующих остатках в полипептиде FVII.
28. Модифицированный полипептид FVII, включающий две или более модификаций в полипептиде FVII, его аллельном или видовом варианте или его активном фрагменте, в котором две или более модификаций аминокислот выбраны из модификаций, соответствующих Н216А, Н257А, E394N, Р395А, R396S, K109N, A292N, A175S, Н257А и замене Gla из FIX.
29. Модифицированный полипептид FVII по любому из пп.1-28, который является активным или активированным.
30. Модифицированный полипептид FVII по любому из пп.1-29, включающий гетерологичный домен Gla или его часть, достаточную для осуществления связывания фосфолипидов.
31. Модифицированный полипептид FVII по п.30, в котором гетерологичный домен Gla выбран из домена Gla фактора IX (FIX), фактора X (FX), протромбина, белка С, белка S, остеокальцина, белка Gla матрикса, Growth-arrest-specific белка 6 (Gas6) и белка Z.
32. Модифицированный полипептид FVII по п.30 или 31, в котором гетерологичный домен Gla имеет последовательность аминокислот, приведенную в любой из SEQ ID NO: 83-91, 93 и 94, или ее часть, достаточную для осуществления связывания фосфолипидов.
33. Модифицированный полипептид FVII по любому из пп.30-32, в котором весь нативный домен Gla FVII или его непрерывную часть удаляли и заменяли гетерологичным доменом Gla, или его частью, достаточной для осуществления связывания фосфолипидов.
34. Модифицированный полипептид FVII по п.33, в котором нативный домен Gla FVII включает аминокислоты 1-45 в полипептиде FVII с последовательностью аминокислот, приведенной в SEQ ID NO: 3, или соответствующие остатки в полипептиде FVII.
35. Модифицированный полипептид FVII по пп.30-34, в котором гетерологичный домен Gla содержит модификации по сравнению с гетерологичным доменом Gla дикого типа.
36. Модифицированный полипептид FVII по п.32, в котором гетерологичный домен Gla представляет собой домен Gla FIX и модификация представляет собой замену аминокислоты в положении, соответствующем положению, выбранному из 19, 40, 43 и 44 домена Gla FIX, приведенного в SEQ ID NO: 83.
37. Модифицированный полипептид FVII по п.33, в котором модификация выбрана из M19K, E40L, K43I и Q44S.
38. Модифицированный полипептид FVII по любому из пп.35-37, в котором гетерологичный домен Gla содержит дополнительные модификации.
39. Модифицированный полипептид FVII по п.38, в котором гетерологичный домен Gla представляет собой домен Gla FIX и дополнительная модификация представляет собой замену аминокислоты в положении, соответствующем положению 19, 40, 43 и 44 домена Gla FIX, приведенного в SEQ ID NO: 83.
40. Модифицированный полипептид FVII по п.38 или 39, в котором дополнительная модификация выбрана из M19K, E40L, K43I и Q44S.
41. Модифицированный полипептид FVII по любому из пп.35-37, в котором модификация представляет собой M19K/E40L/K43I/Q44S.
42. Модифицированный полипептид FVII по любому из пп.30-41, включающий модификации, выбранные из

43. Модифицированный полипептид FVII по пп.1-42, включающий одну или более дополнительных модификаций аминокислоты (аминокислот), которые повышают устойчивость к антитромбину-III, увеличивают связывание и/или аффинность к фосфолипидам, повышают аффинность к тканевому фактору, увеличивают собственную активность, увеличивают ТФ-зависимую активность, увеличивают коагулянтную активность, изменяют конформацию полипептида для изменения зимогенности, увеличивают каталитическую или коагулянтную активность, сдвигая равновесие между высокоактивной и менее активной конформацией FVIIa в пользу высокоактивных конформаций, повышают устойчивость к протеазам, уменьшают гликозилирование, увеличивают гликозилирование, снижают иммуногенность, повышают устойчивость и/или способствуют химическому связыванию групп.
44. Модифицированный полипептид FVII по пп.1-43, включающий одну или более дополнительных модификаций аминокислоты (аминокислот), выбранных из



45. Модифицированный полипептид FVII по пп.1-44, где немодифицированный полипептид FVII имеет последовательность аминокислот, приведенную в SEQ ID NO: 3, или представляет собой аллельный или видовой вариант полипептида, приведенного в SEQ ID NO: 3.
46. Модифицированный полипептид FVII по любому из пп.1-45, который представляет собой зрелый полипептид.
47. Модифицированный полипептид FVII по любому из пп.1-46, который представляет собой одноцепочечный полипептид или двухцепочечный полипептид.
48. Модифицированный полипептид FVII по любому из пп.1-47, который включает пост-трансляционные модификации.
49. Модифицированный полипептид FVII по п.48, в котором пост-трансляционные модификации включают гликозилирование.
50. Модифицированный полипептид FVII по любому из пп.1-49, который является двухцепочечным активированным полипептидом FVIIa.
51. Молекула нуклеиновой кислоты, включающая последовательность нуклеотидов, кодирующую модифицированный полипептид FVII по любому из пп.1-50.
52. Вектор, содержащий молекулу нуклеиновой кислоты по п.51.
53. Клетка, включающая вектор по п.52.
54. Фармацевтическая композиция, включающая терапевтически эффективную концентрацию или количество модифицированного полипептида FVII по любому из пп.1-50 в фармацевтически приемлемом носителе.
55. Фармацевтическая композиция, включающая молекулу нуклеиновой кислоты по п.51 в фармацевтически приемлемом носителе.
56. Фармацевтическая композиция, включающая вектор по п.52 в фармацевтически приемлемом носителе.
57. Фармацевтическая композиция, включающая клетку по п.53 в фармацевтически приемлемом носителе.
58. Фармацевтическая композиция по любому из пп.54-57, разработанная для введения одной дозой.
59. Фармацевтическая композиция по любому из пп.54-58, разработанная для введения способом, выбранным из перорального, назального, легочного, буккального, трансдермального, подкожного, интрадуоденального, энтерального, парентерального, внутривенного или внутримышечного способов введения.
60. Фармацевтическая композиция по любому из пп.54-59, являющаяся лиофилизированной.
61. Способ лечения субъекта, включающий введение субъекту фармацевтической композиции по любому из пп.54-60, где
субъект страдает от заболевания или состояния, которое поддается лечению введением FVII или прокоагулянта, и
заболевание или состояние, подвергающееся лечению, выбрано из нарушений свертывания крови, гематологических нарушений, геморрагических нарушений, гемофилий, дефицита фактора VII, нарушений, связанных с кровотечениями, хирургического кровотечения или кровотечения в результате травмы.
62. Применение модифицированного полипептида FVII по любому из пп.1-50, для лечения заболевания или состояния, выбранного из нарушений свертывания крови, гематологических нарушений, геморрагических нарушений, гемофилий, дефицита фактора VII, нарушений, связанных с кровотечениями, хирургического кровотечения или кровотечения в результате травмы.
63. Применение по п.62, где заболевание или состояние является гемофилией, причем гемофилия представляет собой гемофилию А, или гемофилию В, или гемофилию С.
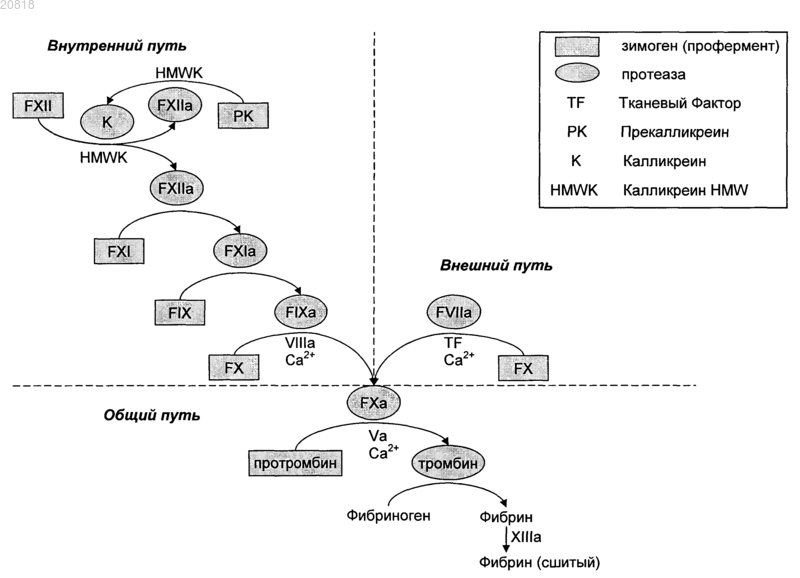
Текст
МОДИФИЦИРОВАННЫЕ ПОЛИПЕПТИДЫ ФАКТОРА VII И ИХ ПРИМЕНЕНИЕ Заявлены модифицированные полипептиды фактора VII. Такие модифицированные полипептиды фактора VII включают фактор VIIa и другие формы фактора VII. Среди описанных модифицированных полипептидов фактора VII имеются такие, которые имеют измененную активность, обычно измененную прокоагулянтную активность, включая увеличенную прокоагулянтную активность. Следовательно, такие модифицированные полипептиды могут быть использованы в терапии. Родственные заявки Преимущество приоритета принадлежит предварительной заявке на патент США 61/124021 Edwin Madison и Christopher Thanos "Модифицированные полипептиды фактора VII и их применение", поданной 11 апреля 2008 г. Эта заявка близка соответствующей заявке США 12/384915 Edwin Madison и Christopher Thanos"Модифицированные полипептиды фактора VII и их применение", поданной 10 апреля 2009 г., которая также претендует на приоритет предварительной заявки США 61/124021. Где это возможно, содержание указанных выше заявок включено в настоящий документ в качестве ссылки в полном объеме. Где это возможно, содержание заявки США 12/082662 Edwin Madison, Christopher Thanos, Sandra Waugh Ruggles и Shaun Coughlin "Модифицированные полипептиды фактора VII и их применение", поданной 11 апреля 2008 г., и соответствующей международной заявкиPCT/US 2008/04795 Edwin Madison, Christopher Thanos, Sandra Waugh Ruggles и Shaun Coughlin "Модифицированные полипептиды фактора VII и их применение", поданной 11 апреля 2008 г., также включено в настоящий документ в качестве ссылки в полном объеме. Перечень последовательностей включен в настоящий документ в качестве ссылки на компакт-диске. Электронная версия Перечня последовательностей на компакт-диске (CD-R) прилагается к настоящему документу в четырех экземплярах (названных копия 1, копия 2, копия 3 и CRF), содержание которых включено в настоящий документ в качестве ссылки в полном объеме. Машиночитаемые файлы на каждом из вышеупомянутых компакт-дисков, созданные 10 апреля 2009 г., являются идентичными, обладают размером 1200 килобайт и названы 4919SEQ.PC1.TXT. Область техники В настоящем изобретении предусмотрены модифицированные белки для лечебных целей. В частности предусмотрены модифицированные полипептиды фактора VII, которые включают фактор VIIa и другие формы фактора VII, и их применение. Уровень техники Гемостаз представляет собой комплекс физиологических процессов, приводящий к прекращению кровотечения. Тромбоциты, белки плазмы и кровеносные сосуды с эндотелиальными клетками являются тремя составляющими этого процесса, каждое из них играет важную роль в событиях, которые непосредственно следуют за повреждением тканей и при нормальных обстоятельствах приводят к быстрому образованию сгустка. Центральное место в каскаде свертывания занимает ряд протеолитических актов, в которых некоторые белки плазмы (или факторы свертывания крови) последовательно активируются в"каскаде" другими ранее активированными факторами свертывания, что приводит к быстрому образованию тромбина. Большие количества образованного в этом каскаде тромбина затем расщепляют фибриноген до фибриновых пептидов, которые необходимы для образования сгустка. Факторы свертывания циркулируют в крови в виде неактивных одноцепочечных зимогенов и активируются путем расщепления по одной или нескольким позициям с образованием двухцепочечной активированной формы белка. Фактор VII (FVII), витамин K-зависимый белок плазмы, первоначально циркулирует в крови как зимоген. Зимоген FVII активируется протеолитическим расщеплением по одному сайту, Arg152-Ile153, с образованием протеазы, состоящей из двух цепей, связанных простой дисульфидной связью (FVIIa). FVIIa связывает свой кофактор, тканевый фактор (ТФ), с образованием комплекса, в составе которого FVIIa может эффективно активировать фактор X (FX) в FXa, тем самым начиная серию событий, которые приводят к образованию фибрина и гемостазу. Несмотря на то, что в большинстве случаев достигается нормальный гемостаз, дефекты в процессе могут привести к кровоточивости, при которой увеличивается необходимое для формирования сгустка время. Такие нарушения могут быть врожденными или приобретенными. Например, гемофилия А и гемофилия В являются наследственными заболеваниями, характеризующимися недостатком фактора VIII(FVIII) и фактора IX (FIX) соответственно. Заместительная терапия является традиционным способом лечения гемофилии А и гемофилии В и включает внутривенное введение фактора VIII или FIX, которые представляют собой полученные из человеческой плазмы или рекомбинантные белки. Во многих случаях, однако, пациенты вырабатывают антитела (также известные как ингибиторы) против вводимых белков, которые уменьшают или сводят на нет эффективность лечения. Рекомбинантный FVIIa (Novoseven(фактор свертывания VIIa (рекомбинантный был одобрен для лечения пациентов с гемофилией А или В, у которых присутствуют ингибиторы фактора VIII или FIX, а также для использования для остановки кровотечений или предотвращения кровотечения, связанного с травмой и/или хирургическим вмешательством. Рекомбинантный FVIIa также был одобрен для лечения пациентов с врожденным дефицитомFVII и все чаще используется не по прямому назначению, например для лечения кровотечений, связанных с другими врожденными или приобретенными нарушениями свертываемости крови, травмами и операциями у пациентов, не больных гемофилией. Применение рекомбинантного FVIIa для ускорения образования сгустка подчеркивает его растущее значение в качестве терапевтического средства. Лечение FVIIa в значительной мере не удовлетворяет медицинские потребности. Например, на основании данных клинических испытаний для помощи пациенту с гемофилией при остром кровотечении в среднем необходимы 3 дозы FVIIa в течение 6 ч или большего периода времени. Для снижения этих потребностей необходимы более эффективные вариантыFVIIa. Таким образом, одной из целей настоящего изобретения является обеспечение модифицированных полипептидов FVII с улучшенными лечебными свойствами. Сущность изобретения В настоящем документе представлены модифицированные полипептиды фактора VII (FVII). В частности, здесь представлены модифицированные полипептиды фактора VII, проявляющие прокоагулянтную активность. Полипептиды фактора VII обладают модификациями первичной последовательности по сравнению с немодифицированными полипептидами FVII и могут включать аминокислотные вставки, удаления и замены. Предусмотренные в настоящем документе модифицированные полипептидыFVII включают полипептиды FVII, которые обладают повышенной устойчивостью к ингибиторам, таким как антитромбин III (AT-III) и ингибитор пути тканевого фактора (TFPI), полипептиды FVII, которые обладают повышенной устойчивостью к ингибиторному эффекту Zn, полипептиды FVII, которые обладают увеличенной каталитической активностью в присутствии и/или в отсутствие ТФ, полипептидыFVII, которые обладают улучшенными фармакокинетическими свойствами, такими как увеличенный период полураспада, полипептиды FVII, которые обладают повышенной способностью связывать тромбоциты и/или аффинностью к поверхности тромбоцитов, полипептиды FVII с повышенной способностью связывать сывороточный альбумин и/или аффинностью к сывороточному альбумину, и полипептиды FVII с повышенной способностью связывать интегрин тромбоцитов IIb3 и/или аффинностью к интегрину тромбоцитов IIb3. Модифицированные полипептиды FVII могут содержать любую комбинацию предусмотренных в настоящем документе модификаций, при которой один или более видов активности или свойств полипептида изменены по сравнению с немодифицированным полипептидом FVII. Обычно модифицированный полипептид FVII сохраняет прокоагулянтную активность. Также в настоящем документе предусмотрены молекулы нуклеиновой кислоты, векторы и клетки, которые кодируют/экспрессируют модифицированные полипептиды FVII. В данной заявке представлены также фармацевтические композиции, изделия, наборы и методы лечения. Полипептиды FVII включают аллельные и видовые варианты полипептидов и другие варианты, которые имеют модификации, затрагивающие другие виды активности и/или свойства. Также предусмотрены активные фрагменты полипептидов FVII,которые включают предусмотренные модификации. Примеры полипептидов FVII представляют собой полипептиды, которые включают последовательность аминокислот, приведенную в SEQ ID NO: 3, а также их варианты, обладающие 60, 65, 70, 75, 80, 85, 88, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или большей идентичностью последовательности с ними. В настоящем документе предусмотрены модифицированные полипептиды FVII (FVII), содержащие модификацию полипептида FVII в позиции Q286 полипептида FVII с последовательностью аминокислот,приведенной в SEQ ID NO: 3, или в соответствующих остатках полипептида FVII. Модификация может представлять собой замену аминокислоты, вставку аминокислоты (аминокислот), удаление аминокислоты (аминокислот) или их комбинацию. Если модификация представляет собой замену аминокислоты,аминокислота может быть заменена на основную аминокислоту (например, Arg (R), Lys (K) и His (Н или аминокислоту, выбранную из Arg (R), Lys (K) His (Н), Tyr (Y), GIy (G), Phe (F), Met (M), Ile (I), Leu(L), Val (V), Pro (P), Glu (E), Trp (W), Asp (D) и Cys (С). Примеры таких аминокислотных замен включают Q286R, Q286K, Q286H, Q286Y, Q286G, Q286F, Q286M, Q286I, Q286L, Q286V, Q286P, Q286E,Q286W, Q286D и Q286C. Такие изменения могут быть введены в немодифицированный полипептидFVII, содержащий последовательность, приведенную в SEQ ID NO: 1-3, или в его аллельный или видовой вариант, или вариант, обладающий, по крайней мере, 60% идентичностью последовательности с FVIISEQ ID NO: 1-3, или изменения могут быть введены в активный фрагмент полипептида FVII, включающий последовательность аминокислот, приведенную в SEQ ID NO: 1-3, или в его аллельный или видовой вариант, или вариант, обладающий по крайней мере 60% идентичностью последовательности с FVII SEQID NO: 1-3. Например, модифицированный полипептид FVII может представлять собой активный фрагмент, который включает замену в положении, соответствующем положению Q286 в полипептиде FVII. В некоторых примерах предусмотренные в настоящем документе модифицированные полипептидыFVII содержат аминокислотную замену в положении, соответствующем положению 286 в полипептидеFVII с последовательностью аминокислот, приведенной в SEQ ID NO: 3, или содержат аминокислотную замену в соответствующем остатке в полипептиде FVII, где модификация представляет собой замену в положении 286 на основную аминокислоту, что приводит к модифицированному полипептиду FVII, который проявляет увеличенную коагулянтную активность по сравнению с полипептидом FVII, который не обладает модификацией в положении 286. Основные аминокислоты могут быть выбраны из Arg (R),Lys (K) и His (H). Например, предусмотренный в настоящем документе модифицированный полипептидFVII может содержать замену Gln (Q) на Arg (R) в позиции 286. В некоторых примерах модифицированные полипептиды FVII включают только одну модификацию в положении 286. В других примерах модифицированные полипептиды FVII также содержат одну или несколько дополнительных модификаций в другом положении в полипептиде FVII. Дополнительная модификация может представлять собой замену аминокислоты, вставку или удаление. Например, допол-2 020818 нительная модификация может представлять собой замену аминокислоты в положении, выбранном из Примеры предусмотренных в данной заявке модифицированных полипептидов FVII включают полипептиды, содержащие модификации В заявке предусмотрены модифицированные полипептиды FVII, содержащие две или более моди-4 020818 фикаций в полипептиде FVII, их аллельные или видовые варианты или их активные фрагменты. По меньшей мере одна из модификаций в таких полипептидах находится в положении, соответствующем положению Q286 в полипептиде FVII с последовательностью аминокислот, приведенной в SEQ ID NO: 3, или в соответствующих остатках в полипептиде FVII, предусмотренном в настоящем документе, при условии, что модификация в положении Q286, отдельно или в сочетании с любой другой модификацией,не приводит к введению нового сайта гликозилирования по сравнению с немодифицированным полипептидом FVII. Такие модификации могут представлять собой замены аминокислот, вставки или удаления. Например, модификация в положении Q286 может представлять собой замену на аминокислоту, выбранную из Arg (R), Lys (K) His (Н), Tyr (Y), Gly (G), Phe (F), Met (M), Ile (I), Leu (L), Val (V), Pro (P), Glu (E),Trp(W), Asp (D) и Cys (С). В некоторых примерах, модификация представляет собой Q286R. Одна или несколько других модификаций может быть выбрана из модификаций В некоторых примерах модифицированные полипептиды FVII включают модификацию в положении, соответствующем положению Р 54, Q66, L121, А 122, Р 129 или Е 132 в полипептиде FVII с аминокислотной последовательностью, приведенной в SEQ ID NO: 3, или включают модификацию в соответствующих остатках в полипептиде FVII. Примеры модификаций включают P54S, Q66N, L121S, A122N,Р 129 А и E132S. В некоторых примерах модифицированные полипептиды FVII, содержащие модификацию в положении, соответствующем Р 54, Q66, L121, А 122, Р 129 или Е 132, также содержат одну или несколько дополнительных модификаций, включая замену аминокислоты, вставку и удаление в другом положении полипептида FVII. Такие модификации включают P54S, S52N, Y58S, S119N, G124S, T128N,T130N, V158D, A175S, S222A, G241S, E296V, M298Q, E394N, Р 395 А, R396S, G318N и Q366V. Таким образом, примеры сочетания модификаций полипептида FVII, предусмотренные здесь, включают Кроме того, в настоящем документе предусмотрены модифицированные полипептиды FVII, включающие модификацию в полипептиде FVII с последовательностью аминокислот, приведенной в SEQ ID NO: 3, или в соответствующих остатках в полипептиде FVII. Дополнительно такие модифицированные полипептиды FVII также могут содержать одну или несколько дополнительных модификаций в другом положении, например,в аминокислотной позиции В настоящем документе предусмотрены модифицированные полипептиды FVII, содержащие две или более модификаций в полипептиде FVII, их аллельные и видовые варианты или активные фрагменты, в которых две или более модификаций аминокислот выбраны из модификаций аминокислот Н 216 А,Н 257 А, E394N, Р 395 А, R396S, K109N, A292N, A175S, Н 257 А и замена Gla из FIX. Например, предусмотренные в настоящем документе модифицированные полипептиды FVII относятся к полипептидам с модификациями, выбранными из Н 216 А/Н 257 А, E394N/P395A/R396S и K109N/A175S. Кроме того, также могут быть включены модификации M298Q или A294S. Таким образом, в настоящем документе также предусмотрены модифицированные полипептиды FVII, включающие модификации, выбранные из Н 216 А/Н 257 А, E394N/P395A/R396S и K109N/A175S. В некоторых примерах модифицированные полипептиды FVII также содержат соответствующие модификации M298Q или A294S. Это может привести,например, к модифицированным полипептидам FVII, включающим модификации H257A/M298Q илиK109N/A292N/A294S. Также в настоящем документе предусмотрены модифицированные полипептидыFVII, включающие модификации S52A/S60A/V158D/E296V/M298Q или V158D/T239I/E296V/M298. В некоторых примерах предусмотренные в настоящем документе модифицированные полипептидыFVII содержат связывающую сывороточный альбумин последовательность, такую как последовательность аминокислот, приведенная в любой из последовательностей SEQ ID NO: 103-109, или ее часть,достаточную для связывания сывороточного альбумина. Такие модифицированные полипептиды FVII могут проявлять повышенную аффинность к сывороточному альбумину или повышенную способность связывать сывороточный альбумин по сравнению с немодифицированным полипептидом FVII. Например, модифицированные полипептиды FVII, содержащие связывающую сывороточный альбумин последовательность, могут обладать повышенной аффинностью или повышенной способностью связывать сывороточный альбумин по меньшей мере приблизительно на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70,80, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 200, 300, 400, 500% или более. Связывающая сывороточный альбумин последовательность может заменить непрерывную последовательность аминокислотных остатков немодифицированного полипептида FVII. Модифицированные полипептиды FVII, содержащие связывающую сывороточный альбумин последовательность, могут содержать модификации, выбранные из В настоящем документе предусмотрены модифицированные полипептиды FVII, содержащие связывающую интегрин тромбоцитов IIb3 последовательность. Такие модифицированные полипептидыFVII могут проявлять повышенную аффинность или связывание с интегрином тромбоцитов IIb3 по сравнению с немодифицированным полипептидом FVII. Например, модифицированные полипептидыFVII, содержащие связывающую интегрин тромбоцитов IIb3 последовательность, могут обладать аффинностью или связыванием с интегрином тромбоцитов IIb3 повышенным по меньшей мере приблизительно на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 200,300, 400, 500% или более по сравнению с немодифицированным полипептидом FVII. Примеры связывающей сывороточный альбумин последовательности, которая может заменить непрерывную последовательность аминокислотных остатков немодифицированного полипептида FVII, включают последовательности аминокислот, приведенные в любой из SEQ ID NO: 110-112, или их части, достаточные для связывания интегрина тромбоцитов IIb3. Модифицированные полипептиды FVII содержат модификации, выбранные из Модифицированные полипептиды FVII, содержащие связывающие сывороточный альбумин или интегрин тромбоцитов IIb3 последовательности, также могут содержать одну или несколько дополнительных модификаций в других положениях полипептида FVII, таких как замена аминокислоты в положении, соответствующем положению G237V. Таким образом, в настоящем документе также предусмотрены модифицированные полипептиды FVII, содержащие модификации, В некоторых примерах в настоящем документе предусмотрены модифицированные полипептидыFVII, содержащие 2, 3, 4, 5, 6, 7 или более модификаций. В дополнительных примерах предусмотренные в настоящем документе модифицированные полипептиды FVII содержат гетерологичный домен Gla или его часть, достаточную для связывания фосфолипидов. Такие полипептиды могут проявлять повышенную аффинность или повышенное связывание с фосфолипидами по сравнению с немодифицированным полипептидом FVII, например аффинность или связывание с фосфолипидами, повышенные по меньшей мере приблизительно на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 91, 92, 93, 94, 95, 96, 97, 98,99, 100, 200, 300, 400, 500% или более. Гетерологичные домены Gla могут быть выбраны из домена Gla фактора IX (FIX), фактора X (FX), протромбина, белка С, белка S, остеокальцина, матриксного белка Gla,Growth-arrest-specific белка 6 (Gas6) и белка Z и в некоторых примерах могут иметь последовательность аминокислот, приведенную в любой из SEQ ID NO: 83-91, 93 и 94, или ее часть, достаточную для связывания фосфолипидов. Нативный домен Gla фактора FVII или его непрерывная часть, которая может включать аминокислоты 1-45 в полипептиде FVII с последовательностью аминокислот, приведенной вSEQ ID NO: 3, или соответствующие остатки в полипептиде FVII, можно удалить и заменить гетерологичным доменом Gla, или его частью, достаточной для связывания фосфолипидов. Предусмотренные в настоящем документе модифицированные полипептиды FVII могут обладать повышенной устойчивостью к антитромбину III по сравнению с немодифицированным полипептидом FVII. Такие модифицированные полипептиды FVII могут обладать большей устойчивостью к антитромбину III по меньшей мере приблизительно на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99,100, 200, 300, 400, 500% или более по сравнению с устойчивостью немодифицированного полипептидаFVII. Предусмотренные в настоящем документе модифицированные полипептиды FVII также могут обладать повышенной каталитической или коагулянтной активностью по сравнению с немодифицированным полипептидом FVII, например повышенной по меньшей мере приблизительно на 1, 2, 3, 4, 5, 6, 7, 8,9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 200, 300, 400, 500% и более по сравнению с немодифицированным полипептидом FVII. Кроме того, модифицированные полипептидыFVII, предусмотренные в настоящем документе, могут обладать повышенной устойчивостью к TFPI по сравнению с немодифицированным полипептидом FVII. Такие модифицированные полипептиды FVII могут быть более устойчивы к TFPI по меньшей мере приблизительно на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30,40, 50, 60, 70, 80, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 200, 300, 400, 500% и более по сравнению с немодифицированным полипептидом FVII. Предусмотренные в настоящем документе модифицированные полипептиды FVII также могут обладать повышенной устойчивостью к ингибиторному эффекту Zn2+ по сравнению с немодифицированными полипептидами FVII. Например, модифицированные полипептидыFVII могут быть более устойчивы к ингибиторному эффекту Zn2+ по меньшей мере приблизительно на 1,2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 200, 300, 400, 500% и более по сравнению с немодифицированными полипептидами FVII. В некоторых примерах предусмотренные в настоящем документе модифицированные полипептидыFVII содержат одну или несколько модификаций, которые вводят и/или ликвидируют один или несколько сайтов гликозилирования по сравнению с немодифицированным полипептидом FVII. Например, 1, 2,3, 4, 5, 6 или более сайтов гликозилирования могут быть введены или ликвидированы. Сайты гликозилирования, которые могут быть введены или ликвидированы, включают сайты N-гликозилирования и Огликозилирования. Модифицированные полипептиды FVII, предусмотренные в настоящем документе,могут содержать одну или несколько других модификаций аминокислот, повышающих устойчивость к антитромбину-III, увеличивающих связывание и/или аффинность к фосфолипидам, повышающих аффинность к тканевому фактору, увеличивающих собственную активность, увеличивающих ТФзависимую активность, увеличивающих коагулянтную активность, изменяющих конформацию полипептида для изменения зимогенности, увеличивающих каталитическую или коагулянтную активность, сдвигающих равновесие между высокоактивной и менее активной конформациями FVIIa в пользу высокоактивной конформации, повышающих устойчивость к протеазам, уменьшающих гликозилирование, увеличивающих гликозилирование, снижающих иммуногенность, повышающих стабильность и/или способствующих связыванию химических групп. В некоторых примерах измененная зимогенность относится к более зимогенподобной форме или менее зимогенподобной форме. В некоторых примерах модифицированные полипептиды FVII, предусмотренные в настоящем документе, содержат одну или несколько других модификаций аминокислот, выбранных из В некоторых примерах модифицированные полипептиды FVII также содержат замещение позиций 300-322, 305-322, 300-312 или 305-312 соответствующими аминокислотами трипсина, тромбина или FX или содержат замещение позиций 310-329, 311-322 или 233-329 соответствующими аминокислотами трипсина. Примеры модифицированных полипептидов FVII, предусмотренных в настоящем документе, имеют последовательности аминокислот, приведенные в любой из SEQ ID NO: 113-273. В некоторых примерах модификации вводят в немодифицированный полипептид FVII, который представляет собой аллельный или видовой вариант полипептида, приведенного в SEQ ID NO: 3. Аллельный, или видовой, или другой вариант может обладать 40, 50, 60, 70, 80, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентичности последовательности с полипептидом, приведенном в SEQ ID NO: 3, исключая модификацию аминокислоты (аминокислот). Модифицированный полипептид FVII, предусмотренный в настоящем документе,может представлять собой человеческий полипептид, не человеческий полипептид и/или зрелый полипептид. В некоторых примерах модифицирована только первичная последовательность. В других примерах также включены химическая модификация или пост-трансляционные модификации. Например, модифицированный полипептид FVII может быть гликозилирован, карбоксилирован, гидроксилирован,сульфатирован, фосфорилирован, альбуминирован или конъюгирован с полиэтиленгликольным (ПЭГ) фрагментом. Модифицированные полипептиды FVII, предусмотренные в настоящем документе, могут представлять собой одноцепочечные полипептиды, двухцепочечные полипептиды и/или быть активными или активированными. Активация может быть осуществлена протеолитическим расщеплением в процессе самоактивации, расщеплением фактором IX (FIX), расщеплением фактором X (FXa), расщеплением фактором XII (FXIIa) или расщеплением тромбином. Модифицированные полипептиды FVII, предусмотренные в настоящем документе, могут сохранить один или более видов активности немодифицированного полипептида FVII. Например, модифицированные полипептиды FVII могут содержать модификации в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50 или в 60 аминокислотных позициях, пока полипептид сохраняет по меньшей мере одну активность немодифицированного полипептида FVII. Такие модифицированные полипептиды FVII могут сохранять по меньшей мере приблизительно 1, 2, 3, 4, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 95, 96, 97, 98, 99, 100, 200, 300, 400,500% или более активности немодифицированного полипептида FVII. В некоторых примерах один или более видов активности выбраны из связывания тканевого фактора (ТФ), активации фактора X (FX), активации фактора IX (FIX), связывания фосфолипидов и коагулянтной активности. Кроме того, сохраненные активности могут быть увеличены или уменьшены по сравнению с немодифицированным полипептидом FVII. В некоторых примерах коагулянтная активность увеличена по сравнению с немодифицированным полипептидом FVII, например увеличена по меньшей мере приблизительно на 1, 2, 3, 4, 5, 6, 7, 8,9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 200, 300, 400, 500% или более по сравнению с коагулянтной активностью немодифицированного полипептида FVII. Активность может быть измерена in vitro, ex vivo или in vivo. В настоящем документе предусмотрены молекулы нуклеиновой кислоты, содержащие последовательность нуклеотидов, кодирующую модифицированные полипептиды FVII по изобретению. Также предусмотрены векторы, содержащие такие молекулы нуклеиновой кислоты, в том числе прокариотические векторы, вирусные векторы или эукариотические векторы, такие как векторы млекопитающих. Вирусные векторы могут быть выбраны из аденовируса, адено-ассоциированного вируса, ретровируса, вируса герпеса, лентивируса, поксвируса и цитомегаловируса. В настоящем документе предусмотрены клетки, содержащие эти векторы, в том числе эукариотические клетки, такие как клетки млекопитающих. Примером клеток млекопитающих являются клетки почки детеныша хомяка (BHK-21), клетки 293 или клетки СНО. В некоторых примерах клетки экспрессируют модифицированный полипептид FVII. Таким образом, в настоящем документе также предусмотрены модифицированные полипептиды FVII,продуцируемые этими клетками. В настоящем документе предусмотрены фармацевтические композиции, содержащие терапевтически эффективную концентрацию или количество любого модифицированного полипептида FVII, молекулы нуклеиновой кислоты, вектора или клеток, предусмотренных в настоящем документе, в фармацевтически приемлемом носителе. В некоторых примерах фармацевтическая композиция составлена для локального, системного или местного введения, такого как оральное, носовое, легочное, буккальное,трансдермальное, подкожное, интрадуоденальное, энтеральное, парентеральное, внутривенное или внутримышечное введение. Фармацевтические композиции также могут быть составлены для контролируемого высвобождения и/или введения одной дозой. В настоящем документе предусмотрены способы лечения введением субъекту предусмотренной в настоящем документе фармацевтической композиции, где субъект страдает заболеванием или состоянием, которое поддается лечению введением FVII или прокоагулянта, например введением активного FVII(FVIIa). В некоторых примерах лечение фармацевтической композицией улучшает или смягчает симптомы, связанные с заболеванием или состоянием. В других примерах способы лечения, предусмотренные в настоящем документе, также включают наблюдение за изменением у субъекта симптомов, связанных с заболеванием или состоянием, которое подвергается лечению введением FVII или прокоагулянта. Заболевания или состояния, подвергающиеся лечению по способам, предусмотренным здесь, могут быть выбраны из нарушений свертывания крови, гематологических нарушений, геморрагических расстройств,гемофилий (таких как гемофилия А, гемофилия В или гемофилия С, врожденная или приобретенная гемофилия), дефицита фактора VII и нарушений, связанных с кровотечением, в том числе кровотечением,вызванным операцией (такой как операция на сердце, ангиопластика, операция на легких, абдоминальная операция, операция на позвоночнике, операция на головном мозге, операция на сосудах, стоматологическая операция или трансплантация органов) или травмой. В некоторых примерах, кровотечение проявляется в виде острых гемартрозов, хронической гемофильной артропатии, гематомы, гематурии, кровотечения в центральной нервной системе, желудочно-кишечного кровотечения или кровоизлияния в мозг. В дополнительных примерах кровотечение происходит из-за удаления зубов. Трансплантационная хирургия может представлять собой трансплантацию костного мозга, сердца, легких, поджелудочной железы и печени. В некоторых примерах предусмотренный здесь способ лечения может быть использован для лечения субъекта, который вырабатывает аутоантитела к фактору VIII или фактору IX. Способы, предусмотренные здесь, также могут включать введение одного или нескольких дополнительных факторов свертывания крови, таких как очищенные из плазмы или рекомбинантные факторы свертывания, прокоагулянтов, включая витамин K, производные витамина K и ингибиторы белка С, плазмы, тромбоцитов, эритроцитов и кортикостероидов или лекарственных средств. В настоящем документе предусмотрены изделия, содержащие упаковочный материал и фармацевтическую композицию, предусмотренную в настоящем документе, помещенную в упаковочный материал. В некоторых примерах модифицированные полипептиды FVII, содержащиеся в фармацевтической композиции, эффективны для лечения связанного с FVII заболевания или нарушения, а упаковочный материал включает этикетку, указывающую, что модифицированные полипептиды FVII используют для лечения связанного с FVII заболевания или нарушения. Кроме того, в настоящем документе предусмотрены комплекты, включающие описанную здесь фармацевтическую композицию, устройство для введения композиции и, при необходимости, инструкции для введения. Краткое описание фигур На фиг. 1 представлен каскад свертывания крови. Показаны внутренний и внешний пути свертывания, приводящие к независимому образованию FXa, и схождение путей в общей путь для образования тромбина и фибрина с образованием сгустка. Эти пути взаимосвязаны. На чертеже изображен порядок молекул, участвующих в активации каскада, в котором зимоген преобразуется в активированную протеазу путем расщепления одной или нескольких пептидных связей. Активированная протеаза затем служит активирующей протеазой для следующей молекулы зимогена в каскаде, что, в конечном счете, приводит к образованию сгустка. На фиг. 2 приведена клеточная модель свертывания (см., например, Hoffman и др., (2001) ThrombHaemost 85:958-965). Изображены акты коагуляции, разделенные на три этапа, где начало коагуляции осуществляется путем активации FX с образованием FXa под действием ТФ/FVIIa комплекса на несущей ТФ клетке, в результате чего образуется небольшое количество тромбина в результате активации FXa/FVa комплексом. Усиление каскада происходит при связывании тромбина с тромбоцитами и их активации, что инициирует активацию достаточного количества соответствующих факторов свертывания крови для образования FVIIIa/FIX и FVa/FXa комплексов. Распространение коагуляции происходит на поверхности большого количества активированных тромбоцитов в месте повреждения, что приводит к быстрому увеличению количества тромбина, образующего достаточное количество фибрина из фибриногена для формирования сгустка в месте повреждения. На фиг. 3 приведены механизмы, посредством которых FVIIa могут инициировать образование тромбина. Фиг. 3 иллюстрирует ТФ-зависимый путь образования тромбина фактором FVIIa, который действует на поверхности ТФ-несущей клетки и включает образование комплекса FVIIa с ТФ для активации FX с образованием FXa. На фигуре также показаны ТФ-независимые пути образования тромбина фактором FVIIa, в ходе которых FVIIa связывается с фосфолипидами на поверхности активированных тромбоцитов и активирует FX в FXa, который, в свою очередь, образует комплекс с FVa и расщепляет протромбин с образованием тромбина. Подробное раскрытие изобретения Последовательность изложения.a. Зависимая от тканевого фактора активность FVIIab. He зависимая от тканевого фактора активность FVIIa 6. FVII как лекарственное средствоD. Модифицированные полипептиды FVII 1. Увеличение каталитической активности а. Примеры изменений для увеличения каталитической активностиI. Основные аминокислотные замены в положении 286.II. Другие мутации в положении 286. 2. Повышенная устойчивость к АТ-III. Примеры модификаций для достижения повышенной устойчивости к АТ-III. 3. Повышенная устойчивость к ингибированию Zn2+. Примеры модификаций для повышения устойчивости к ингибированию Zn2+. 4. Изменение гликозилирования. Примеры модификаций для изменения гликозилирования. 5. Увеличение связывания сывороточного альбумина и/или интегрина тромбоцитов IIb3. а. Примеры полипептидов FVII со связывающей сывороточный альбумин последовательностью.b. Примеры полипептидов FVII со связывающей интегрин тромбоцитов IIb3 последовательностью 6. Модификация введением гетерологичного домена Gla 7. Дополнительные модификации и их комбинацииa. Модификации, которые повышают устойчивость к TFPIb. Модификации, которые увеличивают собственную активностьc. Модификации, которые повышают устойчивость к протеазамd. Модификации, которые повышают аффинность к фосфолипидамf. Модификации, которые облегчают связывание химических группF. Оценка активности модифицированных полипептидов FVIIe. Связывание фосфолипидов 2. Не человеческие животные модели 3. Клинические анализыb. Лекарственные формы 2. Введение модифицированных полипептидов FVII 3. Введение нуклеиновой кислоты, кодирующей модифицированные полипептиды FVII (генная терапия) Н. Терапевтическое применение 1. Врожденные связанные с кровоточивостью нарушенияc. другие 2. Приобретенные нарушения свертываемости кровиd. кровотечение вследствие антикоагулянтной терапииe. приобретенная гемофилия 3. Кровотечения вследствие травмы и хирургического вмешательстваK. Примеры А. Определения. Если не указано иное, все технические и научные термины, используемые здесь, имеют тот же смысл, как это обычно понимается специалистом в области техники, к которой относится изобретение. Если не указано иное, все патенты, заявки, опубликованные заявки и публикации, последовательностиGenbank, базы данных, веб-сайты и другие опубликованные материалы, упомянутые в настоящем документе, приведены в качестве ссылки в полном объеме. Если для упоминаемого в настоящем документе термина существует множество определений, предпочтительно приведенное в этом разделе определение. В случае приведения ссылки на URL или другого подобного идентификатора или адреса понимается, что идентификатор может изменяться и информация в сети Интернет может появляться и исчезать, но аналогичную информацию можно найти в сети Интернет. Подобная ссылка свидетельствует о наличии ин- 14020818 формации и открытом доступе. В настоящем документе термины "путь свертывания" или "свертывание" относятся к серии актов активации, которые приводят к образованию нерастворимого сгустка фибрина. В каскаде или пути свертывания неактивные сериновые протеазы (также называемые зимогенами) превращаются в активные протеазы путем расщепления одной или нескольких пептидных связей, указанные протеазы затем служат для активации следующей молекулы протеазы в каскаде. На конечном этапе протеолитического каскада фибриноген протеолитически расщепляется тромбином с образованием фибрина, который затем сшивается в месте повреждения и формирует сгусток. В настоящем документе термин"гемостаз" относится к остановке кровотечения или притока крови в орган или часть тела. Термин гемостаз может охватывать весь процесс свертывания крови для предотвращения потери крови после повреждения кровеносного сосуда и последующее растворение тромба после восстановления тканей. В настоящем документе термины "коагуляция" или "свертывание" относятся к образованию нерастворимых сгустков фибрина или к процессу, посредством которого факторы свертывания крови взаимодействуют в каскаде свертывания, что, в конечном счете, приводит к образованию нерастворимых сгустков фибрина."Протеаза" представляет собой фермент, который катализирует гидролиз ковалентной пептидной связи. Этот термин включает зимогенную форму и активированные одноцепочечную и двухцепочечную формы протеаз. Упоминание протеазы относится ко всем формам. В зависимости от каталитической активности их активного центра и механизма расщепления пептидных связей в целевом субстрате протеазы включают, например, сериновые протеазы, цистеиновые протеазы, аспарагиновые протеазы, треониновые протеазы и металлопротеазы. В настоящем документе сериновые протеазы или сериновые эндопептидазы относятся к классу пептидаз, которые характеризуются наличием остатка серина в активном центре фермента. Сериновые протеазы участвуют в широком спектре функций в организме, в том числе в свертывании крови и воспалении, а также функционируют в качестве пищеварительных ферментов у прокариот и эукариот. Механизм расщепления связей сериновыми протеазами основан на нуклеофильной атаке целевой пептидной связи серином. Цистеин, треонин или молекула воды, связанная с аспартатом или металлом, также могут играть эту роль. Выровненные боковые цепи серина, гистидина и аспартата формируют каталитическую триаду, общую для большинства сериновых протеаз. Активный центр сериновых протеаз представляет собой расщелину, где связывается полипептидный субстрат. Рассматриваемый в настоящем документе фактор VII (FVII, F7, также упоминается как фактор 7,фактор свертывания VII, сывороточный фактор VII, сывороточный ускоритель преобразования протромбина, SPCA, проконвертин и эптаког ) относится к сериновым протеазам, которые являются частью каскада свертывания. FVII включает домен Gla, два EGF домена (EGF-1 и EGF-2) и домен сериновой протеазы (или пептидазный домен S1), который высоко консервативен у всех членов семейства пептидазы S1 сериновых протеаз, например химотрипсина. Последовательность примера предшественника FVII с сигнальным пептидом и пропептидом приведена в SEQ ID NO: 1. Пример зрелого полипептида FVII приведен в SEQ ID NO: 3. FVII встречается в одноцепочечной зимогенной, зимогеноподобной двухцепочечной цепи и полностью активированной двухцепочечной форме. Полная активация, которая происходит при конформационном изменении зимогеноподобной формы, происходит при связывании с кофактором фермента, тканевым фактором. Кроме того, могут быть введены мутации, приводящие к конформационным изменениям в отсутствие тканевого фактора. Следовательно, упоминание FVII включает его одноцепочечные и двухцепочечные формы, включая зимогеноподобную и полностью активированную двухцепочечные формы. При упоминании полипептида FVII также подразумевают полипептиды-предшественники и зрелые полипептиды FVII в одноцепочечной или двухцепочечной форме, их активные усеченные формы, подразумевают аллельные варианты и видовые варианты, варианты, кодируемые вариантами сплайсинга, и другие варианты, в том числе полипептиды по меньшей мере на 40, 45, 50, 55, 65, 70, 75, 80, 85, 90, 95,96, 97, 98, 99 или более идентичные последовательности предшественника полипептида, приведенной вSEQ ID NO: 1 или последовательности его зрелой формы. Также подразумевают модифицированные полипептиды FVII, такие как приведенные в SEQ ID NO: 113 и 273 и их варианты. Также подразумевают полипептиды, которые сохраняют по меньшей мере одну активность FVII, такую как связывание ТФ,связывание фактора X, связывание фосфолипидов и/или коагулянтная активность FVII. При сохранении активности она может быть изменена, например снижена или повышена по сравнению с FVII дикого типа, пока уровень сохраненной активности достаточен для получения заметного воздействия. Полипептиды FVII включают, но не ограничиваются, тканеспецифическими изоформами и их аллельными вариантами, синтетическими молекулами, полученными трансляцией нуклеиновых кислот, белками, полученными химическим синтезом, таким как синтез, который включает лигирование коротких полипептидов,белками, полученными рекомбинантными методами, белками, выделенными из человеческих и не человеческих тканей и клеток, химерными полипептидами FVII и их модифицированными формами. FVII полипептиды также включают фрагменты или части FVII, которые имеют достаточную длину или включают соответствующие районы для сохранения по меньшей мере одного вида активности (при активации при необходимости) полноразмерного зрелого полипептида. Полипептиды FVII также включают полипептиды с химическими или посттрансляционными модификациями и полипептиды без химических или посттрансляционных модификаций. Такие модификации включают, но не ограничиваются, пегилированием, альбуминированием, гликозилированием, фарнизилированием, карбоксилированием, гидроксилированием, фосфорилированием и другими известными в уровне техники модификациями полипептидов. Примеры полипептидов FVII включают полипептиды млекопитающих, включая человека. Примеры аминокислотных последовательностей FVII человеческого происхождения приведены в SEQ ID1, 2 и 3. Примеры вариантов таких человеческих полипептидов FVII включают любые полипептидыпредшественники, приведены в SEQ ID NO: 18-74. Полипептиды FVII также включают любые полипептиды не человеческого происхождения, включая, но не ограничиваясь, мышиными, собачьими, кошачьими, заячьими, птичьими, бычьими, бараньими, свиными, лошадиными, рыбьими, лягушачьими полипептидами и полипептидами фактора VII приматов. Примеры FVII полипептидов не человеческого происхождения включают, например, полипептиды коровы (Bos taurus, SEQ ID NO: 4), мыши (Mus musculus,SEQ ID NO: 5), карликового шимпанзе (Panpaniscus, SEQ ID NO: 6), шимпанзе (Pan troglodytes, SEQ IDNO: 14), курицы (Gallus Gallus , SEQ ID NO: 15), орангутанга (Pongo pygmaeus, SEQ ID NO: 16) и гориллы (Gorilla gorilla, SEQ ID NO: 17). Специалисту в данной области техники очевидно, что указанные позиции зрелого полипептида фактора VII (SEQ ID NO: 3) отличаются на 60 аминокислотных остатков от позиций изоформы предшественника полипептида FVII, приведенной в SEQ ID NO: 1, где изоформа полипептида фактора VII содержит сигнальный пептид и пропептидную последовательность. Таким образом, первая аминокислота из SEQ ID NO: 3 соответствует шестьдесят первому (61) аминокислотному остатку из SEQ ID NO: 1. Специалисту в данной области также очевидно, что указанные позиции зрелого полипептида фактора VII(SEQ ID NO: 3) отличаются на 38 аминокислотных остатков от позиций предшественника полипептидаFVII, приведенного в SEQ ID NO: 2, который представляет собой изоформу b полипептида фактора VII,содержащую сигнальный пептид и пропептидную последовательность. Таким образом, первый аминокислотный остаток из SEQ ID NO: 3 соответствует тридцать девятому (39) аминокислотному остатку изSEQ ID NO: 2. В настоящем документе "соответствующие остатки" относятся к остаткам, которые находятся в соответствующих локусах. Близкие полипептиды или варианты полипептидов могут быть выровнены любым способом, известным специалистам в данной области. При таких способах обычно добиваются максимального совпадения, и способы включают выравнивание вручную и выравнивание с помощью многочисленных доступных программ выравнивания (например, BLASTP и другие известные специалистам в данной области программы). По выравниванию последовательностей полипептидов специалист в данной области может определить соответствующие остатки, используя консервативные и идентичные аминокислотные остатки в качестве ориентиров. Например, за счет выравнивания последовательностей полипептидов фактора VII, используя консервативные и идентичные аминокислотные остатки в качестве ориентиров, специалист в данной области может определить соответствующие остатки. Например, аланин в положении 1 (А 1) из SEQ ID NO: 3 (зрелый фактор VII) соответствует аланину в положении 61(А 61) из SEQ ID NO: 1 и аланину в положении 39 (A39) из SEQ ID NO: 2. В других случаях могут быть идентифицированы соответствующие районы. Например, домен Gla соответствует аминокислотным позициям с А 1 до F45 из SEQ ID NO: 3, аминокислотным позициям с А 61 до S105 из SEQ ID NO: 1 и аминокислотным позициям с А 39 до S83 из SEQ ID NO: 2. Специалист в данной области также может использовать консервативные аминокислотные остатки в качестве ориентиров для нахождения соответствующих аминокислотных остатков между человеческими и не человеческими последовательностями и среди человеческих и не человеческих последовательностей. Например, аминокислотные остатки с S43 до Е 163 из SEQ ID NO: 3 (человеческий) соответствуют остаткам с S83 до Е 203 из SEQ ID NO: 4 (бычий). Нахождение соответствующих позиций также может быть основано на структурном выравнивании,например компьютерном выравнивании, структуры белка. В других случаях могут быть идентифицированы соответствующие районы. В настоящем документе термины "прорайон", "пропептид" или "пропоследовательность" относятся к домену или сегменту, которые расщепляются с образованием зрелого белка. Они могут включать сегменты, функционирующие для подавления протеолитической активности,маскирующие каталитический центр и, таким образом, предотвращающие образование каталитического интермедиата (т.е. пространственно блокирующие сайт связывания субстрата). Прорайон представляет собой аминокислотную последовательность, расположенную на N-конце зрелого биологически активного полипептида, и может состоять всего лишь из нескольких аминокислот или представлять собой многодоменную структуру. В настоящем документе термин "зрелый фактор VII" относится к полипептиду FVII, у которого отсутствует сигнальная последовательность и пропептидная последовательность. Как правило, сигнальная последовательность направляет белок для секреции через эндоплазматический ретикулум (ЭР) и через аппарат Гольджи и отщепляется после прохождения в ЭР в процессе трансляции. Пропептидная последовательность функционирует при посттрансляционной модификации белка и отщепляется до секреции белка из клетки. Таким образом, зрелый белок FVII представляет собой секретируемый белок. В одном примере зрелый человеческий полипептид FVII приведен в SEQ ID NO: 3. Приведенная в SEQ ID NO: 3 аминокислотная последовательность отличается от последовательностей полипептидовпредшественников, приведенных в SEQ ID NOS: 1 и 2, в последовательности SEQ ID NO: 3 отсутствует сигнальная последовательность, которая соответствует остаткам 1-20 в SEQ ID NOS: 1 и 2; и отсутствует пропептидная последовательность, соответствующая аминокислотным остаткам 21-60 в SEQ ID NO: 1 и аминокислотным остаткам 21-38 в SEQ ID NO: 2. Упоминание зрелого полипептида FVII относится к одноцепочечной зимогенной форме и двухцепочеченой форме. В настоящем документе термины "белок дикого типа" или "нативный белок" по отношению к полипептиду FVII обозначают полипептид FVII, кодируемый нативным или встречающимся в естественных условиях геном, включая аллельные варианты, присутствующие в организме, таком как человек или другие животные. Упоминание фактора VII дикого типа без упоминания вида относится к факторам VII дикого типа любого вида. Полипептиды FVII дикого типа включают полипептиды-предшественники, их фрагменты и процессированные формы, включая полипептиды без сигнального пептида, а также любые их пре- или посттрансляционно процессированные формы. Полипептиды FVII дикого типа также включают посттрансляционно модифицированные полипептиды, включая, но не ограничиваясь гликозилированными, карбоксилированными и гидроксилированными полипептидами. Нативные полипептиды FVII также включают одноцепочечные и двухцепочечные формы. Например, у людей экспрессируется нативный FVII. Примеры аминокислотной последовательности человеческого FVII дикого типа приведены вSEQ ID NOS: 1, 2 и 3, а аллельные варианты и их зрелые формы приведены в SEQ ID NOS: 44-100. Другие животные также производят нативный FVII, включая, но не ограничиваясь, коровой (Bos taurus, SEQ(Pongo pygmaeus, SEQ ID NO: 16) и гориллой (Gorilla gorilla, SEQ ID NO: 17). В настоящем документе "видовые варианты" относятся к вариантам полипептидов среди различных видов, в том числе различных видов млекопитающих, таких как мышь и человек. В настоящем документе аллельные варианты относятся к изменениям в белках среди представителей одного и того же вида. В настоящем документе варианты сплайсинга относятся к вариантам, образованным в результате различного процессинга первичного транскрипта геномной ДНК, что приводит к более чем одному типу мРНК. В настоящем документе термин "зимоген" относится к протеазам, которые активируются посредством протеолитического расщепления, в том числе расщепления, приводящего к созреванию, такого как активационное расщепление, и/или посредством образования комплекса с другим белком(белками) и/или кофактором(кофакторами). Зимоген является неактивным предшественником протеолитических ферментов. Такие предшественники, обычно, хотя и не обязательно, обладают большим размером, чем активная форма белка. Зимогены сериновых протеаз преобразуются в активные ферменты путем специфического расщепления, в том числе каталитического и автокаталитического расщепления, или путем связывания активирующего кофактора, которое приводит к активному ферменту. Как правило, зимогены присутствуют в одноцепочечной форме. Зимогены, как правило, являются неактивными и могут быть преобразованы в зрелый активный полипептид каталитическим или автокаталитическим расщеплением по одному или нескольким протеолитическим сайтам с образованием мультицепочечного, такого как двухцепочечный, полипептида. Зимоген, таким образом, представляет собой ферментативно неактивный белок, который преобразуется в протеолитический фермент под действием активатора. Расщепление может быть осуществлено посредством самоактивации. Множество белков свертывания представляют себя зимогены, они неактивны, но расщепляются и активируются при инициировании системы свертывания после повреждения сосуда. Полипептиды FVII существуют в плазме крови в виде зимогенов до расщепления протеазами, такими как, например, активированный фактор IX (FIX), активированный фактор X (FXa),активированный фактор XII (FXIIa), тромбин, или до самоактивации с образованием зимогеноподобной двухцепочечной формы, которая затем требует дальнейшего изменения конформации для полноценной активности. В настоящем документе "зимогеноподобный" белок или полипептид относится к белку, который был активирован протеолитическим расщеплением, но еще обладает свойствами, которые связывают белок с зимогеном, такими как, например, низкая или нулевая активность или конформация, которая напоминает конформацию зимогенной формы белка. Например, при отсутствии связи с тканевым фактором двухцепочечная активированная форма FVII является зимогеноподобным белком, она сохраняет похожую на нерасщепленный зимоген FVII конформацию и поэтому обладает очень низкой активностью. При связывании с тканевым фактором двухцепочечная активированная форма FVII претерпевает конформационные изменения и приобретает свою полную активность фактора свертывания. В настоящем документе "активационная последовательность" относится к аминокислотной последовательности зимогена, которая представляет собой сайт, необходимый для активационного расщепле- 17020818 ния или расщепления для созревания с образованием активной протеазы. Расщепление активационной последовательности может быть автокаталитическим или катализироваться активирующим партнером. В настоящем документе "активационное расщепление" является одним из видов расщепления для созревания, которое вызывает изменение конформации, необходимое для проявления полной ферментативной активности. Это классический путь активации, например, для сериновых протеаз, в которых расщепление приводит к появлению нового N-конца, взаимодействующего с консервативным районом протеазы, таким как Asp194 в химотрипсине, что вызывает конформационные изменения, необходимые для проявления активности. Активация может привести к образованию мультицепочечной формы протеазы. В некоторых случаях одноцепочечная форма протеазы может проявлять протеолитическую активность. Используемый в настоящем документе термин "активированный фактор VII" или "FVIIa" относится к любой двухцепочечной форме полипептида FVII. Двухцепочечная форма обычно является результатом протеолитического расщепления, но может быть получена синтетическим путем. Активированный фактор VII, таким образом, включает зимогеноподобную двухцепочечную форму с низкой коагулянтной активностью, полностью активированную форму (с приблизительно в 1000 раз большей активностью),которая образуется при связывании с тканевым фактором, и мутированные формы, которые существуют в полностью активированной двухцепочечной форме или проходят конформационные изменения с образованием полностью активированной формы. Например, одноцепочечная форма полипептида FVII (см.,например, SEQ ID NO: 3) претерпевает протеолитическое расщепление между аминокислотными остатками R152 и 1153 зрелого полипептида FVII. Продукты расщепления, тяжелая цепь FVII и легкая цепьFVII, которые удерживаются вместе дисульфидной связью (между аминокислотными остатками С 135 и С 262 в FVII из SEQ ID NO: 3), образуют двухцепочечный активированный FVII фермент. Протеолитическое расщепление может быть осуществлено, например, активированным фактором IX (FIX), активированным фактором X (FXa), активированным фактором XII (FXIIa), тромбином или путем самоактивации. В настоящем документе "свойство" полипептида FVII относится к физическим или структурным свойствам, таким как трехмерная структура, pI, период полураспада, конформация и другие подобные физические характеристики. В настоящем документе "активность" полипептида FVII относится к любой активности, проявляемой полипептидом фактора VII. Такие активности могут быть исследованы in vitro и/или in vivo и включают, но не ограничиваются, свертывание или коагулянтную активность, прокоагулянтную активность,протеолитическую или каталитическую активность, такую как активация фактора X (FX) или активация фактора IX (FIX), антигенность (способность связываться с анти-FVII антителом или конкурировать с полипептидом за связывание с анти-FVII антителом), способность связывать тканевый фактор, фактор X или фактор IX и/или способность связываться с фосфолипидами. Активность может быть оценена in vitro или in vivo с использованием признанных тестов, например путем измерения свертывания in vitro или invivo. Результаты таких анализов показывают, что полипептид проявляет активность, которая может коррелировать с активностью полипептида in vivo, где in vivo активность может быть оценена как биологическая активность. Анализы для определения функциональности или активности модифицированной формы FVII известны специалистам в данной области. Примеры тестов для оценки активности полипептида FVII включают анализ на тромбопластиновое время (ТВ), или анализ на активированное частичное тромбопластиновое время (АЧТВ) для оценки коагулянтной активности, или анализы с использованием хромогенных синтетических субстратов, как описано в примерах ниже, для оценки каталитической или протеолитической активности. В настоящем документе выражение "проявление по меньшей мере одного вида активности" или"сохранение по меньшей мере одного вида активности" относится к активности модифицированного полипептида FVII по сравнению с немодифицированным полипептидом FVII того же вида и в тех же условиях. Например, модифицированный полипептид FVII в двухцепочечной форме сравнивают с немодифицированным полипептидом FVII в двухцепочечной форме в одинаковых экспериментальных условиях, где различием между двумя полипептидами является только модификация исследуемого полипептида. В качестве другого примера модифицированный полипептид FVII в одноцепочечной форме сравнивают с немодифицированным полипептидом FVII в одноцепочечной форме в одинаковых экспериментальных условиях, где различием между двумя полипептидами является только модификация исследуемого полипептида. Как правило, модифицированный полипептид FVII, который сохраняет и проявляет по меньшей мере один вид активности немодифицированного полипептида FVII в такой же форме, сохраняет активность в достаточной степени, поэтому при введении in vivo модифицированный полипептид FVII терапевтически эффективен в качестве прокоагулянтного лекарственного средства. В большинстве случаев для проявления терапевтической эффективности в качестве прокоагулянта модифицированный полипептид FVII должен сохранить приблизительно 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15,16, 17, 18, 19, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500% или более от активности немодифицированного полипептида FVII в той же форме, который проявляет терапевтическую эффективность как прокоагулянт. Активность, которая необходима для поддержания терапевтической эффективности в качестве прокоагулянта, может быть определена эмпирически, если это необходимо. Как правило, сохранение от 0,5 до 20%, от 0,5 до 10%, от 0,5 до 5% активности достаточно для сохранения терапевтической эффективности в качестве прокоагулянта in vivo. Подразумевается, что проявляемая или сохраненная модифицированным полипептидом FVII активность может представлять собой любую активность, включая, но не ограничиваясь коагуляцией или коагулянтной активностью, прокоагулянтной активностью; протеолитической или каталитической активностью, такой как активация фактора X (FX) или активация фактора IX (FIX); антигенностью (способностью связываться с анти-FVII антителом или конкурировать с полипептидом за связывание с антиFVII антителом); способностью связывать тканевый фактор, фактор X или фактор IX; и/или способностью связываться с фосфолипидами. В некоторых случаях модифицированный полипептид FVII может сохранять активность FVII, при этом активность увеличена по сравнению с немодифицированным полипептидом FVII. В некоторых случаях модифицированный полипептид FVII может сохранять активность,при этом активность снижена по сравнению с немодифицированным полипептидом FVII. Активность модифицированного полипептида FVII может составлять любой процент от активности немодифицированного полипептида, включая, но не ограничиваясь, 1, 2, 3, 4, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 95, 96,97, 98, 99, 100, 200, 300, 400, 500% или более от активности немодифицированного полипептида, где оба полипептида представлены в одной форме. Например, модифицированный полипептид FVII может обладать повышенной или пониженной активностью по сравнению с немодифицированным полипептидомFVII в той же форме. Например, он может сохранить по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7,8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 95, 96, 97, 98% или по меньшей мере 99% от активности немодифицированного полипептида FVII. В других вариантах активность увеличена по меньшей мере приблизительно в 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000 раз или более по сравнению с немодифицированным FVII. Конкретный уровень сохраненной активности зависит от предполагаемого использования полипептида и может быть определен эмпирически. Активность может быть измерена, например, с использованием in vitro или in vivo анализов, таких как анализы,описанные здесь или в примерах ниже. В настоящем документе "активность свертывания", "коагулянтная активность" или "прокоагулянтная активность" относятся к способности полипептида вызывать коагуляцию. Анализы для оценки коагулянтной активности известны специалистам в данной области и включают анализ на протромбиновое время (ПВ) или анализ на активированное частичное тромбопластиновое время (АЧТВ). В настоящем документе термины "каталитическая активность" или "протеолитическая активность" со ссылкой на FVII относятся к способности белка FVII катализировать протеолитическое расщепление субстрата и являются взаимозаменяемыми. Анализы для оценки такой активности известны в данной области техники. Например, протеолитическая активность FVII может быть измерена с помощью хромогенных субстратов, таких как субстрат Spectrozyme FVIIa (CH3SO2-D-CHA-But-Arg-pNA), где за расщеплением субстрата следят по оптическому поглощению и скорость гидролиза субстрата определяют с помощью линейной регрессии. В настоящем документе термин "собственная активность" со ссылкой на FVII относится к каталитической, протеолитической и/или коагулянтной активности белка FVII в отсутствие тканевого фактора. В настоящем документе термин "домен" (представляет собой последовательность из трех или более, как правило 5, 7 и более аминокислот) относится к части молекулы, такой как белок или кодирующая нуклеиновая кислота, которая структурно и/или функционально отличается от других частей молекулы и является идентифицируемой. Например, домены включают те участки полипептидной цепи, которые способны самостоятельно формировать складчатую структуру в белке, состоящую из одного или нескольких структурных мотивов и/или распознаваемую по функциональной активности, такой как протеолитическая активность. Белок может иметь один или несколько различных доменов. Например, домен может быть идентифицирован, определен или различен по гомологии последовательности в близких членах семейства, такой как гомология с мотивами, которые определяют протеазный домен или Gla домен. В другом примере домен можно отличить по его функции, например по протеолитической активности или способности взаимодействовать с биомолекулами, например, по связыванию ДНК, связыванию лиганда и димеризации. Домен самостоятельно может проявлять биологическую функцию или активность, так что домен самостоятельно или при слиянии с другой молекулой может проявлять активность,такую как, например, протеолитическая активность или способность связывать лиганд. Домен может представлять собой линейную последовательность аминокислот или не линейную последовательность аминокислот. Многие полипептиды содержат множество доменов. Такие домены известны и могут быть идентифицированы специалистами в данной области. Для иллюстративных целей в настоящем документе приводятся определения, но подразумевается, что специалист в данной области может распознать конкретный домен по названию. Если необходимо, для выявления доменов может быть использовано соответствующее программное обеспечение. В настоящем документе "протеазный домен" представляет собой каталитически активную часть протеазы. Упоминание протеазного домена протеазы подразумевает одно-, двух- и мультицепочечные формы любого из белков по настоящему изобретению. Протеазный домен белка содержит все необходимые свойства для проявления его протеолитической активности, такие как, например, каталитический центр. Протеазный домен FVII обладает гомологией и структурным сходством с протеазными доменами белков семейства химотрипсина/трипсина, включая каталитическую триаду. Например, в последовательности зрелого полипептида FVII, приведенной в SEQ ID NO: 3, протеазный домен соответствует аминокислотным позициям с 153 до 392. В настоящем документе "-карбоксиглутаматный (Gla) домен" относится к части белка, например витамин K-зависимого белка, которая содержит посттрансляционные модификации путем витамин Kзависимого карбоксилирования глутаматных аминокислотных остатков, как правило, большей части, но не всех глутаматных аминокислотных остатков. Gla домен ответственен за высокоаффинное связывание ионов кальция и связывание отрицательно заряженных фосфолипидов. Как правило, домен Gla начинается на N-конце зрелой формы витамин K-зависимых белков и заканчивается консервативным ароматическим остатком. В зрелом полипептиде FVII домен Gla соответствует аминокислотным позициям с 1 по 45 в примере полипептида, приведенном в SEQ ID NO: 3. Домены Gla хорошо известны и их локусы в конкретных полипептидах могут быть определены. Домены Gla различных витамин K-зависимых белков обладают гомологией последовательности, структурной и функциональной гомологией, включая кластеризацию N-концевых гидрофобных остатков в гидрофобную группу, которая выступает посредником во взаимодействии с отрицательно заряженными фосфолипидами на поверхности мембраны клетки. Примеры других Gla-содержащих полипептидов включают, но не ограничиваются, FIX, FX, протромбином,белком С, белком S, остеокальцином, белком Gla, Growth-arrest-specific белком 6 (Gas6) и белком Z. Домены Gla этих и других белков приведены в любой из последовательностей SEQ ID NO: 83-94. Используемые в настоящем документе термины "нативный" или "эндогенный" со ссылкой на доменGla относятся к нативному домену Gla, связанному со всем полипептидом или частью полипептида, обладающего доменом Gla. Для целей настоящего изобретения нативный домен Gla упоминают в связи с полипептидом FVII. Например, нативный домен Gla из FVII, приведенный в SEQ ID NO: 92, соответствует аминокислотам 1-45 из последовательности аминокислот, приведенной в SEQ ID NO: 3. В настоящем документе "гетерологичный домен Gla" представляет собой домен Gla из полипептида того же вида или другого вида, который не является Gla доменом FVII. Примеры гетерологичного домена Gla включают домены Gla из Gla-содержащих полипептидов,включая, но не ограничиваясь, FIX, FX, протромбин, белок С, белок S, остеокальцин, матриксный белокGla, Growth-arrest-specific белоком 6 (Gas6) и белком Z. Домены Gla этих и других белков приведены в любой из последовательностей SEQ ID NO: 83-91, 93 и 94. В настоящем документе "непрерывная часть домена Gla" относится по меньшей мере к двум или нескольким непрерывно соединенным аминокислотам, как правило, 2, 3, 4, 5, 6, 8, 10, 15, 20, 30, 40 или более аминокислотам вплоть до всех аминокислот, которые составляют домен Gla. Используемый в настоящем документе термин "достаточная для связывания фосфолипидов часть домена Gla" относится по меньшей мере к одной аминокислоте, как правило, 2, 3, 4, 5, 6, 8, 10, 15 или более аминокислотам домена, но менее чем всем аминокислотам домена, при этом полипептид, который содержит такие аминокислоты, связывает фосфолипиды. Используемый в настоящем документе термин "замена" по отношению к домену Gla или термин"замена домена Gla" относится к процессу, посредством которого эндогенный домен Gla белка заменен с использованием рекомбинантных, синтетических или других методов на домен Gla другого белка. В контексте "замены домена Gla" "домен Gla" представляет собой любой набор аминокислот из домена Gla и соседних районов, который сохраняет способность связывать фосфолипиды. Как правило, замена домена Gla включает замену от 40 до 50 аминокислот эндогенного белка последовательностью от 40 до 50 аминокислот другого белка, но может включать меньше или больше аминокислот. Используемый в настоящем документе термин "домен эпидермального фактора роста" (EGF) (EGF1 или EGF-2) относится к части белка, обладающей гомологией последовательности со специфической частью последовательности эпидермального фактора роста (EGF), включающей от 30 до 40 аминокислотных остатков. EGF домен включает шесть остатков цистеина, которые (в EGF) образуют дисульфидные связи. Основой структуры домена EGF является двухцепочечный -лист, за которым следует петля с коротким С-концевым двухцепочечным листом. FVII включает два домена EGF: EGF-1 и EGF-2. Эти домены соответствуют аминокислотным позициям 46-82 и 87-128 соответственно, в последовательности зрелого полипептида FVII, приведенной в SEQ ID NO: 3. В настоящем документе термины "немодифицированный полипептид" или "немодифицированныйFVII" и их грамматические модификации относятся к исходному полипептиду, который был выбран для модификации, как это предусмотрено в настоящем документе. Исходный полипептид может представлять собой природную форму, дикий тип полипептида. Кроме того, исходный полипептид может быть изменен или мутирован, так что он отличается от нативной изоформы дикого типа, но, тем не менее, полипептид может упоминаться в настоящем документе в качестве исходного немодифицированного полипептида по отношению к последующей его модификации, производимой по настоящему документу. Таким образом, известные в уровне техники белки, которые были изменены для получения желаемого увеличения или уменьшения конкретного вида активности или свойства по сравнению с немодифицированным белком, могут быть выбраны и использованы в качестве исходного немодифицированного полипеп- 20020818 тида. Например, белок, который был изменен относительно его нативной формы путем одной или нескольких аминокислотных замен и который обладает увеличенным или уменьшенным требуемым свойством, например белок, в котором модифицирован аминокислотный остаток или остатки для изменения гликозилирования, может представлять собой целевой белок для дальнейшей модификации того же или другого свойства и упоминаться в настоящем документе как немодифицированный. Примеры модифицированных полипептидов FVII известны и включают любые полипептиды FVII описанные, например, в патентах США 5580560, 6017882, 6693075, 6762286 и 6806063, опубликованных заявках США 20030100506 и 20040220106 и международных заявкахWO 1988010295, WO 200183725, WO 2003093465, WO 200338162, WO 2004083361, WO 2004108763, WO 2004029090, WO 2004029091, WO 2004111242 и WO 2005123916. Используемые здесь термины "модифицированные полипептиды фактора VII" и "модифицированный фактор VII" относятся к полипептиду FVII, который обладает одним или более отличиями аминокислотной последовательности по сравнению с немодифицированным полипептидом фактора VII. Одно или несколько отличий аминокислотной последовательности могут представлять собой мутации аминокислот, такие как одну или несколько аминокислотных замен (замещений), вставок и удалений или могут представлять собой вставку и удаление целых доменов, а также любые их комбинации. Как правило, модифицированный полипептид FVII обладает одним или несколькими модификациями первичной последовательности по сравнению с немодифицированным полипептидом FVII. Например, модифицированный полипептид FVII, предусмотренный в настоящем документе, может обладать 1, 2, 3, 4, 5, 6, 7, 8, 9,10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 30, 40, 50 или более аминокислотными отличиями по сравнению с немодифицированным полипептидом FVII. Любые модификации допустимы, пока полученный полипептид проявляет по меньшей мере одну активность нативного полипептида FVII, такую как, например, каталитическая активность, протеолитическая активность, способность связывать ТФ или способность связываться с активированными тромбоцитами. В настоящем документе термин "ингибиторы коагуляции" относится к белкам или молекулам, которые ингибируют или предотвращают свертывание или образование сгустков. Ингибирование или предотвращение коагуляции можно наблюдать in vivo или in vitro и проанализировать с помощью любого способа, известного в уровне техники, включая, но не ограничиваясь анализом тромбопластинового времени (ТВ) или активированного частичного тромбопластинового времени (АЧТВ). В настоящем документе "ингибитор пути тканевого фактора" (TFPI, также известный как TFPI-1) является ингибитором Кунитца, который участвует в формировании четвертичного ТФ/FVIIa/TFPI/FXa ингибиторного комплекса, в котором активность FVIIa ингибирована. После альтернативного сплайсинга TFPI экспрессируется с образованием двух предшественников, TFPI (SEQ ID NO: 75) и TFPip (SEQID NO: 77) предшественников, которые расщепляются во время секреции с образованием зрелых белков,содержащих 276 аминокислот (SEQ ID NO: 76) и 223 аминокислоты (SEQ ID NO: 78) соответственно.TFPI содержит 3 домена Кунитца, из которых домен Кунитца 1 отвечает за связывание и ингибированиеFVIIa. В настоящем документе TFPI-2 (также известный как плацентарный белок 5 (РР 5) и связанный с матриксом ингибитор сериновых протеаз (MSPI относится к гомологу TFPI. Состоящий из 213 аминокислот зрелый белок TFPI-2 (SEQ ID NO: 79) содержит три домена Кунитца, которые обладают 43, 35 и 53% идентичности первичной последовательности с доменами Кунитца 1, 2, 3 TFPI-1 соответственно.TFPI-2 играет роль в регуляции расщепления и реконструкции внеклеточного матрикса и не считается важным фактором свертывания. В настоящем документе "антитромбин III" (AT-III) относится к ингибиторам сериновых протеаз(серпинам). АТ-III синтезируется в виде белка-предшественника, содержащего 464 аминокислотных остатка (SEQ ID NO: 95), который расщепляется во время секреции с образованием зрелого антитромбина,включающего 432 аминокислоты (SEQ ID NO: 96). В настоящем документе "кофакторы" относятся к белкам или молекулам, которые связываются с другими специфическими белками или молекулами с образованием активного комплекса. В некоторых примерах связывание с кофактором необходимо для оптимальной протеолитической активности. Например, тканевый фактор (ТФ) является кофактором FVIIa. Связывание FVIIa для ТФ индуцирует конформационные изменения, которые приводят к увеличению протеолитической активности FVIIa по отношению к его субстратам, FX и FIX. В настоящем документе "тканевый фактор" (ТФ) относится к трансмембранному гликопротеину,включающему 263 аминокислоты (SEQ ID NO: 97), который функционирует в качестве кофактора дляFVIIa. Тканевый фактор конститутивно экспрессируется в гладкомышечных клетках и фибробластах и способствует инициации коагуляции путем связывания FVII и FVIIa при контакте указанных клеток с кровотоком после повреждения тканей. В настоящем документе "активированные тромбоциты" относятся к тромбоцитам, в которых связывание молекул, таких как коллаген, тромбоксан А 2, АДФ и тромбин индуцирует различные изменения в морфологии, фенотипе и функции клеток, что, в конечном счете, способствует коагуляции. Например,форма активированных тромбоцитов изменяется на более аморфную форму с пальцеобразными выступами. Активированные тромбоциты также претерпевают "флип-переход" клеточной мембраны, заклю- 21020818 чающийся в перемещении фосфатидилсерина и других отрицательно заряженных фосфолипидов, которые обычно присутствуют на внутренней стороне клеточной мембраны, на внешнюю, обращенную к плазме поверхность мембраны. Мембраны активированных тромбоцитов представляют собой поверхность, на которой осуществляются многие из реакций свертывания. Активированные тромбоциты также секретируют везикулы, содержащие такие прокоагулянтные факторы, как фактора Виллебранда, FV,тромбин, АДФ и тромбоксан А 2, и склеиваются друг с другом с образованием тромбоцитной пробки,которая стабилизируется фибрином с формированием сгустка. В настоящем документе термин "увеличенное связывание и/или увеличенная аффинность к активированным тромбоцитам", а также любые его грамматические изменения относятся к увеличению способности полипептида или белка, например полипептида FVII, связываться с поверхностью активированных тромбоцитов по сравнению с исходным полипептидом или белком. Например, способность модифицированного полипептида FVII связываться с активированными тромбоцитами может быть больше, чем способность немодифицированного полипептида FVII связываться с активированными тромбоцитами. Связывание и/или аффинность полипептида к активированным тромбоцитам может быть увеличена по меньшей мере приблизительно на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400,500% или более по сравнению со связыванием и/или аффинностью немодифицированного полипептида. Анализы для определения связывания и/или аффинности полипептида к активированным тромбоцитам известны в области техники. Связывание полипептида FVII с активированными тромбоцитами опосредуется взаимодействием аминокислот в домене Gla полипептида FVII с отрицательно заряженными фосфолипидами, такими как фосфатидилсерин, на активированных тромбоцитах. Таким образом, способы анализа связывания полипептидов, таких как полипептиды FVII, с активированными тромбоцитами основаны на использовании мембран ивезикул, которые содержат фосфолипиды, такие как фосфатидилсерин. Например, способность полипептида связываться с активированными тромбоцитами отражается на способности полипептида связываться с фосфолипидными везикулами, которую можно измерить с помощью рассеяния света. В настоящем документе термин "увеличенное связывание и/или аффинность к фосфолипидам", а также любые его грамматические изменения относятся к увеличению способности полипептида или белка связываться с фосфолипидами по сравнению с исходным полипептидом или белком. Фосфолипиды могут включать любые фосфолипиды, но особенно фосфатидилсерин. Связывание и/или аффинность полипептида к фосфолипидам может быть увеличена по меньшей мере приблизительно на 1, 2, 3, 4, 5, 6,7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500% или более по сравнению со связыванием и/или аффинностью немодифицированного полипептида. Анализы для определения аффинности и/или связывания полипептида с фосфолипидами известны в уровне техники. Например, связывание полипептида FVII с фосфолипидными везикулами может быть определено по относительному рассеянию света под углом 90 к падающему свету. Для определения константы диссоциации измеряют интенсивность рассеяния света на фосфолипидных везикулах и на фосфолипидных везикулах с FVII. Для измерения аффинности полипептидов FVII к фосфолипидным мембранам также может быть использован поверхностный плазмонный резонанс, например, измеренный на биосенсоре BIAcore. В настоящем документе "повышенная устойчивость к ингибиторам", "повышенная устойчивость к АТ-III" или "повышенная устойчивость к TFPI" относятся к любому снижению чувствительности полипептида к действию ингибитора, такого как АТ-III или TFPI, по сравнению с начальным полипептидом,таким как немодифицированный полипептид FVII. Повышенная устойчивость к ингибитору, такому как АТ-III, может быть оценена по связыванию модифицированного полипептида FVII с ингибитором. Повышенная устойчивость к ингибиторам, таким как АТ-III, также может быть оценена путем измерения собственной активности или коагулянтной активности полипептида FVII в присутствии АТ-III. Анализы для определения связывания полипептида с ингибитором известны в уровне техники. Для ковалентных ингибиторов, таких как, например, АТ-III, может быть измерена константа скорости второго порядка для ингибирования. Для нековалентных ингибиторов, таких как, например, TFPI, может быть измерена константа ингибирования. Кроме того, для измерения связывания полипептидов FVII с АТ-III или другими ингибиторами также может быть использован поверхностный плазмонный резонанс, измеренный, например, с помощью биосенсора BIAcore. Однако для ковалентных ингибиторов, таких как АТ-III, с помощью BIAcore может быть измерена только скорость ассоциации. Анализы для определения ингибиторного эффекта, например ингибиторного эффекта АТ-III, на коагулянтную активность или собственную активность FVII также известны в уровне техники. Например, может быть измерена способность модифицированного полипептида FVII расщеплять его субстрат FX при наличии или в отсутствие АТIII, при этом может быть определена степень, в которой АТ-III ингибирует реакцию. Полученные результаты можно сравнить со способностью немодифицированного полипептида FVII расщеплять его субстрат FX при наличии или в отсутствие АТ-III. Модифицированный полипептид может обладать повышенной устойчивостью к ингибитору, например, повышенной на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50,60, 70, 80, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 200, 300, 400, 500% или более устойчивостью к воздействию ингибитора по сравнению с немодифицированным полипептидом. Используемые в настоящем документе термины "повышенная устойчивость к ингибированиюZn2+" означают любое уменьшение чувствительности полипептида к ингибиторному эффекту Zn2+ по сравнению с начальным полипептидом, таким как немодифицированный полипептид FVII. Повышенная устойчивость к Zn2+ может быть оценена, например, по измерению собственной активности или коагулянтной активности полипептида FVII в присутствии Zn, как описано в примере 11. Повышенная устойчивость к ингибиторному эффекту Zn2+ может быть результатом снижения связывания с Zn2+. Снижение связывания Zn2+ может быть оценено путем измерения количества связанного Zn2+ на молекулу FVIIa,путем измерения аффинности связывания Zn2+ с FVIIa или путем измерения IC50 для ингибирования активности FVIIa цинком. Модифицированный полипептид может обладать повышенной устойчивостью к воздействию Zn2+, например повышенной на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 91, 92,93, 94, 95, 96, 97, 98, 99, 100, 200, 300, 400, 500% или более устойчивостью к воздействию Zn2+ по сравнению с немодифицированным полипептидом. В настоящем документе "связывающая сывороточный альбумин последовательность" относится к последовательности аминокислотных остатков, которая может связывать сывороточный альбумин. Таким образом, при вставке в полипептид FVII связывающей сывороточный альбумин последовательности может быть увеличена аффинность или связывание полипептида FVII с сывороточным альбумином. Модифицированный полипептид может обладать повышенной аффинностью и/или связыванием с сывороточным альбумином, например повышенной на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 91,92, 93, 94, 95, 96, 97, 98, 99, 100, 200, 300, 400, 500% или более аффинностью и/или связыванием с сывороточным альбумином по сравнению с немодифицированным полипептидом. Обычно связывающая сывороточный альбумин последовательность включает 10 или более аминокислот, обычно 10, 11, 12, 13, 14,15, 20, 30, 40 или более аминокислот. Примеры связывающих сывороточный альбумин последовательностей приведены в SEQ ID NOS: 103-109. В настоящем документе "связывающая интегрин тромбоцитов IIb3 последовательность" относится к последовательности аминокислотных остатков, которая может связывать интегрин тромбоцитов IIb3. Таким образом, при вставке в полипептид FVII связывающей интегрин тромбоцитов IIb3 последовательности может быть увеличена способность полипептида FVII связывать интегрин тромбоцитов IIb3 и, следственно, тромбоциты, в том числе активированные тромбоциты. Модифицированные полипептиды FVII, включающие связывающую интегрин тромбоцитов IIb3 последовательность, проявляют увеличенную аффинность и/или связывание с интегрином IIb3 и/или тромбоцитами. Модифицированный полипептид может обладать повышенной аффинностью и/или связыванием с интегрином тромбоцитовIIb3, например повышенной на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 91, 92, 93, 94, 95,96, 97, 98, 99, 100, 200, 300, 400, 500% или более аффинностью и/или связыванием с интегрином тромбоцитов IIb3 по сравнению с немодифицированным полипептидом. Обычно связывающая интегрин тромбоцитов IIb3 последовательность содержит по меньшей мере 5 или более аминокислот, как правило, 5,6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 30, 40 или более аминокислот. Примеры связывающих интегрин тромбоцитов IIb3 последовательностей приведены в SEQ ID NO: 110-112. В настоящем документе "сайт гликозилирования" относится к аминокислоте в полипептиде, к которой может быть присоединен углеводный фрагмент. Как правило, гликозилированный белок содержит один или более аминокислотных остатков, таких как аспарагин или серин, для прикрепления углеводных фрагментов. В настоящем документе "нативный сайт гликозилирования" относится к аминокислоте, к которой в полипептиде дикого типа присоединен углеводный фрагмент. В FVII существует четыре нативных сайта гликозилирования, два сайта N-гликозилирования в положениях N145 и N322 и два сайта Огликозилирования в положениях S52 и S60, положения соответствуют позициям аминокислот в последовательности зрелого полипептида FVII, приведенной в SEQ ID NO: 3. В настоящем документе "ненативный сайт гликозилирования" относится к аминокислоте, к которой в модифицированном полипептиде присоединен углеводный фрагмент и к которой не присоединен такой фрагмент в полипептиде дикого типа. Ненативные сайты гликозилирования могут быть введены в полипептид FVII с помощью замен аминокислот. Сайты О-гликозилирования могут быть созданы, например,путем замены нативного остатка аминокислоты на серин или треонин. Сайты N-гликозилирования могут быть созданы, например, путем создания мотива Asn-XaaSer/Thr/Cys, где Хаа не является пролином. Создание указанной консенсусной последовательности модификацией аминокислот может включать, например, замену одного нативного аминокислотного остатка на аспарагин, замену одного нативного аминокислотного остатка на серин, треонин и цистеин или двойную замену аминокислот, включающую первую замену нативного аминокислотного остатка на аспарагин и вторую замену нативного аминокислотного остатка на серин, треонин и цистеин. Используемый здесь термин "биологическая активность" относится к активности соединения in vivo или физиологической реакции, которая проявляется при in vivo введении соединения, композиции или другой смеси. Биологическая активность, таким образом, охватывает терапевтический эффект и фармацевтическую активность таких соединений, композиций и смесей. Биологическую активность можно наблюдать в in vitro системах, предназначенных для исследования или использования такой активности. Таким образом, в настоящем документе биологическая активность полипептида FVII охватывает коагулянтную активность. Используемый здесь термин "оценка" и его грамматические изменения относятся к качественному и количественному определению абсолютного значения активности полипептида, а также к получению индекса, коэффициента, процента, визуального показателя или другого показателя уровня активности. Оценка может быть прямой или косвенной. Например, обнаружение расщепления субстрата полипептида может осуществляться прямым измерением продукта или косвенным путем через определение активности расщепленного субстрата. В настоящем документе термин "нумерация химотрипсина" относится к нумерации аминокислот зрелого полипептида химотрипсина из SEQ ID NO: 80. Протеазный домен другой протеазы, такой как,например, протеазный домен фактора VII, может быть выровнен с химотрипсином. В этом случае аминокислотам фактора VII, которые соответствуют аминокислотам химотрипсина, дают номера аминокислот химотрипсина. Соответствующие позиции могут быть определены специалистом в данной области техники с помощью ручного выравнивания или с помощью многочисленных доступных программ выравнивания (например, BLASTP). Соответствующие позиции также могут быть определены на основании структурного выравнивания, например с помощью компьютерного выравнивания структуры белка. Утверждение, что аминокислоты полипептида соответствуют аминокислотам указанной последовательности, относится к аминокислотам, идентифицированным в процессе выравнивания полипептида с раскрытой последовательностью с достижением максимальной идентичности или гомологии (выравниваются консервативные аминокислоты) с помощью стандартного алгоритма выравнивания, такого как алгоритм GAP. Соответствующие химотрипсиновыеномера аминокислот с 1 по 406 из полипептида FVII,приведенного в SEQ ID NO: 3, представлены в табл. 1. Аминокислотные позиции, соответствующие приведенной в SEQ ID NO: 3 последовательности, показаны обычным шрифтом, аминокислотные остатки на этих позициях выделены жирным шрифтом, соответствующие номера по нумерации химотрипсина выделены курсивом. Например, при выравнивании зрелого фактора VII (SEQ ID NO: 3) со зрелыми химотрипсином (SEQ ID NO: 80) изолейцину (I) в положении 153 в факторе VII дается номер 116 по нумерации химотрипсина. Последующие аминокислоты пронумерованы соответственно. В еще одном примере глутаминовая кислота (Е) в положении 210 зрелого фактора VII (SEQ ID NO: 3) соответствует аминокислотной позиции Е 70 по нумерации химотрипсина. Если остаток присутствует в протеазе, но отсутствует в химотрипсине, аминокислотному остатку дают буквенное обозначение. Например, остатки, которые являются частью петли с аминокислотой 60 по нумерации химотрипсина, но представляют собой вставку в последовательность фактора VII по сравнению с химотрипсином, называют, например, K60 а, I60b,K60 с и N60d. Эти остатки соответствуют K197, I198, K199 и N200 соответственно, по нумерации последовательности зрелого фактора VII (SEQ ID NO: 3). Таблица 1 Нумерация фактора VII по химотрипсину В настоящем документе "нуклеиновые кислоты" включают ДНК, РНК и их аналоги, в том числе пептидные нуклеиновые кислоты (PNA) и их смеси. Нуклеиновые кислоты могут быть одноцепочечными или двухцепочечными. Когда речь идет о зондах или праймерах, которые по желанию являются мечеными, например, обнаруживаемой меткой, например люминесцентной или радиоактивной меткой,подразумеваются одноцепочечные молекулы. Такие молекулы, как правило, обладают такой длиной, что их мишени при зондировании или праймировании библиотеки являются статистически уникальными или встречаются в виде низкого числа копий (обычно менее 5, как правило, менее 3). Обычно зонд или праймер содержит последовательность по меньшей мере из 14, 16 или 30 непрерывно расположенных нуклеотидов, комплементарных или идентичных интересующему гену. Зонды и праймеры могут включать 10, 20, 30, 50, 100 или более нуклеотидов в длину. В настоящем документе "пептид" относится к полипептиду, который включает от 2 до 40 аминокислот в длину. В настоящем документе аминокислоты, входящие в различные аминокислотные последовательности, предусмотренные здесь, обозначаются в соответствии с известными трехбуквенными или однобуквенными аббревиатурами (табл. 2). Нуклеотиды, входящие в различные фрагменты нуклеиновых кислот,называют стандартными однобуквенными обозначениями, обычно используемыми в уровне техники. В настоящем документе "аминокислота" представляет собой органическое соединение, содержащее аминогруппу и карбоксильную группу. Полипептид содержит две или более аминокислот. В настоящем документе аминокислоты включают двадцать природных аминокислот, неприродные аминокислоты и аналоги аминокислот (например, аминокислоты, у которых -атом углерода имеет боковую цепь). Аббревиатуры для аминокислотных остатков в соответствии со стандартной номенклатурой полипептидов, описанной в J. Biol. Chem., 243:3552-3559 (1969) и принятой 37 C.F.R,1.821-1.822, приведены в табл. 2. Таблица 2 Таблица соответствия Следует отметить, что все последовательности аминокислотных остатков, представленные в настоящем документе в виде формулы, ориентированы слева направо в обычном направлении от аминоконца к карбоксильному концу. Кроме того, термин "аминокислотный остаток" в широком смысле включает аминокислоты, перечисленные в табл. соответствия (табл. 2), модифицированные и необычные аминокислоты, такие как упомянутые в 37 C.F.R.1.821-1.822 и включенные здесь в качестве ссылки. Кроме того, следует отметить, что тире в начале или в конце аминокислотной последовательности указывает на пептидную связь с дальнейшей последовательностью из одного или более аминокислотных остатков, с аминоконцевой группой, такой как NH2, или с карбоксильной группой, такой как СООН. В настоящем документе термин "гидрофобные аминокислоты" включает любую из аминокислот,для которой с использованием непрерывной шкалы гидрофобности Айзенберга установлено, что она является гидрофобной. Примерами являются природные гидрофобные аминокислоты, такие как изолейцин, фенилаланин, валин, лейцин, триптофан, метионин, аланин, глицин, цистеин и тирозин (Eisenberg и др., (1982) Faraday Symp. Chem. Soc.l7:109-120). Неприродные гидрофобные аминокислоты также включены в этот термин. В настоящем документе "кислые аминокислоты" включают аспарагиновую кислоту и глутаминовуюкислоту из природных аминокислот. Неприродные кислые аминокислоты также включены в этот термин. Используемый здесь термин "природные аминокислоты" относится к 20 L-аминокислотам, которые встречаются в полипептидах. Используемый здесь термин "неприродные аминокислоты" относится к органическим соединениям,содержащим аминогруппу и карбоксильную группу, которые не являются природными аминокислотами,перечисленными в табл. 2. Неприродные аминокислоты, таким образом, включают, например, аминокислоты или аналоги аминокислот за исключением 20 природных аминокислот и включают, но не ограничиваются, D-изостереомеры аминокислот. Примеры неприродных аминокислот известны специалистам в данной области и могут быть включены в модифицированные полипептиды фактора VII. В настоящем документе "конструкция ДНК" представляет собой одноцепочечную или двухцепочечную линейную или кольцевую молекулу ДНК, которая содержит сегменты ДНК, комбинированные и составленные в порядке, не встречающемся в природе. Конструкция ДНК существует как результат человеческой деятельности и включает клоны и другие копии подвергнутых манипуляции молекул. В настоящем документе "сегмент ДНК" представляет собой часть большей молекулы ДНК с указанными свойстами. Например, сегмент ДНК, кодирующий указанный полипептид, представляет собой часть большей молекулы ДНК, например плазмиды или фрагмента плазмиды, который при его прочтении от 5'-конца к 3'-концу кодирует последовательность аминокислот указанного полипептида. Используемый здесь термин "полинуклеотид" означает одноцепочечный или двухцепочечный полимер дезоксирибонуклеотидов или рибонуклеотидов, читаемый от 5' к 3' концу. Полинуклеотиды включают РНК и ДНК и могут быть выделены из природных источников, синтезированы in vitro или получены комбинированием натуральных и синтетических молекул. Длина полинуклеотидной молекулы дается здесь в нуклеотидах (сокращенно "нт") или парах оснований (сокращенно "bp"). Термин "нуклеотиды" используется для одноцепочечных и двухцепочечных молекул, где позволяет контекст. Когда термин применяется к двухцепочечной молекуле, он используется для обозначения общей длины и является синонимом термина пара оснований. Для специалиста в данной области техники очевидно, что две цепи двухцепочечного полинуклеотида могут незначительно отличаться по длине, и концы их могут быть расположены уступом, поэтому все нуклеотиды в двухцепочечной молекуле полинуклеотида не могут образовывать пары. Такие неспаренные концы обычно не превышают 20 нуклеотидов в длину. В настоящем документе "первичная последовательность" относится к последовательности аминокислотных остатков в полипептиде. Используемый здесь термин "сходство" для двух белков или нуклеиновых кислот относится к близости аминокислотных последовательностей белков или нуклеотидных последовательностей нуклеиновых кислот. Сходство может быть основано на степени идентичности и/или гомологии последовательностей остатков. Способы оценки степени сходства белков или нуклеиновых кислот известны специалистам в данной области. Например, в одном способе оценки сходства последовательностей две аминокислотные или нуклеотидные последовательности выравнивают таким образом, чтобы достичь максимального уровня идентичности между последовательностями. Идентичность относится к степени, в которой аминокислотные или нуклеотидные последовательности инвариантны. При выравнивании аминокислотных последовательностей и в некоторой степени последовательностей нуклеотидов также можно принять во внимание консервативные различия и/или частые замены аминокислот (или нуклеотидов). Консервативными различиями являются те, при которых сохраняются физико-химические свойства участвующих остатков. Выравнивание может быть глобальным (выравнивание сравниваемых последовательностей по всей длине последовательностей и по всем остаткам) или локальным (выравнивание частей последовательностей, которые включают только наиболее близкий район или районы). Используемые здесь термины "гомология" и "идентичность" употребляются как синонимы, но гомология по отношению к белкам может включать консервативные замены аминокислот. В общем, для определения соответствующих позиций последовательности аминокислот выравнивают для достижения наибольшего совпадения (см., например, Computational Molecular Biology, Lesk, A.M., изд, Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D.W., изд, AcademicCarillo и др. (1988) SIAMJ Applied Math 48:1073). В настоящем документе термин "идентичность последовательности" относится к числу идентичных аминокислот (или нуклеотидных оснований) при сравнении исследуемого и исходного полипептида или полинуклеотида. Гомологичные полипептиды обладают заранее определенным числом идентичных или гомологичных аминокислотных остатков. Гомология подразумевает консервативные аминокислотные замены и идентичные остатки. Идентичность последовательности может быть определена по стандартному алгоритму выравнивания, использующему выбранные по умолчанию штрафы за разрыв в последовательности, установленные разработчиком. Гомологичные молекулы нуклеиновой кислоты обладают заранее определенным числом идентичных или гомологичных нуклеотидов. Гомология подразумевает замены, которые не изменяют закодированные аминокислоты (т.е. "молчащие замены") и идентичные остатки. Существенно гомологичные молекулы нуклеиновых кислот обычно гибридизуются в умеренных условиях или в жестких условиях по всей длине нуклеиновой кислоты или по меньшей мере приблизительно по 70, 80 или 90% от полной длины интересующей молекулы нуклеиновой кислоты. Также предусмотрены молекулы нуклеиновых кислот, которые содержат вырожденные кодоны вместо кодона в гибридизуемой молекуле нуклеиновой кислоты. (Для определения гомологии белков консервативные аминокислоты а также идентичные аминокислоты могут быть выровнены, в этом случае процент идентичности и процент гомологии отличаются). Обладают ли любые две молекулы нуклеиновой кислоты нуклеотидными последовательностями (или любые два полипептида имеют аминокислотные последовательности), которые по меньшей мере на 80, 85, 90, 95, 96, 97, 98 или 99% "идентичны", может быть определено с помощью известных алгоритмов, таких как программа FASTA с использованием, например,параметров по умолчанию, как описано Pearson и др., Proc. Natl. Acad. Sci. USA 85: 2444 (1988) (другие программы включают пакет программ GCG (Devereux, J., и др., Nucleic Acids Research 12(1): 387 (1984,BLASTP, BLASTN, FASTA (Atschul, S.F., и др., J. Molec. Biol. 215:403 (1990); Guide to HugeComputers,Martin J. Bishop, изд., Academic Press, San Diego (1994), и Carillo и др. SIAM J Applied Math 48: 1073(1988. Например, функция BLAST базы данных Национального центра биотехнологической информации может быть использована для определения идентичности. Другие коммерчески доступные или общедоступные программы включают программу DNAStar "MegAlign" (Madison, Висконсин) и программу"Gap" генетической компьютерной группы университета Висконсина University of Wisconsin GeneticsComputer Group (UWG) (Madison, Висконсин). Процент гомологии или идентичность белков и/или молекул нуклеиновых кислот могут быть определены, например, путем сравнения информации о последовательностях с использованием программы GAP (см., например, Needleman и др., J. Mol. Biol. 48: 443(1970), с изменениями, внесенными Smith и Waterman (Adv. Appl. Math. 2: 482 (1981. Программа GAP определяет сходство как число выровненных символов (т.е. нуклеотидов или аминокислот), которые являются одинаковыми, деленное на общее число символов в более короткой из двух последовательностей. Параметры по умолчанию для программы GAP могут включать: (1) унарную матрицу сравнения (содержащую значение 1 для совпадения и 0 для не совпадения) и взвешенную матрицу сравнения Gribskov и др., Nucl. Acids Res. 14: 6745 (1986), как описано Schwartz и Dayhoff, Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, cc. 353-358 (1979); (2) штраф в размере 3,0 для каждого разрыва в последовательности, дополнительный штраф 0,10 для каждого символа в каждом разрыве и (3) штраф не применяется для разрывов в концах последовательности. Таким образом, используемый здесь термин "идентичность" относится к сравнению исследуемого и начального полипептида или полинуклеотида. Например, фраза "по меньшей мере на 90% идентичны" относится к идентичности от 90 до 100% по отношению к начальному полипептиду. Принимая для иллюстративных целей длину исследуемого и начального полипептидов за 100 аминокислот, идентичность на уровне 90% и более свидетельствует о том, что не более чем 10% (т.е. 10 из 100) аминокислот в исследуемом полипептиде отличается от начального полипептида. Подобные сравнения можно провести между исследуемым и начальным полинуклеотидами. Такие различия могут быть представлены в виде точечных мутаций, случайно распределенных по всей длине аминокислотной последовательности, или различия могут быть сосредоточены в одном или нескольких местах различной длины вплоть до максимально допустимой, например, 10/100 различающихся аминокислот (около 90% идентичности). Различия определяются как замены, вставки и удаления нуклеиновых оснований и аминокислот. При уровне гомологии или идентичности выше приблизительно 85-90%) результат не должен зависеть от программы и параметров штрафа за разрыв, такие высокие уровни идентичности могут быть легко оценены, часто без использования программного обеспечения. В настоящем документе термины "в значительной степени идентичные" или "сходные" варьируются в зависимости от контекста, как это понимает специалист в данной области техники. В настоящем документе "выровненная последовательность" относится к использованию гомологии(сходства и/или идентичности) для выравнивания соответствующих позиций в последовательности нуклеотидов или аминокислот. Как правило, две или более последовательности, которые связаны 50% и более идентичности, выравниваются. Выровненное множество последовательностей относится к 2 или более последовательностям, которые являются выровненными в соответствующих позициях, и может включать выравнивание последовательностей, полученных из РНК, таких как EST и другие кДНК, с последовательностью геномной ДНК. В настоящем документе термин "специфически гибридизируется" относится к отжигу через комплементарное спаривание оснований молекулы нуклеиновой кислоты (например, олигонуклеотида) с целевой молекулой нуклеиновой кислоты. Специалистам в данной области известны in vitro и in vivo параметры, которые влияют на специфическую гибридизацию, такие как длина и состав конкретной молекулы. Особенно важные для in vitro гибридизации параметры дополнительно включают температуру отжига и отмывания, состав буфера и концентрацию соли. Примеры условий отмывания для удаления неспецифически связанных молекул нуклеиновой кислоты включают 0,1SSPE, 0,1% SDS, 65 С при высокой жесткости, и 0,2SSPE, 0,1% SDS, 50 С при умеренной жесткости. Эквивалентные условия известны в уровне техники. Специалист в данной области может легко изменить условия, подходящие для конкретной задачи для достижения специфической гибридизации молекул нуклеиновой кислоты с целевыми молекулами нуклеиновой кислоты. В настоящем документе "выделенный" или "очищенный" полипептид или белок или его биологически-активная часть практически не содержит клеточного материала или других загрязняющих белков из клеток или тканей, из которых происходит белок, или является в значительной степени свободным от химических веществ-предшественников и других химических веществ при химическом синтезе. Препараты могут быть определены как существенно чистые, если они являются свободными от легко обнаруживаемых примесей, определяемых с помощью стандартных способов анализа, таких как тонкослойная хроматография (ТСХ), гель-электрофорез и высокоэффективная жидкостная хроматография (ВЭЖХ),используемых специалистами в области техники для оценки чистоты, или препараты могут быть определены как достаточно чистые, если дальнейшая очистка не изменяет физические и химические свойства вещества, такие как протеолитическая и биологическая активность. Способы очистки соединений для получения существенно химически чистых соединений известны специалистам в данной области. Существенно химически чистые соединения, однако, могут представлять собой смесь стереоизомеров. В таких случаях дополнительная очистка может увеличить удельную активность соединения. Термин "практически свободный от клеточного материала" относится к препаратам белков, где белок отделен от клеточных компонентов клеток, из которых он выделен или получен рекомбинантно. В одном варианте термин практически свободный от клеточного материала относится к препарату протеазы, имеющему приблизительно менее 30% (на сухой вес) белков, не являющихся протезами (также называемых здесь загрязняющими белками), как правило, менее 20% белков, не являющихся протезами, или 10% белков, не являющихся протезами, или приблизительно менее 5% белков, не являющихся протезами. Если протеаза или ее активная часть являются рекомбинантными, то они являются существенно свободными от культуральной среды, т.е. культуральная среда составляет менее приблизительно или точно 20, 10 или 5% от объема препарата протеазы. Используемый здесь термин "практически не содержат химических веществ-предшественников и других химических веществ" относится к препарату протеазы, в котором белок отделен от химических веществ-предшественников и других химических веществ, которые использовали в синтезе белка. Этот термин включает препараты протеазы, имеющие менее 30% (на сухой вес), 20, 10, 5% или менее химических веществ-предшественников или химических веществ или компонентов, не являющихся протеазой. В настоящем документе получение рекомбинантными методами с помощью методов рекомбинантной ДНК относится к использованию хорошо известных способов молекулярной биологии для экспрессии белков, кодируемых клонированной ДНК. В настоящем документе "вектор" (или плазмида) относится к дискретному элементу, который используется для введения гетерологичных нуклеиновых кислот в клетки для их экспрессии или репликации. Векторы обычно остаются в эписомном состоянии, но могут быть разработаны для осуществления интеграции гена или его части в хромосому генома. Также предусмотрены векторы, которые представляют собой искусственные хромосомы, такие как бактериальные искусственные хромосомы, искусственные хромосомы дрожжей и искусственные хромосомы млекопитающих. Выбор и использование таких векторов хорошо известны специалистам в данной области. В настоящем документе "экспрессия" означает процесс, посредством которого нуклеиновая кислота транскрибируется в мРНК и транслируется в пептид, полипептид или белок. Если нуклеиновая кислота происходит от геномной ДНК, то при наличии соответствующей выбранной эукариотической клеткихозяина или организма экспрессия может включать процессинг, такой как сплайсинг РНК. В настоящем документе "вектор экспрессии" включает векторы, способные экспрессировать ДНК,функционально связанную с регуляторными последовательностями, такими как промоторные районы,которые способны вызывать экспрессию таких фрагментов ДНК. Такие дополнительные сегменты могут включать промоторные и терминаторные последовательности и, при необходимости, могут включать одну или несколько точек начала репликации, один или более маркеров для отбора, энхансер, сигнал полиаденилирования и т.п. Векторы экспрессии обычно получают из плазмидной или вирусной ДНК,или вектор может содержать элементы того и другого. Таким образом, вектор экспрессии относится к рекомбинантным ДНК или РНК конструкциям, например плазмидам, фагам, рекомбинантным вирусам или другим векторам, которые после введения в соответствующую клетку-хозяина приводят к экспрессии клонированной ДНК. Соответствующие векторы экспрессии хорошо известны специалистам в данной области и включают векторы, которые реплицируются в эукариотических клетках и/или прокариотических клетках, векторы, которые остаются в эписомном состоянии, или векторы, которые интегриру- 29
МПК / Метки
МПК: C12N 9/64
Метки: фактора, модифицированные, применение, полипептиды
Код ссылки
<a href="https://eas.patents.su/30-20818-modificirovannye-polipeptidy-faktora-vii-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Модифицированные полипептиды фактора vii и их применение</a>
Предыдущий патент: Вакцина, содержащая конъюгаты капсульных полисахаридов streptococcus pneumoniae
Следующий патент: Устройство для механизированного извлечения нефти с использованием нефтесборных лент
Случайный патент: Ситовый узел, предназначенный для прикрепления к выпуклой вибрационной деке грохота












