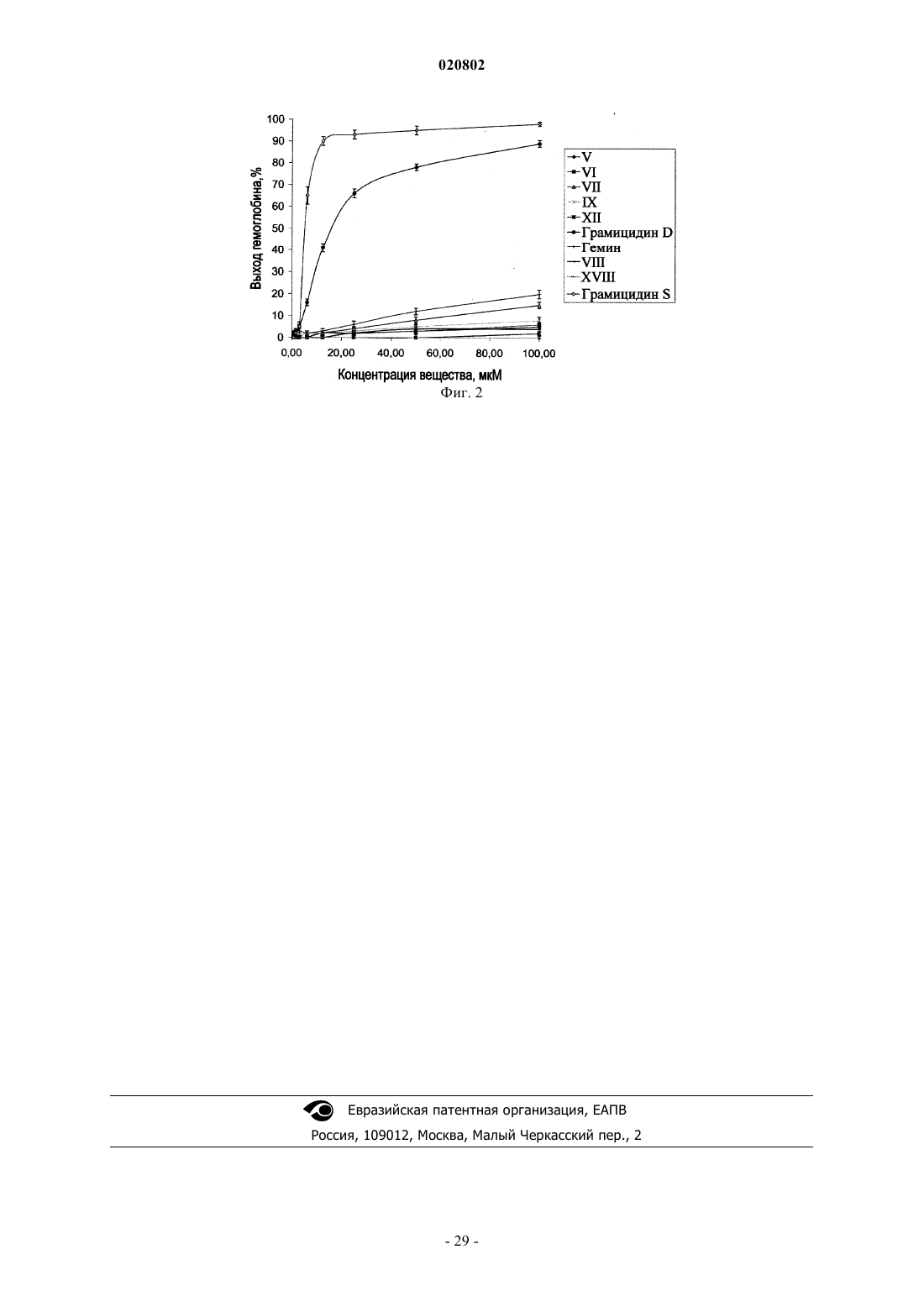
Антимикробные средства на основе производных гемина
Номер патента: 20802
Опубликовано: 30.01.2015
Авторы: Небольсин Владимир Евгеньевич, Желтухина Галина Александровна
Формула / Реферат
1. Применение соединения общей формулы (I)
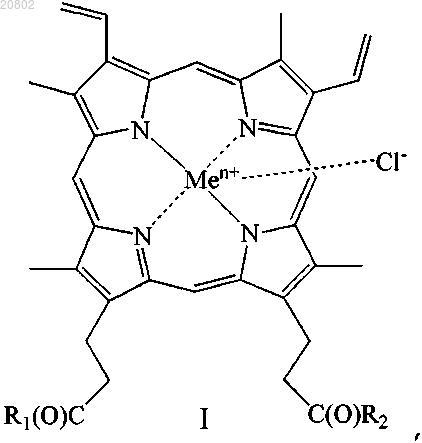
где R1 и R2 одинаковые или различные, при этом
либо один из R1 и R2 представляет собой -ОН, а другой представляет собой
-ArgArgTrpHisArgLeuLysGlu(OMe)ОН, -ArgTrpHisArgLeuLysGlu(OMe)OH, -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или Phe, или Tyr (грамицидин D), -Nδ-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -Arg-Arg-Trp-Trp-Arg-Phe-OH,
либо R1 и R2 оба представляют собой -ArgOMe, -SerOMe, -βAlaHA, -βAlaHis, -NHCH2CH2OH, -GlyOMe,
-NHCH(CH2OH)CH2OH, -NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА или -Arg-ArgOMe, где НА представляет собой остаток гистамина
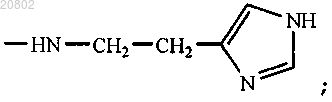
Men+ представляет собой Fe2+ или Fe3+;
или его изомеров, или смесей изомеров, или их фармацевтически приемлемых солей в качестве антимикробного средства.
2. Применение по п.1, где антимикробное средство представляет собой антибактериальное средство.
3. Применение по п.2, где указанное антибактериальное средство проявляет активность в отношении грамположительных бактерий рода Staphylococcus, Bacillus, Enterococcus и/или Micrococcus.
4. Применение по п.3, где бактерии выбирают из видов Staphylococcus aureus, Enterococcus faecalis и Micrococcus luteus.
5. Применение по п.3, где бактерии относятся к штамму Staphylococcus aureus 209P, Enterococcus faecalis BKM B-871, Micrococcus luteus BKM Ac-2230, Staphylococcus aureus № 25923 ATCC, Staphylococcus aureus № 100 KC, Staphylococcus epidermidis № 533, Enterococcus faecalis № 559 или Enterococcus faecium № 569.
6. Применение по п.1, где антимикробное средство представляет собой противогрибковое средство.
7. Применение по п.6, где указанное противогрибковое средство проявляет активность в отношении микроскопических грибов рода Candida и/или Criptococcus.
8. Применение по п.7, где микроскопические грибы представляют собой Cryptococcus neoformans или Candida albicans.
9. Применение по п.6, где микроскопические грибы относятся к штамму Candida albicans № 927 или Cryptococcus neoformans № 3465.
10. Применение по любому из пп.1-9, где в соединениях общей формулы (I)
либо один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или Phe, или Tyr (грамицидин D), -Nδ-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -Arg-Arg-Trp-Trp-Arg-Phe-OH,
либо R1 и R2 оба представляют собой -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH,
-NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -HA или -Arg-ArgOMe, где НА представляет собой остаток гистамина
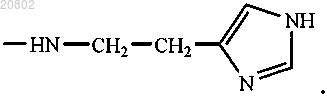
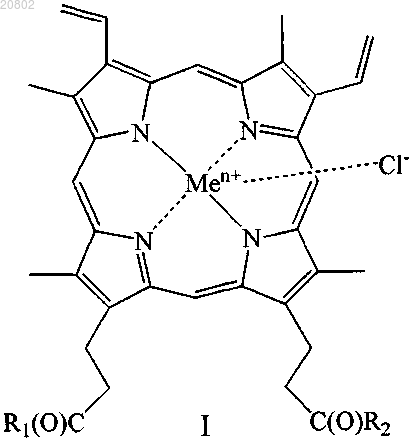
11. Антимикробное средство, представляющее собой производное гемина общей формулы (I)
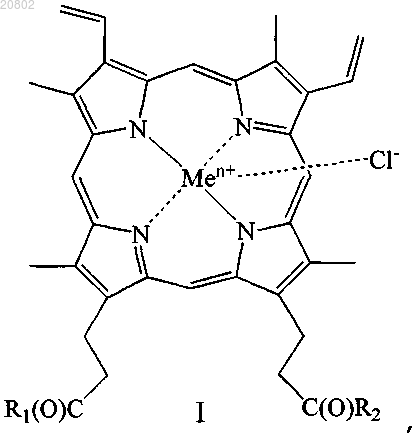
где R1 и R2 одинаковые или различные, при этом
либо один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или Phe, или Tyr (грамицидин D), -Nδ-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -Arg-Arg-Trp-Trp-Arg-Phe-OH,
либо R1 и R2 оба представляют собой -βAlaHis, -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH,
-NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА или -Arg-ArgOMe, где НА представляет собой остаток гистамина
Men+ представляет собой Fe2+ или Fe3+;
или его изомер, или смесь изомеров, или их фармацевтически приемлемую соль.
12. Антимикробное средство по п.11, которое представляет собой антибактериальное средство.
13. Антимикробное средство по п.12, которое проявляет активность в отношении грамположительных бактерий рода Staphylococcus, Bacillus, Enterococcus и/или Micrococcus.
14. Антимикробное средство по п.13, где бактерии выбирают из видов Staphylococcus aureus, Enterococcus faecalis и Micrococcus luteus.
15. Антимикробное средство по п.13, где бактерии относятся к штамму Staphylococcus aureus 209Р, Enterococcus faecalis BKM B-871, Micrococcus luteus BKM Ac-2230, Staphylococcus aureus № 25923 ATCC, Staphylococcus aureus № 100 KC, Staphylococcus epidermidis № 533, Enterococcus faecalis № 559 или Enterococcus faecium № 569.
16. Антимикробное средство по п.11, которое представляет собой противогрибковое средство.
17. Антимикробное средство по п.16, которое проявляет активность в отношении микроскопических грибов рода Candida и/или Criptococcus.
18. Антимикробное средство по п.17, где микроскопические грибы представляют собой Cryptococcus neoformans или Candida albicans.
19. Антимикробное средство по п.17, где микроскопические грибы относятся к штамму Candida albicans № 927 или Cryptococcus neoformans № 3465.
20. Антимикробное средство по любому из пп.11-19, где в соединениях общей формулы (I)
либо один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или Phe, или Tyr (грамицидин D), -Nδ-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -Arg-Arg-Trp-Trp-Arg-Phe-OH,
либо R1 и R2 оба представляют собой -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH,
-NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -HA или -Arg-ArgOMe, где НА представляет собой остаток гистамина
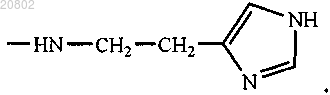
21. Фармацевтическая композиция, обладающая антимикробной активностью, включающая в качестве активного ингредиента соединение формулы (I)
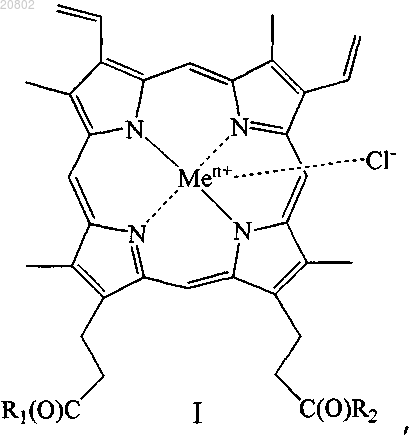
где R1 и R2 одинаковые или различные, при этом
либо один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или Phe, или Tyr (грамицидин D), -Nδ-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -Arg-Arg-Trp-Trp-Arg-Phe-OH,
либо R1 и R2 оба представляют собой -βAlaHis, -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH,
-NHCH2CH(OH)CH2OH, -Glu(ArgOMe) -ArgOMe, -НА или -Arg-ArgOMe, где НА представляет собой остаток гистамина
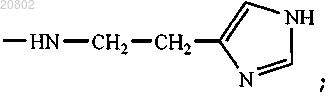
Men+ представляет собой Fe2+ или Fe3+;
или его изомер, или смесь изомеров, или их фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем или наполнителем.
22. Фармацевтическая композиция по п.21, которая представляет собой антибактериальное средство.
23. Фармацевтическая композиция по п.22, которая проявляет активность в отношении грамположительных бактерий рода Staphylococcus, Bacillus, Enterococcus и/или Micrococcus.
24. Фармацевтическая композиция по п.23, где бактерии выбирают из видов Staphylococcus aureus, Enterococcus faecalis и Micrococcus luteus.
25. Фармацевтическая композиция по п.23, где бактерии относятся к штамму Staphylococcus aureus 209P, Enterococcus faecalis BKM B-871, Micrococcus luteus BKM Ac-2230, Staphylococcus aureus № 25923 ATCC, Staphylococcus aureus № 100 KC, Staphylococcus epidermidis № 533, Enterococcus faecalis № 559 или Enterococcus faecium № 569.
26. Фармацевтическая композиция по п.21, которая представляет собой противогрибковое средство.
27. Фармацевтическая композиция по п.26, которая проявляет активность в отношении микроскопических грибов рода Candida и/или Criptococcus.
28. Фармацевтическая композиция по п.27, где микроскопические грибы представляют собой Cryptococcus neoformans или Candida albicans.
29. Фармацевтическая композиция по п.27, где микроскопические грибы относятся к штамму Candida albicans № 927 или Cryptococcus neoformans № 3465.
30. Фармацевтическая композиция по любому из пп.21-29, где в соединениях общей формулы (I)
либо один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или Phe, или Tyr (грамицидин D), -Nδ-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -Arg-Arg-Trp-Trp-Arg-Phe-OH,
либо R1 и R2 оба представляют собой -NHCH2CH2OH, -GlyOMe (XV), -NHCH(CH2OH)CH2OH,
-NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe (XVIII), -НА или -Arg-ArgOMe, где НА представляет собой остаток гистамина
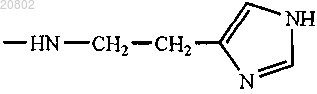
31. Способ лечения и/или профилактики заболеваний, вызванных бактериями или микроскопическими грибами, включающий введение нуждающемуся в этом пациенту средства по любому из пп.11-20 или фармацевтической композиции по любому из пп.21-30.
32. Способ по п.31, в котором заболевание вызвано бактериями.
33. Способ по п.32, в котором бактерии являются грамположительными бактериями рода Staphylococcus, Bacillus, Enterococcus или Micrococcus.
34. Способ по п.33, где бактерии выбирают из видов Staphylococcus aureus, Enterococcus faecalis и Micrococcus luteus.
35. Способ по п.33, где бактерии относятся к штамму Staphylococcus aureus 209P, Enterococcus faecalis BKM B-871, Micrococcus luteus BKM Ac-2230, Staphylococcus aureus № 25923 ATCC, Staphylococcus aureus № 100 KC, Staphylococcus epidermidis № 533, Enterococcus faecalis № 559 или Enterococcus faecium № 569.
36. Способ по п.31, в котором заболевание вызвано микроскопическими грибами.
37. Способ по п.36, где микроскопические грибы относятся к роду Candida или Criptococcus.
38. Способ по п.37, где микроскопические грибы представляют собой Cryptococcus neoformans или Candida albicans.
39. Способ по п.37, где микроскопические грибы относятся к штамму Candida albicans № 927 или Cryptococcus neoformans № 3465.
40. Способ по любому из пп.31-39, где в соединениях общей формулы (I)
либо один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или Phe, или Tyr (грамицидин D), -Nδ-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -Arg-Arg-Trp-Trp-Arg-Phe-OH,
либо R1 и R2 оба представляют собой -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH,
-NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -HA или -Arg-ArgOMe, где НА представляет собой остаток гистамина
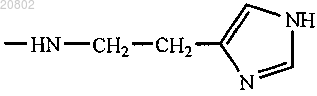
41. Антисептическая и/или дезинфицирующая композиция, содержащая соединение общей формулы (I)
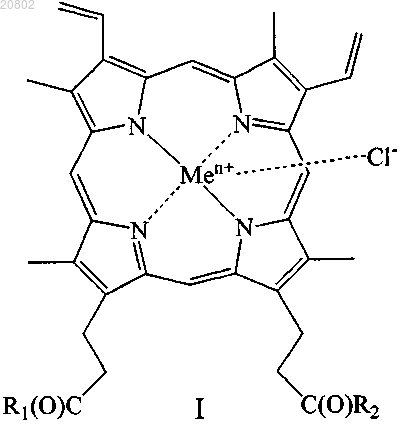
где R1 и R2 одинаковые или различные, при этом
либо один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или Phe, или Tyr (грамицидин D), -Nδ-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -Arg-Arg-Trp-Trp-Arg-Phe-OH,
либо R1 и R2 оба представляют собой -βAlaHis, -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH,
-NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА или -Arg-ArgOMe, где НА представляет собой остаток гистамина
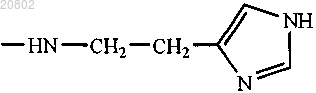
Men+ представляет собой Fe2+ или Fe3+;
или его изомер, или смесь изомеров, или их фармацевтически приемлемую соль.
42. Антисептическая и/или дезинфицирующая композиция по п.41, содержащая соединение общей формулы (I), охарактеризованное в п.10.
43. Производное гемина общей формулы (I)
где R1 и R2 одинаковые или различные, при условии, что оба R1 и R2 одновременно не представляют собой
-ОН, при этом
либо один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или Phe, или Tyr (грамицидин D), -Nδ-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -Arg-Arg-Trp-Trp-Arg-Phe-OH,
либо R1 и R2 оба представляют собой -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH,
-NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe (XVIII), -НА или -Arg-ArgOMe, где НА представляет собой остаток гистамина
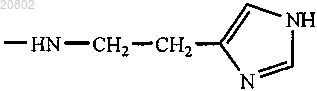
Men+ представляет собой Fe2+ или Fe3+,
или его изомер, или смесь изомеров, или их фармацевтически приемлемая соль.
44. Соединение по п.43, где один из R1 и R2 представляет собой -ОН, а другой представляет собой -Arg-Gly-Asp-OH, или его изомер, или смесь изомеров, или их фармацевтически приемлемая соль.
45. Соединение по п.43, где один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, Phe или Tyr (грамицидин D), или его изомер, или смесь изомеров, или их фармацевтически приемлемая соль.
46. Соединение по п.43, где один из R1 и R2 представляет собой -ОН, а другой представляет собой -Nδ-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), или его изомер, или смесь изомеров, или их фармацевтически приемлемая соль.
47. Соединение по п.43, где R1 = R2 = -NHCH2CH2OH, или его фармацевтически приемлемая соль.
48. Соединение по п.43, где R1 = R2 = -GlyOMe, или его фармацевтически приемлемая соль.
49. Соединение по п.43, где R1 = R2 = -NHCH(CH2OH)СН2ОН, или его фармацевтически приемлемая соль.
50. Соединение по п.43, где R1 = R2 = -NHCH2CH(ОН)СН2ОН, или его фармацевтически приемлемая соль.
51. Соединение по п.43, где, R1 = R2 = -Glu(ArgOMe)-ArgOMe, или его фармацевтически приемлемая соль.
52. Соединение по п.43, где R1 = R2 = -HA, или его фармацевтически приемлемая соль.
53. Соединение по п.43, где один из R1 и R2 представляет собой -ОН, а другой представляет собой -Arg-Arg-Trp-Trp-Arg-Phe-OH, или его изомер, или смесь изомеров, или их фармацевтически приемлемая соль.
54. Соединение по п.43, где R1 = R2 = -Arg-ArgOMe, или его фармацевтически приемлемая соль.
55. Способ получения соединения общей формулы (I) по любому из пп.43-54, включающий взаимодействие активированного по карбоксильной(ым) группе(ам) производного гемина с аминокомпонентом.
56. Способ по п.55, где в качестве активированного производного гемина используют 6,7-бис-N-оксисукцинимидный эфир гемина или 6(7)-моно-N-окси-5-норборнен-2,3-дикарбоксиимидный эфир гемина, а в качестве растворителя используют N,N-диметилформамид.
57. Способ по п.55, где для активирования по одной из карбоксильных групп гемина используют ди-трет-бутилпирокарбонат, причем процесс проводят в N,N-диметилформамиде в присутствии пиридина.
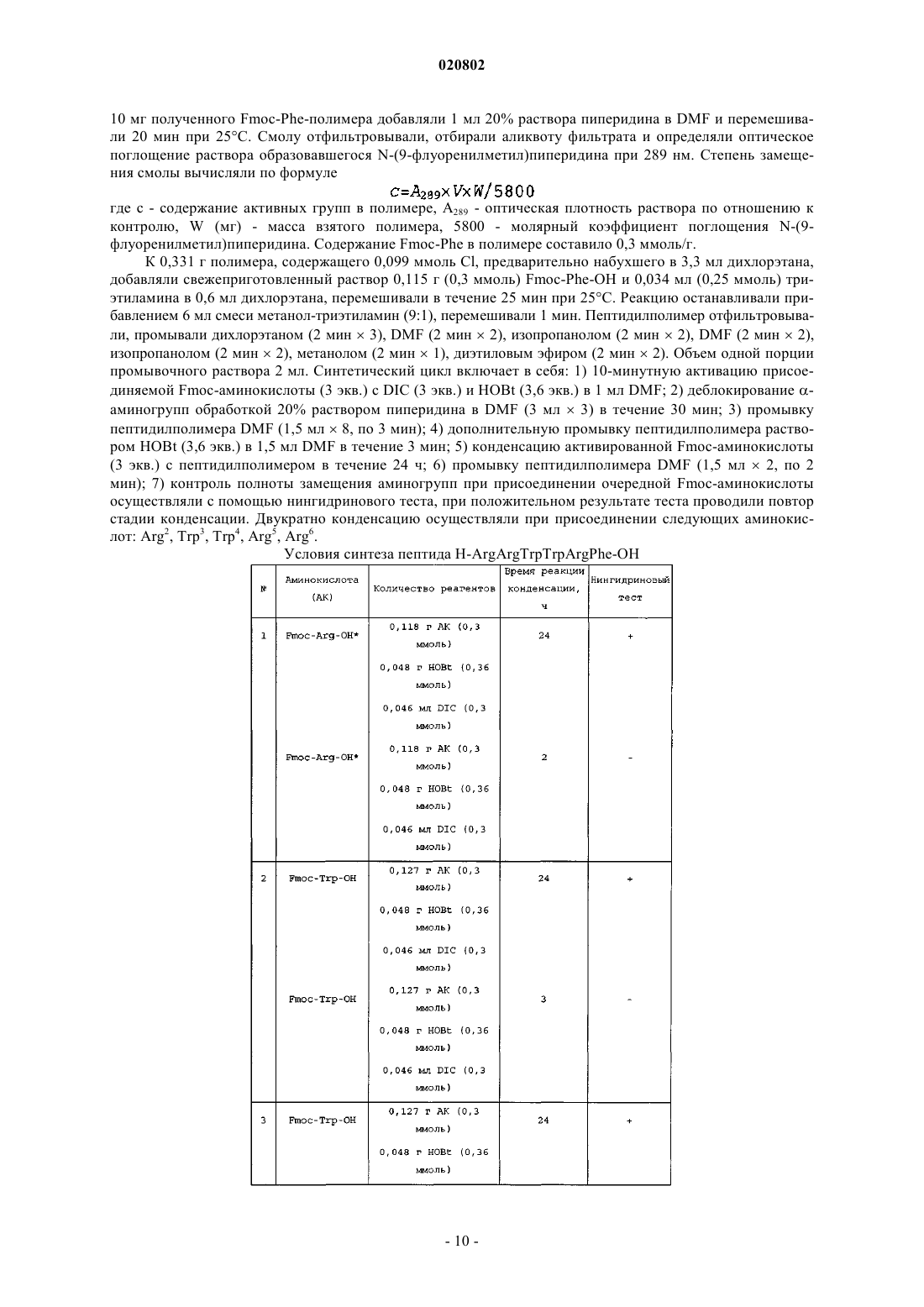
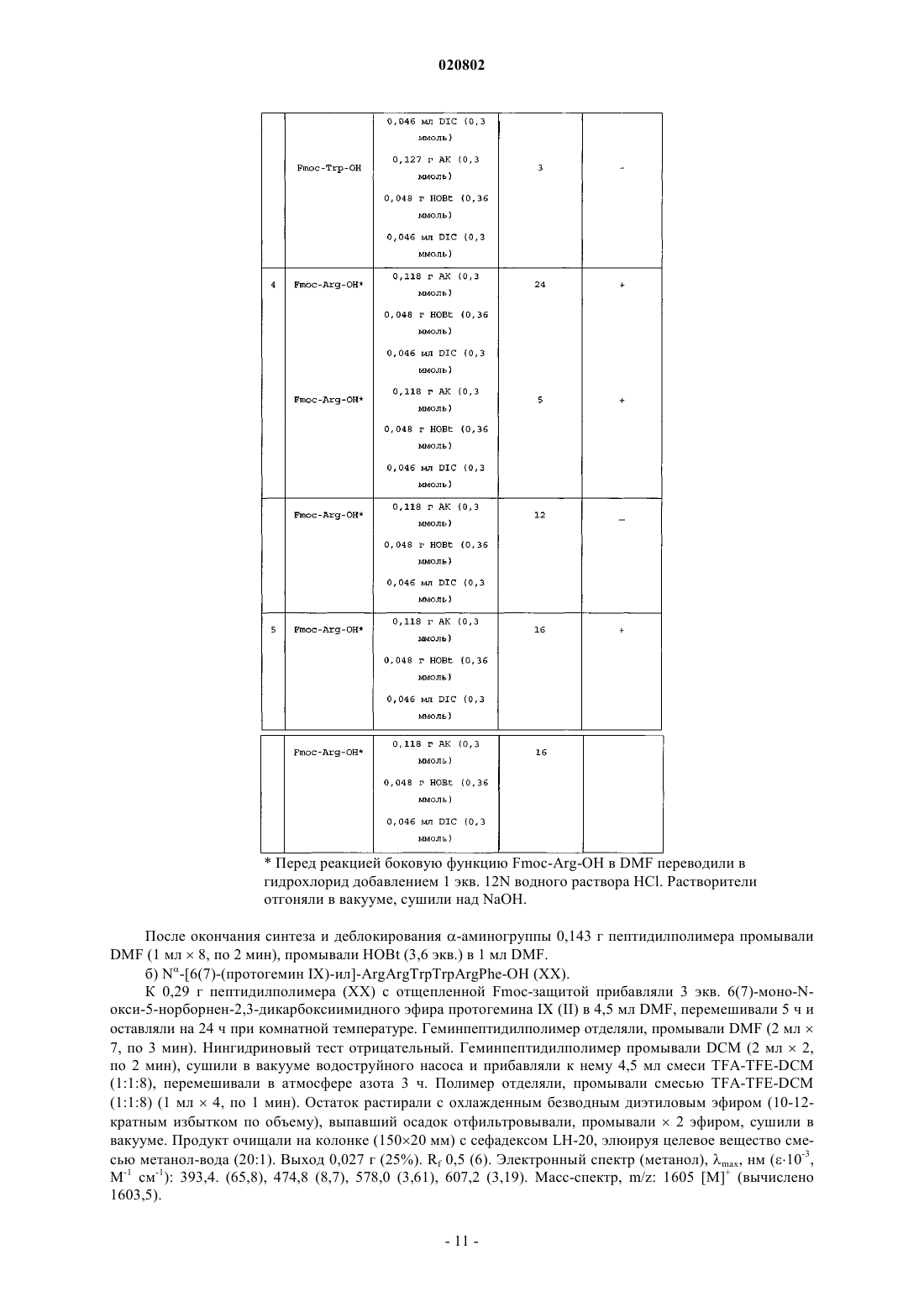
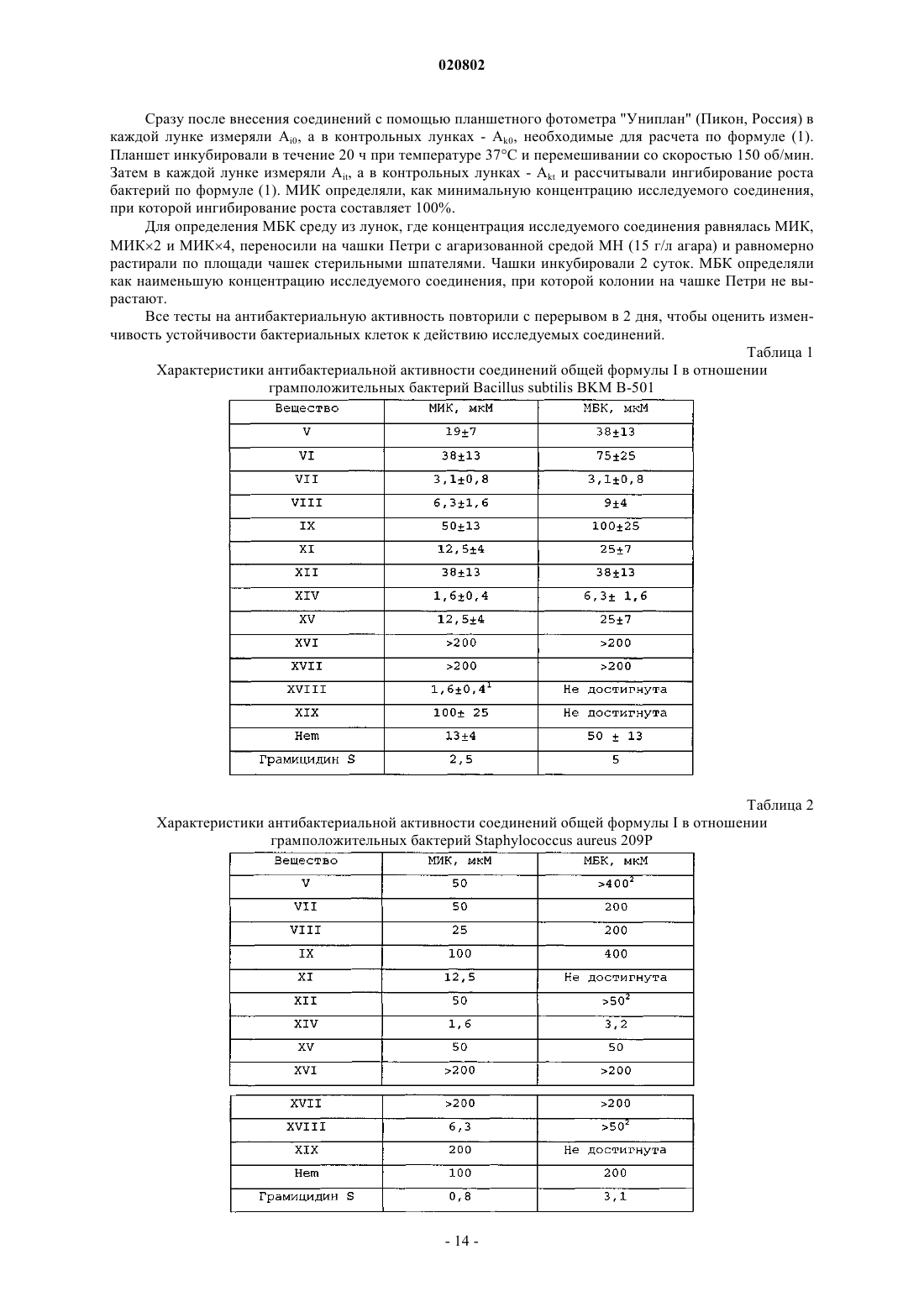
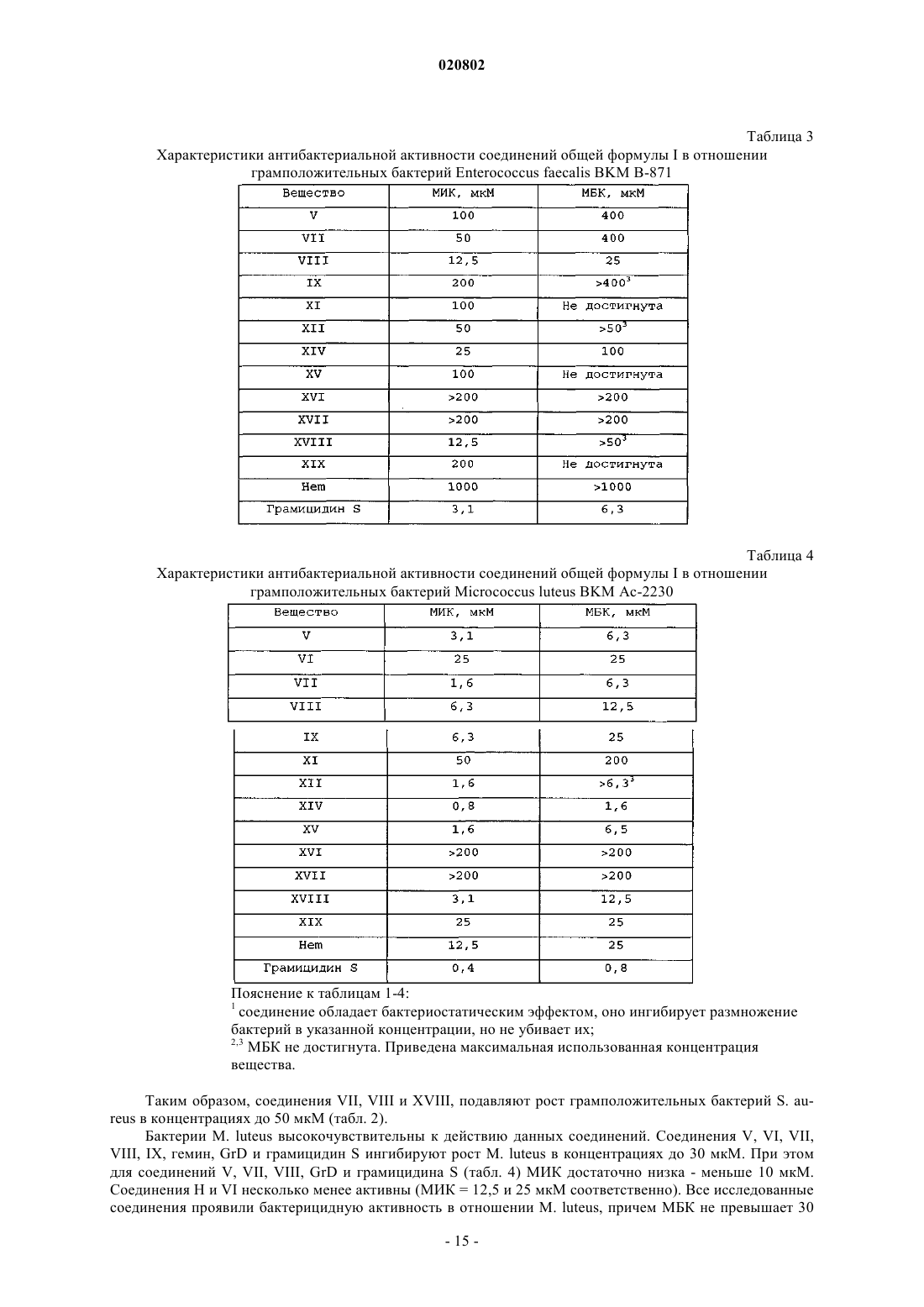
Текст
АНТИМИКРОБНЫЕ СРЕДСТВА НА ОСНОВЕ ПРОИЗВОДНЫХ ГЕМИНА Изобретение относится к новым антимикробным, в том числе антибактериальным и противогрибковым, средствам и композициям на основе производных гемина общей формулы (I),а также к получению новых производных гемина. Преимуществами антибактериальных средств на основе прозводных гемина является их биосовместимость, биодеградируемость, высокая эффективность против резистентных бактерий и широкораспространных и опасных для человека микроскопических грибов, отсутствие токсичности и побочных эффектов. Область техники Изобретение относится к области биоорганической химии и направлено на разработку новых антимикробных средств и композиций на основе производных гемина, а также на получение новых производных гемина. Уровень техники Как известно, многие опасные заболевания человека и животных вызываются микроорганизмами, такими как бактерии и микроскопические грибы. Бактерии вызывают такие заболевания эпидемического характера, как холера, брюшной тиф, паратифы, чума, дифтерия, туляремия, бруцеллез, а также туберкулез,заражение крови (сепсис), проказа, сифилис и др. У животных бактерии вызывают сап, сибирскую язву,туберкулез и др. Грибковые заболевания главным образом поражают кожные покровы и слизистые оболочки и представляют собой, в частности, кератомикозы, микроспорию, трихофитию, криптококкоз и т.п. Борьба с микроорганизмами основывается на применении антимикробных средств, таких как антибактериальные средства (в том числе антибиотики) и противогрибковые средства. Однако многие известные средства обладают рядом недостатков, такими как токсичность, чувствительность к действию протеолитических ферментов, гемолитический эффект, недостаточная широта антимикробного действия. В частности, у бактерий быстро развивается резистентность по отношению к существующим антимикробным средствам, главным образом к антибиотикам. Поэтому проблема поиска новых нетоксичных,биосовместимых антимикробных средств, применение которых не приводило бы к резистентности,весьма актуальна. Известно, что гемин обладает антимикробной активностью в отношении золотистого стафилококкаaureus//FEMS Microbiol. Lett., 1987, v. 48 (3), p. 401-406]. Однако использование гемина в качестве антибактериального средства затруднено вследствие его не растворимости в воде, гемолитической активности, а также кратковременности антибактериального эффекта. Ранее предпринимались попытки модификации гемина путем его конъюгации с аминокислотами и пептидами с целью создания биологически активных производных. В результате модификации карбоксильных групп гемина путем получения соответствующих амидов были получены и исследованы соединения общей формулы (I), где R1 и R2, одинаковые или различные, представляют собой -ОН или остаток аминокислоты или пептида, причем R1 и R2 не могут одновременно обозначать -ОН. Так, для некоторых пептидных производных гемина общей формулы (I), в частности, где один из R1 и R2 представляет собой -ОН, а другой представляет собой -ArgArgTrpHisArgLeuLysGlu(ОМе)ОН (соединение V) или -ArgTrpHisArgLeuLysGlu(ОМе)ОН (соединение VI), установлена нуклеазная (нуклеолитическая) активность, проявляющаяся в способности разрушать плазмидную ДНК [патент RU2250906, 27.04.2005; Желтухина Г.А., Лобанова Т.Н., Небольсин В.Е., Галлямов М.О., Драницына С.М.,Костанян И.А.//Биоорган. химия, 2006. т. 32,2, с. 198-210]. Отдельные аминокислотные и пептидные производные гемина общей формулы (I), а именно те, у которых один из R1 и R2 представляет собой -ОН, а другой представляет собой-ArgArgTrpHisArgLeuLysGlu(ОМе)ОН (соединение V), или R1=R2 = -ArgOMe (соединение VII), способны ингибировать протеиназу ВИЧ и оказывать, вследствие этого, противовирусное анти-ВИЧ действие[патент RU2238950, 27.10.2004]. Также показано, что некоторые производные гемина общей формулы (I), а именно те, у которыхR1=R2 = -SerOMe (соединение VIII), R1=R2 = -AlaHis (соединение X), R1=R2 = -ArgOMe (соединение VII),R1=R2 = -AlaHA (соединение IX, НА - остаток гистамина) или один из R1 и R2 представляет собой -ОН, а другой представляет собой-ArgTrpHisArgLeuLysGlu(ОМе)ОН (соединение VI), обладают противовирусной активностью [заявка RU 2007125604, 20.01.2009]. Однако антимикробная, в том числе антибактериальная и противогрибковая, активность указанных выше производных гемина не известна из уровня техники. С другой стороны, в последнее время много внимания уделялось дизайну новых антимикробных агентов на основе антимикробных пептидов (АМП) [A. Giuliani, G. Pirri, S.F. Nicoletto. Antimicrobial peptides: an overview of a promising class of therapeutics//Central European Journal of Biology, 2007, v. 2(1), p. 133]. Среди известных антимикробных пептидов можно назвать линейный грамицидин D, представляющий собой смесь пептидов формулы (II)[G. Nagamurthi and S. Rambhav. Gramicidin-S: Structure-activity relationship//J. Biosci., 1985, v.7,3-4, p. 323-329]. Соединение II эффективно против грамположительных бактерий [W.E. Herrell and D. Heilman. Experimental and Clinical Studies on Gramicidin//J. Clin. Invest., 1941, v. 20,583] и некоторых вирусов, в частности герпеса [US Patent 6001808, 1999]. Соединение III эффективно главным образом против грамположительных бактерий в концентрациях 5-15 мкМ [Jingbo Xiao, Bernard Weisblum, and Peter Wipf.S Analogues with (E)-Alkene Peptide Isosteres//J. Am. Chem. Soc, 2005, 127 (16), pp. 5742-5743]. Соединения II и III используются в медицинской практике только для наружного применения. Недостатками этих антимикробных соединений являются их относительно большая длина и, соответственно, сравнительно высокая стоимость, недостаточная широта антибактериального, противогрибкового и антивирусного действия, а также побочные эффекты, проявляющиеся при применении, в основном это гемолиз эритроцитов и аллергические реакции. Известен также пептид Arg-Gly-Asp (IV), который является фрагментом антимикробных пептидов семейства цекропинов, многих микробных белков и фибронектина поверхности клеток млекопитающих[A.J. Kastin. Handbook of biologically active peptides//Elsevier, Academic Press, USA, 2006, p. 576]. Однако до настоящего времени возможность его применения в качестве средства для лечения инфекционных заболеваний не была изучена. Основными препятствиями к применению АМП в клинической практике являются их сравнительно высокая стоимость, чувствительность к действию протеолитических ферментов, а также присущий многим АМП гемолитический эффект. Кроме того, в настоящее время антимикробные пептиды получают в основном твердофазным методом, что делает эти вещества чрезвычайно дорогостоящими, а их применение экономически нецелесообразным. Поэтому является весьма актуальным поиск более коротких аналогов АМП и их производных, в том числе конъюгатов с соединениями других классов. В связи с тем, что сохраняется потребность в совершенствовании антимикробных средств в отношении снижения их токсичности, уменьшения других побочных эффектов, а также в повышении активности против резистентных штаммов, было предложено использовать в качестве таких средств производные гемина. Сущность изобретения Настоящее изобретение относится к применению производных гемина общей формулы (I) где R1 и R2 одинаковые или различные при условии, что оба R1 и R2 одновременно не представляют собой -ОН, при этом либо один из R1 и R2 представляет собой -ОН, а другой представляет собой(грамицидин D), -N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -Arg-ArgTrp-Trp-Arg-Phe-OH,либо R1 и R2 оба представляют собой -ArgOMe, -SerOMe, -AlaHA, -AlaHis, -NHCH2CH2OH,-GlyOMe, -NHCH(CH2OH)CH2OH, -NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА или -ArgArgOMe, где НА представляет собой остаток гистаминаMen+ представляет собой Fe2+ или Fe3+; или их изомеров, или смесей изомеров, или их фармацевтически приемлемых солей в качестве антимикробных средств. Также изобретение относится к антимикробному, в том числе антибактериальному и/или противогрибковому, средству на основе вышеуказанных соединений формулы (I) и соответствующим фармацевтическим, антисептическим и/или дезинфицирующим композициям, а также способу лечения и/или профилактики заболеваний, вызванных микроорганизмами. Также изобретение относится к новым производным гемина общей формулы (I) где R1 и R2 одинаковые или различные, при условии, что оба R1 и R2 одновременно не представляют собой -ОН,при этом либо один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или-Arg-Arg-Trp-Trp-Arg-Phe-OH,либо R1 и R2 оба представляют собой -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH,-NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -HA или -Arg-ArgOMe, где НА представляет собой остаток гистаминаMen+ представляет собой Fe2+ или Fe3+; или их изомерам, или смесям изомеров, или их фармацевтически приемлемым солям, а также к способу синтеза этих соединений. Краткое описание чертежей На фиг. 1 изображены графики, отражающие динамику выхода карбоксифлуоресцеина из модельных липосом под действием производных гемина; на фиг. 2 - зависимости гемолитической активности (оцениваемой по интенсивности выхода гемоглобина из эритроцитов) от концентрации производных гемина. Подробное описание изобретения Авторы настоящего изобретения неожиданно обнаружили, что соединения приведенной выше формулы (I), представляющие собой конъюгаты гемина с пептидами, аминокислотами или их аналогами,являются перспективными антимикробными средствами. Преимуществами производных гемина формулы (I) являются их биосовместимость и биодеградируемость, низкая токсичность по отношению к нормальным клеткам человека и отсутствие гемолитического эффекта, а также высокая антибактериальная эффективность, в том числе против резистентных штаммов, в сочетании с противогрибковой активностью. Без намерения ограничения какой-либо теорией, авторы предполагают, что антимикробное действие соединений формулы (I) может быть частично объяснено их деструктирующим действием по отношению к липидной мембране, которое, как известно, является одним из основных механизмов антимикробного действия. Данное действие продемонстрировано в примере 12 и на фиг. 1. Таким образом, были получены и исследованы следующие новые соединения формулы (I). Соединение (XI): один из R1 и R2 представляет собой -ОН, а другой представляет собой -Arg-GlyAsp-OH; соединение (XII): один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-GlyAla-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp,Phe или Туг (грамицидин D); соединение (XIII): один из R1 и R2 представляет собой -ОН, а другой представляет собой -N-цикло(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S); соединение (XIV): R1 = R2 = -NHCH2CH2OH; соединение (XV): R1 = R2 = -GlyOMe; соединение (XVI): R1 = R2 = -NHCH(CH2OH)СН 2 ОН; соединение (XVII): R1 = R2 = -NHCH2CH(ОН)СН 2 ОН; соединение (XVIII): R1 = R2 = -Glu(ArgOMe)-ArgOMe; соединение (XIX): R1 = R2 = -HA; соединение (XX): один из R1 и R2 представляет собой -ОН, а другой представляет собой -Arg-ArgTrp-Trp-Arg-Phe-OH; соединение (XXI): R1 = R2 = -Arg-ArgOMe; где НА представляет собой Кроме новых соединений были исследованы также известные производные гемина общей формулы(I), которые продемонстрировали аналогичные свойства, а именно соединение (V): один из R1 и R2 представляет собой -ОН, а другой представляет собой-ArgTrpHisArgLeuLysGlu(OMe)ОН; соединение (VII): R1 = R2 = -ArgOMe; соединение (VIII): R1 = R2 = -SerOMe; соединение (IX): R1 = R2 = -AlaHA, где НА - остаток гистамина; соединение (X): R1=R2 = -AlaHis; Соединения (V), (VI) раскрыты в патенте RU2250906, 27.04.2005 и статье Желтухина Г.А., Лобанова Т.Н., Небольсин В.Е., Галлямов М.О., Драницына С.М., Костанян И.А.//Биоорган. химия. 2006, т. 32,2, с. 198-210, соединение (VII) раскрыто в патенте RU2238950, 27.10.2004, соединения (VIII),(IX), (X) раскрыты в заявке RU 2007125604, 20.01.2009. Однако антимикробная, в том числе антибактериальная и противогрибковая, активность этих соединений ранее не была исследована. Таким образом, настоящее изобретение направлено на применение производных гемина общей формулы (I) где R1 и R2 одинаковые или различные при условии, что оба R1 и R2 одновременно не представляют собой -ОН, при этом либо один из R1 и R2 представляет собой -ОН, а другой представляет собой(грамицидин D), -N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -Arg-ArgTrp-Trp-Arg-Phe-OH,либо R1 и R2 оба представляют собой -ArgOMe, -SerOMe, -AlaHA, -AlaHis, -NHCH2CH2OH,-GlyOMe, -NHCH(CH2OH)CH2OH, -NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА или -ArgArgOMe, где НА представляет собой остаток гистамина или их изомеров, или смесей изомеров, или их фармацевтически приемлемых солей в качестве антимикробных средств. Антимикробная активность включает как антибактериальную, так и противогрибковую активность. Представленные выше соединения формулы (I) проявляют активность против грамположительных бактерий, таких как бактерии рода Staphylococcus (например, Staphylococcus aureus), Bacillus (например,Bacillus subtilis), Enterococcus (например, Enterococcus faecalis) и Micrococcus (например, Micrococcusluteus), в том числе резистентных, т.е. обладающих устойчивостью к действию известных антибактериальных средств. Предпочтительно указанные бактерии относятся к штаммам Bacillus subtilis BKM B-501,Staphylococcus aureus 209P, Enterococcus faecalis BKM В-871 или Micrococcus luteus BKM Ac-2230. Еще более предпочтительно указанные соединения проявляют антибактериальную активность против резистентных штаммов Staphylococcus aureus25923 АТСС, Staphylococcus aureus100 KC, Staphylococcus epidermidis533, Enterococcus faecalis559 или Enterococcus faecium569. Кроме того, представленные выше соединения формулы (I) проявляют активность против микроскопических грибов Cryptococcus (в частности, Cryptococcus neoformans, предпочтительно штамма Cryptococcus neoformans3465), а также Candida (в частности, Candida albicans, предпочтительно штаммаCandida albicans927). Соединения формулы (I) могут существовать в виде изомеров, а также в виде смесей изомеров, которые полностью входят в объем заявленного изобретения. Например, при модификации одной из двух карбоксильных групп гемина может образовываться смесь (6)-, (7)-производных. Все аминокислоты, входящие в состав производных гемина, представляют собой L-аминокислоты,если не указано иное. Соединения формулы (I) могут быть использованы как в виде солей с фармацевтически приемлемыми кислотами, например молочной, винной, лимонной, хлористо-водородной и др., так и в виде солей по карбоксильным группам с ионами щелочных и щелочно-земельных металлов, таких как натрий, калий, кальций, или, например, с фармацевтически приемлемыми основаниями, такими как аммиак, этаноламин. Указанные выше соединения формулы (I) и/или их соли могут быть использованы в качестве активных ингредиентов в фармацевтических композициях (например, в твердой, полутвердой или жидкой формах) в смеси с органическим или неорганическим носителем или наполнителем. Активный ингредиент может быть включен в композицию вместе с обычно используемыми нетоксичными, фармацевтически приемлемыми носителями, пригодными для изготовления растворов, таблеток,пилюль, капсул, суппозиториев, эмульсий, суспензий, спреев, ингаляторов, капель, мазей и любых других лекарственных форм. В качестве носителей могут быть использованы вода, глюкоза, лактоза, аравийская камедь, желатин, крахмал, триксилит магния, тальк, кукурузный крахмал, мочевина, полиэтиленгликоль и другие носители, пригодные для изготовления твердых, мягких или жидких препаратов. При этом в качестве добавок могут быть использованы стабилизаторы, загустители, красители и отдушки. Соединение формулы I вводят в композицию в количестве, достаточном для получения антимикробного эффекта. При изготовлении разовой лекарственной формы количество активного ингредиента, используемого в комбинации с носителем, может варьировать в зависимости от реципиента, подвергающегося лечению, от конкретного способа введения лекарственного средства. Так, например, при использовании соединений настоящего изобретения в виде растворов для инъекций содержание действующего начала в них составляет 0,001-1 мас.%. В качестве разбавителя вещества могут быть использованы 0,9% раствор натрия хлорида, дистиллированная вода, раствор новокаина для инъекций, раствор Рингера, раствор глюкозы. При использовании соединения общей формулы (I) в виде таблеток и суппозиториев количество вещества составляет 1,0-100,0 мг на единичную дозированную форму. Для таблеток и суппозиториев в качестве фармацевтического наполнителя используют любую фармацевтически пригодную основу. Поскольку соединения общей формулы (I) являются как водорастворимыми, так и липофильными,то они могут применяться в виде водных растворов, спиртовых растворов, мазей, кремов и т.д. Далее изобретение относится к антимикробному лекарственному средству на основе указанных выше соединений формулы (I), а также к способу лечения заболеваний, вызываемых указанными выше бактериями и/или микроскопическими грибами, включающему введение нуждающемуся в этом пациенту указанного выше соединения формулы (I) или фармацевтической композиции на его основе. Способ предназначен для лечения пациентов-млекопитающих, в том числе людей. Рекомендуемые дозы соединения формулы (I) составляют 0,01-10 мг/кг. Поскольку соединения формулы (I) обладают антибактериальной и противогрибковой активностью,они могут также использоваться в качестве или в составе антисептических и/или дезинфицирующих средств. Такие средства могут быть изготовлены, например, в виде растворов с использованием различных растворителей, таких как вода и низшие спирты (например, 1-пропанол или 2-пропанол). Также объектом изобретения являются новые производные гемина общей формулы (I) где R1 и R2 одинаковые или различные при условии, что оба R1 и R2 одновременно не представляют собой -ОН, при этом либо один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala-(D-Leu)Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или Phe, илиTyr (грамицидин D), -N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -ArgArg-Trp-Trp-Arg-Phe-OH,либо R1 и R2 оба представляют собой -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH,-NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -HA или -Arg-ArgOMe, где НА представляет собой остаток гистаминаMen+ представляет собой Fe2+ или Fe3+; или их изомеры, или смеси изомеров, или их фармацевтически приемлемые соли. Еще один аспект изобретения относится к способу получения описанных выше новых соединений формулы (I). Соединения формулы (I) получают путем взаимодействия активированного по карбоксильной(ым) группе(ам) производного гемина с аминокомпонентом. В качестве аминокомпонентов используют пептиды, аминокислоты (в основном, -аминокислоты) или их аналоги, в частности Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(DLeu)-Trp-NHCH2CH2OH, где Х=Trp, или Phe, или Trp (грамицидин D), цикло-(Orn-Leu-D-Phe-Pro-Val)2S),-Arg-Gly-Asp-OH,-NH2CH2CH2OH,-GlyOMe,-NH2CH(CH2OH)CH2OH,-NH2CH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, гистамин (НА), -Arg-Arg-Trp-Trp-Arg-Phe-ОН и -ArgArgOMe. Предпочтительно аминогруппы аминокомпонентов (например, -аминогруппы аминокислот) ацилируют бис-N-оксисукцинимидным эфиром гемина; или при получении монопроизводных гемина 6(7)моно-N-окси-5-норборнен-2,3-дикарбоксиимидным эфиром гемина; или активированным по одной карбоксильной группе производным гемина, причем в качестве активирующего агента используют ди-третбутилпирокарбонат в присутствии пиридина. Реакции проводят в DMF в течение 0,5-2 ч при температуре от -15 до +30 С. Таким образом, предлагаются новые эффективные антимикробные средства с антибактериальным и противогрибковым действием на основе производных гемина. Их преимуществами являются биосовместимость, биодеградируемость, активность в отношении ресистентных штаммов бактерий, отсутствие токсичности и побочных эффектов. При этом концентрации, в которых заявляемые соединения проявляют токсическое действие в отношении нормальных клеток, выше их МИК (минимальной ингибирующей концентрации) и МБК (минимальной бактерицидной концентрации) на 2-3 порядка. Следовательно, заявляемые соединения с большой вероятностью обладают широким спектром антимикробной активности,что делает их перспективными для применения в качестве лекарственных средств. Изобретение далее иллюстрируется с помощью примеров, которые не предназначены для ограничения его объема. Список сокращений МН - среда Mueller-Hilton,Оме - метиловый эфир,ONb - N-окси-5-норборнен-2,3-дикарбоксиимидный эфир,OtBu - трет-бутиловый эфир,Z - карбобензоксигруппа,ДМСО - диметилсульфоксид,ДМФА - N,N'-диметилформамид,ИК - инфракрасная спектроскопия,ИР - ингибирование роста,КФ - карбоксифлуоресцеин,МБК - минимальная бактерицидная концентрация,МИК - минимальная ингибирующая концентрация,МПК - минимальная подавляющая концентрация,ОФ-ВЭЖХ - обращенно-фазная высокоэффективная жидкостная хроматография,Tris - трис-(гидроксиметил)аминометан,ТСХ - хроматография в тонком слое,ХЛФ - хлороформ,ЭА - этилацетат. Все величины, выраженные в процентах, относятся к процентам по массе, если не указано иначе. Примеры В работе использовались аминокислоты и их производные L-ряда фирмы "Bachem" (Германия),"Reanal" (Венгрия), DOPC (Sigma-Aldrich), карбоксифлуоресцеин (Fluka, Германия), MES (SigmaAldrich), Tris (Sigma-Aldrich), грамицидин D (Sigma-Aldrich), грамицидин S (Красфарма, Россия) хлорид калия ч.д.а. (Химмед, Россия). Все растворители безводные, за исключением тех, которые использовались для экстракции из водных растворов. Индивидуальность полученных соединений проверяли методом ТСХ на пластинах Kieselgel 60 F254 (Merck, Германия) в системах хлороформ-метанол 9:1 (1), хлороформ-метанол 8:2 (2), хлороформ-метанол 5:3 (3), хлороформ-метанол-уксусная кислота 5:3:1 (4), метанол-уксусная кислота-вода 4:1:1 (5), бутанол-уксусная кислота-вода 4:1:1 (6). Хроматограммы проявляли хлор-толидиновым реактивом, нингидрином, по свечению в УФ-свете. Масс-спектры высокого разрешения получали на время-пролетном масс-спектрометре "Ultraflex"("Bruker", Германия) методом матриксной лазерно-десорбционной ионизации (TOF MALDI), в качестве матрицы использовалась 2,5-дигидроксибензойная кислота. ИК-спектры регистрировали на Фурье-спектрометре "Magna 750" ("Nicolet", США). Электронные спектры снимали на спектрофотометре "Jasco" модель UV/VS 7800 (Япония). ОФ-ВЭЖХ проводили на приборе Gilson 305 (Gilson, Франция). Препаративную ОФ-ВЭЖХ проводили на колонке Luna 10, обращенная фаза С 5, размеры 25021,2 мм, (Phenomenex, США) в следующих условиях: изократическая элюция 0,1% раствором TFA в воде, скорость потока 4 мл/мин, поглощение регистрировали при длине волны 220 нм (7). Динамику выхода КФ из липосом контролировали на флуориметре Cary Eclipse (Varian, США). Липосомы получали с помощью миниэкструдера Avanti (Avanti Polar Lipids, США). Пример 1. 6,7-бис-(Метиловый эфир N-глицил)протогемин (IX) (соединение XV, R1 = R2 =Et3N и перемешивали при комнатной температуре 3 мин. К полученному раствору прибавляли раствор 0,100 г (0,118 ммоль) 6,7-бис-N-оксисукцинимидного эфира протогемина IX (I) в 5 мл DMF и перемешивали 2 ч при комнатной температуре. Контроль за протеканием реакции осуществляли методом ТСХ в условиях (1) и (2). Раствор концентрировали в вакууме до 0,5 мл и прибавляли 6 мл диэтилового эфира. Полученный остаток растворяли в ХЛФ, при этом наблюдалось выпадение белых кристаллов Et3NHCl,от которых избавлялись декантацией раствора. Растворитель удаляли в вакууме. Для введения противоиона Cl- остаток растворяли в 15 мл смеси ХЛФ-МеОН (8:2), два раза встряхивали с 7,5 мл 0,5N раствора соляной кислоты и промывали водой до нейтральной реакции. Растворитель удаляли в вакууме. Вещество очищали на колонке (202 см) с силикагелем Kieselgel 60 F254 (Merck, Германия), элюировали смесью ХЛФ-МеОН (8:2). Фракцию, содержащую вещество с Rf 0,71 (2), собирали. Растворитель удаляли в вакууме. Выход 0,063 г (67%), Rf 0,26 (1), 0,71 (2). Электронный спектр, max, нм, ХЛФ:МеОН (8:2), (10-3): 400 (115,9), 508 (9,38), 640 (3,81). ИК-Фурье спектр, , см-1, таблетка KBr: 1737 (СО сл.эф.), 1648 (амид I),1539 (амид II). Масс-спектр, m/z: [M]+ 758,5. Пример 2. 6,7-бис-Гистаминил-протогемин (IX) (соединение XIX, R1 = R2 = HA). К раствору 0,026 г (0,236 ммоль) гистамина в 1,5 мл DMF прибавляли раствор 0,100 г (0,118 ммоль) 6,7-бис-N-оксисукцинимидного эфира протогемина IX (I) в 4 мл DMF и перемешивали 20 мин при комнатной температуре. Контроль за протеканием реакции осуществляли методом ТСХ в условиях (2) и (3). Раствор концентрировали в вакууме до 1 мл и прибавляли 10 мл диэтилового эфира. Для введения противоиона Cl- остаток растворяли в 4 мл МеОН и прибавляли 0,093 мл (0,354 ммоль) 3,8N HCl/МеОН до достижения рН 4. Растворитель удаляли в вакууме при температуре 30 С. Вещество очищали на колонкеEt3N и перемешивали при комнатной температуре 5 мин. К полученному раствору прибавляли 0,077 г(0,133 ммоль) бис-пентафторфенилового эфира Вос-глутаминовой кислоты, полученного ранее, и перемешивали 4 ч при комнатной температуре. Контроль за протеканием реакции осуществляли методом ТСХ в условиях (5). Раствор концентрировали в вакууме до 1 мл и прибавляли 10 мл диэтилового эфира. Маслообразный осадок отделяли от растворителя декантированием, остатки растворителя удаляли в вакууме. Вещество очищали на колонке (231 см) с силикагелем Kieselgel 60 F254 (Merck, Германия), злюировали смесью метанол-уксусная кислота-вода 4:0,5:0,5. Фракцию, содержащую вещество с Rf 0,67 (5),собирали. Растворитель удаляли в вакууме. Выход 0,073 г (77%), Rf 0,67 (5). []D25 - 8,53 (С 0,38; МеОН). ИК-Фурье спектр, , см-1, таблетка KBr: 1735 (СО сл. эф.), 1653 (амид I), 1542, 1558 (амид II). Масс-спектр, m/z: [M]+ 588,31. К 0,073 г (0,0946 ммоль) бис-(метилового эфира N-аргинил)-Boc-L-глутаминовой кислоты (V) приливали 6 мл 3N HCl/МеОН. Полученную суспензию перемешивали 2 ч при комнатной температуре. Контроль процесса осуществляли ТСХ в условиях (6). После достижения полной конверсии в аминосвободный дипептид растворитель удаляли в вакууме при 30 С. Маслообразный остаток кристаллизовали под безводным диэтиловым эфиром, растворитель отделяли декантацией. 2. 6,7-бис-[(бис-Метиловый эфир N-L-аргинил)-L-глутамил]протогемин IX (XVIII). К суспензии полученного H-Glu(ArgOMe)23HCl в 1,5 мл DMF прибавляли 0,047 мл (0,335 ммоль)Et3N и перемешивали при комнатной температуре 2 мин. Наблюдали выпадение осадка Et3NHCl. К полученной суспензии прибавляли раствор 0,047 г (0,0558 ммоль) 6,7-бис-N-оксисукцинимидного эфира протогемина IX (I) в 2 мл DMF и перемешивали 22 ч при комнатной температуре. Контроль за протеканием реакции осуществляли ТСХ в условиях (6). Раствор концентрировали в вакууме до 1 мл и прибавляли 10 мл диэтилового эфира. Для введения противоиона Cl- остаток растворяли в 4 мл МеОН и прибавляли 3,8N HCl/МеОН до достижения рН 4. Растворитель удаляли в вакууме при температуре 30 С. Вещество трижды очищали на колонке (131 см) с сефадексом LH-20, элюировали МеОН. Фракцию,содержащую вещество с Rf 0,07 (6), собирали. Растворитель удаляли в вакууме. Выход 0,030 г (34%). Rf 0,07 (6), Rf(на окиси алюминия) 0,70 (6). Электронный спектр, max, нм, ХЛФ:МеОН (8:2), (10-3): 400 (92,2), 508DMF прибавляли 0,010 мл (0,118 ммоль) аминоэтанола и перемешивали 20 мин при комнатной температуре. Контроль за протеканием реакции осуществляли методом ТСХ в условиях (2) и (3). Раствор концентрировали в вакууме до 1 мл и прибавляли 10 мл диэтилового эфира. Для введения противоиона Clостаток растворяли в 3 мл МеОН и прибавляли 3,8N HCl/МеОН до достижения рН 4. Растворитель удаляли в вакууме при температуре 30 С. Вещество очищали на колонке (241 см) с силикагелем Kieselgel 60 F254 (Merck, Германия), элюировали смесью ХЛФ-МеОН (5:3). Фракцию, содержащую вещество с Rf 0,52 (3), собирали. Растворитель удаляли в вакууме. Выход 0,036 г (82,5%), Rf 0,35 (2), 0,52 (3). Электронный спектр, max, нм, ХЛФ:МеОН (8:2), (10-3): 400 (183,0), 508 (5,23), 640 (2,08). ИК-Фурье спектр см-1, таблетка KBr: 1632 (амид I), 1549 (амид II). Масс-спектр, m/z: [M]+ 702,5. Пример 5. 6,7-бис-N-(1,3-дигидроксипропан-2-ил)амид протогемина (IX) (XVI, R1 = R2 = -HNCH(CH2OH)-CH2OH). К раствору 0,050 г (0,0591 ммоль) 6,7-бис-N-оксисукцинимидного эфира протогемина IX (I) в 3 млDMF прибавляли раствор 0,012 г (0,118 ммоль) 2-амино-1,3-пропандиола в 0,5 мл DMF и перемешивали 20 мин при комнатной температуре. Контроль за протеканием реакции осуществляли методом ТСХ в условиях (4). Раствор концентрировали в вакууме до 0,5 мл и прибавляли 6 мл диэтилового эфира. Для введения противоиона Cl- остаток растворяли в 9 мл смеси ХЛФ-МеОН (8:2), один раз встряхивали с 4 мл 0,06N раствора соляной кислоты, насыщенного NaCl, и промывали водой до нейтральной реакции. Растворитель удаляли в вакууме. Вещество очищали на колонке (212 см) с сефадексом LH-20, элюиро-8 020802DMF прибавляли 0,009 мл (0,118 ммоль) 3-амино-1,2-пропандиола и перемешивали 20 мин при комнатной температуре. Контроль за протеканием реакции осуществляли методом ТСХ в условиях (3) и (4). Раствор концентрировали в вакууме до 0,5 мл и прибавляли 6 мл диэтилового эфира. Для введения противоиона Cl- остаток растворяли в 3 мл МеОН и прибавляли 3,8N HCl/МеОН до достижения рН 4. Растворитель удаляли в вакууме при температуре 30 С. Вещество очищали на колонке (302 см) с силикагелем Kieselgel 60 F254 (Merck, Германия), элюировали смесью ХЛФ-МеОН:АсОН (5:3:0,5). Фракцию, содержащую вещество с Rf 0,69 (4), собирали. Растворитель удаляли в вакууме. Выход 0,023 г (46%), Rf 0,33 (3), 0,69 (4). Электронный спектр, max, нм, ХЛФ:МеОН (8:2), (10-3): 396-400 (24,2), 488 (2,14), 600-Val-Gly-Ala-D-Leu-Ala-D-Val-Val-D-Val-Trp-D-Leu-X-D-Leu-Trp-D-Leu-Trp-NHCH2CH2OH, где X = Trp, Tyr, Phe). К раствору 32 мг (0,017 ммоль) грамицидина D в 0,650 мл сухого ДМФА прибавляли 48 мкл 1N HCl в метаноле. Реакционную смесь перемешивали 72 ч в темноте при комнатной температуре. Растворитель удаляли в вакууме при 30 С. Выход 30 мг (98%). Масс-спектр, m/z: [M]+ 1854,0. К раствору 30 мг (0,016 ммоль) деформилированного грамицидина D в 0,2 мл ДМФА прибавляли 13,2 мг (0,016 ммоль) 6(7)-моно-N-окси-5-норборнен-2,3-дикарбоксиимидного эфира гемина и перемешивали 1,5 ч при комнатной температуре. Растворитель удаляли в вакууме при 30 С. Остаток растворяли в хлороформе. Остаток очищали на колонке (302 см) с силикагелем Kieselgel 60 F254 (Merck, Германия),элюировали смесью ХЛФ-МеОН 9:1. Выход 23,5 мг (59%). ИК-Фурье спектр, , см-1, таблетка KBr: 1634R2 представляет собой -ОН, а другой представляет собой -N-[цикло-(Orn-Leu-D-Phe-Pro-Val)2]). К раствору 50 мг (0,077 ммоль) гемина в 0,5 мл сухого ДМФА прибавляли 1 мл пиридина и 25,3 мг(0,116 ммоль) ди-трет-бутилпирокарбоната и перемешивали 15 мин при комнатной температуре. Одновременно к суспензии 93,5 мг (0,077 ммоль) дигидрохлорида грамицидина S в 0,5 мл ДМФА прибавляли 22 мкл (0,154 ммоль) триэтиламина и перемешивали 2 мин. К полученному смешанному ангидриду гемина прибавляли раствор аминосвободного грамицидинаS и перемешивали 3 ч. Растворитель удаляли в вакууме при температуре 30 С. Остаток растворяли в хлороформе. Остаток очищали на колонке (302 см) с силикагелем Kieselgel 60 F254 (Merck, Германия),элюировали смесью ХЛФ-МеОН 12:1. Выход 20 мг (15%). Масс-спектр, m/z: [M]+ 1739,5. Электронный спектр, max, нм, хлороформ:метанол (4:1), (10-3): 400 (105), 492 (10,6), 640 (6). Пример 9. 6(7)-Моно-(Arg-Gly-Asp)-протогемин (IX) (XI, один из R1 и R2 представляет собой -ОН, а другой представляет собой -Arg-Gly-Asp-OH). К суспензии 20 мг (0,038 ммоль) Arg-Gly-AspCH3COOHCF3COOH в 0,5 мл ДМФА добавляли 5 мкл (0,038 ммоль) триэтиламина и перемешивали 2 мин. Затем добавляли 62 мкл (0,251 ммоль) бис-(О,Nтриметилсилил)ацетамида и перемешивали при комнатной температуре 30 мин. В полученную суспензию вносили 32 мг (0,038 ммоль) 6,7-бис-N-оксисукцинимидного эфира протогемина IX и реакционную массу перемешивали 6 ч. Затем растворитель удаляли в вакууме, осадок растворяли в метаноле для десилилирования карбоксильных групп трипептида. Целевой продукт перекристаллизовывали из метанола. Выход 20 мг (54%). Масс-спектр, m/z: [M]+ 981,3. Пример 10. N-[6(7)-(протогемин IX)-ил]-ArgArgTrpTrpArgPhe-OH (XX, один из R1 и R2 представляет собой -ОН, а другой представляет собой -ArgArgTrpTrpArgPhe-OH). а) Твердофазный синтез ArgArgTrpTrpArgPhe-OH (XXI) на 2-хлортритилхлоридном полимере. Определение степени присоединения стартовой аминокислоты. К 0,1 г полимера, содержащего 1,43 ммоль активных групп, предварительно набухшего в 5 мл дихлорэтана, добавляли свежеприготовленный раствор 0,044 г (0,1143 ммоль) Fmoc-Phe-OH и 0,040 мл(0,286 ммоль) триэтиламина в 2 мл дихлорэтана, перемешивали воздухом в течение 25 мин при 25 С. Реакцию останавливали прибавлением 2 мл смеси метанол-триэтиламин (9:1), перемешивали 1 мин. Пептидилполимер отфильтровывали, промывали дихлорэтаном (2 мин 3), DMF (2 мин 2), изопропанолом (2 мин 2), DMF (2 мин 2), изопропанолом (2 мин 2), метанолом (2 мин 1), диэтиловым эфиром (2 мин 2), сушили на водоструе. Степень замещения смолы определяли спектрофотометрически. К 10 мг полученного Fmoc-Phe-полимера добавляли 1 мл 20% раствора пиперидина в DMF и перемешивали 20 мин при 25 С. Смолу отфильтровывали, отбирали аликвоту фильтрата и определяли оптическое поглощение раствора образовавшегося N-(9-флуоренилметил)пиперидина при 289 нм. Степень замещения смолы вычисляли по формуле где с - содержание активных групп в полимере, А 289 - оптическая плотность раствора по отношению к контролю, W (мг) - масса взятого полимера, 5800 - молярный коэффициент поглощения N-(9 флуоренилметил)пиперидина. Содержание Fmoc-Phe в полимере составило 0,3 ммоль/г. К 0,331 г полимера, содержащего 0,099 ммоль Cl, предварительно набухшего в 3,3 мл дихлорэтана,добавляли свежеприготовленный раствор 0,115 г (0,3 ммоль) Fmoc-Phe-OH и 0,034 мл (0,25 ммоль) триэтиламина в 0,6 мл дихлорэтана, перемешивали в течение 25 мин при 25 С. Реакцию останавливали прибавлением 6 мл смеси метанол-триэтиламин (9:1), перемешивали 1 мин. Пептидилполимер отфильтровывали, промывали дихлорэтаном (2 мин 3), DMF (2 мин 2), изопропанолом (2 мин 2), DMF (2 мин 2),изопропанолом (2 мин 2), метанолом (2 мин 1), диэтиловым эфиром (2 мин 2). Объем одной порции промывочного раствора 2 мл. Синтетический цикл включает в себя: 1) 10-минутную активацию присоединяемой Fmoc-аминокислоты (3 экв.) с DIC (3 экв.) и HOBt (3,6 экв.) в 1 мл DMF; 2) деблокирование аминогрупп обработкой 20% раствором пиперидина в DMF (3 мл 3) в течение 30 мин; 3) промывку пептидилполимера DMF (1,5 мл 8, по 3 мин); 4) дополнительную промывку пептидилполимера раствором HOBt (3,6 экв.) в 1,5 мл DMF в течение 3 мин; 5) конденсацию активированной Fmoc-аминокислоты(3 экв.) с пептидилполимером в течение 24 ч; 6) промывку пептидилполимера DMF (1,5 мл 2, по 2 мин); 7) контроль полноты замещения аминогрупп при присоединении очередной Fmoc-аминокислоты осуществляли с помощью нингидринового теста, при положительном результате теста проводили повтор стадии конденсации. Двукратно конденсацию осуществляли при присоединении следующих аминокислот: Arg2, Trp3, Trp4, Arg5, Arg6. Условия синтеза пептида H-ArgArgTrpTrpArgPhe-OH Перед реакцией боковую функцию Fmoc-Arg-OH в DMF переводили в гидрохлорид добавлением 1 экв. 12N водного раствора HCl. Растворители отгоняли в вакууме, сушили над NaOH. После окончания синтеза и деблокирования -аминогруппы 0,143 г пептидилполимера промывалиDMF (1 мл 8, по 2 мин), промывали HOBt (3,6 экв.) в 1 мл DMF. б) N-[6(7)-(протогемин IX)-ил]-ArgArgTrpTrpArgPhe-OH (XX). К 0,29 г пептидилполимера (XX) с отщепленной Fmoc-защитой прибавляли 3 экв. 6(7)-моно-Nокси-5-норборнен-2,3-дикарбоксиимидного эфира протогемина IX (II) в 4,5 мл DMF, перемешивали 5 ч и оставляли на 24 ч при комнатной температуре. Геминпептидилполимер отделяли, промывали DMF (2 мл 7, по 3 мин). Нингидриновый тест отрицательный. Геминпептидилполимер промывали DCM (2 мл 2,по 2 мин), сушили в вакууме водоструйного насоса и прибавляли к нему 4,5 мл смеси TFA-TFE-DCM(1:1:8) (1 мл 4, по 1 мин). Остаток растирали с охлажденным безводным диэтиловым эфиром (10-12 кратным избытком по объему), выпавший осадок отфильтровывали, промывали 2 эфиром, сушили в вакууме. Продукт очищали на колонке (15020 мм) с сефадексом LH-20, элюируя целевое вещество смесью метанол-вода (20:1). Выход 0,027 г (25%). Rf 0,5 (6). Электронный спектр (метанол), max, нм (10-3,М-1 см-1): 393,4. (65,8), 474,8 (8,7), 578,0 (3,61), 607,2 (3,19). Масс-спектр, m/z: 1605 [М]+ (вычислено 1603,5).-Arg-ArgOMe). а) N-оксисукцинимидный эфир N,NG,NG-трибензилоксикарбониларгинина. К раствору 0,410 г (0,709 ммоль) Z3ArgOH в 5 мл ХЛФ (безв.) добавляли 0,0816 г (0,709 ммоль) Nоксисукцинимида в 1 мл DMF. Реакционную смесь охлаждали до -10 С и прибавляли по каплям в течение 10 мин 0,146 г (0,709 ммоль) DCC в 5 мл ХЛФ. Реакционную смесь перемешивали 2 ч при 0 С, затем 5 ч при комнатной температуре и оставляли на 17 ч при 4-5 С. Контроль за протеканием реакции осуществляли методом ТСХ в условиях (11). Выпавший осадок DCU отделяли двукратным фильтрованием,растворитель удаляли в вакууме. Остаток кристаллизовали из этилацетата петролейным эфиром. Твердый осадок сушили в вакууме над безводным CaCl2. Выход 0,380 г (81%), Rf 0,68 (11). ИК-спектр Фурье см-1, таблетка KBr: 1742 (СО сл.эф.), 1610 (OCONH), 1541 (OCONH), 1262 (ароматика). Масс-спектр,m/z: [М]+ 673,7. Лит. [106]: Т.пл. 85-86. []D25 -9,7 (С 2; диоксан). б) Метиловый эфир N,NG,NG-трибензилоксикарбониларгиниларгинина. К суспензии 0,023 г (0,0890 ммоль) H-ArgOMe2HCl в 2 мл DMF прибавляли 0,024 мл (0,178 ммоль)Et3N и перемешивали при комнатной температуре 5 мин. К полученному раствору прибавляли 0,060 г(0,890 ммоль) N-оксисукцинимидного эфира N,NG,NG-трибензилоксикарбониларгинина, полученного ранее в смеси 1,5 мл DMF, и перемешивали 22 ч при комнатной температуре. Контроль за протеканием реакции осуществляли методом ТСХ в условиях (2). Растворитель концентрировали в вакууме до 1 мл и прибавляли 10 мл диэтилового эфира. Маслообразный осадок отделяли от растворителя декантированием, остатки растворителя удаляли в вакууме. Остаток растворяли в 15 мл смеси ХЛФ:МеОН (8:2) и промывали водой. Органический слой удаляли в вакууме. Вещество очищали колоночной хроматографией на силикагеле Kieselgel 60 F254 (Merck, Германия) (83 см), элюировали смесью ХЛФ-МеОН (9:1). Фракции, содержащие вещество с Rf 0,48 (2), собирали. Растворитель удаляли в вакууме. Выход 0,056 г (78%),Rf 0,48 (2). ИК-Фурье спектр, , см-1, таблетка KBr: 1727 (СО сл.эф.), 1642 (амид I), 1548 (амид II). Массспектр, m/z: [M]+ 748. в) 6,7-бис-[(Метиловый эфир N-L-аргинил)-L-аргинил]протогемин IX. К 0,054 г (0,0511 ммоль) метилового эфира N-аргинил-Z3-аргинина приливали 8 мл смеси метанолуксусная кислота-вода (6:1:1). К раствору прибавляли палладиевый катализатор и гидрировали при комнатной температуре 1 ч, контролируя ход реакции ТСХ в системе (2). После окончания реакции катализатор отфильтровывали, промывали водой, растворитель удаляли в вакууме при 40 С. К суспензии полученного H-ArgArgOMe3CH3COOH в 2 мл DMF прибавляли 0,0216 мл (0,1542 ммоль) Et3N и перемешивали при комнатной температуре 2 мин. Наблюдали выпадение осадка Et3NHCl. К полученной суспензии прибавляли раствор 0,022 г (0,0257 ммоль) 6,7-бис-N-оксисукцинимидного эфира протогемина IX (I) в 1 мл DMF и перемешивали 3,5 ч при комнатной температуре. Контроль за протеканием реакции осуществляли ТСХ в условиях (5). Раствор концентрировали в вакууме до 1 мл и прибавляли 7 мл диэтилового эфира. Для введения противоиона Cl- остаток растворяли в 15 мл смеси ХЛФ-МеОН (8:2), два раза встряхивали с 7,5 мл 0,1N раствора соляной кислоты и промывали водой до нейтральной реакции. Растворитель удаляли в вакууме. Вещество очищали препаративной ТСХ на силикагеле Kieselgel 60 F254(5). Электронный спектр, max, нм, ХЛФ:МеОН (8:2), (10-3): 400 (79,2), 478 (5,72), 596 (3,41). ИК-Фурье спектр, , см-1, таблетка KBr: 1739 (СО сл.эф.), 1642 (амид I), 1531 (амид II). Масс-спектр, m/z: [M]+ 1270,4. Пример 12. Исследование деструктирующего действия производных гемина общей формулы I в отношении липидных мембран. Для изучения влияния производных гемина на проницаемость липидной мембраны была использована методика измерения индуцированного этими веществами выхода карбоксифлуоресцеина (КФ) из нагруженных им липосом по методике, описанной в [Y.N. Antonenko, Т.В. Stoilova, S.I. Kovalchuk, et al.of gramicidin A//FEBS Letters, 2005, v. 579, p. 5247-5252]. Для приготовления липосом использовали стоковый раствор DOPC в хлороформе с концентрацией 20 мг/мл. Стоковый раствор объемом 200 мкл упаривали в токе азота, добавляли 0,4 мл буферного раствора, содержащего 10 мМ Трис, 10 мМ MES, 100 мМ KCl 100 мМ КФ, встряхивали 2 мин и подвергали трем циклам замораживания-оттаивания, встряхивая смесь после каждого цикла. Полученную смесь мультиламеллярных липосом продавливали через поликарбонатный фильтр с порами диаметром 0,1 мкм, используя миниэкструдер Avanti (Avanti PolarLipids, США). Невключившийся в липосомы КФ отделяли гель-хроматографией на сефадексе G-50. Сефадекс оставляли на ночь в воде для набухания. Колонку объемом 20 мл заполняли набухшим сефадексом, после чего уравновешивали 60 мл буфера, содержащего 10 мМ Tris, 10 мМ MES, 100 мМ KCl (буфер А). Объем суспензии липосом, содержащих КФ, составлял 500 мкл (концентрация липида 0,045 мг/мл). Суспензию помещали в кювету, объем доводили до 2 мл буфером А. К полученной суспензии липосом добавляли 10 мкл 10-4 М раствора производного гемина общей формулы I в ДМСО. Динамику выхода КФ контролировали флуориметрически. Флуоресценцию карбоксифлуоресцеина возбуждали при длине волны 490 нм, регистрировали при 520 нм (ширина обеих щелей 5 нм). Относительное количество вышедшего из липосом красителя в конкретный момент времени рассчитывали по формуле где F0 и Ff являются уровнем флуоресценции до и после добавления пептида соответственно, a Fm - значение флуоресценции после полного разрушения липосом детергентом Triton Х-100, добавленным до конечной концентрации 2,4 мас.%. На фиг. 1 представлена динамика выхода карбоксифлуоресцеина из липосом под действием производных гемина общей формулы I при соотношении липид/производное гемина 10:1 (моль/моль). Пример 13. Исследование антибактериальной активности соединений общей формулы I. Для определения антибактериальной активности веществ были использованы штаммы Bacillus subtilis BKM В-501, Staphylococcus aureus 209P, Enterococcus faecalis BKM B-871, Micrococcus luteus BKMAc-2230 (получены из Всероссийской коллекции микроорганизмов Института биохимии и физиологии микроорганизмов РАН). Основные параметры, которые характеризуют антибактериальную активность, это минимальная ингибирующая концентрация (МИК) и минимальная бактерицидная концентрация(МБК). МИК - это наименьшая концентрация исследуемого соединения, полностью ингибирующая размножение бактерий в жидкой среде. МБК - это наименьшая концентрация, вызывающая гибель всех клеток. МИК оценивали методом ингибирования роста культуры в жидкой среде с серийными разведениями веществ по модифицированной методике [Amsterdam, D. 1996. Susceptibility testing of antimicrobials inliquid media, pp. 52-111. In Loman, v., ed. Antibiotics in laboratory medicine, 4th ed. Williams and Wilkins,Baltimore]. Бактерии культивировали и тестирование проводили в жидкой среде МН (среда Mueller-Hinton: сухой экстракт говяжьего бульона 4 г/л, крахмал 1,5 г/л, гидролизат казеина 17,5 г/л; Sigma-Fluka каталожный номер 70192) при 37 С, 100% влажности и перемешивании. Для тестирования использовали культуру (с 4 по 7 пересев от разморозки) в экспоненциальной фазе роста. Все исследуемые соединения кроме грамицидина D поглощают свет на длине волны 595 нм, используемой для оценки роста бактериальной культуры. Поэтому при оценке оптической плотности суспензии бактерий учитывали поправку на поглощение каждого соединения с учетом его концентрации в лунке. Ингибирование роста (ИР) бактерий рассчитывали в процентах через 20 ч инкубации клеток с веществами по оптической плотности (А), измеряемой в каждой лунке на длине волны 595 нм, используя формулу где индекс i обозначает номер лунки, k - контрольная лунка с бактериями, в которую исследуемое соединение не вносится, 0 - измерение проводится сразу же после внесения исследуемого вещества в лунку, t измерение через 20 ч после внесения вещества. Для определения антибактериальной активности исследуемых соединений использовали следующий экспериментальный протокол. Криопробирку с культурой тестируемого штамма (Bacillus subtilis ВКМ В-501, Staphylococcus aureus 209P, Enterococcus faecalis ВКМ В-871, Micrococcus luteus BKM Ac2230) в среде с 7% ДМСО, хранившуюся в жидком азоте, быстро размораживали, 100 мкл суспензии клеток добавляли к 1,5 мл свежей среды МН. Клетки растили в течение суток при температуре 37 С и перемешивании на орбитальном шейкере со скоростью 150 об/мин. Морфологические признаки штамма и отсутствие контаминации посторонними бактериями проверяли (а) путем посева на агаризованную (15 г/л агара) среду МН по форме и цвету образующихся колоний, (б) под микроскопом (Микмед-2, ЛОМО,Россия) с 40 объективом по характерным морфологическим признакам клеток. Далее бактерии культивировали в 1 мл жидкой среды МН при температуре 37 С и перемешивании. Клетки пересевали каждые сутки. Начиная с 3-го и заканчивая 6-м пересевом, культуру клеток использовали для постановки тестов. Для постановки теста 5 мкл бактериальной суспензии в стационарной фазе роста переносили в 1 мл стерильной среды МН и инкубировали до достижения экспоненциальной фазы роста (3-5 ч, 37 С при перемешивании со скоростью 150 об/мин). Чтобы оценить концентрацию микроорганизмов, измеряли оптическую плотность (А) полученной бактериальной культуры на длине волны 595 нм. Считали, что А=0,2, измеренная от 200 мкл суспензии клеток в 96-луночном планшете с учетом поглощения среды,соответствует 4108 клеток/мл для обоих используемых штаммов. С учетом измерения концентрации клеток суспензию разбавляли средой МН до 5104-1l05 клеток/мл и переносили в стерильный 96 луночный планшет по 100 мкл на лунку. Затем к клеткам вносили исследуемые соединения и делали серийные двукратные разведения этих соединений в лунках планшета. Максимальная концентрация веществ в серии составляла 10-4 М, минимальная - 1,610-6 М. Исследование антибактериальной активности выполняли в 2 повторах для каждого соединения, а результат усредняли. В качестве контролей использовали 100 мкл бактериальной культуры без добавления каких-либо веществ (4 лунки); бактериальную культуру, в которую добавлен 1% ДМСО или вода в объеме, как в лунках с максимальной концентрацией тестируемых соединений (4 лунки); 100 мкл стерильной среды МН без бактерий и без исследуемых веществ для контроля случайной контаминации в планшете (4 лунки). Сразу после внесения соединений с помощью планшетного фотометра "Униплан" (Пикон, Россия) в каждой лунке измеряли Ai0, а в контрольных лунках - Ak0, необходимые для расчета по формуле (1). Планшет инкубировали в течение 20 ч при температуре 37 С и перемешивании со скоростью 150 об/мин. Затем в каждой лунке измеряли Ait, а в контрольных лунках - Akt и рассчитывали ингибирование роста бактерий по формуле (1). МИК определяли, как минимальную концентрацию исследуемого соединения,при которой ингибирование роста составляет 100%. Для определения МБК среду из лунок, где концентрация исследуемого соединения равнялась МИК,МИК 2 и МИК 4, переносили на чашки Петри с агаризованной средой МН (15 г/л агара) и равномерно растирали по площади чашек стерильными шпателями. Чашки инкубировали 2 суток. МБК определяли как наименьшую концентрацию исследуемого соединения, при которой колонии на чашке Петри не вырастают. Все тесты на антибактериальную активность повторили с перерывом в 2 дня, чтобы оценить изменчивость устойчивости бактериальных клеток к действию исследуемых соединений. Таблица 1 Характеристики антибактериальной активности соединений общей формулы I в отношении грамположительных бактерий Bacillus subtilis BKM B-501 Таблица 2 Характеристики антибактериальной активности соединений общей формулы I в отношении грамположительных бактерий Staphylococcus aureus 209P Таблица 3 Характеристики антибактериальной активности соединений общей формулы I в отношении грамположительных бактерий Enterococcus faecalis BKM В-871 Таблица 4 Характеристики антибактериальной активности соединений общей формулы I в отношении грамположительных бактерий Micrococcus luteus BKM Ac-2230 Пояснение к таблицам 1-4: соединение обладает бактериостатическим эффектом, оно ингибирует размножение бактерий в указанной концентрации, но не убивает их; 2,3 МБК не достигнута. Приведена максимальная использованная концентрация вещества. 1 Таким образом, соединения VII, VIII и XVIII, подавляют рост грамположительных бактерий S. aureus в концентрациях до 50 мкМ (табл. 2). Бактерии М. luteus высокочувствительны к действию данных соединений. Соединения V, VI, VII,VIII, IX, гемин, GrD и грамицидин S ингибируют рост М. luteus в концентрациях до 30 мкМ. При этом для соединений V, VII, VIII, GrD и грамицидина S (табл. 4) МИК достаточно низка - меньше 10 мкМ. Соединения Н и VI несколько менее активны (МИК = 12,5 и 25 мкМ соответственно). Все исследованные соединения проявили бактерицидную активность в отношении М. luteus, причем МБК не превышает 30 мкМ. Энтерококки Е. faecalis в среднем более устойчивы к действию данных соединений, чем микрококки М. luteus и стафилококки S. fureus. Наиболее эффективным соединением в отношении Е. faecalis оказалось соединение XVIII: МИК 12,5 мкМ. Все исследованные соединения проявляют активность в отношении грамположительных бактерий В. subtilis. Наиболее активными оказались вещества VII и XVIII (МИК меньше 10 мкМ). Пример 14. Определение специфической активности производных гемина в отношении штаммов резистентных бактерий. Материалы и методы. Испытуемые препараты - производные гемина, растворимые в воде (VII, XVIII) и растворимые в ДМСО (VIII, XV, XIV). В качестве препарата сравнения был взят ванкомицин. Каждое вещество испытывалось в трех повторах. В работе использовались одноразовые стерильные 96-луночные плоскодонные планшеты, чашки Петри, пипетки, наконечники и пробирки (Пан-Эко, Москва). Питательные среды: бульон Мюллера-Хинтон для работы готовили из сухих сред (Mueller Hintonbroth, Acumedia, Baltimore) и стеризовали автоклавированием при 121 С в течение 15 мин. Для культивирования Staphylococcus aureus использовали готовую сухую среду - триптиказосоевый агар (Tripticase Soy Agar, BBL). Для культивирования Enterococcus faecalis использовали готовую сухую среду - Колумбийский агар (Columbia Agar Base, BBL). Среды стерилизовали автоклавированием при 121 С в течение 15 мин. Исследуемые резистентные бактериальные штаммы. Грамположительные:Enterococcus faecium569. Бактериальный инокулюм был постоянный и составлял 5105 КОЕ/мл. Полученные результаты представлены в таблицах (Mcp). Постановка эксперимента. Для водорастворимых соединений с 2 по 8 лунки вносили растворитель (вода) по 15 мкл, затем в 1 лунку вносили 30 мкл стокового раствора исследуемого соединения в воде с концентрацией 1103 М и последовательным двукратным разведением доводили его концентрацию до 0,007103 М. Из каждой лунки отбирали по 10 мкл и добавляли по 190 мкл бактериальной культуры (105 КОЕ). Для растворимых в ДМСО соединений с 2 по 8 лунки вносили растворитель (ДМСО) по 10 мкл, затем в 1 лунку вносили 20 мкл стокового раствора исследуемого соединения в воде с концентрацией 5103 М и последовательным двукратным разведением доводили его концентрацию до 0,039l03 M. Из каждой лунки отбирали по 2 мкл и добавляли по 198 мкл бактериальной культуры (105 КОЕ). В качестве контроля включали лунки, не содержащие тестируемых препаратов (контроль роста культуры). Кроме того, ставился контроль чистоты питательных сред и растворителей. Планшеты инкубировали в термостате при 36 С в течение 24 ч. Оценку роста культур проводили визуально, сравнивая рост микроорганизмов в присутствии изучаемых тест-соединений с ростом культуры без них. За МПК - минимальную подавляющую концентрацию принимали последнее разведение испытуемых препаратов с подавлением роста бактериальной культуры. Полученные результаты представлены в таблицах. Определение МИК производных гемина в отношении Гр+ штаммов (10 M) Таблица 6 Определение МИК ванкомицина в отношении Гр+ и Гр- штаммов (мкг/мл) Таким образом, производные гемина общей формулы I активны в разной степени в отношении Гр+ штаммов резистентных бактерий. Пример 15. Методика определения гемолитической активности соединений общей формулы I. Для исследования гемолитической активности использовали свежую капиллярную кровь человека. Эффективность гемолиза определяли по выходу гемоглобина из эритроцитов в среде RPMI-1640 (без фенолового красного, с добавлением 10% фетальной телячьей сывотки и 20 мМ L-глутамина) при начальной плотности эритроцитов (1,00,1)107 клеток/мл через 3 ч инкубации с агентом (37 С, 5% CO2,100% влажность, перемешивание на орбитальном шейкере). В качестве характеристики гемолитической активности использовали долю гемоглобина, вышедшего из эритроцитов во внешнюю среду. Эритроциты, тени и промежуточные формы, содержащие не вышедший гемоглобин, отделяли центрифугированием. Гемоглобин определяли по поглощению супернатанта на длине волны 414 нм (вблизи максимума полосы Соре гема). Поскольку все исследуемые соединения кроме GrD поглощают свет на данной длине волны, при расчете доли вышедшего гемоглобина учитывали поправку на поглощение каждого соединения с учетом его концентрации. Выход гемоглобина (ВГ) рассчитывали в процентах по оптической плотности (А) на длине волны 414 нм, используя формулу где индекс е обозначает супернатант образца с эритроцитами, i - добавленную концентрацию соединения, о - супернатант образца без добавления исследуемых соединений, m - раствор без эритроцитов, t супернатант образца с 100% лизированными эритроцитами. Доля вышедшего гемоглобина равна доле лизированных эритроцитов при условии, что лизис происходит полностью, то есть при лизисе из эритроцита выходит весь содержащийся в нем гемоглобин. Исследование гемолитической активности выполняли в 2 повторах для каждого соединения, а результат усредняли. Для определения гемолитической активности соединений использовали следующий экспериментальный протокол. Кровь (100 мкл) отбирали из пальца здорового донора в пробирку, содержащую 0,9 мл среды RPMI-1640 (без фенолового красного) и гепарин (10 ед/мл). Клетки осаждали центрифугированием в течение 5 мин при 200g и переносили в 10 мл среды RPMI-1640 (без фенолового красного, с добавлением 10% фетальной телячьей сывотки и 20 мМ L-глутамина, далее - полная среда). Плотность эритроцитов в суспензии определяли подсчетом в камере Горяева с помощью микроскопа "Микмед-2"(ЛОМО, Россия) и разбавляли полной средой до (20,2)107 клеток/мл. Методом последовательных разведений с шагом в 2 раза готовили серии растворов соединений в полной среде (максимальная концентрация 200 мкМ, минимальная - 1,6 мкМ, объем 75 мкл). К приготовленным растворам быстро добавляли 75 мкл суспензии эритроцитов с плотностью (20,2)107 клеток/мл. Для отрицательных контролей к 75 мкл суспензии эритроцитов с плотностью (20,2)107 клеток/мл добавляли: а) 75 мкл полной среды (4 образца); б) 60 мкл полной среды и 15 мкл воды (4 образца) или в) 73,5 мкл полной среды и 1,5 мкл ДМСО (4 образца). Для определения 100%-ного выхода гемоглобина(положительный контроль, 4 образца) эритроциты из 75 мкл суспензии осаждали центрифугированием (5 мин при 200g), осадок ресуспендировли в деионизированной воде (50 мкл), после полного лизиса объем пробы доводили полной средой до 150 мкл. Все образцы (кроме положительного контроля) инкубировали в течение 3 ч при температуре 37 С,5% CO2, 100% влажности и перемешивании со скоростью 150 об/мин. Затем все образцы центрифугировали в течение 5 мин при 2700g. В лунки 96-луночного планшета переносили по 130 мкл супернатанта из каждого образца. После чего с помощью фотометрического анализатора "Униплан" (Пикон, Россия) измеряли оптическую плотность в лунках планшета на длине волны 414 нм. Выход гемоглобина рассчитывали по формуле (2). На фиг. 2 представлена гемолитическая активность производных гемина и соединений сравнения - грамицидина S, грамицидина D и гемина. Данные представлены в виде среднего по 2 повторамстандартное отклонение. Соединение XII не проявляет гемолитическую активность вплоть до 100 мкМ. Вещества V, VI, VIII,IX, XVIII имеют низкую гемолитическую активность (фиг. 2), причем эффективность гемолиза всех синтезированных соединений значительно ниже, чем у гемина, и весьма низка даже при максимальной концентрации соединений (100 мкМ). Пример 16. Исследование цитотоксической активности соединений общей формулы (I) в отношении лейкоцитов человека. Суммарную фракцию лейкоцитов выделяли из крови человека методом свободной седиментации,для чего использовали свежеотобранную венозную кровь здорового донора. Кровь (10 мл) с добавкой 10 ед./мл гепарина выдерживали в течение 2,5 ч при температуре 15-18 С в темноте. Отбирали светлый верхний слой жидкости (4 мл) над столбом оседающих эритроцитов, трижды отмывали сбалансированным солевым раствором Хенкса и ресуспендировали в среде RPMI-1640 (с добавлением 8% эмбриональной бычьей сыворотки, 2 мМ L-глутамина и 10 мМ HEPES, далее - полная среда). Концентрацию лейкоцитов и эритроцитов в суспензии определяли подсчетом в камере Горяева, после чего суспензию доводили полной средой до концентрации лейкоцитов (1,00,1)106 клеток/мл. При этом концентрация эритроцитов в используемой для измерений суспензии клеток крови не превышала 30% от концентрации лейкоцитов. Для определения цитотоксичности исследуемых соединений для лейкоцитов человека суспензию клеток переносили в лунки стерильных 96-луночных планшетов, методом последовательных разведений с шагом в 2 раза вносили исследуемые вещества (диапазон тестируемых концентраций: 3,2-100 мкМ для соединений GrD и грамицидина S 8-500 мкМ для соединения XIII; 8-1000 мкМ для соединений V, VI,VII, VIII, IX, X, XI, XIV, XV, XIX и Hem) и аккуратно перемешивали. Эксперимент выполняли в двух параллельных повторах. В качестве контролей использовали клетки, к которым добавляли эквивалентное количество растворителя, в котором были приготовлены исследуемые вещества: воду для соединений VII и X; водный раствор ДМСО для соединения V, VI, VIII, IX; ДМСО для GrD, грамицидин S, Hem, XI, XIII, XIV, XV,XIX. Дополнительный контроль - суспензия лейкоцитов без всяких добавок. Клетки инкубировали с исследуемыми соединениями 3 ч (37 С, 5% СО 2, 100% влажность). Гибель лейкоцитов оценивали при помощи флуоресцентной микроскопии. Для выявления мертвых и живых клеток использовали окрашивание йодистым пропидием (проникает только в ядра мертвых клеток) и Hoechst 33342 (окрашивает все ядра). Клетки инкубировали в планшетах 15 мин одновременно с йодистым пропидием и Hoechst 33342 (37 С, 5% СО 2), а затем планшеты помещали под микроскоп для анализа. Долю погибших клеток определяли по флуоресцентным изображениям клеток в синей (Hoechst 33342) и красной (йодистый пропидий) областях спектра, полученным при помощи флуоресцентного микроскопа Axio Observer (Zeiss, Германия) с 10 объективом ("Plan-Neofluar" 10/0,3). Использовали следующие наборы флуоресцентных фильтров. Для йодистого пропидия: полосовой фильтр на возбуждение 530-585 нм; барьерное дихроичное зеркало 600 нм, длинноволновый барьерный анализирующий фильтр 615 нм. Для Hoechst 33342: полосовой фильтр на возбуждение 359-372 нм; барьерное дихроичное зеркало 395 нм, длинноволновый барьерный анализирующий фильтр 397 нм. С помощью цифровой фотокамеры регистрировали три типа изображений клеток: а) в проходящем белом свете; б) флуоресцентное изображение в синей области спектра с ультрафиолетовым возбуждением; в) флуоресцентное изображение в красной области спектра с возбуждением зеленым светом. Фотографировали не менее 4 полей зрения на лунку в разных ее областях. Результат анализа усредняли по 1000-1500 клеток для каждой концентрации исследуемых соединений. Таблица 7 Цитотоксическая активность соединений общей формулы (I) в отношении лейкоцитов человека Соединения V, VII, VIII, IX и X в концентрации до 1 мМ не вызывают гибель лейкоцитов из крови человека. При этом небольшой токсический эффект растворов грамицидина S, XI, в ДМСО полностью обусловлен токсическим действием растворителя (ДМСО). Для соединений VI, XIII, XIV, XV и XIX обнаружен слабый токсический эффект, который проявляется при концентрациях, близких к 1 мМ, для соединений XIV, XV и XIX, при концентрациях больше 125 мкМ для соединений VI и XIII. Соединение сравнения - гемин обладает существенно более высокой токсичностью в отношении лейкоцитов по сравнению с заявляемыми соединениями (40% против 3-17%, табл. 7). Полученные результаты свидетельствуют о перспективности заявляемых веществ для создания на их основе нетоксичных, биосовместимых антимикробных агентов, в том числе для профилактики и лечения заболеваний, вызванных различными грамположительными бактериями, в том числе резистентными. Пример 17. Исследование противогрибковой активности соединений общей формулы (I). Объектом воздействия являлись клетки музейного штамма Cryptococcus neoformans3465, а также клетки музейного штамма Candida albicans927, выращенных на глюкозо-пептон-дрожжевой среде при 32 С в течение 1 суток. В качестве соединения сравнения использовались антимикотики пимафуцин,амфотерицин, флуконазол. Эксперимент проводили в круглодонных 96-луночных планшетах фирмы "Ленмедполимер" в двух повторностях. В первый столбец (0) вносили 10 мкл стокового раствора водорастворимых препаратов с концентрацией 10-2-10-3 моль/л, во второй также 10 мкл плюс 10 мкл растворителя, соответствующего данному соединению, суспендировали и переносили 10 мкл в следующую ячейку, и т.д. до 8 ячейки ряда. Стоковые растворы водонерастворимых соединений общей формулы I (V, VIII, XII, XIII, XIV, гемин) готовили в ДМСО, разбавляли ДМСО и средой. Концентрация ДМСО в реакционной ячейке составляла 5%. Затем в каждую ячейку вносили 190 мкл суспензии клеток культуры Cr. neoformans в синтетической питательной среде (конечная концентрация клеток примерно 103 КОЕ/мл), содержащей рНиндикатор бромкрезоловый синий (рН среды 5,5, цвет индикатора - голубой). При понижении рН до 4,5 цвет индикатора в среде изменяется на желтый, что является признаком роста клеток гриба. Синтетическая среда состояла из следующих компонентов: соли, аминокислоты, микроэлементы, витамины, антибиотик и глюкоза (всего 30 компонентов) [Yarrow D. Methods for the isolation, maintenance and identification of yeasts//In: The Yeasts, A Taxonomic Study. 1998. Elsevier. Ed. by Kurtsman C.P, Fell J.W., p.77-100]. После внесения суспензии клеток Cr. neoformans планшет в течение 1 ч инкубировали при 32 С с пере- 19020802 мешиванием, затем переносили в стационарный термостат и инкубировали 2 и 5 суток при 27 С. После внесения суспензии клеток С. albicans планшеты инкубировали в течение 1 ч при 32 С с перемешиванием, затем переносили в стационарный термостат и инкубировали 1 и 4 суток при 27 С. Результаты приведены в табл. 8 и 9. Таблица 8 Рост культуры Cryptococcus neoformans в присутствии соединений общей формулы I- слабый рост, индикатор желтый, но осадок выросших клеток в виде размытого пятна;(+) - сильный рост, индикатор желтый, осадок клеток в виде плотного компактного пятна;на 2 сутки голубой цвет до 6 ячейки, но с небольшим осадком на дне; на 5 сутки желтый;концентрация препаратов в 0 ячейке составляет 5,0010-4 М. Таблица 9 Рост культуры Candida albicans в присутствии соединений общей формулы I Контрольные посевы из ячеек, проведенные через 1-4 сутки воздействия соединениями общей формулы I, показали практически фунгицидный эффект соединения XVIII в концентрации около 510-5 М. Кроме того, соединение XII оказалось эффективным против одного из возбудителей крипотоккозаCryptococcus humicolus с МПК 12,5 мкМ. Таким образом, соединения общей формулы I проявляют фунгистатический и/или фунгицидный эффекты, величина которых зависит от строения и проявляется в интервале концентраций от 10-4 до 10-6 М. Пример 18. Примеры лекарственных форм. А. Желатиновые капсулы. Состав вводимого в капсулу порошка: Указанные выше ингредиенты смешивают и смесь вводят в твердые желатиновые капсулы в количестве 151-285 мг. Б. Таблетированная форма. Таблетированную форму получают, используя приведенные ниже ингредиенты: Компоненты смешивают и прессуют для образования таблеток весом 200 мг каждая. В. Аэрозольная форма. Состав аэрозольной смеси, рассчитанной на 10 приемов: Соединение смешивают с наполнителями и помещают в специальное устройство для распыления. Г. Суппозитории. В качестве суппозиторной основы могут быть использованы основы, не растворимые в воде - масло какао; основы, растворимые в воде или смешиваемые с водой - желатино-глицериновые или полиэтиленоксидные; комбинированные основы - мыльно-глицериновые. Пример состава суппозитория. Соединение, соответствующее общей формуле (I) - 1-50 мг,Масло какао - количество, необходимое для получения суппозитория. При необходимости возможно изготовление ректальных, вагинальных и уретральных суппозиториев с соответствующими наполнителями. Д. Мази. В качестве мазевой основы могут быть использованы углеводородные мазевые основы - вазелин белый и желтый (Vaselinum album, Vaselinum flavum),вазелиновое масло (Oleum Vaselini), мазь белая и жидкая (Unguentum album, Unguentum flavum), а в качестве добавок для придания более плотной консистенции - твердый парафин и воск; абсорбтивные мазевые основы - гидрофильный вазелин (Vaselinum hydrophylicum), ланолин (Lanolinum), кольдкрем (Unguentum leniens); мазевые основы, смываемые водой - гидрофильная мазь (Unguentum hydrophylum); водорастворимые мазевые основы - полиэтиленгликолевая мазь (Unguentum Glycolis Polyaethyleni), бентонитовые основы и другие. Пример состава мази. Мази изготавливают по соответствующей технологии. Е. Раствор для инъекций. В качестве растворителя при приготовлении раствора для инъекций могут быть использованы 0,9% раствор натрия хлорида, дистиллированная вода, раствор новокаина. Форма выпуска - ампулы, флаконы,шприц-тюбики. Возможно изготовление различных лекарственных форм для инъекций - стерильных растворов,стерильных порошков и таблеток. Примеры композиций для дезинфицирующих и антисептических средств. Таким образом, производные гемина общей формулы (I) обладают антибактериальной и противогрибковой активностью, в том числе в отношении патогенного для человека S. aureus и его резистентных штаммов. Кроме того, практически все заявленные производные гемина в различной степени обладают способностью увеличивать проницаемость модельных липидных мембран, что, как известно из литературных данных, представляет собой важную часть механизма антимикробного (антибактериального,противогрибкового,) действия антимикробных агентов. Эффективность соединений, соответствующих общей формуле I, подтверждает их пригодность для промышленного применения в составе дезинфицирующих, антисептических и терапевтических средств с противогрибковым и антибактериальным действием. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения общей формулы (I) где R1 и R2 одинаковые или различные, при этом либо один из R1 и R2 представляет собой -ОН, а другой представляет собой(грамицидин D), -N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -Arg-ArgTrp-Trp-Arg-Phe-OH,либо R1 и R2 оба представляют собой -ArgOMe, -SerOMe, -AlaHA, -AlaHis, -NHCH2CH2OH,-GlyOMe, -NHCH(CH2OH)CH2OH, -NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА или -ArgArgOMe, где НА представляет собой остаток гистаминаMen+ представляет собой Fe2+ или Fe3+; или его изомеров, или смесей изомеров, или их фармацевтически приемлемых солей в качестве антимикробного средства. 2. Применение по п.1, где антимикробное средство представляет собой антибактериальное средство. 3. Применение по п.2, где указанное антибактериальное средство проявляет активность в отношении грамположительных бактерий рода Staphylococcus, Bacillus, Enterococcus и/или Micrococcus. 4. Применение по п.3, где бактерии выбирают из видов Staphylococcus aureus, Enterococcus faecalis иMicrococcus luteus. 5. Применение по п.3, где бактерии относятся к штамму Staphylococcus aureus 209P, Enterococcusfaecalis BKM B-871, Micrococcus luteus BKM Ac-2230, Staphylococcus aureus25923 ATCC, Staphylococcus aureus100 KC, Staphylococcus epidermidis533, Enterococcus faecalis559 или Enterococcus faecium569. 6. Применение по п.1, где антимикробное средство представляет собой противогрибковое средство. 7. Применение по п.6, где указанное противогрибковое средство проявляет активность в отношении микроскопических грибов рода Candida и/или Criptococcus. 8. Применение по п.7, где микроскопические грибы представляют собой Cryptococcus neoformans или Candida albicans. 9. Применение по п.6, где микроскопические грибы относятся к штамму Candida albicans927 илиCryptococcus neoformans3465. 10. Применение по любому из пп.1-9, где в соединениях общей формулы (I) либо один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala-(D-Leu)Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или Phe, илиTyr (грамицидин D), -N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -ArgArg-Trp-Trp-Arg-Phe-OH,либо R1 и R2 оба представляют собой -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH,- 23020802-NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -HA или -Arg-ArgOMe, где НА представляет собой остаток гистамина 11. Антимикробное средство, представляющее собой производное гемина общей формулы (I) где R1 и R2 одинаковые или различные, при этом либо один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala-(D-Leu)Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или Phe, илиTyr (грамицидин D), -N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -ArgArg-Trp-Trp-Arg-Phe-OH,либо R1 и R2 оба представляют собой -AlaHis, -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH,-NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА или -Arg-ArgOMe, где НА представляет собой остаток гистаминаMen+ представляет собой Fe2+ или Fe3+; или его изомер, или смесь изомеров, или их фармацевтически приемлемую соль. 12. Антимикробное средство по п.11, которое представляет собой антибактериальное средство. 13. Антимикробное средство по п.12, которое проявляет активность в отношении грамположительных бактерий рода Staphylococcus, Bacillus, Enterococcus и/или Micrococcus. 14. Антимикробное средство по п.13, где бактерии выбирают из видов Staphylococcus aureus, Enterococcus faecalis и Micrococcus luteus. 15. Антимикробное средство по п.13, где бактерии относятся к штамму Staphylococcus aureus 209 Р,Enterococcus faecalis BKM B-871, Micrococcus luteus BKM Ac-2230, Staphylococcus aureus25923 ATCC,Staphylococcus aureus100 KC, Staphylococcus epidermidis533, Enterococcus faecalis559 или Enterococcus faecium569. 16. Антимикробное средство по п.11, которое представляет собой противогрибковое средство. 17. Антимикробное средство по п.16, которое проявляет активность в отношении микроскопических грибов рода Candida и/или Criptococcus. 18. Антимикробное средство по п.17, где микроскопические грибы представляют собой Cryptococcus neoformans или Candida albicans. 19. Антимикробное средство по п.17, где микроскопические грибы относятся к штамму Candida albicans927 или Cryptococcus neoformans3465. 20. Антимикробное средство по любому из пп.11-19, где в соединениях общей формулы (I) либо один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala-(D-Leu)Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или Phe, илиTyr (грамицидин D), -N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -ArgArg-Trp-Trp-Arg-Phe-OH,либо R1 и R2 оба представляют собой -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH,-NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -HA или -Arg-ArgOMe, где НА представляет собой остаток гистамина 21. Фармацевтическая композиция, обладающая антимикробной активностью, включающая в качестве активного ингредиента соединение формулы (I) где R1 и R2 одинаковые или различные, при этом либо один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala-(D-Leu)Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или Phe, илиTyr (грамицидин D), -N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -ArgArg-Trp-Trp-Arg-Phe-OH,либо R1 и R2 оба представляют собой -AlaHis, -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH,-NHCH2CH(OH)CH2OH, -Glu(ArgOMe) -ArgOMe, -НА или -Arg-ArgOMe, где НА представляет собой остаток гистаминаMen+ представляет собой Fe2+ или Fe3+; или его изомер, или смесь изомеров, или их фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем или наполнителем. 22. Фармацевтическая композиция по п.21, которая представляет собой антибактериальное средство. 23. Фармацевтическая композиция по п.22, которая проявляет активность в отношении грамположительных бактерий рода Staphylococcus, Bacillus, Enterococcus и/или Micrococcus. 24. Фармацевтическая композиция по п.23, где бактерии выбирают из видов Staphylococcus aureus,Enterococcus faecalis и Micrococcus luteus. 25. Фармацевтическая композиция по п.23, где бактерии относятся к штамму Staphylococcus aureus 209P, Enterococcus faecalis BKM B-871, Micrococcus luteus BKM Ac-2230, Staphylococcus aureus25923ATCC, Staphylococcus aureus100 KC, Staphylococcus epidermidis533, Enterococcus faecalis559 или Enterococcus faecium569. 26. Фармацевтическая композиция по п.21, которая представляет собой противогрибковое средство. 27. Фармацевтическая композиция по п.26, которая проявляет активность в отношении микроскопических грибов рода Candida и/или Criptococcus. 28. Фармацевтическая композиция по п.27, где микроскопические грибы представляют собой Cryptococcus neoformans или Candida albicans. 29. Фармацевтическая композиция по п.27, где микроскопические грибы относятся к штамму Candida albicans927 или Cryptococcus neoformans3465. 30. Фармацевтическая композиция по любому из пп.21-29, где в соединениях общей формулы (I) либо один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala-(D-Leu)Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или Phe, илиTyr (грамицидин D), -N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -ArgArg-Trp-Trp-Arg-Phe-OH,либо R1 и R2 оба представляют собой -NHCH2CH2OH, -GlyOMe (XV), -NHCH(CH2OH)CH2OH,-NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe (XVIII), -НА или -Arg-ArgOMe, где НА представляет собой остаток гистамина 31. Способ лечения и/или профилактики заболеваний, вызванных бактериями или микроскопическими грибами, включающий введение нуждающемуся в этом пациенту средства по любому из пп.11-20 или фармацевтической композиции по любому из пп.21-30. 32. Способ по п.31, в котором заболевание вызвано бактериями. 33. Способ по п.32, в котором бактерии являются грамположительными бактериями рода Staphylococcus, Bacillus, Enterococcus или Micrococcus. 34. Способ по п.33, где бактерии выбирают из видов Staphylococcus aureus, Enterococcus faecalis иMicrococcus luteus. 35. Способ по п.33, где бактерии относятся к штамму Staphylococcus aureus 209P, Enterococcus faecalis BKM B-871, Micrococcus luteus BKM Ac-2230, Staphylococcus aureus25923 ATCC, Staphylococcusaureus100 KC, Staphylococcus epidermidis533, Enterococcus faecalis559 или Enterococcus faecium569. 36. Способ по п.31, в котором заболевание вызвано микроскопическими грибами. 37. Способ по п.36, где микроскопические грибы относятся к роду Candida или Criptococcus. 38. Способ по п.37, где микроскопические грибы представляют собой Cryptococcus neoformans илиCandida albicans. 39. Способ по п.37, где микроскопические грибы относятся к штамму Candida albicans927 илиCryptococcus neoformans3465. 40. Способ по любому из пп.31-39, где в соединениях общей формулы (I) либо один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala-(D-Leu)Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или Phe, илиTyr (грамицидин D), -N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -ArgArg-Trp-Trp-Arg-Phe-OH,либо R1 и R2 оба представляют собой -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH,-NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -HA или -Arg-ArgOMe, где НА представляет собой остаток гистамина 41. Антисептическая и/или дезинфицирующая композиция, содержащая соединение общей формулы (I) где R1 и R2 одинаковые или различные, при этом либо один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala-(D-Leu)Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или Phe, илиTyr (грамицидин D), -N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -ArgArg-Trp-Trp-Arg-Phe-OH,либо R1 и R2 оба представляют собой -AlaHis, -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH,-NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА или -Arg-ArgOMe, где НА представляет собой остаток гистаминаMen+ представляет собой Fe2+ или Fe3+; или его изомер, или смесь изомеров, или их фармацевтически приемлемую соль. 42. Антисептическая и/или дезинфицирующая композиция по п.41, содержащая соединение общей формулы (I), охарактеризованное в п.10. 43. Производное гемина общей формулы (I) где R1 и R2 одинаковые или различные, при условии, что оба R1 и R2 одновременно не представляют собой -ОН, при этом либо один из R1 и R2 представляет собой -ОН, а другой представляет собой -Val-Gly-Ala-(D-Leu)Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, где X=Trp, или Phe, илиTyr (грамицидин D), -N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), -Arg-Gly-Asp-OH или -ArgArg-Trp-Trp-Arg-Phe-OH,либо R1 и R2 оба представляют собой -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH,-NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe (XVIII), -НА или -Arg-ArgOMe, где НА представляет собой остаток гистаминаMen+ представляет собой Fe2+ или Fe3+,или его изомер, или смесь изомеров, или их фармацевтически приемлемая соль. 44. Соединение по п.43, где один из R1 и R2 представляет собой -ОН, а другой представляет собой-Arg-Gly-Asp-OH, или его изомер, или смесь изомеров, или их фармацевтически приемлемая соль. 45. Соединение по п.43, где один из R1 и R2 представляет собой -ОН, а другой представляет собойX=Trp, Phe или Tyr (грамицидин D), или его изомер, или смесь изомеров, или их фармацевтически приемлемая соль. 46. Соединение по п.43, где один из R1 и R2 представляет собой -ОН, а другой представляет собой-N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (грамицидин S), или его изомер, или смесь изомеров, или их фармацевтически приемлемая соль. 47. Соединение по п.43, где R1 = R2 = -NHCH2CH2OH, или его фармацевтически приемлемая соль. 48. Соединение по п.43, где R1 = R2 = -GlyOMe, или его фармацевтически приемлемая соль. 49. Соединение по п.43, где R1 = R2 = -NHCH(CH2OH)СН 2 ОН, или его фармацевтически приемлемая соль. 50. Соединение по п.43, где R1 = R2 = -NHCH2CH(ОН)СН 2 ОН, или его фармацевтически приемлемая соль. 51. Соединение по п.43, где, R1 = R2 = -Glu(ArgOMe)-ArgOMe, или его фармацевтически приемлемая соль. 52. Соединение по п.43, где R1 = R2 = -HA, или его фармацевтически приемлемая соль. 53. Соединение по п.43, где один из R1 и R2 представляет собой -ОН, а другой представляет собой-Arg-Arg-Trp-Trp-Arg-Phe-OH, или его изомер, или смесь изомеров, или их фармацевтически приемлемая соль. 54. Соединение по п.43, где R1 = R2 = -Arg-ArgOMe, или его фармацевтически приемлемая соль. 55. Способ получения соединения общей формулы (I) по любому из пп.43-54, включающий взаимодействие активированного по карбоксильной(ым) группе(ам) производного гемина с аминокомпонентом. 56. Способ по п.55, где в качестве активированного производного гемина используют 6,7-бис-Nоксисукцинимидный эфир гемина или 6(7)-моно-N-окси-5-норборнен-2,3-дикарбоксиимидный эфир гемина, а в качестве растворителя используют N,N-диметилформамид. 57. Способ по п.55, где для активирования по одной из карбоксильных групп гемина используют дитрет-бутилпирокарбонат, причем процесс проводят в N,N-диметилформамиде в присутствии пиридина.
МПК / Метки
МПК: C07K 14/805, A61K 38/42, A61P 31/04, C07F 15/02, A61P 31/10, C07D 487/22
Метки: антимикробные, гемина, средства, основе, производных
Код ссылки
<a href="https://eas.patents.su/30-20802-antimikrobnye-sredstva-na-osnove-proizvodnyh-gemina.html" rel="bookmark" title="База патентов Евразийского Союза">Антимикробные средства на основе производных гемина</a>
Предыдущий патент: Гомо- и гетерополиаминокислотные производные фуллерена с60, способ их получения и фармацевтические композиции на их основе
Следующий патент: Упаковка для табачных изделий