Способ получения бензотиазепинов из γ-аминоалкилбензолов
Номер патента: 20602
Опубликовано: 30.12.2014
Авторы: Белведере Сандро, Дэн Шисянь, Ландри Доналд, Янь Цзямин
Формула / Реферат
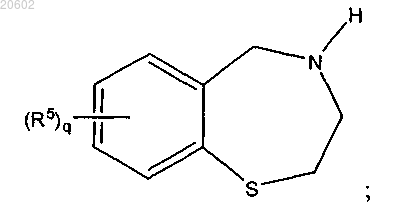
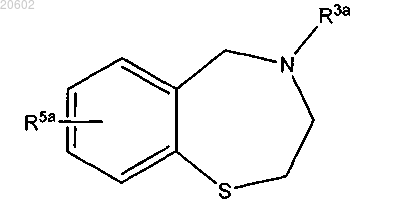
1. Способ получения 2,3,4,5-тетрагидро[1,4]бензотиазепина формулы
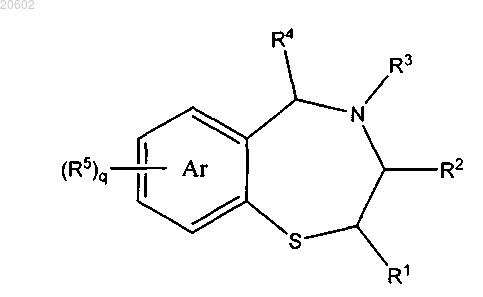
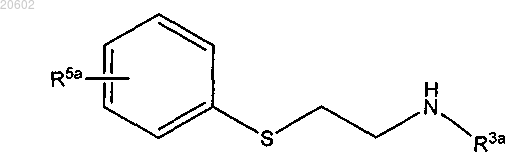
который включает реакцию [2-(ациламиноэтил)тио]арена формулы
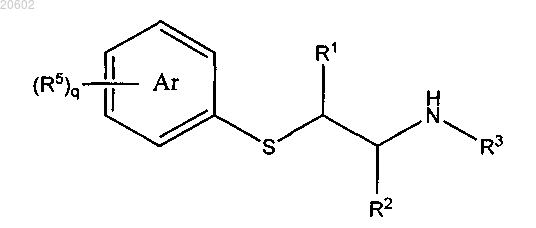
с альдегидом формулы R4CHO или его олигомером или полимером и с сульфоновой кислотой или кислотой Льюиса, где
Ar означает моноциклическую арильную кольцевую систему;
R1, R2 и R4 означают H;
R3 означает (C1-C10)ацил, C(=O)-R10, (CH2)mR13 или
взятые вместе R2 и R3 образуют оксозамещенный азотсодержащий гетероцикл;
R5 независимо, в каждом случае его присутствия, выбирают из Н, (C1-C4)алкила, галогена, -OR6, -SR6, -NO2, -CN, -(C1-C4)галоалкила или -O-(C1-C4)галоалкила;
R10 означает H, -OR14, -NR6aR6b, CO2R15, галоген, (C1-C8)алкокси, арилокси, аллилокси, бензилокси, замещенный бензилокси, флуоренилметокси, адамантилокси, (C1-C6)алкил, который необязательно замещен одним-тремя атомами галогена, арил или (C1-C6)алкиларил;
R6 означает H или (C1-C6)алкил,
R6a, R6b, R7, R14 и R17, каждый независимо, в каждом случае своего присутствия, означают H, -OR15, (C1-C6)алкил, арил, гетероциклил, гетероарил, (C1-C6)алкиларил, (C1-C6)алкилгетероциклил или (C1-C6)алкилгетероарил, причем каждый из указанных арила, гетероциклила и гетероарила необязательно замещен одним-тремя заместителями, независимо выбранными из группы, состоящей из галогена, алкила, (C1-C8)алкоксила, нитро, циано и галоалкила, или R6a и R6b вместе с азотом, к которому они присоединены, представляют 5-, 6- или 7-членный азотсодержащий гетероцикл;
R15 независимо, в каждом случае своего присутствия, означает H, (C1-C6)алкил, арил, гетероциклил, гетероарил, (C1-C6)алкиларил, (C1-C6)алкилгетероциклил или (C1-C6)алкилгетероарил, причем каждый из указанных арила, гетероциклила и гетероарила необязательно замещен одним-тремя заместителями, независимо выбранными из группы, состоящей из галогена, алкила, (C1-C8)алкоксила, нитро, циано и галоалкила;
R13 означает C(=O)R17;
m означает целое число от 1 до 10;
q означает 0 или целое число от 1 до 4;
причем термин "арил" означает фенильную, нафтильную, инданильную, тетралинильную или флуоренильную группы;
термин "гетероарил" означает имидазолильную, пиридильную, индолильную, тиофенильную, бензопиранонильную, тиазолильную, фуранильную, бензофуранильную, бензимидазолильную, хинолинильную, изохинолинильную, хиноксалинильную, пиримидинильную, пиразинильную, тетразолильную или пиразолильную группы;
термин "гетероциклил" означает пирролидинильную, пиперидинильную, морфолинильную, 4-CBZ-пиперазинильную или азепанильную группы.
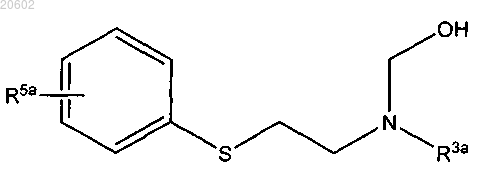
2. Способ по п.1, где [2-(ациламиноэтил)тио]арен сначала вводят в реакцию с альдегидом или его олигомером или полимером и основанием с получением [N-гидроксиметил-2-(ациламиноэтил)тио]арена формулы
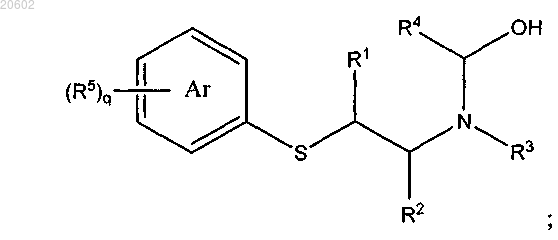
и [N-гидроксиметил-2-(ациламиноэтил)тио]арен затем обрабатывают кислотой с образованием 2,3,4,5-тетрагидро[1,4]бензотиазепина.
3. Способ по п.1 или 2, где основание представляет собой гидрид, гидроксид или карбонат щелочного металла, пиридин или триалкиламин.
4. Способ по п.3, где основание представляет собой NaH, NaOH, KOH, Na2CO3, K2CO3, Cs2CO3, Et3N или (iPr)2NEt.
5. Способ по п.1, где сульфоновая кислота выбрана из группы, состоящей из толуолсульфоновой, бензолсульфоновой, метансульфоновой кислот, п-толуолсульфоната пиридиния и трифторметансульфоновой кислоты, и кислота Льюиса выбрана из группы, состоящей из эфирата трифторида бора, тетрахлорида титана, хлорида алюминия и хлорида цинка.
6. Способ по п.1, где альдегид или его олигомер или полимер представляет собой формальдегид, параформальдегид или 1,3,5-триоксан.
7. Способ по п.1, где R3 означает ацетил, бензоил, толуоил, бензилоксикарбонил, т-бутоксикарбонил, акрилоил, оксалил или -C(=O)N(R19)2, где каждый R19 означает водород, алкил, арил, гетероциклил, гетероарил, алкиларил, алкилгетероциклил или алкилгетероарил, или взятые вместе N(R19)2 означают 5-, 6- или 7-членный азотсодержащий гетероцикл.
8. Способ по п.1, где Ar означает фенил или взятые вместе R2 и R3 образуют пирролидон, оксазолидинон или пиперидинон.
9. Способ по п.1, где
q означает 0 или 1;
R3 означает (C1-C10)ацил формулы -C(=O)-R18, где R18 означает H, (C1-C6)алкил, (C1-C6)алкокси, аллилокси, бензилокси, замещенный бензилокси, флуоренилметокси или адамантилокси; и
способ дополнительно включает превращение соединения формулы

в оксалатное соединение формулы
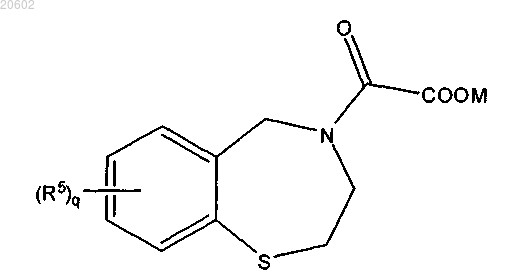
где M означает H, аммоний, щелочной металл или щелочно-земельный металл.
10. Способ по п.9, где указанная стадия превращения включает
расщепление R3 группы с обеспечением 2,3,4,5-тетрагидробензо[f][1,4]тиазепина формулы
ацилирование 2,3,4,5-тетрагидробензо[f][1,4]тиазепина сложным эфиром щавелевой кислоты;
осуществление гидролиза сложного эфира.
11. Способ по п.10, где стадия гидролиза включает обработку сложного эфира основанием - гидридом, гидроксидом или карбонатом щелочного металла, пиридином или триалкиламином и, необязательно, когда M означает H, подкисление.
12. Способ по п.11, где основание представляет собой NaH, NaOH, KOH, Na2CO3, K2CO3, Cs2CO3, Et3N или (iPr)2NEt.
13. Способ по п.10, который дополнительно включает превращение оксалатного соединения, где M означает H, в его соль, где M означает катион, такой как Na+, Mg++, Ca++ или аммоний.
14. Способ по п.10, где q означает 1; R5 означает OCH3 в положении 7 бензотиазепинового кольца и соединение имеет формулу
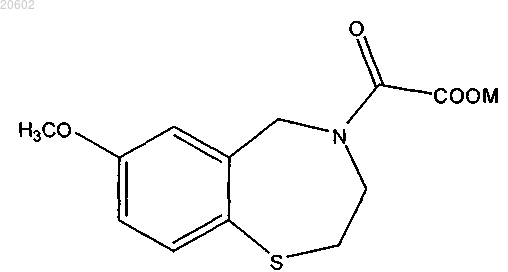
где M означает водород, аммоний, щелочной металл или щелочно-земельный металл.
15. Способ по п.14 для конкретного получения соединения формулы
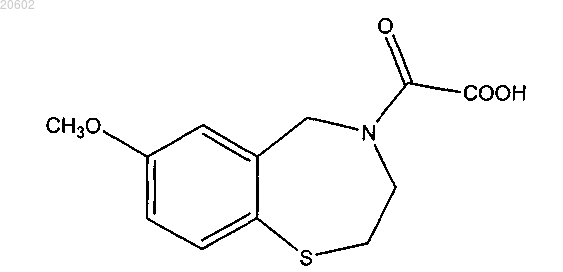
где [2-(ациламиноэтил)тио]арен имеет формулу
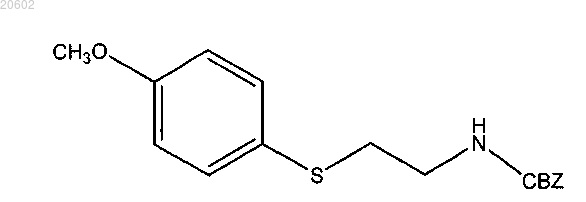
альдегид представляет собой параформальдегид, кислота представляет собой толуолсульфоновую кислоту, реакция обеспечивает CBZ-защищенный бензотиазепин формулы
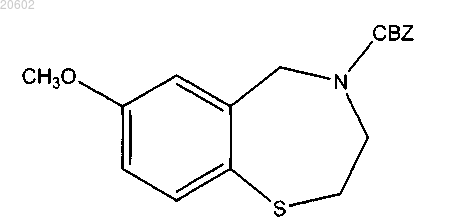
и способ дополнительно включает
расщепление карбобензилоксильной группы кислотой с обеспечением 7-метокси-2,3,4,5-тетрагидробензо[f][1,4]тиазепина;
ацилирование 7-метокси-2,3,4,5-тетрагидробензо[f][1,4]тиазепина метилхлороксалатом;
осуществление гидролиза сложного метилового эфира с помощью водного основания;
подкисление с образованием кислотного соединения;
необязательно превращение кислотного соединения в соединение формулы
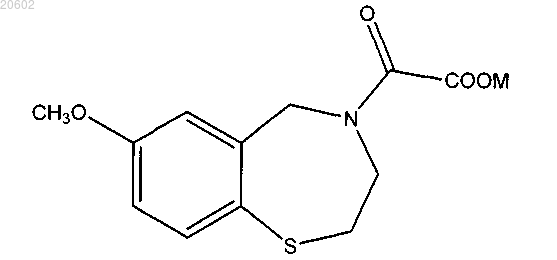
где M означает аммоний, щелочной металл или щелочно-земельный металл.
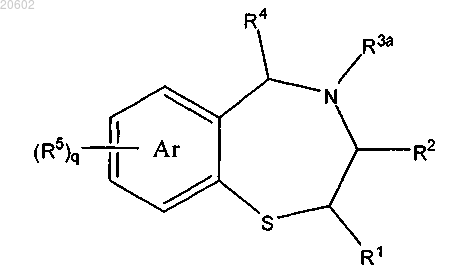
16. Способ по п.1, где R3 означает R3a и 2,3,4,5-тетрагидро[1,4]бензотиазепин получают путем обработки [2-(ациламиноэтил)тио]арена формулы
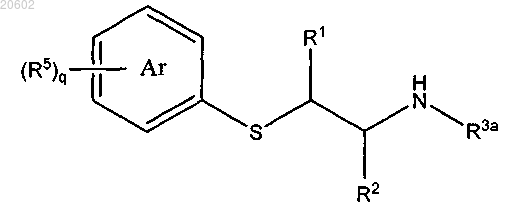
альдегидом формулы R4CHO или его олигомером или полимером и кислотой с получением соединения формулы
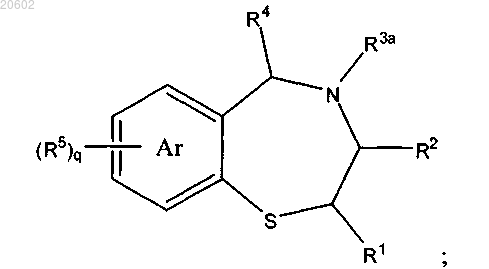
где R3a означает (C1-C10)ацил формулы -C(=O)-R18 или азот-защитную группу, где R18 означает H, (C1-C6)алкил, (C1-C6)алкокси, аллилокси, бензилокси, замещенный бензилокси, флуоренилметокси или адамантилокси.
17. Способ по п.16, который дополнительно включает расщепление R3a с получением 4-незамещенного-2,3,4,5-тетрагидробензо[f][1,4]тиазепина формулы
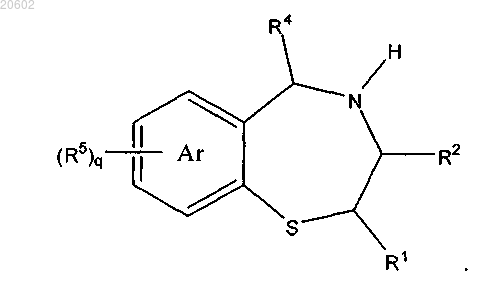
18. Способ по п.17, который дополнительно включает ацилирование 4-незамещенного-2,3,4,5-тетрагидробензо[f][1,4]тиазепина с помощью R3X с получением соединения формулы

где R3 означает (C1-C10)ацил; C(=O)-R10, (CH2)mR13, азот-защитную группу или
взятые вместе R2 и R3 образуют оксозамещенный азотсодержащий гетероцикл;
X означает галоген, (C1-C10)ацилокси или активированный сложноэфирный остаток.
19. Способ по п.17, который дополнительно включает реакцию 4-незамещенного-2,3,4,5-тетрагидробензо[f][1,4]тиазепина с соединением формулы X-CH2-COOR', где X означает галоген и R' означает алкил, с образованием сложноэфирного соединения формулы
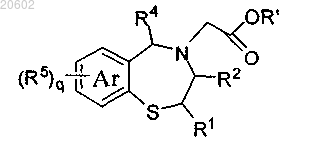
и осуществление гидролиза сложного эфира с образованием соединения формулы
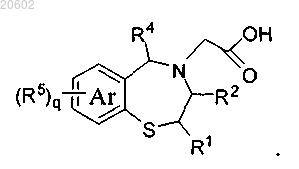
20. Способ по п.16, где R3a означает т-бутоксикарбонил, бензилоксикарбонил, замещенный бензилоксикарбонил или флуоренилметоксикарбонил.
21. Способ по п.16, где способ дополнительно включает обработку соединения формулы
где R3a означает -C(=O)-R18, где R18 означает (C1-C4)алкокси, аллилокси, бензилокси, замещенный бензилокси, флуоренилметокси или адамантилокси,
амином формулы HN(R19)2, где каждый R19 означает водород, алкил, арил, гетероциклил, гетероарил, алкиларил, алкилгетероциклил или алкилгетероарил, или взятые вместе N(R19)2 означают 5-, 6- или 7-членный азотсодержащий гетероцикл, с образованием соединения формулы
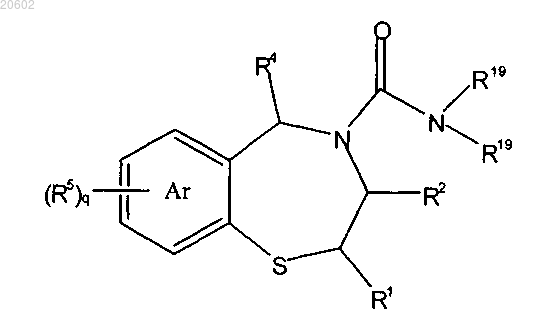
22. Способ по п.16, где [2-(ациламиноэтил)тио]ареновое соединение имеет формулу
и его вводят в реакцию с
(i) формальдегидом и кислотой с образованием защищенного бензотиазепина формулы
или
(ii) формальдегидом и основанием с образованием [N-гидроксиметил-2-(ациламиноэтил)тио]бензола формулы
и [N-гидроксиметил-2-(ациламиноэтил)тио]бензол дополнительно вводят в реакцию с кислотой с обеспечением защищенного бензотиазепина формулы
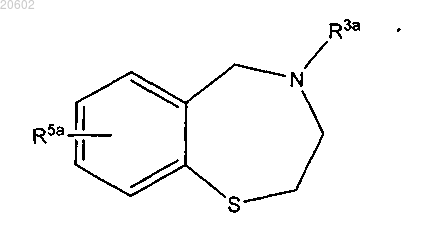
где R3a означает (C1-C10)ацил формулы -C(=O)-R18 или азот-защитную группу;
R5a означает H, (C1-C4)алкил, галоген, -OR6, -SR6, -NO2, -CN, -(C1-C4)галоалкил или -O-(C1-C4)галоалкил;
R18 означает H, (C1-C6)алкил, (C1-C4)алкокси, аллилокси, бензилокси, замещенный бензилокси, флуоренилметокси или адамантилокси.
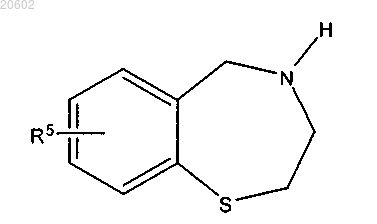
23. Способ по п.22, дополнительно включающий стадию расщепления R3a группы с получением соединения формулы
24. Способ по п.23, дополнительно включающий стадию ацилирования 4-незамещенного-2,3,4,5-тетрагидробензо[f][1,4]бензотиазепина с помощью R3X с получением соединения формулы
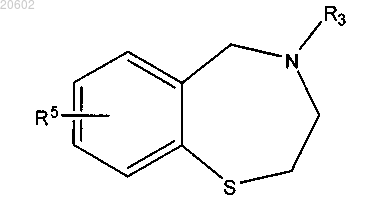
где R3 означает (C1-C10)ацил, C(=O)-R10, (CH2)mR13;
X означает галоген, (C1-C10)ацилокси или активированный сложноэфирный остаток.
25. Способ по п.22, который дополнительно включает превращение
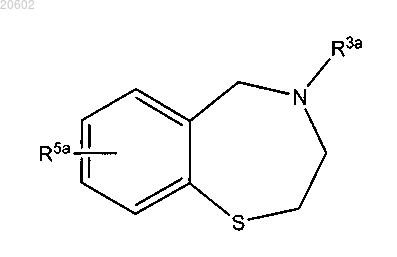
в
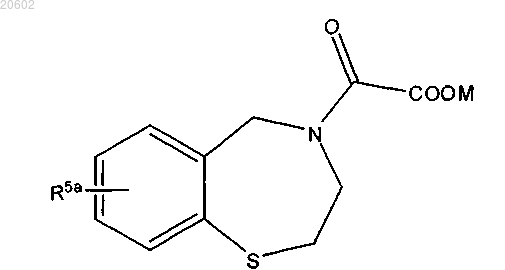
где M означает H, аммоний, щелочной металл или щелочно-земельный металл.
26. Способ по п.25, где
превращение завершают путем расщепления R3a группы с обеспечением 2,3,4,5-тетрагидробензо[f][1,4]тиазепина, ацилированием 2,3,4,5-тетрагидробензо[f][1,4]тиазепина сложным эфиром щавелевой кислоты и осуществлением гидролиза сложного эфира; и/или
стадия гидролиза включает обработку сложного эфира основанием и, необязательно, когда M означает H, подкисление, где основание представляет собой гидрид, гидроксид или карбонат щелочного металла, пиридин или триалкиламин, и необязательно превращение получающегося продукта, где M означает H, в его соль, где M означает катион.
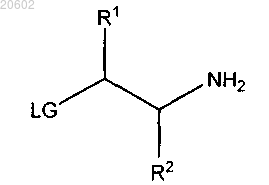
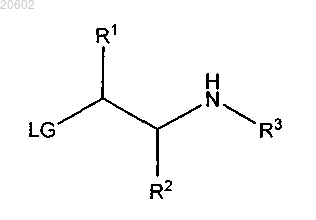
27. Способ по п.1, который дополнительно включает получение [2-(ациламиноэтил)тио]арена по реакции соединения формулы
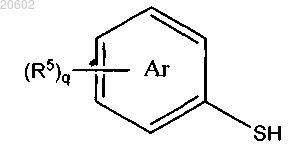
с соединением формулы
с обеспечением соединения формулы
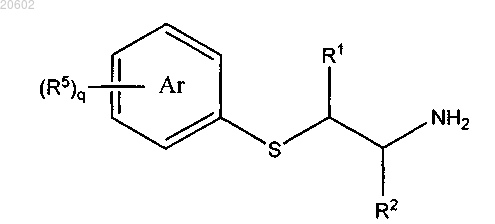
необязательно в присутствии основания с последующей реакцией с соединением формулы R3X, где LG означает уходящую группу для реакции нуклеофильного замещения тиолом и X означает уходящую группу для реакции нуклеофильного замещения амином.
28. Способ по п.27, где LG означает галоген или сульфонат, основание представляет собой гидрид, гидроксид или карбонат щелочного металла, пиридин или триалкиламин и R3X означает хлорангидрид, ангидрид кислоты, активированный сложный эфир, хлорформиат или хлорангидрид карбаминовой кислоты; где сульфонат выбирают из группы, состоящей из метансульфоната, толуолсульфоната, бензолсульфоната, трифторметансульфоната, нитрофенилсульфоната и бромфенилсульфоната, и где галоген выбирают из группы, состоящей из хлора, йода и брома.
29. Способ по п.1, где [2-(ациламиноэтил)тио]арен получают путем
реакции соединения формулы
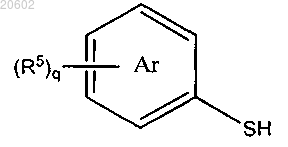
с соединением формулы
необязательно в присутствии основания, где LG означает уходящую группу для реакции нуклеофильного замещения тиолом.
30. Способ по п.29, где LG означает галоген или сульфонат и основание представляет собой гидрид, гидроксид или карбонат щелочного металла, пиридин или триалкиламин, где сульфонат выбирают из группы, состоящей из метансульфоната, толуолсульфоната, бензолсульфоната, трифторметансульфоната, нитрофенилсульфоната и бромфенилсульфоната, и где галоген выбирают из группы, состоящей из хлора, йода и брома.
31. Способ по п.18, где R3X означает хлорангидрид, ангидрид кислоты, активированный сложный эфир, хлорформиат или хлорангидрид карбаминовой кислоты.
Текст
СПОСОБ ПОЛУЧЕНИЯ БЕНЗОТИАЗЕПИНОВ ИЗ -АМИНОАЛКИЛБЕНЗОЛОВ Изобретение обеспечивает способ получения 2,3,4,5-тетрагидро[1,4]бензотиазепина формулы с альдегидом или его мультимером и с кислотой. Изобретение также обеспечивает способ,включающий сперва реакцию [2-(ациламиноэтил)тио]арена с альдегидом или его мультимером и основанием с образованием [N-гидроксиметил-2-(ациламиноэтил)тио]арена формулы(71)(73) Заявитель и патентовладелец: АРМГО ФАРМА, ИНК. (US); ЛЕ ЛАБОРАТУАР СЕРВЬЕ (FR) Область техники, к которой относится изобретение Изобретение относится к способам получения 2,3,4,5-тетрагидробензо[1,4]тиазепинов из соответствующих [2-(ациламиноэтил)тио]аренов. Предпосылки создания изобретения 2,3,4,5-Тетрагидробензо[f][1,4]тиазепины являются важными соединениями из-за их биологической активности, как раскрыто, например, в патентах США 5416066 и 5580866 и опубликованных заявках на патент США 2005/0215540, 2007/0049572 и 2007/0173482. Существуют синтетические методики получения 2-оксо-, 3-оксо-, 5-оксо- и 3,5-диоксо-1,4 бензотиазепинов и 2,3-дигидро-1,4-бензотиазепинов. Однако относительно мало публикаций описывают получение 2,3,4,5-тетрагидробензо-1,4-тиазепинов, которые не содержат карбонильных групп, и многие из этих способов включают восстановление карбонильной группы или имина. Многие из путей, описанных в литературе, исходят из ортозамещенного арена и используют ортозаместители в качестве "якорей" для присоединения семичленного кольца. По существу, все препаративно-пригодные синтезы, приведенные в литературе, которые не начинаются с ортозамещенного арена, используют модификацию реакции Бишлера-Напиральского, в которой углерод ацильной группы на -амиде становится углеродом, расположенным рядом с головой мостика, а ацильный заместитель становится 5-заместителем. Подобный ранее упомянутым синтезам, синтез Бишлера-Напиральского требует восстановления иминиевого интермедиата. Было бы полезно обладать внутримолекулярной реакцией для непосредственного построения 2,3,4,5-тетрагидробензо[1,4]тиазепинов, которая позволила бы большую гибкость касательно 4- и 5 заместителей и которая позволила бы избежать отдельной стадии восстановления. Реакция ПиктетаШпенглера, в которой -арилэтиламин, такой как триптамин, подвергают 6-членному замыканию кольца после конденсации с альдегидом (циклизации), широко использовалась в синтезе 6-членных кольцевых систем в течение минувшего столетия, и могла бы быть рассмотрена с этой целью. Однако реакция Пиктета-Шпенглера, как правило, не пригодна для 7-членных кольцевых систем, таких как 1,4 бензотиазепины. Вероятное пояснение состоит в том, что неудача реакции в случае типичных аренов наблюдалась из-за невыгодной конформации 7-членного кольца. Существует два отдельных примера внутримолекулярной реакции типа Пиктета-Шпенглера, приводящей к хорошему выходу бензотиазепина благодаря добавлению формальдегида. В одном случае исходное вещество являлось очень необычным активированным ареном (производным катехина) [Manini и др. J. Org. Chem. (2000), 65, 4269-4273]. В другом случае исходное вещество является бис-(бензотриазолилметил)амином, который циклизовали в моно(бензотриазолил)бензотиазол [Katritzky и др. J. Chem. Soc. P1 (2002), 592-598]. Краткое изложение сущности изобретения Согласно настоящему изобретению неожиданно было обнаружено, что при введении в первичный амин функциональной группы, такой как амидная, мочевинная или карбаматная группы, можно с высоким выходом в одну стадию получить семичленные кольца. Кроме того, ацильную группу можно без труда удалить, что позволяет дериватизацию в положении 4. Изобретение относится к способу получения 2,3,4,5-тетрагидробензо[f][1,4]бензотиазепина формулы В одном аспекте способ включает реакцию [2-(ациламиноэтил)тио]арена формулы с альдегидом формулы R4CHO или его олигомером или полимером и с сульфоновой кислотой или кислотой Льюиса. В этих формулахAr означает моноциклическую арильную кольцевую систему;R3 означает (C1-C10)ацил, C(=O)-R10, (CH2)mR13 или взятые вместе R2 и R3 образуют оксозамещенный азотсодержащий гетероцикл;R5 независимо, в каждом случае его присутствия, выбирают из Н, (C1-C4)алкила, галогена, -OR6,-SR , -NO2, -CN, -(C1-C4)галоалкила или -O-(C1-C4)галоалкила;R10 означает H, -OR14, -NR6aR6b, CO2R15, галоген, (C1-C8)алкокси, арилокси, аллилокси, бензилокси,замещенный бензилокси, флуоренилметокси, адамантилокси, (C1-C6)алкил, который необязательно замещен одним-тремя атомами галогена, арил или (C1-C6)алкиларил;R6a, R6b, R7, R14 и R17, каждый независимо, в каждом случае своего присутствия, означают H, -OR15,(C1-C6)алкил, арил, гетероциклил, гетероарил, (C1-C6)алкиларил, (C1-C6)алкилгетероциклил или (C1C6)алкилгетероарил, причем каждый из указанных арила, гетероциклила и гетероарила необязательно замещен одним-тремя заместителями, независимо выбранными из группы, состоящей из галогена, алкила, (C1-C8)алкоксила, нитро, циано и галоалкила, или R6a и R6b вместе с азотом, к которому они присоединены, представляют 5-, 6- или 7-членный азотсодержащий гетероцикл;R15 независимо, в каждом случае своего присутствия, означает H, (C1-C6)алкил, арил, гетероциклил,гетероарил, (C1-C6)алкиларил, (C1-C6)алкилгетероциклил или (C1-C6)алкилгетероарил, причем каждый из указанных арила, гетероциклила и гетероарила необязательно замещен одним-тремя заместителями, независимо выбранными из группы, состоящей из галогена, алкила, (C1-C8)алкоксила, нитро, циано и галоалкила;m означает целое число от 1 до 10;q означает 0 или целое число от 1 до 4. Причем термин "арил" означает фенильную, нафтильную, инданильную, тетралинильную или флуоренильную группы. Термин "гетероарил" означает имидазолильную, пиридильную, индолильную, тиофенильную, бензопиранонильную, тиазолильную, фуранильную, бензофуранильную, бензимидазолильную, хинолинильную, изохинолинильную, хиноксалинильную, пиримидинильную, пиразинильную, тетразолильную или пиразолильную группы, а термин "гетероциклил" означает пирролидинильную, пиперидинильную, морфолинильную, 4-CBZ-пиперазинильную или азепанильную группы. Преимущественно R3 означает ацетил, бензоил, толуоил, бензилоксикарбонил, т-бутоксикарбонил,акрилоил, оксалил или -C(=O)NR6aR6b, R5 означает (C1-C4)алкил, галоген, -OR6, -SR6, -NO2, -CN или -(C1C4)галоалкил; R6 означает H. Также, Ar предпочтительно означает фенил. Альтернативно, R2 и R3, взятые вместе, образуют пирролидон, оксазолидинон или пиперидинон. В другом аспекте изобретения [2-(ациламиноэтил)тио]арен можно сперва подвергать реакции с альдегидом и основанием с образованием [N-гидроксиметил-2-(ациламиноэтил)тио]арена формулы 6 и затем [N-гидроксиметил-2-(ациламиноэтил)тио]арен обрабатывать кислотой с образованием 2,3,4,5-тетрагидробензо[f][1,4]тиазепина. В обоих аспектах изобретения сульфоновая кислота может быть такой, как, например, толуолсульфоновая кислота, бензолсульфоновая кислота, метансульфоновая кислота, п-толуолсульфонат пиридиния или трифторметансульфоновая кислота, или кислота Льюиса может быть такой, как, например, эфират трихфторида бора, тетрахлорид титана, хлорид алюминия или хлорид цинка, а предпочтительный альдегид или его олигомер или полимер представляет собой формальдегид, параформальдегид или 1,3,5 триоксан. Во втором аспекте изобретения основание может представлять собой одно или несколько соединений, выбранных из гидрида, гидроксида или карбоната щелочного металла, пиридина или триалкиламина. Примеры оснований включают, но не ограничены, NaH, NaOH, KOH, Na2CO3, K2CO3, Cs2CO3,Et3N или (iPr)2NEt. В предпочтительном варианте осуществления изобретения, когда R3 означает (C1-C10)ацил формулы где M может означать H, аммоний, щелочной металл или щелочно-земельный металл. В этом отдельном варианте q означает 0 или 1;R6 означает H или (C1-C6)алкил. Стадия превращения типично включает расщепление R3 группы с обеспечением 2,3,4,5 тетрагидробензо[f][1,4]тиазепина формулы ацилирование 2,3,4,5-тетрагидробензо[f][1,4]тиазепина сложным эфиром щавелевой кислоты; и затем осуществление гидролиза сложного эфира. В одном варианте стадия гидролиза включает обработку сложного эфира основанием типа, упомянутого выше, и, необязательно, когда M означает H, подкисление. Когда M означает H, оксалатное соединение можно дополнительно превратить в его соль, где М означает катион щелочного или щелочно-земельного металла, такой как Na+, Mg или Ca, или M означает аммоний, такой как NH4+. В особом варианте, где q означает 1 и R5 означает OCH3 в положении 7 бензотиазепинового кольца,соединение имеет формулу В этом особом варианте M может означать водород, щелочной металл, щелочно-земельный металл или аммоний. В другом варианте осуществления изобретения соединение формулы В этом варианте альдегид представляет собой параформальдегид и кислота представляет собой то-3 020602 луолсульфоновую кислоту или соляную кислоту. Реакция обеспечивает CBZ-защищенный бензотиазепин формулы Этот способ дополнительно включает расщепление карбобензилоксильной группы кислотой с обеспечением 7-метокси-2,3,4,5-тетрагидробензо[f][1,4]тиазепина; ацилирование 7-метокси-2,3,4,5 тетрагидробензо[f][1,4]тиазепина метилхлороксалатом; осуществление гидролиза сложного метилового эфира с помощью водного основания; подкисление с образованием кислотного соединения и необязательно превращение кислотного соединения в соединение формулы В этом варианте M означает аммоний, щелочной металл или щелочно-земельные металл. В другом варианте осуществления изобретения 2,3,4,5-тетрагидро[1,4]бензотиазепин получают путем обработки [2-(ациламиноэтил)тио]арена формулы альдегидом формулы R4CHO или его олигомером или полимером и кислотой с получением соединения формулы В этом варианте R3 означает (C1-C10)ацил, C(=O)-R10, (CH2)mR13, азот-защитную группу или взятые вместе R2 и R3 образуют оксозамещенный азотсодержащий гетероцикл;X означает галоген, (C1-C10)ацилокси или активированный сложноэфирный остаток. В особом варианте R3 означает т-бутоксикарбонил, бензилоксикарбонил, замещенный бензилоксикарбонил или флуоренилметоксикарбонил. В другом варианте осуществления изобретения R3X означает хлорангидрид, ангидрид кислоты, активированный сложный эфир, хлорформиат или хлорангидрид карбаминовой кислоты. В другом варианте осуществления изобретения соединение формулы где Ar, R1, R2, R4, R5 и q принимают значения согласно вышеприведенному определению; где каждый R19 означает водород, алкил, арил, гетероциклил, гетероарил, алкиларил, алкилгетероциклил или алкилгетероарил и предпочтительно означает H и (C1-C6)алкил или взятые вместе N(R19)2 означают 5-, 6- или 7-членный азотсодержащий гетероцикл; 5-, 6- или 7-членный азотсодержащий гетероцикл может представлять собой, например, пирролидин, пиперидин, морфолин, 4-CBZ-пиперазин или азепан. В другом предпочтительном варианте осуществления изобретения,когда его можно вводить в реакцию с формальдегидом или его олигомером или полимером и кислотой с образованием защищенного бензотиазепина формулы или его можно вводить в реакцию с формальдегидом или его олигомером или полимером и основанием с образованием [N-гидроксиметил-2-(ациламиноэтил)тио]бензола формулы[N-Гидроксиметил-2-(ациламиноэтил)тио]бензол можно далее вводить в реакцию кислотой с обеспечением защищенного бензотиазепина формулыR3a группу далее можно расщепить с получением соединения формулыX означает галоген, (C1-C10)ацилокси или активированный сложноэфирный остаток. В другом варианте осуществления изобретения соединение формулы где M означает H, аммоний, щелочной металл или щелочно-земельный металл. В этом варианте превращение завершают путем расщепления R3a группы с обеспечением 2,3,4,5 тетрагидробензо[f][1,4]тиазепина, ацилирования 2,3,4,5-тетрагидробензо[f][1,4]тиазепина сложным эфиром щавелевой кислоты и осуществления гидролиза сложного эфира. В одном варианте стадия гидролиза включает обработку сложного эфира основанием и, необязательно, когда M означает H, подкисление. Необязательно, получающийся продукт, где M означает H, превращают в его соль, где M означает катион, такой как щелочной металл, щелочно-земельный металл или аммоний. В третьем аспекте изобретения [2-(ациламиноэтил)тио]арен получают по реакции соединение формулы с последующей реакцией с соединением формулы R3X. Необязательно может применяться основание. LG означает уходящую группу для реакции нуклеофильного замещения тиолом и X означает уходящую группу для реакции нуклеофильного замещения амином. LG может быть галогеном, таким как,например, хлор, йод или бром, или сульфонатом, таким как, например, метансульфонат, толуолсульфонат, бензолсульфонат, трифторметансульфонат, нитрофенилсульфонат или бромфенилсульфонат. R3X типично означает хлорангидрид, ангидрид кислоты, активированный сложный эфир, хлорформиат или хлорангидрид карбаминовой кислоты. В еще одном аспекте изобретения [2-(ациламиноэтил)тио]арен получают по реакции соединения формулы Необязательно может применяться основание. LG означает уходящую группу для реакции нуклеофильного замещения тиолом и может представлять собой галоген (такой как, например, хлор, йод и бром) или сульфонат (такой как, например, метансульфонат, толуолсульфонат, бензолсульфонат, трифторметансульфонат, нитрофенилсульфонат и бромфенилсульфонат). Подробное описание предпочтительных вариантов осуществления Изобретение относится к способам получения арилконденсированных тетрагидротиазепинов, таких как 2,3,4,5-тетрагидробензо[f][1,4]тиазепины. Определения. По всему данному описанию термины и заместители сохраняют свои определения. Подразумевается, что алкил включает линейные, разветвленные или циклические углеводородные структуры и их комбинации. Низший алкил относится к алкильным группам, содержащим от 1 до 6 атомов углерода. Примеры низших алкильных групп включают метил, этил, пропил, изопропил, бутил,втор- и т-бутил и т.п. Циклоалкил является подгруппой алкила и включает циклические углеводородные группы, содержащие от 3 до 6 атомов углерода. Примеры циклоалкильных групп включают ц-пропил, цбутил, ц-пентил и т.п. Алкокси или алкоксил относится к группам, содержащим от 1 до 8 атомов углерода прямой, разветвленной, циклической конфигурации и их комбинациям, присоединенным к первичной структуре через кислород. Примеры включают метокси, этокси, пропокси, изопропокси, циклопропилокси, циклогексилокси и т.п. Низший алкокси относится к группам, содержащим от одного до четырех атомов углерода. Метокси является предпочтительным. В контексте данного патента алкокси и низший алкокси включают метилендиокси и этилендиокси. Оксоалкил относится к алкильным остаткам, в которых один или несколько атомов углерода заменены кислородом. Примеры включают метоксипропокси, 3,6,9-триоксадецил и т.п. Ацил относится к заместителю, который присоединен через -С(=О)- и который содержит от одного до десяти атомов углерода. Группа также может включать гетероатомы, такие как кислород и азот. В одном варианте ацил относится к формилу и к группам, содержащим от 1 до 10 атомов углерода прямой,разветвленной, циклической конфигурации, насыщенным, ненасыщенным и ароматическим, и их комбинациям, присоединенным к первичной структуре через карбонильную функцию. Один или несколько атомов углерода в ацильном остатке могут быть заменены азотом, кислородом или серой до тех пор, пока точка присоединения к первичной структуре не остается на карбониле. Примеры включают ацетил,бензоил, пропионил, изобутирил, m-бутоксикарбонил, бензилоксикарбонил, -C(=O)NH2 и т.п. Низший ацил относится к группам, содержащим от одного до четырех атомов углерода. Примеры (C1-C10)ацила также включают толуоил, бензилоксикарбонил, т-бутоксикарбонил, акрилоил, оксалил и -C(=O)N(R11)2,где каждый R11 независимо означает H или (C1-C6)алкил, или взятые вместе N(R11)2 означают 5-, 6- или 7 членный азотсодержащий гетероцикл. 5-, 6- или 7-членный азотсодержащий гетероцикл может представлять собой, например, пирролидин, пиперидин, морфолин, 4-CBZ-пиперазин или азепан. Специалист в данной области техники будет осознавать, что группы -C(=O)N(R11)2, вместе с азотом кольца, к которому они присоединены, можно было бы также назвать мочевинами. В определенных вариантах осуществления также могут предполагаться другие (C1-C10)ацильные группы, описанные в Protective Groups inOrganic Synthesis авторами T.W. Greene и P.G.M. Wuts [John WileySons, New York, 1999]. Арил (Ar) и гетероарил означают 5- или 6-членное ароматическое или гетероароматическое кольцо,содержащее 0-3 гетероатомов, выбранных из O, N или S; бициклическую 9- или 10-членную ароматическую или гетероароматическую кольцевую систему, содержащую 0-3 гетероатомов, выбранных из O, N или S; или трициклическую 13- или 14-членную ароматическую или гетероароматическую кольцевую систему, содержащую 0-3 гетероатомов, выбранных из O, N или S. Ароматические 6-14-членные карбоциклические кольца включают, например, бензол, нафталин, индан, тетралин и флуорен, а 5-10-членные ароматические гетероциклические кольца включают, например, имидазол, пиридин, индол, тиофен, бензопиранон, тиазол, фуран, бензофуран, бензимидазол, хинолин, изохинолин, хиноксалин, пиримидин,пиразин, тетразол и пиразол. Арилалкилы относятся к заместителю, в котором арильный остаток присоединен к первичной структуре через алкил. Примерами являются бензил, фенэтил и т.п. Гетероарилалкил относится к заместителю, в котором гетероарильный остаток присоединен к первичной структуре через алкил. Примеры включают, например, пиридинилметил, пиримидинилэтил и т.п. Гетероцикл означает циклоалкильный или арильный остаток, в котором от одного до трех атомов углерода заменены гетероатомом, выбранным из группы, состоящей из N, O и S. Гетероатомы, такие как азот и сера, необязательно могут быть окислены, а азот необязательно может быть кватернизирован. Примеры гетероциклов, которые подпадают под изобретение, включают пирролидин, пиразол, пиррол,тетрагидроизохинолин, бензодиоксан, бензодиоксол (обычно именуемый метилендиоксифенилом, когда встречается в качестве заместителя), тетразол, морфолин, тиазол, пиридин, пиридазин, пиримидин, тиофен, фуран, оксазол, оксазолин, изоксазол, диоксан, тетрагидрофуран и т.п. Следует отметить, что гетероарил является подгруппой гетероцикла, в которой гетероцикл является ароматическим. Замещенный алкил, арил, циклоалкил, гетероциклил и так далее относятся к алкилу, арилу, циклоалкилу или гетероциклилу, где вплоть до трех атомов Н в каждом остатке заменены на галоген, галоалкил, гидрокси, низший алкокси, карбокси, карбоалкокси (также именуемый алкоксикарбонилом), карбоксамидо (также именуемый алкиламинокарбонилом), циано, карбонило, нитро, амино, алкиламино,диалкиламино, меркапто, алкилтио, сульфоксид, сульфон, ациламино, амидино, фенил, бензил, гетероарил, фенокси, бензилокси или гетероарилокси. Термин "галоген" означает фтор, хлор, бром или йод. По всему данному патенту встречается терминология, относящаяся к "защите", "снятию защиты" и"защищенной" функции. Такая терминология хорошо знакома специалистам в данной области техники и используется в контексте способов, которые касаются последовательной обработки рядом реагентов. В таком контексте защитная группа относится к группе, которая используется для маскировки функции во время осуществления стадии способа, на которой она реагировала бы иначе, но на которой такая реакция нежелательна. Защитная группа предотвращает реакцию на такой стадии, но может быть впоследствии удалена с целью оставить незащищенной исходную функцию. Удаление или "снятие защиты" происходит после завершения реакции или реакций, в которых данная функция создавала трудности. Таким образом, когда оговаривается ряд реактивов, как это сделано в способах изобретения, средний специалист может легко предвидеть те группы, которые будут пригодными в качестве "защитных групп". В случае настоящего изобретения функции, которые могут быть защищены, включают амины и иногда карбоновые кислоты и спирты. Пригодные группы для такой цели рассмотрены в стандартных руководствах в области химии, таких как работа Protective Groups in Organic Synthesis авторов T.W.Greene и P.G.M. Wuts [John WileySons, New York, 1999], которая включена в данный документ путем ссылки. Особое внимание заслуживает глава, озаглавленная как "Protection for the Amino Group" (c. 494614). Сокращения Me, Et, Ph, Tf, Ts и Ms означают метил, этил, фенил, трифторметансульфонил, толуолсульфонил и метансульфонил соответственно. Обширный перечень сокращений, используемых химиками-органиками (т.е. средними специалистами в данной области), приведен в первом номере каждого тома журнала Journal of Organic Chemistry. Такой перечень, который типично представлен в таблице, озаглавленной "Standard List of Abbreviations", включен в данный документ путем ссылки. Как ясно специалисту в данной области техники, термины "изопропанол", "изопропиловый спирт" и "2-пропанол" являются эквивалентными и представлены в реестре CAS под номером 67-63-0. Пример сульфоновой кислоты включает, без ограничения, толуолсульфоновую кислоту, бензолсульфоновую кислоту, метансульфоновую кислоту, трифторметансульфоновую кислоту. Пример кислоты Льюиса включает, без ограничения, эфират трихфторида бора, тетрахлорид титана, хлорид алюминия или хлорид цинка. Примером соли кислоты является п-толуолсульфонат пиридиния. Пример основания, которое можно использовать в способах изобретения, включает, без ограничения, гидрид, гидроксид или карбонат щелочного металла, пиридин или триалкиламин. Отдельные основания включают NaH, NaOH, KOH, Na2CO3, K2CO3, Cs2CO3, Et3N и (iPr)2NEt. Ссылка на кислоту или основание в различных вариантах осуществления, изложенных ниже, включает ссылку на любое вещество из перечисленных выше. Способы изобретения показаны на схеме 1. Схема 1 В первом аспекте изобретение тетрагидробензо[1,4]тиазепина формулы[2 с альдегидом формулы R4CHO или его олигомером или полимером и с сульфоновой кислотой или кислотой Льюиса, гдеAr означает моноциклическую арильную кольцевую систему;R3 означает (C1-C10)ацил; C(=O)-R10, (CH2)mR13 или взятые вместе R2 и R3 образуют оксозамещенный азотсодержащий гетероцикл;R5 независимо, в каждом случае его присутствия, выбирают из Н, (C1-C4)алкила, галогена, -OR6,6R10 означает H, -OR14, -NR6aR6b, CO2R15, галоген, (C1-C8)алкокси, арилокси, аллилокси, бензилокси,замещенный бензилокси, флуоренилметокси, адамантилокси, (C1-C6)алкил, который необязательно замещен одним-тремя атомами галогена, арил или (C1-C6)алкиларил;R6a, R6b, R7, R14 и R17, каждый независимо, в каждом случае своего присутствия, означают H, -OR15,(C1-C6)алкил, арил, гетероциклил, гетероарил, (C1-C6)алкиларил, (C1-C6)алкилгетероциклил или (C1C6)алкилгетероарил, причем каждый из указанных арила, гетероциклила и гетероарила необязательно замещен одним-тремя заместителями, независимо выбранными из группы, состоящей из галогена, алкила, (C1-C8)алкоксила, нитро, циано и галоалкила, или R6a и R6b вместе с азотом, к которому они присоединены, представляют 5-, 6- или 7-членный азотсодержащий гетероцикл;R15 независимо, в каждом случае своего присутствия, означает H, (C1-C6)алкил, арил, гетероциклил,гетероарил, (C1-C6)алкиларил, (C1-C6)алкилгетероциклил или (C1-C6)алкилгетероарил, причем каждый из указанных арила, гетероциклила и гетероарила необязательно замещен одним-тремя заместителями, независимо выбранными из группы, состоящей из галогена, алкила, (C1-C8)алкоксила, нитро, циано и галоалкила;m означает целое число от 1 до 10;q означает 0 или целое число от 1 до 4; причем термин "арил" означает фенильную, нафтильную, инданильную, тетралинильную или флуоренильную группы; термин "гетероарил" означает имидазолильную, пиридильную, индолильную, тиофенильную, бензопиранонильную, тиазолильную, фуранильную, бензофуранильную, бензимидазолильную, хинолинильную, изохинолинильную, хиноксалинильную, пиримидинильную, пиразинильную, тетразолильную или пиразолильную группы; термин "гетероциклил" означает пирролидинильную, пиперидинильную, морфолинильную, 4-CBZпиперазинильную или азепанильную группы. Как подразумевается в данном документе, ацил относится к заместителю, который присоединен через -С(=О)- и который содержит от одного до десяти атомов углерода. Данная группа также может содержать гетероатом, такой как кислород и азот. Примеры (C1-C10)ацила включают ацетил, бензоил, толуоил, бензилоксикарбонил, т-бутоксикарбонил, акрилоил, оксалил и -C(=O)N(R19)2, где каждый R19 означает водород, алкил, арил, гетероциклил, гетероарил, алкиларил, алкилгетероциклил или алкилгетероарил, или взятые вместе N(R19)2 означают 5-, 6- или 7-членный азотсодержащий гетероцикл. 5-, 6- или 7-членный азотсодержащий гетероцикл может представлять собой, например, пирролидин, пиперидин,морфолин, 4-CBZ-пиперазин или азепан. В подгруппе R3, R3a означают (C1-C10)ацил формулы -C(=O)R18; и R18 может представлять собой Н, (C1-C4)алкил, (C1-C4)алкокси, аллилокси, бензилокси, замещен- 10020602 ный бензилокси, флуоренилметокси или адамантилокси. В определенных вариантах осуществления также могут предполагаться другие (C1-C10)ацильные группы, описанные в Protective Groups in Organic Synthesis авторами T.W. Greene и P.G.M. Wuts. Специалист в данной области будет осознавать, что группы-C(=O)N(R19)2, вместе с азотом кольца, к которому они присоединены, можно было бы также назвать мочевинами. В качестве альтернативы, R2 и R3, взятые вместе, могут образовывать оксозамещенный азотсодержащий гетероцикл. Примеры включают пирролидон, оксазолидинон или пиперидинон. В этих гетероциклах оксо будет расположен рядом с азотом, например В альдегидном компоненте R4 представляет собой H, т.е. формальдегид. Формальдегид как таковой является газом, и поэтому, им часто более легко манипулировать в виде одного из его доступных для приобретения олигомеров и полимеров, а именно в виде 1,3,5-триоксана и параформальдегида. Подобным образом, ацетальдегид можно использовать в виде его доступного для приобретения тримера, паральдегида (2,4,6-триметил-1,3,5-триоксана), или альдегид представляет собой параформальдегид. Специалисту в данной области техники будет ясно, что в способе изобретения взамен любого альдегида можно было бы использовать олигомер или полимер такого альдегида. Заместитель(и) на карбоцикле, (R5)q, независимо может представлять собой H, (C1-C4)алкил, галоген, -OR6, -SR6, -NO2, -CN, -(C1-C4)галоалкил, -O-(C1-C4)галоалкил. В этих заместителях R6 может представлять собой H, (C1-C6)алкилуглеводород, гетероциклил, гетероциклил(C1-C6)алкил или арил(C1C6)алкил; R7 может представлять собой (C1-C6)алкил, гетероциклил, гетероциклилалкил или арилалкил. В определенных вариантах осуществления R5 может представлять собой H, (C1-C4)алкил, галоген, -OR6,-SR6, -NO2, -CN и -(C1-C4)галоалкил; и R6 может представлять собой H. Во втором аспекте изобретения тиазепиновое кольцо замыкают в две стадии взамен одной. [2(Ациламиноэтил)тио]арен вводят в реакцию с вышеупомянутым альдегидом и основанием с образованием [N-гидроксиметил-2-(ациламиноэтил)тио]арена формулы[N-Гидроксиметил-2-(ациламиноэтил)тио]арен обрабатывают кислотой с образованием 2,3,4,5 тетрагидробензо[1,4]тиазепина. В одном варианте осуществления изобретения, когда R3 означает (C1C10)ацил формулы -C(=O)-R18, или азот-защитную группу, OH, где R18 означает H, (C1-C6)алкил, (C1C6)алкокси, аллилокси, бензилокси, замещенный бензилокси, флуоренилметокси или адамантилокси,способ включает превращение соединения формулы Стадию превращения завершают путем расщепления R3 группы с обеспечением 2,3,4,5 тетрагидробензо[f][1,4]тиазепина формулы ацилирования 2,3,4,5-тетрагидробензо[f][1,4]тиазепина сложным эфиром щавелевой кислоты; и удаления сложного эфира. В одном варианте сложный эфир удаляют путем гидролиза. В соответствии с этим вариантом осуществления гидролиз осуществляют путем обработки сложного эфира основанием или кислотой. В другом варианте осуществления изобретения, однако, когда сложный эфир включает функциональную группу, расщепляемую путем гидрирования (например, бензиловый сложный эфир),бензил или другая расщепляемая группа могут быть удалены путем каталитического гидрирования, например с использованием H2 и металлического катализатора, такого как Pd/C и Pt/C.M может означать H, аммоний, щелочной металл (например, натрий) или щелочно-земельный металл (например, магний или кальций). Термин "аммоний" подразумевают включающим все типы катионных азотных соединений, включая аргинин, NH+, N-алкил-H3+, N(алкил)2H+, N(алкил)3H+ и N(алкил)4+. Специалист в данной области поймет, что соединения, полученные с помощью способов настоящего изобретения, могут находиться в гидратированной форме, например в форме моногидрата, дигидрата,тригидрата и т.п., или они могут находиться в безводной форме. Подобным образом, соединения, полученные с помощью способов настоящего изобретения, могут находиться в форме сольвата с органическим растворителем, таким как спирт, например, в форме метанолата, этанолата и т.п. В одном варианте способ проводят согласно вышеописанной процедуре с использованием веществ,в которых R1, R2 и R4 означают водород и R3 означает COOR. Получающийся сложный эфир расщепляют с получением кислоты, которую необязательно можно превратить в ее соли, где M принимает описанные выше значения. В предпочтительном на данный момент варианте осуществления M означает натрий. В другом варианте осуществления изобретения способ включает получение соединения формулы альдегид представляет собой параформальдегид и кислота представляет собой толуолсульфоновую кислоту или соляную кислоту; реакция обеспечивает CBZ-защищенный бензотиазепин формулы Карбобензилоксильную группу расщепляют кислотой с обеспечением 7-метокси-2,3,4,5 тетрагидробензо[f][1,4]тиазепина, который ацилируют метилхлороксалатом. Сложный метиловый эфир гидролизуют водным основанием; и затем среду подкисляют до образования кислотного соединения. Кислотное соединение необязательно превращают в соединение формулы где M означает аммоний, щелочной металл или щелочно-земельный металл. В другом варианте осуществления изобретения, когда R3 означает R3a, 2,3,4,5 тетрагидробензо[1,4]тиазепин получают путем обработки [2-(ациламиноэтил)тио]арена формулы альдегидом формулы R4CHO или его олигомером или полимером и кислотой с получением соединения формулы где R3a означает (C1-C10)ацил формулы -C(=O)-R18 или азот-защитную группу, где R18 означает H,(C1-C6)алкил, (C1-C6)алкокси, аллилокси, бензилокси, замещенный бензилокси, флуоренилметокси или адамантилокси. Заместитель R3a можно далее расщеплять с получением 4-незамещенного-2,3,4,5 тетрагидробензо[f][1,4]тиазепина формулы Заместитель R3 означает (C1-C10)ацил, C(=O)-R10, (CH2)mR13, азот-защитную группу или взятые вместе R2 и R3 образуют оксозамещенный азотсодержащий гетероцикл;X означает галоген, (C1-C10)ацилокси или активированный сложноэфирный остаток. В особом варианте R3 заместитель означает т-бутоксикарбонил, бензилоксикарбонил, замещенный бензилоксикарбонил или флуоренилметоксикарбонил; R3X означает хлорангидрид, ангидрид кислоты,активированный сложный эфир, хлорформиат или хлорангидрид карбаминовой кислоты. В особом варианте [2-(ациламиноэтил)тио]ареновое соединение имеет формулу и может вводиться в реакцию с формальдегидом или его олигомером или полимером и кислотой с образованием защищенного бензотиазепина формулы или с формальдегидом или его олигомером или полимером и основанием с образованием [Nгидроксиметил-2-(ациламиноэтил)тио]бензола формулы[N-Гидроксиметил-2-(ациламиноэтил)тио]бензол может далее вводиться в реакцию с кислотой с обеспечением защищенного бензотиазепина формулыR означает H, (C1-C4)алкил, галоген, -OR6, -SR6, -NO2, -CN, -(C1-C4)галоалкил или -O-(C1-C4)галоалкил; и заместитель R18 означает H, (C1-C6)алкил, (C1-C4)алкокси, аллилокси, бензилокси, замещенный бензилокси, флуоренилметокси или адамантилокси. Дальнейшее расщепление приводит к соединению формулы 5a Соединение можно далее ацилировать R3X с получением соединения формулыR10 означает H, -OR14, -NR6aR6b, CO2R15, галоген, (C1-C8)алкокси, арилокси, аллилокси, бензилокси,замещенный бензилокси, флуоренилметокси, адамантилокси, (C1-C6)алкил, который необязательно замещен одним-тремя атомами галогена, арил, (C1-C6)алкиларил;m означает целое число от 1 до 10;R6a, R6b, R7, R14 и R17, каждый независимо, в каждом случае своего присутствия, означают H, -OR15,(C1-C6)алкил, арил, гетероциклил, гетероарил, (C1-C6)алкиларил, (C1-C6)алкилгетероциклил или (C1C6)алкилгетероарил, причем каждый из указанных арила, гетероциклила и гетероарила необязательно замещен одним-тремя заместителями, независимо выбранными из группы, состоящей из галогена, алкила, (C1-C8)алкоксила, нитро, циано и галоалкила, или R6a и R6b вместе с азотом, к которому они присоединены, представляют 5-, 6- или 7-членный азотсодержащий гетероцикл;R15 независимо, в каждом случае своего присутствия, означает H, (C1-C6)алкил, арил, гетероциклил,гетероарил, (C1-C6)алкиларил, (C1-C6)алкилгетероциклил или (C1-C6)алкилгетероарил, причем каждый из указанных арила, гетероциклила и гетероарила необязательно замещен одним-тремя заместителями, независимо выбранными из группы, состоящей из галогена, алкила, (C1-C8)алкоксила, нитро, циано и галоалкила;X означает галоген, (C1-C10)ацилокси или активированный сложноэфирный остаток. В другом варианте осуществления изобретения дальнейшее превращение соединения формулы где M означает H, аммоний, щелочной металл или щелочно-земельный металл,завершают путем расщепления R3a группы с обеспечением 2,3,4,5-тетрагидробензо[f][1,4]тиазепина,ацилирования 2,3,4,5-тетрагидробензо[f][1,4]тиазепина сложным эфиром щавелевой кислоты и осуществления гидролиза сложного эфира. Стадия гидролиза включает обработку сложного эфира основанием или кислотой и, необязательно,когда M означает H, подкисление. Получающийся продукт, где M означает H, необязательно превращают в его соль. M может быть катионом, таким как Na+, Ca, Mg или аммоний.[2-(Ациламиноэтил)тио]ареновое соединение, использованное в одностадийном и двухстадийном замыкании кольца, можно получить по реакции соединения формулы необязательно в присутствии основания. LG означает уходящую группу для реакции нуклеофильного замещения тио-группой. Уходящие группы для замещения тиолом известны в данной области техники. Они включают галогены и сульфонаты. Примеры включают хлор, йод, бром, метансульфонат, толуолсульфонат, бензолсульфонат, трифторметансульфонат, нитрофенилсульфонат и бромфенилсульфонат. В другом варианте осуществления изобретения [2-(ациламиноэтил)тио]ареновое соединение можно получить по реакции соединения формулы необязательно в присутствии основания. Ацильный заместитель R3 можно ввести во второй стадии реакции с помощью соединения формулы R3X, необязательно в присутствии основания. LG означает уходящую группу для реакции нуклеофильного замещения тиолом и X означает уходящую группу для реакции нуклеофильного замещения амином. Таким образом, R3X может представлять собой хлорангидрид, ангидрид кислоты, активированный сложный эфир, хлорформиат, сульфонилхлорид или хлорангидрид карбаминовой кислоты. "Активированный сложный эфир" является термином, хорошо известным в данной области техники, в частности в области пептидного синтеза, и обозначает сложные эфиры, которые способны вступать в реакцию замещения с аминами с образованием амидов. Термин включает сложные эфиры, "активированные" посредством близлежащих электроноакцепторных заместителей. Примеры включают сложные эфиры фенолов, в частности сложные эфиры электроотрицательно замещенных фенолов, такие как сложные эфиры пентафторфенола; О-сложные эфиры изомочевины, такие как получающиеся при взаимодействии с карбодиимидами; О-сложные эфиры N-гидроксиимидов и Nгидроксигетероциклов. Отдельные примеры включают S-т-бутиловые сложные эфиры, S-фениловые сложные эфиры, S-2-пиридиловые сложные эфиры, N-гидроксипиперидиновые сложные эфиры, Nгидроксисукцинимидные сложные эфиры, N-гидроксифталимидные сложные эфиры и Nгидроксибензотриазольные сложные эфиры. В другом варианте осуществления изобретение включает способ получения 2,3,4,5 тетрагидро[1,4]тиазепина путем расщепления R3 группы с образованием соединения формулыX означает уходящую группу для реакции нуклеофильного замещения амином. R3X выбирают из хлорангидрида, ангидрида кислоты, активированного сложного эфира, хлорформиата и хлорангидрида карбаминовой кислоты. В одном отдельном варианте осуществления соединение формулы вводят в реакцию с соединением формулы X-CH2-COOR', где X означает галоген и R' означает алкил, с образованием сложноэфирного соединения формулы Далее путем гидролиза сложного эфира образуют соединение формулы В одном отдельном варианте осуществления настоящее изобретение обеспечивает способы получения соединения формулы где Ar, R1, R2, R4, R5 и q принимают значения согласно вышеприведенному определению;R3 означает -C(=O)-R20, где R20 означает N(R21)2, где каждый R21 независимо выбирают из водорода,(C1-C6)алкила, арила, гетероциклила, гетероарила, (C1-C6)алкиларила, (C1-C6)алкилгетероциклила или(C1-C6)алкилгетероарила; или взятые вместе N(R21)2 означают 5-, 6- или 7-членный азотсодержащий гетероцикл; 5-, 6- или 7-членный азотсодержащий гетероцикл представляет собой пирролидин, пиперидин,морфолин, 4-CBZ-пиперазин или азепан. В соответствии с этим вариантом осуществления способ включает реакцию соединения формулы где Ar, R1, R2, R4, R5 и q принимают значения согласно вышеприведенному определению и Этот вариант осуществления имеет преимущества, заключающиеся в простом и обеспечивающем высокие выходы синтезе карбаматов посредством способов настоящего изобретения, и дальнейшем превращении карбаматов в производные мочевины простым и эффективным способом, который обеспечивает высококачественный продукт с высокими выходами. Специалисту в данной области очевидно, что соединения формулы бензотиазепиновых соединений, таких как соединения, описанные в заявках на патент США 11/506285 (US 2007/0173482), 11/212413 (US 2007/0049572), 11/212309 (US 2006/0194767) и 10/809089(US 2005/0215540), содержание которых в полном объеме включено путем ссылки. Примеры Иллюстративные способы, которые входят в рамки изобретения, приведены ниже. Пример 1. Синтез 2-(7-метокси-2,3-дигидробензо[f][1,4]тиазепин-4(5H)-ил)-2-оксоуксусной кислоты (6) (схема 2). Схема 2 2-(4-Метоксифенилтио)этанамин (1). 4-Метокситиофенол (50 г, 0.357 моль), моногидрохлорид 2-хлорэтиламина (39.8 г, 0.343 моль),K2CO3 (78.8 г, 0.57 моль) и диизопропилэтиламин (32 мл, 0.178 моль) смешивали в 200 мл ТГФ. Смесь дегазировали в течение 5 мин при пониженном давлении и нагревали с обратным холодильником под аргоном в течение ночи. Растворитель удаляли и в колбу добавляли воду (300 мл). Смесь экстрагировали дихлорметаном (3200 мл). Органику собирали, дихлорметан удаляли и добавляли 50 мл конц. HCl и далее 200 мл воды. Раствор экстрагировали смесью 1:1 EtOAc/гексан (3200 мл). Значение pH водного слоя устанавливали на 10 с помощью 2 М NaOH и экстрагировали дихлорметаном (3200 мл). Объединенный органический раствор сушили над безводным сульфатом натрия. Удаление растворителя обеспечивало 61 г целевого соединения в виде бесцветной жидкости с выходом 97%. 1(100 мл) и дихлорметан (200 мл), по каплям при 0 С добавляли бензилхлорформиат (8.2 г, 48.1 ммоль,разведенный в 100 мл дихлорметана). После добавления смесь перемешивали при к.т. в течение 5 ч. Органический слой собирали, а водный раствор экстрагировали 100 мл дихлорметана. Объединенный органический раствор сушили над сульфатом натрия. Растворитель удаляли и получающееся твердое вещество растирали с 200 мл смеси ТГФ/гексан (1:10). Твердое вещество собирали и сушили, получая целевой продукт (12.9 г) с выходом 93%. Альтернативный способ. К раствору соединения 1 (10 г, 54.6 ммоль) и триэтиламина (15 мл, 106 ммоль) в 200 мл дихлорметана по каплям при 0 С добавляли бензилхлорформиат (7.24 мл, 51.5 ммоль, разведенный в 100 мл дихлорметана). После добавления раствор перемешивали при к.т. в течение 1 ч. Твердое вещество удаляли путем фильтрования. Раствор экстрагировали 100 мл 0.1 М HCl и 100 мл насыщ. карбоната натрия и сушили над безводным сульфатом натрия. Удаление растворителя обеспечивало белое твердое вещество,которое перемешивали в 200 мл смеси ТГФ/гексан (1:20) в течение 3 ч. Твердое вещество собирали путем фильтрования с получением 14.2 г целевого соединения с выходом 87%. 1H-ЯМР (300 МГц, CDCl3): 7.35 (m, 7H), 6.83 (d, J=8.7 Гц, 2H), 5.07 (m, 3H), 3.77 (s, 3H), 3.10 (q,J=6.3 Гц, 2H), 2.92 (t, J=6.3 Гц, 2H). Бензил 7-метокси-2,3-дигидробензо[f][1,4]тиазепин-4(5H)-карбоксилат (3). Смесь соединения 2 (7.3 г, 23 ммоль), параформальдегида (6.9 г, 0.23 моль) и п-толуолсульфоновой кислоты (1.45 г, 7.6 ммоль) в 250 мл толуола перемешивали при 70C в течение ночи. После охлаждения до к.т. твердое вещество отфильтровывали. Раствор экстрагировали насыщ. карбонатом натрия (100 мл),и органический слой сушили над безводным сульфатом натрия. Целевой продукт (7.4 г) после удаления растворителя получали в виде жидкости с 97% выходом. 1(m, 1.30H), 5.04 (s, 2H), 4.59 (ss, 2H), 3.96 (br, 1.80), 3.80 (ss, 1.23 H), 3.55 (s, 1.97H), 2.76 (m, 2H). Гидробромид 7-метокси-2,3,4,5-тетрагидробензо[f][1,4]тиазепина (4 HBr соль). Первый способ. Раствор HBr (33% в уксусной кислоте, 10 мл) добавляли к соединению 3 (4.2 г, 12.8 ммоль). После добавления начинал выделяться диоксид углерода и образовывалось белое твердое вещество. Смесь оставляли стоять при к.т. в течение новых 2 ч. К смеси добавляли диэтиловый эфир (150 мл) и ее перемешивали в течение 30 мин. Твердое вещество собирали путем фильтрования и промывали диэтиловым эфиром. Твердое вещество сушили в вакууме с получением 3.40 г целевого соединения с выходом 91.8%. 1H-ЯМР (300 МГц, ДМСО-d6): 9.02 (br, 2H), 7.52 (d, J=8.1 Гц, 1H), 7.27 (d, J=3.3 Гц, 1H), 6.92 (dd,J=8.4, 2.7 Гц, 1H), 4.41 (s, 2H), 3.77 (s, 3H), 3.53 (m, 2H), 2.96 (m, 2H). Альтернативный способ (свободное основание 4 а). Соединение 3 (10 г, 30 ммоль) смешивали с 50 мл конц. HCl, 50 мл воды и 30 мл диоксана. Смесь перемешивали при 100C в течение ночи. После охлаждения до к.т. большую часть растворителя и HCl удаляли при пониженном давлении. К раствору добавляли воду (100 мл) и твердое вещество отфильтровывали. Водный раствор экстрагировали смесью EtOAc/гексан (1:1, 3100 мл) и подщелачивали путем добавления 15 г NaOH. Смесь экстрагировали дихлорметаном (3150 мл). Объединенный раствор сушили над безводным сульфатом натрия. Удаление растворителя обеспечивало жидкость, которая отверждалась при стоянии при к.т., приводя к 6.2 г целевого соединения. 1H-ЯМР (300 МГц, CDCl3): 7.42 (d, J=8.1 Гц, 1H), 6.78 (d, J=2.7 Гц, H), 6.68 (dd, J=2.7, 8.1 Гц, 1H),4.08 (s, 2H), 3.96 (br, 1.80), 3.76 (s, 3 H), 3.38 (m, 2H), 2.68 (m, 2H). Метил 2-(7-метокси-2,3-дигидробензо[f][1,4]тиазепин-4(5H)-ил)-2-оксоацетат (5). К раствору соединения 4 (580 мг, 2.97 ммоль) и диизопропилэтиламина (1.0 мл, 5.5 ммоль) в 20 мл дихлорметана добавляли метилхлороксоацетат (301 мкл, 3.27 ммоль). Раствор перемешивали при к.т. в течение 4 ч. Его разбавляли 40 мл дихлорметана и экстрагировали 1 М HCl (230 мл). Органический слой сушили над сульфатом натрия. Удаление растворителя обеспечивало целевое соединение (740 мг) с выходом 89%. 1H-ЯМР (300 МГц, CDCl3): 7.46 (d, J=8.4 Гц, 1H), 7.09 (d, J=2.7 Гц, 1H), 6.73 (m, 1H), 4.76 (br, 2H),4.06 (m, 0.6H), 3.87 (m, 7.4H), 2.81 (m, 2H). 2-(7-Метокси-2,3-дигидробензо[f][1,4]тиазепин-4(5H)-ил)-2-оксоуксусная кислота (6). Соединение 5 (740 мг) растворяли в 30 мл смеси ТГФ, метанола и 1 М NaOH (1:1:1). Раствор перемешивали при к.т. в течение 6 ч и подкисляли 1 н. HCl. Органический растворитель удаляли и получающееся твердое вещество собирали и промывали водой. Твердое вещество сушили в вакууме с получением 600 мг твердого вещества с выходом 85%. 1 Соединение 1 реагирует с ClC(=O)OR с образованием соединения 36, где R означает фенил, 4-NO2 фенил, метил, этил, бензил, аллил, CH2CCl3, CH2CF3 или другую группу, которые, вместе с кислородом, к которому они присоединены, могли бы служить в качестве отходящей группы в реакции с амином. Соединение 36 реагирует с (CH2O)n, в кислоте с образованием соединение 37. Нагревание смеси соединения 37 и амина (HNR") в присутствии основания или катализатора, такого как Al(CH3)3 (Janda, K.D. et al. Tetrahedron 2004, 60, 3439), или -Al2O3 (Vauthey, I. et al. Tetrahedron Lett. 2000, 41, 6347), приводит к соединению 38. Альтернативно, реакцию между соединением 37 и амином (HNR") можно катализировать путем использования металлического катализатора, такого как Zr(O-трет-Bu)4 (Porco, J.A. et al. Organic Lett. 2007, 1517). С целью получения ARM064, HNR" означает пиперазин или Boc-защищенный пиперазин. Когда используют Boc-защищенный пиперазин, Boc группа может быть удалена в кислоте, такой как ТФУ. Получающееся соединение 38 представляет собой ARM064. Выход: 85-95%. Пример 3. Синтез соединения 38 (например, 7-метокси-2,3-дигидробензо[f][1,4]тиазепин-4(5H)ил(пиперазин-1-ил)метанона (ARM064 (схема 4). Схема 4 Соединение 1 реагирует с ClC(=O)OR с образованием соединения 36, где R означает фенил, 4-NO2 фенил, метил, этил, бензил, аллил, CH2CCl3, CH2CF3 или другую группу, которые могли бы служить в качестве отходящей группы в реакции с амином. Соединение 36 реагирует с (CH2O)n, в кислоте с образованием соединения 37. Карбаматную группу затем удаляют с получением свободного амина, соединения 4 а. Когда R означает бензил, карбамат 37 можно превратить в соединение 4 или его свободное основание соединение 4 а, как описано в примере 1 касательно превращения соединения 3 в соединения 4 и 4 а. Соединение 4 а (или 4) вводят в реакцию с трифосгеном и, далее, амином (HNR") необязательно в присутствии основания. Для получения ARM064 HNR" предпочтительно представляет собой Вос-защищенный пиперазин. Когда используют Boc-защищенный пиперазин, Boc группа может быть удалена в кислоте,такой как ТФУ. Получающееся соединение 38 представляет собой ARM064. Пример 4. Синтез метил 7-метокси-2,3-дигидробензо[f][1,4]тиазепин-4(5H)-карбоксилата (8) (схема 5). Схема 5(200 мл) перемешивали при 60C в течение 2 дней. Растворители удаляли путем упаривания при пониженном давлении и сырой продукт растворяли в 300 мл EtOAc. Органические фазы промывали Н 2 О(250 мл) и концентрировали при пониженном давлении. Остаток растворяли в 200 мл 1 н. HCl и промывали EtOAc (250 мл). Упаривание водной фазы давало целевой продукт в форме HCl соли и в виде белого твердого вещества. Выход: 34.8 г, 91% (свободный амин можно получить путем обработки соли 1 н.NaOH). Метил 2-(4-метоксифенилтио)этилкарбамат (7). К раствору соединения 1-HCl (0.466 г) в CH2Cl2 (20 мл), охлажденному до 0C, добавляли метилхлорформиат (1.1 экв.) и триэтиламин (2.5 экв.). Реакционную смесь перемешивали в течение 2 ч при 0C и промывали 1 н. HCl и насыщ. NaHCO3. Растворители удаляли путем упаривания при пониженном давлении с получением продукта 7 в виде белого твердого вещества с выходом 480 мг, 98%. 1(30 мг) в бензоле (4 мл) перемешивали при 60C в течение ночи. Анализ согласно ТСХ показывал новое пятно и полное исчезновение исходного вещества. Фильтрование с последующим концентрированием и хроматографированием на SiO2 давало 92 мг чистого продукта 8. Выход: 95%. 1 Метил гидроксиметил(2-(4-метоксифенилтио)этил)карбамат (9). Смесь соединения 7 (2.0 г), параформальдегида (1.5 г), Cs2CO3 (1.2 экв.) в ТГФ (50 мл) перемешивали при 70C в течение 3 ч. Фильтрование и концентрирование растворителя давало указанный в заголовке продукт 9 в виде чистого белого твердого вещества. Выход: 2.2 г, 98%. 1H-ЯМР (300 МГц, CDCl3) : 7.4 (d, 2H), 6.89 (d, 2H), 4.7 (широкий, 2H), 3.75 (s, 3H), 3.65 (s, 3H),3.40 (t, 2H), 2.95 (t, 2H). Метил 7-метокси-2,3-дигидробензо[f][1,4]тиазепин-4(5H)-карбоксилат (8). Раствор соединения 9 (20.0 мг) в 10 мл CH2Cl2 обрабатывали 1.1 экв. BF3-OEt2 под Ar. Смесь перемешивали в течение ночи и промывали 1 н. HCl и насыщ. NaHCO3. Удаление растворителя давало сырой продукт и ТСХ анализ показывал одно крупное пятно. Сырой продукт далее очищали на SiO2 колонке с обеспечением указанного в заголовке соединения (16 мг). Строение подтверждали с помощью ЯМР и ТСХ сопоставления с достоверным образцом, полученным путем реакции 7-МеО-2,3,4,5-тетрагидро-1,4 бензотиазепина с метилхлорформиатом. 1N-(2-(4-метоксифенилтио)этил)ацетамид (10). К раствору соединения 1-HCl (0.44 г) в CH2Cl2 (15 мл), охлажденному до 0C, добавляли ацетилхлорид (1.0 мл) и триэтиламин (1.0 мл). Реакционную смесь перемешивали в течение 1 ч при 0C и промывали 1 н. HCl, насыщ. NaHCO3. Растворители удаляли путем упаривания при пониженном давлении с получением продукта 10 в виде твердого вещества (чистого согласно ТСХ и ЯМР). Выход: 0.5 г. 1H-ЯМР (300 МГц, CDCl3) : 7.4 (d, 2H), 6.8 (d, 2H), 5.90 (s, широкий, 1H), 3.8 (s, 3H), 3.40 (t, 2H),2.95 (t, 2H), 2.1 (s, 3H). 1-(7-Метокси-2,3-дигидробензо[f][1,4]тиазепин-4(5H)-ил)этанон (11). Смесь соединения 11 (70 мг), параформальдегида (70 мг), п-толуолсульфоновой кислоты (40 мг) в бензоле (4 мл) перемешивали при 70C в течение ночи. Фильтрование с последующим промыванием насыщ. раствором NaHCO3 давало сырой продукт, который очищали с помощью хроматографии на SiO2 с получением целевого соединения (11) с выходом 91%. 1 2,2,2-Трифтор-N-(2-(4-метоксифенилтио)этил)ацетамид (12). К раствору соединения 1 (в виде гидрохлорида, 1.8 г) в CH2Cl2 (20 мл), охлажденному до 4C, добавляли трифторуксусный ангидрид (1.1 экв.) и триэтиламин (1.5 экв.). Реакционную смесь перемешивали при к.т. в течение ночи и промывали 1 н. HCl и насыщ. NaHCO3. Растворители удаляли путем упаривания при пониженном давлении с получением продукта 12 в виде твердого вещества (чистого согласно ТСХ и ЯМР). Выход: 2.5 г. 1H-ЯМР (300 МГц, CDCl3) : 7.4 (d, 2H), 6.8 (d, 2H), 6.6 (s, широкий, 1H), 3.8 (s, 3H), 3.40 (t, 2H),2.95 (t, 2H). 2,2,2-Трифтор-1-(7-метокси-2,3-дигидробензо[f][1,4]тиазепин-4(5H)-ил)этанон (13). Смесь соединения 12 (100 мг), параформальдегида (100 мг), п-толуолсульфоновой кислоты (60 мг) в толуоле (10 мл) перемешивали при 80C в течение ночи. Фильтрование с последующим промыванием насыщ. раствором NaHCO3 давало сырой продукт 13 с расчетным выходом 70% согласно ТСХ и ЯМР. 1N-(2-(4-Метоксифенилтио)этил)формамид (14). Раствор соединения 1 (550 мг) и Et3N (1 мл) в HCO2Et (20 мл) нагревали с обратным холодильником в течение 12 ч. Смесь охлаждали и промывали 1 н. HCl и насыщ. NaHCO3. Растворители удаляли путем упаривания при пониженном давлении с получением продукта 14 в виде твердого вещества: 606 мг. Сырой продукт, согласно ТСХ и ЯМР, образовывался чистым и использовался на следующей стадии реакции без дополнительной очистки. 1 3.40 (t, 2H), 2.95 (t, 2H). 7-Метокси-2,3-дигидробензо[f][1,4]тиазепин-4(5H)-карбальдегид (15). Смесь соединения 14 (100 мг), параформальдегида (100 мг), п-толуолсульфоновой кислоты (60 мг) в бензоле (5 мл) перемешивали при 70-75C в течение 2 дней. Фильтрование, промывание насыщ. NaHCO3 и концентрирование давало сырой продукт 15 с расчетным выходом 70% согласно ТСХ и ЯМР. 1N-(2-(4-Метоксифенилтио)этил)морфолин-4-карбоксамид (16). К раствору соединения 1 (400 мг) в CH2Cl2 (10 мл) при 0C добавляли трифосген (1.0 экв.) и триэтиламин (2.5 экв.). Реакционную смесь перемешивали в течение 2 ч при к.т. и добавляли морфолин (3.0 экв.). Реакционную смесь перемешивали до тех пор, пока реакция согласно ТСХ не была завершена (4 ч.), и промывали 1 н. HCl и насыщ. NaHCO3 (310 мл). Растворители удаляли путем упаривания при пониженном давлении с получением продукта 16 (520 мг). Сырой продукт согласно ТСХ и ЯМР образовывался чистым и использовался на следующей стадии реакции без дополнительной очистки. 1(7-Метокси-2,3-дигидробензо[f][1,4]тиазепин-4(5H)-ил)(морфолино)метанон (17). Смесь соединения 16 (100 мг), параформальдегида (110 мг), п-толуолсульфоновой кислоты (60 мг) в бензоле (5 мл) перемешивали при 70-75C в течение 14 ч. Реакционный раствор фильтровали, промывали насыщ. NaHCO3 и концентрировали с получением сырого, указанного в заголовке продукта 17 с расчетным выходом 50% согласно ТСХ и ЯМР. Хроматография на SiO2 (CH2Cl2/EtOAc 10:1) обеспечивала чистый образец для подтверждения структуры. 1 Бензил 4-(2-(4-метоксифенилтио)этилкарбамоил)пиперазин-1-карбоксилат (18). К раствору соединения 1 (183 мг) в CH2Cl2 (10 мл) при 0C добавляли трифосген (0.7 экв.) и триэтиламин (1.0 экв.). Реакционную смесь перемешивали в течение 1 ч при к.т. и добавляли N-Cbzпиперидин (1.5 экв.) и Et3N (0.5 мл). Реакционную смесь перемешивали в течение ночи и промывали 1 н.HCl и насыщ. NaHCO3 (35 мл). Растворители удаляли путем упаривания при пониженном давлении с получением указанного в заголовке продукта 18, который очищали с помощью хроматографии (SiO2,- 23020602(19). Смесь соединения 18 (30 мг), параформальдегида (100 мг), п-толуолсульфоновой кислоты (30 мг) в бензоле (5 мл) перемешивали при 70-75C в течение 2 дней. Реакционную смесь фильтровали, промывали насыщ. NaHCO3 и концентрировали с получением сырого продукта 19, который очищали с помощью хроматографии на SiO2 (CH2Cl2/EtOAc 10:1). Выход: 21 мг, 69%. 1CH3CN (60 мл) перемешивали при 60C в течение 20 ч. К реакционной смеси добавляли EtOAc (100 мл) и промывали H2O (230 мл). Органическую фазу концентрировали при пониженном давлении с получением продукта 20 (выход: 6.2 г, 95%), который, согласно ТСХ и ЯМР, образовывался чистым и использовался на следующей стадии реакции без дополнительной очистки. Бензил 2-(3-метоксифенилтио)этилкарбамат (21). К раствору соединения 20 (1.0 г) в EtOAc (50 мл), охлажденному до 0C, добавляли бензилхлорформиат (1.1 экв.) и триэтиламин (1.2 экв.). Реакционную смесь перемешивали в течение 4 ч при к.т. и промывали 1 н. HCl и насыщ. NaHCO3 (210 мл). Растворители удаляли путем упаривания при пониженном давлении с получением сырого, указанного в заголовке продукта. Очистка с помощью хроматографии давала 21 в виде белого твердого вещества. Выход: 1.61 г. 1(5 мл) перемешивали при 76C в течение 20 ч. Фильтрование с последующим концентрированием и хроматографией на SiO2 давало смесь продуктов 22 и 23 в соотношении 50:1. Общий выход: 83 мг. 1 2-(п-Толилтио)этанамин (24). Смесь 4-метилбензолтиола (1.24 г), 2-хлорэтиламина HCl (2.3 г) и Cs2CO3 (5.3 г) в CH3CN (30 мл) перемешивали при 50C в течение 2 дней. К реакционной смеси добавляли EtOAc (50 мл) и Н 2 О (30 мл). Органическую фазу отделяли, промывали H2O (230 мл) и концентрировали при пониженном давлении с получением продукта 24. Выход: 1.67 г, 95%. 1Cs2CO3 (3.2 г, 3 экв.). Реакционную смесь перемешивали при к.т. в течение 5 ч. Добавляли триэтиламин(2 мл) и реакционную смесь перемешивали в течение 3 ч. После добавления Н 2 О (30 мл) органическую фазу отделяли и промывали 1 н. HCl (230 мл) и насыщ. NaHCO3 (230 мл). Растворитель удаляли путем упаривания при пониженном давлении с получением продукта 25 в виде белого твердого вещества. Выход: 2.4 г, 79.7%. 1H-ЯМР (300 МГц, CDCl3) : 7.35 (m, 5H), 7.3 (d, 2H), 7.1 (d, 2H), 5.1 (s, широкий, 2H), 3.4 (s, широкий, 2H), 3.0 (t, 2H), 2.3 (s, 3H). Бензил 7-метил-2,3-дигидробензо[f][1,4]тиазепин-4(5H)-карбоксилат (26). Смесь соединения 25 (120 мг), параформальдегида (120 мг, избыток), п-толуолсульфоновой кислоты (40 мг) в толуоле (10 мл) перемешивали при 70C в течение 24 ч. Реакционную смесь фильтровали и промывали насыщ. NaHCO3 (25 мл). Удаление растворителя давало продукт 26 в виде чистого продукта согласно ТСХ и ЯМР. Выход: 110 мг, 89%. 1 Бензил 7-(метилтио)-2,3-дигидробензо[f][1,4]тиазепин-4(5H)-карбоксилат (28). Смесь соединения 27 (3 г), параформальдегида (3.5 г, избыток), п-толуолсульфоновой кислоты (1.5 г) в бензоле (120 мл) перемешивали при 80C в течение 14 ч. Реакционную смесь фильтровали и промывали насыщ. NaHCO3 (330 мл). Удаление растворителя давало соединение 28 в виде белого твердого вещества. Выход: 2.98 г, 90%. 1(300 г), п-толуолсульфоновой кислоты (100 г) в бензоле (15 мл) перемешивали при 80C в течение 3 дней. Реакционную смесь фильтровали и промывали насыщ. NaHCO3 (25 мл). Удаление растворителя давало 30 в виде белого твердого вещества. Продукт очищали с помощью хроматографии на SiO2 (петролейный эфир/EtOAc=3/1). Выход: 235 мг, 76%. 1H-ЯМР (CDCl3) : 7.6 (d, 1H), 7.4 (m, 6H), 7.1 (s, 1H), 5.1 (s, 2H), 4.5 (s, 2H), 4.0 (m, 2H), 2.8 (m, 2H). Гидробромид 7-(трифторметокси)-2,3,4,5-тетрагидробензо[f][1,4]тиазепина (31). Исходное вещество 30 (200 мг) обрабатывали 3 мл раствора HBr/АсОН в течение 1 ч. К реакционной смеси добавляли диэтиловый эфир (20 мл). Белое твердое вещество отфильтровывали с получением указанного в заголовке соединения в виде HBr соли. Выход: 182 мг. 1N-(2-(4-Метоксифенилтио)этил)акриламид (32). К раствору соединения 1 (1.83 г) в EtOAc (50 мл) добавляли хлорангидрид акриловой кислоты (1.35 г, 1.5 экв.) и Na2CO3 (2.12 г, 2.0 экв.). Реакционную смесь перемешивали при к.т. в течение ночи и добавляли триэтиламин. После перемешивания в течение 20 мин, смесь промывали H2O (20 мл), 1 н. HCl (220 мл) и насыщ. NaHCO3 (220 мл). Растворители удаляли путем упаривания при пониженном давлении с получением продукта 32 в виде белого твердого вещества (одно пятно на ТСХ). Выход: 2.2 г, 92.8%. 1H-ЯМР (300 МГц, CDCl3) : 7.4 (d, 2H), 6.8 (d, 2H), 6.3 (d, 1H), 6.1 (dd, 1H), 5.95 (широкий, 1H,NH), 5.6 (d, 1H), 3.8 (s, 3H), 3.5 (m, 2H), 3.0 (t, 2H). 1-(7-Метокси-2,3-дигидробензо[f][1,4]тиазепин-4(5H)-ил)проп-2-ен-1-он (33). Смесь соединения 32 (280 мг), параформальдегида (600 мг), п-толуолсульфоновой кислоты (140 мг) в бензоле (7.0 мл) перемешивали при 80C в течение 16 ч. Реакционную смесь фильтровали и промывали насыщ. раствором NaHCO3 (23 мл). Растворители удаляли путем упаривания при пониженном давлении с получением продукта 33 в виде масла. Выход: 253 мг, 86%. 1(R)-5-4-метоксифенилтио)метил)пирролидин-2-он (34). К раствору (R)-(5-оксопирролидин-2-ил)метил 4-метилбензолсульфоната (Helvetica Chimica Acta 1990, 73, 122-32; Tetrahedron: Asymmetry 2007, 18, 664-670) (1.05 г, 3.9 ммоль) в CH3CN (30 мл) добавляли 4-метоксибензолтиол (0.55 г, 3.9 ммоль) и Cs2CO3 (5 г, избыток). Реакционную смесь перемешивали в течение 3 дней. К раствору добавляли EtOAc (50 мл) и H2O (30 мл). Органическую фазу отделяли. Растворители удаляли путем упаривания с получением указанного в заголовке соединения в виде масла(0.91 г, 98%). ТСХ и ЯМР указывали на то, что продукт является достаточно чистым для следующей стадии. 1H-ЯМР (300 МГц, CDCl3) : 7.4 (d, 2H), 6.8 (d, 2H), 6.19 (s, br, 1H), 3.8 (s, 3H), 3.7 (m, 1H), 3.0 (dd,1H), 2.8 (dd, 1H), 2.3 (m, 3H), 1.80 (m, 1H). 7-Метокси-1,2,11,11 а-тетрагидробензо[f]пирроло[2,1-с][1,4]тиазепин-3(5H)-он (35). Смесь 5-4-метоксифенилтио)метил)пирролидин-2-она (34) (160 мг), параформальдегида (2.0 г), птолуолсульфоновой кислоты (200 мг) в бензоле (60 мл) перемешивали при 80C в течение 18 ч. Реакционную смесь фильтровали и промывали насыщ. раствором NaHCO3 (210 мл). Растворители удаляли путем упаривания при пониженном давлении с получением сырого продукта 34 в виде масла. Продукт очищали с помощью хроматографии на SiO2 (CH2Cl2/EtOAc=5/1). Выход: 140 мг, 87.5%. 1 Соединение 1 превращают в соединение 4 или его свободное основание 4 а, как описано в примере 1. Для получения соединения 40 смесь соединения 4 или его свободное основание 4 а, метил 1 бромацетат и пиридин вводят в реакцию в ДМФА в течение подходящего промежутка времени. К этой смеси добавляют этилацетат и, при необходимости, реакционную смесь промывают основным раствором(например, NaHCO3) или водой. Продукт - соединение 39 (ARM 110) в виде масла можно очистить, например, с помощью колоночной хроматографии на SiO2. Затем, к соединению 39 в растворителе (таком,как MeOH) добавляют основание (такое как 1 н. NaOH) и смесь оставляют реагировать в течение подходящего промежутка времени. Растворители затем удаляют, например, при пониженном давлении, а остаток затем можно растворить в водном растворе, например воде. Водную фазу можно промыть этилацетатом и подкислить, например, с помощью 1 н. HCl, до pH приблизительно 4. Растворители затем можно удалить, например, при пониженном давлении с получением сырого соединения 40. NaCl можно отделить с использованием спирта, такого как этанол, с получением чистого 40 в виде твердого вещества. Объем изобретения не должен ограничиваться отдельными вариантами осуществления, описанными здесь. Несомненно, различные модификации в рамках сущности и объема изобретения, в дополнение к описанным здесь, будут очевидны специалисту в данной области техники из предшествующего описания. Такие модификации должны подпадать под объем описанного изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения 2,3,4,5-тетрагидро[1,4]бензотиазепина формулы который включает реакцию [2-(ациламиноэтил)тио]арена формулы с альдегидом формулы R4CHO или его олигомером или полимером и с сульфоновой кислотой или кислотой Льюиса, гдеAr означает моноциклическую арильную кольцевую систему;R3 означает (C1-C10)ацил, C(=O)-R10, (CH2)mR13 или взятые вместе R2 и R3 образуют оксозамещенный азотсодержащий гетероцикл;R5 независимо, в каждом случае его присутствия, выбирают из Н, (C1-C4)алкила, галогена, -OR6,6R10 означает H, -OR14, -NR6aR6b, CO2R15, галоген, (C1-C8)алкокси, арилокси, аллилокси, бензилокси,замещенный бензилокси, флуоренилметокси, адамантилокси, (C1-C6)алкил, который необязательно замещен одним-тремя атомами галогена, арил или (C1-C6)алкиларил;R6 означает H или (C1-C6)алкил,R6a, R6b, R7, R14 и R17, каждый независимо, в каждом случае своего присутствия, означают H, -OR15,- 27020602(C1-C6)алкил, арил, гетероциклил, гетероарил, (C1-C6)алкиларил, (C1-C6)алкилгетероциклил или (C1C6)алкилгетероарил, причем каждый из указанных арила, гетероциклила и гетероарила необязательно замещен одним-тремя заместителями, независимо выбранными из группы, состоящей из галогена, алкила, (C1-C8)алкоксила, нитро, циано и галоалкила, или R6a и R6b вместе с азотом, к которому они присоединены, представляют 5-, 6- или 7-членный азотсодержащий гетероцикл;R15 независимо, в каждом случае своего присутствия, означает H, (C1-C6)алкил, арил, гетероциклил,гетероарил, (C1-C6)алкиларил, (C1-C6)алкилгетероциклил или (C1-C6)алкилгетероарил, причем каждый из указанных арила, гетероциклила и гетероарила необязательно замещен одним-тремя заместителями, независимо выбранными из группы, состоящей из галогена, алкила, (C1-C8)алкоксила, нитро, циано и галоалкила;m означает целое число от 1 до 10;q означает 0 или целое число от 1 до 4; причем термин "арил" означает фенильную, нафтильную, инданильную, тетралинильную или флуоренильную группы; термин "гетероарил" означает имидазолильную, пиридильную, индолильную, тиофенильную, бензопиранонильную, тиазолильную, фуранильную, бензофуранильную, бензимидазолильную, хинолинильную, изохинолинильную, хиноксалинильную, пиримидинильную, пиразинильную, тетразолильную или пиразолильную группы; термин "гетероциклил" означает пирролидинильную, пиперидинильную, морфолинильную, 4-CBZпиперазинильную или азепанильную группы. 2. Способ по п.1, где [2-(ациламиноэтил)тио]арен сначала вводят в реакцию с альдегидом или его олигомером или полимером и основанием с получением [N-гидроксиметил-2-(ациламиноэтил)тио]арена формулы и [N-гидроксиметил-2-(ациламиноэтил)тио]арен затем обрабатывают кислотой с образованием 2,3,4,5-тетрагидро[1,4]бензотиазепина. 3. Способ по п.1 или 2, где основание представляет собой гидрид, гидроксид или карбонат щелочного металла, пиридин или триалкиламин. 4. Способ по п.3, где основание представляет собой NaH, NaOH, KOH, Na2CO3, K2CO3, Cs2CO3, Et3N или (iPr)2NEt. 5. Способ по п.1, где сульфоновая кислота выбрана из группы, состоящей из толуолсульфоновой,бензолсульфоновой, метансульфоновой кислот, п-толуолсульфоната пиридиния и трифторметансульфоновой кислоты, и кислота Льюиса выбрана из группы, состоящей из эфирата трифторида бора, тетрахлорида титана, хлорида алюминия и хлорида цинка. 6. Способ по п.1, где альдегид или его олигомер или полимер представляет собой формальдегид,параформальдегид или 1,3,5-триоксан. 7. Способ по п.1, где R3 означает ацетил, бензоил, толуоил, бензилоксикарбонил, тбутоксикарбонил, акрилоил, оксалил или -C(=O)N(R19)2, где каждый R19 означает водород, алкил, арил,гетероциклил, гетероарил, алкиларил, алкилгетероциклил или алкилгетероарил, или взятые вместеN(R19)2 означают 5-, 6- или 7-членный азотсодержащий гетероцикл. 8. Способ по п.1, где Ar означает фенил или взятые вместе R2 и R3 образуют пирролидон, оксазолидинон или пиперидинон. 9. Способ по п.1, гдеR3 означает (C1-C10)ацил формулы -C(=O)-R18, где R18 означает H, (C1-C6)алкил, (C1-C6)алкокси, аллилокси, бензилокси, замещенный бензилокси, флуоренилметокси или адамантилокси; и способ дополнительно включает превращение соединения формулы где M означает H, аммоний, щелочной металл или щелочно-земельный металл. 10. Способ по п.9, где указанная стадия превращения включает расщепление R3 группы с обеспечением 2,3,4,5-тетрагидробензо[f][1,4]тиазепина формулы ацилирование 2,3,4,5-тетрагидробензо[f][1,4]тиазепина сложным эфиром щавелевой кислоты; осуществление гидролиза сложного эфира. 11. Способ по п.10, где стадия гидролиза включает обработку сложного эфира основанием - гидридом, гидроксидом или карбонатом щелочного металла, пиридином или триалкиламином и, необязательно, когда M означает H, подкисление. 12. Способ по п.11, где основание представляет собой NaH, NaOH, KOH, Na2CO3, K2CO3, Cs2CO3,Et3N или (iPr)2NEt. 13. Способ по п.10, который дополнительно включает превращение оксалатного соединения, где M означает H, в его соль, где M означает катион, такой как Na+, Mg, Ca или аммоний. 14. Способ по п.10, где q означает 1; R5 означает OCH3 в положении 7 бензотиазепинового кольца и соединение имеет формулу где M означает водород, аммоний, щелочной металл или щелочно-земельный металл. 15. Способ по п.14 для конкретного получения соединения формулы альдегид представляет собой параформальдегид, кислота представляет собой толуолсульфоновую кислоту, реакция обеспечивает CBZ-защищенный бензотиазепин формулы
МПК / Метки
МПК: C07D 281/08, C07D 281/10
Метки: gamma;-аминоалкилбензолов, бензотиазепинов, способ, получения
Код ссылки
<a href="https://eas.patents.su/30-20602-sposob-polucheniya-benzotiazepinov-iz-gamma-aminoalkilbenzolov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения бензотиазепинов из γ-аминоалкилбензолов</a>
Предыдущий патент: Способ дезинфекции или стерилизации изделия
Следующий патент: Поддерживающая простетическая основа для молочной железы человека и способ имплантирования
Случайный патент: Неорганический сцинтилляционный материал, кристаллический сцинтиллятор и детектор излучения












