Новые фунгицидно активные пиразолкарбоксамиды
Формула / Реферат
1. Соединение формулы (I)
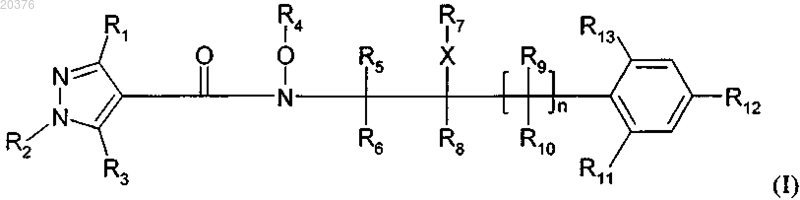
в которой R1 обозначает С1-С4-галогеналкил;
R2 обозначает С1-С4-алкил;
R3 обозначает водород или галоген;
R4 обозначает водород или С1-С4-алкил;
R5, R6, R8, R9 и R10 независимо друг от друга обозначают водород или С1-С4-алкил;
R7 обозначает водород;
R11 обозначает водород или галоген;
R12 обозначает галоген, С1-С6-алкил или галогенфеноксигруппу;
R13 обозначает водород или галоген;
X отсутствует и
n равно 0 или 1.
2. Соединение по п.1, в котором R1 обозначает дифторметил или трифторметил.
3. Соединение по п.1, в котором R2 обозначает метил.
4. Соединение по п.1, в котором R3 обозначает водород или фтор.
5. Соединение по п.1, в котором R4 обозначает водород, метил или этил.
6. Соединение по п.1, в котором R4 обозначает метил.
7. Соединение по п.1, в котором R5 обозначает водород или метил.
8. Соединение по п.1, в котором n равно 0.
9. Соединение по п.1, в котором R8, R9 и R10 обозначают водород.
10. Соединение по п.1, в котором R12 обозначает хлор или С1-С4-алкил.
11. Соединение по п.1, которое представляет собой метокси[1-метил-2-(2,4,6-трихлорфенил)этил]амид 3-дифторметил-1-метил-1Н-пиразол-4-карбоновой кислоты.
12. Способ борьбы с заражением полезных растений фитопатогенными грибами или его предупреждения, в котором соединение формулы (I) по п.1 или композицию, включающую это соединение в качестве активного ингредиента, наносят на растения, на их части или участок их произрастания.
13. Композиция, предназначенная для борьбы с заражением фитопатогенными грибами и защиты от него, включающая соединение формулы (I) по п.1 и инертный носитель.
Текст
НОВЫЕ ФУНГИЦИДНО АКТИВНЫЕ ПИРАЗОЛКАРБОКСАМИДЫ В изобретении приведено описание соединения формулы (I) в которой заместители являются такими, как определено в п.1 формулы изобретения, пригодные для применения в качестве фунгицидов. Настоящее изобретение относится к новым микробиоцидно активным, в частности фунгицидно активным, карбоксамидам. Настоящее изобретение также относится к промежуточным продуктам, использующимся при получении этих соединений, к композициям, которые содержат эти соединения, и к их применению в сельском хозяйстве или садоводстве для борьбы с заражением растений фитопатогенными микроорганизмами, предпочтительно грибами, или его предупреждения. Фунгицидно активные карбоксамиды описаны в ЕР 1787981 и ЕР 1792901. Согласно изобретению установлено, что новые карбоксамиды, содержащие определенную комбинацию заместителей, обладают микробиоцидной активностью. Таким образом, настоящее изобретение относится к N-алкоксикарбоксамидам формулы (I)R3 обозначает водород или галоген;R4 обозначает водород или C1-C4-алкил;R5, R6, R8, R9 и R10 независимо друг от друга обозначают водород или C1-C4-алкил;R11 обозначает водород или галоген;R13 обозначает водород или галоген;n равно 0 или 1. Алкильные группы, содержащиеся в определениях заместителей, могут обладать линейной или разветвленной цепью и представляют собой, например, метил, этил, н-пропил, н-бутил, н-пентил, н-гексил,изопропил, н-бутил, втор-бутил, изобутил или трет-бутил. Алкоксильные, алкенильные и алкинильные радикалы образованы из указанных алкильных радикалов. Алкенильные и алкинильные группы могут быть моно- или диненасыщенными. Циклоалкильные группы, содержащиеся в определениях заместителей, представляют собой, например, циклопропил, циклобутил, циклопентил или циклогексил. Галоген обычно означает фтор, хлор, бром или йод, предпочтительно фтор, бром или хлор. Это также относится к комбинациям галогена с другими значениями, таким как галогеналкил или галогеналкоксигруппа. Галогеналкильные группы предпочтительно содержат в цепи от 1 до 4 атомов углерода. Галогеналкил представляет собой, например фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, 2,2,2-трифторэтил, 2-фторэтил, 2-хлорэтил, пентафторэтил, 1,1-дифтор-2,2,2-трихлорэтил,2,2,3,3-тетрафторэтил и 2,2,2-трихлорэтил, предпочтительно трихлорметил, дифторхлорметил, дифторметил, трифторметил и дихлорфторметил. Алкоксигруппа представляет собой, например, метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, вторбутоксигруппу и трет-бутоксигруппу, предпочтительно метоксигруппу и этоксигруппу. Галогеналкоксигруппа представляет собой, например, фторметоксигруппу, дифторметоксигруппу, трифторметоксигруппу,2,2,2-трифторэтоксигруппу,1,1,2,2-тетрафторэтоксигруппу,2-фторэтоксигруппу,2-хлорэтоксигруппу, 2,2-дифторэтоксигруппу и 2,2,2-трихлорэтоксигруппу, предпочтительно дифторметоксигруппу, 2-хлорэтоксигруппу и трифторметоксигруппу. В предпочтительных соединениях формулы (I) независимо друг от друга:a) R1 обозначает дифторметил или трифторметил;c) R3 обозначает водород или фтор;f) R5 обозначает водород или метил;j) R11 и R13 обозначает водород или хлор;k) R12 обозначает хлор или C1-C4-алкил;m) R7 обозначает водород. Особенно предпочтительными соединениями формулы (I) являются такие, в которых:R1 обозначает дифторметил или трифторметил;R11 и R13 независимо друг от друга обозначают водород или галоген, предпочтительно водород или хлор. Другими предпочтительными соединениями формулы (I) являются такие, в которых X отсутствует и R7 обозначает водород. Соединения формулы (I) можно получить по реакции соединения формулы (II) в которой R4, R5, R6, R7, X, R8, R9, R10, n, R11, R12 и R13 являются такими, как определено для формулы (I),с соединением формулы (III) в которой R1, R2 и R3 являются такими, как определено для формулы (I), иR обозначает галоген, гидроксигруппу или C1-C6-алкоксигруппу, предпочтительно хлор. Реакции, приводящие к получению соединений формулы (I), предпочтительно проводят в апротонных инертных органических растворителях. Такими растворителями являются углеводороды, такие как бензол, толуол, ксилол или циклогексан, хлорированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорметан или хлорбензол, простые эфиры, такие как диэтиловый эфир, диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля, тетрагидрофуран или диоксан, нитрилы, такие как ацетонитрил или пропионитрил, амиды, такие как N,N-диметилформамид, диэтилформамид илиN-метилпирролидинон. Температура проведения реакции предпочтительно составляет от -20 до 120C. Обычно реакции являются немного экзотермичными, и, как правило, их можно проводить при температуре окружающей среды. Для сокращения длительности проведения реакции или для инициирования реакции смесь можно кратковременно нагреть до температуры кипения реакционной смеси. Длительности проведения реакции также можно сократить путем добавления нескольких капель основания, в качестве катализатора реакции. Подходящими основаниями являются, в частности, третичные амины, такие как триметиламин, триэтиламин, хинуклидин, 1,4-диазабицикло[2.2.2]октан, 1,5-диазабицикло[4.3.0]нон 5-ен или 1,5-диазабицикло[5.4.0]ундец-7-ен. Однако в качестве оснований также можно использовать неорганические основания, такие как гидриды, например гидрид натрия или гидрид кальция, гидроксиды, например гидроксид натрия или гидроксид калия, карбонаты, такие как карбонат натрия и карбонат калия, или гидрокарбонаты, такие как гидрокарбонат калия и гидрокарбонат натрия. Основания можно использовать в чистом виде или с добавлением каталитических количеств межфазного катализатора, например краун-эфира, в частности 18-краун-6, или соли тетраалкиламмония. Если R обозначает гидроксигруппу, то можно использовать реагент сочетания, такой как бензотриазол-1-илокси-трис-(диметиламино)фосфонийгексафторфосфат,хлорангидрид бис-(2-оксо-3 оксазолидинил)фосфиновой кислоты (ВОР-Cl), N,N'-дициклогексилкарбодиимид (ДЦК) или 1,1'-карбонилдиимидазол (КДИ). Промежуточные продукты формулы (II) в которой R4, R5, R6, R7, X, R8, R9, R10, n, R11, R12 и R13 являются такими, как определено для формулы (I), где R4 предпочтительно обозначает C1-C4-алкил,являются новыми и разработаны специально для получения соединений формулы (I). Предпочтительные определения заместителей для соединений формулы (I) также относятся к соединению формулы (II). Таким образом, предпочтительными соединениями формулы (II) являются такие, в которых, независимо друг от друга:b) R5 обозначает водород или метил;f) R11 и R13 обозначают водород или хлор;g) R12 обозначает хлор или C1-C4-алкил;i) R7 обозначает водород. Промежуточные продукты формулы (IIA) в которой R4, R5, X, R7, R11, R12 и R13 являются такими, как определено для формулы (I),можно получить, как показано на схеме реакций 1. Схема 1 Нитроалкены формулы (VI), в которой R5, R11, R12 и R13 являются такими, как определено для формулы (IIA), можно получить по реакции Генри (нитроальдольная реакция) нитроалкана формулы (V), в которой R5 является таким, как определено для формулы (IIA), с карбонильным соединением формулы(IV), в которой R11, R12 и R13 являются такими, как определено для формулы (IIA), в присутствии уксусной кислоты и ацетата аммония при температуре от температуры окружающей среды до температуры кипения реакционной смеси. Присоединение по Михаэлю соединения формулы (VIIa), в которой R7 и X являются такими, как определено для формулы (I), и М обозначает Li, Na, K или водород, к нитроалкенам формулы (VI) можно провести с использованием алкоголятов щелочных металлов, предпочтительно солей натрия калия и лития в соответствующем спирте, тиоле, толуоле или эфирном растворителе, таком как диэтиловый эфир,диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля, тетрагидрофуран или диоксан, и получить нитроалканы формулы (VIII), в которой R5, R7, R11, R12 и R13 являются такими, как определено для формулы (IIA). Нитроалкены формулы (VI), в которой R5, R11, R12 и R13 являются такими, как определено для формулы (IIA), можно восстановить с использованием железа хлористо-водородной кислоты и получить оксимы формулы (IX), в которой R5, R11, R12 и R13 являются такими, как определено для формулы (IIA). Указанные оксимы можно гидролизовать с получением кетонов формулы (Ха), в которой R5, R11, R12 иR13 являются такими, как определено для формулы (IIA), как это описано, например, в публикации М.Commun., 35, 913-922, 2005. Реакцию проводят при температурах от 40 до 100C в подходящем органическом растворителе, таком как метанол, этанол, трет-бутанол, трифторэтанол или диоксан. Алкилирование кетонов формулы (Xa) с использованием соединения формулы R7-Y, в которой R7 является таким, как определено для формулы (IIA), и Y обозначает отщепляющуюся группу, такую как галогенидная, мезилатная или тозилатная, в присутствии основания дает -алкилированный кетон формулы (Xb), в которой R5, R7, R11, R12 и R13 являются такими, как определено для формулы (IIA). Реакцию алкилирования предпочтительно проводят в апротонных инертных органических растворителях. Такими растворителями являются углеводороды, такие как бензол, толуол, ксилол или циклогексан, простые эфиры, такие как диэтиловый эфир, диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля, тетрагидрофуран или диоксан, амиды, такие как N,N-диметилформамид, диэтилформамид илиN-метилпирролидинон. Температура проведения реакции предпочтительно составляет от -20 до 120C. Подходящими основаниями являются неорганические основания, такие как гидриды, например гидрид натрия или гидрид кальция, гидроксиды, например гидроксид натрия или гидроксид калия, в качестве оснований также можно использовать карбонаты, такие как карбонат натрия и карбонат калия, или гидрокарбонаты, такие как гидрокарбонат калия и гидрокарбонат натрия. Основания можно использовать в чистом виде или с добавлением каталитических количеств межфазного катализатора, например краунэфира, в частности 18-краун-6, или соли тетраалкиламмония. Производные О-алкоксиоксима формулы (XIIa), (XIIb) можно получить путем оксимирования кетонов формул (Ха) и (Xb) с использованием производных О-алкилгидроксиламина О-алкилгидроксиламина формулы XI или их солей. Растворителями, подходящими для проведения стадии оксимирования, являются углеводороды, такие как бензол, толуол, ксилол или циклогексан, хлорированные углеводороды, такие как дихлорметан,трихлорметан, тетрахлорметан или хлорбензол, простые эфиры, такие как диэтиловый эфир, диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля, тетрагидрофуран или диоксан, нитрилы,такие как ацетонитрил или пропионитрил, амиды, такие как N,N-диметилформамид, диэтилформамид,N-метилпирролидинон, вода или их смеси. Температура проведения реакции предпочтительно составляет от -20 до 120C. Обычно реакции можно проводить при температуре окружающей среды. Подходящими основаниями являются, в частности, третичные амины, такие как триметиламин, триэтиламин,хинуклидин,1,4-диазабицикло[2.2.2]октан,1,5-диазабицикло[4.3.0]нон-5-ен или 1,5-диазабицикло[5.4.0]ундец-7-ен. Однако в качестве оснований можно использовать неорганические основания, такие как гидриды, например гидрид натрия или гидрид кальция, гидроксиды, например гидроксид натрия или гидроксид калия, карбонаты, такие как карбонат натрия и карбонат калия, или гидрокарбонаты, такие как гидрокарбонат калия и гидрокарбонат натрия. Производные оксима формулы (XIII) можно получить путем селективного восстановления нитроалкенов формулы (VI) в спирте или тиоле формулы (VIIb) с использованием SnCl22H2O в соответствии с методикой, описанной в публикации R.S. Varma and G.W. Kabalka Chem. Lett., 243-244 (1985). Производные простого эфира оксима формулы (XIIc) можно получить путем О-алкилирования производных оксима формулы (XIII) с использованием соединения формулы R4-Y, в которой R4 является таким, как определено для формулы (IIA), и Y обозначает отщепляющуюся группу, такую как галогенидная, мезилатная или тозилатная, в присутствии основания. Альтернативно, производные простого эфира оксима формулы (XIIc) также можно получить путем оксимирования кетона формулы (XIV) с использованием производных О-алкилгидроксиламина формулы (XI) или их солей. Кетоны формулы (XIV) можно получить путем превращения нитроалканов формулы (VIII) по реакции Нефа в соответствии с методикой, описанной в публикации J.M. Aizpurua and С. Palomo THL, vol. 28, No. 44, p. 5361-5364 (1987). О-алкилгидроксиламины формул (IIAa)-(IIAc) можно получить путем восстановления производных О-алкоксиоксима формул (XIIa)-(XIIc). Промежуточные продукты формулы (IIA) в которой R4, R5, R7, R11, R12 и R13 являются такими, как определено для формулы (I),можно получить, как показано на схеме реакций 2. Производные -алкилированных арилацетатов формулы (XVI) можно синтезировать путем алкилирования производных арилацетата формулы (XV), галогенидом, таким как формулы R7-Y, в которой R7 является таким, как определено для формулы (IIA), и Y обозначает отщепляющуюся группу, такую как галогенидная, мезилатная или тозилатная, в присутствии основания. Соединение формулы (XVI) гидролизуют гидроксидом, таким как LiOH. Затем полученную кислоту формулы (XVII) можно превратить в соответствующий ацилхлорид и затем этот ацилхлорид можно in situ ввести в реакцию сN,O-диметилгидроксиламином и получить амид Вайнреба формулы (XVIII), в которой R7, R11, R12 и R13 являются такими, как определено для формулы (IIA). Последующая реакция с реагентом Гриньяра формулы R5-MgBr, в которой R5 является таким, как определено для формулы (IIA), дает кетон формулы(Xb), который можно превратить в соединение формулы (IIAb) по реакциям, приведенным на схеме 1. Производные альдегидов формулы (Xb1) можно получить путем неполного восстановления амида Вайнреба формулы (XVIII) с помощью LiAlH4 или DIBAL-Н (диизобутилалюминий гидрид). Промежуточные продукты формулы (IIA) в которой R4, R5, R11, R12 и R13 являются такими, как определено для формулы (I),можно получить, как показано на схеме реакций 3. Производные альдегидов формулы (Xa1) можно получить в соответствии с методиками, известными в данной области техники, путем восстановления производного кислоты формулы (XIX) в производное спирта формулы (XX) с последующим превращением в активированное бензильное производное формулы (XXI), превращением в нитрильное производное формулы (XXII), с последующим восстановлением производного альдегида (Xa1), которое описано в разделе, посвященном примерам получения. Последующая реакция нитрильного производного формулы (XXII) с реагентом Гриньяра формулыR5-MgBr, в которой R5 является таким, как определено для формулы (IIA), дает кетон формулы (Ха), который можно превратить в соединение формулы (IIAb) по реакциям, приведенным на схеме 1. Промежуточные продукты формулы (IIB) в которой R4, R5, R11, R12 и R13 являются такими, как определено для формулы (I),можно получить, как показано на схеме реакций 4. Альдегид формулы (IV) с использованием кислоты Мельдрума и триэтиламмонийформиата можно превратить в соответствующую кислоту формулы (XXIII), как это описано, например, в публикации G.Toth et al. in Synth. Commun. 25(19), 3067-3074 (1995). Указанную кислоту можно превратить в соответствующий ацилхлорид и затем этот ацилхлорид можно in situ ввести в реакцию сN,О-диметилгидроксиламином и получить амид Вайнреба формулы (XXIV). Последующая реакция амида Вайнреба формулы (XXIV) с реагентом Гриньяра формулы R5-MgY, в которой R5 является таким, как определено для формулы (IIA), дает кетон формулы (XXVa). Альдегид формулы (XXVb) можно получить путем неполного восстановления амида Вайнреба(XXIV) с помощью LiAlH4 или DIBAL-H. Альтернативно, указанный альдегид можно получить путем окисления спирта формулы (XXVI). Подходящие окислительные реагенты включают пиридинийхлорхромат (ПХХ), реагент Сверна (оксалилхлорид/ДМСО (диметилсульфоксид, перйодинан ДессаМартина и MnO2. Подходящие растворители включают дихлорметан и ТГФ (тетрагидрофуран). Температура проведения реакции обычно находится в диапазоне от -50 до 20C. Затем производные кетонов или альдегидов формулы (XXVa) и (XXVb) можно превратить в соединения формулы (IIBa) и (IIBb) по реакциям, приведенным на схеме 1. Промежуточные продукты формулы (IIB) в которой R4, R5, R7, R11, R12 и R13 являются такими, как определено для формулы (I),можно получить, как показано на схеме реакций 5. Производные кетонов или альдегидов формулы (XXIX) можно получить путем катализируемого палладием арилирования аллиловых спиртов формулы (XXVIII) арилйодидами формулы (XXVII) в воде,как описано, например, в публикациях Hong Zhao, Ming-Zhong Cai et al. in Synth. Commun. 31(23), 36653669 (2001), Alberto Scrivanti, Ugo Matteoli et al. in Tetrahedron, 64, 543-548 (2008). Затем производные кетонов или альдегидов формулы (XXIX) можно превратить в соединения формулы (IIBc) по реакциям,приведенным на схеме 1. Соединения формулы (I) и, если это целесообразно, их таутомеры также можно, если это целесообразно, получить в форме гидратов и/или в форме, включающей другие растворители, например, те, которые могли использоваться для кристаллизации соединений, которые находятся в твердой форме. Согласно изобретению было установлено, что соединения формулы (I), предлагаемые в настоящем изобретении, с практической точки зрения обладают очень привлекательным спектром активности для защиты полезных растений от болезней, которые вызываются фитопатогенными микроорганизмами, такими как грибы, бактерии или вирусы. Настоящее изобретение относится к способу борьбы с заражением полезных растений фитопатогенными грибами или его предупреждения, в котором соединение формулы (I) наносят в качестве активного ингредиента на растения, на их части или участок их произрастания. Соединения формулы (I),предлагаемые в настоящем изобретении, отличаются превосходной активностью при низких нормах расхода, хорошо переносятся растениями, и они являются экологически безопасными. Они обладают очень полезными лечебными, предупредительными и системными характеристиками и применяются для защиты многочисленных культурных растений. Соединения формулы (I) можно использовать для подавления или уничтожения возбудителей заболеваний, находящихся на растениях или частях растений (плодах,цветках, листьях, стеблях, клубнях, корнях) различных культур полезных растений, и одновременно для защиты также и тех частей растений, которые вырастают позднее, например, от фитопатогенных микроорганизмов. Соединения формулы (I) также можно использовать в качестве протравливающих агентов для обработки материала для размножения растений, в особенности семян (плоды, клубни, зерна) и саженцев растений (например, риса), для защиты от грибковых инфекций, а также фитопатогенных грибов, встречающихся в почве. Кроме того, соединения формулы (I), предлагаемые в настоящем изобретении, можно использовать для борьбы с грибами в смежных отраслях, например, для защиты технических материалов, включая древесину и изготовленные с использованием древесины технические продукты, при хранении пищевых продуктов или при гигиенических мероприятиях. Соединения формулы (I), например, эффективны против фитопатогенных грибов следующих классов: Fungi imperfecti (например, Botrytis, Pyricularia, Helminthosporium, Fusarium, Septoria, Cercospora иAlternaria) и базидиомицеты (например, Rhizoctonia, Hemileia, Puccinia). Кроме того, они также эффективны против классов аскомицетов (например, Venturia и Erysiphe, Podosphaera, Monilinia, Uncinula) и классов оомицетов (например, Phytophthora, Pythium, Plasmopara). Обнаружена чрезвычайно высокая активность по отношению к настоящей мучнистой росе (Erysiphe spp.). Кроме того, новые соединения формулы (I) эффективны против фитопатогенных бактерий и вирусов (например, против Xanthomonasspp, Pseudomonas spp, Erwinia amylovora, а также против вируса табачной мозаики). Обнаружена хорошая активность по отношению к азиатской соевой ржавчине (Phakopsora pachyrhizi). В объеме настоящего изобретения полезные растения, подлежащие защите, обычно включают следующие виды растений: злаки (пшеница, ячмень, рожь, овес, рис, кукуруза, сорго и родственные виды); свеклу (сахарная свекла и кормовая свекла); яблоки, косточковые и ягоды (яблоки, груши, сливы, персики, миндаль, вишни, земляника, малина и черная смородина); бобовые растения (бобы, чечевица, горох,соя); масличные растения (рапс, горчица, мак, оливы, подсолнечник, кокос, клещевина, какао-бобы, земляной орех); огуречные растения (тыквы, огурцы, дыни); волокнистые растения (хлопок, лен, конопля,джут); цитрусовые фрукты (апельсины, лимоны, грейпфруты, мандарины); овощи (шпинат, латук, спаржа, капуста, морковь, луки, томаты, картофель, красный перец); лавровые (авокадо, корица, камфара) и такие растения, как табак, орехи, кофе, баклажаны, сахарный тростник, чай, перец, виноград, хмель, бананы и натуральные каучуконосные растения, а также декоративные растения. Термин "полезные растения" следует понимать как включающий и полезные растения, которым придана стойкость к гербицидам, таким как бромоксинил, или к классам гербицидов (таким как, например ингибиторы HPPD (4-гидроксифенилпируватдиоксигеназа), ингибиторы ALS (ацетолактатсинтаза),например,примисульфурон,просульфурон и трифлоксисульфурон,ингибиторы(5-енолпировилшикимат-3-фосфатсинтаза), ингибиторы GS (глутаминсинтетаза), с помощью обычных методик селекции или генной инженерии. Примером культуры, которой с помощью обычных методик селекции (мутагенеза) придана стойкость к имидазолинонам, например имазамоксу, является сурепицаClearfield (канола). Примеры культур, которым с помощью методик генной инженерии придана стойкость к гербицидам или классам гербицидов, включают сорта кукурузы, стойкие к глифосату и глуфосинату, которые имеются в продаже под торговыми названиями RoundupReady и LibertyLink. Термин "полезные растения" следует понимать как включающий и полезные растения, которые путем использования методики на основе рекомбинантной ДНК изменены таким образом, что они способны синтезировать один или большее количество оказывающих селективное воздействие токсинов, таких как, для которых известно, например, что они вырабатываются продуцирующими токсины бактериями, в особенности рода Bacillus. Примерами таких растений являются: YieldGard (сорт кукурузы, который экспрессирует токсинCryIA(b; YieldGard Rootworm (сорт кукурузы, который экспрессирует токсин CryIIIB(b1; YieldGardPlus (сорт кукурузы, который экспрессирует токсины CryIA(b) и CryIIB(b1; Starlink (сорт кукурузы,который экспрессирует токсин Cry9(c; Herculex I (сорт кукурузы, который экспрессирует токсинCryIF(a2) и фермент фосфинотрицин-N-ацетилтрансферазу (PAT) для придания стойкости к гербициду глуфосинат-аммонию); NuCOTN 33B (сорт хлопка, который экспрессирует токсин CryIA(c;Bollgard I (сорт хлопка, который экспрессирует токсин CryIA(c; Bollgard II (сорт хлопка, который экспрессирует токсин CryIA(c) и a CryIIA(b; VIPCOT (сорт хлопка, который экспрессирует токсинVIP); NewLeaf (сорт картофеля, который экспрессирует токсин CryIIIA); NatureGard Agrisure GTAdvantage (GA21, придающий стойкость к глифосату); Agrisure CB Advantage (Bt11, придающий стойкость к мотыльку кукурузному (МК и Protecta. Термин "полезные растения" следует понимать, как включающий и полезные растения, которые путем использования методики на основе рекомбинантной ДНК изменены таким образом, что они способны синтезировать оказывающие селективное воздействие противопатогенные вещества, такие как, например, так называемые "связанные с патогенезом белки" (PRP, см., например, ЕР-А-0392225). Примеры таких противопатогенных веществ и трансгенных растений, способных синтезировать такие противопатогенные вещества, приведены, например, в ЕР-А-0392225, WO 95/33818 и ЕР-А-0353191. Методики получения таких трансгенных растений обычно известны специалисту в данной области техники и описаны, например, в указанных выше публикациях. Термин "участок произрастания" полезного растения при использовании в настоящем изобретении означает участок, на котором произрастают полезные растения, на котором высеяны материалы для размножения полезных растений или на котором будут помещены в почву материалы для размножения полезных растений. Примером такого участка произрастания является поле, на котором произрастают культурные растения. Термин "материал для размножения растений" следует понимать, как означающий все генеративные части растения, такие как семена, которые можно применять для размножения последних, и вегетативный материал, такой как черенки и клубни, например картофель. Например, можно отметить семена(в строгом смысле слова), корни, плоды, клубни, луковицы, корневища, части растений. Также можно отметить проросшие растения или рассаду, которые необходимо пересадить после прорастания или появления всходов из почвы. Эту рассаду можно защитить до пересадки путем полной или частичной обработки, проводимой путем погружения. Следует понимать, что предпочтительный "материал для размножения растений" означает семена. Соединения формулы (I) можно применять в неизмененном виде или предпочтительно совместно с носителями и вспомогательными веществами, обычно применяющимися для приготовления препаратов. Поэтому настоящее изобретение также относится к композициям для борьбы с фитопатогенными грибами и защиты от них, включающим соединение формулы (I) и инертный носитель, и к способу борьбы с заражением полезных растений фитопатогенными грибами и его предупреждения, в котором композицию, включающую соединение формулы (I) в качестве активного ингредиента и инертный носитель,наносят на растения, на их части или на участок их произрастания. Для этого соединения формулы (I) и инертные носители обычно приготавливают известным образом в виде эмульгирующихся концентратов, паст для нанесения, непосредственно распрыскиваемых или разбавляемых растворов, разбавленных эмульсий, смачивающихся порошков, растворимых порошков,дустов, гранулятов, а также форм, капсулированных, например, в полимерных веществах. Как и тип композиции, методики внесения, такие как опрыскивание, атомизация, опыление, разбрасывание, нанесение слоя или полив, выбираются в соответствии с решаемыми задачами и превалирующими условиями. Композиции также могут содержать другие вспомогательные вещества, такие как стабилизаторы,противопенные вещества, регуляторы вязкости, связующие или вещества, придающие липкость, а также удобрения, источники питательных микроэлементов или другие композиции, предназначенные для обеспечения специальных эффектов. Подходящие носители и вспомогательные вещества могут быть твердыми или жидкими и являются веществами, применяющимися в технологии приготовления препаратов, например натуральные или регенерированные минеральные вещества, растворители, диспергирующие вещества, смачивающие агенты,вещества, придающие липкость, загустители, связующие или удобрения. Такие носители, например, описаны в WO 97/33890. Соединения формулы (I) или композиции, включающие соединение формулы (I) в качестве активного ингредиента и инертный носитель, можно наносить на участок произрастания растений или на обрабатываемое растение одновременно или последовательно с дополнительными соединениями. Этими дополнительными соединениями могут быть, например, удобрения или источники микроэлементов или другие препараты, которые влияют на рост растений. Ими также могут быть селективные гербициды, а также инсектициды, фунгициды, бактерициды, нематоциды, моллюскоциды или смеси нескольких из этих препаратов, при необходимости вместе с дополнительными носителями, поверхностно-активными веществами или вспомогательными веществами, улучшающими нанесение, обычно применяющимися в области приготовления препаратов. Предпочтительным способом внесения соединения формулы (I) или композиции, включающей соединение формулы (I) в качестве активного ингредиента и инертный носитель, является некорневое внесение. Частота внесения и норма расхода зависят от опасности заражения соответствующим патогеном. Однако соединения формулы (I) также могут проникать в растение через корни из почвы (системное воздействие) при дождевании участка произрастания растений жидким препаратом или при внесении соединений в почву в твердом виде, например в гранулированном виде (почвенное внесение). Под затопляемые культуры, такие как рис, такие грануляты можно вносить на залитое рисовое поле. Соединения формулы (I) также можно наносить на семена (в виде покрытия) путем пропитывания семян или клубней жидким препаратом фунгицида или нанесения на них покрытия из твердого препарата. Препарат, т.е. композицию, содержащую соединение формулы (I) и при необходимости твердое или жидкое вспомогательное вещество, готовят по известным методикам, обычно путем тщательного смешивания и/или размола соединения с наполнителями, например растворителями, твердыми носителями и необязательно поверхностно-активными веществами. Агрохимические препараты обычно содержат от 0,1 до 99 мас.%, предпочтительно от 0,1 до 95 мас.% соединения формулы (I), от 99,9 до 1 мас.%, предпочтительно от 99,8 до 5 мас.% твердого или жидкого вспомогательного вещества и от 0 до 25 мас.%, предпочтительно от 0,1 до 25 мас.% поверхностно-активного вещества. В то время как коммерческие продукты предпочтительно готовить в виде концентратов, конечный пользователь обычно будет использовать разбавленные препараты. Предпочтительные нормы расхода обычно составляют от 5 г до 2 кг активного ингредиента (АИ) на гектар (га), предпочтительно от 10 г до 1 (кг АИ)/га, наиболее предпочтительно от 20 г до 600 (г АИ)/га. При использовании в качестве средства для замачивания семян обычные дозы составляют от 10 мг до 1 г активного вещества на 1 кг семян. Норму расхода для обеспечения необходимого воздействия можно определить экспериментально. Она зависит, например, от типа воздействия, стадии развития полезного растения и от нанесения (участка, временного режима, методики внесения) и в зависимости от этих параметров меняется в широких пределах. Неожиданно было установлено, что соединения формулы (I) также можно использовать в способах защиты культур полезных растений от нашествия фитопатогенных микроорганизмов, а также для лечения культур полезных растений, зараженных фитопатогенными микроорганизмами, включающих нанесение комбинации глифосата и по меньшей мере одного соединения формулы (I) на растение или участок его произрастания, в котором растение устойчиво или чувствительно к глифосату. Указанные способы могут обеспечить неожиданное улучшение борьбы с болезнями по сравнению с использованием соединений формулы (I) при отсутствии глифосата. Указанные способы могут быть эффективными для улучшения борьбы с болезнями с помощью соединений формулы (I). Хотя смесь глифосата и по меньшей мере одного соединения формулы (I) может, по меньшей мере, частично расширить спектр болезней, с которыми проводится борьба с помощью соединения формулы (I), также может наблюдаться повышение активности воздействия соединения формулы (I) при воздействии на болезни, для которых уже известно, что они в определенной степени подавляются соединением формулы (I). Указанные способы являются особенно эффективными для борьбы с фитопатогенными микроорганизмами царства грибы, типа базидиомицеты, класса Uredinomycetes, подкласса Urediniomycetidae и отряда Uredinales (обычно называющихся ржавчинами). Виды ржавчины, особенно сильно влияющие на сельскохозяйственные культуры, включают виды семейства Phakopsoraceae, в особенности виды родаPhakopsora, например Phakopsora pachyrhizi, которая также называется азиатской соевой ржавчиной, и виды семейства Pucciniaceae, в особенности виды рода genus Puccinia, такие как Puccinia graminis, также известная, как стеблевая ржавчина или черная ржавчина, которая является опасной болезнью злаков, иPuccinia recondita, также известная, как бурая ржавчина. Соединения по изобретению могут использоваться в способе защиты культур полезных растений от нашествия фитопатогенных микроорганизмов и/или лечения культур полезных растений, зараженных фитопатогенными микроорганизмами, указанный способ включает одновременное нанесение глифосата,включая его соли или сложные эфиры, и по меньшей мере одного соединения формулы (I), которое обладает активностью по отношению к фитопатогенным микроорганизмам, по меньшей мере на один объект, выбранный из группы, включающей растение, часть растения и участок произрастания растения. Соединения формулы (I) или их фармацевтические соли, описанные выше, также могут обладать спектром активности, подходящим для лечения и/или предупреждения микробной инфекции у животного. "Животным" может быть любое животное, например насекомое, млекопитающее, рептилия, рыба,амфибия, предпочтительно млекопитающее, наиболее предпочтительно человек. "Лечение" означает применение к животному, у которого имеется микробная инфекция, для уменьшения, или ослабления,или остановки усиления или распространения инфекции, или для ослабления инфекции, или для устранения инфекции. "Предупреждение" означает применение к животному, у которого отсутствуют видимые признаки микробной инфекции, для предупреждения какой-либо будущей инфекции, или для уменьшения, или ослабления усиления, или распространения какой-либо будущей инфекции. Соединения по изобретению могут использоваться для приготовления лекарственного средства,предназначенного для лечения и/или предупреждения микробной инфекции у животного. Соединения по изобретению могут использоваться в качестве лекарственного средства. Соединения по изобретению могут использоваться в качестве противомикробного средства для лечения животного. Соединения по изобретению могут использоваться в фармацевтической композиции, включающей в качестве активного ингредиента соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый разбавитель или носитель. Эту композицию можно применять для лечения и/или предупреждения микробной инфекции у животного. Эта фармацевтическая композиция может находиться в форме, подходящей для перорального введения, такой как таблетка, лепешки, твердые капсулы, водные суспензии, масляные суспензии, эмульсии, диспергирующиеся порошки, диспергирующиеся гранулы, сиропы и эликсиры. Альтернативно, эта фармацевтическая композиция может находиться в форме, подходящей для местного нанесения, такой как спрей, крем или лосьон. Альтернативно, эта фармацевтическая композиция может находиться в форме, подходящей для парентерального введения, например инъекции. Альтернативно, эта фармацевтическая композиция может находиться в форме, подходящей для ингаляции, такой как распыляемый аэрозоль. Соединения формулы (I) могут быть эффективны для борьбы с микроорганизмами разных видов,которые могут привести к микробной инфекции у животного. Примерами таких видов микроорганизмов являются те, которые вызывают аспергиллез, такие как Aspergillus fumigatus, A.flavus, A.terrus, A.nidulans и A.niger, которые вызывают бластомикоз, такие как Blastomyces dermatitidis, которые вызывают кандидоз, такие как Candida albicans, С.glabrata, С.tropicalis, С.parapsilosis, С.krusei и С.lusitaniae, которые вызывают кокцидиоидомикоз, такие как Coccidioides immitis, которые вызывают криптококкоз, такие какCryptococcus neoformans, которые вызывают гистоплазмоз, такие как Histoplasma capsulatum, и которые вызывают зиготомикоз, такие как Absidia corymbifera, Rhizomucor pusillus и Rhizopus arrhizus. Другими примерами являются Fusarium Spp, такие как Fusarium oxysporum и Fusarium solani, и Scedosporium Spp,такие как Scedosporium apiospermum и Scedosporium prolificans. Дополнительными примерами являютсяMicrosporum Spp, Trichophyton Spp, Epidermophyton Spp, Mucor Spp, Sporothorix Spp, Phialophora Spp,Cladosporium Spp, Petriellidium spp, Paracoccidioides Spp и Histoplasma Spp. Приведенные ниже неограничивающие примеры более подробно иллюстрируют настоящее изобретение, описанное выше, не налагая на него ограничения. Примеры получения Пример Р 1. Получение [2-(4-хлорфенил)-1-метилэтил]метоксиамида 3-дифторметил-1-метил-1 Нпиразол-4-карбоновой кислоты (соединение 1.001): Раствор 3-дифторметил-1-метил-1 Н-пиразол-4-карбонилхлорида (564 мг, 2,9 ммоль) в дихлорметане (5 мл) при 0C при перемешивании по каплям добавляли к раствору N-[2-(4-хлорфенил)-1-метилэтил]О-метилгидроксиламина (600 мг, 2,9 ммоль), полученного, как описано в примере Р 13, и триэтиламина(0,80 мл, 5,8 ммоль) в дихлорметане (10 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 6 ч. Реакционную смесь промывали 1 М раствором NaOH (20 мл), 1 М раствором HCl (20 мл), рассолом (20 мл) и затем сушили над Na2SO4. После удаления растворителя остаток очищали с помощью флэш-хроматографии на силикагеле (элюент: циклогексан/этилацетат 1:1). Получали 0,99 г (93,4% от теоретического значения) [2-(4-хлорфенил)-1-метилэтил]метоксиамида 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты (соединение 1.001) в виде смолообразного вещества. 1 Н ЯМР (CDCl3, 400 МГц):1,33-1,37 (d, 3H), 2,77-2,82 (dd, 1H), 3,07-3,13 (dd, 1H), 3,64 (s, 3H), 3,94(5 мл) при 0C при перемешивании по каплям добавляли к раствору N-[2-(2,4-дихлорфенил)-1 метилэтил]-О-метилгидроксиламина (1,0 г, 4,27 ммоль), полученного, как описано в примере Р 14, и триэтиламина (0,90 мл, 6,4 ммоль) в дихлорметане (7 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 1,5 ч. Реакционную смесь промывали 1 М раствором NaOH (20 мл),1 М раствором HCl (20 мл), рассолом (20 мл) и затем сушили над Na2SO4. После удаления растворителя остаток очищали с помощью флэш-хроматографии на силикагеле (элюент: гексан/этилацетат 7:3). Получали 1,35 г (80,3% от теоретического значения) [2-(2,4-дихлорфенил)-1-метилэтил]метоксиамида 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты (соединение 1.002) в виде белого твердого вещества. Т.пл.: 98-102C. 1 Н ЯМР (CDCl3, 400 МГц):1,41-1,46 (d, 3H), 2,99-3,04 (dd, 1H), 3,17-3,23 (dd, 1H), 3,60 (s, 3H), 3,95 К раствору О-метил-N-[1-метил-2-(2,4,6-трихлорфенил)этил]гидроксиламина (0,65 г, 2,4 ммоль),полученного, как описано в примере P15d, в дихлорметане (5 мл) добавляли триэтиламин (0,844 мл,6,0 ммоль), затем при 0C по каплям добавляли раствор 3-дифторметил-1-метил-1 Н-пиразол-4 карбонилхлорида (0,519 г, 2,67 ммоль) в дихлорметане. После завершения добавления хлорангидрида кислоты смесь перемешивали при температуре окружающей среды в течение 18 ч. После завершения реакции (по данным ТСХ) (тонкослойная хроматография) реакционную смесь разбавляли водой и экстрагировали дихлорметаном (360 мл). Объединенные слои, содержащие дихлорметан, промывали 2 н. раствором HCl, затем насыщенным раствором NaHCO3, затем водой и в заключение рассолом, затем сушили над сульфатом натрия и растворитель выпаривали. Полученную неочищенную смесь очищали с помощью колоночной хроматографии с использованием силикагеля с частицами размером 60-120 мкм и продукт собирали при использовании в качестве элюента 30% этилацетата в гексане и получали метокси[1-метил-2-(2,4,6-трихлорфенил)этил]амид 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты(0,51 г, 49%) в виде почти белого твердого вещества. Раствор 3-дифторметил-1-метил-1H-пиразол-4-карбонилхлорида (797 мг, 4,1 ммоль) в дихлорметане (5 мл) при 0C при перемешивании по каплям добавляли к раствору N-2-[4-(4-хлорфенокси)фенил]1-метилэтил-О-метилгидроксиламина (1,2 г, 4,1 ммоль), полученного, как описано в примере Р 16, и триэтиламина (1,10 мл, 8,2 ммоль) в дихлорметане (10 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение ночи. После удаления растворителя остаток очищали с помощью флэш-хроматографии на силикагеле (элюент: циклогексан/этилацетат 1:1). Получали 1,2 г (66% от теоретического значения) 2-[4-(4-хлорфенокси)фенил]-1-метилэтилметоксиамида 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты (соединение 1.015) в виде масла. 1 Раствор 3-дифторметил-1-метил-1 Н-пиразол-4-карбонилхлорида (2,10 г, 11,0 ммоль) в дихлорметане (5 мл) при 0C при перемешивании по каплям добавляли к суспензии N-[2-(2,4-дихлорфенил)-1 метилэтил]гидроксиламина (2,0 г, 9,10 ммоль), полученного, как описано в примере Р 17, и триэтиламина(3,10 мл, 22 ммоль) в дихлорметане (15 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь выливали в 1 М раствор HCl (50 мл), экстрагировали дихлорметаном (320 мл) и затем сушили над Na2SO4. После удаления растворителя остаток (5,08 г) очищали с помощью флэш-хроматографии на силикагеле (элюент: циклогексан/этилацетат 7:3). Получали 1,51 г (43,8% от теоретического значения) [2-(2,4-дихлорфенил)-1-метилэтил]гидроксиамида 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты (соединение 1.028) в виде белого твердого вещества. Т.пл.: 162-167C. 1(5 мл) при 0C при перемешивании по каплям добавляли к раствору N-[2-(2,4-дихлорфенил)-1 метилэтил]-О-этилгидроксиламина (1,0 г, 4,0 ммоль), полученного, как описано в примере Р 18, и триэтиламина (0,82 мл, 6,0 ммоль) в дихлорметане (7 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 1,5 ч. Реакционную смесь промывали 1 М раствором NaOH (20 мл),1 М раствором HCl (20 мл), рассолом (20 мл) и затем сушили над Na2SO4. После удаления растворителя остаток очищали с помощью флэш-хроматографии на силикагеле (элюент: гексан/этилацетат 7:3). Получали 0,75 г (45,7% от теоретического значения) [2-(2,4-дихлорфенил)-1-метилэтил]этоксиамида 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты (соединение 1.031) в виде белого твердого вещества. Т.пл.: 116-118C. К раствору О-этил-N-[1-метил-2-(2,4,6-трихлорфенил)этил]гидроксиламина (0,5 г, 1,63 ммоль) в дихлорметане (5 мл) добавляли триэтиламин (0,566 мл, 4,07 ммоль), затем по каплям добавляли раствор 3-дифторметил-1-метил-1 Н-пиразол-4-карбонилхлорида (0,34 г, 1,79 ммоль) в дихлорметане при температуре, равной 0C. После завершения добавления хлорангидрида кислоты смесь перемешивали при температуре окружающей среды в течение 18 ч. После завершения реакции (по данным ТСХ) реакционную смесь разбавляли водой и экстрагировали дихлорметаном (360 мл). Объединенные слои, содержащие дихлорметан, промывали 2 н. раствором HCl, затем насыщенным раствором NaHCO3, затем водой и в заключение рассолом, сушили над сульфатом натрия и растворитель выпаривали при пониженном давлении. Полученную неочищенную смесь очищали с помощью колоночной хроматографии с использованием силикагеля с частицами размером 60-120 мкм и продукт собирали при использовании в качестве элюента 30% этилацетата в гексане и получали этокси[1-метил-2-(2,4,6-трихлорфенил)этил]амид 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты (0,390 г, 50%) в виде почти белого твердого вещества. Т.пл.: 111-114C 1 Н ЯМР (400 МГц, CDCl3):1,20-1,24 (t, 3H), 1,35-1,37 (d, 3H), 3,23-3,28 (dd, 1H), 3,33-3,38 (dd, 1H),3,84-3,88 (q, 2H), 3,96 (s, 3H), 4,86-4,91 (m, 1H), 7,01-7,5 (t, 1H), 7,28 (s, 2H), 7,83 (s, 1H).(5 мл) при 0C при перемешивании по каплям добавляли к раствору N-[2-(2,4-дихлорфенил)-1 метилэтил]-О-изопропилгидроксиламина (1,5 г, 5,7 ммоль), полученного, как описано в примере Р 20, и триэтиламина (1,6 мл, 11,4 ммоль) в дихлорметане (10 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение ночи. После удаления растворителя остаток очищали с помощью флэш-хроматографии на силикагеле (элюент: циклогексан/этилацетат 7:3). Получали 1,30 г (54% от теоретического значения) [2-(2,4-дихлорфенил)-1-метилэтил]изопропоксиамида 3-дифторметил-1-метил 1 Н-пиразол-4-карбоновой кислоты (соединение 1.033) в виде желтого масла. 1 Раствор 3-дифторметил-1-метил-1 Н-пиразол-4-карбонилхлорида (2,20 г, 11,0 ммоль) в дихлорметане (10 мл) при 0C при перемешивании по каплям добавляли к раствору N-[2-(2,4-дихлорфенил)пентил]О-метилгидроксиламина (3,0 г, 11,0 ммоль), полученного, как описано в примере Р 22, и триэтиламина(3,0 мл, 22 ммоль) в дихлорметане (20 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 6 ч. После удаления растворителя остаток очищали с помощью флэшхроматографии на силикагеле (элюент: циклогексан/этилацетат 1:1). Получали 3,85 г (83% от теоретического значения) [2-(2,4-дихлорфенил)пентил]метоксиамида 3-дифторметил-1-метил-1 Н-пиразол-4- 14020376 К раствору О-метил-N-[1-метил-3-(2,4,6-трихлорфенил)пропил]гидроксиламина (0,6 г, 2,1 ммоль),полученного, как описано в примере P23d, в дихлорметане (6 мл), добавляли триэтиламин (0,73 мл,5,2 ммоль), затем при 0C по каплям добавляли раствор 3-дифторметил-1-метил-1 Н-пиразол-4 карбонилхлорида (0,415 г, 2,1 ммоль) в дихлорметане. После завершения добавления хлорангидрида кислоты реакционную смесь перемешивали при температуре окружающей среды в течение 18 ч. После завершения реакции (по данным ТСХ) реакционную смесь разбавляли водой и экстрагировали дихлорметаном (360 мл). Объединенные слои, содержащие дихлорметан, промывали 2 н. раствором HCl, затем насыщенным раствором NaHCO3, затем водой и в заключение рассолом, сушили над сульфатом натрия и растворитель выпаривали при пониженном давлении. Полученную неочищенную смесь очищали с помощью колоночной хроматографии с использованием силикагеля с частицами размером 60-120 мкм и продукт собирали при использовании в качестве элюента 30% этилацетата в гексане и получали метокси[1-метил-3-(2,4,6-трихлорфенил)пропил]амид 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты (0,53 г, 57%) в виде смолообразного вещества. Физические характеристики: 1 Н ЯМР (CDCl3, 400 МГц):1,41 (d, 3H, CH3), 1,71-1,80 (m, 1H, CH2),1,94-2,04 (m, 1H, CH2), 1,87-1,92 (m, 2H, CH2), 3,78 (s, 3H, CH3), 3,98 (s, 3H, CH3), 4,66-4,71 (m, 1H, CH),7,11 (t, 1H, CHF2), 7,28 (s, 2H, Ar-H), 7,88 (s, 1H, H пиразола). При перемешивании к раствору О-метил-N-[3-(2,4,6-трихлорфенил)пропил]гидроксиламина (0,35 г,1,3 ммоль), полученного, как описано в примере Р 24 с, в дихлорметане (5 мл), при температуре, равной 0C, медленно добавляли триэтиламин (0,55 мл, 3,9 ммоль) раствора 3-дифторметил-1-метил-1 Нпиразол-4-карбонилхлорида в дихлорметане (2 мл). После завершения добавления хлорангидрида кислоты смесь перемешивали при температуре окружающей среды в течение еще 3 ч. После завершения реакции (по данным ТСХ) реакционную смесь разбавляли водой и экстрагировали дихлорметаном (360 мл). Объединенные слои, содержащие дихлорметан, промывали 2 н. раствором HCl, затем насыщенным раствором NaHCO3, затем водой и в заключение рассолом. Затем органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученную неочищенную смесь очищали с помощью колоночной хроматографии (силикагель с частицами размером 60-120 мкм, 26% этилацетата в гексане) и получали метокси[3-(2,4,6-трихлорфенил)пропил]амид 3-дифторметил-1-метил 1 Н-пиразол-4-карбоновой кислоты (0,5 г, 91%) в виде белого кристаллического твердого вещества. Т.пл.: 95-96C. Физические характеристики: 1 Н ЯМР (CDCl3, 400 МГц):1,89-1,96 (m, 2H, CH2), 2,91-2,95 (m, 2H,CH2), 3,66 (s, 3H, CH3), 3,83-3,86 (t, 2H, CH2), 3,97 (s, 3H, CH3), 7,31 (t, 1H, CHF2), 7,28 (s, 2H, Ar-H), 7,89(5 мл) при 0C при перемешивании по каплям добавляли к раствору N-[3-(4-трет-бутилфенил)-2 метилпропил]-О-метилгидроксиламина (1,0 г, 4, 2 ммоль), полученного, как описано в примере Р 25, и триэтиламина (0,86 мл, 6,3 ммоль) в дихлорметане (7 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 1,5 ч. Реакционную смесь промывали 1 М раствором NaOH (20 мл),1 М раствором HCl (20 мл), рассолом (20 мл) и затем сушили над Na2SO4. После удаления растворителя остаток очищали с помощью флэш-хроматографии на силикагеле (элюент: гексан/этилацетат 7:3). Получали 0,59 г (35,3% от теоретического значения) [3-(4-трет-бутилфенил)-2-метилпропил]метоксиамида 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты (соединение 2.057) в виде смолообразного вещества. 1 Н ЯМР (CDCl3, 400 МГц):0,90-0,95 (d, 3H), 1,30 (s, 9H), 2,24-2,36 (m, 1H), 2,39-2,45 (dd, 1H), 2,672,72 (dd, 1H), 3,58 (s, 3H), 3,68-3,70 (d, 2H), 3,98 (s, 3H), 7,09-7,11 (d, 2H), 7,15-7,42 (m, 3H), 7,90 (s, 1H). Раствор 1-(4-хлорфенил)пропан-2-она (8,5 г, 50,4 ммоль) в метаноле (100 мл) обрабатывали пиридином (5,2 мл, 62 ммоль), затем О-метилгидроксиламингидрохлоридом (5,20 г, 62 ммоль). Полученную смесь перемешивали при 23C в течение 16 ч. Реакционную смесь выливали в воду (200 мл) и экстрагировали дихлорметаном (350 мл). Органические слои промывали рассолом и сушили над безводнымNa2SO4. После удаления растворителя остаток очищали с помощью флэш-хроматографии на силикагеле Раствор 1-(4-хлорфенил)пропан-2-он-О-метилоксима (1,0 г, 5,1 ммоль) в уксусной кислоте (7,6 мл) при 10C обрабатывали цианоборогидридом натрия (641 мг, 10,2 ммоль), который добавляли в течение 10 мин небольшими порциями, и полученный раствор перемешивали при 24C в течение 5 ч. Растворитель выпаривали при пониженном давлении (дважды выпаривали вместе с толуолом) и остаток диспергировали в воде и 1 М раствором NaOH значение рН доводили до 9. Водную фазу экстрагировали дихлорметаном (220 мл), промывали рассолом и сушили над безводным Na2SO4. После удаления растворителя (100 мбар, 45C) остаток (910 мг) очищали с помощью флэш-хроматографии на силикагеле (элюент: циклогексан/этилацетат 9:1). Получали 830 мг (82% от теоретического значения)(50 мл) обрабатывали ацетатом натрия (5,9 г, 0,0720 моль), затем 1-(2,4-дихлорфенил)пропан-2-оном(10 г, 0,0496 моль) и полученную смесь перемешивали при 23C в течение 4 ч. Затем реакционную смесь разбавляли этилацетатом, промывали рассолом и сушили над безводным Na2SO4. Растворитель выпаривали при пониженном давлении (100 мбар, 45C). Получали 13,5 г (100% от теоретического значения) неочищенного 1-(2,4-дихлорфенил)пропан-2-он-О-метилоксима в виде прозрачной жидкости, которую использовали на следующей стадии без дополнительной очистки. 1(100 мл) при 10C обрабатывали цианоборогидридом натрия (5,41 г, 0,0862 моль), который добавляли в течение 15 мин небольшими порциями, и полученный раствор перемешивали при 24C в течение 6 ч. Растворитель выпаривали при пониженном давлении (дважды выпаривали вместе с толуолом) и остаток диспергировали в воде и 1 М раствором NaOH значение рН доводили до 9. Водную фазу экстрагировали дихлорметаном (2100 мл), промывали рассолом и сушили над безводным Na2SO4. Растворитель выпаривали при пониженном давлении (100 мбар, 45C). Получали 8,13 г (81,3% от теоретического значения) неочищенного N-[2-(2,4-дихлорфенил)-1-метилэтил]-О-метилгидроксиламин в виде прозрачной жидкости, которую использовали на следующей стадии без дополнительной очистки. 1 Н ЯМР (CDCl3, 400 МГц):1,04-1,09 (d, 3H), 2,66-2,71 (dd, 1H), 2,93-2,99 (dd, 1H), 3,25-3,33 (m,1H), 3,52 (s, 3H), 5,2-5,4 (sbr, 1H), 7,17-7,18 (m, 2H), 7,35 (d, 1H).(16,75 г, 217 ммоль) в уксусной кислоте (76 мл, 4 об.) при температуре, равной 0C, по каплям добавляли нитроэтан (45,1 мл, 625 моль). Реакционную смесь перемешивали при температуре, равной 100C, в течение 90 мин. После завершения реакции (по данным ТСХ) реакционной смеси давали охладиться до температуры окружающей среды и ее разбавляли охлажденной льдом водой (700 мл), затем водный слой экстрагировали этилацетатом (350 мл). Объединенные слои, содержащие этилацетат, промывали насыщенным раствором бикарбоната натрия до нейтральной реакции, затем водой, затем промывали рассолом и сушили над безводным Na2SO4, затем растворители полностью выпаривали. Полученную неочищенную смесь очищали с помощью колоночной хроматографии с использованием силикагеля с частицами размером 60-120 мкм и продукт собирали при использовании в качестве элюента 1% этилацетата в гексане и получали 1,3,5-трихлор-2-Е)-2-нитропропенил)бензол (15 г, 61%). 1 Н ЯМР (400 МГц, CDCl3):2,10 (s, 3H, CH3), 7,24 (s, 2H, Ar-H), 7,77 (s, 1H, CH). При перемешивании к раствору полученного выше нитростирола (5 г, 18,72 ммоль) в воде (20 мл) и метаноле (60 мл) в атмосфере азота при температуре окружающей среды добавляли порошкообразное железо (2,355 г, 42,12 ммоль), затем концентрированную HCl (11,5 мл, 112 моль). Реакционную смесь перемешивали при 70C в течение 1 ч. Через 1 ч к этой реакционной смеси добавляли оставшееся количество порошкообразного железа (2,355 г, 42,12 ммоль) и концентрированной HCl (11,5 мл, 112 моль) и перемешивание продолжали при 70C в течение 2 ч. После завершения реакции (по данным ТСХ) реакционную смесь охлаждали до температуры окружающей среды и метанол удаляли в роторном испарителе. Полученный остаток затем разбавляли водой и экстрагировали этилацетатом (380 мл). В заключение объединенные слои, содержащие этилацетат, промывали водой, затем промывали рассолом и сушили над безводным сульфатом натрия, затем растворители полностью выпаривали. Полученную неочищенную смесь очищали с помощью колоночной хроматографии с использованием силикагеля с частицами размером 60-120 мкм и продукт собирали при использовании в качестве элюента 5% этилацетата в гексане и получали 1-(2,4,6-трихлорфенил)пропан-2-он (3,7 г, 83,3%). 1 Н ЯМР (400 МГц, CDCl3):2,26 (s, 3H, CH3), 4,05 (s, 2H, CH2), 7,34 (s, 2H, Ar-H). с) Получение 1-(2,4,6-трихлорфенил)пропан-2-он-О-метилоксима: Раствор О-метилгидроксиламингидрохлорида (0,79 г, 9,4 ммоль) в метаноле (20 мл) обрабатывали триэтиламином (1,32 мл, 9,4 ммоль), затем 1-(2,4,6-трихлорфенил)пропан-2-оном (1,5 г, 6,31 ммоль). Полученную смесь перемешивали при 60C в течение 3 ч. Реакцию останавливали водой и метанол выпари- 17020376 вали. Полученную водную смесь экстрагировали этилацетатом (350 мл). Объединенные органические слои промывали рассолом и сушили над безводным Na2SO4. Растворитель выпаривали при пониженном давлении (100 мбар, 45C). Полученную неочищенную смесь очищали с помощью колоночной хроматографии с использованием силикагеля с частицами размером 60-120 мкм и продукт собирали при использовании в качестве элюента 2% этилацетата в гексане и получали 1-(2,4,6-трихлорфенил)пропан-2-он-Ометилоксим (1,2 г, 76%), который затем вводили в реакцию восстановления. При перемешивании к раствору полученного выше 1-(2,4,6-трихлорфенил)пропан-2-он-Ометилоксима (1,2 г, 4,51 ммоль) в 12 мл уксусной кислоты, добавляли цианоборогидрид натрия (0,568,9 моль). Реакционную смесь перемешивали при температуре окружающей среды в течение 6 ч. После завершения реакции (по данным ТСХ) растворитель выпаривали при пониженном давлении (дважды выпаривали вместе с толуолом). Полученный остаток разбавляли водой и 2 н. раствором гидроксида натрия значение рН доводили до 9, затем экстрагировали этилацетатом (350 мл). Объединенный органический слой промывали рассолом, затем сушили над безводным сульфатом натрия, затем растворитель выпаривали. Полученную неочищенную смесь очищали с помощью колоночной хроматографии с использованием силикагеля с частицами размером 60-120 мкм и продукт собирали при использовании в качестве элюента 5% этилацетата в гексане и получали О-метил-N-[1-метил-2-(2,4,6 трихлорфенил)этил]гидроксиламин (0,91 г, 75%). 1 Н ЯМР (400 МГц, CDCl3):0,91-0,93 (d, 3H), 2,72-2,77 (dd, 1H), 2,98-3,03 (dd, 1H), 3,25-3,30 (m,1 Н), 3,93 (s, 3H), 7,15 (s, 2H). Пример Р 16. Получение N-2-[4-(4-хлорфенокси)фенил]-1-метилэтил-О-метилгидроксиламина. а) Получение 1-[4-(4-хлорфенокси)фенил]пропан-2-он-О-метилоксима: Раствор 1-[4-(4-хлорфенокси)фенил]пропан-2-она (10,0 г, 38 моль) в метаноле (65 мл) обрабатывали О-метилгидроксиламингидрохлоридом (3,90 г, 47 моль), затем пиридином (4,0 мл, 47 моль). Полученную смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь выливали в воду (150 мл) и экстрагировали дихлорметаном (350 мл). Органические слои промывали рассолом и сушили над безводным Na2SO4. Получали 11,0 г (100% от теоретического значения) неочищенного 1-[4(4-хлорфенокси)фенил]пропан-2-он-О-метилоксима в виде желтой жидкости, которую использовали на следующей стадии без дополнительной очистки. 1 Н ЯМР (CDCl3, 400 МГц):1,73+1,81 (2s, 3H), 3,44+3,65 (2s, 2H), 3,88+3,89 (2s, 3H), 6,89-6,94 (m,4H), 7,15-7,28 (m, 4H). Раствор неочищенного 1-[4-(4-хлорфенокси)фенил]пропан-2-он-О-метилоксима (6,0 г, 20,7 ммоль) в уксусной кислоте (50 мл) при 10C обрабатывали цианоборогидрид натрия (2,6 г, 41,4 ммоль), который добавляли в течение 10 мин небольшими порциями, и полученный раствор перемешивали при 23C в течение 3,5 ч. Растворитель выпаривали при пониженном давлении (дважды выпаривали вместе с толуолом) и остаток диспергировали в воде и 1 М раствором NaOH значение рН доводили до 11. Водную фазу экстрагировали дихлорметаном (220 мл), промывали рассолом и сушили над безводным Na2SO4. После удаления растворителя (100 мбар, 45C) остаток (7,17 г) очищали с помощью флэш-хроматографии на силикагеле (элюент: циклогексан). Получали 3,91 г (65% от теоретического значения) Раствор 1-(2,4-дихлорфенил)пропан-2-она (3,46 г, 16,7 ммоль) в метаноле (40 мл) обрабатывали гидроксиламингидрохлоридом (1,40 г, 20,6 ммоль), затем пиридином (1,7 мл, 20,6 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь выливали в воду (200 мл). Твердый продукт собирали фильтрованием, промывали водой и сушили (40C,100 мбар). Получали 3,63 г (100% от теоретического значения) 1-(2,4-дихлорфенил)пропан-2-оноксима в виде белого твердого вещества. Т.пл.: 120-124C. 1 Н ЯМР (CDCl3, 400 МГц):1,86 (s, 3H), 3,61 (s, 2H), 7,12-7,21 (m, 2H), 7,39-7,41 (d, 1H), 8,2 (sbr,1H). Раствор 1-(2,4-дихлорфенил)пропан-2-оноксима (3,3 г, 15,1 ммоль) в уксусной кислоте (30 мл) при 10C обрабатывали цианоборогидридом натрия (1,90 г, 30,3 ммоль), который добавляли в течение 10 мин небольшими порциями, и полученный раствор перемешивали при 23C в течение 5 ч. Растворитель выпаривали при пониженном давлении (дважды выпаривали вместе с толуолом) и остаток диспергировали в воде и 1 М раствором NaOH значение рН доводили до 10. Водную фазу экстрагировали дихлорметаном(320 мл), промывали рассолом и сушили над безводным Na2SO4. После удаления растворителя(100 мбар, 45C) получали 3,18 г (96% от теоретического значения) N-[2-(2,4-дихлорфенил)-1 метилэтил]гидроксиламина в виде белого твердого вещества. Т.пл.: 83-86C. 1 Н ЯМР (CDCl3, 400 МГц):1,08-1,11 (d, 3H), 2,69-2,74 (dd, 1H), 2,98-3,03 (dd, 1H), 3,24-3,32 (m,1H), 5,3-5,6 (sbr, 1H), 7,8-7,19 (m, 2H), 7,39 (m, 1H), 7,5-8,2 (sbr, 1H).(50 мл) обрабатывали ацетатом натрия (2,95 г, 72 ммоль), затем 1-(2,4-дихлорфенил)пропан-2-оном (5 г,24,8 ммоль) и полученную смесь перемешивали при 23C в течение 4 ч. Затем реакционную смесь разбавляли этилацетатом, промывали рассолом и сушили над безводным Na2SO4. Растворитель выпаривали при пониженном давлении (90 мбар, 45C). Получали 6,0 г (99% от теоретического значения) неочищенного 1-(2,4-дихлорфенил)пропан-2-он-О-этилоксима в виде прозрачной жидкости, являющейся смесьюE/Z-изомеров, которую использовали на следующей стадии без дополнительной очистки. 1 Н ЯМР (CDCl3, 400 МГц):1,23-1,28 (2t, 3H), 1,74+1,76 (2s, 3H), 3,60+3,78 (2s, 3H), 4,09-4,16 (2q,2H), 7,12-7,19 (m, 2H), 7,38 (d, 1H). МС [М+Н]+ 246/248/250.(100 мл) при 10C обрабатывали цианоборогидридом натрия (5,41 г, 0,0862 моль), который добавляли в течение 10 мин небольшими порциями, и полученный раствор перемешивали при 24C в течение 6 ч. Растворитель выпаривали при пониженном давлении (дважды выпаривали вместе с толуолом) и остаток диспергировали в воде и 1 М раствором NaOH значение рН доводили до 9. Водную фазу экстрагировали дихлорметаном (2100 мл), промывали рассолом и сушили над безводным Na2SO4. Растворитель выпа- 19020376 ривали при пониженном давлении (100 мбар, 45C). Получали 5,09 г (51% от теоретического значения) неочищенного N-[2-(2,4-дихлорфенил)-1-метилэтил]-О-этилгидроксиламин в виде прозрачной жидкости,которую использовали на следующей стадии без дополнительной очистки. 1 Н ЯМР (CDCl3, 400 МГц):0,98-1,02+1,08-1,12 (2d, 3H), 1,13-1,18 (2t, 3H), 2,63-2,68+2,70-2,78 Раствор 1-(2,4-дихлорфенил)пропан-2-она (5,1 г, 25,0 ммоль) в метаноле (45 мл) обрабатывали О-изопропилгидроксиламингидрохлоридом (3,50 г, 31 ммоль), затем пиридином (2,6 мл, 31 ммоль) и полученную смесь перемешивали при 23C в течение ночи. Реакционную смесь выливали в воду (100 мл) и экстрагировали дихлорметаном (350 мл). Органические слои промывали рассолом и сушили над безводным Na2SO4. Растворитель выпаривали при пониженном давлении (90 мбар, 45C). Получали 6,48 г(99% от теоретического значения) неочищенного 1-(2,4-дихлорфенил)пропан-2-он-О-изопропилоксима в виде прозрачной жидкости, являющейся смесью E/Z-изомеров, которую использовали на следующей стадии без дополнительной очистки. 1 Н ЯМР (CDCl3, 400 МГц):1,23-1,26 (d, 6H), 1,74 (s, 3H), 3,60+3,78 (2s, 3H), 4,25-4,38 (2m, 1H),7,14-7,21 (m, 2H), 7,39 (d, 1H).(40 мл) при 10C обрабатывали цианоборогидридом натрия (2,90 г, 46 моль), который добавляли в течение 15 мин небольшими порциями, и полученный раствор перемешивали при 24C в течение 4 ч. Растворитель выпаривали при пониженном давлении (дважды выпаривали вместе с толуолом) и остаток диспергировали в воде и 1 М раствором NaOH значение рН доводили до 10. Водную фазу экстрагировали дихлорметаном (280 мл), промывали рассолом и сушили над безводным Na2SO4. Растворитель выпаривали при пониженном давлении (100 мбар, 45C). Получали 5,90 г (98% от теоретического значения) неочищенного N-[2-(2,4-дихлорфенил)-1-метилэтил]-О-изопропилгидроксиламина в виде прозрачной жидкости, которую использовали на следующей стадии без дополнительной очистки. 1 Н ЯМР (CDCl3, 400 МГц):1,03-1,07 (d, 3H), 1,13-1,19 (m, 6H), 2,61-2,68+2,94-3,03 (2dd, 2H), 3,213,31 (m, 1H), 3,78-3,84 (m, 1H), 5,2 (sbr, 1H), 7,14-7,18 (m, 2H), 7,35-7,36 (m, 1H).(100 мл) в атмосфере азота при 0C в течение 15 мин медленно добавляли тионилхлорид (6,07 мл,85,1 ммоль), затем каталитическое количество ДМФ (диметилформамид). Реакционную смесь перемешивали при температуре окружающей среды в течение 3 ч. Реакцию останавливали с помощью 50 мл воды, водный слой экстрагировали с помощью ДХМ (дихлорметан) (3100 мл). Объединенный органический слой промывали 5% раствором бикарбоната натрия (250 мл), затем рассолом (50 мл) и сушили над безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении. Получали 10,9 г(100% от теоретического значения) 1,3,5-трихлор-2-хлорметилбензола в виде белого твердого вещества. 1 Н ЯМР (CDCl3, 400 МГц):7,37 (2 Н, s), 4,82 (2 Н, s). Масс-спектр: М = 229,8.(45 мл) при температуре окружающей среды добавляли раствор NaCN (3,20, 67,0 ммоль) в воде (15 мл). Реакционную смесь кипятили с обратным холодильником в течение 4 ч до завершения реакции. Этанол выпаривали и реакционную смесь разбавляли водой (50 мл). Водный слой экстрагировали с помощьюEtOAc (3100 мл). Объединенный органический слой промывали рассолом (30 мл) и сушили над сульфатом натрия. Органический слой концентрировали в вакууме и получали белое твердое вещество. Неочищенный продукт очищали с помощью хроматографии на колонке с силикагелем и получали 9,0 г (75% от теоретического значения) (2,4,6-трихлорфенил)ацетонитрила. 1 Н ЯМР (CDCl3, 400 МГц):7,41 (s, 2 Н), 3,97 (s, 2H). Масс-спектр: М = 218,9. с) Получение (2,4,6-трихлорфенил)ацетальдегида: При перемешивании к холодному (-70C) раствору (2,4,6-трихлорфенил)ацетонитрила (5,7 г,26,0 ммоль) в толуоле (120 мл) в атмосфере N2 в течение 30 мин по каплям добавляли DIBAL-H (28,1 мл 1 М раствор в ТГФ, 28,6 ммоль). Реакционную смесь перемешивали при -70C в течение 3 ч. После завершения реакции ее останавливали при -40C путем проводимого по каплям добавления HCl (60 мл, 2 н. раствор) и смесь выдерживали при температуре окружающей среды в течение 30 мин. Слой, содержащий толуол, отделяли и водный слой экстрагировали этилацетатом (3100 мл). Объединенный органический слой промывали рассолом (30 мл) и сушили над сульфатом натрия. Органический слой концентрировали в вакууме. Получали 4,5 г (78% от теоретического значения) (2,4,6-трихлорфенил)ацетальдегида в виде белого твердого вещества. 1 Раствор 2-(4-хлорфенил)пентаналя (43,0 ммоль) в метаноле (75 мл) обрабатывали О-метилгидроксиламингидрохлоридом (4,40 г, 53 ммоль), затем пиридином (4,5 мл, 53 ммоль). Полученную смесь перемешивали при 23C в течение ночи. Реакционную смесь выливали в воду (200 мл) и экстрагировали дихлорметаном (350 мл). Органические слои промывали рассолом и сушили над безводнымNa2SO4. Растворитель выпаривали при пониженном давлении (100 мбар, 45C). Получали 11,20 г (100% от теоретического значения) неочищенного 2-(2,4-дихлорфенил)пентаналь-О-метилоксима в виде прозрачной жидкости, которую использовали на следующей стадии без дополнительной очистки. МС [М+Н]+ 260/262/264. Раствор 2-(2,4-дихлорфенил)пентаналь-О-метилоксима (6,0 г, 23 ммоль) в уксусной кислоте (50 мл) при 10C обрабатывали цианоборогидридом натрия (2,90 г, 46 моль), который добавляли в течение 10 мин небольшими порциями, и полученный раствор перемешивали при 24C в течение 4 ч. Растворитель выпаривали при пониженном давлении (дважды выпаривали вместе с толуолом) и остаток диспергировали в воде и 1 М раствором NaOH значение рН доводили до 11. Водную фазу экстрагировали дихлорметаном (250 мл), промывали рассолом и сушили над безводным Na2SO4. После удаления растворителя (100 мбар, 45C) остаток (6,2 г) очищали с помощью флэш-хроматографии на силикагеле (250 г,элюент: циклогексан). Получали 5,15 г К кислоте Мельдрума (2,06 г, 14,32 ммоль) при перемешивании при температуре окружающей среды добавляли к ТЭАФ (7,05 мл) и реакционную смесь выдерживали в атмосфере азота. Через 10 мин к реакционной смеси добавляли 2,4,6-трихлорбензальдегид (3 г, 14,32 ммоль). Затем смесь кипятили с обратным холодильником при 120C в течение 3 ч. После завершения реакции смесь охлаждали до температуры окружающей среды и выливали в смесь воды со льдом (50 мл). Затем водный слой экстрагировали этилацетатом (380 мл), объединенный органический слой промывали рассолом (40 мл) и сушили над сульфатом натрия. Органический слой концентрировали в вакууме. Получали 3,10 г (86% от теоретического значения) 3-(2,4,6-трихлорфенил)пропионовой кислоты в виде белого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3):7,32 (s, 2H), 3,26-3,22 (m, 2H), 2,63-2,58 (m, 2H). МС [М+Н]+ 253/255/257. Получение ТЭАФ (триэтиламмонийформиат). К раствору муравьиной кислоты (1,12 г, 0,93 мл, 24,5 ммоль) в атмосфере азота при 0C медленно добавляли триэтиламин (1 г, 1,37 мл, 9,8 ммоль) и смесь перемешивали в течение при температуре окружающей среды 1,5 ч. К раствору хлорангидрида кислоты в хлороформе [хлорангидрид кислоты получали из соответствующей 3-(2,4,6-трихлорфенил)пропионовой кислоты (5 г, 19,7 ммоль) и тионилхлорида (5,87 г,49,4 ммоль) при кипячении с обратным холодильником при 110C в течение 3 ч] при 0C по каплям добавляли N,O-диметилгидроксиламингидрохлорид (2,3 г, 23,9 ммоль), затем пиридин (3,77 мл,47,7 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 3 ч. После завершения реакции реакционную смесь разбавляли с помощью 70 мл ДХМ и 40 мл воды. Органический слой отделяли и водный слой дважды экстрагировали с помощью ДХМ (250 мл). Объединенный органический слой промывали рассолом (40 мл) и сушили над сульфатом натрия. После удаления растворителя остаток очищали с помощью хроматографии на силикагеле. Получали 3,0 г (52% от теоретического значения) N-метокси-N-метил-3-(2,4,6-трихлорфенил)пропионамида в виде твердого вещества. 1N-метокси-N-метил-3-(2,4,6 трихлорфенил)пропионамида (1 г, 3,37 ммоль) в ТГФ (15 мл) в атмосфере азота добавляли MeMgI(1,3 мл 3 М раствора в эфире, 3,9 ммоль) и перемешивание продолжали при 0C в течение 2 ч. Реакцию останавливали при 0C 5% раствором HCl (10 мл) и водный слой экстрагировали с помощью EtOAc(330 мл). Объединенный органический слой промывали с помощью 20 мл рассола и сушили над сульфатом натрия, концентрировали в вакууме и получали почти белое твердое вещество. Остаток очищали с помощью хроматографии на силикагеле. Получали 0,50 г (60% от теоретического значения) 4-(2,4,6-трихлорфенил)бутан-2-она в виде твердого вещества. 1 Н ЯМР (CDCl3, 400 МГц):2,14 (s, 3H, CH3), 2,72-2,76 (t, 2H, CH2), 2,93-2,97 (t, 2H, CH2), 7,137,16+7,16-7,19 (2d, 2H, Ar-H), 7,34-7,35 (d, 1H, Ar-H).(5 мл) добавляли триэтиламин (0,73 мл, 5,3 ммоль) и O-метилгидроксиламингидрохлорид (0,447 г,5,3 ммоль). Реакционную смесь нагревали при температуре, равной 60C, в течение 3 ч. После завершения реакции (по данным ТСХ) реакционной смеси давали охладиться до температуры окружающей среды. Реакционную смесь разбавляли водой и метанол выпаривали, затем водный слой экстрагировали этилацетатом (330 мл). Объединенные слои, содержащие этилацетат, промывали водой, затем рассолом и сушили над сульфатом натрия, затем растворители полностью выпаривали и получали неочищенный 4-(2,4,6-трихлорфенил)бутан-2-он-О-метилоксим (0,980 г), который вводили в реакцию восстановления без какой-либо дополнительной очистки. К раствору 4-(2,4,6-трихлорфенил)бутан-2-он-О-метилоксима (0,650 г, 2,33 ммоль) в уксусной кислоте добавляли цианоборогидрид натрия (0,293 г, 4,66 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 6 ч. После завершения реакции (по данным ТСХ) из реакционной смеси удаляли уксусную кислоту путем азеотропной перегонки. Затем остаток подщелачивали 10% раствором NaOH и экстрагировали этилацетатом (330 мл). Объединенные слои, содержащие этилацетат, промывали водой, затем рассолом и сушили над сульфатом натрия, затем концентрировали. Полученную неочищенную смесь очищали с помощью колоночной хроматографии с использованием силикагеля с частицами размером 60-120 мкм и продукт собирали при использовании в качестве элюента 3% этилацетата в гексане и получали О-метил-N-[1-метил-3-(2,4,6-трихлорфенил)пропил]гидроксиламин (0,6 г,90%). 1 Н ЯМР (400 МГц, CDCl3):1,21 (d, 3H), 1,52-1,59 (m, 1H), 1,68-1,76 (m, 1H), 2,80-2,83 (q, 2H), 3,063,13 (m, 1H), 3,55 (s, 3H), 5,45 (s, 1H), 7,29 (s, 2H). Физические характеристики: 1 Н ЯМР (CDCl3, 400 МГц):1,21 (d, 3H, CH3), 1,52-1,59 (m, 1 Н, СН 2),1,68-1,76 (m, 1 Н, СН 2), 2,80-2,83 (m, 2H, CH2), 3,06-3,13 (m, 1H, CH), 1,45 (s, 1H, NH), 7,29 (s, 2H, Ar-H). Пример Р 24. Получение О-метил-N-[3-(2,4,6-трихлорфенил)пропил]гидроксиламина. а) Получение 3-(2,4,6-трихлорфенил)пропан-1-ола: При перемешивании к раствору N-метокси-N-метил-3-(2,4,6-трихлорфенил)пропионамида (0,9 г,3,04 ммоль) в толуоле (18 мл) при -60C в течение 20 мин медленно по каплям добавляли DIBAL-H(15,2 мл, 15,2 ммоль) и реакционную смесь перемешивали при -60C в течение 3 ч. Затем реакцию останавливали путем проводимого по каплям добавления разбавленной HCl (20 мл), затем смесь разбавляли водой (10 мл) и перемешивали в течение 15 мин. Слой, содержащий толуол, и полученную водную фазу экстрагировали этилацетатом (330 мл). Объединенный органический слой промывали водой и рассолом. Затем органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученную неочищенную смесь очищали с помощью колоночной хроматографии(силикагель с частицами размером 60-120 мкм, 2% этилацетата в гексане) и получали 3-(2,4,6-трихлорфенил)пропионовый альдегид (0,45 г, 62,5%) в виде белого кристаллического твердого вещества. 1 Н ЯМР (400 МГц, CDCl3):2,68 (t, 2H), 3,19-3,23 (t, 2H), 7,29 (s, 2H), 9,86 (s, 1H). МС [М+Н]+ 235,9/239,9. Физические характеристики: 1 Н ЯМР (CDCl3, 400 МГц):2,68-2,72 (m, 2H, CH2), 3,19-3,23 (m, 2H,CH2), 7,29 (s, 2H, Ar-H), 9,86 (s, 1H, CHO). с) Получение О-метил-N-[3-(2,4,6-трихлорфенил)пропил]гидроксиламина: К раствору 3-(2,4,6-трихлорфенил)пропионового альдегида (0,45 г, 1,8 ммоль) в метаноле (5 мл) добавляли триэтиламин (0,4 мл, 2,8 ммоль), затем О-метилгидроксиламингидрохлорид (0,24 г, 2,8 ммоль) и смесь нагревали при 60C в течение 2 ч. После завершения реакции (по данным ТСХ) реакционной смеси давали охладиться до температуры окружающей среды и реакцию останавливали водой и метанол удаляли в роторном испарителе. Полученный водный раствор экстрагировали этилацетатом (330 мл). Объединенные слои, содержащие этилацетат, промывали водой и сушили над сульфатом натрия, затем растворители полностью выпаривали и получали неочищенную смесь. Полученную неочищенную смесь очищали с помощью колоночной хроматографии (силикагель с частицами размером 60-120 мкм, 1% этилацетата в гексане) и получали О-метилоксим 3-(2,4,6-трихлорфенил)пропионового альдегида (0,5 г,80%). При перемешивании к раствору О-метилоксима 3-(2,4,6-трихлорфенил)пропионового альдегида в уксусной кислоте при 0-10C добавляли NaCNBH3. Затем реакционную смесь перемешивали при температуре окружающей среды в течение 6 ч. После завершения реакции (по данным ТСХ) уксусную кислоту удаляли путем азеотропной перегонки. Остаток подщелачивали 10% раствором NaOH и водный раствор экстрагировали этилацетатом (330 мл). Объединенный органический слой промывали водой и рассолом. Затем органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученную неочищенную смесь очищали с помощью колоночной хроматографии(2,85 г,0,0348 моль),затем 3-(4-трет-бутилфенил)метилпропионовым альдегидом (5 г, 0,024 моль) и полученную смесь перемешивали при 23C в течение 4 ч. Затем реакционную смесь разбавляли этилацетатом, промывали рассолом и сушили над безводным Na2SO4. Растворитель выпаривали при пониженном давлении (100 мбар, 45C). Получали 6,01 г (100% от теоретического значения) неочищенного О-метилоксима 3-(4-трет-бутилфенил)метилпропионового альдегида в виде прозрачной жидкости, которую использовали на следующей стадии без дополнительной очистки. МС [М+Н]+ 234. Раствор О-метилоксима 3-(4-трет-бутилфенил)метилпропионового альдегида (5,0 г, 0,0213 моль) в уксусной кислоте (50 мл) при 10C обрабатывали цианоборогидридом натрия (2,63 г, 0,042 моль), который добавляли в течение 15 мин небольшими порциями, и полученный раствор перемешивали при 24C в течение 6 ч. Растворитель выпаривали при пониженном давлении (дважды выпаривали вместе с толуолом) и остаток диспергировали в воде и 1 М раствором NaOH значение рН доводили до 9. Водную фазу экстрагировали дихлорметаном (2100 мл), промывали рассолом и сушили над безводным Na2SO4. Растворитель выпаривали при пониженном давлении (100 мбар, 45C). Получали 4,52 г (89,5% от теоретического значения) неочищенного N-[3-(4-трет-бутилфенил)-2-метилпропил]-О-метилгидроксиламина в виде прозрачной жидкости, которую использовали на следующей стадии без дополнительной очистки. МС [М+Н]+ 236. Пример Р 26. Получение 2,4-дихлор-1-(1-метокси-2-нитропропил)бензола. а) Получение 2,4-дихлор-1-Е)-2-нитропропенил)бензола: В колбе для сульфирования к ледяной уксусной кислоте (600 мл) добавляли 2,4-дихлорбензальдегид (77 г, 0,44 моль), нитроэтан (216 мл, 3,04 моль) и ацетат аммония (81,4 г,1,06 моль). Полученный раствор нагревали при 90C в течение 3 ч. После удаления растворителя добавляли воду со льдом (400 мл). Твердый продукт собирали фильтрованием, промывали водой и перекристаллизовывали из этанола. Получали 55,9 г (55% от теоретического значения) 2,4-дихлор-1-Е)-2 нитропропенил)бензола в виде желтого твердого вещества. Т.пл.: 79-81C. 1 Н ЯМР (400 МГц, CDCl3):8,11 (s, 1H), 7,51 (d, 1H), 7,34 (dd, 1H), 7,27 (d, 1H), 2,33 (s, 3H, CH3). При перемешивании к желтому раствору 2,4-дихлор-1-Е)-2-нитропропенил)бензола (4 ммоль,0,93 г) в сухом толуоле (20 мл) в атмосфере N2 при 0C в течение 2 мин по каплям добавляли смесь 5,4 М раствора CH3ONa в метаноле (16,2 ммоль, 3 мл) и метанол (2 мл). После перемешивания в течение 1,5 ч добавляли ледяную уксусную кислоту (3 мл), затем воду (20 мл). Водный раствор экстрагировали дихлорметаном (230 мл), органические слои объединяли, сушили (MgSO4), фильтровали, выпаривали при пониженном давлении и получали 0,78 г неочищенного 1-арил-1-метокси-2-нитропропана в виде желтого масла. Это неочищенное вещество очищали с помощью колоночной хроматографии (силикагель, гексан/этилацетат 8:2) и получали 0,45 г (43% от теоретического значения) 2,4-дихлор-1-(1-метокси-2 нитропропил)бензола (в виде смеси диастереоизомеров) в виде жидкости. 1 Н ЯМР (400 МГц, CDCl3):1,35-1,37+1,39-1,40 (2d, 3H, CH3), 3,18+3,21 (2s, 3H, СН 3), 3,88+3,92 При перемешивании к раствору нитроэтана (8,3 г, 0,11 моль) в ацетонитриле (150 мл) добавляли безводный фосфат калия (1,0 г, 4,6 ммоль), затем 2,4-дихлорбензальдегид (17,5 г, 0,10 моль). Реакционную смесь перемешивали в течение 4 ч. Добавляли воду (300 мл) и реакционную смесь экстрагировали диэтиловым эфиром (200 мл). Органический экстракт промывали водой и сушили над безводнымNa2SO4, растворитель удаляли и полученный остаток очищали с помощью флэш-хроматографии на силикагеле (элюент: циклогексан/этилацетат 9:1). Получали 20,7 г (82,5% от теоретического значения) смеси трео-/эритро-изомеров 1-(2,4-дихлорфенил)-2-нитропропан-1-ола. Кристаллизация из циклогексана давала чистый эритро-1-(2,4-дихлорфенил)-2-нитропропан-1-ол. При перемешивании к смеси эритро-1-(2,4-дихлорфенил)-2-нитропропан-1-ола (2,5 г, 10,0 ммоль) в сухом дихлорметане (20 мл) в атмосфере азота при охлаждении до 5C по каплям добавляли ДАТС диэтиламино)трифторид серы) (1,3 мл, 10,0 ммоль) в дихлорметане (5 мл). Раствор перемешивали при температуре окружающей среды в течение 1 ч. Добавляли дихлорметан (80 мл) и органический слой последовательно промывали насыщенным раствором NaHCO3 (50 мл), 1 М раствором HCl (30 мл) и рассолом(30 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали. Получали 2,5 г 2,4-дихлор-1-(1-фтор-2-нитропропил)бензола в виде коричневого масла. Пример Р 28. Получение 1-(2,4,6-трихлорфенил)пропан-2-она:H2O (20 мл) и МеОН (60 мл) в атмосфере азота при температуре окружающей среды добавляли порош- 25020376 кообразное железо (2,355 г, 42,12 ммоль) и концентрированную HCl (11,5 мл, 112 моль). Реакционную смесь перемешивали при 70C в течение 1 ч. Через 1 ч добавляли дополнительные количества порошкообразного железа (2,355 г, 42,12 ммоль) и концентрированной HCl (11,5 мл, 112 моль) и перемешивание продолжали при 70C в течение 2 ч. После завершения реакции (по данным ТСХ) реакционную смесь охлаждали до температуры окружающей среды и МеОН выпаривали. Полученный остаток разбавляли водой и экстрагировали этилацетатом (380 мл). Объединенные слои, содержащие этилацетат, промывали водой и рассолом и сушили над безводным Na2SO4. Органический слой концентрировали в вакууме. Неочищенное вещество очищали с помощью колоночной хроматографии (силикагель с частицами размером 60-120 мкм, гексан/этилацетат 95:5) и получали 3,7 г (83,3% от теоретического значения) 1-(2,4,6-трихлорфенил)пропан-2-она. Табл. 1-6. Соединения формулы Ia. Настоящее изобретение дополнительно иллюстрируется предпочтительными отдельными соединениями формулы (Ia), приведенными в табл. 1-6. Характеризующие данные приведены в табл. 9.n равно 0 или 1. В каждой из табл. 1-6, которые приведены ниже после табл. Y, приведены 100 соединений формулы(Ia), в которой R4, R5, R7, X, R11, R12 и R13 обладают значениями, приведенными в табл. Y, и А обладает значением, приведенным в соответствующей табл. 1-6, и n обладает значением, приведенным в соответствующей табл. 1-6. Таким образом, табл. 1 соответствует табл. Y, когда Y равно 1 и А обладает значением, приведенным в заголовке табл. 1, табл. 2 соответствует табл. Y, когда Y равно 2 и А обладает значением, приведенным заголовке табл. 2, и так далее для табл. 3-6. В табл. 1-6 "Me" означает метил, "Et" означает этил, "i-Pr" означает изопропил, "с-Pr" означает циклопропил и "t-Bu" означает трет-бутил.
МПК / Метки
МПК: C07C 239/10, C07C 239/12, A01N 43/26, C07C 239/20
Метки: пиразолкарбоксамиды, активные, новые, фунгицидно
Код ссылки
<a href="https://eas.patents.su/30-20376-novye-fungicidno-aktivnye-pirazolkarboksamidy.html" rel="bookmark" title="База патентов Евразийского Союза">Новые фунгицидно активные пиразолкарбоксамиды</a>












