Антитело или его эпитоп-связывающий фрагмент, которые связываются с гликотопом са6, и способы их применения
Формула / Реферат
1. Антитело позвоночного или его эпитоп-связывающий фрагмент, которые связываются с гликотопом СА6, включающие по меньшей мере две области, определяющие комплементарность (CDR) и имеющие аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO: 1-6 и 22.
2. Антитело позвоночного или его эпитоп-связывающий фрагмент, которые связываются с гликотопом СА6, включающие по меньшей мере одну вариабельную область тяжелой цепи или ее фрагмент и по меньшей мере одну вариабельную область легкой цепи или ее фрагмент, где указанная по меньшей мере одна вариабельная область тяжелой цепи или ее фрагмент включает три последовательные области, определяющие комплементарность и имеющие аминокислотные последовательности, представленные SEQ ID NO: 1, 2 или 21 и 3, и где указанная по меньшей мере одна вариабельная область легкой цепи или ее фрагмент включает три последовательные области, определяющие комплементарность и имеющие аминокислотные последовательности, представленные SEQ ID NO: 4-6.
3. Антитело или его эпитоп-связывающий фрагмент по п.2, где указанная вариабельная область легкой цепи или ее фрагмент имеет по меньшей мере 90%-ную идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 7 или SEQ ID NO: 8.
4. Антитело или его эпитоп-связывающий фрагмент по п.3, где указанная вариабельная область легкой цепи или ее фрагмент имеет по меньшей мере 95%-ную идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 7 или SEQ ID NO: 8.
5. Антитело или его эпитоп-связывающий фрагмент по п.3, где указанная вариабельная область легкой цепи или ее фрагмент имеет аминокислотную последовательность SEQ ID NO: 7 или SEQ ID NO: 8.
6. Антитело или его эпитоп-связывающий фрагмент по п.2, где указанная вариабельная область тяжелой цепи или ее фрагмент имеет по меньшей мере 90%-ную идентичность последовательности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 9, SEQ ID NO: 10 и SEQ ID NO: 11.
7. Антитело или его эпитоп-связывающий фрагмент по п.6, где указанная вариабельная область тяжелой цепи или ее фрагмент имеет по меньшей мере 95%-ную идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 9, SEQ ID NO: 10 или SEQ ID NO: 11.
8. Антитело или его эпитоп-связывающий фрагмент по п.6, где указанная вариабельная область тяжелой цепи или ее фрагмент имеет аминокислотную последовательность SEQ ID NO: 9, SEQ ID NO: 10 или SEQ ID NO: 11.
9. Полинуклеотид, кодирующий антитело или его эпитоп-связывающий фрагмент по любому из пп.1-3 или 6.
10. Полинуклеотид, кодирующий легкую или тяжелую цепь антитела или его эпитоп-связывающего фрагмента по любому из пп.1-3 или 6.
11. Вектор, включающий полинуклеотид по п.9.
12. Вектор, включающий полинуклеотид по п.10.
13. Вектор по п.11, который является экспрессионным вектором, экспрессирующим указанное антитело или его эпитоп-связывающий фрагмент.
14. Вектор по п.12, который является экспрессионным вектором, экспрессирующим указанное антитело или его эпитоп-связывающий фрагмент.
15. Гуманизированное антитело грызуна или его эпитоп-связывающий фрагмент, которые связываются с гликотопом СА6, включающие по меньшей мере два CDR, имеющие аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO: 1-6 и 22, полученные способом изменения поверхности, включающим:
(а) создание выравнивания позиций исходя из распределений относительной доступности на основании рентгеновских кристаллографических структур совокупности вариабельных областей тяжелых и легких цепей антител человека и грызунов с получением набора экспонированных на поверхности позиций каркаса вариабельной области тяжелой и легкой цепи, где позиции в выравнивании для всех вариабельных областей грызунов и человека являются по меньшей мере на 98% идентичными;
(б) определение для антитела грызуна или его эпитоп-связывающего фрагмента набора экспонированных на поверхности аминокислотных остатков каркаса вариабельной области тяжелой и легкой цепи с использованием названного набора экспонированных на поверхности позиций каркаса вариабельной области тяжелой и легкой цепи, созданного на указанной стадии (а);
(в) идентификацию на основании аминокислотных последовательностей человеческих антител набора аминокислотных остатков, экспонированных на поверхности аминокислотных остатков каркаса вариабельной области тяжелой и легкой цепи, которые наиболее близко идентичны названному набору экспонированных на поверхности аминокислотных остатков антитела грызуна, определенному на указанной стадии (б);
(г) замещение в аминокислотной последовательности каркаса вариабельной области названного антитела грызуна или его эпитоп-связывающего фрагмента этого названного набора экспонированных на поверхности аминокислотных остатков каркаса вариабельной области тяжелой и легкой цепи, определенного на указанной стадии (б), указанным набором экспонированных по поверхности аминокислотных остатков каркаса вариабельной области тяжелой и легкой цепи, идентифицированным на указанной стадии (в);
(д) конструирование трехмерных моделей указанных вариабельных областей названного антитела грызуна или его эпитоп-связывающего фрагмента и указанной вариабельной области указанного антитела грызуна или его эпитоп-связывающего фрагмента, являющихся результатом указанного замещения на стадии (г);
(е) сравнение названных трехмерных моделей, сконструированных на указанной стадии (д), и идентификация любых аминокислотных остатков из указанного набора, идентифицированного на указанных стадиях (б) или (в), которые находятся в пределах 5Å от любого атома любого остатка в областях, определяющих комплементарность, указанного антитела грызуна или его эпитоп-связывающего фрагмента;
(ж) изменение любых аминокислотных остатков, идентифицированных на указанной стадии (е), с человеческих на исходные аминокислотные остатки антитела грызуна, чтобы таким образом определить гуманизирующий набор экспонированных на поверхности аминокислотных остатков;
(з) замена набора экспонированных на поверхности аминокислотных остатков каркаса вариабельной области антитела грызуна, определенного на стадии (б), гуманизирующим набором экспонированных на поверхности аминокислотных остатков каркаса вариабельной области, определенным на указанной стадии (ж); и
(и) производство указанного гуманизированного антитела грызуна или его эпитоп-связывающего фрагмента, которые связываются с СА6 гликотопом.
16. Гуманизированное антитело грызуна или его эпитоп-связывающий фрагмент по п.15, где указанный эпитоп-связывающий фрагмент выбран из группы, состоящей из Fab фрагмента, Fab' фрагмента, F(ab')2 фрагмента, Fd фрагмента, одноцепочечного Fvs (scFv) фрагмента, одноцепочечного антитела, дисульфид-связанного Fvs (sdFv) фрагмента и фрагмента, включающего или VL, или VH домен.
17. Гуманизированное антитело грызуна или его эпитоп-связывающий фрагмент по п.15, где указанные аминокислотные остатки, экспонированные на поверхности, являются аминокислотными остатками, чья доступность для растворителя выше 30%.
18. Гуманизированное антитело грызуна или его эпитоп-связывающий фрагмент по п.15, включающие по меньшей мере одну вариабельную область тяжелой цепи или ее фрагмент и по меньшей мере одну вариабельную область легкой цепи или ее фрагмент, где указанная по меньшей мере одна вариабельная область тяжелой цепи или ее фрагмент включает три последовательные области, определяющие комплементарность и имеющие аминокислотные последовательности, представленные SEQ ID NO: 1, 2 или 21 и 3, и где указанная по меньшей мере одна вариабельная область легкой цепи или ее фрагмент включает три последовательные области, определяющие комплементарность и имеющие аминокислотные последовательности, представленные SEQ ID NO: 4-6.
19. Гуманизированное антитело грызуна или его эпитоп-связывающий фрагмент по п.15, включающие вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 7 или SEQ ID NO: 8.
20. Гуманизированное антитело грызуна или его эпитоп-связывающий фрагмент по п.15, включающие вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 9, SEQ ID NO: 10 или SEQ ID NO: 11.
21. Антитело или его эпитоп-связывающий фрагмент, которые обладают повышенными аффинностью связывания с гликотопом СА6 и уровнем экспрессии по сравнению с антителом по п.1, полученные путем:
(а) обеспечения ДНК-полинуклеотида, кодирующего антитело или его эпитоп-связывающий фрагмент, включающих по меньшей мере две последовательности, выбранные из группы, состоящей из SEQ ID NO: 1-6 и 22, или по меньшей мере одну последовательность, выбранную из группы, состоящей из SEQ ID NO: 7-11;
(б) введения по меньшей мере одной нуклеотидной мутации, делеции или вставки в названный ДНК-полинуклеотид (а) так, что, по меньшей мере, изменен один остаток аминокислотной последовательности, кодируемой указанным ДНК-полинуклеотидом;
(в) экспрессии антитела или фрагмента антитела, кодируемого ДНК-полинуклеотидом (б); и
(г) скрининга указанного экспрессированного антитела или фрагмента антитела на предмет улучшения сродства связывания антитела с клеткой, экспрессирующей СА6 гликотоп, таким образом получая улучшенное антитело или его эпитоп-связывающий фрагмент.
22. Антитело или его эпитоп-связывающий фрагмент по п.21, где указанная по меньшей мере одна нуклеотидная мутация, делеция или вставка сделана способом, выбранным из группы, включающей олигонуклеотид-опосредованный сайт-направленный мутагенез, кассетный мутагенез, подверженную ошибкам ПЦР, перетасовку ДНК и применение мутаторных линий Е. coli.
23. Цитотоксический конъюгат антитела или его эпитоп-связывающего фрагмента, включающий антитело или его фрагмент и цитотоксический агент, где указанное антитело или указанный фрагмент связываются с СА6 гликотопом и где указанное антитело или указанный фрагмент включают по меньшей мере две области, определяющие комплементарность и имеющие аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO: 1-6 и 22.
24. Цитотоксический конъюгат по п.23, где указанное антитело или указанный фрагмент и указанный цитотоксический агент связаны ковалентно.
25. Цитотоксический конъюгат по п.23, где указанное антитело или указанный фрагмент и указанный цитотоксический агент связаны ковалентно через линкерную группу PEG.
26. Цитотоксический конъюгат по п.23, где указанное антитело или указанный фрагмент и указанный цитотоксический агент ковалентно связаны через тиоловую или дисульфидную функциональные группировки названного цитотоксического агента.
27. Цитотоксический конъюгат по п.23, где указанное антитело или указанный фрагмент выбраны из группы, состоящей из поликлонального антитела, моноклонального антитела, фрагмента антитела, гуманизированного антитела, антитела с измененной поверхностью, функционального эквивалента антитела, антитела, обладающего повышенными аффинностью связывания с гликотопом СА6 и уровнем экспрессии по сравнению с антителом по п.1.
28. Цитотоксический конъюгат по п.23, где указанный фрагмент антитела выбран из группы, состоящей из Fab фрагмента, Fab' фрагмента, F(ab')2 фрагмента, Fd фрагмента, одноцепочечного Fvs (scFv) фрагмента, одноцепочечного антитела, дисульфид-связанного Fvs (sdFv) фрагмента и фрагмента, включающего или VL, или VH домен.
29. Цитотоксический конъюгат по п.23, где указанное антитело или указанный фрагмент являются анти-CA6 моноклональным антителом или его эпитоп-связывающим фрагментом.
30. Цитотоксический конъюгат по п.29, где указанное антитело или указанный фрагмент являются мышиным анти-CA6 моноклональным антителом DS6 или его эпитоп-связывающим фрагментом.
31. Цитотоксический конъюгат по п.30, где указанное антитело или указанный фрагмент являются гуманизированной версией мышиного анти-CA6 моноклонального антитела DS6 или ее эпитоп-связывающим фрагментом.
32. Цитотоксический конъюгат по п.23, где указанный цитотоксический агент выбран из группы, состоящей из мейтансиноидного соединения, таксоидного соединения, соединения СС-1065, соединения доластатина, соединения даунорубицина и соединения доксорубицина.
33. Цитотоксический конъюгат по п.32, где указанный цитотоксический агент является мейтансином DM1 формулы (I)

34. Цитотоксический конъюгат по п.32, где указанный цитотоксический агент является мейтансином DM4 формулы (II)
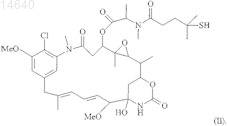
35. Цитотоксический конъюгат по п.32, где указанный цитотоксический агент является мейтанзином формулы (III)
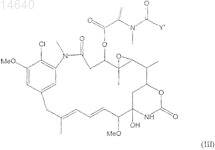
где Y' представляет ![]()
R1 и R2,каждый, являются независимо CH3, С2Н5 линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом и дополнительно R2может быть Н;
А, В, D являются циклоалкилом или циклоалкенилом, имеющим 3-10 атомов углерода, простым или замещенным арилом или гетероциклическим ароматическим или гетероциклоалкильным радикалом;
R3, R4, R5, R6, R7, R8, R9, R11 и R12, каждый независимо, являются Н, CH3, С2Н5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом;
l, m, n, о, р, q, r, s, t и u, каждый, являются независимо 0 или целым числом от 1 до 5 с условием, что по меньшей мере два из l, m, n, о, р, q, r, s, t и u не равны 0 одновременно, и
Z является Н, SR или -COR, где R является линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, или простым или замещенным арилом или гетероциклическим радикалом.
36. Цитотоксический конъюгат по п.35, где R1 является метилом, R2 является Н и Z является Н.
37. Цитотоксический конъюгат по п.35, где R1 и R2 являются метилом и Z является Н.
38. Цитотоксический конъюгат по п.35, где R1 является метилом, R2 является Н и Z является -SCH3.
39. Цитотоксический конъюгат по п.35, где R1 и R2 являются метилом и Z является -SCH3.
40. Цитотоксический конъюгат по п.32, где указанный цитотоксический агент является мейтансином, выбранным из группы, включающей формулы (IV-L), (IV-D) и (IV-D,L)
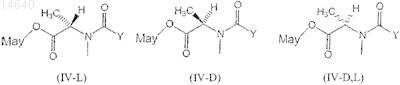
где Y представляет ![]()
R1 и R2, каждый независимо, являются СН3, С2Н5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом и дополнительно R2 может быть Н;
R3, R4, R5, R6, R7 и R8, каждый независимо, являются Н, CH3, С2Н5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом;
l, m и n, каждый независимо, являются целым числом от 1 до 5 и дополнительно n может быть 0;
Z является Н, SR или -COR, где R является линейным или разветвленным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов, или простым или замещенным арилом или гетероциклическим радикалом; и
May представляет собой мейтансиноид, несущий боковую цепь в положении С-3, С-14 гидроксиметил, С-15 гидрокси или С-20 десметил.
41. Цитотоксический конъюгат по п.40, где R1 является метилом; R2 является Н; R5, R6, R7 и R8, каждый, являются Н; l и m, каждый, равны 1, n равен 0 и Z является Н.
42. Цитотоксический конъюгат по п.40, где R1 и R2 являются метилом; R5, R6, R7и R8, каждый, являются Н; l и m равен 1, n равен 0 и Z является Н.
43. Цитотоксический конъюгат по п.40, где R1 является метилом; R2является Н; R5, R6, R7и R8, каждый, являются Н; l и m, каждый, равны 1, n равен 0 и Z является -SCH3.
44. Цитотоксический конъюгат по п.40, где R1 и R2 являются метилом; R5, R6, R7и R8, каждый, являются Н; l и m, каждый, равны 1, n равен 0 и Z является -SCH3.
45. Цитотоксический конъюгат по п.40, где цитотоксический агент представлен формулой (IV-L).
46. Цитотоксический конъюгат по п.32, где указанный цитотоксический агент является мейтансином формулы (V)
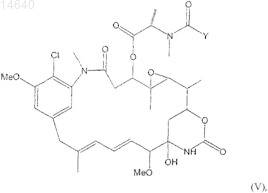
где Y представляет ![]()
каждый из R1 и R2является независимо CH3, С2Н5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом, и дополнительно R2может быть Н;
каждый из R3, R4, R5, R6, R7 и R8независимо является Н, СН2, C2H5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом;
l, m и n, каждый независимо, является целым числом от 1 до 5 и дополнительно n может быть 0;
Z является Н, SR или -COR, где R является линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, или простым или замещенным арилом или гетероциклическим радикалом.
47. Цитотоксический конъюгат по п.46, где R1 является метилом; R2является Н; R5, R6, R7 и R8, каждый, являются Н; l и m, каждый, равны 1; n равен 0 и Z является Н.
48. Цитотоксический конъюгат по п.46, где R1 и R2 являются метилом; R5, R6, R7 и R8, каждый, являются Н; l и m равны 1; n равен 0 и Z является Н.
49. Цитотоксический конъюгат по п.46, где R1 является метилом; R2является Н; R5, R6, R7 и R8, каждый, являются Н; l и m, каждый, равны 1; n является 0 и Z является -SCH3.
50. Цитотоксический конъюгат по п.46, где R1 и R2 являются метилом; R5, R6, R7и R8, каждый, являются Н; l и m равны 1; n равен 0 и Z является -SCH3.
51. Цитотоксический конъюгат по п.32, где указанный цитотоксический агент является мейтансином, выбранным из группы, включающей формулы (VI-L), (VI-D) и (VI-D,L)
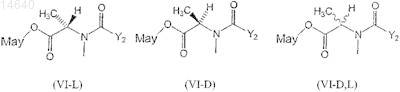
где Y2представляет ![]()
R1 и R2, каждый независимо, являются CH3, С2Н5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом и дополнительно R2может быть Н;
R3, R4, R5, R6, R7 и R8, каждый независимо, являются Н, СН3, С2Н5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом;
l, m и n, каждый независимо, являются целым числом от 1 до 5 и дополнительно n может быть 0;
Z2 является SR или -COR, где R является линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленными или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов, или простым или замещенным арилом или гетероциклическим радикалом; и
May представляет собой мейтансиноид.
52. Цитотоксический конъюгат по п.32, где указанный цитотоксический агент является мейтансином формулы (VII)
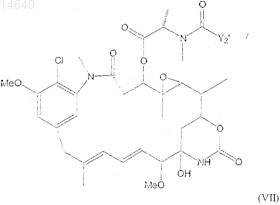
где Y2' представляет ![]()
R1 и R2, каждый независимо, являются СН3, C2H5, линейным или разветвленным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом и дополнительно R2 может быть Н;
А, В и D, каждый независимо, являются циклоалкилом или циклоалкенилом, имеющим от 3 до 10 атомов углерода, простым или замещенным арилом, или гетероциклическим радикалом;
R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12, каждый независимо, являются Н, CH3, С2Н5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом;
l, m, n, о, р, q, r, s, t и u, каждый независимо, являются 0 или целым числом от 1 до 5 при условии, что по меньшей мере два из l, m, n, о, р, q, r, s, t и u не являются 0 одновременно; и
Z является SR или -COR, где R является линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, или простым или замещенным арилом или гетероциклическим радикалом.
53. Цитотоксический конъюгат по п.52, где R1 является метилом и R2 является Н.
54. Цитотоксический конъюгат по п.32, где указанный цитотоксический агент является мейтансином формулы (VIII)
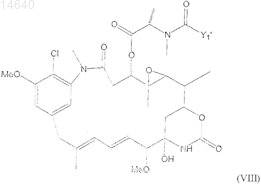
где Y1' представляет собой ![]()
А, В и D, каждый независимо, являются циклоалкилом или циклоалкенилом, имеющим 3-10 атомов углерода, простым или замещенным арилом или гетероциклическим радикалом;
R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12, каждый независимо, являются Н, CH3, C2H5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом и
l, m, n, о, р, q, r, s, t и u, каждый независимо, являются 0 или целым числом от 1 до 5 при условии, что по крайней мере два из l, m, n, о, р, q, r, s, t и u не являются 0 одновременно.
55. Цитотоксический конъюгат по п.54, где R1 является метилом и R2 является Н.
56. Цитотоксический конъюгат по п.54, где R1 и R2 являются метилом.
57. Цитотоксический конъюгат по п.32, где указанный цитотоксический конъюгат является мейтансином, выбранным из группы, состоящей из формул (IX-L), (IX-D) и (IX-D,L)
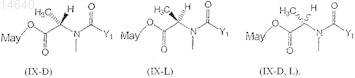
где Y1представляет собой ![]()
R1 и R2, каждый независимо, являются CH3, С2Н5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом, гетероциклическим радикалом и дополнительно R2может быть Н;
R3, R4, R5, R6, R7 и R8, каждый независимо, являются Н, СН3, С2Н5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом;
l, m и n, каждый независимо, являются целым числом от 1 до 5 и дополнительно n может быть 0 и
May представляет собой мейтансинол, который несет боковую цепь при С-3, С-14 гидроксиметил, С-15 гидрокси или С-20 десметил.
58. Цитотоксический конъюгат по п.57, где R1 является метилом и R2 является Н или R1и R2 являются метилом.
59. Цитотоксический конъюгат по п.57, где R1 является метилом и R2является Н; R5, R6, R7 и R8, каждый, являются Н; l и m, каждый, равны 1, n равен 0.
60. Цитотоксический конъюгат по п.57, где R1 и R2 являются метилом; R5, R6, R7и R8, каждый, являются Н; l и m равны 1, n равен 0.
61. Цитотоксический конъюгат по п.58, где мейтансиноид представлен формулой (IX-L).
62. Цитотоксический конъюгат по п.59, где мейтансиноид представлен формулой (IX-L).
63. Цитотоксический конъюгат по п.60, где мейтансиноид представлен формулой (IX-L).
64. Цитотоксический конъюгат по п.32, где указанный цитотоксический агент является мейтансином формулы (X)
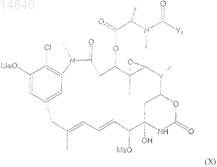
где Y1представляет собой ![]()
R1 и R2, каждый независимо, являются CH3, С2Н5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом, гетероциклическим радикалом и дополнительно R2может быть Н;
R3, R4, R5, R6, R7 и R8, каждый независимо, являются Н, CH3, С2Н5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом;
l, m и n, каждый независимо, являются целым числом от 1 до 5 и дополнительно n может быть 0 и
May представляет собой мейтансинол, который несет боковую цепь в положении С-3, C-14 гидроксиметил, С-15 гидрокси или С-20 десметил.
65. Цитотоксический конъюгат по п.64, где R1 является метилом и R2является Н; R5, R6, R7 и R8, каждый, является Н; l и m, каждый, равны 1 и n равен 0.
66. Цитотоксический конъюгат по п.64, где R1 и R2 являются метилом; R5, R6, R7и R8, каждый, является Н: l и m равны 1 и n равен 0.
67. Цитотоксический конъюгат по п.23, где указанное антитело или указанный фрагмент являются гуманизированной версией мышиного анти-CA6 моноклонального антитела DS6 или ее эпитоп-связывающим фрагментом и где названный цитотоксический агент является DM1 или DM4.
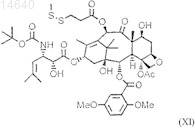
68. Цитотоксический конъюгат по п.32, где названный цитотоксический агент является таксаном формулы (XI)
69. Способ ингибирования роста клетки, экспрессирующей СА6 гликотоп, включающий контактирование клетки, экспрессирующей СА6 гликотоп, с цитотоксическим конъюгатом по п.24.
70. Способ по п.69, где цитотоксический конъюгат включает анти-CA6 моноклональное антитело или его эпитоп-связывающий фрагмент в качестве указанного антитела или указанного фрагмента и DM1 и DM4 в качестве цитотоксического агента.
71. Способ по п.69, где цитотоксический конъюгат включает анти-CA6 моноклональное антитело или его эпитоп-связывающий фрагмент в качестве указанного антитела или указанного фрагмента и таксан в качестве цитотоксического агента.
72. Способ по п.70, где цитотоксический конъюгат включает гуманизированную версию мышиного моноклонального антитела DS6 или его эпитоп-связывающего фрагмента в качестве указанного антитела или указанного фрагмента и DM1 и DM4 в качестве цитотоксического агента.
73. Способ по п.71, где цитотоксический конъюгат включает гуманизированную версию мышиного антитела DS6 или его эпитоп-связывающего фрагмента в качестве указанного антитела или указанного фрагмента и таксан в качестве цитотоксического агента.
74. Способ по п.69, приводящий к гибели клетки.
75. Способ по п.69, где названный способ осуществляют in vivo, in vitro или ex vivo.
76. Терапевтическая композиция, включающая цитотоксический конъюгат по п.23 и фармацевтически приемлемый носитель или эксципиент.
77. Терапевтическая композиция по п.76, где цитотоксический конъюгат включает гуманизированную версию мышиного антитела DS6 или его эпитоп-связывающего фрагмента и DM1 и DM4 в качестве цитотоксического агента.
78. Терапевтическая композиция по п.76, где цитотоксический конъюгат включает гуманизированную версию мышиного антитела DS6 или его эпитоп-связывающего фрагмента и таксан в качестве цитотоксического агента.
79. Способ лечения субъекта, больного раком, включающий введение терапевтически эффективного количества терапевтической композиции по п.76 указанному субъекту.
80. Способ лечения субъекта по п.79, где цитотоксический конъюгат включает гуманизированную версию мышиного антитела DS6 или его эпитоп-связывающего фрагмента и DM1 и DM4 в качестве цитотоксического агента.
81. Способ лечения субъекта по п.79, где цитотоксический конъюгат включает гуманизированную версию мышиного антитела DS6 или его эпитоп-связывающего фрагмента и таксан в качестве цитотоксического агента.
82. Способ лечения субъекта по п.79, где при указанном раковом заболевании экспрессируется или сверхэкспрессируется СА6 гликотоп.
83. Способ лечения субъекта по п.79, где рак выбран из группы, включающей серозную карциному яичника, эндометриоидную карциному яичника, новообразование шейки матки, новообразование эндометрия, новообразование вульвы, карциному молочной железы, опухоль поджелудочной железы и уротелиальную опухоль.
84. Набор, включающий цитотоксический конъюгат по п.23 и инструкцию по использованию набора.
85. Набор по п.84, где указанный цитотоксический конъюгат включает гуманизированную версию мышиного антитела DS6 или его эпитоп-связывающего фрагмента и DM1 и DM4 в качестве цитотоксического агента.
86. Набор по п.85, где указанный цитотоксический конъюгат включает гуманизированную версию мышиного антитела DS6 или его эпитоп-связывающего фрагмента и таксан в качестве цитотоксического агента.
87. Набор по п.84, где указанная инструкция включает инструкцию по лечению субъекта, больного раком.
88. Набор по п.87, где при указанном раковом заболевании экспрессируется или сверхэкспрессируется гликотоп СА6.
89. Набор по п.88, где рак выбран из группы, включающей серозную карциному яичника, эндометриоидную карциному яичника, новообразование шейки матки, новообразование эндометрия, новообразование вульвы, карциному молочной железы, опухоль поджелудочной железы и уротелиальную опухоль.
90. Набор, включающий терапевтическую композицию по п.76 и инструкции по применению набора.
91. Набор по п.90, где цитотоксический конъюгат терапевтической композиции включает гуманизированную версию мышиного антитела DS6 или его эпитоп-связывающего фрагмента и DM1 и DM4 в качестве цитотоксического агента.
92. Набор по п.90, где цитотоксический конъюгат терапевтической композиции включает гуманизированную версию мышиного антитела DS6 или его эпитоп-связывающего фрагмента и таксан в качестве цитотоксического агента.
93. Набор по п.90, где указанная инструкция включает инструкции по лечению субъекта, больного раком.
94. Набор по п.93, где при указанном раковом заболевании экспрессируется или сверхэкспрессируется гликотоп СА6.
95. Набор по п.94, где рак выбран из группы, включающей серозную карциному яичника, эндометриоидную карциному яичника, новообразование шейки матки, новообразование эндометрия, новообразование вульвы, карциному молочной железы, опухоль поджелудочной железы и уротелиальную опухоль.
Текст
АНТИТЕЛО ИЛИ ЕГО ЭПИТОП-СВЯЗЫВАЮЩИЙ ФРАГМЕНТ, КОТОРЫЕ СВЯЗЫВАЮТСЯ С ГЛИКОТОПОМ СА 6, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ Раскрыты цитотоксические конъюгаты, включающие связывающийся с клеткой агент и цитотоксический агент, терапевтические композиции, включающие конъюгат, способы применения конъгатов для ингибирования роста клетки и лечения заболевания, и набор, включающий цитотоксический конъюгат, все являющиеся воплощениями изобретения. В частности, связывающийся с клеткой агент является моноклональным антителом и его эпитоп-связывающим фрагментом,который рапознает и связывает CA6 гликотоп. Настоящее изобретение направлено также на гуманизированную версию или версию с измененной поверхностью DS6 или DS6, анти-DS6 мышиное моноклональное антитело и его эпитоп-связывающий фрагмент. 014640 Настоящая заявка заявляет о своих правах на преимущества предварительной заявки США номер 60/488,447, поданной 21 июля 2003. Область техники, к которой относится изобретение Настоящее изобретение направлено на моноклональное антитело мыши против гликотопа СА 6 и его гуманизированный вариант или вариант с измененной поверхностью. Настоящее изобретение направлено также на эпитопсвязывающие фрагменты гликотопного моноклонального антитела против гликотопа СА 6, а также на эпитопсвязывающие фрагменты гуманизированных вариантов или вариантов с измененной поверхностью моноклонального антитела против гликотопа СА 6. Далее настоящее изобретение направлено на цитотоксические конъюгаты, включающие связывающийся с клеткой агент и цитотоксический агент, терапевтические композиции, включающие конъюгат,способы применения конъюгатов для ингибирования роста клеток и для лечения заболеваний, и набор реагентов, включающий цитотоксический конъюгат. В частности, агент, связывающийся с клеткой, является моноклональным антителом, или его эпитопсвязывающим фрагментом, который узнает и связывается с СА 6 гликотопом, или гуманизированным вариантом или вариантом с измененной поверхностью. Уровень техники Существуют многочисленные попытки создания противораковых терапевтических средств, которые специфически разрушают раковые клетки без ущерба для окружающих нераковых клеток и тканей. Такие терапевтические агенты обладают гигантским потенциалом для усовершенствования способов лечения рака человека. Один из многообещающих подходов состоял в том, чтобы соединить агенты, связывающиеся с клеткой, такие как моноклональные антитела, с цитотоксическими агентами (Sela et al., in Immunoconjugates 189-216 (С. Vogel, ed. 1987); Ghose et al., in Targeted Drags 1-22 (E. Goldberg, ed. 1983); Diener et al.,in Antibody mediated delivery systems 1-23 (J. Rodwell, ed. 1988); Pietersz et al., in Antibody mediated delivery systems 25-53 J. Rodwell, ed. 1988); Bumol et al., in Antibody mediated delivery systems 55-79 (J.Rodwell, ed. 1988). В зависимости от выбора агента, связывающегося с клеткой, эти цитотоксические конъюгаты могут создаваться для узнавания и связывания только специфических типов раковых клеток,на основе экспрессионного профиля молекул, экспрессируемых на поверхности таких клеток. Цитотоксические агенты, такие как метотрексат, даунорубицин, доксорубицин, винкристин, винбластин, мелфалан, митомицин С и хлорамбуцил, были использованы в таких цитотоксических конъюгатах, связанные с различными моноклональными антителами мыши. В некоторых случаях молекулы лекарственных средств соединяли с молекулами антитела через промежуточную молекулу-носитель, такую как сывороточный альбумин (Garnett et al., 46 Cancer Res. 2407-2412 (1986); Ohkawa et al 23 Cancer Immunol. Immunother. 81-86 (1986); Endo et al., 47 Cancer Res. 1076-1080 (1980, декстран (Hurwitz et al., 2Res. 4886-4891 (1986); Shoval et al., 85 Proc. Natl. Acad. Sci. 8276-8280 (1988, или полиглутаминовую кислоту (Tsukada et al., 73 J. Natl. Cane. Inst. 721-729 (1984); Kato et al.27 J. Med. Chem. 1602-1607 (1984);Tsukada et al., 52 Br. J. Cancer 111-116 (1985. Примером специфического конъюгата с некоторыми перспективами является конъюгат антитела С 242, которое направлено против CanAg, антигена, экспрессируемого в опухолях толстого кишечника и поджелудочной железы, и производного мейтансина DM1 (Liu et al., Proc Natl Acad Sci USA, 93: 86188623 (1996. Оценка этого конъюгата, проведенная in vitro, показала, что его сродство к CanAg, находящемуся на поверхности клеток, было высоким и имело кажущиеся значения Kd 310-11 М. Его цитотоксическая эффективность для CanAg-положительных клеток была достаточно высокой с IC50 610-11 М. Эта цитотоксичность была антигензависимой, поскольку она ингибировалась избытком неконъюгированного антитела, и поскольку антигеннегативные клетки были более чем в 100 раз менее чувствительными к конъюгату. Другие примеры конъюгатов "DM1-антитело", имеющих высокое сродство по отношению к соответствующим клеткам-мишеням и высокую антиген-селективную цитотоксичность, включают huN901, гуманизированную версию антитела против человеческого CD56; huMy9-6, гуманизированную версию антитела против человеческого CD33; tmC242, гуманизированную версию антитела против Muc1 эпитопа CanAg; huJ591, деиммунизированное антитело против PSMA; трастузумаб, гуманизированное антитело против Her2/neu; и биватузумаб, гуманизированное антитело против CD44v6. Создание дополнительных цитотоксических конъюгатов, которые специфически распознают определенные типы раковых клеток, будет крайне важным этапом в процессе непрерывного усовершенствования способов лечения пациентов, больных раком. С этой целью настоящее изобретение направлено на создание антител, которые распознают и связываются с молекулами/рецепторами, находящимися на поверхности раковых клеток, а также на создание новых цитотоксических конъюгатов, включающих агенты, связывающиеся с клетками, такие как антитела, и цитотоксические агенты, направленные на молекулы/рецепторы, экспрессируемые на поверхности раковых клеток. Более конкретно, настоящее изобретение направлено на характеристику нового СА 6 сиалогликотопа, находящегося на муциновом рецепторе Muc1, экспрессируемом раковыми клетками, и на получении-1 014640 антител, предпочтительно гуманизированных антител, которые распознают СА 6 сиалогликотоп муцинаMuc1 и которые могут использоваться для ингибирования роста клетки, экспресирующей СА 6 гликотоп в контексте цитотоксического агента. Раскрытие изобретения Настоящее изобретение включает антитела, которые специфически распознают и связываются с новым СА 6 сиалогликотопом рецептора муцина Muc1, или их эпитопсвязывающий фрагмент. В другом воплощении настоящее изобретение включает гуманизированное антитело или его эпитопсвязывающий фрагмент, который распознает новый СА 6 сиалогликотоп ("СА 6 гликотоп") рецептора муцина Muc1. В предпочтительных воплощениях настоящее изобретение включает мышиное анти-СА 6 моноклональное антитело DS6 ("DS6 антитело") и гуманизированную версию DS6 антитела или версию с измененной поверхностью, где экспонированные на поверхности аминокислотные остатки антитела или его эпитопсвязывающих фрагментов как в легких, так и в тяжелых цепях заменены с тем, чтобы более близко напоминать известные поверхности человеческих антител. Гуманизированные антитела и их эпитопсвязывающие фрагменты настоящего изобретения обладают улучшенными свойствами, поскольку они являются значительно менее иммуногенными (или полностью неиммуногенными) в организме человека,которому они введены, чем полностью мышиные варианты. Таким образом, гуманизированные DS6 антитела и их эпитопсвязывающие фрагменты настоящего изобретения специфически распознают новый сиалогликотоп на рецепторе муцина Muc1, то есть СА 6 сиалогликотоп, несмотря на то, что они является неиммуногенными для человека. Гуманизированные антитела и их эпитопсвязывающие фрагменты могут быть конъюгированы с лекарственными агентами, таким как мейтансиноид, с образованием пролекарства, обладающего специфической токсичностью по отношению к клеткам, экспрессирующим антиген, за счет нацеливания лекарственного средства на СА 6 сиалогликотоп Muc1. Следовательно, цитотоксические конъюгаты, включающие такие антитела и небольшие высокотоксичные лекарственные агенты(например, мейтансиноиды, таксаны, и аналоги СС-1065), могут быть использованы как терапевтические средства для лечения опухолей, таких как опухоли молочной железы и яичников. Гуманизированные версии DS6 настоящего изобретения охарактеризованы здесь полностью в отношении аминокислотных последовательностей вариабельных областей как их легких, так и тяжелых цепей, последовательностей генов ДНК для вариабельных областей их легких и тяжелых цепей, идентификации областей, определяющих комплементарность (гипервариабельных участков, CDR), идентификации их аминокислотных остатков и раскрытия способов их экспрессии в рекомбинантной форме. В одном воплощении обеспечивается гуманизированное антитело DS6 или эпитопсвязывающий фрагмент его тяжелой цепи, включающий CDR с аминокислотными последовательностями, представленными SEQ ID NO: 1-3: и имеющими легкую цепь, которая включает CDR, имеющие аминокислотные последовательности,представленные SEQ ID NO:4-6: Обеспечивается также гуманизированное DS6 антитело и его эпитопсвязывающие фрагменты, содержащие вариабельную область легкой цепи, которая включает аминокислотную последовательность,имеющую по меньшей мере 90% идентичность последовательности с аминокислотной последовательностью, представленной SEQ ID NO:7 или SEQ ID NO: 8: Подобным образом обеспечиваются гуманизированные DS6 антитела и их эпитопсвязывающие фрагменты, имеющие вариабельную область тяжелой цепи, для которой характерна аминокислотная последовательность, которая имеет по меньшей мере на 90% идентичность последовательности аминокислотной последовательностью, представленной SEQ ID NO:9, SEQ ID NO:10 или SEQ ID NO: 11: В другом воплощении обеспечиваются гуманизированные DS6 антитела и их эпитопсвязывающие фрагменты, имеющие гуманизированную или с измененной поверхностью вариабельную область легкой цепи с аминокислотной последовательностью, соответствующей SEQ ID NO:8. Подобным образом обеспечиваются гуманизированные DS6 антитела и их эпитоп-связывающие фрагменты, имеющие гуманизированную вариабельную область тяжелой цепи или эту область с измененной поверхностью, для которой характерна аминокислотная последовательность, соответствующая Гуманизированные DS6 антитела и их эпитопсвязывающие фрагменты настоящего изобретения могут также включать замены определенных аминокислотных остатков (отмечены звездой в табл. 1) в одной или более позициях аминокислотных последовательностей легких и/тяжелых цепей. Таблица представляет аминокислотные остатки, характерные для поверхности каркаса мышиных антител, выявленные в пределах 5 ангстрем от CDR, которые необходимо заменить на аминокислотные остатки, характерные для человеческих антител. Например, для гуманизации антитела первый аминокислотный остаток Q в мышиной последовательности (SEQ ID NO:7) был замещен на Е (SEQ ID NO:8). Однако из-за близости этого остатка к CDR, для сохранения аффинности антител может требоваться обратная мутация на мышиный аминокислотный остаток Q. Таблица 1 Это демонстрируется далее в табл. 2, где показаны поверхностные аминокислотные остатки вариабельной области muDS6, выровненные по отношению к трем самым гомологичным поверхностным остаткам вариабельной области антитела человека. Аминокислотные остатки в табл. 1 соответствуют подчеркнутым аминокислотным остаткам в табл. 2. Дополнительно настоящее изобретение обеспечивает цитотоксичные коньюгаты, включающие (1) связывающийся с клеткой агент, который распознает и связывает CA6 гликотоп, и (2) цитотоксический агент. В цитотоксических коньюгатах агент, связывающийся с клеткой, имеет высокое сродство к СА 6 гликотопу, а цитотоксический агент имеет высокую степень цитотоксичности для клеток, экспрессирующих СА 6 гликотоп, таким образом, цитотоксические коньюгаты настоящего изобретения образуют агенты, эффективно уничтожающие клетки. В предпочтительном воплощении связывающийся с клеткой агент представляет собой анти-CA6 антитело или его эпитопсвязывающий фрагмент, более предпочтительно гуманизированное анти-CA6 антитело или его эпитопсвязывающий фрагмент, где цитотоксический агент ковалентно связан с антителом или его эпитопсвязывающим фрагментом напрямую или через расщепляемый или нерасщепляемый линкер. В более предпочтительных воплощениях связывающийся с клеткой агент представляет собой гуманизированное DS6 антитело или его эпитопсвязывающий фрагмент, и цитотоксический агент представляет собой таксол, мейтансиноид, СС-1065 или аналог СС-1065. В предпочтительных воплощениях изобретения связывающийся с клеткой агент представляет собой анти-CA6 антитело, а цитотоксический агент представляет собой такое цитотоксическое лекарственное средство, как мейтансиноид или таксан. Более предпочтительно, связывающийся с клеткой агент представляет собой гуманизированное анти-CA6 антитело DS6, а цитотоксический агент представляет собой соединение мейтансина, такое какDM1 или DM4. Настоящее изобретение включает также способ ингибирования роста клетки, экспрессирующей СА 6 гликотоп. В предпочтительных воплощениях способ ингибирования роста клетки, экспрессирующей СА 6 гликотоп, имеет место in vivo и приводит к смерти клеток, несмотря на то, что применение invitro и ex vivo также включено в изобретение. Настоящее изобретение также предоставляет терапевтическую композицию, включающую цитотоксический коньюгат и фармацевтически приемлемый носитель или эксципиент. Далее настоящее изобретение включает способ лечения субъекта, больного раком, с использованием терапевтической композиции. В предпочтительных воплощениях цитотоксический коньюгат включает анти-CA6 антитело и цитотоксический агент. В более предпочтительных воплощениях цитотоксический коньюгат включает коньюгат DM1 с гуманизированными DS6-антителами, коньюгат DM4 с гуманизированными DS6-антителами или коньюгат таксана с гуманизированными DS6-антителами, и коньюгат вводится вместе с фармацевтически приемлемым носителем или эксципиентом. Настоящее изобретение также содержит набор, включающий коньюгат "анти-CA6 антителоцитотоксический агент" и инструкции по применению. В предпочтительных воплощениях анти-CA6 антитело представляет собой гуманизированное DS6 антитело, цитотоксический агент представляет собой соединение мейтансина, такое как DM1 или DM4, или таксан, и инструкции по применению коньюгатов при лечении субъектов, больных раком. Набор может также включать компоненты, необходимые для приготовления фармацевтически приемлемого состава, определенный растворитель, если коньюгат находится в лиофилизированной или концентрированной форме, и для введения состава. Настоящее изобретение также включает производные антител, которые специфически связывают и распознают СА 6 гликотоп. В предпочтительных воплощениях производные антител готовят путем изменения поверхности или гуманизации антител, которые связывают СА 6 гликотоп, таким образом, у производных уменьшается иммуногенность по отношению к хозяину. Дополнительно настоящее изобретение обеспечивает гуманизированные антитела или их фрагменты, которые дополнительно метят для применения в исследованиях и для диагностики. В предпочтительных воплощениях метка является радиоактивной меткой, флуорофором, хромофором, формирующим изображение агентом или ионом металла. Обеспечивается также способ диагностики, в котором вышеупомянутые меченые гуманизированные антитела или их эпитопсвязывающие фрагменты вводят субъектам с подозрением на рак и измеряют или наблюдают распределение метки в теле субъекта.-4 014640 Настоящее изобретение также предусматривает способы лечения субъектов, больных раком, путем введения коньюгата гуманизированных антител настоящего изобретения, либо одного, либо в комбинации с другими цитотоксическими или терапевтическими агентами. Рак может быть один или более, например рак молочной железы, рак толстой кишки, карцинома яичников, рак эндометрия, остеосаркома,рак шейки матки, рак предстательной железы, рак легких, синовиальная саркома, рак поджелудочной железы, саркома или карцинома, в которых экспрессируется СА 6, или другой рак, для которого будет определено, что преимущественно экспрессируется СА 6 гликотоп. Если не утверждается иное, все ссылки и патенты, цитированные здесь, включены путем отсылки. Краткое описание фигур На фиг. 1 показаны результаты исследований, выполненных для того, чтобы установить способность DS6 антител связываться с поверхностью выбранных раковых линий клеток. Флуоресценцию клеточных линий, инкубированных с первичными антителами DS6 и ФИТЦ-коньюгированными антимышиными IgG(H+L) вторичными антителами, измеряли методом проточной цитометрии. DS6 антитело связывалось с Caov-3 (фиг. 1 А) и T-47D (фиг. 1 В) клетками с кажущимися Kd, равными 1,848 нМ и 2,586 нМ, соответственно. Показано, что антиген-негативные клеточные линии, SK-OV-3 (фиг. 1 С) и Colo205(фиг. 2 А и фиг. 2 В), SKMEL28 (фиг. 2 С) и Colo205 (фиг. 2D) отдельно наносили в виде пятен на нитроцеллюлозные мембраны и затем по отдельности инкубировали с проназой, протеиназой K, нейраминидазой и йодной кислотой. Затем на мембранах проводили иммуноблоттинг с DS6 антителами (фиг. 2 А),СМ 1 антителами (фиг. 2 В), R24 антителами (фиг. 2 С) или с С 242 антителами (фиг. 2D). На фиг. 3 показаны результаты дот-блот анализа экспрессии DS6 антигена. Клеточные лизаты Caov3 отдельно наносили в виде пятен на PVDF мембраны и затем инкубировали в присутствии трифторметансульфоновой кислоты (TFMSA). Затем на мембранах проводили иммуноблоттинг с СМ 1 антителами(1 и 2) или DS6 антителами (3 и 4). На фиг. 4 показаны результаты гликотопного анализа DS6 антигена. Клеточные лизаты Caov-3,предварительно обработанные N-гликаназой ("N-gly"), О-гликаназой ("О-gly") и/или сиалидазой ("S"),наносили в виде пятен на нитроцеллюлозу и затем проводили иммуноблоттинг с DS6 антителами или СМ 1 антителами (Muc-1 VNTR). На фиг. 5 показаны результаты Вестерн-блот анализа DS6 антигена. Клеточные лизаты иммунопреципитировали ("IP") и проводили иммуноблоттинг с DS6 антителами. Антиген соответствовал полосе белка с молекулярной массой более 250 кДа, наблюдаемой в антигенпозитивных клетках Caov-3 (фиг. 5 А и фиг. 5 В) и T47D (фиг. 5 С). Антигеннегативные клеточные линии SK-OV-3 (фиг. 5D) и Colo205 (фиг. 5 Е) не имеют данной белковой полосы. После иммунопреципитации Протеин G гранулы, полученные из клеточных лизатов Caov-3, инкубировали с (фиг. 5 А) нейраминидазой ("N") или (фиг. 5 В) йодной кислотой ("РА"). Антитело ("а"), контроль до IP ("Lys") и контроль "проскока" ("FT") лизатов после IP наносили на тот же гель. Иммунопреципитаты, полученные из Caov-3, инкубировали также с N-гликаназой ("Ngly"), О-гликаназой ("O-gly") и/или сиалидазой ("S") (см. фиг. 5F), где блот был альтернативно гибридизован с использованием биотинилированных DS6 и стрептавидин-HRP. На фиг. 6 показаны результаты иммунопреципитаций и/или иммуноблоттингов, проведенных с использованием DS6 антител и СМ 1 антител в клеточных лизатах Caov-3 (фиг. 6 А) и HeLa (фиг. 6 В). Перекрывающиеся СМ 1 и DS6 сигналы при Вестерн-блот анализе означают, что DS6 антиген расположен на белке Muc1. В лизатах HeLa дуплет Muc1 является результатом Muc1, на управляемой двумя отдельными аллелями, различающимися числом тандемных повторов. На фиг. 7 показана модель сэндвич-ELISA с DS6 антителом (фиг. 7 А) и стандартная кривая (фиг. 7 В). Стандартную кривую строили, используя известные концентрации коммерчески доступных стандартов СА 15-3 (где 1 единица СА 15-3 = 1 единица DS6). На фиг. 8 показаны стандартные кривые для количественной ELISA. Стандартные кривые детекции сигнала (фиг. 8 С) антитела (стрептавидин-HRP биотин-DS6) были построены путем использования известных концентраций биотин- DS6, либо после их связывания анти-мышиными IgG козы, сорбированными на планшете (фиг. 8 А), либо связанными непосредственно на ELISA-планшете (фиг. 8 В). На фиг. 9 показаны кДНК и аминокислотные последовательности вариабельного участка легкой цепи (фиг. 9 А) и тяжелой цепи (фиг. 9 В) DS6 антитела. В каждой последовательности подчеркнута тройка CDR (определение по Kabat). На фиг. 10 показана легкая (фиг. 10 А) и тяжелая (фиг. 10 В) цепи CDR мышиного DS6 антитела, установленные согласно определению по Kabat. Компьютерные программы моделирования AbM дают слегка различное определение CDR тяжелой цепи (фиг. 10 С). На фиг. 11 показаны аминокислотные последовательности легкой цепи ("muDS6LC") (остатки 1-95SEQ ID NO:7) и тяжелой цепи ("muDS6HC") (остатки 1-98 SEQ ID NO:9) мышиного DS6 антитетела, выровненные с последовательностями зародышевых линий генов IgVap4 (SEQ ID NO:23) и IgVh J558.41(SEQ ID NO:24). Серым цветом обозначена дивергенция последовательностей. На фиг. 12 показано 10 последовательностей легкой и тяжелой цепи антител, наиболее гомологич-5 014640 ных последовательностям легкой цепи мышиного DS6 (muDS6) ("muDS6LC") и тяжелой цепи("muDS6HC"), для которых в информационной базе Brookhaven имеются файлы расшифрованных структур. Последовательности были выровнены в порядке от наибольшей к наименьшей гомологии. На фиг. 13 показана информация о поверхностной доступности и расчеты, предсказывающие, какие каркасные остатки вариабельного участка легкой цепи мышиного DS6 анитетела являются поверхностно доступными. Отмечены позиции со средней величиной поверхностной доступности 25-35% , которые были подвергнуты второму раунду анализа. Вариабельный участок легкой цепи DS6 антитела (фиг. 13 А) и вариабельный участок тяжелой цепи (фиг. 13 В). На фиг. 14 показана карта экспрессионной плазмиды млекопитающих prDS6 v1.0. Эта плазмида была использована для построения и экспрессии рекомбинантных химерных и гуманизированных DS6 антител. На фиг. 15 показаны аминокислотные последовательности вариабельных доменов легкой цепи (фиг. 15 А) и тяжелой цепи (фиг. 15 В) мышиного ("muDS6") и гуманизированного ("huDS6") (v1.0 и v1.2) DS6 антитела. На фиг. 16 показаны аминокислотные последовательности вариабельного участка легкой цепи гуманизированного DS6 антитела ("huDS6") (v1.0 и v1.2). На фиг. 17 показаны кДНК и аминокислотные последовательности вариабельного участка тяжелой цепи гуманизированного DS6 антитела ("huDS6") v1.0 (фиг. 17 А) и v1.2 (фиг. 17 В). На фиг. 18 показаны кривые связывания в проточной цитометрии клонов muDS6 и huDS6, оцененные при анализе на клетках WISH. Сродство связывания химерных (фиг. 18 А), v1.0 и v1.2 клонов DS6 человека (Kd = 3,15, 3,71 и 4,20 нМ, соответственно) сопоставимы с (фиг. 18 В) нативным и биотинилированным мышиным DS6 (Kd = 1,93 и 2,80 нМ, соответственно). На фиг. 19 показаны результаты конкурентного анализа связывания huDS6 антител с muDS6 (фиг. 19 А). Клетки WISH инкубировали с биотин-muDS6 и стрептавидин-DTAF, строя кривую связывания с кажущейся Kd 6,76 нМ. (фиг. 19 В) Различные концентрации нативных muDS6, huDS6 v 1,0 и v 1,2 были объединены с 2 нМ биотин-muDS6 и вторичными стрептавидин-DTAF. На фиг. 20 показаны результаты определения сродства связывания неконьюгированного DS6 антитела по сравнению с коньюгатом "DS6 антитело-DM1". Результаты показывают, что конъюгация с DM1 не оказывает неблагоприятного действия на сродство связывания антитела. Кажущаяся Kd для коньюгата(2,020 нМ) ("DS6"). На фиг. 21 показаны результаты непрямого анализа жизнеспособности клеток при использованииDS6 антитела в присутствии или отсутствие коньюгата антимышиного IgG (H-L) с DM1 (2Ab-DM1). Антиген-позитивные клетки Caov-3 были уничтожены DS6-антитело-зависимым способом (IC50 = 424,9 пМ) только в присутствии вторичного коньюгата ("DS6 + 2Ab-DM1"). На фиг. 22 показаны результаты анализа комплемент-зависимой цитотоксичности (CDC) DS6 антитела и гуманизированного DS6 антитела. Результаты показали отсутствие опосредованного CDC эффектаDS6 антитела и гуманизированного DS6 антитела (v1.0 и v1.2) на клетки НРАС (фиг. 22A) и ZR-75-1(фиг. 22 В). На фиг. 23 показаны результаты in vitro анализа цитотоксичности коньюгата DS6 антитела с DM1 в сравнении со свободным мейтансином. При клоногенном анализе клеточные линии рака яичников (фиг. 23 А), молочной железы (фиг. 23 В), шейки матки (фиг. 23 С) и поджелудочной железы (фиг. 23D) были протестированы на цитотоксичность постоянного воздействия коньюгата DS6 антитела с DM1 (левые панели). Таким же образом эти клеточные линии тестировали на чувствительность к мейтансину путем 72-часового воздействия свободного мейтансина (правые панели). Тестировали линии клеток рака яичников OVCAR5, TOV-21G, Caov-4 и Caov-3. Тестировали линии клеток рака молочной железы T47D,ВТ-20 и ВТ-483. Тестировали линии клеток рака шейки матки KB, HeLa и WISH. Тестировали линии клеток рака поджелудочной железы НРАС, Hs766T и HPAF-II. На фиг. 24 показаны результаты in vitro анализа цитотоксичности коньюгата DS6 с DM1. При анализе жизнеспособности клеток, раковые клетки яичников человека (фиг. 24 А, фиг. 24 В и фиг. 24 С), молочной железы (фиг. 24D и фиг. 24 Е), шейки матки (фиг. 24F и фиг. 24G) и поджелудочной железы (фиг. 24 Н и фиг. 24I) были уничтожены зависимым от коньюгата DS6 антитела с DM1 образом. Нативные DS6 не оказывали неблагоприятного действия на рост этих клеток, демонстрируя, что конъюгация с DM1 является обязательной для обеспечения цитотоксичности. На фиг. 25 А показаны результаты изучения in vivo антиопухолевой эффективности коньюгата DS6 антитела с DM1 на привычных подкожных ксенотрансплантантах опухоли КВ. Опухолевые клетки инокулировали в нулевой день, а первое лечение проводили на 6 день. Лечение иммуноконьюгатом продолжали ежедневно до получения суммарно 5 доз. Контрольные животные, получавшие PBS, подвергались эвтаназии, как только объем опухоли превышал 1500 мм 3. Коньюгат давали в дозе от 150 до 225 мкг/кгDM1, соответствующей концентрации антител 5,7 и 8,5 мг/кг, соответственно. Массу тела мышей (фиг. 25 В) контролировали на протяжении курса исследования. На фиг. 26 показаны результаты изучения антиопухолевой эффективности коньюгата DS6 антитела-6 014640 с DM1 на привитых подкожных опухолевых ксенотрансплантантах. Клетки OVCAR5 (фиг. 26 А и фиг. 26 В), TOV-21G (фиг. 26 С и фиг. 26D), HPAC (фиг. 26 Е и фиг. 26F) и HeLa (фиг. 26G и фиг. 26 Н) в нулевой день инокулировали, а лечение иммуноконъюгатом проводили на 6 и 13 день. Контрольные животные, получившие PBS, подвергались эвтаназии, как только объем опухоли превышал 1000 мм. Коньюгат давали в дозе 600 мкг/кг DM1, соответствующей концентрации антител 27,22 мг/кг. Объем опухоли (фиг. 26 А, фиг. 26 С, фиг. 26 Е и фиг. 26G) и массу тела мышей (фиг. 26 В, фиг. 26D, фиг. 26F и фиг. 26 Н) контролировали на протяжении курса исследования. На фиг. 27 показаны результаты изучения in vivo антиопухолевой эффективности коньюгата DS6 антитела с DM1 на внутрибрюшинных опухолях OVCAR5. В нулевой день внутрибрюшинно вводили опухолевые клетки, и лечение иммуноконъюгатом проводили на 6 и 13 день. Животные подвергались эвтаназии при потере массы тела более 20%. На фиг. 28 показаны кривые связывания, полученные методом проточной цитометрии, при изучении сродства связывания нативного и коньюгированного с таксаном DS6 антитела на клетках HeLa. Конъюгация с таксаном (ММ 1-202) не имеет неблагоприятного эффекта на сродство связывания антитела. Кажущаяся Kd для коньюгата DS6-MM1-202 (1,24 нМ) была незначительно лучше, чем для нативногоDS6 антитела (620 рМ). Осуществление изобретения Настоящее изобретение среди других возможностей обеспечивает моноклональные анти-CA6 антитела, гуманизированные анти-CA6 антитела и фрагменты анти-CA6 антител. Каждое из антител или фрагментов антител настоящего изобретения предназначены для специфического распознавания и связывания СА 6 гликотопа на поверхности клетки. Известно, что СА 6 экспрессируется многими опухолями человека: 95% серозных карцином яичников, 50% эндометриоидных карцином яичников, 50% новообразований шейки матки, 69% новообразований эндометрия, 80% новообразований вульвы, 60% карцином молочной железы, 67% опухолей поджелудочной железы и 48% уротелиальных опухолей, но редко экспрессируется нормальными тканями человека. В сообщении Kearse и других, Int. J. Cancer 8S(6):S66-872 (2000) при использовании супернатанта гибридомы для характеристики был ошибочно определен белок, в котором был обнаружен СА 6 эпитоп как 80 кДа белок, содержащий N-связанный углевод, включающий СА 6 эпитоп. Позднее, используя очищенный DS6, мы показали, что СА 6 эпитоп обнаружен на О-связанном углеводе не связанного дисульфидом гликопротеина с массой более 250 кДа. Более того, гликопротеин был идентифицирован как муцин Muc1. Поскольку разные аллели Muc1 имеют различное число тандемных повторов в домене с вариабельным числом тандемных повторов (VNTR), клетки часто экспрессируют два различных белкаMuc1, отличающихся по размеру (Taylor-Papadimitriou. Biochim. Biophys. Acta 1455(2-3):301-13 (1999). Из-за различий в числе повторов в VNTR домене, а также различий в гликозилировании молекулярная масса Muc1 варьирует между клеточными линиями. Чувствительность иммунореактивности СА 6 к йодной кислоте показывает, что СА 6 является углеводным эпитопом "гликотопом". Кроме того, чувствительность иммунореактивности СА 6 к воздействию нейраминидаз Vibrio cholerae показывает, что СА 6 эпитоп представляет собой зависимым от сиаловой кислоты гликотоп, то есть "сиалогликотоп". Подробности характеристики могут быть найдены в примере 2 (смотри далее). Дополнительные детали можно найти в WO 02/16401; Wennerberg et al., Am. J. Pathol 143(4): 1050-1054 (1993); Smith et al.,Human Antibodies 9:61-65 (1999); Kearse et al., Int. J. Cancer 88(6):866-872 (2000); Smith et al., Int. J. Gynecol. Pathol. 20(3):260-6 (2001); и Smith et al., Appl. Immunohistochem. Mol. Morphol. 10(2): 152-8 (2002). Настоящее изобретение также включает цитотоксические коньюгаты, включающие два основных компонента. Первый компонент является связывающимся с клеткой агентом, который распознает и связывает СА 6 гликотоп. Связывающийся с клеткой агент должен распознавать и связывать с высокой степенью специфичности СА 6 сиалогликотоп на Muc1 для того, чтобы цитотоксические коньюгаты распознавали и связывали только те клетки, которые запланированы. Высокая степень специфичности позволит коньюгатам действовать направленным образом с малыми побочными эффектами в результате неспецифического связывания. В другом воплощении связывающийся с клеткой агент настоящего изобретения также распознает СА 6 гликотоп с высоким сродством, так что коньюгаты могут контактировать с клеткой-мишенью значительный отрезок времени, что позволяет порции цитотоксического лекарства действовать на клетку и/или предоставляет коньюгатам значительное время, в течение которого они могут интернализоваться клеткой. В предпочтительном воплощении цитотоксические коньюгаты включают анти-СА антитело в качестве связывающегося с клеткой агента, более предпочтительно моноклональное мышиное анти-CA6 антитело DS6. В более предпочтительном воплощении цитотоксический коньюгат включает гуманизированное DS6 антитело или его эпитоп-связывающий фрагмент. DS6 антитело способно распознавать СА 6 с высокой степенью специфичности и направляет цитотоксический агент к поврежденной клетке или ткани, такой как раковые клетки, направленным образом. Второй компонент цитотоксических коньюгатов настоящего изобретения представляет собой цито-7 014640 токсический агент. В предпочтительных воплощениях цитотоксическим агентом является таксол, мейтансиноид, такой как DM1 или DM4, СС-1065 или аналог СС-1065. В предпочтительных воплощениях,связывающийся с клеткой агент настоящего изобретения является ковалентно связанным с цитотоксическим агентом, напрямую или посредством расщепляемого или нерасщепляемого линкера. Связывающиеся с клеткой агенты, цитотоксические агенты и линкеры более подробно обсуждены ниже. Связывающиеся с клеткой агенты Эффективность соединений настоящего изобретения как терапевтических агентов зависит от тщательного отбора соответствующих связывающихся с клеткой агентов. Связывающиеся с клеткой агенты могут быть любыми из известных в настоящее время соединений или тех, которые станут известными, и включают пептиды и непептиды. Связывающийся с клеткой агент может представлять собой вещество,которое может связываться с клеткой либо специфическим, либо неспецифическим способом. Обычно ими могут быть антитела (особенно моноклональные антитела), лимфокины, гормоны, факторы роста,витамины, молекулы, транспортирующие питательные вещества (такие как трансферрин) или другие связывающиеся с клеткой молекулы или вещества. Более специфичные примеры связывающихся с клеткой молекул, которые могут быть использованы, включают:(д) гормоны, такие как инсулин, TRH (рилизинг фактор тиреотропина), MSH (меланоцитстимулирующий гормон), стероидные гормоны, такие как андрогены и эстрогены;(з) витамины, такие как фолиевая кислота. Антитела Отбор подходящего агента, связывающегося с клеткой, является предметом выбора, который зависит от конкретной клеточной популяции, которая представляет собой мишень, но обычно антитела являются предпочтительными, если соответствующие антитела доступны или могут быть приготовлены,более предпочтительны моноклональное антитела. Техника получения моноклонального антитела позволяет производить очень специфичные связывающиеся с клеткой агенты в форме специфичных моноклональных антител. Хорошо известна специалистам техника создания моноклональных антител, продуцируемых мышами, крысами, хомяками или другими млекопитающими, иммунизированными интересующим антигеном, таким как интактные клетки-мишени, выделенные из клетки-мишени антигены, целые вирусы, ослабленные целые вирусы и вирусные белки, такие как вирусные белки оболочки. Могут быть использованы также сенситизированные клетки человека. Другой метод создания моноклональных антител заключается в использовании фаговых библиотек scFv (одноцепочечный вариабельный участок), конкретно человеческий scFv (смотри, например, Griffiths et al., патенты США 5885793 и 5969108; McCafferty et al., WO 92/01047; Liming et al., WO 99/06587). Типичное антитело состоит из двух идентичных тяжелых цепей и двух идентичных легких цепей,которые объединены дисульфидными связями. Вариабельный участок является частью тяжелых цепей и легких цепей антитела, который отличается по последовательности между антителами и участвует в связывании и обеспечении специфичности каждого отдельного антитела к его антигену. Вариабельность обычно неравномерно распределена по вариабельным участкам антитела. Обычно она сконцентрирована внутри трех сегментов вариабельного участка, называемых участками, определяющими комплементарность (complementarity-determining regions, CDR) или гипервариабельными участками, в вариабельных участках обоих легкой и тяжелой цепей. Наиболее консервативные фрагменты вариабельных участков называются каркасными участками. Вариабельные участки тяжелых и легких цепей включают четыре каркасных области, по большей части принимающих структуру бета-листа, причем каждый каркасный участок соединен тремя CDR, которые формируют петли, соединяющие структуры бета-листа, и в некоторых случаях формируя часть структуры бета-листа. CDR в каждой цепи удерживается каркасными областями в тесной близости и вместе с CDR другой цепи способствует формированию антигенсвязывающего центра антител (Е. А. Kabat et al. Sequences of Proteins of Immunological Interest Fifth Edition, 1991, NIH). Константный участок является частью тяжелой цепи. Несмотря на невовлеченность напрямую в связывание антигена антителом, он проявляет разнообразные эффекторные функции, такие как совместное участие антитела в антитело-зависимой клеточной токсичности.-8 014640 Применимые для использования в настоящем изобретении моноклональные антитела включают моноклональное мышиное антитело DS6 (патент США 6596503; депозитный номер РТА-4449 в АТСС). Гуманизированные DS6 антитела или DS6 антитела с измененной поверхностью Предпочтительно, в качестве связывающегося с клеткой агента в настоящем изобретении используют гуманизированное анти-CA6-антитело. Предпочтительное воплощение такого гуманизированного антитела представляет собой гуманизированное DS6 антитело или его эпитопсвязывающий фрагмент. Целью гуманизации является уменьшение иммуногенности экзксеноогенного антитела, такого как мышиное антитело, для введения человеку при сохранении полного сродства связывания антигена и специфичности антитела при введении человеку. Гуманизированные антитела могут быть произведены с использованием нескольких технологий,таких как изменение поверхности и пересадка CDR. Как используется здесь, технология изменения поверхности использует комбинирование молекулярного моделирования, статистического анализа и мутагенеза с целью изменения не содержащих CDR поверхностей вариабельных участков антитела для придания сходства с поверхностями известных антител мишени-хозяина. Стратегии и методы для изменения поверхности антител и другие методы уменьшения иммуногенности антител внутри другого хозяина раскрыты в патенте США 5639641 (Pedersen et al.), которые таким образом целиком включены сюда путем отсылки. Коротко, в предпочтительном методе (1) производят выравнивание позиций совокупности вариабельных участков тяжелой и легкой цепей антитела с получением набора экспонированных на поверхности позиций каркаса вариабельного участка тяжелой и легкой цепей, где выровненные позиции для всех вариабельных областей идентичны по крайней мере на 95%;(2) определяют набор экспонированных на поверхности аминокислотных остатков каркаса вариабельного участка тяжелой и легкой цепей для антитела грызунов (или его фрагмента); (3) идентифицируют набор экспонированных на поверхности каркасных аминокислотных остатков каркаса вариабельного участка тяжелой и легкой цепи, который является наиболее идентичным набору экспонированных на поверхности аминокислотных остатков антитела грызунов; (4) набор экспонированных на поверхности аминокислотных остатков каркаса вариабельного участка тяжелой и легкой цепей, определенный на стадии (2), заменяют на набор экспонированных на поверхности аминокислотных остатков каркаса вариабельного участка тяжелой и легкой цепей, определенный на стадии (3), за исключением тех аминокислотных остатков, которые находятся в пределах 5 от любого атома любого остатка областей, определяющих комплементарность антитела грызуна; и (5) получают гуманизированное антитело грызуна,имеющее специфичность связывания. Антитела могут быть гуманизированы с использованием ряда других технологий, включая пересадку CDR (ЕР 0 239 400; WO 91/09967; патенты США 5530101 и 5585089), облицовку или изменение поверхности (ЕР 0592106; ЕР 0519596; Padlan E. А., 1991, Molecular Immunology 28(4/5):489-498; StudnickaG. M. et al., 1994, Protein Engineering 7(6):805-814; Roguska M.A. et al., 1994, PNAS 91:969-973) и перетасовку цепей (патент США 5565332). Антитела человека могут быть приготовлены рядом методов, известных специалистам, включая методы фагового дисплея. Смотри также патенты США 4444887,4716111, 5545806 и 5814313 и публикации международных патентных заявок с номерами WO 98/46645,WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741 (названные публикации целиком включены сюда путем отсылки). В предпочтительном воплощении настоящее изобретение обеспечивает гуманизированные антитела или их фрагменты, которые распознают новый сиалогликотоп (СА 6 гликотоп) на муцине Muc1. В другом воплощении гуманизированные антитела или их эпитопсвязывающие фрагменты имеют дополнительную способность ингибировать рост клетки, экспрессирующей СА 6 гликотоп. В более предпочтительных воплощениях обеспечиваются гуманизированные варианты DS6 антитела или варианты с измененной поверхностью, где экспонированные на поверхности аминокислотные остатки антитела или его фрагментов замещены в обеих легкой и тяжелой цепях таким образом, чтобы более близко напоминать известные поверхности антитела человека. Гуманизированные DS6 антитела или их эпитопсвязывающие фрагменты настоящего изобретения имеют улучшенные свойства. Например, гуманизированные DS6 антитела или их эпитопсвязывающие фрагменты специфично распознают новый сиалогликотоп (СА 6 гликотоп) на муцине Muc1. Более предпочтительно гуманизированные DS6 антитела или их эпитопсвязывающие фрагменты имеют дополнительную способность ингибировать рост клеток, экспрессирующих СА 6 гликотоп. Гуманизированное антитело или его эпитопсвязывающий фрагмент может быть коньюгирован с лекарством, таким как мейтансиноид, для образования пролекарства, имеющего специфическую цитотоксичность против антигенэкспрессирующих клеток за счет нацеливания лекарства на новый сиалогликотоп Muc1, CA6. Цитотоксические коньюгаты, включающие такие антитела и небольшую молекулу высокотоксичного лекарственного средства (например, мейтансиноиды,таксаны и аналоги СС-1065), могут использоваться в качестве терапевтических агентов для лечения опухолей, таких как опухоли молочной железы и яичников. Гуманизированные варианты DS6 антитела полностью здесь также охарактеризованы в отношении соответствующей аминокислотной последовательности их вариабельных участков обеих легкой и тяжелой цепей, ДНК-последовательности генов вариабельных участков легкой и тяжелой цепей, идентифика-9 014640 ции CDR, идентификации аминокислот их поверхности и раскрытия способа их экспрессии в рекомбинантной форме. В одном воплощении обеспечивается гуманизированное антитело или его эпитоп-связывающий фрагмент, имеющее тяжелую цепь, включающую CDR с аминокислотной последовательностью, представленной SEQ ID NO:1-3: В том случае, когда CDR тяжелой цепи определены при помощи программы для моделирования В том же воплощении гуманизированное антитело или его эпитоп-связывающий фрагмент имеет легкую цепь, которая состоит из CDR с аминокислотной последовательностью, представленной SEQ ID Обеспечиваются также гуманизированные антитела и их эпитоп-связывающие фрагменты, имеющие вариабельный участок легкой цепи с аминокислотной последовательностью, которая имеет по меньшей мере 90% степень идентичности последовательности с аминокислотной последовательностью,представленной SEQ ID NO:7 или SEQ ID NO:8: Подобным образом здесь обеспечиваются гуманизированные антитела и их эпитоп-связывающие фрагменты, имеющие вариабельный участок тяжелой цепи с аминокислотной последовательностью, которая имеет по меньшей мере 90% степень идентичности последовательности с аминокислотной последовательностью, представленной SEQ ID NO:9, SEQ ID NO:10 или SEQ ID NO:11: В другом воплощении обеспечиваются гуманизированные антитела и их эпитоп-связывающие фрагменты, имеющие гуманизированную вариабельную область легкой цепи или вариабельную область с измененной поверхностью, имеющую аминокислотную последовательность, соответствующую SEQ ID Также обеспечиваются гуманизированные антитела и их эпитоп-связывающие фрагменты, имеющие гуманизированную вариабельную область тяжелой цепи или область с измененной поверхностью,имеющую аминокислотную последовательность, соответствующую SEQ ID NO: 10 или SEQ ID NO:11: Гуманизированные антитела и их эпитоп-связывающие фрагменты настоящего изобретения могут также включать варианты вариабельных областей легкой и тяжелой цепи, в которых ближайшие к CDR человеческие поверхностные аминокислотные остатки замещены на соответствующие поверхностные остатки muDS6 в одном и более позициях, определяемых остатками в табл. 1 (нумерация Kabat), отмеченных звездочкой, для того, чтобы сохранить аффинность и специфичность связывания muDS6. Таблица 1 Здесь раскрыты первичная аминокислотная и ДНК последовательности легкой и тяжелой цепейDS6 антитела или его гуманизированных вариантов. Однако пределы настоящего изобретения не ограничены антителами и фрагментами, включающими в себя эти последовательности. Напротив, в настоящее изобретение включены все антитела и фрагменты, которые специфично связывают СА 6 в качестве уникального опухоль-специфичного гликотопа на рецепторе Muc1. Предпочтительно антитела и фрагменты, которые специфично связывают СА 6, также противодействуют биологической активности рецептора. Более предпочтительно, далее определенные антитела по существу лишены агонистической активности. Таким образом, антитела и фрагменты антител настоящего изобретения могут отличаться от DS6 антитела и его гуманизированных производных по аминокислотной последовательности и их укладке,CDR и/или легкой цепи и тяжелой цепи, но все еще находиться в рамках настоящего изобретения.CDR участки DS6 антитела идентифицированы с помощью моделирования, и их молекулярная структура была предсказана. Кроме того, в то время как CDR участки важны для распознавания эпитопа,они не являются существенными для антител и фрагментов изобретения. Таким образом, предусмотрены антитела и фрагменты с улучшенными свойствами, полученные, например, путем созревания по аффинности антител настоящего изобретения. Эмбриональный ген легкой цепи IgV ap4 мыши и эмбриональный ген тяжелой цепи, из которых,по всей видимости, было получено DS6, выровненные с последовательностью DS6 антитела, показаны на фиг. 11. Их сравнение показало вероятные соматические мутации в DS6 антителе, включая некоторые мутации в CDR участках. Последовательность вариабельного участка тяжелой цепи и легкой цепи DS6 антитела и последовательности CDR DS6 антитела не были ранее известны, и они представлены на фиг. 9 А и 9 В. Такая информация может быть использована для получения гуманизированных вариантов DS6 антитела. Фрагменты антитела Антитела настоящего изобретения включают как рассмотренное выше полноразмерное антитело,так и эпитопсвязывающие фрагменты. Используемые здесь "фрагменты антитела" включают любую часть антитела, которая сохраняет способность связывать эпитоп, распознаваемый целым антителом,обычно называемую "эпитоп-связывающие фрагменты". Примеры фрагментов антитела включают, но не ограничиваются, Fab, Fab' и F(ab')2, Fd, одноцепочечные Fvs (scFv), одноцепочечные антитела, дисульфид-связанные Fvs (dsFv) и фрагменты, включающие либо VL участок, либо VH участок. Эпитопсвязывающие фрагменты, включающие одноцепочечные антитела, могут включать одну(и) вариабельный(ые) область(и) или в сочетании с цельным или частью следующего: шарнирный участок, CH1, CH2 иCH3 домены. Таким образом, фрагменты могут содержать один или оба Fab-фрагмента или F(ab')2-фрагмент. Предпочтительно фрагменты антитела содержат все шесть участков CDR целого антитела, хотя фраг- 11014640 менты, содержащие не все эти участки, например три, четыре или пять CDR, также функциональны. Более того, фрагменты могут являться членами или могут объединять члены любого из следующих классов иммуноглобулинов: IgG, IgM, IgA, IgD или IgE, и их подклассы.Fab и F(ab')2 фрагменты могут быть получены путем протеолитического расщепления при использовании таких ферментов, как папаин (Fab-фрагменты) или пепсин (F(ab')2-фрагменты). Одноцепочечные FVs (scFvs) фрагменты являются эпитоп-связывающими фрагментами, которые содержат по меньшей мере один фрагмент вариабельного участка тяжелой цепи антитела (VH), связанный по меньшей мере с одним фрагментом вариабельного участка легкой цепи (VL). Линкер может быть коротким гибким пептидом, выбранным для обеспечения того, чтобы надлежащая пространственная укладка (VL) и (VH) областей имела место, когда они связаны, так, чтобы сохранить молекулярную специфичность связывания мишени целого антитела, из которого получен одноцепочечный фрагмент. Последовательность карбоксильного конца (VL) или (VH) может быть ковалентно связана с помощью линкера с аминоконцом комплементарной последовательности (VL) или (VH). Одноцепочечные фрагменты настоящего изобретения содержат аминокислотные последовательности, имеющие по меньшей мере один вариабельный участок или участок, определяющий комплементарность (CDR), целых антител, описанных в данном описании, но с отсутствием нескольких или всех константных доменов этих антител. Эти константные домены не являются необходимыми для связывания антигена, но составляют основную часть структуры целого антитела. Поэтому одноцепочечные антитела могут преодолевать некоторые из проблем, связанных с использованием антител, содержащих часть или все константные домены. Например, одноцепочечные фрагменты антитела имеют тенденцию быть свободными от нежелательных взаимодействий между биологическими молекулами и константным участком тяжелой цепи или другой нежелательной биологической активности. Кроме того, одноцепочечные фрагменты антитела значительно меньше, чем целые антитела, и, следовательно, могут иметь большую капиллярную проницаемость, чем целые антитела, позволяя одноцепочечным фрагментам антитела локализовывать и связывать в антигенсвязывающем центре мишень более эффективно. Также фрагменты антител могут быть получены в относительно больших количествах в прокариотических клетках, что таким образом облегчает их получение. Более того, относительно маленький размер одноцепочечных фрагментов антитела делает их менее склонными индуцировать иммунный ответ у реципиента по сравнению с целыми антителами. Одноцепочечные фрагменты антитела могут быть получены путем молекулярного клонирования, с помощью фагового дисплея библиотеки антител, или с использованием подобных методов, хорошо известных специалистам в данной области. Эти белки могут быть синтезированы, например, в эукариотических или прокариотических клетках, включая бактерии. Также эпитопсвязывающие фрагменты настоящего изобретения могут быть созданы с использованием методов фагового дисплея, известных специалистам. При использовании методов фагового дисплея, домены функционального антитела находятся на поверхности частиц фага, который несет полинуклеотидные последовательности, кодирующие их. В частности, такой фаг может быть использован для представления эпитопсвязывающего домена, экспрессируемого из репертуарной или комбинаторной библиотеки антител (например, человека или мыши). Фаг, экспрессирующий эпитопсвязывающий домен, который связывает интересующий антиген, может быть выбран или идентифицирован с использованием антигена, например с использованием меченого антигена, связанного или сорбированного на твердой поверхности или бусинах. Фаг, используемый в этих методах, обычно нитчатый фаг, включая fd и М 13. Связывающие домены экспрессируются фагом в виде Fab, Fv или стабилизированного дисульфидными связями Fv домена антитела, рекомбинантно слитого либо с белком гена III, либо гена белка VIII фага. Примеры методов фагового дисплея, которые могут быть использованы для приготовления эпитопсвязывающих фрагментов настоящего изобретения, включают те, что раскрыты у Brinkman et ah. 1995. J.Immunol. Methods lS2:41-50; Ames et ah. 1995. J. Immunol. Methods 1S4:177-186; Kettleborough et al., 1994,Eur. J. Immunol. 24:952-958; Persic et al., 1997, Gene 187:9-18; Burton et al., 1994, Advances in Immunology 57:191-280; PCT заявка No. PCT/GB91/01134; PCT публикации WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619; WO 93/11236; WO 95/15982; WO 95/20401 и патенты США: 5698426; 5223409; 5403484; 5580717; 5427908; 5750753; 5821047; 5571698; 5427908; 5516637; 5780225; 5658727; 5733743 и 5969108; каждый из которых во всей полноте включен сюда путем отсылки. После селекции фага те области фага, что кодируют фрагменты, могут быть выделены и использованы для получения эпитопсвязывающих фрагментов путем экспрессии в выбранном хозяине, включая клетки млекопитающих, клетки насекомых, клетки растений, дрожжи и бактерии с использованием технологии рекомбинантной ДНК, например, как подробно описано ниже. Например, могут быть применены также подходы для рекомбинантного получения фрагментов Fab, Fab' и F(ab')2 с использованием таких методов, что раскрыты в публикациях PCT WO 9222324; Mullinax et al., 1992. BioTechniques 12(6):864-S69; Sawai et al., 1995, AJRI 34:26-34; and Better et al., 1988, Science 240:1041-1043; названные публикации во всей полноте включены сюда путем отсылки. Примеры методов, которые могут быть использованы для производства одноцепочечных Fv и антител включают те, что описаны в патентах США 4946778 и 5 258498; Huston el al., 1991. Methods in Enzymology 203:46-SS; Shu et al., 1993, PNAS 90:7995- 12014640 7999; Skerra et al., 1988, Science 240:1038-1040. Функциональные эквиваленты В рамки настоящего изобретения включены также функциональные эквиваленты анти-CA6 антитела и гуманизированного анти-CA6 антитела. Термин "функциональные эквиваленты" включает антитела с гомологичными последовательностями, химерные антитела, искусственные антитела и модифицированные антитела, где, например, каждый функциональный эквивалент определен благодаря его способности связываться с СА 6. Специалист поймет, что имеется перекрывание между группой молекул, называемых "фрагментами антитела", и группой, называемой "функциональными эквивалентами." Способы получения таких эквивалентов раскрыты, например, в заявке РСТ WO 9321319, заявке на Европейский патент 239400; заявке РСТ WO 89/09622; заявке на Европейский патент 338745 и в заявке на Европейский патент European ЕР 332424, которые включены сюда во всей полноте путем отсылки. Антитела с гомологичными последовательностями являются антителами с аминокислотными последовательностями, которые имеют гомологию с последовательностью аминокислот анти-CA6 антитела и гуманизированного анти-CA6 антитела настоящего изобретения. Предпочтительно гомология имеет место в отношении вариабельных областей анти-CA6 антитела и гуманизированного анти-CA6 антитела настоящего изобретения. "Гомология последовательности" по отношению к аминокислотным последовательностям определяется здесь как последовательность, которая, по меньшей мере, примерно на 90, 91,92, 93 или 94% гомологична последовательности и более предпочтительно по меньшей мере примерно на 95, 96, 97, 98 или 99% гомологична другой аминокислотной последовательности, как определено, например, методом поиска FASTA в соответствии с Pearson and Lipman, Proc. Natl. Acad. Sci. USA S5, 24442448 (1988). Термин "химерное антитело", как он используется здесь, означает антитело, в котором различные части происходят из различных видов животных. Например, антитело, имеющее вариабельную область,происходящую из моноклонального антитела мыши, соединяют с константной областью иммуноглобулина человека. Способы получения химерных антител известны специалистам. Смотри, например, Morrison, 1985, Science 229:1202; Oi et al., 1986, BioTeehniques 4:214; Gillies et al., 1989, J. Immunol. Methods 125:191-202: патент США 5807715; 4816567 и 4816397, которые полностью включены сюда путем отсылки. Гуманизированные формы химерных антител получают путем замещения областей, определяющих комплементарность, например, антитела мыши, на каркасный домен человека, например, смотри РСТ патент WO92/22653. Гуманизированные химерные антитела предпочтительно имеют константные и вариабельные области иные, чем определяющие комплементарность области (CDR), происходящие по существу или исключительно из соответствующих областей антитела человека, и CDR, происходящие по существу или исключительно из млекопитающего, иного чем человек. Искусственные антитела включают scFv фрагменты, диантитела, триантитела, тетраантитела и mruImmunology 11: 548-557), каждое из которых обладает способностью связывать антиген. В единичной цепи Fv фрагмента (scFv) VH и VL домены антитела соединены гибким пептидом. Типично этот связующий пептид имеет длину примерно 15 аминокислотных остатков. Если связующий пептид намного меньше, например 5 аминокислотных остатков, образуются диантитела, которые являются бивалентными димерами scFv. Если линкер уменьшается до менее чем трех аминокислотных остатков, образуются тримерные и тетрамерные структуры, которые называют триантителами и тетраантителами. Наименьшей связывающей единицей антитела является CDR, типично CDR2 тяжелой цепи, который обладает достаточной распознающей и связывающей способностью, поэтому может быть использован отдельно. Такой фрагмент называется молекулярной единицей распознавания или mru. Несколько таких mru могут быть соединены с использованием коротких связующих пептидов, образуя, таким образом, искусственный связывающий белок с более высокой авидностью, чем единичный mru. Функциональные эквиваленты настоящей заявки включают также модифицированные антитела,например антитела, модифицированные путем ковалентного присоединения к антителу молекулы любого типа. Например, модифицированные антитела включают антитела, которые были модифицированы,например, путем гликозилирования, ацетилирования, модификации ПЭГ, фосфорилирования, амидилирования, дериватизации с использованием известных защитных/блокирующих групп, протеолитического расщепления, связывания с клеточными лигандами или другим белком и так далее. Ковалентное присоединение не препятствует генерации антителом антиидиотипического ответа. Эти модификации могут быть проведены с использованием известных методов, включая, но, не ограничиваясь этим, специфическое химическое расщепление, ацетилирование, формилирование, метаболический синтез туникамицина и так далее. Дополнительно модифицированные антитела могут содержать одну или более неклассических аминокислот. Функциональные эквиваленты могут быть получены путем взаимозамены различных CDR на различных цепях в пределах различных каркасов. Следовательно, например, возможно получение различных классов антител для данного набора CDR путем замены различных тяжелых цепей, например могут быть получены IgG1-4, IgM, IgA1-2, IgD, IgE типы и изотипы антител. Подобным образом можно сделать- 13014640 искусственные антитела в пределах рамок изобретения за счет встраивания данного набора CDR в полностью синтетический каркас. Функциональные эквиваленты могут быть легко получены путем мутации, делеции и/или встраивания в области вариабельных и константных последовательностей, которые фланкируют определенный набор CDR с использованием широкого набора способов, известных специалистам. Фрагменты антитела и функциональные эквиваленты настоящего изобретения включают молекулы с обнаруживаемой степенью связывания СА 6 по сравнению с DS6 антителом. Обнаруживаемая степень связывания включает все значения в ряду по меньшей мере 10-100%, предпочтительно по меньшей мере 50, 60 или 70%, более предпочтительно по меньшей мере 75, 80, 85, 90, 95 или 99% от связывающей способности DS6 антитела мыши к СА 6. Улучшенные антителаCDR представляют наибольшую важность для распознавания эпитопа и связывания антитела. Однако можно сделать изменения в остатках, которые входят в CDR, без нарушения способности антитела распознавать и связывать его родственный эпитоп. Например, могут быть произведены изменения, которые не влияют на распознавание эпитопа, но увеличивают сродство для связывания антитела. Следовательно, в рамки настоящего изобретения включаются также улучшенные варианты антител мыши и человека, которые также специфически распознают и связывают СА 6, предпочтительно с увеличенным сродством. В нескольких исследованиях были рассмотрены эффекты, обеспечиваемые изменением одного или более аминокислотных остатков в различных положениях последовательности антитела, основываясь на знании последовательности первичного антитела, на такие свойства, как связывание и уровень экспрессии (Yang. W. P. et al., 1995, J. Mol. BioL 254, 392-403; Rader, С et al., 1995, Proc. Natl. Acad. Sci. USA, 95,8910-8915; Vaughan, T. J. et al., 1993. Nature Biotechnology, 16, 535-539). В этих исследованиях путем изменения генов тяжелых и легких цепей в CDR1, CDR2, CDR3 или в каркасных областях с использованием таких методов, как олигонуклеотид-опосредованный сайтнаправленный мутагенез, кассетный мутагенез, подверженная ошибкам ПЦР, перетасовка ДНК или мутаторные линии Е. coli, были получены эквиваленты первичного антитела (Vaughan, Т. J. et al., I998, Nature Biotechnology, 16, 535-539: Adey, N. В. et al., 1996, Chapter 16. pp. 277-291. in "Phage Display of Peptides and Proteins", Eds. Kay, В. K. et al. Academic Press). Эти методы изменения последовательности первичного антитела привели к улучшению сродства вторичных антител (Gram, Н. et al., 1992, Proc. Natl.Short, M. K. et al., 2002, J. Biol. Chem., 277, 16365-16370; Furukawa, K. et al., 2001, J. Biol. Chem., 276,27622-27628). С помощью подобной направленной стратегии изменения одного или более аминокислотных остатков антитела последовательность антитела, описанная в этом изобретении, может быть использована для разработки анти-CA6 с улучшенной функцией, включая улучшенное сродство к СА 6. Улучшенные антитела могут также включать антитела, имеющие улучшенные характеристики, которые получают с использованием стандартных методов иммунизации животных путем получения гибридомы и селекции антител со специфическими характеристиками. Цитотоксические агенты Цитотоксический агент, использованный в цитотоксическом конъюгате настоящего изобретения,может быть любым соединением, которое приводит к смерти клетки или вызывает смерть клетки или неким образом снижает жизнеспособность клетки. Предпочтительно цитотоксический агент включает,например, мейтансиноиды и аналоги мейтансиноидов, таксоиды, аналоги СС-1065 и СС-1065, доластатин и аналоги доластатина, определенные ниже. Эти цитотоксические агенты соединяют с антителами,фрагментами антител, функциональными эквивалентами, улучшенными антителами и их аналогами, как раскрыто здесь. Цитотоксические конъюгаты могут быть получены с использованием методов in vitro. Для того чтобы связать лекарство или пролекарство с антителом, используется связующая группа. Подходящие связующие группы хорошо известны специалистам и включают дисульфидные группы, тиоэфирные группы, кислотолабильные группы, фотолабильные группы, группы, разрушаемые пептидазами и эстеразами. Предпочтительными связующими группами являются дисульфидные и тиоэфирные группы. Например, конъюгаты могут быть сконструированы с использованием реакции дисульфидного обмена или путем образования тиоэфирной связи между антителом и лекарством или пролекарством. Мейтансиноиды Среди цитотоксических агентов, которые могут быть использованы в настоящем изобретении для образования цитотоксического конъюгата, могут быть мейтансиноиды и аналоги мейтансиноидов. Примеры подходящих мейтансиноидов включают мейтансинол и аналоги мейтансинола. Мейтансиноиды представляют собой лекарства, которые ингибируют формирование микротрубочек и являются высокотоксичными для клеток млекопитающих. Примеры подходящих аналогов мейтансинола включают таковые, имеющие модифицированное- 14014640 ароматическое кольцо и таковые, имеющие модификации в других положениях. Такие подходящие мейтансиноиды раскрыты в патентах США 4424219; 4256746; 4294757; 4307016; 4313946; 4315929; 4331598; 4361650; 4362663; 4364866; 4450254; 4322348; 4371533; 6333410; 5475092; 5535499 и 5846545. Специфические примеры подходящих аналогов мейтансинола, имеющих модифицированное ароматическое кольцо, включают:(3) С-20-деметокси, С-20-ацилокси (-OCOR), +/-дехлоро (патент США 4294757) (приготовлены путем ацилирования с использованием ацилхлоридов). Специфические примеры подходящих аналогов мейтансинола, имеющие модификации в других положениях, включают:(1) C-9-SH (патент США 4424219) (получен путем реакции мейтансинола с H2S или P2S5);(6) С-18-N-деметил (патенты США 4362663 и 4322348) (получены путем деметилирования мейтансинола Streptomyces) и(7) 4,5-дезокси (патент США 4371533) (получен путем восстановления мейтансинола трихлоридом титана/LAH). В предпочтительном воплощении цитотоксические конъюгаты настоящего изобретения используют содержащие тиолы мейтансиноид (DM1), формально называемый N2-деацетил-N2'-(3-меркапто-1 оксопропил)мейтансин, в качестве цитотоксического агента. DM1 представлен следующей структурной формулой (I) В другом предпочтительном воплощении цитотоксические конъюгаты настоящего изобретения используют тиолсодержащий мейтансиноид N2'-деацетил-N2'-(4-метил-4-меркапто-1-оксопентил)мейтансин в качестве цитотоксического агента. DM4 представлен следующей структурной формулой (II) В дополнительном воплощении могут быть использованы другие мейтансины, включая тиол- и дисульфидсодержащие мейтансиноиды, несущие моно- или диалкильные заместители у атома углерода,несущего атом серы. Они включают мейтансиноиды, имеющие при атоме С-3, С-14 гидроксиметил, С-15 гидрокси или С-20 десметил ацилированную боковую аминокислотную цепь с ацильной группой, несущей заторможенную сульфгидрильную группу, где атом углерода ацильной группы, несущий тиоловую функциональную группу, имеет один или два заместителя, где названные заместители являются СН 3,С 2 Н 5, линейным или разветвленным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или ароматическим или гетероциклоалкильным радикалом, и дополнительно где один из заместителей может быть Н и где ацильная группа имеет линейную цепь с длиной по крайней мере три атома углерода между карбонильной функциональной группой и атомом серы.- 15014640 Такие дополнительные мейтансины включают соединения, представленные формулой (III) где Y' представляет где R1 и R2 каждый являются независимо CH3, С 2 Н 5 линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом, и дополнительно R2 может быть Н; А, В, D являются циклоалкилом или циклоалкенилом, имеющим 3-10 атомов углерода, простым или замещенным арилом или гетероциклическим ароматическим или гетероциклическим радикалом;R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12, каждый независимо, являются Н, CH3, С 2 Н 5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом;l, m, n, о, р, q, r, s, t и u каждый является независимо 0 или целым числом от 1 до 5, при условии, что по крайней мере два из l, m, n, о, р, q, r, s, t и u не равны 0 одновременно, и Z является Н, SR или -COR,где R является линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, или простым или замещенным арилом или гетероциклическим радикалом. Предпочтительное воплощение формулы (III) включает соединение формулы (III), гдеR1 является метилом, R2 является Н, и Z является Н. R1 и R2 являются метилом, и Z является Н. R1 является метилом, R2 является Н, и Z является -SCH3. R1 и R2 являются метилами, и Z является -SCH3. Такие дополнительные мейтансины включают также соединения, представленные формулой (IV-L),(IV-D) или (IV-D,L): где Y представляет где R1 и R2, каждый независимо, являются CH3, С 2 Н 5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом, и дополнительно R2 может быть Н;R3, R4, R5, R6, R7 и R8, каждый независимо, являются Н, CH3, С 2 Н 5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом,имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом;l, m и n, каждый независимо, являются целым числом от 1 до 5, и дополнительно n может быть 0;Z является Н, SR или -COR, где R является линейным или разветвленным алкилом или алкенилом,имеющим от 1 до 10 атомов углерода, циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов, или простым или замещенным арилом или гетероциклическим радикалом; иMay представляет мейтансиноид, который несет боковую цепь в положении С-3, С-14 гидроксиметил, С-15 гидрокси или С-20 десметил. Предпочтительные воплощения формул (IV-L), (IV-D) и (IV-D,L) включают соединения формулR1 и R2 являются метилом, каждый из R5, R6, R7, R8 являются Н, l и m являются 1, n - это 0, и Z является -SCH3. Предпочтительно цитотоксический агент представлен формулой (IV-L). Такие дополнительные мейтансины включают также соединения, представленные формулой (V): где Y представляет где каждый из R1 и R2 являются независимо CH3, С 2 Н 5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом, и дополнительно R2 может быть Н; каждый из R3, R4, R5, R6, R7 и R8 независимо является Н, СН 2, C2H5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом,имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом;l, m и n независимо являются целым числом от 1 до 5, и дополнительно n может быть 0; иZ является H, SR или -COR, где R является линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, или простым или замещенным арилом или гетероциклическим радикалом. Предпочтительные воплощения формулы (V) включают соединения формулы (V), гдеR1 и R2 являются метилом, R5, R6, R7, R8 являются каждый Н, l и m являются 1, n - это 0 и Z - это SCH3. Эти дополнительные мейтансины дополнительно включают соединения, представленные формулой где Y2 представляет где R1 и R2, каждый независимо, являются CH3, С 2 Н 5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом, и дополнительно R2 может быть Н;R3, R4, R5, R6, R7 и R8 независимо каждый являются Н, CH3, С 2 Н 5, линейным циклическим алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом;l, m и n, каждый независимо, являются целым числом от 1 до 5, и дополнительно n может быть равен 0;Z2 является SR или COR, где R является линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов- 17014640 углерода, или простым или замещенным арилом, или гетероциклическим радикалом; и May является майтонсиноидом. Такие дополнительные мейтансины включают также соединения, представленные формулой (VII) где Y2' представляет где R1 и R2, каждый независимо, являются CH3, С 2 Н 5, линейным или разветвленным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом, и дополнительно R2 может быть Н; А, В, и D, каждый независимо, являются циклоалкилом или циклоалкенилом, имеющим от 3 до 10 атомов углерода, простым или замещенным арилом, или гетероциклическим радикалом;R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12, каждый независимо, являются Н, СН 3, С 2 Н 5,линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом; 1, m, n, o, p, q, r, s, t и u, каждый независимо, являются 0 или целым числом от 1 до 5 при условии,что по меньшей мере два из l, m, n, о, р, q, r, s, t и u не являются нулем одновременно; иZ2 является SR или -COR, где R является линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, или простым или замещенным арилом или гетероциклическим радикалом. Предпочтительные воплощения формулы (VII) включают соединения формулы (VII), где R1 является метилом, и R2 является Н. Упомянутые выше мейтансиноиды могут быть конъюгированы с анти-CA6 антителом DS6 или его гомологом или фрагментом, где антитело связывают с мейтансиноидом с использованием тиоловой или дисульфидной функциональной группы, которая присутствует на ацильной группе боковой цепи ацилированной аминокислоты, находящейся в мейтансиноиде в положениях С-3, С-14 гидроксиметил, С-15 гидрокси или С-20 десметил, и где ацильная группа боковой цепи ацилированной аминокислоты содержит тиоловую или дисульфидную функциональную группу, расположенную у атома углерода, который имеет один или два заместителя, причем названные заместители являются CH3, С 2 Н 5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом, и дополнительно одни из заместителей может быть Н, и где ацильная группа имеет линейную цепь с длиной по меньшей мере три атома углерода между карбонильной функциональной группой и атомом серы. Предпочтительным конъюгатом настоящего изобретения является конъюгат, который включает анти-CA6 антитело DS6, или его гомолог или фрагмент, конъюгированное с мейтансиноидом формулы- 18014640 где А, В и D, каждый независимо, являются циклоалкилом или циклоалкилом, имеющим 3-10 атомов углерода, простым или замещенным арилом или гетероциклическим радикалом;R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12, каждый независимо, являются Н, CH3, С 2 Н 5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом; иl, m, n, о, р, q, r, s, t и u, каждый независимо, являются 0 или целым числом от 1 до 5, при условии,что по меньшей мере два из l, m, n, о, р, q, r, s, t и u не являются нулем одновременно. Предпочтительно R1 является метилом, и R2 является Н, или R1 и R2 являются метилами. Еще более предпочтительным конъюгатом настоящего изобретения является конъюгат, который включает анти-CA6 антитело DS6 или его гомолог или фрагмент, конъюгированный с мейтансиноидом формулы (IX-L), (IX-D) или (IX-D,L):Y1 представляет где R1 и R2, каждый независимо, являются CH3, C2H5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом, имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом, гетероциклическим радикалом, и дополнительно R2 может быть Н;R3, R4, R5, R6, R7 и R8, каждый независимо, являются Н, CH3, С 2 Н 5, линейным алкилом или алкенилом, имеющим от 1 до 10 атомов углерода, разветвленным или циклическим алкилом или алкенилом,имеющим от 3 до 10 атомов углерода, фенилом, замещенным фенилом или гетероциклическим радикалом;l, m и n, каждый независимо, являются целым числом от 1 до 5, и дополнительно n может быть 0; иMay представляет мейтансинол, который несет боковую цепь в положениях С-3, С-14 гидроксиметил, С-15 гидрокси или С-20 десметил. Предпочтительные воплощения формул (IX-L), (IX-D) и (IX-D,L) включают соединения формул(IX-L), (IX-D) и (IX-D,L), где R1 является метилом, и R2 является Н, или R1 и R2 являются метилами, R1 является метилом, R2 является Н, R5, R6, R7 и R8 каждый являются Н; l и m каждый являются l; n является 0,R1 и R2 являются метилом; R5, R6, R7 и R8 каждый являются Н; l и m являются l; n является 0. Предпочтительно цитотоксический агент представлен формулой (IX-L). Дополнительно предпочтительный конъюгат настоящего изобретения является конъюгатом, который включает анти-CA6 антитело DS6, или его гомолог или фрагмент, конъюгированный с мейтансиноидом формулы (X) где заместители определены, как в формуле (IX) выше. Особенно предпочтительными являются любые из описанных выше соединений, где R1 является метилом, R2 является Н, R5, R6, R7 и R8 каждый являются Н, l и m каждый являются 1, и n является 0. Далее особенно предпочтительными являются любые из описанных выше соединений, где R1 и R2 являются метилом; R5, R6, R7 и R8 каждый являются Н; l и m являются 1; n является 0. Дополнительно предпочтительным является L-аминоацильный стереоизомер. Каждый из мейтаносинидов, описанный в находящейся на рассмотрении заявке на патент США с номером 10/849136, поданной 20 мая 2004, также может быть использован в цитотоксическом конъюгате настоящего изобретения. Полное раскрытие заявки патента США с номером 10/849136 полностью включено сюда путем отсылки.- 19014640 Содержащие дисульфид связующие группы Для того чтобы связать мейтансиноид с агентом, связывающимся с клеткой, таким как антителоDS6, в мейтансиноид включают связующий (линкерный) компонент. Связующий компонент содержит химическую связь, которая позволяет освободить полностью активный мейтансиноид в определенном участке. Подходящие химические связи хорошо известны специалистам и включают дисульфидные связи, кислотолабильные связи, фотолабильные связи, связи, разрушаемые пептидазами и эстеразами. Предпочтительными являются дисульфидные связи. Связующий компонент включает также реакционноспособную химическую группу. В предпочтительном воплощении реакционноспособная химическая группа может быть ковалентно связана с мейтансиноидом через дисульфидную связь. Особенно предпочтительными реакционноспособными химическими группами являются Nсукцинимидильные сложные эфиры и N-сульфосукцинимидильные сложные эфиры. Особенно предпочтительными мейтансиноидами, включающими линкерный компонент, который содержит реакционноспособную химическую группу, являются С-3 сложные эфиры метансинола и его аналоги, где связующий компонент содержит дисульфидную связь и реакционноспособная химическая группа включает N-сукцинимидильные сложные эфиры или N-сульфосукцинимидильные сложные эфиры. Многие положения в молекулах мейтансиноидов могут служить в качестве положений для химического присоединения связующего компонента. Например, ожидается, что все следующие положения могут быть полезными для этого: С-3 положение, имеющее гидроксильную группу, С-14 положение, модифицированное гидроксиметилом, С-15 положение, модифицированное гидрокси группировкой, и С-20 положение, имеющее гидрокси группу. Однако положение С-3 является предпочтительным, а положение С-3 мейтансинола является особенно предпочтительным. Хотя синтез сложных эфиров мейтансинола, имеющего связующий компонент, описан в плане связующих компонентов, содержащих дисульфидную связь, специалисты поймут, что связующие компоненты с другими химическими связями (как описано выше) также могут быть использованы в настоящем изобретении, как могут быть использованы другие мейтансиноиды. Характерные примеры других химических связей включают кислотолабильные связи, фотолабильние связи, связи, разрушаемые пептидазами и эстеразами. Раскрытие патента США 5208020, включенного в данное описание, обучает производству мейтансиноидов, несущих такие связи. Синтез мейтансиноидов и производных мейтансиноидов, имеющих дисульфидную группировку,которая несет реакционноспособную группу, описан в патентах США 6441163 и 6333410 и заявке на патент США 10/161651, каждый из которых включен сюда путем отсылки. Мейтансиноиды, содержащие реакционноспособные группы, такие как DM1, вводят в реакцию с антителом, таким как DS6 антитело, для получения цитотоксических конъюгатов. Эти конъюгаты могут быть очищены с использованием жидкостной хроматографии высокого разрешения (ВЭЖХ) или путем гель-фильтрации. Несколько превосходных схем для получения таких конъюгатов антитело-мейтансиноид описаны в патенте США 6333410 и заявке на патент США 09/867598, 10/161651 и 10/024290, каждый из которых в своей полноте включен сюда путем отсылки. В общем, раствор антитела в водном буфере можно проинкубировать с молярным избытком мейтансиноидов, имеющих дисульфидную группировку, которая несет реакционноспособную группу. Реакция может быть прекращена добавлением избытка амина (такого как этаноламин, таурин и так далее). Затем конъюгат мейтансиноидантитело может быть очищен с использованием гель-фильтрации. Количество молекул мейтансиноида, связанных с молекулой антитела, может быть определено путем спектрофотометрических измерений соотношения поглощения света при длине волны 252 нм и 280 нм. В среднем предпочтительным является 1-10 молекул мейтансиноида /молекулу антитела. Конъюгаты антител с мейтансиноидами могут быть оценены по их способности подавлять пролиферацию различных нежелательных клеточных линий in vitro. Например, такие клеточные линии, как линия эпидермоидальной карциномы человека А-431, линия мелкоклеточного рака легких человека SW2,линия рака молочной железы человека SKBR3 и линия Namalwa лимфомы Беркитта, могут быть легко использованы для оценки цитотоксичности этих соединений. Клетки, которые должны быть оценены,могут быть выдержаны с соединениями в течение 24 ч, и фракции выживших клеток измеряются прямым анализом известными методами. Затем из данных анализа могут быть рассчитаны значения IC50. Содержащие ПЭГ связующие группы Мейтансиноиды могут быть также присоединены к агентам, связывающимися с клетками с использованием связующих групп ПЭГ, как определено в заявке США 10/024290. Эти связующие группы ПЭГ растворимы в воде и в неводных растворителях и могут быть использованы для присоединения одного или более цитотоксических агентов к агентам, связывающимся с клеткой. Примеры связующих групп ПЭГ включают гетеробифункциональные ПЭГ-линкеры, которые связываются с цитотоксическими агентами и агентами, связывающимися с клетками, на противоположных концах линкера через функциональные сульфгидрильную или дисульфидную группы на одном конце и активный сложный эфир на- 20014640 другом конце. Как основной пример синтеза цитотоксического конъюгата с использованием связующей группы ПЭГ снова делается ссылка на заявку на патент США 10/024290 в отношении подробностей. Синтез начинается с реакции одного или более цитотоксических агентов, несущих реакционноспособную группировку ПЭГ, с агентом, связывающимся с клеткой, что приводит к замещению терминального активного сложного эфира каждой реакционноспособной группировки ПЭГ аминокислотным остатком агента, связывающегося с клеткой, с получением цитотоксического конъюгата, включающего один или более цитотоксических агентов, ковалентно связанных с агентом, связывающимся с клеткой, через содержащую связующую группу ПЭГ. Таксаны Цитотоксический агент, использованный в цитотоксических конъюгатах в соответствии с настоящим изобретением, может быть также таксаном или его производным. Таксаны представляют собой семейство соединений, которое включает паклитаксел (Taxol), цитотоксический природный продукт, и доцетаксел (Таксотер), полусинтетическое производное, - два соединения, которые широко используются при лечении рака. Таксаны являются ядами, влияющими на митотическое веретено, которые ингибируют деполимеризацию тубулина, что приводит к смерти клетки. Хотя доцетаксел и паклитаксел являются полезными агентами при лечении рака, их антиопухолевая активность ограничена ввиду их неспецифической токсичности по отношению к нормальным клеткам. Дополнительно соединения, подобные паклитакселу и доцетакселу, сами по себе недостаточно сильны для использования в конъюгатах связывающихся с клетками агентов. Предпочтительным таксаном для использования в получении цитотоксических конъюгатов является таксан с формулой (XI) Способы синтеза таксанов, которые могут быть использованы в цитотоксических конъюгатах настоящего изобретения, вместе со способами конъюгации таксанов с агентами, связывающимися с клеткой, такими как антитела, подробно описаны в патентах США 5416064, 5475092, 6340701, 6372738 и 6436931 и в заявках на патент США 10/024290, 10/144042, 10/207814, 10/210112 и 10/369563. Аналоги СС-1065 Цитотоксический агент, используемый в цитотоксических конъюгатах в соответствии с настоящим изобретением, может быть также СС-1065 или его производным. СС-1065 является мощным противоопухолевым антибиотиком, выделенным из культуральной жидкости Streptomyces zelensis. СС-1065 in vitro является примерно в 1000 раз более сильным, чем широко используемые антираковые лекарственные препараты, такие как доксорубицин, метотрексат и винкристин (В.K1. Bhuyan et al., Cancer Res., 42, 3532-3537 (1982). СС-1065 и его аналог раскрыты в патентах США 6372738, 6340701, 5846545 и 5585499. Цитотокситеская способность СС-1065 коррелировала с его алкилирующей активностью и его ДНК-связывающей или ДНК-интеркалирующей активностью. Эти две активности находятся в разных частях молекулы. Таким образом, алкилирующая активность содержится в циклопропапирролоиндольной (CPI) субъединице и ДНК-связывающая активность находится в двух пирролоиндольных субъединицах. Хотя СС-1065 как цитотоксический агент обладает определенными привлекательными свойствами,он имеет ограничения при терапевтическом использовании. Введение СС-1065 мышам вызывало замедленную гепатотоксичность, приводящую к смерти на 50 день после единичной внутривенной дозы 12,5 мкг/кг V.L. Reynolds et al. J. Antibiotics. XXIX, 319-334 (1986). Были предприняты прямые попытки создать аналоги, которые не вызывали бы замедленной токсичности, и был описан синтез простых аналогов, смоделированных на основе СС-1065 М.А. Warpehoski et al. J. Med. Chem., 31, 590-603 (1988). В другом из аналогов CPI компонент был замещен циклопропабензиндольной (CBI) структуройD.L. Boger et al., J. Org. Chem., 55, 5S23-5S33, (1990), D.L. Boger et al., BioOrg. Med. Chem. Lett., 1, 115120 (1991). Эти соединения in vitro сохраняют высокую эффективность парентарального лекарственного средства, не вызывая замедленную токсичность у мышей. Подобно СС-1065, эти соединения являются алкилирующими агентами, которые ковалентным способом связываются с малой бороздкой ДНК, вызывая смерть клеток. Однако клиническая оценка наиболее перспективных соединений, адозелезина и карзелезина, привела к разочаровывающим результатам B.F. Foster et al., Investigational New Drags.13, 321- 21014640 326 (1996): I. Wolff et al., Clin. Cancer Res. 2, 1717-1723 (1996). Эти лекарства демонстрируют плохое терапевтическое действие из-за их высокой системной токсичности. Терапевтическая эффективность аналогов СС-1065 может быть значительно улучшена за счет изменения их распределения in vivo путем направленной доставки к опухоли, что приводит к пониженной токсичности по отношению к тканям, к которым они не направлены, и таким образом, к более низкой системной токсичности. Для того чтобы достичь этой цели, были описаны конъюгаты аналогов и производных СС-1065 с агентами, связывающимися с клеткой, которые специфически взаимодействуют с опухолевыми клетками (патенты США 5475092; 5535499; 5846545). In vitro эти конъюгаты обычно проявляют высокую цитотоксичность, специфичную по отношению к мишени, и исключительную антиопухолевую активность на моделях ксенотрансплаНтантов опухолей человека у мышей (R.V. J. Chari et al.,Cancer Res., 55, 4079-4084(1995. Способы синтеза аналогов СС-1065, которые могут быть использованы в цитотоксических конъюгатах настоящего изобретения вместе с методами конъюгации аналогов с агентами, связывающимися с клеткой, такими как антитела, подробно описаны в патентах США 5475092, 5846545, 5585499, 6534660 и 6586618 и в заявках на патент США 10/116053 и 10/265452. Другие лекарственные средства Такие лекарственные средства, как метотрексат, даунорубицин, доксорубицин, винкристин, винбластин, мелфалан, митомицин С, хлорамбуцил, калихеамицин, тубулизин и аналоги тубулизина, дуокармицин и аналоги дуокармицина, доластатин и аналоги долостатина, также являются подходящими для приготовления конъюгатов настоящего изобретения. Молекулы лекарственных средств также могут быть связаны с молекулами антитела с использованием промежуточной молекулы-носителя, такой как сывороточный альбумин. Соединения доксарубицин и данорубицин также могут быть полезными цитотоксическими агентами, как это описано, например, в заявке США 09/740991. Терапевтические композиции Настоящее изобретение обеспечивает также терапевтические композиции, которые включают:(a) эффективное количество одного или более цитотоксических конъюгатов и(b) фармацевтически приемлемый носитель. Подобным образом настоящее изобретение обеспечивает способ ингибирования роста избранных популяций клеток, включающий контактирование клеток-мишеней, или ткани, содержащей клеткимишени с эффективным количеством цитотоксического конъюгата, или терапевтическим агентом, включающим цитотоксический конъюгат, один или в комбинации с другими цитотоксическими или терапевтическими агентами. Настоящее изобретение включает также способ лечения субъекта, больного раком, с использованием терапевтической композиции настоящего изобретения. Эффективность и специфичность цитотоксических конъюгатов может быть оценена in vitro с помощью ранее описанных методов (смотри, например, RV.J. Chari et al., Cancer Res. 55:4079-40S4 (1995. Антиопухолевая активность может быть оценена с использованием модели ксенотрансплантанта человеческой опухоли у мышей с помощью ранее описанных методов (смотри, например, Liu et al., Proc. Natl.Acad. Sci. 93:8618-8623 (1996. Подходящие фармацевтически приемлемые носители хорошо известны и могут быть определены средним специалистом на основании клинической ситуации. Носители, используемые здесь, включают растворители и эксципиенты. Примеры подходящих носителей, растворителей и/или эксципиентов включают: (1) Фосфатносолевая среда Дульбекко, рН 7.4, содержащая или не содержащая примерно от 1 мг/мл до 25 мг/мл человеческого сывороточного альбумина, (2) 0,9% солевой раствор (0,9% вес/объем хлорид натрия (NaCl,и (3) 5% (вес/объем) декстроза; и может также содержать антиоксидант, такой как триптамин, и стабилизирующий агент, такой как Твин 20. Способ ингибирования роста выбранных популяций клеток может быть использован in vitro, in vivo или ex vivo. Ингибирование роста, как это используется здесь, означает замедление роста клетки,уменьшение жизнеспособности клетки, что вызывает смерть клетки, лизирование клетки и индукцию смерти клетки, в течение короткого или длительного периода времени. Примеры применения in vitro включают обработку взятого у той же особи костного мозга перед его трасплантацией тому же пациенту, для того чтобы убить больные или злокачественные клетки; обработку взятого у той же особи костного мозга перед его трасплантацией для того, чтобы убить компетентные Т-клетки и предотвратить болезнь трансплантант-против-хозяина (GVHD); обработку клеточных культур, для того чтобы убить все клетки, исключая желаемые варианты, которые не экспрессируют антигенмишень; или для того чтобы убить варианты, которые экспрессируют нежелательный антиген. Условия неклинического применения in vitro легко определяются средним специалистом. Примеры клинического применения ex vivo - это удаление опухолевых или лимфоидных клеток из костного мозга перед аутологичной трасплантацией при лечении рака или лечении аутоиммунной болезни, или для удаления Т-клеток и других лимфоидных клеток из аутологичного или аллогенного костного мозга или ткани перед трансплантацией, для того чтобы предотвратить GVHD. Лечение может быть про- 22014640 ведено следующим образом. Собирается костный мозг пациента или другого индивидуума и затем инкубируется в среде, содержащей сыворотку, к которой добавляется цитотоксический агент изобретения. Концентрации варьируют примерно от 10 мкМ до 1 пМ, в течение от примерно 30 мин до примерно 48 ч при температуре примерно 37 С. Точные условия, концентрации и время инкубации, то есть доза, легко определяется средним специалистом. После инкубации клетки костного мозга отмываются средой, содержащей сыворотку, и возвращаются пациенту путем внутривенной инфузии в соответствии с известными методами. При обстоятельствах, когда пациент получает другое лечение, такое как курс аблативной химиотерапии или облучение всего тела, между тем временем, когда собирается костный мозг и когда проводится реинфузия обработанных клеток, обработанные клетки костного мозга хранят замороженными в жидком азоте с использованием стандартного медицинского оборудования. Для клинического применения in vivo цитотоксический конъюгат изобретения будет поставляться в виде растворов, которые проверяются на стерильность и уровни эндотоксина. Примеры подходящих протоколов введения цитотоксического конъюгата являются следующими. Конъюгаты даются еженедельно в течение 4 недель как внутривенный болус. Болусные дозы вводят в 50-100 мл нормального солевого раствора, к которому можно добавить 5-10 мл человеческого сывороточного альбумина. Дозировки будут от 10 мкг до 100 мг/введение, внутривенно (в диапазоне от 100 нг до 1 мг/кг в день). Более предпочтительные дозировки будут в диапазоне от 50 мкг до 30 мг. Самые предпочтительные дозировки будут в диапазоне от 1 мг до 20 мг. После 4 недель лечения пациент может продолжать получать лечение на еженедельной основе. Конкретные клинические протоколы по отношению к пути введения, эксципиентам, растворителям, дозировкам, времени и так далее могут быть определены средним специалистам на основе клинической ситуации. Примеры медицинских состояний, которые можно лечить в соответствии со способами уничтожения выбранных популяций клеток in vivo или ex vivo, включают злокачественность любого типа, включая, например, рак легких, молочной железы, кишечника, простаты, почек, поджелудочной железы, яичника, шейки матки и лимфатических органов, остеосаркому, синовиальную карциному, саркому или карциному, при которых экспрессируется СА 6, и другие формы рака, которые еще только будут определены, в которых преимущественно экспрессируется гликотоп СА 6; аутоиммунные заболевания, такие как системная волчанка, ревматоидный артрит и множественный склероз, отторжение трансплантанта, такое как отторжение почечного трансплантанта, печеночного трасплантанта, трансплантанта легких, сердечного трасплантанта и трансплантанта костного мозга, GVHD, вирусные инфекции, такие как mV инфекция, ВИЧ-инфекция, СПИД и так далее; и паразитарные инфекции, такие как жиардиаз, амебиаз, шистозоматоз и другие, как определяется средним специалистом. Набор Настоящее изобретение включает также наборы, то есть включает описанный цитотоксический конъюгат и инструкцию по применению цитотоксического конъюгата для уничтожения определенных типов клеток. Инструкции могут включать указания по применению цитотоксических конъюгатов in vitro, in vivo или ex vivo. Типично, набор будет иметь отсек, содержащий цитотоксический конъюгат. Для включения в набор цитотоксический конъюгат может быть в лиофилизированной форме, жидкой форме или другой форме,пригодной для включения в состав набора. Набор может также содержать дополнительные элементы,необходимые для осуществления способа, описанного в инструкции к набору, такие как стерилизованный раствор для восстановления лиофилизированного порошка, дополнительные агенты для комбинирования с цитотоксическим конъюгатом перед введением пациенту и инструменты, которые нужны для введения конъюгата пациенту. Дополнительные воплощения Дополнительно настоящее изобретение обеспечивает моноклональные антитела, гуманизированные антитела и их эпитопсвязывающие фрагменты, которые дополнительно метят для использования в исследовательских или диагностических применениях. В предпочтительных воплощениях метка является радиоактивной меткой, флуорофором, хромофором, формирующим изображение агентом или ионом металла. Обеспечивается также способ диагностики, в котором названные меченые антитела или их эпитопсвязывающие фрагменты вводятся субъекту, подозреваемому на заболевание раком, и распределение метки в теле субъекта измеряется или регистрируется. Примеры Широкие рамки этого изобретения легче понимать при ссылке на следующие примеры, которые предназначены не для ограничения изобретения специфическими воплощениями. Пример 1. Идентификация антиген-позитивных и антиген-негативных клеточных линий с использованием анализа связывания на основе проточной цитометрии. Для локализации DS6 эпитопа СА 6 на поверхности клеток был использован анализ с использованием проточной цитометрии. Линии клеток человека были получены из Американской Коллекции Типовых Культур (American Type Culture Collection, ATCC) за исключением клеток OVCAR5 (Kearse et al., Int. J.- 23014640 растили на среде RPMI, дополненной 4 мМ L-глутамином, 50 ед./мл пенициллина, 50 мг/мл стрептомицина (Cambrex Bio Science, Rockland, ME) и 10% (объем/объем) сывороткой эмбриона теленка (AtlasBiologicals, Fort Collins, CO), обозначаемой здесь как культуральная среда. Клетки поддерживали при 37 С и 5% содержании СО 2 во влажном инкубаторе. Клетки (1-210-5 клеток/лунку) инкубировали на льду в течение 3-4 ч с серийно разведенными концентрациями антитела DS6, раствор которого готовили на буфере для FACS (2% сыворотка козы, RPMI) в 96-луночных планшетах. Клетки осаждали в настольной центрифуге с крышкой при 1500 об/мин в течение 5 мин при 4 С. После удаления среды лунки были повторно заполнены 150 мкл буфера для FACS. Затем стадию отмывания повторяли. Меченый ФИТЦ козий антимышиный IgG (Jackson Immunoresearch) был разведен в соотношении 1:100 буфером для FACS и инкубирован с клетками в течение 1 ч на льду. Планшет был покрыт фольгой для предотвращения фотообесцвечивания метки. После двух отмываний клетки фиксировали 1% формальдегидом и анализировали с использованием проточного цитометра. Эпитоп СА 6 был обнаружен преимущественно в клеточных линиях, происходящих из яичника, молочной железы, шейки матки и поджелудочной железы (табл. 3), как предсказано на основании иммуноцитохимии опухолей. Однако некоторые клеточные линии других типов опухолей демонстрировали ограниченную экспрессию СА 6. DS6 антитело связывается с кажущейся Kd 135,6 пМ (в клетках РС-3, табл. 3). Максимальная средняя флуоресценция (табл. 3) кривой связывания (фиг. 1) антиген-позитивных клеточных линий свидетельствует об относительной плотности антигена. Таблица 3 средний максимум относительной средней флуоресценции.- 24014640 Пример 2. Характеристика эпитопа DS6. Свойства антигена DS6, СА 6, были проанализированы путем иммуноблотинга дот-блотов лизатовCA6-позитивных клеток (Caov-3), которые были обработаны протеолитическими ферментами (проназой и протеиназой К) и/или гликолитическими воздействиями (нейраминидазой и йодной кислотой). Для позитивных контролей на лизатах антиген-позитивных клеточных линий (Caov-3 b CM1; Colo205 и С 242;SKMEL28 и R24) были тестированы другие антитела, распознающие разнообразные эпитопы. СМ 1 является антителом, распознающим белковый эпитоп домена (VNTR) Muc-1 с вариабельным числом тандемных повторов и, таким образом, обеспечивает контрольно-белковый эпитоп. С 242 связывается с новым специфическим зависимым от сиаловой кислоты гликотопом (CanAg) на Muc-1, характерным для колоректального рака, который обеспечивает контроль на гликотоп на белке. R24 связывается с GD3 ганглиозидом, который специфичен для меланомы и таким образом обеспечивает контроль на гликотоп, расположенный на небелковом каркасе. Клетки Caov-3, Colo205 и SKMEL28 помещали на 15-см чашки для культуры тканей. Культуральная среда (30 мл/чашку) был заменена за день до лизиса. Модифицированный буфер RIPA (50 мМ трисHCl, рН 7,6, 150 мМ NaCl, 5 мМ ЭДТА, 1% NP40, 0,25% дезоксихолат натрия), ингибиторы протеаз(PMSF, пепстатин А, лейпептин и апротинин) и PBS были предварительно охлаждены на льду. После того, как культуральная среда была удалена отсасыванием из чашек, клетки были дважды отмыты 10 мл охлажденного PBS. Все последующие стадии были проведены на льду и/или в холодной комнате при 4 С. После последнего промывания PBS был удален отсасыванием, клетки были лизированы в 1-2 мл буфере для лизиса (буфер RIPA со свежедобавленными ингибиторами протеаз до конечной концентрации 1 мМ PMSF, 1 мкМ пепстатин А, 10 мкг/мл лейпептин и 2 мкг/мл апротинин). Лизаты соскребали чашек с использованием съемника для клеток и растирали путем пипетирования суспензии вверх и вниз(5-10 раз) при помощи иглы 18G. Лизаты вращали в течение 10 мин и затем центрифугировали в микроцентрифуге на максимальных оборотах (13 тыс. об/мин) в течение 10 мин. Осадки отбрасывали и в супернатантах определяли белок по Бредфорду с использованием набора реактивов (Biorad). Лизаты (2 мкл) наносили пипеткой на сухие 0,2 мкм нитроцеллюлозные мембраны. Пятнам позволяли высохнуть на воздухе в течение примерно 30 мин. Мембраны были разрезаны на куски, каждый из которых содержал одно пятно. Кусочки мембраны с пятном инкубировали в присутствии проназы (1 мг/мл фермента, 50 мМ трис рН 7,5, 5 мМ CaCl2), протеиназы К (1 мг/мл фермента, 50 мМ трис рН 7,5, 5 мМ CaCl2), нейраминидазы (20 мЕд/мл фермента, 50 мМ ацетат натрия рН 6,5, 5 мМ CaCl2, 100 мкг/млBSA) или йодной кислоты (20 мМ, 0,5 М ацетат натрия, рН 5) в течение 1 ч при 37 С. Реагенты покупали у фирмы Roche (ферменты) и VWR (йодная кислота). Мембраны отмывали (5 мин) в T-TBS промывочном буфере (0,1% Твин 20, 1X TBS), блокировали в блокирующем буфере (3% BSA, T-TBS) в течение 2 ч при комнатной температуре и инкубировали в течение ночи с 2 мкг/мл первичного антитела (то естьDS6, СМ 1, С 242, R24) в блокирующем буфере при 4 С. Мембраны отмывали три раза в течение 5 мин вT-TBS буфере и затем инкубировали с HPR-конъюгированным козьим антимышиным (или человеческим) IgG вторичным антителом (Jackson Immunoresearch; разведение 1:2000 в блокирующем буфере) в течение 1 ч при комнатной температуре. Иммуноблоты были промыты три раза и проявлены с использованием системы ECL (Amersham). Иммуноблоты (фиг. 2) переваренных контрольных лизатов показали, что сигнал от СМ 1 был разрушен протеолитической обработкой, в то время как сигналы после разрушения углеводов сохранились,как ожидалось для антитела, распознающего белковый эпитоп. Сигнал от С 242 был разрушен либо протеолитической обработкой, либо разрушением углеводов, как ожидалось для антитела, распознающего гликотоп, находящийся на белке. Сигнал от R24, на который не влияла протеолитическая обработка, был устранен обработкой нейраминидазой или йодной кислотой, как ожидалось для антитела, распознающего ганглиозид. Иммуноблотинг дот-блотов переваренного лизата Caov-3 при помощи DS6 показал потерю сигнала при обработке, разрушающей либо белки, либо углеводные соединения. Таким образом, подобно С 242, DS6 связывается с углеводным эпитопом на белковом ядре. Более того, сигнал на DS6 иммуноблоте был чувствителен к обработке нейраминидазой. Таким образом, СА 6, подобно CanAg, является гликотопом, зависящим от сиаловой кислоты. Для того чтобы подтвердить углеводную природу СА 6, лизат Caov-3 наносили в виде пятен наPVDF мембрану и обрабатывали химическим дегликозилирующим агентом, трифторметансульфоновой кислотой (TFMSA) под азотом при температуре окружающей среды в течение 5 мин. Блот был промытT-TBS и иммуноблотирован либо с СМ 1, либо с DS6 (фиг. 3). Сигнал был разрушен при обработке кислотой, дополнительно свидетельствуя, что СА 6 является гликотопом. Усиление сигнала СМ 1 при обработке TFSMA показывает, что обработка кислотой не влияет на белок на фильтре, и позволяет предположить, что гликолитическая обработка демаскирует белковый эпитоп, распознаваемый СМ 1. Для дополнительного выявления структуры углевода, на котором находится СА 6, дот-блот был подвергнут перевариванию N-гликаназой, О-гликаназой и/или сиалидазой (фиг. 4). Лизаты клеток линии(Glyco), содержащего SDS и р-меркаптоэтанол. Затем денатурированные лизаты были подвергнуты перевариванию путем добавления 1 мкл N-гликаназы, О-гликаназы и/или сиалидазы A (Glyco) при 37 С в- 25014640 течение 1 ч. Затем переваренные лизаты были нанесены в виде пятен (2 мкл) на нитроцеллюлозу и иммуноблотированы, как описано выше.N-гликаназа не оказывала видимого действия на DS6 сигналы при иммуноблотинге. Однако образцы, переваренные сиалидазой, сигнала не давали. Поскольку О-гликаназа не может разрушать сиалированные О-связанные углеводы без предварительной обработки сиалидазой, DS6 сигнал образцов, обработанных одной O-гликаназой, не будет изменяться. N-гликаназа, напротив, для проявления активности не требует предварительной обработки любыми ферментами, разрушающими углеводы. Факт, что обработка N-гликаназой не влияет на DS6 сигнал, позволяет предполагать, что СА 6 эпитоп с наибольшей вероятностью представлен на сиалированных углеводных цепях, связанных О-гликозидными связями. Пример 3. Выявление антигена, на котором находится СА 6 эпитоп. Для идентификации антигена, на котором находится СА 6 сиалогликотоп, иммунопреципитаты DS6 были проанализированы с использованием электрофореза в полиакриламидном геле (SDS-PAGE) и Вестерн-блоттинга. Супернатанты клеточных лизатов (1 мкл/образец; 3-5 мг белка) предварительно были очищены с использованием бусин, конъюгированных с протеином G (30 мкл), уравновешены с 1 мл буфера RIPA в течение 1-2 ч при вращении и 4 С. Все последующие стадии были проведены на льду и/или при 4 С в холодной комнате. Бусины, предварительно освобожденные от неспецифически связанных белков, центрифугировали в течение 2-3 с на микроцентрифуге. Супернатант переносили в свежие пробирки и инкубировали в течение ночи с 2 мкг DS6 при вращении. К лизату добавляли свежие, уравновешенные бусины с протеином G (30 мкл) и инкубировали в течение 1 ч при вращении. Суспензию бусин в лизате быстро осаждали в микроцентрифуге и при необходимости отбирали, необязательно брали, образцы лизатов после иммунопреципитации. Бусины отмывали 5-10 раз с 1 мл буфера RIPA. Иммунопреципитированные при помощи DS6 образцы были подвергнуты перевариванию с 30 мкл нейраминидазы (20 мЕд нейраминидазы (Roche), 50 мМ ацетата натрия рН 5, 5 мМ CaCl2, 100 мкг/млBSA) или 30 мкл йодной кислоты (20 мМ йодной кислоты (VWR), 0,5 М ацетата натрия, рН 5,) в течение 1 ч при 37 С. Затем они были ресуспендированы в 30 мкл 2 Х буфера для образцов (содержащего меркаптоэтанол). Бусины кипятили в течение 5 мин и супернатанты в буфере для нанесения наносили на 4-12% или 4-20% трис-глициновый гель (Invitrogen). Образцы с геля подвергали разделению в электрофоретическом разделяющем буфере Леммли при 125 В в течение 1,5 ч. Белки геля были перенесены в течение ночи при силе тока 20 мА на 0,2 мкм нитроцеллюлозные мембраны (Invitrogen) с использованием аппарата для переноса "Mini Trans-blot"(Biorad). Мембраны были иммуноблотированы с DS6, как описано выше в примере 2. Альтернативно иммунопреципитированные бусины были сначала денатурированы и затем энзиматически переварены с использованием N-гликаназы, О-гликаназы и/или сиалидазы A (Glyko). Бусины ресуспендировали в 27 мкл буфера для инкубации и 2 мкл денатурирующего раствора (Glyko) и инкубировали при 100 С в течение 5 мин. После охлаждения до комнатной температуры был добавлен раствор детергента (2 мкл), и образцы инкубировали с 1 мкл N-гликаназы, О-гликаназы и/или сиалидазы А при 37 С в течение 4 ч. После добавления 5 Х буфера для образцов (7 мкл) образцы кипятили в течение 5 мин. Образцы были подвергнуты SDS-PAGE и иммуноблотированы, как описано выше.DS6 иммунопреципитирует белок с молекулярной массой более 250 кДа, который можно увидеть в лизатах антиген-позитивных клеток (фиг. 5 А, В и С). В некоторых клеточных линиях (то есть T-47D) наблюдается две белковых полосы (дублет). Полоса, соответствующая белку с молекулярной массой более 250 кДа, исчезала в иммунопреципитатах клеток Caov-3, которые были обработаны нейраминидазой или йодной кислотой (фиг. 5 А и В). Это позволяет предполагать, что эпитоп СА 6 находится на белке с молекулярной массой боле 250 кДа. Было также показано, что белок с молекулярной массой более 250 кДа нечувствителен к обработке иммунопреципитатов N-гликаназой, что согласуется с локализацией СА 6 на углеводе, связанном О-гликозидной связью (фиг. 5F). Дополнительным подтверждением того,что 250 кДа белковая полоса представляет собой антиген СА 6, является факт, что DS6 не иммунопреципитирует такой полосы из негативных по DS6 антигену клеток (фиг. 5 D и Е). Несколько линий доказательств позволяют предположить, что СА 6 антигеном был Muc1. Исходя из большой молекулярной массы и чувствительности к ферментам, расщепляющим О-гликозидные связи углеводов, кажется вероятным, что СА 6 антиген был муцином. Сверхэкспрессия муцина в опухолях,особенно в опухолях молочной железы и яичника, хорошо охарактеризована, что находится в соответствии с основной реактивностью опухолей в отношении DS6. Более того, CA6, подобно CanAg (сиалогликотоп на Muc1), нечувствителен к преципитации йодной кислотой, что позволяет предполагать, что СА 6 антиген является высоко О-гликозилированным. То наблюдение, что в некоторых клеточных линиях,экспрессирующих CA6, DS6 иммунопреципитирует дублет с молекулярной массой более 250 кДа, предполагает, что CA6 является Muc1. Признаком Muc1 у человека является присутствие двух различных аллелей Muc1, различающихся по количеству тандемных повторов, что приводит к экспрессии двух белков Muc1 с различной молекулярной массой. Для тестирования того, присутствует ли CA6 на Muc1, DS6 иммунопреципитаты из лизатов клетокCaov-3 были подвергнуты SDS-PAGE и иммуноблотированы либо с DS6, либо с антителом Muc1 VNTR,CM1. Как можно видеть на фиг. 6 А, СМ 1 интенсивно реагирует с белковой полосой с молекулярной мас- 26014640 сой более 250 кДа, иммунопреципитированной DS6. На фиг. 6 В DS6 и СМ 1 в иммунопреципитатах из лизата клеток HeLa при иммуноблотинге либо с DS6, либо с СМ 1 обнаруживается тот же белковый дублет с молекулярной массой более 250 кДа. Эти результаты показывают, что СА 6 эпитоп действительно расположен на белке Muc1. Наличие DS6 дублета, видимого в иммунопреципитатах из лизатов HeLa (иT-47D) клеток, может объясняться фактом, что экспрессия Muc1 направляется различными аллелями,имеющими различное число тандемных повторов. Хотя СМ 1 и DS6 связываются с одним и тем же белком Muc1, они имеют различные эпитопы. Химическое дегликозилирование дот-блотов лизата клеток Caov-3 с помощью трифторметансульфоновой кислоты (TFMSA) приводило к устранению сигнала от DS6 (фиг. 3). Однако та же обработка усиливала сигнал от СМ 1. Дегликозилирование может выявить скрытые эпитопы для антитела СМ 1. Более того,сравнение результатов связывания DS6 и СМ 1, проведенное методом проточной цитометрии (табл. 4),показывает, что СА 6 эпитоп не существует на каждой клетке, экспрессирующей Muc1. Интересно отметить, что эпитоп СА 6 не экспрессируется на Colo205 (табл. 3), клеточной линии, которая известна как экспрессирующая высокие уровни Muc1 CanAg сиалогликотопа. Таблица 4 ММР=максимальная средняя относительная флуоресценция Пример 4. Количественный анализ сброшенного СА 6 эпитопа. Поскольку СА 6 эпитоп располагается на Muc1, молекуле, которая, как известно, сбрасывается в кровеносное русло у многих пациентов, больных раком, был использован количественный подход для определения того, будет ли такой уровень непомерно высоким при терапии антителом DS6. Полагают,что связывание циркулирующего в крови антитела с антигеном приводит к быстрому выведению иммунного комплекса из крови. Если значительная порция введенной дозы антитела быстро удаляется из кровеносного русла, количество, достигающее опухоли, вероятно, уменьшится, что приведет к уменьшению антиопухолевой активности терапевтического антитела. Когда антитело конъюгировано с высокоактивным цитотоксическим соединением, быстрое выведение конъюгата может потенциально увеличить неспецифическую токсичность. Таким образом, в случае конъюгатов антитело-малая молекула, таких какDS6-DM1, высокие уровни распространения антигена могут приводить к снижению антиопухолевого эффекта и увеличению ограничивающей дозу токсичности. Недавние клинические испытания терапевтических средств на основе антител дали информацию относительно влияния концентрации сброшенного антигена на фармакокинетику. Например, в клинических исследованиях с трастузумабом (Герцептин), антителом, использованным для лечения метастатического рака молочной железы, экспрессирующего her2/neu, было показано, что фармакокинетика клиренса трастузумаба не изменяется, когда уровень сброшенного Her2/neu был менее 500 нг/мл (Pegram et al., J.Clin. Oncol. 16(8):2659-71 (1998). Предполагая, что молекулярная масса сброшенного Her2/neu составляет 110000 дальтон, молярная концентрация сброшенного Her2/neu менее 4,5 нМ, по-видимому, оказывает незначительное влияние на фармакокинетику. В другом примере клиническое испытание кантузумаба мертанзина (huC242-DM1) показало, что не было корреляции с уровнями сброшенного CanAg (эпитоп С 242) до обработки и фармакокинетикой клиренса антитела (Tolcher et al., J. Clin. Oncol. 21(2):211-22 (2003). Эпитоп CanAg, подобно эпитопу СА 6,распознаваемому DS6, является уникальным специфичным для опухоли О-связанным сиалогликотопом на Muc1. Однако гетерогенная природа эпитопа CanAg затрудняет его количественное определение в терминах молярности. В основном популяция Muc1 аллелей варьирует по длине в зависимости от количества тандемных повторов в домене с вариабельным числом тандемных повторов (VNTR). На каждом тандемном повторе имеется несколько участков для О-связанного гликозилирования. Дополнением к сложности экспрессия CanAg является вариация от клетки к клетке в присущей гликозилтрансферазной активности. Таким образом, даже у одного пациента возможны широкие вариации в числе CanAg эпитопов на молекулу Muc1. Более того, соотношение числа эпитопов CanAg на молекулу Muc1 будет различаться в популяции пациентов. По этой причине сброшенный CanAg в образцах сыворотки определяется с использованием сэндвич-ELISA теста, где сброшенный Muc1 с CanAg эпитопом улавливается С 242 и- 27014640 обнаруживается в системе биотинилированный С 242/стрептавидин HRP. Сброшенный CanAg определяется количественно в стандартных единицах (ед.) пропорционально количеству эпитопов на мл сыворотки, а не как молярная концентрация Muc1. Аналогичным образом подобная ситуация имеет место при количественном определении сброшенных СА 6 эпитопов. Напротив, для трастузумаба имеется только один эпитоп на her2/neu молекулу, что существенно упрощает количественное определение сброшенного антигена. Для того чтобы соотнести уровни сброшенного СА 6 эпитопа с таковыми, выявленными при клинических испытаниях трастузумаба и кантузумаба мертанзина, был разработан метод для получения молярных концентраций сложных сброшенных эпитопов, таких как сиалогликотопы на Muc1. Во-первых,был налажен простой анализ с использованием сэндвича-ELISA для DS6. Пример анализа приведен на фиг. 7A. DS6 был использован для связывания Muc1, имеющего СА 6 эпитоп. Поскольку каждая молекула Muc1 имеет множественные СА 6 эпитопы, биотинилированный DS6 был также использован как индикаторное антитело. Биотинилированный DS6, связанный с иммобилизованной молекулой СА 6, был обнаружен с использованием стрептавидин-HRP и ABST в качестве субстрата. СА 6 эпитоп был иммобилизован из сыворотки больной с раком яичника или из стандартов, которые были получены из коммерчески доступного тест-набора для Muc1 (CA15-3), используемого для мониторинга сброшенного Muc1 у пациентов при раке молочной железы. Уровень DS6 ед./мл был произвольно принят равным единицам/мл по стандарту СА 15-3. На фиг. 7 В показаны результаты сэндвича-ELISA с DS6, в котором использованы стандарты СА 153. Полученная кривая очень похожа на ту, что получена с СА 15-3 стандартами в системе для СА 15-3 анализа. Для того чтобы превратить DS6 ед./мл в молярные концентрации СА 6, требуется стандартная кривая для биотинилированного DS6, которая переводит сигнал в пикограммы DS6. Предполагая стехиометрию взаимодействия между эпитопом СА 6 и биотинилированным DS6 антителом один к одному и молекулярную массу для биотинилированного DS6 160000 дальтон, можно рассчитать моли связанного СА 6 на объем добавленного образца. На фиг. 8 А и 8 В представлены два альтернативных способа построения стандартной кривой для биотинилированного DS6. На фиг. 8 А использовались козьи поликлональные антитела против мышиногоIg для связывания биотинилированного DS6, которые, в свою очередь, детектировали способом, подобным тому, что использовался при анализе сэндвич-ELISA, показанном на фиг. 7. В методе, представленном на фиг. 8 В, биотинилированный DS6 был помещен непосредственно на планшет для ELISA и детектировался, как на фиг. 8 А. Как видно на фиг. 8 С, стандартные кривые для биотинилированного DS6, полученные с использованием каждого метода, находятся в хорошем соответствии друг с другом. В табл. 5 показаны результаты анализа образцов сыворотки пациентов, больных раком яичников, на различные сброшенные антигены. СА 125 ELISA в основном используется для мониторинга хода лечения пациентов, больных раком яичников, путем измерения сброшенного СА 125 ед./мл. Статус по СА 125 сопровождал образцы сыворотки. В основном СА 15-3 ELISA используется для мониторинга хода лечения пациентов, больных раком молочной железы, путем измерения концентрации (ед./мл) сброшенного Muc1 с использованием связывания и детекции антител, распознающих эпитопы, отличные от тех, которые распознаются DS6. В табл. 5 приведены данные об измерении СА 15-3 в образцах сыворотки пациентов,больных раком яичников. Таблица 5 определено с использованием коммерческого набора ELISA; определено с использованием коммерческих стандартов СА 15-3 (1 ед. СА 15-3=1 ед.DS6); 3 стандартная кривая с козьим анти-мышиным IgG и биотин-DS6; 4 стандартная кривая с биотин-DS6. Для получения значений СА 15-3, приведенных в табл. 5, был использован коммерчески доступный 2- 28014640 набор СА 15-3 для иммуноферментного анализа от CanAg Diagnostics. Для DS6 (ед./мл) была построена стандартная кривая с использованием СА 15-3 стандарта (из набора СА 15-3 для иммуноферментного анализа от CanAg Diagnostics) в DS6 сэндвич-ELISA. Ед./мл DS6 было произвольно выбрана равной ед./мл СА 15-3. В последних двух колонках пикомолярные (пМ) концентрации сброшенного СА 6 были рассчитаны с использованием стандартных кривых для биотинилированного DS6, показанных на фиг. 8 С. Для количественного анализа уровней CanAg сывороточные уровни CanAg были таковыми, которые сообщались для пациентов, участвующих в клиническом испытании кантузумаба мертанзина, до лечения (Tolcher et al., J.Clin. Oncol. 21(2):211-22(2003). Анализ ELISA, аналогичный таковому, описанному для DS6, был использован для получения стандартной кривой для CanAg с использованием стандартов CanAg. C242 был использован для адсорбции стандартов CanAg. Детекция адсорбированного CanAg была достигнута с использованием биотинилированных С 242 в качестве индикатора с последующим проявлением стрептавидин-HRP и ABTS в качестве субстрата. Была сконструирована стандартная кривая для биотинилированного С 242, такая как сделанная для биотинилированного DS6, что позволяло превращать ед./мл в молярные концентрации циркулирующих CanAg эпитопов. В табл. 6 сообщается об уровнях CanAg у пациентов из клинического испытания кантузумаба мертанзина с соответствующими рассчитанными молярными концентрациями циркулирующего CanAg. Таблица 6 Уровни циркулирующего в крови CanAg до лечения, измеренные с использованием сэндвичELISA; 2 Стандартная кривая, построенная с использованием козьих анти-мышиных IgG биотин-С 242; 3 Стандартная кривая для биотин-С 242. Сравнение уровней сброшенного СА 6 (в пМ) у пациентов с раком яичников с таковыми, рассчитанными для сброшенного CanAg у CanAg-позитивных пациентов больных раком, показывает, что в основном уровни сброшенного СА 6 сходны с уровнями сброшенного CanAg. Более того, только 2 из 16 образцов сыворотки пациентов, больных раком, потенциально имели уровни СА 6 больше, чем 4,5 нМ (образцы сыворотки 5 и 9, сигнал которых находится вне ряда стандартной кривой), - уровень, выше которого наблюдалась измененная фармакокинетика герцептина при клинических испытаниях у Her2/neuположительных пациентов с раком молочной железы. Уровни CanAg выше 4,5 нМ наблюдались только у
МПК / Метки
МПК: C07K 16/00, C07H 21/04, A61K 39/395
Метки: применения, способы, эпитоп-связывающий, которые, связываются, антитело, гликотопом, са6, фрагмент
Код ссылки
<a href="https://eas.patents.su/30-14640-antitelo-ili-ego-epitop-svyazyvayushhijj-fragment-kotorye-svyazyvayutsya-s-glikotopom-sa6-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Антитело или его эпитоп-связывающий фрагмент, которые связываются с гликотопом са6, и способы их применения</a>
Предыдущий патент: Система мобильной связи, устройство базовой станции и устройство мобильной станции
Следующий патент: Сукцинатная и малонатная соли транс-4-((1r,3s )-6 хлор-3-фенилиндан -1-ил)-1,2,2-триметилпиперазина и их применение в качестве лекарственного средства
Случайный патент: Связанные с полиэтиленгликолем соединения гпп-1












