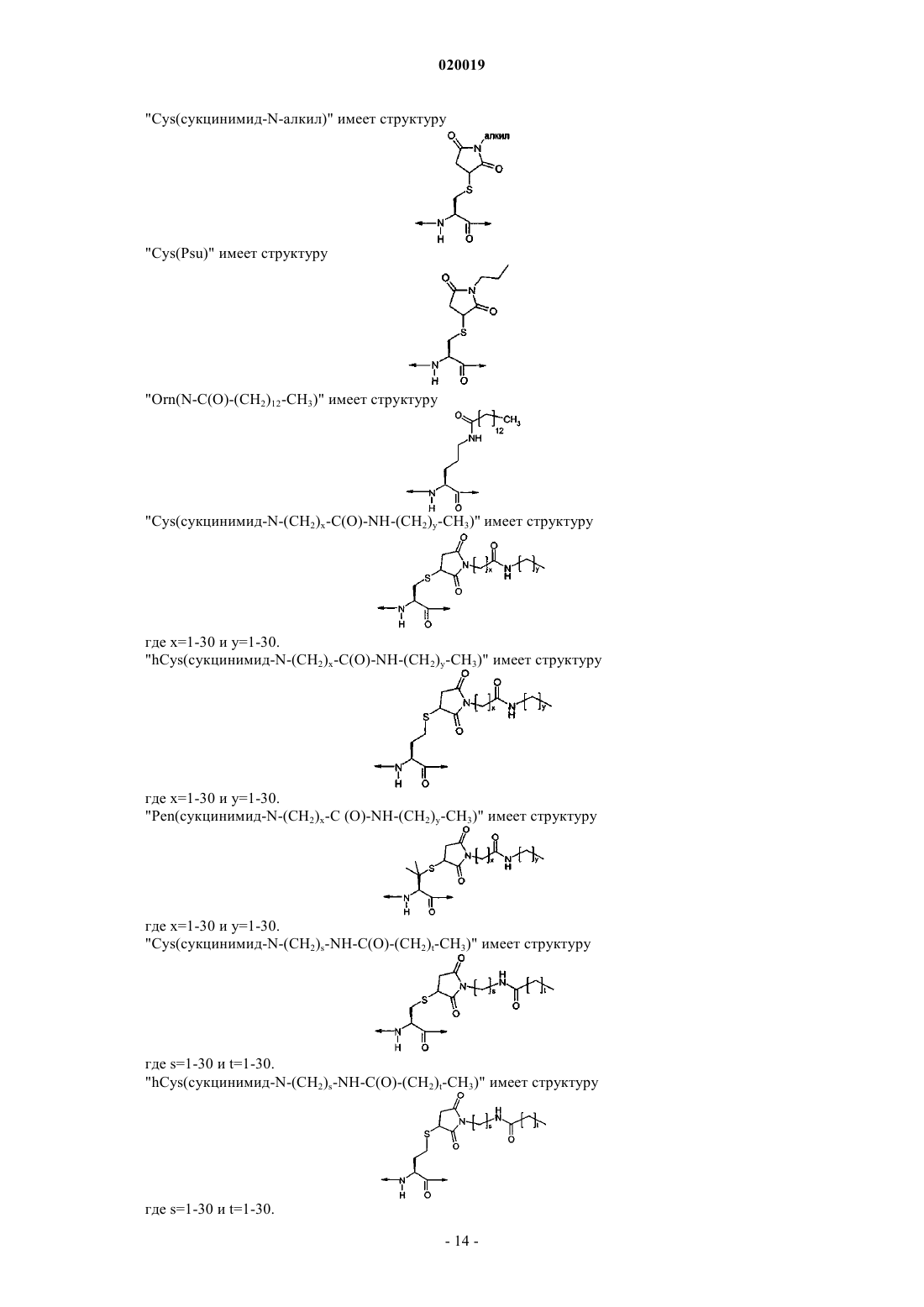
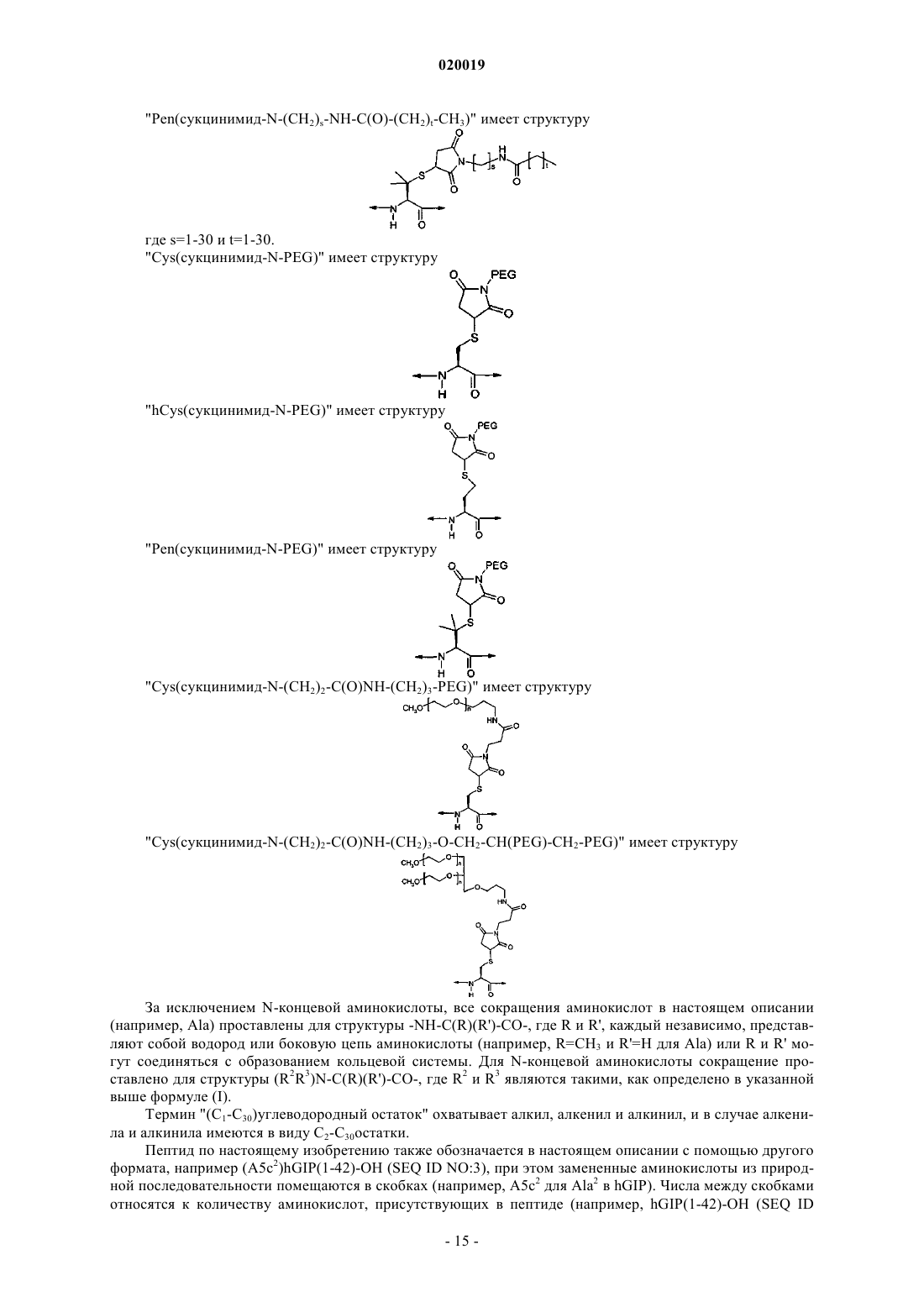
Аналоги глюкозозависимого инсулинотропного полипептида
Формула / Реферат
1. Соединение формулы (I)

в котором А1 представляет собой Tyr, N-Me-Tyr, 4Hppa или Orn(N-C(O)-(СН2)12-СН3);
А2 представляет собой Ala, A5c, А6с, Aib, D-Ala или Gly;
А3 представляет собой Glu, Dhp, 3Нур, 4Нур, Pro, hPro или Tic;
А4 представляет собой Gly или Aib;
А5 представляет собой Thr, A5c или Aib;
А6 представляет собой Phe;
А7 представляет собой Ile, А5с, А6с или Aib;
А8 представляет собой Ser или Aib;
А9 представляет собой Asp или Aib;
А10 представляет собой Tyr;
А11 представляет собой Ser, A5c, А6с или Aib;
А12 представляет собой Ile, А5с или Aib;
А13 представляет собой Ala или Aib;
А14 представляет собой Met, A5c, А6с или Nle;
А15 представляет собой Asp;
А16 представляет собой Lys;
А17 представляет собой Ile или А6с;
А18 представляет собой His;
А19 представляет собой Gln;
А20 представляет собой Gln;
А21 представляет собой Asp;
А22 представляет собой Phe;
А23 представляет собой Val;
А24 представляет собой Asn;
А25 представляет собой Trp;
А26 представляет собой Leu или А6с;
А27 представляет собой Leu или А6с;
А28 представляет собой Ala или Aib;
А29 представляет собой Gln;
А30 представляет собой Lys;
А31 представляет собой Gly, Aib, Cys(Psu), His или отсутствует;
А32 представляет собой Lys, Cys(Psu) или отсутствует;
А33 представляет собой Lys, Cys(Psu) или отсутствует;
А34 представляет собой Asn, Cys(Psu) или отсутствует;
А35 представляет собой Asp, Cys(Psu) или отсутствует;
А36 представляет собой Trp, Cys(Psu) или отсутствует;
А37 представляет собой Lys, Cys(Psu) или отсутствует;
А38 представляет собой His, Cys(Psu) или отсутствует;
А39 представляет собой Asn, Cys(Psu) или отсутствует;
А40 представляет собой Ile, А5с, А6с, Cys(Psu) или отсутствует;
А41 представляет собой Thr, А5с, А6с, Aib, Cys(Psu) или отсутствует;
А42 представляет собой Gln или отсутствует;
А43 представляет собой Cys(Psu), Gln, His или отсутствует;
R1 представляет собой ОН, NH2, (C1-C30)алкокси или NH-X2-CH2-Z0, где X2 представляет собой (С0-С30) углеводородный остаток и Z0 представляет собой Н, ОН, СО2Н или CONH2;
каждый из R2, R3 и R4 независимо выбирают из группы, состоящей из Н, (C1-C30)алкила, (C1-C30)гетероалкила, (C1-С30)ацила, (C2-C30)алкенила, (C2-C30)алкинила, арил(C1-C30)алкила, арил(C1-C30)ацила, замещенного (C1-C30)алкила, замещенного (C1-С30)гетероалкила, замещенного (C1-C30)ацила, замещенного (С2-С30)алкенила, замещенного (C2-C30)алкинила, замещенного арил(С1-С30)алкила и замещенного арил(C1-C30)ацила; при условии, что, когда R2 представляет собой (C1-C30)ацил, арил(C1-C30)ацил, замещенный (C1-C30)ацил или замещенный арил(C1-C30)ацил, тогда R3 представляет собой Н, (C1-C30)алкил, (C1-C30)гетероалкил, (С2-С30)алкенил, (С2-С30)алкинил, арил(C1-C30)алкил, замещенный (C1-С30)алкил, замещенный (C1-C30)гетероалкил, замещенный (С2-С30)алкенил, замещенный (C2-C30)алкинил или замещенный арил(С1-С30)алкил; при дополнительном условии, что, когда R4 представляет собой (C1-C30)ацил, арил(C1-C30)ацил, замещенный(C1-C30)ацил или замещенный арил(C1-C30)ацил, тогда R5 представляет собой Н, (C1-С30)алкил, (C1-C30)гетероалкил, (C2-C30)алкенил, (С2-С30)алкинил, арил (C1-C30)алкил, замещенный (C1-C30)алкил, замещенный (С1-С30)гетероалкил, замещенный (C2-C30)алкенил, замещенный (С2-С30)алкинил или замещенный арил(C1-C30)алкил;
n представляет собой, независимо для каждого случая, целое число от 1 до 5 включительно;
s, t, х и у, каждый независимо, представляют собой для каждого случая целое число от 1 до 30 включительно;
при условии, что, когда А1 представляет собой 4Нрра, тогда R2 и R3 отсутствуют;
при дополнительном условии, что только одна аминокислота в положениях 1, 2 или 3 соединения заменена или модифицирована;
при условии, что соединение содержит по меньшей мере одну дополнительную аминокислотную замену или модификацию в любом из положений 4-42, которая не является аминокислотным остатком в соответствующем положении в нативном GIP;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, которое представляет собой




или его фармацевтическая соль.
3. Соединение по п.1, в котором А2 представляет собой D-Ala, или его фармацевтически приемлемая соль.
4. Соединение по п.3, которое представляет собой


или его фармацевтическая соль.
5. Соединение по п.1, в котором А31-А43 отсутствуют, или его фармацевтически приемлемая соль.
6. Соединение по п.5, которое представляет собой

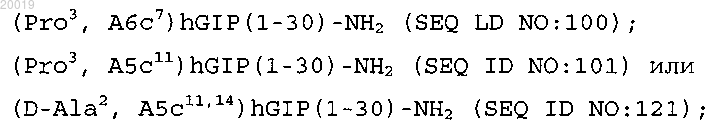
или его фармацевтическая соль.
7. Соединение, состоящее, по существу, из остатков 1-30 SEQ ID NO:1, где последовательность дополнительно содержит замену А5с, А6с, Aib, D-Ala или Gly в положении 2 и по меньшей мере одну дополнительную аминокислотную замену или модификацию в положениях 3-30, или его фармацевтически приемлемая соль.
8. Соединение по п.7, в котором А2 представляет собой Aib; А3 представляет собой Pro и по меньшей мере один из А7, А11, А13 и А14 не является аминокислотным остатком из соответствующего положения в нативном GIP, или его фармацевтически приемлемая соль.
9. Соединение по п.8, которое представляет собой

или
или его фармацевтическая соль.
10. Соединение, состоящее, по существу, из остатков 1-42 SEQ ID NO:1, где последовательность дополнительно содержит замену А5с, А6с, Aib, D-Ala или Gly в положении 2 и по меньшей мере одну дополнительную аминокислотную замену или модификацию в положениях 3-42, или его фармацевтически приемлемая соль.
11. Соединение по п.10, в котором А2 представляет собой Aib, или его фармацевтически приемлемая соль.
12. Соединение по п.11, которое представляет собой
или его фармацевтическая соль.
13. Соединение по п.1, в котором А2 представляет собой Ala, А5с, А6с или Gly и А3 представляет собой Glu, Dhp, 3Нур, 4Нур, hPro или Tic, или его фармацевтически приемлемая соль.
14. Соединение по п.13, которое представляет собой

или его фармацевтическая соль.
15. Соединение по любому из пп.1-14, дополнительно содержащее ковалентно связанный остаток PEG, или его фармацевтически приемлемая соль.
16. Соединение по п.15, в котором указанный остаток PEG связывается с соединением через Cys(малеимидный), hCys(малеимидный) или Pen(малеимидный) линкер с образованием Cys(сукцинимид-N-PEG), hCys(сукцинимид-N-PEG) или Pen(сукцинимид-N-PEG), или его фармацевтически приемлемая соль.
17. Соединение по п.16, в котором пегилирование осуществляют по любому из положений аминокислотных остатков 16, 30 и 31-43, при этом Cys(сукцинимид-N-PEG), hCys(сукцинимид-N-PEG) или Pen(сукцинимид-N-PEG) располагаются в любом из положений аминокислотных остатков 16, 30 и 31-43, или его фармацевтически приемлемая соль.
18. Соединение по п.17, в котором пегилирование осуществляют по любому из положений аминокислотных остатков 32, 33 и 43, при этом Cys(сукцинимид-N-PEG), hCys(сукцинимид-N-PEG) или Pen(сукцинимид-N-PEG) располагаются в любом из положений аминокислотных остатков 32, 33 и 43, или его фармацевтически приемлемая соль.
19. Соединение по п.18, в котором указанный остаток PEG имеет среднюю молекулярную массу от примерно 2000 до примерно 80000, или его фармацевтически приемлемая соль.
20. Соединение по п.19, в котором указанный PEG выбирают из группы, состоящей из 5K PEG, 10K PEG, 20K PEG, 30K PEG, 40K PEG, 50K PEG и 60К PEG, с образованием Cys(сукцинимид-N-5K PEG), Cys(сукцинимид-N-10K PEG), Cys(сукцинимид-N-20K PEG), Cys(сукцинимид-N-30K PEG), Cys(сукцинимид-N-40К PEG), Cys(сукцинимид-N-50K PEG), Cys(сукцинимид-N-60K PEG), hCys(сукцинимид-N-5K PEG), hCys(сукцинимид-N-10K PEG), hCys(сукцинимид-N-20K PEG), hCys(сукцинимид-N-30K PEG), hCys(сукцинимид-N-40K PEG), hCys(сукцинимид-N-50K PEG), hCys(сукцинимид-N-60K PEG), Pen(сукцинимид-N-5K PEG), Pen(сукцинимид-N-10K PEG), Pen(сукцинимид-N-20K PEG), Pen(сукцинимид-N-30K PEG), Pen(сукцинимид-N-40К PEG), Pen(сукцинимид-N-50K PEG) или Pen(сукцинимид-N-60K PEG), или его фармацевтически приемлемая соль.
21. Соединение по любому из пп.16-20, в котором указанный сукцинимид-N-PEG является линейным, или его фармацевтически приемлемая соль.
22. Соединение по п.21, в котором указанный линейный сукцинимид-N-PEG представляет собой сукцинимид-N-(СН2)2-С(О)NH-(CH2)3-PEG, или его фармацевтически приемлемая соль.
23. Соединение по любому из пп.16-20, в котором указанный сукцинимид-N-PEG является разветвленным, или его фармацевтически приемлемая соль.
24. Соединение по п.23, в котором указанный разветвленный сукцинимид-N-PEG представляет собой сукцинимид-N-(СН2)2-С(О)NH-(СН2)3-O-CH2-CH-PEG-CH2-PEG, или его фармацевтически приемлемая соль.
25. Фармацевтическая композиция, содержащая эффективное количество соединения по любому из пп.1-24.
26. Фармацевтическая композиция по п.25, дополнительно содержащая фармацевтически приемлемый носитель.
27. Способ агонистического воздействия на рецептор GIP у субъекта, нуждающегося в этом, включающий введение указанному субъекту терапевтически эффективного количества соединения по любому из пп.1-24 или фармацевтической композиции по п.25 или 26.
28. Способ антагонистического воздействия на рецептор GIP у субъекта, нуждающегося в этом, включающий введение указанному субъекту терапевтически эффективного количества соединения по любому из пп.1-24 или фармацевтической композиции по п.25 или 26.
29. Способ лечения состояний или заболеваний, опосредуемых связыванием с GIP-рецептором, включающий стадию введения субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения по любому из пп.1-24 или фармацевтической композиции по п.25 или 26.
30. Способ по п.29, в котором указанное состояние или заболевание, опосредуемое связыванием с GIP-рецептором, выбрано из группы, состоящей из диабета типа I, диабета типа II, ожирения, резистентности к инсулину, непереносимости глюкозы, жировой дистрофии печени, глюкагона, секреторных расстройств дыхательных путей, расстройства метаболизма, артрита, остеопороза, заболевания центральной нервной системы, рестеноза, нейродегенеративного заболевания, почечной недостаточности, ишемической болезни сердца, нефротического синдрома, цирроза печени, отека легких, гипертонии и расстройств, где желательным является уменьшение приема пищи и/или уменьшение массы тела.
31. Способ лечения диабета, включающий стадию введения субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения по любому из пп.1-24 или фармацевтической композиции по п.25 или 26.
32. Способ по п.31, в котором указанный диабет представляет собой диабет типа II.
33. Способ лечения расстройств, связанных с диабетом, включающий стадию введения субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения по любому из пп.1-24 или фармацевтической композиции по п.25 или 26.
34. Способ по п.33, в котором указанное расстройство, связанное с диабетом, выбрано из группы, состоящей из гипергликемии, гиперинсулинемии, нарушенной переносимости глюкозы, нарушенной гликемии натощак, дислипидемии, гипертриглицеридемии и резистентности к инсулину.
35. Способ лечения или предотвращения вторичных причин диабета, включающий стадию введения субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения по любому из пп.1-24 или фармацевтической композиции по п.25 или 26.
36. Способ по п.35, в котором указанная вторичная причина выбрана из группы, состоящей из избытка глюкокортикоидов, избытка гормона роста, феохромоцитомы и лекарственного диабета.
37. Способ лечения ожирения, включающий стадию введения субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения по любому из пп.1-24 или фармацевтической композиции по п.25 или 26.
38. Способ стимулирования секреции инсулина у субъекта, нуждающегося в этом, посредством введения указанному субъекту терапевтически эффективного количества соединения по любому из пп.1-24 или фармацевтической композиции по п.25 или 26.
39. Применение соединения по любому из пп.1-24 для получения лекарственного средства для связывания с GIP-рецептором, для предотвращения или лечения заболеваний или состояний, связанных с нарушением связывания аналогов GIP-рецепторов.
40. Применение по п.39 для получения лекарственного средства для предотвращения или лечения апоптоза β-клеток поджелудочной железы.
41. Применение по п.39 для получения лекарственного средства для усиления глюкозозависимой пролиферации β-клеток поджелудочной железы.
Текст
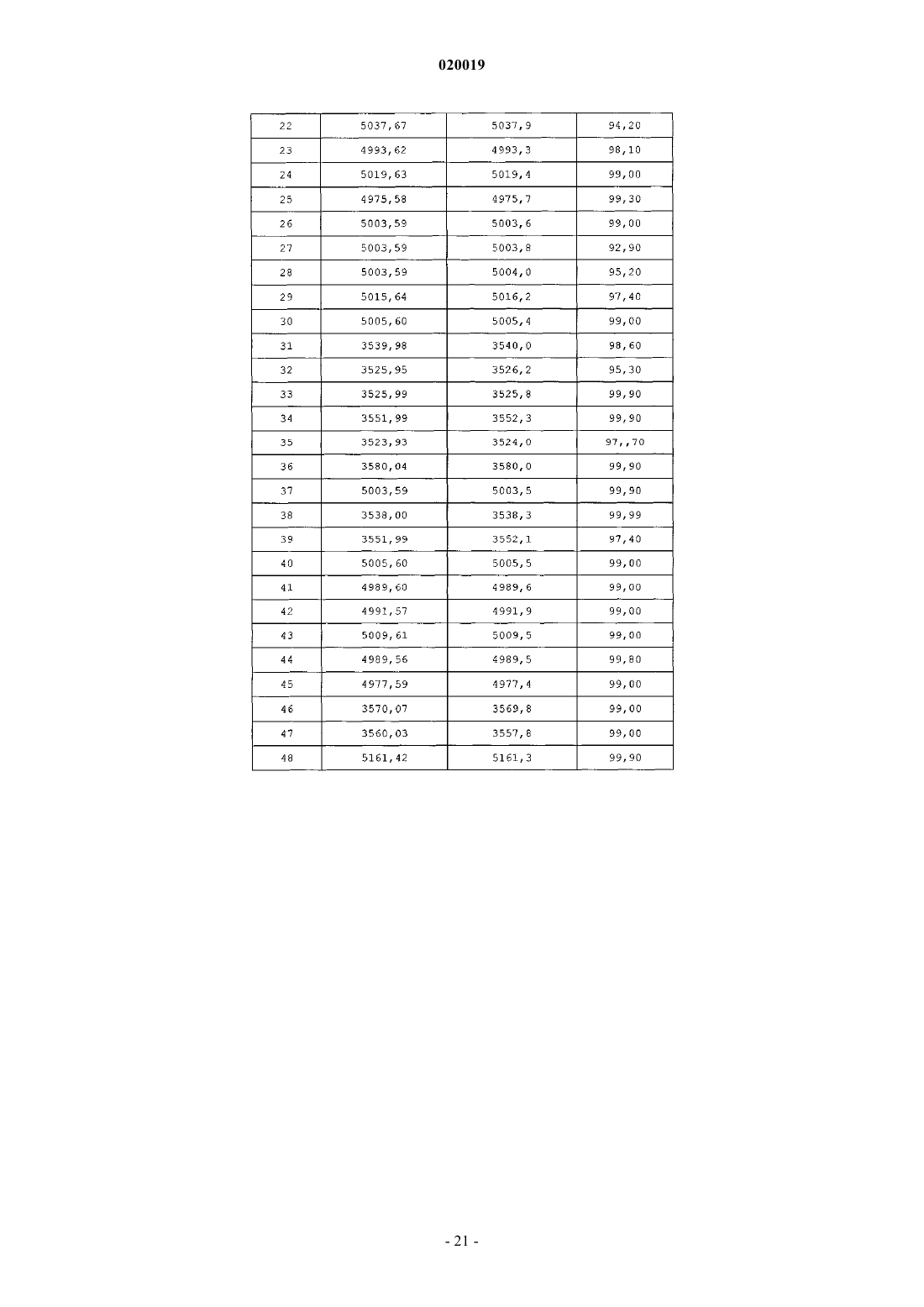
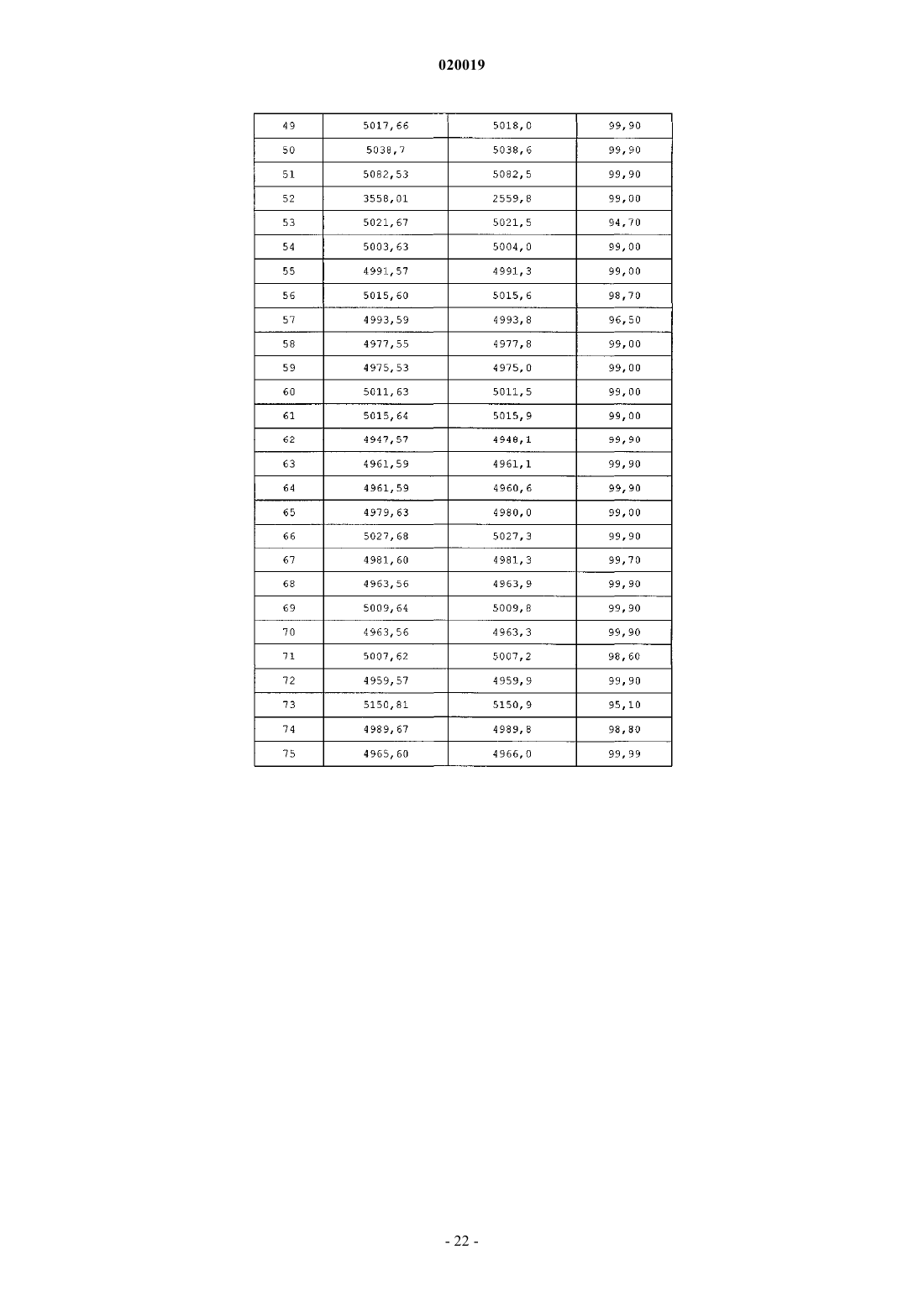
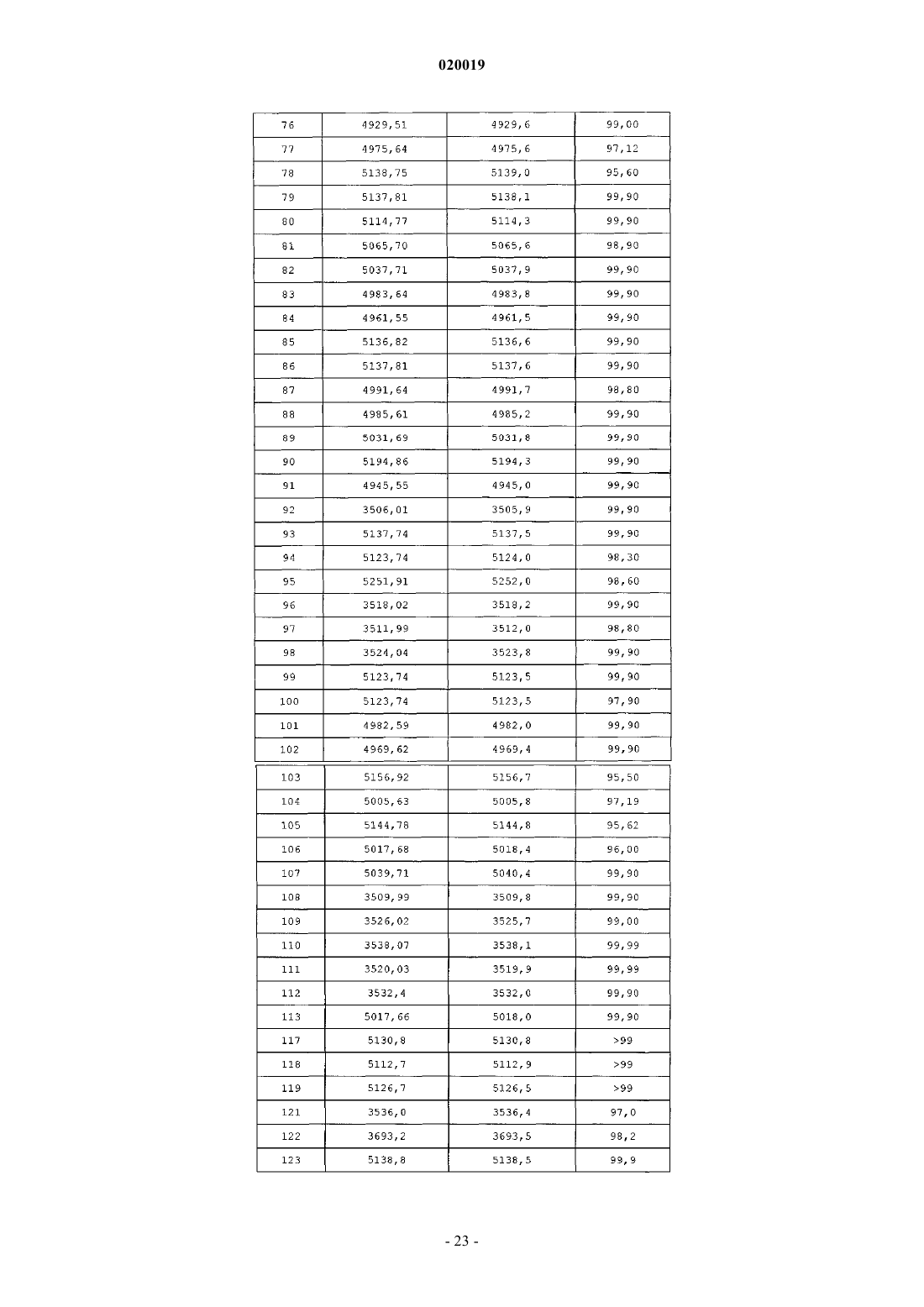
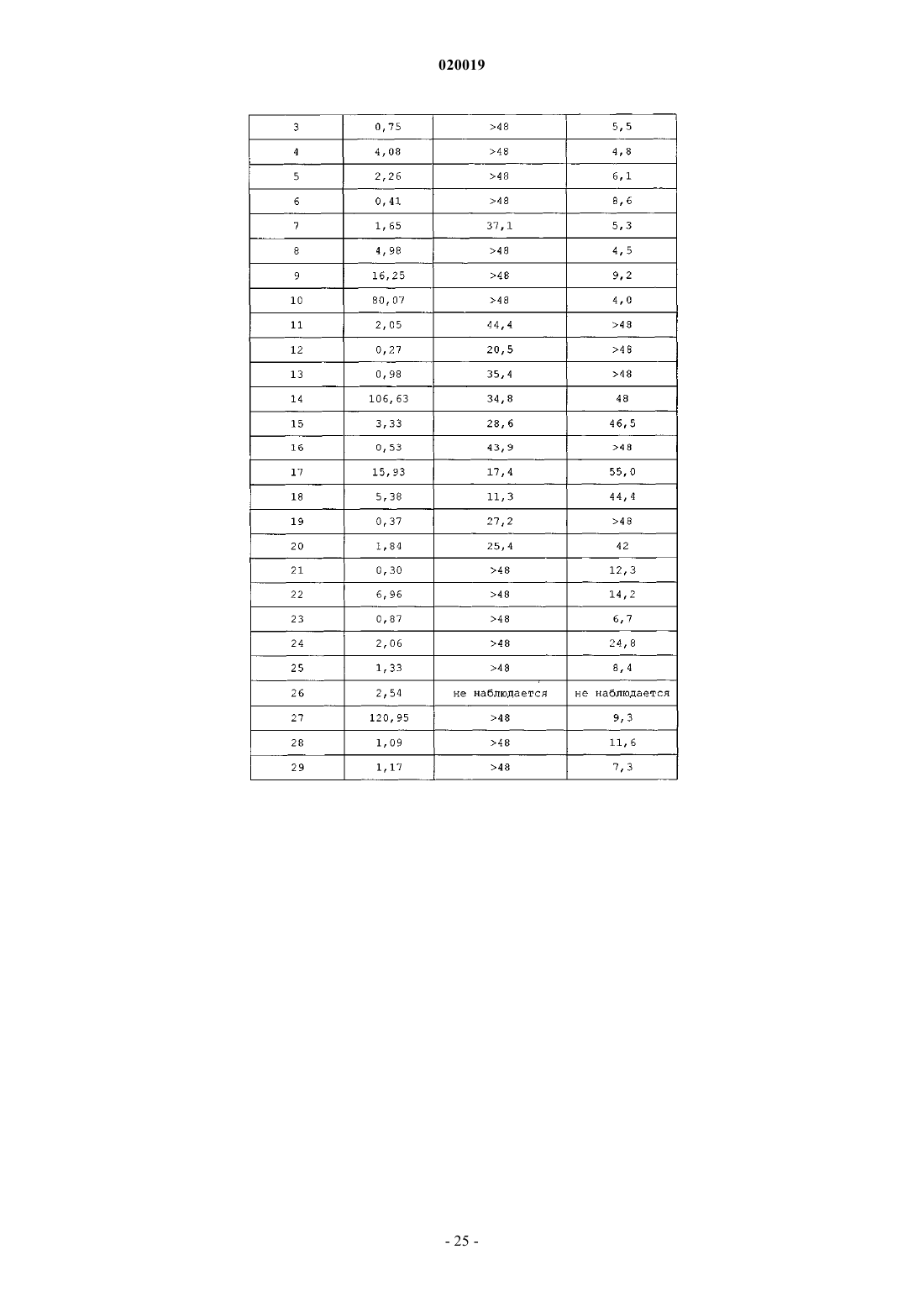
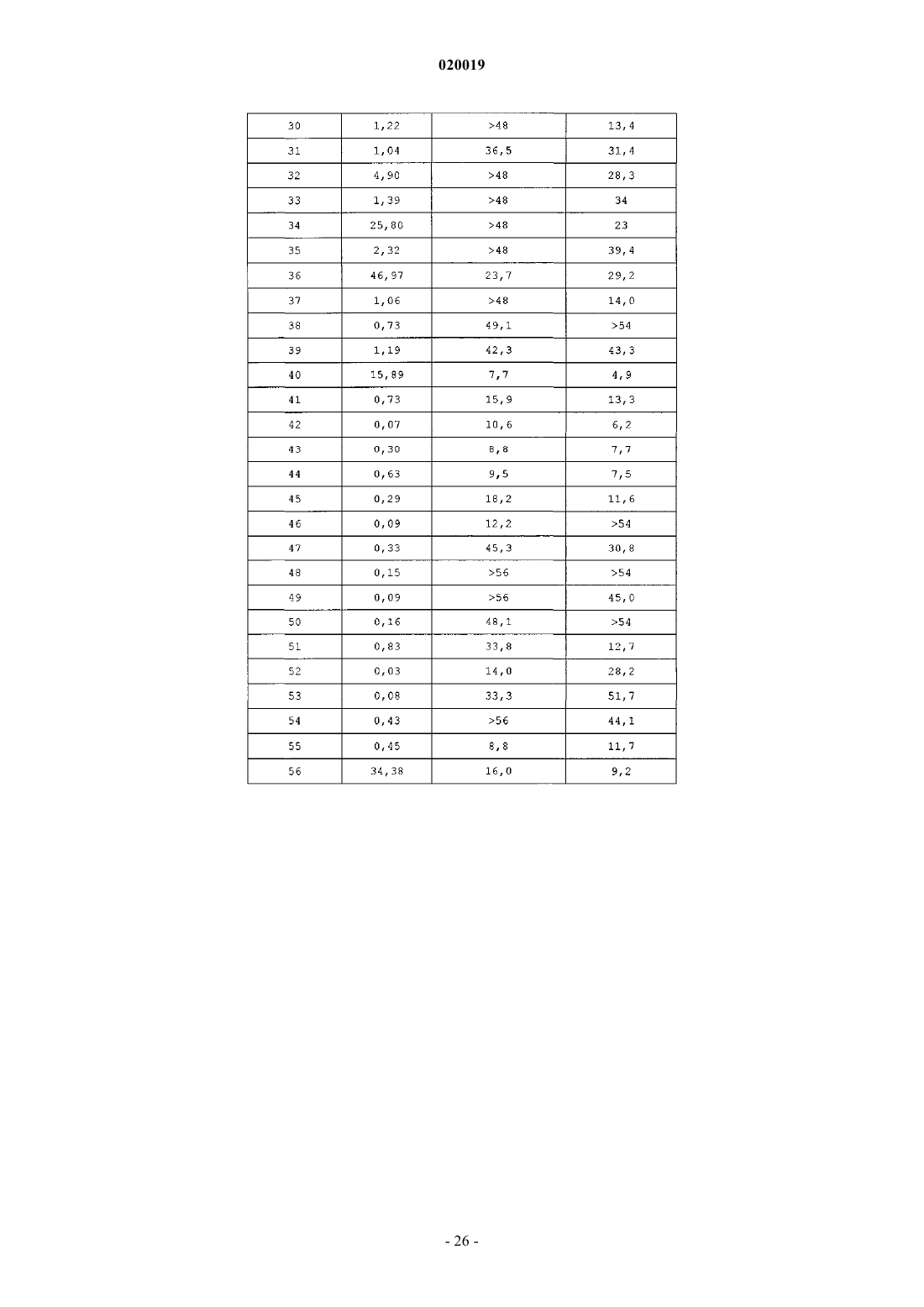
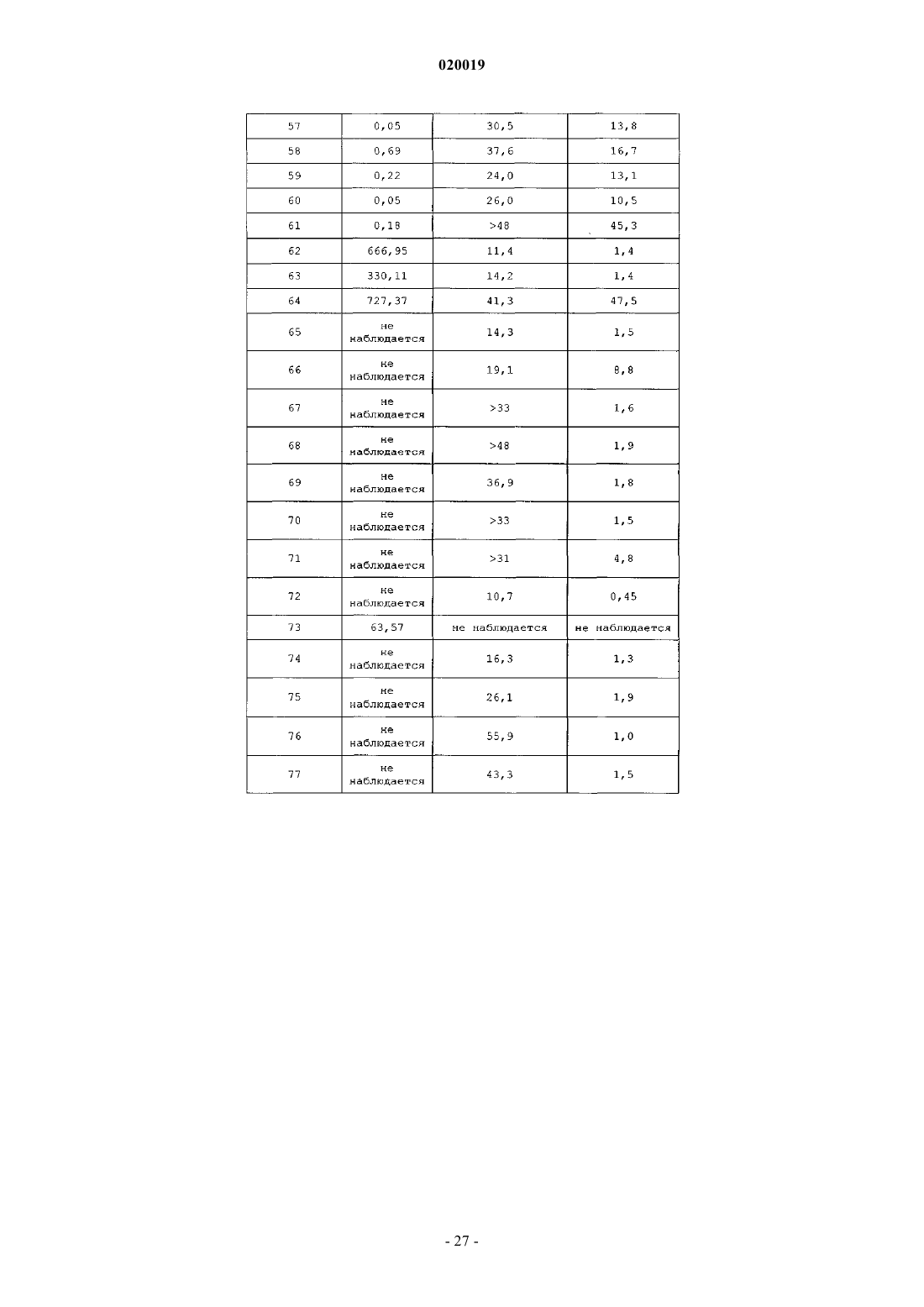
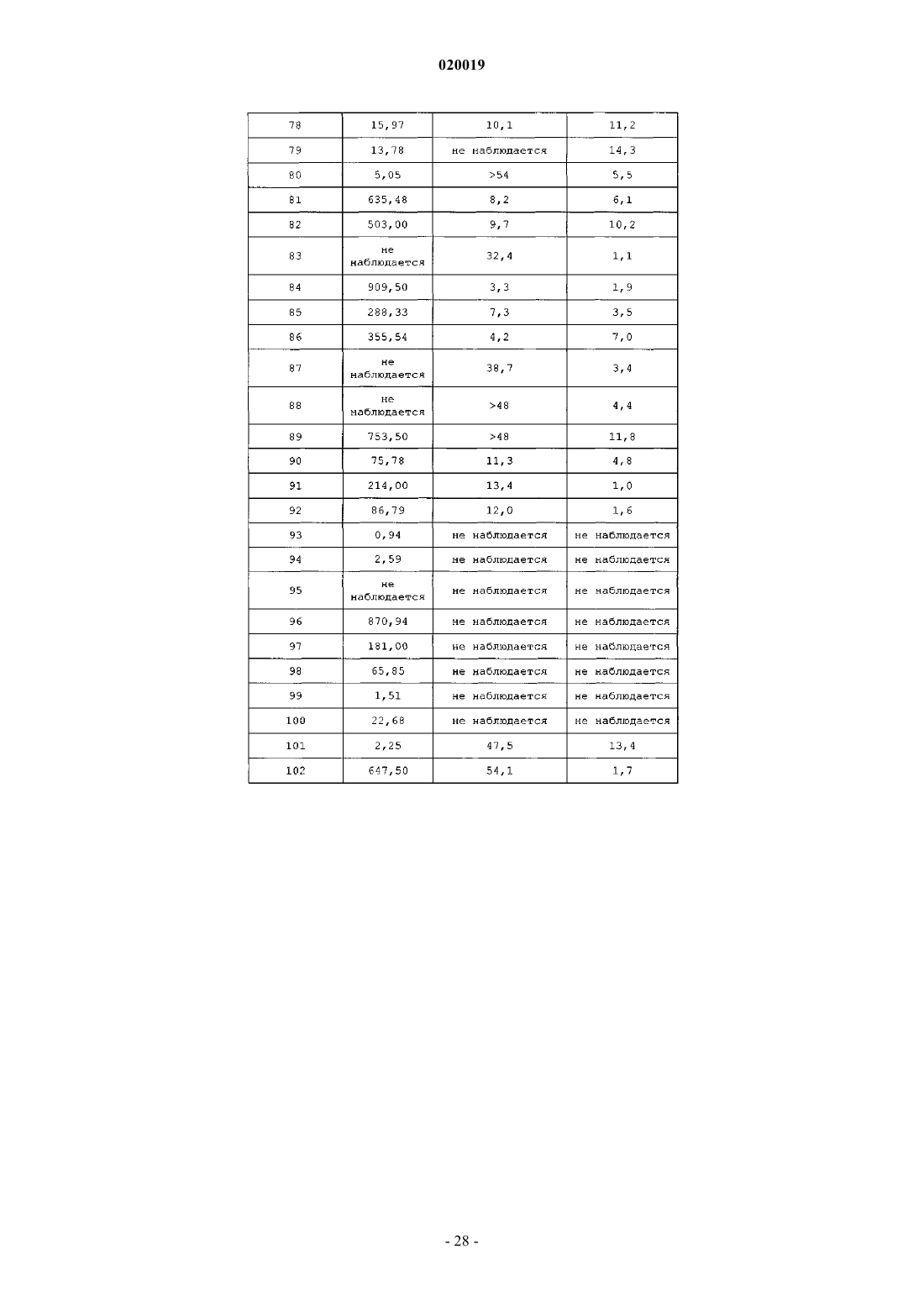
АНАЛОГИ ГЛЮКОЗОЗАВИСИМОГО ИНСУЛИНОТРОПНОГО ПОЛИПЕПТИДА В изобретении предусматриваются новый ряд аналогов соединений глюкозозависимого инсулинотропного полипептида, фармацевтические композиции, содержащие указанные соединения, и применение указанных соединений в качестве агонистов или антагонистовGIP-рецепторов для лечения состояний, опосредуемых GIP-рецепторами, таких как инсулиннезависимый сахарный диабет и ожирение. Дун Чжэн Синь (US) Медведев В.Н. (RU) Область техники, к которой относится изобретение Настоящее изобретение относится к области новых аналогов соединений глюкозозависимого инсулинотропного полипептида, к фармацевтическим композициям, содержащим указанные соединения, и к применению указанных соединений в качестве агонистов или антагонистов GIP-рецепторов для лечения состояний, опосредуемых GIP-рецепторами, таких как инсулиннезависимый сахарный диабет и ожирение. Уровень техники Глюкозозависимый инсулинотропный полипептид ("GIP", известный так же, как "желудочный ингибиторный полипептид"; SEQ ID NO:1), представляет собой пептид из 42 остатков, секретируемый энтероэндоринными K-клетками тонкого кишечника в кровоток в ответ на пероральное поглощение питательных веществ. GIP ингибирует секрецию желудочного сока и, как показано, является сильнодействующим стимулятором секреции инсулина из -клеток поджелудочной железы после перорального поглощения глюкозы ("инкретиновый эффект") (Creutzfeldt, W., et al., 1979, Diabetologia, 16:75-85). Высвобождение инсулина, индуцируемое поглощением глюкозы и других питательных веществ,вызывается как гормональными, так и нервными факторами (Creutzfeldt, W., et al., 1985, Diabetologia,28:565-573). В качестве инкретинов предложены несколько желудочно-кишечных регуляторных пептидов, и среди этих кандидатов только GIP и глюкагоноподобный пептид 1 ("GLP-1"), видимо, удовлетворяют требованиям, чтобы рассматривать их как физиологические стимуляторы постпрандиального выделения инсулина (Nauck, et al., 1989, J. Clin. Endocrinol. Metab., 69:654-662). Показано, что сочетанные воздействия GIP и GLP-1 являются достаточными для объяснения всего инкретинового воздействия энтероинсулярной оси (Fehmann, H.С., et al., 1989, FEBS Lett, 252: 109-112). Как хорошо известно специалистам в данной области, известные и потенциальные применения GIP являются разнообразными и многочисленными. Таким образом, введение соединений по настоящему изобретению для целей выяснения воздействия агониста может иметь такие же воздействия и применения, как и сам GIP. Эти разнообразные применения GIP могут быть перечислены как следующие: лечение заболевания, выбранного из группы, состоящей из диабета типа I, диабета типа II (Visboll, Т., 2004,Dan. Med. Bull, 51:364-70), резистентности к инсулину (WO 2005/082928), ожирения (Green, В. D., et al.,2004, Current Pharmaceutical Design, 10:3651-3662), метаболического расстройства (Gault, V. A., et al.,2003, Biochem. Biophys. Res. Commun., 308:207-213), заболевания центральной нервной системы, нейродегенеративного заболевания, ишемической болезни сердца, гипогликемии, и таких расстройств, когда желательными являются уменьшение приема пищи и потеря массы. GIP не только резко увеличивает секрецию инсулина в островковых клетках поджелудочной железы, но он также стимулирует продуцирование инсулина посредством усиления транскрипции и трансляции проинсулина (Wang, et al., 1996,Mol. Cell. Endocrinol, 116:81-87) и усиливает рост и выживаемость -клеток поджелудочной железы(Trumper, et al., 2003, Diabetes, 52:741-750). В дополнение к воздействию на поджелудочную железу для усиления секреции инсулина GIP также осуществляет воздействие на целевые ткани инсулина, непосредственно понижая уровень глюкозы в плазме крови: усиление потребления глюкозы при адипозе(Eckel, et al., 1979, Diabetes, 28: 1141-1142) и в мышцах (O'Harte, et al., 1998, J. Endocrinol, 156:237-243) и ингибирование продуцирования глюкозы в печени (Elahi, D., et al., 1986, Can. J. Physiol. Pharmacol,65:A18). В дополнение к этому антагонист рецептора GIP в соответствии с настоящим изобретением ингибирует, блокирует или уменьшает поглощение глюкозы из кишечника животного. В соответствии с этим наблюдением терапевтические композиции, содержащие антагонисты GIP, могут быть использованы у пациентов с инсулиннезависимым сахарным диабетом для улучшения переносимости перорального приема глюкозы у млекопитающих, таких как люди, для предотвращения, ингибирования или уменьшения ожирения посредством ингибирования, блокирования или уменьшения поглощения глюкозы из кишечника млекопитающего. Использование немодифицированного GIP в качестве терапевтического средства, однако, ограничивается коротким временем полужизни in vivo, примерно 2 мин (Said and Mutt, 1970, Science, 169:12171218). В сыворотке оба инкретина как GIP, так и GLP-1, разрушаются под действием дипептидилпептидазы IV ("DPPIV"). Улучшение стабильности GIP по отношению к протеолизу не только поддерживает активность GIP на его рецепторе, но, что более важно, предотвращает образование фрагментов GIP, некоторые из которых действуют как антагонисты рецепторов GIP (Gault, et al., 2002, J. Endocrinol, 175:525533). Известные из литературы модификации включают защиту N-конца GIP от протеолиза под действием DPPIV посредством модифицирования N-концевого тирозина (O'Harte, et al., 2002, Diabetologia, 45: 1281-1291), мутации аланина в положении 2 (Hinke, et al., 2002, Diabetes, 51:656-661), мутации глутаминовой кислоты в положении 3 (Gault, et al., 2003, Biochem. Biophys. Res. Commun., 308:207-213) и мутации аланина в положении 13 (Gault, et al., 2003, Cell Biol. International, 27:41-46). Поданы следующие заявки на патенты, относящиеся к воздействиям аналогов GIP на функционирование различных целевых органов и к их потенциальному применению в качестве терапевтических агентов. РСТ публикация WO 00/58360 описывает пептидильные аналоги GIP, которые стимулируют высвобождение инсулина. В частности, это изобретение описывает конкретные пептидильные аналоги, содержащие по меньшей мере 15 аминокислотных остатков от N-концевой части GIP(1-42), например аналогGIP, содержащий ровно одну аминокислотную замену или модификацию в положениях 1, 2 и 3, такой как [Pro3]GIP(1-42). РСТ публикация WO 98/24464 описывает антагонист GIP, состоящий, по существу, из полипептида,содержащего 24 аминокислоты, соответствующих положениям 7-30 последовательности GIP, способ лечения инсулиннезависимого сахарного диабета и способ улучшения переносимости глюкозы у пациента с инсулиннезависимым сахарным диабетом. РСТ публикация WO 03/082898 описывает С-концевые процессированные фрагменты и аналогиGIP с модифицированным N-концом, а также различные аналоги GIP с восстановленной пептидной связью или с изменениями аминокислот вблизи DPPIV-специфичного сайта расщепления. Это изобретение дополнительно описывает аналоги с различными линкерами между потенциальными сайтами связыванияGIP с рецепторами. Соединения этого изобретения, как предполагается, должны быть пригодными для лечения состояний, опосредуемых GIP-рецепторами, таких как инсулиннезависимый сахарный диабет и ожирение. Имеется необходимость в улучшенных аналогах GIP, которые являются стабильными в виде препаратов и имеют продолжительное время полужизни in vivo в плазме, возникающее в результате понижения чувствительности к протеолизу и уменьшения выделения из организма, в то же время сохраняя сродство связывания с рецептором GIP, чтобы вызвать соответствующие агонистические или антагонистические воздействия. Кроме того, среди других терапевтических воздействий соединений по настоящему изобретению, как иллюстрируется в настоящем описании, более точный контроль уровней глюкозы в плазме крови может предотвратить долговременные диабетические осложнения, обеспечивая тем самым улучшение качества жизни для пациентов. Сущность изобретения В одном из аспектов настоящее изобретение относится к пептидным вариантам GIP следующей формулы (I):R1 представляет собой OH, NH2, (C1-C30)алкокси или NH-X2-CH2-Z0, где X2 представляет собой (С 0 С 30) углеводородный остаток и Z0 представляет собой Н, ОН, СО 2 Н или CONH2; каждый из R2, R3, R4 и R5 независимо выбирают из группы, состоящей из Н, (C1-C30)алкила, (C1C30)гетероалкила, (C1-С 30)ацила, (С 2-С 30)алкенила, (С 2-С 30)алкинила, арил(C1-C30)алкила, арил(С 1 С 30)ацила, замещенного (C1-C30)алкила, замещенного (C1-С 30)гетероалкила, замещенного (C1-C30)ацила,замещенного (С 2-С 30)алкенила, замещенного (С 2-С 30)алкинила, замещенного арил(С 1-С 30)алкила и замещенного арил(C1-C30)ацила; при условии, что, когда R2 представляет собой (C1-C30)ацил, арил(C1C30)ацил, замещенный (C1-C30)ацил или замещенный арил(C1-C30)ацил, тогда R3 представляет собой Н,(C1-C30)алкил, (C1-C30)гетероалкил, (С 2-С 30)алкенил, (С 2-С 30)алкинил, арил(C1-C30)алкил, замещенныйn представляет собой, независимо для каждого случая, целое число от 1 до 5 включительно;s, t, х и у, каждый независимо, представляют собой для каждого случая целое число от 1 до 30 включительно;X4, X5, X6, X7 и X8, каждый независимо, представляют собой для каждого случая Н, F, Cl, Br, I,(C1-10)алкил, замещенный(C1-10)алкил, арил, замещенный арил, ОН, NH2, NO2 или CN; при условии, что, когда А 1 представляет собой 4 Нрра, тогда R2 и R3 отсутствуют; при дополнительном условии, что только одна аминокислота в положениях 1, 2 или 3 соединения заменена или модифицирована; при дополнительном условии, что соединение формулы (I) не представляет собой (D-Ala2)hGIP(142), (Pro3)hGIP(1-42) (SEQ ID NO:120), (Aib3)hGIP(1-42) (SEQ ID NO:121), (Ser2)hGIP(1-42) (SEQ IDNO:122), (Abu2)hGIP(1-42) (SEQ ID NO:123), (D-Abu2)hGIP(1-42), (D-Ser2)hGIP(1-42), (D-Thr2)hGIP(1-42) или (D-Val2)hGIP(1-42). Подмножество (А) соединений, охватываемых указанной выше формулой (I), составляют такие соединения, в которых А 1 представляет собой Tyr, N-Me-Tyr, 4Hppa или Orn(N-C(O)-(CH2)12-CH3); А 2 представляет собой Ala, A5c, А 6 с, Aib, D-Ala, Gly или Ser; А 3 представляет собой Glu, Dhp, 3 Нур, 4 Нур, Pro, hPro или Tic; А 4 представляет собой Gly или Aib; А 5 представляет собой Thr, A5c или Aib; А 6 представляет собой Phe или А 6 с; А 7 представляет собой Ile, А 5 с, А 6 с или Aib; А 8 представляет собой Ser или Aib; А 9 представляет собой Asp или Aib; А 10 представляет собой Tyr; А 11 представляет собой Ser, A5c, А 6 с, Aib или Nle; А 12 представляет собой Ile, А 5 с или Aib; А 13 представляет собой Ala или Aib; А 14 представляет собой Met, A5c, А 6 с или Nle; А 15 представляет собой Asp; А 16 представляет собой Lys; А 17 представляет собой Ile или А 6 с;-4 020019 А 18 представляет собой His; А 19 представляет собой Gln; А 20 представляет собой Gln; А 21 представляет собой Asp; А 22 представляет собой Phe; А 23 представляет собой Val; А 24 представляет собой Asn; А 25 представляет собой Trp; А 26 представляет собой Leu или А 6 с; А 27 представляет собой Leu или А 6 с; А 28 представляет собой Ala или Aib; А 29 представляет собой Gln; А 30 представляет собой Lys; А 31 представляет собой Gly, Aib, Cys(Psu), His или отсутствует; А 32 представляет собой Lys, Cys(Psu) или отсутствует; А 33 представляет собой Lys, Cys(Psu) или отсутствует; А 34 представляет собой Asn, Cys(Psu) или отсутствует; А 35 представляет собой Asp, Cys(Psu) или отсутствует; А 36 представляет собой Trp, Cys(Psu) или отсутствует; А 37 представляет собой Lys, Cys(Psu) или отсутствует; А 38 представляет собой His, Cys(Psu) или отсутствует; А 39 представляет собой Asn, Cys(Psu) или отсутствует; А 40 представляет собой Ile, А 5 с, А 6 с, Cys (Psu) или отсутствует; А 41 представляет собой Thr, A5c, А 6 с, Aib, Cys (Psu) или отсутствует; А 42 представляет собой Gln или отсутствует; А 43 представляет собой Cys(Psu), Gln, His или отсутствует; при условии, что соединение содержит по меньшей мере одну дополнительную аминокислотную замену или модификацию в любом из положений 4-42, которая не является аминокислотным остатком в соответствующем положении в нативном GIP. Подмножество соединений предыдущего подмножества (А) составляют такие соединения, в которых А 2 представляет собой D-Ala. Другое подмножество соединений предыдущего подмножества (А) составляют такие соединения, в которых А 31-А 43 отсутствуют. Другое подмножество соединений предыдущего подмножества (А) составляют такие соединения, в которых А 2 представляет собой Ala, A5c, А 6 с или Gly и А 3 представляет собой Glu, Dhp, 3 Нур, 4 Нур,hPro или Tic. Другой аспект настоящего изобретения охватывает соединения, состоящие, по существу, из последовательности из первых 30 последовательных аминокислотных остатков от N-конца аминокислотной последовательности нативного hGIP, где последовательность содержит замену А 5 с, А 6 с, Aib, D-Ala, Gly или Ser в положении 2 и по меньшей мере одну дополнительную аминокислотную замену или модификацию в положениях 3-30. Подмножество соединений непосредственно по предыдущему аспекту настоящего изобретения составляют такие соединения, в которых А 2 представляет собой Aib; А 3 представляет собой Pro и по меньшей мере один из А 7, А 11, А 13 и А 14 не является аминокислотным остатком из соответствующего положения в нативном GIP. Еще один аспект настоящего изобретения охватывает аналоги GIP, содержащие замену А 5 с, А 6 с,Aib, D-Ala, Gly или Ser в положении 2 и по меньшей мере одну дополнительную аминокислотную замену или модификацию в положениях 1 и 3-42. Подмножество соединений непосредственно по предыдущему аспекту настоящего изобретения составляют такие соединения, в которых А 2 представляет собой Aib. Предпочтительные соединения формулы (I) представляют собой Еще более предпочтительные соединения формулы (I) представляют собой или их фармацевтически приемлемая соль. И еще более предпочтительное соединение в соответствии с формулой (I) представляет собой (Aib2,11A5C , Nle14)hGIP(1-42)-ОН (SEQ ID NO:57) или его фармацевтическая соль. В соответствии с другим аспектом настоящего изобретения соединение в соответствии с настоящим изобретением, как описывается выше и заявляется в прилагаемой формуле изобретения, может дополнительно содержать ковалентно связанный остаток PEG, при этом указанный остаток PEG ковалентно связывается с соединением через Cys(малеимидный), hCys(малеимидный) или Pen(малеимидный) линкер, с образованием Cys(сукцинимид-N-PEG), hCys(сукцинимид-N-PEG) или Pen(сукцинимид-N-PEG), где"сукцинимид-N-PEG" является либо линейным, либо разветвленным, как определено ниже. Такой остаток PEG имеет среднюю молекулярную массу от примерно 2000 до примерно 80000, а предпочтительно такой остаток PEG выбран из группы, состоящей из 5K PEG, 10K PEG, 20K PEG, 30K PEG, 40K PEG,50K PEG и 60K PEG, с образованием Cys(сукцинимид-N-5K PEG), Cys(сукцинимид-N-10K PEG),Cys(сукцинимид-N-20K PEG), Cys(сукцинимид-N-30K PEG), Cys(сукцинимид-N-40K PEG),Cys(сукцинимид-N-50K PEG), Cys(сукцинимид-N-60K PEG), hCys(сукцинимид-N-5K PEG),hCys(сукцинимид-N-10K PEG), hCys(сукцинимид-N-20K PEG), hCys(сукцинимид-N-30K PEG),hCys(сукцинимид-N-40K PEG), hCys(сукцинимид-N-50K PEG), hCys(сукцинимид-N-60K PEG),Pen(сукцинимид-N-5KPen(сукцинимид-N-60K PEG). Пегилирование осуществляют по любому из положений аминокислотных остатков 16, 30 и 31-43, а предпочтительно по любому из положений аминокислотных остатков 32, 33 и 43, при этомCys(сукцинимид-N-PEG), hCys(сукцинимид-N-PEG) или Pen(сукцинимид-N-PEG) располагаются в любом из таких положений аминокислотных остатков. Кроме того, приведенная выше формула (I) может быть расширена с получением сайтов пегилирования в положениях А 44-А 47. С-концы таких пегилированных соединений по настоящему изобретению могут быть амидированы, например, (Aib2,11)hGIP(1-42)-NH2 (SEQ ID NO:119) или могут оставаться как свободная кислота, например (Aib2,11)hGIP(1-42)-ОН (SEQ ID NO:4). Подробное описание изобретения Настоящее изобретение использует следующие понятные всем сокращения:Acn: ацетонитрил,Вос: трет-бутилоксикарбонил,BSA: бычий сывороточный альбумин,DCM: дихлорметан,DIPEA: диизопропилэтиламин,DMF: диметилформамид,ESI: электрораспылительная ионизация,Fmoc: 9-флуоренилметилоксикарбонил,HBTU: 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат,HOBt: 1-гидроксибензотриазол,HPLC: высокоэффективная жидкостная хроматография,IBMX: изобутилметилксантин,LC-MS: жидкостная хроматография - масс-спектрометрия,Mtt: метилтритил,NMP: N-метилпирролидон,5K PEG: полиэтиленгликоль, который может содержать другие функциональные группы или остатки, такие как линкер, и который является либо линейным, либо разветвленным, как определено ниже, со средней общей молекулярной массой примерно 5000,10K PEG: полиэтиленгликоль, который может содержать другие функциональные группы или остатки, такие как линкер, и который является либо линейным, либо разветвленным, как определено ниже,со средней общей молекулярной массой примерно 10000,20K PEG: полиэтиленгликоль, который может содержать другие функциональные группы или остатки, такие как линкер, и который является либо линейным, либо разветвленным, как определено ниже,со средней общей молекулярной массой примерно 20000,30K PEG: полиэтиленгликоль, который может содержать другие функциональные группы или остатки, такие как линкер, и который является либо линейным, либо разветвленным, как определено ниже,со средней общей молекулярной массой примерно 30000,40K PEG: полиэтиленгликоль, который может содержать другие функциональные группы или остатки, такие как линкер, и который является либо линейным, либо разветвленным, как определено ниже,со средней общей молекулярной массой примерно 40000,50K PEG: полиэтиленгликоль, который может содержать другие функциональные группы или остатки, такие как линкер, и который является либо линейным, либо разветвленным, как определено ниже,со средней общей молекулярной массой примерно 50000,60K PEG: полиэтиленгликоль, который может содержать другие функциональные группы или остатки, такие как линкер, и который является либо линейным, либо разветвленным, как определено ниже,со средней общей молекулярной массой примерно 60000,tBu: трет-бутил,TIS: триизопропилсилан,Trt: тритил,TFA: трифторуксусная кислота,Z: бензилоксикарбонил. За исключением N-концевой аминокислоты, все сокращения аминокислот в настоящем описании(например, Ala) проставлены для структуры -NH-C(R)(R')-CO-, где R и R', каждый независимо, представляют собой водород или боковую цепь аминокислоты (например, R=СН 3 и R'=Н для Ala) или R и R' могут соединяться с образованием кольцевой системы. Для N-концевой аминокислоты сокращение проставлено для структуры (R2R3)N-C(R)(R')-CO-, где R2 и R3 являются такими, как определено в указанной выше формуле (I). Термин "(C1-С 30)углеводородный остаток" охватывает алкил, алкенил и алкинил, и в случае алкенила и алкинила имеются в виду С 2-С 30 остатки. Пептид по настоящему изобретению также обозначается в настоящем описании с помощью другого формата, например (A5c2)hGIP(1-42)-OH (SEQ ID NO:3), при этом замененные аминокислоты из природной последовательности помещаются в скобках (например, А 5 с 2 для Ala2 в hGIP). Числа между скобками относятся к количеству аминокислот, присутствующих в пептиде (например, hGIP(1-42)-ОН (SEQ IDNO:1) представляет собой аминокислоты 1-42 последовательности пептидов для hGIP). ОбозначениеID NO:1) или hGIP(1-42)-ОН (SEQ ID NO:1) означает, что С-конец представляет собой свободную кислоту."Ацил" относится к R"-C(O)-, где R" представляет собой Н, алкил, замещенный алкил, гетероалкил,замещенный гетероалкил, алкенил, замещенный алкенил, арил, алкиларил или замещенный алкиларил."Алкил" относится к углеводородной группе, содержащей один или несколько атомов углерода, где множество атомов углерода, если они присутствуют, соединяются с помощью одинарных связей. Алкильная углеводородная группа может представлять собой прямую цепь или содержать одну или несколько ветвей или циклических групп."Замещенный алкил" относится к алкилу, где один или несколько атомов водорода углеводородной группы заменяются одним или несколькими заместителями, выбранными из группы, состоящей из галогена (то есть фтора, хлора, брома и йода), -ОН, -CN, -SH, -NH2, -NHCH3, -NO2, -С 1-20 алкила, замещенного галогенами, -CF3, -ОСН 3, -OCF3 и -(СН 2)0-20-СООН. В различных вариантах осуществления присутствуют 1, 2, 3 или 4 заместителей. Присутствие -(СН 2)0-20-СООН приводит к получению алкиловой кислоты. Примеры алкиловых кислот, содержащих -(СН 2)0-20-СООН или состоящих из них, включают 2 норборнануксусную кислоту, трет-масляную кислоту и 3-циклопентилпропионовую кислоту."Гетероалкил" относится к алкилу, где один или несколько атомов углерода в углеводородной группе заменяются одной или несколькими из следующих групп: амино, амидо, -O-, -S- или карбонилом. В различных вариантах осуществления присутствуют 1 или 2 гетероатома."Замещенный гетероалкил" относится к гетероалкилу, где один или несколько атомов водорода углеводородной группы заменяются одним или несколькими заместителями, выбранными из группы, состоящей из галогена, -ОН, -CN, -SH, -NH2, -NHCH3, -NO2, -C1-20 алкила, замещенного галогенами, -CF3,-ОСН 3, -OCF3 и -(CH2)0-20-COOH. В различных вариантах осуществления присутствуют 1, 2, 3 или 4 заместителей."Алкенил" относится к углеводородной группе, состоящей из двух или более атомов углерода, где присутствуют одна или несколько двойных связей углерод-углерод. Алкенильная углеводородная группа может представлять собой прямую цепь или содержать одну или несколько ветвей или циклических групп."Замещенный алкенил" относится к алкенилу, где один или несколько атомов водорода заменяются одним или несколькими заместителями, выбранными из группы, состоящей из галогена, ОН, -CN, -SH,-NH2, -NHCH3, -NO2, -C1-20 алкила, замещенного галогенами, -CF3, -ОСН 3, -OCF3 и -(СН 2)0-20-СООН. В различных вариантах осуществления присутствуют 1, 2, 3 или 4 заместителей."Арил" относится к необязательно замещенной ароматической группе по меньшей мере с одним кольцом, имеющим систему сопряженных пи-электронов, содержащую вплоть до трех сопряженных или конденсированных кольцевых систем. Арил включает карбоциклическую арильную, гетероциклическую арильную и биарильную группы. Предпочтительно арил представляет собой 5- или 6-членное кольцо. Предпочтительные атомы для гетероциклического арила представляют собой один или несколько атомов серы, кислорода и/или азота. Примеры арила включают фенил, 1-нафтил, 2-нафтил, индол, хинолин, 2 имидазол и 9-антрацен. Арильные заместители выбираются из группы, состоящей из -C1-20 алкила, -C1-20 алкокси, галогена, -ОН, -CN, -SH, -NH2, -NO2, -С 1-20 алкила, замещенного галогенами, -CF3, -OCF3 и-(СН 2)0-20-СООН. В различных вариантах осуществления арил содержит 0, 1, 2, 3 или 4 заместителей."Алкиларил" относится к "алкилу", соединенному с "арилом". Синтез. Пептиды по настоящему изобретению могут быть получены с помощью стандартного твердофазного пептидного синтеза; см., например, Stewart, J.M., et al., 1984, Solid Phase Synthesis, Pierce Chemical Co.,2d ed. Если R1 представляет собой NH-X2-CH2-CONH2, то есть Z0=CONH2, синтез пептида начинается сFmoc-HN-X2-CH2-CONH2, который связан с амидной МВНА смолой Rink. Если R1 представляет собойNH-X2-CH2-COOH, то есть Z0=СООН, синтез пептида начинается с Fmoc-HN-X2-CH2-COOH, который связан со смолой Wang. Для этой конкретной стадии используют 2 мол.экв. Fmoc-HN-X2-COOH, HBTU иHOBt и 10 мол.экв. DIPEA. Время конденсации составляет примерно 8 ч. При синтезе аналога GIP по настоящему изобретению, содержащего А 5 с, А 6 с и/или Aib, время конденсации составляет 2 ч, для этих остатков и для остатка, следующего непосредственно после них. Заместители R2 и R3 указанной выше общей формулы могут быть присоединены к свободному амину N-концевой аминокислоты А с помощью стандартных способов, известных в данной области. Например, алкильные группы, например (C1-C30)алкил, могут быть присоединены с использованием восстановительного алкилирования. Гидроксиалкильные группы, например (C1-C30)гидроксиалкил, могут быть также присоединены с использованием восстановительного алкилирования, где свободная гидрокси- 16020019 группа защищена сложным трет-бутиловым эфиром. Ацильные группы, например -С(О)Х 3, могут быть присоединены посредством связывания свободной кислоты, например -Х 3 СООН, со свободным аминомN-концевой аминокислоты посредством смешивания готовой смолы с 3 мол.экв., как свободной кислоты,так и диизопропилкарбодиимида, в метиленхлориде в течение примерно 1 ч. Если свободная кислота содержит свободную гидроксигруппу, например 3-фтор-4-гидроксифенилуксусную кислоту, тогда конденсация должна осуществляться с дополнительными 3 мол.экв. НОВТ. Следующие далее примеры описывают способы синтеза для получения пептида по настоящему изобретению, эти способы хорошо известны специалистам в данной области. Другие способы также известны специалистам в данной области. Примеры приводятся для целей иллюстрации и не предназначены для ограничения рамок настоящего изобретения каким-либо образом. Пример 73. [Aib2, А 6 с 7, Cys(Psu)41]hGIP(1-42)-ОН. Твердофазный пептидный синтез используют для сборки пептида с использованием метода Fmoc с микроволновым нагреванием на Liberty Peptide Synthesizer (СЕМ; Matthews, NC, USA) в масштабе 0,1 ммоль. Предварительно нагруженную Fmoc-Gln(Trt) на смолу Wang (0,59 ммоль/г; Novabiochem, SanDiego, СА, USA) используют для генерирования пептида с С-концевой кислоты. Смолу (0,17 г) помещают в 50-мл коническую пробирку вместе с 15 мл диметилформамида (DMF) и помещают на место смолы в синтезаторе. Затем смолу количественно переносят в реакционную емкость посредством автоматизированного способа. Используют стандартный протокол синтеза Liberty для масштаба 0,1 ммоль. Этот протокол включает снятие защиты с N-концевого остатка Fmoc посредством начальной обработки с помощью 7 мл 20% пиперидина, содержащего 0,1 MN-гидроксибензотриазола (НОВТ), в DMF. Начальную стадию снятия защиты осуществляют в течение 30 с с подачей микроволновой мощности (45 Вт, максимальная температура 75 С) при барботировании азота (3 с включено/7 с выключено). Затем реакционную емкость осушают и осуществляют вторую обработку пиперидином, идентичную первой обработке, за исключением того, что она происходит в течение 3 мин. Затем смолу осушают и несколько раз тщательно промывают DMF. После этого добавляют защищенную аминокислоту, Fmoc-Thr(tBu)-ОН, приготовленную как 0,2 М исходный раствор в DMF, (2,5 мл, 5 экв.), а затем 1,0 мл 0,45 М (4,5 экв.) HBTU [2-(1 Нбензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат] в DMF. За этим следует добавление 0,5 мл 2 М (10 экв.) DIPEA (диизопропилэтиламин) в NMP (N-метилпирроллидинон). Стадию конденсации осуществляют в течение 5 мин с использованием микроволновой мощности 20 Вт, максимальной температуры 75 С и такой же скорости барботирования азота. После начальной стадии конденсации реакционную емкость осушают от отходов и стадию конденсации повторяют. Затем инициируют цикл 2, сходный с циклом 1. Все аминокислоты вводят сходным образом и используют стратегию двойной конденсации для всей последовательности. Циклы 1-3, 19-20,25-26 и 30-39 включают процедуру кэппирования непосредственно после стадии конденсации. Кэппирование осуществляют посредством добавления 7 мл 0,5 М уксусного ангидрида, содержащего 0,015 М НОВТ, в NMP, вместе с 2 мл 2 М раствора DIPEA с использованием многостадийного микроволнового протокола: 50 Вт мощности в течение 30 с (максимальная температура 65 С), затем 30 с без микроволной мощности, затем второй заход в 30 с подачи микроволновой мощности (50 Вт), а затем опять 30 с без микроволновой мощности. Затем смолу осушают и тщательно промывают DMF. Используют следующие аминокислоты (Advanced Chemtech, Louisville, KY, USA): цикл 1: Fmoc-Cys(Trt)-OH; цикл 2: Fmoc-IleOH; цикл 3: Fmoc-Asn(Trt)-OH; цикл 4: Fmoc-His (Trt)-ОН; цикл 5: Fmoc-Lys(Boc)-ОН; цикл 6: FmocTrp(Boc)-ОН; цикл 7: Fmoc-Asp(OtBu)-ОН; цикл 8: Fmoc-Asn (Trt)-OH; цикл 9: Fmoc-Lys(Boc)-ОН; цикл 10: Fmoc-Lys(Boc)-ОН; цикл 11: Fmoc-Gly-OH; цикл 12: Fmoc-Lys(Boc)-ОН; цикл 13: Fmoc-Gln(Trt)-ОН; цикл 14: Fmoc-Ala-OH; цикл 15: Fmoc-Leu-OH; цикл 16: Fmoc-Leu-OH; цикл 17: Fmoc-Trp(Boc)-ОН; цикл 18: Fmoc-Asn (Trt)-OH; цикл 19: Fmoc-Val-OH; цикл 20: Fmoc-Phe-OH; цикл 21: Fmoc-Asp(OtBu)-ОН; цикл 22: Fmoc-Gln(Trt)-ОН; цикл 23: Fmoc-Gln(Trt)-ОН; цикл 24: Fmoc-His(Trt)-ОН; цикл 25: Fmoc-IleОН; цикл 26: Fmoc-Lys(Boc)-ОН; цикл 27: Fmoc-Asp(OtBu)-ОН; цикл 28: Fmoc-Met-OH; цикл 29: FmocAla-OH; цикл 30: Fmoc-Ile-OH; цикл 31: Fmoc-Tyr(tBu)-Ser(psiMe,Me,Pro)-ОН; цикл 32: Fmoc-Asp(OtBu)-OH; цикл 33: Fmoc-Ser(tBu)-ОН; цикл 34: Fmoc-A6c-OH; цикл 35: Fmoc-Phe-OH; цикл 36: FmocGly-Thr(psiMe,Me,Pro)-OH; цикл 37: Fmoc-Glu (OtBu)-ОН; цикл 38: Fmoc-Ala-OH и цикл 39: FmocTyr(tBu)-ОН. Протокол конденсации для Fmoc-His(Trt)-ОН представляет собой слегка модифицированную версию стандартного протокола. Микроволновую мощность отключают в течение первых 2 мин,затем следуют 4 мин с подачей микроволновой мощности (20 Вт; максимальная температура 50 С). После завершения основной пептидной цепи используют стандартную обработку пиперидином для удаления N-концевой группы Fmoc. Затем смолу тщательно промывают DMF, а затем переносят обратно в 50 мл коническую пробирку с использованием DMF в качестве транспортного растворителя. Со смолы снимают защиту и отщепляют пептид от смолы посредством обработки с помощью 5 мл следующего реагента: 5% TIS, 2% воды, 5% (мас./об.) дитиотреитола (DTT), 88% TFA, и позволяют перемешиваться в течение 3,5 ч. Фильтрат собирают в 45 мл холодного водного этилового эфира. Осадок осаждают в течение 10 мин при 3500 об/мин в охлаждаемой центрифуге. Эфир декантируют и пептид повторно суспендируют в свежем эфире. Извлечение в эфире осуществляют в целом 2 раза. После последней промывки в эфире пептиду позволяют сушиться на воздухе для удаления остатка эфира. Пеп- 17020019 тидный осадок повторно суспендируют в 8 мл ацетонитрила (Acn), затем в 8 мл деионизованной воды и позволяют ему полностью раствориться. Затем раствор пептида анализируют с помощью массспектрометрии. Масс-спектрометрический анализ с использованием электрораспылительной ионизации идентифицирует главный продукт, содержащий массу 5011,7 Да; соответствующий желаемому линейному продукту. Сырой продукт (приблизительно 500 мг) анализируют с помощью HPLC с использованием колонки С 18 2504,6 мм (Phenomenex; Torrance, CA, USA), используя градиент 2-80% ацетонитрила(0,1% TFA) в течение 30 мин. Аналитическая HPLC идентифицирует продукт с 34% чистотой. Затем сырой пептид очищают с помощью препаративной HPLC, снабженной колонкой С 18 с обращенной фазой, с использованием 10-60% ацетонитрила (0,1% TFA) в течение 50 мин при скорости потока 10 мл/мин. Затем очищенный пептид лиофилизируют с получением 15 мг пептида. Затем линейный пептид дериватизируют с помощью N-пропилмалеимида (Pma) с генерированием пропилсукцинимидного производного(Psu) на боковой цепи цистеина. Очищенный линейный пептид помещают в воду, доводят рН до 6,5 с помощью карбоната аммония, 5 мг/мл. 5 экв. Pma добавляют при постоянном перемешивании в течение 30 с. Затем раствор дериватизированного пептида анализируют с помощью масс-спектрометрии. Массспектрометрический анализ идентифицирует главный продукт, содержащий массу 5150,7 Да; соответствующий желаемому дериватизированному продукту Psu. Затем продукт повторно очищают с помощью препаративной HPLC с использованием градиента, сходного с тем, что указано выше. Очищенный продукт анализируют с помощью HPLC на чистоту (95,10%) и с помощью масс-спектрометрии (5150,9 Да) и затем лиофилизируют. Пример 103. [Orn1(N-C(О)-(СН 2)12-СН 3), A6c7]hGIP(1-42)-ОН. Твердофазный пептидный синтез используют для сборки пептида с использованием метода Fmoc с микроволновым нагреванием на Liberty Peptide Synthesizer (СЕМ; Matthews, NC, USA) в масштабе 0,1 ммоль. Предварительно нагруженную Fmoc-Gln(Trt) на смолу Wang (0,59 ммоль/г; Novabiochem, SanDiego, CA, USA) используют для генерирования пептида с С-концевой кислоты. Смолу (0,17 г) помещают в 50-мл коническую пробирку вместе с 15 мл диметилформамида (DMF) и помещают на место смолы в синтезаторе. Затем смолу количественно переносят в реакционную емкость посредством автоматизированного способа. Используют стандартный протокол синтеза Liberty для масштаба 0,1 ммоль. Этот протокол включает снятие защиты с N-концевого остатка Fmoc посредством начальной обработки с помощью 7 мл 20% пиперидина, содержащего 0,1 М N-гидроксибензотриазола (НОВТ), в DMF. Начальную стадию снятия защиты осуществляют в течение 30 с с подачей микроволновой мощности (45 Вт, максимальная температура 75 С) при барботировании азота (3 с включено/7 с выключено). Затем реакционную емкость осушают и осуществляют вторую обработку пиперидином, идентичную первой обработке, за исключением того, что она происходит в течение 3 мин. Затем смолу осушают и тщательно промываютDMF несколько раз. После этого добавляют защищенную аминокислоту Fmoc-Thr(tBu)-ОН, приготовленную как 0,2 М исходный раствор в DMF, (2,5 мл, 5 экв.), а затем 1,0 мл 0,45 М (4,5 экв.) HBTU [2-(1 Нбензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат] в DMF. За этим следует добавление 0,5 мл 2 М (10 экв.) DIPEA (диизопропилэтиламин) в NMP (N-метилпирроллидинон). Стадию конденсации осуществляют в течение 5 мин с использованием микроволновой мощности 20 Вт, максимальной температуры 75 С и такой же скорости барботирования азота. После начальной стадии конденсации реакционную емкость осушают от отходов и повторяют стадию конденсации. Затем инициируют цикл 2, сходный с циклом 1. Все аминокислоты вводят сходным образом и используют стратегию двойной конденсации для всей последовательности. Циклы 1-3, 19-20,25-26 и 30-39 включают процедуру кэппирования непосредственно после стадии конденсации. Кэппирование осуществляют посредством добавления 7 мл 0,5 М уксусного ангидрида, содержащего 0,015 М НОВТ в NMP, вместе с 2 мл 2 М раствора DIPEA с использованием многостадийного микроволнового протокола: 50 Вт мощности в течение 30 с (максимальная температура 65 С), затем 30 с без микроволной мощности, затем второй заход в 30 с микроволновой мощности (50 Вт), а затем опять 30 с без микроволновой мощности. Затем смолу осушают и тщательно промывают DMF. Используют следующие аминокислоты (Advanced Chemtech, Louisville, KY, USA): цикл 1: Fmoc-Thr(tBu)-ОН; цикл 2: Fmoc-Ile-OH; цикл 3: Fmoc-Asn(Trt)-ОН; цикл 4: Fmoc-His (Trt)-ОН; цикл 5: Fmoc-Lys(Вое)-ОН; цикл 6: FmocTrp(Boc)-ОН; цикл 7: Fmoc-Orn(Mtt)-ОН; цикл 8: Fmoc-Asn(Trt)-ОН; цикл 9: Fmoc-Lys(Boc)-ОН; цикл 10:Fmoc-Lys(Boc)-ОН; цикл 11: Fmoc-Gly-OH; цикл 12: Fmoc-Lys(Boc)-ОН; цикл 13: Fmoc-Gln(Trt)-ОН; цикл 14: Fmoc-Ala-OH; цикл 15: Fmoc-Leu-OH; цикл 16: Fmoc-Leu-OH; цикл 17: Fmoc-Trp(Boc)-ОН; цикл 18: Fmoc-Asn(Trt)-ОН; цикл 19: Fmoc-Val-OH; цикл 20: Fmoc-Phe-OH; цикл 21: Fmoc-Asp(OtBu)-OH; цикл 22: Fmoc-Gln(Trt)-ОН; цикл 23: Fmoc-Gln(Trt)-ОН; цикл 24: Fmoc-His(Trt)-ОН; цикл 25: Fmoc-IleOH; цикл 26: Fmoc-Lys(Boc)-ОН; цикл 27: Fmoc-Asp (OtBu)-ОН; цикл 28: Fmoc-Met-OH; цикл 29: FmocAla-OH; цикл 30: Fmoc-Ile-OH; цикл 31: Fmoc-Tyr(tBu)-Ser(psiMe,Me,Pro)-ОН; цикл 32: Fmoc-Asp(OtBu)ОН; цикл 33: Fmoc-Ser(tBu)-ОН; цикл 34: Fmoc-A6c-OH; цикл 35: Fmoc-Phe-OH; цикл 36: Fmoc-GlyThr(psiMe,Me,Pro)-ОН; цикл 37: Fmoc-Glu(OtBu)-ОН; цикл 38: Fmoc-Ala-OH и цикл 39: Boc-Tyr(tBu)-ОН. Протокол конденсации для Fmoc-His(Trt)-ОН представляет собой слегка модифицированную версию стандартного протокола. Микроволновую мощность отключают в течение первых 2 мин, затем следуют 4 мин с подачей микроволновой мощности (20 Вт; максимальная температура 50 С). После завершения основной пептидной цепи смолу обрабатывают 12 мл 1% трифторуксусной кислоты (TFA)/5% триизопропилсилана (TIS) в дихлорметане (DCM) в течение 5 мин и с продувкой N2, 5 с включено и 10 с выключено. Затем смолу сушат и опять обрабатывают 1% TFA/5% TIS в растворе в DCM в течение 5 мин. Это осуществляется в целом 7 раз для эффективного удаления остатка Mtt из боковой цепи орнитина. Смолу несколько раз тщательно промывают DCM, а затем обрабатывают с помощью стандартной обработки пиперидином для нейтрализации остаточной соли TFA наN орнитина. Миристиновую кислоту(СН 3-(СН 2)12-COOH; Aldrich, St. Louis, MO, USA), приготовленную как 0,2 М раствор в DMF, связывают с боковой цепью орнитина с использованием стандартного протокола конденсации аминокислот. Затем смолу тщательно промывают DMF, а затем переносят обратно в 50-мл коническую пробирку с использованием DMF в качестве транспортного растворителя. Со смолы снимают защиту и отщепляют пептид от смолы посредством обработки с помощью 5 мл следующего реагента: 5% TIS, 2% воды, 5% (мас./об.) дитиотреитола (DTT), 88% TFA, и позволяют перемешиваться в течение 3,5 ч. Фильтрат собирают в 45 мл холодного водного этилового эфира. Осадок осаждают в течение 10 мин при 3500 об/мин в охлаждаемой центрифуге. Эфир декантируют и пептид повторно суспендируют в свежем эфире. Извлечение в эфире осуществляют в целом 2 раза. После последней промывки в эфире пептиду позволяют сушиться на воздухе для удаления остатка эфира. Пептидный осадок повторно суспендируют в 8 мл ацетонитрила (Acn), затем в 8 мл деионизованной воды и позволяют ему полностью раствориться. Затем раствор пептида анализируют с помощью массспектрометрии. Масс-спектрометрический анализ с использованием электрораспылительной ионизации идентифицирует главный продукт, содержащий массу 5205,1 Да; соответствующий желаемому продукту. Сырой продукт анализируют с помощью HPLC с использованием колонки С 18 2504,6 мм (Phenomenex;Torrance, СА, USA), используя градиент 2-80% ацетонитрила (0,1% TFA) в течение 30 мин. Аналитическая HPLC идентифицирует продукт с 50% чистотой. Затем сырой пептид очищают с помощью препаративной HPLC, снабженной колонкой С 18, с использованием сходного градиента элюирования. Очищенный продукт повторно анализируют с помощью HPLC на чистоту (95,50%) и с помощью массспектрометрии (5156,7 Да), а затем лиофилизируют. После лиофилизации получают 6,2 мг очищенного продукта, что соответствует выходу 1,2%. Другие пептиды по настоящему изобретению могут быть получены специалистом в данной области с использованием процедур синтеза, аналогичных тем, которые описаны в указанных выше примерах. Физические данные для соединений, иллюстрируемых в настоящем описании, представлены в табл. 1. Функциональные анализы. А. Анализ связывания с рецептором hGIP in vitro. Мембраны для анализа связывания с рецептором in vitro готовят посредством гомогенизации клональных клеток СНО-K1, экспрессирующих рекомбинантный рецептор GIP человека, с помощью Brinkman Polytron (настройки 6, 15 с), в 50 мМ охлаждаемого на льду Tris-HCl, а затем подвергают воздействию двух центрифугирований при 39000 g в течение 10 мин с повторным суспендированием в свежем буфере между ними. Для анализа аликвоты промытых препаратов мембраны инкубируют (100 мин при 25 С вместе с 0,05 нМ [125I]GIP (приблизительно 2200 Кюри/ммоль) в 50 мМ Tris-HCl, 0,1 мг/мл бацитрацина и 0,1% BSA. Конечный объем анализа составляет 0,5 мл. Инкубирование завершают посредством быстрого фильтрования через фильтры GF/C (предварительно пропитанные в 0,5% полиэтиленимина) с использованием фильтрационного коллектора Brandel. Каждую пробирку и фильтр затем промывают три раза с помощью 5-мл аликвоты буфера, охлажденного на льду. Специфичное связывание определяют как общее количество связанного радиоактивного лиганда минус то количество, которое связывается в присутствии 1000 нМ GIP. Данные связывания с рецептором hGIP in vitro для соединений, иллюстрируемых в настоящем описании, представлены в табл. 2. В. Анализ времени полужизни в плазме крови людей и крыс. Пептид GIP (50 мкл, 1 мг/мл) добавляют к 450 мкл плазмы крови (человека или крысы), встряхивают в течение короткого времени и инкубируют при 37 С. 50 мкл удаляют в различные моменты времени,например через 0, 1, 2, 3, 4, 8, 24, 32, 48, 56, 72 ч, смешивают с 5 мкл муравьиной кислоты и 150 мкл ацетонитрила в пробирке для микроцентрифуги, встряхивают и центрифугируют в течение 10 мин при 10000 об/мин. Супернатант переносят во флакон для инъекций и анализируют с помощью LC-MS. Система LC-MS состоит из масс-спектрометра API4000 с датчиком ESI. Используют режим положительных ионов и детектирование полного сканирования. Разделение с помощью HPLC осуществляют на колонкеLuna C8, 3 мкм (2), 230 мм с градиентом от 90% А до 90% В через 10 мин при скорости потока 0,3 мл/мин. Буфер А представляет собой 1% муравьиную кислоту в воде, а буфер В представляет собой 1% муравьиную кислоту в ацетонитриле. Данные относительно времени полужизни для плазмы крови человека и крысы для соединений, иллюстрируемых в настоящем описании, представлены в табл. 2. Таблица 2 При сравнении данных, перечисленных в табл. 2, данные по связыванию рецепторов hGIP in vitro и данные по времени полужизни в плазме крови человека и крысы для [Pro3]hGIP(1-42)-ОН, для соединения, описанного в публикации WO 00/58360, измеряются при таких же экспериментальных условиях, как описано выше, они должны составлять 170,8 нМ и 10,8 и 0,8 ч соответственно. С. Определение стимулирования циклического AMP. 1105 клеток СНО-K1, экспрессирующих рекомбинантный рецептор GIP человека, или клеток инсулиномы RIN-5F высевают на ночь в 24-луночные планшеты для культур клеток (Corning Incorporate,Corning, NY, USA). Для анализа клетки предварительно инкубируют в 500 мкл сбалансированного солевого раствора Хэнкса (Sigma, St. Louis, МО, USA) вместе с 0,55 мМ IBMX (Sigma, St. Louis, МО, USA) и доводят рН до 7,3 в течение 10 мин. Затем добавляют GIP или его аналоги при концентрации 100 нМ. После 30-минутного инкубирования при 37 С планшеты помещают на лед и добавляют 500 мкл охлажденного на льду абсолютного этанола для остановки реакции. Содержимое лунок собирают, центрифугируют при 2700 g в течение 20 мин при 4 С для удаления клеточных остатков. Уровни сАМР в супернатантах определяют с помощью радиоиммунологического анализа (New England Nuclear, Boston, MA,USA).D. Определение секреции инсулина in vivo у нормальных крыс. В качестве субъектов экспериментов используют самцов крыс Sprague Dawley с массой тела приблизительно 275-300 г. В день перед лечением правые атриальные канюли имплантируют через югулярную вену под хлоргидратным наркозом. Каждую канюлю заполняют 100 единиц/мл гепаринового солевого раствора и перевязывают. Крыс фиксируют в течение приблизительно 18 ч перед дозированием соединения или носителя (солевой раствор/0,25% BSA). В день эксперимента аликвоты соединения оттаивают, доводят до комнатной температуры и тщательно встряхивают. Тщательно проверяют наличие любого признака соединения, выпадающего из раствора. За 10 мин перед инъекцией соединения/глюкозы,500-мкл образец крови отбирают и заменяют равным объемом гепаринизированного солевого раствора(10 единиц/мл). В момент времени 0 отбирают через канюлю 500-мкл образец крови. Затем либо носитель, либо соответствующую дозу соединения вводят в канюлю и проталкивают ее с помощью раствора глюкозы (1 г/кг) или носителя. Наконец, 500-мкл объем гепаринизированного солевого раствора (10 единиц/мл) используют для проталкивания остальной глюкозы через канюлю. Дополнительные 500-мкл образцы крови отбирают через 2,5, 5, 10 и 20 мин после дозирования глюкозы; после каждого отбора непосредственно следует болюс, внутривенная инъекция 500 мкл гепаринизированного солевого раствора (10 единиц/мл) через канюлю. Плазму собирают из образцов крови посредством центрифугирования и хранят при -20 С до осуществления анализа на содержание инсулина. Численные значения общей секреции инсулина, которые показывают воздействия соединений примеров 105, 106, 118 и 119 in vivo, представлены в табл. 3.
МПК / Метки
МПК: C07K 14/62, C07K 14/46
Метки: инсулинотропного, аналоги, глюкозозависимого, полипептида
Код ссылки
<a href="https://eas.patents.su/30-20019-analogi-glyukozozavisimogo-insulinotropnogo-polipeptida.html" rel="bookmark" title="База патентов Евразийского Союза">Аналоги глюкозозависимого инсулинотропного полипептида</a>
Предыдущий патент: Процессированные аналоги глюкозозависимого инсулинотропного полипептида
Следующий патент: Использование тепла текучих сред, добытых при нефтегазовых операциях, для получения энергии
Случайный патент: Трансформируемый легковой автомобиль и способ его трансформации