Аналоги глюкозазависимого инсулинотропного полипептида
Формула / Реферат
Данные на сервере публикаций отсутствуют
Текст
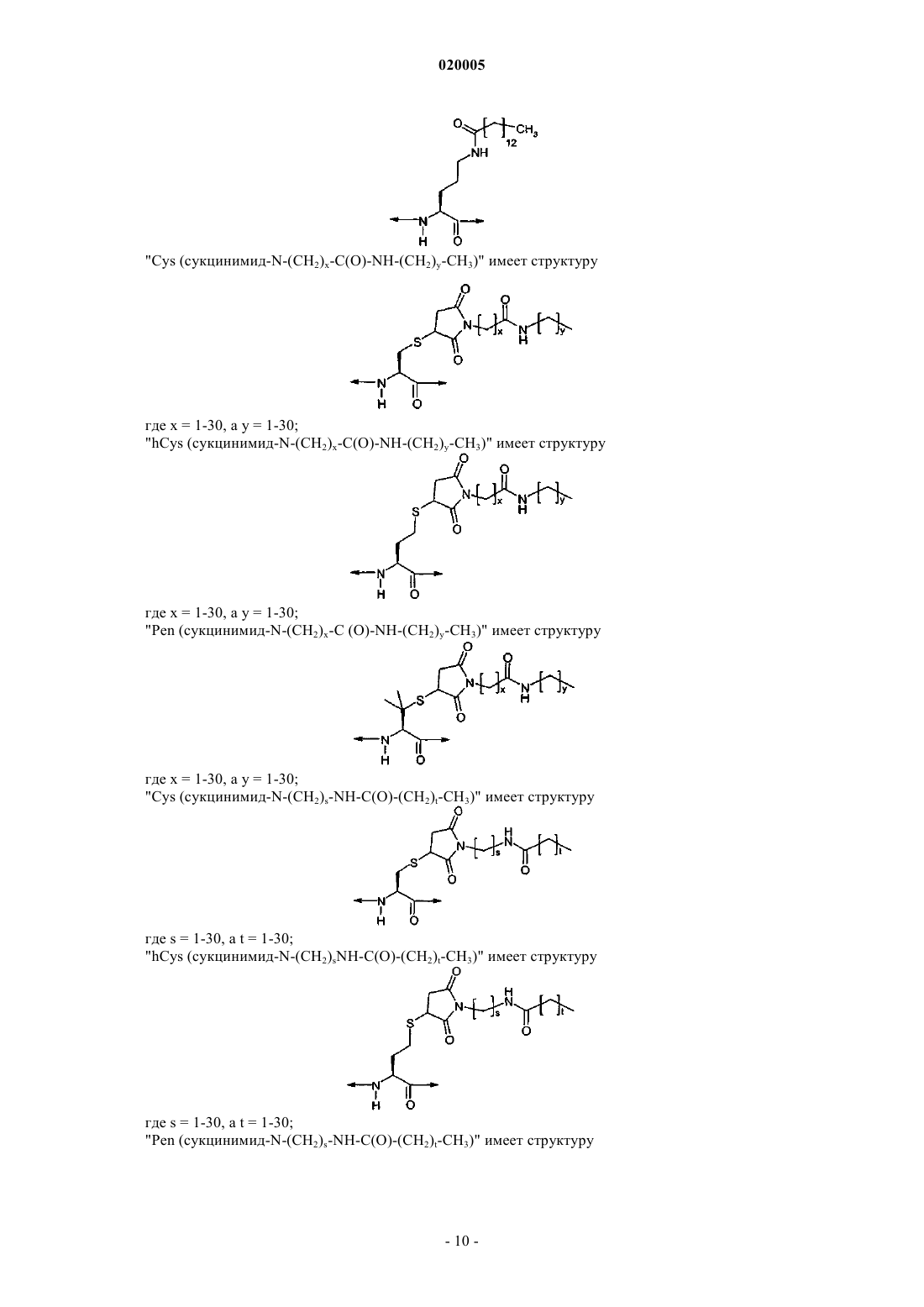
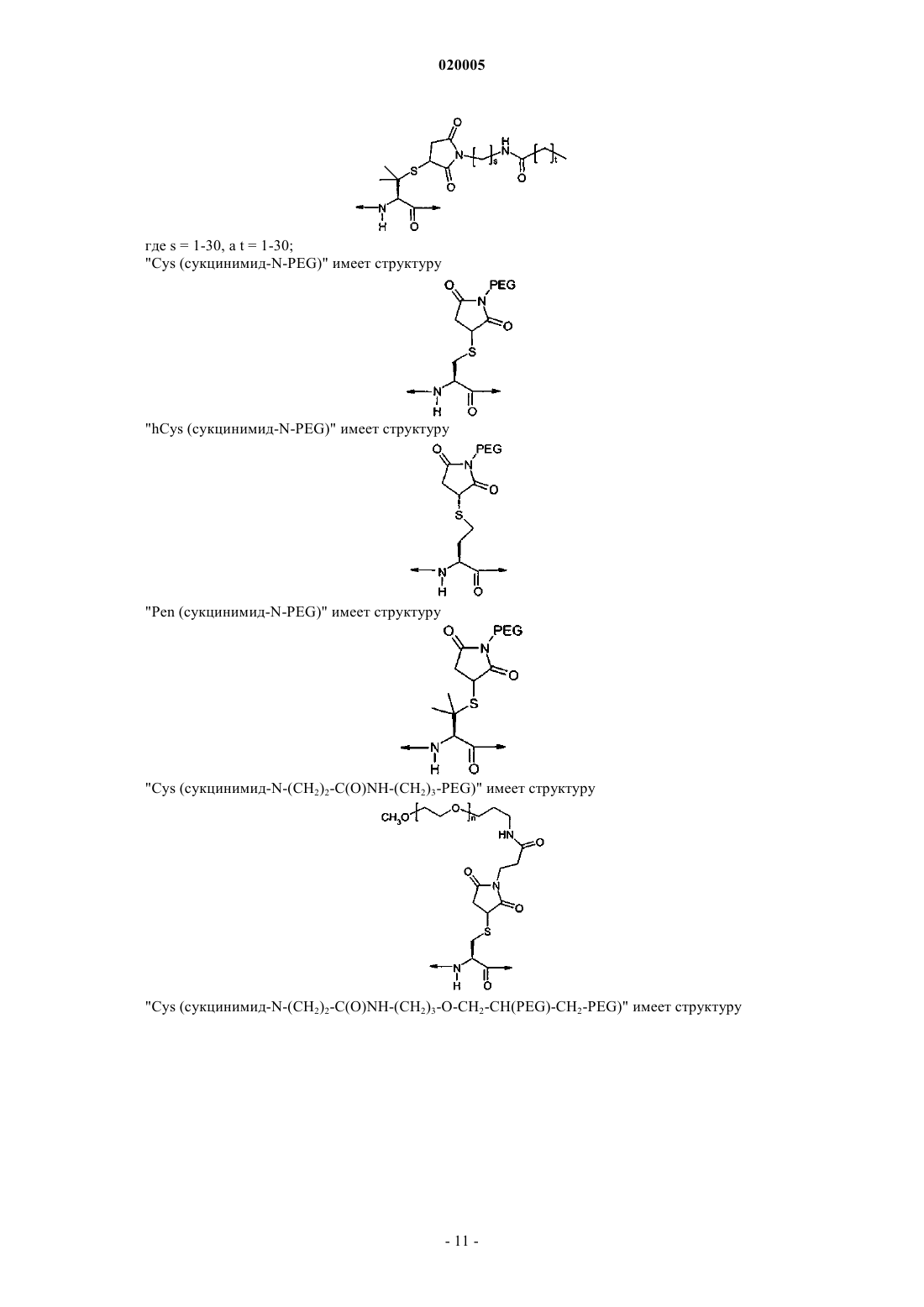
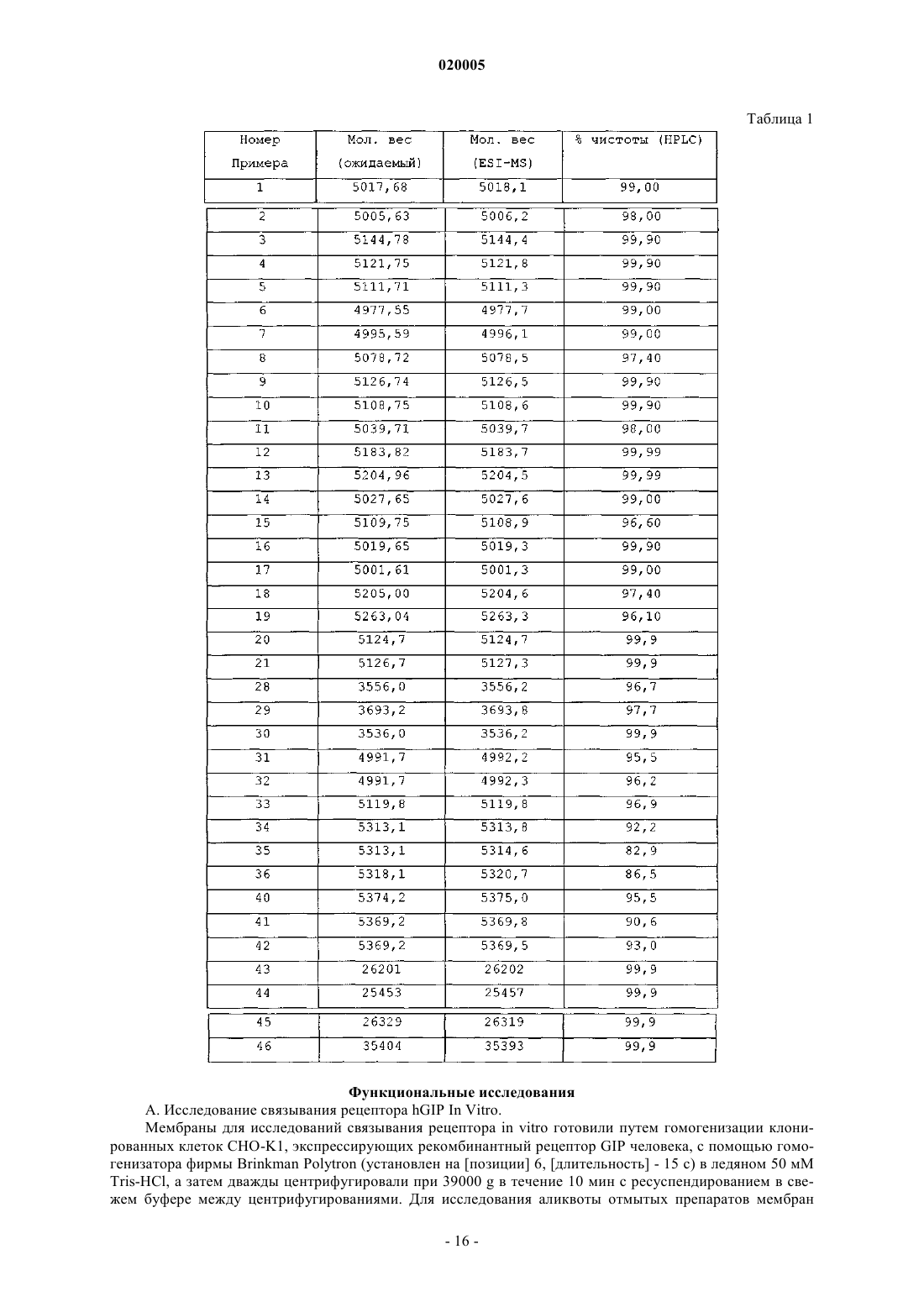
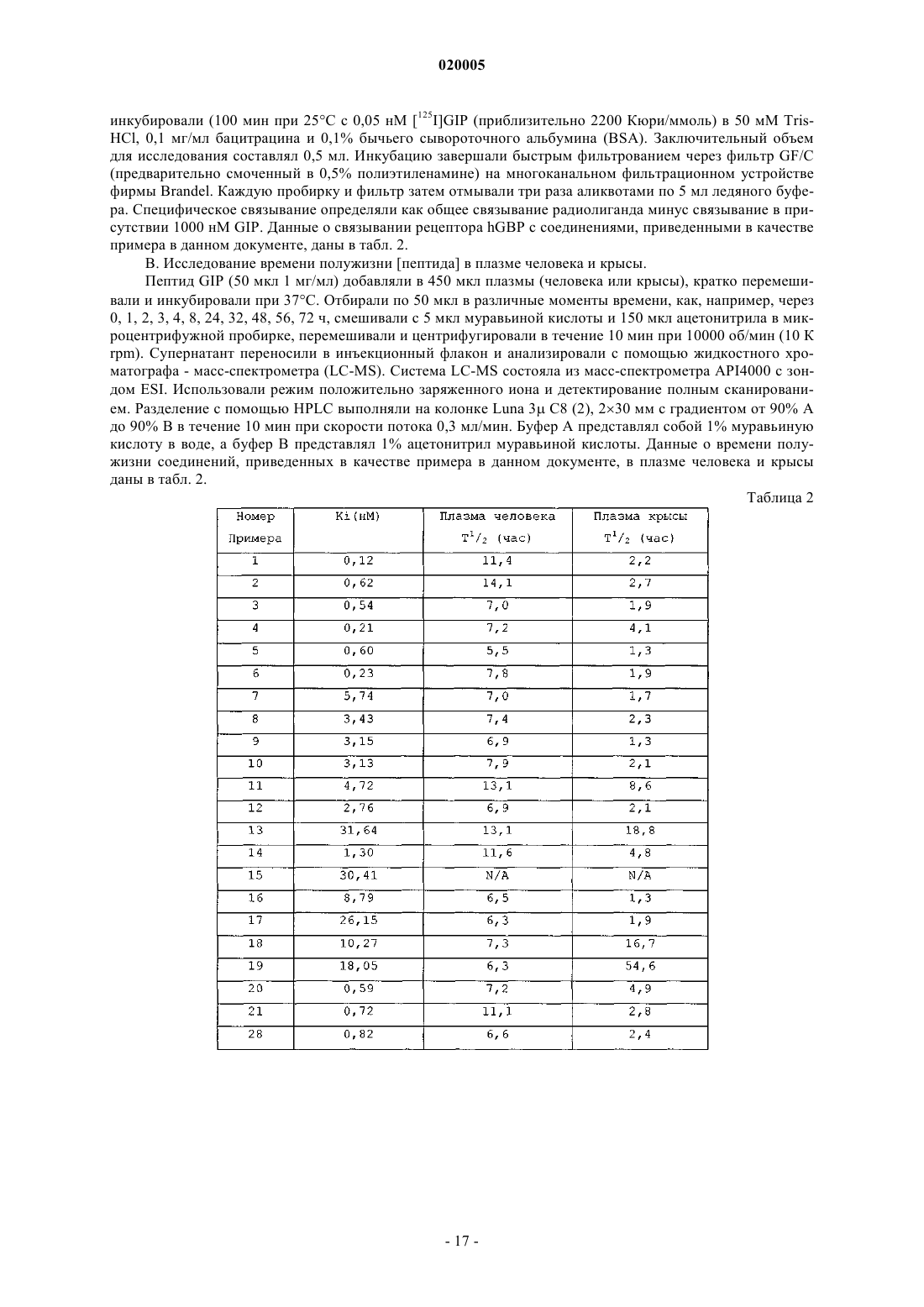
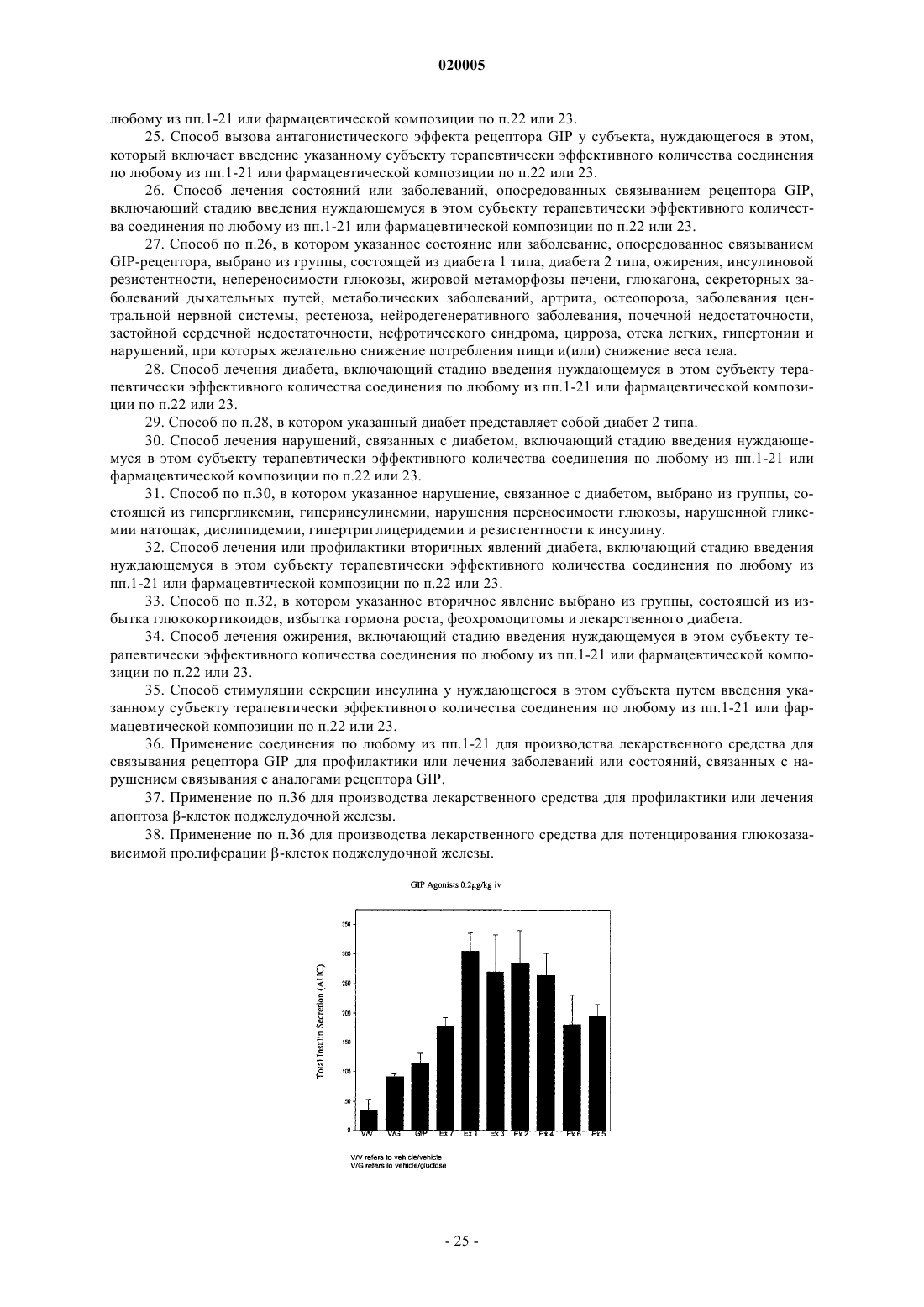
АНАЛОГИ ГЛЮКОЗАЗАВИСИМОГО ИНСУЛИНОТРОПНОГО ПОЛИПЕПТИДА Представлена новая серия аналогов соединений глюкозазависимого инсулинотропного пептида,фармацевтические композиции, содержащие указанные соединения, и применение указанных соединений в качестве агонистов или антагонистов рецептора GIP для лечения опосредованных рецептором GIP состояний, таких как инсулиннезависимый сахарный диабет и ожирение. Дун Чжэн Синь (US) Медведев В.Н. (RU) Область техники, к которой относится изобретение Данное изобретение относится к области новых аналогов соединений глюкозазависимого инсулинотропного пептида (GIP), фармацевтических композиций, содержащих указанные соединения, и к применению указанных соединений в качестве агонистов или антагонистов рецептора GIP для лечения состояний, опосредованных рецептором GIP, таких как инсулиннезависимый сахарный диабет и ожирение. Уровень техники Глюкозазависимый инсулинотропный пептид ("GIP", также известный как "желудочный ингибиторный полипептид"; последовательность (SEQ ID NO: 1) представляет собой пептид, состоящий из 42 остатков пептида, секретируемый энтероэндокринными K-клетками тонкого кишечника в кровоток в ответ на пероральный прием питательных веществ. GIP ингибирует секрецию желудочной кислоты и,как было показано, является мощным стимулятором секреции инсулина -клетками поджелудочной железы после перорального приема глюкозы ("инкретиновый эффект") (Creutzfeldt, W., et al., 1979, Diabetologia, 16:75-85). Выделение инсулина, индуцированное приемом глюкозы и других питательных веществ, происходит благодаря гормональным и нервным факторам (Creutzfeldt, W., et al., 1985, Diabetologia, 28: 565-573). Несколько желудочно-кишечных регуляторных пептидов предполагались в качестве инкретинов, и среди таких кандидатов только GIP и глюкагоноподобный пептид-1 ("GLP-1") выглядят соответствующими требованиям для того, чтобы рассматриваться как физиологические стимуляторы выделения инсулина после приема пищи (Nauck, et al., 1989, J. Clin. Endorinol. Metab., 69: 654-662). Было показано, что комбинированные эффекты GIP и GLP-1 достаточны для того, чтобы объяснить полный инкретиновый эффект энтероинсулярной оси (Fehmann, H.С, et al., 1989, FEBS Lett., 252: 109-112). Как известно специалистам в данной области техники, известные и потенциально возможные применения GIP разнообразны и многочисленны. Таким образом, введение соединений по данному изобретению в целях получения агонистического эффекта может иметь те же эффекты, что и применение самого GIP. Эти разнообразные применения GIP могут быть суммированы следующим образом: лечение заболеваний, выбранных из группы, состоящей из сахарного диабета 1 типа, сахарного диабета 2 типа(Gault, V. A., et al, 2003, Biochem. Biophys. Res. Commun., 308: 207-213), заболеваний центральной нервной системы, нейродегенеративных заболеваний, острой сердечной недостаточности, гипогликемии и нарушений, при которых желательно уменьшение потребления пищи и снижение веса тела. В островках поджелудочной железы GIP не только резко усиливает секрецию инсулина, но также стимулирует продукцию инсулина путем усиления транскрипции и трансляции проинсулина (Wang, et al., 1996, Mol. Cell.al., 2003, Diabetes, 52: 741-750). В дополнение к эффектам на поджелудочную железу, усиливающим секрецию инсулина, GIP также имеет непосредственные эффекты на ткани, являющиеся мишенями инсулина, снижающие уровень глюкозы в плазме: усиление захвата глюкозы жировой тканью (Eckel et al., 1979,Diabetes, 28: 1141-1142) и мышцам (O'Harte et al., 1998, J. Endocrinol., 156: 237-243) и ингибирование продукции глюкозы в печени (Elahi D., et al., 1986, Can. J. Physiol. Pharmacol., 65: A18). Кроме того, антагонист рецептора GIP по данному изобретению ингибирует, блокирует или уменьшает абсорбцию глюкозы из кишечника животного. В соответствии с этим наблюдением терапевтические композиции, содержащие антагонисты GIP, могут быть применены на пациентах с инсулиннезависимым сахарным диабетом для улучшения переносимости глюкозы при пероральном приеме млекопитающими, таких как человек, для предупреждения, замедления или уменьшения ожирения путем ингибирования, блокирования или уменьшения абсорбции глюкозы из кишечника млекопитающего. Применение немодифицированного GIP в качестве терапевтического средства, однако, ограничено коротким временем его полужизни in vivo, составляющим около 2 мин (Said and Mutt, 1970, Science, 169: 1217-1218). В сыворотке оба инкретина, GIP и GLP-1, подвергаются деградации дипептидилпептидазойIV (DPPIV). Улучшение устойчивости GIP к протеолизу не только поддерживает активность GIP и его рецептора, но и, что более существенно, предупреждает формирование фрагментов GIP, некоторые из которых действуют как антагонисты рецептора GIP (Gault, et al., 2002, J. Endocrinol., 175: 525-533). Модификации, о которых сообщалось, что они включают защиту N-конца GIP от протеолиза с помощьюDPPIV путем модификации тирозина на N-конце (O'Harte et al., 2002, Diabetologia, 45: 1281-1291), мутации аланина в положении 2 (Hinke, et al., 2002, Diabetes, 51: 656-661), мутации глютаминовой кислоты в положении 3 (Gault, et al., 2003, Biochem. Biophys. Res. Commun., 308: 207-213) и мутации аланина в положении 13 (Gault, et al., 2003, Cell Biol. International, 27:41-46). Нижеследующие патентные заявки приведены в связи с эффектами аналогов GIP на функцию различных органов, являющихся их мишенями, и их потенциальным применением в качестве терапевтических средств. Публикация РСТ WO 00/58360 описывает пептидильные аналоги GIP, которые стимулируют выделение инсулина. В частности, данная заявка описывает специфические пептидильные аналоги, содержа-1 020005 щие по меньшей мере 15 аминокислотных остатков на N-конце GIP(1-42), например, аналог GIP, содержащий только одну аминокислотную замену или модификацию в положениях 1, 2 и 3, такой как [Pro3]GIP(1-42). Публикация РСТ WO 98/24464 описывает антагонист GIP, состоящий, по существу, из полипептида, содержащего 24 аминокислоты, соответствующих положениям 7-30 последовательности GIP, способ лечения инсулиннезависимого сахарного диабета и способ улучшения переносимости глюкозы у пациента с инсулиннезависимым сахарным диабетом. Публикация РСТ WO 03/082898 описывает С-концевые усеченные фрагменты и N-концевые модифицированные аналоги GIP, также как и различные аналоги GIP с ослабленной пептидной связью и изменениями аминокислот вблизи от специфического сайта, по которому происходит расщепление под действием DPPIV. Эта заявка также описывает аналоги с различными линкерами между потенциальными местами связывания рецептора GIP. Предполагается, что соединения по этой патентной заявке полезны в лечении состояний, опосредованных рецептором GIP, таких как инсулиннезависимый сахарный диабет и ожирение. Существует потребность в улучшенных аналогах GIP, которые стабильны в фармацевтической форме и имеют длительное время полужизни в плазме in vivo вследствие уменьшения подверженности протеолизу и уменьшения выведения при поддержании аффинности связывания с рецептором GIP, вызывающего агонистический или антагонистический эффекты. Далее среди прочих терапевтических эффектов соединений по данному изобретению, как это проиллюстрировано в данном документе, более строгий контроль уровня глюкозы в крови может предупредить отдаленные диабетические осложнения,представляя, таким образом, улучшение качества жизни пациентов. Сущность изобретения Один из аспектов данного изобретения относится к вариантам пептида GIP следующей формулы (I):R1 представляет собой ОН, NH2, (С 1-С 30)алкокси или NH-X2-CH2-Z0, где X2 представляет собой (С 0 С 30) углеводородный остаток, a Z0 представляет собой Н, ОН, СО 2 Н или CONH2; каждый из R2, R3, R4 и R5, независимо выбранный из группы, состоящей из Н, (C1-C30) алкила, (С 1 С 30) гетероалкила, (С 1-С 30) ацила, (С 2-С 30) алкенила, (С 2-С 30) алкинила, арил (C1-C30) алкила, арил (C1-С 30) ацила, замещенного (C1-C30) алкила, замещенного (C1-С 30) гетероалкила, замещенного (C1-С 30) ацила,замещенного (С 2-С 30) алкенила, замещенного (С 2-С 30) алкинила, замещенного арил(С 1-С 30) алкила и замещенного арил (С 1-С 30) ацила; в том случае, когда R2 представляет собой (C1-С 30) ацил, арил (C1-C30) ацил, замещенный (С 1-С 30)ацил или замещенный арил (С 1-С 30) ацил, тогда R3 представляет собой Н, (C1C30) алкил, (C1-С 30) гетероалкил, (С 2-С 30)алкенил, (С 2-С 30) алкинил, арил (С 1-С 30) алкил, замещенный (С 1 С 30) алкил, замещенный (C1-C30) гетероалкил, замещенный (С 2-С 30)алкенил, замещенный (С 2-С 30) алкинил или замещенный арил(С 1-С 30)алкил; также, при условии, когда R4 представляет собой (C1-С 30)ацил,арил (C1-C30) ацил, замещенный (С 1-С 30)ацил или замещенный арил (C1-С 30) ацил, тогда R5 представляет собой Н, (C1-C30) алкил, (C1-С 30) гетероалкил, (С 2-С 30) алкенил, (С 2-С 30) алкинил, арил(С 1-С 30) алкил, замещенный (C1-C30) алкил, замещенный (C1-С 30) гетероалкил, замещенный (С 2-С 30) алкенил, замещенный(С 2-С 30) алкинил или замещенный арил (C1-С 30) алкил;n представляет собой целое число от 1 до 5 включительно, независимое в каждом случае; каждый из s, t, х и у независимо в каждом случае представляет собой целое число от 1 до 30 включительно; и каждый из X4, X5, X6, X7 и X8 независимо в каждом случае представляет собой Н, F, Cl, Br, I, (C1-10) алкил, замещенный (C1-10) алкил, арил, замещенный арил, ОН, NH2, NO2 или CN. В набор соединений (А), охватываемый приведенной выше формулой (I), входят те, в которых А 4 представляет собой Gly; А 5 представляет собой Thr; А 6 представляет собой Phe; А 7 представляет собой Ile или А 6 с; А 8 представляет собой Ser; А 9 представляет собой Asp; А 10 представляет собой Tyr; А 11 представляет собой Ser, А 5 с, или А 6 с; А 12 представляет собой Ile; А 13 представляет собой Ala или Aib; А 14 представляет собой Met, A5c, А 6 с или Nle; А 15 представляет собой Asp; А 16 представляет собой Lys; А 17 представляет собой Ile; А 18 представляет собой His; А 19 представляет собой Gln; А 20 представляет собой Gln; А 21 представляет собой Asp; А 22 представляет собой Phe; А 23 представляет собой Val; А 24 представляет собой Asn; А 25 представляет собой Trp; А 26 представляет собой Leu; А 27 представляет собой Leu; А 28 представляет собой Ala; А 29 представляет собой Gln; А 30 представляет собой Lys; А 31 представляет собой Gly, His, Orn(N-C(О)-(СН 2)12-СН 3) или отсутствует; А 32 представляет собой Lys, Cys, Cys (сукцинимид-N-(СН 2)11-CH3), Cys (сукцинимид-N-(CH2)15CH3), Orn(N-C(O)-(CH2)10-CH3), Orn(N-C(O)-(CH2)14-CH3) или отсутствует; А 33 представляет собой Lys, Cys, Cys (сукцинимид-N-(CH2)11-CH3), Cys (сукцинимид-N-(CH2)15CH3), Orn(N-C(O)-(CH2)10-CH3) или Orn(N-C(O)-(CH2)14-CH3) или отсутствует; А 34 представляет собой Asn или отсутствует;-4 020005 А 35 представляет собой Asp, Orn(N-C(О)-(СН 2)12-СН 3) или отсутствует; А 36 представляет собой Trp или отсутствует; А 37 представляет собой Lys или отсутствует; А 38 представляет собой His или отсутствует; А 39 представляет собой Asn или отсутствует; А 40 представляет собой Ile, А 5 с, А 6 с или отсутствует; А 41 представляет собой Thr, A5c, А 6 с или отсутствует; А 42 представляет собой Gln, Cys(Psu) или отсутствует; А 43 представляет собой Ado, Ala, Asn, Asp, Cys, Cys (сукцинимид-N-(CH2)11-СН 3), Cys (сукцинимид-N-(CH2)15-CH3), His, Lys(N-C(O)-(CH2)10-CH3), Lys(N-C(O)-(CH2)14-CH3), Orn(N-C(O)-(CH2)14-CH3),Phe, Thr, Tip или отсутствует; и при условии, что по меньшей мере один из А 7, А 11, А 13, А 14, А 31, А 35, А 40, А 41 и А 42 не является аминокислотным остатком в соответствующем положении в природном GIP. В набор соединений приведенного выше набора (А) входят те, в которых А 7 представляет собой Ile; А 13 представляет собой Ala или Aib; А 14 представляет собой Met, A5c, А 6 с или Nle; А 31 представляет собой Gly; А 35 представляет собой Asp и А 42 представляет собой Gln. В набор соединений приведенного выше набора (А) входят те, в которых А 7 представляет собой А 6 с; А 11 представляет собой Ser; А 13 представляет собой Ala; А 14 представляет собой Met или Nle; А 31 представляет собой Gly или Orn(N-C(О)-(СН 2)12-СН 3); А 32 представляет собой Lys; А 33 представляет собой Lys; А 35 представляет собой Asp или Orn(N-C(О)-(СН 2)12-СН 3); А 40 представляет собой Ile; А 41 представляет собой Thr или А 6 с; А 42 представляет собой Gln или Cys(Psu) и А 43 отсутствует. Предпочтительными соединениями формулы (I) являются Пример 1: (А 5c11,41)hGIP(1-42)-ОН (SEQ ID NO:4); Пример 2: (Abe11,40)hGIP(1-42)-ОН (SEQ ED NO:5); Пример 3: (А 5 с 11, His43)hGIP(1-43)-ОН (SEQ ID NO:6); Пример 4: (A5c11, Asn43)hGIP(1-43)-ОН (SEQ ID NO:7); Пример 5: (Aib13, Asp43)hGIP(1-43)-NH2 (SEQ ID NO:8); Пример 6: (Aib13, Nle14, A5c40)hGIP(1-42)-OH (SEQ ID NO:9); Пример 7: (Aib13, A5c40)hGIP(1-42)-OH (SEQ ID NO:10); Пример 8: (А 5 с 11, Ala43)hGIP(1-43)-OH (SEQ ID NO: 11); Пример 9: (Aib13, Nle14, Phe43)hGIP(1-43)-OH (SEQ ID NO: 12); Пример 10: (А 5 с 11, Thr43)hGIP(1-43)-OH (SEQ ID NO: 13); Пример 11: (А 6 с 11,14,41)hGIP(1-42)-OH (SEQ ID NO: 14); Пример 12: (Aib13, Trp43)hGIP(1-43)-OH (SEQ ID NO: 15); Пример 13: (A5c11, Ado43)hGIP(1-43)-OH (SEQ ED NO: 16); Пример 14: (А 6 с 11,14,40)GIP(1-42)-OH (SEQ ID NO: 17); Пример 15: [А 6 с 7, Cys(Psu)42]hGIP(1-42)-OH (SEQ ID NO: 18); Пример 16: (А 6 с 7,41)hGIP(1-42)-OH (SEQ ID NO:19); Пример 17: (А 6 с 7,41, Nle14)hGIP(1-42)-OH (SEQ ID NO: 20); Пример 18: [А 6 с 7, Orn35(N-C(O)-(CH2)12-CH3)]hGIP(1-42)-OH (SEQ ID NO: 21); Пример 19: [А 6 с 7, Orn31(N-C(O)-(CH2)12-CH3)]hGIP(1-42 )-OH (SEQ ID NO: 22); Пример 20: (A5c11,14, His43)hGIP(1-43)-OH (SEQ ID NO: 23); Пример 21: (A5c11, Nle14, His43)hGIP(1-43)-OH (SEQ ID NO: 24); Пример 22: [A5c11, Orn32(N-C(О)-(CH2)14-CH3), His43]hGIP (1-43)-OH (SEQ ID NO: 25); Пример 23: [А 5 с 11, Orn33(N-C(O)-(CH2)14-CH3), His43]hGIP(1-43)-OH (SEQ ID NO: 26); Пример 24: [A5c11, Orn43(N-C (O)-(CH2)14-CH3)]hGIP (1-43)-OH (SEQ ID NO: 27); Пример 25: [A5c11, Cys32(сукцинимид-N-(CH2)15-CH3), His43]hGIP(1-43)-OH (SEQ ID NO: 28); Пример 26: [A5c11, Cys33(сукцинимид-N-(CH2)15-CH3), His43]hGIP(1-43)-OH (SEQ ID NO: 29); Пример 27: [A5c11, Cys43(сукцинимид-N-(CH2)15-CH3)]hGIP(1-43)-OH (SEQ ID NO: 30); Пример 28: (A5c11)hGIP(1-30)-NH2 (SEQ ID NO: 31);-5 020005 Пример 29: (A5c11, His31)hGIP(1-31)-NH2 (SEQ ID NO: 32); Пример 30: (A5c11,14)hGIP(1-30)-NH2 (SEQ ID NO: 33); Пример 31: (A5c11,41, Cys32)hGIP(1-42)-NH2 (SEQ ID NO: 34); Пример 32: (A5c11,41, Cys33)hGIP(1-42)-NH2 (SEQ ID NO: 35); Пример 33: (A5c11,41, Cys43)hGIP(1-43)-NH2 (SEQ ID NO: 36); Пример 34: [A5c11, Orn32(N-C(O)-(CH2)10-CH3), His43]hGIP(1-43)-OH (SEQ ID NO: 37); Пример 35: [A5c11, Orn33(N-C(O)-(CH2)10-CH3), His43]hGIP(1-43)-OH (SEQ ID NO: 38); Пример 36: [A5c11, Lys43(N-C(О)-(CH2)10-CH3)]hGIP(1-43)-OH (SEQ ED NO: 39); Пример 37: [A5c11, Cys32(сукцинимид-N-(CH2)11-СН 3), His43]hGIP(1-43)-OH (SEQ ID NO: 40); Пример 38: [A5c11, Cys33(сукцинимид-N-(CH2)11-CH3), His43]hGIP(1-43)-OH (SEQ ID NO: 41); Пример 39: [A5c11, Cys43 (сукцинимид-N-(CH2) 11-CH3)]hGIP (1-43)-OH (SEQ ID NO: 42); Пример 40: [A5c11, Lys43(N-C(O)-(CH2)14-CH3)]hGIP(1-43)-OH (SEQ ID NO: 43); Пример 41: [А 5 с 11, Orn32 (N-C(O)-(CH2)14-CH3), His43]hGIP (1-43)-OH (SEQ ID NO: 44); и Пример 42: [A5c11, Orn33(N-C(O)-(CH2)14-CH3), His43]hGIP(1-43)-OH (SEQ ID NO: 45). В соответствии с еще одним аспектом данного изобретения соединение по данному изобретению,как это просуммировано выше в данном документе и заявлено в прилагаемой формуле изобретения, может также содержать ковалентно связанный остаток полиэтиленгликоля (PEG), где указанный остатокPEG связан с соединением через связующий агент Cys (малеимид), hCys (малеимид) или Pen (малеимид) с образованием Cys (сукцинимид-N-PEG), hCys (сукцинимид-N-PEG) или Pen (сукцинимид-N-PEG), где"сукцинимид-N-PEG" является линейным или разветвленным, как это определено ниже в данном документе. Такой остаток PEG имеет средний молекулярный вес от около 2000 до около 80000 Да, и предпочтительно такой остаток PEG выбирают из группы, содержащей 5 кДа (K) PEG, 10K PEG, 20K PEG,30K PEG, 40K PEG, 50K PEG и 60 К PEG, с образованием Cys (сукцинимид-N-5K PEG), Cys (сукцинимид-N-10K PEG), Cys (сукцинимид-N-20K PEG), Cys (сукцинимид-N-30K PEG), Cys (сукцинимид-N-40K(сукцинимид-N-10K PEG), hCys (сукцинимид-N-20K PEG), hCys (сукцинимид-N-30K PEG), hCys (сукцинимид-N-40K PEG), hCys (сукцинимид-N-50K PEG), hCys (сукцинимид-N-60K PEG), Pen (сукцинимидN-5K PEG), Pen (сукцинимид-N-10K PEG), Pen (сукцинимид-N-20K PEG), Pen (сукцинимид-N-30K PEG),Pen (сукцинимид-N-40K PEG), Pen (сукцинимид-N-50K PEG) или Pen (сукцинимид-N-60K PEG). Полиэтиленгликолирование (PEG-илирование) происходит по какому-либо из аминокислотных остатков в положениях 16, 30 и 31-43 и предпочтительно по какому-либо из аминокислотных остатков в положениях 32, 33 и 43, тогда как Cys (сукцинимид-N-PEG), hCys (сукцинимид-N-PEG) или Pen (сукцинимид-N-PEG) располагаются в любом из таких положений аминокислотных остатков. Далее вышеприведенная формула (I) может быть расширена для обеспечения мест PEG-илирования в положениях А 44-А 47. С-концы таких PEG-илированных соединений по данному изобретению могут быть амидированы, например (А 5 с 11,41)hGIP(1-42)-NH2 (SEQ ID NO: 68), или они могут оставаться свободными кислотами, например (А 5 с 11,41)hGIP(1-42 )-ОН (SEQ ID NO: 4). Предпочтительными соединениями таких PEG-илированных соединений являются пример 43: [А 5 с 11,41, Cys32(сукцинимид-N-20K PEG)]hGIP(1-42)-NH2 (SEQ ID NO: 46); пример 44: [А 5 с 11,41, Cys33(сукцинимид-N-20K PEG)]hGIP(1-42)-NH2 (SEQ ID NO: 47); пример 45: [A5c11,41, Cys43 (сукцинимид-N-20K PEG)]hGIP(1-43)-NH2 (SEQ ID NO: 48); пример 46: [А 5 с 11,41, Cys43 (сукцинимид-N-30K PEG)]hGIP(1-43)-NH2 (SEQ ID NO: 49); пример 47: [А 5 с 11, Nle14, Cys43 (сукцинимид-N-(CH2)2-C(O)NH-(CH2)3-20K PEG)]hGIP(1-43)-NH2PEG)]hGIP(1-42)-NH2 (SEQ ID NO: 67). Еще более предпочтительные соединения формулы I представляют собой пример 3: (А 5 с 11, His43)hGIP(1-43)-ОН (SEQ ID NO:6); пример 33: (А 5 с 11,41, Cys43)hGIP(1-43)-NH2 (SEQ ID NO: 36); пример 46: [А 5 с 11,41, Cys43 (сукцинимид-N-30K PEG)]hGIP(l-43)-NH2 (SEQ ID NO: 49); пример 40: [А 5 с 11, Lys43 (N-C(О)-(CH2)14-CH3)]hGIP(1-43)-ОН (SEQ ID NO: 43); пример 1: (A5c11,41) hGIP (1-42)-OH (SEQ ID NO:4); пример 4: (А 5 с 11, Asn43)hGIP(1-43)-OH (SEQ ID NO:7); пример 6: (Aib13, Nle14, A5c40)hGIP(1-42)-OH (SEQ ID NO:9); пример 29: (A5c11, His31)hGIP(1-31)-NH2 (SEQ ID NO: 32); пример 20: (А 5 с 11,14, His43)hGIP(1-43)-OH (SEQ ID NO: 23); пример 5: (Aib13, Asp43)hGIP(1-43)-NH2 (SEQ ID NO:8); пример 2: (А 5 с 11,40)hGIP(1-42)-OH (SEQ ED NO:5); пример 43: [А 5 с 11,41, Cys32 (сукцинимид-N-20K PEG)]hGIP(l-42)-NH2 (SEQ ID NO: 46); пример 45: [А 5 с 11,41, Cys43 (сукцинимид-K1-20K PEG)]hGIP(1-43)-NH2 (SEQ ID NO: 48); пример 21: (А 5 с 11, Nle14, His43)hGIP(1-43)-OH (SEQ ID NO: 24); пример 44: [А 5 с 11,41, Cys33 (сукцинимид-N-20K PEG)]hGIP(1-42)-NH2 (SEQ ID NO: 47); пример 30: (A5c11,14)hGIP(1-30)-NH2 (SEQ ID NO: 33); пример 28: (А 5 с 11)hGIP(1-30)-NH2 (SEQ ID NO: 31); пример 36: [A5c11, Lys43 (N-C(O)-(CH2)10-CH3)]hGIP(1-43)-OH (SEQ ED NO: 39); пример 31: (A5c11,41, Cys32)hGIP(1-42)-NH2 (SEQ ID NO: 34); пример 32: (A5c11,41, Cys33)hGIP(1-42)-NH2 (SEQ ID NO: 35); пример 12: (Aib13, Trp43)hGIP(1-43)-OH (SEQ ID NO: 15); пример 9: (Aib13, Nle14, Phe43)hGIP(1-43)-OH (SEQ ID NO: 12); пример 8: (A5c11, Ala43)hGIP(1-43)-OH (SEQ ID NO: 11); пример 7: (Aib13, A5c40)hGIP(1-42)-OH (SEQ ID NO:10); или их фармацевтически приемлемые соли. Еще более предпочтительные соединения формулы I представляют собой пример 3: (А 5 с 11, His43)hGIP(1-43)-ОН (SEQ ID NO: 6); пример 33: (А 5 с 11,41, Cys43)hGIP(1-43)-NH2 (SEQ ID NO: 36); пример 46: [A5c11,41, Cys43 (сукцинимид-N-30K PEG)]hGIP(1-43)-NH2 (SEQ ID NO: 49) и пример 40: [A5c11, Lys43 (N-C O)-(CH2)14-CH3)]hGIP (1-43)-OH (SEQ ID NO: 43); или их фармацевтически приемлемые соли. Особенно предпочтительное соединение формулы I представляет собой пример 3: (А 5 с 11, His43)hGIP(1-43)-ОН (SEQ ID NO: 6) или их фармацевтически приемлемые соли. Краткое описание чертежа Чертеж показывает эффекты in vivo соединений по примерам 1-7 и природного GIP на выделение инсулина у крыс Sprague Dawley. Подробное описание изобретения В изобретении использованы нижеследующие общепринятые сокращения:HPLC: жидкостная хроматография высокого разрешения;NMP: N-метилпирролидон; 5K PEG: полиэтиленгликоль, который может включать другие функциональные группы или остатки, такие как линкер, и которые являются либо линейными, либо разветвленными, как это определено ниже в данном документе, со средним суммарным молекулярным весом около 5000; 10K PEG: полиэтиленгликоль, который может включать другие функциональные группы или остатки, такие как линкер, и которые являются либо линейными, либо разветвленными, как это определено ниже в данном документе, со средним суммарным молекулярным весом около 10000; 20K PEG: полиэтиленгликоль, который может включать другие функциональные группы или остатки, такие как линкер, и которые являются либо линейными, либо разветвленными, как это определено ниже в данном документе, со средним суммарным молекулярным весом около 20000; 30K PEG: полиэтиленгликоль, который может включать другие функциональные группы или остатки, такие как линкер, и которые являются либо линейными, либо разветвленными, как это определено ниже в данном документе, со средним суммарным молекулярным весом около 30000; 40K PEG: полиэтиленгликоль, который может включать другие функциональные группы или остатки, такие как линкер, и которые являются либо линейными, либо разветвленными, как это определено ниже в данном документе, со средним суммарным молекулярным весом около 40000; 50K PEG: полиэтиленгликоль, который может включать другие функциональные группы или остатки, такие как линкер, и которые являются либо линейными, либо разветвленными, как это определено ниже в данном документе, со средним суммарным молекулярным весом около 50000; 60K PEG: полиэтиленгликоль, который может включать другие функциональные группы или остатки, такие как линкер, и которые являются либо линейными, либо разветвленными, как это определено ниже в данном документе, со средним суммарным молекулярным весом около 60000; За исключением N-концевой аминокислоты, все сокращения (например, Ala) для аминокислот в данном описании обозначают структуру -NH-Cl(R')-СО-, где R и R', каждый независимо друг от друга,представляют собой водород или боковую цепь аминокислоты (например, R = СН 3, a R' = Н для Ala), илиR и R' могут соединяться, образуя кольцевую систему. Для N-концевой аминокислоты сокращения даны для структуры (R2R3)N-Cl(R')-СО-, где R2 и R3 определены в вышеприведенной формуле (I). Термин "(C1-С 30)углеводородный остаток" охватывает алкил, алкенил и алкинил, и в случае алкенила и алкинила - это С 2-С 30. Пептид по данному изобретению также описывается в данном документе в еще одном формате, например (А 5 с 2)hGIP(1-42)-ОН (SEQ ID NO: 3), с замещенными аминокислотами природной последовательности, помещенными в квадратных скобках (например, А 5 с 2 вместо Ala2 вhGIP). Число в круглых скобках относится к числу аминокислот, присутствующих в пептиде (например,hGIP(1-42)-ОН (SEQ ID NO: 1) - это аминокислоты с 1-й до 42-й пептидной последовательности hGIP). Обозначение "NH2" в hGIP(1-30)-NH2 (SEQ ID NO: 2) показывает, что С-конец пептида амидирован;hGIP(1-42) (SEQ ID NO: 1) или hGIP(1-42)-OH (SEQ ID NO: 1) означает, что С-конец представляет собой свободную кислоту."Ацил" обозначает R"-C(O)-, где R" представляет собой Н, алкил, замещенный алкил, гетероалкил,замещенный гетероалкил, алкенил, замещенный алкенил, арил, алкиларил или замещенный алкиларил."Алкил" обозначает углеводородную группу, содержащую один или более атомов углерода, где множественные атомы углерода, если они наличествуют, соединены одинарными связями. Алкильная углеводородная группа может представлять собой линейную цепь или содержать одну или более ветвей или циклических групп."Замещенный алкил" обозначает алкил, в котором один или более атомов водорода углеводородной группы замещен одним или более заместителем, выбранным из группы, состоящей из галогена (т.е. фтора, хлора, брома и йода), -ОН, -CN, -SH, -NH2, -NHCH3, -NO2, -C1-20 алкила, замещенного галогеном, -CF3,-OCH3, -OCF3 и -(СН 2)0-20-СООН. В различных вариантах осуществления присутствуют 1, 2, 3 или 4 заместителя. Присутствие -(СН 2)0-20-СООН приводит к образованию алкилкислоты. Примеры алкилкислот, содержащих или состоящих из -(СН 2)0-20-СООН включают 2-норборнан уксусную кислоту, третмасляную кислоту и 3-циклопентил пропионовую кислоту."Гетероалкил" обозначает алкил, в котором один или более атомов углерода в углеводородной группе замещен одной или более нижеследующих групп: амино, амидо, -O-, -S- или карбонил. В различных вариантах осуществления присутствуют 1 или 2 гетероатома."Замещенный гетероалкил" обозначает гетероалкил, в котором один или более атомов водорода в углеводородной группе замещены одним или более заместителей, выбранными из группы, состоящей из галогена, -ОН, -CN, -SH, -NH2, -NHCH3, -NO2, -C1-20 алкил, замещенный галогенами, -CF3, -ОСН 3, -OCF3 и -(СН 2)0-20-СООН. В различных вариантах осуществления присутствуют 1, 2, 3 или 4 заместителя."Алкенил" обозначает углеводородную группу из двух или более атомов углерода, в которой присутствует одна или более двойная связь между атомами углерода. Алкениловая углеводородная группа может иметь линейную цепь или содержать одну или более ветвей и циклических групп."Замещенный алкенил" обозначает алкенил, в котором один или более атомов водорода замещен одним или более заместителями, выбранными из группы, состоящей из галогена,-ОН, -CN, -SH, -NH2,-NHCH3, -NO2, -С 1-20 алкила, замещенного галогенами, -CF3, -ОСН 3, -OCF3 и -(СН 2)0-20-СООН. В различных вариантах осуществления присутствуют 1, 2, 3 или 4 заместителя."Арил" обозначает ароматическую группу, необязательно замещенную по меньшей мере одним кольцом, имеющим сопряженную pi-электронную систему, содержащую до трех сопряженных или со- 12020005 единенных кольцевых систем. Арил включает карбоциклический арил, гетероциклический арил и биарильные группы. Предпочтительно арил представляет собой 5- или 6-членное кольцо. Предпочтительные атомы для гетероциклического арила - это один или более [атом] серы, кислорода и(или) азота. Примеры арила включают пентил, 1-нафтил, 2-нафтил, индол, хинолин, 2-имидазол и 9-антрацен. Арильные заместители выбраны из группы, состоящей из -C1-20 алкила, -C1-20 алкокси, галогена, -ОН, -CN,-SH, -NH2, NO2, -C1-20 алкила, замещенного галогенами, -CF3, -OCF3 и -(СН 2)0-20-СООН. В различных вариантах осуществления арил содержит 0, 1, 2, 3 или 4 заместителя."Алкиларил" обозначает "алкил", присоединенный к "арилу". Синтез. Пептиды по данному изобретению могут быть получены с помощью обычного твердофазного синтеза пептидов. См., например, Stewart, J.M., et al., 1984, Solid Phase Synthesis, Pierce Chemical Co., 2d ed. Если R1 представляет собой NH-X2-CH2-CONH2, т.е. Z0 = CONH2, синтез пептида начинается с Fmoc-HNX2-CH2-CONH2, который связан со смолой Rink amide MBHA. Если R1 представляет собой NH-X2-CH2COOH, т.е. Z0 = СООН, синтез пептида начинается с Fmoc-HN-X2-CH2-COOH, который связан со смолойWang. Для этой конкретной стадии использовали 2 моль-эквивалента Fmoc-HN-X2-COOH, HBTU и HOBt и 10 моль-эквивалентов DIPEA. Время связывания составляло около 8 ч. При синтезе аналога GIP по данному изобретению, содержащего А 5 с, А 6 с и(или) Aib, время связывания составляет 2 ч для этих остатков и для остатков, следующих непосредственно за ними. Заместители R2 и R3 в приведенной выше тривиальной формуле могут быть присоединены к свободному амину N-концевой аминокислоты А 1 стандартными способами, известными в данной области техники. Например, алкильные группы, например (С 1-С 30)алкил, могут быть присоединены с помощью восстановительного алкилирования. Гидроксиалкильные группы, например (C1-С 30)гидроксиалкил, также могут быть присоединены с помощью восстановительного алкилирования, при котором свободная гидроксильная группа защищена трет-бутиловым эфиром. Ацильные группы, например -С(O)Х 3, могут быть присоединены связыванием свободной кислоты, например -Х 3 СООН, со свободным амином Nконцевой аминокислоты путем смешивания смолы с 3 моль-эквивалентами как свободной кислоты, так и диизопропилкарбодиимида в метиленхлориде в течение около 1 ч. Если свободная кислота содержит свободную гидроксильную группу, например 3-фторо-4-гидроксифенилуксусная кислота, тогда присоединение должно проводиться с дополнительными 3 моль-эквивалентами НОВТ. Нижеследующие примеры описывают синтетические способы изготовления пептида по данному изобретению, каковые способы известны специалистам в данной области техники. Другие способы также известны специалистам в данной области техники. Примеры представлены с целью иллюстрации и не означают ограничения сферы данного изобретения каким-либо путем. Пример 15. [А 6 с 7, Cys(Psu)42]hGIP(1-42)-ОН. Твердофазный синтез пептида использовали для сборки пептида с помощью химической микроволновой системы с Fmoc на пептидном синтезаторе Liberty Peptide Synthesizer (фирма СЕМ; Мэтьюз, Северная Каролина, США) в диапазоне 0,1 ммоль. Преднагруженная Fmoc-Cys(Trt)-Wang смола (0,59 ммоль/г; фирма Novabiochem, Сан-Диего, Калифорния, США) была использована для генерации Сконцевой кислоты пептида. Смолу (0,17 г) помещали в 50 мл коническую пробирку с 15 мл диметилформамида (DMF) и загружали на место для смолы в синтезаторе. Смола затем количественно перемещалась в реакционный сосуд с помощью автоматизированного процесса. Использовали стандартный протокол синтеза Liberty для диапазона синтеза 0,1 ммоль. Этот протокол вовлекает депротектирование Nконцевого остатка Fmoc путем первоначальной обработки 7 мл 20% пиперидина, содержащего 0,1 М Nгидроксибензотриазола (НОВТ) в DMF. Первоначальная стадия депротектирования проходила в течение 30 с при микроволновом воздействии (45 Вт, максимальная температура 75 С) и пробулькивании азота(включение на 3 с/выключение на 7 с). Затем реакционный сосуд осушали и проводили вторую обработку пиперидином, идентичную первой обработке, за исключением того, что она продолжалась 3 мин. Затем смолу осушали и тщательно промывали в DMF несколько раз. Затем добавляли (2,5 мл, 5 экв.) защищенную аминокислоту Fmoc-Thr(tBu)-ОН, приготовленную в виде 0,2 М маточного раствора в DMF, а затем-1,0 мл 0,45 М (4,5 экв.) HBTU [2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурониум гексафторфосфат] в DMF. За этим следовало добавление 0,5 мл 2 М (10 экв.) DIPEA (диизопропиламин) в NMP (Nметилпирролидон). Эта стадия соединения проводилась в течение 5 мин в микроволновой системе при микроволновой мощности 20 Вт, максимальной температуре 75 С и такой же скорости пробулькивания азота. После начальной стадии присоединения реакционный сосуд опустошается, и стадия присоединения повторяется. Цикл 2 начинается подобно тому, как начинался цикл 1. Все аминокислоты вводятся сходным образом, и стратегия двойного связывания применялась для всей последовательности. Циклы 1-3,19-20, 25-26 и 30-39 содержали процедуру блокирования непосредственно вслед за стадией связывания. Блокирование выполняли путем добавления 7 мл 0,5 М уксусного ангидрида, содержащего 0,015 М НОВТ в NMP, вместе с 2 мл раствора 2 М DIPEA с помощью многостадийного микроволнового протокола: мощность 50 Вт в течение 30 с (максимальная температура 65 С), после чего микроволновая энергия отключалась на 30 с, затем второй цикл включения микроволновой энергии на 30 с (50 Вт), в затем снова 30-секундное отключение микроволной энергии. Затем смолу осушали и тщательно отмывали DMF. Использовали нижеследующие аминокислоты (фирма Advanced Chemtech, Луисвилль, Кентукки, США). Цикл 1: Fmoc-Thr(OtBu)-ОН; цикл 2: Fmoc-Ile-OH; цикл 3: Fmoc-Asn(Trt)-ОН; цикл 4: Fmoc-His(Trt)-ОН; цикл 5: Fmoc-Lys(Вос)-ОН; цикл 6: Fmoc-Trp(Вос)-ОН; цикл 7: Fmoc-Asp(OtBu)-ОН; цикл 8: FmocAsn(Trt)-ОН; цикл 9: Fmoc-Lys(Вос)-ОН; цикл 10: Fmoc-Lys (Вос)-ОН; цикл 11: Fmoc-Gly-OH; цикл 12:Fmoc-A6c-OH. цикл 35: Fmoc-Phe-OH; цикл 36: Fmoc-Gly-Thr(psiMe, Me, Pro)-ОН; цикл 37: FmocGlu(OtBu)-ОН; цикл 38: Fmoc-Ala-OH и цикл 39: Fmoc-Tyr(tBu)-ОН. Протокол связывания для FmocHis(Trt)-ОН представлял собой несколько модифицированную версию стандартного протокола. Микроволновую энергию отключали на первые 2 мин, после чего включали на 4 мин (20 Вт; максимальная температура 50 С). После того как построение скелета пептида завершалось, использовали стандартную обработку пиперидином для удаления N-концевой группы Fmoc. Смолу тщательно отмывали DMF, а затем переносили снова в 50 мл коническую пробирку с использованием DMF как растворителя для переноса. Смолу депротектировали и проводили отщепление от нее с помощью обработки 5 мл нижеследующего реагента: 5% TIS, 2% воды, 5% (вес./об.) дитиотреитол (DTT), 88% TFA, и давали перемешаться в течение 3,5 ч. Фильтрат собирали в 45 мл холодного безводного этилового эфира. Преципитат осаждали в течение 10 мин при 3500 об/мин в охлаждаемой центрифуге. Эфир декантировали, а пептид ресуспендировали в свежем эфире. Обработку эфиром проводили всего 2 раза. После последней отмывки эфиром пептиду позволяли высыхать на воздухе, чтобы удалить остаточный эфир. Осадок пептида ресуспендировали в 8 мл ацетонитрила (Acn), после чего в 8 мл деионизированной воды и давали полностью раствориться. Раствор пептида затем анализировали с помощью масс-спектрометрии. С помощью массового анализа, при котором использовали ионизацию электрораспылением, идентифицировали основной продукт с массой 4970,7 Да, соответствующий линейному продукту. Неочищенный продукт (приблизительно 500 мг) анализировали с помощью HPLC с использованием колонки 2504,6 мм С 18 (фирма Phenomenex; Торанс, Калифорния, США) и градиента 2-80% ацетонитрила (0,1% TFA) в течение 30 мин. Неочищенный пептид затем дериватизовали N-пропилмалеимидом (Pma) с получением пропилсукцинимидного (Psu) производного на боковой цепи цистеина. Неочищенный линейный пептид переводили в воду (5 мг/мл) и с помощью карбоната аммония устанавливали рН 6,5. Пять эквивалентов Pma добавляли при постоянном перемешивании в течение 30 с. Реакцию с избытком Pma останавливали с помощью 5 экв. дитиотреитола (DTT). Раствор дериватизированного пептида затем анализировали с помощью массспектрометрии. Массовый анализ идентифицировал основной продукт с массой 5109,7 Да, соответствующий желаемому Psu-дериватизированному продукту. Продукт затем очищали препаративной HPLC с помощью градиента, сходного с указанным выше. Очищенный продукт анализировали с помощью HPLC на чистоту (96,60%) и с помощью масс-спектрометрии (5108,9 Да), а затем лиофилизировали. После лиофилизации получали 10,3 мг очищенного продукта, представляющего 2% выход. Пример 18: [А 6 с 7, Orn35(N-C(О)-(СН 2)12-СН 3)]hGIP(1-42)-ОН. Твердофазный синтез пептида использовали для сборки пептида с помощью химической микроволновой системы с Fmoc на пептидном синтезаторе Liberty Peptide Synthesizer (фирма СЕМ; Мэтьюз, Северная Каролина, США) в диапазоне 0,1 ммоль. Преднагруженная Fmoc-Cys(Trt)-Wang смола (0,59 ммоль/г; фирма Novabiochem, Сан-Диего, Калифорния, США) была использована для генерации Сконцевой кислоты пептида. Смолу (0,17 г) помещали в 50 мл коническую пробирку с 15 мл диметилформамида (DMF) и загружали на место для смолы в синтезаторе. Смолу затем количественно перемещали в реакционный сосуд с помощью автоматизированного процесса. Использовали стандартный протокол синтеза Liberty для диапазона синтеза 0,1 ммоль. Этот протокол вовлекает депротектирование Nконцевого остатка Fmoc путем первоначальной обработки 7 мл 20% пиперидина, содержащего 0,1 М Nгидроксибензотриазола (НОВТ) в DMF. Первоначальная стадия депротектирования проходила в течение 30 с при микроволновом воздействии (45 Вт, максимальная температура 75 С) и пробулькивании азота(включение на 3 с/выключение на 7 с). Затем реакционный сосуд осушали и проводили вторую обработку пиперидином, идентичную первой обработке, за исключением того, что она продолжалась 3 мин. Затем смолу осушали и тщательно промывали в DMF несколько раз. Затем добавляли (2,5 мл, 5 экв.) защищенную аминокислоту Fmoc-Thr(tBu)-ОН, приготовленную в виде 0,2 М маточного раствора в DMF, а затем-1,0 мл 0,45 М (4,5 экв.) HBTU [2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурониум гексафторфосфат] в DMF. За этим следовало добавление 0,5 мл 2 М (10 экв.) DIPEA (диизопропилэтиламин) в NMP(N-метилпирролидон). Эта стадия присоединения проводилась в течение 5 мин в микроволновой системе при микроволновой мощности 20 Вт, максимальной температуре 15 С и такой же скорости пробулькивания азота. Вслед за начальной стадией присоединения реакционный сосуд опустошается, и стадия присоединения повторяется. Цикл 2 начинается подобно тому, как начинался цикл 1. Все аминокислоты вводятся сходным образом, и стратегия двойного связывания применялась для всей последовательности. Циклы 13, 19-20, 25-26 и 30-39 содержали процедуру блокирования непосредственно вслед за стадией связывания. Блокирование выполняли путем добавления 7 мл 0,5 М уксусного ангидрида, содержащего 0,015 М НОВТ в NMP, вместе с 2 мл раствора 2 М DIPEA с помощью многостадийного микроволнового протокола: мощность 50 Вт в течение 30 с (максимальная температура 65 С), после чего микроволновая энергия отключалась на 30 с, затем-второй цикл включения микроволновой энергии на 30 с (50 Вт), а затем снова 30-секундное отключение микроволной энергии. Затем смолу осушали и тщательно отмывали DMF. Использовали нижеследующие аминокислоты (фирма Advanced Chemtech, Луисвиль, Кентукки, США): цикл 1: Fmoc-Thr(tBu)-ОН; цикл 2: Fmoc-Ile-OH; цикл 3: Fmoc-Asn(Trt)-ОН; цикл 4: Fmoc-His(Trt)-ОН; цикл 5: Fmoc-Lys(Вос)-ОН; цикл 6: Fmoc-Trp(Вос)-ОН; цикл 7: Fmoc-Orn(Mtt)-OH; цикл 8: FmocAsn(Trt)-ОН; цикл 9: Fmoc-Lys(Вос)-ОН; цикл 10: Fmoc-Lys (Вос)-ОН; цикл 11: Fmoc-Gly-OH; цикл 12:Fmoc-А 6 с-ОН; цикл 35: Fmoc-Phe-OH; цикл 36: Fmoc-Gly-Thr(psiMe, Me, Pro)-ОН; цикл 37: FmocGlu(OtBu)-ОН; цикл 38: Fmoc-Ala-OH и цикл 39: Boc-Tyr(tBu)-ОН. Протокол присоединения FmocHis(Trt)-ОН представлял собой несколько модифицированную версию стандартного протокола. Микроволновую энергию отключали на первые 2 мин, после чего включали на 4 мин (20 Вт; максимальная температура 50 С). После того как построение скелета пептида завершалось, смолу обрабатывали 12 мл 1% трифторуксусной кислоты (TFA)/5% триизопропилсилана (TIS) в дихлорметане (DCM) в течение 5 мин, при режиме подачи N2-включение на 5 с и отключение на 10 с. Затем смолу осушали и снова обрабатывали 1% TFA/5% TIS в растворе DCM в течение 5 мин. Это проделывали всего 7 раз, чтобы эффективно удалить остаток Mtt из боковой цепи орнитина. Смолу тщательно отмывали с помощью DCM несколько раз, а затем обрабатывали с помощью стандартной обработки пиперидином, чтобы нейтрализовать остаточную соль TFA на N орнитина. Тетрадекановую (миристиновую) кислоту (СН 3-(СН 2)12 СООН; фирма Aldrich, St. Louis, МО, США), приготовленную в виде 0,2 М раствора в DMF, присоединяли к боковой цепи орнитина с помощью стандартного протокола присоединения аминокислоты. Затем смолу тщательно отмывали в DMF, после чего переносили снова в 50 мл коническую пробирку, используя DMF в качестве растворителя для переноса. Смолу депротектировали и проводили отщепление от нее с помощью обработки 5 мл нижеследующего реагента: 5% TIS, 2% вода, 5% (вес./об.) дитиотреитол (DTT), 88% TFA, и позволяли перемешиваться в течение 3,5 ч. Фильтрат собирали в 45 мл холодного безводного этилового эфира. Преципитат осаждали в охлаждающей центрифуге в течение 10 мин при 3500 об/мин. Эфир декантировали и пептид ресуспендировали в свежем эфире. Обработку эфиром проводили всего 2 раза. После последней отмывки эфиром пептиду позволяли высушиваться на воздухе для устранения остаточного эфира. Осадок пептида ресуспендировали в 8 мл ацетонитрила (Acn), после чего в 8 мл деионизированной воды и давали ему полностью раствориться. Раствор пептида затем анализировали с помощью масс-спектрометрии. С помощью массового анализа, при котором использовали ионизацию электрораспылением, идентифицировали основной продукт с массой 5205,1 Да, соответствующий линейному продукту. Неочищенный продукт (приблизительно 500 мг) анализировали с помощью HPLC, с использованием колонки 2504,6 ммCI8 (фирма Phenomenex; Торанс, Калифорния, США) и градиента 2-80% ацетонитрила (0,1% TFA) в течение 30 мин. Аналитическая HPLC идентифицировала продукт с 50% частотой. Затем пептид очищали на препаративной HPLC, снабженной колонкой CI8, с помощью сходного градиента элюции. Очищенный продукт повторно анализировали с помощью HPLC до чистоты (97,40%) и масс-спектрометрии(5204,6 Да) и затем лиофилизировали. После лиофилизации получали 6,2 мг очищенного продукта, представляющих выход 1,2%.PEG-илированные соединения GIP, описанные в данном документе, могут быть синтезированы, в основном, в соответствии с процедурой, описанной для синтеза соединения по примеру 15, с использованием PEG-малеимида в качестве исходного материала вместо N-пропилмалеимида, использованного в примере 15. Другие пептиды по данному изобретению могут быть получены работниками с обычным уровнем подготовки в данной области техники с использованием процедур синтеза, аналогичных таковым, описанным в приведенных выше примерах. Физические данные для соединений, примеры которых приведены в данном документе, даны в табл. 1.A. Исследование связывания рецептора hGIP In Vitro. Мембраны для исследований связывания рецептора in vitro готовили путем гомогенизации клонированных клеток СНО-K1, экспрессирующих рекомбинантный рецептор GIP человека, с помощью гомогенизатора фирмы Brinkman Polytron (установлен на [позиции] 6, [длительность] - 15 с) в ледяном 50 мМTris-HCl, а затем дважды центрифугировали при 39000 g в течение 10 мин с ресуспендированием в свежем буфере между центрифугированиями. Для исследования аликвоты отмытых препаратов мембран- 16020005 инкубировали (100 мин при 25 С с 0,05 нМ [125I]GIP (приблизительно 2200 Кюри/ммоль) в 50 мМ TrisHCl, 0,1 мг/мл бацитрацина и 0,1% бычьего сывороточного альбумина (BSA). Заключительный объем для исследования составлял 0,5 мл. Инкубацию завершали быстрым фильтрованием через фильтр GF/C(предварительно смоченный в 0,5% полиэтиленамине) на многоканальном фильтрационном устройстве фирмы Brandel. Каждую пробирку и фильтр затем отмывали три раза аликвотами по 5 мл ледяного буфера. Специфическое связывание определяли как общее связывание радиолиганда минус связывание в присутствии 1000 нМ GIP. Данные о связывании рецептора hGBP с соединениями, приведенными в качестве примера в данном документе, даны в табл. 2.B. Исследование времени полужизни [пептида] в плазме человека и крысы. Пептид GIP (50 мкл 1 мг/мл) добавляли в 450 мкл плазмы (человека или крысы), кратко перемешивали и инкубировали при 37 С. Отбирали по 50 мкл в различные моменты времени, как, например, через 0, 1, 2, 3, 4, 8, 24, 32, 48, 56, 72 ч, смешивали с 5 мкл муравьиной кислоты и 150 мкл ацетонитрила в микроцентрифужной пробирке, перемешивали и центрифугировали в течение 10 мин при 10000 об/мин (10 Кrpm). Супернатант переносили в инъекционный флакон и анализировали с помощью жидкостного хроматографа - масс-спектрометра (LC-MS). Система LC-MS состояла из масс-спектрометра API4000 с зондом ESI. Использовали режим положительно заряженного иона и детектирование полным сканированием. Разделение с помощью HPLC выполняли на колонке Luna 3 С 8 (2), 230 мм с градиентом от 90% А до 90% В в течение 10 мин при скорости потока 0,3 мл/мин. Буфер А представлял собой 1% муравьиную кислоту в воде, а буфер В представлял 1% ацетонитрил муравьиной кислоты. Данные о времени полужизни соединений, приведенных в качестве примера в данном документе, в плазме человека и крысы даны в табл. 2. Таблица 2 С. Определение стимуляции циклического АМФ. 1105 клеток СНО-K1, экспрессирующих рекомбинантный рецептор GIP человека или клеток инсулиномы RIN-5F, высаживали в течение ночи на 24-луночные планшеты для культуры клеток (фирмаCorning Incorporate, Corning, NY, США). Для исследований клетки преинкубировали в 500 мкл сбалансированного солевого раствора Хенкса (фирма Sigma, Сент-Луис, Миссури, США) с 0,55 мМ изобутилметилксантина (IBMX) (фирма Sigma, Сент-Луис, Миссури, США), рН, установленным на 7,3, в течение 10 мин. Затем добавляли GIP или его аналог в концентрации 100 нМ. После 30-минутной инкубации при 37 С планшеты помещали на лед и добавляли 500 мкл ледяного абсолютного этанола, чтобы остановить реакцию. Содержимое лунок собирали и центрифугировали при 2700 g в течение 20 мин при 4 С, чтобы удалить остатки клеток. Уровень цАМФ в супернатантах определяли с помощью радиоиммуноанализаD. Определение секреции инсулина у нормальных крыс in vivo. В качестве объекта эксперимента использовали самцов крыс Sprague Dawley с весом тела приблизительно в 275-300 г. За день до воздействия под хлоргидратным [наркозом] имплантировали в правое предсердие канюлю через яремную вену. Каждая канюля была заполнена физиологическим раствором со 100 ед./мл гепарина и перетянута. Крыс не кормили приблизительно 18 ч до введения соединения или среды (физиологический раствор/0,25% BSA). В день эксперимента аликвоты соединения размораживали, доводили до комнатной температуры и тщательно перемешивали. Тщательно следили за признаками выпадения соединения из раствора. За 10 мин перед инъекцией соединения/глюкозы 500 мкл образца крови удаляли и заменяли равным объемом гепаринизированного физиологического раствора (10 ед./мл). В момент времени "0" 500 мкл крови сливали через канюлю. Затем в канюлю инъецировали или среду,или подходящую дозу соединения и лили туда же глюкозу (1 г/кг) или раствор среды. Наконец, объем в 500 мкл гепаринизированного физиологического раствора (10 ед./мл) использовали, чтобы смыть через канюлю оставшуюся глюкозу. Дополнительные 500 мкл образцы крови брали через 2,5, 5, 10 и 20 мин после введения глюкозы; после каждого из них немедленно болюсом вводили путем внутривенной (iv) инъекции 500 мкл гепаринизированного физиологического раствора (10 ед./мл) через канюлю. Плазму собирали из образцов крови путем центрифугирования и хранили при -20 С до исследования на содержание инсулина. Чертеж показывает эффекты in vivo соединений по примерам 1-7 и природного GIP на выделение инсулина у крыс Sprague Dawley. Численные значения общей секреции инсулина, показанные на чертеже, суммированы в табл. 3. Эффект in vivo соединения по примеру 20 определяли в отдельном тесте при идентичных условиях эксперимента, как описано выше, а численные значения общей секреции инсулина для соединения по примеру 20 суммированы в табл. 4. Таблица 4 Введение. Пептиды по данному изобретению могут быть приготовлены в форме фармацевтически приемлемых солей. Примеры таких солей включают, без ограничения, таковые, образованные органическими кислотами (например, уксусной, молочной, малеиновой, лимонной, яблочной, аскорбиновой, янтарной,бензойной, метансульфоновой, толуолсульфоновой или памовой кислотой), неорганическими кислотами(например, соляной кислотой, серной кислотой или фосфорной кислотой) и полимерными кислотами(например, дубильной кислотой, карбоксиметил целлюлозой, полимолочной, полигликолевой или сополимерами полимолочной-гликолевой кислот). Типичный способ изготовления соли пептида по данному изобретению хорошо известен в данной области техники и может быть выполнен стандартными способами обмена солей. Соответственно, TFA соль пептида по данному изобретению (TFA соль образуется при очистке пептида с помощью препаративной HPLC (жидкостной хроматографией высокого разрешения) при элюции с помощью содержащего TFA буферного раствора) может быть преобразована в другую соль, такую как уксусная соль, путем растворения пептида в малом количестве водного раствора 0,25 н. уксусной кислоты. Образовавшийся раствор наносят на полупрепаративную колонку HPLC (фирма Zorbax, 300 SB, C-8). Колонку элюировали с помощью (1) водного раствора 0,1 н. ацетата аммония в течение 0,5 ч, (2) водного раствора 0,25 н. уксусной кислоты в течение 0,5 ч и (3) линейного градиента(20-100% раствора В в течение 30 мин) при скорости потока 4 мл/мин (раствор А представляет собой водный раствор 0,25 н. уксусной кислоты; раствор В представляет собой 0,25 н. уксусную кислоту в ацетонитрил/воде, 80:20). Фракции, содержащие пептид, собирали и лиофилизировали до высушивания. Дозировка активного ингредиента в композициях по данному изобретению может варьировать; однако, необходимо, чтобы количество активного ингредиента было таким, чтобы получить подходящую форму дозировки. Выбранная дозировка зависит от желаемого терапевтического эффекта, от способа введения и от длительности лечения. В целом, эффективная доза для активности по данному изобретению находится в диапазоне 110-7-200 мг/кг/день, предпочтительно 110-4-100 мг/кг/день, которая может быть введена в виде разовой дозы или разделена на множество доз. Соединения по данному изобретению могут быть введены пероральным, парентеральным (например, внутримышечной, интраперитонеальной, внутривенной или подкожной инъекцией или имплантом),назальным, вагинальным, ректальным, подъязычным или наружным путями введения и могут быть изготовлены в виде формы с фармацевтически приемлемыми носителями для получения форм дозировок,пригодных для каждого из путей введения. Твердые формы дозировок для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В каждой из твердых форм дозировок активное соединение смешано по меньшей мере с одним инертным фармацевтически приемлемым носителем, таким как сахароза, лактоза или крахмал. Такие формы дозировок также могут содержать, как это принято в обычной практике, дополнительные вещества, иные, чем такие инертные разбавители, например смазывающие агенты, такие как стеарат магния. В случае капсул, таблеток и пилюль форма дозировки может также содержать буферные агенты. Таблетки и пилюли могут дополнительно быть изготовлены с кишечными оболочками. Жидкие формы дозировки для перорального введения включают без ограничений, фармацевтиче- 19020005 ски приемлемые эмульсии, растворы, суспензии, сиропы, эликсиры и им подобное, содержащие инертные разбавители, обычно используемые в данной области техники, такие как вода. Кроме таких инертных разбавителей, композиции могут также включать адъюванты, такие как увлажняющие агенты,эмульгирующие и суспендирующие агенты и подслащивающие, вкусовые и ароматизирующие агенты. Препараты по данному изобретению для парентерального введения включают, без ограничений,стерильные водные или неводные растворы, суспензии, эмульсии и им подобное. Примеры неводных растворителей или сред включают пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло и кукурузное масло, желатин и пригодные для инъекций органические эфиры, такие как этилолеат. Такие формы дозировок могут также содержать адъюванты, такие как консервирующие, увлажняющие, эмульгирующие и диспергирующие агенты. Они могут быть стерилизованы путем, например, фильтрации через фильтр, задерживающий бактерии, путем включения стерилизующих агентов в композиции, путем облучения композиций или нагреванием композиций. Они также могут быть произведены в форме стерильных твердых композиций, которые могут быть растворены в стерильной воде или какой-либо другой стерильной пригодной к инъекции среде непосредственно перед употреблением. Композиции для ректального или вагинального введения предпочтительно являются суппозиториями, которые могут содержать в дополнение к активному веществу наполнители, такие как масло коки или воск для суппозиториев. Композиции для назального и подъязычного введения также готовят со стандартными наполнителями, хорошо известными в данной области техники. Далее соединение по данному изобретению может быть введено в композицию с замедленным высвобождением, такую как описано в нижеследующих патентах и патентных заявках. Патент США 5672659 описывает композиции с продолжительным выделением, содержащие биоактивный агент и полиэфир. Патент США 5595760 описывает композиции с продолжительным выделением, содержащие биоактивный агент в желеобразной форме. Патент США 5821221 описывает полимерные композиции с продолжительным выделением, содержащие биоактивный агент и хитозан. Патент США 5916883 описывает композиции с продолжительным выделением, содержащие биоактивный агент и циклодекстрин. Патентная публикация WO 99/38536 описывает абсорбируемые композиции биоактивного агента с продолжительным выделением. Патентная публикация WO 00/04916 описывает процесс получения микрочастиц, содержащих терапевтический агент, такой как пептид, в процессе "масло-в-воде". Патентная публикация WO 00/09166 описывает комплексы, содержащие терапевтический агент, такой как пептид, и фосфорилированный полимер. Патентная публикация WO 00/25826 описывает комплексы, содержащие терапевтический агент, такой как пептид, и полимер, несущий неполимеризуемый лактон. Если не определено иное, все технические и научные термины, использованные в данном документе, имеют такое же значение, как это обычно понимается специалистами, обладающими обычными знаниями в области техники, к которой данное изобретение относится. Также все публикации, патентные заявки, патенты и другие ссылки, упомянутые в данном документе, являются, таким образом, включенными по ссылке, каждый во всей своей полноте. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I)R1 представляет собой ОН, NH2, (C1-C30)алкокси или NH-X2-CH2-Z0, где X2 представляет собой (С 0 С 30) углеводородный остаток, a Z0 представляет собой Н, ОН, СО 2 Н или CONH2; каждый из R2 и R3 независимо выбран из группы, состоящей из Н, (C1-С 30)алкила, (С 1 С 30)гетероалкила, (C1-C30)ацила, (С 2-С 30)алкенила, (С 2-С 30)алкинила, арил(С 1-С 30)алкила, арил(С 1 С 30)ацила, замещенного (C1-C30)алкила, замещенного (С 1-С 30)гетероалкила, замещенного (C1-C30)ацила,замещенного (С 2-С 30)алкенила, замещенного (С 2-С 30)алкинила, замещенного арил(С 1-С 30)алкила и замещенного арил(С 2-С 30)ацила; при условии, что когда R2 представляет собой (C1-C30)ацил, арил(С 1 С 30)ацил, замещенный (С 1-С 30)ацил или замещенный арил(C1-C30)ацил, тогда R3 представляет собой Н,(C1-C30)алкил, (C1-C30)гетероалкил, (С 2-С 30)алкенил, (С 2-С 30)алкинил, арил(C1-C30)алкил, замещенный(C1-С 30)алкил, замещенный (C1-C30)гетероалкил, замещенный (С 2-С 30)алкенил, замещенный (С 2 С 30)алкинил или замещенный арил(С 1-С 30)алкил; при условии, что по меньшей мере один из А 7, A11, A13, А 14, А 31, А 35, А 40, А 41 и А 42 не является аминокислотным остатком в соответствующем положении природного GIP; или его фармацевтически приемлемая соль. 2. Соединение по п.1, в котором А 4 представляет собой Gly; А 5 представляет собой Thr; А 6 представляет собой Phe; А 7 представляет собой Ile; А 8 представляет собой Ser; А 9 представляет собой Asp; А 10 представляет собой Tyr; А 11 представляет собой Ser, A5c или А 6 с; А 12 представляет собой Ile; А 13 представляет собой Ala или Aib; А 14 представляет собой Met, A5c или Nle; А 15 представляет собой Asp; А 16 представляет собой Lys; А 17 представляет собой Ile; А 18 представляет собой His; А 19 представляет собой Gln; А 20 представляет собой Gln; А 21 представляет собой Asp; А 22 представляет собой Phe;- 21020005 А 23 представляет собой Val; А 24 представляет собой Asn; А 25 представляет собой Trp; А 26 представляет собой Leu; А 27 представляет собой Leu; А 28 представляет собой Ala; А 29 представляет собой Gln; А 30 представляет собой Lys; А 31 представляет собой Gly; А 32 представляет собой Lys ; А 33 представляет собой Lys; А 34 представляет собой Asn; А 35 представляет собой Asp; А 36 представляет собой Trp; А 37 представляет собой Lys; А 38 представляет собой His; А 39 представляет собой Asn; А 40 представляет собой Ile или А 5 с; А 41 представляет собой Thr или А 5 с; А 42 представляет собой Gln; А 43 представляет собой Asn, Asp, His или отсутствует; или его фармацевтически приемлемая соль. 3. Соединение по п.2, которое представляет собой[A5c11, Orn33(N-C(O)-(CH2)14-CH3), His43]hGIP(1-43)-OH (SEQ ID NO: 45); или его фармацевтически приемлемая соль. 4. Соединение по п.3, которое представляет собой[A5c11, Lys43(N-C(O)-(CH2)14-CH3)]hGIP(1-43)-OH (SEQ ID NO: 43); или его фармацевтически приемлемые соли. 5. Соединение по п.3, которое представляет собой (А 5c11, His43)hGIP(1-43)-ОН (SEQ ID NO: 6); или его фармацевтически приемлемая соль. 6. Соединение по п.2, в котором А 7 представляет собой Ile; А 13 представляет собой Ala или Aib; А 14 представляет собой Met, A5c, А 6 с или Nle; А 31 представляет собой Gly или отсутствует; А 35 представляет собой Asp или отсутствует и А 42 представляет собой Gln или отсутствует; или его фармацевтически приемлемая соль. 7. Соединение по п.6, которое представляет собой[A5c11, Orn33(N-C(O)-(CH2)14-CH3), His43]hGIP(1-43)-OH (SEQ ID NO: 45); или его фармацевтически приемлемая соль. 8. Соединение по п.2, в котором А 7 представляет собой А 6 с; А 11 представляет собой Ser; А 13 представляет собой Ala; А 14 представляет собой Met или Nle; А 31 представляет собой Gly или Orn (N-C(О)-(СН 2)12-CH3); А 32 представляет собой Lys;- 23020005 А 33 представляет собой Lys; А 35 представляет собой Asp или Orn(N-C(О)-(СН 2)12-CH3); А 40 представляет собой Ile; А 41 представляет собой Thr или А 6 с; А 42 представляет собой Gln или Cys(Psu) и А 43 отсутствует; или его фармацевтически приемлемая соль. 9. Соединение по п.8, которое представляет собой[А 6 с 7, Orn31(N-C(O)-(CH2)12-CH3)]hGIP(1-42)-OH (SEQ ID NO: 22); или его фармацевтически приемлемая соль. 10. Соединение по любому из пп.1-9, дополнительно содержащее ковалентно связанный остатокPEG, или его фармацевтически приемлемая соль. 11. Соединение по п.10, в котором указанный PEG связан с соединением через линкер Cys (малеимид), hCys (малеимид) или Pen (малеимид) с образованием Cys (сукцинимид-N-PEG), hCys (сукцинимидN-PEG) или Pen (сукцинимид-N-PEG), или его фармацевтически приемлемая соль. 12. Соединение по п.11, в котором PEG-илирование имеет место в любом из положений аминокислотных остатков 16, 30 и 31-43, в результате чего Cys (сукцинимид-N-PEG), hCys (сукцинимид-N-PEG) или Pen (сукцинимид-N-PEG) располагаются в любом из положений аминокислотных остатков 16, 30 и 31-43, или его фармацевтически приемлемая соль. 13. Соединение по п.12, в котором PEG-илирование имеет место в любом из положений аминокислотных остатков 32, 33 и 43, в результате чего Cys (сукцинимид-N-PEG), hCys (сукцинимид-N-PEG) илиPen (сукцинимид-N-PEG) располагаются в любом из положений аминокислотных остатков 32, 33 и 43,или его фармацевтически приемлемая соль. 14. Соединение по п.13, в котором указанный остаток PEG имеет средний молекулярный вес от около 2000 до около 80000, или его фармацевтически приемлемая соль. 15. Соединение по п.14, в котором указанный остаток PEG выбран из группы, состоящей из 5K(сукцинимид-N-60K PEG), или его фармацевтически приемлемая соль. 16. Соединение по любому из пп.11-15, в котором указанный сукцинимид-N-PEG является линейным, или его фармацевтически приемлемая соль. 17. Соединение по п.16, в котором указанный линейный сукцинимид-N-PEG представляет собой сукцинимид-N-(СН 2)2-С(О)NH-(CH2)3-PEG, или его фармацевтически приемлемая соль. 18. Соединение по любому из пп.11-15, в котором указанный сукцинимид-N-PEG является разветвленным, или его фармацевтически приемлемая соль. 19. Соединение по п.18, в котором указанный разветвленный сукцинимид-N-PEG представляет собой сукцинимид-N-(СН 2)2-С(О)NH-(СН 2)3-О-СН 2-СН(PEG)-CH2-PEG, или его фармацевтически приемлемая соль. 20. Соединение по любому из пп.15-19, которое представляет собой[A5c11,41, Cys43(сукцинимид-N-30K PEG)]hGIP(1-43)-NH2 (SEQ ID NO: 49); или его фармацевтически приемлемая соль. 21. Соединение по п.20, которое представляет собой[А 5c11,41, Cys43 (сукцинимид-N-30K PEG]hGIP(1-43)NH2 (SEQ ID NO: 49); или его фармацевтически приемлемая соль. 22. Фармацевтическая композиция, содержащая эффективное количество соединения по любому из пп.1-21. 23. Фармацевтическая композиция по п.22, дополнительно содержащая фармацевтически приемлемый носитель. 24. Способ вызова агонистического эффекта рецептора GIP у субъекта, нуждающегося в этом, который включает введение указанному субъекту терапевтически эффективного количества соединения по любому из пп.1-21 или фармацевтической композиции по п.22 или 23. 25. Способ вызова антагонистического эффекта рецептора GIP у субъекта, нуждающегося в этом,который включает введение указанному субъекту терапевтически эффективного количества соединения по любому из пп.1-21 или фармацевтической композиции по п.22 или 23. 26. Способ лечения состояний или заболеваний, опосредованных связыванием рецептора GIP,включающий стадию введения нуждающемуся в этом субъекту терапевтически эффективного количества соединения по любому из пп.1-21 или фармацевтической композиции по п.22 или 23. 27. Способ по п.26, в котором указанное состояние или заболевание, опосредованное связываниемGIP-рецептора, выбрано из группы, состоящей из диабета 1 типа, диабета 2 типа, ожирения, инсулиновой резистентности, непереносимости глюкозы, жировой метаморфозы печени, глюкагона, секреторных заболеваний дыхательных путей, метаболических заболеваний, артрита, остеопороза, заболевания центральной нервной системы, рестеноза, нейродегенеративного заболевания, почечной недостаточности,застойной сердечной недостаточности, нефротического синдрома, цирроза, отека легких, гипертонии и нарушений, при которых желательно снижение потребления пищи и(или) снижение веса тела. 28. Способ лечения диабета, включающий стадию введения нуждающемуся в этом субъекту терапевтически эффективного количества соединения по любому из пп.1-21 или фармацевтической композиции по п.22 или 23. 29. Способ по п.28, в котором указанный диабет представляет собой диабет 2 типа. 30. Способ лечения нарушений, связанных с диабетом, включающий стадию введения нуждающемуся в этом субъекту терапевтически эффективного количества соединения по любому из пп.1-21 или фармацевтической композиции по п.22 или 23. 31. Способ по п.30, в котором указанное нарушение, связанное с диабетом, выбрано из группы, состоящей из гипергликемии, гиперинсулинемии, нарушения переносимости глюкозы, нарушенной гликемии натощак, дислипидемии, гипертриглицеридемии и резистентности к инсулину. 32. Способ лечения или профилактики вторичных явлений диабета, включающий стадию введения нуждающемуся в этом субъекту терапевтически эффективного количества соединения по любому из пп.1-21 или фармацевтической композиции по п.22 или 23. 33. Способ по п.32, в котором указанное вторичное явление выбрано из группы, состоящей из избытка глюкокортикоидов, избытка гормона роста, феохромоцитомы и лекарственного диабета. 34. Способ лечения ожирения, включающий стадию введения нуждающемуся в этом субъекту терапевтически эффективного количества соединения по любому из пп.1-21 или фармацевтической композиции по п.22 или 23. 35. Способ стимуляции секреции инсулина у нуждающегося в этом субъекта путем введения указанному субъекту терапевтически эффективного количества соединения по любому из пп.1-21 или фармацевтической композиции по п.22 или 23. 36. Применение соединения по любому из пп.1-21 для производства лекарственного средства для связывания рецептора GIP для профилактики или лечения заболеваний или состояний, связанных с нарушением связывания с аналогами рецептора GIP. 37. Применение по п.36 для производства лекарственного средства для профилактики или лечения апоптоза -клеток поджелудочной железы. 38. Применение по п.36 для производства лекарственного средства для потенцирования глюкозазависимой пролиферации -клеток поджелудочной железы.
МПК / Метки
МПК: A61K 38/00
Метки: полипептида, глюкозазависимого, аналоги, инсулинотропного
Код ссылки
<a href="https://eas.patents.su/30-20005-analogi-glyukozazavisimogo-insulinotropnogo-polipeptida.html" rel="bookmark" title="База патентов Евразийского Союза">Аналоги глюкозазависимого инсулинотропного полипептида</a>
Предыдущий патент: Устройство для сжигания газа
Следующий патент: Гайка, а также способ и инструмент для ее изготовления
Случайный патент: Композиция для ухода за волосами и/или волосистой частью головы